0
ISOLASI DAN UJI ANTIMIKROB METABOLIT SEKUNDER
EKSTRAK KULTUR JAMUR ENDOFIT AFKR-5 DARI
TUMBUHAN AKAR KUNING
(
Arcangelisia flava
(L) Merr)
FAUZI DARMA ANGGRAINI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
FAUZI DARMA ANGGRAINI. Isolasi dan Uji Antimikrob Metabolit Sekunder
Ekstrak Kultur Jamur Endofit AFKR-5 dari Tumbuhan Akar Kuning
(Arcange-lisia flava (L) Merr). Dibimbing oleh DUDI TOHIR dan ANDRIA AGUSTA.
Jamur endofit yang berasosiasi dengan tumbuhan obat diketahui
mengha-silkan senyawa metabolit sekunder bioaktif seperti tumbuhan inangnya. Penelitian
ini bertujuan mendapatkan metabolit sekunder bioaktif sebagai antimikrob dari
jamur endofit AFKR-5 yang berasosiasi dengan tumbuhan akar kuning asal
Kebun Raya Bogor. Fraksi metanol ekstrak etil asetat kultur AFKR-5 dalam
media kaldu dekstrosa kentang mampu melakukan bioproduksi metabolit
sekunder bioaktif F3.4 (10.375 mg/L) dengan faktor retensi 0.30. Uji aktivitas
antimikrob dengan metode difusi cakram Kirby-Bauer menunjukkan bahwa F3.4
bersifat antimikrob berspektrum luas terhadap 3 mikrob patogen, yaitu
bakteri
Gram positif
Staphylococcus aureus, bakteri Gram negatif
Escherichia coli, dan
kapang
Candida albicans. Penentuan konsentrasi hambat minimum (KHM) dan
konsentrasi bunuh minimum (KBM) dilakukan dengan metode mikrodilusi cair.
F3.4 memiliki potensi tertinggi dengan nilai KHM 16 µg/mL terhadap
C.
albicans, 2× lebih kuat dibandingkan dengan antijamur komersial Nistatin yang
hanya bersifat fungistatik dengan nilai KHM 32 µg/mL. F3.4 bersifat fungisidal
dengan nilai KBM 32 µg/mL terhadap
C. albicans, sehingga berpotensi
dikembangkan menjadi antimikrob, khususnya sebagai antijamur.
ABSTRACT
FAUZI DARMA ANGGRAINI. Isolation and Antimicrobial Test of Secondary
Metabolites from Endophytic Fungi AFKR-5 Culture Extract Associated with
Akar Kuning (Arcangelisia flava (L) Merr) Plant. Supervised by DUDI TOHIR
and ANDRIA AGUSTA.
ISOLASI DAN UJI ANTIMIKROB METABOLIT SEKUNDER
EKSTRAK KULTUR JAMUR ENDOFIT AFKR-5 DARI
TUMBUHAN AKAR KUNING
(
Arcangelisia flava
(L) Merr)
FAUZI DARMA ANGGRAINI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Isolasi dan Uji Antimikrob Metabolit Sekunder Ekstrak Kultur
Jamur Endofit AFKR-5 dari Tumbuhan Akar Kuning
(Arcangelisia flava (L) Merr)
Nama
: Fauzi Darma Anggraini
NIM
: G44051737
Disetujui
Pembimbing I
Drs Dudi Tohir MS
NIP 19571104 198903 1 001
Pembimbing II
Dr Andria Agusta
NIP 19690816 199403 1 003
Diketahui
Ketua Departemen Kimia
Prof Dr Ir Tun Tedja Irawadi MS
NIP 19501227 197603 2 002
PRAKATA
Alhamdulillah, puji syukur penulis panjatkan kepada Allah SWT atas
berkat limpahan rahmat dan hidayah-Nya penulis dapat menyelesaikan karya
ilmiah dengan judul Isolasi dan Uji Antimikrob Metabolit Sekunder Ekstrak
Kultur Jamur Endofit AFKR-5 dari Tumbuhan Akar Kuning (Arcangelisia flava
(L) Merr). Penelitian dilakukan di Laboratorium Biosains-Fitokimia Bidang
Botani Puslit Biologi LIPI Cibinong.
Penulis mengucapkan terima kasih yang mendalam dan penghargaan
kepada Bapak Drs Dudi Tohir, MS dan Bapak Dr Andria Agusta selaku
pembim-bing yang senantiasa dengan kesabaran memberikan arahan, dorongan, semangat,
saran dan solusi kepada penulis selama melaksanakan penelitian dan penyusunan
karya ilmiah ini. Ungkapan terima kasih juga disampaikan kepada pihak Puslit
Biologi LIPI Cibinong dan Bapak Dr Andria Agusta selaku Kepala Laboratorium
Biosains-Fitokimia yang telah mengizinkan dan memfasilitasi penulis dalam
melaksanakan penelitian ini. Penghargaan penulis sampaikan kepada Ibu Dr
Praptiwi, Ibu Dra Yuliasri Jamal, MSc, Kak Sultoni, Bu Hertina, Kak Asep
beserta staf lain dari Lab Biosains-Fitokimia Bidang Botani Puslit Biologi LIPI
Cibinong yang telah banyak membantu selama penelitian, dan seluruh staf LIPI
Cibinong.
Ungkapan terima kasih mendalam juga rasa sayang ditujukan untuk
keluarga terutama Bapak, Mama, Pupu Eric Rosady, Diah Paramita, Mas Iim,
Kharisma, Dawud, Satria, Ir Widya Rachman, Bunda Retno D Lestari, dan para
sahabat atas doa, kasih sayang, dan motivasinya, serta teman-teman IPB (Malia,
Dian, Aulia, Diah, Vani, Dwi, Marlia, Irma, dkk), Kak Budi Arifin, Msi atas
segala dukungan dan bantuannya, para dosen IPB, seluruh staf laboran, karyawan
Komdik Departemen Kimia, Bu Aah, Kak Eko, Pak Didi, para staf IPB, para
dokter, Prof Putra, teman-teman Primagama Merdeka Bogor, teman-teman di Lab
Biosains, dan semua pihak yang telah ikut membantu atas segala dukungan, doa,
dan semangatnya.
Semoga karya ilmiah ini dapat bermanfaat bagi perkembangan ilmu
pengetahuan.
Bogor, September 2012
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 7 Agustus 1987 sebagai putri dari
pasangan Bapak Darsono dan Ibu Siti Hasanah.
Tahun 2005 penulis lulus dari SMA Negeri 2 Depok dan pada tahun yang
sama lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur Seleksi
Nasional Masuk Perguruan Tinggi Negeri (SNMPTN).
DAFTAR ISI
Halaman
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... ix
DAFTAR SINGKATAN DAN LAMBANG... x
PENDAHULUAN ... 1
BAHAN DAN METODE
Bahan dan Alat ... 2
Metode ... 2
HASIL DAN PEMBAHASAN
Hasil Kultivasi Jamur Endofit ... 4
Hasil Penapisan Metabolit Sekunder Kultur Jamur ... 6
Potensi Antimikrob Ekstrak Kultur ... 7
Hasil Partisi dan Fraksionasi Ekstrak Kultur Aktif ... 8
Aktivitas Antimikrob Fraksi Dominan ... 9
Hasil Isolasi dan Pemurnian Metabolit Sekunder Fraksi Teraktif
Ekstrak Kultur ... 9
Bioaktivitas Antimikrob Isolat Metabolit Sekunder Dominan
Fraksi Teraktif ... 10
SIMPULAN DAN SARAN
Simpulan ... 12
Saran ... 12
DAFTAR PUSTAKA ... 12
DAFTAR TABEL
Halaman
1 Rendemen ekstrak kultur AFKR-5 ... 6
2 Uji aktivitas penghambatan mikrob oleh ekstrak EtOAc kultur AFKR-5
konsentrasi 100 µg/cakram ... 7
3 Hasil partisi ekstrak EtOAc kultur AFKR-5 media PDB dengan n-heksana-
MeOH (1:1) (v/v) ... 8
4 Bobot dan warna fraksi-fraksi pada Gambar 8 ... 9
5 Aktivitas penghambatan mikrob fraksi dominan ekstrak EtOAc kultur
AFKR-5 media PDB ... 9
6 Diameter daya hambat fraksi F3.4 ... 11
7 Hasil uji KHM F3.4 ... 11
DAFTAR GAMBAR
Halaman
1 Profil isolat jamur endofit AFKR-5 selama peremajaan pada media PDA ... 5
2 Jamur endofit AFKR-5 dalam media kultivasi PDB dan GYP ... 5
3 Ekstrak EtOAc kultur AFKR-5 media PDB (a) dan GYP (b) ... 6
4 Profil KLT ekstrak EtOAc kultur AFKR-5 media PDB (I) dan GYP (II) ... 6
5 Zona hambat ekstrak EtOAc kultur AFKR-5 media PDB konsentrasi 100
µg/cakram terhadap E. coli (a), S. aureus (b), dan C. albicans (c) ... 8
6 Profil partisi n-heksana-MeOH (1:1) (v/v) ekstrak EtOAc kultur AFKR-5
media PDB ... 8
7 Profil KLT ekstrak EtOAc kultur AFKR-5 media PDB (a, c, dan e) dan hasil
partisi MeOH (1) dan n-heksana (2) (b, d, dan f) ... 8
8 Fraksi-fraksi ekstrak EtOAc kultur AFKR-5 media PDB fraksi MeOH ... 9
9 Zona hambat fraksi F3 konsentrasi 100 µg/cakram terhadap E. coli (a),
S. aureus (b), dan C. albicans (c) ... 9
10 Profil KLT fraksi F3 dalam ekstrak EtOAc: setelah disemprot VH (a),
fraksi MeOH (I) dan n-heksana (II) setelah disemprot VH (b) dan CH
(c), fraksi MeOH: orisinal (d), di bawah UV 254 nm (e), setelah disemprot
VH (f), dan setelah disemprot CH (g) ... 9
11 Profil KLT preparatif fraksi F3 ... 10
13 Fraksi-fraksi hasil KLT preparatif F3 ... 10
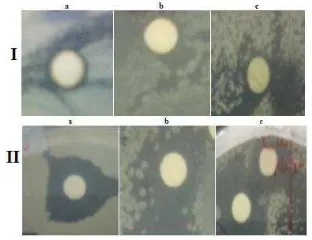
14 Zona hambat fraksi F3.4 (I), kontrol positif Kloramfenikol (IIa dan IIb),
dan Nistatin (IIc), pada konsentrasi 100 µg/cakram terhadap: E. coli (a),
S.
aureus (b), C. albicans (c) ... 10
15 Nilai KHM fraksi F3.4 ... 12
DAFTAR LAMPIRAN
Halaman
1 Komposisi dan prosedur pembuatan media ... 18
2 Diagram alir penelitian ... 19
3 Bagan penentuan nilai KHM ... 20
4 Contoh perhitungan kadar bioproduksi kultur ... 20
5 Profil fraksi-fraksi hasil KLT preparatif F3 ... 21
6 Hasil penentuan KHM fraksi F3.4 dan kontrol positif ... 22
DAFTAR SINGKATAN DAN LAMBANG
Singkatan
Keterangan
A.flava Arcangelisia flava (L) Merr ‘akar kuning’
b/b bobot/bobot
bk bobot kering
C. albicans Candida albicans
CFU colony forming units
CH Ce(SO4)2 1%/H2SO4 10%
CMMA corn meal mealt agar ‘agar-agar tepung jagung malt’
DCM diklorometana
DDH diameter daya hambat
E. coli Escherichia coli
EtOAc etil asetat
GC growth control ‘kontrol pertumbuhan’
GYP glucose yeast pepton ‘glukosa-ekstrak khamir-pepton’
KBM konsentrasi bunuh minimum
KHM konsentrasi hambat minimum
KLT kromatografi lapis tipis
LAF laminar air flow‘lemari aliran udara laminar’
MeOH metanol
MHA Mueller hinton agar ‘agar-agar Mueller Hinton’
MHB Mueller hinton broth ‘kaldu Mueller Hinton’
N2 gas nitrogen
NA nutrient agar ‘agar-agar nutrien’
PDA potato dextrose agar ‘agar-agar dekstrosa kentang’
PDB potato dextrose broth ‘kaldu dekstrosa kentang’
Rf faktor retensi
S. aureus Staphylococcus aureus
SB Sabouraud broth ‘kaldu dekstrosa Sabouraud’
UV ultraviolet ‘ultraungu’
v/v volume/volume
1
PENDAHULUAN
Jamur endofit merupakan salah satu golongan mikrob endofit yang paling banyak ditemukan di alam (Strobel & Daisy 2003) dan sumber yang kaya akan metabolit sekun-der bioaktif (Tan & Zou 2001). Oleh karena itu, Owen dan Hundley (2004) menyebutnya sebagai chemical synthesizer inside plant. Jamur ini hidup berasosiasi secara simbiosis mutualisme dengan tumbuhan inangnya. Jamur endofit menginfeksi tumbuhan sehat pada jaringan tertentu tanpa menimbulkan tanda-tanda adanya infeksi (Bacon & White 2000) lalu menghasilkan enzim dan metabolit sekunder yang bermanfaat bagi fisiologi dan ekologi tumbuhan inang (Tan & Zou 2001; Prihatiningtias 2006; Zhang et al. 2006), mi-kotoksin, dan juga antibiotik (Carrol 1988; Clay 1988) yang dimanfaatkan tumbuhan inang untuk melawan penyakit yang ditimbul-kan oleh patogen tumbuhan. Sebaliknya, ja-mur endofit dapat memperoleh nutrisi untuk melengkapi siklus hidupnya dari tumbuhan inangnya (Petrini et al. 1992; Bacon & White 1994; Rao 1994).
Jamur endofit berperanan penting dalam industri farmasi karena kemampuannya dalam memproduksi senyawa metabolit yang berva-riasi, baik dari struktur maupun fungsinya. Berbagai golongan senyawa metabolit sekun-der seperti alkaloid, flavonoid, kuinon, terpe-noid, antrakuinon, fenil propaterpe-noid, turunan isokumarin, peptida, dan senyawa alifatik, te-lah diisolasi dan dicirikan dari kultur jamur endofit (Agusta 2009). Senyawa bioaktif yang berasal dari jamur endofit ada yang berpotensi antimikrob (menghambat pertumbuhan atau membunuh mikrob-mikrob patogen) (Castillo
et al. 2002; Strobel & Daisy 2003; Owen & Hundley 2004; Agusta et al. 2006; Simamarta
et al. 2007; Jamal et al. 2008, 2009; Agusta 2009); antikanker (Kumala 2005), contohnya senyawa taksol (Stierle et al. 1993, 1994; Li et al. 1996; Strobel et al. 1996); antiserangga (Azevedo et al. 2000); zat pengatur tumbuh (Tan & Zou 2001); serta penghasil enzim hidrolitik seperti amilase, selulase, xilanase, ligninase (Choi et al. 2005), dan kitinase (Zin-niel et al. 2002). Potensi biologis dari jamur endofit lainnya ialah sebagai antiimunosu-presif (Lee et al. 1995), anti-HIV, antioksidan (Strobel et al. 2002), antivirus (Guo et al.
2000), antidiabetes (Zhang et al. 1999, Strobel & Daisy 2003), anti-HSV-1, antituberkular (Agusta 2009), dan antimalaria (Lu et al.
2000; Simanjuntak et al. 2002; Castillo et al.
2003).
Tumbuhan famili Menispermaceae seperti akar kuning (Arcangelisia flava) memiliki aktivitas biologi sebagai antimikrob dan sito-toksik (Dzulkarnain et al. 1996; Subeki et al.
2005; Harborne 2006). Alkaloid protoberberin yang terdapat dalam akar kuning dilaporkan aktif sebagai antibiotik melawan bakteri Gram positif maupun Gram negatif seperti Escheri-chia coli, Salmonella typhosa, Neisseria go-norrhoeae, Diplococcus pneumoniae, Shigela dysentriae, dan Staphylococcus aureus (Jamal
et al. 2011). Selain itu, tumbuhan ini telah di-gunakan untuk mengobati penyakit kuning, sebagai obat cacing, obat seriawan, dan di Ambon digunakan sebagai plester pada pe-nyakit cacar (Heyne 1987). Khasiat anti-malaria (Kaur et al. 2009), hepatoprotektor (Meistiani 2001; Batubara 2003), serta anti-oksidan dan antikanker (Keawpradub et al. 2005), juga telah dilaporkan pada tumbuhan akar kuning. Akan tetapi, pengobatan meng-gunakan tumbuhan obat membutuhkan ba-nyak biomassa dan waktu tumbuh yang lama, serta dapat mengganggu kelestarian alam jika dieksploitasi secara berlebihan, sehingga di-perlukan inovasi yang efektif dan efisien seba-gai solusi permasalahan tersebut.
Cara inovatif untuk mengefisienkan sum-ber senyawa bioaktif adalah dengan meman-faatkan jamur endofit yang berasosiasi dengan tumbuhan obat tersebut. Jamur endofit yang diisolasi dari tumbuhan obat akan memiliki aktivitas senyawa bioaktif yang sama atau bahkan lebih baik dibandingkan dengan tum-buhan inangnya, karena mekanisme perubah-an kimia oleh mikroorgperubah-anisme sperubah-angat mirip dengan yang terjadi pada organisme tingkat tinggi. Hal ini menguntungkan karena siklus hidup jamur endofit lebih singkat dari-pada tumbuhan inangnya dan dapat diproduksi dalam skala besar dengan menggunakan pro-ses fermentasi. Hal ini merupakan peluang yang dapat dioptimalkan untuk memproduksi metabolit sekunder secara efisien dan cepat dengan tetap menjaga kelestarian tumbuhan obat, terutama yang sudah dikategorikan langka seperti akar kuning (Setyowati & Wardah 2007).
2
AFAS.F3 yang berasosiasi dengan tumbuhan akar kuning asal Sukabumi juga dilaporkan memiliki kemampuan untuk memproduksi floroglusinol sebanyak 14.9 mg/L pada media kultivasi PDB (Jamal et al. 2011). Penggalian potensi antimikrob isolat kultur jamur endofit lainnya yang berasosiasi dengan tumbuhan akar kuning perlu dilakukan. Oleh sebab itu, penelitian ini bertujuan mengisolasi metabolit sekunder bioaktif antimikrob dari kultur jamur endofit AFKR-5 yang berasosiasi dengan tum-buhan akar kuning koleksi Kebun Raya Bo-gor.
BAHAN DAN METODE
Bahan dan AlatBahan utama adalah AFKR-5, salah satu galur jamur endofit AFKR hasil isolasi Dr Andria Agusta dari jaringan akar muda tum-buhan akar kuning asal Kebun Raya Bogor koleksi Lab Biosains-Fitokimia, Bidang Bota-ni, Puslit Biologi LIPI Cibinong. Bahan kimia meliputi pelarut yang umum di laboratorium, dimetil sulfoksida (DMSO), gas N2, silika gel
60(70230meshASTM), reagen Dragendorf, vanilin-H2SO4, Ce(SO4)2 1%/H2SO4 10%,
an-tijamur komersial Nistatin (Sigma), dan anti-biotik komersial Kloramfenikol (Sigma). Me-dia yang digunakan meliputi agar-agar nutrien (NA) (Difco), agar-agar dekstrosa kentang (PDA) (Difco), glukosa-ekstrak khamir-pep-ton (GYP), kaldu dekstrosa kentang (PDB) (Difco), kaldu dekstrosa Sabouraud (SB) (Cri-terion), agar-agar Mueller Hinton (MHA) (Criterion), dan kaldu Mueller Hinton (MHB) (Criterion). Komposisi dan prosedur pembuat-an media dapat dilihat di Lampirpembuat-an 1. Bakteri uji yang digunakan adalah bakteri patogen Es-cherichia coli ATCC 25923dan Staphyloco-ccus aureus ATCC 25923, sedangkan kapang uji yang digunakan adalah kapang patogen
Candida albicansATCC 10231.
Alat-alat yang digunakan adalah seperang-kat alat untuk ekstraksi, purifikasi, dan uji an-timikrob, alat-alat kaca, penguap putar (Hei-dolph WB), UV-viewing cabinet, vorteks, test tube mixer (Vortex Sibata), autoklaf (Hiclave HVE 5.0 Hirayama), spreader, inkubator, pe-ngering-beku (Eyela FDE 1200), syringe dri-ven filter unit (Miller GP) ukuran 0.22 µm,
platform shaker (Innova 2100), inkubator/ penangas air kocok (Kottermann), pengaduk magnet (Cimarec 3), pelat kromatografi lapis tipis (KLT) silika gel 60 F254 (Merck),
mikro-pipet, microtiter plate, dan laminar air flow
(LAF).
Metode
Lingkup Penelitian
Tahapan yang dilakukan dalam penelitian ini dapat dilihat pada Lampiran 2. Penelitian terdiri atas kultivasi isolat AFKR-5 pada media PDB dan GYP, ekstraksi hasil biopro-duksi kultur AFKR-5, uji aktivitas antimik-rob ekstrak kultur AFKR-5, fraksionasi eks-trak kultur aktif, uji aktivitas antimikrob fraksi dominan ekstrak aktif, pemurnian fraksi do-minan teraktif dengan KLT preparatif, serta penentuan konsentrasi hambat dan bunuh mi-nimum (KBM) dan (KBM) metabolit sekun-der bioaktif.
Kultivasi Jamur Endofit AFKR-5 (Jamal et al. 2009; Agusta et al. 2010)
Peremajaan Isolat
Jamur endofit AFKR-5 diisolasi dengan media agar-agar jagung-malt (CMMA) pada keadaan aseptik sampai didapatkan isolat mur-ni kemudian dipindahkan ke dalam media NA atau agar miring. Isolat AFKR-5 selanjutnya diremajakan dalam media PDA 39 g/L. Isolat AFKR-5 dalam agar-agar miring dipotong dengan diameter ± 0.5 × 0.5 cm2 dan dipin-dahkan ke atasnya. Media yang telah berisi jamur lalu diinkubasi pada suhu kamar dan kondisi gelap minimum 7 hari.
Kultivasi Isolat (Jamal et al. 2009; Agusta et al. 2010)
Dua potong inokulum jamur AFKR-5 setelah peremajaan berumur 1 minggu ber-diameter ± 0.5 × 0.5 cm2 diinokulasikan ma-sing-masing pada 200 mL media PDB (24 g/L) dan media GYP (27.21 g/L) yang sudah steril dan dingin. Kultur dibuat 4× ulangan da-lam Erlenmeyer 500 mL, 1 Erlenmeyer lain-nya halain-nya berisi media dan digunakan sebagai blangko. Seluruhnya diinkubasi di platform shaker pada suhu 27 C dengan kecepatan 120 rpm selama 14 hari.
Penapisan Metabolit Sekunder Kultur
Ekstraksi Kultur
3
dengan etil asetat (EtOAc) sebanyak 3×1 L atau sampai miselium tidak berwarna sambil diaduk dengan pengaduk magnetik selama 1 jam untuk setiap ekstraksi. Ekstrak EtOAc di-saring dari fragmen miselium lalu dipisahkan dengan corong pisah. Lapisan atas (fraksi Et-OAc) dipekatkan dengan penguap putar da-lam kondisi vakum, suhu air bak 30 °C, ke-mudian dikeringbekukan dan ditimbang bo-botnya.
Analisis Kromatografi Lapis Tipis
Ekstrak EtOAc kultur jamur dipantau pada pelat KLT silikagel 60 F254. Metode KLT
di-lakukan menurut Wall-hausser (1969). Eks-trak ditotolkan pada titik awal di pelat ber-ukuran 3 × 6 cm2. Dibuat 3 buah pelat KLT, masing-masing terdiri atas 1 atau 2 titik peno-tolan. Bejana pengembang diisi dengan cam-puran diklorometana (DCM)-MeOH 10:1 (v/v) dan dibiarkan beberapa menit hingga je-nuh. Pelat dimasukkan ke dalam bejana dan dielusikan sampai batas pelarut atau garis depan mendekati bagian ujung. Batas pelarut ditandai dengan pensil segera setelah pelat di-keluarkan dari bejana.
Bercak diamati di bawah penyinaran sinar UV 254 dan 366 nm. Bercak tertentu akan berpendarflour dan ditandai dengan pensil. Deteksi kemudian dilakukan menggunakan pereaksi pembentuk warna, yang disemprot-kan merata pada permukaan pelat. Pereaksi yang digunakan di antaranya ialah Dragen-dorf, vanilin-H2SO4, dan Ce(SO4)2 1%/ H2SO4
10% (Krebs et al. 1969). Pelat yang disem-protkan pereaksi Ce(SO4)2 1%/H2SO4 10% dan
vanilin-H2SO4 dipanaskan di atas penangas
hingga timbul warna yang jelas pada bercak.
Uji Aktivitas Antimikrob Ekstrak Kultur
Aktivitas antimikrob diuji dengan metode cakram (paper disk) Kirby-Bauer menurut panduan dalam National Committee for Clinical Laboratory Standards Institute (CLSI 2003, 2006) serta Sung & Lee (2007). Bakteri patogen E. coli dan S. aureus pada media NA yang diinkubasi 24 jam diambil sebanyak 2 ose kemudian dikultivasi pada media MHB pada suhu 37 C selama 48 jam dalam in-kubator bergoyang. Bakteri uji dalam media MHB selanjutnya diinokulasi sebanyak 0.2 mL ke dalam 20 mL media MHA, diinkubasi selama 24 jam pada suhu 37 C. Sementara kapang uji yang digunakan, yaitu C. albicans
diremajakan pada media SB dan diinokulasi pada media PDA dengan suhu inkubasi 30 C.
Uji aktivitas antimikrob dilakukan ter-hadap ekstrak EtOAc dan fraksi air kultur AFKR-5 pada media GYP dan PDB. Cakram kertas saring steril ditetesi 10 µL larutan eks-trak uji dengan konsentrasi 10 µg/µL dengan menggunakan mikropipet steril, lalu diletak-kan di atas inokulan bakteri atau kapang uji. Aseton digunakan sebagai pelarut dan kontrol negatif. Kontrol positif ialah Nistatin dan Kloramfenikol sebagai antijamur dan antibak-teri komersial, masing-masing dengan konsen-trasi 10 µg/µ L sebanyak 10 µL. Inokulan yang sudah diberi larutan stok diinkubasi dengan suhu 30 C untuk jamur dan 37 C untuk bak-teri, selama 24 jam, lalu diamati zona ham-batnya.
Partisi dan Fraksionasi Ekstrak Kultur Aktif
Ekstrak EtOAc kultur AFKR-5 pada media PDB yang aktif sebagai antimikrob selanjutnya dipartisi dengan n-heksana dan MeOH. Fraksi MeOH dan n-heksana masing-masing dikumpulkan dan dipekatkan dengan penguap putar. Hasil partisi dipantau dengan KLT. Pelat KLT silika gel 60 F254 (Merck)
sebagai fase diam dan fase geraknya campur-an pelarut DCM-MeOH (10:1) (v/v). Noda yang muncul diamati di bawah sinar UV pada 254 dan 366 nm, kemudian disemprot dengan pereaksi Dragendorf, vanilin-H2SO4, dan
Ce(SO4)2 1%/H2SO4 10%.
Pemisahan kandungan kimia dari fraksi MeOH dilakukan dengan kromatografi kolom. Digunakan sistem isokratik dengan komposisi fase gerak DCM-MeOH (20:1; 15:1; 10:1; 5:1; 3:1; 2:1; 1:1) (v/v) dan fase diam silika gel 60 (70230 mesh ASTM). Eluat yang keluar dari kolom ditampung ke dalam tabu-ng-tabung reaksi dan dipantau dengan KLT. Noda yang muncul diamati di bawah sinar UV pada 254 dan 366 nm lalu disemprot dengan pereaksi Ce(SO4)2 1%/ H2SO4 10%. Tabung
eluat dan nilai Rf yang sama digabung dan di-jadikan 1 fraksi. Setiap fraksi dipekatkan, bila masih mengandung air dikeringkan dengan pengering-beku, kemudian ditimbang bobot keringnya.
Uji Aktivitas Antimikrob Fraksi Dominan
-4
heksana hasil partisi ekstrak EtOAc sebelum-nya.
Isolasi dan Pemurnian Metabolit Sekunder Fraksi Teraktif
Fraksi F3 yang diperoleh sebagai fraksi dominan teraktif dimurnikan dengan KLT preparatif. Adsorben yang digunakan ialah pe-lat KLT silika gel 60 F254 (Merck).
Pemisah-an dilakukPemisah-an menurut Wallhausser (1969). Se-banyak 20 mg fraksi F3 dilarutkan dalam ase-ton kemudian ditotolkan sedikit demi sedikit pada seluruh titik awal di pelat berukuran 10 × 20 cm2, penotolan berikutnya dilakukan bila penotolan sebelumnya sudah mengering sam-pai seluruh larutan habis. Bejana pengembang diisi dengan campuran pelarut DCM-aseton, 5:1 (v/v) dan dibiarkan beberapa menit hingga jenuh. Pelat dimasukkan ke dalam bejana dan dibiarkan sampai batas pelarut atau garis de-pan mendekati bagian ujung pelat. Batas pelarut ditandai segera setelah pelat dikeluar-kan dari bejana. Bercak diamati di bawah pe-nyinaran sinar UV pada 254 dan 366 nm. Bercak tertentu akan berpendar. Bercak yang terlihat baik di bawah UV ditandai dan di-kerok kemudian masing-masing dilarutkan dengan aseton dan dipekatkan dengan pe-nguap putar. Setiap fraksi dikeringkan dengan gas N2 kemudian ditimbang bobotnya. Fraksi
dominan, yaitu F3.4 ditentukan nilai hambat-nya terhadap mikrob uji.
Penentuan Nilai Hambat Metabolit Sekunder Dominan Fraksi Teraktif
Penentuan Diameter Daya Hambat (DDH)
Penentuan DDH fraksi F3.4 dilakukan seperti pada uji aktivitas antmikrob awal. Cak-ram steril diteteskan larutan stok dengan kon-sentrasi 10 µg/µL menggunakan mikropipet steril sebanyak 5 dan 10 µL lalu diletakkan di atas inokulan mikrob uji. Aseton digunakan sebagai pelarut dan kontrol negatif, sedangkan sebagai kontrol positif digunakan Kloramfeni-kol dan Nistatin. Inokulan yang sudah diberi larutan uji diinkubasi dengan suhu 30 C un-tuk jamur dan 37 C untuk bakteri, selama 24 jam. Zona hambat yang ditandai dengan ter-bentuknya zona bening di sekitar cakram di-amati dan diukur reratanya.
Penentuan Konsentrasi Hambat Minimum (KHM)
Sampel uji dipersiapkan dengan konsentra-si 512 µg/mL menggunakan pelarut DMSO. Pengenceran sampel uji dilakukan berseri dari
konsentrasi 512 µg/mL menjadi 256, 128, dan seterusnya sampai 0.06 µg/mL menggunakan
microtiter plate dengan 12 × 8 kolom. Untuk bakteri digunakan media MHB dan untuk kapang digunakan media SB. Misalnya, untuk uji terhadap kapang, kolom 1 berisi 0.1 mL media SB 2×, kolom 2–12 berisi 0.1 mL media SB 1×, dan disediakan kolom lain untuk kontrol pertumbuhan (GC) dan blangko. Blangko berisi 0.2 mL media SB, begitu juga untuk uji terhadap bakteri patogen. Sampel uji dipipet 0.1 mL ke dalam kolom 1, kemudian dari kolom 1 dipipet 0.1 mL ke dalam kolom 2 dan seterusnya sampai kolom 12, lalu dari kolom 12 dibuang 0.1 mL. Uji dilakukan 3× ulangan (Lampiran 3).
Inokulum dipersiapkan dari mikrob uji yang telah diremajakan dan diencerkan untuk mendapatkan koloni mikrob 15 × 105 CFU/ mL. Mikrob uji tersebut dipipet 0.1 mL ke setiap kolom 1 sampai 12, kemudian micro-titer plate diinkubasi bergoyang pada suhu 37
C selama 2448 jam. Dengan pengamatan visual, ditentukan konsentrasi terendah kolom masih mempertahankan kebeningannya, seba-gai nilai KHM. Hasilnya dibandingkan de-ngan pengukuran nilai KHM antimikrob mersial, yaitu Kloramfenikol (antibakteri ko-mersial) dan Nistatin (antijamur koko-mersial).
HASIL DAN PEMBAHASAN
Hasil Kultivasi Jamur Endofit (Jamal et al. 2009; Agusta et al. 2010)Isolat dan Hasil Peremajaan
Galur jamur endofit AFKR-5 (Gambar 1), diisolasi dari jaringan akar muda tumbuhan A. flava asal Kebun Raya Bogor (Agusta et al. 2010). Isolat jamur AFKR-5 koleksi dalam media agar miring sudah menghasilkan mise-lium berwarna hitam, maka harus diremajakan dan minimum berumur 7 hari sebelum dikul-tivasi lebih lanjut pada media cair. Tujuannya ialah memastikan isolat dapat tumbuh di me-dia PDA tanpa kontaminan, serta sudah meng-hasilkan miselium (Gambar 1a) dan pigmen warna (Gambar 1b). Lama waktu inkubasi ju-ga dapat memenju-garuhi produksi metabolit se-kunder saat proses kultivasi selanjutnya.
5
concentric (sepusat), bentuk tepi wavy ( undu-late atau bergelombang), dengan elevasi hilly
(berbukit). Ciri-ciri ini mirip dengan koloni jamur Aspergillus sp. Miselium sudah mulai terbentuk pada hari ke-3 (Gambar 1a), jumlah dan ukurannya bertambah besar sejalan de-ngan bertambah lamanya waktu inkubasi. Ba-gian bawah koloni jamur atau substrat mise-lium dicirikan oleh penyebaran, tembusan de-ngan pola pigmentasi berwarna kuning keco-kelatan. Warna tersebut mulai terbentuk sete-lah hari ke-5 dan semakin dominan sampai ha-ri ke-14 (Gambar 1c; 1d). Kemungkinan zat warna diakibatkan adanya asosiasi antara bio-sintesis metabolit sekunder dan proses spo-rulasi pada jamur endofit.
Kondisi lingkungan yang cocok sangat dibutuhkan untuk terjadinya proses sporulasi seperti media tumbuh, suhu, udara, dan caha-ya. Peremajaan isolat AFKR-5 optimum dila-kukan pada suhu kamar dan kondisi gelap karena secara fisiologis suhu optimum untuk pertumbuhan jamur endofit sebagai organisme saprofit ialah 2230 C dan tidak memerlukan cahaya untuk tumbuh (Pelczar & Chan 2010). Media PDA digunakan dalam proses perema-jaan isolat. Karbohidrat dan glukosida dalam kentang serta dekstrosa dalam media PDA merupakan sumber karbon untuk meningkat-kan kecepatan dan pemulihan pertumbuhan ja-mur. Pada hari ke-21, miselium sudah berwar-na cokelat (Gambar 1e; 1f). Hal ini menunjuk-kan bahwa isolat sudah mati dan tidak meng-hasilkan metabolit sekunder, kemungkinan ka-rena nutrisi yang tersedia telah habis
Gambar 1 Profil isolat jamur endofit AFKR-5 selama diremajakan pada media PDA: hari 3 (a), 5 (b), ke-14 (tampak atas) (c), ke-ke-14 (tam-pak bawah) (d), ke-21 (atas) (e), dan ke-21 (bawah) (f).
Hasil Kultivasi Isolat
Jamur endofit bersifat culturable (dapat di-tumbuhkan pada kondisi artifisial) (Agusta
2009). Media kultivasi jamur endofit mengan-dung karbon, nitrogen, belerang dan fosforus, mineral logam, vitamin, dan tentunya air (Pel-czar & Chan 2010). Dalam penelitian ini digu-nakan 2 jenis media, yaitumedia GYP 27.21 g/L dan PDB Difco 24 g/L. Kultur AFKR-5 dalam media PDB maupun GYP telah menghasilkan zat warna pada hari ke-7 (Gam-bar 2a; 2b). Kultivasi dilakukan sampai isolat kultur berumur 14 hari (Gambar 2c; 2d).
Gambar 2 Jamur endofit AFKR-5 dalam media kultivasi PDB dan GYP hari 7 (a dan b) dan hari ke-14 (c dan d).
Media PDB lazim digunakan untuk kulti-vasi jamur, kapang, dan khamir. Media ini mengandung sumber nutrisi kaya gizi (seduh-an kent(seduh-ang) y(seduh-ang mendorong sporulasi kapa-ng, produksi zat warna, dan pertumbuhan ja-mur secara subur (AOAC 1995; MacFaddin 1985; Pelczar & Chan 2010). Media GYP ter-diri atas glukosa, ekstrak khamir, pepton, dan beberapa garam mineral. Ekstrak khamir amat kaya akan vitamin B, juga mengandung kar-bohidrat tinggi dan nitrogen sehingga diguna-kan untuk memperkaya media kultur. Pepton mengandung campuran asam amino bebas, peptida, dan protease merupakan sumber uta-ma nitrogen. Kehadiran zat lain seperti garam mineral dapat merangsang pertumbuhan dan adanya logam alkali atau fosfat dapat menye-babkan pH netral pada pepton.
6
Hasil Penapisan Metabolit Sekunder Kultur Jamur
Kultur jamur endofit AFKR-5 dalam media cair PDB dan GYP terdiri atas fraksi air/filtrat kultur dan fraksi miselium/biomassa kultur. Fraksi air (komponen polar) dipisah-kan dari miselium kemudian dikering-beku-kan dan didapatdikering-beku-kan kadar bioproduksinya da-lam media PDB dan GYP masing-masing se-besar 95.75 dan 660.25 mg/L (Tabel 1). Kadar bioproduksi fraksi air AFKR-5 yang lebih ke-cil dalam media PDB menandakan bahwa me-tabolit sekunder yang lebih bersifat polar dan larut air lebih sedikit jumlahnya. Tabel 1 me-nunjukkan, ekstrak EtOAc kultur AFKR-5 da-lam media PDB (Gambar 3a) memiliki kadar bioproduksi terbesar (804.125 mg/L), lebih besar dibandingkan dengan ekstrak dalam me-dia GYP yang lebih kaya akan nutrisi (Gam-bar 3b) (509.875 mg/L). Contoh perhitungan rendemen diberikan pada Lampiran 4.
Tabel 1 Rendemen ekstrak kultur AFKR-5
Ekstrak AFKR-5 Fraksi ekstrak Bobot (g) Kemampuan produksi (mg/L) Warna
PDB EtOAc 0.6433 804.125 Merah-cokelat
Air 0.0766 95.75 Merah
GYP EtOAc 0.4079 509.875 Cokelat
Air 0.5282 660.25 Kuning
Ekstraksi miselium kultur menggunakan metode maserasi dengan pelarut etil asetat (EtOAc). Pelarut ini umum digunakan dalam mengekstraksi kultur jamur endofit (Sarker et al. 2006; Sarker & Nahar 2007). Sifatnya semipolar sehingga dapat mengekstraksi kom-ponen-komponen yang terdapat dalam kultur jamur. Etil asetat merupakan pelarut dengan polaritas medium (Houghton & Raman 1998). Maserasi dilakukan berulang kali, masing-masing selama 1 jam pada suhu kamar, sam-pai filtrat dari kultur jamur endofit tidak berwarna lagi, yang menandakan semua se-nyawa yang berbobot molekul rendah sudah terekstraksi (Harborne 2006). Pelarut akan menembus dinding sel dan masuk ke dalam rongga sel yang mengandung zat aktif. Zat aktif akan larut dan karena perbedaan konsen-trasi antara larutan zat aktif di dalam dan di luar sel, zat aktif didesak ke luar. Peristiwa tersebut berulang hingga terjadi kesetimbang-an konsentrasi. Pengadukkesetimbang-an akkesetimbang-an meratakkesetimbang-an konsentrasi larutan di luar sehingga memper-cepat tercapai kesetimbangan konsentrasi ba-han ekstraktif. Metode maserasi memerlukan banyak pelarut dan waktu yang lama dalam
prosesnya, tetapi dapat menjaga agar kan-dungan senyawa dalam contoh yang tidak ta-han panas tidak rusak. Senyawa antimikrob yang bersifat atsiri akan menguap dan hilang jika dipanaskan (Branen & Davidson 1993).
Ekstrak EtOAc kultur dalam media PDB dan GYP (Gambar 3) selanjutnya dianalisis KLT untuk menentukan jumlah komponen se-nyawa yang terdapat di dalamnya. Fase diam yang dipakai ialah silika gel 60 F254,
meru-pakan silika yang dibebaskan dari air, bersifat sedikit asam, tergolong fase normal, dan dapat berpendarflour. Larutan pengembang yang di-gunakan adalah DCM-MeOH. Gambar 4 (I) dan (II) memperlihatkan profil KLT ekstrak EtOAc kultur AFKR-5 dalam media PDB dan GYP.
Gambar 3 Ekstrak EtOAc kultur AFKR-5 media PDB (a) dan GYP (b).
VH= vanilin-H2SO4, CH = Ce(SO4)2 1%/H2SO4 10%
Gambar 4 Profil KLT ekstrak EtOAc kultur AFKR-5 media PDB (I) dan GYP (II). Kondisi KLT: pelat silika gel 60 F254, eluen: DCM-MeOH 10:1
(v/v), visualisasi di bawah UV 254 (a) dan 366 nm (b), setelah disemprot penampak noda VH (c) dan CH (d).
7
bioproduksi terbesar (Tabel 1). Hal ini ke-mungkinan disebabkan media PDB, meskipun lebih sederhana komposisinya dibandingkan dengan media GYP (Lampiran 1), mengan-dung sumber nutrisi kaya gizi (seduhan ken-tang) yang spesifik mendorong sporulasi ka-pang, produksi zat warna, dan pertumbuhan jamur secara subur (AOAC 1995, MacFaddin 1985). Secara umum biosintesis metabolit se-kunder ini berasosiasi dengan proses sporulasi (Agusta 2009).
Penampak-noda vanilin-H2SO4 atau
ani-saldehida 0.5% dalam H2SO4-HOAc
glasial-MeOH 5:10:85 digunakan untuk mendeteksi terpenoid, umumnya menghasilkan bercak berwarna ungu, biru, atau merah. Warna ungu menunjukkan triterpenoid, warna hijau biru menunjukkan steroid. Senyawa lain yang da-pat dideteksi ialah monoterpena (jingga tipis, biru, hijau kebiru-biruan); seskuiterpena (hijau kecokelatan, biru gelap, ungu, lembayung muda, merah marun, dan hijau tua), iridoid/ monoterpena lakton (biru, ungu, merah-jing-ga, merah); terpena alkohol (jingga kebiruan); ester geranil, terpinil, neril asetat (biru kela-bu); fenolat (merah muda untuk resorsinol dan floroglusinol, flavonoid lignan, fenilprope-na/fenilpropanoid; serta fase minyak atsiri/n -heksana (merah jambu untuk estragol, anetol, timol; cokelat untuk miristisin, apiol, dan eugenol; merah untuk isoeugenol). Reagen Ce(SO4)2 1%/H2SO4 10% digunakan dalam
mendeteksi keberadaan beberapa tipe alkaloid dan komponen lainnya (Houghton & Raman 1998; Gocan 2004; Harborne 2006).
Potensi Antimikrob Ekstrak Kultur
Berdasarkan Gambar 4 diketahui bahwa ekstrak kultur AFKR-5 memiliki beberapa profil metabolit sekunder. Di antaranya mung-kin ada yang mempunyai aktivitas biologis, tetapi ada pula yang tidak. Oleh karena itu, perlu dilakukan uji aktivitas biologis. Uji diarahkan pada aktivitas sebagai antimikrob. Secara etnofarmasi, tumbuhan A. flava digu-nakan oleh masyarakat sebagai obat tradisio-nal dan memiliki aktivitas biologi sebagai an-timikrob (Dzulkarnain et al. 1996; Subeki et al. 2005).
Uji aktivitas dilakukan secara kualitatif dengan menggunakan 2 kelompok mikroor-ganisme uniselular target, yaitu bakteri (pro-kariotik) dan kapang (eu(pro-kariotik). Bakteri tar-get yang digunakan meliputi bakteri Gram positif S. aureus dan Gram negatif E. coli, se-dangkan kapang yang digunakan ialah C.
albicans. Mikrob target yang digunakan selu-ruhnya patogen terhadap manusia.
Uji bioaktivitas antimikrob dilakukan de-ngan metode difusi cakram. Larutan stok eks-trak yang diketahui konsentrasinya diserap dengan cakram kertas dan dikontakkan de-ngan media yang telah diinokulasi mikrob uji. Untuk menurunkan limit deteksi, sistem ter-lebih dahulu dibiarkan pada suhu rendah se-lama beberapa jam sebelum diinokulasi. Per-lakuan ini memberikan kesempatan kepada larutan stok untuk berdifusi sebelum mikrob tumbuh. Inkubasi selanjutnya dilakukan pada suhu yang sesuai untuk pertumbuhan mikrob uji, yaitu 37 °C untuk bakteri dan 30 °C untuk kapang selama 2448 jam. Apabila terjadi hambatan pertumbuhan terhadap mikrob uji, maka akan terlihat zona bening pada tempat-tempat tertentu sepanjang ekstrak bermigrasi pada lempengan cakram. Aktivitas senyawa uji dinyatakan dengan zona bening ini.
Hasil uji aktivitas menunjukkan bahwa pada konsentrasi 100 µg/cakram terhadap mikrob uji, hanya ekstrak EtOAc kultur dengan media PDB yang berpotensi sebagai antimikrob dengan spektrum luas karena menghasilkan zona hambat terhadap semua mikrob uji, terutama kapang C. albicans
(Tabel 2). Hasil ini juga menunjukkan bahwa fraksi air kultur jamur AFKR-5 tidak menun-jukkan aktivitas penghambatan. Sebelumnya telah dilaporkan bahwa pelarut organik memi-liki efisiensi lebih tinggi dalam mengekstraksi senyawa untuk aktivitas antimikrob diban-dingkan dengan air (Lima-Filho et al. 2002).
Tabel 2 Uji aktivitas penghambatan mikrob oleh ekstrak EtOAc kultur AFKR-5 konsentrasi 100 µg/cakram
Sampel AFKR-5
Aktivitas daya hambat Kapang uji Bakteri uji
C. albicans S. aureus E.coli
air PDB - - -
GYP - - -
EtOAc PDB + + +
GYP - - -
Kontrol (+)
Kloramfenikol - + +
Nistatin + - -
Kontrol (-) aseton - - -
+ terbentuk zona bening
Aktivitas antibakteri ekstrak EtOAc terha-dap S. aureus dan E. coli lebih lemah diban-dingkan dengan aktivitas antijamur terhadap
kom-8
petisi di antara kelompok mikroorganisme. Hal ini memicu jamur endofit memiliki ka-rakteristik antimikrob berspektrum luas. Bio-sintesis senyawa antimikrob berperan penting dalam proses pelekatan, kolonisasi target, hingga kompetisi dalam mendapatkan ruang dan nutrisi dengan mikrob lainnya (Long & Farook 2001; Romanengko et al. 2008).
Gambar 5 Zona hambat ekstrak EtOAc kul-tur AFKR-5 media PDB konsen-trasi 100 µg/cakram terhadap E.
coli (a), S. aureus (b), dan C. al-bicans (c).
.
Hasil Partisi dan Fraksionasi Ekstrak Kultur Aktif
Profil KLT ekstrak EtOAc kultur jamur endofit AFKR-5 dalam media PDB masih memperlihatkan beberapa komponen dengan
Rf besar. Komponen ini diduga bersifat non-polar, seperti lemak, minyak, atau hidrokar-bon jenuh, karena terjerap sedikit atau tidak terjerap sama sekali pada fase diam yang ber-sifat polar (Stahl 1985). Untuk memudahkan isolasi zat antimikrob dalam kultur, kompo-nen yang bersifat polar dan nonpolar dipisah-kan. Di samping itu, lemak dan minyak ter-kadang tidak terlalu aktif secara biologis (Houghton & Raman 1998), dapat menggang-gu proses difusi komponen bioaktif, dan dapat melindungi sel bakteri dari senyawa antimik-rob (Moshi & Mbwambo 2005). Oleh karena itu, diharapkan potensi antimikrob komponen bioaktif ekstrak lebih besar setelah dipartisi. Partisi cair-cair menggunakan pelarut n- hek-sana-MeOH 1:1 (v/v) sebanyak 3× ulangan (Gambar 6).
Gambar 6 Profil partisi n-heksana-MeOH (1:1) (v/v) ekstrak EtOAc kultur AFKR-5 media PDB.
Ekstrak EtOAc lebih banyak terpartisi da-lam fraksi MeOH, menunjukkan bahwa
kom-ponen ekstrak lebih banyak yang bersifat po-lar. Rendemen fraksi MeOH dan n-heksana berturut-turut 68.8dan 33.2% (Tabel 3). Pola KLT masing-masing fraksi dipantau dan di-bandingkan dengan ekstrak EtOAc awal.
Tabel 3 Hasil partisi ekstrak EtOAc kultur AFKR-5 media PDB dengan n -hek-sana-MeOH (1:1) (v/v)
Fraksi ekstrak
Bobot Rendemen Warna
rendemen
(g) (% b/b)
MeOH 0.3852 68.8 Merah-cokelat
n-heksana 0.1912 33.2 Putih-kuning
Berdasarkan Gambar 7, sudah terjadi pe-misahan antara komponen polar dan nonpolar. Walaupun beberapa bercak sama nilai Rf-nya, warna yang dihasilkan dengan reagen penam-pak-noda berbeda. Hal ini menunjukkan kom-ponen yang berbeda. Misalnya, pada Gambar 7f.2 garis yang melengkung pada kira-kira Rf = 0.7 berwarna cokelat dan bercak di atasnya berwarna merah menunjukkan komponen mi-nyak (Harborne 2006).
Gambar 7 Profil KLT ekstrak EtOAc kultur AFKR-5 media PDB (a, c, dan e) dan hasil partisi MeOH (1) dan n -heksana (2) (b, d, dan f). Kondisi KLT: pelat silika gel60 F254,
elu-en: DCM-MeOH 10:1 (v/v), visu-alisasi di bawah UV 366 nm (a dan b), setelah disemprot penam-pak noda VH (c dan d) dan CH (e dan f).
9
Gambar 8 Fraksi-fraksi ekstrak EtOAc kultur AFKR-5 media PDB fraksi MeOH.
Tabel 4 Bobot dan warna fraksi-fraksi pada Gambar 8.
Fraksi Bobot (mg) Warna No tabung
F1 1.4 Kuning + 1
F2 0.9 Kuning + 2
F3 22.6 Jingga 35
F4 9.1 Cokelat jingga ++ 68
F5 5.7 Cokelat jingga + 911
F6 11.9 Cokelat jingga + 1223
F7 4.9 Cokelat jingga + 2437
F8 8.5 Cokelat jingga ++ 3859
F9 12 Cokelat jingga +++ 6088
F10 47.9 Hitam 89habis
Aktivitas Antimikrob Fraksi Dominan
Fraksi n-heksana ekstrak EtOAc AFKR-5 PDB dan fraksi dominan ekstrak EtOAc fraksi MeOH (F3 dan F10) diuji kembali bioaktivi-tas antimikrobnya menggunakan metode difu-si cakram dengan konsentradifu-si 10 µg/cakram. Hanya fraksi F3 yang bersifat antimikrob (Tabel 5; Gambar 9). Hal ini menandakan fraksi F3 dalam ekstrak aktif tidak bekerja sinergis da-lam menghambat pertumbuhan mikrob. Daya hambatnya tetap ada walaupun senyawa tersebut tidak berada bersama de-ngan senyawa lain dalam ekstrak.
Tabel 5 Aktivitas penghambatan mikrob frak-si dominan ekstrak EtOAc kultur AFKR-5 media PDB
Sampel
Aktivitas daya hambat Kapang uji Bakteri uji
C. albicans S. aureus E.coli
Fraksi MeOH
F3 + + +
F10 - - -
Fraksi n-heksana - - -
Kontrol (+) Kloramfenikol - + +
Nistatin + - -
Kontrol (-) aseton - - -
+ menghambat pertumbuhan mikrob uji
Gambar 9 Zona hambat fraksi F3 konsentra-si 100 µg/cakram terhadap E. coli
(a), S. aureus (b), C. albicans (c).
Hasil Isolasi dan Pemurnian Metabolit Sekunder Fraksi Teraktif Ekstrak Kultur
Profil KLT fraksi F3 ditunjukkan pada Gambar 10. Warna bercak yang terdeteksi be-ragam, bergantung pada pendeteksian yang di-gunakan. Dalam profil KLT ekstrak EtOAc, fraksi F3 terdeteksi berwarna biru-keunguan setelah disemprot penampak noda vanilin-H2SO4, setelah dipartisi dalam fraksi MeOH
dan disemprot reagen yang sama berwarna ungu, bercak berwarna kuning pudar sebelum disemprot reagen, dan berwarna merah muda dan abu-abu kecoklatan setelah disemprot Ce(SO4)2 1%/H2SO4 10%. Diduga fraksi F3
mengandung metabolit sekunder golongan terpenoid (Houghton & Raman 1998, Harbor-ne 2006).
VH= vanilin-H2SO4, CH = Ce(SO4)2 1%/H2SO4 10%
Gambar 10 Profil KLT fraksi F3 dalam eks- trak EtOAc: setelah disemprot
VH (biru-keunguan) (a), fraksi MeOH (I) dan n-heksana (II) se-telah disemprot VH (ungu) (b) dan CH (merah muda) (c), fraksi MeOH: orisinal (kuning pudar) (d), di bawah UV 254 nm (e), se-telah disemprot VH (ungu) (f), dan setelah disemprot CH (abu-abu kecokelatan) (g).
Pemisahan lanjutan terhadap fraksi F3 dilakukan dengan KLT preparatif karena ren-demen fraksi sedikit dan nilai Rf antar fraksi berdekatan, sehingga kurang efektif jika dipi-sahkan dengan kromatografi kolom. Fase diam yang digunakan ialah pelat KLT silika gel 60 F254 (Merck) dan fase geraknya
be-10
lakang merah muda. Oleh karena itu, ketiga fraksi tersebut diduga berasal dari golongan terpenoid.
Gambar 11 Profil KLT preparatif fraksi F3. Kondisi KLT: pelat silika gel60 F254, eluen: DCM-aseton (5:1)
(v/v), visualisasi: UV 254 nm.
Gambar 12 Profil KLT fraksi-fraksi hasil KLT preparatif F3. Kondisi KLT: pelat KLT silika gel60 F254, eluen
DCM-aseton (5:1), visualisasi: cahaya matahari (a), UV 254 (b), dan 366 nm (c).
Nilai Rf fraksi F3.1–F3.5 berturut-turut 0.72, 0.56, 0.50, 0.30, dan 0.16 (Gambar 12). Seluruh fraksi dikerok dan dilarutkan dengan aseton lalu dipekatkan dengan penguap putar. Hasilnya dapat dilihat pada Gambar 13, bo-botnya ditunjukkan di Lampiran 5. Fraksi F3.4 merupakan komponen dominan fraksi F3 dengan bobot 8.3 mg (41% b/b fraksi F3). Bila dihitung berdasarkan rendemen kultur, maka ekstrak kultur AFKR-5 mampu melaku-kan bioproduksi komponen F3.4 sebesar 10.375 mg/L. Selanjutnya fraksi F3.4 ditentu-kan nilai penghambatannya terhadap mikrob uji.
Gambar 13 Fraksi-fraksi hasil KLT preparatif F3.
Bioaktivitas Antimikrob Isolat Metabolit Sekunder Dominan Fraksi Teraktif
Diameter Daya Hambat
Uji bioaktivitas antimikrob fraksi F3 juga dilakukan dengan metode difusi cakram Kirby-Bauer. Dengan metode difusi ini,
anti-mikrob uji diserap dengan kertas cakram dan dikontakkan dengan media agar-agar yang te-lah diinokulasi mikrob uji pada jumte-lah terten-tu. Air segera diserap ke dalam cakram dari media agar-agar, sementara antimikrob mulai berdifusi ke dalam agar-agar disekitarnya. La-ju difusi melalui agar-agar tidak secepat laLa-ju keluarnya antimikrob dari cakram. Karena itu, konsentrasi antimikrob paling tinggi paling ada di dekat cakram dan menurun secara loga-ritmik sebagai fungsi jarak dari cakram ( Jor-gensen & Turnidge 2007). Laju difusi anti-mikrob melalui agar-agar bergantung pada sifat difusi dan kelarutan (Bauer et al. 1966) serta bobot molekul senyawa antimikrob. Mo-lekul yang lebih besar akan menyebar lebih lambat. Setelah diinkubasi selama 24 jam, apabila terjadi hambatan pertumbuhan terha-dap mikrob uji, maka akan terlihat zona bening. Diameter daerah bening ini merupa-kan daerah inhibisi sampel uji terhadap mik-rob uji. Semakin besar diameternya, semakin besar aktivitas antimikrob.
Diameter daya hambat (DDH) komponen bioaktif F3.4 terhadap mikrob uji meningkat dengan meningkatnya konsentrasi (Tabel 6). Pada konsentrasi 100 µg/cakram, F3.4 meng-hasilkan DDH untuk bakteri uji Gram negatif
E. coli dan Gram positif S. aureus sebesar 9 dan 8 mm (Gambar 14.Ia dan b; Tabel 6). Dengan konsentrasi yang sama, F3.4 meng-hasilkan DDH yang lebih sensitif terhadap kapang uji C. albicans, yaitu 13 mm (Gambar 14.Ic; Tabel 6). Berdasarkan hasil tersebut, dapat dikatakan bahwa F3.4 merupakan anti-mikrob berspektrum luas, yang dapat meng-hambat pertumbuhan mikroorganisme proka-riotik seperti bakteri Gram negatif maupun positif, maupun eukariotik (kapang).
Gambar 14 Zona hambat fraksi F3.4 (I), kontrol positif Kloramfenikol (IIa dan IIb), dan Nistatin (IIc), pada konsentrasi 100 µg/cakram terhadap: E. coli (a), S. aureus
11
Tabel 6 Diameter daya hambat fraksi F3.4
Sampel
Konsentrasi 10 µg/µL
(µL)
Rerata diameter DDH (mm) Kapang uji
C. albicans
Bakteri uji
S. aureus E.coli
F3.4 5
10 9 13 6.5 8 7 9 Kontrol (-)
aseton 20 - - -
Kontrol (+) Kloramfenikol 5 10 20 - - - 7 10 13.5 12 17 20 Kontrol (+) Nistatin 5 10 20 10 15 18 - - - - - -
Nilai DDH kontrol positif Kloramfenikol sebagai antibakteri komersial dan Nistatin se-bagai antijamur komersial juga meningkat de-ngan meningkatnya konsentrasi zat uji (Tabel 6). Pada konsentrasi 100 µg/cakram, Kloram-fenikol menghasilkan nilai DDH terhadap bakteri E. coli dan S. aureus sebesar 17 dan 10 mm (Gambar 14.IIa dan b; Tabel 6). Dari hasil ini, Kloramfenikol didapati lebih efektif dalam menghambat pertumbuhan kedua bak-teri. Kloramfenikol diketahui bersifat bakte-riostatik berspektrum luas, artinya dapat menghambat pertumbuhan bakteri Gram posi-tif maupun negaposi-tif, tetapi tidak membunuhnya sehingga pembasmian bakteri sangat bergan-tung pada daya tahan tubuh inang (Katzung 2001). Mekanisme kerja Kloramfenikol dalam melawan bakteri adalah dengan menghambat sintesis protein dengan cara berikatan dengan subunit 50s pada ribosom dan berefek pada penghambatan pembentukan protein (Pelczar & Chan 2010). Namun, bakteri S. aureus dan
E. coli bersifat resisten baik terhadap fraksi F3.4 maupun kontrol positif Kloramfenikol karena meng-hasilkan DDH < 14 mm pada konsentrasi zat uji sebesar 50 µg/cakram.
Nilai DDH Nistatin pada konsentrasi 100 µg/cakram terhadap bakteri kapang uji C. albicans sebesar 15 mm(Gambar 14.IIc; Ta-bel 6). Dibandingkan dengan fraksi F3.4 yang menghambat bakteri dan kapang, aktivitas Nistatin terbatas hanya pada kapang dan cen-dawan lain dengan cara bergabung dengan sterol yang terdapat dalam membran sel. Hal ini mengakibatkan kacaunya organisasi di da-lam struktur molekular membran, diikuti de-ngan gangguan pada fungsinya. Sterol bukan komponen membran bakteri sehingga Nistatin tidak efektif bagi bakteri (Agusta 2006; Pelc-zar & Chan 2010).
Konsentrasi Hambat Minimum
Konsentrasi hambat minimum (KHM) adalah konsentrasi terendah antimikrob yang dapat menghambat pertumbuhan mikrob ter-tentu. Penentuan nilai KHM digunakan oleh
laboratorium diagnostik terutama untuk me-ngonfirmasi resistensi dan juga untuk menen-tukan aktivitas in vitro antimikrob baru. Nilai KHM spesifik untuk setiap kombinasi anti-mikrob dan anti-mikrob, dan digunakan untuk me-nentukan kepekaan mikrob terhadap anti-mikrob tersebut. Semakin rendah nilai KHM sebuah antimikrob, semakin peka mikrobnya.
Prinsip dasar penentuan KHM adalah mikrob uji yang disiapkan dengan kepadatan tertentu diinkubasi dengan larutan stok yang akan diuji aktivitas antimikrobnya pada kon-sentrasi berseri yang semakin kecil. Setelah inkubasi, pertumbuhan mikrob ditentukan se-cara visual atau dengan membandingkan ke-keruhan kultur uji dengan kultur kontrol. Kontrol pertumbuhan (GC) adalah kultur yang berisi media dan inokulum mikrob uji, tetapi tidak diberi sampel yang akan diuji bioak-tivitasnya. Setelah masa inkubasi, GC akan terlihat keruh yang menandakan terjadinya pertumbuhan mikrob. GC dapat digunakan se-bagai standar tidak terjadinya penghambatan pada sumuran uji yang berisi sampel uji. Kon-trol negatif berisi media dan inokulum mikrob ditambah pelarut DMSO. Tujuannya memasti-kan bahwa DMSO sebagai pelarut sampel uji tidak memiliki aktivitas penghambatan terha-dap mikrob uji. Blangko hanya berisi media kultur sebagai kontrol untuk memastikan tidak terjadi kontaminasi pada pengujian ini. Kon-sentrasi sampel uji terendah yang menghasil-kan tingkat kejernihan sumur uji mirip dengan blangko dapat ditentukan sebagai nilai KHM (Lampiran 6). Nilai KHM fraksi F3.4 terhadap bakteri Gram positif S. aureus, Gram negatif
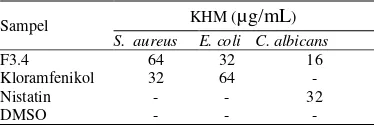
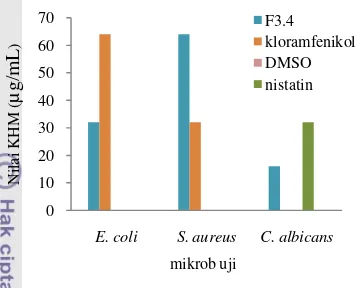
E. coli, dan kapang C. albicans menunjukkan tingkat kepekaan yang meningkat, berturut-turut sebesar 64, 32, dan 16 µg/mL (Tabel 7). Aktivitas antimikrob dapat dibandingkan de-ngan aktivitas kontrol positif Kloramfenikol dan Nistatin.
Tabel 7 Hasil uji KHM fraksi F3.4
Sampel KHM (µg/mL)
S. aureus E. coli C. albicans
F3.4 64 32 16
Kloramfenikol 32 64 -
Nistatin - - 32
DMSO - - -
konsen-12
trasi bunuh minimum (KBM) fraksi F3.4 ter-hadap kapang uji C. albicans (Lampiran 7), dengan kultivasi pada media PDA.
Gambar 15 Nilai KHM fraksi F3.4.
Bakteri uji S. aureus menunjukkan kepe-kaan yang lebih lemah dibandingkan dengan bakteri E. coli. Hal ini dapat dikarenakan bak-teri S. aureus cepat menjadi resisten terhadap beberapa antibakteri (Jawetz et al. 2001) atau karena fraksi F3.4 lebih potensial dalam menghambat bakteri Gram negatif. Bakteri Gram positif umumnya lebih peka terhadap senyawa antibakteri karena dinding selnya mengandung lapisan peptidoglikan yang lebih tebal (90%) dibandingkan dengan bakteri Gram negatif (520%). Senyawa antibakteri dapat mencegah sintesis peptidoglikan pada sel yang sedang tumbuh, maka bakteri Gram positif seharusnya lebih peka dibandingkan dengan Gram negatif (Fardiaz & Jenie 1988). Sekalipun terdapat perbedaan, fakta bahwa bakteri Gram negatif adalah patogen paling utama dibandingkan dengan Gram positif me-munculkan wawasan baru terhadap perkem-bangan antibakteri Gram negatif yang berasal dari jamur endofit.
Mekanisme kerja antibakteri dapat terjadi melalui berbagai jalur antara lain dengan me-rusak struktur dinding sel, dengan cara meng-hambat pembentukannya atau mengubahnya setelah selesai terbentuk; mengubah permea-bilitas sel yang akan mengakibatkan terham-batnya pertumbuhan atau matinya sel; meru-sak molekul protein dan asam nukleat; meng- hambat kerja enzim; atau menghambat sintesis asam nukleat dan protein (Pelczar & Chan 2010). Sementara mekanisme kerja antijamur secara garis besar terbagi atas 2 jalur, yaitu apoptosis dan non-apoptosis. Mekanisme anti-jamur melalui proses apo-ptosis salah satunya ditandai dengan terjadinya degradasi DNA se-cara terpola dengan panjang 180 pasangan-ba-sa. Proses ini identik dengan proses apoptosis
pada sel mamalia/kanker (Talaro 2008). Pada penelitian ini belum dapat dipastikan mekanis-me penghambatan mikrob uji oleh fraksi F3.4. Namun, AFKR-5 dapat dikembangkan ke arah obat antijamur karena bersifat fungisida sete-lah menjalani uji klinis lebih lanjut.
SIMPULAN DAN SARAN
SimpulanJamur endofit AFKR-5 yang berasosiasi dengan tumbuhan akar kuning asal Kebun Ra-ya Bogor dapat melakukan bioproduksi kom-ponen bioaktif sebagai antimikrob berspek-trum luas terhadap bakteri Gram positif S. au-reus, Gram negatif E. coli, dan kapang pato-gen C. albicans. Media kultivasinya ialah PDB dengan kondisi kultivasi menggunakan pengocok pada kecepatan 120 rpm, suhu 27 °C selama 2 minggu, menghasilkan F3.4 se-besar 10.375 mg/L. Aktivitas penghambatan terbesar ialah terhadap kapang Candida albi-cans dengan nilai DDH pada konsentrasi 100 µg/cakram sebesar 13 mm, nilai KHM sebesar 16 µg/mL, dan bersifat fungisidal dengan nilai KBM 32 µg/mL. Aktivitas F3.4 2× lebih baik dibandingkan dengan antijamur komersial Nistatin yang hanya bersifat fungistatik de-ngan nilai KHM sebesar 32 µg/mL. Oleh ka-rena itu, isolat AFKR-5 dalam media PDB berpotensi dikembangkan sebagai antimikrob, khususnya menjadi obat antijamur.
Saran
Perlu dilakukan optimasi faktor-faktor yang memengaruhi produksi antimikrob kul-tur jamur endofit AFKR-5. Di samping itu, perlu dilakukan identifikasi jamur endofit AFKR-5, serta analisis lebih lanjut berupa nentuan struktur komponen bioaktif F3.4, pe-nentuan mekanisme antimikrobnya, dan peng-ujian secara klinis agar dapat digunakan untuk pengembangan antimikrob khususnya antija-mur untuk manusia.
DAFTAR PUSTAKA
[AOAC] Association of Official Analytical Chemists. 1995. Bacteriological Analyti-cal Manual. Ed ke-8. Gaithersburg MD: AOAC International.
Agusta A. 2006. Diversivitas jalur biosintesis senyawa terpena pada makhluk hidup se-0 10 20 30 40 50 60 70
E. coli S. aureus C. albicans
13
bagai target obat antiinfektif: tinjauan ula-ng. Berita Biol 8:142-151.
Agusta A, Ohashi K, Shibuya H. 2006. Com-position of the endophytic fungi isolated from tea plant Camelia sinensis. J Nat Med 60:268-272.
Agusta A. 2009. Biologi dan Kimia Jamur En-dofit. Bandung: ITB Pr.
Agusta A, Jamal Y, Praptiwi, Fathoni A. 2010. Biooxidation of berberine by the endophytic fungus Coelomycetes AFKR-1 isolated from kayu kuning [Archangelisia flava (L.) MERR: Menispermaceae]. Di dalam: Biotechnology for Enhancement The Tropical Biodiversity. International Seminar Biotechnology for Enhancement The Tropical Biodiversity; Bandung, 18-20 Okt 2010. Bandung: Universitas Pajajaran, 2010. hlm hlm 1-6.
Atlas RM. 1993. Handbook of Microbiolo-gical Media. Boca Raton: CRC Pr.
Azevedo JL, W Maccheroni, JO Pereira, W Luiz. 2000. Endophytic microorganism: A review on insect control and recent advan-ces on tropical plants. ElectrJ Biotechnol
3:40-65.
Bacon CW, White JF. 1994. Biotechnology of Endophytic Fungi of Grasses. Boca Raton: CRC Pr.
Bacon CW, White JF. 2000. Microbial Endo-phytes. New York: Marcel Dekker.
Batubara I. 2003. Saponin akar kuning ( Arca-ngelisia flava (L) Merr) sebagai hepato-protektor: ekstraksi, pemisahan, dan bioak-tivitasnya [tesis]. Bogor: Program Pasca-sarjana, Institut Pertanian Bogor.
Bauer AW, Kirby WMM, Sherris JC, Turck M. 1966. Antibiotic susceptibility testing by a standardized single disk method. Am J Clin Pathol 36:493-496.
Benson. 2001. Microbiological Applications Lab Manual. Ed ke-8. Fornango J, Smith J, editor. New York: McGraw-Hill.
Branen AL, Davidson PM. 1993. Antimicro-bial in Food. New York: Marcel Dekker.
[CLSI] National Committee for Clinical Labo-ratory Standards Institute. 2003. Methods for Dilution Antimicrobial Susceptibility Tests for Bacteria that Grow Aerobically, Approved Standard. Ed ke-6. Wayne PA: CL-SI.
[CLSI] National Committee for Clinical Labo-ratory Standards Institute. 2006. Performa-nce Standards for Antimicrobial Disk Sus- ceptibility Testing, Approved Standard. Ed ke-9. CLSI Document M2 A9.26:1. Way-ne PA: CLSI.
Calvo AM, Hinze LL, Gardner HW, Keller NP. 1999. Sporogenic effect of polyunsa-turated fatty acids on development of
Aspergillus spp. Appl Environ Microbiol
65:3668.
Calvo AM, Wilson RA, Bok JW, Keller NP. 2002. Relationship between secondary metabolism and fungal development. Mic-robiol Mol Biol Rev 66:447.
Carrol GC. 1988. Fungal endophytes in stem and leaves from latent pathogens to mutua-listic symbiont. Ecology 69:2-9.
Castillo UF, Strobel GA, Ford EJ, Hess WM, Poter H, Jenson JB, Albert H, Robinson R, Condron MA, Teplow DB et al. 2002. Munumbicins, wide spectrum antibiotics produced by Steptomyces NRRL 30562, endophytic on Kennedia nigriscans. Mic-robiology 148:2675-2685.
Castillo UJ. Harper K, Strobel GA, Sears J, Alesi K, Ford E, Lin J, Hunter M, Maranta M, Ge H et al. 2003. Kakandumycins, no-vel antibiotica from Streptomyces sp. NR-RL 30566, an endophyte of Grevillea pte-ridifolia.FEMS Lett 24:183-190.
Choi YW, Hodgkiss IJ, Hyde KD. 2005. En-zyme production by endophytes of Brucea javanica. J Agric Tech 1:55-65.
Clay K. 1988. Fungal endophytes of grasses: A defensive mutualism between plants and fungi. Ecology 69:10-16.
14
Fardiaz S, Jenie BSL. 1988. Microbiologi Pa-ngan II. Bogor: PAU IPB.
Gocan S, 2004. Analysis of Terpenoids by Thin-Layer Chromatography. Di dalam: Cazes J, editor. Encyclopedia of Chroma-tography. New York: Marcel Dekker. hlm 1-6.
Guo B, Dai J, Ng S, Huang Y, Leong C, Ong W, Carte BK.. 2002. Cytonic acid A dan B, novel tridepside inhibitor of hCMV protease from the endophytic fungus Cy-tonaena sp. J Nat Prod 63:602-604.
Harborne JB. 2006. Metode Fitokimia. Ed ke-2. Padmawinata K, Soediro I, penerjemah; Bandung: Penerbit ITB. Terjemahan dari:
Phytochemical Methods.
Heyne K. 1987. Tumbuhan Berguna Indone-sia. Ed ke-4. Balitbang Kehutanan, pener- jemah. Jakarta: Yayasan Sarana Warna. Terjemahan dari: Useful Indonesian Plants.
Houghton PJ, Raman A. 1998. Laboratory Handbook for the Fractination of Natural Extracts. Ed ke-1. London: Chapman & Hall.
Jamal Y, Ilyas M, Katit A, Agusta A. 2008. Diversitas dan profil metabolit sekunder jamur endofit yang diisolasi dari tumbuhan gambir (Uncaria gambier) serta aktivitas-nya sebagai antibakteri. Berita Biol 9:149-154.
Jamal Y, Ilyas M, Katit A, Agusta A. 2009. Keragaman jenis jamur endofit pada tum-buhan pandan wangi (Pandanus amary-lifolius) dan aktivitas antijamur metabolit yang diproduksinya. Biota 14:81-86.
Jamal Y. Praptiwi, Fathoni A, Agusta A. 2011. Bioproduksi floroglusinol oleh ja-mur endofit coelomycetes AFAS-F3 yang diisolasi dari tumbuhan Arcangelisia fla-va L. Merr. Berk Penel Hayati 16:169-172.
Jawetz E, Melnick J, Adelberg E. 2001. Mik-robiologi Kedokteran. Ed ke-20.
Jorgensen JH, Turnidge JD. 2007. Susceptibi-lity test methods: dilution and disk diffu-sion methods. Di dalam: Murray PR, Ba-ron EJ, Jorgensen JH, Landry M, Pfaller M, editor, Manual of Clinical
Microbio-logy. Ed ke-9. Washington DC: ASM Pr. hlm 1152-1172.
Katzung BG. 2001. Basic and Clinical Phar-macology. Ed ke-8. San Fransisco: Mc- Graw-Hill.
Kaur K, Jain M, Kaur T, Jain R. 2009. Anti-malarials from nature. Bioorg Med Chem
17:2950-2962.
Keawpradub N, Yuenyongsawad S, Dejadisai S. 2005. Antioxidant and cytotoxic activities of Thai medicinal plants named khamin-khruea: Arcangelisia flava, Coscinum blu-meanum, and Fibraurea tinctoria. Songkla-nakarin J Sci 27:455-467.
Krebs KG, Heusser D, Wimmer H. 1969.
Spray Reagents. Di dalam: Stahl E, editor.
Thin Layer Chromatography: A Labor tory Handbook. Berlin: Springer -Verlaag. hlm 855-911.
Kumala S. 2005. Isolasi dan penapisan mik-roba endofit tanaman Brucea-javanica (L) Merr. serta uji sitotoksik metabolit sekun-der terhadap beberapa sel kanker secara in vitro [disertasi]. Jakarta: Program Pasca-sarjana, Universitas Indonesia.
Lee J. Lobkovsky E. Pliam NB, Strobel GA, Clardy J. 1995. Subglutinols A and B; im-munosuppressive compounds from the en-dophytic fungus Fusarium subglutinans. J Org Chem 60:7076-7077.
Li J, Strobel GA, Sidhu R, Hess WM, Ford EJ. 1996. Endophytic taxol producing fungi from bald cypress, Taxodium disti-chum. Microbiology 142:2223-2226.
Lima-Filho JVM., Carvalho AFFU, Freitas SM, Melo VMM. 2002. Antibacterial activity of extracts of six macroalgae from the northeastern Brazilian coast.
Braz J Microbiol 33:311-313.
Long RA, Farook A. 2001. Antagonistic interactions among marine pelagic bacte-ria. Appl Environ Microbiol 67:4975-4983.
15
Moshi MJ, Mbwambo ZH. 2005. Some phar-macological properties of extract of Termi-nalia sericea roots. J Ethnopharm 97:43-47.
MacFaddin JF. 1985. Media for Isolation Cultivation-Identification Maintenance of Medical Bacteria. Vol ke-1. Baltimore: Williams & Wilkins.
Meistiani Y. 2001. Isolasi dan identifikasi se-nyawa alkaloid dari akar kuning ( Arca-ngelisia flava (L) Merr) [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengeta-huan Alam, Institut Pertanian Bogor.
Owen NL, Hundley N. 2004. Endophytes the chemical synthesizer inside plant. Sci Prog
87:79-99.
Pelczar MJ, Chan ECS. 2010. Dasar-dasar Mikrobiologi. Jilid ke-1 dan 2. Hadioetomo RS, Imas T, Tjitrosomo SS, Angka SL, penerjemah. Jakarta: UI Pr. Terjemahan dari: Elements of Microbiology.
Petrini OTN, Sieber LT, Viret O. 1992. Ecology metabolite production and substrate utili-zation in endophytic fungi. Nat Toxin 1:189-196.
Praptiwi, Jamal Y, Fathoni A, Agusta A, 2010. Antimicrobial metabolite from the culture of endophytic fungus AFK-8 isola-ted from kayu kuning (Archangelisia flava (L.) Merr. Di dalam: Biotechnology for Enhancement The Tropical Biodiver-sity. International Seminar Biotechnology for Enhancement The Tropical Biodiver-sity; Bandung, 18-20 Okt 2010. Bandung: Universitas Pajajaran, 2010. hlm 35-43.
Prihatiningtias W. 2006. Mikroba Endofit Sumber Penghasil Antibiotik yang Poten-sial. Fakultas Farmasi UGM. [terhubung berkala]. http://www.biotek.lipi.go.id/in-dex.html [19 Mar 2012].
Rao NS. 1994. Mikroorganisme Tanah dan Pertumbuhan Tanaman. Ed ke-2. Jakarta: UI Pr. Susilo H, penerjemah. Terjemahan dari: Soil Microorganisms and Plant Gro-wth.
Romanengko LA, Naoto T, Masataka U, Natalia IK, Valery VM. 2008. Diversity and antagonistik activity of sea ice
bacte-ria isolated from the sea of Japan. Micro Environ 23:209-214.
Sarker SD, Latif Z, Gray AI. 2006. Natural Products Isolation. Ed ke-2. (Methods in Biotechnology. Vol ke-20. New Jersey: Humana Pr.
Sarker SD, Nahar L. 2007. Chemistry for Pharmacy Student (General, Organic and Natural Product Chemistry). Chichester: J Wiley.
Setyowati FM, Wardah. 2007. Keaneka-ragaman tumbuhan obat masyarakat Talang Mamak di sekitar Taman Nasional Bukit Tigapuluh, Riau. Biodiversitas 8: 228-232.
Simamarta R, Sylvia L, dan Harmastini. 2007. Isolasi mikroba endofit dari tanaman obat sambung nyawa (Gyunura procumbens) dan analisis potensinya sebagai antimik-roba. Berk Penel Hayati 15:85-99.
Simanjuntak P, Parwati T, Bustanussalam, Prana TK, Wibowo S, Shibuya H. 2002. Isolasi dan kultivasi mikroba endofit peng-hasil senyawa alkaloid kinkona dari Chin-chona spp. J Mikrobiol 7:27-30.
Stahl E. 1985. Analisis Obat Secara Kromato-grafi dan Mikroskopi. Padmawinata K, Soediro I, penerjemah; Niksolihin S, edi-tor. Bandung: ITB Pr. Terjemahan dari:
Drug Analysis by Chromatography and Microscopy: a Practical Supplement to Pharmacopoeias.
Stierle A, Stierle D, Strobel GA. 1993. Taxol and taxane production by Taxomyces an-dreana, endophytic fungus of pacific yew.
Science 260:214-216.
Stierle A, Stierle D, Strobel G, Bignami G, Grothaus P. 1994. Endophytic fungi of pacific yew (Taxus brevifolia) as a source of taxol, taxanes, and other pharma-cophores in bioregulators for crop protec-tion and pest control. JAm Chem Soc 557: 64-77.
16
Strobel GA, Ford E, Woapong J, Harper JK, Arif AM, Grant DM, Fung PCW, Chan K. 2002. Isopestacin, an isobenzopuranone from Pestalotiopsis microspora, prosses-ing antifungal and antioxidant activities.
Phytochemistry 60:179-183.
Strobel GA, Daisy B. 2003. Bioprospecting for microbial endophytes and their natural products. Microbiol Mol Biol Rev 67:419- 502.
Subeki, Matsuura H, Takahashi K, Yamasaki M, Yamato O, Maede Y, Katakura K, Suzuki M, Trimurningsih, Chairul et al. 2005. Antibabesial activity of protoberbe-rine alkaloids and 20 hidroxyecdysone from Arcangelisia flava against Babesia gibsoni in culture. J Vet Med Sci 67:223-227.
Sung WS, Lee DG. 2007. Indole-3-carbaniol against human pathogenic microorgan-isms. Biol Pharm Bull 30:1865-1869.
Talaro KP. 2008. Foundation in Microbiologi.
Ed ke-6. New York: McGraw-Hill.
Tan RX, Zou WX. 2001. Endophytes: a rich source of functional metabolites. Nat Prod Rep 18:488-459.
Wallhausser KH. 1969. Antibiotics. Di dalam: Stah