SEBARAN DAN AKUMULASI LOGAM BERAT (Cu DAN Pb)
PADA IKHTIOFAUNA DI SUNGAI MUSI BAGIAN HILIR
PROVINSI SUMATERA SELATAN
WIKE AYU EKA PUTRI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa disertas berjudul “Sebaran dan Akumulasi Logam Berat (Cu dan Pb) pada Ikhtiofauna di Sungai Musi Bagian Hilir Provinsi Sumatera Selatan” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2016
Wike Ayu Eka Putri
RINGKASAN
WIKE AYU EKA PUTRI. Sebaran dan Akumulasi Logam Berat Cu dan Pb pada Ikhtiofauna di Sungai Musi bagian Hilir Provinsi Sumatera Selatan. Dibimbing oleh DIETRIECH G. BENGEN, TRI PRARTONO dan ETTY RIANI.
Sungai Musi merupakan satu dari sekian banyak sungai besar yang terdapat di Pulau Sumatera. Membentang sejauh kurang lebih 720 km, memiliki hulu di Provinsi Bengkulu dan bermuara ke Selat Bangka yang terdapat di Provinsi Sumatera Selatan. Kawasan hilir Sungai Musi telah banyak menerima masukan limbah akibat aktivitas manusia mulai dari hulu hingga hilir berupa pertanian, perkebunan, industri, transportasi dan pelabuhan. Kondisi ini dapat meningkatkan konsentrasi beberapa komponen kimia di perairan termasuk logam berat. Hal ini didukung oleh beberapa penelitian sebelumnya yang menemukan telah adanya akumulasi logam tertentu di perairan dan terhadap organisme yang hidup di daerah tersebut. Penelitian ini memiliki tiga tujuan utama yaitu : (1) menentukan sebaran logam berat Cu dan Pb dalam air dan sedimen di Sungai Musi bagian hilir; (2) mengungkap keberadaan kandungan logam berat Cu dan Pb yang terakumulasi di dalam jaringan organisme (plankton dan ikan) di Sungai Musi bagian hilir serta kajian bioakumulasi pada setiap organ dan jenis ikan dan (3) menjelaskan pengaruh logam berat terhadap kerusakan organ ikan.
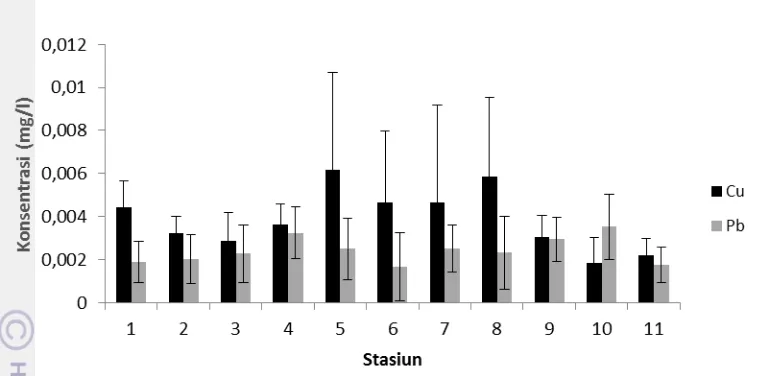
Hasil penelitian menunjukkan bahwa kandungan logam berat Cu (0,002-0,006 mg/l) dan Pb (0,002-0,004 mg/l) dalam fase terlarut telah melebihi konsentrasi alamilnya di perairan. Peningkatan ini dapat disebabkan oleh faktor alam seperti proses pelapukan tanah dan batuan yang terdapat di bagian hulu sungai. Selain itu, aktivitas manusia yang beragam di sepanjang aliran sungai dari hulu hingga hilir seperti pertanian, perkebunan, industri, transportasi, pemukiman dan pelabuhan serta lain sebagainya diduga juga berkontribusi terhadap peningkatan kandungan Cu dan Pb di perairan. Secara umum terlihat bahwa konsentrasi logam Cu terlarut lebih tinggi dibandingkan Pb. Sebaliknya, konsentrasi logam Pb (31,56-89,52 mg/kg) dalam bentuk tersuspensi ditemukan lebih tinggi dibandingkan Cu (5,65-15,17 mg/kg). Hal ini diduga karena adanya perbedaan daya larut diantara kedua jenis logam tersebut. Akumulasi logam Cu (6,14-15,28 mg/kg) dan Pb (5,79- 11,1 mg/kg) juga ditemukan di dalam sedimen di sepanjang aliran Sungai Musi bagian hilir. Logam Cu dan Pb juga ditemukan terakumulasi dalam organisme yang hidup di Sungai Musi bagian hilir. Akumulasi logam Cu (1,82-3,70 mg/kg) dan Pb (1,01-2,87 mg/kg) ditemukan pada organisme plankton yang hidup di daerah tersebut. Selanjutnya terdapat variasi akumulasi logam Cu dan Pb dalam setiap jenis dan organ ikan. Akumulasi logam dalam organ ikan berturut-turut terdapat pada hati>insang>daging. Organ hati mengakumulasi Cu (1,958-7,239 mg/kg) dan Pb (0,329-0,996 mg/kg) lebih tinggi dibandingkan daging (0,171-0,292 mg/kg Cu dan 0,157-0,204 mg/kg Pb) dan insang (0,807-1,158 mg/kg Cu dan 0,202-0,328 mg/kg Pb). Selain itu, konsentrasi Cu dan Pb juga bervariasi diantara keempat jenis ikan yang diamati. Insang dan hati ikan belanak (Mugil chepalus) mengakumulasi Cu lebih besar
Terdapat variasi nilai faktor bioakumulasi antar jenis ikan dan organ yang diamati. Ikan belanak memiliki kemampuan akumulasi logam Cu lebih tinggi dibandingkan ikan juaro, seluang dan sembilang. Kemampuan daging ikan belanak mengakumulasi logam Cu 123 kali lebih tinggi dibandingkan kandungan logam tersebut di perairan, insang 524 kali dan hati 3051 kali. Untuk logam Pb, daging dan insang ikan juaro memiliki kemampuan akumulasi Pb yang lebih tinggi dibandingkan ikan lainnya. Daging ikan juaro mampu mengakumulasi Pb 83 kali lebih tinggi dibandingkan konsentrasinya di air, adapun insang 158 kali sementara hati ikan seluang mampu mengakumulasi logam Pb 481 kali lebih tinggi dibandingkan konsentrasinya di perairan. Berdasarkan ambang batas yang ditetapkan oleh beberapa negara dan lembaga, dapat disimpulkan bahwa logam Pb dan Cu dalam semua organ dan jenis ikan belum tergolong ke dalam kriteria akumulatif (BAF ≤ 5000 l/kg). Meskipun demikian, akumulasi logam Cu pada hati ikan belanak dan seluang perlu diwaspadai karena lebih tinggi dibandingkan organ lainnya. Demikian juga halnya dengan plankton, secara umum terlihat bahwa plankton yang hidup di daerah Sungai Musi mampu mengakumulasi logam Cu dan Pb masing-masing sebanyak 741 kali dan 795 kali lebih tinggi dibandingkan keberadaannya di dalam air. Sementara plankton yang terdapat di Muara Sungai Musi memiliki kemampuan mengakumulasi Cu dan Pb masing-masing sebanyak 698 dan 603 kali lebih tinggi dibandingkan ketersediaan logam tersebut di perairan.
Hasil pengamatan terhadap jaringan organ insang semua jenis ikan menunjukkan bahwa lamela primer semua jenis ikan berada dalam kondisi normal. Jaringan kartilago sebagian nampak utuh namun pada ikan belanak telah mengalami kerusakan. Lamela sekunder tampak mengalami penambahan sel (hyperplasia epitel) sehingga ujung lamela sekunder lebih tebal. Beberapa penyebab utama meningkatnya jumlah sel dalam jaringan adalah iritasi kronis oleh logam dan infeksi beberapa jenis virus. Selanjutnya insang ikan belanak dan sembilang mengalami hiperplasia yang lebih parah dibandingkan ikan jenis lainnya bahkan sudah mengarah ke kondisi fusi. Pengamatan terhadap organ hati menunjukkan umumnya sel hati semua jenis ikan mengalami pembengkakan sel hati (edema). Kerusakan paling parah terjadi pada hati ikan belanak, inti sel mengalami kerusakan bahkan telah dikeilingi oleh sel radang. Akumululasi Cu dan Pb yang lebih tinggi dalam kedua organ ini berkontribusi terhadap kerusakan yang terjadi.
SUMMARY
WIKE AYU EKA PUTRI. The Distribution and Accumulation of Heavy Metals Cu and Pb on Ichthyofauna at Musi River Downstream, South Sumatra. Supervised by DIETRIECH G. BENGEN, TRI PRARTONO and ETTY RIANI.
Musi River is one of many great rivers in Sumatera. It has more extents over 720 km which is upstream in the Province of Bengkulu and ends into Bangka Strait, which is in the province of South Sumatra. Musi River downstream region has received a lot of waste and pollutant due to human activities such as agriculture, plantation, industrial, transportation and ports. This condition might increases the concentration of some chemical components in the water including heavy metals. This theory is supported by several previous studies which have indicated that some heavy metals were found and accumulated in water and several organisms live there. The study had three main objectives: (1) to determine the distribution of Cu and Pb in the waters and in the sediment of Musi River downstream; (2) to reveal the presence and accumulation of Cu and Pb in the tissues of organisms (plankton and fish), to analyze the bioaccumulation in every fish species and fish organs and (3) to explain the damaging effect of heavy metals on fish organs.
The results were shown that dissolved phase of Cu (0.002-0.006 mg/l) and Pb (0.002-0.004 mg/l) have exceeded their natural concentration in the waters. It might caused by natural factors such as soil and rock weathering processes at the upstream of the river. In addition, human activities at upstream and downstream river (agriculture, plantation, industrial, transportation, residential and ports as well as others) also contribute to increasing the concentration of Cu and Pb component in the waters. It was widely perceived that the concentration of dissolved Cu is higher than Pb. On the contrary, the concentrations of Pb suspension (31.56-89.52 mg/kg) were found to be higher than Cu (5.65 to 15.17 mg/kg). This was presumably due to the differences in solubility between these two types of heavy metal. The accumulation of Cu (6.14-15.28 mg/kg) and Pb (5,79-11.1 mg/kg) were also found in the sediments of Musi River downstream. Cu and Pb were also found have accumulated in organisms living there. Cu (1.82-3.70 mg/kg) and Pb (1.01-2.87 mg/kg) were found have accumulated in planktonic organisms. Furthermore, there are variations of Cu and Pb accumulation in every type of fish and in their organs. The accumulation of heavy metal were highest found in liver and followed by gill and muscle respectively. The accumulation of Cu in liver was between 1.958-7.239 mg/kg and Pb 0.329 to 0.996 mg/kg, which was higher than muscle (0.171-0.292 mg/kg Cu and 0.157-0.204 mg/kg Pb) and gill (0.807-1.158 mg/kg Cu and 0.202-0.328 mg/kg Pb). In addition, Cu and Pb have varied concentration were observed among the four types of fish. The gill and the liver of Mugil chepalus was accumulated more Cu
compared to other types of fish, these were consecutively 1.26 mg/kg and 8.42 mg/kg. There are several factors which causing the higher accumulation, such as the differences of food habits and their living environments.
polyuronodon, Rasbora sp and Paraloptosus albilabris. Muscles of M. chepalus
had an ability to accumulate Cu 123 times, gills had 524 times and liver had 3051 times higher than the concentration of Cu in waters. The muscle and the gills of P. polyuronodon were able to accumulate Pb in higher concentration than other fish.
The muscles of P. polyuronodon were able to accumulate Pb 83 times and the
gills had 158 times higher than the concentration in the waters. The gills and the livers of Rasbora sp had an ability to accumulate Pb 481 times higher than the
concentration in the waters. Based on the threshold has been determined by some countries and institutions, it can be concluded that the heavy metals Cu and Pb in all organs and types of fishes did not belong to the accumulative criteria (BAF ≤ 5000 l / kg). Nevertheless, the accumulation of Cu in the liver of M. chepalus and P. polyuronodon must be observed carefully because it was higher than other
fishes and organs. Similarly with plankton, it is generally seen which the plankton living in Musi River downstream can accumulate Cu and Pb respectively 741 times and 795 times higher than the concentration in the waters. While plankton that live in the estuary of Musi River can accumulate Cu and Pb 698 and 603 times higher than their availability in the water.
The observation of the gill tissues on all kinds of fishes indicated that the primary lamella are in normal condition. Partially, the cartilage tissue in M. chepalus has been damaged. Secondary lamela seems had an addition of cells
(epithelial hyperplasia) which thicker in the end of secondary. The main causes of increasing number of cells in tissue were a chronic irritation by heavy metals and some types of viral infections. Further, the gills of M. chepalus and P. albilabris
had severe hyperplasia than other types of fish which have been led to fusion conditions. Generally, the observation of livers showed liver cell swelling (edema) on all kinds of fishes. The most severe damage that occurred inside the M. Chepalus liver; focal necrosis arose and inflammatory cells surrounded the liver.
Cu and Pb accumulation were higher in both organs have ccontributed to the damage.
The conclusion can be drawn that increases of heavy metals Cu and Pb in the Musi River downstream can affects to the accumulation in gill, liver and muscle of four types consumption fishes. The higher accumulation of Cu and Pb in liver and gill was contributed and affected to organ damage which is indicated by hyperplasia and fusion in the gills and an edema in liver tissues.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor
pada
Program Studi Ilmu Kelautan
SEBARAN DAN AKUMULASI LOGAM BERAT (Cu DAN Pb)
PADA IKHTIOFAUNA DI SUNGAI MUSI BAGIAN HILIR
PROVINSI SUMATERA SELATAN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
Penguji pada Ujian Tertutup : Prof. Dr. Ir. Dedi Soedharma, DEA Prof. Hilda Zulkifli, MSi, DEA
PRAKATA
Alhamdulillahirabbil’alamiin. Puji syukur kehadirat Allah subhanahu wa
ta’ala, Sang Pemilik Ilmu Pengetahuan, atas segala rahmat, karunia dan kasih-Nya sehingga karya ilmiah ini berhasil diselesaikan. Penelitian bertemakan pencemaran ini berjudul Sebaran dan Akumulasi Logam Berat (Cu dan Pb) pada Ikhtiofauna di Sungai Musi Bagian Hilir Provinsi Sumatera Selatan telah
dilaksanakan sepanjang bulan Maret 2014-Mei 2015.
Terima kasih yang tak terhingga penulis ucapkan kepada Bapak Prof. Dr Ir. Dietriech G. Bengen, DEA, Bapak Dr. Ir. Tri Prartono, MSc dan Ibu Dr. Ir. Etty Riani, MS yang telah meluangkan waktu untuk membimbing penulis. Kepada bapak Prof. Dr. Ir. Dedi Soedharma, DEA dan Ibu Prof. Hilda Zulkifli, MSi, DEA selaku penguji luar komisi, terimakasih atas masukan dan saran yang sangat bermanfaat. Ibu Dr. Ir Neviaty P. Zamani, M.Sc selaku Ketua Program Studi dan Mba Ani. Terimakasih kepada kepada Rektor Universitas Sriwijaya, Dekan FMIPA-UNSRI, rekan sejawat di kampus kelautan UNSRI serta mahasiswa yang telah membantu selama penelitian. Tidak lupa terimakasih kepada Kemenristekdikti, sebagian dari penelitian ini dibiayai dari dana penelitian Hibah Bersaing tahun 2015-2017. Terimakasih kepada Anna Ida Sunaryo Purwiyanto selaku rekan satu tim, atas bantuan dan kerjasamanya selama ini.
Penghargaan penulis sampaikan kepada Ibu Lestari, Bapak Abdul Rozak dan Bapak Taufik Kaisupy dari P2O LIPI yang telah membantu analisa sampel logam berat di laboratorium. Ibu Dr. Muharni dan Mba Wiwiek di LDB UNSRI, Mba Nani di Program Pascasarjana UNSRI, Miftahussalam dan Dewi serta mas Aris di Lab. Bima MSP, drh. Mawar Subangkit MSi, drh. Joni Saputra dan mas Arbi, terimakasih atas bantuannya selama ini. Kepada teman-teman di PS. IKL-IPB (Mba Riris, Iwan, Mutia, Khalid, Pak Tumpak, Mas Muhaimin UNILA, bang Udin serta bang Rozirwan), Mba Lilik di UNDIP dan Baharuddin di UNLAM, Ni Vivi serta kak Rosa, terimakasih banyak untuk diskusi dan bantuan petanya.
Ungkapan terima kasih yang tulus dan tak terhingga kepada kedua orang tua terkasih (Bapak Drs. Arwis Suin dan Ibu Yusnawati), suami tercinta Ferry Arisandy dan anak-anak yang senantiasa menjadi penyemangat menyelesaikan studi ini, Faiq Aghra Firjatullah dan Fairuzia Azzura Radinka. Tidak lupa kepada bapak dan ibu mertua (Bapak Fauzi Dt. Bungsu dan Ibu Baridah), adik-adik yang selalu bisa diandalkan dalam kondisi apapun (Haris Bayu Vani serta keluarga dan Tito Trio Putra serta keluarga). Kepada seluruh keluarga besar di Solok dan Bukit Tinggi, terimakasih atas semua doa, kasih sayang dan bantuan serta dukungannya selama ini. Semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2016
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 3
Tujuan Penelitian 4
Manfaat Penelitian 4
Kebaharuan 4
2 TINJAUAN PUSTAKA 6
3 DISTRIBUSI LOGAM BERAT Cu DAN Pb DI SUNGAI MUSI BAGIAN HILIR
Pendahuluan 18
Metode Penelitian 18
Hasil dan Pembahasan 21
Simpulan 31
4 LOGAM BERAT Cu DAN Pb DALAM PLANKTON DAN IKAN DI SUNGAI MUSI BAGIN HILIR
Pendahuluan 32
Metode Penelitian 33
Hasil dan Pembahasan 35
Simpulan 46
5 KONDISI HISTOPATOLOGI ORGAN INSANG DAN HATI EMPAT JENIS IKAN DI SUNGAI MUSI BAGIAN HILIR
Pendahuluan 47
Metode Penelitian 48
Hasil dan Pembahasan 50
Simpulan 55
6 PEMBAHASAN UMUM 56
7 SIMPULAN DAN SARAN
Simpulan 62
Saran 62
DAFTAR PUSTAKA 63
LAMPIRAN 73
DAFTAR TABEL
1 Sumber dan jenis polutan di Sungai Musi bagian hilir 11 2 Konsentrasi rata-rata parameter fisika kimia di lokasi penelitian 22 3 Faktor bioakumulasi Cu pada semua organ dan jenis ikan 44 4 Faktor bioakumulasi Cu pada semua organ dan jenis ikan 44
5 Faktor bioakumulasi Cu dan Pb pada plankton 45
6 Ambang batas logam berat dalam makanan di beberapa negara (mg/kg
bb) 60
DAFTAR GAMBAR
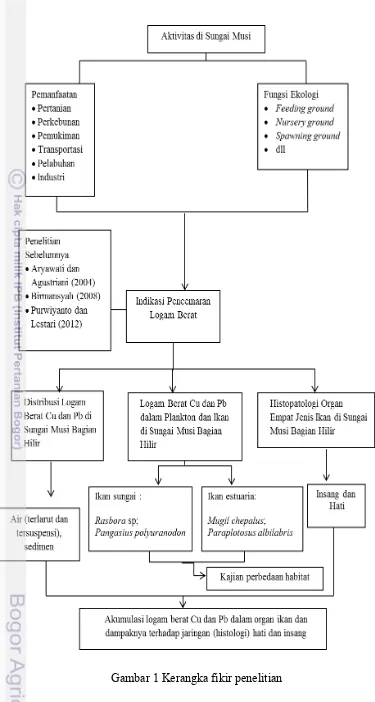
1 Kerangka fikir penelitian 5
2 Zonasi Sungai Musi dari hulu hingga hilir (Kompas 2010) 7
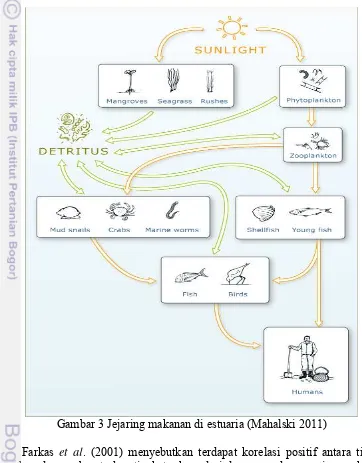
3 Jaring-jaring makanan di estuaria 13
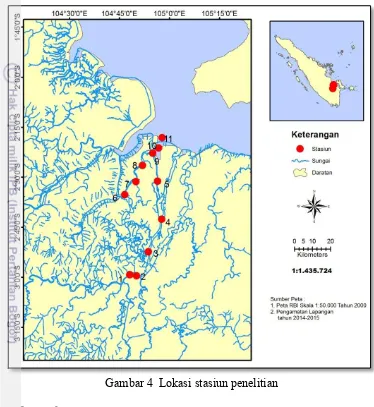
4 Lokasi stasiun penelitian 19
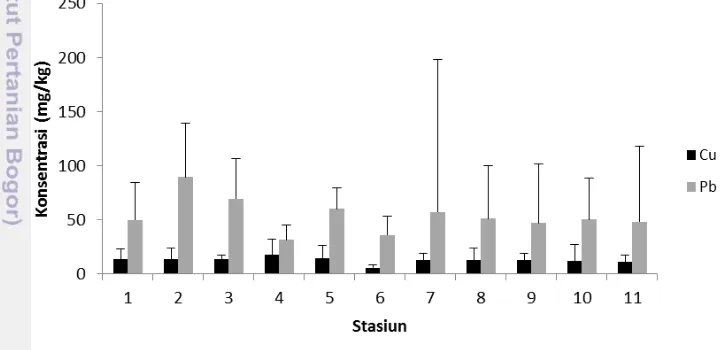
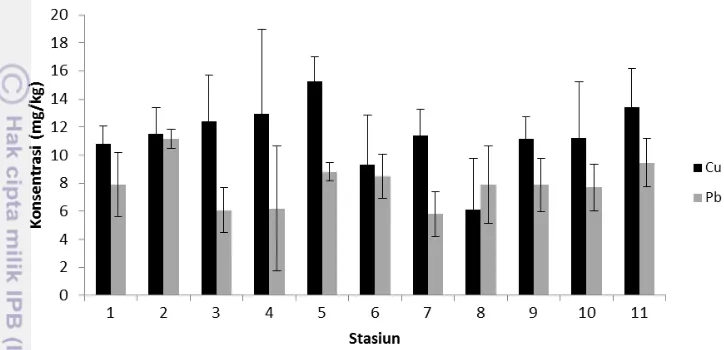
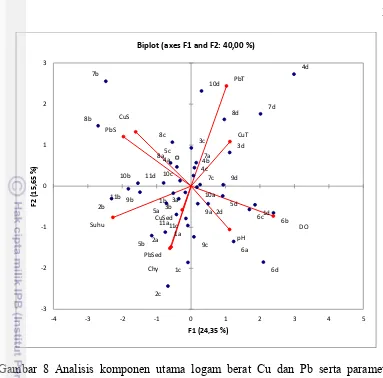
5 Konsentrasi rata-rata Cu dan Pb terlarut selama penelitian 25 6 Konsentrasi rata-rata Cu dan Pb tersuspensi selama penelitian 27 7 Konsentrasi rata-rata Cu dan Pb sedimen selama penelitian 28 8 Analisis komponen utama logam berat Cu dan Pb di lokasi penelitian 31
9 Lokasi stasiun penelitian 33
10 Konsentrasi rata-rata Cu dan Pb dalam plankton 36
11 Konsentrasi rata-rata Cu dan Pb dalam ikan 38
12 Konsentrasi rata-rata Cu dan Pb dalam masing-masing organ ikan 41
13 Lokasi stasiun penelitian 48
14 Struktur histopatologi insang ikan yang ditemukan selama penelitian 51
15 Struktur histopatologi insang normal 51
16 Struktur histopatologi hati ikan yang ditemukan selama penelitian 53
DAFTAR LAMPIRAN
1 Posisi koordinat stasiun penelitian 73
2 Hasil pengukuran kualitas air setiap pengambilan sampel 74 3 Hasil pengukuran logam Cu dan Pb selama penelitian 76 4 Tabel test of equality of group means terhadap semua jenis ikan 78
5 Tabel test of equality of group means dari hasil analisa diskriminan
terhadap ikan yang hidup di sungai (pelagis-demersal) 79 6 Tabel test of equality of group means dari hasil analisa diskriminan
terhadap ikan yang hidup di muara (pelagis-demersal) 80 7 Tabel test of equality of group means dari hasil analisa diskriminan
terhadap ikan pelagis (muara-sungai) 81
8 Tabel test of equality of group means dari hasil analisa diskriminan
terhadap ikan demersal (muara-sungai) 82
9 Konsentrasi rata-rata logam dalam organ ikan dan kolom air
sebagai dasar perhitungan faktor bioakumulasi 83
10 Gambar ikan yang menjadi objek penelitian 84
1 PENDAHULUAN
Latar Belakang
Estuaria merupakan ekosistem peralihan antara air tawar dan air laut. Pengaruh air laut saat pasang terhadap badan sungai dapat dilihat dari salinitas yang bervariasi pada lapisan kedalaman. Demikian juga pengaruh air sungai saat surut terhadap perairan laut yang menyebabkan salinitas di muara sungai menjadi lebih rendah dibandingkan salinitas laut pada umumnya. Ekosistem estuaria merupakan ekosistem produktif dan memiliki peranan ekologis penting bagi organisme yang hidup di dalamnya. Produktivitas hayati estuaria setara dengan produktivitas hayati hutan hujan tropis dan ekosistem terumbu karang. Peran ekologis penting estuaria antara lain sebagai sumber zat hara dan bahan organik yang diangkut lewat sirkulasi pasang surut (tidal circulation), penyedia habitat
bagi sejumlah organisme, sebagai tempat berlindung dan mencari makanan (feeding ground), tempat untuk bereproduksi dan tumbuh besar (nursery ground)
terutama bagi sejumlah spesies ikan dan udang.
Salah satu ekosistem estuaria yang terdapat di pesisir timur Kabupaten Banyuasin Provinsi Sumatera Selatan adalah Muara Sungai Musi. Selain sebagai habitat berbagai jenis biota yang bernilai ekonomis, kawasan ini juga dimanfaatkan sebagai daerah penangkapan ikan dan jalur pelayaran kapal penumpang dan barang tujuan Pulau Bangka. Beberapa anak sungai bermuara ke daerah ini, dua diantaranya yang cukup besar adalah Sungai Musi dan Sungai Telang. Sungai Musi adalah satu dari beberapa sungai yang terdapat di Provinsi Sumatera Selatan dengan panjang mencapai ± 750 km dan debit air bervariasi antara 2.700 m3/detik pada musim kemarau dan mencapai 4000 m3/detik pada musim hujan. Pada aliran utama Sungai Musi, bermuara sembilan buah anak sungai besar yang sering disebut Batang Hari Sembilan yaitu Sungai Kelingi, Sungai Kikim, Sungai Lakitan, Sungai Rawas, Sungai Semangus, Sungai Batanghari Leko, Sungai Lematang, Sungai Ogan dan Sungai Komering yang tersebar di beberapa kabupaten (BRPPU 2010).
Sungai Musi bagian hulu berarus deras yang terdapat di kaki gunung dan bagian hilir merupakan dataran rendah yang dipengaruhi oleh kondisi pasang surut yaitu daerah muara yang berbatasan dengan Selat Bangka. Aliran air Sungai Musi melewati bermacam fungsi dan tata guna lahan mulai dari kegiatan pertanian, hutan lindung, perkebunan, pemukiman, transportasi, kawasan industri, pertambangan (stockpile batu bara) dan hutan mangrove di bagian hilirnya (BPS
2
gas, cold storage, electroplating, industri minuman ringan, pengilangan minyak,
pengolahan karet alam, kayu lapis dan lain-lain. Sebagian besar industri tersebut
diketahui belum memiliki Instalasi Pengolahan Air Limbah (IPAL) yang optimal dengan kata lain kualitas buangan limbah padat dan limbah cair tergolong belum baik. Kondisi ini berpotensi memberikan kontribusi beban buangan di Sungai Musi (Bapedalda Provinsi Sumatera Selatan 2006). Selain itu, aktivitas bongkar muat batu bara, pelabuhan dan transportasi air juga diperkirakan dapat berkontribusi terhadap peningkatan beberapa jenis logam di kolom perairan. Penumpukan batu bara di sekitar pelabuhan dapat meningkatkan masukan logam berat baik melalui deposisi partikel debu maupun melalui air limpasan atau air lindi dari tumpukan batu bara. Demikian juga dengan aktifitas transportasi dan pelabuhan yang menghasilkan ceceran bahan bakar dari mesin serta pencucian kapal juga berkontribusi terhadap pencemaran logam berat di perairan.
Pencemaran logam berat di lingkungan pesisir telah menjadi fenomena global karena sifat toksik dan keberadaan logam yang stabil (persisten) serta diikuti oleh proses bioakumulasi dan biomagnifikasi pada rantai makanan. Kemampuan biota mengakumulasi zat dari mediumnya dinyatakan dengan faktor bioakumulasi, yaitu perbandingan kandungan zat dalam biota terhadap kandungan zat dalam mediumnya. Akumulasi logam pada hewan dihasilkan melalui proses pengambilan (uptake) logam terlarut dari media air serta melalui makanan
(Reinfelder et al. 1998; Garnier-Laplace et al. 2000; Besser et al. 2001). Adapun
proses masuknya logam berat ke dalam tubuh organisme dapat melalui penyerapan secara langsung melalui insang dan dapat juga melalui mekanisme transfer dari tingkat tropik paling bawah ke tingkat tropik berikutnya. Logam yang ditransfer melalui rantai makanan akuatik yang masuk ke dalam tubuh ikan dan hewan lainnya sangat terkait dengan kesehatan manusia (Farkas et al. 2001; Chen et al. 2000).
Logam berat merupakan salah satu jenis limbah B3 yang dapat membahayakan kehidupan organisme di perairan karena bersifat akumulatif melalui rantai makanan, baik rantai makanan detrivor maupun planktivor. Akumulasi logam berat pada jaring-jaring makanan dapat terjadi melalui proses biokonsentrasi dan bioakumulasi dari media sekitarnya seperti air dan sedimen atau melalui biomagnifikasi dari sumber makanan (Tulonen et al. 2006). Menurut
Unlu and Gumgum (1993) logam berat dapat diserap langsung oleh organisme dan dapat juga ditransfer dari tropik level paling rendah hingga tropik level paling tinggi melalui rantai makanan. Akumulasi logam berat yang tinggi pada komponen-komponen tersebut dapat menyebabkan perubahan ekologis yang serius (Veena et al. 1997; Tulonen et al. 2006). Diantara dampak serius
3
Perumusan Masalah
Intensifikasi dan ekstensifikasi industri, aktivitas pelabuhan, transportasi dan pemukiman di kawasan Kota Palembang telah memberikan dampak lingkungan hingga ke daerah muara Sungai Musi. Muara sungai dan laut memiliki kapasitas terbatas dalam menerima beban pencemar yang masuk. Kelebihan pasokan beban pencemar yang masuk dibandingkan dengan kapasitas dan daya dukung lingkungan yang dimiliki dapat berdampak buruk bagi organisme yang hidup di dalamnya. Berdasarkan hasil penelitian sebelumnya, salah satu bahan pencemar di Sungai Musi bagian hilir adalah logam berat yang terkonsentrasi pada air, sedimen dan biota yang hidup disana. Birmansyah (2008) menemukan kandungan logam berat Pb dalam fraksi sedimen di sepanjang aliran Sungai Musi bagian hilir berkisar antara 0,0196-0,3097 µg/g (April) dan 0,03630-1,747 µg/g (Juli). Selain itu, logam Pb terkonsentrasi lebih tinggi pada daerah-daerah industri, transportasi dan sarana pelabuhan yaitu di sekitar Jembatan Ampera dan Pusri. Selain itu, hasil penelitian Aryawati dan Agustriani (2004) menemukan sampel kerang darah Anadara granosa Linnaeus yang berasal dari perairan pesisir timur
Sumatera Selatan mengandung Cu dan Zn walaupun konsentrasinya masih di bawah ambang batas yang diperbolehkan dalam makanan laut yaitu berkisar 0,387 –28,621 ppm. Selanjutnya, hasil penelitian Purwiyanto dan Lestari (2012) juga menunjukkan bahwa konsentrasi Pb dan Cu di kolom air dan sedimen pesisir timur Muara Sungai Banyuasin telah melebihi baku mutu yang ditetapkan oleh KepMenLH No. 51 tahun 2004. Selain itu juga ditemukan adanya kandungan Pb dan Cu pada daging kepiting Scylla serrata yang dikonsumsi oleh manusia.
Khusus logam berat Fe dan Mn, konsentrasi yang tinggi juga ditemukan di dalam sedimen di sekitar Muara Sungai Banyuasin.
Penelitian tentang pergerakan atau “fate” logam berat di perairan telah banyak dilakukan terutama di perairan tawar namun masih ada beberapa informasi yang belum diketahui dengan baik. Sebagian besar studi tersebut hanya terbatas pada satu jenis logam atau mekanisme transfer yang diamati masih pada sebagian kecil dari komponen jaring-jaring makanan. Hal ini membuat kesulitan dalam membandingkan proses transfer pada logam jenis lain. Kesulitan lain yang dialami adalah generalisasi hasil penelitian atau temuan di setiap sistem yang ada serta kesulitan dalam memprediksi pergerakan logam di dalam rantai makanan.
Hingga saat ini belum tersedia informasi tentang bagaimana mekanisme atau alur kontaminasi logam Cu dan Pb di Sungai Musi bagian hilir yang dapat menerangkan adanya transfer logam berat melalui tingkat trofik dan dampaknya bagi organisme terutama ikan. Sebagai contoh : seberapa besar konsentrasi dan akumulasi logam Cu dan Pb dalam komponen perairan?; apakah ikan-ikan konsumsi di daerah tersebut telah terkontaminasi logam berat dan bagaimana dampak logam berat tersebut terhadap jaringan ikan?. Informasi-informasi ini sangat penting untuk dijadikan bahan evaluasi terkait dengan dampak aktivitas pembangunan di sepanjang aliran Sungai Musi terhadap ekosistem perairan. Oleh karena itu dibutuhkan penelitian tersendiri tentang bagaimana kondisi dan akumulasi logam berat Cu dan Pb di Sungai Musi bagian hilir sehingga informasi yang diperoleh menggambarkan kondisi wilayah tersebut yang sebenarnya.
4
terlibat di dalamnya apalagi penelitian dilakukan di alam. Penelitian ini difokuskan pada akumulasi logam berat Cu dan Pb dalam organisme plankton dan empat jenis ikan konsumsi yang terdapat di Sungai Musi bagian hilir (Gambar 1) serta dampak yang ditimbulkan terhadap organisme.
Tujuan Penelitian
Penelitian ini bertujuan mengetahui dan mengungkap lebih lanjut bagaimana pengaruh logam berat (Pb dan Cu) terhadap komponen rantai makanan di Muara Sungai Musi. Secara khusus tujuan dari penelitian ini adalah :
1. Menentukan sebaran logam berat Cu dan Pb dalam air dan sedimen di Sungai Musi bagian hilir
2. Mengungkap keberadaan logam berat Cu dan Pb yang terakumulasi di dalam jaringan organisme (plankton dan ikan) di Sungai Musi bagian hilir serta kajian bioakumulasi pada setiap organ dan jenis ikan
3. Menjelaskan pengaruh logam berat terhadap kerusakan organ ikan (histopatologi)
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat :
1. Memberikan informasi tentang kondisi lingkungan Sungai Musi bagian hilir khususnya logam berat,
2. Mendapatkan informasi tentang dampak yang telah ditimbulkan oleh kegiatan pertarnian, perkebunan, industri, pelabuhan dan transportasi terhadap kualitas kehidupan organisme di Sungai Musi.
3. Mendapatkan informasi dasar tentang upaya pencegahan bahaya lingkungan akibat kontaminasi logam berat
4. Hasil penelitian diharapkan dapat menjadi acuan bagi pemerintah dalam mengambil kebijakan guna antisipasi degradasi lingkungan.
Kebaharuan
5
6
2 TINJAUAN PUSTAKA Sekilas tentang Sungai Musi
Sungai Musi adalah sungai terpanjang di Provinsi Sumatera Selatan yang membentang melewati dua provinsi yaitu Bengkulu dan Sumatera Selatan. Pada aliran utama Sunga Musi bermuara sembilan buah anak sungai besar yang sering disebut Batang Hari Sembilan yaitu Sungai Kelingi, Sungai Kikim, Sungai Lakitan, Sungai Rawas, Sungai Semangus, Sungai Batanghari Leko, Sungai Lematang, Sungai Ogan dan Sungai Komering yang tersebar di beberapa kabupaten (BRPPU 2010).
Badan utama Sungai Musi dikelompokkan menjadi tiga bagian yaitu Musi bagian hulu, Musi bagian tengah dan Musi bagian hilir. Bagian hulu bersumber dari sumber mata air yang terdapat di Provinsi Bengkulu hingga ke Muara Kelingi, bagian tengah dimulai dari Muara Kelingi hingga Tebing Abang dan bagian hilir dari Tebing Abang hingga Muara Sungai Musi (BRPPU 2010). Berikut penjelasan tentang karakteristik dan tata guna lahan tiga bagian utama Sungai Musi.
1. Zona bagian hulu (Up Stream)
Zona musi bagian hulu dimulai dari Desa Tabarena di Kabupaten Rejang Lebong Provinsi Bengkulu dengan ketinggian ± 600 meter di atas permukaan laut. Sungai Musi bagian hulu memiliki ciri sungai pegunungan yang berarus deras , banyak tebing curam dengan dasar batuan pasir, berkerikil, alur sungai yang berkelok-kelok serta memiliki hidrografi aliran dengan puncak-puncak yang tajam sewaktu mendaki (rising stage) dan menurun (fallen stage). Dasar sungai
merupakan bebatuan dengan kondisi air jernih dan kedalaman 30-80 cm serta kecepatan arus berkisar 1,0-2,0 meter/detik. Pemanfaatan lahan pada bagian hulu Sungai Musi umumnya pertanian padi, hortikultura, perkebunan kopi sedangkan di bagian tepi sungai didominasi oleh usaha perikanan dan pertambangan (pasir dan batu bara). Batas akhir zona bagian hulu Sungai Musi berada disekitar Kecamatan Muara Kelingi Kabupaten Musi Rawas Provinsi Sumatera Selatan dengan ketinggian ±40 meter diatas permukaan laut.
2. Zona bagian tengah (Middle Stream)
Zona Musi bagian tengah dimulai dari Kecamatan Muara Kelingi Kabupaten Musi Rawas sampai ke Desa Tebing Abang yang terletak di bagian hilir Kota Sekayu. Zona Musi bagian tengah memiliki ketinggian antara 40-45 meter diatas permukaan laut. Di sekitar badan sungai, banyak terdapat area hutan rawa yang disebut rawang. Disamping hutan rawa, beberapa jenis perairan lain yang juga terdapat di zona tengah adalah rawa banjiran, sungai mati (oxbow lake)
7
3. Zona bagian hilir (Down Stream)
Zona Musi bagian hilir dimulai dari desa Tebing Abang hingga ke Selat Bangka dekat Desa Sungsang yang beada pada ketinggian 0-15 meter diatas permukaan laut. Pada daerah yang berdekatan dengan muara, kondisi perairan sudah dipengaruhi oleh salinitas air laut yang berasal dari Selat Bangka. Saat musim hujan, kondisi salinitas Sungai Musi di sekitar daerah Makarti (20 km dr muara) memiliki salinitas ±3 ppt dan pada musim kemarau ±6,5 ppt. Arus di zona hilir lebih lemah dibandingkan zona hulu dan tengah karena badan sungai berada di daerah yang sangat landai. Selain itu pengaruh fluktuasi harian pasang dan surut juga berperan di zona ini. Substrat dasar didominasi oleh lumpur, pasir dan liat. Tata guna lahan Sungai Musi bagian hilir terutama sekitar Kota Palembang hingga bagian hilir yaitu sekitar Pulau Borang dan Selat Ajaran banyak dijumpai industri-industri besar antara lain industri pupuk urea (PUSRI), industri pengolahan minyak bumi (Pertamina), industri pengolahan karet, industri kayu lapis, industri pengolahan minyak kelapa sawit dan lain-lain.
8
lebak lebung (Nasution et al. 1993). Data BRPPU (2010), Sungai Musi
mempunyai keanekaragaman hayati yang tinggi. Diantara jenis organisme yang bernilai ekonomis tinggi adalah ikan, krustasea, moluska dan reptil.
Seperti halnya beberapa sungai besar lainnya, aliran air Sungai Musi melalui beberapa tata guna lahan seperti perkebunan, pertanian, pemukiman, pelabuhan, industri, pertambangan, perikanan dan lainnya. Sungai Musi termasuk kategori sungai besar dengan panjang sungai yang dapat dilayari kurang lebih mencapai 700 km (BPS Provinsi Sumatera Selatan 2012). Luas Daerah Aliran Sungai Musi ± 2,5 juta ha yang terdiri atas sungai dan rawa (Manggabarani 2005; Sukadi 2005). Aliran air Sungai Musi melalui beberapa tata guna lahan dan sarat dengan pemanfaatan dimulai dari hulu hingga bagian hilir. Bagian hulu dan tengah Sungai Musi pemanfaatan lahan yang ditemukan umumnya adalah pertanian padi, hortikultura, perkebunan kopi dan coklat serta karet, sedangkan pada bagian pinggir perairan dijumpai usaha perikanan dan pertambangan seperti penambangan pasir dan batu bara. Pemanfaatan lahan Sungai Musi bagian hilir lebih banyak dan bervariasi antara lain pemukiman, kegiatan rumah tangga, transportasi air dan didominasi oleh kegiatan industri seperti pengilangan minyak, pabrik pupuk, pengolahan karet alam, kayu lapis dan lain-lain (Husnah et al.
2006; BRPPU 2010).
Logam Berat
Sebagaian besar degradasi kualitas lingkungan diakibatkan oleh ulah manusia. Salah satu komponen pencemar tersebut adalah logam berat yang dapat berasal dari kegiatan seperti pertambangan, pertanian, perkotaan, transportasi dan pembakaran bahan bakar fosil. Pencemaran logam berat di lingkungan pesisir telah menjadi fenomena global karena sifat toksik dan keberadaan logam yang stabil (persisten) untuk beberapa dekade, serta proses bioakumulasi dan biomagnifikasi pada rantai makanan. Logam berat ditransfer menuju ikan, manusia dan karnivor lainnya melalui rantai makanan akuatik (Chinnaraja et al.
2011).
Logam merupakan zat murni organik dan anorganik yang berasal dari kerak bumi. Secara alami siklus perputaran logam adalah dari kerak bumi ke lapisan tanah, ke makhluk hidup, ke dalam air selanjutnya mengendap dan akhirnya kembali ke kerak bumi lagi (Darmono 2006). Logam berat adalah logam dengan berat jenis lebih besar dari 5 gr/cm3 dan mempunyai nilai atom lebih besar dari 21 dan terletak di bagian tengah daftar periodik (Connel dan Miller 1995). Logam
berat memiliki karakter yang lunak, berkilau, daya hantar panas dan listrik yang tinggi, bersifat kimiawi sebagai dasar pembentukan reaksi dengan asam (Connel dan Miller 1995).
Berdasarkan kegunaannya, logam berat dapat dibedakan atas dua golongan yaitu esensial, golongan yang dalam konsentrasi tertentu berfungsi sebagai mikronutrien yang bermanfaat bagi kehidupan organisme perairan seperti Zn, Fe, Cu, Co. Selanjutnya adalah golongan yang sama sekali belum diketahui manfaatnya bagi organisme perairan (non esensial), seperti Hg, Cd, dan Pb (Darmono 2006; Chinaraja et al. 2011). Umumnya logam berat non esensial
9 logam yang yang bersifat esensial dan umumnya bersifat toksik pada konsentrasi yang tinggi (Darmono 2006; Chinaraja et al. 2011).
Berbagai aktifitas di daratan seringkali limbahnya berakhir di sungai yang kemudian akan bermuara ke laut, termasuk logam berat. Logam berat yang masuk ke lingkungan akuatik umumnya berasal dari atmosfir, erosi lapisan permukaan bumi atau akibat aktivitas antropogenik seperti industri, limbah domestik dan limbah pertambangan (Forstner and Wittmann 1979; Nriagu 1989; Veena et al.
1997; Tarvainen et al. 1997; Puspitasari 2007). Logam berat umumnya masuk ke
lingkungan perairan akuatik melalui deposisi atmosfir, erosi matriks geologi atau melalui masukan antropogenik yang disebabkan oleh limbah idustri, limbah domestik dan limbah pertambangan (Tarvainen et al. 1997). Logam berat dapat
hadir di lingkungan perairan dengan konsentrasi beberapa kali lebih tinggi dibandingkan konsentrasi alami di alam dan dapat mencemari sedimen laut di area sekitar kawasan industri dan pemukiman. Logam berat masuk ke dalam ekosistem darat dan perairan melalui limbah lumpur, limbah pertambangan, pembuangan limbah industri, deposisi atmosfer dan penerapan pupuk dan pestisida di lahan pertanian (Forstner 1995).
Hutagalung (1994) menyatakan bahwa senyawa logam berat banyak digunakan untuk kegiatan industri sebagai bahan baku, katalisator, biosida maupun sebagai additive. Limbah yang mengandung logam berat ini akan terbawa
oleh sungai dan umumnya limbah industri merupakan sumber pencemar logam berat yang potensial bagi pencemaran laut. Logam berat tergolong dalam kategori komponen pencemar lingkungan karena efek racun pada tanaman, manusia dan makanan. Beberapa logam berat seperti arsen (As), kadmium (Cd), timbal (Pb), merkuri (Hg) bersifat akumulatif, keberadaannya persisten atau stabil, terakumulasi dan tidak dapat dimetabolisme serta tidak mudah terurai di lingkungan.
10
Logam berat Cu dan Pb di perairan terdapat dalam bentuk terlarut dan tersuspensi. Umumnya konsentrasi Pb di dalam air rendah karena daya larutnya yang juga rendah (Effendi 2003). Hasil penelitian Siahaan (2003) menyebutkan bahwa kelarutan Pb pada air payau dan air laut kecil jika dibandingkan air tawar. Hal ini disebabkan anion-anion yang melimpah di air payau dan laut sehingga terjadi pembentukan PbCl2 dan PbCO3. Ion-ion terlarut seperti Pb42- dan Cl- dalam
air payau dan air laut akan menyebabkan anion-anion bereaksi dengan logam Pb dan menghasilkan suspensi PbCl2 dan PbSO4 yang kemudian mengendap.
Menurut Trefry and Metz (1985) sekitar 90% timbal berasosiasi dengan sedimen tersuspensi dan sebagian besarnya merupakan run off dari area pemukiman dan
industri. Di lingkungan perairan, logam bisa berpindah dari air ke sedimen, air ke biota atau sebaliknya. Perilaku logam di lingkungan sangat dinamik dan dipengaruhi oleh kondisi fisik-kimia seperti salinitas, pH, suhu dan reaksi redoks. Logam yang larut dalam air berada dalam bentuk ion, dapat berupa ion-ion bebas (Pb2+, Cu2+, Zn2+), pasangan ion organik (Cu2(OH)22+ atau Pb(CO3)22-), kompleksi
organik dan ion logam organik (CH3-Hg+) (Palar 2004). Sedangkan keberadaan
logam di sedimen dipengaruhi beberapa proses yaitu sedimentasi dan flokulasi, presipitasi dan adsorpsi (Matagi et al. 1998), oleh karena proses-proses tersebut
sehingga sedimen umumnya mengakumulasi logam dalam jumlah yang besar (Che et al. 2003). Menurut Luoma (1983) umumnya logam dalam fase larut
merupakan bentuk yang bioavailable bahkan beberapa studi bioavailabiliitas
logam menunjukkan bahwa organisme akuatik menyerap logam dalam bentuk ion bebas (free ion) sangat efisien.
Timbal merupakan salah satu jenis logam berat yang memiliki penyebaran cukup luas di alam terutama diakibatkan oleh aktivitas manusia. Jenis industri yang banyak menggunakan Pb antara lain industri pipa, cat, senjata dan batere. Aktivitas lain yang dapat menyumbangkan Pb dalam jumlah besar di perairan adalah pertambangan minyak bumi dan perkapalan (Moore and Ramamoorthy 1984; Darmono 2006). Sumber timbal di perairan alami berupa batuan kapur dan dalam bentuk sulfide (gelana) (PbS), Pb karbonat, PbSO4 (Moore 1991; Palar
2004). Selain itu komponen gugus alkyl timbal yang digunakan sebagai bahan additive bensin, beracun terhadap seluruh aspek kehidupan. Secara alamiah timbal masuk ke perairan melalui pengkristalan timbal di udara dengan batuan air hujan, jatuhan debu yang mengandung timbal seperti bahan bakar yang mengandung timbal tetraetil. Selain itu, erosi dan korosifikasi batuan mineral dan limbah industri seperti pabrik batrai, amunisi, kawat dan cat juga berkontribusi terhadap Pb di perairan (Saeni 1989).
Timbal (Pb) merupakan logam berat yang relatif sukar terdegradasi, selain itu afinitasnya yang cukup besar dengan gugus protein yang terdapat pada organisme air menyebabkan logam berat tersebut mudah terabsorpsi dan terakumulasi pada organ tubuh ikan. Peningkatan konsentrasi dan toksisitas Pb di perairan dipengaruhi oleh pH, kesadahan dan oksigen terlarut. Lebih lanjut, dijelaskan bahwa Pb beracun bagi sistem syaraf, hati, darah dan mempengaruhi kerja ginjal. Keracunan akut Pb pada manusia akan menyebabkan tidak berfungsinya ginjal, sistem reproduksi, hati, otak dan sistem saraf pusat yang berakibat pada rasa sakit bahkan kematian (Satya et al. 2011). Saeni (1989)
11 akumulatif. Meskipun demikian limbah pembuangan Pb paling banyak jika dibandingkan Hg yang paling sedikit diantara logam berat. Umumnya Hg berasal dari limbah pembuangan penggunaan energi batubara dan minyak bumi yaitu sebesar 221 ton/tahun, As = 678 ton/tahun, Cd = 256 ton/tahun dan Pb = 2.835 ton/tahun. Hal ini menyebabkan Hg relatif kurang menjadi pusat perhatian bagi manusia dibandingkan Pb. Dengan demikian timbal menjadi pusat perhatian manusia tidak hanya karena bahayanya, akan tetapi juga karena pencemarannya paling tinggi (data untuk seluruh dunia).
Tembaga atau copper (Cu) merupakan logam berat yang dijumpai pada
perairan alami dan tergolong unsur essensial bagi hewan dan tumbuhan. Pada tumbuhan termasuk algae, tembaga berperan sebagai penyusun plastocyanin yang
berfungsi dalam transpor elektron pada proses fotosintesis (Boney 1989 dalam
Effendi 2003). Tembaga (Cu) terdapat dalam bentuk partikulat, koloid dan terlarut. Fase terlarut merupakan Cu2+ bebas dan ikatan kompleks, baik dengan ligan
inorganik (CuOH+, Cu2(OH)22+) maupun organik. Selain dengan ligan OH-, Cu
membentuk ikatan kompleks dengan ligan inorganik lainnya yaitu dengan: karbonat (CO32-), nitrat (NO3-), fosfat (HPO42-), sulfat (SO42-), sulfida (SH-),
klorida(Cl-) dan ammonia (NH3) yang bersifat basa dengan stabilitas berbeda-beda.
Ikatan Cu–kompleks dengan ammonia dan sulfida tergolong stabil (Sanusi 2006). Hasil penelitian Birmansyah (2008) menyebutkan bahwa kandungan logam berat Pb dalam fraksi sedimen disepanjang aliran sungai musi bagian hilir berkisar antara 0,0196-0,3097 µg/g (April) dan 0,03630-1,747 µg/g (Juli). Konsentrasi Pb lebih tinggi pada daerah-daerah industri, transportasi dan sarana pelabuhan yaitu disekitar Jembatan Ampera dan Pusri. Secara umum, sumber dan jenis polutan Sungai Musi bagian hilir dapat diringkas dalam Tabel 1.
Tabel 1 Sumber dan jenis polutan di Sungai Musi bagian hilir
Kegiatan/Sumber Polutan Jenis Polutan
Industri Padatan minyak dan lemak, unsur/senyawa
kimia beracun, suhu panas, logam berat Pertambangan Padatan unsur/senyawa kimia, radioaktif
Pariwisata Padatan/sampah, cairan/MCK
Transportasi Padatan minyak dan lemak
Pembangkit listrik/energi Suhu panas radioaktif
Kesehatan/rumah sakit Padatan cair, senyawa kimia, radioaktif Sumber : Bapedalda Propinsi Sumatera Selatan, 2007
Akumulasi Logam Berat dalam Organisme
12
(herbivor) yang biasa disebut konsumen primer. Hewan pemakan konsumen primer menempati tingkat tropik ketiga (karnivora). Setiap perpindahan energi dari satu tingkat tropik ke tingkat tropik lainnya akan ada sebagian energi yang hilang (Kennish 1990).
Jaring-jaring makanan di estuaria dimulai dengan mengkonversi energi matahari menjadi energi makanan yang dilakukan oleh tumbuhan tingkat tinggi dan fitoplankton. Gambaran sederhana dapat dilihat pada Gambar 3, terlihat dua pola makan-memakan yang terjadi. Pertama dimulai dengan tumbuhan berukuran besar seperti mangrove dan lamun. Ketika tumbuhan berukuran besar tersebut mati, daun dan akarnya akan diuraikan oleh bakteri menjadi detritus. Detritus kemudian dimakan oleh hewan berukuran kecil seperti siput, cacing dan kerang-kerangan yang pada gilirannya nanti juga akan dimangsa oleh hewan yang lebih besar seperti ikan dan burung. Pola yang kedua dimulai oleh tumbuhan fitoplankton, fitoplankton kemudian dimakan/dicerna oleh zooplankton yang juga merupakan makanan bagi siput dan kerang-kerangan (Mahalski 2011).
Aktivitas manusia yang berkaitan dengan industri logam dapat meningkatkan masukan logam berat ke dalam sistem perairan. Logam-logam tersebut kemudian diakumulasi oleh organisme akuatik dan kemudian ditransfer menuju tropik level paling tinggi (top predator). Secara umum diketahui bahwa akumulasi logam berat oleh organisme (hewan) dapat terjadi melalui pengambilan komponen terlarut dan melalui makanan (Reinfelder et al. 1998; Garnier-Laplace et al. 2000; Besser et al. 2001) dimana insang dan saluran pencernaan merupakan
media reseptor utama pada ikan (Wong et al. 2001).
Logam berat dianggap sebagai komponen pencemar serius dalam lingkungan perairan karena keberadaannya yang persisten atau stabil di dalam lingkungan dan kecenderungan untuk terkonsentrasi dalam jaringan tubuh pada organisme akuatik (Harte et al. 1991; Yigit and Altindag 2006). Bahkan
keberadaan logam berat dalam konsentrasi yang cukup tinggi dapat menyebabkan kematian ikan karena terganggunya pengaturan ion, kecepatan berenang yang berkurang dan pertumbuhan yang melambat. Menurut Connel dan Miller (1995), pengaruh toksisitas logam berat terhadap berbagai biota laut terjadi dalam waktu yang relatif lebih cepat dibandingkan manusia (>10 tahun).
13 pencernaan. Selain itu, sifat logam berat yang akumulatif di dalam jaringan tubuh biota menyebabkan konsentrasi logam tersebut meningkat. Akumulasi logam berat dalam organ biota laut dapat mensubsitusi kofaktor enzim yang menyebabkan kegiatan enzim dan metabolism dalam jaringan tubuh biota terganggu. Hasil penelitian menunjukkan bahwa Pb dapat mensubsitusi kofaktor enzim Zn (Darmono 2006). Selain itu, disebutkan juga bahwa Pb merupakan logam berat yang relatif sukar terdegradasi dan memiliki daya afinitas yang cukup besar terhadap gugus protein yang terdapat dalam organ tubuh organisme air sehingga menyebabkan Pb mudah terabsorpsi dan terakumulasi dalam organ tubuh ikan.
Gambar 3 Jejaring makanan di estuaria (Mahalski 2011)
Farkas et al. (2001) menyebutkan terdapat korelasi positif antara tingkat
14
bahwa konsentrasi Cu, Zn, Cd dan Pb di dalam plankton lebih tinggi dibandingkan konsentrasi di dalam air. Kondisi ini mungkin terkait dengan metabolisme aktif plankton memicu penyerapan bermacam polutan secara cepat (Ravera 2001). Selanjutnya dijelaskan bahwa beberapa spesies algae melindungi diri dengan cara mengikat dan mengakumulasi polutan (salah satunya logam) di dinding polisakarida yang dimilikinya. Urutan konsentrasi logam berat di dalam tubuh plankton adalah Zn>Cu>Pb>Cd. Hal ini terkait dengan urutan kelimpahan logam-logam tersebut di dalam air. Kondisi ini mendukung hipotesis bahwasanya kolom air merupakan sumber penting kontaminasi logam berat terhadap plankton. Elmaci et al. (2007) menyebutkan bahwa jumlah logam berat di dalam organisme
plankton dipengaruhi oleh konsentrasi logam di dalam air dan sedimen.
Biomonitoring adalah sarana yang efektif dalam mengevaluasi kesehatan lingkungan secara keseluruhan (Al Tisan and Chandy 1995) dan plankton dianggap sebagai indikator yang baik dari aliran energi pada rantai makanan di laut. Hal ini disebabkan plankton sensitif terhadap kehadiran polutan dalam area yang luas, selain itu keragaman dan atau kelimpahan spesies dapat dijadikan indikator kualitas air. Luas area permukaan dibandingkan volume rasio dikaitkan dengan efisiensi adsorpsi atau absorpsi berbagai komponen kimia termasuk polutan. Pengukuran konsentrasi logam berat di dalam organisme plankton penting dilakukan karena plankton merupakan makanan utama bagi beberapa predator dan sangat berkontribusi dalam transfer logam berat menuju tropik level yang lebih tinggi (Yigit and Altindag 2006; Tulonen et al. 2006; Bahnasawy et al.
2009). Nybakken (1992) menyebutkan bahwa semua organ tubuh vertebrata yang berkuran kecil sampai berukuran besar dapat mengakumulasi logam berat melalui air dan makanan.
Hasil penelitian Veena et al. (1997) menyebutkan tingginya konsentrasi
logam berat di kolom air, sedimen dan dalam jaringan tubuh organisme akan menyebabkan konsekuensi ekologi yang serius. Konsentrasi logam berat yang tinggi dalam air dan sedimen dapat menyebabkan terjadinya gangguan ekosistem bahkan dapat menyebabkan terjadinya seleksi alam dan evolusi pada biota laut seperti hilangnya kelompok organisme yang intolerean terhadap pencemaran.
Selain itu, kandungan logam berat yang tinggi dalam tubuh organisme dapat menyebabkan organisme laut yang bernilai ekonomi menjadi tidak diminati. Kondisi ini disebabkan buruknya mutu produk perikanan sehingga tidak dikonsumsi oleh masyarakat. Contoh untuk hal tersebut adalah budidaya kerang hijau di Teluk Jakarta. Secara kuantitas, memang terjadi kenaikan yang signifikan terhadap pertumbuhan kerang hijau namun tidak secara kualitas. Kondisi Teluk Jakarta yang tercemar logam berat menyebabkan konsentrasi logam berat dalam tubuh kerang hijau juga tinggi dan menyebabkannya tidak layak dikonsumsi.
Farkas et al. (2001) menyebutkan ikan sebagai organisme indikator bagi
pencemaran logam berat dan berpotensi menimbulkan resiko bagi manusia. Akumulasi logam pada ikan dihasilkan melalui proses pengambilan (uptake)
logam terlarut serta melalui makanan (Reinfelder et al. 1998; Gaenier-Laplace et al. 2000; Besser et al. 2001) dimana insang dan saluran pencernaan dapat menjadi
reseptor utama yang paling memungkinkan pada ikan (Dallinger et al. 1987;
Szebedinszky et al. 2001). Secara umum, insang, hati dan ginjal mengandung
15 merupakan organ akhir dalam deposisi logam (Dallinger et al. 1987; Thomann et al. 2000; Szebedinszky et al. 2001). Beberapa hasil penelitian telah membuktikan
bahwa makanan dapat menjadi sumber utama sumber bioakumulasi logam di dalam tubuh ikan (Spry et al. 1988; Bowie et al. 1996). Namun, angkanya dapat
bervariasi tergantung jenis dan kelimpahan pemangsa (Dallinger et al. 1987; Spry et al. 1988).
Hasil penelitian Chinnaraja et al. (2001) menyebutkan bahwa organisme
planktonik di Pantai Nagapattinam (Pantai Timur India) mengakumulasi Zinc yang lebih tinggi dibandingkan logam berat lainnya. Hal ini disebabkan oleh masukan yang bersumber dari daerah budidaya, daerah pertanian, pelabuhan dan limbah pelayaran. Selain itu, hasil penelitian ini juga menunjukkan bahwa organisme plankonik dapat mengakumulasi logam berat untuk kemudian mentransfernya ke ikan-ikan planktivor. Selanjutnya hasil penelitian Yigit dan Altindag (2006) menemukan konsentrasi Cd, Pb dan Cr yang tinggi pada sampel plankton yang disebabkan oleh peningkatan konsentrasi logam dalam kolom air di Danau Egirdir. Selain plankton, di habitat tersebut juga terdapat ikan braskap atau ikan koan (Grass Carp, Ctenopharyngodon idella) yang merupakan ikan yang
bernilai ekonomis penting dan konsentrasi logam berat ditemukan di dalam ikan koan (Grass carp) tersebut lebih tinggi dibandingkan baku mutu yang diizinkan. Selanjutnya hasil penelitian Bahnasawy et al. (2009) menemukan konsentrasi
logam yang lebih tinggi pada sampel plankton di Danau Manzala Mesir, dibandingkan pada sampel air dan ikan. Selanjutnya pada sampel ikan, akumulasi logam berat lebih tinggi ditemukan pada organ insang dibandingkan pada daging ikan Liza aurata.
Beberapa hal mempengaruhi kemampuan akumulasi logam oleh ikan, seperti jenis ikan, pola mencari makan, faktor lingkungan dan musim. Geldiay and Balık (2000 dalam Yigit and Altindag 2006) menduga laju akumulasi logam yang
berbeda pada ikan dapat disebabkan oleh perbedaan pola makan setiap spesies. Sesuai dengan Chen and Folt (2000), bahkan di dalam kelompok tropik tertentu (antara zooplankton atau ikan), hewan dengan pola mencari makan yang berbeda diduga memiliki beban logam yang juga berbeda. Selanjutnya menurut Farkas et al. (2001) musim juga memiliki pengaruh terhadap akumulasi logam oleh ikan.
Pengaruh Logam Berat terhadap Jaringan Organ Ikan
Logam berat adalah istilah yang digunakan secara umum untuk kelompok logam berat dan metaloid yang densitasnya lebih besar dari 5 gr/cm3. Logam berat
16
dalam air, sedimen dan biota makanan ikan. Pada konsentrasi tertentu dapat menyebabkan edema, lisis, hipertrofi, atrofi dan nekrosis sel-sel lamella insang ikan. Pada sel-sel hati dan ginjal dapat menyebabkan lisis, atrofi, hiperplasia dan nekrosis serta nekrosis pada sel-sel kulit dan otot. Ditambahkan bahwa pada kondisi tertentu dapat menyebabkan kematian dan penurunan populasi ikan.
Senyawa-senyawa kimia selain masuk melalui saluran pencernaan, juga dapat masuk melalui saluran pernafasan (insang). Senyawa kimia tersebut akan masuk melalui insang yang langsung bersentuhan dengan lingkungan air. Setelah melewati insang, bahan-bahan kimia termasuk logam berat akan ikut ke dalam sistem pernafasan, akhirnya akan menembus sel endothelial kapiler darah untuk masuk ke dalam cairan darah. Selanjutnya akan terbawa aliran darah dan ikut dalam proses metabolisme (Connel 1990). Beberapa pengaruh toksisitas logam pada ikan yang telah terpapar logam berat yaitu pada insang, alat pencernaan dan ginjal. Jumlah logam berat yang terakumulasi pada tubuh ikan tergantung dari ukuran, umur dan kondisi ikan. Distribusi dan akumulasi logam tersebut sangat berbeda-beda untuk organisme air. Hal ini tergantung pada spesies, konsentrasi logam dalam air, pH, fase pertumbuhan dan kemampuan untuk pindah tempat (Darmono 2006).
Insang merupakan organ respirasi yang utama dan vital bagi ikan. Komponen pernapasan insang terdiri dari filamen atau lamela primer dan lamela sekunder. Pada bagian tengah lamela primer terdapat tulang atau plat-plat kartilago yang mendukung struktur lamela. Diantara struktur pendukung terdapat suatu lapisan jaringan ikat yang berisi sel-sel eosinofilik dan pembuluh darah. Lamela primer merupakan tempat suplai darah dari dan ke lengkungan insang yang mana terdapat limfosit dan granul eosinifilik (EGCs). Lamela sekunder terdiri atas dua permukaan yang dihubungkan oleh sel-sel tiang yaitu sel yang terletak diantara sirkulasi darah menjaga kesatuan lamela. Sel-sel pernapasan ikan yang sehat hanya terdiri dari dua atau tiga lapis sel epitelium yang rata dan terletak di membran basal. Di antara sel epitelium terdapat sel goblet yang menghasilkan sel-sel mukus dan sel klorid yang penting di dalam osmoregulasi. Lamela sekunder ikan memiliki sedikit mukus, yaitu suatu lapisan sel epitelia (Roberts 2001) dan kapiler-kapiler darah yang dibatasi oleh sel tiang dan makrofag (Hibiya and Fumio 1995). Epitel insang ikan merupakan bagian utama untuk pertukaran gas, keseimbangan asam basa, regulasi ion dan ekskresi nitrogen. Oleh karena itu, jika media tempat ikan hidup tercemar oleh polutan seperti amonia, pestisida, logam berat, nitrit dan petroleum hidrokarbon, fungsi vital ini menjadi terganggu karena menghalangi penerimaan oksigen.
17 (Lu 1995). Organ hati memiliki beberapa fungsi, antara lain detoksikasi, yaitu hati bertanggung jawab atas biotransformasi zat-zat berbahaya menjadi zat-zat yang tidak berbahaya yang kemudian diekskresi oleh ginjal. Suatu toksikan dalam hati akan diinaktifkan oleh enzim-anzim di dalam hati, tapi apabila toksikan masuk secara terus-menerus, kemungkinan toksikan di dalam hati akan menjadi jenuh (enzim tidak mampu mendetoksifikasi toksikan lagi), sehingga terjadi penurunan aktifitas metabolisme dalam hati. Hal ini akan menyebabkan proses detoksifikasi tidak efektif lagi, maka senyawa metabolit akan dapat bereaksi dengan unsur sel dan hal tersebut dapat menyebabkan kematian sel. Fungsi yang lain adalah pembentukan dan eksresi empedu, metabolisme garam empedu, metabolisme karbohidrat (glikogenesis, glikogenolisis, glukogenesis), sintesis protein, metabolisme dan penyimpanan lemak (Anderson 1995). Otot dan kulit ikan berperan sebagai pelindung dan penutup permukaan tubuh ikan. Kulit ikan menyerap logam berat dalam air dan dari makanan. Paparan logam berat dalam otot dan kulit ikan menyebabkan gerakan tubuh ikan terganggu sehingga ikan mudah dimangsa oleh predator.
Depurasi Logam Berat
Logam berat yang masuk ke dalam tubuh organisme tidak selalu terakumulasi dalam tubuh. Sebagian akan keluar melalui proses sekresi dan sisanya akan terikat dan terakumulasi dalam jaringan organ. Bagian yang terakumulasi membahayakan kesehatan organisme yang pada akhirnya akan berdampak terhadap keamanan konsumsi. Murtini dan Ariyanti (2005) mengatakan bahwa kualitas dan keamanan konsumsi produk-produk perikanan merupakan hal yang sangat penting dan perlu diperhatikan dalam hubungannya dengan dibukanya perdagangan bebas, karena menyangkut kepercayaan konsumen dalam dan luar negeri terhadap produk yang dihasilkan. Oleh sebab itu beberapa perlakuan khusus dapat dilakukan untuk mengurangi kontaminasi logam berat yang ada dalam tubuh organisme yang terkontaminasi.
Putro (2007) mengatakan bahwa depurasi merupakan suatu langkah yang sangat penting untuk menurunkan kandungan berbagai cemaran pada kekerangan khususnya kotoran, bakteri patogen dan logam berat sebelum dijual di pasar. Begitu pula pendapat Brite et al. (2006) yang mengatakan depurasi merupakan
salah satu langkah untuk mengurangi kandungan berbahaya seperti logam berat dan bakteri patogen. Terdapat dua metode untuk menurunkan kandungan logam berat dari tubuh biota akuatik, yaitu metode transplantasi dan depurasi. Metode transplantasi dilakukan dengan memindahkan organisme yang tercemar ke perairan yang bersih (bebas pencemar) dan memberikan waktu bagi kerang untuk membersihkan diri sendiri melalui proses ekskresi. Metode ini memakan waktu lama, minimal satu musim pemijahan dan dinilai efektif menghilangkan pencemar bakteri E. coli namun kurang efektif untuk menghilangkan jenis pencemar lain,
seperti paralytic shellfish poisoning (PSP), logam berat atau bahan kimia organik.
18
3 SEBARAN LOGAM BERAT Cu DAN Pb DI SUNGAI MUSI BAGIAN HILIR
Pendahuluan
Sungai Musi bagian hilir merupakan kawasan yang banyak mendapat tekanan dari beragam aktifitas yang terdapat di sekitar aliran sungai diantaranya adalah pertanian, perkebunan, industri pupuk, kilang minyak, pemukiman, penangkapan ikan, transportasi dan pelabuhan. Bapedalda Provinsi Sumatera Selatan (2006) mencatat ada kurang lebih 20 industri terdapat di bagian hilir Sungai Musi yaitu industri pengolahan kayu, karet (crumbber), pupuk, keramik, dok kapal, detergen, minyak, gas, cold storage, electroplating dan industri
minuman ringan. Sebagian besar industri tersebut diketahui belum memiliki Instalasi Pengolahan Air Limbah (IPAL) yang optimal. Selain itu, Sungai Musi juga merupakan daerah alur pelayaran beragam jenis kapal seperti tongkang pengangkut batu bara, kayu, kapal feri dan kapal penumpang lainnya serta kapal muatan barang. Selain di bagian hilir, bagian hulu dan tengah Sungai Musi juga memiliki aktifitas pemanfaatan yang beragam. Pertanian, perkebunan dan penambangan pasir menjadi sektor andalan di kawasan ini. Berbagai kegiatan ini berpotensi memberikan kontribusi bahan pencemar seperti logam berat. Sebagaimana kita ketahui, logam berat yang masuk ke dalam ekosistem perairan dapat mengganggu dan merusak kehidupan biota. Bahkan pada konsentrasi yang lebih tinggi dapat menyebabkan kematian.
Beberapa penelitian di Sungai Musi telah memberikan informasi adanya kontaminasi bahan pencemar yang dapat menurunkan kualitas perairan. Widyastuti (2001) menyebutkan bahwa parameter COD di Sungai Musi telah melewati ambang batas yang ditetapkan dalam yaitu sebesar 10 mg/l dan Surat Keputusan Gubernur No 407/SK/XI/1991. Selanjutnya berdasarkan parameter biologi (Indeks Shanon-Wiener), air Sungai Musi bagian hilir termasuk kategori tercemar sedang-berat (Widyastuti 2001). Beberapa penelitian yang terkait dengan logam berat juga pernah dilakukan di Sungai Musi bagian hilir. Emilia et al.
(2013) menyebutkan konsentrasi rata-rata logam kadmium (Cd) pada sampel air Sungai Musi sebesar 0,0091 mg/l dan dalam sedimen sebesar 0,1520 mg/kg. Selanjutnya Setiawan et al. (2013) menemukan bahwa daerah Sungai Musi
Palembang antara Pulokerto sampai Pulau Salah Nama telah tercemar merkuri total dengan kisaran 17,250–21,750 µg/L, sedangkan kadar merkuri total dalam sedimen berkisar antara 1,12 – 2,521 µg/L. Dibutuhkan penelitian komprehensif terkait distribusi logam berat Cu dan Pb dalam air dan sedimen di aliran Sungai Musi bagian hilir. Hasil penelitian diharapkan dapat melengkapi informasi berkaitan dengan kontaminasi logam Cu dan Pb di Sungai Musi bagian hilir.
Metode Penelitian Waktu dan tempat
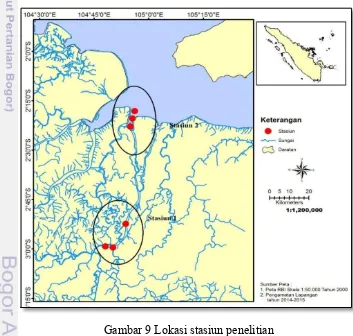
19 2015 dan Mei 2015. Lokasi penelitian di Sungai Musi bagian hilir hingga ke muara (dekat daerah Sungsang) Provinsi Sumatera Selatan. Pengambilan contoh dilakukan pada sebelas stasiun pengamatan yang diharapkan mewakili lokasi penelitian secara keseluruhan (Gambar 3). Analisa logam berat di lakukan di Laboratorium Pencemaran Laut P2O LIPI-Jakarta.
Gambar 4 Lokasi stasiun penelitian
Alat dan Bahan
Alat dan bahan yang digunakan selama penelitian terdiri dari alat pengukuran kualitas fisika kimia perairan serta alat untuk pengambilan dan penanganan sampel logam berat. Terdiri atas CTD, Eckman Grab, botol polietilen,
DO meter, pH meter, botol kaca, kertas label, GPS, cool box dan es batu serta kamera.
Metode Kerja
Penentuan lokasi pengambilan contoh
Penentuan lokasi pengambilan contoh (stasiun penelitian) dipilih menggunakan metode purposive sampling, stasiun pengamatan dipilih dengan
20
Jembatan Ampera, mewakili daerah pemukiman yang padat dengan aktifitas perkotaan, pelabuhan dan transportasi serta industri. Stasiun 2 terletak di muara Sungai Ogan yang berdekatan dengan aktifitas pengolahan minyak bumi oleh Pertamina, pabrik pupuk PT. Pusri serta bedekatan dengan stockpile batu bara dan merupakan daerah lalu lintas kapal. Stasiun 3 dan 4 terletak di sekitar daerah Upang, merupakan daerah pemukiman dan persinggahan kapal-kapal yang melalui perairan sekitar. Stasiun 5 terletak sebelum Pulau Payung yang dicirikan dengan kondisi perairan yang masih alami, sisi kiri dan kanan sungai banyak dijumpai hutan mangrove. Stasiun 6, 7 dan 8 terletak di dalam Sungai Telang yang juga bermuara ke Sungai Musi. Terdapat aktifitas pelabuhan untuk bongkar muat kayu gelondongan dan batu bara (stockpile) serta pemukiman. Stasiun 9, 10
dan 11 terletak di daerah sekitar Sungsang dan Tanjung Carat yang mewakili daerah muara Sungai Musi yang padat dengan aktifitas penangkapan ikan, pemukiman serta lalu lintas kapal nelayan dan penduduk (posisi koordinat masing-masing stasiun disajikan pada Lampiran 1).
Pengambilan dan analisa contoh air dan sedimen
Contoh air diambil pada lapisan permukaan perairan (kisaran 0-50 cm) sebanyak 1 liter (Bahnasawy et al. 2009). Sampel air kemudian disaring
menggunakan kertas saring membrane selulosa Whatman 7184004 (membran Cicles, Cellulose nitrat, white plain 0,45 µm, diameter 47 mm). Fase terlarut disimpan dalam botol polietilen dan diawetkan dengan HNO3 pekat hingga pH< 2
(Batley and Garnerd 1977; APHA/AWWA/WEF Standard Methods 20th ed 2001; Taftazani et al. 2005). Di laboratorium, sampel air (250 ml) dimasukkan dalam
corong pisah teflon, kemudian diekstraksi dengan APDC/NaDDC/ MIBK. Fase organik diekstraksi kembali dengan HNO3 (back extraction) (Bruland et al. 1979).
Biarkan selama 20 menit, tambahkan 9,75 ml air suling dan kocok. Hasil ekstraksi dalam fase air diambil dan simpan dalam botol polyethylene kemudian diukur menggunakan AAS.
Contoh sedimen diambil menggunakan Sediment Grab kemudian
dimasukan ke dalam botol polietilen dan disimpan dalam cool box kemudian
dibawa ke laboratorium. Di laboratorium, contoh sedimen dimasukkan dalam
beaker teflon dan dikeringkan dalam oven pada suhu 105°C selama 24 jam
kemudian dihaluskan hingga homogen (Hutagalung 1994). Sebanyak satu gram sampel sedimen kering didestruksi dengan campuran larutan HNO3-H2O2-HCl
pada suhu 95 oC selama 6 jam (USEPA 2006). Kadar logam berat Pb dan Cu
dalam contoh air dan sedimen ditentukan dengan AAS (Atomic Absorption Spectroscopy) jenis Varian SpectrAA plus Varian dengan menggunakan flame
campuran udara – asetilen dengan batas deteksi untuk Pb 0,01 µg/L dan Cu 0,003 µg/L. Digunakan standar internal untuk logam terlarut dan CRM PACS-2 untuk sedimen agar dapat menjamin mutu pengukuran di laboratorium.
Analisis Data