ELIMINASI P
ASSOCIATED-VI
MELALUI PER
S
INS
PMWaV (PINEAPPLE MEALYBUG W
VIRUS) DARI JARINGAN TANAMAN
ERLAKUAN AIR PANAS DAN RIBAV
MIMI SUTRAWATI
SEKOLAH PASCASARJANA
NSTITUT PERTANIAN BOGOR
BOGOR
2009
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis ELIMINASI PMWaV (PINEAPPLE MEALYBUG WILT-ASSOCIATED VIRUS) DARI JARINGAN TANAMAN NANAS MELALUI PERLAKUAN AIR PANAS DAN RIBAVIRIN adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Februari 2009
Mimi Sutrawati
ABSTRACT
MIMI SUTRAWATI. Elimination of PMWaV (Pineapple Mealybug Wilt-associated Virus) at Pineapple Tissue by Hot Water Treatment and Ribavirin. Under direction of GEDE SUASTIKA and SOBIR.
Mealybug wilt of pineapple (MWP) is the devastating disease found in all the major pineapple growing regions of the world. The disease is characterized by severe tip dieback, downword curving of the leaf margins, reddening, and wilting of the leaves that can cause total collapse of the plant. Closterovirus particles were detected in both MWP symptomatic and asymptomatic pineapple worldwide. The particles, referred to as Pineapple Mealybug Wilt-associated Virus-1 and PMWaV-2. Both viruses are mealybug transmitted. Two species of mealybug, the pink mealybug Dysmicoccus brevipes (Cockerell), and the grey mealybug Dysmicoccus neobrevipes (Beardsley) have been associated with MWP. One method for managing MWP disease is rogue symptomatic plant, but this method remain PMWaV at asymptomatic plant. Use of pesticide to control mealybug and ants is not efficient and high cost. The research was conducted to develop elimination method for PMWaV-free plant by hot water treatment and ribavirin. PMWaV infected plant (leave, stem, crown) were given two hot water treatment consisting of 35 ºC for 24 hour as pre-treatment followed immediately by hot water treatment either 56 ºC for 60 minute or 58 ºC for 40 minute in a water bath. Infected plant without hot water treatment as positive control, and healthy plant without hot water treatment as negative control. Ribavirin were added to medium culture 10 mg/l medium. PMWaV infection can be eliminated from propagative material through hot water treatment 58 ºC 40 minute in a water bath without decrease propagative material viability.
RINGKASAN
MIMI SUTRAWATI. Eliminasi PMWaV (Pineapple Mealybug Wilt-associated Virus) dari Jaringan Tanaman Nanas melalui Perlakuan Air Panas dan Ribavirin. Dibimbing oleh GEDE SUASTIKA dan SOBIR.
Penyakit layu nanas merupakan penyakit yang sangat merugikan di sentra budidaya nanas di seluruh dunia. Gejala penyakit layu berupa mati ujung daun, daun menggulung, kemerahan, dan kelayuan daun dapat menyebabkan penurunan hasil panen, bahkan kematian tanaman. Penyakit layu nanas berasosiasi dengan Pineapple Mealybug Wilt-associated Virus (PMWaV) dan ditularkan oleh Dysmicoccus brevipes dan D. neobrepives (Hemiptera: Pseudococcidae). Pengendalian penyakit dengan eradikasi tanaman bergejala tidak menjamin lahan bebas dari sumber inokulum, karena infeksi PMWaV juga dapat terjadi pada tanaman tanpa menimbulkan gejala. Penggunaan pestisida untuk pengendalian kutu putih tidak efisien dan meningkatkan biaya produksi. Penggunaan varietas tahan belum dapat dilakukan karena hingga saat ini belum ada varietas nanas yang tahan terhadap kutu putih dan PMWaV. Salah satu cara pengendalian yang perlu dikaji yaitu dengan penggunaan bibit bebas PMWaV. Penggunaan bibit bebas PMWaV akan menekan jumlah sumber inokulum PMWaV di lapang sehingga menurunkan laju penyebaran penyakit, dan pada akhirnya mengurangi resiko kehilangan hasil, serta meningkatkan peluang bagi petani untuk membudidayakan nanas dengan ratoon crop sampai beberapa generasi. Sistem perbanyakan massal nanas dapat dilakukan dengan cara teknik kultur jaringan in vitro, dan stek. Kedua cara ini dapat menghasilkan bibit nanas dalam jumlah besar dalam waktu singkat, dan seragam. Penelitian ini bertujuan mengeliminasi PMWaV pada bahan perbanyakan bibit nanas melalui perlakuan air panas dan ribavirin untuk memperoleh bibit bebas PMWaV. Hasil penelitian ini diharapkan dapat menyediakan metode eliminasi PMWaV dari jaringan tanaman nanas untuk memproduksi bibit bebas PMWaV. Perbanyakan bibit nanas bebas PMWaV secara massal dengan metode kultur jaringan dan stek diharapkan dapat menghasilkan bibit bebas PMWaV dalam jumlah besar dalam waktu yang relatif singkat sehingga memungkinkan untuk dapat segera diaplikasikan di lapang sebagai langkah pengendalian penyakit layu nanas.
Penelitian ini meliputi tiga kegiatan yaitu: (1) Eliminasi PMWaV melalui perlakuan air panas dan ribavirin pada planlet; (2) Eliminasi PMWaV melalui perlakuan air panas dan ribavirin pada eksplan; dan (3) Eliminasi PMWaV melalui perlakuan air panas pada stek nanas.
sistem budidaya ratoon crop dibandingkan plant crop. Kutu putih ditemukan baik pada tanaman bergejala layu maupun tanaman sehat. Kutu putih ditemukan baik pada tanaman bergejala layu maupun tanaman sehat. Kutu putih mengkoloni tanaman nanas terutama pada bagian pangkal daun, crown, atau pada akar.
Perlakuan air panas sebagai teknik eliminasi virus tidak dapat diaplikasikan pada planlet karena lemahnya jaringan planlet untuk menerima perlakuan suhu tinggi. Planlet nanas diduga sangat sensitif terhadap ribavirin, sehingga tidak mampu tumbuh pada media dengan ribavirin 10 mg/l.
Tunas apikal mulai tumbuh dengan membentuk daun sejak 1 msi, sedangkan tunas lateral belum menunjukkan tanda pertumbuhan tunas. Pertumbuhan eksplan tunas lateral mulai terjadi sejak 2 msi ditandai dengan terjadinya pembengkakan mata tunas dan penebalan pada mata tunas sehingga terlihat berwarna gelap. Eksplan berumur 4 msi mata tunas dari eksplan tunas lateral mulai pecah dan berwarna hijau menunjukkan calon tunas akan muncul. Selama 12 msi pada media B2N1, eksplan tidak menunjukkan pertumbuhan yang berarti namun mata tunas tetap hijau, menandakan eksplan tersebut hidup. Terhambatnya pertumbuhan eksplan dapat disebabkan oleh banyak faktor antara lain ketidak sesuaian jenis dan konsentrasi zat pengatur tumbuh, maupun penurunan viabilitas eksplan.
@ Hak cipta milik IPB, tahun 2009
Hak Cipta dilindungi Undang-undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber
a. Penyutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah
b. Pengutipan tidak merugikan kepentingan yang wajar IPB
ELIMINASI PMWaV (PINEAPPLE MEALYBUG
WILT-ASSOCIATED-VIRUS) DARI JARINGAN TANAMAN NANAS
MELALUI PERLAKUAN AIR PANAS DAN RIBAVIRIN
MIMI SUTRAWATI
Tesis
sebagai salah satu syarat untuk memperoleh gelar
Magister Sains pada
Program Studi Entomologi-Fitopatologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Penelitian : Eliminasi PMWaV (Pineapple Mealybug Wilt-associated Virus)dari Jaringan Tanaman Nanas Melalui Perlakuan Air Panas dan Ribavirin
Nama Mahasiswa : Mimi Sutrawati
NRP : A451060061
Disetujui Komisi Pembimbing
Dr. Ir. Gede Suastika, M.Sc. Dr. Ir. Sobir, M.Si Ketua Anggota
Diketahui
Ketua Program Studi
Entomologi-Fitopatologi
Dekan Sekolah Pascasarjana
Dr. Ir. Sri Hendrastuti Hidayat, M.Sc
Tanggal Ujian: 18 Februari 2009
Prof. Dr. Ir. Khairil A. Notodiputro, MS
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga penulis dapat menyelesaikan tesis dengan judul “Eliminasi PMWaV (Pineapple Mealybug Wilt-associated Virus) dari Jaringan Tanaman Nanas Melalui Perlakuan Air Panas dan Ribavirin”. Penelitian dan penulisan tesis dilaksanakan sejak Agustus 2007 hingga Januari 2009. Tesis ini merupakan salah satu syarat untuk memperoleh gelar Magister Sains pada Program studi Entomologi-Fitopatologi Sekolah Pascasarjana Institut Pertanian Bogor.
Terima kasih penulis ucapkan kepada Dr. Ir. Gede Suastika, M.Sc. dan Dr. Ir. Sobir, M.Si., selaku komisi pembimbing atas bimbingan, saran, dan masukannya selama penelitian hingga penulisan tesis ini. Terimakasih penulis ucapkan kepada Dr. Ir. Giyanto, M.Si., selaku penguji luar komisi atas koreksi, saran, dan kritiknya.
Penulis juga mengucapkan terima kasih kepada Kepala Laboratorium Virologi Tumbuhan Departemen Proteksi Tanaman Faperta IPB atas izin penggunaan bahan dan peralatan laboratorium yang digunakan selama penelitian. Terimakasih kepada Kepala Pusat Kajian Buah Tropika (PKBT) IPB atas bantuan dana penelitian dan izin penggunaan Laboratorium Kultur Jaringan Pusat Kajian Buah-buahan Tropika (PKBT) serta terimakasih kepada Kepala Kebun Percobaan Tajur II atas izin penggunaan rumah kasa di kebun percobaan Tajur II. Terimakasih juga kepada Tuti Legiastuti, Rai Maya Temaja, Irwan Lakani, Endang Opriana, Devi Agustina, Ifa Manzilla dan teman-teman di Laboratorium Virologi Tumbuhan, terimakasih kepada Sulassih, Pipit, dan teman-teman di Laboratorium Kultur Jaringan PKBT, serta kepada Bapak Ibram dan Bu Yuyun di kebun percobaan PKBT Tajur II atas bantuan dan kerjasamanya selama pelaksanaan penelitian. Terima kasih juga kepada Bu Rita Noveriza yang telah membantu penulis dalam pengolahan data dengan analisis statistik.
Ungkapan terima kasih yang tulus untuk kedua orangtuaku tercinta, Bapak Sudardjat dan Ibu Dalemawati atas perhatian, kasih sayang, doa yang tak pernah henti, serta dukungan untuk selalu berjuang mengejar impian dan cita-cita putra-putrinya. Terimakasih kepada adik-adikku tersayang Sari, Neli, dan Medi, terima kasih juga pada Kakak-kakakku Renville, Dedi, Anto, Nozy atas kasih sayang, dukungan, dan doa yang selalu menyertaiku. Ungkapan terima kasih yang tulus untuk Deden Dani, SP. yang selalu membantu selama pelaksanaan penelitian, selalu memberi dukungan, pengertian dan doa selama ini. Terima kasih kepada semua pihak yang tidak dapat disebutkan satu persatu yang telah banyak membantu penulis selama penelitian hingga penulisan tesis ini, semoga Allah SWT membalas kebaikan Bapak/Ibu dan teman-teman semua. Amin.
Akhir kata, semoga tulisan ini bermanfaat dalam menambah khazanah ilmu pengetahuan.
Bogor, Februari 2009
RIWAYAT HIDUP
Penulis dilahirkan di Curup, Bengkulu pada tanggal 23 Mei 1982 dari ayah Sudardjat dan ibu Dalemawati sebagai putri sulung dari empat bersaudara.
Penulis menyelesaikan pendidikan Sekolah Menengah Umum di SMUN 1 Curup pada tahun 2000. Pada tahun yang sama penulis diterima di Departemen Proteksi Tanaman IPB melalui jalur USMI. Pendidikan Sarjana diselesaikan oleh penulis pada September 2004. Sejak Januari 2005 penulis bekerja sebagai staf pengajar di Program Studi Perlindungan Tanaman, Fakultas Pertanian Universitas Bengkulu. Tahun 2006 penulis melanjutkan studi di Sekolah Pascasarjana Institut Pertanian Bogor, Program Studi Entomologi-Fitopatologi dengan Beasiswa Pendidikan Pascasarjana dari DIKTI.
Bogor, Februari 2009
DAFTAR ISI
Eliminasi PMWaV melalui Perlakuan Air Panas dan Ribavirin pada Planlet ... 15
Penyiapan Planlet Nanas ... 15
Inokulasi PMWaV pada Planlet ... 16
Eliminasi PMWaV dengan Perlakuan Air Panas dan Ribavirin ... 16
HASIL DAN PEMBAHASAN ... 21
Penyakit Layu Nanas di Sentra Produksi Nanas Jawa Barat ... 21
Eliminasi PMWaV dengan Perlakuan Air Panas dan Ribavirin pada planlet ... 23
Pengaruh Perlakuan Air Panas terhadap Pertumbuhan Planlet . 23 Pengaruh Perlakuan Ribavirin terhadap Pertumbuhan Planlet .. 24
Pengaruh Perlakuan Air Panas dan Ribavirin terhadap Infektifitas PMWaV pada Planlet ... 26
Eliminasi PMWaV dengan Perlakuan Air Panas dan Ribavirin pada eksplan ... 27
Pengaruh Perlakuan Air Panas terhadap Daya Tumbuh Eksplan 27 Eliminasi PMWaV dengan Perlakuan Air Panas pada Bahan Stek .. 29
Keadaa Umum ... 29
Pengaruh Perlakuan Air Panas terhadap Daya Tumbuh Stek ... 30
Pengaruh Perlakuan Air Panas terhadap Infektifitas PMWaV .. 33
KESIMPULAN DAN SARAN ... 38
Kesimpulan ... 38
Saran ... 38
DAFTAR PUSTAKA ... 39
DAFTAR TABEL
Halaman
1 Pengaruh perlakuan air panas terhadap pertumbuhan planlet nanas
selama 7 hari setelah perlakuan air panas ... 23 2 Pengaruh perlakuan ribavirin terhadap pertumbuhan planlet nanas
selama 11 hari setelah perlakuan ribavirin ... 25 3 Persentase daya tumbuh stek nanas berumur 7 minggu setelah semai
(mss) ... 33 4 Persentase stek terinfeksi PMWaV setelah mendapat perlakuan air panas . 36
DAFTAR GAMBAR
Halaman
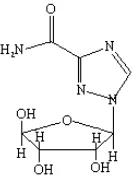
1 Struktur kimia ribavirin... 14 2 Stek daun (a) dan stek batang (b) tanaman nanas ... 19 3 Gejala penyakit layu pada tanaman nanas di Desa Bunihayu, Kecamatan Jalancagak, Kabupaten Subang, Jawa Barat. Gejala dicirikan dengan daun berwarna kuning kemerahan(a), kebugaran daun menurun sampai layu (b) ujung daun mengalami nekrotik (c), dan tepi daun menggulung ke bawah (d). ... 21 4 Hasil pengamatan koloni kutu putih (Dysmicoccus brevipes
Cockerell) pada pangkal batang (a) dan perakaran (b) tanaman nanas di Lapang ... 22 5 Pertumbuhan eksplan tunas apikal (a) dan tunas lateral (b) berumur 1
minggu setelah inisiasi (msi) ... 27 6 Daun induk pada stek daun dengan perlakuan panas (a) dan tanpa
perlakuan panas (b) ... 30 7 Stek daun (a), stek batang (b), dan stek crown (c) berumur 2 mst; stek
daun (d), stek batang (e), crown (f) berumur 4 mst; stek daun (g), stek
batang (h), crown (i) berumur 5 mst. ... 31 8 Bibit nanas berumur 2 mst (a) dan 3 mst (b) ... 33 9 Membran hasil deteksi PMWaV-1 dengan metode TBIA. Daun stek
kontrol positif (K+), daun stek kontrol negatif (K-), daun stek tanaman sakit yang diberi perlakuan suhu 56 ºC (H56), daun dari stek tanaman sakit yang diberi perlakuan air panas 58 ºC (H58). Sinyal berwarna ungu (ditunjuk oleh tanda panah) pada jaringan pembuluh menunjukkan bahwa sampel daun positif terinfeksi PMWaV-1. ... 34 10 Membran hasil deteksi PMWaV-2 dengan metode TBIA. Daun stek
DAFTAR LAMPIRAN
Halaman
PENDAHULUAN
Latar Belakang
Tanaman nanas (Ananas comosus L. (Merrill)) cv. Smooth Cayenne merupakan tanaman buah tropika yang banyak dibudidayakan di Indonesia. Produksi nanas Indonesia pada tahun 2000 yaitu 399,299 ton meningkat menjadi 1.427.781 ton pada tahun 2003 (Deptan 2008). Selain untuk memenuhi kebutuhan dalam negeri, nanas merupakan komoditas ekspor yang penting. Volume ekspor nanas kaleng Indonesia mencapai 11% dari total ekspor dunia dan menempati urutan ketiga setelah Thailand dan Filipina (CABI 2005). Potensi pengembangan produksi nanas Indonesia dapat lebih ditingkatkan jika faktor-faktor pembatas produksi nanas dapat diminimalkan.
Salah satu kendala utama dalam produksi nanas adalah serangan penyakit layu nanas yang juga telah menjadi masalah serius dalam budidaya nanas di seluruh dunia. Penyakit layu nanas berasosiasi dengan infeksi Pineapple mealybug wilt-associated virus (PMWaV) (Tryono 2006; Sether & Hu 2002a). Di lapangan, virus ini dengan efektif dapat ditularkan oleh dua spesies kutu putih yaitu Dysmicoccus brevipes Cockerell dan D. neobrevipes Cockerell (Hemiptera : Pseudococcidae) (Sether et al. 1998).
Beberapa teknik pengendalian telah diterapkan untuk mengurangi kejadian penyakit layu di lapang, namun belum dapat memberikan hasil yang diharapkan. Pengendalian penyakit layu dengan eradikasi tanaman sakit di lapang ternyata tidak menjamin lahan tersebut terbebas dari sumber inokulum karena tidak semua tanaman terinfeksi PMWaV menunjukkan gejala. Pengendalian populasi kutu putih dan semut juga kurang berhasil. Simbiosis semut dengan kutu putih (Rohrbach et at. 1988; Beardsley 1996) dan tempat hidup (nice) kutu putih di bagian yang tertutup dari tanaman nanas (di ketiak daun dan pangkal batang di bawah tanah) (Beardsley 1996) menyebabkan parasit atau predator alami (maupun yang diinnundasi) tidak dapat bekerja optimal dan tetap menyisakan populasi kutu putih yang potensial menyebarkan PMWaV. Sedangkan pengendalian kutu putih dengan aplikasi insektisida kimia kurang berhasil karena tubuh serangga ini diselimuti lilin. Pengendalian dengan varietas tahan juga belum dapat dilakukan karena semua varietas tanaman nanas di Indonesia rentan terhadap PMWaV maupun kutu putih (Hidayat 2006). Salah satu cara pengendalian penyakit layu yang memberi harapan serta perlu dikaji adalah penggunaan bibit bebas virus.
Penggunaan bibit bebas PMWaV akan menekan jumlah sumber inokulum PMWaV di lahan sehingga peluang penyebarannya menjadi kecil meskipun ada serangga vektor. Perkembangan penyakit layu pada 3 bulan pertama pertumbuhan tanaman nanas dapat menyebabkan penurunan bobot buah sampai 55% ( Sether & Hu 2002b). Dengan demikian, penggunaan bibit bebas PMWaV diharapkan dapat mencegah terjadinya penyakit layu pada fase awal pertumbuhan tanaman nanas sehingga dapat mengurangi resiko kehilangan hasil akibat penyakit layu. Rendahnya laju penyebaran penyakit layu akan mengurangi resiko kehilangan hasil dan memberikan banyak peluang bagi petani untuk membudidayakan nanas dengan tanaman ratoon sampai beberapa generasi.
Sistem perbanyakan massal tanaman nanas dapat dilakukan melalui teknik kultur jaringan in vitro dan stek. Kedua cara ini dapat menghasilkan bibit nanas yang seragam dalam jumlah besar dan dalam waktu relatif singkat. Cara perbanyakan tanaman ini apabila dikombinasikan dengan metode eliminasi PMWaV akan dapat digunakan untuk menghasilkan bibit nanas bebas virus. Pada penelitian ini dilakukan eliminasi PMWaV dari jaringan tanaman dengan perlakuan air panas atau ribavirin pada kultur jaringan dan stek.
Dalam penelitian ini eliminasi PMWaV dilakukan dengan termoterapi yaitu perlakuan air panas, dan kemoterapi yaitu dengan perlakuan ribavirin. Banyak virus yang dapat dieliminasi dari tanaman inangnya dengan cara perlakuan panas (heat treatment). Eliminasi PMWaV-1 dapat dilakukan dengan cara crown tanaman nanas yang terinfeksi di beri pre-treatment pada suhu 35°C selama 24 jam kemudian dilanjutkan dengan suhu 58°C selama 40 menit atau 56°C selama 60 menit (Sether et al. 2001). Selain perlakuan air panas, eliminasi virus dapat dilakukan dengan cara kemoterapi menggunakan ribavirin. Penambahan 10-50 mg/L ribavirin ke dalam media kultur efektif mencegah infeksi beberapa virus yaitu PVX, PVY, PVS, dan PVM pada kentang dan tembakau, juga mencegah CMV pada kultur meristem Nicotiana rustika (Hadidi et al. 1998).
Tujuan Penelitian
Tujuan penelitian ini adalah untuk mengeliminasi PMWaV pada bahan perbanyakan bibit nanas melalui perlakuan air panas dan ribavirin untuk memperoleh bibit bebas PMWaV.
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat menyediakan metode eliminasi PMWaV dari jaringan tanaman nanas untuk memproduksi bibit bebas PMWaV. Penggunaan bibit bebas PMWaV diharapkan dapat menekan kejadian penyakit layu nanas di lapang dan meningkatkan produksi nanas di Indonesia.
TINJAUAN PUSTAKA
Nanas (Ananas comosus L. (Merr.))
Nanas dibudidayakan untuk dikonsumsi sebagai buah segar maupun buah kaleng. Nanas merupakan penghasil bromelein, enzim yang diperlukan dalam industri farmasi juga sebagai agen pelunak daging dalam proses pengolahan makanan. Buah ini merupakan komoditas ekspor yang penting bagi Indonesia. Indonesia merupakan produsen nanas menempati posisi ketiga di Asia Tenggara setelah Thailand dan Filipina (CABI 2005).
Tanaman nanas berupa herba tahunan atau dua tahunan dengan tinggi 50-150 cm, terdapat tunas merayap pada bagian pangkalnya. Daun berkumpul dalam roset akar dan pada bagian pangkalnya melebar menjadi pelepah. Helaian daun berbentuk pedang, tebal, panjang 80-120 cm, lebar 2-6 cm, ujung lancip menyerupai duri. Bunga majemuk tersusun dalam bulir yang sangat rapat, letaknya terminal dan bertangkai panjang. Buahnya buah buni majemuk, bulat panjang, berwarna hijau, jika masak warnanya menjadi kuning. Tanaman nanas (Ananas comosus (L.) Merr. merupakan anggota family Bromeliaceae dari kelas Angiospermae (Dalimartha, 2004).
Tanaman nanas membentuk suatu roset yang lambat laun daun-daunnya yang lebih besar mencapai ukuran yang mencerminkan pertumbuhan normal. Setelah itu, ukuran daun konstan dan jika meristem pucuknya telah menghasilkan 70-80 lembar daun, dengan kecepatan satu lembar daun per minggu selama perode pertumbuhan yang cepat itu, meristem pucuk itu berubah menjadi bongkol bunga dan bongkol tanaman, yaitu poros tengah yang memanjang ke bunga dan buah (Wee & Thongtham, 1997).
Tanaman nanas merupakan herba perennial monokotil. Setelah pematangan buah pertama, pada tanaman berkembang tunas baru dari pucuk aksilar, yang kemudian berkembang dan mampu menghasilkan buah. Pada budidaya nanas komersial, sebaiknya tanaman nanas dipelihara hanya 2-3 generasi, sehingga petani dapat memperoleh buah yang seragam dengan kualitas yang baik (Bartholomew et. al 2003). Selanjutnya harus dilakukan penanaman bibit baru secara regular.
cara budidaya dengan penggunaan bibit baru pada awal masa tanam disebut plant crop. Sistem ratoon crop sangat penting dalam manajemen budidaya nanas karena dapat menekan biaya produksi daripada melakukan penanaman ulang atau plant crop (Bartholomew et. al 2003).
Perbanyakan Tanaman Nanas
Perbanyakan tanaman nanas umumnya dilakukan dengan menggunakan mahkota buah (crown), tunas akar (sucker), tunas batang (shoot), tunas tangkai buah (hapas), tunas dasar buah (slips), dan stek batang (Collin 1960). Petani biasanya menggunakan bibit dari tunas-tunas tersebut dengan status kesehatan bibit yang tidak diketahui, dan tidak seragam. Sejumlah besar crown dapat dengan mudah dikumpulkan bersamaan dengan pemanenan buah. Namun, crown tidak dapat dijadikan sebagai bibit jika produksi nanas ditujukan untuk pemasaran buah segar. Hal ini dikarenakan pada produksi nanas untuk pemasaran buah segar buah dijual utuh dengan mahkota buah yang masih melekat pada buah nanas. Hapas dan slips merupakan diferensiasi tunas-tunas lateral yang berkembang pada tangkai buah (peduncle) selama pembentukan buah (Bartholomew et al. 2003). Biasanya hapas dan slips dipanen dari tanaman beberapa minggu setelah pemanenan buah, sehingga membutuhkan lebih banyak waktu dan tenaga kerja dibandingkan penanganan crown. Tidak semua varietas nanas menghasilkan slips, sedangkan keberadaan slips dalam jmlah besar pada tanaman dapat mereduksi rata-rata bobot buah (Collin 1960); (Wang & Chang 1960 dalam Bartholomew et al. 2003). Sucker tumbuh pada tanaman nanas beberapa minggu setelah pemanenan buah, sehingga membutuhkan tenaga kerja untuk pemanenan dengan cara memotong sucker dari tanaman induk. Kelemahan lain penggunaan sucker sebagai bibit yaitu adanya diferensiasi pembungaan sehingga tanaman dari bibit sucker menghasilkan buah yang berukuran lebih kecil (Bartholomew et al. 2003). Ketersediaan bibit dari mahkota buah (crown), tunas akar (sucker), tunas batang (shoot), tunas tangkai buah (hapas), tunas dasar buah (slips) sangat terbatas yaitu dua sampai sepuluh tunas per tanaman per tahun (Bartholomew et al. 2003); Smith et al. (2002).
pengembangan metode perbanyakan bibit nanas untuk mendapatkan bibit nanas dalam jumlah besar dalam waktu relatif singkat. Sistem perbanyakan massal nanas dapat dilakukan dengan teknik kultur jaringan in vitro dan stek (sectioning) (Bartholomew et al. 2003).
Kultur Jaringan
Kultur jaringan adalah suatu metode untuk mengisolasi bahan tanaman yaitu sel, kelompok sel, jaringan, dan organ serta menumbuhkannya dalam kondisi aseptik sehingga bagian-bagian tersebut dapat memperbanyak diri dan beregenerasi menjadi tanaman lengkap (Gunawan, 1988). Tujuan dari teknik kultur jaringan antara lain menciptakan tanaman baru bebas penyakit, memperbanyak tanaman yang sukar diperbanyak secara seksual dan memproduksi tanaman dalam jumlah besar dalam waktu singkat (Katuuk, 1989). Perbanyakan nanas dengan kultur jaringan dapat menghasilkan 1 juta tanaman dari satu tunas aksilar selama 2 tahun (Pannetier & Lanaud 1976 dalam Bartholomew et al. 2003).
Aplikasi kultur jaringan untuk perbanyakan dan pengembangan nanas meliputi mikropropagasi melalui proliferasi tunas aksilar, proliferasi tunas adventif, regenerasi dari kultur kalus, konservasi plasma nutfah in vitro serta kultur protoplas, ovule, dan anter (Bartholomew et al. 2003). Menurut Roostika dan Mariska (2003) sistem regenerasi tanaman nanas pada kultur in vitro dapat dilakukan melalui dua jalur, yaitu organogenesis dan embriogenesis.
Stek (Sectioning)
Salah satu alternatif perbanyakan massal bibit nanas yang dapat mengatasi kebutuhan bibit nanas adalah dengan stek (sectioning) (Bartholomew et al. 2003; PKBT 2008). Teknik sectioning dalam sistem perbanyakan nanas merupakan cara baru yang belum umum digunakan. Teknologi perbanyakan massal dengan sectioning, antara lain dengan stek daun, dan stek batang dapat lebih mudah ditransfer ke petani, karena tidak membutuhkan keahlian khusus dan biayanya relatif murah.
Tunas-tunas vegetatif dari tanaman nanas dapat dipotong untuk perbanyakan bibit dengan stek daun jika setiap potongan mempunyai minimal satu atau dua tunas aksilar dan sebagian daun tanaman induk. Penggunaan stek batang dapat dilakukan dengan melepaskan bagian daun dari batang tersebut, kemudian batang dipotong menjadi empat bagian. Crown juga dapat dipotong menjadi 4 potongan stek atau lebih. Bahan stek tersebut kemudian diberi perlakuan fungisida, selanjutnya bahan stek ditanam pada media semai yang telah dipersiapkan (Bartholomew et al. 2003).
Semua bahan stek pada media semai harus ditumbuhkan hingga mencapai ukuran yang cukup dan vigor yang baik untuk siap dipindah tanam ke lahan. Bibit stek akan tumbuh dan berkembang dengan baik di lahan jika bibit tersebut pertumbuhan perakarannya optimal saat dipindah tanam (Bartholomew et al. 2003).
Gejala Penyakit Layu dan Kisaran Inang PMWaV
Serangan penyakit layu oleh PMWaV telah dilaporkan menyebabkan kerugian industri nanas di Hawaii mencapai 35% (Sether & Hu 2002b) serta kehilangan hasil sampai 40% di Kuba (Anonim 1989 dalam Borroto et.al. 2007). Dalam beberapa tahun terakhir penyakit layu nanas oleh PMWaV menjadi masalah serius di sentra budidaya nanas di Indonesia, antara lain di Subang dengan kejadian penyakit layu 60-70%, Blitar 90%, Simalungun 50-60%, dan Bogor 50% (Hutahayan 2006). Penyakit layu menyebabkan petani mengalami gagal panen, karena buah yang dihasilkan berukuran sangat kecil dan matang prematur. Rata-rata bobot buah dari tanaman bergejala layu 35% lebih rendah daripada bobot buah tanaman bebas virus, dan 30% lebih rendah daripada tanaman terinfeksi PMWaV-1 (Sether & Hu 2002b).
Tanaman induk yang terlihat sehat belum tentu terbebas dari PMWaV karena infeksi PMWaV pada nanas tidak selalu menunjukkan gejala. Tryono (2006) melaporkan hasil deteksi TBIA pada sampel tanaman bergejala maupun tidak bergejala menunjukkan adanya variasi infeksi PMWaV-1 dan PMWaV-2 di lapang. Hal ini sesuai dengan yang dilaporkan Sether et al. (2001) bahwa tanaman nanas yang tidak bergejala layu umumnya terinfeksi PMWaV-1, dan pada tanaman yang bergejala layu umumnya terinfeksi PMWaV-2. Walaupun tidak menunjukkan gejala layu, infeksi PMWaV-1 menyebabkan reduksi hasil tanaman nanas.
Infeksi awal biasanya terjadi pada tanaman di tepi lahan kemudian menyebar ke tanaman di bagian dalam lahan. Gejala penyakit ini berupa nekrotik di ujung daun, tepi daun menggulung ke bawah dan warna daun menjadi kemerahan. Kemudian gejala berkembang menjadi kehilangan kebugaran daun dan menjadi layu. Pada serangan yang parah, pertumbuhan tanaman menjadi kerdil, pertumbuhan akar terhambat hingga perakaran lemah, kemudian tanaman roboh. Jika tanaman terinfeksi pada fase awal pertumbuhan maka tanaman tersebut tidak mampu menghasilkan buah, atau hanya menghasilkan buah berukuran kecil (Sether & Hu 2002b).
Karakteristik PMWaV
Penyakit layu nanas berasosiasi dengan partikel virus dengan asam nukleat berupa ssRNA, partikel berbentuk batang lentur yang tidak beramplop dengan ukuran 1200-1500 nm x 12 nm. Virus tersebut adalah pineapple mealybug wilt-associated virus (PMWaV). PMWaV terdiri atas kompleks dua virus yang berbeda yaitu PMWaV-1 dan PMWaV-2. Berdasarkan morfologi partikel dan karakteristik genom, PMWaV-1 dan PMWaV-2 termasuk genus Ampelovirus Famili Closteroviridae (Melzer et. al 2001, Martelli et. al 2005, Sether et. al 2005). Berdasarkan karakterisasi genom dilaporkan bahwa PMWaV-1 terdiri dari 10,7 kb (7 ORF nomor aksesi AF4141119), sedangkan PMWaV-2 terdiri dari 14,8 kb (10 ORF nomor aksesi AF283103) (Melzer et. al 2001). Partikel virus yang diwarnai dengan uranyl formate jenuh dalam metanol menunjukkan suatu struktur lubang pada sub unit selubung protein yang merupakan karakteristik Closterovirus (Gunasinghe & German 1989).
Deteksi dan identifikasi virus merupakan langkah penting untuk mengetahui keberadaan virus dan asosiasinya dengan tanaman inang. Cara terbaik untuk mendeteksi PMWaV adalah dengan mengisolasi dsRNA yang diikuti dengan separasi RNA pada gel elektroforesis (Gunasinghe & German 1989). Deteksi dan identifikasi virus dapat dilakukan dengan berbagai cara antara lain deteksi serologi dan deteksi asam nukleat. Deteksi serologi dengan Enzyme Linked Immunosorbent Assay (ELISA) dan Serological Spesific Electron Mycroscopy (SSEM) dapat dilakukan, namun dengan metode Tissue Blot Immunoassay (TBIA) dapat diperoleh hasil deteksi yang lebih baik. Deteksi asam nukleat dilakukan dengan pengujian reverse transcription-polymerase chain reaction (RT-PCR). Kedua PMWaV berbeda dengan 50% asam nukleat yang homolog berdasarkan sekuensi genom yang telah dilakukan. Berdasarkan hasil deteksi dan identifikasi Tryono (2006) PMWaV yang ada di Indonesia mirip dengan PMWaV yang ada di Hawaii dan partikel virus ini hanya ada pada jaringan pembuluh.
mengintroduksikan PMWaV ke jaringan floem tanaman, kemudian virus tersebut menyebar secara sistemik di dalam tanaman. Sifat virus yang terbatas pada floem merupakan salah satu karakteristik Closteroviridae. Hu et al. (1997) melaporkan bahwa antigen PMWaV terdeteksi dengan TBIA daun berumur sedang, juga pada akar tetapi tidak pada daun muda.
Kutu Putih dan Penularan PMWaV
Kutu putih Dysmicoccus brevipes Cockerell(Hemiptera: Pseudococcidae) dan Dysmicoccus neobrevipes Cockerell (Hemiptera: Pseudococcidae) merupakan hama utama tanaman nanas yang menjadi masalah serius dalam budidaya nanas (Sether & Hu 1998). Selain sebagai hama yang merusak karena aktivitas makannya, serangga ini juga berperan sebagai vektor PMWaV yang menjadi penyebab penyakit layu nanas (Sether et al. 1998). Kutu putih ditemukan selalu berasosiasi dengan beberapa jenis semut (Rohrbach et at. 1988) sehingga mobilitasnya meningkat demikian juga dengan penyebaran PMWaV di lapangan.
Penyakit layu nanas dilaporkan dapat ditularkan melalui perbanyakan vegetatif tanaman nanas dan melalui vektornya yaitu Dysmicoccus brevipes (pink mealybug) (Hemiptera: Pseudococcidae) dan D. neobrevipes (grey mealybug) (Hemiptera: Pseudococcidae) (Sether et al. 1998). Kutu putih tersebut merupakan hama kosmopolitan pada tanaman nanas (Rorhbach et al. 1988). D. brevipes bersifat polifagus dengan kisaran inang lebih dari 100 genus dari 53 famili tanaman, termasuk beberapa gulma yang tumbuh di sekitar tanaman nanas.
Perbanyakan tanaman nanas yang umum dilakukan hanya dengan cara vegetatif. Jika tanaman induk terinfeksi PMWaV maka tanaman anakannya akan ikut terinfeksi karena penyebaran PMWaV dalam tanaman yaitu secara sistemik pada pembuluh. Petani menggunakan bibit nanas dari ratoon, jika ratoon tersebut berasal dari tanaman induk terinfeksi PMWaV maka bibit yang diperoleh juga terinfeksi PMWaV.
Sether et al. (1998) melaporkan bahwa tidak ada infeksi PMWaV pada sampel tanaman yang dikumpulkan dari lapang, yaitu gulma, tumbuhan semak, dan pohon yang tumbuh di sekitar lahan nanas. Sether et. al (2002) juga melaporkan tidak ada infeksi PMWaV pada Agave, pisang, ketela pohon, Chenopodium, tembakau, dan rumput-rumputan, di mana tanaman nanasnya sendiri terinfeksi setelah diinokulasi dengan D. brevipes yang viruliferous, meskipun beberapa dari tanaman non nanas ini dapat dijadikan inang oleh D. brevipes.
Pengendalian Penyakit Layu
Eradikasi tanaman sakit di lahan dapat menjadi strategi pengendalian penyakit layu di lapang (Sether & Hu et al. 2002b). Namun, teknik eradikasi tanaman memerlukan banyak tenaga kerja dan tidak efisien karena tidak semua tanaman sakit menunjukkan gejala layu, akibatnya tujuan eradikasi untuk menghilangkan inokulum di lapangan tidak tercapai. Populasi kutu putih yang tinggi sepanjang tahun sangat mendukung penyebaran inokulum di alam. Penanggulangan penyakit layu melalui pengendalian populasi kutu putih juga kurang berhasil. Simbiosis semut dengan kutu putih (Rohrbach et at. 1988; Beardsley 1996) dan tempat hidup (nice) kutu putih di bagian yang tertutup dari tanaman nanas (di ketiak daun dan di pangkal batang bawah tanah) (Beardsley 1996) menyebabkan parasit atau predator alami (maupun yang diinnundasi) tidak dapat bekerja optimal dan tetap menyisakan populasi kutu putih yang potensial menyebarkan PMWaV. Sedangkan pengendalian kutu putih dan semut dengan aplikasi insektisida kimia tidak ekonomis karena biaya produksi semakin tinggi dan juga tidak dapat menjamin populasi kutu putih selalu pada tingkat aman bagi penyebaran PMWaV.
melalui tanaman varietas tahan. Salah satu cara pengendalian penyakit layu yang sangat menjanjikan dan perlu dikaji adalah penggunaan bibit bebas virus.
Penggunaan bibit bebas PMWaV dapat menekan sumber inokulum sehingga dapat mengurangi laju infeksi pada tanaman nanas di lahan. Jika infeksi PMWaV dapat dicegah sampai tanaman melewati fase vegetatif, maka petani dapat mengurangi resiko penurunan hasil panen. Berdasarkan penelitian Sether & Hu (2002b), tanaman nanas yang terinfeksi PMWaV lebih awal yaitu saat tanaman berumur 3-6 bulan (fase vegetatif) maka tanaman akan menghasilkan buah berukuran relatif lebih kecil dari pada tanaman yang terinfeksi PMWaV setelah berumur lebih dari 10 bulan (fase generatif).
Eliminasi Virus dengan Perlakuan Panas
Dalam beberapa tahun terakhir, perlakuan panas (heat treatment) menjadi metode yang umum digunakan untuk memproduksi propagasi tanaman yang bebas virus, viroid dan fitoplasma (Hadidi et al. 1998). Banyak virus yang dapat dieliminasi dari tanaman inangnya dengan cara heat treatment. Awalnya perlakuan panas diperlakukan pada keseluruhan tanaman pada suhu konstan yang berkisar dari 35-40°C. Meskipun banyak tanaman yang mati setelah mendapatkan perlakuan ini, beberapa tanaman yang bertahan dapat menjadi tanaman yang bebas virus. Bagian tanaman dorman yang biasa digunakan adalah biji, umbi dan tunas. Secara umum bagian tanaman tersebut lebih tahan terhadap suhu tinggi dari pada jaringan tanaman lainnya. Setelah beberapa tahun, metode heat treatment dimodifikasi, yaitu dikombinasikan dengan kultur meristem apikal untuk memperbesar peluang mendapatkan tanaman bebas virus.
Perlakuan panas in vivo menghambat replikasi virus di dalam tanaman, translokasi virus, dan proses-proses dalam tanaman. Perlakuan panas dengan suhu di atas 37 °C mampu menghambat multiplikasi banyak virus, merusak movement protein yang sangat berperan dalam transportasi virus dalam tanaman, serta merusak coat protein virus yang juga berperan dalam translokasi sistemik virus dalam tanaman ( Hadidi et.al 1998). Perlakuan panas in vivo tidak hanya berpengaruh terhadap virus di dalam tanaman, tetapi juga menghambat proses fotosintesis, meningkatkan respirasi gelap, dan mereduksi translokasi karbohidrat, mempengaruhi sintesis protein, mempengaruhi pembelahan sel, pertumbuhan sel dan hormon tumbuhan. Perubahan proses dalam tumbuhan juga dapat mempengaruhi virus dalam tumbuhan tersebut ( Hadidi et.al 1998).
Salah satu cara mengeliminasi keberadaan PMWaV pada tanaman nanas adalah dengan perlakuan panas pada bibit nanas yang terinfeksi. Beberapa laporan menyebutkan PMWaV dapat dieliminasi dengan cara bibit nanas diberi perlakuan air panas 50°C selama 120 menit (Hadidi et al. 1998). Sedangkan Sether et al. (2001) menyebutkan bahwa PMWaV dapat dieliminasi melalui perbanyakan vegetatif dengan kultur jaringan meristem apikal dan meristem lateral dari crown tanaman nanas yang terinfeksi. Eliminasi PMWaV-1 dapat dilakukan dengan cara crown tanaman nanas yang terinfeksi di beri perlakuan air panas di dalam penangas air pada suhu 35°C selama 24 jam kemudian dilanjutkan dengan suhu 58°C selama 40 menit atau 56°C selama 60 menit (Sether et al. 2001).
Eliminasi Virus dengan Ribavirin
beberapa virus yaitu PVX, PVY, PVS, dan PVM pada kentang dan tembakau, juga mencegah CMV pada kultur meristem Nicotiana rustika (Hadidi et al. 1998).
Keberadaan substansi analog guanosin akan mengganggu pembentukan asam nukleat virus sehingga multiplikasi virus dalam tanaman terhambat. Ribavirin aktif dalam bentuk trifosfat yang menghambat proses capping pada 5’ RNA virus (Dawson & Saldana 1984). Selain itu ribavirin menghambat replikasi virus pada fase awal yaitu dengan mengganggu síntesis RNA-dependent RNA polymerase, dan pada fase akhir dengan mengganggu síntesis selubung protein (Schuster & Huber 1991 dalam Sharma et.al 2006). Berikut ini adalah gambar struktur kimia ribavirin (gambar 1).
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium Virologi Tumbuhan Departemen Proteksi Tanaman IPB, Laboratorium Kultur Jaringan Pusat Kajian Buah Tropika (PKBT) IPB, dan Kebun Percobaan Tajur II PKBT IPB sejak Agustus 2007 sampai Januari 2009.
Metode Penelitian
Penelitian ini meliputi tiga kegiatan yaitu: (1) Eliminasi PMWaV melalui perlakuan air panas dan ribavirin pada planlet; (2) Eliminasi PMWaV melalui perlakuan air panas dan ribavirin pada eksplan; dan (3) Eliminasi PMWaV melalui perlakuan air panas pada bahan stek nanas.
Pengamatan Penyakit Layu dan Kutu Putih di Lapang
Pengamatan penyakit layu dan kutu putih pada tanaman nanas telah dilakukan di sentra produksi nanas di Jawa Barat yaitu di Desa Bunihayu, Kec. Jalancagak, Kab. Subang.
Tanaman nanas cv Smooth Cayenne yang bergejala layu diambil dari pertanaman nanas Kab. Subang Jawa Barat. Tanaman yang diambil adalah tanaman nanas yang menunjukkan gejala penyakit layu berwarna merah dan nekrosis pada ujung daun. Verifikasi PMWaV pada sampel tanaman dilakukan dengan TBIA. Tanaman nanas yang positif terinfeksi PMWaV ditanam dalam polibag yang berisi campuran tanah dan kompos dengan perbandingan 1:1. Tanaman nanas tersebut kemudian digunakan sebagai sumber inokulum PMWaV dalam percobaan berikutnya.
Eliminasi PMWaV melalui Perlakuan Air Panas dan Ribavirin pada Planlet
untuk menginduksi pengakaran pada planlet. Planlet tersebut kemudian diinokulasi dengan PMWaV menggunakan vektor kutu putih.
Inokulasi PMWaV pada Planlet. Kutu putih (Dysmicoccus sp.) diambil dari pelepah pangkal batang dan akar tanaman nanas kemudian diperbanyak pada buah kabocha (Cucurbita maxima). Kutu putih dipindahkan dengan menggunakan kuas basah ke buah kabocha yang diletakkan dalam kotak kardus dan disimpan pada suhu ruang. Nimfa-nimfa yang diletakkan oleh imago betina kutu putih tersebut dipelihara pada kabocha sampai menghasilkan kutu putih generasi ke dua yang selanjutnya digunakan sebagai vektor penularan PMWaV. Nimfa kutu putih generasi ke dua dibiarkan makan akuisisi pada tanaman nanas sumber PMWaV selama 72 jam, kemudian dibiarkan makan inokulasi pada planlet dalam botol kultur selama 7-14 hari. Jumlah planlet yang diinokulasi adalah sebanyak 10 botol kultur, masing-masing 3 planlet/botol. Jumlah kutu putih yang digunakan sebagai vektor adalah 10 individu/planlet.
Eliminasi PMWaV dengan Perlakuan Air Panas dan Ribavirin. Planlet yang telah diinokulasi PMWaV kemudian diberi perlakuan air panas atau ribavirin. Planlet terlebih dahulu diberi pre-treatment dalam penangas air (waterbath) pada suhu konstan 35°C selama 24 jam untuk mengurangi kejutan (shock) terhadap suhu panas yang diberikan selanjutnya. Segera setelah pre-treatment ini, suhu waterbath dinaikkan menjadi 58°C kemudian planlet dimasukkan ke waterbath selama 30-40 menit atau 56°C selama 30-60 menit. Selanjutnya planlet ditanam kembali pada media Murashige & Skoog (MS). Percobaan ini terdiri dari 6 taraf perlakuan suhu yaitu perlakuan air panas 35 ºC selama 24 jam; perlakuan 35 ºC selama 24 jam dilanjutkan dengan 56 ºC selama 30 menit; perlakuan 35 ºC selama 24 jam dilanjutkan 56 ºC selama 60 menit; perlakuan 35 ºC selama 24 jam 58 ºC selama 30 menit; perlakuan 35 ºC selama 24 jam dilanjutkan 58 ºC selama 40 menit; dan tanpa perlakuan panas sebagai kontrol negatif. Setiap perlakuan terdiri dari 3 botol kultur sebagai ulangan, dan masing-masing ulangan terdiri dari 4 planlet sehingga terdapat 72 unit percobaan.
aquades kemudian ditambahkan pada media MS yang masih cair dalam botol kultur dan ditutup rapat dengan plastik bening. Selanjutnya media+ ribavirin disimpan pada suhu ruang sampai media menjadi padat. Percobaan ini terdiri dari 3 macam perlakuan yaitu planlet terinfeksi PMWaVyang ditumbuhkan pada media ribavirin 10 mg/l, planlet terinfeksi PMWaV pada media MS tanpa ribavirin sebagai kontrol positif, dan planlet sehat pada media MS tanpa ribavirin sebagai kontrol negatif. Perlakuan ribavirin 10 mg/l terdiri dari 11 botol kultur sebagai ulangan, setiap ulangan terdiri dari 4 planlet, sedangkan kontrol positif dan kontrol negatif masing-masing dilakukan 1 ulangan yang terdiri dari 4 planlet. Sehingga jumlah planlet yang digunakan dalam percobaan ini adalah 52 planlet.
Eliminasi PMWaV dengan Perlakuan Air Panas dan Ribavirin pada Eksplan
Bahan Tanaman Nanas. Bahan tanaman yang digunakan untuk kultur jaringan adalah mahkota buah (crown) nanas cv Smooth Cayenne terinfeksi PMWaV yang diambil dari pertanaman nanas di Desa Bunihayu, Kecamatan Jalancagak, Kabupaten Subang, Provinsi Jawa Barat. Verifikasi infeksi PMWaV pada crown yang digunakan sebagai bahan kultur jaringan dilakukan dengan tissue blot immunoassay (TBIA) berdasarkan metode Hu et.al (1997). Sebagai kontrol negatif digunakan crown tanaman sehat. Eksplan yang digunakan untuk inisiasi kultur nanas yaitu tunas aksilar dan tunas apikal yang diambil dari crown.
Kultur Jaringan Nanas. Daun crown dilepaskan dari bonggol, kemudian bonggol direndam dalam larutan detergen selama 30 menit dan dibilas dengan air mengalir selama 30-60 menit. Mata tunas aksilar dan tunas apikal dari bonggo crown diambil dengan menggunakan scalpel dan langsung direndam dalam larutan fungisida dan bakterisida selama 30 menit, dan dibilas dengan aquades steril sebanyak 2 kali. Selanjutnya, mata tunas tersebut direndam dalam NaOCl 20% dan 10% masing-masing selama 5 menit, dan dibilas dengan aquades steril. Mata tunas tersebut kemudian ditanam pada media inisiasi yaitu media MS dasar yang terdiri dari larutan makro, larutan mikro A, larutan mikro B ditambah NAA 2 mg/l, BA 2 mg/l (Lampiran 1) dipelihara sampai 12 minggu, selanjutnya tunas dipindahtanam ke media B2N1 (Lampiran 2) untuk menginduksi pembentukan tunas dan akar.
Eliminasi PMWaV dengan Perlakuan Air Panas pada Bahan Stek
Penyiapan Bahan Tanaman. Bahan tanaman diambil dari tanaman nanas induk yang menunjukkan gejala penyakit layu (diverifikasi dengan TBIA) dan tanaman sehat sebagai kontrol negatif dari Kebun Percobaan PKBT Tajur II. Bahan stek yang digunakan adalah daun, batang, dan crown.
Penanaman Stek. Bahan stek daun diperoleh dengan cara pemotongan bagian dasar daun sampai mengenai jaringan meristem kulit batang dengan tunas lateral (Gambar 2a). Sedangkan stek batang didapatkan dengan cara memotong batang secara longitudinal menjadi 2 bagian potongan (Gambar 2b). Crown digunakan utuh, tanpa pemotongan karena crown masih sangat muda.
Gambar 2 Stek daun (a) dan stek batang (b) tanaman nanas
Media semai yang digunakan adalah sekam bakar. Sekam bakar dibasahi sampai basah kapasitas lapang untuk menjaga kelembaban kemudian sekam ditebar pada meja pesemaian seluas 1-2 m2 dengan ketebalan media tanam 10 cm. Semua bahan stek direndam dalam larutan fungisida dan bakterisida. Kemudian bahan stek ditanam pada media semai dengan jarak tanam 5 cm. Selama 2 minggu pertama penyemaian, meja semai disungkup plastik bening untuk mengurangi laju penguapan supaya stek tidak cepat mengering.
Bibit stek yang telah berumur 7 minggu dipindah tanam ke media tanam dalam polibag 15x25 cm. Media tanam yang digunakan adalah sekam bakar dan kompos (1:1). Bibit dipelihara sampai 4 minggu, dan dilakukan pengamatan jumlah daun yang tumbuh dan tinggi tanaman. Kemudian daun dipanen untuk deteksi PMWaV dengan TBIA.
Data daya tumbuh stek dan persentase infeksi PMWaV dianalisis dengan ANOVA program SAS versi 9.0. Apabila terdapat beda nyata di antara perlakuan maka dilakukan uji lanjut Duncan’s Multiple Range Test (DMRT) ( =0,05).
Verifikasi Infeksi PMWaV dengan Tissue Blot Immunoassay (TBIA)
PMWaV pada tanaman dideteksi secara serologi dengan TBIA berdasarkan metode Hu et al. (1997). Daun dipotong melintang pada bagian dasar daun dengan
potongan yang rata. Potongan ini kemudian diblot pada 0,45 m Nitro ME nitrocellulose membrane (Amersham Pharmacia Biotec, USA) selama 60 detik. Pola jaringan pembuluh daun menempel dan meninggalkan jejak pada membran. Membran dapat disimpan kering di antara lipatan kertas saring pada suhu ruang sampai siap dianalisis.
HASIL DAN PEMBAHASAN
Penyakit Layu Nanas di Sentra Produksi Nanas Jawa Barat
Pengamatan penyakit layu pada tanaman nanas telah dilakukan di sentra produksi nanas di Jawa Barat yaitu di Desa Bunihayu, Kec. Jalancagak, Kab. Subang. Tanaman nanas bergejala layu dapat diamati dengan mudah karena terjadi perubahan warna daun menjadi kemerahan, atau kekuningan. Gejala awal penyakit layu dimulai dengan perubahan warna daun terutama pada daun bagian tengah menjadi merah (Gambar 3a). Pada perkembangan selanjutnya semakin banyak daun yang berwarna merah, terutama daun bagian bawah sampai pada akhirnya semua daun menjadi merah. Kebugaran daun menurun sehingga tanaman layu (Gambar 3b), dan terlihat nekrotik pada ujung daun (Gambar 3c). Bila sudah kering, umumnya tepi daun menggulung ke bawah dan layu (Gambar 3d).
Gambar 3 Gejala penyakit layu pada tanaman nanas di Desa Bunihayu, Kecamatan Jalancagak, Kabupaten Subang, Jawa Barat. Gejala dicirikan dengan daun berwarna kuning kemerahan (a), kebugaran daun menurun sampai layu (b), ujung daun mengalami nekrotik (c), dan tepi daun menggulung ke bawah (d).
c
a b
Hasil pengamatan penyakit layu di lapangan menunjukkan bahwa penyakit layu yang terjadi pada fase vegetatif sangat mempengaruhi produksi buah pada fase generatif. Hal ini sesuai dengan hasil penelitian Sether & Hu (2002b) bahwa rata-rata bobot buah yang dihasilkan oleh tanaman bergejala layu berkorelasi positif dengan umur tanaman saat terjadinya gejala penyakit layu. Tanaman yang bergejala layu pada umur 3-6 bulan menghasilkan bobot buah yang lebih rendah daripada tanaman yang bergejala layu pada umur 10-14 bulan. Rata-rata bobot buah dari tanaman terinfeksi PMWaV-2 35% lebih rendah daripada tanaman sehat, dan 30% lebih rendah dari tanaman yang hanya terinfeksi PMWaV-1 (Sether & Hu 2002b).
Hasil pengamatan juga menunjukkan bahwa kejadian penyakit layu cenderung lebih tinggi pada sistem budidaya ratoon crop dibandingkan plant crop. Widyanto (2005) melaporkan bahwa luas serangan penyakit layu nanas di Desa Bunihayu pada sistem ratoon crop mencapai 50% sedangkan kejadian penyakit layu pada pertanaman sistem plant crop hanya 15%.
Kutu putih ditemukan baik pada tanaman bergejala layu maupun tanaman sehat. Serangga ini mengkoloni tanaman nanas terutama pada bagian pangkal daun (Gambar 4a), crown, atau pada akar (Gambar 4b). Kutu putih yang berasosiasi dengan tanaman nanas di Subang telah diidentifikasi sebagai Dysmicoccus brevipes (Hemiptera: Pseudococcidae) (Hutahayan 2006).
Gambar 4 Hasil pengamatan koloni kutu putih (Dysmicoccus brevipes Cockerell) pada pangkal batang (a) dan perakaran (b) tanaman nanas di lapang
Eliminasi PMWaV dengan Perlakuan Air Panas dan Ribavirin pada Planlet
Pengaruh Perlakuan Air Panas terhadap Pertumbuhan Planlet
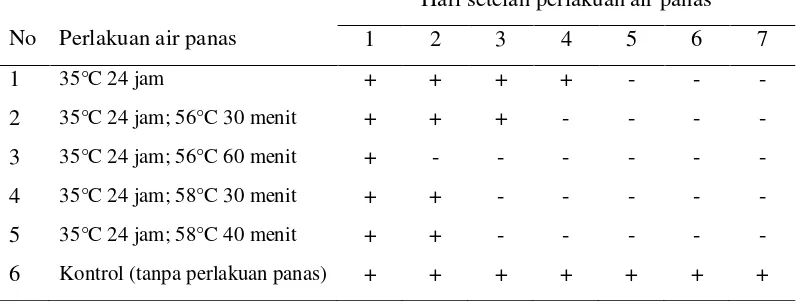
Hasil pengamatan menunjukkan bahwa pertumbuhan planlet menjadi sangat terganggu setelah mendapat perlakuan air panas (Tabel 1). Plantlet yang masih hidup ditandai dengan warna daun tetap hijau, dan terjadi pertumbuhan daun yang baru, sedangkan planlet yang mati diawali dengan perubahan warna planlet menjadi berwarna kuning atau kecoklatan, serta tidak terjadi pertumbuhan daun baru. Planlet yang diberi perlakuan air panas hanya dapat bertahan hidup sampai maksimal hari ketiga setelah perlakuan dan tanda-tanda kematian telah tampak jelas pada hari-hari selanjutnya.
Tabel 1 Pengaruh perlakuan air panas terhadap pertumbuhan planlet nanas selama 7 hari setelah perlakuan air panas
Perlakuan air panas tidak hanya berpengaruh terhadap virus di dalam jaringan tanaman tetapi juga berpengaruh terhadap metabolisme dan fisiologi tanaman. Perlakuan panas menyebabkan perubahan pada kloroplas dan perubahan sitoplasma sel sehingga mengganggu proses fotosintesis tanaman. Kerusakan klorofil menyebabkan tanaman mengalami klorosis sehingga tanaman berwarna hijau kekuningan bahkan kecoklatan, selanjutnya tanaman mengalami dehidrasi dan absisi. Perlakuan panas juga dapat mempengaruhi sintesis protein tanaman, meningkatkan reaksi gelap, dan mereduksi translokasi karbohidrat (Hadidi et. al 1998).
mempunyai ambang toleransi yang rendah terhadap perlakuan air panas sehingga jaringan planlet mengalami kerusakan jaringan, dan mati. Perlakuan air panas sebagai teknik eliminasi virus tampaknya tidak dapat diaplikasikan pada planlet karena lemahnya jaringan planlet untuk menerima perlakuan suhu tinggi. Hal ini sesuai dengan pernyataan Hadidi (1998) bahwa perlakuan air panas umumnya diterapkan pada bagian tanaman dorman seperti biji, maupun tunas. Sedangkan untuk tanaman yang sedang tumbuh lebih sering digunakan perlakuan udara panas dengan suhu yang lebih rendah dan waktu aplikasi yang lebih panjang.
Pada penelitian ini, planlet yang diberi perlakuan air panas tidak menunjukkan pertumbuhan daun baru. Hal ini diduga disebabkan oleh perlakuan panas berpengaruh langsung terhadap pembelahan sel dan pertumbuhan tanaman. Hadidi et al. (1998) menyatakan bahwa perlakuan suhu di atas 40 ºC menyebabkan reduksi pembelahan dan pertumbuhan sel tanaman. Faktor utama yang mempengaruhi pembelahan dan pertumbuhan sel adalah zat pengatur tumbuh. Beberapa penelitian menunjukkan bahwa stres suhu tinggi menyebabkan peningkatan level abscisic acid (ABA) dan menekan aktivitas sitokinin, auksin dan giberelin (Hadidi et al. 1998).
Pengaruh Perlakuan Ribavirin terhadap Pertumbuhan Planlet
Tabel 2 Pengaruh perlakuan ribavirin terhadap pertumbuhan planlet nanas selama 11
Keterangan: K- = kontrol negatif (planlet sehat, tanpa ribavirin), K+ = kontrol positif (planlet sakit tanpa ribavirin), (+) planlet hidup, (-) planlet mati.
Pengaruh Perlakuan Air Panas dan Ribavirin terhadap Infektifitas PMWaV pada Planlet
Eliminasi PMWaV dengan Perlakuan Air Panas pada Eksplan
Pengaruh Perlakuan Air Panas terhadap Daya Tumbuh Eksplan
Pertumbuhan eksplan di dalam media inisiasi mulai terlihat sejak 1 minggu setelah inisiasi (msi) pada media inisiasi. Pertumbuhan eksplan tunas apikal menunjukkan perbedaan dengan eksplan mata tunas lateral. Tunas apikal mulai tumbuh dengan membentuk daun sejak 1 msi (Gambar 5a), sedangkan tunas lateral belum menunjukkan tanda pertumbuhan tunas (Gambar 5b). Pertumbuhan eksplan tunas lateral mulai terjadi sejak 2 msi ditandai dengan terjadinya pembengkakan mata tunas dan penebalan pada mata tunas sehingga terlihat berwarna gelap. Setelah 4 msi mata tunas dari eksplan tunas lateral mulai pecah dan berwarna hijau menunjukkan calon tunas akan muncul. Namun sampai eksplan berumur 12 msi tidak terjadi perubahan yang signifikan pada mata tunas tersebut. Selanjutnya eksplan dipindah ke media B2N1 untuk menginduksi pembentukan tunas dan akar. Selama 12 msi pada media B2N1, eksplan juga tidak menunjukkan pertumbuhan yang berarti namun mata tunas tetap hijau, menandakan eksplan tersebut hidup.
Gambar 5 Pertumbuhan eksplan tunas apikal (a) dan tunas lateral (b) berumur 1 minggu setelah inisiasi (msi)
Pengamatan eksplan pada medium kultur dilakukan sampai 12 msi, namun hingga akhir pengamatan pertumbuhan pada eksplan tunas lateral terhambat. Nodul yang membengkak tetap berwarna hijau dan tidak terlihat adanya pertumbuhan tunas maupun akar. Terhambatnya pertumbuhan eksplan dapat disebabkan oleh banyak faktor antara lain perubahan keseimbangan dan konsentrasi zat pengatur tumbuh, maupun penurunan daya tumbuh eksplan.
a
Perbanyakan tanaman dengan kultur jaringan menunjukkan adanya perbedaan respon antar spesies, klon, maupun varietas tanaman terhadap komposisi media dan zat pengatur tumbuh. Menurut Gunawan (1988), zat pengatur tumbuh merupakan komponen yang penting dalam kultur jaringan, namun jenis dan kompisisinya sangat tergantung pada jenis tanaman dan tujuan kulturnya. Pertumbuhan dan morfogenesis tanaman in vitro dikendalikan oleh keseimbangan dan konsentrasi zat pengatur tumbuh di dalam tanaman tersebut. Salah satu zat pengatur tumbuh yang digunakan dalam percobaan ini adalah benzyl adenin (BA) yang merupakan salah satu sitokinin sintetik yang cukup efektif dan NAA yang merupakan auksin. BA mampu menginduksi produksi hormon alami di dalam tanaman dan hormon alami tersebut bekerja dalam menginduksi organogenesis (Zaers & Mapes 1982). Auksin berperan dalam pemunculan kalus, suspensi sel, pertumbuhan akar, dan bersama-sama dengan sitokinin mengatur morfogenesis tanaman. Selain itu, auksin berperan dalam pembentukan klorofil, embriogenesis, serta morfogenesis tunas dan akar (Wattimena 1988).
Di dalam tanaman terdapat zat pengatur tumbuh endogen antara lain IAA (indoleacetic acid), dan N6 (2-isopentenyl) adenin (iP), N6 (2-isopentenyl) adenosine (iPR), Zeatin (Z), Zeatin riboside (ZR), dan N6-benzyladenin (BA) yang berada pada bagian dasar daun. Penyerapan BA dan NAA dari medium kultur menyebabkan peningkatan level ZPT endogen yaitu iP dan IAA yang kemudian terlibat dalam proses organogenesis tunas (Auer et al. 1999).
PMWaV adalah penurunan daya tumbuh eksplan akibat perubahan metabolisme pada tanaman nanas sakit. Tanaman yang terserang penyakit layu mengalami perubahan metabolisme antara lain peningkatan kadar asam absisat, protein terlarut, prolin dan fenol, munculnya peroksidase dan aktivitas asam invertase (Nieves et al. (1996) dalam Borroto et al. 2007). Perubahan metabolisme dalam tanaman sakit tersebut diduga mempengaruhi daya tumbuh eksplan yang berasal dari tanaman sakit.
Eliminasi PMWaV dengan Perlakuan Air Panas pada Stek
Keadaan Umum
Bahan perbanyakan yang digunakan adalah stek daun, batang, dan crown. Stek yang disemai pada media sekam bakar mulai memperlihatkan pertumbuhan tunas sejak 2 minggu setelah semai (mss). Pertumbuhan perakaran pada bibit mulai terlihat sejak 3 minggu setelah semai (mss). Daya tumbuh stek pada tabel 1 merupakan pertumbuhan tunas pada 7 mss. Perlakuan panas pada stek menyebabkan daun induk pada stek daun lebih cepat mengalami perubahan warna menjadi kekuningan, kemudian mengering (Gambar 6a) berbeda dengan stek daun tanaman sakit tanpa perlakuan panas (Gambar 6b).
Gambar 6 Daun induk pada stek daun dengan perlakuan panas (a) dan tanpa perlakuan panas (b)
Stek daun dan stek batang menghasilkan 1-2 tunas per stek. Stek daun ditanam dengan cara membenamkan bagian stek yang mengandung mata tunas ke dalam media semai, dengan daun berada di permukaan media semai. Sedangkan cara penanaman stek batang yang baik yaitu dengan cara batang dibagi menjadi dua bagian
dan permukaan batang yang mengandung tunas berada di atas permukaan media semai.
Pengaruh Perlakuan Air terhadap Daya Tumbuh Stek
Bahan perbanyakan yang digunakan adalah stek daun, batang, dan crown. Tunas pada stek mulai tumbuh sejak 2 minggu setelah semai (mss). Pada umumnya tumbuh satu sampai dua tunas pada stek daun, batang, dan crown. Tunas yang tumbuh dari crown berukuran relatif lebih besar dari pada tunas dari stek daun dan batang.
Gambar 7 Stek daun (a), stek batang (b), dan stek crown (c) berumur 2 minggu setelah semai (mss); stek daun (d), stek batang (e), crown (f) berumur 4 mss; stek daun (g), stek batang (h), crown (i) berumur 5 mss.
Berdasarkan pengamatan selama pesemaian, tidak ada perbedaan warna maupun bentuk tunas pada stek dari tanaman sakit maupun tanaman sehat, baik yang diberi perlakuan panas maupun tanpa perlakuan panas. Hal ini menunjukkan bahwa infeksi PMWaV tidak menimbulkan gejala pada bibit/anakan di pesemaian. Namun demikian, bibit atau anakan yang terlihat sehat tanpa gejala layu belum tentu bebas infeksi PMWaV. Persentase daya tumbuh stek diperoleh dengan cara menghitung jumlah stek yang tumbuh pada 7 mss dibandingkan dengan jumlah total stek yang ditanam. Daya tumbuh stek pada 7 mss ditampilkan dalam tabel 3.
a b c
d e f
g h i
Stek daun Stek batang Stek crown
Umur 2 mss
Umur 4 mss
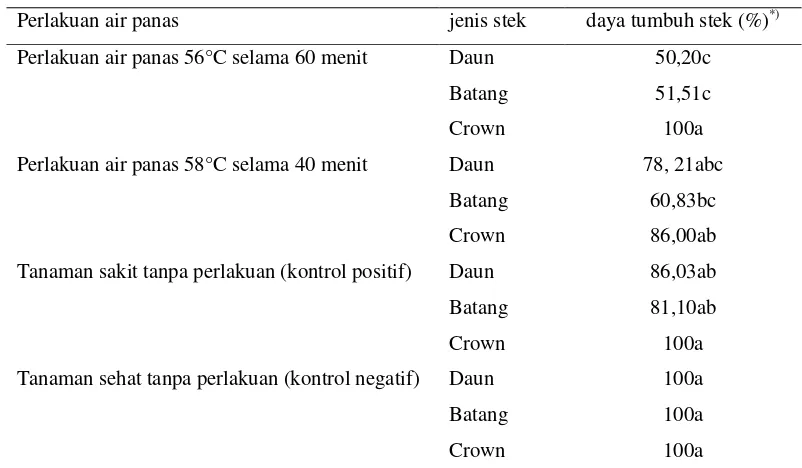
Tabel 3 Persentase daya tumbuh stek nanas berumur 7 minggu setelah semai (mss)
Perlakuan air panas jenis stek daya tumbuh stek (%)*) Perlakuan air panas 56°C selama 60 menit Daun 50,20c
Batang 51,51c
Crown 100a
Perlakuan air panas 58°C selama 40 menit Daun 78, 21abc Batang 60,83bc
*)Angka yang diikuti huruf yang sama pada kolom yang sama tidak berbeda nyata pada taraf uji 5%
(DMRT)
Perlakuan air panas 56°C selama 60 menit menyebabkan penurunan daya tumbuh stek daun dan batang. Sedangkan perlakuan air panas 58°C 40 menit tidak mengurangi viabilitas stek (Tabel 3). Dari penelitian ini diketahui bahwa perlakuan air panas dengan waktu aplikasi yang lebih panjang menghambat daya tumbuh stek, sedangkan perlakuan air panas dengan suhu lebih tinggi namun diaplikasikan dalam waktu yang singkat tidak mempengaruhi daya tumbuh dan vigor stek.
Gambar 8 Bibit nanas berumur 2 mst (a) dan 3 mst (b)
Pengaruh Perlakuan Air Panas terhadap Infektifitas PMWaV
Bibit dari stek tanaman sehat maupun tanaman sakit terlihat sehat dan tidak menunjukkan gejala penyakit layu sampai akhir pengamatan (4 minggu setelah tanam). Namun hasil deteksi PMWaV pada bibit dengan menggunakan antibodi monoklonal terhadap PMWaV-1 dan PMWaV-2 menunjukkan bahwa sebagian bibit positif terinfeksi PMWaV-1, PMWaV-2, maupun infeksi ganda PMWaV-1 dan PMWaV-2 (Tabel 4).
Antibodi monoklonal spesifik PMWaV-1 dan PMWaV-2 yang digunakan dalam pengujian TBIA menunjukkan reaksi kuat terhadap antigen PMWaV, dan tidak terdapat reaksi terhadap tanaman sehat pada blot membran. Reaksi BCIP/NBT terhadap konjugate-antigen PMWaV ditunjukkan dengan warna ungu (ditunjuk dengan tanda panah) yang terlihat jelas pada jaringan pembuluh daun tanaman yang terinfeksi PMWaV (Gambar 9 dan 10). Hasil pengujian ini menunjukkan bahwa distribusi PMWaV pada jaringan tanaman nampaknya terbatas pada jaringan pembuluh. Hasil ini mendukung laporan sebelumnya oleh Hu et al. (1997), Sether et al. (1998), dan Tryono (2006) bahwa antigen PMWaV terdeteksi hanya berada pada jaringan pembuluh pada daun muda, daun berumur sedang, juga pada akar, tetapi tidak pada daun tua.
Sinyal berupa titik berwarna ungu menunjukkan bahwa sampel daun positif terinfeksi oleh PMWaV-1 (Gambar 9) atau PMWaV-2 (Gambar 10). Sinyal ungu terlihat pada sepanjang jaringan pembuluh daun nanas pada perlakuan kontrol positif (K+), dan beberapa titik pembuluh pada sampel daun nanas dari stek yang diberi perlakuan air panas 56 ºC selama 40 menit, serta sampel daun nanas dari stek yang
diberi perlakuan air panas 58 ºC selama 60 menit (Gambar 9). Sinyal titik ungu terlihat lebih jelas jika dilakukan pengamatan dengan bantuan kaca pembesar.
Gambar 9 Membran hasil deteksi PMWaV-1 dengan metode TBIA. Daun stek kontrol positif (K+), daun stek kontrol negatif (K-), daun stek tanaman sakit yang diberi perlakuan suhu 56 ºC (H56), daun dari stek tanaman sakit yang diberi perlakuan air panas 58 ºC (H58). Sinyal berwarna ungu (ditunjuk oleh tanda panah) pada jaringan pembuluh menunjukkan bahwa sampel daun positif terinfeksi PMWaV-1.
Sinyal ungu terlihat pada sepanjang jaringan pembuluh daun nanas pada perlakuan kontrol positif (K+), dan beberapa titik pembuluh pada sampel daun nanas dari stek yang diberi perlakuan air panas 56 ºC selama 40 menit, serta tidak ada sinyal ungu pada sampel daun nanas dari stek yang diberi perlakuan air panas 58 ºC selama 60 menit (Gambar 10). Sinyal titik ungu terlihat lebih jelas jika dilakukan pengamatan dengan bantuan kaca pembesar.
Gambar 10 Membran hasil deteksi PMWaV-2 dengan metode TBIA. Daun stek kontrol positif (K+), daun stek kontrol negatif (K-), daun stek tanaman sakit yang diberi perlakuan suhu 56 ºC (H56), daun dari stek tanaman sakit yang diberi perlakuan air panas 58 ºC (H58). Sinyal berwarna ungu (ditunjuk oleh tanda panah) pada jaringan pembuluh menunjukkan bahwa sampel daun positif terinfeksi PMWaV-2.
Persentase stek terinfeksi PMWaV dihitung berdasarkan jumlah stek terinfeksi dibagi jumlah stek yang diberi perlakuan. Persentase stek terinfeksi PMWaV-1, PMWaV-2 dan infeksi ganda kedua virus ditampilkan pada tabel 4.
Tabel 4 Persentase stek terinfeksi PMWaV setelah mendapat perlakuan air panas
Perlakuan Air Panas Persentase stek terinfeksi PMWaV*)
PMWaV-1 PMWaV-2 PMWaV-1 & PMWaV-2 Suhu 56°C selama 60 menit 32,00a 20,00ab 10,00ab
Suhu 58°C selama 40 menit 21,00ab 0,00b 0,00b Kontrol positif 44,33a 66,77a 18,33a Kontrol negatif 0,00d 0,00b 0,00b
*)Angka yang diikuti huruf yang sama pada kolom yang sama tidak berbeda nyata pada taraf uji 5%
(DMRT)
Berdasarkan persentase infeksi PMWaV-1 dan PMWaV-2 pada stek dari tanaman sakit diketahui bahwa perlakuan air panas 58°C selama 40 menit pada tanaman sakit mampu menekan infeksi PMWaV-2. Sedangkan perlakuan air panas 56°C selama 60 menit pada tanaman sakit tidak berpengaruh nyata terhadap infeksi PMWaV-1 maupun PMWaV-2.
Eliminasi patogen dari bahan tanaman dengan perlakuan panas dapat dilakukan jika toleransi patogen terhadap panas lebih rendah dibandingkan toleransi bahan tanaman. Jika kedua syarat tersebut dapat terpenuhi, maka akan terdapat interval perlakuan suhu perlakuan panas yang dapat mengeliminasi patogen tanpa mengurangi viabilitas bahan tanaman. Interval suhu yang dapat mengeliminasi patogen tanpa mengurangi viabilitas bahan tanaman tersebut disebut ”treatment window” (Forsberg 2001). Dalam penelitian ini, perlakuan air panas 58 ºC selama 40 menit memenuhi persyaratan dalam ”treatment window” karena perlakuan tersebut mampu menekan infeksi PMWaV-2 pada stek tanpa mengurangi viabilitas stek tersebut.
KESIMPULAN DAN SARAN
Kesimpulan
Berdasarkan penelitian ini dapat disimpulkan bahwa:
1. Perlakuan air panas 58 °C selama 40 menit pada bahan stek nanas mampu mengeliminasi PMWaV-2 tanpa mengurangi daya tumbuh dan vigor stek nanas.
2. Perlakuan air panas dan ribavirin pada perbanyakan kultur jaringan menyebabkan terhambatnya pertumbuhan eksplan dan planlet setelah perlakuan. Sehingga pengaruh perlakuan air panas dan ribavirin dalam eliminasi PMWaV belum dapat diketahui.
Saran