FO
EKST
DAN
DORMUL
TRAK E
UJI AKT
BAK
Diajukan unt GePROGR
UNIV
LASI KR
ETANOL
TIVITAS
KTERI P
tuk Melengk elar Sarjana FUnive
HETTI
NI
RAM STU
FAKU
VERSITA
RIM YAN
L DAUN
SNYA T
ENYEBA
SKRIPS
kapi Salah Sa Farmasi pada ersitas Sumat
OLEH
PURNAM
IM 09150
UDI SAR
ULTAS FA
AS SUMA
MEDAN
2014
NG MEN
AFRIKA
TERHAD
AB JERA
SI
FO
EKST
DAN
DORMUL
TRAK E
UJI AKT
BAK
Diajukan unt GePROGR
UNIV
LASI KR
ETANOL
TIVITAS
KTERI P
tuk Melengk elar Sarjana FUnive
HETTI
NI
RAM STU
FAKU
VERSITA
RIM YAN
L DAUN
SNYA T
ENYEBA
SKRIPS
kapi Salah Sa Farmasi pada ersitas Sumat
OLEH
PURNAM
IM 09150
UDI SAR
ULTAS FA
AS SUMA
MEDAN
2014
NG MEN
AFRIKA
TERHAD
AB JERA
SI
PENGESAHAN SKRIPSI
FORMULASI KRIM YANG MENGANDUNG EKSTRAK
ETANOL DAUN AFRIKA (
Vernonia
sp.) DAN UJI
AKTIVITASNYA TERHADAP BEBERAPA BAKTERI
PENYEBAB JERAWAT
OLEH:
HETTI PURNAMA HULU NIM 091501055
Dipertahankan di Hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal: 07 Desember 2013
Pembimbing I,
Dra. Nazliniwaty, M.Si., Apt. NIP 196005111989022001
Pembimbing II,
Dra. Erly Sitompul, M.Si., Apt. NIP 195006121980032001
Panitia Penguji,
Dra. Juanita Tanuwijaya, M.Si., Apt. NIP 195111021977102001
Dra. Nazliniwaty, M.Si., Apt. NIP 196005111989022001
Dra. Anayanti Arianto, M.Si., Apt. NIP 195306251986012001
Drs. Suryanto, M.Si., Apt. NIP 196106191991031001
Medan, Januari 2014
Fakultas Farmasi
Universitas Sumatera Utara
Dekan,
Prof. Dr. Sumadio Hadisahputra, Apt.
KATA PENGANTAR
Puji dan syukur kehadirat Tuhan Yang Maha Esa yang telah
melimpahkan rahmat dan karuniaNya, sehingga penulis dapat menyelesaikan
skripsi yang berjudul “Formulasi Krim Yang Mengandung Ekstrak Etanol
Daun Afrika (Vernonia sp.) dan Uji Aktivitasnya Terhadap Beberapa Bakteri
Penyebab Jerawat”. Skripsi ini diajukan sebagai salah satu syarat untuk
memperoleh gelar sarjana Farmasi pada Fakultas Farmasi Universitas Sumatera
Utara.
Pada kesempatan ini penulis menyampaikan terima kasih yang
sebesar-besarnya kepada Ibu Dra. Nazliniwaty, M.Si., Apt., dan Dra. Erly Sitompul,
M.Si., Apt., yang telah membimbing dengan penuh kesabaran, tulus dan ikhlas
selama penelitian dan penulisan skripsi ini berlangsung. Ucapan terima kasih
juga disampaikan kepada Dekan Fakultas Farmasi Universitas Sumatera Utara,
Prof. Dr. Sumadio Hadisahputra, Apt., yang telah memberikan bantuan dan
fasilitas selama masa pendidikan. Ibu Sumaiyah, S.Si., M.Si., Apt., selaku
penasehat akademik yang memberikan bimbingan kepada penulis selama ini.
Bapak dan Ibu staf pengajar Fakultas Farmasi Universitas Sumatera Utara yang
telah mendidik penulis selama perkuliahan. Ibu Dra. Aswita Hafni Lubis,
M.Si., Apt., selaku Kepala Laboratorium Fitokimia, Dra. Erly Sitompul, M.Si.,
Apt., selaku Kepala Laboratorium Mikrobiologi dan Virologi dan Ibu Dra.
Ibu Dra. Juanita Tanuwijaya, M.Si., Apt., Ibu Dra. Nazliniwaty, M.Si., Apt.,
Ibu Dra. Anayanti Arianto, M.Si., Apt., dan Bapak Drs. Suryanto, M.Si., Apt.,
selaku dosen penguji yang memberikan masukan, kritikan, arahan, dan saran
dalam penyusunan skripsi ini.
Penulis juga tidak lupa mengucapkan terima kasih dan penghargaan
yang tulus kepada orang tua, Ayahanda Obaza Hulu dan Ibunda Sotani M.
Zalukhu, atas doa dan dukungan baik moril maupun materil, serta Hasti P.
Hulu, Ester Hulu, Winda A. Hulu, Ones P. Hulu, Marveline Hulu, Nice A.
Mendrofa, Jun P. Harefa, Shanty Hutabarat, Nulika F.S., Triputriana D.S.,
Arnes A.S., Alfades dan rekan-rekan GKB NHC atas doa, dorongan dan
semangat dalam penyelesaian Skripsi ini.
Penulis menyadari bahwa skripsi ini masih banyak kekurangannya, oleh
karena itu sangat diharapkan kritik dan saran yang bersifat membangun dari
semua pihak guna perbaikan skripsi ini. Akhir kata penulis berharap semoga
skripsi ini bermanfaat bagi ilmu pengetahuan khususnya bidang farmasi.
Medan, November 2013
Penulis,
Hetti Purnama Hulu
FORMULASI KRIM YANG MENGANDUNGEKSTRAK ETANOL DAUN AFRIKA (Vernonia sp.) DAN UJI AKTIVITASNYA TERHADAP
BEBERAPA BAKTERI PENYEBAB JERAWAT
ABSTRAK
Daun Afrika (Vernonia sp.) mengandung saponin, flavonoid, tanin dan steroid/triterpenoid yang berperan sebagai senyawa antimikroba. Ekstrak daun Afrika diformulasi menjadi sediaan krim. Sediaan krim dipilih karena kemampuannya melekat pada permukaan kulit dalam waktu yang cukup lama, dapatmelembabkan, mudah tersebar merata, mudah berpenetrasi pada kulit, mudah diusap dan mudah dicuci air. Tujuan penelitian adalah untuk mengetahui aktivitas antibakteri ekstrak daun Afrika terhadap beberapa bakteri penyebab jerawat, membuat sediaan krim antijerawat yang mengandung ekstrakdaun Afrika dan untuk mengetahui aktivitas antibakteri krim.
Metode penelitian yang dilakukan meliputi karakterisasi simplisia daun Afrika, pembuatan ekstrak daun Afrika dengan cara maserasi menggunakan pelarut etanol 80%, uji aktivitas antibakteri ekstrak, formulasi sediaan krim, evaluasi sediaan dan uji aktivitas antibakteri sediaan krimdengan metode disc diffusion. Bakteri yang digunakan adalah Propionibacterium acne dan Staphylococcus epidermidis. Formula sediaan krim ekstrak daun Afrika terdiri atas asam stearat, setil alkohol, gliserin, trietanolamin, nipagin, akuades dan ekstrak etanol daun Afrika. Krim dibuat dengan konsentrasi 6, 7, 8, 9 dan 10%.
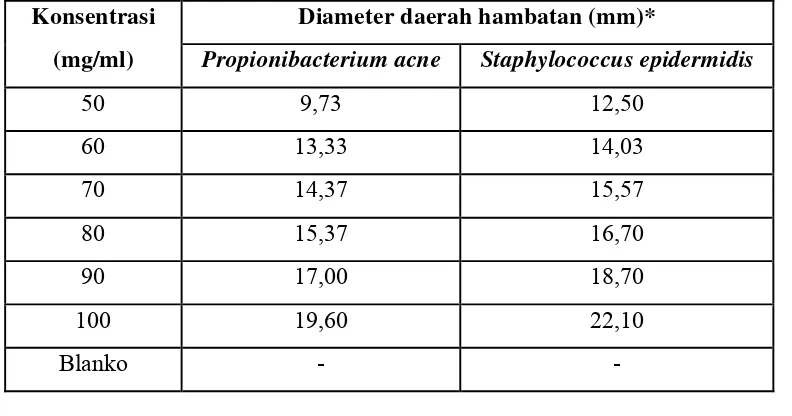
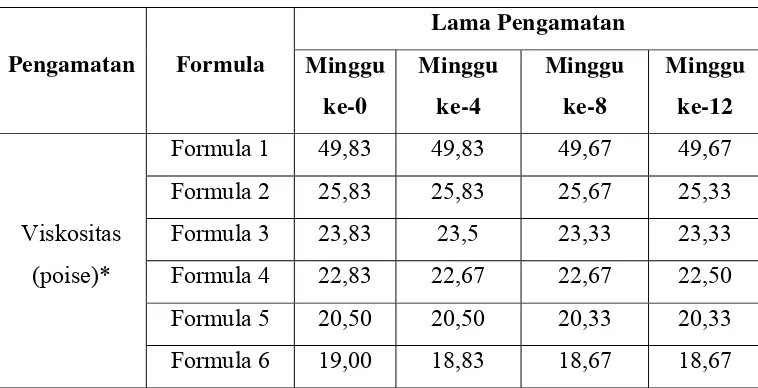
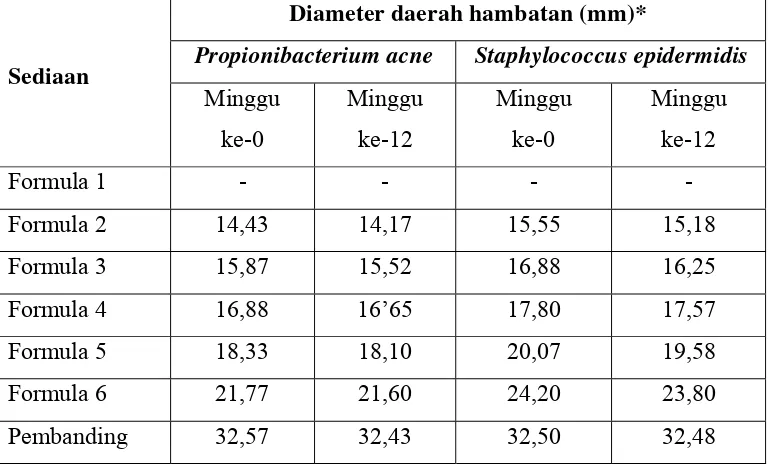
Hasil karakterisasi terhadap simplisia daun Afrika memiliki kadar air 7,99%, kadar sari larut dalam air 25,90%, kadar sari larut dalam etanol 14,89%, kadar abu total 9,75% dan kadar abu tidak larut asam 0,71%. Hasil evaluasi sediaan krim dengan konsentrasi 6, 7, 8, 9 dan 10% secara fisik stabil selama penyimpanan 12 minggu pada suhu kamar, homogen, pH dan viskositas stabil dan tidak menyebabkan iritasi. Berdasarkan hasil uji, ekstrak daun Afrika dengan konsentrasi 60 mg/ml efektif menghambat pertumbuhan bakteri Propionibacterium acne dan Staphylococcus epidermidis dan sediaan krim dengan konsentrasi 6% efektif menghambat pertumbuhan bakteri dengan diameter zona hambat rata-rata sebesar 14,43 mm untuk bakteri Propionibacterium acne dan 15,55 mm untuk bakteri Staphylococcus epidermidis. Kesimpulan dari hasil penelitian ini adalah ekstrak daun Afrika mempunyai aktivitas antibakteri terhadap Propionibacterium acne dan Staphylococcus epidermidis dan ekstrak daun afrika dapat diformulasi menjadi sediaan krim antijerawat.
FORMULATION OF CREAM CONTAINING ETHANOL EXTRACT OF AFRICAN LEAVES (Vernonia sp.) and ACTIVITIES TEST
AGAINST SOME BACTERIA CAUSE ACNE
ABSTRACT
African leaves (Vernonia sp.) contain saponins, flavonoids, tannins and steroids/triterpenoids that act as antimicroba compound. Extract of African leaves was formulated into cream that selected because of its ability to stick on surface area of skin in a long time, moisten, easy to spread evenly, easily penetrate the skin, easily rubbed and easily washed with water. The research purposes wereto determine antibacterial activity against some bacteria cause acne, to make the anti acne cream containing extract of African leaves and to determine antibacterial activity.
The methods of research conducted were characterization of simplicia African leaves, making extract of African leaves by maceration using the 80% ethanol solvent, activities test of antibacterial extract, formulation of cream, evaluation of cream and antibacterial activities test of the cream by disc diffusion method. The bacteria that used were Propionibacterium acne and Staphylococcus epidermidis. The formula of cream consisting of stearic acid, cetyl alcohol, glyserin, triethanolamin, nipagin, aquades and extract of African. The cream was made with concentration 6, 7, 8, 9 and 10%.
The characterization results of African leaves extract had 7.99% water content, 25.90% levels of soluble extract in water, 14.89% levels of soluble extract in ethanol, 9.75% of total ash content and 0.71% acid insoluble ash content.The evaluation of cream results at concentration of 6, 7, 8, 9 and 10% were physically stable during storage for 12 weeks at room temperature, homogeneous, pH and viscosity were stable and not cause irritation.Based on test results, extract of African leaves at concentration 60 mg/ml effective to inhibit the growth of Propionibacterium acne and Staphylococcus epidermidis and cream at concentration 6% effective to inhibit the growth of bacteria with the diameters of inhibitory zone average are 14,43 mm against Propionibacterium acne and 15,55 mm against Staphylococcus epidermidis. The conclusions of this research are extract of African leaves has antibacterial activity against Propionibacterium acne and Staphylococcus epidermidis and extract of African leaves can formulated to be anti acne cream.
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN PENGESAHAN ... ii
PENGESAHAN SKRIPSI ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... xiv
DAFTAR LAMPIRAN ... xv
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian ... 4
1.5 Manfaat Penelitian ... 4
BAB II TINJAUAN PUSTAKA ... 5
2.1 Uraian Tumbuhan ... 5
2.2 Uraian Kulit ... 7
2.2.1 Struktur kulit ... 7
2.2.2 Fungsi biologik kulit ... 8
2.3 Uraian Jerawat ... 10
2.3.1 Penyebab terjadinya jerawat ... 10
2.3.2 Tahap terjadinya jerawat ... 12
2.3.3 Penanggulangan jerawat ... 13
2.4 Uji Aktivitas Antibakteri ... 14
2.5 Uraian Bakteri ... 15
2.5.1 Bakteri Propionibacterium acne ... 15
2.5.2 Bakteri Staphylococcus epidermidis ... 16
2.6 Simplisia ... 16
2.7 Ekstraksi ... 17
2.8 Krim (Cremoris) ... 19
2.8.1 Komponen utama dalam sediaan krim ... 19
2.8.1.1Sabun trietanolamin-stearat ... 19
2.8.1.2Metil paraben ... 20
BAB IIIMETODE PENELITIAN ... 22
3.1 Tempat Pelaksanaan ... 22
3.2 Metode Penelitian ... 22
3.3 Alat ... 22
3.4 Bahan ... 23
3.5 Penyiapan Sampel ... 23
3.5.1 Pengambilan bahan ... 24
3.5.2 Identifikasi tumbuhan ... 24
3.6 Pembuatan Pereaksi ... 24
3.6.1 Pereaksi asam klorida 2 N ... 24
3.6.2 Pereaksi asam sulfat 2 N ... 24
3.6.3 Pereaksi besi (III) klorida 1% ... 25
3.6.4 Pereaksi Bouchardat ... 25
3.6.5 Pereaksi Dragendorf ... 25
3.6.6 Pereaksi Liebermann-Burchard ... 25
3.6.7 Pereaksi Meyer ... 25
3.6.8 Pereaksi Molish ... 25
3.6.9 Pereaksi natrium hidroksida 2 N ... 26
3.6.10 Pereaksi timbal (II) asetat 0,4 M ... 26
3.7 Pemeriksaan Karakteristik Simplisia ... 26
3.7.1 Penetapan kadar air ... 26
3.7.2 Penetapan kadar sari larut dalam air ... 27
3.7.3 Penetapan kadar sari larut dalam etanol ... 27
3.7.4 Penetapan kadar abu total ... 28
3.7.5 Penetapan kadar abu tidak larut dalam asam .... 28
3.8 Skrining Fitokimia Simplisia ... 28
3.8.1 Pemeriksaan alkaloid ... 29
3.8.2 Pemeriksaan glikosida ... 29
3.8.3 Pemeriksaan saponin ... 30
3.8.4 Pemeriksaan flavonoid ... 30
3.8.6 Pemeriksaan tannin ... 31
3.8.7 Pemeriksaan steroid/triterpenoid ... 31
3.9 Pembuatan Ekstrak Etanol Daun Afrika ... 31
3.10 Skrining Fitokimia Ekstrak Etanol Daun Afrika ... 32
3.11 Pembuatan Media Untuk Bakteri Uji ... 32
3.11.1 Nutrien agar ... 32
3.11.2 Nutrien broth ... 32
3.11.3 Pembuatan agar miring ... 33
3.12 Penyiapan Inokulum ... 33
3.12.1 Pembuatan stok kultur bakteri uji ... 33
3.12.2 Pembuatan inokulum bakteri uji ... 33
3.13 Sterilisasi Alat dan Bahan ... 34
3.14 Pembuatan Larutan Uji Ekstrak Etanol Daun Afrika ... 34
3.15 Pengujian Aktivitas Antibakteri Terhadap Ekstrak EtanolDaun Afrika ... 34
3.15.1 Bakteri Propionibacterium acne ... 35
3.15.2 Bakteri Staphylococcus epidermidis ... 35
3.16 Pembuatan Sediaan Krim ... 35
3.16.1 Formulasi dasar krim ... 35
3.16.2 Formulasi sediaan krim ... 37
3.17 Evaluasi Terhadap Sediaan ... 38
3.17.1 Pemeriksaan homogenitas ... 38
3.17.2 Pemeriksaan tipe emulsi sediaan ... 38
3.17.4 Pengukuran viskositas sediaan ... 39
3.17.5 Pemeriksaan sediaan ... 39
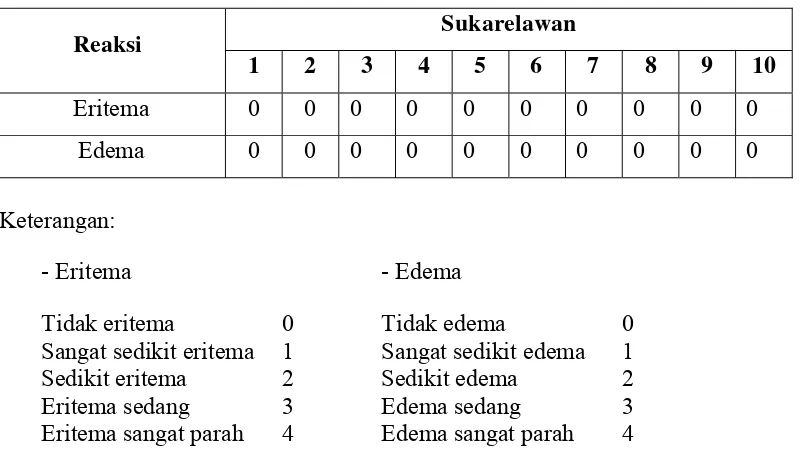
3.17.6 Uji iritasi terhadap sukarelawan ... 39
3.17.7 Uji mikrobiologi sediaan ... 41
3.17.7.1Pembuatan larutan uji krim ... 41
3.17.7.2Bakteri Propionibacterium acne ... 41
3.17.7.3Bakteri Staphylococcus epidermidis ... 41
BAB IV HASIL DAN PEMBAHASAN ... 43
4.1 Hasil Identifikasi Tumbuhan ... 43
4.2 Hasil Karakterisasi Simplisia Daun Afrika ... 43
4.3 Hasil Skrining Fitokimia Simplisia dan Ekstrak Etanol Daun Afrika ... 46
4.4 Hasil Ekstraksi Serbuk Simplisia Daun Afrika ... 47
4.5 Hasil Uji Aktivitas Antibakteri Ekstrak Etanol Daun Afrika ... 48
4.6 Hasil Evaluasi Terhadap Sediaan ... 49
4.6.1 Hasil pemeriksaan homogenitas sediaan ... 49
4.6.2 Hasil penentuan tipe emulsi sediaan ... 50
4.6.3 Hasil pengukuran pH sediaan ... 51
4.6.4 Hasil pengukuran viskositas sediaan ... 52
4.6.5 Hasil pemeriksaan stabilitas ... 53
4.6.6 Hasil uji iritasi terhadap sukarelawan ... 54
BAB V KESIMPULAN DAN SARAN ... 57
5.1 Kesimpulan ... 57
5.2 Saran ... 58
DAFTAR PUSTAKA ... 59
DAFTAR TABEL
Halaman
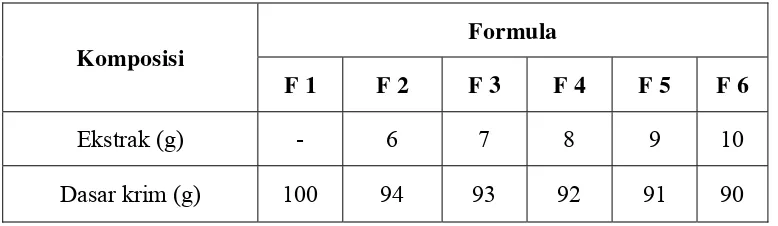
Tabel 3.1 Formula sediaan krim ekstrak etanol daun Afrika ... 37
Tabel 4.1 Data karakterisasi simplisia daun Afrika ... 44
Tabel 4.2 Hasil skrining fitokimia simplisia dan ekstrak etanol
daun Afrika ... 46
Tabel 4.3 Hasil uji aktivitas antibakteri ekstrak etanol daun Afrika .... 48
Tabel 4.4 Data penentuan tipe emulsi sediaan krim ekstrak etanol
daun Afrika ... 50
Tabel 4.5 Data pengukuran pH sediaan krim ekstrak etanoldaun
Afrika ... 51
Tabel 4.6 Data pengukuran viskositas sediaan krim ekstrak etanol
DaunAfrika ... 52
Tabel 4.7 Data pemeriksaan stabilitas sediaan krim ekstrak etanol
daun Afrika ... 53
Tabel 4.8 Data uji iritasi sediaan krim ekstrak etanol daun Afrika ... 54
Tabel 4.9 Hasil uji aktivitas antibakteri krim ekstrak etanol daun
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Hasil identifikasi tumbuhan ... 62
Lampiran 2. Gambar tumbuhan daun Afrika dan daun Afrika ... 63
Lampiran 3. Simplisia daun Afrika kering dan serbuk simplisia
daun Afrika ... 64
Lampiran 4. Bagan kerja penelitian ... 65
Lampiran 5. Perhitungan penetapan kadar air simplisia daun
Afrika ... 67
Lampiran 6. Perhitungan penetapan kadar sari larut air simplisia
daun Afrika ... 68
Lampiran 7. Perhitungan penetapan kadar sari larut etanol
simplisia daun Afrika ... 69
Lampiran 8. Perhitungan penetapan kadar abu total simplisia
daun Afrika ... 70
Lampiran 9. Perhitungan penetapan kadar abu tidak larut asam
simplisia daun Afrika ... 71
Lampiran10. Gambar hasil uji aktivitas antibakteri ekstrak
terhadap bakteri Propionibacterium acne ... 72
Lampiran 11. Gambar hasil uji aktivitas antibakteri ekstrak
terhadap bakteri Staphylococcus epidermidis ... 73
Lampiran 12. Hasil pengukuran diameter daerah hambatan oleh
ekstrak etanol daun Afrika... 74
Lampiran 13. Gambar sediaan krim ekstrak etanol daun Afrika ... 75
Lampiran 14. Gambar hasil pemeriksaan homogenitas krim
ekstrak etanol daun Afrika ... 76
Lampiran 15. Gambar hasil penentuan tipe emulsi krim ekstrak
Lampiran 16. Hasil pengukuran viskositas krim ekstrak etanol
daun Afrika ... 78
Lampiran 17. Gambar hasil uji aktivitas antibakteri krim terhadap
bakteri Propionibacterium acne minggu ke-0 ... 79
Lampiran 18. Gambar hasil uji aktivitas antibakteri krim terhadap
bakteri Staphylococcus epidermidis minggu ke-0 ... 80
Lampiran 19. Gambar hasil uji aktivitas antibakteri krim terhadap
bakteri Propionibacterium acne minggu ke-12 ... 81
Lampiran 20. Gambar hasil uji aktivitas antibakteri krim terhadap
bakteri Staphylococcus epidermidisminggu ke-12 ... 82
Lampiran 21. Hasil pengukuran diameter daerah oleh krim
ekstrak etanol daun Afrika minggu ke-0 ... 83
Lampiran 22. Hasil pengukuran diameter daerah oleh krim
ekstrak etanol daun Afrika minggu ke-12 ... 84
Lampiran 23. Perbandingan hasil pengukuran diameter daerah hambatanekstrak etanol daun Afrika dengan
FORMULASI KRIM YANG MENGANDUNGEKSTRAK ETANOL DAUN AFRIKA (Vernonia sp.) DAN UJI AKTIVITASNYA TERHADAP
BEBERAPA BAKTERI PENYEBAB JERAWAT
ABSTRAK
Daun Afrika (Vernonia sp.) mengandung saponin, flavonoid, tanin dan steroid/triterpenoid yang berperan sebagai senyawa antimikroba. Ekstrak daun Afrika diformulasi menjadi sediaan krim. Sediaan krim dipilih karena kemampuannya melekat pada permukaan kulit dalam waktu yang cukup lama, dapatmelembabkan, mudah tersebar merata, mudah berpenetrasi pada kulit, mudah diusap dan mudah dicuci air. Tujuan penelitian adalah untuk mengetahui aktivitas antibakteri ekstrak daun Afrika terhadap beberapa bakteri penyebab jerawat, membuat sediaan krim antijerawat yang mengandung ekstrakdaun Afrika dan untuk mengetahui aktivitas antibakteri krim.
Metode penelitian yang dilakukan meliputi karakterisasi simplisia daun Afrika, pembuatan ekstrak daun Afrika dengan cara maserasi menggunakan pelarut etanol 80%, uji aktivitas antibakteri ekstrak, formulasi sediaan krim, evaluasi sediaan dan uji aktivitas antibakteri sediaan krimdengan metode disc diffusion. Bakteri yang digunakan adalah Propionibacterium acne dan Staphylococcus epidermidis. Formula sediaan krim ekstrak daun Afrika terdiri atas asam stearat, setil alkohol, gliserin, trietanolamin, nipagin, akuades dan ekstrak etanol daun Afrika. Krim dibuat dengan konsentrasi 6, 7, 8, 9 dan 10%.
Hasil karakterisasi terhadap simplisia daun Afrika memiliki kadar air 7,99%, kadar sari larut dalam air 25,90%, kadar sari larut dalam etanol 14,89%, kadar abu total 9,75% dan kadar abu tidak larut asam 0,71%. Hasil evaluasi sediaan krim dengan konsentrasi 6, 7, 8, 9 dan 10% secara fisik stabil selama penyimpanan 12 minggu pada suhu kamar, homogen, pH dan viskositas stabil dan tidak menyebabkan iritasi. Berdasarkan hasil uji, ekstrak daun Afrika dengan konsentrasi 60 mg/ml efektif menghambat pertumbuhan bakteri Propionibacterium acne dan Staphylococcus epidermidis dan sediaan krim dengan konsentrasi 6% efektif menghambat pertumbuhan bakteri dengan diameter zona hambat rata-rata sebesar 14,43 mm untuk bakteri Propionibacterium acne dan 15,55 mm untuk bakteri Staphylococcus epidermidis. Kesimpulan dari hasil penelitian ini adalah ekstrak daun Afrika mempunyai aktivitas antibakteri terhadap Propionibacterium acne dan Staphylococcus epidermidis dan ekstrak daun afrika dapat diformulasi menjadi sediaan krim antijerawat.
FORMULATION OF CREAM CONTAINING ETHANOL EXTRACT OF AFRICAN LEAVES (Vernonia sp.) and ACTIVITIES TEST
AGAINST SOME BACTERIA CAUSE ACNE
ABSTRACT
African leaves (Vernonia sp.) contain saponins, flavonoids, tannins and steroids/triterpenoids that act as antimicroba compound. Extract of African leaves was formulated into cream that selected because of its ability to stick on surface area of skin in a long time, moisten, easy to spread evenly, easily penetrate the skin, easily rubbed and easily washed with water. The research purposes wereto determine antibacterial activity against some bacteria cause acne, to make the anti acne cream containing extract of African leaves and to determine antibacterial activity.
The methods of research conducted were characterization of simplicia African leaves, making extract of African leaves by maceration using the 80% ethanol solvent, activities test of antibacterial extract, formulation of cream, evaluation of cream and antibacterial activities test of the cream by disc diffusion method. The bacteria that used were Propionibacterium acne and Staphylococcus epidermidis. The formula of cream consisting of stearic acid, cetyl alcohol, glyserin, triethanolamin, nipagin, aquades and extract of African. The cream was made with concentration 6, 7, 8, 9 and 10%.
The characterization results of African leaves extract had 7.99% water content, 25.90% levels of soluble extract in water, 14.89% levels of soluble extract in ethanol, 9.75% of total ash content and 0.71% acid insoluble ash content.The evaluation of cream results at concentration of 6, 7, 8, 9 and 10% were physically stable during storage for 12 weeks at room temperature, homogeneous, pH and viscosity were stable and not cause irritation.Based on test results, extract of African leaves at concentration 60 mg/ml effective to inhibit the growth of Propionibacterium acne and Staphylococcus epidermidis and cream at concentration 6% effective to inhibit the growth of bacteria with the diameters of inhibitory zone average are 14,43 mm against Propionibacterium acne and 15,55 mm against Staphylococcus epidermidis. The conclusions of this research are extract of African leaves has antibacterial activity against Propionibacterium acne and Staphylococcus epidermidis and extract of African leaves can formulated to be anti acne cream.
BAB I
PENDAHULUAN
1.1 Latar Belakang
Jerawat adalah suatu proses peradangan kronik kelenjar-kelenjar
pilosebasea. Keadaan ini sering dialami oleh remaja dan dewasa muda yang
akan menghilang dengan sendirinya pada usia sekitar 20-30 tahun, ada juga
orang setengah baya yang mengalami jerawat. Jerawat biasanya berkaitan
dengan tingginya sekresi sebum (Muttaqin dan Sari, 2011).
Propionibacterium acne dan Staphylococcus epidermidis adalah
organisme utama yang pada umumnya memberi kontribusi terhadap terjadinya
jerawat. Propionibacterium acnes adalah termasuk gram-positif berbentuk
batang, tidak berspora, sedangkan Staphylococcus epidermidis sel gram positif
berbentuk bulat biasanya tersusun dalam bentuk kelompok-kelompok yang
tidak teratur seperti anggur (Pelczar dan Chan, 1998).
Pengobatan jerawat di klinik kulit biasanya menggunakan antibiotik,
benzoil peroksida dan retinoid, obat ini memiliki efek samping antara lain
iritasi (Wasitaatmaja, 1997). Oleh karena itu dicari alternatif dalam pengobatan
jerawat dengan menggunakan bahan-bahan alam yang berkhasiat sebagai
antibakteri yaitu daun Afrika. Daun Afrika banyak tumbuh di benua Afrika
bagian barat terutama di Nigeria dan negara yang beriklim tropis salah satunya
adalah Indonesia (Ibrahim, et al., 2004; Anonim, 2010). Daun Afrika memang
nama daun pahit di pulau Jawa, sedangkan di Padang tanaman ini dikenal
dengan nama daun insulin. Pada tahun 2009 di Bogor, telah dilakukan
pembudidayaan tanaman daun Afrika. Tanaman ini mudah tumbuh pada daerah
yang curah hujan cukup tinggi (Anonim, 2010).
Daun Afrika mengandung flavonoid, tanin, saponin dan terpenoid yang
mampu membunuh parasit penyebab schistosomiasis, malaria, leishmaniasis,
antiamoeba, antitumor dan antimikroba (Ohigashi, et al., 1994). Penelitian
terhadap aktivitas antimikroba ekstrak daun Afrika yang dilakukan oleh
Sharma dan Smita (2010) menunjukkan hasil yang positif terhadap bakteri
Streptococcus mutans, Staphylococcus aureus dan Lactobacillus acidophilus.
Ekstrak daun Afrika memiliki aktivitas antibakteri yang mampu membunuh
bakteri gram positf dan gram negatif.
Penggunaan ekstrak daun Afrika secara langsung pada kulit tidak
praktis, oleh karena itu perlu dibuat sediaan yang cocok agar mudah
digunakan. Salah satu alternatif sediaan yang dapat digunakan untuk
pengobatan jerawat adalah sediaan topikal misalnya krim. Sifat umum sediaan
krim ialah mampu melekat pada permukaan tempat pemakaian dalam waktu
yang cukup lama sebelum sediaan ini dicuci atau dihilangkan. Krim dapat
melembapkan dan mudah tersebar merata, mudah berpenetrasi pada kulit,
mudah diusap, mudah dicuci air (Anwar, 2012). Berdasarkan penjelasan di
atas, maka dibuat formula ekstrak etanol daun Afrika dalam bentuk sediaan
krim untuk pengobatan jerawat. Sediaan krim dipilih karena mempunyai
daya menyerap yang baik dan memberikan rasa dingin pada kulit (Ditjen POM,
1995). Pengujian aktivitas antibakteri dilakukan terhadap Staphylococcus
epidermidis dan Propionibacterium acne.
1.2 Perumusan Masalah
Berdasarkan latar belakang di atas, maka perumusan masalah pada
penelitian ini adalah:
1. Apakah ekstrak etanol daun Afrika (Vernonia sp.) mempunyai aktivitas
antibakteri terhadap bakteri Propionibacterium acne dan Staphylococcus
epidermidis?
2. Apakah ekstrak etanol daun Afrika dapat diformulasi dalam bentuk sediaan
krim?
3. Bagaimana aktivitas antibakteri sediaan krim dari ekstrak etanol daun
Afrika terhadap bakteri penyebab jerawat?
1.3 Hipotesis
Berdasarkan perumusan masalah di atas, maka hipotesis pada penelitian
ini adalah:
1. Ekstrak etanol daun Afrika mempunyai aktivitas antibakteri terhadap
bakteri Propionibacterium acne dan Staphylococcus epidermidis.
2. Ekstrak etanol daun Afrika dapat diformulasi dalam bentuk sediaan krim.
3. Ekstrak etanol daun Afrika mempunyai aktivitas sebagai antibakteri
1.4 Tujuan Penelitian
Adapun tujuan dari penelitian ini adalah untuk:
1. Mengetahui aktivitas antibakteri dari ekstrak daun Afrika terhadap bakteri
Propionibacterium acne dan Staphylococcus epidermidis.
2. Memformulasi sediaan krim antijerawat yang mengandung ekstrak etanol
daun Afrika.
3. Mengetahui bagaimana aktivitas antibakteri sediaan krim dari ekstrak
etanol daun Afrika terhadap bakteri penyebab jerawat.
1.5 Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan informasi ilmiah
tentang efek antijerawat dari ekstrak etanol daun Afrika terhadap bakteri
Staphylococcus epidermidis dan Propionibacterium acne yang diformulasikan
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan
Daun Afrika banyak tumbuh di benua Afrika bagian barat terutama di
Nigeria dan negara yang beriklim tropis salah satunya adalah Indonesia
(Ibrahim, et al., 2004; Anonim, 2010). Daun Afrika memiliki nama lain di
negara-negara lain seperti bitter leaf (daun pahit) di Nigeria, Shiwaka di
Nigeria bagian Utara, Grawa di Amharic, Ewuro di Yoruba, Etidot di Ibibio,
Onugbu di Igbo, Ityuna di Tiv, Oriwo di Edo, Chusar-doki di Hausa Shiwaka
(Ijeh dan Ejike, 2010), Nan Fei Shu di Cina, dan daun Kupu-kupu di Malaysia
(Anonim, 2010). Daun Afrika juga memiliki nama daerah tersendiri di negara
Indonesia seperti daun pahit di pulau Jawa dan daun insulin di kota Padang
(Anonim, 2010).
Berikut adalah sistematika tumbuhan:
Kingdom : Plantae
Divisi : Spermatophyta
Subdivisi : Angiospermae
Kelas : Dicotyledoneae
Bangsa : Asterales
Suku : Asteraceae atau Compositae
Marga : Vernonia
Daun Afrika mempunyai ciri-ciri morfologi sebagai berikut: Batang
tegak, tinggi 1-3m, bulat, berkayu, berwarna coklat, daun majemuk, anak daun
berhadapan, panjang 15-25 cm, lebar 5-8 cm, tebal 7-10 mm, berbentuk seperti
ujung tombak, tepi bergerigi, ujung runcing, pangkal membulat, pertulangan
menyirip, berwarna hijau tua; akar tunggang, berwarna coklat kotor (Ibrahim,
et al., 2004; Ijeh, 2010).
Hasil penelitian (Ijeh, 2010) menunjukkan bahwa tanaman daun
Afrika banyak mengandung nutrisi dan senyawa kimia, antara lain adalah
sebagai berikut: protein 19,2%, serat 19,2%, karbohidrat 68,4%, lemak 4,7%,
asam askorbat 166,5 mg/100 g, karotenoid 30 mg/100 g, kalsium 0,97 g/ 100 g,
besi 7,5 mg/100 g, fosfor, kalium, sulfur, natrium, mangan, tembaga, zink,
magnesium dan selenium. Senyawa kimia yang terkandung dalam daun Afrika
antara lain: saponin (vernoniosida dan steroid saponin), seskuiterpen lakton
(vernolida, vernodalol, vernolepin, vernodalin, dan vernomygdin), flavonoid,
koumarin, asam fenolat, lignan, xanton, terpen, peptida, dan luteolin.
Daun Afrika mengandung flavonoid, tannin, saponin dan terpenoid
yang mampu membunuh parasit penyebab schistosomiasis, malaria,
leishmaniasis, antiamoeba, antitumor dan antimikroba (Ohigashi, et al., 1994).
Penelitian terhadap aktivitas antimikroba ekstrak daun Afrika yang dilakukan
oleh Sharma dan Smita (2010) menunjukkan hasil yang positif terhadap bakteri
Streptococcus mutans, Staphylococcus aureus dan Lactobacillus acidophilus.
Ekstrak daun Afrika memiliki aktivitas antibakteri yang mampu membunuh
Daun Afrika telah banyak digunakan untuk obat-obatan dan telah
banyak penelitian yang telah dilakukan untuk tumbuhan tersebut seperti
antimutagenik (Ginting, 2012), antikanker, antidiabetes (Setiawan, 2012) dan
analgetik (Njan, et al., 2008).
2.2 Uraian Kulit
Kulit merupakan “selimut” yang menutupi permukaan tubuh dan
memiliki fungsi utama sebagai pelindung dari berbagai macam gangguan dan
rangsangan luar. Fungsi perlindungan ini terjadi melalui sejumlah mekanisme
biologis, seperti pembentukan lapisan tanduk secara terus-menerus, respirasi,
pengaturan suhu tubuh, produksi sebum dan keringat, pembentukan pigmen
melanin untuk melindungi kulit dari bahaya sinar ultraviolet matahari, sebagai
peraba dan perasa, serta pertahanan terhadap tekanan dan infeksi dari luar
(Tranggono dan Latifah, 2007).
2.2.1 Struktur kulit
Struktur kulit terdiri dari tiga lapisan utama, yaitu : Lapisan epidermis,
lapisan dermis dan lapisan hypodermis (Wasitaatmadja, 1997).
1. Lapisan epidermis
Epidermis merupakan bagian kulit paling luar yang paling menarik
untuk diperhatikan dalam perawatan kulit, karena kosmetik dipakai pada
bagian epidermis. Ketebalan epidermis berbeda-beda pada berbagai bagian
tubuh, yang paling tebal berukuran 1 milimeter misalnya pada telapak tangan
kelopak mata, pipi, dahi dan perut. Sel-sel epidermis disebut keratinosit.
Epidermis melekat erat pada dermis karena secara fungsional epidermis
memperoleh zat-zat makanan dan cairan antar sel dari plasma yang merembes
melalui dinding-dinding kapiler dermis ke dalam epidermis kulit. Lapisan
epidermis terdiri atas 5 lapisan: stratum korneum (lapisan tanduk), stratum
lusidum (lapisan jernih), stratum granulosum (lapisan butir), stratum spinosum
(lapisan taju), dan stratum basalis (lapisan benih) (Wasitaatmadja, 1997).
2. Lapisan dermis
Lapisan dermis ini jauh lebih tebal daripada epidermis dan tersusun
atas jaringan fibrosa dan jaringan ikat yang elastis. Lapisan ini terdiri atas: a.
Pars papilaris, yaitu bagian yang menonjol ke dalam epidermis berisi ujung
serabut saraf dan pembuluh darah; b. Pars retikularis, yaitu bagian bawah
dermis yang berhubungan dengan lapisan hypodermis yang terdiri atas serabut
kolagen. Serat-serat kolagen ini disebut juga jaringan penunjang, karena
fungsinya dalam membentuk jaringan-jaringan kulit yang menjaga kekeringan
dan kelenturan kulit (Wasitaatmadja, 1997).
3. Lapisan hipodermis
Lapisan ini terutama mengandung jaringan lemak, pembuluh darah
dan limfe, saraf-saraf yang berjalan sejajar dengan permukaan kulit.
Cabang-cabang dari pembuluh-pembuluh dan saraf-saraf menuju lapisan kulit jangat.
Jaringan ikat bawah kulit berfungsi sebagai bantalan atau penyangga bagi
organ-organ tubuh bagian dalam, dan sebagai cadangan makanan
2.2.2 Fungsi biologik kulit
1. Proteksi
Serabut elastis yang terdapat pada dermis serta jaringan lemak
subkutan berfungsi mencegah trauma mekanik langsung terhadap interior
tubuh. Lapisan tanduk dan mantel lemak kulit menjaga kadar air tubuh dengan
cara mencegah masuknya air dari luar tubuh dan mencegah penguapan air,
selain itu juga berfungsi sebagai barrier terhadap racun dari luar. Mantel asam
kulit dapat mencegah pertumbuhan bakteri di kulit.
2. Thermoregulasi
Kulit mengatur temperatur tubuh melalui mekanisme dilatasi dan
konstriksi pembuluh kapiler dan melalui perspirasi, yang keduanya dipengaruhi
saraf otonom. Pusat pengatur temperatur tubuh di hipotalamus. Pada saat
temperatur badan menurun terjadi vasokonstriksi, sedangkan pada saat
temperatur badan meningkat terjadi vasodilatasi untuk meningkatkan
pembuangan panas.
3. Persepsi sensoris
Kulit sangat sensitif terhadap rangsangan dari luar berupa tekanan,
raba, suhu dan nyeri. Rangsangan dari luar diterima oleh reseptor-reseptor
tersebut dan diteruskan ke sistem saraf pusat selanjutnya diinterpretasi oleh
4. Absorbsi
Beberapa bahan dapat diabsorbsi kulit masuk ke dalam tubuh melalui
dua jalur yaitu melalui epidermis dan melalui kelenjar sebasea dari folikel
rambut (Tranggono dan Latifah, 2007).
2.2.3 Absorbsi obat melalui kulit
Tujuan umum pengunaan obat topikal pada terapi adalah untuk
menghasilkan efek terapetik pada tempat-tempat spesifik di jaringan epidermis.
Daerah yang terkena, umumnya epidermis dan dermis, sedangkan sediaan
topikal tertentu seperti pelembab dan antimikroba bekerja dipermukaan kulit
saja (Lachman, dkk., 1994).
Beberapa cara penetrasi obat yang mungkin ke dalam kulit menurut
Tranggono dan Latifah (2007), yaitu: lewat antara sel-sel stratum korneum
(interselular), menembus sel-sel stratum korneum (transelular), melalui
kelenjar keringat, melalui kelenjar sebasea dan melalui dinding saluran folikel
rambut.
2.3 Uraian Jerawat
Jerawat merupakan penyakit peradangan yang terjadi akibat
penyumbatan pada pilosebasea yang ditandai dengan adanya komedo, papul,
postul, nodus dan kista pada daerah wajah, leher, lengan atas, dada dan
punggung. Peradangan dipicu oleh bakteri Propionibacterium acne,
Staphylococcus epidermidis dan Staphylococcus aureus (Mitsui, 1997;
2.3.1 Penyebab terjadinya jerawat
1. Hormonal
Sekresi kelenjar sebaseus yang hiperaktif dipacu oleh pembentukan
hormon testoteron (androgen) yang berlebih, sehingga pada usia pubertas akan
banyak timbul jerawat pada wajah, dada, punggung, sedangkan pada wanita
selain hormon androgen, produksi lipida dari kelenjar sebaseus dipacu oleh
hormon luteinizing yang meningkat saat menjelang menstruasi (Mitsui, 1997).
2. Makanan
Menurut penelitian yang dilakukan oleh sebuah institusi kecantikan
kulit di Amerika Serikat (Academy of Dermatology) mengatakan bahwa
jerawat tidak disebabkan oleh makanan. Tidak ada makanan yang secara
signifikan dapat menimbulkan jerawat, tetapi ternyata sebuah hasil studi kasus
yang terbaru, membuktikan hal yang bertolak belakang. Para pakar peneliti di
Colorado State University Department of Health and Exercise menemukan
bahwa makanan yang mengandung kadar gula dan kadar karbohidrat yang
tinggi memiliki pengaruh yang cukup besar dalam menimbulkan jerawat.
Secara ilmiah dapat dibuktikan bahwa mengkonsumsi terlalu banyak gula
dapat meningkatkan kadar insulin dalam darah, dimana hal tersebut memicu
produksi hormone androgen yang membuat kulit jadi berminyak dan kadar
minyak yang tinggi dalam kulit merupakan pemicu paling besar terhadap
3. Kosmetik
Penggunaan kosmetika yang melekat pada kulit dan menutupi
pori-pori, jika tidak segera dibersihkan akan menyumbat saluran kelenjar palit dan
menimbulkan jerawat yang disebut komedo. Kosmetik yang paling umum
menjadi penyebab timbulnya jerawat yaitu kosmetik pelembab yang langsung
menempel pada kulit.
4.Infeksi bakteri
Propionibacterium acnes (Corynebacterium acnes) dan Staphylococcus
epidermidis biasanya ditemukan pada lesi-lesi akne. Berbagai strain
Propionibacterium acnes dan Staphylococcus epidermidis dapat menghidrolis
trigliserida menjadi asam lemak bebas dan gliserol, asam lemak bebas tersebut
memungkinkan terjadinya lesi komedo (Mitsui, 1997).
2.3.2 Tahap terjadinya jerawat
Pada kulit yang semula dalam kondisi normal, sering kali terjadi
penumpukan kotoran dan sel kulit mati karena kurangnya perawatan dan
pemeliharaan, khususnya pada kulit yang memiliki tingkat reproduksi minyak
yang tinggi. Akibatnya saluran kandung rambut (folikel) menjadi tersumbat.
Sel kulit mati dan kotoran yang menumpuk tersebut kemudian terkena bakteri
acne, maka timbulah jerawat. Dalam waktu tertentu, jerawat yang tidak diobati
akan mengalami pembengkakan (membesar dan berwarna kemerahan), disebut
papule.
Pradangan semakin parah bila sel darah putih mulai naik ke
pastules. Jerawat radang terjadi akibat folikel yang ada di dalam dermis
mengembang karena berisi lemak padat, kemudian pecah, menyebabkan
serbuan sel darah putih ke area folikel sebasea, sehingga terjadilah reaksi
radang. Peradangan akan semakin parah jika kuman dari luar ikut masuk ke
dalam jerawat akibat perlakuan yang salah seperti dipijat dengan kuku atau
benda lain yang tidak steril. Jerawat radang mempunyai ciri berwarna merah,
cepat membesar, berisi nanah dan terasa nyeri. Bila Cyst tidak terawat, maka
jaringan kolagen akan mengalami kerusakan sampai pada lapisan dermis,
sehingga kulit/wajah menjadi bopeng (Scar) (Mitsui, 1997).
2.3.3 Penanggulangan jerawat
Usaha pengobatan jerawat menurut Wasitaatmadja (1997) dapat
dilakukan dengan 3 cara:
1. Pengobatan topikal
Prinsip pengobatan topikal adalah mencegah pembentukan komedo
(jerawat ringan), ditujukan untuk mengatasi menekan peradangan dan
kolonisasi bakteri, serta penyembuhan lesi jerawat. Misalnya dengan
pemberian bahan iritan dan antibakteri topikal serta kortikosteroid topikal
seperti; sulfur, resorsinol, asam salisilat, benzoil peroksida, asam azelat,
tetrasiklin, eritromisin dan klindamisin.
2. Pengobatan sistemik
Pengobatan sistemik ditujukan untuk penderita jerawat sedang sampai
berat, dengan prinsip menekan aktivitas bakteri, menekan reaksi radang,
Golongan obat sistemik misalnya: pemberian antibiotik (tetrasiklin, eritromisin
dan klindamisin), obat hormonal (etinil estradiol, antiandrogen siproteron
asetat), penggunaan retinoid untuk menekan hiperkeratinisasi dan atas dasar
serta tujuan berbeda dapat digunakan berupa antiinflamasi nonsteroid, dapson
atau seng sulfat.
3. Bedah kulit
Bedah kulit ditujukan untuk memperbaiki jaringan parut yang terjadi
akibat jerawat. Tindakan dapat dilaksanakan setelah jerawat sembuh baik
dengan cara bedah listrik, bedah pisau, dermabrasi atau bedah laser.
2.4 Uji Aktivitas Antibakteri
Aktivitas (potensi) antibakteri dapat ditunjukkan pada kondisi yang
sesuai dengan efek daya hambatnya terhadap bakteri. Ada dua metode umum
yang dapat digunakan yaitu metode difusi dan metode dilusi (Pratiwi, 2008).
Metode difusi untuk menentukan aktifitas agen antimikroba. Piringan
yang berisi agen antimikroba diletakkan pada media agar yang telah ditanami
mikroorganisme yang akan berdifusi pada media agar tersebut. Area jernih
mengindikasikan adanya hambatan pertumbuhan mikroorganisme oleh agen
antimikroba pada permukaan media agar.
Metode dilusi terdiri menjadi dua tahap. Tahap awal disebut metode
dilusi cair/broth dilution test. Metode ini mengukur MIC (minimum inhibitory
concentration atau kadar hambat minimum, KHM) dan MBC (minimum
dilakukan adalah dengan membuat seri pengenceran agen antimikroba pada
medium cair yang ditambahkan dengan mikroba uji. Larutan uji agen
antimikroba pada kadar terkecil yang terlihat jernih tanpa adanya pertumbuhan
mikroba uji ditetapkan sebagai KHM. Larutan yang ditetapkan sebagai KHM
tersebut selanjutnya dikultur ulang pada media cair tanpa penambahan mikroba
uji ataupun agen antimikroba dan diinkubasi selama 18-24 jam. Media cair
yang tetap terlihat jernih setelah inkubasi ditetapkan sebagai KBM. Tahap
selajutnya disebut metode dilusi padat/solid dilution test. Metode ini serupa
dengan metode dilusi cair namun menggunakan media padat (solid).
Keuntungan metode ini adalah satu konsentrasi agen mikroba yang diuji dapat
digunakan untuk menguji beberapa mikroba uji (Pratiwi, 2008).
2.5 Uraian Bakteri
2.5.1 Bakteri Propionibacterium acne
Dalam penelitian ini salah satu bakteri yang digunakan adalah
Propionibacterium acne. Propionibacterium acne adalah organisme utama
yang pada umumnya memberi kontribusi terhadap terjadinya jerawat.
Propionibacterium acnes adalah termasuk gram-positif berbentuk batang, tidak
berspora, tangkai anaerob ditemukan dalam spesimen-spesimen klinis,
beberapa strain/jenis adalah aerotoleran, tetapi tetap menunjukkan
pertumbuhan lebih baik sebagai anaerob. Bakteri ini mempunyai kemampuan
untuk menghasilkan asam propionat, sebagaimana ia mendapatkan namanya
Adapun sistematika bakteri Propionibacterium acne menurut Irianto
(2006), adalah sebagai berikut:
Divisi : Protophyta
Kelas : Schizomycetes
Bangsa : Eubacteriales
Suku : Propionibacteriaceae
Marga : Propionibacterium
Jenis : Propionibacterium acne
2.5.2 Bakteri Staphylococcus epidermidis
Sistematika bakteri Staphylococcus epidermidis menurut Irianto
(2006) adalah sebagai berikut:
Divisi : Protophyta
Kelas : Schizomycetes
Bangsa : Eubacteriales
Suku : Micrococaceae
Marga : Staphylococcus
Jenis : Staphylococcus epidermidis
Staphylococcus epidermidis merupakan sel gram positif berbentuk
bulat biasanya tersusun dalam bentuk kluster yang tidak teratur seperti anggur.
Staphylococcus epidermidis membentuk koloni berupa abu-abu sampai putih,
non patogen, koagulasi negatif, memfermentasi glukosa, dapat bersifat aerob
dan anaerob fakultatif. Staphylococcus epidermidis merupakan flora normal
rambut atau abses, terdapat juga sebagai reaksi inflamasi yang kuat dan
terlokalisir (Irianto, 2006).
2.6 Simplisia
Simplisia adalah bahan alamiah yang dipergunakan sebagai obat yang
belum mengalami pengolahan apapun juga dan kecuali dinyatakan lain, berupa
bahan alam yang telah dikeringkan. Simplisia dibedakan atas simplisia nabati,
simplisia hewani dan simplisia mineral (pelikan) (Ditjen POM, 1979).
Simplisia tumbuhan obat merupakan bahan baku proses pembuatan
ekstrak, baik sebagai bahan obat atau sebagai produk. Ekstrak tumbuhan obat
dapat berfungsi sebagai bahan baku obat tradisional atau sebagai produk yang
dibuat dari simplisia (Ditjen POM, 1979).
2.7 Ekstraksi
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut
sehingga terpisah dari bahan yang tidak dapat larut dengan pelarut cair. Dengan
diketahui senyawa aktif yang dikandung simplisia akan mempermudah
pemilihan pelarut dengan cara ekstraksi yang tepat (Ditjen POM, 1995).
Ekstrak adalah sediaan pekat yang diperoleh dengan mengekstraksi
zat aktif dari simplisia nabati atau hewani menggunakan pelarut yang sesuai,
kemudian semua atau hampir semua pelarut diuapkan dan massa atau serbuk
yang tersisa diperlakukan sedemikian rupa hingga memenuhi baku yang telah
Ada beberapa metode ekstraksi dengan menggunakan pelarut (Ditjen
POM, 2000), yaitu:
1. Cara Dingin
a. Maserasi adalah proses penyarian simplisia dengan menggunakan pelarut
dengan beberapa kali pengocokan atau pengadukan pada temperatur
kamar.
b. Perkolasi adalah ekstraksi dengan pelarut yang selalu baru, yang
umumnya dilakukan pada temperatur ruangan. Prosesnya terdiri dari
tahapan pengembangan bahan, tahapan maserasi antara tahap perkolasi
sebenarnya (penetesan/penampungan ekstrak), terus menerus sampai
diperoleh ekstrak (perkolat) yang tidak meninggalkan sisa bila 500 mg
perkolat terakhir diuapkan pada suhu + 50oC.
2. Cara Panas
a. Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya,
selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan
dengan adanya pendingin balik. Umumnya dilakukan pengulangan
proses pada residu pertama sampai 3-5 kali sehingga proses ekstraksi
sempurna.
b. Sokletasi adalah ekstraksi menggunakan pelarut yang selalu baru yang
umumnya dilakukan dengan alat khusus sehingga terjadi ekstrak kontinu
c. Digesti adalah maserasi kinetik (dengan pengadukan kontinu) pada
temperatur yang lebih tinggi dari temperatur kamar, yaitu secara umum
dilakukan pada temperatur 40-50oC.
d. Infudasi adalah ekstraksi dengan pelarut air pada temperatur 96-98oC
selama 15-20 menit di penangas air dapat berupa bejana infus tercelup
dengan penangas air mendidih. Dekoktasi adalah proses penyarian
dengan menggunakan pelarut air pada temperatur 90oC selama 30 menit.
2.8 Krim (Cremoris)
Krim adalah sediaan setengah padat berupa emulsi kental
mengandung tidak kurang dari 60% air, dimaksudkan untuk pemakaian luar.
Tipe krim yaitu krim tipe air minyak (A/M) dan krim minyak air (M/A). Untuk
membuat krim digunakan zat pengemulsi umumnya berupa surfaktan,
surfaktan anionik, kationik dan nonionik (Anief, 2000).
Suatu sediaan krim dikatakan baik apabila fungsinya dapat
melembutkan kulit, menjaga keseimbangan kulit, dapat dipakai dengan mudah
dan dapat disapukan dengan cepat pada permukaan kulit, tidak meninggalkan
selaput yang retak-retak pada pemakaiannya, tidak mempengaruhi pengeluaran
keringat, mempunyai bau, warna, dan kestabilan fisik yang baik (Balsam dan
Sagarin, 1972).
2.8.1 Komponen utama dalam sediaan krim
Bahan yang biasa digunakan mencakup zat emolien, zat sawar
zat pengental dan pembentuk lapisan tipis, zat pengemulsi, zat pengawet,
parfum dan zat warna (Ditjen POM, 1985).
2.8.1.1Sabun trietanolamin-stearat
Sabun trietanolamin-stearat termasuk pengemulsi anionik. Kelebihan
dari pengemulsi ini adalah lebih lembut dan lebih mudah larut daripada
natrium atau kalium stearat. Sabun trietanolamin-stearat menghasilkan emulsi
yang stabil, tetapi pada penyimpanan cenderung mengental dan akhirnya
membentuk gel. Sedangkan pengemulsi natrium stearat akan menghasilkan
krim yang pada awalnya memiliki konsistensi yang sangat keras. Pada
penyimpanan, konsistensinya menjadi lebih lunak dan akhirnya sangat pekat.
Hal ini dikarenakan natrium stearat tidak larut sempurna dalam air pada
temperatur rendah (Balsam dan Sagarin, 1972).
a. Asam Stearat
Pemeriannya yaitu keras, berwarna putih atau kuning pucat, agak
mengkilap, kristal padat atau serbuk putih atau putih kekuningan, bau lemah
dan berasa lemak. Kelarutannya yaitu mudah larut dalam benzena, kloroform,
dan eter; larut dalam etanol (95%); praktis tidak larut dalam air. Memiliki titik
lebur 69-70oC. Penggunaannya dalam sediaan topikal sebesar 1-20%,
digunakan sebagai bahan pengemulsi ketika direaksikan dengan basa (Rowe,
dkk., 2005).
b. Trietanolamin
Trietanolamin merupakan cairan kental yang bening, tidak berwarna
higroskopis, memiliki titik lebur 20-25oC dan pH 10,5. Kelarutannya yaitu
mudah larut dalam air, metanol, dan aseton. Digunakan sebagai bahan
pengemulsi dengan konsentrasi 0,5-3%, menambah kebasaan, dan sebagai
humektan (Rowe, dkk., 2005).
2.8.1.2Metil paraben
Metil paraben berbentuk kristal tidak berwarna atau serbuk kristal
putih; tidak berbau atau hampir tidak berbau dan berasa sedikit terbakar.
Kelarutannya yaitu sukar larut dalam air, dalam benzene dan dalam karbon
tetraklorida; mudah larut dalam etanol dan dalam eter; larut dalam air 80oC.
Penggunaan dalam sediaan topikal sebanyak 0,02-0,3% sebagai antimikroba,
BAB III
METODE PENELITIAN
3.1Tempat Pelaksanaan Penelitian
Penelitian ini dilaksanakan di Laboratorium Fitokimia, Laboratorium
Mikrobiologi dan Laboratorium Kosmetologi Fakultas Farmasi, Universitas
Sumatera Utara.
3.2 Metode Penelitian
Metode yang digunakan dalam penelitian adalah metode eksperimental
parametrik. Penelitian ini meliputi karakterisasi dan skrining fitokimia
simplisia daun Afrika, pembuatan ekstrak etanol daun Afrika dengan cara
maserasi menggunakan pelarut etanol 80%, skrining ekstrak, uji aktivitas
antibakteri ekstrak, formulasi sediaan krim, evaluasi dan uji aktivitas
antibakteri sediaan krim terhadap bakteri Propionibacterium acne dan
Staphylococcus epidermidis dengan metode disc diffusion.
3.3Alat
Alat-alat yang digunakan adalah: spektrofotometer Visibel (Dynamica
Halo Vis-10), laminar airflow cabinet (Astec HLF 1200 L), oven
(Gallenkamp), autoklaf (Fison), inkubator (Memmert), lemari pendingin
(Toshiba), neraca kasar (Ohanus), neraca analitik (Mettler AE 200), pH meter
blender, alat maserasi, alat penetapan kadar air, lemari pengering, jarum ose,
bunsen, mikro pipet (Eppendorf), pipet tetes, alumunium foil, kertas
perkamen, tissu, pencadang kertas, cawan petri, kapas steril, jangka sorong,
mortir, stamfer, spatula dan peralatan gelas di laboratorium.
3.4 Bahan
Bahan – bahan yang digunakan untuk penelitian ini adalah daun Afrika,
etanol 80%, akuades, asam stearat, setil alkohol, trietanolamin, gliserin,
nipagin, natrium metabisulfit, metil biru, larutan dapar pH asam (4,0), larutan
dapar pH netral (7,0), nutrient agar, nutrient broth, Propionibacterium acne
(ATCC 6919), Staphylococcus epidermidis (ATCC 12228), bahan kimia yang
digunakan berkualitas pro analisa, kecuali dinyatakan lain: alfa naftol, asam
klorida pekat, asam asetat anhidrida, asam nitrat pekat, asam sulfat pekat,
benzen, besi (III) klorida, bismut (III) nitrat, etanol, n-heksan, iodium,
isopropanol, kalium iodida, kloroform, metanol, natrium hidroksida, raksa (II)
klorida, serbuk magnesium, timbal (II) asetat, amil alkohol, besi klorida dan
toluena.
3.5Penyiapan Sampel
Penyiapan sampel meliputi pengambilan bahan, identifikasi tumbuhan
3.5.1 Pengambilan bahan
Bahan yang digunakan adalah daun Afrika yang masih segar dan tua.
Pengambilan bahan dilakukan secara purposif tanpa membandingkan dengan
tumbuhan yang sama dari daerah lain. Bahan diperoleh dari daerah Pasar I
Padang Bulan, Medan, Provinsi Sumatera Utara.
3.5.2 Identifikasi tumbuhan
Identifikasi tumbuhan dilakukan di Herbarium Bogoriense, Bidang
Botani Pusat Penelitian Biologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI),
Bogor.
3.5.3 Pembuatan simplisia
Bahan baku daun Afrika tua yang masih segar dikumpulkan, dicuci
bersih di bawah air mengalir, ditiriskan, dan ditimbang berat basahnya. Daun
Afrika selanjutnya dikeringkan di lemari pengering hingga kering, kemudian
diblender sampai diperoleh serbuk simplisia, ditimbang berat keringnya dan
disimpan dalam wadah plastik yang tertutup rapat.
3.6Pembuatan Pereaksi
3.6.1 Pereaksi asam klorida 2 N
Sebanyak 17 ml asam klorida pekat dilarutkan dalam air suling hingga
volume 100 ml (Depkes RI, 1979).
3.6.2 Pereaksi asam sulfat 2 N
Sebanyak 5,4 ml asam sulfat pekat kemudian diencerkan dengan air
3.6.3 Pereaksi besi (III) klorida 1%
Sebanyak 1 g besi (III) klorida dilarutkan dalam air suling hingga 100
ml (Ditjen POM, 1995).
3.6.4 Pereaksi Bouchardat
Sebanyak 4 g kalium iodida ditimbang, kemudian dilarutkan dalam air
suling, ditambahkan iodium sebanyak 2 g dan dicukupkan dengan air suling
hingga 100 ml (Ditjen POM, 1995).
3.6.5 Pereaksi Dragendorff
Campur 20 ml larutan bismuth nitrat P 40% dalam asam nitrat P dengan
50 ml larutan kalium iodida P 54,4%, diamkan sampai memisah sempurna.
Ambil larutan jernih dan encerkan dengan air secukupnya hingga 100 ml
(Depkes RI, 1995).
3.6.6 Pereaksi Liebermann-Burchard
Sebanyak 5 ml asam sulfat pekat dicampurkan dengan 50 ml etanol
96%. Kemudian tambahkan 5 ml asetat anhidrida, dinginkan (Depkes RI,
1995).
3.6.7 Pereaksi Mayer
Sebanyak 1,35 g raksa (II) klorida dilarutkan dalam 60 ml air suling.
Kemudian pada wadah lain sebanyak 5 g kalium iodida dilarutkan dalam 10
ml air lalu campurkan keduanya dan ditambahkan air suling hingga 100 ml
(Ditjen POM, 1995).
3.6.8 Pereaksi Molish
nitrat 0,5 N hingga volume 100 ml (Ditjen POM, 1995).
3.6.9 Pereaksi natrium hidroksida 2 N
Sebanyak 8,002 g kristal natrium hidroksida dilarutkan dalam air suling
hingga 100 ml (Depkes RI, 1979).
3.6.10 Pereaksi timbal (II) asetat 0,4 M
Sebanyak 15,17 g timbal (II) asetat dilarutkan dalam air bebas
karbondioksida hingga 100 ml (Depkes RI, 1995).
3.7 Pemeriksaan Karakteristik Simplisia
Pemeriksaan karakteristik simplisia meliputi penetapan kadar air,
penetapan kadar sari larut air, penetapan kadar sari larut etanol, penetapan
kadar abu total, dan penetapan kadar abu tidak larut asam (Depkes RI, 1995;
WHO, 1992).
3.7.1 Penetapan kadar air
a. Penjenuhan toluen
Toluen sebanyak 200 ml dimasukkan ke dalam labu alas bulat, lalu
ditambahkan 2 ml air suling, kemudian alat dipasang dan dilakukan destilasi
selama 2 jam. Destilasi dihentikan dan dibiarkan dingin selama ± 30 menit,
kemudian volume air dalam tabung penerima dibaca dengan ketelitian 0,05 ml.
b. Penetapan kadar air simplisia
Labu berisi toluen tersebut dimasukkan 5 g serbuk simplisia yang telah
ditimbang seksama, dipanaskan hati-hati selama 15 menit. Setelah toluen
terdestilasi, kemudian kecepatan destilasi dinaikkan sampai 4 tetes per detik.
Setelah semua air terdestilasi, bagian dalam pendingin dibilas dengan toluen.
Destilasi dilanjutkan selama 5 menit, tabung penerima dibiarkan mendingin
pada suhu kamar. Setelah air dan toluen memisah sempurna, volume air dibaca
dengan ketelitian 0,05 ml. Selisih kedua volume air yang dibaca sesuai dengan
kadar air yang terdapat dalam bahan yang diperiksa. Kadar air dihitung dalam
persen (WHO, 1992).
3.7.2 Penetapan kadar sari larut dalam air
Sebanyak 5 g serbuk yang telah dikeringkan di udara, dimaserasi
selama 24 jam dalam 100 ml air-kloroform (2,5 ml kloroform dalam air suling
sampai 1 liter) dalam labu bersumbat sambil sesekali dikocok selama 6 jam
pertama, kemudian dibiarkan selama 18 jam, kemudian disaring. Sejumlah 20
ml filtrat pertama diuapkan sampai kering dalam cawan penguap yang berdasar
rata yang telah dipanaskan dan ditara. Sisa dipanaskan pada suhu 105oC sampai
bobot tetap. Kadar dalam persen sari yang larut dalam air dihitung terhadap
bahan yang telah dikeringkan di udara (Depkes RI, 1995).
3.7.3 Penetapan kadar sari larut dalam etanol
Sebanyak 5 g serbuk yang telah dikeringkan di udara, dimaserasi
selama 24 jam dalam 100 ml etanol 96% dalam labu bersumbat sambil dikocok
sesekali selama 6 jam pertama, kemudian dibiarkan selama 18 jam. Kemudian
disaring cepat untuk menghindari penguapan etanol. Sejumlah 20 ml filtrat
diuapkan sampai kering dalam cawan penguap yang berdasar rata yang telah
Kadar dalam persen sari yang larut dalam etanol 96% dihitung terhadap bahan
yang telah dikeringkan di udara (Depkes RI, 1995).
3.7.4 Penetapan kadar abu total
Sebanyak 2 g serbuk yang telah digerus dan ditimbang seksama
dimasukkan dalam krus porselin yang telah dipijar dan ditara, kemudian
diratakan. Krus dipijar perlahan-lahan sampai arang habis, pemijaran dilakukan
pada suhu 600oC selama 3 jam kemudian didinginkan dan ditimbang sampai
diperoleh bobot tetap. Kadar abu dihitung terhadap bahan yang telah
dikeringkan di udara (Depkes RI, 1995).
3.7.5 Penetapan kadar abu tidak larut dalam asam
Abu yang telah diperoleh dalam penetapan kadar abu dididihkan dalam
25 ml asam klorida encer selama 5 menit, bagian yang tidak larut dalam asam
dikumpulkan, disaring melalui kertas saring dipijarkan sampai bobot tetap,
kemudian didinginkan dan ditimbang. Kadar abu yang tidak larut dalam asam
dihitung terhadap bahan yang dikeringkan di udara (Depkes RI, 1995).
3.8 Skrining Fitokimia Simplisia
Skrining fitokimia serbuk simplisia daun Afrika meliputi pemeriksaan
senyawa alkaloid, glikosida, saponin, flavonoid, antrakinon, tanin dan
3.8.1 Pemeriksaan alkaloid
Sebanyak 0,5 g serbuk simplisia ditimbang, kemudian ditambahkan 1
ml asam klorida 2 N dan 9 ml air suling, dipanaskan di atas penangas air
selama 2 menit, didinginkan dan disaring. Filtrat dipakai untuk tes alkaloid.
Diambil 3 tabung reaksi, lalu ke dalam masing-masing tabung reaksi
dimasukkan 0,5 ml filtrat. Pada tabung:
a. Ditambahkan 2 tetes pereaksi Bouchardat
b. Ditambahkan 2 tetes pereaksi Dragendorff
c. Ditambahkan 2 tetes pereaksi Meyer
Alkaloid disebut positif jika terjadi endapan atau kekeruhan pada paling
sedikit 2 tabung reaksi dari percobaan di atas (Depkes RI, 1995).
3.8.2 Pemeriksaan glikosida
Serbuk simplisia ditimbang sebanyak 3 g kemudian disari dengan 30 ml
campuran 7 bagian volume etanol 96% dan 3 bagian volum air suling ditambah
dengan 10 ml asam klorida 2N. Direfluks selama 30 menit, didinginkan dan
disaring. Diambil 20 ml filtrat ditambahkan 25 ml air suling dan 25 ml timbal
(II) asetat 0,4M, lalu dikocok selama 5 menit dan disaring. Filtrat disari dengan
20 ml campuran 3 bagian kloroform dan 2 isopropanol dilakukan berulang
sebanyak tiga kali. Kumpulan sari air diuapkan pada temperatur tidak lebih dari
500C. Sisanya dilarutkan dalam 2 ml metanol. Larutan sisa digunakan untuk
percobaan berikut, yaitu 0,1 ml larutan percobaan dimasukkan ke dalam tabung
tetes pereaksi Molish. Kemudian secara perlahan ditambahkan 2 ml asam sulfat
pekat. Glikosida positif jika terbentuk cincin ungu (Depkes RI, 1995).
3.8.3 Pemeriksaaan saponin
Sebanyak 0,5 g sampel dimasukkan ke dalam tabung reaksi dan
ditambahkan 10 ml air suling panas, didinginkan kemudian dikocok kuat-kuat
selama 10 detik, timbul busa yang mantap tidak kurang dari 10 menit setinggi
1-10 cm. Ditambahkan 1 tetes larutan asam klorida 2N, bila buih tidak hilang
menunjukkan adanya saponin (Depkes RI, 1995).
3.8.4 Pemeriksaan flavonoid
Sebanyak 10 g sebuk simplisia kemudian ditambahkan 100 ml air
panas, dididihkan selama 5 menit dan disaring dalam keadaan panas, filtrat
yang diperoleh kemudian diambil 5 ml lalu di tambahkan 0,1 g serbuk Mg dan
1 ml asam klorida pekat dan 2 ml amil alkohol, dikocok, dan dibiarkan
memisah. Flavonoid positif jika terjadi warna merah, kuning, jingga pada
lapisan amil alkohol (Farnsworth, 1966).
3.8.5 Pemeriksaan antrakinon
Sebanyak 0,2 g serbuk simplisia ditambahkan 5 ml asam sulfat 2N,
dipanaskan sebentar, dinginkan. Tambahkan 10 ml benzena, kocok, diamkan.
Pisahkan lapisan benzen, saring; filtrat berwarna kuning, menunjukkan adanya
antrakinon. Kocok lapisan benzena dengan 1-2 ml natrium hidroksida 2N,
diamkan; lapisan air berwarna merah dan lapisan benzena tidak berwarna
3.8.6 Pemeriksaan tanin
Sebanyak 0,5 g sampel disari dengan 10 ml air suling, disaring lalu
filtratnya diencerkan dengan air suling sampai tidak berwarna. Diambil 2 ml
larutan lalu ditambahkan 1 sampai 2 tetes pereaksi besi (III) klorida. Terjadi
warna biru atau hijau kehitaman menunjukkan adanya tanin (Depkes RI, 1979).
3.8.7 Pemeriksaan steroid / triterpenoid
Sebanyak 1 g sampel dimaserasi dengan n-heksan selama 2 jam, lalu
disaring. Filtrat diuapkan dalam cawan penguap. Pada sisa ditambahkan 2 tetes
asam asetat anhidrida dan 1 tetes asam sulfat pekat. Timbul warna biru atau
hijau menunjukkan adanya steroid dan timbul warna merah, pink atau ungu
menunjukkan adanya triterpenoid (Farnsworth, 1966).
3.9 Pembuatan Ekstrak Etanol Daun Afrika
Sebanyak 600 g serbuk simplisia daun Afrika dimasukkan ke dalam
wadah gelas berwarna gelap lalu dimaserasi dengan 7,5 bagian pelarut (4,5
liter) etanol 80% selama 5 hari terlindung dari cahaya matahari sambil sering
diaduk, setelah 5 hari hasil maserasi disaring dan diperas dengan kain flanel
lalu ampas ditambahkan cairan penyari secukupnya sehingga diperoleh seluruh
maserat sebanyak 6 liter, kemudian didiamkan selama 2 hari dan dienap
tuangkan. Maserat diuapkan dengan bantuan alat penguap rotary evaporator
pada temperatur tidak lebih dari 70oC kemudian diuapkan di atas penangas air
3.10 Skrining Fitokimia Ekstrak Etanol Daun Afrika
Skrining fitokimia ekstrak etanol daun Afrika meliputi pemeriksaan
senyawa alkaloid, glikosida, saponin, flavonoid, antrakinon, tanin dan
steroid/triterpenoid (Depkes RI, 1995; Farnsworth, 1966). Prosedur
pemeriksaan ekstrak etanol daun Afrika sama seperti prosedur skrining
fitokimia terhadap simplisia daun Afrika
3.11 Pembuatan Media Untuk Bakteri Uji
3.11.1 Nutrient agar
Komposisi: Lab-lamco powder 1,0 g
Yeast extract 2,0 g
Peptone 5,0 g
Sodium chloride 5,0 g
Agar 15,0 g
Air suling ad 1 L
Cara pembuatan:
Sebanyak 28 gram serbuk nutrient agar dilarutkan dalam air suling steril sedikit
demi sedikit kemudian volumenya dicukupkan hingga 1 L dengan bantuan
pemanasan sampai semua bahan larut sempurna. Kemudian disterilkan di
3.11.2 Nutrient broth
Komposisi: Lab-lamco powder 9,0 g
Yeast extract 3,0 g
Peptone 5,0 g
Sodium chloride 5,0 g
Air suling ad 1 L
Cara pembuatan:
Sebanyak 13 gram serbuk nutrient broth dilarutkan dalam air suling steril
sedikit demi sedikit kemudian volumenya dicukupkan hingga 1 L dengan
bantuan pemanasan sampai semua bahan larut sempurna. Kemudian disterilkan
di autoklaf pada suhu 121oC selama 15 menit (Difco Laboratories,1997).
3.11.3 Pembuatan agar miring
Ke dalam tabung reaksi yang steril dimasukkan 3 ml media nutrient
agar steril, didiamkan pada temperatur kamar sampai sediaan membeku pada
posisi miring membentuk sudut 45oC. Kemudian disimpan dalam lemari
pendingin.
3.12 Penyiapan Inokulum
3.12.1 Pembuatan stok kultur bakteri uji
Cara kerja:
Biakan bakteri Propionibacterium acne dari strain utama diambil dengan jarum
kemudian diinkubasikan pada suhu 35 ± 2oC selama 24 jam dan dengan cara
yang sama dibuat stok kultur bakteri Staphylococcus epidermidis.
3.12.2 Pembuatan inokulum bakteri uji
Cara kerja:
Koloni bakteri Propionibacterium acne diambil dari stok kultur diambil
menggunakan jarum ose steril kemudian disuspensikan ke dalam 10 ml larutan
Nutrient Broth (NB) steril lalu diinkubasikan pada suhu 35 ± 2oC sampai
didapat kekeruhan dengan transmitan 25% menggunakan alat spektrofotometer
UV panjang gelombang 580 nm (Ditjen POM, 1995) dan dengan cara yang
sama dibuat inokulum bakteri Staphylococcus epidermidis.
3.13 Sterilisasi Alat dan Bahan
Sterilisasi alat-alat non gelas dan media menggunakan metode
sterilisasi panas basah dengan autoklaf pada suhu 121°C selama 15 menit dan
sterilisai alat-alat gelas menggunakan metode sterilisasi panas kering dengan
oven pada suhu 170°C selama 2 jam. Jarum ose dipijarkan dengan api Bunsen
(Pratiwi, 2008).
3.14 Pembuatan Larutan Uji Ekstrak Etanol Daun Afrika
Sebanyak 1000 mg ekstrak etanol daun Afrika ditimbang, kemudian
ditambahkan etanol (p.a) hingga volume total 10 ml dan diaduk hingga larut
60 dan 50 mg/ml dan dimasukkan ke dalam vial, masing-masing vial diberi
label.
3.15 Pengujian Aktivitas Antibakteri Terhadap Ekstrak Etanol Daun
Afrika
Pengujian aktivitas antibakteri dilakukan terhadap ekstrak daun Afrika
dengan berbagai konsentrasi. Pengujian ini dilakukan dengan metode disc
diffusion.
3.15.1 Bakteri Propionibacterium acne
0,1 ml inokulum dimasukkan ke dalam cawan petri steril, setelah itu
dituang media nutrient agar sebanyak 20 ml dengan suhu 45 – 50oC.
Selanjutnya cawan digoyang di atas permukaan meja, agar media dan suspensi
bakteri tercampur rata. Pencadang kertas yang telah direndam di dalam larutan
uji ekstrak etanol diletakkan pada permukaan media yang telah padat,
kemudian diinkubasi dalam inkubator pada suhu 35 ± 2oC selama 18–24 jam,
setelah itu diukur diameter daerah hambatan (zona jernih) pertumbuhan di
sekitar pencadang dengan menggunakan jangka sorong.
3.15.2 Bakteri Staphylococcus epidermidis
0,1 ml inokulum dimasukkan ke dalam cawan petri steril, setelah itu
dituang media nutrient agar sebanyak 20 ml dengan suhu 45–50oC.
Selanjutnya cawan digoyang di atas permukaan meja, agar media dan suspensi
bakteri tercampur rata. Pencadang kertas yang telah direndam di dalam larutan
kemudian diinkubasi dalam inkubator pada suhu 35 ± 2oC selama 18–24 jam,
setelah itu diukur diameter daerah hambatan (zona jernih) pertumbuhan di
sekitar pencadang dengan menggunakan jangka sorong.
3.16 Pembuatan Sediaan Krim
3.16.1 Formulasi dasar krim
Sediaan krim yang digunakan adalah krim dengan tipe m/a.
a. Formula dasar krim (Young, 1972)
R/ Asam stearat 12 g
Setil alkohol 0,5 g
Sorbitol sirup 5 g
Propilen glikol 3g
Trietanolamin 1g
Nipagin secukupnya
Air suling ad 100 ml
b. Formula yang telah di modifikasi
R/ Asam stearat 12 g
Setil alkohol 0,5 g
Gliserin 2 g
Trietanolamin 1 g
Nipagin 0,1 %
Na Metabisulfit 2%
Cara pembuatan dasar krim:
Asam stearat dan setil alkohol dimasukkan ke dalam cawan penguap
dan dilebur di atas penangas air (massa I). Nipagin dan Na metabisulfit
dilarutkan dalam air panas, lalu ditambahkan trietanolamin dan diaduk sampai
larut (massa II). Lalu ditambahkan massa II ke dalam massa I di dalam
lumpang panas sambil digerus secara terus menerus hingga terbentuk dasar
krim.
3.16.2 Formulasi sediaan krim
Rancangan formula sediaan krim yang mengandung ekstrak etanol daun
Afrika, yang akan digunakan dalam penelitian ini dapat dilihat pada Tabel 3.1
[image:55.595.112.501.429.542.2]berikut ini.
Tabel 3.1 Formula Sediaan Krim Ekstrak Etanol Daun Afrika
Komposisi
Formula
F 1 F 2 F 3 F 4 F 5 F 6
Ekstrak (g) - 6 7 8 9 10
Dasar krim (g) 100 94 93 92 91 90
Keterangan:
Cara pembuatan:
Ekstrak etanol daun Afrika digerus di dalam lumpang, lalu ditambahkan sedikit
demi sedikit dasar krim dan digerus hingga homogen. Sebagai pembanding
digunakan ERYMEDR (Erythromycin 2%).
3.17 Evaluasi Terhadap Sediaan
3.17.1 Pemeriksaan homogenitas
Sejumlah tertentu sediaan jika dioleskan pada sekeping kaca atau bahan
transparan lain yang cocok, sediaan harus menunjukkan susunan yang
homogen dan tidak terlihat adanya butiran kasar (Ditjen POM, 1979).
3.17.2 Penentuan tipe emulsi sediaan
Penentuan tipe emulsi sediaan dilakukan dengan dua cara, yaitu
pengenceran dengan air dan pengecatan atau pewarnaan. Pengenceran dengan
air dilakukan dengan cara mengencerkan 100 mg sediaan kri