DWI ARYANTI NUR’UTAMI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
TOLERANSI
Saccharomyces cerevisiae
TEREKAYASA
TERHADAP STRES HIPEROSMOSIS PADA MEDIA
BERKONSENTRASI GULA TINGGI UNTUK PRODUKSI
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa Tesis yang berjudul Toleransi Saccharomyces cerevisiae Terekayasa terhadap Stres Hiperosmosis pada Media Berkonsentrasi Gula Tinggi untuk Produksi Bioetanol adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2016
Dwi Aryanti Nur’utami
terhadap Stres Hiperosmosis pada Media Berkonsentrasi Gula Tinggi untuk Produksi Bioetanol. Dibimbing oleh KHASWAR SYAMSU dan LIESBETINI HADITJAROKO.
Bioetanol merupakan salah satu energi alternatif terbarukan yang dapat dibuat dari berbagai bahan yang banyak tersedia di alam, salah satunya adalah molase. Dalam pembuatan bioetanol dibutuhkan khamir yang berperan dalam mengubah monosakarida di dalam media menjadi etanol dan karbon dioksida pada kondisi yang sesuai. Salah satu khamir yang banyak digunakan adalah Saccharomyces cerevisiae yang juga dapat mengubah disakarida karena khamir ini dapat menghasilkan invertase. Penggunaan Saccharomyces cerevisiae dalam pembuatan bioetanol dengan bahan baku molase adalah tepat karena molase mengandung total gula sebesar 62% yang terdiri dari 32% sukrosa, 14% glukosa, dan 16% fruktosa.
Tingginya konsentrasi gula yang terkandung pada molase dapat menyebabkan sel khamir mengalami stres hiperosmosis yang secara tidak langsung juga dapat menyebabkan sel mengalami stres oksidatif. Oleh karena itu pada pembuatan bioetanol, molase yang digunakan selalu diencerkan terlebih dahulu. Proses pengenceran tersebut dapat menambah biaya produksi, waktu, dan tenaga, selain itu juga hanya dapat menghasilkan etanol sebesar 6-12%. Oleh karena itu penggunaan khamir yang dapat tumbuh/toleran pada konsentrasi gula tinggi menjadi sebuah solusi yang menjanjikan pada pembuatan bioetanol agar molase yang digunakan tidak banyak diencerkan dan menghasilkan etanol dengan konsentrasi yang tinggi.
Sejumlah strain khamir yang toleran terhadap berbagai stres lingkungan telah dibuat dengan teknik rekayasa genetika oleh Sasanoet al.(2012a), Iinoya et al. (2009), Sasano et al. (2010), dan Sasano et al. (2012b) yaitu strain Pro1(I150T), Mpr1(K63R), Pro1(I150T)/Mpr1(K63R), dan MSN2-OP yang digunakan dalam pembuatan sake, roti manis, ragi roti, dan etanol. Hanya saja keempat strain khamir terekayasa tersebut belum diuji tingkat toleransinya terhadap substrat berkonsentrasi gula tinggi dalam pembuatan bioetanol. Oleh karena itu tujuan dari penelitian ini adalah untuk mengkaji toleransi khamir terekayasa tersebut terhadap stres hiperosmosis dalam pembuatan bioetanol pada media gula berkonsentrasi tinggi. Selain itu, untuk mengetahui kinerja proses fermentasi juga dilakukan penghitungan parameter kinetika dari masing-masing strain.
karakter/kinerjanya dalam melakukan fermentasi alkohol. Hasil uji fermentasi menunjukkan bahwa pola kurva pertumbuhan ketiga strain terekayasa pilihan [Pro1(I150T), Mpr1(K63R), Pro1(I150T)/Mpr1(K63R)] tidak berbeda signifikan, begitu juga parameter kinetikanya. Namun untuk nilai rendemen etanol per gram biomassa (Yp/x), strain Mpr1(K63R) memberikan nilai yang paling besar diantara strain lainnya yaitu sebesar 4,84±0,07 g etanol/g biomassa. Ketiga strain terekayasa dapat digunakan dalam memperbaiki produktivitas etanol di industri dengan nilai etanol yang dihasilkan sebesar 139,55±5,59 g/L untuk strain Pro1(I150T), 147,75±3,61 g/L untuk strain Mpr1(K63R), dan 146,00±3,32 g/L untuk strain Pro1(I150T)/Mpr1(K63R). Perolehan ini lebih besar dari perolehan etanol pada proses konvensional di industri (6 - 12% v/v atau setara dengan 47,34
–94,68 g/L).
Modified Saccharomyces cerevisiae in High Sugar Concentration Media during Bioethanol Production. Supervised by KHASWAR SYAMSU and LIESBETINI HADITJAROKO.
Bioethanol is one of alternative and renewable fuels that are made from any biological materials which are readily available in nature, one of them is molasses. In bioethanol production, some of yeasts are needed to convert monosaccharide in the media into ethanol and carbon dioxide in appropriate condition. The most widely used yeast is Saccharomyces cerevisiae which also has ability to convert disaccharide because this yeast produces invertase. So the use of Saccharomyces cerevisiae in bioethanol production is very suitable with molasses as raw material because the molasses contains of 62% total sugar which consists of 32% sucrose, 14% glucose, and 16% fructose. The high amount of total sugar in molasses, however, makes yeast cell is exposed to hyperosmotic stress and it makes yeast cells also exposed to oxidative stress indirectly. Therefore, in bioethanol industry, the molasses that used as raw materials are always diluted whereas the dilution process is water- and energy-wasting and also time consuming and it is only produce small amount of ethanol, it is about 6-12%. The use of hyperosmotic stress tolerance yeast in production of bioethanol, therefore, is a promising strategy for obtaining a higher amount of ethanol at a lower cost.
Some of yeast strains which tolerant to environmental stress have been made by genetic engineering technique. Sasano et al. (2012a), Iinoya et al. (2009), Sasano et al. (2010), and Sasano et al. (2012b) have made that kind of yeast strains which tolerant to any stress namely Pro1(I150T), Mpr1(K63R), Pro1(I150T)/Mpr1(K63R), and MSN2-OP which are used in the production of sake, sweet bread, dry yeast, and ethanol. But that all yeast strains have not been tested about their tolerance in high sugar concentration media in bioethanol production. Based on that, the aim of this study was to assess the tolerance of that genetically modified Saccharomyces cerevisiae in hyperosmotic stress and to determine the kinetic parameters of them in the production of bioethanol in high sugar concentration media.
because their amount of ethanol production higher than in industry (6 - 12% v/v or 47,34 - 94,68 g/L). The ethanol production of them was about 139.55±5.59 g/L for Pro1(I150T), 147.75±3.61 g/L for Mpr1(K63R), and 146.00±3.32 g/L for Pro1(I150T)/Mpr1(K63R).
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB.
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Bioteknologi
TOLERANSI
Saccharomyces cerevisiae
TEREKAYASA
TERHADAP STRES HIPEROSMOSIS PADA MEDIA
BERKONSENTRASI GULA TINGGI UNTUK PRODUKSI
BIOETANOL
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah SWT atas rahmat dan karunia-Nya sehingga penelitian ini berhasil diselesaikan. Penelitian yang berjudul Toleransi Saccharomyces cerevisiae Terekayasa terhadap Stres Hiperosmosis pada Media Berkonsentrasi Gula Tinggi untuk Produksi Bioetanol, ini ditujukan sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada Program Studi Bioteknologi Sekolah Pascasarjana IPB Bogor.
Penulis mengucapkan terima kasih kepada semua pihak yang telah membantu dalam penyusunan tesis ini baik secara langsung maupun tidak langsung. Ucapan terima kasih penulis sampaikan kepada Prof Dr Ir Khaswar Syamsu, MSc ST selaku ketua komisi pembimbing dan Dr Ir Liesbetini Haditjaroko, MS selaku anggota komisi pembimbing atas bimbingan dan motivasi yang diberikan kepada penulis. Selain itu juga ucapan terima kasih penulis sampaikan kepada Dr Ir Mulyorini Rahayuningsih, MSi selaku dosen penguji luar yang telah memberi banyak masukan untuk tesis ini. Ucapan terima kasih juga penulis sampaikan kepada Prof Dr Ir Suharsono, DEA selaku Ketua Program Studi Bioteknologi IPB yang telah memberi bimbingan dan memberikan kesempatan kepada penulis untuk melakukan internship di Lab Applied Sress Biology, Nara Institute of Science and Technology, Jepang.
Terima kasih juga penulis sampaikan kepada Prof Hiroshi Takagi dan Assoc Prof Daisuke Watanabe yang telah memberikan bimbingan, motivasi serta menyiapkan dan memberikan sejumlah strain khamir Saccharomyces cerevisiae baik yang terekayasa maupun belum terekayasa untuk digunakan pada penelitian ini. Terima kasih juga penulis ucapkan kepada teknisi dan anggota Lab Applied Stress Biology, NAIST, Hashida-san, kakak Noreen Suliani, Ibu Dr Indah Wijayanti, dan Ibu Dr Rika Indri Astuti yang memberikan bimbingan, bantuan, pengarahan, dan motivasi selama penulis melakukan internship. Ucapan terima kasih juga penulis sampaikan kepada seluruh teknisi Lab Bioindustri dan Lab Keamanan Pangan IPB yang banyak membantu penulis dalam melaksanakan penelitian ini.
Penghargaan setinggi-tingginya penulis persembahkan kepada ayah (alm), ibu, suami, dan kakak atas doa yang dipanjatkan untuk penulis dan segala bentuk bantuan juga dukungan yang diberikan kepada penulis selama studi Magister Sains. Terima kasih kepada Arinta, anak pertama penulis yang memberikan kekuatan dan semangat selama penulis melakukan penelitian dan menyelesaikan tugas akhir. Terima kasih kepada teh Pipit, Ifa, mbak Yanti, Fith, teman-teman di Lab Bioindustri dan Sekolah Pascasarjana Bioteknologi Angkatan 2012 atas dukungan dan bantuannya selama studi Magister Sains.
Penulis menyadari bahwa karya ilmiah ini tidak sempurna, oleh karena itu kritik dan saran diharapkan untuk perbaikan di masa mendatang. Penulis berharap semoga hasil penelitian ini dapat bermanfaat.
Bogor, Agustus 2016
5
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vii
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 3
Tujuan Penelitian 3
Manfaat Penelitian 3
Hipotesis 3
2 TINJAUAN PUSTAKA 4
Stres Hiperosmosis 4
RekayasaSaccharomyces cerevisiae 4
Kinetika Fermentasi Bioetanol 10
3 METODE 12
Bahan 12
ProsedurKerja 12
4 HASIL DAN PEMBAHASAN 14
Toleransi Khamir terhadap Sukrosa dan Etanol Tinggi 14 Uji Fermentasi dan Pengukuran Parameter Kinetika 16
5 SIMPULAN 21
Simpulan 21
Saran 21
DAFTAR PUSTAKA 22
LAMPIRAN 26
DAFTAR TABEL
1. Jumlah koloniSaccharomyces cerevisiaepadaspot test(CFU) 16 2. Parameter kinetika strain khamir terekayasa pada uji fermentasi 18
DAFTAR GAMBAR
1. Jalur metabolisme prolin di dalam selSaccharomyces cerevisie 6 2. Jalur metabolisme prolin dan arginin di dalam sel
Saccharomyces cerevisiae 8
3. Skema biokimia penyerapan dan metabolisme oligosakarida dan
heksosa oleh khamir 10
4. Hasil Spot test 5 strain khamir yang berbeda pada media YPD
kontrol, YPD yang mengandung 50%, 60%, dan 70% sukrosa. 14 5. Spot test 5 strain khamir yang berbeda pada media YPD kontrol,
YPD yang mengandung 11%, 12%, 13%, dan 14% etanol. 15 6. Kurva pola pertumbuhan, total gula sisa, dan etanol yang
diproduksi oleh strain khamir 17
DAFTAR LAMPIRAN
1. Diagram alir metode penelitian 26
2. Prosedur kerjaspot test 27
1 PENDAHULUAN
Latar Belakang
Bioetanol merupakan salah satu bahan bakar penting yang dapat diperbaharui dan berkontribusi dalam mengurangi dampak negatif dari penggunaan bahan bakar fosil terhadap lingkungan. Bioetanol dapat dibuat dari berbagai bahan yang banyak tersedia di alam diantaranya bahan yang mengandung gula, pati, dan lignoselulosa. Selain banyak digunakan pada industri bioetanol, bahan yang paling mudah digunakan adalah bahan yang mengandung gula, salah satunya molase karena hanya membutuhkan satu tahap proses saja yaitu fermentasi. Proses fermentasi membutuhkan agen fermentasi berupa khamir yang berperan dalam mengubah sejumlah gula (monosakarida) di dalam media menjadi etanol dan karbon dioksida pada kondisi yang sesuai. Salah satu khamir yang biasa digunakan selama ribuan tahun pada fermentasi alkohol adalah Saccharomyces cerevisiae (Ma & Liu dalam Liu 2012). Saccharomyces cerevisiae tidak hanya dapat menggunakan monosakarida tetapi juga disakarida karena khamir ini memiliki invertase intraselular dan ekstraselular yang dapat mengkatalisis proses penguraian sukrosa menjadi glukosa dan fruktosa (Aslamet al. 2013). Penggunaan Saccharomyces cerevisiae dalam pembuatan bioetanol dengan bahan baku molase adalah tepat karena molase mengandung total gula sebesar 62% yang terdiri dari 32% sukrosa, 14% glukosa, dan 16% fruktosa (Olbrich 1963).
Tingginya konsentrasi gula yang terkandung pada molase dapat menyebabkan sel khamir mengalami stres hiperosmosis yaitu kondisi dimana terjadi perubahan konsentrasi solut (gula, etanol, garam) di luar sel menjadi lebih tinggi dibanding di dalam sel (Ma & Liu dalam Liu 2012). Stres hiperosmosis juga dapat menginduksi terbentuknya Reactive Oxygen Species (ROS) di dalam sel, sehingga secara tidak langsung sel juga mengalami stres oksidatif (Giannattasio et al. dalam Liu 2012). Oleh karena itu pada produksi bioetanol, molase yang digunakan selalu diencerkan terlebih dahulu dan proses pengenceran tersebut dapat menambah biaya produksi, waktu, dan tenaga, sehingga penggunaan khamir yang dapat tumbuh/toleran pada konsentrasi gula tinggi menjadi sebuah solusi yang menjajikan pada pembuatan bioetanol agar molase yang digunakan tidak banyak diencerkan.
berperan sebagai stress protectant. Sasano et al. (2012a) telah mengembangkan khamir roti (baker’s yeast) terekayasa Pro1(I150T) yang dapat mengekspresikan prolin yang berperan sebagai osmolit/osmoprotektan dalam jumlah yang banyak (proline overexpression). Hasil rekayasa khamir Pro1(I150T) tersebut menghasilkan khamir yang memiliki viabilitas sel yang tinggi dan level intraselular ROS yang rendah dibanding tipe liar. Selain itu khamir terekayasa ini dapat meningkatkan kemampuan fermentasi pada adonan roti yang mengandung gula berkonsentrasi tinggi.
Mekanisme lain dalam merespon stres adalah melakukan upregulasi/ peningkatan ekspresi gen penyandi enzim antioksidan untuk melawan Reactive Oxygen Species (ROS). Salah satu novel enzim antioksidan adalah N-acetyltransferase Mpr1 yang disandikan oleh gen MPR1 (Takagi et al. 2000). Overekspresi enzim tersebut pada khamir terekayasa Mpr1(K63R) dilaporkan dapat meningkatkan viabilitas sel dan menurunkan level ROS intraselular ketika terpapar etanol (stres etanol) atau H2O2 (stres oksidatif) dibandingkan tipe liar Mpr1 (Iinoya et al. 2009). Khamir Mpr1(K63R) juga dapat meningkatkan kemampuan fermentasi pada adonan roti setelah khamir mengalami stres akibat pengeringan (air drying stress) yang merupakan kondisi stres yang paling merusak dengan terbentuknya ROS (Sasanoet al.2010).
Upregulasi/peningkatan ekspresi gen penyandi faktor transkripsi stress-induced genes juga dapat dilakukan untuk merespon stres. Salah satu faktor/aktivator transkripsi di dalam sel khamir yaitu Msn2 yang dikodekan oleh gen MSN2. Sasano et al. (2012b) telah mengkonstruksi strain khamir yang mengoverekspresikan gen MSN2, MSN2-OP. Khamir terekayasa MSN2-OP memiliki level intraselular trehalosa yang lebih tinggi dibandingkan dengan tipe liar dan khamir terekayasa tersebut dapat toleran terhadap freeze thaw stress. Overekspresi Msn2 pada khamir strain laboratorium dan strain industri juga menunjukkan toleransinya terhadap stres oksidatif akibat furfural sebagai hasil samping dalam fermentasi etanol dari bahan lignoselulosa (lignocellulosic biomass), terutama karena tingginya tingkat transkripsi gen penyandi antioksidan (Sasanoet al.2012c).
3
Perumusan Masalah
Strain khamir yang biasa digunakan di industri bioetanol dengan bahan baku molase adalah strain khamir yang tahan terhadap gula dengan konsentrasi 16-20% dengan etanol yang dihasilkan maksimal sebesar 6-12%. Oleh karena itu, molase yang mengandung total gula hingga 60% harus diencerkan terlebih dahulu. Penggunaan strain khamir yang toleran terhadap konsentrasi gula dan etanol tinggi dapat menghilangkan atau mengurangi proses pengenceran. Sejumlah strain khamir dengan karakteristik tersebut telah dibuat dengan teknik rekayasa genetika oleh Sasano et al. (2012a), Iinoya et al. (2009), Sasano et al. (2010), dan Sasano et al. (2012b) yaitu strain Pro1(I150T), Mpr1(K63R), Pro1(I150T)/Mpr1(K63R), dan MSN2-OP yang digunakan dalam pembuatan sake, roti manis, dan ragi roti dimana khamir terpapar berbagai stres. Hanya saja keempat strain khamir terekayasa tersebut belum diuji tingkat toleransinya terhadap substrat berkonsentrasi gula tinggi dalam pembuatan bioetanol.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengkaji toleransi khamir komersial Saccharomyces cerevisiae Ethanol Red terekayasa terhadap stres hiperosmosis dalam sintesis bioetanol pada media gula tinggi. Selain itu juga dilakukan penghitungan parameter kinetika dari data penelitian dengan masing-masing strain, sehingga diperoleh gambaran mengenai kemampuan khamir dalam menghasilkan bioetanol.
Manfaat Penelitian
Dengan diperolehnya informasi berupa karakteristik toleransi strain khamir terekayasa terhadap konsentrasi gula tinggi diharapkan dapat meningkatkan produktivitas bioetanol di industri dan dapat mengurangi biaya, energi, dan waktu produksinya.
Hipotesis
2 TINJAUAN PUSTAKA
Stres Hiperosmosis
Stres hiperosmosis adalah kondisi dimana terjadinya perubahan konsentrasi solut (gula, etanol, garam) di luar sel menjadi lebih tinggi dibanding di dalam sel (Ma & Liu dalam Liu 2012). Menurut Attfield (1997), khamir yang terpapar kondisi hiperosmosis menyebabkan terjadinya peningkatan pengeluaran cairan dari sel yang meningkat, berkurangnya volume sel dan penyusutan sel, kehilangan tekanan turgor, dan meningkatnya konsentrasi cairan/solut di dalam sel. Brocker et al. (2012) juga menyatakan bahwa kondisi hiperosmosis dapat berakibat negatif bagi sel dari segala sisi. Ketidakseimbangan osmosis pada mulanya dapat menyebabkan pengerutan sel karena air keluar dari dalam sel. Kehilangan air intraselular merusak banyak proses homeostatis, termasuk sintesis dan perbaikan DNA, transkripsi, translasi dan degradasi protein, dan juga fungsi mitokondria. Hasilnya, siklus sel dan proliferasi sel menjadi terhenti dimana fase G1 sebagai tahap pembentukan organel-organel dan fase S sebagai tahap penduplikasian kromosom dan replikasi DNA menjadi tertunda, sehingga viabilitas sel menurun. Keluarnya air dari dalam sel juga menyebabkan volume sel dan inti sel berkurang, sehingga menyebabkan konsentrasi makromolekul intraselular meningkat secara signifikan. Perubahan volume inti sel tersebut menyebabkan terjadinya kondensasi kromatin.
Stres hiperosmosis juga dapat menginduksi terbentuknya Reactive Oxygen Species (ROS) berupa radikal superoksida (O2-), radikal peroksil (HO2), dan radikal hidroksil (HO) di dalam sel, sehingga secara tidak langsung sel juga mengalami stres oksidatif yang akan menyebabkan kerusakan asam nukleat, protein, lipid, dan komponen selular lainnya bahkan menyebabkan sel mengaktivasi jalur apoptosis atau kematian terprogram (Landolfo et al. 2008; Giannattasioet al.dalam Liu 2012). Namun, terdapat banyak mekanisme adaptif untuk melawan efek buruk dari stress hiperosmotik, termasuk sintesis osmolit/osmoprotektan, enzim antioksidan, faktor transkripsi, transporter, dan heat shock protein/molecular chaperone(Brockeret al.2012).
RekayasaSaccharomyces cerevisiae
Spesies Saccharomyces cerevisiae termasuk ke dalam famili Saccharomycetaceae, genus Saccharomyces (Reed dan Nagodawithana 1991). Saccharomyces merupakan salah satu genus khamir yang sangat umum digunakan dan dieksploitasi untuk kepentingan hidup manusia dan sangat luas penggunaannya. Spesies khamir Saccharomyces cerevisiae dianggap bermanfaat dari segi komersial/ekonomis karena spesies khamir tersebut paling dikenal dan paling banyak digunakan dalam berbagai industri (Reed dan Nagodawithana 1991).
5
yang busuk. Hanya saja khamir tipe liar memiliki keterbatasan dalam penggunaanya secara komersial di dunia industri. Contohnya pada industri bioetanol yang menggunakan molase sebagai medianya. Penggunaan molase menciptakan kondisi yang tidak menguntungkan bagi khamir tipe liar untuk tumbuh seperti adanya tekanan osmosis/stres hiperosmosis akibat kadar gula yang tinggi dan kadar etanol yang tinggi, sehingga menyebabkan turunnya kemampuan fermentasi bahkan menyebabkan kematian pada khamir. Oleh karena itu, dilakukan pengembangan agar diperoleh strain khamir dengan karakteristik yang diinginkan. Salah satunya yaitu dengan melakukan rekayasa genetika. Rekayasa tersebut dapat dilakukan dengan menginduksi gen-gen yang terlibat dalam sintesis osmolit/overekspresi osmolit, upregulasi/peningkatan ekspresi gen penyandi enzim antioksidan untuk menangkap Reactive Oxygen Species (ROS) (Brocker et al. 2012) dan melakukan upregulasi/peningkatan ekspresi gen penyandi aktivator/faktor transkripsi gen-gen yang diinduksi oleh stres (stress-induced genes) (Ma & Liu dalam Liu 2012).
Overekspresi Prolin sebagai Osmolit/Osmoprotektan
Osmolit dikategorikan sebagai komponen inert yang dapat terakumulasi hingga konsentrasi tinggi tanpa mengganggu homeostatis selular, sehingga sering disebut sebagai compatible osmolyte. Akumulasi osmolit di dalam sel berperan dalam menyeimbangkan tekanan osmosis intraselular dengan ekstraselular lingkungannya sehingga terbentuk kondisi yang isotonik. Akumulasi osmolit juga dapat mencegah air keluar dari sel, sehingga dapat mempertahankan volume sel. Ciri utama dari respon selular terhadap stres hiperosmosis yaitu meningkatkan konsentrasi intraselular osmolit dengan (i) meningkatkan transpor osmolit dan/atau (ii) meningkatkan sintesis osmolit. Akumulasi osmolit tidak hanya berperan penting dalam mempertahankan volume sel tapi juga mempertahankan dan menjaga homeostatik selular. Osmolit berperan sebagai chemical chaperone dengan menstabilkan struktur protein dan mempertahanan fungsi enzim. Senyawa ini diduga dapat mendorong pelipatan unstructured protein atau protein yang terdenaturasi melalui interaksi osmofobik yang dibuat antara unfolded atau misfolded peptide backbone dan osmolit. Terdapat sejumlah kelompok osmolit yang telah diidentifikasi, meliputi polyol (sorbitol, xylitol, mannitol, gliserol, dan adonitol), cyclitol (myoinositol, trehalosa), methylamines (glisin betain, trimethylamine N-oxide/TMAO, dan α-GPC), asam amino dan asam amino
turunannya (glisin, prolin, isoleusin, leusin, fenilalanin, valin, β-alanin, taurin, dan hipotaurin) (Brockeret al.2012).
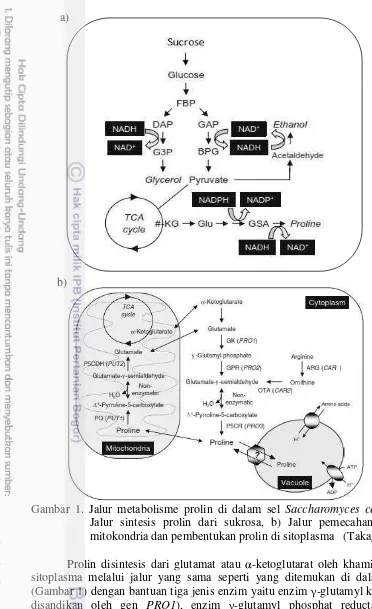
Gambar 1. Jalur metabolisme prolin di dalam sel Saccharomyces cerevisie: a) Jalur sintesis prolin dari sukrosa, b) Jalur pemecahan prolin di mitokondria dan pembentukan prolin di sitoplasma (Takagi 2008).
Prolin disintesis dari glutamat atau α-ketoglutarat oleh khamir di dalam sitoplasma melalui jalur yang sama seperti yang ditemukan di dalam bakteri (Gambar 1) dengan bantuan tiga jenis enzim yaitu enzim γ-glutamyl kinase (GK; disandikan oleh gen PRO1), enzim γ-glutamyl phosphat reductase (GPR; disandikan oleh gen PRO2), dan enzim ∆-pyrroline-5-carboxylate reductase (P5CR; disandikan oleh gen PRO3). Glutamat dan α-ketoglutarat yang diubah menjadi prolin di sitosol berasal dari pemecahan glukosa melalui jalur glikolisis dan siklus Krebs/TCA (Tricarboxylic Acid) di mitokondria (Takagi 2008).
a)
7
Proses rekayasa khamir S. cerevisiae dalam meningkatkan toleransinya terhadap berbagai stres lingkungan dilakukan pada salah satu gen yang berperan dalam sintesis prolin, sehingga prolin dapat dihasilkan berlebih di dalam sel. Untuk mengakumulasi prolin berlebih di dalam sel, dilakukan proses mutasi pada gen PRO1 yaitu penyandi enzim GK yang berperan dalam mengubah glutamat menjadi γ-glutamyl phosphate yang kemudian menjadi prolin (Sekine et al. 2007). Enzim GK yang dihasilkan dari khamir mutan bersifat kurang sensitif terhadap feedback inhibition, sehingga enzim GK akan terus aktif mensintesis prolin walaupun akumulasi prolin di dalam sel sudah banyak/mencukupi kebutuhan sel.
Mutasi gen PRO1 untuk membuat enzim GK yang kurang sensitif terhadap feedback inhibition dilakukan dengan melakukan random mutagenesis yang menyebabkan terjadinya perubahan salah satu asam amino pada gen PRO1. Asam amino yang berubah adalah asam amino isoleusin pada urutan ke-150 menjadi threonin (I150T). Hanya saja, prolin yang terlalu berlebihan kemungkinan dapat bersifat toksik ketika prolin terakumulasi di dalam sitosol (Matsuura dan Takagi 2005) atau mungkin dapat menyebabkan pertumbuhan sel menjadi terhambat jika berada pada media yang mengandung etanol (Takagi et al. 2007). Berdasarkan hal tersebut, Takagi (2008) menyarankan bahwa jumlah prolin yang tepat di dalam sel khamir, sangat penting pengaruhnya sebagai pelindung stres.
Sejumlah penelitian juga telah membuktikan bahwa akumulasi prolin dapat melindungi sel khamir dari stres akibat konsentrasi gula yang tinggi pada adonan roti manis (Sasano et al. 2012a) dan melindungi sel khamir dari kerusakan akibat stres oksidatif (Takagi 2008). Selain itu, prolin dapat berperan sebagai krioprotektan dengan meningkatkan stabilitas protein atau membran sel selama proses pembekuan (Sekine et al. 2007), dehidrasi/kehilangan air, atau akibat kenaikan suhu (Takagi 2008). Di industri sake, prolin juga berperan dalam mencegah proses denaturasi protein dan kerusakan membran sel, ketika khamir terpapar etanol dengan konsentrasi tinggi, sehingga khamir menjadi tahan dan memiliki viabilitas sel yang tinggi ketika proses fermentasi. Selain itu juga prolin berperan dalam mempercepat waktu fermentasi tanpa mengubah kualitas sake (Takagiet al.2005, Takagi 2008).
Peningkatan Aktivitas Enzim Antioksidan Mpr1
Strategi lain dalam merespon stres hiperosmosis dan stres oksidatif adalah dengan mengaktifkan sistem antioksidan untuk menangkap Reactive Oxygen Species (ROS) yang terakumulasi ketika khamir mengalami stres. Salah satu enzim antioksidan baru (novel) pada khamir Saccharomyces cerevisiae Σ1278b
walaupun telah mengalami pengeringan/terpapar air drying stress. Iinoya et al. (2009) melakukannya pada khamir sake, sehingga khamir memiliki viabilitas sel yang tinggi dengan level intraselular ROS yang rendah ketika terpapar stres etanol dan hidrogen peroksida.
Enzim antioksidan N-acetyltransferase Mpr1 tidak seperti banyak enzim antioksidan lainnya yang mengkatalisis dekomposisi ROS (Reactive Oxygen Species) secara langsung, mekanisme enzim N-acetyltransferase Mpr1 dikategorikan baru karena enzim ini mengasetilasi metabolit toksik seperti intermediate metabolisme prolin (P5C/GSA) yang terlibat dalam produksi ROS ketika terpapar stres oksidatif akibat heat-shock, pembekuan, atau perlakuan oleh etanol (Du dan Takagi 2007; Nomura dan Takagi 2004). Enzim N-acetyltransferase Mpr1 mengubah GSA menjadi N-Acetyl GSA yang kemudian menjadi arginin dan dengan bantuan enzim NO sinthase (NOS) selanjutnya diubah menjadi nitric oxide (NO) yang dapat membuat khamir menjadi toleran terhadap berbagai stres. Hanya saja, mekanisme sintesis dan peran fisiologis dari NO tersebut di dalam Saccharomyces cerevisiae masih belum jelas. Berikut gambar jalur mekanisme pembentukan arginin dan nitric oxide (NO) dengan bantuan enzim N-acetyltransferase Mpr1 (Gambar 2).
Gambar 2. Jalur metabolisme prolin dan arginin di dalam sel Saccharomyces cerevisiae(Sasanoet al.2012d).
9
Overekspresi Aktivator Transkripsi Msn2
Aktivator transkripsi Msn2 yang disandikan oleh gen MSN2 diketahui sebagai aktivator bagi 180 gen yang merespon beberapa stres (stress induced genes) termasuk stres akibat oksidasi, heat-shock, dan etanol yang tinggi (Causton et al. 2001, Estruch 2000, Gasch et al. 2000, Sasano et al. 2012c). Beberapa gen tersebut diantaranya adalah gen penyandi enzim antioksidan (CTT1, SOD2) yang berperan dalam menangkap Reactive Oxygen Species, molecular chaperone (HSP12, HSP104) yang berperan untuk memastikan ketepatan pelipatan (folding) atau pelipatan kembali (refolding) nascent protein atau yang telah terdenaturasi dan juga enzim untuk mempertahankan konformasi fungsionalnya (Ma dan Liu dalam Liu 2012), dan gen yang berperan dalam sintesis trehalosa (TPS1, TPS2) yang berperan dalam melindungi sel dari kerusakan akibat oksigen radikal atau berperan sebagaistress protectant (Sasano et al.2012b).
Gen-gen tersebut memiliki transcriptional element di bagian promotornya, yaitu stress-response element (STRE). STRE akan berikatan dengan faktor transkripsi Msn2 yang berbentuk heterodimer dengan Msn4 ketika sel khamir terpapar stres lingkungan dan akan memulai proses transkripsi gen-gen tersebut (stress-induced gen-genes) di dalam nukleus. STRE ditandai dengan adanya inti pentametric cis-acting sequence CCCCT dan/atau fungsi kebalikannya AGGGG di bagian awal/upstreamsekuens gen. Ikatan antara STRE dan faktor transkripsi Msn2 disebut sebagai stress general response karena mampu berperan dalam merespon berbagai stres seperti stres osmosis dan oksidatif, heat shock, dan stres akibat konsentrasi etanol yang tinggi melalui penginduksian sejumlah stress-induced genes. Namun, bagaimana mekanisme STRE dalam sensing dan membedakannya, masih belum diketahui (Estruch 2000; Sasanoet al. 2012c).
Peningkatan toleransi khamir terhadap stres dapat dilakukan dengan mengekspresikan faktor/aktivator transkripsi Msn2 berlebih/overekspresi faktor transkripsi Msn2 (Sasano et al. 2012b, 2012c) dengan cara proses rekayasa genetika, yaitu menggunakan promoterTDH3 yang bersifat konstitutif pada gen MSN2, sehingga faktor transkripsi Msn2 akan secara terus-menerus diekspresikan dan menginduksi proses transkripsi sejumlah stress-induced genes. Overekspresi faktor transkripsi Msn2 telah dilakukan ke dalam sel ragi roti dan menghasilkan khamir/ragi roti yang resisten/toleran terhadap stres akibat freeze-thaw. Hal tersebut dikarenakan tingginya ekspresi dari gen TPS1 yang menyandikan trehalosa-6-fosfat sintase yang dibutuhkan untuk sintesis trehalosa dari glukosa-6-fosfat dan uridin-difosfat (UDP)-glukosa (Sasanoet al.2012b). Telah diketahui bahwa akumulasi trehalosa di dalam sel dapat meningkatkan toleransi terhadap stres akibatfreeze-thawdan meningkatkan kemampuan fermentasi di dalam sel di dalam adonan roti yang telah dibekukan (Shima et al. 1999) hanya saja mekanismenya masih kurang dipahami.
meningkatkan kecepatan fermentasinya walaupun terdapat inhibitor fermentasi, seperti furfural (Sasanoet al.2012c).
Kinetika Fermentasi Bioetanol
Kinetika kultivasi/fermentasi yaitu proses mengukur dan menghitung pertumbuhan mikroorganisme berdasarkan pemantauan konsentrasi biomassa dan produk yang terbentuk, baik berupa produk primer maupun sekunder yang merupakan hasil dari substrat/nutrisi yang dikonsumsi pada media pertumbuhannya pada kondisi yang sesuai. Salah satu metabolit/produk primer yang dihasilkan oleh kultivasi khamir Saccharomyces cerevisiae dengan menggunakan substrat berupa gula sebagai sumber karbon adalah bioetanol.
11
Proses pembentukan bioetanol sering disebut juga dengan proses fermentasi karena khamir tidak membutuhkan oksigen/anaerobik di dalam metabolismenya, namun tetap menggunakan oksigen/aerobik untuk membentuk biomassa. Biokimia prosesnya dapat dilihat pada skema Gambar 3, yang menunjukkan bahwa ketika terdapat O2 di dalam media pertumbuhan, maka khamir Saccharomyces cerevisiae yang bersifat anaerob fakultatif akan melakukan respirasi dengan memasuki siklus TCA dengan membentuk sel, sedangkan jika tidak terdapat O2 maka khamir sepenuhnya akan melakukan fermentasi dan membentuk etanol.
Proses fermentasi anaerobik (tanpa adanya oksigen pada lingkungan) terhadap substrat glukosa ditulis dengan persamaan C6H12O6 2C2H5OH + 2CO2. Persamaan tersebut menunjukkan bahwa setiap satu molekul glukosa yang dikonsumsi, maka akan terbentuk dua molekul etanol, yang berarti etanol yang akan terbentuk sebesar 51,1 gram per 100 gram glukosa yang dikonsumsi atau 0,51 gram etanol per 1 gram glukosa. Dengan demikian setiap pertumbuhan dan pembentukan produk (etanol) pada khamir dapat diestimasi berdasarkan nilai faktor konversi/koefisien efisiensi pada teori tersebut.
Dalam proses fermentasi/kultivasi, penting untuk diketahui kinetika pertumbuhan mikroba yang digunakan seperti laju pertumbuhan spesifik (µ), penggunaan/konsumsi substrat untuk pertumbuhan atau untuk produksi metabolit pada waktu tertentu, dan laju pertumbuhan produk per satuan waktu tertentu, sehingga dapat diketahui jumlah sel atau produk yang terbentuk per satuan substrat yang dikonsumsi (Yx/s, Yp/s) dan jumlah produk yang terbentuk per sel (Yp/x). Perhitungan yang biasa dilakukan untuk proses pembentukan produk yang berasosiasi dengan pertumbuhan sel dan penggunaan substrat adalah sebagai berikut (Shuler dan Kargi 1992):
(1) Rendemen pemakaian substrat untuk pembentukan biomassa sel (Yx/s)
Yx/s=
(2) Rendemen pemakaian substrat untuk pembentukkan produk (Yp/s)
Yp/s=
(3) Rendemen pembentukkan produk setiap satuan biomassa sel (Yp/x)
Yp/x=
(4) Efisiensi penggunaan substrat
=
3 METODE
Penelitian dilaksanakan di Laboratorium Bioindustri Departemen Teknologi Industri Pertanian IPB dan di Laboratorium Mutu dan Keamanan Pangan 1 & 2 Pusat Antar Universitas (PAU), SEAFAST Center–IPB. Kegiatan penelitian berlangsung dari Juni 2014–April 2016.
Bahan
Bahan yang digunakan berupa strain khamir industri/Ethanol Red (ER) Saccharomyces cerevisiae yang berasal dari Nara Institute of Science and Technology – Jepang, diantaranya ER Wild Type, ER Pro1(I150T), ER Mpr1(K63R), ER Pro1(I150T)/Mpr1(K63R) yang merupakan kombinasi rekayasa Pro1(I150T) dan Mpr1(K63R), dan ER MSN2-OP. Seluruh strain ditumbuhkan pada media agar SD (Synthetic Defined) yang mengandung AZC (azetidine-2-carboxylic acid). Media partumbuhan yang digunakan adalah YPD (Yeast extractPeptone Dextrose) yang terdiri dari 2% glukosa, 1%yeast extract, 2%bacto peptonedan 2% agar untuk membuat media cawan agar. Selain itu juga menggunakan media YPD yang mengandung sukrosa sebesar 50% - 70% untuk menguji toleransi khamir terhadap konsentrasi gula tinggi dan YPD yang mengandung etanol sebesar 11% - 14% untuk menguji toleransi khamir terhadap etanol tinggi.
ProsedurKerja
Penelitian ini terdiri atas dua kegiatan, yaitu (1) Uji toleransi khamir terhadap sukrosa dan etanol tinggi, (2) Uji fermentasi/kultivasi pada media sukrosa tinggi dan penghitungan parameter kinetikanya (Lampiran 1).
Uji Toleransi Khamir terhadap Sukrosa dan Ethanol Tinggi
13
untuk uji etanol) dan dihitung jumlah koloni yang terbentuk dengan batas 5-40 koloni per spot/totolan.
Uji Fermentasi dan Pengukuran Parameter Kinetika
4 HASIL DAN PEMBAHASAN
Toleransi Khamir terhadap Sukrosa dan Etanol Tinggi
Tingginya konsentrasi sukrosa yang terkandung di dalam media pertumbuhan khamir membuat sel mengalami stres hiperosmosis yang menyebabkan tingginya pengeluaran air dari dalam sel. Hal tersebut berpengaruh terhadap volume sel, sehingga terjadi pengerutan sel dan hilangnya turgor. Pengerutan sel dapat meningkatkan konsentrasi zat terlarut di dalam sel yang menyebabkan terjadinya karbonilasi protein, depolarisasi mitokondria, kerusakan DNA, dan tertahannya siklus sel pada G1 atau G2, sehingga menghambat pertumbuhan khamir (Brockeret al.2012).
Semakin tinggi konsentrasi gula yang digunakan/dikonsumsi oleh khamir pada pembuatan bioetanol maka akan semakin tinggi pula konsentrasi etanol yang dihasilkan. Namun tingginya konsentrasi etanol yang terakumulasi pada media akan menyebabkan khamir mengalami stres hiperosmosis dimana etanol berdifusi secara bebas melintas membran sel khamir untuk mencapai kesetimbangan konsentrasi etanol antara intra dan ekstraselular sel. Peningkatan konsentrasi etanol menghambat pertumbuhan sel, mereduksi viabilitas sel dan menyebabkan kematian sel yang kemudian dapat mereduksi laju fermentasi etanol dan menurunkan rendemennya (Ma & Liu dalam Liu 2012).
Untuk melihat tingkat toleransi/ketahanan suatu strain khamir terhadap stres hiperosmosis akibat sukrosa dan etanol tinggi, maka dilakukan pengujian penghambatan pertumbuhan dari setiap strain khamir dan penentuan jumlah selnya ketika pada fase eksponensial dengan metode spot test. Semakin toleran suatu strain khamir terhadap stres hiperosmosis, maka semakin baik pertumbuhannya yang berarti tidak mengalami penghambatan pertumbuhan. Pada penelitian inispot test dilakukan pada media YPD yang mengandung konsentrasi sukrosa 50% - 70% dan etanol 11% - 14%. Hasil spot test dapat dilihat pada Gambar 4 dan 5 dan juga pada Tabel 1.
15
Hasilspot test pada media YPD yang mengandung berbagai konsenstrasi sukrosa menunjukkan bahwa hampir seluruh strain khamir baik terekayasa maupun belum direkayasa dapat bertahan tumbuh hingga konsentrasi sukrosa 70%. Hanya koloni strain ER MSN2-OP yang mengalami penghambatan pertumbuhan. Hal tersebut dapat dilihat pada hasil penghitungan koloninya pada konsentrasi sukrosa 70% pada Tabel 1 yang lebih sedikit dibandingkan strain lainnya. Artinya bahwa strain khamir terekayasa Pro1(I150T), Mpr1(K63R), Pro1(I150T)/Mpr1(K63R) lebih toleran terhadap stres hiperosmosis yang diinduksi oleh konsentrasi gula tinggi dibanding MSN2-OP, hanya saja tidak lebih toleran dibanding strain khamir yang belum direkayasa. Hal ini disebabkan strain tersebut merupakan strain khamir industri/komersial (Ethanol Red) yang merupakan strain khamir yang secara khusus dipilih dan dikembangkan untuk industri etanol dengan toleransi terhadap etanol yang tinggi dan dapat menghasilkan etanol yang banyak dengan waktu yang cepat, juga dapat mempertahankan viabilitas sel yang tinggi selama fermentasi khususnya pada fermentasivery high gravity(VHG).
Penelitian Sasano et al. (2012b) menunjukkan bahwa strain khamir MSN2-OP yang ditumbuhkan pada media 30% glukosa juga tidak lebih toleran dibanding strain kontrolnya (vektor) atau memiliki karakter pertumbuhan yang tidak berbeda signifikan ketika diuji pada spot test. Selain itu juga dikarenakan strain khamir ini hanya toleran terhadap freeze thaw stress dan stres oksidatif yang diinduksi oleh furfural (Sasanoet al.2012b, 2012c).
Gambar 5. Spot test 5 strain khamir yang berbeda [WT = khamir belum direkayasa, PRO1 = Pro1(I150T), MPR1 = Mpr1(K63R), PRO1-MPR1 = Pro1(I150T)/ Mpr1(K63R), MSN2-OP] pada media YPD kontrol, YPD yang mengandung 11%, 12%, 13%, dan 14% etanol.
jumlah level ekspresi antaran gen penyandi Msn2 dan Msn4. Menurutnya, faktor transkripsi Msn4 yang merupakan homolog dari Msn2 memiliki peran lebih tidak hanya sebagai perespon stres etanol. Namun bagaimana mekanisme molekuler mengenai toleransi terhadap etanolnya masih belum diketahui dengan baik hingga saat ini sekalipun sudah banyak kajian yang dilakukan untuk meneliti mengenai toleransi terhadap etanol (Ma & Liu dalam Liu 2012).
Tabel 1. Jumlah koloniSaccharomyces cerevisiaepadaspot test(sel/mL)
Perlakuan
*PRO1 = Pro1(I150T); MPR1 = Mpr1(K63R); PRO1-MPR1 = Pro1(I150T)/ Mpr1(K63R)
Pada konsentrasi etanol 14% seluruh strain tidak dapat tumbuh. Hanya saja ketika waktu inkubasi ditambah lebih lama beberapa hari koloni khamir mulai terlihat. Artinya pertumbuhan khamir jauh lebih terhambat pada konsentrasi 14%. Pada konsentrasi etanol 13%, seluruh strain khamir tumbuh (kecuali MSN2-OP). Strain khamir yang belum direkayasa telah mengalami penghambatan pertumbuhan yang dibuktikan dengan jumlah koloni yang tumbuh paling sedikit dibandingkan strain khamir terekayasa yang lain [Pro1(I150T), Mpr1(K63R), Pro1(I150T)/Mpr1(K63R)]. Oleh karena itu, ketiga strain khamir terekayasa diuji kembali kemampuannya dalam melakukan fermentasi dengan menentukan sejumlah parameter kinetikanya.
Uji Fermentasi dan Pengukuran Parameter Kinetika
17
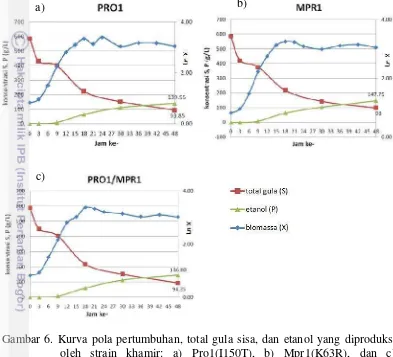
sebelum kultivasi yang terukur pada media fermentasi YPD+30% sukrosa adalah sebesar 58,67%. Nilainya hampir menyerupai total gula molase yaitu 62%. Hal tersebut dikarenakan total gula media YPD sendiri sudah mencapai 35,17%. Uji fermentasi dilakukan selama 48 jam dan menghasilkan data berupa kurva pola pertumbuhan, substrat yang dikonsumsi berupa data total gula sisa, dan jumlah etanol yang terbentuk dari setiap strain terekayasa terpilih pada jam tertentu (Gambar 6).
Gambar 6. Kurva pola pertumbuhan, total gula sisa, dan etanol yang diproduksi oleh strain khamir: a) Pro1(I150T), b) Mpr1(K63R), dan c) Pro1(I150T)/ Mpr1(K63R).
Seluruh strain khamir memiliki tipikal pola pertumbuhan, penggunaan substrat, dan produksi etanol yang relatif sama. Seluruh strain khamir memiliki 4 fase pertumbuhan pada titik-titik waktu yang relatif sama pula, diantaranya fase lag/awal pada jam 0-3 yang merupakan masa penyesuaian khamir sejak inokulum sel khamir diinokulasikan ke dalam media. Pada fase ini etanol yang terbentuk sangat kecil dan bahkan tidak ada penambahan jumlah sama sekali. Substrat yang tersedia pada media mulai mengalami penurunan yang artinya khamir mengkonsumsi gula untuk pertumbuhan dan untuk mensintesis enzim-enzim yang diperlukan sel untuk metabolisme (Mangunwijaya & Suryani 1994). Setelah fase lag selesai dilanjutkan dengan fase eksponensial/log dimana mulai terjadi reproduksi selular dan konsentrasi biomassa yang semakin lama semakin meningkat yaitu pada jam ke-3 hingga 15. Pada fase tersebut mulai terbentuk
) )
)
a) b)
c)
) )
)
etanol dengan jumlah yang cukup besar dan jumlah gula yang tersisa di dalam media semakin kecil.
Semakin banyak etanol yang terakumulasi di dalam media kultivasi menyebabkan sel khamir mulai mengalami penurunan laju pertumbuhan dan penghambatan pertumbuhan. Khamir memasuki fase perlambatan dan pada akhirnya mencapai titik konsentrasi biomassa terbesar/maksimal yang menandakan khamir memasuki fase stasioner. Fase perlambatan pada setiap strain relatif sama yaitu pada jam ke-15 hingga 18 yang kemudian dilanjutkan dengan fase stasioner hingga jam ke-48. Pada fase stasioner pertumbuhan sel berhenti yang ditandai dengan konstannya jumlah biomassa hingga waktu tertentu. Namun jumlah etanol yang diproduksi semakin meningkat hingga ±140 g/L pada jam ke-48. Hal tersebut dikarenakan jumlah gula yang tersedia pada media kultivasi masih sangat besar dan masih bisa dikonsumsi oleh khamir untuk diubah menjadi etanol dan juga karena tingginya toleransi khamir terhadap etanol dan gula tinggi, sehingga khamir masih dapat bertahan hidup untuk memproduksi etanol. Besarnya total gula yang tersisa pada setiap strain pada jam ke-48 menyebabkan khamir belum mengalami fase penurunan/kematian yang diakibatkan karena kekurangan nutrisi, sehingga ada kemungkinan khamir masih dapat meningkatkan jumlah etanol yang diproduksi jika waktu fermentasi ditambah. Untuk mengetahuinya perlu adanya pengujian dengan menambah waktu kultivasi.
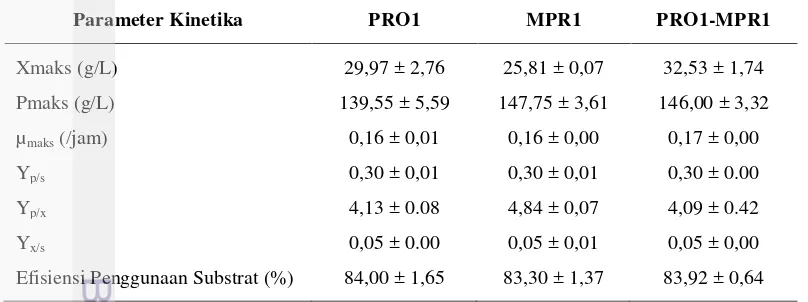
Berdasarkan kajian pola pertumbuhan mikroba tersebut dapat ditentukan parameter kinetika pertumbuhan, yaitu rendemen biomassa yang terbentuk per substrat yang dikonsumsi (Yx/s), rendemen produk yang terbentuk per substrat yang dikonsumsi (Yp/s), rendemen produk yang terbentuk per biomassa (Yp/x), laju pertumbuhan spesifik maksimal (µmaks), biomassa maksimal, etanol maksimal yang dihasilkan, dan persentase efisiensi penggunaan substrat. Nilai-nilai parameter kinetika tersebut dapat dilihat pada Tabel 2.
Tabel 2. Parameter kinetika strain khamir terekayasa pada uji fermentasi/kultivasi selama 48 jam
Efisiensi Penggunaan Substrat (%) 84,00 ± 1,65 83,30 ± 1,37 83,92 ± 0,64
*PRO1 = Pro1(I150T); MPR1 = Mpr1(K63R); PRO1-MPR1 = Pro1(I150T)/ Mpr1(K63R)
19
83,92±0,64%. Ketiga strain tersebut menggunakan substrat untuk membentuk biomassa dan etanol yang kemudian dihitung rendemen pembentukannya. Dari substrat yang digunakan, ketiga strain dapat menghasilkan biomassa per gram substrat (Yx/s) dengan nilai yang sama yaitu sebesar 0,05±0,00 g biomassa/g substrat untuk strain Pro1(I150T) dan Pro1(I150T)/Mpr1(K63R) dan sebesar 0,05±0,01 g biomassa/g substrat untuk strain Mpr1(K63R). Substrat juga digunakan untuk pembentukan produk berupa etanol dengan nilai rendemen etanol per gram substrat (Yp/s) sebesar 0,30±0,01 g etanol/g substrat untuk strain Pro1(I150T) dan Mpr1(K63R), dan sebesar 0,30±0,00 g etanol/g substrat untuk strain Pro1(I150T)/Mpr1(K63R).
Nilai rendemen etanol yang terbentuk per gram biomassa (Yp/x), menunjukkan bahwa strain Mpr1(K63R) menghasilkan etanol per gram biomassa yang paling besar dengan standar deviasi yang tidak berhimpit dengan strain lainnya. Hal tersebut menandakan bahwa setiap satu satuan biomassa, strain Mpr1(K63R) dapat menghasilkan etanol lebih besar dibanding strain yang lainnya yaitu sebesar 4,84±0,07 g etanol/g biomassa, sedangkan strain Pro1(I150T) dan Pro1(I150T)/Mpr1(K63R) menghasilkan Yp/x yang relatif sama yaitu sebesar 4,13±0.08 g etanol/g biomassa Pro1(I150T) dan 4,09±0.42 g etanol/g biomassa Pro1(I150T)/Mpr1(K63R).
Hasil penghitungan parameter kinetika juga menunjukkan bahwa ketiga strain khamir memiliki nilai laju pertumbuhan spesifik (µmaks) yang sama. Artinya setiap strain tumbuh dengan laju relatif yang sama yaitu sebesar 0,16±0,01 /jam. Hal tersebut ditunjang dengan nilai biomassa maksimal (Xmaks) dan etanol maksimal (Pmaks) yang juga tidak jauh berbeda dimana menunjukkan standar deviasi yang berhimpit walaupun nilai rata-rata setiap strain berbeda. Nilai biomassa maksimal strain Pro1(I150T), Mpr1(K63R), dan Pro1(I150T)/ Mpr1(K63R) berurutan adalah sebesar 29,97±2,76 g/L, 25,81±0,07 g/L, dan 32,53±1,74 g/L dengan nilai etanol yang dihasilkan sebesar 139,55±5,59 g/L, 147,75±3,61 g/L, dan 146,00±3,32 g/L atau setara dengan 13,96%, 14,78%, dan 14,6% (w/v) etanol dengan waktu fermentasi selama 48 jam.
Menurut Puligundha et al.(2011), kondisi fermentasi dapat menyebabkan stres hiperosmosis (fermentasi very high gravity) pada khamir yaitu pada media yang mengandung total gula lebih dari 300 g/L padatan terlarut yang berisi nutrisi lain seperti amino nitrogen bebas, yeast extract, sterol, dan lain-lainnya. Hasil penelitian Zhang et al. (2012) menunjukkan bahwa rendemen etanol maksimal yang dihasilkan pada fermentasi media yang mengandung gula 300 g/L oleh khamirSaccharomyces cerevisiae yang belum direkayasa dan diisolasi dari wine adalah sebesar 137 g/L pada jam ke-48 dengan jumlah glukosa akhir sebesar 4,71 g/L.
fermentasi terhadap media molase dengan nilai total gula yang lebih rendah yaitu sebesar 15 - 17% dan menggunakan khamir Ethanol Red mutan sebagai agen fermentasinya yang dilakukan selama 16 jam pada suhu 32 ± 2oC dapat menghasilkan rendemen etanol sebesar 8,8% (v/v) atau setara dengan 111,53 g/L. Penelitian lain yang juga menggunakan khamir Ethanol Red (Dziugan et al. 2013) pada fermentasi bioetanol selama 96 jam di dalam media thick sugar beet juice dengan kandungan ekstrak sebesar 250 g/kg dan ditambah dengan (NH4)2HPO4sebesar 0,3 g/L dapat menghasilkan rendemen etanol sebesar 14,2 ± 0,4% (v/v) atau setara dengan 112,04 ± 3,16 g/L.
Jayus et al. (2016) di dalam penelitiannya yang menggunakan khamir komersial lain dengan nama New Aule Alcohol Yeast terhadap fermentasi bioetanol selama 72 jam pada media molases yang diencerkan hingga mengandung gula pereduksi sebesar 300 g/L dengan penambahan (NH4)2HPO4 sebesar 100 ppm dapat menghasilkan bioetanol maksimal sebesar 74,80 g/L pada jam ke-48 dengan nilai Yp/s sebesar 0,378 g etanol/g substrat. Khamir komersial New Aule Alcohol Yeast merupakan khamir yang toleran terhadap suhu, konsentrasi asam, alkohol dan gula tinggi, yaitu toleran pada suhu 32 - 42oC, pH 2,5, kadar alkohol 13% dan kandungan glukosa sebesar 60%. Selain itu khamir ini memiliki kecepatan yang tinggi dalam menghasilkan etanol dengan sisa gula yang rendah dan menghasilkan rendemen yang tidak asam (non-acil yielding).
21
5 SIMPULAN
Simpulan
Berdasarkan hasil penelitian dapat disimpulkan bahwa seluruh strain khamir terekayasa [Pro1(I150T), Mpr1(K63R), dan Pro1(I150T)/Mpr1(K63R)] toleran dan dapat tumbuh pada media berkonsentrasi sukrosa tinggi hingga 70% dan etanol tinggi hingga 13%, kecuali strain MSN2-OP yang mengalami penghambatan tumbuh dan lebih sensitif terhadap konsentrasi sukrosa 70% dan etanol 11%. Pola kurva pertumbuhan ketiga strain terekayasa pilihan [Pro1(I150T), Mpr1(K63R), Pro1(I150T)/Mpr1(K63R)] tidak berbeda signifikan, begitu juga parameter kinetikanya. Namun untuk nilai rendemen etanol per gram biomassa (Yp/x), strain Mpr1(K63R) memberikan nilai yang paling besar diantara strain lainnya yaitu sebesar 4,84±0,07 g etanol/g biomassa. Ketiga strain terekayasa dapat digunakan untuk memperbaiki produktivitas etanol di industri dengan nilai rendemen etanol yang dihasilkan sebesar 139,55±5,59 g/L untuk strain Pro1(I150T), 147,75±3,61 g/L untuk strain Mpr1(K63R), dan 146,00±3,32 g/L untuk strain Pro1(I150T)/Mpr1(K63R). Perolehan ini lebih besar dari perolehan etanol pada proses konvensional di industri (6 – 12% v/v atau setara dengan 47,34–94,68 g/L).
Saran
DAFTAR PUSTAKA
Aslam A, Ikram-ul-haq, Ali S. 2013. Purification and characterization of two invertases from mutant strain of Saccharomyces cerevisiae. Pak J Bot. 45(1): 285-291.
Attfield PV. 1997. Stress tolerance: The key to effective strains of industrial
baker’s yeast. Nature Biotechnology. Vol 15: 1351-1357
Brocker C, Thompson DC, Vasiliou V. 2012. The role of hyperosmotic stress in inflammation and disease.Biomol Concepts. 3(4): 345-364.
Cardona F, Carrasco P, Perez-Ortin JE, del Olmo M, Aranda A. 2007. A novel approach for the improvement of stress resistance in wine yeasts. Int J Food Microbiol. 114(1): 83-91.
Causton HC, Ren B, Koh SS, Harbison CT, Kanin E, Jennings EG, Lee TL, True HL, Lander ES, Young RA. 2001. Remodelling of yeast genome expression in response to environmental changes. Mol Biol Cell. 12: 323-337.
Clontech Laboratories, Inc. 2009. Yeast Protocols Handbook. www.clontech.com/xxclt_ibcGetAttachment.jsp?cItemId=17602
Du X, Takagi H. 2005. N-acetyltransferase Mpr1 conferred freeze tolerance in Saccharomyces cerevisiae by reducing reactive oxygen species. J Biochem.138: 1343-1351. doi: 10.1093/jb/mvi134.
Du X, Takagi H. 2007. N-Acetyltransferase Mpr1 confers ethanol tolerance on Saccharomyces cerevisiae by reducing reactive oxygen species. Appl Microbiol Biotechnol.75: 1343-1351. doi: 10.1007/500253.007.0940-x. Dziugan P, Balcerek M, Pielech-Przybylska K, Patelski P. 2013. Evaluation of
the fermentation of high gravity thick sugar beet juice worts for efficient bioethanol production. 2013(6): 158.
Estruch F. 2000. Stress-controled transcription factors, stress-induced genes and stress tolerance in budding yeast.FEMS Microbiol Rev.24(4): 469-486. Gasch AP, Spellman PT, Kao CM, Carmel-Harel O, Eisen MB, Storz G, Botstein
D, Brown PO. 2000. Genomic expression programs in the response of yeast cells to environmental changes.Mol Biol Cell.12:323-337.
Gaudy AF, Abu-Niaaj F Jr., Gaudy ET. 1962. Statistical study of the spot-plate technique for viable-cell counts. Appl Microbiol. 11: 305-309.
Giannattasio S, Guaragnella N, Marra E. 2012. Molecular Mechanism of Programmed Cell Death Induced by Acetic Acid. In: Zonglin LL (ed). Microbial Stress Tolerance for Biofuels: Systems Biology. Germany: Springer.
Iinoya K, Kotani T, Sasano Y, Takagi H. 2009. Engineering of the yeast antioxidant enzyme Mpr1 for enhanced activity and stability. Biotechnology and Bioengineering. 103(2): 341-352. doi: 10.1002/bit.22247.
Jayus, Nurhayati, Mayzuhroh A, Arindhani S, Caroenchai C. 2016. Studies on
23
Agricultural Science Procedia. 9(2016): 493-499. doi: 10.1016/j.aaspro.2016.02.168.
Landolfo S, Politi H, Angelozzi D, Mannazzu I. 2008. ROS accumulation and oxidative damage to cell structures in Saccharomyces cerevisiae wine strains during fermentation of high-sugar-containing medium.Biochimica et Biophysica Acta. 1780: 892-898.
Ma M dan Liu ZL. 2012. Molecular Mechanism of Ethanol Tolerance in Saccharomyces cerevisiae. In: Zonglin LL (ed). Microbial Stress Tolerance for Biofuels: Systems Biology. Germany: Springer.
Mangunwijaya D dan Suryani A. 1994. Teknologi Bioproses. Penebar Swadaya: Jakarta
Matsuura K, Takagi H. 2005. Vacuolar functions are involved in stress-protective effect of intracellular proline in Saccharomyces cerevisiae. Journal of Bioscience and Bioengineering. 100: 538-544. doi: 10.1263/jbb.100.538. Mousdale DM. 2008. Biofuels: Biotechnology, Chemistry, and Sustainable
Development. USA: CRC Press.
Mukhtar K, Asgher M, Afghan S, Hussain K, Zia-ul-Hussnain S. 2010. Comparative study on two commercial strains of Saccharomyces cerevisiaefor optimum ethanol production on industrial scale. Journal of Biomedicine and Biotechnology. Vol 2010: 1-5. doi: 10.1155/2010/419586.
Nomura M dan Takagi H. 2004. Rofe of the yeast acetyltransferase Mpr1 in oxidative stress: Regulation of oxygen reactive species caused by a toxic proline catabolism intermediate. Proc Natl Acad Sci USA. 101(34): 12616-12621. doi: 10.1073/pnas.0403349101.
Olbrich H. 1963. The Molasses. Berlin: Biotechnologie-Kempe GmbH (2006). Pons A, Roca P, Aguilo C, Garcia FJ, Alemany M, Palou A. 1981. A method for
the simultaneous determination of total carbohydrate and glycerol in biological samples with the anthrone reagent.Journal of Biochemical and Biophysical Methods. 4: 227-231
Puligundla P, Smogrovicova D, Obulam VSR, Ko S. 2011. Very high gravity (VHG) ethanolic brewing and fermentation: a rsearch update. J Ind Microbiol Biotechnol.38: 1133-1144. doi: 10.1007/s100295-011-0999-3. Reed G, Nagodawithana TW. 1991. Yeast technology 2nd ed. New York: Van
Nostrand Reinhold.
Sasano Y, Takahashi S, Shima J, Takagi H. 2010. Antioxidant
N-acetyltransferase Mpr1/2 of industrial baker’s yeast enhances fermentation
ability after air drying stress in bread dough. Int Journal of Food Microbiology. 138: 181-185.
Sasano Y, Haitani Y, Ohtsu I, Shima J, Takagi H. 2012a. Proline accumulation in
baker’s yeast enhances high-sucrose stress tolerance and fermentation ability in sweet dough.International Journal of Food Microbiology. 152: 40-43. doi: 10.1016/j.ijfoodmicro.2011.10.004.
Sasano Y, Haitani Y, Hashida K, Ohtsu I. 2012b. Overexpression of the transcription activator Msn2 enhances the fermentation ability of
Sasano Y, Watanabe D, Ukibe K, Inai T, Ohtsu I, Shimoi H, Takagi H. 2012c. Overexpression of the yeast transcription activator Msn2 confers furfural resistance and increases the initial fermentation rate in ethanol production. Journal of Bioscience and Bioengineering. 113(4): 451-455. doi: 10.1016/j.jbiosc.2011.11.017.
Sasano Y, Haitani Y, Hashida K, Ohtsu I, Shima J, Takagi H. 2012d. Enhancment of the proline and nitric oxide synthetic pathway improves fermentation ability under multiple baking-associated stress conditions in
industrial baker’s yeast.Microbial Cell Factories. 11: 40.
Sekine T, Kawaguchi A, Hamano Y, Takagi H. 2007. Desensitization of feedback inhibition of the Saccharomyces cerevisiae γ-glutamyl kinase enhance proline accumulation and freezing tolerance. Appl Environ Microbiol. 73(12): 4011-4019. doi: 10.1128/AEM.00730-07.
Sherman F. Getting started with yeast.Methods Enzymol. 350: 3-41
Shima J, Hino A, Yamada-Iyo C, Suzuki Y, Nakajima R, Watanabe H, Mori K, Takano H. 1999. Stress tolerance in doughs of Saccharomyces cerevisiae
trehalase mutantas derived from commercial baker’s yeast. Appl Environ Microbiol. 65(7): 2841-2846
Shuler ML, Kargi F. 1992. Bioprocess Engineering Basic Concepts. New Jersey: Prentice-Hall, Inc.
Snoek T, Nicolino MP, Bremt SV, Mertens S, Saels V, Verplaetse A, Steensels J, Verstrepen KJ. 2015. Large-scale robot-assisted genome shuffling yields industrial Saccharomyces cerevisiae yeasts with increased ethanol tolerance. Biotechnology for Biofuels. (2015): 8-32. doi: 10.1186/s13068-015-0216-0.
Takagi H, Shichiri M, Takemura M, Mohri M, Nakamori S. 2000. Saccharomyces cerevisiae Σ1278b has novel genes of the N -Acetyltransferase gene superfamily required for L-proline analogue resistance.Journal of Bacteriology. 182(15): 4249-4256.
Takagi H, Takaoka M, Kawaguchi A, Kubo Y. 2005. Effect of L-proline in sake brewing and ethanol stress in Saccharomyces cerevisiae. Appl Environ Microbiol.71(12): 8656-8662. doi: 10.1128/AEM.71.12.8656-8662.2005. Takagi H, Matsui F, Kawaguchi A, Wu H, Shimoi H, Kubo Y. 2007.
Construction and analysis of self-cloning sake yeasts that accumulate proline.J. Biosci Bioeng.103(4): 377-380. doi: 10.1263/jbb.103.377. Takagi H. 2008. Proline as stress protectant in yeast: physiological function,
metabolic regulations, and biotechnological applications. Appl Microbiol Biotechnol. 81: 211-223. doi: 10.1007/s00253-008-1698-5.
Watanabe M, Watanabe D, Akao T, Shimoi H. 2009. Overexpression of MSN2 in a sake yeast strain promotes ethanol tolerance and increases ethanol production in sake brewing. J Biosci Bioeng. 107(5): 516-518. doi: 10.1016/j.jbiosc.2009.01.006.
25
LAMPIRAN
Lampiran 1 Diagram alir metode penelitian
TOLERANSIS. cerevisiaeTEREKAYASA TERHADAP STRESS HIPEROSMOSIS PADA MEDIA BERKONSENTRASI GULA TINGGI
UNTUK PRODUKSI BIOETANOL
Uji Toleransi dengan Spot Test Uji Fermentasi
27
Lampiran 2 Prosedur kerja spot test (Gaudy et al. 1962; Sherman 2002; Clontech Lab 2009)
1) Pembuatan media a. Pre-kultur
Media pre-kultur merupakan media YPD yang terdiri dari 2% glukosa, 1% yeast extract, dan 2% bacto peptone yang dicampur dengan air dan dihomogenisasi menggunakan magnetic stirrer di dalam labu Erlenmeyer atau di dalam media storage bottle untuk membuat stok media. Kemudian disterilisasi selama 15 menit dengan suhu 121oC dan disimpan pada suhu ruang dengan kondisi tertutup rapat dan jika ingin digunakan, pengambilan media dilakukan secara steril di dalamclean bench/laminar flow.
b. Agar YPD + 50% - 70% sukrosa
Dalam satu cawan petri, berisi kurang lebih sebanyak 25 ml media agar. Untuk membuat 25 ml media YPD + 50%, 60%, dan 75% sukrosa, maka yang dilakukan adalah membuat media YPD agar dan larutan sukrosa steril di dalam Erlenmeyer terpisah yang kemudian setelah hangat disatukan/dicampur dan dihomogenisasi dengan menggunakan magnetic stirrer dan dituang ke dalam cawan petri dan dibiarkan mengeras selama 15 menit dengan tutup terbuka, setelah mengeras dan uap panas hilang, cawan petri yang berisi media ditutup rapat. Proses pencampuran dan penuangan media dilakukan secara steril di dalam laminar flow. Berikut formulasi medianya.
• YPD + 50% sukrosa (25 ml)
o membuat 12,5 ml larutan media agar YPD dengan hitungan konsentrasi penyusunnya untuk 25 ml di dalam labu Erlenmeyer, terdiri
Dihomogenisasi dengan magnetic stirrer dan ditutup dengan aluminum foil yang selanjutnya disterilisasi 121oC, 15 menit. o membuat 12,5 ml larutan sukrosa 50% dengan
Menambahkan sebanyak 12,5 gram sukrosa dengan 12,5 ml air dan dihomogenisasi menggunakan magnetic stirrer. Selanjutnya ditutup dengan aluminum foil dan disterilisasi selama 15 menit pada suhu 121oC.
• YPD + 60% sukrosa (25 ml)
o membuat 12,5 ml larutan media agar YPD (cara dan formulasi sama seperti diatas)
o membuat 12,5 ml larutan sukrosa 60% dengan hitungan konsentrasi untuk 25 ml di dalam labu Erlenmeyer, dengan cara:
Menambahkan sebanyak 15 gram sukrosa dengan 12,5 ml air dan dihomogenisasi Menggunakan magnetic stirrer. Selanjutnya ditutup dengan aluminum foil dan disterilisasi selama 15 menit pada suhu 121oC.
• YPD + 70% sukrosa (25 ml)
o membuat 12,5 ml larutan media agar YPD (cara dan formulasi sama seperti diatas)
o membuat 12,5 ml larutan sukrosa 70% dengan hitungan konsentrasi untuk 25 ml di dalam labu Erlenmeyer, dengan cara:
Menambahkan sebanyak 17,5 gram sukrosa dengan 12,5 ml air dan dihomogenisasi menggunakan magnetic stirrer. Selanjutnya ditutup dengan aluminum foil dan disterilisasi selama 15 menit pada suhu 121oC.
c. YPD + 11% - 14% etanol agar
29
• YPD + 11% etanol (25 ml)
o membuat 22,75 ml larutan media agar YPD ditambah dengan 2,25 ml etanol setelah disterilisasi dan hangat. Formulasi YPD agar terdiri dari:
Dihomogenisasi dengan magnetic stirrer dan ditutup dengan aluminum foil yang selanjutnya disterilisasi 121oC, 15 menit.
• YPD + 12% etanol (25 ml)
o membuat 22 ml larutan media agar YPD ditambah dengan 3 ml etanol setelah
disterilisasi dan hangat. Formulasi YPD agar terdiri dari:
Dihomogenisasi dengan magnetic stirrer dan ditutup dengan aluminum foil yang selanjutnya disterilisasi 121oC, 15 menit.
• YPD + 13% etanol (25 ml)
o membuat 21,75 ml larutan media agar YPD ditambah dengan 3,25 ml etanol setelah disterilisasi dan hangat. Formulasi YPD agar terdiri dari:
Dihomogenisasi dengan magnetic stirrer dan ditutup dengan aluminum foil yang selanjutnya disterilisasi 121oC, 15 menit.
• YPD + 14% etanol (25 ml)
disterilisasi dan hangat. Formulasi YPD agar terdiri dari:
2% glukosa = 0,5 g 1%yeast extract= 0,25 g 2%bacto peptone= 0,5 g 2% agar = 0,5 g
21,5 ml air
Dihomogenisasi dengan magnetic stirrer dan ditutup dengan aluminum foil yang selanjutnya disterilisasi 121oC, 15 menit.
2) Pembuatan pre-kultur 5 strainS. cerevisiae
Masing-masing sebanyak 5 ml media pre-kultur (YPD steril) dimasukkan ke dalam 10 tabung reaksi berulir. Selanjutnya setiap strainS. cerevisiaediinokulasi ke dalam dua tabung reaksi (duplo dari koloni yang berbeda dalam satu strain) yang diambil dari media cawan agar dengan tip mikropipet 1 ml. Kemudian dihomogenisasi dengan vortex dan diinkubasi pada suhu 30oC pada rotary shaker dengan kecepatan kurang lebih 200 rpm selama 16 jam.
3) Pengukuran absorbansi pre-kultur
31
Lampiran 3 Prosedur kerja dan data pada uji fermentasi (Clontech Lab 2009; Zhanget al.2012)
1) Pembuatan media fermentasi YPD + 30% sukrosa
Fermentasi dilakukan untuk 3 strain khamir dan dilakukan secara duplo pada labu Erlenmeyer 500 ml. Masing-masing Erlenmeyer diisi dengan 350 ml media YPD+30% sukrosa. Media dibuat sebanyak 2100 ml di dalam satu Erlenmeyer besar kemudian disterilisasi dan selanjutnya dibagi ke dalam 6 labu Erlenmeyer 500 ml steril (disterilisasi dengan tutup kapas dan aluminium foil) di dalamlaminar flow. Media tersebut dibuat dari pencampuran 1050 ml YPD steril (42 g glukosa, 21 g yeast extract, 42 g pepton, dan 1050 ml akuades) dengan 1050 ml larutan sukrosa 30% steril (630 g sukrosa dengan 1050 ml akuades). Keenam Erlenmeyer yang berisi 350 ml media YPD+30% sukrosa steril ditutup kembali dengan kapas dan aluminium foil.
2) Pengukuran berat kering biomassa a. Metode pengukuran
Pengukuran biomassa dilakukan dengan mengukur nilai absorbansi sampel jam ke-0, 3, 6, 9, 12, 15, 18, 21, 24, 30, 36, 42, dan 48 pada panjang gelombang 600 nm. Pada jam ke-0 dilakukan pengenceran 2 kali (2 ml kultur ditambah 2 ml akuades steril), jam ke-3 dengan pengenceran 4 kali, jam ke-6 dengan pengenceran 20 kali. Pada jam ke-9 dengan pengenceran 40 kali, jam ke-12 & 15 dilakukan pengenceran 80 kali sedangkan jam ke-15 pengenceran 100 kali. Sampel jam ke 21, 24, 30, dan 36 diencerkan sebanyak 200 kali. Sedangkan jam ke-42 dan 48 dilakukan pengenceran sebanyak 100 kali. Nilai absorbansi/OD yang telah diketahui kemudian dikonversi ke dalam berat kering melalui persamaan garis dari kurva strandar antara OD600/absorbansi pada sumbu x dan berat kering pada sumbu y.
b. Metode pembuatan kurva standar berat kering biomassa
nilai berat falcon kosong sehingga diperoleh berat pellet kering dan dibuat grafik/kurvanya.
c. Kurva standar berat kering biomassa
d. Data pengukuran biomassa
• Pro1(I150T)
Pengenceran Jam
ke-PRO1
1 2
OD600 OD600xFP x (g/L) OD600 OD600xFP x (g/L) 2 0 0.1747 0.3494 2.28 0.1747 0.3493 2.28 4 3 0.3347 1.3388 2.64 0.3103 1.2413 2.60 20 6 0.3456 6.9114 4.66 0.3056 6.1116 4.37 40 9 0.5689 22.7556 10.39 0.4449 17.7972 8.60 80 12 0.4878 39.0216 16.28 0.5077 40.6120 16.86 80 15 0.6829 54.6328 21.94 0.7017 56.1360 22.48 100 18 0.6820 68.2020 26.85 0.7558 75.5780 29.52 100 21 0.5513 55.1280 22.12 0.6020 60.2000 23.95 100 24 0.7145 71.4460 28.02 0.8221 82.2140 31.92 100 30 0.5531 55.3060 22.18 0.4788 47.8780 19.49 100 36 0.6085 60.8470 24.19 0.5952 59.5220 23.71 100 42 0.5968 59.6810 23.76 0.6030 60.3000 23.99 100 48 0.5383 53.8320 21.65 0.5019 50.1940 20.33
• Mpr1(K63R)
Pengenceran Jam
ke-MPR1
1 2
33
80 15 0.6860 54.8824 22.03 0.7338 58.7024 23.41 100 18 0.6520 65.2020 25.76 0.6548 65.4760 25.86 100 21 0.7176 71.7620 28.14 0.5570 55.6960 22.32 100 24 0.5411 54.1060 21.75 0.5549 55.4930 22.29 100 30 0.3793 37.9270 15.89 0.6022 60.2240 23.96 100 36 0.5541 55.4080 22.22 0.5632 56.3230 22.55 100 42 0.5683 56.8300 22.73 0.5997 59.9690 23.87 100 48 0.5194 51.9440 20.96 0.5223 52.2250 21.06
• Pro1(I150T)/Mpr1(K63R)
Pengenceran Jam
ke-PRO1-MPR1
1 2
OD600 OD600xFP x (g/L) OD600 OD600xFP x (g/L) 2 0 0.1682 0.3365 2.28 0.1738 0.3476 2.28 4 3 0.3106 1.2423 2.60 0.2264 0.9054 2.48 20 6 0.3034 6.0676 4.35 0.3432 6.8638 4.64 40 9 0.4457 17.8292 8.61 0.4533 18.1316 8.72 80 12 0.5470 43.7624 18.00 0.4545 36.3624 15.32 80 15 0.6667 53.3352 21.47 0.6001 48.0064 19.54 100 18 0.6919 69.1880 27.21 0.8050 80.4970 31.30 100 21 0.8729 87.2940 33.76 0.5469 54.6860 21.96 100 24 0.5279 52.7870 21.27 0.7267 72.6710 28.47 100 30 0.6371 63.7080 25.22 0.5294 52.9420 21.32 100 36 0.5280 52.7950 21.27 0.4948 49.4750 20.07 100 42 0.5434 54.3430 21.83 0.5661 56.6110 22.65 100 48 0.5103 51.0320 20.63 0.5009 50.0930 20.29
3) Pengukuran Total Gula
a. Metode Pengukuran (Ponset al.1981)