LAPORAN PRAKTEK KERJA PROFESI
FARMASI INDUSTRI
di
Lembaga Farmasi Angkatan Udara (LAFI AU)
Drs. Roostyan Effendie, Apt.
Bandung
Disusun oleh:
Opa Meliawati, S.Farm. NIM 083202151
PROGRAM STUDI PENDIDIKAN PROFESI APOTEKER
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
Lembar Pengesahan
LAPORAN PRAKTEK KERJA PROFESI
FARMASI INDUSTRI
di
Lembaga Farmasi Angakatan Udara
Drs. Roostyan Effendie, Apt.
Laporan ini disusun untuk melengkapi salah satu syarat untuk memperoleh gelar Apoteker pada Fakultas Farmasi Universitas Sumatera Utara Medan
Disusun oleh:
Opa Meliawati, S.Farm. NIM 083202151
Lembaga Farmasi Angakatan Udara
Drs. Roostyan Effendie, Apt.
Pembimbing,
Drs. Akmal, M. Si., Apt. Letkol Kes NRP 527570
Mengetahui,
Kepala Lembaga Farmasi Dekan Fakultas Farmasi TNI Angakatan Udara Roostyan Effendie., Apt.
KATA PENGANTAR
Segala puji dan syukur penulis sampaikan kehadirat Allah SWT yang telah
melimpahkan Rahmat dan Karunia-Nya, sehingga dapat menyelesaikan kegiatan
Praktik Kerja Profesi Apoteker di Lembaga Farmasi Angkatan Udara Drs.
ROOSTYAN EFFENDIE, Apt Bandung dan menyelesaikan penyusunan laporan
ini dengan baik.
Pelaksanaan Praktek Kerja Profesi Apoteker (PKPA) di Lafiau ini
berlangsung mulai tanggal 03 Agustus sampai 28 Agustus 2009. PKPA ini untuk
memenuhi salah satu syarat guna mencapai gelar Apoteker di Fakultas Farmasi
Universitas Sumatera Utara. PKPA ini dilaksanakan untuk meningkatkan
pemahaman tentang aspek industri farmasi bagi mahasiswa profesi Apoteker
sehingga setelah lulus dan menjadi Apoteker mempunyai kompetensi yang
mampu bersaing di dunia kerja.
Kami menyadari bahwa pelaksanaan PKPA sampai penyusunan laporan
ini dapat terlaksana dengan lancar berkat kerja sama, bantuan, pengarahan dan
dukungan dari berbagai pihak baik secara langsung maupun tidak langsung. Oleh
karena itu pada kesempatan ini kami ingin menyampaikan terima kasih kepada:
1. Bapak Kolonel Kes Drs. Purwanto Budi T,M.M., Apt., selaku Kepala
Lembaga Farmasi Angkatan Udara Lanud Husein Sastranegara, Bandung yang
telah memberikan kesempatan kepada kami untuk melakukan Praktek Kerja
2. Bapak Letkol Kes Drs. Akmal, M.Si., Apt., selaku pembimbing dari lembaga
Farmasi Angkatan Udara Lanud Husein Sastranegara.
3. Bapak Prof. Dr. Sumadio Hadisahputra, Apt., selaku Dekan Program
Pendidikan Profesi Apoteker Fakultas Farmasi Universitas Sumatera Utara.
4. Bapak Drs. Wiryanto, M.S., Apt., selaku Ketua Program Pendidikan Profesi
Apoteker Fakultas Farmasi Universitas Sumatera Utara.
5. Segenap Apoteker, staf dan karyawan Lembaga Farmasi Angkatan Udara yang
telah banyak memberikan bimbingan dan masukan selama Praktek Kerja
Profesi Apoteker (PKPA) di Lembaga Farmasi Angkatan Udara.
6. Segenap dosen, karyawan dan pengelolah Program Profesi Apoteker Fakultas
Farmasi Universitas Sumatera Utara.
7. Orang tua serta saudara kami tercinta atas dukungan dan do’a yang telah
diberikan kepada kami.
8. Semua pihak yang tidak dapat kami sebutkan satu per satu atas bantuan dan
dukungan yang diberikan, baik secara langsung maupun tidak langsung.
Semoga Allah SWT selalu membalas semua bantuan yang telah diberikan
kepada kami. Kami sadar bahwa laporan ini masih jauh dari sempurna
dikarenakan keterbatasan pengetahuan dan pengalaman dari kami. Oleh karena itu
kami sangat mengharapkan adanya kritik dan saran yang membangun dari semua
pihak. Dengan segala kerendahan hati, semoga laporan ini dapat bermanfaat bagi
almamater dan mahasiswa seprofesi serta sejawat.
Penulis
DAFTAR ISI
Halaman
HALAMAN JUDUL
LEMBAR PENGESAHAN ... ii
KATA PENGANTAR... iii
DAFTAR ISI... v
DAFTAR LAMPIRAN ... viii
RINGKASAN………. ix
BAB I PENDAHULUAN... 1
1.1 Latar Belakang ... 1
1.2 Tujuan Praktik Kerja Profesi ... 2
BAB II TINJAUAN PUSTAKA... 4
2.1 Pengertian Industri Farmasi ... 4
2.2 Persyaratan Industri Framasi... 5
2.3 Pencabutan Izin Usaha Industri Farmasi... 5
2.4.1 Sistem Manajemen Mutu ... 7
2.4.2 Personalia ... 7
2.4.3 Bangunan ... 8
2.4.4 Peralatan... 10
2.4.5 Sanitasi dan Higiene... 10
2.4.6 Produksi ... 11
2.4.7 Pengawasan Mutu ... 14
2.4.8 Inspeksi Diri dan Audit Mutu ... 14
2.4.9 Penanganan Keluhan Terhadap Obat, Penarikan Kembali Obat dan Obat Kembalian ... 14
2.4.10 Dokumentasi ... 15
2.4.11 Pembuatan dan Analisa Berdasarkan Kontrak... 15
2.4.12 Kualifikasi dan Validasi... 15
2.5. Pengolahan Limbah ... 16
BAB III TINJAUAN UMUM LEMBAGA FARMASI ANGKATAN UDARA ... 17
3.2 Visi, Misi, dan Tujuan Lembaga Farmasi
Angkatan Udara ... 17
3.2.1 Visi dari Lafiau ... 17
3.2.2 Misi dari Lafiau... 18
3.3.3 Tujuan dari Lafiau... 18
3.3 Susunan Organisasi ... 18
3.4 Sarana dan Fasilitas Produksi ... 19
3.4.1 Bangunan ... 19
3.4.2 Sarana Gudang ... 19
BAB IV KEGIATAN LEMBAGA FARMASI TNI AU ... 20
4.1 Pengelolaan Pembekalan Kesehatan ... 20
4.2 Bagian Gudang Pusat Farmasi ... 20
4.3 Bagian Produksi ... 22
4.3.1 Tata Letak dan Klasifikasi Ruang Produksi... 22
43.2 Produksi Obat... 23
4.3.3 Unit Pemeriksaan In Process Control dan Pengujian Obat Jadi ... 25
4.3.5 Pengujian Sampel Pertinggal ... 27
4.4 Bagian Pengujian dan Pengembangan ... 28
4.5 Sanitasi dan Higiene... 28
4.6 Produk ... 30
BAB V PEMBAHASAN ... 31
BAB VI KESIMPULAN DAN SARAN... 38
4.1 Kesimpulan ... 38
4.2 Saran... 39
DAFTAR LAMPIRAN
Lampiran Halaman
Struktur Organisasi Lafiau ... 41
Denah Pengolahan Limbah ... 42
Alur Kegiatan Produksi... 43
Alur Produksi Tablet ... 44
Alur Produksi Kapsul... 45
Alur Produksi Sirup ... 46
Alur Produksi Salep/Krim... 47
RINGKASAN
Penulis melakukan Praktek Kerja Profesi (PKP) di Lembaga Farmasi
Angkatan Udara (LAFIAU) Drs. Roostyan Effendie, Apt., Bandung pada tanggal
03 agustus sampai 28 agustus 2009.
Tujuan dilaksanakan Praktek Kerja Profesi di Lembaga Farmasi Angkatan
Udara adalah agar mahasiswa mampu mengelola dan memahami permasalahan
industri secara profesional sesuai dengan peraturan perundangan yang berlaku,
dan PKP ini dilaksanakan untuk meningkatkan pemahaman tentang aspek industri
farmasi bagi mahasiswa Profesi Apoteker sehingga setelah lulus dan menjadi
apoteker mempunyai kompetensi yang mampu bersaing di dunia kerja.
RINGKASAN
Penulis melakukan Praktek Kerja Profesi (PKP) di Lembaga Farmasi
Angkatan Udara (LAFIAU) Drs. Roostyan Effendie, Apt., Bandung pada tanggal
03 agustus sampai 28 agustus 2009.
Tujuan dilaksanakan Praktek Kerja Profesi di Lembaga Farmasi Angkatan
Udara adalah agar mahasiswa mampu mengelola dan memahami permasalahan
industri secara profesional sesuai dengan peraturan perundangan yang berlaku,
dan PKP ini dilaksanakan untuk meningkatkan pemahaman tentang aspek industri
farmasi bagi mahasiswa Profesi Apoteker sehingga setelah lulus dan menjadi
apoteker mempunyai kompetensi yang mampu bersaing di dunia kerja.
BAB I
PENDAHULUAN
1.1 Latar Belakang
Perubahan konsep pelayanan kesehatan dari mengatasi faktor penyebab
penyakit menjadi konsep peningkatan derajat hidup masyarakat, mendorong
farmasis untuk mengubah konsep dari product oriented menjadi patient oriented.
Untuk mencapai pelayanan kesehatan yang optimal harus didukung oleh seluruh
aspek pelayanan kesehatan baik tenaga kesehatan, sarana kesehatan, pembekalan
farmasi, pembiayaan kesehatan, pengolahan, penelitian dan pengembangan
kesehatan. Dalam hal ini obat memegang peranan penting, karena itu harus
diperhatikan dengan seksama mulai dari aktivitas di industri farmasi yang
memproduksi dan mendistribusikan obat-obatan berkualitas tinggi, berkhasiat,
aman dalam jumlah yang dapat memenuhi kebutuhan masyarakat dan terjangkau
secara ekonomi.
Ketergantungan suatu negara terhadap pemenuhan kebutuhan kesehatan
militer sangat berisiko tinggi, terutama karena tersedianya obat-obatan yang
didatangkan dari pihak lain. Hal ini semakin tidak menguntungkan bagi Tentara
Nasional Indonesia (TNI) karena tingkat mobilitas dan tuntutan kesigapan yang
tinggi dalam menghadapi segala macam kemungkinan yang dapat memperbesar
merupakan hal yang tidak dapat ditawar lagi dalam suatu negara. Kualitas
kesehatan prajurit dapat dipertahankan pada tingkat kemampuan tertentu untuk
menambah kemampuan pertahanan dan perlawanan suatu negara dalam menjaga
kedaulatan yang lebih baik. Manfaat lain dari kemandirian kesehatan sektor
militer yaitu semakin meningkatnya kemampuan teknologi kesehatan khususnya
dibidang produksi obat-obatan.
Untuk mewujudkan hal tersebut maka perlu didukung oleh tenaga-tenaga
farmasis yang profesional dan memiliki kualifikasi yang tinggi. Agar diperoleh
tenaga farmasi yang berkualitas di industri farmasi maka seorang Apoteker perlu
memahami konsep CPOB baik secara teoritis maupun praktek di lapangan.
Industri farmasi merupakan tempat pengabdian profesi Apoteker yang akan lebih
menuntut profesionalisme dan kreativitas sebagai penanggung jawab maupun
pelaksana kegiatan industri untuk menghasilkan obat bermutu dan aman.
Yang dimaksud dengan “Cara Pembuatan yang Baik” adalah petunjuk
yang menyangkut segala aspek dalam produksi dan pengendalian mutu meliputi
seluruh rangkaian pembuatan obat yang bertujuan untuk menjamin agar produk
obat yang dihasilkan memenuhi persyaratan mutu yang telah ditetapkan sesuai
dengan tujuan penggunaannya.
Sehubungan dengan hal tersebut, Fakultas Farmasi Universitas Sumatera
Utara telah mengadakan kerja sama dengan beberapa industri farmasi, yang
memberikan kesempatan kepada para calon Apoteker untuk melaksanakan praktik
kerja profesi di indutri farmasi sehingga diharapkan seorang calon Apoteker
mempunyai pengalaman dan pengetahuan agar mengetahui secara pasti tugas dan
1.2 Tujuan Praktek Kerja Profesi
Tujuan Praktik Kerja Profesi mahasiswa Program Profesi Apoteker di
Lembaga Farmasi Angkatan Udara di Bandung adalah :
1. Mahasiswa dapat memahami fungsi dan peran farmasis/apoteker di industri
farmasi baik manajerial maupun penerapan CPOB dalam industri farmasi.
2. Memahami dan menguasai aspek-aspek yang ada di industri farmasi sehingga
benar-benar mempunyai kompetensi ketika harus terjun secara nyata ke dunia
kerja di industri farmasi.
3. Mempelajari dan memahami pengelolaan industri farmasi yang dilakukan
dengan baik dan profesional serta mengetahui peran dan fungsi apoteker di
industri farmasi sebagai penanggung jawab produksi, pengawasan mutu dan
BAB II
TINJAUAN PUSTAKA
2.1 Pengertian Industri Farmasi.
Industri farmasi menurut Surat Keputusan Menteri Kesehatan Nomor.
245/Menkes/V/1990 adalah industri obat jadi dan industri bahan baku obat.
Industri obat jadi adalah industri yang menghasilkan suatu produk yang telah
melalui seluruh tahap proses pembuatan. Obat jadi tersebut dapat berupa sediaan
atau paduan bahan-bahan yang siap digunakan untuk mempengaruhi atau
menyelidiki sistem fisiologi atau patologi dalam rangka penetapan diagnosis,
pencegahan, penyembuhan, pemulihan, peningkatan kesehatan, dan kontrasepsi.
Sedangkan industri bahan baku adalah bahan baku yang diproduksi oleh suatu
industri, dimana bahan baku tersebut adalah semua bahan baik yang berkhasiat
maupun tidak berkhasiat, yang digunakan dalam proses pengolahan obat.
Industri farmasi dibagi dalam dua kelompok yaitu industri padat modal
dan industri padat karya. industri padat modal adalah industri yang menggunakan
mesin-mesin produksi dalam jumlah yang lebih besar dari pada jumlah tenaga
kerjanya, sedangkan industri padat karya lebih banyak menggunakan tenaga
manusia dari pada tenaga mesin.
Obat adalah bahan atau campuran bahan-bahan baik yang berasal dari
penyakit atau gejala-gejalanya, memulihkan kesehatan baik pada manusia ataupun
hewan. Obat dikatakan bermutu bila memenuhi persyaratan aman, berkhasiat
tinggi dan dapat diterima masyarakat.
2.2 Persyaratan Industri Farmasi
Berdasarkan surat keputusan Menteri Kesehatan Republik Indonesia
Nomor. 245/MENKES/SK/V/1990, persyaratan industri farmasi adalah :
1. Didirikan oleh perusahaan umum (Perum), Badan Hukum berbentuk Perseroan
Terbatas (PT) dan Koperasi.
2. Memiliki rencana investasi.
3. Memiliki Nomor Pokok Wajib Pajak (NPWP).
4. Memenuhi persyaratan Cara Pembuatan Obat yang Baik (CPOB) sesuai SK
MenKes RI No. 43/MENKES/SK/II/1988.
5. Memperkerjakan sekurang-kurangnya dua orang Apoteker WNI,
masing-masing sebagai penanggung jawab pengawasan mutu dan pengawasan
produksi.
6. Obat jadi yang diproduksi hanya boleh diedarkan setelah mendapat
persetujuan sesuai dengan ketentuan perundang-undangan yang berlaku.
Izin usaha industri farmasi diberikan oleh Menteri Kesehatan dan
wewenang pemberian izin dilimpahkan oleh Badan Pengawasan Obat dan
Makanan (Badan POM). Izin ini berlaku seterusnya selama perusahaan industri
farmasi tersebut masih berproduksi. Sedangkan untuk industri farmasi yang
modalnya berasal dari Penanaman Modal Asing (PMA), izin masa berlakunya
sesuai dengan ketentuan dalam UU No. 1 tahun 1967 tentang Penanaman Modal
2.3 Pencabutan Izin Usaha Industri Farmasi
Pencabutan izin usaha industri farmasi dilakukan apabila industri yang
bersangkutan melakukan pelanggaran :
1. Melakukan pemindahtanganan hak milik ijin usaha industri farmasi dan
perluasan tanpa ijin.
2. Tidak menyampaikan informasi industri secara berturut-turut 3 kali atau
dengan sengaja menyampaikan informasi yang tidak benar.
3. Melakukan pemindahan lokasi usaha industri farmasi tanpa persetujuan tertulis
terlebih dahulu dari Menteri Kesehatan Republik Indonesia.
4. Dengan sengaja memproduksi obat jadi atau bahan baku yang tidak memenuhi
persyaratan dan ketentuan yang berlaku (obat palsu).
5. Tidak memenuhi ketentuan dalam ijin usaha industri farmasi.
2.4 Pembuatan Obat Yang Baik
Industri farmasi merupakan industri yang menghasilkan/memproduksi
obat yang aman dan berkualitas. Untuk menjamin mutu obat yang berkualitas,
maka industri farmasi melakukan seluruh aspek rangkaian kegiatan produksinya
dengan menerapkan Cara Pembuatan Obat yang Baik (CPOB).
CPOB dilakukan secara menyeluruh dan terpadu dengan mengadakan
pengawasan baik sebelum, selama, dan sesudah proses produksi berlangsung
untuk memastikan mutu produk obat agar memenuhi standart yang telah
ditetapkan. Jadi CPOB adalah suatu konsep yang ditetapkan dalam industri
farmasi mengenai langkah-langkah atau prosedur yang dilakukan dalam suatu
“Good Manufacturing Practices” dalam seluruh aspek dan rangkaian kegiatan
produksi, sehingga obat yang dihasilkan senantiasa memenuhi persyaratan mutu
yang ditentukan sesuai dengan tujuan penggunaannya.
2.4.1 Sistem Manajemen Mutu
Cara Pembuatan Obat yang Baik (CPOB) menyangkut seluruh aspek
produksi dan pengendalian mutu, bertujuan untuk menjamin bahwa produk obat
yang dibuat senantiasa memenuhi persyaratan mutu yang telah disesuaikan
dengan tujuan penggunaannya.
Dalam ketentuan umum, ada beberapa landasan yang penting untuk
diperhatikan yaitu :
a. Pengawasan menyeluruh pada proses pembuatan obat untuk menjamin bahwa
konsumen menerima obat yang bermutu tinggi.
b. Mutu obat tergantung pada bahan awal, proses pembuatan dan pengawasan
mutu, bangunan, peralatan yang digunakan, dan personalia.
c. Untuk menjamin mutu suatu obat jadi tidak boleh hanya mengandalkan pada
suatu pengujian tertentu saja, melainkan semua obat hendaknya dibuat dalam
kondisi terkendali dan terpadu dengan cermat.
2.4.2 Personalia
Personalia karyawan semua tingkatan harus memiliki pengetahuan,
ketrampilan dan kemampuan sesuai tugasnya. Karyawan memiliki kesehatan
mental dan fisik yang baik sehingga mampu melaksanakan tugasnya secara
professional dan sebagaimana mestinya. Karyawan mempunyai sikap dan
Manajer produksi seorang Apoteker yang cakap, terlatih dan memiliki
pengalaman praktis yang memadai dibidang industri farmasi dan keterampilan
dalam kepemimpinan sehingga memungkinkan melaksanakan tugas secara
profesional. Manajer produksi memiliki wewenang dan tanggung jawab khusus
penuh untuk mengelola produksi obat.
Manajer pengawasan mutu seorang Apoteker yang cakap, terlatih, dan
memiliki pengalaman praktis yang memadai untuk memungkinkan melaksanakan
tugasnya secara professional. Manajer pengawasan mutu diberi wewenang dan
tanggung jawab penuh dalam seluruh tugas pengawasan mutu yang dalam
penyusunan, verifikasi dan pelaksanaan seluruh prosedur pengawasan mutu.
Manajer pengawasan mutu adalah satu-satunya yang memiliki wewenang untuk
meluluskan bahan awal, produk antara, produk ruahan dan obat jadi bila produk
tersebut sesuai dengan spesifikasinya, atau menolaknya bila tidak cocok dengan
spesifikasinya, atau bila tidak dibuat sesuai dengan prosedur yang disetujui dan
kondisi yang ditentukan.
Manajer produksi dan pengawasan mutu bersama-sama bertanggung jawab
dalam penyusunan dan pengesahan prosedur-prosedur tertulis, pemantauan dan
pengawasan lingkungan pembuatan obat, kebersihan pabrik dan validasi proses
produksi, kalibrasi alat-alat pengukur, latihan personalia, pemberian persetujuan
dan dalam penyimpanan catatan.
2.4.3 Bangunan
Bangunan untuk pembuatan obat memiliki ukuran, rancang bangun,
konstruksi, serta letak yang memadai agar memudahkan dalam pelaksanaan kerja,
hendaknya memadai, sehingga setiap resiko terjadinya kekeliruan, pencemaran
silang dan berbagai kesalahan lain yang dapat menurunkan mutu obat dapat
dihindari.
Bangunan hendaknya mendapat penerangan dan ventilasi yang efektif
dengan fasilitas pengontrolan udara (suhu, kelembaban, filtrasi) sesuai dengan
kegiatan diluar dan didalam. Daerah penyimpan hendaknya dirancang, ditata dan
mempunyai kapasitas yang cukup sehingga memungkinkan pemisahan yang
teratur dari berbagai kelompok bahan yang disimpan serta memudahkan
perputaran sediaan.
Penentuan rancangan bangunan dan penataan gedung dipertimbangkan
kesesuaiannya dengan kegiatan lain untuk menjamin mutu obat dan kelangsungan
produksi. Untuk itu daerah pabrik dibagi atas tiga zona :
a. Zona hitam
Zona yang bebas dimasuki sembarang petugas. Pada zona ini dilakukan
pekerjaan-pekerjaan yang tidak memerlukan penjagaan ketat terhadap
kontaminasi dari udara luar.
b. Zona abu-abu
Zona tempat proses produksi non steril berlangsung. Pada zona ini kebebasan
karyawan dan barang yang memasuki ruangan dikurangi. Untuk memasuki
daerah ini karyawan terlebih dahulu harus mencuci tangan dan memakai
pakaian khusus yang bersih. Barang yang memasuki daerah ini harus diganti
kemasannya dengan kemasan khusus.
Zona produksi aseptis, seperti pembuatan sediaan injeksi dan salep mata.
Untuk memasuki daerah ini kaaryawan harus mencuci tangan dan memakai
pakaian khusus yang steril. Semua peralatan yang dipakai harus disterilkan
terlebih dahulu, begitu juga ruangannya.
2.4.4 Peralatan
Peralatan yang digunakan dalam pembuatan obat hendaklah memiliki
rancang bangun, dan konstruksi yang tepat, ukuran yang memadai serta
ditempatkan dengan tepat sehingga mutu yang dirancang bagi tiap produk obat
terjamin secara seragam dari batch ke batch dan untuk memudahkan pembersihan
dan perawatannya.
2.4.5 Sanitasi dan Higiene
Tingkat sanitasi dan higiene yang tinggi hendaklah diterapkan pada setiap
pembuatan obat. Ruang lingkup sanitasi dan higiene meliputi semua sumber
pencemaran produk seperti personalia, bangunan, peralatan, bahan awal serta
wadahnya. Sumber pencemaran hendaklah dihilangkan melalui program sanitasi
dan higiene yang menyeluruh dan terpadu.
1. Personalia
Seluruh karyawan hendaknya menjalani pemeriksaan kesehatan baik sebelum
maupun setelah diterima sebagai karyawan selama bekerja. Higiene
perorangan harus dilatih dan diterapkan semua karyawan yang berhubungan
dalam proses produksi.
2. Bangunan
Bangunan yang digunakan untuk pembuatan obat hendaknya dirancang dan
Bangunan hendaknya dilengkapi fasilitas sanitasi yang memadai seperti toilet,
loker, bak cuci, tempat penyimpan bahan pembersih, insektisida, dan bahan
fungigasi.
3. Peralatan
Setelah digunakan, peralatan hendaklah dibersihkan bagian luar maupun
bagian dalam sesuai prosedur yang telah ditetapkan, serta dijaga dan disimpan
dalam kondisi bersih. Sebelum dipakai, kebersihannya diperiksa lagi untuk
memastikan bahwa seluruh produk atau bahan dari batch sebelumnya telah
dihilangkan. Prosedur ini dirancang dengan tepat agar pencemaran peralatan
oleh bahan pembersih dan sanitasi dapat dicegah.
2.4.6 Produksi
Beberapa hal yang harus diperhatikan dalam kegiatan produksi adalah
sebagai berikut :
a. Bahan awal
Bahan awal sebelum dinyatakan lulus untuk digunakan hendaklah memenuhi
spesifikasi yang sudah ditetapkan dan diberi label dengan nama yang
dinyatakan dalam spesifikasi. Semua pemasukan, pengeluaran, dan sisa bahan
hendaknya dicatat.
b. Validasi proses
Luas serta tingkat validasi yang dilakukan tergantung dari sifat dan kerumitan
produk dan proses yang bersangkuatan. Program dan dokumentasi validasi
hendaklah membuktikan kecocokan bahan yang dipakai, keandalan peralatan
c. Sistem penomoran batch dan lots
Sistem penomoran batch adalah suatu sistem yang menjabarkan cara
penomoran batch dan lot secara rinci yang diperlukan untuk memastikan
bahwa produk antara, produk ruahan atau obat jadi suatu batch atau lot dapat
dikenali dengan nomor batch atau lot tertentu.
d. Pengembalian
Bahan baku, bahan pengemas, produk antara, dan produk ruahan yang
dikembalikan ke tempat penyimpanan hendaklah didokumentasikan dan
dirujuk sesuai dengan prosedur. Bahan baku, bahan pengemas, produk antara,
dan produk ruahan tidak boleh dikembalikan ke gudang, kecuali bila tidak
memenuhi spesifikasi yang ditetapkan.
e. Pengolahan
Bahan yang dipakai dalam pengolahan hendaklah diperiksa terlebih dahulu
sebelum digunakan. Sebelum pengolahan dimulai hendaknya ditempuh
langkah yang menjamin bahwa daerah pengolahan dan peralatan bebas dari
bahan, produk atau dokumen yang diperlukan untuk pengolahan yang
bersangkutan.
1. Bahan dan produk kering.
Dalam pengolahan bahan dan produk kering, masalah utamanya adalah
pengendalian debu dan kontaminasi silang. Untuk mengatasinya
diperlukan perhatian khusus dalam rancang bangun, pemeliharaan serta
penggunaan sarana dan peralatan.
2. Pencampuraaan dan granulasi.
sistem pengendalian debu, kecuali bila bekerja dengan sistem tertutup.
Pembuatan, penggunaan larutan dan suspensi dilakukan sedemikian rupa
sehingga resiko pencemaran atau pertumbuhan mikroba dapat dicegah.
3. Pencetakan tablet.
Mesin pencetak tablet dilengkapi dengan fasilitas pengendalian debu yang
efektif dan ditempatkan sedemikian rupa untuk menghindari campur aduk
antar produk, tiap mesin ditempatkan dalam ruang terpisah kecuali mesin
tersebut membuat produk yang sama.
4. Penyalutan.
Larutan penyalut dibuat dan digunakan dengan cara yang dapat menekan
seminimal mungkin resiko pertumbuhan mikroba.
5. Pengisian kapsul keras.
Kapsul kosong diangkat dan diperlakukan sebagai bahan awal. Kapsul
kosong ini harus disimpan dalam yang dapat mencegahnya menjadi
kering, regas atau terkena pengaruh kelembaban.
6. Pemberian tanda tablet bersalut atau kapsul.
Tindakan khusus diberikan untuk menghindari campur baur produk
selama proses pemberian tanda pada tablet bersalut atau kapsul. Apabila
pada saat yang sama dilakukan pemberian tanda pada produk yang
berbeda, atau pada batch yang berbeda, pengerjaannya harus dipisahkan.
7. Cairan krim dan salep (non steril).
Produk berupa cairan, krim dan salep seharusnya dibuat sedemikian rupa
agar produk terlindung dari pencemaran mikroba dan pencemaran lain.
Kualitas kimiawi dan mikrobiologi air yang digunakan harus ditetapkan
dan selalu dipantau.
8. Pengemasan
Kegiatan pengemasan berfungsi membagi dan mengemas produk ruahan
menjadi obat jadi. Proses pengemasan hendaknya dilaksanakan dibawah
pengawasan ketat untuk menjaga identitas, keutuhan, dan kualitas barang
yang sudah dikemas.
2.4.7 Pengawasan Mutu
a. Pengawasan mutu adalah bagian yang esensial dari cara pembuatan obat yang
baik untuk memastikan tiap obat yang dibuat senantiasa memenuhi persyaratan
mutu yang sesuai. Pengendalian mutu obat dilaksanakan melalui sistem
pengawasan yang terencana dan terpadu. Pengawasan mutu ini penting dalam
hal penetapan spesifikasi, pengambilan contoh dan pengujian beserta
dokumentasi dan prosedur pelulusan yang menjamin bahwa pengujian yang
diperlukan benar-benar dilaksanakan, serta pelulusan bahan dan produk untuk
dijual tidak akan diberikan sebelum mutunya dinilai memuaskan.
Bagian pengawasan mutu ini memiliki wewenang khusus untuk
memberikan keputusan akhir meluluskan atau menolak atas mutu bahan baku atau
produk obat ataupun hal lain yang mempengaruhi mutu obat.
2.4.8 Inspeksi Diri dan Audit Mutu
Tujuan dari inspeksi diri melakukan penilaian apakah seluruh aspek
produksi dan pengendalian mutu selalu memenuhi CPOB. Program inspeksi diri
menetapkan tindakan perbaikan. Sehingga dibentuk suatu tim yang cakap dan
mampu menilai secara obyektif pelaksanaan CPOB, melaksanakan inspeksi
terhadap prosedur produksi dan pengawasan mutu secara menyeluruh. Prosedur
pelaksanaan dan catatan mengenai inspeksi diri perlu di dokumentasikan.
2.4.9 Dokumentasi
Sistem dokumentasi merupakan bagian dari sistem informasi manajemen
yang harus disiapkan dalam kegiatan pembuatan obat. Dokumen berisi informasi
lengkap mengenai batch yang sedang dibuat, mulai dari awal sampai obat jadi,
sehingga bila terjadi sesuatu pada batch tersebut dapat dilihat dari dokumennya.
2.4.10 Pembuatan dan Analisis Berdasarkan Kontrak
Prinsip pembuatan dan analisis berdasarkan kontrak harus dibuat secara
benar, disetujui, dan dikendalikan untuk menghindari kesalah pahaman yang dapat
menyebabkan produk atau pekerjaan dengan mutu yang tidak memuaskan.
2.4.11 Kualifikasi dan Validasi
Validasi merupakan tindakan pembuktian dengan cara yang sesuai bahwa
setiap bahan, proses, prosedur, kegiatan, pelaksanaan atau mekanisme yang
digunakan dalam proses produksi dan pengemasan akan senantiasa mencapai hasil
yang diinginkan.
Macam-macam validasi adalah sebagai berikut :
a. Validasi prospektif, berdasarkan protokol validasi yang dirancang sebelumnya
sebelum produk dipasarkan.
b. Validasi kongkruen, berdasarkan data yang diperoleh selama proses terkini
produksi rutin.
d. Revalidasi, berdasarkan kajian data pengulangan validasi periodik perubahan
signifikan.
2.5 Pengolahan Limbah
Semua sarana termasuk daerah produksi, laboratorium, gudang, dan daerah
sekitar gudang sebaiknya dijaga agar senantiasa dalam keadaan bersih dan rapi.
Saluran pembuangan sebaiknya berukuran layak, memiliki bak kontrol dan
validasi yang cukup dan setiap saluran yang terbuka dan cukup dangkal agar
BAB III
TINJAUAN UMUM LEMBAGA FARMASI ANGKATAN UDARA
3.1 Sejarah dan Perkembangan Lembaga Farmasi Angkatan Udara
Pada tahun 1964 dibawah kepemimpinan LU I Drs. Roostyan Effendie,
Apt. mulai dikembangkan produksi obat-obatan dengan skala lebih besar, dan
didatangkan pula peralatan produksi obat dari Amerika Serikat. Juga dilaksanakan
renovasi pembangunan untuk produksi obat sesuai dengan persyaratan teknis
farmasi saat itu. Unit produksi obat diresmikan oleh Deputi Menteri bidang
Logistik tanggal 16 Agustus 1965. Selanjutnya tanggal ini ditetapkan sebagai hari
jadi Lembaga Farmasi Angkatan Udara.
Saat ini Lafiau dipimpin oleh Kolonel Kes Drs. Purwanto Budi, M.M., Apt. yang dalam pengambilan kebijakannya tetap berpedoman pada kebijakan para pendahulunya. Buah pikiran dan keberanian Drs. Roostyan Effendie, Apt. untuk mulai memproduksi obat-obatan sesuai dengan ketentuan farmasi telah memberi dorongan dan semangat bagi generasi berikutnya sehingga terbentuk Lembaga Farmasi Angkatan Udara seperti saat ini. Sebagai bentuk penghargaan jasa beliau di masa lalu, dan sesuai keputusan KASAU No.Kep/95/VII/2007 tanggal 31 juli 2007 maka pada hari kamis 1 November 2007, diresmikan nama Lembaga Farmasi Angkatan Udara Drs. Roostyan Effendie, Apt. dan tanggal 16 agustus 1965 ditetapkan sebagai hari jadi.
3.2 Visi, Misi, dan Tujuan Lembaga Farmasi Angkatan Udara 3.2.1 Visi dari Lafiau adalah :
3. Terlaksananya pembekalan matkes tepat waktu, tepat jumlah, tepat sasaran dan
aman.
4. Tegaknya sistem manajemen mutu dalam kinerjanya.
3.2.2 Misi dari Lafiau adalah :
1. Melaksanakan produksi obat jadi dengan menerapkan CPOB secara konsisten.
2. Melaksanakan pembekalan matkes mulai dari penerimaan, penyimpanan,
penyaluran, pencacahan dan penghapusan berdasarkan kebijaksanaan
Diskesau.
3. Melaksanakan pengawasan dan pemastian mutu matkes sesuai dengan
persyaratan teknis kefarmasian.
4. Melaksanakan penelitian dan pengembangan serta pendidikan dan pelatihan
dengan mengedepankan profesionalitas, efisien, efektif dan modern.
3.2.3 Tujuan dari Lafiau
1. Menyiapkan rumusan kebijakan terhadap teknis produksi.
2. Mengupayakan peralatan untuk produksi antibiotik golongan sefalosporin.
3. Mengajukan sertifikat CPOB untuk produk injeksi kering antibiotik golongan sefalosporin.
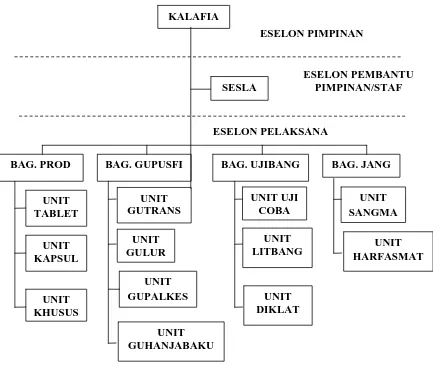
3.3 Susunan Organisasi
Organisasi di Lafiau tersusun dari tiga eselon, yaitu eselon pimpinan,
eselon pembantu pimpinan/staf dan eselon pelaksana. Eselon pimpinan yaitu
Kepala Lembaga Farmasi Angkatan Udara (Kalafiau) dan eselon pembantu
pimpinan/staf adalah Sektretaris Lembaga (Sesla), sedangkan eselon pelaksana
meliputi Kepala Bagian Produksi (Kabag Prod), Kepala Bagian Gudang Pusat
Farmasi (Kabag gupusfi), Kepala Bagian Pengujian dan Pengembangan (Kabag
3.4 Sarana dan Fasilitas Produksi 3.4.1 Bangunan
Bangunan di Lafiau telah dilengkapi dengan gedung dan peralatan yang
memenuhi persyaratan Cara Pembuatan Obat yang Baik (CPOB). Untuk bagian
produksi, Lafiau memiliki tiga gedung yang terpisah, satu gedung sefalosporin,
gedung beta laktam yang digunakan untuk memproduksi antibiotik beta laktam
dan gedung non beta laktam. Semua ruangan produksi terpisah sesuai jenis
produksinya, hal ini untuk menghindari adanya kontaminasi silang antara produk
beta laktam dengan produk non beta laktam. Bangunan produksi dilengkapi
dengan fasilitas pengendali udara yang terdiri dari AC baik lokal mau pun
terpusat, exhaust fan, dehumidefier. Permukaan bagian dalam ruangan (dinding,
lantai, dan langit-langit) dibuat licin bebas dari keretakan, dan sambungan terbuka
sehingga mudah dibersihkan.
3.4.2 Sarana Gudang
Lafiau mempunyai bangunan yang digunakan sebagai tempat
penyimpanan atau gudang. Bangunan pertama digunakan sebagai gudang
penyaluran dan gudang perbekalan kesehatan, bangunan kedua digunakan sebagai
gudang bahan baku dan obat jadi yang dipisahkan oleh dinding, gudang ini
dilengkapi dengan humidifier yang berfungsi menyerap kelembaban udara dalam
ruangan. Untuk obat-obat jenis narkotika dan sediaan steril disimpan dalam
yang tidak stabil pada suhu kamar/harus disimpan pada suhu dingin. Pada gudang
terdapat alat ultrasonik yang digunakan sebagai anti serangga.
BAB IV
KEGIATAN LEMBAGA FARMASI ANGKATAN UDARA
IV.1 Pengelolaan Perbekalan Kesehatan
Pengadaan perbekalan kesehatan yang mengacu kepada Program Kerja.
Dinas Kesehatan Angkatan Udara (Diskesau) dan Pusat Kesehatan TNI (Puskes),
diajukan oleh Kalafiau kepada Kepala Dinas Kesehatan Angkatan Udara
(Kadiskesau) dengan pertimbangan seperti rencana produksi satu tahun anggaran,
persediaan perbekalan kesehatan dan kebutuhan satuan kerja. Usulan dari
Kalafiau akan dipertimbangkan dan dievaluasi lebih lanjut sesuai dengan
kebijaksanaan dan anggaran dari Diskesau.
IV.2 Bagian Gudang Pusat Farmasi
Gudang Pusat Farmasi merupakan pembantu pelaksana Kalafiau yang
bertugas menerima, menyimpan, memelihara dan mengeluarkan serta menghapus
perbekalan kesehatan yang ada di Lafiau. Gupusfi dipimpin oleh kepala gudang
yang tugasnya bertanggung jawab kepada Kalafiau. Kepala gudang dibantu oleh
unit gudang transit, unit gudang obat jadi dan bahan baku, unit gudang peralatan
kesehatan dan unit gudang penyaluran. Bangunan gudang terdiri dari empat unit
gedung.
1. Gudang transit (Gutrans)
Bekal kesehatan yang dikirim dari rekanan ke Lafiau akan diterima di
barang selesai. Untuk bahan baku atau obat jadi yang diberi label kuning
(karantina) menandakan bahwa obat jadi atau bahan baku tersebut masih dalam uji
pemeriksaan laboratorium Ujibang.
2. Gudang bahan jadi dan bahan baku (Guhanjabaku)
Bahan baku yang dalam penyimpanannya membutuhkan kondisi khusus
maka harus segera disimpan dalam gudang bahan baku, obat jadi dan embalage
yang sudah dilengkapi dengan alat pengatur suhu dan kelembaban udara. Setelah
barang dinyatakan memenuhi syarat yang ditandai dengan dikeluarkannya berita
acara oleh panitia penerima barang, maka barang dipindahkan ke gudang bahan
baku, obat jadi dan embalage. Barang yang masuk disusun berdasarkan fungsi
terapi atau farmakologi dan alfabetis. Jumlahnya dicatat dalam kartu stok barang
yang terdapat dimasing-masing gudang.
Penyusunan barang digudang menggunakan sistem First In First Out
(FIFO) dengan memperhatikan waktu masuknya barang dan tanggal
kadaluarsanya sehingga memungkinkan barang yang masuk lebih awal akan
dikeluarkan terlebih dahulu. Sehingga dapat dicegah rusaknya barang akibat
penyimpanan terlalu lama. Sedangkan untuk barang-barang yang waktu
kadaluarsanya singkat disusun menggunakan sistem First Expired First Out
(FEFO).
3. Gudang Peralatan Kesehatan (Gupalkes)
Gupalkes di Lafiau merupakan salah satu gudang yang kedudukannya
berada di bawah bagian pergudangan Lafiau. Kegiatan penyimpanan dan
pengendalian peralatan kesehatan merupakan kelanjutan dari kegiatan penerimaan
ini adalah untuk memelihara mutu, menghindari penggunaan yang tidak
bertanggung jawab, menjaga kelangsungan persediaan, memudahkan pencarian
dan pengawasan serta menjaga keseimbangan antara persediaan dan penggunaan
peralatan kesehatan.
4. Gudang penyaluran (Gulur)
Pengeluaran barang dari Gupalkes atau Guhanjabaku dan embalage
dilakukan di Gulur setelah ada SPPB dari Kadiskesau kepada Kalafiau,berisi
tentang barang yang dibutuhkan oleh satker .
IV.3 Bagian Produksi
IV.3.1 Tata Letak dan Klasifikasi Ruang Produksi
Gedung produksi terdiri dari tiga bagian, yaitu bagian produksi
sefalosporin, obat beta laktam dan non beta laktam. Ruang-ruang produksi
terpisah satu sama lain sesuai dengan jenis produksi. Hal ini bertujuan untuk
menghindari kontaminasi antara produk yang satu dengan produk yang lain.
Berdasarkan tingkat kebersihan ruangan, ruang produksi Lafiau dibagi menjadi
dua kelas yaitu:
1. Black area
Daerah ini meliputi kamar ganti pakaian, toilet, kamar mandi, ruang
pengemasan, ruang pencetakan nomor batch, ruang mesin cuci botol, ruang
administrasi produksi, ruang istirahat, dan gudang produksi.
2. Grey area
Daerah ini meliputi ruang pengolahan dan pengemasan obat non steril,
ruang timbang, pembuatan dan pencampuran sirup dan salep/krim, ruang
process control, penyalutan, stripping, dan ruang penyimpanan obat setengah jadi.
Pakaian yang digunakan di daerah ini adalah pakaian khusus produksi yang
terbuat dari bahan dengan serat yang tidak mudah lepas dan dilengkapi dengan
sarung tangan, penutup kepala, serta penutup hidung dan mulut.
IV.3.2 Produksi Obat
Produksi di Lafiau dilakukan berdasarkan adanya Surat Perintah Produksi
(SPP) yang dilakukan oleh Kadiskesau kepada Kalafiau kemudian Kalafiau
mengeluarkan SP3 kepada Kabag prod dan pelaksanaannya dilakukan oleh Kaunit
(Kepala Unit) berdasarkan Surat Perintah Kerja.
1. Unit Produksi Tablet
Unit produksi tablet bertanggung jawab dalam memproduksi tablet dan
kaplet baik antibiotik maupun non antibiotik. Kegiatan produksi tablet yang
dilakukan dimulai dengan penimbangan bahan baku yang dinyatakan telah
memenuhi syarat oleh unit uji coba.
Bahan baku tersebut meliputi bahan aktif, pengembang dalam dan
pengembang luar, selanjutnya dilakukan pencampuran bahan aktif dan
pengembang dalam. Sebelum digranulasi, diperiksa dulu oleh unit uji coba untuk
mengetahui apakah pencampuran sudah homogen. Granul yang diperoleh dari
proses granulasi basah dikeringkan, dilakukan pengujian kadar air oleh unit uji
coba. Granul yang lulus pemeriksaan dicampur dengan pengembang luar dan
dicetak menjadi tablet dan mengalami proses “coating” untuk tablet salut
sebelum dikemas. Setelah proses pencetakan tablet diperiksa secara fisik (bentuk,
bau, warna, keseragaman bobot, ukuran, kekerasan, kerapuhan, waktu hancur, dan
Metode yang banyak dipakai untuk produksi tablet non beta laktam adalah
granulasi basah, selain itu metode cetak langsung juga dilakukan. Untuk produksi
tablet beta laktam metode yang dipakai adalah granulasi kering dan cetak
langsung.
2. Unit Produksi Kapsul
Unit produksi kapsul bertanggungjawab dalam memproduksi kapsul.
Kegiatan produksi kapsul dimulai dengan penimbangan bahan baku, diayak dan
dicampurkan. Selanjutnya dilakukan pengisian kapsul lalu dikemas. Pada setiap
tahap mulai dari tahap pencampuran sampai tahap pengemasan dilakukan
pengawasan mutu oleh unit uji coba
3. Unit Produksi Khusus
Unit produksi khusus Lafiau memproduksi sediaan cair, sediaan semisolid
(salep/krim), dan pengolahan air demineralisata.
a. Proses produksi sirup
Produksi sirup dimulai dengan penimbangan bahan baku meliputi bahan
aktif, bahan pembantu dan bahan sirup simpleks. Bahan aktif dan bahan pembantu
dilarutkan, sementara sirup simpleks disaring, larutan bahan aktif dan sirup
simpleks dicampur, larutan hasil pencampuran diuji kadar, viskositas, pH dan
berat jenisnya oleh unit uji coba.Larutan jernih hasil penyaringan diisi ke dalam
botol yang sudah dicuci. Botol yang telah diisi larutan disortir dan diberi etiket.
b. Proses produksi salep/krim
Proses pembuatan salep/krim dimulai dengan penimbangan bahan aktif,
basis salep dan bahan pembantu. Basis salep dan bahan pembantu dilebur dan
konsistensi oleh unit uji coba. Setelah hasil pengujian dilakukan pengisian dan
penutupan tube, penyortiran dan pemberian etiket.
c. Proses pembuatan aqua demineralisata (aqua DM)
Lafiau mendapatkan air demineralisata dengan cara memproduksi dan
mengolahnya sendiri. Sumber air yang digunakan untuk membuat aqua DM
berasal dari sumur artesis. Dalam mencukupi kebutuhan aqua DM untuk proses
produksi dan pemeriksaan laboratorium maka dilakukan proses pengolahan air.
Air artesis disaring terlebih dahulu dan dialirkan ke Multi Sorb yang merupakan
penyaringan zat secara mekanik termasuk dapat menyaring besi, kemudian air
dialirkan ke penukar ion positif dan penukar ion negatif. Setelah itu air dididihkan
dan dapat digunakan untuk proses produksi.
Aqua DM berasal dari air bersih yang diproses lebih lanjut dengan
menggunakan resin penukar ion. Parameter mutu air yang dapat diperiksa disini
adalah kejarnihan, bau, rasa, warna, pH serta kandungan ion. Air yang telah diolah
harus jernih, tidak berbau, tidak berasa dan tidak berwarna serta pH sekitar 6-7.
Air yang telah diolah selanjutnya dididihkan jika langsung dipakai dalam proses
produksi.
IV.3.3 Unit Pemeriksaan In Process Control dan Pengujian Obat Jadi
Pemeriksaan in process control (IPC) dan pengujian obat jadi dilakukan
pada bentuk sediaan tablet, kapsul, sirup, dan salep/krim.
a. Sediaan Tablet
Pemeriksaan tablet pada saat IPC dilakukan terhadap granul meliputi
pemeriksaan kadar air dan zat aktifnya. Setelah proses pencetakan, tablet
kerapuhan, waktu hancur, disolusi) dan secara kimia (pemeriksaan kadar zat
berkhasiat secara kuantitatif).
b. Sediaan Kapsul
Pemeriksaan pada saat IPC dilakukan setelah pencampuran bahan aktif
dan bahan tambahan meliputi pemeriksaan kadar zat aktifnya. Kapsul diperiksa
secara fisik (keseragaman bobot, waktu hancur, disolusi) dan secara kimia
(pemeriksaan kadar zat aktif secara kuantitatif).
Selama proses pengisian ke dalam kapsul, beberapa sampel diambil untuk
dilakukan pengujian keseragaman bobot setiap 15 menit sekali. Jika ada
penyimpangan selama pengisian kapsul, maka proses dihentikan dan diperbaiki.
Pengujian yang dilakukan terhadap obat jadi sama dengan pengujian IPC pada
pengisian kapsul.
c. Sediaan Sirup
Pemeriksaan pada saat IPC dilakukan setelah pencampuran bahan aktif
dan bahan tambahan meliputi pemeriksaan secara fisik (warna, bau, rasa,
kejernihan, viskositas, stabilitas, pH) dan secara kimia (pemeriksaan kadar zat
aktif secara kuantitatif). Pengujian yang dilakukan terhadap obat jadi sama dengan
pengujian pada saat IPC.
d. Sediaan Salep
Pemeriksaan pada saat IPC dilakukan setelah pencampuran bahan aktif
dan bahan tambahan meliputi pemeriksaan secara fisik (warna, bau, homogenitas)
dan secara kimia (pemeriksaan kadar zat aktif secara kuantitatif). Pada saat
kadarnya. Pengujian yang dilakukan terhadap obat jadi sama dengan pengujian
pada saat IPC.
IV.3.4 Pengemasan
Proses pengemasan sediaan obat di Lafiau sebagai berikut:
1. Tablet, tablet salut, dan kapsul
Pengemasan dilakukan dengan cara stripping kemudian sejumlah tertentu
dimasukkan ke dalam dus disertai brosur dan dikemas dalam kotak karton. Untuk
tablet-tablet tertentu dikemas ke dalam kantong plastik kemudian dimasukkan ke
dalam botol plastik.
2. Salep/krim
Salep/krim dikemas dalam tube kemudian tube yang telah diberi nomor
batch dimasukkan ke dalam kardus disertai brosur. Sejumlah kardus tertentu
dikemas dalam kotak karton.
3. Sirup
Botol-botol sirup diberi etiket dan dimasukkan ke dalam kardus. Untuk
semua jenis obat yang telah dikemas baik berupa tablet, kapsul, salep, dan sirup
dilakukan pemeriksaan secara manual terhadap kemasan obat untuk melihat
apakah terdapat kerusakan pada kemasan.
IV.3.5 Pengujian Sampel Pertinggal
Sampel pertinggal yang disimpan adalah obat jadi yang telah dikemas.
Sampel disimpan lengkap dengan etiket yang memuat nama sampel, nomor batch,
dan jika ada keluhan dari konsumen, maka dilakukan pengujian terhadap sampel
tersebut. Setelah lima tahun, sampel pertinggal dapat dimusnahkan.
IV.4 Bagian Pengujian dan Pengembangan
Bagian pengujian dan pengembangan bertugas melaksanakan pengujian
dan percobaan atas kualitas perbekalan kesehatan, melaksanakan penelitian dan
pengembangan untuk meningkatkan hasil produksi obat jadi serta
menyelenggarakan perencanaan dan pelaksanaan pendidikan dan pelatihan baik
untuk personel Lafiau atau siswa dan mahasiswa yang sedang Praktik Kerja
Profesi Apoteker di Lafiau.
Ruang bagian ujibang terdiri dari ruang penelitian dan pengembangan,
ruang penyimpanan bahan baku dan peratan gelas, ruang contoh pertinggal, ruang
timbang, ruang analisis, ruang reagensia, ruang instrument dan laboratorium
mikrobiologi. Ruang bagian ujibang dilengkapi dengan pengatur suhu untuk
menjaga kelembaban dan penghisap udara, serta meja yang dilapisi porselen agar
mudah dibersihkan.
IV.5 Sanitasi dan Higiene
Lafiau memiliki sarana pengolahan limbah, baik untuk limbah padat
berupa debu-debu yang tersebar di daerah produksi maupun limbah cair dari
pencucian peralatan.
a. Pengolahan Limbah Padat
Pengolahan limbah padat dilakukan dengan menggunakan dust collector
ruangan, vacum cleaner untuk debu-debu yang berserakan pada peralatan dan
lantai.
b. Pengolahan Limbah Cair
Pengolahan limbah cair terdiri dari proses destruksi, penetralan,
pengendapan, dan aerasi di dalam beberapa kolam yang saling berhubungan satu
sama lain berdasarkan proses pengolahan.
Proses pengolahan limbah beta dan non beta laktam yaitu :
1. Limbah dari produksi obat beta laktam dialirkan ke kolam pertama, kemudian
ditambahkan asam/basa kuat untuk memecah cincin beta laktam. Dari kolam
pertama dialirkan ke kolam kedua untuk diendapkan.
2. Cairan dari limbah kolam kedua dialirkan ke kolam ketiga. Limbah dari
produksi obat non beta laktam masuk ke kolam ketiga sehingga terjadi
pencampuran. Kemudian dilakukan penetralan (pH=7 namun jika terlalu asam
ditambahkan NaOH dan jika terlalu basa ditambahkan HCl) dan pengenceran
dengan penambahan air.
3. Limbah dari kolam ketiga dialirkan ke kolam keempat untuk proses
pengendapan kedua.
4. Cairan dari limbah kolam keempat dialirkan ke kolam kelima dimana terjadi
proses aerasi, yaitu penambahan oksigen yang bertujuan untuk menurunkan
biologycal oxygen demand (BOD) dan chemical oxygen demand (COD) dari
limbah tersebut. Air kolam kemudian diuji di laboratorium untuk penentuan
5. Limbah dari kolam kelima dialirkan ke kolam keenam yang merupakan kolam
kontrol. Sebagai kontrol digunakan ikan sebagai bio indicator, apabila air pada
kolam memenuhi persyaratan, maka akan dialirkan ke pembuangan umum.
Denah bak pengolahan air limbah dapat dilihat pada bagian lampiran.
Untuk pengolahan limbah laboratorium pada dasarnya sama dengan
pengolahan limbah produksi. Untuk limbah yang mengandung mikroorganisme
terlebih dahulu harus didestruksi dengan tujuan untuk mematikan mikroorganisme
tersebut.
IV.6 Produk
Obat-obatan yang telah diproduksi oleh Lafiau hingga saat ini antara lain
sebagai berikut :
1. Kaplet dan Tablet Antibiotik: Kaplet Amoxixillin, Kaplet Rifampisin, Tablet
Bactrim AU dan Tablet Cefadroxil
2. Kaplet dan Tablet non Antibiotik: Kaplet Afostan, Tablet Antalgin, Tablet
Antiflu, Tablet Asetilet, Tablet CTM, Tablet vitamin B12, Tablet B complex,
Tablet Dekstrometrophan, Kaplet Energikstrip C, Tablet INH plus, Tablet
Vitamin C, Tablet Prednison dll
3. Kapsul Antibiotik: Kapsul Amoxixillin, Kapsul Eritromicin dan Kapsul
Khloramphenicol
4. Kapsul non Antibiotik: Kapsul Afostan
5. Sediaan khusus (salep/krim): Salep kulit Khloramphenicol, Salep
6. Sedian cair(sirup): Sirup Deflugen, Sirup Difenhidramin- DMP, Sirup
Difenhidramin Exp, Sirup Chloramphenicol, Larutan Antiseptik Lafiodine,
Sirup kering Amoxicillin.
BAB V
PEMBAHASAN
Lafiau merupakan sebuah Lembaga industri Farmasi Angkatan Udara
yang berperan sebagai pelaksana teknis dari Dinas Kesehatan TNI AU (Diskesau)
yang memproduksi obat jadi. Sebagai industri farmasi, Lafiau mempunyai tugas
utama yaitu melaksanakan produksi obat jadi, pendistribusian obat dan perbekalan
kesehatan lainnya dengan pengawasan kualitas dan persyaratan teknis
kefarmasian untuk pelaksanaan dukungan pelayanan kesehatan bagi seluruh
anggota TNI AU dan keluarganya.
Peran lain yang dilakukan Lafiau adalah melaksanakan penerimaan,
penyimpanan , penyaluran dan penghapusan perbekalan kesehatan sesuai dengan
kebijaksanaan Diskesau. Perbekalan kesehatan yang dimaksud adalah sediaan
farmasi hasil produksi Lafiau, sediaan obat jadi yang dibeli dari industri lain dan
peralatan kesehatan yang diadakan oleh Disadaau (Dinas Pengadaan AU) melalui
sistem tender.
5.1 Personalia
Secara umum, Lafiau memiliki sumber daya manusia berkualitas yang
dapat mendukung tugas dan fungsi Lafiau dimana jumlah personil yang dimiliki
sebanyak 61 orang, meliputi 6 orang Apoteker S2, 8 orang Apoteker, 8 orang
berlatar belakang pendidikan sekolah menengah, jumlah personil ini belum
memadai untuk berlangsungnya proses produksi. Sumber daya manusia tersebut
dapat benar-benar bermanfaat apabila ditempatkan sesuai dengan kemampuannya
masing-masing dan didukung dengan penataan organisasi yang baik. Dengan
didukung 14 orang apoteker sebagai pengemban utama dalam pelayanan
kesehatan maka proses pembuatan, pengadaan obat dan persediaan perbekalan
kesehatan dapat terlaksana dengan baik dan profesional.
Hal penting dalam penataan organisasi perusahaan farmasi adalah bahwa
bagian produksi dan pengawasan mutu harus dipimpin oleh apoteker yang
berbeda. Di Lafiau hal ini sudah diterapkan dimana pada Bagian Produksi dan
Bagian Ujibang dipimpin oleh apoteker yang berbeda. Meskipun pada Bagian
Produksi dan Bagian Ujibang di Lafiau tidak terjadi perangkapan jabatan namun
ada perangkapan jabatan pada sub unit-sub unit tertentu, hal ini terjadi karena
keterbatasan personil.
5.2 Bangunan dan Fasilitas
Bangunan Lafiau terdiri dari bangunan produksi, pengawasan mutu,
gudang, dan bangunan untuk administrasi. Lafiau memiliki tiga bangunan utama
produksi yang terpisah satu sama lain dan sesuai dengan CPOB. Bangunan
tersebut digunakan untuk produksi obat golongan beta laktam, non beta laktam
dan sefalosporin. Pemisahan bangunan produksi bertujuan untuk menghindari
reaksi alergi, resistensi dan mencegah kontaminasi silang. Ruangan produksi baik
beta laktam maupun non beta laktam terbagi menjadi dua kelas yaitu black area
dan grey area. Sedangkan untuk ruangan produksi sefalosporin terbagi menjadi
Ruang kerja dibuat teratur dan logis sedemikian rupa sehingga menunjang
kelancaran dan mempermudah dalam bekerja serta lalu lintas barang dan personil.
Bagian dalam ruang produksi Lafiau baik dinding, langit-langit maupun lantai
dibuat licin, kedap air, tidak retak, tanpa sudut dan tertutup rapat untuk mencegah
pencemaran dari ruang atas. Hal ini ditujukan untuk mempermudah pembersihan.
Lantai bagian produksi dilapisi dengan epoksi sehingga lebih tahan goresan dan
tidak mudah terkelupas. Lantai dan dinding ruang produksi terbuat dari bahan
yang kedap air.
Fasilitas penerangan cukup efektif dan ventilasi udara baik, ditunjang
dengan adanya pengendalian udara melalui sistem AHU (Air Handling Unit),
pengaturan suhu, kelembaban dan penyaring udara. Pengaturan suhu dan
kelembaban diatur pada tingkat kenyamanan karyawan dengan mengatur suhu
agar tidak menyebabkan karyawan kedinginan atau berkeringat secara berlebihan
dalam pakaian kerjanya sehingga proses kerja tidak terganggu. Disamping faktor
kenyamanan, faktor lain yang terpenting adalah diharapkan pengaturan suhu dan
kelembaban tidak mempengaruhi stabilitas obat yang sedang di produksi pada saat
itu.
Pada ruang produksi dilakukan juga pengaturan tekanan udara. Ruangan
produksi tablet beta laktam dan non beta laktam, tekanan udara pada koridor
dibuat lebih besar dibandingkan ruang produksi. Hal ini bertujuan untuk
mencegah agar partikel atau debu dari ruang produksi tidak keluar dan langsung
dapat dibersihkan dengan dust collector. Untuk ruang produksi sirup tekanan
ruangan dibuat besar untuk mencegah partikel atau debu dari luar mencemari
AC dan exhaust fan serta dengan adanya ruang antara yang dirancang untuk
membatasi ruangan yang memiliki tekanan berbeda.
Ruangan laboratorium di Lafiau terpisah dari ruang produksi, di dalamnya
dilengkapi dengan peralatan yang sesuai untuk uji secara fisika, kimia dan
mikrobiologi. Meja untuk pengujian dilapisi porselen untuk memudahkan dalam
proses pembersihan. Prosedur kerja setiap instrumen atau alat di letakkan dekat
alat yang bersangkutan. Pereaksi yang digunakan tersusun rapi dan teratur disertai
dengan label pada rak-rak yang ada di laboratorium untuk memudahkan
pengambilan. Catatan pengujian yang ada di laboratorium memuat nama, nomor
batch, dan jumlah yang diuji, nama petugas penguji, metode analisa, peralatan,
perhitungan dan rumus, pernyataan syarat spesifikasi dan tanda tangan penguji.
Catatan pengujian ini disimpan dalam bentuk dokumen selama 5 tahun. Di
dalam laboratorium terdapat ruangan khusus yang digunakan sebagai ruang
penyimpan contoh pertinggal dengan suhu kamar tapi tidak dilengkapi pengatur
suhu. Contoh pertinggal dimaksudkan untuk pengujian ulang apabila terjadi
komplain pada obat yang telah beredar.
Selain bangunan produksi, gudang merupakan bangunan lain yang harus
dijaga kondisinya. Gudang sebaiknya kering, tidak lembab, bebas hama dan
memudahkan arus pergerakan barang dan manusia serta dijaga kebersihannya.
Gudang di Lafiau memanfaatkan exhaust fan untuk menjaga aliran udara dalam
gudang. Untuk mencegah masuknya hama dan serangga yang dapat menyebabkan
rusaknya material yang disimpan, gudang Lafiau dilengkapi dengan pest control
5.3Peralatan
Penempatan peralatan di Lafiau disesuaikan dengan tahapan kegiatan yang
dilakukan, dan jarak yang memadai untuk memudahkan kegiatan karyawan di
dalamnya. Hal ini untuk menghindari adanya kontaminasi silang antar bahan di
daerah yang sama. Peralatan dirawat menurut jadwal yang tepat sesuai protap
yang ada. Peralatan juga dilengkapi dengan label yang menunjukkan alat tersebut
siap atau tidak digunakan. Disetiap alat mesin diberi kode tertentu dan terdapat
protap penggunaan yang akan memudahkan pemakaian peralatan.
5.4 Sanitasi dan Higiene
Lafiau sudah menerapkan prosedur sanitasi dan higiene ini dengan baik.
Untuk personalia sudah diterapkan prosedur penggunaan pakaian khusus dengan
penutup kepala dan sarung tangan. Selain itu, protap mengenai higiene sebelum
masuk ruang produksi sudah ada dan terdokumentasi. Bangunan produksi juga
dilengkapi dengan toilet, locker yang berfungsi untuk menyimpan keperluan
pribadi karyawan. Kegiatan untuk menjaga kebersihan lingkungan khususnya
daerah di sekitar produksi, laboratorium dan gudang diadakan seminggu sekali
setiap hari Rabu melalui program kurve yang dilakukan oleh semua personilnya.
Selain itu setiap selesai produksi satu macam obat dilakukan clearance line
supaya tidak terjadi kontaminasi silang.
Sistem pengolahan limbah di Lafiau dibagi menjadi dua yaitu limbah
padat dan limbah cair. Pengolahan limbah padat dilakukan dengan pembakaran,
sedangkan untuk limbah cair terbagi menjadi dua yaitu limbah beta laktam dan
non beta laktam. Pengolahan limbah cair menggunakan 6 bak yang sistem
Bak I : Untuk menampung limbah produksi beta laktam dan limbah dari
laboratorium. Pada bak I ditambahkan air yang berfungsi untuk
hidrolisis dan pengenceran ditambah H2SO4 pekat (40%) yang
ditujukan untuk memecah cincin beta laktam sehingga menjadi tidak
aktif lagi.
Bak II : Dipergunakan untuk menampung residu (pengendapan) yang terbentuk
dari bak I dan pengenceran dengan air.
Bak III : Sebagai tempat pencampuran antara cairan dari bak II dengan limbah
non beta laktam dibantu dengan mixer. Kemudian dilakukan cek pH
untuk mengetahui keasaman limbah. Setelah itu dilakukan netralisasi
dengan penambahan basa kuat (NaOH) dan air. Range pH yang
diharapkan 5-9.
Bak IV : Terjadi proses pengendapan cairan yang mengalir dari bak III.
Bak V : Dipasang aerator untuk menambah mutu oksigen dalam limbah
sehingga meningkatkan kemampuan bakteri aerob untuk menetralkan
limbah di bak V Serta dilakukan pemeriksaan pH, BOD, COD dan
logam berat pada limbah.
Bak VI : Untuk menampung cairan dari bak V, dimana dilengkapi dengan ikan
mas dan ikan nila sebagai bio indicator.. Apabila ikan-ikan di bak VI
tidak mati maka limbah dinyatakan aman untuk dialirkan ke tempat
pembuangan umum. Bila tidak lolos pemeriksaan maka diproses ulang.
Untuk penanganan endapan yang terdapat di dalam bak tiap akhir periode
produksi dikumpulkan, dikeringkan kemudian dibakar ditempat khusus.
Bagian produksi di Lafiau dilaksanakan dengan mengikuti prosedur yang
telah ditetapkan dan menjamin obat jadi yang dihasilkan memenuhi spesifikasi
yang ditentukan. Untuk itu selalu dilakukan validasi terhadap bahan, prosedur,
kegiatan, sistem, perlengkapan atau mekanisme yang digunakan dalam produksi
dan pengawasan mutu.
Produksi di Lafiau berdasarkan anggaran tahunan. Produksi berdasarkan
kebutuhan satker-satker yang terealisasi dengan adanya perintah untuk
melaksanakan produksi, sehingga jenis dan jumlah obat jadi yang akan diproduksi
telah ditentukan dalam satu tahun, yang teknis pelaksanaan produksinya
diserahkan kepada Lafiau. Selain memproduksi obat jadi, Lafiau juga
memproduksi air demineralisata yang dapat digunakan untuk kepentingan
produksi sehingga mengurangi biaya produksi.
5.6Bagian Pengawasan Mutu
Pengawasan mutu di Lafiau dilakukan oleh bagian uji coba yang berada di
bawah bagian pengujian dan pengembangan. Pengambilan contoh untuk uji
dilakukan dengan metode yang telah ditetapkan dan sesuai dengan kebutuhan
yang dapat mewakili seluruh bahan atau produk yang digunakan, yaitu dengan
rumus: n+1, untuk tiap sampel minimum dilakukan tiga kali pemeriksaan.
Dalam setiap batch produksi diambil contoh pertinggal yang akan
disimpan pada suhu kamar dan diuji tiap tiga bulan tahun pertama dan setiap
tahun pada tahun selanjutnya untuk mengetahui stabilitas dari produk. Contoh
pertinggal dapat sewaktu-waktu diuji jika ada laporan atau klaim dari
selanjutnya dimusnahkan dengan cara dibakar atau ditanam sesuai dengan sifat
obat tersebut.
BAB VI
KESIMPULAN DAN SARAN
6.1 Kesimpulan
Dari hasil Praktik kerja Profesi Apoteker(PKPA) di Lafiau dapat diambil
kesimpulan sebagai berikut:
1. PKPA adalah sarana pelatihan kerja yang sangat bermanfaat bagi calon
Apoteker guna mempersiapkan diri sebagai bekal pengalaman kelak dalam
memasuki dunia kerja, sehingga siap menjadi tenaga profesional di bidang
kefarmasian khususnya bidang industri.
2. Lafiau adalah pelaksana teknis dari Diskes AU yang mempunyai tugas
membina kemampuan dan pelaksanaan produksi obat jadi, pembekalan
kefarmasian dengan pengawasan kualitas dan persyaratan teknis kefarmasian
untuk pelaksanaan dukungan pelayanan kesehatan bagi anggota TNI AU pada
khususnya dan TNI pada umumnya.
3. Lafiau bukan lembaga yang didirikan untuk bisnis atau mencari keuntungan,
melainkan lembaga yang didirikan untuk pemenuhan kebutuhan internal TNI
4. Lafiau telah memenuhi persyaratan CPOB yang meliputi personalia,
peralatan, bangunan, produksi, pengawasan mutu, sanitasi dan higiene, serta
dokumentasi. Lafiau telah memperoleh 15 sertifikat CPOB untuk berbagai
golongan obat dari DepKes.
6.2 Saran
1. Perlu penekanan aspek inspeksi diri CPOB bagi para personel ruang
produksi.
2. Sistem administrasi akan lebih berjalan dengan baik jika ditunjang dengan
sistem komputerisasi secara on line, sehingga dapat cepat dan mudah dalam
memonitor pelaksanaan kegiatan.
3. Perlu dilakukan validasi secara berkala dan sistem dokumentasi yang telah
ditetapkan sesuai rencana produksi baik untuk alat, bahan-bahan, proses,
prosedur, kegiatan, sistem, perlengkapan, atau mekanisme yang dilakukan.
4. Pengolahan limbah padat akan lebih efisien jika dilengkapi dengan
incenerator, sehingga limbah dapat terurai sempurna dan tidak mencemari
lingkungan khususnya untuk pengolahan bahan yang berbahaya.
5. Perlu dilakukan pengepoksian kembali lantai yang berada di ruang produksi
non beta laktam.
6. Perlu dilakukan regenerasi alat untuk meningkatkan efisiensi dan efektifitas
DAFTAR PUSTAKA
Anonim, 1996, ASEAN Good Manufacturing Practices Guideline, third edition.
Anonim, 1997, Sejarah Perkembangan Pobekkes AU sampai tahun 1997,
Lembaga Farmasi Dinas Kesehatan TNI AU Bandung.
Anonim, 1999, Pokok-pokok Organisasi dan Prosedur Lembaga Farmasi TNI
AU, Lembaga Farmasi Dinas Kesehatan TNI AU Bandung.
Anonim, 2001, Petunjuk Operasional Penetapan Cara Pembuatan Obat yang
Baik, Departemen Kesehatan RI, Jakarta.
Anonim, 1990, Keputusan Menteri Kesehatan RI No.245/MenKes/SK/V/1990,
Tentang Industri Farmasi, Jakarta.
Ansel, Howard C, 1989, Pengantar Bentuk Sediaan Farmasi, Edisi Ke Empat, UI
Press, Jakarta
Badan POM., Petunjuk Operasional Penerapan Cara Pembuatan Obat yang Baik,
Jakarta, 2006
Lampiran 3. Alur Kegiatan Produksi
Bahan Baku
Karantina
Pemeriksaan
Memenuhi syarat Tidak Memenuhi syarat
Produksi
In Process Control (IPC) Produk Ruahan
Pengemasan
Produk Jadi
Tidak Memenuhi Syarat
Karantina
Pemeriksaan
Sampel pertinggal
Gudang Obat
Lampiran 4. Alur Produksi Tablet
Penimbangan
Granulasi Basah Granulasi Kering
Bahan Aktif Bahan Pembantu
Bahan Aktif Bahan Pembantu
Pencampuran Pencampuran
Granulasi Basah Granulasi Kering
Lampiran 5. Alur Produksi Kapsul
Penimbangan
Pengayakan
Mixing
Pengisian Kapsul
Keseragaman Bobot Keseragaman Kandungan Waktu Hancur
IPC QC
Disolusi
Lampiran 6. Alur Produksi Sirup
Penimbangan
Bahan Aktif Bahan Pembantu
Pelarutan Pembuatan Sirupus
Simplex
Penutupan Pemeriksaan Visual
Pengemasan QC
Pemeriksaan Volume
Lampian 7. Alur Produksi Salep/Krim
Peleburan
Pencampuran
Pengadukan
QC
Homogenitas Konsistensi Viskositas Kadar zat aktif
QC Penimbangan
Bahan Aktif Bahan Pembantu dan Basis
Salep/Krim
Pengisian
Pemeriksaan visual Berat Tube
Wadah/Tube
Penutupan
Pengemasan
Lampiran 8. Alur Pembuatan Aqua Demineralisata
Penampungan air sumur artesis
Penyaringan
Penyaringan multisorb
Resin penukar ion
Penyimpanan
Pendidihan