LAPORAN PRAKTEK KERJA PROFESI APOTEKER FARMASI INDUSTRI
di
LEMBAGA FARMASI
DIREKTORAT KESEHATAN ANGKATAN DARAT (LAFI DITKESAD)
BANDUNG
Disusun oleh:
JOHAN, S.Farm 093202035
PROGRAM PENDIDIKAN PROFESI APOTEKER FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
Lembar Pengesahan
LAPORAN PRAKTEK KERJA PROFESI FARMASI INDUSTRI
di
LEMBAGA FARMASI
DIREKTORAT KESEHATAN ANGKATAN DARAT
BANDUNG
TANGGAL 03 MEI – 31 MEI 2010
Laporan ini disusun untuk melengkapi salah satu syarat untuk memperoleh gelar
Apoteker pada Fakultas Farmasi Universitas Sumatera Utara Medan
Disusun Oleh:
Johan, S.Farm NIM 093202035
Lembaga Farmasi
Direktorat Kesehatan Angkatan Darat
Bandung
Pembimbing,
Drs. Agoes Iman Noegroho, Apt Mayor Ckm NRP. 1910011300860
Fakultas Farmasi
Universitas Sumatera Utara
Dekan
KATA PENGANTAR
Puji dan syukur penulis ucapkan kehadirat Tuhan Yang Maha Esa yang
telah memberikan rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan
Praktek Kerja Profesi Apoteker dan laporan ini di Lembaga Farmasi Direktorat
Kesehatan Angkatan Darat (Lafi Ditkesad) Bandung.
Pelaksanaan Praktek Kerja Profesi Apoteker di Lafi Ditkesad ini
berlangsung mulai tanggal 03 Mei sampai 31 Mei 2010. Laporan ini merupakan
hasil Praktek Kerja Profesi Apoteker (PKPA) yang kami laksanakan di Lafi
Ditkesad sebagai salah satu syarat untuk menyelesaikan Program Profesi Apoteker
di Fakultas Farmasi Universitas Sumatera Utara.
Pada kesempatan ini penulis ingin mengucapkan terima kasih kepada:
1. Kolonel Ckm Drs.WSM. Manurung, Apt, M.Bus.MARS., selaku Kepala
Lembaga Farmasi Direktorat Kesehatan Angkatan Darat.
2. Letkol Ckm. (K). Dra. Nur Laila, Apt., M.Si., selaku Kepala Instalasi
Pengawasan Mutu Lembaga Farmasi Direktorat Kesehatan Angkatan Darat.
3. Letkol Ckm Drs. Yan Suryana Ilham, Apt., M.M., selaku Kepala Instalasi
Penelitian dan Pengembangan Lembaga Farmasi Direktorat Kesehatan
Angkatan Darat.
4. Letkol Ckm Drs. Abdul Azis, S.M., selaku Kepala Bagian Administrasi
Logistik Lembaga Farmasi Direktorat Kesehatan Angkatan Darat.
5. Mayor Ckm Drs. Junaedi, Apt., selaku Kepala Instalasi Produksi Lembaga
Farmasi Direktorat Kesehatan Angkatan Darat dan sebagai pembimbing
PKPA.
6. Mayor Ckm Drs. Agoes Iman Noegroho, Apt., selaku Kepala Instalasi
Pemeliharaan dan Sistem Penunjang Lembaga Farmasi Direktorat
Kesehatan Angkatan Darat dan sebagai pembimbing PKPA.
7. Mayor Ckm. (K). Dra. Emmy Winarni, Apt., selaku Kepala Instalasi
Penyimpanan Lembaga Farmasi Direktorat Kesehatan Angkatan Darat.
8. Mayor Ckm Drs. T.P.H. Simorangkir, Apt., M.Si., selaku Koordinator
Praktik Kerja Mahasiswa di Lembaga Farmasi Direktorat Kesehatan
9. Mayor Ckm Tantri Murdoyo, S.Si., Apt., selaku Kepala Seksi Perencanaan
dan Pemprograman Anggaran Lembaga Farmasi Direktorat Kesehatan
Angkatan Darat.
10. Mayor Ckm Gogok Hariyanto Apt., M.Si., selaku Kepala Sediaan Cair
Instalasi Produksi Lembaga Farmasi Angkatan Darat dan sebagai
pembimbing PKPA.
11. Dra. Lisa Olii, Apt., M.Si., selaku Kepala Seksi Sediaan Non Betalaktam
Instalasi Produksi Lembaga Farmasi Direktorat Kesehatan Angkatan Darat.
12. Dra. Neneng Cahyati, Apt., selaku Kepala Seksi Kemas Instalasi Produksi
Lembaga Farmasi Direktorat Kesehatan Angkatan Darat.
13. Dra. Weni Widaningsih, Apt., selaku Kepala Seksi Kimia Fisika Instalasi
Pengawasan Mutu Lembaga Farmasi Direktorat Kesehatan Angkatan Darat.
14. Bapak/Ibu serta seluruh staf Lembaga Farmasi Direktorat Kesehatan
Angkatan Darat yang telah memberikan bantuan, pengalaman, bimbingan,
dan kerjasama selama pelaksanaan PKPA.
15. Rekan-rekan mahasiswa Profesi Apoteker UI, UNPAD, UNAIR,UP dan
UNAND atas kerjasamanya selama mengikuti PKPA di Lafi Ditkesad.
Penulis menyadari bahwa dalam penulisan laporan ini masih banyak
terdapat kekurangan dan kesalahan. Kami berharap semoga pengetahuan dan
pengalaman yang kami peroleh selama menjalani praktek kerja profesi apoteker
ini dapat memberikan manfaat bagi rekan-rekan sejawat dan semua pihak yang
memerlukan.
Bandung, Mei 2010
DAFTAR ISI
Halaman
JUDUL ... i
LEMBAR PENGESAHAN ... ii
KATA PENGANTAR ... iii
DAFTAR ISI ... v
DAFTAR TABEL ... xiii
DAFTAR LAMPIRAN ... ix
BAB I PENDAHULUAN ... 1
1.1Latar Belakang ... 1
1.2Tujuan Praktek Kerja Profesi ... 3
1.3Metodologi Praktek Kerja Profesi Apoteker ... 3
1.4Waktu & Tempat Pelaksanaan Praktek Kerja Profesi Apoteker ... 3
BAB II TINJAUAN PUSTAKA ... 4
2.1 Industri Farmasi ... 4
2.1.1 Pengertian Industri Farmasi ... 4
2.1.2 Izin Usaha Industri Farmasi ... 4
2.2 Cara Pembuatan Obat yang Baik ... 4
2.2.1 Manajemen Mutu ... 5
2.2.2 Personalia ... 6
2.2.3 Bangunan dan Fasilitas ... 6
2.2.4 Peralatan ... 6
2.2.5 Sanitasi dan Higiene ... 7
2.2.7 Pengawasan Mutu ... 8
2.2.8 Inspeksi Diri dan Audit Mutu ... 9
2.2.8.1 Inspeksi Diri ... ... 9
2.2.8.2 Audit Mutu ... ... 9
2.2.9 Penanganan Keluhan Terhadap Produk, Penarikan Kembali Produk dan Produk Kembalian ... 10
2.2.10 Dokumentasi ... 10
2.2.11 Pembuatan dan Analisis Berdasarkan Kontrak ... 11
2.2.12 Kualifikasi dan Validasi ... 11
2.2.12.1 Kualifikasi ... 11
2.2.12.2 Validasi .... ... 12
BAB III TINJAUAN KHUSUS LEMBAGA FARMASI DIREKTORAT KESEHATAN ANGKATAN DARAT... 14
3.1 Visi, Misi dan Tujuan Lafi Ditkesad ... 14
3.1.1 Visi ... 14
3.1.2 Misi ... 14
3.2 Kedudukan, Tugas Pokok dan Fungsi Lafi Ditkesad ... 14
3.3 Kualifikasi Tenaga Kerja Lafi Ditkesad ... 15
3.4 Sertifikasi CPOB Lafi Ditkesad ... 15
3.5 Kegiatan Lafi Ditkesad ... 16
3.5.1 Kegiatan Bagminlog ... 16
3.5.2 Kegiatan Instalasi Produksi ... 17
3.5.3 Kegiatan Instalasi Pengawasan Mutu ... 20
3.5.4 Kegiatan Instalasi Penyimpanan ... 22
3.5.6 Kegiatan Instalasi Pemeliharaan dan Sisjang... 23
BAB IV PEMBAHASAN... 35
4.1 Manajemen Mutu ... 35
4.2 Personalia ... 36
4.3 Bangunan dan Fasilitas ... 36
4.3.1 Instalasi Produksi ... 37
4.3.2 Instalasi Penyimpanan ... 38
4.3.3 Instalasi Pengawasan Mutu ... 38
4.3.4 Instalasi Pemeliharaan dan Sistem Penunjang ... 38
4.4 Peralatan... 39
4.5 Sanitasi dan Higiene ... 39
4.6 Produksi ... 40
4.7 Pengawasan Mutu ... 41
4.8 Inspeksi Diri ... 42
4.9 Penanganan Keluhan Terhadap Obat, Penarikan Kembali Obat dan Obat Kembalian ... 42
4.10 Dokumentasi ... 42
4.11 Pembuatan dan analisis berdasarkan kontrak ... 43
4.12 Kualifikasi dan Validasi ………... 43
BAB V KESIMPULAN DAN SARAN ... 46
5.1 Kesimpulan ... 46
5.2 Saran ... 46
BAB VI TUGAS KHUSUS: STUDI PRAFORMULASI TABLET KLORDIAZEPOKSID DENGAN VITAMIN B1,B6, DAN B12 .... 47
6.1.1 Latar Belakang ... 47
6.1.2 Tujuan ... 47
6.2 Tinjauan Umum ... 48
6.2.1 Defenisi Tablet ... 48
6.2.2 Komposisi Umum Sediaan Tablet ... 48
6.2.3 Metode Pembuatan Tablet ... 49
6.3 Studi Praformulasi ... 52
6.3.1 Spesifikasi Zat Aktif ... 52
6.3.2 Spesifikiasi Bahan Tambahan ... 55
6.3.3 Formulasi ... 59
6.4 Pembahasan ... 65
6.5 Kesimpulan ... 67
6.5.1 Kesimpulan ... 67
6.5.2 Saran ... 67
DAFTAR PUSTAKA ... 68
DAFTAR TABEL
Halaman
Tabel 1. Data Personil Lafi Ditkesad Bulan Mei 2010
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Blanko Laporan Hasil Pengujian Laboratorium ... 69
Lampiran 2. Blanko Catatan Pengujian Tablet dan Kapsul ... 70
Lampiran 3. Blanko Laporan Hasil Pengujian Larutan/ Sirup/ Injeksi ... 71
Lampiran 4. Blanko Laporan Hasil Pengujian Salep/ Krim ... 72
Lampiran 5. Alur Proses Produksi Tablet Biasa/Salut Secara Granulasi Basah ... 73
Lampiran 6. Alur Proses Produksi Tablet Biasa/Salut Secara Granulasi Basah ... 74
Lampiran 7. Alur Produksi Kapsul ... 75
Lampiran 8. Alur Proses Produksi Sirup Kering ... 76
Lampiran 9. Alur Proses Produksi Sediaan Cairan Obat Luar ... 77
Lampiran 10. Alur Proses Produksi Sirup ... 78
Lampiran 11. Skema IPAL ... 79
BAB I PENDAHULUAN 1.1Latar Belakang
Salah satu sarana pelayanan kesehatan untuk melayani kebutuhan akan
obat adalah industri farmasi. Menurut SK Menkes No. 245/Menkes/SK/V/1990
industri farmasi adalah industri obat jadi dan industri bahan baku obat. Industri
obat jadi adalah industri yang memproduksi suatu produk yang telah melalui
seluruh tahap proses pembuatan. Obat jadi ini dapat berupa sediaan atau paduan
bahan yang siap digunakan untuk mempengaruhi sistem fisiologi atau keadaan
patologi dalam rangka penetapan diagnosa, pencegahan, penyembuhan,
pemulihan, peningkatan kesehatan dan kontrasepsi. Industri farmasi merupakan
salah satu tempat dimana apoteker melakukan pekerjaan kefarmasian terutama
menyangkut pengadaan, pengolahan dan pengemasan, pengendalian mutu sediaan
farmasi, penyimpanan, pendistribusian dan pengembangan obat.
Sasaran utama industri farmasi adalah memproduksi obat jadi dengan
mengutamakan keamanan, keefektifan, kualitas dan harga yang terjangkau oleh
masyarakat. Untuk menghasilkan obat jadi yang memenuhi persyaratan yang telah
ditetapkan sesuai dengan tujuan penggunaannya, setiap industri farmasi harus
menerapkan CPOB (Cara Pembuatan Obat yang Baik).
Pemerintah Indonesia melalui Departemen Kesehatan dengan Keputusan
Menkes No. 43/Menkes/SK/II/1988 tentang CPOB, yang kemudian direvisi
dengan Keputusan Kepala Badan Pengawasan Obat dan Makanan No: HK.
00.05.3.02152 tahun 2001 tentang CPOB yang mengharuskan pembuatan obat
seluruh aspek dan serangkaian kegiatan produksi sehingga obat jadi yang
dihasilkan memenuhi syarat mutu yang ditentukan dan sesuai dengan tujuan
penggunaannya. Pedoman CPOB hendaklah diperbaiki secara berkesinambungan
mengikuti perkembangan ilmu pengetahuan dan teknologi untuk mengantisipasi
era globalisasi dan harmonisasi di bidang farmasi terutama pemenuhan terhadap
persyaratan dan standar produk farmasi global terkini. Oleh karena itu, pedoman
CPOB edisi 2001 direvisi kembali menjadi pedoman CPOB yang dinamis edisi
tahun 2006, berdasarkan Surat Keputusan Kepala Badan Pengawas Obat dan
Makanan No: HK. 00.06.0511 tanggal 24 Januari 2006. Hal yang perlu
diperhatikan untuk menjamin mutu obat yang dihasilkan antara lain pengadaan
bahan baku, proses pembuatan dan pengawasan mutu, bangunan, peralatan yang
digunakan serta personel yang terlibat dalam proses pembuatan obat tersebut.
Pelaksanaan pedoman CPOB di industri farmasi membutuhkan peranan
apoteker, sehingga seorang apoteker dituntut memiliki pengetahuan dan
keterampilan yang memadai. Tuntutan tersebut dapat diperoleh salah satunya
melalui praktek kerja di industri farmasi yang telah melaksanakan produksi sesuai
dengan pedoman CPOB.
Sebagai upaya untuk memberikan wawasan yang luas tentang industri
farmasi bagi mahasiswa profesi apoteker, maka Fakultas Farmasi Universitas
Sumatera Utara Medan bekerja sama dengan Lembaga Farmasi Direktorat
Kesehatan Angkatan Darat (Lafi Ditkesad) Bandung memberikan kesempatan
bagi calon apoteker untuk mengenal lingkungan kerja dan memperluas
pengetahuan tentang industri farmasi melalui program Praktek Kerja Profesi
1.2Tujuan Praktek Kerja Profesi
Adapun tujuan praktek kerja profesi apoteker yang dilakukan di Lafi
Ditkesad, sebagai berikut:
1. Mengetahui dan memahami bagaimana pengelolaan industri farmasi secara
profesional serta melihat tentang penerapan aspek CPOB di industri farmasi.
2. Mengetahui dan memahami tugas dan tanggung jawab apoteker di industri,
sehingga dapat dijadikan bekal guna mempersiapkan diri dalam menghadapi
dunia kerja sesungguhnya.
1.3 Metodologi Praktek Kerja Profesi Apoteker
Metodologi Praktek Kerja Profesi Apoteker yang dilakukan di Lembaga
Farmasi Direktorat Kesehatan Angkatan Darat adalah:
a. Melakukan kunjungan langsung ke instalasi-instalasi di lingkungan Lafi
Ditkesad.
b. Interaksi langsung mahasiswa dengan pihak-pihak terkait.
c. Diskusi dengan para pembimbing dan antar mahasiswa.
d. Pemberian materi oleh kepala masing-masing instalasi di Lafi Ditkesad.
1.4 Waktu dan Tempat Pelaksanaan Praktek Kerja Profesi Apoteker
Pelaksanaan Praktek Kerja Profesi Apoteker dilakukan pada tanggal 3-31
Mei 2010 di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat Jl. Gudang
BAB II
TINJAUAN PUSTAKA 2.1 Industri Farmasi
2.1.1 Pengertian Industri Farmasi
Industri farmasi menurut Surat Keputusan Menteri Kesehatan Republik
Indonesia Nomor 245/Menkes/SK/V/1990 terdiri dari industri obat jadi dan
industri bahan baku obat. Industri obat jadi adalah industri yang memproduksi
suatu produk obat yang telah melalui seluruh tahap proses pembuatan, dimana
obat jadi tersebut dapat berupa sediaan atau bahan-bahan yang sering digunakan
untuk mempengaruhi atau menyelidiki sistem fisiologis atau keadaan patologi
dalam rangka penetapan diagnosis, pencegahan, penyembuhan, pemulihan,
peningkatan kesehatan dan kontrasepsi. Industri bahan baku adalah industri yang
memproduksi bahan baku dimana bahan baku tersebut adalah seluruh bahan, baik
berkhasiat ataupun tidak berkhasiat yang digunakan dalam proses pengolahan
obat.
2.1.2 Izin usaha industri farmasi
Izin usaha industri farmasi diberikan oleh Menteri Kesehatan dan
wewenang pemberian izin dilimpahkan kepada Badan Pengawasan Obat dan
Makanan (BPOM). Izin ini berlaku seterusnya selama industri tersebut
berproduksi dengan perpanjangan izin setiap 5 tahun.
2.2 Cara Pembuatan Obat yang Baik (CPOB)
CPOB merupakan pedoman yang harus diterapkan dalam seluruh
rangkaian proses di industri farmasi dalam pembuatan obat jadi, sesuai dengan
Pembuatan Obat yang Baik. Pedoman CPOB bertujuan untuk menghasilkan
produk obat yang senantiasa memenuhi persyaratan mutu yang telah ditetapkan
sesuai dengan tujuan penggunaannya.
Perkembangan yang sangat pesat dalam teknologi farmasi menyebabkan
perubahan-perubahan yang sangat cepat pula dalam konsep serta persyaratan
CPOB. Konsep CPOB yang bersifat dinamis yang memerlukan penyesuaian dari
waktu ke waktu mengikuti perkembangan teknologi di bidang farmasi.
Aspek-aspek yang merupakan cakupan CPOB tahun 2006 meliputi 12 Aspek-aspek yang
dibicarakan, yaitu:
2.2.1 Manajemen Mutu
Industri farmasi harus membuat obat sedemikian rupa agar sesuai dengan
tujuan penggunaannya, memenuhi persyaratan yang tercantum dalam dokumen
izin edar (registrasi) dan tidak menimbulkan resiko yang membahayakan
penggunanya karena tidak aman, mutu rendah atau tidak efektif. Manajemen
bertanggung jawab untuk mencapai tujuan ini melalui suatu “kebijakan mutu”
yang memerlukan partisipasi dan komitmen dari semua jajaran departemen di
dalam perusahaan, para pemasok dan para distributor. Untuk mencapai tujuan
mutu secara konsisten dan dapat diandalkan, diperlukan manjemen mutu yang
didesain secara menyeluruh dan diterapkan secara benar.
Semua bagian sistem pemastian mutu hendaklah didukung dengan
tersedianya personil yang kompeten, bangunan dan sarana serta peralatan yang
cukup dan memadai. Pemastian mutu adalah totalitas semua pengaturan yang
dibuat dengan tujuan untuk memastikan bahwa obat dihasilkan dengan mutu yang
2.2.2 Personalia
Jumlah personil di semua tingkat harus memadai serta memiliki
pengetahuan, keterampilan dan kemampuan yang sesuai dengan tanggung
jawabnya. Kesehatan mental dan fisik yang baik harus dimiliki personil agar
mampu melaksanakan tugas secara profesional. Selain itu, para personil
hendaklah memiliki sikap dan kesadaran tinggi untuk mewujudkan CPOB.
2.2.3 Bangunan dan Fasilitas
Bangunan untuk pembuatan obat hendaklah memiliki ukuran, rancangan,
konstruksi serta letak yang memadai agar memudahkan pelaksanaan kerja,
pembersihan dan pemeliharaan, tiap sarana kerja hendaklah memadai, sehingga
setiap resiko terjadi kekeliruan, pencemaran silang dan berbagai kesalahan lain
yang dapat menurunkan mutu obat dapat dihindarkan.
2.2.4 Peralatan
Peralatan yang digunakan dalam pembuatan obat hendaklah memiliki
rancangan bangunan dan konstruksi yang tepat, ukuran yang memadai serta
ditempatkan dengan tepat sehingga mutu setiap produk obat terjamin secara
seragam dari bets ke bets serta untuk memudahkan pembersihan dan
perawatannya.
1. Rancang Bangun dan Konstruksi
a. Peralatan yang digunakan tidak bereaksi atau menimbulkan akibat
terhadap bahan yang diolah.
b. Peralatan hendaklah mudah dibersihkan baik bagian dalam maupun
c. Peralatan yang digunakan untuk menimbang, mengukur, menguji dan
mencatat hendaklah diperiksa ketelitiannya secara teratur serta ditara
menurut program dan prosedur yang tepat, hasil pemeriksaannya dicatat
dan disimpan dengan baik.
d. Penyaring untuk cairan tidak boleh melepaskan serat ke dalam produk.
2. Pemeliharaan
a. Peralatan hendaknya dirawat sesuai jadwal yang tepat agar berfungsi
dengan baik dan mencegah pencemaran.
b. Prosedur-prosedur tertulis untuk peralatan dibuat dan dipatuhi.
2.2.5 Sanitasi dan Higiene
Tingkat sanitasi dan higiene yang tinggi hendaklah diterapkan pada setiap
aspek pembuatan obat. Ruang lingkup sanitasi dan higiene meliputi personalia,
bangunan, peralatan dan perlengkapan, bahan produksi serta wadahnya dan setiap
hal yang merupakan sumber pencemaran produk. Sumber pencemaran hendaknya
dihilangkan melalui suatu program sanitasi dan higiene yang menyeluruh dan
terpadu.
2.2.6 Produksi
Produksi hendaklah dilaksanakan dengan mengikuti prosedur yang telah
ditetapkan dan memenuhi ketentuan CPOB yang menjamin senantiasa
menghasilkan produk yang memenuhi persyaratan mutu serta memenuhi
ketentuan izin pembuatan dan izin edar (registrasi).
Prinsip utama produksi adalah:
b. Proses produksi dan pengemasan senantiasa menghasilkan produk yang
seidentik mungkin (dalam batas syarat mutu) baik bagi bets yang sudah
diproduksi maupun yang akan diproduksi.
Prosedur produksi dibuat oleh penanggung jawab produksi bersama
dengan penanggung jawab pengawasan mutu yang dapat menjamin obat yang
dihasilkan memenuhi spesifikasi yang dibutuhkan. Pada proses produksi, mutu
produk yang dihasilkan sangat ditentukan oleh bahan awal, proses produksi,
personil, dan sistem tervalidasi.
Tekanan udara dalam ruangan yang memiliki resiko yang lebih tinggi
terhadap suatu produk hendaklah selalu lebih tinggi daripada ruangan lain. Bila
suatu pintu dibuka, tekanan atau hembusan udara dari arah ruangan yang beresiko
tinggi hendaklah cukup mampu untuk menciptakan arus udara ke arah ruang yang
beresiko lebih rendah untuk menghindarkan pencemaran balik.
2.2.7 Pengawasan Mutu
Pengawasan mutu merupakan bagian yang esensial dari cara pembuatan
obat yang baik untuk memberikan kepastian bahwa produk secara konsisten
mempunyai mutu yang sesuai dengan tujuan pemakaiannya.
Pengawasan mutu hendaklah mencakup semua kegiatan analitis yang
dilakukan di laboratorium, termasuk pengambilan sampel, pemeriksaan dan
pengujian bahan awal, produk antara, produk ruahan dan produk jadi. Kegiatan ini
juga mencakup uji stabilitas, pengujian yang dilakukan dalam rangka validasi,
penanganan sampel pertinggal, menyusun dan memperbaharui spesifikasi bahan,
Dokumentasi dan prosedur pelulusan yang diterapkan bagian pengawasan
mutu hendaklah menjamin bahwa pengujian yang diperlukan telah dilakukan
sebelum bahan digunakan dalam produksi dan produk disetujui sebelum
didistribusikan. Personil pengawasan mutu hendaklah memiliki akses ke area
produksi untuk melakukan pengambilan sampel dan investigasi bila diperlukan.
2.2.8 Inspeksi Diri dan Audit Mutu 2.2.8.1 Inspeksi Diri
Tujuan inspeksi diri adalah untuk mengevaluasi apakah semua aspek
produksi dan pengawasan mutu industri farmasi memenuhi ketentuan CPOB.
Program inspeksi diri hendaklah dirancang untuk mendeteksi kelemahan dalam
pelaksanaan CPOB dan untuk menetapkan tindakan perbaikan yang diperlukan.
Inspeksi diri dilakukan secara independen dan rinci oleh petugas yang kompeten
dari perusahaan. Inspeksi diri dilakukan secara rutin dan di samping itu, pada
situasi khusus, misalnya dalam hal terjadi penarikan kembali obat jadi atau terjadi
penolakan yang berulang. Prosedur dan catatan inspeksi diri hendaklah
didokumentasikan dan dibuat program tindak lanjut yang efektif.
Inspeksi meliputi personil, bangunan, penyimpanan, bahan awal, obat jadi,
produksi, pengawasan mutu, dokumentasi dan pemeliharaan gedung serta
peralatan.
2.2.8.2 Audit Mutu
Penyelenggaraan audit mutu berguna sebagai pelengkap inspeksi diri.
Audit mutu meliputi pemeriksaan dan penilaian semua atau sebagian dari sistem
Audit mutu umumnya dilaksanakan oleh spesialis dari luar atau
independen atau tim yang dibentuk khusus dalam hal ini oleh manajemen
perusahaan. Audit mutu juga dapat diperluas terhadap pemasok dan penerima
kontrak.
2.2.9 Penanganan Keluhan Terhadap Produk, Penarikan Kembali Produk dan Produk Kembalian
Penarikan kembali produk adalah suatu proses penarikan kembali dari satu
atau beberapa bets atau seluruh bets produk tertentu dari rantai distribusi karena
keputusan bahwa produk tidak layak lagi untuk diedarkan.
Produk kembalian adalah obat jadi yang telah keluar dari industri atau
beredar, yang kemudian dikembalikan ke industri karena kerusakan, kadaluarsa,
atau alasan lain misalnya kondisi wadah atau kemasan yang dapat menimbulkan
keraguan akan identitas, mutu, keamanan obat serta kesalahan administratif yang
menyangkut jumlah dan jenis. Semua keluhan dan informasi lain yang berkaitan
dengan kemungkinan terjadi kerusakan obat, dapat bersumber dari dalam maupun
dari luar industri, dan memerlukan penanganan serta pengkajian secara teliti.
Keluhan atau informasi yang bersumber dari dalam industri antara lain
dari bagian produksi, bagian pengawasan mutu, bagian gudang, dan bagian
pemasaran, sementara dari luar industri antara lain dapat berasal dari pasien,
dokter, paramedik, klinik, rumah sakit, apotek, distributor.
2.2.10 Dokumentasi
Dokumentasi adalah bagian dari sistem manajemen informasi dan
dokumentasi yang baik merupakan bagian yang esensial dari pemastian mutu.
Dokumentasi sangat penting untuk memastikan bahwa setiap petugas mendapat
sehingga memperkecil resiko terjadinya kekeliruan yang biasanya timbul karena
mengandalkan komunikasi lisan.
2.2.11 Pembuatan dan Analisis Berdasarkan Kontrak
Pembuatan dan analisis berdasarkan kontrak harus dibuat secara benar,
disetujui dan dikendalikan untuk menghindari kesalahpahaman yang dapat
menyebabkan produk atau pekerjaan dengan mutu yang tidak memuaskan.
Kontrak tertulis antara pemberi kontrak dan penerima kontrak harus dibuat secara
jelas menentukan tanggung jawab dan kewajiban masing-masing pihak. Kontrak
harus menyatakan secara jelas prosedur pelulusan tiap bets produk untuk
diedarkan yang menjadi tanggung jawab penuh kepala bagian manajemen mutu.
2.2.12 Kualifikasi dan Validasi 2.2.12.1 Kualifikasi
Kualifikasi adalah “kegiatan pembuktian” bahwa perlengkapan, fasilitas
atau sistem yang digunakan dalam suatu proses/sistem akan selalu bekerja sesuai
dengan kriteria yang diinginkan dan konsisten.
Validasi/kualifikasi mesin, peralatan produksi dan sarana penunjang terdiri
dari 4 tingkatan, yaitu:
a. Kualifikasi Rancangan (Design Qualification)
Kualifikasi rancangan adalah unsur pertama dalam melakukan validasi
terhadap fasilitas, sistem atau peralatan baru. Tujuannya adalah untuk menjamin
dan mendokumentasikan bahwa sistem atau peralatan atau bangunan yang akan
dipasang atau dibangun sesuai dengan ketentuan atau spesifikasi yang diatur
dalam ketentuan CPOB yang berlaku. Kualifikasi ini dilakukan sebelum
b. Kualifikasi Instalasi (Installation Qualification)
Tujuannya adalah untuk menjamin dan mendokumentasikan bahwa sistem
atau peralatan yang diinstalasi sesuai dengan spesifikasi yang tertera pada
dokumen pembelian, manual alat yang bersangkutan dan pemasangannya
dilakukan memenuhi spesifikasi yang telah ditetapkan. Kualifikasi instalasi
dilakukan pada waktu instalasi (pemasangan baru), modifikasi atau pemindahan
alat yang bersangkutan.
c. Kualifikasi Operasional (Operational Qualification)
Tujuannya adalah untuk menjamin dan mendokumentasikan bahwa sistem
atau peralatan yang telah diinstalasi bekerja (beroperasi) sesuai dengan
spesifikasi yang diinginkan. Kualifikasi operasional dilakukan setelah
kualifikasi instalasi (pemasangan baru), modifikasi atau pemindahan alat yang
bersangkutan.
d. Kualifikasi Kinerja (Performance Qualification)
Tujuannya adalah untuk menjamin dan mendokumentasikan bahwa sistem
atau peralatan yang telah diinstalasi bekerja sesuai dengan spesifikasi yang
diinginkan dengan cara menjalankan sistem sesuai dengan tujuan penggunaan.
2.2.12.2 Validasi
CPOB mensyaratkan industri farmasi untuk mengidentifikasi validasi yang
perlu dilakukan sebagai bukti pengendalian terhadap aspek kritis dari kegiatan
yang dilakukan. Seluruh kegiatan validasi hendaklah direncanakan.
a. Validasi Metode Analisa
Tujuannya adalah untuk membuktikan bahwa semua metode analisa yang
hasil yang diinginkan secara konsisten. Dalam validasi metode analisa yang
divalidasi adalah Protap atau Prosedur Tetap pengujian yang bersangkutan.
Protap tersebut bisa dibuat oleh bagian pengawasan mutu. Apabila protap
belum tersedia maka harus dibuat terlebih dahulu, baru divalidasi.
b. Validasi Proses Produksi
Tujuannya adalah untuk memberikan dokumentasi secara tertulis bahwa
prosedur produksi yang berlaku dan digunakan dalam proses produksi rutin
(batch processing record), senantiasa mencapai hasil yang diinginkan secara
terus-menerus.
c. Validasi Proses Pengemasan
Tujuannya adalah:
− Memberikan dokumentasi secara tertulis bahwa prosedur pengemasan
yang berlaku dan digunakan dalam proses pengemasan rutin (batch
packaging record) sesuai dengan persyaratan rekonsiliasi yang telah
ditentukan, secara konsisten.
− Proses pengemasan yang dilakukan, tidak terjadi peristiwa mix-up (campur
baur) antar produk maupun antar bets.
d. Validasi Pembersihan
Tujuannya adalah:
− Memberikan dokumentasi secara tertulis bahwa prosedur pembersihan
yang berlaku dan digunakan sudah tepat dan dapat dilakukan
berulang-ulang (reliable and reproducible).
− Peralatan/mesin yang dibersihkan tidak terdapat pengaruh yang negatif
BAB III
TINJAUAN KHUSUS LEMBAGA FARMASI DIREKTORAT KESEHATAN ANGKATAN DARAT
3.1 Visi, Misi dan Tujuan Lafi Ditkesad 3.1.1 Visi
Visi Lafi Ditkesad adalah menjadi salah satu lembaga produksi yang
mampu memenuhi kebutuhan obat yang bermutu bagi prajurit dan PNS TNI
Angkatan Darat serta keluarganya.
3.1.2 Misi
Lafi Ditkesad mempunyai misi sebagai berikut:
− Memberikan jasa dan informasi yang terbaik terhadap penggunaan obat
(rational use of drug).
− Membantu fungsi pelayanan kesehatan atas ketersediaan obat atau produk
kesehatan lainnya untuk prajurit dan PNS TNI Angkatan Darat serta
keluarganya.
− Terlibat secara aktif dalam fungsi dukungan kesehatan pada penggunaan
kekuatan untuk prajurit tugas operasi.
− Memanfaatkan kapabilitas atau kemampuan produksi untuk kepentingan
strategis.
3.2 Kedudukan, Tugas Pokok dan Fungsi Lafi Ditkesad
Lafi Ditkesad adalah badan pelaksana di tingkat Ditkesad yang
berkedudukan langsung di bawah Direktur Kesehatan Angkatan Darat (Dirkesad).
pembinaan dan melaksanakan produksi, penelitian dan pengembangan obat dalam
rangka mendukung tugas pokok Ditkesad.
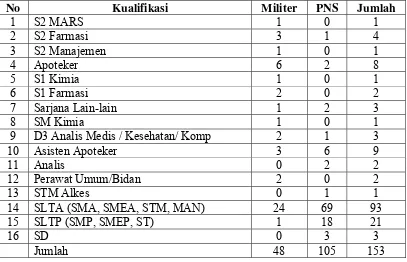
3.3 Kualifikasi Tenaga Kerja Lafi Ditkesad
Berdasarkan statusnya, personil Lafi Ditkesad terdiri dari militer dan
Pegawai Negeri Sipil (PNS). Adapun data personil Lafi Ditkesad Bulan Mei 2010
[image:25.595.110.517.278.540.2]berdasarkan jenjang pendidikannya dapat dilihat pada Tabel 1.
Tabel 1. Data Personil Lafi Ditkesad Bulan Mei 2010 Berdasarkan Jenjang Pendidikannya.
No Kualifikasi Militer PNS Jumlah
1 S2 MARS 1 0 1
2 S2 Farmasi 3 1 4
3 S2 Manajemen 1 0 1
4 Apoteker 6 2 8
5 S1 Kimia 1 0 1
6 S1 Farmasi 2 0 2
7 Sarjana Lain-lain 1 2 3
8 SM Kimia 1 0 1
9 D3 Analis Medis / Kesehatan/ Komp 2 1 3
10 Asisten Apoteker 3 6 9
11 Analis 0 2 2
12 Perawat Umum/Bidan 2 0 2
13 STM Alkes 0 1 1
14 SLTA (SMA, SMEA, STM, MAN) 24 69 93
15 SLTP (SMP, SMEP, ST) 1 18 21
16 SD 0 3 3
Jumlah 48 105 153
3.4 Sertifikasi CPOB Lafi Ditkesad
Sertifikasi CPOB yang telah diterima oleh Lafi Ditkesad sampai bulan
Februari 2007 ditujukan untuk sediaan Betalaktam dan non Betalaktam.
a. Sertifikat CPOB untuk Sediaan Betalaktam:
1) Tablet Antibiotika Penisilin dan turunannya
2) Tablet salut Antibiotika Penisilin dan turunannya
4) Suspensi kering oral Antibiotika Penisilin dan turunannya
5) Serbuk steril injeksi Antibiotika Penisilin dan turunannya
b. Sertifikat CPOB untuk Sediaan non Betalaktam:
1) Tablet biasa non Antibiotik
2) Tablet salut non Antibiotik
3) Kapsul keras non Antibiotik
4) Serbuk oral non Antibiotik
5) Cairan obat luar non Antibiotik
Sertifikasi ini merupakan pengakuan Badan Pengawas Obat dan Makanan
yang berlaku selama industri menjalankan prinsip CPOB yang telah ditetapkan.
3.5 Kegiatan Lafi Ditkesad
Kegiatan Lafi Ditkesad dalam melaksanakan tugas dan fungsi produksi
obat-obatan meliputi perencanaan dan pengadaan barang, penyimpanan barang,
proses produksi, pengawasan mutu, penelitian dan pengembangan, pemeliharaan
dan kegiatan administrasi.
3.5.1 Kegiatan Bagminlog
Perencanaan dan pengadaan barang untuk produksi obat Lafi Ditkesad
dilakukan berdasarkan data dari Sub Direktorat Pembinaan Pelayanan Kesehatan
(Subditbinyankes) yang disusun berdasarkan masukan pola penyakit dari daerah
dan laporan dari masing-masing Kesehatan Daerah Militer (Kesdam), Satuan
Kesehatan (Satkes) dan Rumah Sakit Pusat Angkatan Darat (RSPAD). Rencana
pengadaan obat kemudian dibuat dengan melakukan penyesuaian antara daftar
kebutuhan obat dengan anggaran yang tersedia dan selanjutnya dianalisa dan
Bagminlog membuat rencana kebutuhan produksi obat Lafi Ditkesad yang
terdiri dari rencana kebutuhan bahan aktif, bahan pembantu dan bahan pengemas
(embalage). Perencanaan tersebut disusun berdasarkan formula dan spesifikasi
obat yang telah ditentukan oleh Lafi Ditkesad, disamping itu Bagminlog juga
menyusun rencana dan anggaran untuk pemeliharaan sarana operasional yang
digunakan di tiap instalasi atau bagian di Lafi Ditkesad.
Penerimaan barang dilakukan oleh Ditkesad melalui panitia pengadaan,
kemudian Dirkesad membentuk tim komisi penerimaan barang yang bertugas
memeriksa keadaan barang secara administrasi dan fisik, uji kimia dan uji mutu
dilakukan oleh Instalwastu. Setelah barang lulus uji mutu maka dibuat Laporan
Hasil Pengujian (LHP) dan Berita Acara (BA) penerimaan. Bila barang yang
dikirim tidak sesuai dengan spesifikasi diminta atau tidak memenuhi syarat, maka
barang akan dikembalikan untuk diganti, kemudian barang yang lolos administrasi
dan uji mutu dikirim ke Gudang Pusat II yang disertai dengan surat Perintah
Penerimaan Material (PPnM).
3.5.2 Kegiatan Instalasi Produksi (Instalprod)
Produk yang dihasilkan oleh Lafi Ditkesad berupa produk Betalaktam dan
produk non Betalaktam, dimana masing-masing produk dikerjakan pada gedung
yang berbeda. Pada instalasi produksi terdapat empat seksi yaitu: seksi
non-betalaktam, seksi sediaan non-betalaktam, seksi sediaan sefalosporin dan seksi kemas.
Masing-masing seksi dikepalai oleh seorang Apoteker.
Obat-obat yang diproduksi oleh Lafi Ditkesad tidak diperdagangkan bagi
masyarakat umum, sudah memiliki nomor registrasi dan proses produksinya tetap
Seluruh proses produksi yang dilaksanakan, dicatat dan didokumentasikan
dalam Catatan Pengolahan Bets dan Catatan Pengemasan Bets (Batch Record)
yang disusun oleh tim CPOB dan disetujui oleh Kainstalprod dan Kainstalwastu,
kemudian didistribusikan dan didokumentasikan. Hal yang diuraikan dalam
catatan pengolahan bets dan catatan pengemasan bets adalah kode produk, nama
produk, nomor bets, besar bets, bentuk sediaan, kemasan, tanggal dan cara
pengolahan serta tanggal dan cara pengemasan.
Selain itu dalam catatan pengolahan bets diuraikan mengenai komposisi,
spesifikasi, peralatan, penimbangan bahan, prosedur pengolahan dan rekonsiliasi.
Pada catatan pengemasan bets dicantumkan tentang penerimaan bahan pengemas,
prosedur pengemasan primer, prosedur pengemasan sekunder, pelulusan oleh
pengawasan mutu, rekonsiliasi pengemasan dan pengiriman obat jadi ke instalasi
penyimpanan.
Proses produksi dimulai dari penimbangan bahan baku yang akan
digunakan dan dikeluarkan dari instalasi penyimpanan berdasarkan catatan
pengolahan bets dan catatan pengemasan bets untuk setiap produk. Barang yang
telah dikeluarkan dari instalasi penyimpanan selanjutnya memasuki tahap
pengolahan pada masing-masing seksi produksi
1. Seksi Sediaan Non Betalaktam (Sidia Non Betalaktam)
Seksi sediaan Non Betalaktam dipimpin oleh seorang Apoteker yang
bertanggung jawab kepada Kepala Instalasi produksi. Pada seksi ini memproduksi
obat-obatan yang terdiri dari: sediaan tablet, sediaan kapsul, salep, sirup basah dan
2. Seksi Sediaan Betalaktam
Seksi sediaan betalaktam dikepalai oleh seorang kepala seksi yang
bertanggung jawab kepada Kepala Instalasi Produksi. Produksi Betalaktam di Lafi
Ditkesad telah mendapatkan sertifikat CPOB pada tanggal 1 Juni 2000. Proses
produksi Betalaktam dilakukan pada gedung yang terpisah dengan produksi non-
betalaktam untuk menghindari terjadinya pencemaran silang. Gedung produksi
betalaktam telah dilengkapi dengan sistem pengaturan udara (Air Handling
System), air washer, air shower, dan ruang penyangga (air lock). Lantai, dinding
dan langit-langit dilapisi oleh bahan epoksi untuk memudahkan pembersihan.
Produk yang dihasilkan saat ini oleh Seksi sediaan Betalaktam Lafi
Ditkesad yaitu:
a.Kapsul Ampisillin 250 mg
b.Kapsul Amoksisillin 250 mg
c.Sirup kering Ampisillin 60 ml
d.Sirup kering Amoksisillin 60 ml
e.Kaplet Amoksisillin 500 mg
f.Kaplet Ampisillin 500 mg
3. Seksi Sediaan Sefalosporin
Seksi sediaan sefalosporin dikepalai oleh seorang kepala seksi yang
bertanggung jawab kepada Kepala Instalasi Produksi. Produksi Sefalosporin
belum dimulai karena bangunan produksi untuk sefalosporin belum siap untuk
4. Seksi Kemas
Pengemasan dilakukan pada produk ruahan tablet, kaplet, kapsul, sirup,
salep, dan cairan obat luar. Pengemasan tablet dilakukan setelah proses stripping.
Tablet yang sudah distrip, dipilih yang baik kemudian dimasukkan ke dalam sak
plastik dilengkapi dengan brosur lalu diseal, setiap sak plastik berisi 25 strip,
tiap-tiap strip berisi 10 tablet. Hasil seal kemudian dimasukkan ke dalam dus
dilengkapi dengan identitas berupa slip sak dimana setiap dus isinya berbeda
sesuai dengan ukuran diameter tablet yaitu:
a. Untuk tablet dengan diameter 6,5-7,5 mm, setiap dus berisi 50 sak plastik.
b. Untuk tablet dengan diameter 10-13 mm, setiap dus berisi 30 sak plastik.
c. Untuk kaplet dan kapsul, setiap dus berisi 20 sak plastik.
Setelah pengemasan selesai, dilakukan pemeriksaan oleh instalasi
pengawasan mutu dan tim komisi, kemudian instalasi pengawasan mutu
menempelkan label released di kemasan sekunder dan setelah diperiksa oleh tim
komisi seksi kemas membuat laporan administrasi yang terdiri dari laporan
bulanan dan bukti penyerahan obat jadi yang dikirim ke instalasi penyimpanan.
3.5.3 Kegiatan Instalasi Pengawasan Mutu (Instalwastu)
Pengawasan mutu merupakan bagian integral dari suatu produksi obat.
Instalasi pengawasan mutu bertanggung jawab terhadap setiap hal yang
menyangkut kualitas bahan baku obat, bahan pembantu, bahan pengemas, produk
antara, produk ruahan, dan obat jadi yang dihasilkan sampai dengan pemantauan
kualitas setelah didistribusikan (dengan standar waktu kadaluarsa). Selain itu
instalasi pengawasan mutu juga bertanggung jawab terhadap kualitas lingkungan
penunjang lainnya seperti pemeriksaan sirkulasi udara, pengendalian mutu air dan
pemeriksaan limbah. Pelaksanaan kegiatan di Instalwastu ditunjang oleh fasilitas
Instrumen HPLC, spektrofotometer dengan sistem terkomputerisasi, Laminar Air
Flow, Climatic Chamber, Dissolution Tester serta berbagai fasilitas penunjang
lainnya.
Dalam menjalankan tugasnya, instalasi pengawasan mutu didukung oleh
personil yang terdiri dari apoteker dan analis yang terlatih dan berpengalaman
dalam menjalankan tugasnya.
Kegiatan instalasi pengawasan mutu tersebut dilaksanakan pada tahap
persiapan, selama proses produksi dan setelah proses produksi.
Beberapa kegiatan instalasi pengawasan mutu diantaranya:
1. Menyiapkan metode pemeriksaan, pengujian dan validasi metoda analisa
yang sesuai dengan acuan standar resmi seperti Farmakope Indonesia.
2. Menyiapkan prosedur pengambilan sampel untuk pemeriksaan dan
pengujian, dimana setiap sampel yang diambil dicatat dan
didokumentasikan.
3. Menyiapkan dan menyimpan baku pembanding kerja untuk pengujian.
4. Menyimpan contoh pertinggal setiap bets produk jadi dan bahan baku serta
Catatan Pengujian atau Pemeriksaan.
5. Meluluskan atau menolak bahan yang akan digunakan dalam produksi
meliputi bahan baku obat, bahan baku pembantu dan bahan pengemas.
6. Melaksanakan In Process Control (IPC) selama proses produksi dan
memberikan keputusan atas diluluskan atau tidaknya hasil suatu tahap
produksi sampai hasil produk akhir.
7. Melaksanakan pengujian terhadap hasil jadi suatu sediaan yang diperoleh.
Dicatat pada Catatan Pengujian sediaan jadi (Blanko Hasil Pengujian
Laboratorium dapat dilihat pada Lampiran 2,3,4).
8. Meneliti dokumen produksi (Catatan Pengolahan Bets dan Catatan
Pengemasan Bets) sebelum obat diluluskan.
9. Melaksanakan uji stabilitas dipercepat untuk menetapkan kondisi
penyimpanan dan masa edar suatu produk.
10. Membantu pelaksanaan validasi proses produksi.
11. Memantau stabilitas produk-produk yang telah dikeluarkan atau
didistribusikan sampai beberapa waktu setelah batas kadaluarsa terutama
untuk sediaan antibiotika.
Hasil pengujian laboratorium yang dilaksanakan diringkas, dicatat dan
didokumentasikan dalam lembaran yang disebut Laporan Hasil Pengujian.
3.5.4 Kegiatan Instalasi Penyimpanan (Instalsimpan)
Instalasi penyimpanan (Instalsimpan) bertanggung jawab terhadap
penyimpanan barang-barang yang berkaitan dengan setiap proses kerja yang
berlangsung di Lafi Ditkesad yaitu produksi, pengawasan mutu, administrasi dan
logistik serta proses pendukung lainnya. Barang-barang yang disimpan di gudang
Kegiatan yang dilakukan oleh instalasi penyimpanan meliputi:
1. Menerima dan menyimpan bahan baku, bahan pendukung produksi,
reagensia, dan bahan lain serta peralatan produksi dari Gudang Pusat II.
2. Menyerahkan bahan baku, bahan pengemas, reagensia, dan bahan lain
serta peralatan kepada bagian dan instalasi yang membutuhkan.
3. Menerima obat jadi dari Instalasi Produksi
4. Menyerahkan obat jadi ke Gudang Pusat II.
3.5.5 Kegiatan Instalasi Penelitian dan Pengembangan (Installitbang)
Dalam menjalankan perannya, Installitbang melakukan penelitian terhadap
produk baru dan pengembangan produk lama untuk memperoleh kualitas yang
lebih baik. Pelaksanaan kegiatan dimulai dengan pengajuan rencana penelitian
dan pengembangan produk Lafi Ditkesad yang meliputi:
1. Membuat spesifikasi teknis bahan baku obat, bahan pembantu dan bahan
pengemas (embalage).
2. Mencari dan meneliti formula yang dapat dikembangkan sebagai produk Lafi
Ditkesad.
3. Merevisi ulang suatu formula yang sudah ditetapkan bila suatu saat terjadi
perubahan alat, bahan baku dan komponen produksi lainnya.
4. Mengadakan evaluasi terhadap keluhan yang terjadi dan obat kembalian.
3.5.6 Kegiatan Instalasi Pemeliharaan dan Sistem Penunjang
Instalasi pemeliharaan dan sistem penunjang merupakan pelaksana fungsi
pemeliharaan dan perbaikan terhadap alat produksi sehingga siap digunakan,
penatalaksanaan limbah industri, menyiapkan utilitas guna mendukung kegiatan
pemeliharaan dan perbaikan. Seluruh kegiatan pemeliharaan dan perbaikan
dilaporkan kepada Kalafi.
Fasilitas pendukung (utility) yang ada di Lafi Ditkesad adalah pengolahan
air baku farmasi, instalasi listrik, instalasi boiler (steam), instalasi udara
bertekanan, Instalasi Pengolahan Air Limbah (IPAL) dan sistem pengaturan udara
(AHS). Penanggung jawab pengolahan fasilitas utility ini adalah Kepala Instalasi
Pemeliharaan dan Sistem Penunjang (Kainstalhar & Sisjang).
Fasilitas utility terdiri dari:
1. Listrik
Sumber listrik Lafi Ditkesad berasal dari PLN dengan daya sebesar 1000
kW. Pada saat ini belum digunakan generator karena beberapa pertimbangan
antara lain karena jarang terjadi pemadaman listrik dari PLN dan penggunaan
generator terdapat delayed bila listrik dari PLN padam, tetapi pada produksi
steril diperlukan adanya aliran listrik secara terus-menerus.
2. Pengolahan Air Demineralisata
Sumber air bersih didapat dari suplai Perusahaan Daerah Air Minum
(PDAM) yang kemudian diolah menjadi air baku farmasi melalui instalasi
pengolahan air. Air baku farmasi adalah air yang telah memenuhi syarat untuk
digunakan sebagai bahan baku air untuk produksi steril maupun nonsteril.
Pemilihan PDAM sebagai sumber air oleh Lafi Ditkesad adalah karena
Jenis-jenis air di industri farmasi, terdiri dari:
a. Raw Water
Merupakan air yang berasal dari 3 sumber, antara lain: air tanah, air sungai
dan PDAM.
b. Drinking Water
Merupakan air yang telah mengalami proses pengolahan, yang dapat
digunakan untuk air minum.
c. Purified Water
Merupakan air yang telah mengalami atau melalui proses penyaringan,
penukaran ion, dan penyaringan kembali. Tahap-tahap pengolahan air hingga
menjadi purified water dengan cara demineralisasi, antara lain:
1) Saringan Pasir (sand filter)
Menyaring secara fisik menggunakan pasir silika dan berfungsi untuk
mengikat partikel-partikel yang terbawa oleh air selama pengolahan air di
PDAM.
2) Saringan Karbon (carbon filter)
Berfungsi untuk menyerap bau, rasa, warna, kontaminan organik dan
unsur klor yang ditambahkan pada pengolahan air di PDAM.
3) Resin Kation
Resin kation berfungsi untuk menghilangkan ion-ion positif pada air
dan kemudian akan digantikan dengan ion hidrogen.
4) Resin Anion
Resin anion berfungsi untuk menghilangkan ion-ion negatif dan
kandungan Total Dissolved Solid (TDS) kurang dari 8 ppm dan silika
kurang dari 0,1 ppm. Setelah mengalami beberapa tahap pemurnian, air
demineralisata dialirkan ke ruangan-ruangan produksi dan laboratorium
untuk digunakan.
5) Tangki Penampung
Setelah mengalami beberapa tahap pemurnian, air demineralisata
ditampung dalam tangki penampung untuk dialirkan ke ruangan-ruangan
produksi untuk digunakan sesuai dengan keperluan.
d. High Purified Water
Merupakan air yang diperoleh dari hasil penyaringan Purified Water, yang
difilter dengan Cartridge Filter 0,2-0,3 µm.
e. Water for Injection
Merupakan air yang telah mengalami destilasi. Air ini digunakan untuk
sediaan akhir yang akan disterilkan kembali (untuk zat berkhasiat yang tahan
terhadap pemanasan).
f. Sterile Water for Injection
Merupakan air yang telah mengalami destilasi kemudian disterilkan. Air
ini digunakan untuk sediaan akhir yang tidak dapat disterilisasi akhir (untuk
zat berkhasiat yang tidak tahan terhadap pemanasan).
3. Boiller (Steam)
Air baku untuk menghasilkan uap panas adalah aqua demineralisata yang
diberi tekanan melalui pompa air masuk ke filter kemudian ditampung di dalam
tangki stainless steel untuk mensuplai steam. Air dipanaskan melalui boiler
lengkap. Udara panas yang dihasilkan dialirkan melalui pipa ke ruang-ruang
produksi yang membutuhkannya.
4. Udara Bertekanan
Udara bertekanan diperoleh dengan menggunakan alat kompresor yang
bekerja secara otomatis. Instalasi kompresor ini digunakan hanya pada
peralatan yang memerlukan udara bertekanan seperti mesin stripping (udara
bertekanan digunakan untuk menggerakkan pisau pemotong strip).
5. Instalasi Pengolahan Air Limbah (IPAL)
Limbah dari industri farmasi harus diolah sedemikian rupa sehingga
memenuhi persyaratan yang telah ditetapkan agar tidak mencemari lingkungan
di sekitar industri tersebut. Limbah Lafi Ditkesad berasal dari proses produksi
dan proses pengujian yang terbagi atas limbah padat dan limbah cair.
Pada produksi obat non betalaktam, pengolahan limbah padat dilakukan
dengan menggunakan dust collector dimana limbah berupa debu disedot dari
ruang produksi dengan blower kemudian dikumpulkan dalam kantong
penampung dan dibakar, sedangkan limbah cair produksi non betalaktam
langsung dialirkan ke Instalasi Pengolahan Air Limbah (IPAL).
Pada produksi betalaktam, pengolahan limbah terlebih dahulu diolah
melalui air washer, dimana limbah padat (debu-debu) disedot oleh blower dari
ruangan yang berdebu seperti ruang strip, ruang pengisian kapsul, ruang cetak,
ruang coating, ruang pencampuran dan ruang pengisian sirup kering,
kemudian disemprot dengan air bertekanan 4 bar sehingga debu akan jatuh di
bak penampungan. Air dialirkan ke bak destruksi yang dilengkapi dengan
betalaktam dengan menggunakan larutan NaOH 0,1 N yang diteteskan secara
otomatis sampai diperoleh pH 9. Selanjutnya, limbah hasil produksi
betalaktam dialirkan ke IPAL untuk dilakukan pengolahan lebih lanjut.
Pengolahan limbah pada IPAL menggunakan prinsip fisika, kimia dan
mikrobiologi. Cara fisika dilakukan dengan mengendapkan kotoran pada bak
pengendap. Cara kimia dilakukan dengan menambahkan koagulan Poly
Aluminium Chloride pada bak koagulasi dan polimer anionik pada bak
flokulasi. Cara mikrobiologi dilakukan dengan mengembangbiakkan bakteri
aerobik pada bak aerasi agar dapat menghancurkan zat organik. Untuk
menjaga pertumbuhan bakteri ditambahkan pupuk urea sebagai nutrisi untuk
bakteri.
Tahapan pengolahan air limbah di IPAL Lafi Ditkesad melibatkan proses
fisika, kimia dan biologi. Tahapan tersebut adalah sebagai berikut:
a. Bak Penampungan Awal
Air limbah baik yang berasal dari produksi betalaktam yang telah
mengalami destruksi dan produksi non-betalaktam akan ditampung dan
pengotornya diendapkan dalam bak ini, kemudian dialirkan ke bak
pengendapan (sedimentasi pertama).
b. Bak Sedimentasi Pertama
Disini terjadi proses pengendapan kembali. Di dalam bak ini terdapat
sekat-sekat yang menghambat laju aliran air sehingga reaksi
pengendapan berlangsung lama. Air limbah dari bak ini mengalir ke
c. Bak Equalisasi
Disini terjadi proses fisika. Di bak ini material padat dihancurkan
dengan menggunakan Communitor, pasir terbawa diendapkan. Bak ini
dilengkapi dengan pompa untuk mengendalikan fluktuasi jumlah air
kotor yang tidak merata, yaitu pada jam kerja dan di luar jam kerja.
Bak ini juga terdapat pengaduk untuk mengaduk bahan organik agar
tidak mengendap.
d. Bak Aerasi dan Stabilisasi
Air limbah masuk ke dalam bak ini dengan menggunakan pompa
secara kontinu. Di dalam bak ini limbah diolah menggunakan bakteri
aerob yang berguna untuk menghancurkan zat-zat organik. Bak ini
dilengkapi dengan aerator untuk memasukkan oksigen dari udara yang
dihasilkan oleh blower dan ditransfer ke dalam air limbah, sehingga
mikroorganisme mampu melanjutkan dekomposisi bahan pencemar
menjadi gas yang tidak mencemari. Di dalam bak ini dilakukan juga
pengadukan untuk menjamin seluruh material yang ada di dalam
limbah cair dalam kondisi tersuspensi.
e. Bak Sedimentasi Kedua (Clarifier)
Air limbah dari bak aerasi mengalir ke dalam bak sedimentasi kedua.
Dalam bak ini air mengalami penjernihan. Bak ini memiliki dinding
pemisah bergerigi untuk menahan pengotor dan dasar yang berbentuk
kerucut untuk mengendapkan sedimen sehingga air yang mengalir ke
f. Bak Koagulasi
Cairan dari bak sedimentasi kedua masuk ke dalam bak koagulasi. Di
dalam bak ini ditambahkan koagulan PAC (Poly Aluminium Chloride),
dimana koagulasi berfungsi untuk mengikat protein. Konsentrasi PAC
yang diteteskan dalam larutan yaitu 50 kg PAC dalam 1000 L air. Bak
koagulasi berfungsi sebagai bak penampung koagulan.
g. Bak Flokulasi
Dari bak koagulasi cairan dialirkan ke bak flokulasi yang berfungsi
untuk mengendapkan endapan yang masih terbawa. Di dalam bak ini
air limbah mengalami penambahan flokulan berupa polimer elektrolit
sebagai polianionik dengan konsentrasi 1 kg polianionik dalam 1000 L
air sehingga terbentuk flok-flok yang kemudian diendapkan di bak
sedimentasi kedua. Untuk air yang sudah jernih akan langsung menuju
ke bak penampungan akhir melalui bidang miring.
h. Bak Pengendapan akhir (Bak Sedimentasi Ketiga):
1) Dari bak flokulasi, cairan yang masih mengandung endapan
dialirkan ke dalam bak sedimentasi ketiga yang berbentuk kerucut
di bagian bawah bak. Pada bak ini diberi karung yang berfungsi
sebagai penyaring untuk menampung endapan, sedangkan cairan
yang lebih jernih masuk ke dalam bak penampung cairan.
2) Bak Penampung Cairan, cairan yang masih mungkin mengandung
limbah dialirkan kembali ke bak sedimentasi pertama untuk diolah
kembali sampai limbah tersebut benar-benar bersih dari senyawa
i. Bak Bidang Miring
Bak bidang miring berbentuk miring ke satu arah yang
menghubungkan bak flokulasi dan bak kontrol yang gunanya untuk
menahan endapan dan partikel lain yang masih terdapat dalam air
limbah dari bak flokulasi. Melalui bak bidang miring, air dari bak
flokulasi mengalir ke bak kontrol.
j. Bak Kontrol (Bak Pembuangan Akhir)
Cairan yang sudah jernih dialirkan ke bak kontrol yang berisi ikan
sebagai kontrol biologi untuk diperiksa kadar COD dan BOD serta
TDS (jumlah total zat padat yang tidak larut), dan pH. Jika hasilnya
memenuhi syarat air dapat dibuang ke saluran pembuangan umum.
Parameter yang harus dipantau untuk limbah cair adalah : pH, suhu,
TSS, TDS, BOD, COD. Skema IPAL dapat dilihat pada Lampiran 11.
6. Air Handling System (AHS)
Air Handling System (AHS) adalah sistem pengaturan udara yang
berfungsi mengkondisikan udara dalam ruangan produksi yang dilengkapi
dengan sarana pengatur suhu dan kelembaban. Parameter ini dapat
mempengaruhi kualitas produk dari industri farmasi, selain itu juga terdapat
parameter lainnya antara lain air change (pertukaran udara), tekanan udara,
kontaminasi mikroba dan cemaran partikel. Tujuan dari sistem ini adalah
untuk menyediakan aliran udara kering dan dingin yang tepat untuk tiap-tiap
ruangan produksi.
Pada ruang kelas III terdapat prefilter dan medium filter, sedangkan pada
kelas I selain terdapat prefilter, medium filter dan HEPA filter juga
dilengkapi dengan LAF (Laminar Air Flow). Pada ruang produksi tablet dan
sirup kering, tekanan udara ruangan akan lebih negatif dari tekanan udara
ruang koridor. Sebaliknya, untuk ruang produksi sirup cair tekanan udara di
ruang produksi akan lebih positif dibandingkan koridor. Hal ini dimaksudkan
untuk mencegah kontaminasi debu, karena aliran udara bergerak dari tekanan
yang tinggi ke rendah. Pada ruang produksi betalaktam, tekanan udara di
dalam ruang produksi harus lebih rendah daripada koridor agar tidak terjadi
pencemaran partikel betalaktam ke daerah koridor yang dilewati personil.
Berikut pengendalian udara di beberapa ruang produksi Lafi Ditkesad:
a. Pengendalian udara di ruang kelas III
Ukuran partikel : 0,5 μm maksimum 100.000/feet3
Relative humidity : 40 – 60%
Filter : Pre-filter (efisiensi 30 - 60%)
Medium filter (efisiensi 80 – 95%)
Sirkulasi udara : ≥ 20 kali per jam
Asal udara : fresh air
b. Pengendalian udara di ruang kelas II
Ukuran partikel : 0,5 μm maksimum 10.000/feet3
Relative humidity : 45 – 50 %
Filter : Medium filter (efisiensi 80–95%)
HEPA filter (efisiensi 99,997%)
Sirkulasi udara : > 20 kali per jam
c. Pengendalian udara di ruang kelas I
Ukuran partikel : 0,5 μm maksimum 100/feet3
Relative humidity : 40 - 55%
Filter : Pre-filter (efisiensi 30 - 60%)
Medium filter (efisiensi 80 – 95%)
HEPA filter (efisiensi 99,997%)
Sirkulasi udara : >120 kali per jam dan bersifat Laminar.
Sistem tata udara secara umum dapat dijelaskan secara singkat
sebagai berikut:
Suplai udara dalam sistem tata udara berasal dari udara luar (udara terbuka)
dikenal istilah fresh air. Volume fresh air yang masuk ke sistem ditentukan
oleh volume dumper yang telah terpasang. Udara tersebut disaring pada
saringan pertama/pre filter yang mampu menangkap partikel yang berukuran
≥ 1 µm. Udara tersebut akan disaring kembali untuk yang kedua kalinya oleh
medium filter yang mampu menangkap partikel yang berukuran ≥ 0.5 µm,
selanjutnya oleh Cooling Coil udara tersebut diatur suhunya sesuai dengan
yang dikehendaki. Tahap selanjutnya udara akan melewati Heating Coil yang
berfungsi untuk mengatur kelembaban sesuai dengan yang dikehendaki.
Udara yang sudah terkondisi tersebut akan dihembuskan oleh fan coil ke
kelas III. Fan Coil berfungsi sebagai pengatur jumlah sirkulasi udara (air
change) yang dalam kerjanya dikombinasikan dengan sistem dumper. Udara
bersih yang dihembuskan ke kelas III 100% berasal dari fresh air yang
Suplai udara untuk ruang kelas I dengan II merupakan udara recycle
yang bersirkulasi terus menerus melalui filter-filter yang digunakan. Untuk
mencukupi suplai oksigen di kelas I dan kelas II, dimasukkan udara segar
melalui dumper yang dapat mencukupi suplai oksigen ± 20%. Sistem ini
dibuat dengan proses pengolahan seperti aliran udara untuk kelas III
BAB IV PEMBAHASAN 4.1Manajemen Mutu
Manajemen mutu suatu obat jadi tidak hanya mengandalkan pelulusan dari
serangkaian pengujian tetapi mutu obat hendaklah dibangun sejak awal ke dalam
produk tersebut. Mutu obat tergantung dari bahan awal, proses pembuatan dan
pengawasan mutu, bangunan dan peralatan yang dipakai serta personil yang
terlibat. Semua obat hendaklah dibuat dalam kondisi yang dikendalikan dan
dipantau agar obat yang dihasilkan dapat memenuhi persyaratan.
Sistem manajemen mutu pada Lafi Ditkesad telah memenuhi persyaratan
sesuai dengan petunjuk CPOB, dimana mutu suatu produk obat jadi tidak
ditentukan pada hasil akhirnya saja, tetapi terus dipantau di setiap tahapan proses
produksi. Semua langkah produksi dan pengendalian diterapkan sesuai CPOB.
Demikian juga pengawasan terhadap produk antara, ruahan, dan obat jadi
dilakukan pengawasan selama proses (in proses control).
Struktur organisasi dalam industri farmasi juga termasuk dalam kategori
manajemen mutu dalam CPOB. Lafi Ditkesad telah melakukan pemisahan tugas
dan tanggung jawab yang jelas dalam struktur organisasinya sesuai dengan
petunjuk CPOB agar dapat dihasilkan kinerja perusahaan yang optimal. Hal ini
terlihat dari penempatan tenaga farmasi pada posisi kepala instalasi produksi,
kepala instalasi penelitian dan pengembangan, kepala instalasi pemeliharaan dan
sistem penunjang, kepala instalasi penyimpanan, dan kepala instalasi pengawasan
mutu.
4.2 Personalia
Sumber daya manusia sangat penting dalam pembentukan dan penerapan
sistem pemastian mutu yang memuaskan dan pembuatan obat yang benar. Industri
farmasi bertanggung jawab untuk menyediakan personil yang terkualifikasi dalam
jumlah yang memadai untuk melaksanakan semua tugas. Tiap personil hendaklah
memahami tanggung jawab masing-masing dan dicatat. Seluruh personil
hendaklah memahami prinsip CPOB dan memperoleh pelatihan awal dan
berkesinambungan, termasuk instruksi mengenai higiene yang berkaitan dengan
pekerjaan.
Dalam struktur organisasi Lafi Ditkesad setiap personil mempunyai tugas,
wewenang dan tanggung jawab yang jelas, sehingga tiap personil mengetahui hak
dan kewajiban masing-masing. Instalasi Produksi dan Instalasi Pengawasan Mutu
dipimpin oleh masing-masing seorang Apoteker yang berbeda, tetapi memiliki
kewajiban yang sama untuk menghasilkan produk yang bermutu.
Lafi Ditkesad senantiasa melakukan pelatihan bagi personil yang
pelaksanaannya selalu mengacu pada CPOB serta disesuaikan dengan bidang
tugas dan tanggung jawab masing-masing.
Materi pelatihan dibuat secara bertahap dan tertulis dalam bentuk prosedur
tetap yang disetujui oleh Kepala Instalasi Pengawasan Mutu dan Kepala Instalasi
Produksi. Materi tersebut disampaikan secara bertahap dan terjadwal disesuaikan
dengan kebutuhan dan jenis materi.
4.3 Bangunan dan Fasilitas
Bangunan dan fasilitas untuk pembuatan obat hendaklah memiliki desain,
dirawat dengan baik untuk mempermudah pelaksanaan operasi yang benar. Tata
letak dan desain ruangan harus dibuat sedemikian rupa untuk memperkecil resiko
terjadinya kekeliruan, pencemaran silang atau kesalahan lain, memudahkan
pembersihan, serta sanitasi dan perawatan yang efektif untuk menghindari
pencemaran silang.
4.3.1 Instalasi Produksi
Lafi Ditkesad mempunyai gedung produksi non betalaktam dan
betalaktam. Kegiatan produksi non betalaktam dilaksanakan di dua tempat yaitu
gedung lama di Jl. Gudang Utara No.25 dan gedung baru di Jl. Gudang Utara No.
26. Hampir semua kegiatan produksi dilakukan di gedung baru. Kegiatan yang
masih dilakukan di gedung lama adalah pembuatan salep dan larutan cairan obat
luar. Dalam pelaksanaannya diusahakan secara maksimal untuk tetap menjaga
kualitas obat yang diproduksi. Kegiatan produksi yang dilakukan di gedung baru
adalah penimbangan, pencampuran, granulasi basah, pengeringan granul,
pengayakan, pencetakan, penyalutan, stripping, pengisian kapsul dan pembuatan
sirup.
Pada gedung produksi betalaktam dan non betalaktam permukaan lantai,
dinding dan langit-langit dilapisi cat epoksi, permukaannya rata, halus dan
dihindari adanya celah, tidak terdapat sambungan agar tidak terjadi pertumbuhan
mikroba, mudah dibersihkan, tahan terhadap bahan pembersih, tidak melepas atau
menahan partikel dan sudut-sudut antara dinding, lantai dan langit-langit
berbentuk lengkungan.
Untuk mengendalikan udara, pada ruang produksi betalaktam dilengkapi
mikroba, air change, dan air flow. Penyaringan udara dilakukan melalui filter
udara yang dilengkapi dengan pre-filter, medium filter dan HEPA filter. HEPA
filter mampu menyaring partikel berukuran 0,5 μm dengan efisiensi 99,997%.
Pada ruang produksi obat-obat golongan non betalaktam, bangunan telah
memenuhi aspek CPOB tetapi sistem HVAC belum beroperasi secara maksimal
karena masih adanya ruang produksi yang tekanannya lebih rendah daripada
koridor seperti ruang pengisian kapsul.
4.3.2 Instalasi Pengawasan Mutu
Bangunan instalasi pengawasan mutu telah memenuhi persyaratan CPOB
dengan adanya pembagian ruangan yang jelas untuk setiap bagian. Penataan
ruangan di instalasi pengawasan mutu dibuat sesuai dengan tujuan
penggunaannya, seperti ruangan uji potensi antibiotik terhadap mikroba
dipisahkan dengan ruangan steril.
4.3.3 Instalasi Penyimpanan
Penyimpanan barang di Lafi Ditkesad tidak diurutkan secara alfabetis
tetapi hanya berdasarkan adanya tempat yang kosong. Selain itu, pada instalasi
penyimpanan belum terdapat gudang obat jadi sehingga obat jadi disimpan pada
koridor kelas empat yang mengakibatkan karyawan tidak leluasa melewati koridor
dan kemungkinan kontaminasi terhadap produk juga lebih tinggi pada koridor.
4.3.4 Instalasi Pemeliharaan dan Sistem Penunjang
Utilitas merupakan sarana pendukung yang diperlukan untuk
terlaksananya proses produksi di dalam suatu pabrik yang meliputi berbagai
komponen seperti instalasi listrik, air, AHS, steam, kompressor, gas dan air
Sebagai sarana penunjang, komponen listrik sangat berperan penting bagi
terlaksananya semua kegiatan yang berkaitan dengan produksi seperti proses
pencampuran, pencetakan, pengisian sirup, stripping, pengemasan, sistem tata
udara, pengawasan mutu, Sistem Pengolahan Air (SPA), Instalasi Pengolahan Air
Limbah (IPAL), dan lain sebagainya.
Dalam hal ini LAFI AD sebagai salah satu industri farmasi menyuplai
tenaga listrik dari PLN. Jika terjadi pemadaman listrik secara bergilir maka dua
hari sebelumnya akan diberitahukan oleh pihak PLN sehingga semua proses yang
berkaitan dengan proses produksi akan dihentikan untuk sementara waktu.
4.4 Peralatan
Mesin-mesin produksi dan peralatan penunjang dalam proses produksi
betalaktam, non betalaktam dan pengawasan mutu sebagian besar telah memenuhi
persyaratan CPOB. Perawatan dan kualifikasi ulang juga dilakukan secara berkala
untuk menjamin proses produksi senantiasa terjaga dan kinerja mesin senantiasa
terawat. Setiap peralatan dilengkapi dengan protap yang memudahkan operator
dalam mengoperasikan alat tersebut.
4.5 Sanitasi dan Higiene
Tingkat sanitasi dan higiene di Lafi Ditkesad sudah dilaksanakan dengan
baik walaupun masih banyak yang harus dibenahi lagi seperti higiene perorangan
dan sanitasi bangunan yang masih belum maksimal pelaksanaannya dan perlu
pengawasan yang lebih ketat lagi. Selain itu, higiene pakaian karyawan belum
maksimal karena tempat pengeringan pakaian karyawan masih dilakukan di
Penerapan sanitasi dan higiene pada bangunan dan ruangan di Lafi
Ditkesad, yaitu:
1. Gedung atau ruang untuk proses produksi dirancang sedemikian rupa
sehingga mudah dibersihkan.
2. Tersedia toilet dan ruang ganti dalam jumlah yang cukup, berventilasi
baik, mudah dicapai dari daerah kerja tetapi tidak berhubungan langsung
dengan daerah kerja.
3. Upaya pembersihan atau sanitasi terhadap mikroba dan pencegahan
terhadap serangga atau binatang kecil lainnya, binatang pengerat dan
lain-lain sudah dilaksanakan.
4. Sanitasi dilakukan secara teratur dan periodik yang didukung oleh
prosedur tetap yang terperinci, antara lain metode, jadwal dan alat yang
dipakai, bahan pembersih dan desinfektan yang dipakai, pelaksana dan
penanggung jawab, pemeriksa dan pengawasan serta dokumentasi.
Prosedur sanitasi dan higiene belum divalidasi dan dievaluasi secara
periodik sehingga penerapan prosedur yang bersangkutan belum dapat dinyatakan
seratus persen memenuhi persyaratan.
4.6 Produksi
Setiap bahan awal yang masuk ke instalasi produksi telah dinyatakan lulus
uji mutu. Pelaksanaan produksi senantiasa mengikuti protap yang telah dibuat
sesuai CPOB. Setiap produk yang akan diproduksi memiliki catatan bets tersendiri
sehingga produk obat yang dihasilkan memenuhi spesifikasi yang telah
Setiap produk telah memiliki batch record tersendiri, sehingga produk
obat yang dihasilkan dapat memenuhi spesifikasi yang telah ditentukan. Setiap
personil yang terlibat dalam proses produksi telah menyadari akan pentingnya
mengikuti petunjuk yang ada dalam batch record. Kedisiplinan setiap personil di
bagian produksi dalam mencatat semua kejadian selama proses produksi dalam
kolom yang tersedia di batch record, merupakan suatu konsekuensi dari tugas dan
tanggung jawabnya.
4.7 Pengawasan Mutu
Pengawasan mutu merupakan bagian yang esensial dari cara pembuatan
obat yang baik untuk memberikan kepastian bahwa produk secara konsisten
mempunyai mutu yang sesuai dengan tujuan pemakaiannya.
Instalasi pengawasan mutu Lafi Ditkesad bertugas melakukan pengawasan
mutu terhadap obat-obat produksi Lafi Ditkesad yang mencakup pemeriksaan
bahan awal, produk antara, produk ruahan, in process control dan obat jadi. Hal
ini dilakukan tanpa adanya campur tangan dari pihak produksi dalam menentukan
kualitas bahan baku, bahan pengemas dan obat jadi. Instalasi pengawasan mutu
juga melakukan pengujian stabilitas dipercepat dan penetapan tanggal kadaluarsa,
validasi metode analisa, dokumentasi dari suatu bets dan penyimpanan contoh
pertinggal.
Selain itu instalasi pengawasan mutu juga bertanggung jawab terhadap
kualitas lingkungan kerja menyangkut pengawasan bangunan, ruangan dan
peralatan serta fasilitas penunjang lain seperti kualitas udara dan pengendalian
4.8 Inspeksi Diri
Inspeksi diri adalah peninjauan kembali atau pemeriksaan secara jujur
seluruh tata kerja diri sendiri dari setiap segi yang dapat berpengaruh pada
jaminan mutu. Tujuan dari inspeksi diri adalah menilai penerapan CPOB dalam
seluruh aspek produksi dan pengendalian mutu. Inspeksi diri dilakukan terhadap
karyawan, bangunan dan fasilitas, ,penyimpanan bahan baku, obat jadi, peralatan,
produksi, pengawasan mutu dan pemeliharaan gedung. Sasaran inspeksi diri
adalah mencari setiap kekurangan dalam penerapan CPOB dan memberi saran
untuk dilakukan perbaikan. Inspeksi diri di Lafi Ditkesad dilaksanakan minimal
setahun sekali.
4.9 Penanganan Keluhan Terhadap Produk, Penarikan Kembali Produk dan Produk Kembalian
Lafi Ditkesad memiliki tempat penyimpanan khusus untuk contoh
pertinggal dari obat-obat yang telah diproduksi dengan tujuan jika suatu saat
terjadi keluhan terhadap obat yang diproduksi, pihak Lafi Ditkesad dalam hal ini
instalasi pengawasan mutu dapat memeriksa kembali produk obat tersebut.
Pemeriksaan dilakukan melalui retained sample (sampel pertinggal) sebagai
bahan pembanding yang dilakukan oleh instalasi pengawasan mutu. Hasil
pemeriksaan tersebut dianalisis dan dievaluasi oleh instalasi pengawasan mutu,
kemudian instalasi pengawasan mutu akan melakukan perbaikan-perbaikan, bila
perlu dilakukan penarikan produk obat tersebut.
4.10 Dokumentasi
Dokumentasi adalah bagian dari sistem manajemen informasi dari sebuah
organisasi perusahaan. Lafi Diketsad merupakan sebuah perusahaan obat yang
terutama yang berkenaan dengan kegiatan pengadaan, produksi dan distribusi obat
ya