LAPORAN PRAKTEK KERJA PROFESI APOTEKER
DI LEMBAGA FARMASI DIREKTORAT KESEHATAN
ANGKATAN DARAT
BANDUNG
Disusun Oleh :
DESMARIA SYAFRUL, S.Farm 083202010
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
LEMBAR PENGESAHAN
LAPORAN PRAKTEK KERJA PROFESI APOTEKER
DI LEMBAGA FARMASI DIREKTORAT KESEHATAN ANGKATAN DARAT
BANDUNG
Diajukan untuk melengkapi salah satu syarat untuk mencapai gelar Apoteker pada Fakultas Farmasi
Universitas Sumatera Utara
Oleh:
Desmaria Syafrul, S.Farm.
083202010
Disetujui Oleh Pembimbing
Letkol.CKM.Drs. Yan Suryana Ilham, Apt., MM.
Disahkan Oleh:
Dekan Fakultas Farmasi USU Kepala Lembaga Farmasi Ditkesad,
KATA PENGANTAR
Puji dan syukur penulis ucapkan kehadirat Tuhan Yang Maha Esa yang telah
memberikan rahmat dan karuniaNya sehingga penulis dapat menyelesaikan
laporan ini sebagai hasil Praktek Kerja Profesi Apoteker di Lembaga Farmasi
Direktorat Kesehatan Angkatan Darat (Lafi Ditkesad) Bandung, yang
dilaksanakan pada tanggal 2 Februari – 27 Februari 2009.
Praktek Kerja Profesi di Lembaga Farmasi Direktorat Kesehatan Angkatan
Darat telah memperluas wawasan penulis tentang gambaran sebuah industri
farmasi bagaimana cara mengelola dan manajemen dari suatu industri farmasi.
Pelaksanaan Praktek Kerja Profesi Apoteker ini beserta penyusunan
laporannya tidak terlepas dari dukungan dan bantuan berbagai pihak, untuk itu
penulis mengucapkan terima kasih kepada semua pihak yang telah memberikan
bantuan, dukungan, petunjuk, bimbingan, saran serta berbagai fasilitas dan
kemudahan bagi penulis.
Pada kesempatan ini izinkanlah penulis mengucapkan rasa terima kasih
kepada :
1. Prof. Dr. Sumadio Hadisahputra., Apt, selaku Dekan Fakultas Farmasi
Universitas Sumatera Utara Medan.
2. Drs. Wiryanto, MSi., Apt, selaku Koordinator Program Pendidikan
Apoteker Fakultas Farmasi Universitas Sumatera Utara Medan.
3. Letkol CKM Drs. Sambas Setiawan, Apt, selaku Kepala Lembaga Farmasi
Direktorat Kesehatan Angkatan Darat.
4. Letkol CKM Drs.Yan Suryana Ilham, Apt, M.M selaku kepala Instalasi
Penelitian dan Pengembangan Lembaga Farmasi Direktorat Kesehatan
Angkatan Darat.
5. Letkol CKM. (K). Dra.Nur Laila, Apt, M.Si. selaku Kepala Instalasi
Pengawasan Mutu Lembaga Farmasi Direktorat Kesehatan Angkatan Darat.
6. Mayor CKM Drs. Abdul Azis, MM selaku Kepala Bagian Administrasi dan
Logistik Lembaga Farmasi Direktorat Kesehatan Angkatan Darat.
7. Mayor CKM Drs. Junaedi, Apt. selaku Kepala Instalasi Produksi Lembaga
8. Mayor CKM. (K). Dra. Emmy Winarni, Apt. selaku Kepala Instalasi
Penyimpanan Lembaga Farmasi Direktorat Kesehatan Angkatan Darat.
9. Mayor CKM Drs. Agoes Imam Nugroho, Apt. selaku Kepala Instalasi
Pemeliharaan Lembaga Farmasi Direktorat Kesehatan Angkatan Darat.
10. Mayor CKM Drs. T.P. Simorangkir, M.Si., Apt. selaku Koordinator
Mahasiswa Praktek Kerja Profesi di Lembaga Farmasi Direktorat Kesehatan
Angkatan Darat dan sebagai Pembimbing.
11. Dra. Neneng Cahyati, Apt. selaku Kepala Seksi Kemas Instalasi simpan dan
sebagai pembimbing dan sebagai Pembimbing..
12. Dra. Lisa Olii, Apt, M.Si. selaku Wakil Koordinator Mahasiswa Praktek
Kerja Profesi di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat.
13. Dra. Weni Widaningsih, Apt. selaku Kepala Seksi Kimia Fisika Instalasi
Pengawasan Mutu dan sebagai Pembimbing.
14. Seluruh Staf dan Karyawan Lembaga Farmasi Direktorat Kesehatan
Angkatan Darat.
Semoga Tuhan membalas budi baik Bapak dan Ibu dengan balasan yang
berlipat ganda. Penulis berharap semoga tulisan ini dapat memberikan manfaat
bagi kita semua.
Bandung, Februari 2009
DAFTAR ISI
1.2 Metodologi Praktek Kerja Profesi Apoteker ... 3
1.3 Tujuan Praktek Kerja Profesi Apoteker ... 3
BAB II TINJAUAN PUSTAKA ... 4
2.1 Industri Farmasi ... 4
2.2 Persyaratan Industri Farmasi... 4
2.3 Pencabutan Izin Usaha Industri Farmasi... 5
8. Produk Steril ... 17
2.4.7 Pengawasan Mutu ... 20
1. Pengawasan Mutu ... 20
2. Laboratorium... 20
3. Validasi ... 21
4. Pengawasan terhadap bahan awal, produk antara, produk ruahan dan produk jadi ... 21
5. Produksi-produksi dan perubahannya ... 21
6. Peninjauan Catatan Produksi dan Batch Produk 21 7. Penelitian stabilitas ... 21
8. Penilaian terhadap pemasok... 22
2.4.8 Inspeksi Diri ... 22
2.4.9 Penanganan Keluhan Terhadap Obat, Penarikan Kembali Obat dan Obat Kembalian ... 22
2.4.10 Dokumentasi ... 23
2.4.11 Pembuatan dan Analisis Berdasarkan Kontrak ... 24
2.4.12 Kualifikasi dan Validasi... 24
BAB III TINJAUAN KHUSUS LEMBAGA FARMASI DIREKTORAT KESEHATAN ANGKATAN DARAT... 27
3.1 Sejarah... 27
3.2 Visi, Misi serta Tujuan... 28
3.3 Kedudukan, Tugas Pokok dan Fungsi Lafi Ditkesad... 28
3.3.1 Tugas melaksanakan Fungsi Utama ... 29
3.3.2 Tugas melaksanakan Fungsi Organik ... 29
3.4 Struktur Organisasi Lafi Ditkesad... 30
3.4.1 Eselon Pimpinan ... 30
3.4.2 Eselon Pembantu Pimpinan ... 30
3.4.3 Eselon Pelayanan (Seksi Tata Usaha Urusan Dalam)... 31
3.4.4 Eselon Pelaksana... 32
3.5 Kualifikasi Tenaga Kerja Lafi Ditkesad ... 34
3.7 Kegiatan Lafi Ditkesad ... 38
3.7.1 Kegiatan Bagminlog ... 39
3.7.2 Kegiatan Instalasi Pengawasan Mutu... 40
3.7.3 Kegiatan Instalasi Penelitian dan Pengembangan (Installitbang) ... 42
3.7.4 Kegiatan Instalasi Produksi... 43
1. Seksi Sediaan Non Betalaktam ... 44
2. Seksi Sediaan Sefalosporin ... 52
3. Seksi Sediaan Betalaktam ... 52
4. Seksi Kemas ... 53
3.7.5 Kegiatan Instalasi Simpan... 54
3.7.6 Kegiatan Instalasi Pemeliharaan dan Sisjang... 55
3.8 Pengolahan Dokumen ... 62
DAFTAR TABEL
Halaman
Tabel 1. Data Personil Lafi Ditkesad Bulan September 2008
Berdasarkan Jenjang Pendidikannya... 35
2. Baku Mutu Limbah Cair untuk Industri Farmasi
DAFTAR LAMPIRAN
Halaman
Lampiran 1 Struktur Organisasi Lembaga Farmasi Ditkesad
Berdasarkan Eselon dan Jabatan (Peraturan Kasad
Nomor Perkasad/219/XII/2007 Tanggal 10-12-2007) ... 76
Lampiran 2 Blanko Hasil Pengujian Laboratorium ... 77
Lampiran 3 Blanko Catatan Pengujian Tablet dan Kapsul ... 78
Lampiran 4 Blanko Laporan Hasil Pengujian Larutan/ Sirup/ Injeksi ... 79
Lampiran 5 Blanko Laporan Hasil Pengujian Salep/ Krim ... 80
Lampiran 6 Alur Proses Produksi Tablet Biasa/Salut Secara Granulasi Basah ... 81
Lampiran 7 Alur Produksi Tablet Biasa/ Salut dengan Metode Cetak Langsung ... 82
Lampiran 8 Alur Produksi Kapsul ... 83
Lampiran 9 Alur Proses Produksi Sirup kering ... 84
Lampiran 10 Alur Produksi Salep ... 85
Lampiran 11 Alur Proses Produksi Sediaan Cairan (Sirup) ... 86
BAB I
PENDAHULUAN
1.1 Latar Belakang
Industri farmasi menurut SK Menkes No. 245/Menkes/SK/V/1990 adalah
industri obat jadi dan industri bahan baku obat. Industri obat jadi adalah industri
yang memproduksi suatu produk yang telah melalui seluruh tahap proses
pembuatan. Obat jadi ini dapat berupa sediaan atau paduan bahan yang siap
digunakan untuk mempengaruhi sistem fisiologi atau keadaan patologi dalam
rangka penetapan diagnosa, pencegahan, penyembuhan, pemulihan, peningkatan
kesehatan dan kontrasepsi. Industri farmasi merupakan salah satu tempat dimana
apoteker melakukan pekerjaan kefarmasian terutama menyangkut pengadaan,
pengolahan dan pengemasan, pengendalian mutu sediaan farmasi, penyimpanan,
pendistribusian dan pengembangan obat.
Sasaran utama industri farmasi adalah memproduksi obat jadi dengan
mengutamakan keamanan, keefektifan, kualitas dan harga yang terjangkau oleh
masyarakat. Untuk menghasilkan obat jadi yang memenuhi persyaratan yang telah
ditetapkan sesuai dengan tujuan penggunaannya, setiap industri farmasi harus
menerapkan CPOB (Cara Pembuatan Obat yang Baik).
Pada saat ini industri farmasi di Indonesia telah menghasilkan berbagai
produk obat yang jumlahnya semakin meningkat dan tersebar luas, sehingga
diharapkan dapat menjangkau semua lapisan masyarakat. Industri farmasi
bertanggung jawab sepenuhnya dalam menjamin tersedianya produk obat yang
memenuhi standar mutu. Oleh karena itu, industri farmasi harus dapat
sesuai dengan keputusan Menteri Kesehatan Republik Indonesia
No.43/Menkes/SK/II/1988 tentang CPOB, yang kemudian direvisi dengan
keputusan Kepala Badan Pengawasan Obat dan Makanan No:HK.00.05.3.02152
tahun 2001 tentang Penerapan Pedoman Cara Pembuatan Obat yang Baik.
Pedoman CPOB hendaklah diperbaiki secara berkesinambungan mengikuti
perkembangan ilmu pengetahuan dan teknologi untuk mengantisipasi era
globalisasi dan harmonisasi di bidang farmasi terutama pemenuhan terhadap
persyaratan dan standar produk farmasi global terkini. Oleh karena itu, pedoman
CPOB edisi 2001 direvisi kembali menjadi pedoman CPOB yang dinamis edisi
tahun 2006, berdasarkan Surat Keputusan Kepala Badan Pengawas Obat dan
Makanan No.HK.00.06.0511, tanggal 24 Januari 2006.
Dalam melaksanakan tugas dan tanggung jawabnya di industri farmasi,
apoteker sebagai personil yang profesional harus memahami penerapan CPOB
disamping adanya pengetahuan dan keterampilan, baik yang berhubungan dengan
kefarmasian ataupun kepemimpinan.
Sebagai upaya untuk memberikan wawasan yang luas tentang industri
farmasi bagi calon apoteker, maka Fakultas Farmasi Universitas Sumatera Utara
Medan bekerja sama dengan Lembaga Farmasi Direktorat Kesehatan Angkatan
Darat (Lafi Ditkesad) Bandung memberikan kesempatan bagi calon apoteker
untuk mengenal lingkungan kerja dan memperluas pengetahuan tentang industri
famasi melalui program Praktek Kerja Profesi Apoteker yang dilaksanakan dari
1.2 Metodologi Praktek Kerja Profesi Apoteker
Metodologi kerja praktek profesi apoteker yang dilakukan di Lembaga
Farmasi Direktorat Kesehatan Angkatan Darat adalah :
1. Interaksi langsung mahasiswa dengan pihak-pihak terkait dengan cara
melakukan kunjungan langsung ke instalasi-instalasi di lingkungan Lafi
Ditkesad
2. Diskusi dengan para pembimbing dan antar mahasiswa.
3. Belajar mandiri melalui data perpustakaan Lafi Ditkesad dan website farmasi.
4. Pemberian materi oleh masing-masing kepala instalasi di Lafi Ditkesad.
1.3 Tujuan Praktek Kerja Profesi Apoteker
Tujuan praktek kerja profesi apoteker, sebagai berikut:
1. Memahami dan melihat secara langsung gambaran umum tentang kegiatan
suatu industri farmasi
2. Mengetahui dan memahami bagaimana pengelolaan industri farmasi secara
profesional serta melihat tentang penerapan aspek CPOB di industri farmasi
3. Mengetahui dan memahami tugas dan tanggung jawab serta wewenang
apoteker, sehingga dapat dijadikan bekal guna mempersiapkan diri dalam
menghadapi dunia kerja sesungguhnya.
4. Mengetahui perencanaan dan pelaksanaan produksi di industri farmasi
khususnya di Lafi Ditkesad yang merupakan perusahaan non profit oriented.
BAB II
TINJAUAN PUSTAKA
2.1 Industri Farmasi
Industri farmasi menurut Surat Keputusan Menteri Kesehatan Republik
Indonesia Nomor 245/Menkes/SK/V/1990 adalah industri obat jadi dan industri
bahan baku obat. Industri obat jadi adalah industri yang menghasilkan suatu
produk yang telah melalui seluruh tahap proses pembuatan, dimana obat jadi
tersebut dapat berupa sediaan atau bahan-bahan yang sering digunakan untuk
mempengaruhi atau menyelidiki sistem fisiologis atau keadaan patologi dalam
rangka penetapan diagnosis, pencegahan, penyembuhan, pemulihan, peningkatan
kesehatan dan kontrasepsi. Industri bahan baku adalah industri yang memproduksi
bahan baku dimana bahan baku tersebut adalah seluruh bahan, baik berkhasiat
ataupun tidak berkhasiat yang digunakan dalam proses pengolahan obat.
2.2 Persyaratan Industri Farmasi
Perusahaan industri farmasi wajib memperoleh izin usaha industri farmasi,
karena itu industri tersebut wajib memenuhi persyaratan yang telah ditetapkan
oleh Menteri Kesehatan. Persyaratan industri farmasi tercantum dalam Surat
Keputusan Menteri Kesehatan RI No. 245//Menkes/SK/V/1990 adalah sebagai
berikut :
1. Industri farmasi merupakan suatu perusahaan umum, badan hukum berbentuk
Perseroan Terbatas atau Koperasi.
3. Memiliki Nomor Pokok Wajib Pajak (NPWP).
4. Industri farmasi obat jadi dan bahan baku wajib memenuhi persyaratan CPOB
sesuai dengan ketentuan SK Menteri Kesehatan No. 43/Menkes/SK/II/1988.
5. Industri farmasi obat jadi dan bahan baku, wajib mempekerjakan secara tetap
sekurang-kurangnya dua orang apoteker warga negara Indonesia,
masing-masing sebagai penanggung jawab produksi dan penanggung jawab
pengawasan mutu sesuai dengan persyaratan CPOB.
6. Obat jadi yang diproduksi oleh industri farmasi hanya dapat diedarkan setelah
memperoleh izin edar sesuai dengan ketentuan perundang-undangan yang
berlaku.
Izin usaha industri farmasi diberikan oleh Menteri Kesehatan dan
wewenang pemberian izin dilimpahkan kepada Badan Pengawasan Obat dan
Makanan (BPOM). Izin ini berlaku seterusnya selama industri tersebut
berproduksi dengan perpanjangan izin setiap 5 tahun, sedangkan untuk industri
farmasi Penanaman Modal Asing (PMA) masa berlakunya sesuai dengan
ketentuan dalam Undang-Undang No. 1 Tahun 1967 tentang Penanaman Modal
Asing dan pelaksanaannya.
2.3 Pencabutan Izin Usaha Industri Farmasi
Izin usaha industri farmasi dapat dicabut dalam hal:
1. Melakukan pemindah tanganan hak milik izin usaha industri farmasi dan
2. Tidak menyampaikan informasi mengenai perkembangan industri secara
berturut-turut tiga kali atau dengan sengaja menyampaikan informasi yang
tidak benar.
3. Melakukan pemindahan lokasi usaha industri tanpa persetujuan tertulis
terlebih dahulu.
4. Dengan sengaja memproduksi obat jadi atau bahan baku obat yang tidak
memenuhi persyaratan dan ketentuan yang berlaku (obat palsu).
5. Tidak memenuhi ketentuan dalam izin usaha industri farmasi.
2.4 Cara Pembuatan Obat yang Baik
Surat Keputusan Menteri Kesehatan No. 245/Men.Kes/SK/V/1990,
menjelaskan bahwa CPOB merupakan syarat wajib untuk memperoleh izin usaha
industri farmasi. CPOB harus diterapkan di industri farmasi karena CPOB
bertujuan untuk menjamin obat dibuat secara konsisten, memenuhi persyaratan
yang ditetapkan dan sesuai dengan tujuan penggunaannya. CPOB mencakup
seluruh aspek produksi dan pengendalian mutu.
Pedoman CPOB telah terbit tiga edisi, yaitu pedoman CPOB edisi 1988,
2001, dan 2006. Dibandingkan dengan edisi sebelumnya, Pedoman CPOB edisi
2006 mengandung perbaikan sesuai persyaratan CPOB dinamis, antara lain “
Kualifikasi dan Validasi “, “Pembuatan dan Analisis Obat Berdasarkan Kontrak”,
“Pembuatan Produk Steril”, dan penambahan beberapa bab serta aneks yaitu
“Manajemen Mutu”, “Pembuatan Produk Darah”, “Sistem Komputerisasi”, dan
“Pembuatan Produk Investasi untuk UJi Klinis”. Aspek-aspek CPOB 2006
2.4.1 Manajemen Mutu
Industri farmasi harus memberikan jaminan khasiat, keamanan dan mutu
produk yang dihasilkan agar sesuai dengan tujuan penggunaanya. Manajemen
bertanggung jawab untuk mencapai tujuan ini melalui suatu kebijakan mutu
dimana diperlukan manajemen mutu yang didesain secara menyeluruh dan
diterapkan secara benar.
Unsur dasar dari manajemen mutu adalah :
1. Sistem mutu yang tepat mencakup struktur organisasi, prosedur, proses dan
sumber daya
2. Pemastian Mutu
Pemastian mutu adalah totalitas semua pengaturan yang dibuat dengan
tujuan untuk memastikan bahwa obat dihasilkan dengan mutu yang sesuai dengan
tujuan pemakaiannya, karena itu Pemastian Mutu mencakup CPOB ditambah
dengan faktor lain seperti desain dan pengembangan produk.
Cara Pembuatan Obat yang Baik (CPOB) merupakan bagian dari Pemastian
Mutu yang memastikan bahwa obat dibuat dan dikendalikan secara konsisten
untuk mencapai standar mutu yang sesuai dengan tujuan penggunaan dan
dipersyaratkan dalam izin edar dan spesifikasi produk. CPOB mencakup Produksi
dan Pengawasan Mutu.
Pengawasan Mutu berhubungan dengan pengambilan sampel, spesifikasi
dan pengujian, organisasi, dokumentasi dan prosedur pelulusan yang memastikan
bahwa pengujian yang diperlukan dan relevan telah dilakukan dan bahwa bahan
yang belum diluluskan tidak digunakan serta produk yang belum diluluskan tidak
Pengawasan mutu secara menyeluruh mempunyai tugas lain, yaitu
menetapkan, memvalidasi dan menerapkan semua prosedur pengawasan mutu,
mengevaluasi, mengawasi dan menyimpan bahan baku pembanding, memastikan
kebenaran label wadah bahan dan produk, memastikan bahwa stabilitas dari zat
aktif dan obat jadi dipantau, mengambil bagian dalam investigasi keluhan yang
terkait dengan mutu produk, dan ikut mengambil bagian dalam pemantauan
lingkungan. Semua kegiatan tersebut hendaklah dilaksanakan sesuai dengan
prosedur tertulis dan jika perlu dicatat. Personil pengawasan mutu hendaklah
memiliki akses ke area produksi untuk melakukan pengambilan sampel dan
investigasi bila diperlukan. Pengkajian mutu produk secara berkala biasanya
dilakukan tiap tahun dan didokumentasikan dengan mempertimbangkan hasil
kajian ulang sebelumnya.
2.4.2 Personalia
Jumlah personil di semua tingkat harus memadai serta memiliki
pengetahuan, keterampilan dan kemampuan yang sesuai dengan tanggung
jawabnya. Kesehatan mental dan fisik yang baik harus dimiliki personil agar
mampu melaksanakan tugas secara profesional. Selain itu, para personil
hendaklah memiliki sikap dan kesadaran tinggi untuk mewujudkan CPOB.
Hal-hal yang harus diperhatikan dalam aspek personalia adalah :
1. Organisasi, kualifikasi, dan tanggung jawab
a. Struktur organisasi perusahaan bagian produksi dan pengawasan mutu
harus dipimpin oleh apoteker yang berbeda, yang tidak saling bertanggung
kepentingan di luar organisasi perusahaan, yang dapat menghambat atau
membatasi tanggung jawabnya.
b. Manajer produksi hendaklah seorang apoteker yang terlatih serta memiliki
pengalaman yang memadai, diberikan wewenang dan tanggung jawab
penuh untuk mengelola produksi obat.
c. Manajer pengawasan mutu hendaklah seorang apoteker yang handal,
terlatih dan memiliki pengalaman praktis yang memadai, memiliki
wewenang dan tanggung jawab penuh dalam penyusunan dan pelaksanaan
seluruh prosedur pengawasan mutu.
d. Manajer produksi dan pengawasan mutu bersama-sama bertanggung jawab
dalam penyusunan dan pengesahan prosedur-prosedur tertulis, pemantauan
dan pengawasan lingkungan pembuatan obat, kebersihan pabrik dan
validasi proses produksi, kalibrasi alat-alat pengukur, pelatihan personalia,
pemberian persetujuan terhadap pemasok bahan dan kontraktor,
pengamanan produk dan bahan terhadap kerusakan serta kemunduran
mutu dan dalam penyimpanan dokumen.
e. Tersedianya tenaga yang terampil dalam jumlah memadai untuk
melaksanakan supervisi langsung di bagian produksi dan pengawasan
mutu obat. Setiap supervisor tersebut hendaklah terlatih dan memiliki
keterampilan teknis, pengalaman dan bertanggung jawab kepada manajer
produksi dan pengawasan mutu.
f. Tersedianya tenaga yang terlatih secara teknis dalam jumlah memadai
untuk melaksanakan kegiatan produksi dan pengawasan mutu sesuai
g. Tanggung jawab yang diberikan pada setiap personil hendaklah tidak
terlalu berlebihan sehingga dapat menimbulkan resiko terhadap mutu obat.
h. Tugas dan tanggung jawab hendaklah diberikan dengan jelas serta dapat
dipahami dengan baik oleh setiap personil.
2. Pelatihan
a. Seluruh personil yang terlibat dalam kegiatan pembuatan obat, hendaklah
dilatih mengenai kegiatan yang sesuai dengan tugasnya maupun mengenai
prinsip CPOB.
b. Pelatihan hendaklah diberikan oleh orang yang ahli. Perhatian khusus
diberikan bagi mereka yang bekerja di daerah steril dan daerah bersih atau
yang bekerja dengan bahan yang beresiko tinggi atau yang menimbulkan
sensitifitas.
c. Pelatihan mengenai CPOB dilakukan secara berkesinambungan dengan
frekuensi yang memadai untuk menjamin agar personil terbiasa dengan
persyaratan CPOB.
d. Pelatihan CPOB dilaksanakan menurut program tertulis yang disetujui
oleh manajer produksi dan pengawasan mutu.
e. Catatan pelatihan mengenai CPOB kepada personil hendaklah disimpan
dan efektivitas program pelatihan dan prestasi personil hendaklah dinilai
secara berkala untuk menentukan apakah mereka telah memiliki
kualifikasi yang memadai untuk melaksanakan tugas yang diberikan.
2.4.3 Bangunan dan Fasilitas
Bangunan untuk pembuatan obat hendaklah memiliki ukuran, rancangan,
pembersihan dan pemeliharaan, tiap sarana kerja hendaklah memadai, sehingga
setiap resiko terjadi kekeliruan, pencemaran silang dan berbagai kesalahan lain
yang dapat menurunkan mutu obat dapat dihindarkan. Hal-hal yang perlu
diperhatikan antara lain:
1. Lokasi bangunan hendaklah dapat mencegah terjadinya pencemaran dari
lingkungan sekelilingnya. Seperti pencemaran udara, tanah dan air maupun
kegiatan di sekitarnya.
2. Bangunan dirancang dengan baik sehingga dapat terpelihara dan berfungsi
sebagaimana mestinya
3. Saluran air limbah hendaklah cukup besar dan mempunyai bak kontrol serta
ventilasi yang baik.
4. Tenaga listrik, suhu, kelembaban dan ventilasi harus tepat supaya tidak
mengakibatkan dampak yang merugikan baik secara langsung ataupun tidak
langsung terhadap produk selama proses pembuatan dan penyimpanan.
2.4.4 Peralatan
Peralatan yang digunakan dalam pembuatan obat hendaklah memiliki
rancangan bangunan dan konstruksi yang tepat, ukuran yang memadai serta
ditempatkan dengan tepat sehingga mutu setiap produk obat terjamin secara
seragam dari bets ke bets serta untuk memudahkan pembersihan dan
perawatannya
1. Rancang Bangun dan Konstruksi
a. Peralatan yang digunakan tidak bereaksi atau menimbulkan akibat
b. Peralatan hendaklah mudah dibersihkan baik bagian dalam maupun bagian
luarnya.
c. Peralatan yang digunakan untuk menimbang, mengukur, menguji dan
mencatat hendaklah diperiksa ketelitiannya secara teratur serta ditara
menurut program dan prosedur yang tepat, hasil pemeriksaannya dicatat
dan disimpan dengan baik.
d. Penyaring untuk cairan tidak boleh melepaskan serat ke dalam produk dan
tidak boleh mengandung asbes.
2. Pemasangan dan Penempatan
a. Peralatan hendaklah ditempatkan pada posisi yang tepat untuk
memperkecil pencemaran silang antar bahan.
b. Peralatan ditempatkan dengan jarak yang cukup renggang untuk
memberikan keleluasaan kerja.
c. Peralatan utama diberi nomor pengenal yang dipakai pada semua perintah
dan catatan pembuatan bets untuk menunjukkan unit atau alat tertentu.
d. Semua pipa, tangki, selubung hendaknya diberikan pelekat untuk
memperkecil kehilangan energi.
e. Saluran pipa yang menggunakan uap bertekanan hendaknya dilengkapi
dengan peralatan uap dan saluran pembuangan yang berfungsi dengan
baik.
f. Sistem-sistem penunjang hendaknya divalidasi untuk memastikan
3. Pemeliharaan
a. Peralatan hendaknya dirawat sesuai jadwal yang tepat agar berfungsi
dengan baik dan mencegah pencemaran.
b. Prosedur-prosedur tertulis untuk peralatan dibuat dan dipatuhi.
c. Catatan pelaksanaan pemeliharaan pemakaian peralatan utama hendaklah
dicatat dalam buku harian dan catatan untuk peralatan yang digunakan
khusus untuk satu produk saja dapat dimasukkan ke catatan produksi bets
produk tertentu.
2.4.5 Sanitasi dan Higiene
Tingkat sanitasi dan higiene yang tinggi hendaklah diterapkan pada setiap
aspek pembuatan obat. Ruang lingkup sanitasi dan higiene meliputi personalia,
bangunan, peralatan dan perlengkapan, bahan produksi serta wadahnya dan setiap
hal yang merupakan sumber pencemaran produk. Sumber pencemaran hendaknya
dihilangkan melalui suatu program sanitasi dan higiene yang menyeluruh dan
terpadu.
2.4.6 Produksi
Produksi hendaklah dilaksanakan dengan prosedur yang telah ditetapkan
serta dapat menjamin produk obat jadi memenuhi spesifikasi yang ditentukan.
1. Bahan Awal
a. Setiap bahan awal hendaklah memenuhi spesifikasi dan diberi label
dengan nama yang dinyatakan dalam spesifikasi sebelum dinyatakan lulus
untuk digunakan.
b. Untuk setiap kiriman atau bets hendaklah diberi nomor rujukan yang
c. Saat penerimaan barang selalu dilakukan pemeriksaan visual tentang
kondisi umum dan contoh untuk pengujian yang diambil oleh petugas
menggunakan metode yang disetujui oleh manajer pengawasan mutu.
d. Persediaan awal hendaklah diperiksa dalam selang waktu tertentu.
e. Bahan awal yang tidak stabil oleh pengaruh suhu, hendaklah disimpan
pada ruangan dengan suhu udara yang dapat diatur.
f. Pengeluaran bahan awal dilakukan oleh petugas yang berwenang.
g. Semua bahan awal yang tidak memenuhi syarat diberi tanda silang,
disimpan terpisah dan secepatnya dimusnahkan atau dikembalikan ke
pemasok.
2. Validasi Proses
a. Semua proses produksi divalidasi dengan tepat serta dilaksanakan sesuai
prosedur yang telah ditentukan dan hasilnya disimpan.
b. Sebelum suatu proses pengolahan induk diterapkan hendaklah dilakukan
langkah-langkah untuk membuktikan kecocokan dengan pelaksanaan
produksi.
c. Perubahan peralatan atau bahan disertai dengan tindakan validasi ulang.
d. Proses dan prosedur yang kritis dievaluasi kembali secara rutin untuk
memastikan bahwa proses dan prosedur tersebut tetap mampu memberikan
hasil yang diinginkan.
3. Pencemaran
Pencemaran kimiawi atau mikroba terhadap suatu obat yang dapat merugikan
kesehatan atau mengurangi daya terapeutik maupun mempengaruhi kualitas suatu
4. Sistem Penomoran bets dan Lot
a. Sistem penomoran selanjutnya hendaklah saling berkaitan.
b. Sistem penomoran hendaklah menjamin bahwa nomor tidak digunakan
secara berulang.
5. Penimbangan dan Penyerahan
a. Metode penanganan, penimbangan, perhitungan dan penyerahan bahan
dan produk tercakup dalam prosedur tertulis.
b. Bahan dan produk yang boleh diserahkan hanya yang telah diluluskan oleh
pengawasan mutu
c. Pada setiap penimbangan maupun pengukuran hendaklah dilakukan
pembuktian kebenarannya, ketepatan identitas, dan jumlah bahan.
d. Kebersihan tempat penimbangan dan penyerahan bahan ataupun obat
hendaklah dijaga.
e. Penimbangan dan penyerahan hendaklah menggunakan peralatan yang
cocok dan bersih.
f. Bahan baku produk yang diserahkan hendaknya diperiksa ulang.
6. Pengembalian
Semua bahan yang dikembalikan ke tempat penyimpanan hendaklah
didokumentasikan dengan baik.
7. Pengolahan
a. Semua bahan dan peralatan yang dipakai hendaklah diperiksa terlebih
b. Semua kegiatan pengolahan hendaklah mengikuti prosedur tertulis yang
telah ditentukan dan penyimpangan dilaporkan dengan alasan dan
penjelasan.
c. Wadah dan penutup untuk bahan dan produk hendaklah selalu bersih.
d. Seluruh pengawasan dalam proses harus dicatat dengan teliti.
e. Bahan dan produk kering.
Penanganannya menimbulkan masalah debu, oleh karena itu perlu
dipasang sistem penghisap debu untuk mencegah penyebarannya. Produk
hendaklah dilindungi dari pencemaran dan jangan sampai ada produk yang
tertinggal di dalam peralatan.
f. Pencampuran dan granulasi.
Mesin pencampur, pengayak dan pengaduk dilengkapi dengan sistem
pengendalian debu. Parameter operasional tercantum dalam Dokumen
Produksi Induk. Bahan yang beresiko tinggi digunakan kantong pelindung.
Pada pembuatan dan penggunaan larutan atau suspensi dicegah terjadinya
pencemaran atau pertumbuhan mikroba.
g. Pencetakan tablet.
Mesin dilengkapi dengan fasilitas pengendali debu yang memadai,
dilakukan pengendalian secara fisik, prosedur dan penandaan untuk
menghindari campur aduk antar produk. Tersedianya alat timbang yang
telah ditara. Tablet yang diambil untuk diuji tidak boleh dikembalikan dan
tablet yang ditolak atau disingkirkan hendaklah ditempatkan dalam wadah
m. Penyalutan
Udara yang dialirkan disaring dan memiliki mutu yang tepat dan larutan
penyalut digunakan dengan cara yang dapat menekan pertumbuhan jasad
renik.
n. Pengisian kapsul keras.
Kapsul kosong sebagai bahan awal, disimpan dalam kondisi yang baik.
o. Pemberian tanda tablet bersalut dan kapsul.
Hendaklah dihindari terjadinya campur-baur selama proses pemberian
tanda, pemeriksaan, pemilahan dan proses pengkilapan kapsul dan tablet
bersalut. Tinta yang digunakan untuk penandaan hendaklah tinta yang
memenuhi persyaratan untuk bahan makanan.
p. Produk cair, krim dan salep.
Proses produksi produk cair, krim, dan salep terlindung dari pencemaran.
Peralatan yang digunakan dirancang dan dipasang secara tepat sehingga
mudah untuk melakukan pembersihan. Kualitas kimiawi dan mikrobiologi
air hendaklah diperiksa pada awal, sesudah penghentian dan pada akhir
proses pengisian untuk memastikan homogenitas produk.
8. Produk Steril
a. Cara produksi ada dua kategori yaitu aseptik dan sterilisasi akhir.
b. Semua produk steril dibuat dengan kondisi yang terkendali dan dipantau
dengan teliti, diperlukan tindakan khusus untuk meyakinkan sterilisasi
akhir.
c. Untuk membuat produk steril diperlukan ruangan terpisah yang dirancang
d. Pembuatan produk steril memerlukan tiga kualitas ruangan yang berbeda
yaitu ruang ganti pakaian, ruang bersih, dan ruang steril.
e. Kontaminasi jasad renik tidak melebihi nilai batas yang ditentukan.
f. Personalia.
Personil yang bekerja hendaklah dipilih dengan seksama. Standar higiene
dan kebersihan perorangan sangat penting. Oleh karena itu semua personil
dilatih dalam bidang yang berkaitan dengan pembuatan produk steril.
g. Pakaian.
Personil memakai pakaian khusus untuk daerah bersih dan steril. Pakaian
biasa dari luar tidak boleh dibawa ke dalam. Arloji, perhiasan dan
kosmetika tidak boleh dipakai dalam ruangan bersih dan steril. Pakaian
ditangani dengan cepat dan pencucian terpisah sehingga tidak terkena
cemaran.
h. Bangunan.
Bangunan untuk ruang steril dirancang khusus, ruangan diberi aliran udara
bertekanan positif secara efektif melalui saringan. Permukaan kedap air
dan tidak retak. Tidak boleh ada bagian yang dapat terjadi penumpukan
debu. Pipa-pipa dipasang dengan tepat. Saluran pembuangan terpisah dan
bak cuci ditiadakan. Dan semua aspek yang memungkinkan pencemaran
dihindari.
i. Peralatan dirancang dan dipasang dengan tepat dan mudah dibersihkan.
j. Sterilisasi dapat dilakukan dengan cara panas basah, panas kering, cara
Selain hal-hal di atas, masalah yang perlu diperhatikan adalah masalah air,
penyelesaian produk steril, kesiapan jalur pengemasan, pengawasan dalam proses,
pelaksanaan pengemasan, produk pilihan, sisa produk dan obat jadi yang
dikembalikan dari gudang pabrik, obat kembalian, karantina obat jadi,
pengawasan distribusi, penyimpanan bahan awal, produk antara, ruahan dan obat
jadi, penyimpanan bahan baku dan bahan pengemas, serta penyimpanan produk
antara, produk ruahan dan obat jadi.
Pembuatan obat berdasarkan kontrak hanya boleh diberikan kepada pabrik
yang sudah memiliki sertifikat CPOB dan disertai surat perjanjian yang merinci
tugas dan tanggung jawab masing-masing pihak.
Pembuatan produk steril dilakukan di area bersih yang tingkat
kebersihannya sesuai dengan standar kebersihan dengan udara yang telah
melewati filter dengan efisiensi yang sesuai. Pembuatan produk steril dibedakan
menjadi 4 kelas :
1. Kelas A
Zona untuk kegiatan yang beresiko tinggi, misalnya untuk zona pengisian
ampul dan vial terbuka, penyambungan secara aseptik dan wadah tutup karet.
Kondisi ini umumnya dicapai dengan memasang Laminar Air Flow (LAF).
2. Kelas B
Untuk pembuatan dan pengisian secara aseptik, kelas ini merupakan latar
belakang untuk zona kelas A.
3. Kelas C dan D
Area bersih untuk melakukan tahap pembuatan produk steril dengan tingkat
2.4.7 Pengawasan Mutu
Pengawasan mutu merupakan bagian yang esensial dari cara pembuatan
obat yang baik, agar tiap obat yang dibuat memenuhi persyaratan mutu yang
sesuai dengan tujuan penggunaannya. Hal-hal yang perlu dibicarakan dalam
pengawasan mutu antara lain :
1. Pengawasan mutu
Pengawasan mutu hendaklah dirancang dengan tepat meliputi semua fungsi
analisis yang dilakukan di laboratorium. Sistem dokumentasi dan prosedur
hendaklah menjamin bahwa pemeriksaan dilakukan dengan tepat. Tugas
pokok pengawasan mutu meliputi penyusunan prosedur, penyiapan, instruksi,
menyusun rencana pengambilan contoh, meluluskan atau menolak
bahan-bahan dan produk, meneliti catatan sebelum produk didistribusikan,
menetapkan tanggal kadaluwarsa, mengevaluasi pengujian ulang, menyetujui
penunjukan pemasok, mengevaluasi keluhan, menyediakan baku pembanding,
menyimpan catatan, mengevaluasi obat kembalian, ikut serta dalam program
inspeksi diri dan memberikan rekomendasi untuk pembuatan obat oleh pihak
lain atas dasar kontrak.
2. Laboratorium
Laboratorium pengujian meliputi bangunan dan alat-alat penunjang yang
lengkap dan memadai, personalia yang terlatih dan bertanggung jawab,
peralatan instrumen yang cocok untuk prosedur dan dikalibrasi secara berkala,
pereaksi dan media pembiakan yang sesuai, baku pembanding resmi yang
sesuai dengan monografi yang bersangkutan, spesifikasi dan prosedur
yang mencakup seluruh aspek yang diperlukan dan contoh pertinggal untuk
disimpan yang dipergunakan dalam pengujian selanjutnya.
3. Validasi
Bagian pengawasan mutu melakukan validasi terhadap prosedur penetapan
kadar dan penerapan alat-alat instrumen yang ada, serta memberi bantuan
dalam pelaksanaan validasi di bagian produksi.
4. Pengawasan terhadap bahan awal, produk antara, produk ruahan dan obat jadi,
diperhatikan dalam hal spesifikasi, cara pengambilan contoh, pengujian
terhadap bahan baku, pengemas, produk antara, produk ruahan dan obat jadi.
Uji sterilitas untuk produk steril, uji pirogenitas serta pengawasan lingkungan
secara berkala terhadap mutu kimiawi dan mikrobiologi dari air dan
lingkungan produksi.
5. Produksi-produksi dan perubahannya
Bagian pengawasan mutu ikut serta dalam pembuatan prosedur pengolahan
induk dan prosedur pengemasan induk.
6. Peninjauan catatan produksi dan bets produk
Semua catatan produksi dan pengawasan tiap bets dilakukan oleh bagian
pengawasan mutu dan bets yang menyimpang diselidiki secara tuntas.
7. Penelitian stabilitas
Penelitian dirancang untuk mengetahui stabilitas dari produk, dan program ini
dipatuhi mencakup jumlah, kondisi penyimpanan dan metode pengujian.
Penelitian stabilitas dilakukan terhadap produk baru, kemasan baru, perubahan
8. Penilaian terhadap pemasok
Bagian pengawasan mutu bertanggung jawab menentukan pemasok yang
dipercaya, yang sebelumnya dievaluasi dan diinspeksi bersama oleh bagian
pengawasan mutu, bagian produksi dan bagian pembelian secara berkala.
2.4.8 Inspeksi Diri
Tujuan inspeksi diri adalah untuk melakukan penilaian apakah seluruh
aspek produksi dan pengendalian mutu memenuhi standar CPOB. Program
inspeksi diri dirancang untuk mendeteksi kelemahan dalam pelaksanaan CPOB
dan untuk menetapkan tindakan perbaikan yang diperlukan. Inspeksi diri
dilakukan secara indepeden dan dirinci oleh petugas yang kompeten dari
perusahaan. Inspeksi diri dilakukan secara rutin dan disamping itu pada situasi
khusus, misalnya dalam hal terjadi penarikan kembali obat jadi atau terjadi
penolakan yang berulang. Prosedur dan catatan inspeksi diri hendaklah
didokumentasikan dan dibuat program tindak lanjut yang efektif.
Inspeksi meliputi personil, bangunan, penyimpanan, bahan awal, obat jadi,
produksi, pengawasan mutu, dokumentasi dan pemeliharaan gedung serta
peralatan.
2.4.9 Penanganan Keluhan Terhadap Obat dan Penarikan Kembali Obat
Serta Obat Kembalian
Penarikan kembali obat adalah suatu proses penarikan kembali dari satu
atau beberapa bets atau seluruh bets obat tertentu dari peredaran. Penarikan
kembali obat dilakukan apabila ditemukan obat yang cacat mutu atau bila ada
laporan mengenai reaksi yang merugikan yang serius serta beresiko terhadap
dikembalikan ke pabrik pembuatnya karena adanya keluhan, kerusakan,
kadaluwarsa, masalah keabsahan atau sebab-sebab lain mengenai kondisi obat,
wadah atau kemasan sehingga menimbulkan keraguan akan keamanan, khasiat
atau mutu obat.
Semua keluhan dan informasi lain yang berkaitan dengan kemungkinan
terjadi kerusakan obat hendaklah dikaji dengan teliti sesuai dengan prosedur
tertulis. Untuk menangani semua kasus yang mendesak, hendaklah disusun suatu
sistem, bila perlu mencakup penarikan kembali produk yang diketahui atau diduga
cacat dari peredaran secara cepat dan efektif.
2.4.10 Dokumentasi
Dokumentasi adalah seluruh prosedur, instruksi dan catatan yang
berhubungan dengan proses pembuatan Obat. Fungsi dokumentasi adalah:
1. Merupakan bagian dari sistem manajemen mutu dalam c-GMP
2. Memastikan bahwa setiap petugas mendapat instruksi secara rinci dan jelas
mengenai bidang tugas yang harus dilaksanakan
3. Menggambarkan riwayat lengkap dari setiap bets/lot produk sehingga
menjamin ketelusuran
Dokumentasi pembuatan obat merupakan bagian dari sistem informasi
manajemen yang meliputi spesifikasi bahan baku, bahan pengemas, produk
antara, produk ruahan dan obat jadi, dokumen dalam produksi, dokumen dalam
pengawasan mutu, dokumen dalam penyimpanan dan distribusi, dokumen dalam
pemeliharaan, pembersihan dan pengendalian ruangan dan peralatan, dokumen
dalam penanganan keluhan obat yang ditarik kembali, obat kembalian dan
prosedur dan catatan tentang inspeksi diri, pedoman dan catatan tentang pelatihan
CPOB bagi personil.
2.4.11 Pembuatan dan Analisis Berdasarkan Kontrak
Pembuatan analisis berdasarkan kontrak harus dibuat secara benar,
disetujui dan dikendalikan untuk menghindari kesalahpahaman yang dapat
menyebabkan produk atau pekerjaan dengan mutu yang tidak memuaskan.
Kontrak tertulis antara pemberi Kontrak dan Penerima Kontrak harus dibuat
secara jelas menentukan tanggung jawab dan kewajiban masing-masing pihak.
Kontrak harus menyatakan secara jelas prosedur pelulusan tiap bets produk untuk
diedarkan yang menjadi tanggung jawab penuh kepala bagian Manajemen Mutu
(Pemastian Mutu). Hal – hal yang harus diperhatikan dari pembuatan dan analisis
berdasarkan kontrak, yaitu :
1. Hendaklah dibuat kontrak tertulis yang meliputi pembuatan dan/atau analisis
obat yang dikontrakkan dan semua pengaturan teknis terkait.
2. Semua pengaturan untuk pembuatan dan analisis berdasarkan kontrak
termasuk usulan perubahan dalam pengaturan teknis atau pengaturan lain
hendaklah sesuai dengan izin edar untuk produk bersangkutan.
3. Kontrak hendaklah mengizinkan Pemberi Kontrak untuk mengaudit sarana
dari Penerima Kontrak.
4. Dalam hal analisis berdasarkan kontrak, pelulusan akhir harus diberikan oleh
kepala bagian Manajemen Mutu (Pemastian Mutu) Pemberi Kontrak
2.4.12 Kualifikasi dan Validasi
a. Seluruh kegiatan validasi hendaklah direncanakan. Unsur utama program
validasi hendaklah dirinci dengan jelas dan didokumentasikan di dalam
Rencana Induk Validasi (RIV) atau dokumen setara.
b. RIV hendaklah merupakan dokumen yang singkat, tepat dan jelas.
c. RIV hendaklah mencakup sekurang-kurangnya data sebagai berikut:
1) Kebijakan validasi.
2) Struktur organisasi kegiatan validasi.
3) Ringkasan fasilitas, sistem, peralatan dan proses yang akan divalidasi.
4) Format dokumen, format protokol dan laporan validasi, perencanaan
dan jadwal pelaksanaan.
5) Pengendalian perubahan, dan
6) Acuan dokumen yang digunakan.
d. RIV terpisah mungkin diperlukan untuk suatu proyek besar.
2. Kualifikasi terdiri dari :
a. Kualifikasi Desain
Kualifikasi Desain adalah unsur pertama dalam melakukan validasi
terhadap fasilitas, sistem atau peralatan baru.
b. Kualifikasi Instalasi
Kualifikasi Instalasi hendaklah dilakukan terhadap fasilitas, sistem dan
peralatan baru atau yang dimodifikasi.
c. Kualifikasi Operasional
Kualifikasi Operasional hendaklah dilakukan setelah Kualifikasi Instalasi
d. Kualifikasi Kinerja
Kualifikasi Kinerja hendaklah dilakukan setelah Kualifikasi Instalasi dan
BAB III
TINJAUAN KHUSUS LEMBAGA FARMASI
DIREKTORAT KESEHATAN ANGKATAN DARAT
3.1. Sejarah Perkembangan Lafi Ditkesad
Lembaga Farmasi Direktorat Kesehatan Angkatan Darat (Lafi Ditkesad)
berasal dari MSL (Militaire Scheikundig Laboratorium). Lembaga ini berfungsi
sebagai tempat pemeriksaan obat-obatan bagi kebutuhan tentara Belanda.
Pada tanggal 23 Januari 1950 dibentuk panitia pengalihan, sehingga pada
tanggal 1 Juni 1950 dilakukan serah terima dari MSL kepada TNI AD yang
menjadi dasar dalam penetapan hari jadi Lafi Ditkesad melalui SK No.
Kep/23/I/1997 tanggal 31 Januari 1997. Setelah serah terima pada tanggal 1 Juni
1950 MSL terbagi menjadi dua :
1. Laboratorium Kimia Tentara (LKT) yang kemudian berkembang menjadi
Laboratorium Kimia Angkatan Darat (LKAD).
2. Depot Obat Tentara Pusat (DOTP) yang berkembang menjadi Depot Obat
Angkatan Darat (DOAD).
Berdasarkan SK Ditkesad No. Kpts/61/10/IX/1960 tanggal 13 September
1960 terhitung mulai tanggal 8 Juni 1960 LKAD dan DOAD disatukan menjadi
Lembaga Farmasi Angkatan Darat (LAFIAD). Pada tanggal 15 Oktober 1970
LAFIAD dipisah kembali menjadi :
1. LAFIAD yang akhirnya menjadi Lembaga Farmasi Jawatan Kesehatan
2. Depot Obat Angkatan Darat (DOAD) berkembang menjadi Depot Alat
Peralatan Kesehatan (Dopalkes) dan berakhir menjadi Depot Pusat Perbekalan
Kesehatan (Dopusbekkes) Jankesad
Selanjutnya tahun 1985 antara Lafi Jankesad dan Dopusbekkes Jankesad
disatukan kembali menjadi Lafi Ditkesad hingga 31 Maret 2005 dan mulai 1 April
2005 dipisah lagi menjadi Lafi Ditkesad dan Gudang Pusat II Ditkesad.
3.2 Visi dan Misi LAFI DITKESAD
Visi Lafi Ditkesad adalah menjadi satu-satunya lembaga produksi yang
mampu memenuhi kebutuhan obat yang bermutu bagi TNI AD.
Lafi Ditkesad mempunyai misi sebagai berikut :
1. Mampu memenuhi kebutuhan obat TNI AD
2. Pusat litbang dan informasi obat TNI AD.
3. Mampu menjadi mitra industri farmasi lain dalam memenuhi kebutuhan obat
nasional.
3.3 Kedudukan, Tugas Pokok dan Fungsi Lafi Ditkesad
Lembaga Farmasi Direktorat Kesehatan Angkatan Darat (Lafi Ditkesad)
adalah badan pelaksana di tingkat Ditkesad yang berkedudukan langsung di
bawah Direktur Kesehatan Angkatan Darat (Dirkesad). Tugas pokok Lafi
Ditkesad adalah membantu Dirkesad dalam menyelenggarakan pembinaan dan
melaksanakan produksi, penelitian dan pengembangan obat dalam rangka
Dalam melaksanakan tugas pokok tersebut Lafi Ditkesad
menyelenggarakan tugas-tugas sebagai berikut :
3.3.1 Tugas dalam melaksanakan fungsi utama
1. Penelitian dan Pengembangan; meliputi segala usaha, pekerjaan, kegiatan di
bidang penelitian dan pengembangan produk, sistem metode dan personel
dalam rangka penyelenggaraan produksi obat.
2. Produksi; meliputi segala usaha, pekerjaan dan kegiatan di bidang produksi
obat
3. Pengawasan mutu; meliputi segala usaha, pekerjaan dan kegiatan pemeriksaan
fisika, kimia, mikrobiologi, terhadap bahan baku, bahan pendukung produksi,
pengawasan selama proses, produk antara, produk ruahan dan produk jadi.
4. Pemeliharaan; meliputi segala usaha, pekerjaan, kegiatan di bidang
pemeliharaan dan perbaikan peralatan produksi, pengawasan mutu dan sistem
penunjang.
5. Penyimpanan; meliputi segala usaha, pekerjaan, dan kegiatan di bidang
penerimaan, penyimpanan dan pengeluaran bahan baku, bahan pendukung
produksi, peralatan dan obat jadi.
3.3.2 Tugas Melaksanakan Fungsi Organik
1. Fungsi Organik Militer
Meliputi segala usaha, pekerjaan dan kegiatan di bidang intelijen, operasi,
personil, logistik, teritorial, perencanaan dan pengawasan serta pemeriksaan
2. Fungsi Organik Pembinaan
Meliputi segala usaha, pekerjaan dan kegiatan di bidang latihan kesatuan
dalam rangka mendukung tugas pokok Lafi Ditkesad.
3.4 Struktur Organisasi Lafi Ditkesad
Peraturan Kepala Staf TNI AD No. Perkasad/219/XII/2007 tanggal 10
Desember 2007 tentang organisasi dan tugas Lafi Ditkesad telah mengalami
perkembangan mengenai struktur organisasi yang bertujuan untuk lebih
mengoptimalkan kinerja personil dalam menghadapi kemajuan ilmu pengetahuan
dan teknologi. Struktur organisasi Lafi Ditkesad dapat dilihat pada lampiran 1.
Susunan organisasi adalah sebagai berikut:
3.4.1 Eselon Pimpinan
1. Kepala Lembaga Farmasi, disingkat Kalafi
Kalafi dijabat oleh seorang Pamen TNI Angkatan Darat berpangkat Letnan
Kolonel CKM, dalam melaksanakan tugas kewajibannya bertanggung jawab
kepada Direktur Kesehatan Angkatan Darat.
2. Wakil Kepala Lembaga Farmasi, disingkat Wakalafi
Wakalafi dijabat oleh seorang Pamen TNI Angkatan Darat, berpangkat Letnan
Kolonel CKM, dalam melaksanakan tugas kewajibannya bertanggung jawab
kepada Kalafi.
3.4.2 Eselon Pembantu Pimpinan
Pa Ahli Lafi dijabat oleh Pamen TNl Angkatan Darat berpangkat Letnan
Kolonel CKM, dalam melaksanakan tugas kewajibannya bertanggung jawab
kepada Kalafi. Pa Ahli terdiri dari:
a. Perwira Ahli Madya Manajemen Mutu, disingkat Paahli Madya Jemen
Mutu.
b. Perwira Ahli Madya Teknologi Farmasi, disingkat Paahli Madya
Biotekfi.
c. Perwira Ahli Madya Analisa Mengenai Dampak Lingkungan, disingkat
Paahli Madya Amdal.
2. Bagian Administrasi Logistik, disingkat Bagminlog.
Kabagminlog dijabat oleh Pamen TNI Angkatan Darat berpangkat Letnan
Kolonel CKM, dalam pelaksanaaan tugas kewajibannya bertanggung jawab
kepada Kalafi. Kabagminlog dalam melaksanakan tugasnya dibantu oleh dua
kepala seksi yang masing-masing dijabat oleh Pamen TNI Angkatan Darat
berpangkat Mayor CKM, terdiri dari:
a. Kepala Seksi Perencanaan Program dan Anggaran, disingkat
Kasirengarprogar.
b. Kepala Seksi Pengendalian Materil, disingkat Kasidalmat.
3.4.3 Eselon Pelayanan (Seksi Tata Usaha dan Urusan Dalam, disingkat Si
TUUD)
Kasi TUUD dijabat oleh seorang Pamen TNI Angkatan Darat
berpangkat Mayor CKM dalam melaksanakan tugas kewajibannya bertanggung
jawab kepada Kalafi. Kasi TUUD dalam melaksanakan tugasnya dibantu oleh
berpangkat Kapten CKM dan PNS golongan tiga serta satu perwira urusan yang
dijabat oleh Pama TNI Angkatan Darat berpangkat Letnan CKM terdiri dari:
1. Kepala Urusan Administrasi Personil dan Logistik, disingkat
Kaurminperslog.
2. Kepala Urusan Tata Usaha, disingkat Kaurtu.
3. Kepala Urusan Dalam, disingkat Kaurdal.
4. Perwira Urusan Pengamanan, disingkat Paurpam.
3.4.4 Eselon Pelaksana
1. Instalasi Penelitian dan Pengembangan, disingkat Installitbang
KaInstallitbang dijabat oleh seorang Pamen TNI Angkatan Darat berpangkat
Letnan Kolonel CKM, dalam melaksanakan tugasnya dibantu oleh dua Kepala
Seksi yang masing-masing dijabat oleh Pamen TNI Angkatan Darat
berpangkat Mayor CKM, terdiri dari:
a. Kepala Seksi Penelitian dan Pengembangan Produksi, disingkat
Kasilitbangprod.
b. Kepala Seksi Penelitian dan Pengembangan Sistem Metode dan Personel,
disingkat Kasilitbangsistodapers.
KaInstallitbang dalam pelaksanaan tugas kewajibannya bertanggung jawab
kepada Kalafi.
2. Instalasi Produksi, disingkat Instalprod.
KaInstalprod dijabat oleh seorang Pamen TNI Angkatan Darat berpangkat
Letnan Kolonel CKM (Berkualifikasi Apoteker), dalam pelaksanaan tugas
melaksanakan tugasnya dibantu oleh empat Kepala Seksi yang masing-masing
dijabat oleh Pamen TNI Angkatan Darat berpangkat Mayor CKM, terdiri dari:
a. Kepala Seksi Sediaan Non Betalaktam, disingkat Kasidia Non
Betalaktam
b. Kepala Seksi Sediaan Betalaktam, disingkat Kasidia Betalaktam
c. Kepala Seksi Sediaan Sefalosforin disingkat Kasidia Sefalosforin.
d. Kepala Seksi Kemas, disingkat Kasi Kemas.
3. Instalasi Pengawasan Mutu, disingkat Instal wastu
KaInstal wastu dijabat oleh seorang Pamen TNI Angkatan Darat berpangkat
Letnan Kolonel CKM (Apoteker), dalam melaksanakan tugasnya dibantu
oleh dua Kepala Seksi yang masing-masing dijabat oleh Pamen TNI
Angkatan Darat berpangkat Mayor CKM, terdiri dari:
a. Kepala Seksi Pengujian Kimia, Fisika dan mikrobiologi, disingkat
Kasiuji Kifis dan Mikro
b. Kepala Seksi Inspeksi, disingkat Kasiinspek.
KaInstal wastu dalam pelaksanaan tugas kewajibannya bertanggung
jawab kepada Kalafi.
4. Instalasi Pemeliharaan dan sistem penunjang, disingkat Instalhar dan
Sisjang.
Kainstalhar dan Sisjang dijabat oleh Pamen TNI Angkatan Darat berpangkat
Mayor CKM yang dalam melaksanakan tugasnya dibantu oleh dua Kepala
Urusan yang masing-masing dijabat oleh Pama TNI Angkatan Darat
berpangkat Kapten CKM, terdiri dari:
b. Kepala Urusan Sistem Penunjang, disingkat Kaursisjang.
Kainstalhar dan Sisjang dalam pelaksanaan tugas kewajibannya bertanggung
jawab kepada Kalafi.
5. Instalasi Simpan, disingkat Instal simpan
Kainstalsimpan di.jabat oieh Pamen TNI Angkatan Darat berpangkat Mayor
CKM, dalam melaksanakan tugasnya dibantu oleh satu Kepala Urusan yang
dijabat oleh Pama TNI Angkatan Darat berpangkat Kapten CKM dan satu
Perwira Urusan yang dijabat oleh Pama TNI Angkatan Darat berpangkat
Letnan CKM, terdiri dari:
a. Kepala Urusan Penyimpanan Material Produksi, disingkat Kaur
simpanmatprod.
b. Perwira Urusan Penyimpanan Obat Jadi, disingkat Paursimpan Obat Jadi.
Kainstalsimpan dalam pelaksanaan tugas kewajibannya bertanggung jawab
kepada Kalafi.
3.5 Kualifikasi Tenaga Kerja Lafi Ditkesad
Berdasarkan statusnya, personil Lafi Ditkesad terdiri dari militer dan
Pegawai Negeri Sipil (PNS). Adapun data personil Lafi Ditkesad Bulan Februari
Tabel 1. Data Personil Lafi Ditkesad Bulan September 2008 Berdasarkan
Jenjang Pendidikannya.
No Kualifikasi Militer PNS Jumlah
1 S2 Farmasi 2 1 3
2 S2 Manajemen 1 - 1
3 S1 Apoteker 7 3 10
4 S1 Kimia / Sarjana lain-lain 5 3 8
5 Sarjana Muda Kimia 1 - 1
6 D3 Analisis Medis / Kesehatan 2 1 3
7 Asisten Apoteker 2 6 8
8 Analis - 2 2
9 Perawat Umum/Bidan 1 - 1
10 Perawat Veteriner - - -
11 STM Alkes - 2 2
12 SLTA (SMA, SMEA, STM) 21 75 96
13 SLTP 2 15 17
14 SD - 3 3
Jumlah 44 111 155
3.6 Sertifikasi CPOB Lafi Ditkesad
Lembaga Farmasi Angkatan Darat merupakan salah satu badan pelaksana di
tingkat Ditkesad yang bertugas melaksanakan fungsi penelitian, pengembangan
pemerintah melalui keputusan MenKes RI No. 43/MenKes/SK/II/1988 tentang
Cara Pembuatan Obat Yang Baik yang mengharuskan seluruh industri farmasi
melaksanakan seluruh kegiatan sesuai dengan tuntunan CPOB.
Dengan pertimbangan efisiensi dan efektifitas maka dimulailah
pembangunan gedung baru di Jl. Gudang Utara No. 26 Bandung dengan rancang
bangun sesuai CPOB dan perkembangan teknologi di bidang industri farmasi.
Pembangunan gedung baru ini dilaksanakan setelah Rencana Induk Pembangunan
(RIP) dalam rangka sertifikasi CPOB Lafi Ditkesad mendapatkan persetujuan dari
Dirjen POM Depkes RI dengan surat keputusan No. 02.01.2.4.96.665 tanggal 28
Februari 1996.
Pembangunan dan pekerjaan yang sudah dilaksanakan Lafi Ditkesad pada
saat ini adalah :
1. Bangunan
a. Bangunan Instalasi Produksi Betalaktam.
b. Sebagian bangunan Instalasi Produksi Non Betalaktam.
c. Bangunan Instalasi Pengawasan Mutu.
d. Fasilitas sumber air PDAM dan air baku farmasi untuk seluruh kebutuhan
Instalasi Produksi (Betalaktam dan non Betalaktam), Instalasi Pengawasan
Mutu dan perkantoran.
e. Fasilitas gardu listrik mencakup seluruh kebutuhan Instalasi Produksi,
Instalasi Pengawasan Mutu dan perkantoran.
f. Fasilitas Instalasi Pengolahan Air Limbah (IPAL) yang mampu mengolah
limbah pabrik.
h. Kompresor udara bertekanan yang mampu mendukung seluruh kebutuhan
pabrik.
i. Air Handling System (AHS) untuk unit produksi Betalaktam, ruang
laboratorium mikrobiologi dan Instalasi Pengawasan Mutu dan sebagian
unit produksi Non Betalaktam sudah terpasang dan memenuhi syarat
CPOB.
2. Peralatan
Peralatan untuk Betalaktam, sebagian non Betalaktam dan Instalasi
Pengawasan Mutu sudah terpasang dan memenuhi syarat CPOB.
3. Dokumen Prosedur Tetap (Protap)
Dokumen protap untuk sediaan Betalaktam dan non Betalaktam yang telah
dibuat sudah dilaksanakan sesuai aturan CPOB
4. Pelatihan CPOB
Pelatihan CPOB umum dan khusus baik untuk Betalaktam dan Non Beta
laktam telah dilaksanakan secara berkala.
5. Sertifikasi CPOB
Sertifikasi CPOB yang telah diterima oleh Lafi Ditkesad sampai bulan
Februari 2007 ditujukan untuk sediaan Betalaktam dan non Betalaktam.
a. Sertifikat CPOB untuk Sediaan Betalaktam :
1) Tablet antibiotika turunan Penisilin.
Kaplet Amoxicillin 500 mg dan Ampicillin 500 mg
2) Tablet salut antibiotika turunan Penisilin
3) Kapsul keras antibiotika turunan Penisilin
Ampicillin 250 mg dan Amoxicillin 250 mg
4) Suspensi kering oral antibiotika turunan Penisilin
Sirup kering Ampicillin 125 mg dan Amoxicillin 125 mg
5) Serbuk steril injeksi antibiotika turunan Penisilin
Amoxicillin dan Ampicillin.
b. Sertifikat CPOB untuk Sediaan non Betalaktam :
1) Tablet biasa non antibiotik
Fimol 500 mg, Dexamethason, Lafihistin, Lafimag, Lafiten, Neuralgad
2) Tablet salut non antibiotik
Imodiad, Neurobiad, Buscofiad
3) Kapsul keras non antibiotik
Yaitu Sangobiad
4) Sirop oral non antibiotik
Lafidril, Paracetamol
5) Cairan obat luar non antibiotik
Lafiodin 15 mL dan Lafiodin 1 L
Sertifikasi ini merupakan pengakuan Badan Pengawas Obat dan Makanan
yang berlaku selama industri menjalankan prinsip CPOB yang telah ditetapkan.
3.7 Kegiatan Lafi Ditkesad
Kegiatan Lafi Ditkesad dalam melaksanakan tugas dan fungsi produksi
proses produksi, pengawasan mutu, penelitian dan pengembangan, pemeliharaan
dan kegiatan administrasi.
3.7.1 Kegiatan Bagian Administrasi dan logistik (Bagminlog)
Perencanaan dan pengadaan barang untuk produksi obat Lafi Ditkesad
dilakukan berdasarkan data dari Sub Direktorat Pembinaan Pelayanan Kesehatan
(Subditbinyankes) yang disusun berdasarkan masukan pola penyakit dari daerah
dan laporan dari masing-masing Kesehatan Daerah Militer (Kesdam), Satuan
Kesehatan (Satkes) dan Rumah Sakit Pusat Angkatan Darat (RSPAD). Rencana
pengadaan obat kemudian dibuat dengan melakukan penyesuaian antara daftar
kebutuhan obat dengan anggaran yang tersedia dan selanjutnya dianalisa dan
dievaluasi oleh Subditbinyankes yang dilakukan setahun sebelum pelaksanaan.
Surat Keputusan Kasad No. Skep/336/X/2005 tanggal 17 Oktober 2005
tentang Pengadaan Barang/Material dan Jasa di Lingkungan Angkatan Darat
mengatur tata cara pengadaan obat yang dilakukan dengan cara pembuatan obat
jadi dan produksi di Lafi Ditkesad. Bagminlog membuat rencana kebutuhan
produksi obat Lafi Ditkesad yang terdiri dari rencana kebutuhan bahan aktif,
bahan pembantu dan bahan pengemas (embalage). Perencanaan tersebut disusun
berdasarkan formula dan spesifikasi obat yang telah ditentukan oleh Lafi
Ditkesad, disamping itu Bagminlog juga menyusun rencana dan anggaran untuk
pemeliharaan sarana operasional yang digunakan di tiap instalasi atau bagian di
Lafi Ditkesad.
Pengadaan barang dilakukan oleh Ditkesad melalui panitia pengadaan atau
lelang, kemudian Dirkesad membentuk tim komisi penerimaan barang yang
uji mutu dilakukan oleh Instal Wastu setelah barang lulus uji mutu maka dibuat
Laporan Hasil Pengujian (LHP) dan Berita Acara (BA) penerimaan. Bila barang
yang dikirimkan tidak sesuai dengan spesifikasi diminta atau tidak memenuhi
syarat, maka barang akan dikembalikan untuk diganti, kemudian barang yang
lolos administrasi dan uji mutu dikirim ke Gudang Pusat II yang disertai dengan
surat Perintah Penerimaan Material (PPnM).
3.7.2 Kegiatan Instalasi Pengawasan Mutu (Instal wastu)
Pengawasan mutu merupakan bagian integral dari suatu produksi obat.
Instal wastu bertanggung jawab terhadap setiap hal yang menyangkut kualitas
bahan baku obat, bahan pembantu, bahan pengemas, produk antara, produk
ruahan, dan obat jadi yang dihasilkan sampai dengan pemantauan kualitas setelah
didistribusikan (dengan standar waktu kadaluarsa). Instal wastu juga bertanggung
jawab terhadap kualitas lingkungan kerja yang menyangkut pengawasan
bangunan, ruangan dan peralatan serta fasilitas penunjang lainnya seperti
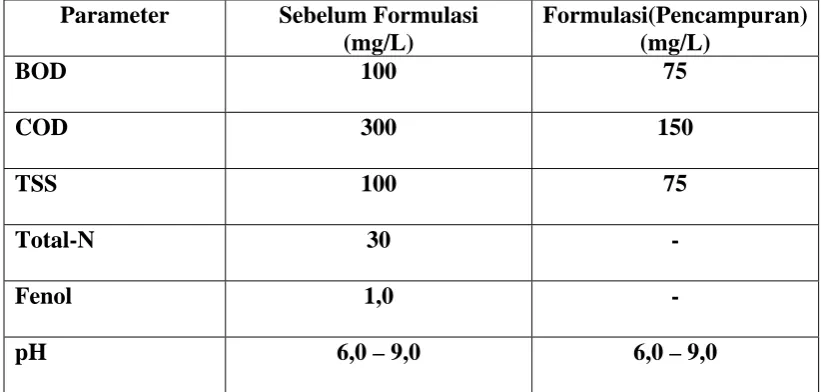
pemeriksaan kualitas udara, pengendalian mutu air dan pemeriksaan limbah.
Pelaksanaan kegiatan di Instal wastu ditunjang oleh fasilitas Instrumen HPLC,
spektrofotometer dengan sistem terkomputerisasi, Laminar Air Flow, Read Biotic
(pembaca jumlah bakteri), Climatic Chamber, Dissolution Tester serta berbagai
fasilitas penunjang lainnya.
Dalam menjalankan tugasnya, Instal wastu didukung oleh personel yang
terdiri dari apoteker dan analis yang terlatih dan berpengalaman dalam
Kegiatan Instal wastu tersebut dilaksanakan pada tahap persiapan, selama
proses produksi dan setelah proses produksi.
Beberapa kegiatan Instal wastu diantaranya:
1. Menyiapkan metode pemeriksaan, pengujian dan validasi metoda analisa yang
sesuai dengan acuan standar resmi seperti Farmakope Indonesia.
2. Menyiapkan prosedur pengambilan sampel untuk pemeriksaan dan pengujian,
dimana setiap sampel yang diambil dicatat dan didokumentasikan.
3. Menyiapkan dan menyimpan baku pembanding kerja untuk pengujian.
4. Menyimpan contoh pertinggal obat jadi dan bahan baku serta Catatan
Pengujian atau Pemeriksaan.
5. Meluluskan atau menolak bahan yang akan digunakan dalam produksi
meliputi bahan baku obat, bahan baku pembantu dan embalage. Hasilnya
dapat dicatat pada Laporan Hasil Pengujian (Laporan Hasil Pengujian dapat
dilihat pada Lampiran 2).
6. Melaksanakan In Process Control (IPC) selama proses produksi dan
memberikan keputusan atas diluluskan atau tidaknya hasil suatu tahap
produksi sampai hasil produk akhirnya.
7. Melaksanakan pengujian terhadap hasil jadi suatu sediaan yang diperoleh.
Dicatat pada Catatan Pengujian sediaan jadi (Blanko Hasil Pengujian
Laboratorium dapat dilihat pada Lampiran 3,4,5).
8. Meneliti dokumen produksi (Catatan Pengolahan Bets dan Catatan
Pengemasan Bets) sebelum obat diluluskan.
9. Melaksanakan uji stabilitas dipercepat untuk menetapkan kondisi
10.Membantu pelaksanaan validasi proses produksi.
11.Memantau stabilitas produk-produk yang telah dikeluarkan atau
didistribusikan sampai beberapa waktu setelah batas kadaluarsa terutama
untuk sediaan antibiotika.
12.Hasil pengujian laboratorium yang dilaksanakan diringkas, dicatat dan
didokumentasikan dalam lembaran yang disebut Laporan Hasil Pengujian.
3.7.3 Kegiatan Instalasi Penelitian dan Pengembangan (Installitbang)
Dalam menjalankan perannya Installitbang melakukan penelitian terhadap
produk baru dan pengembangan produk lama untuk memperoleh kualitas yang
lebih baik. Pelaksanaan kegiatan dimulai dengan pengajuan rencana penelitian
dan pengembangan produk Lafi Ditkesad yang meliputi :
1. Membuat spesifikasi teknis bahan baku obat, bahan pembantu dan bahan
pengemas (embalage).
2. Mencari dan meneliti formula yang dapat dikembangkan sebagai produk Lafi
Ditkesad.
3. Merevisi ulang suatu formula yang sudah ditetapkan bila suatu saat terjadi
perubahan alat, bahan baku dan komponen produksi lainnya.
4. Mengadakan evaluasi terhadap keluhan yang terjadi dan obat kembalian.
Penelitian dan pengembangan dimulai dari penelusuran pustaka, pengadaan
bahan, penelitian skala laboratorium dan skala produksi, selanjutnya dilakukan
validasi proses produksi dan pengawasan mutu dengan kerjasama antara
3.7.4 Kegiatan Instalasi Produksi (Instalprod)
Kegiatan produksi obat-obatan dilaksanakan oleh Instalprod yang meliputi
perencanaan, pengaturan, pelaksanaan dan pengendalian. Produk yang dihasilkan
oleh Lafi Ditkesad berupa produk Betalaktam dan produk non Betalaktam, dimana
masing-masing produk dikerjakan pada gedung yang berbeda. Pada Instalprod
terdapat empat seksi yaitu: seksi non Betalaktam, seksi sediaan Betalaktam, seksi
sediaan sefalosporin dan seksi kemas. Masing-masing seksi dikepalai oleh
seorang Apoteker.
Obat-obat yang diproduksi oleh Lafi Ditkesad tidak diperdagangkan bagi
masyarakat umum, dan belum memiliki nomor registrasi, namun demikian proses
produksinya tetap dilaksanakan sesuai dengan Pedoman CPOB yang dikeluarkan
oleh Badan POM.
Rencana produksi dibuat berdasarkan pada banyaknya jenis obat yang
diminta, jenis peralatan yang dimiliki (kapasitas dan spesifikasi mesin), jumlah
sumber daya manusia dan jam kerja serta waktu produksi yang tersedia.
Seluruh proses produksi yang dilaksanakan, dicatat dan didokumentasikan
dalam Catatan Pengolahan Bets dan Catatan Pengemasan Bets (Batch Record)
yang disusun oleh tim CPOB dan disetujui oleh Kainstal prod dan Kainstal wastu,
kemudian didistribusikan dan didokumentasikan. Hal yang diuraikan dalam
catatan pengolahan bets dan catatan pengemasan bets adalah kode produk, nama
produk, nomor bets, besar bets, bentuk sediaan, kemasan, tanggal pengolahan dan
Selain itu dalam catatan pengolahan bets diuraikan mengenai komposisi,
spesifikasi, peralatan, penimbangan bahan dan prosedur pengolahan. Pada catatan
pengemasan bets di cantumkan tentang penerimaan bahan pengemas, prosedur
pengemasan primer, prosedur pengemasan sekunder dan pelulusan oleh
pengawasan mutu.
Proses produksi dimulai dari penimbangan bahan baku yang akan
digunakan dan dikeluarkan dari Instalsimpan berdasarkan catatan pengolahan bets
dan catatan pengemasan bets untuk setiap produk. Barang yang telah dikeluarkan
dari Ins. Simpan selanjutnya memasuki tahap pengolahan pada masing-masing
seksi produksi, yaitu seksi sediaan non Betalaktam atau seksi sediaan Betalaktam.
Berikut ini adalah uraian mengenai proses produksi pada masing-masing
seksi yang ada di Instalasi Produksi :
1. Seksi Sediaan Non Betalaktam (Sidia Non Betalaktam)
Seksi sediaan Non Betalaktam adalah seorang Apoteker yang bertanggung
jawab kepada Kepala Instalasi produksi. Pada seksi ini memproduksi
obat-obatan yang terdiri dari: sediaan tablet, sediaan kapsul dan sediaan sirup
kering, salep dan sirup basah
a. Sediaan Tablet
Pembuatan tablet meliputi kegiatan pencampuran, granulasi, pengeringan,
pencetakan, penyalutan dan stripping. Hasil dari seksi sediaan non
Betalaktam kemudian dikirim ke seksi pengemasan untuk dikemas.
Tablet merupakan sediaan padat kompak yang dibuat secara kempa cetak
cembung, mengandung satu jenis bahan obat atau lebih dengan atau tanpa
zat tambahan.
Peralatan yang digunakan oleh seksi sediaan padat untuk pembuatan tablet
diantaranya adalah mesin pembuat mucilago dengan energi panas dari uap,
mesin pencampur basah sekaligus campur kering, oven pengering,
granulator, mesin cetak tablet, mesin salut film serta mesin strip tablet.
Metoda pembuatan tablet yang biasa digunakan adalah metoda cetak
langsung dan metoda granulasi basah. Tablet yang diproduksi adalah tablet
biasa dan tablet salut
Alur proses produksi tablet di Lafi Ditkesad dengan menggunakan metoda
granulasi basah dimulai dengan urutan sebagai berikut:
1) Penimbangan bahan baku
Bahan yang ditimbang diambil dari Instalasi simpan. Bahan yang
dibawa ke ruang timbang hanya boleh terbungkus oleh kemasan
primernya, sedangkan kemasan sekundernya tidak disertakan. Proses
penimbangan dilakukan di ruang kelas III. Ruang timbang dilengkapi
dengan dust collector dan meja timbang yang kuat dan tahan getar.
Bahan baku yang akan digunakan adalah bahan baku yang sudah
dinyatakan lulus.
2) Proses pencampuran bahan berkhasiat dengan fase dalam
Bahan berkhasiat dicampurkan dengan fase dalam, diaduk sampai
homogen. Pada pencampuran ini yang harus diperhatikan adalah
waktu pencampuran dan putaran mesin pencampur agar dihasilkan
3) Proses pembuatan bahan pengikat (mucilago)
Bahan pengikat ini harus dibuat baru dengan menambahkan air pada
bahan pengikat contohnya Amylum, lalu dipanaskan Kemudian
dilakukan pengadukan sampai terbentuk massa bening. Pembuatan
mucilago ini dilakukan di dalam tangki pemanas double jacket.
4) Proses granulasi basah
Pada proses granulasi ditambahkan sejumlah bahan pengikat
(mucilago) ke dalam hasil campuran zat berkhasiat dengan fase dalam
dan diaduk hingga homogen sampai terbentuk massa yang dapat
dikepal. Proses granulasi ini dilakukan didalam Mixer Planetary.
5) Proses pengeringan
Massa yang diperoleh dikeringkan pada suhu 600C, sampai terbentuk
massa setengah kering (tergantung jenis tablet yang dibuat).
6) Proses pengayakan
Massa setengah kering diayak dengan ayakan mesh tertentu
tergantung dari jenis dan ukuran tablet yang akan dibuat. Hasil
pengayakan disebut dengan granul setengah kering.
7) Pada granul dilakukan IPC yang meliputi pemeriksaan kadar air
granul
8) Proses pembuatan massa cetak
Setelah granul lulus pemeriksaan uji mutu dibuat massa cetak yaitu
dengan penambahan bahan pelincir dan bahan pengembang luar.
Diaduk sampai homogen.