LAPORAN PRAKTEK KERJA PROFESI APOTEKER
DI LEMBAGA FARMASI DIREKTORAT KESEHATAN
ANGKATAN DARAT (LAFI DITKESAD)
OLEH :
Ira Syahputri, S. Farm 083202023
PROGRAM PENDIDIKAN PROFESI APOTEKER
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
▸ Baca selengkapnya: aspek cpob yang menjamin proses produksi obat yang berkualitas, bermutu dan aman disebut aspek ?
(2)KATA PENGANTAR
Puji dan syukur penulis ucapkan kehadirat Tuhan Yang Maha Esa yang telah memberikan rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan Praktek Kerja Profesi Apoteker dan laporan ini di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat (Lafi Ditkesad) Bandung.
Pelaksanaan Praktek Kerja Profesi Apoteker di Lafi Ditkesad ini berlangsung mulai tanggal 01 Februari sampai 28 Februari 2008. Laporan ini merupakan hasil Praktek Kerja Profesi Apoteker (PKPA) yang kami laksanakan di Lafi Ditkesad sebagai salah satu syarat untuk menyelesaikan Program Profesi Apoteker di Fakultas Farmasi Universitas Sumatera Utara.
Pada kesempatan ini penulis ingin mengucapkan terima kasih kepada: 1. Kolonel Ckm Drs. Sambas Setiawan, Apt., selaku Kepala Lembaga Farmasi
Direktorat Kesehatan Angkatan Darat.
2. Letkol Ckm. (K). Dra. Nur Laila, Apt., M.Si., selaku Kepala Instalasi Pengawasan Mutu Lembaga Farmasi Direktorat Kesehatan Angkatan Darat. 3. Letkol Ckm Drs. Yan Suryana Ilham, Apt., M.M., selaku Kepala Instalasi Penelitian dan Pengembangan Lembaga Farmasi Direktorat Kesehatan Angkatan Darat.
4. Letkol Ckm Drs. Abdul Azis, S.M., selaku Kepala Bagian Administrasi Logistik Lembaga Farmasi Direktorat Kesehatan Angkatan Darat.
5. Mayor Ckm Drs. Junaedi, Apt., selaku Kepala Instalasi Produksi Lembaga Farmasi Direktorat Kesehatan Angkatan Darat.
6. Mayor Ckm Drs. Agoes Iman Noegroho, Apt., selaku Kepala Instalasi Pemeliharaan dan Sistem Penunjang Lembaga Farmasi Direktorat Kesehatan Angkatan Darat dan sebagai pembimbing PKPA.
8. Mayor Ckm Drs. T.P.H. Simorangkir, Apt., M.Si., selaku Koordinator Praktik Kerja Mahasiswa di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat dan sebagai pembimbing PKPA.
9. Mayor Ckm Tantri Murdoyo, S.Si., Apt., selaku Kepala Seksi Perencanaan dan Pemprograman Anggaran Lembaga Farmasi Direktorat Kesehatan Angkatan Darat dan sebagai pembimbing PKPA.
10. Dra. Lisa Olii, Apt., M.Si., selaku Kepala Seksi Sediaan Non Betalaktam Instalasi Produksi Lembaga Farmasi Direktorat Kesehatan Angkatan Darat dan sebagai pembimbing PKPA.
11. Dra. Neneng Cahyati, Apt., selaku Kepala Seksi Kemas Instalasi Produksi Lembaga Farmasi Direktorat Kesehatan Angkatan Darat.
12. Dra. Weni Widaningsih, Apt., selaku Kepala Seksi Kimia Fisika Instalasi Pengawasan Mutu Lembaga Farmasi Direktorat Kesehatan Angkatan Darat. 13. Bapak/Ibu serta seluruh staf Lembaga Farmasi Direktorat Kesehatan
Angkatan Darat yang telah memberikan bantuan, pengalaman, bimbingan, dan kerjasama selama pelaksanaan PKPA.
14. Rekan-rekan mahasiswa Profesi Apoteker UNPAD dan UMS atas kerjasamanya selama mengikuti PKPA di Lafi Ditkesad.
Penulis menyadari bahwa dalam penulisan laporan ini masih banyak terdapat kekurangan dan kesalahan. Kami berharap semoga pengetahuan dan pengalaman yang kami peroleh selama mepnjalani praktek kerja profesi apoteker ini dapat memberikan manfaat bagi rekan-rekan sejawat dan semua pihak yang memerlukan.
Bandung, Agustus 2009
DAFTAR ISI
1.3 Metodologi Praktek Kerja Profesi Apoteker ... 4
1.4 Waktu & Tempat Pelaksanaan Praktek Kerja Profesi Apoteker ... 4
BAB II TINJAUAN PUSTAKA... 5
2.1 Industri Farmasi ... 5
2.1.1 Pengertian Industri Farmasi ... 5
2.1.2 Persyaratan Industri Farmasi ... 5
2.2.9 Penanganan Keluhan Terhadap Produk, Penarikan
Kembali Produk dan Produk Kembalian... 19
2.2.10 Dokumentasi ... 20
2.2.11 Pembuatan dan Analisis Berdasarkan Kontrak ... 20
2.2.12 Kualifikasi dan Validasi... 21
2.2.12.1 Kualifikasi .... ... 21
2.2.12.2 Validasi .... ... 22
BAB III TINJAUAN KHUSUS LEMBAGA FARMASI DIREKTORAT KESEHATAN ANGKATAN DARAT... 25
3.1 Sejarah Perkembangan Lafi Ditkesad ... 25
3.2 Visi, Misi dan Tujuan Lafi Ditkesad ... 26
3.2.1 Visi ... 26
3.2.2 Misi ... 26
3.2.3 Tujuan ... 27
3.3 Kedudukan, Tugas Pokok dan Fungsi Lafi Ditkesad... 27
3.4 Struktur Organisasi Lafi Ditkesad... 27
3.4.1 Eselon Pimpinan ... 28
3.4.2 Eselon Pembantu Pimpinan ... 28
3.4.3 Eselon Pelayanan (Seksi Tata Usaha Urusan Dalam)... 29
3.4.4 Eselon Pelaksana... 29
3.5 Kualifikasi Tenaga Kerja Lafi Ditkesad ... 30
3.6 Sertifikasi CPOB Lafi Ditkesad ... 31
3.7 Kegiatan Lafi Ditkesad ... 34
3.7.1 Kegiatan Bagminlog ... 34
3.7.2 Kegiatan Instalasi Pengawasan Mutu... 35
3.7.3 Kegiatan Instalasi Penelitian dan Pengembangan (Installitbang) ... 38
3.7.4 Kegiatan Instalasi Produksi... 38
3.7.5 Kegiatan Instalasi Penyimpanan ... 42
3.7.7 Pengolahan Dokumen ... 56
BAB IV PEMBAHASAN... 76
4.1 Manajemen Mutu ... 77
4.2 Personalia ... 77
4.3 Bangunan dan Fasilitas ... 78
4.3.1 Instalasi Produksi... 78
4.3.2 Instalasi Penyimpanan ... 80
4.3.3 Instalasi Pengawasan Mutu ... 80
4.3.4 Instalasi Pemeliharaan dan Sistem Penunjang ... 80
4.4 Peralatan ... 81
4.5 Sanitasi dan Higiene ... 81
4.6 Produksi ... 82
4.7 Pengawasan Mutu... 83
4.8 Inspeksi Diri ... 83
4.9 Penanganan Keluhan Terhadap Obat, Penarikan Kembali Obat dan Obat Kembalian... 83
4.10 Dokumentasi ... 84
BAB V KESIMPULAN DAN SARAN... 85
5.1 Kesimpulan ... 85
5.2 Saran... 86
DAFTAR PUSTAKA... 87
DAFTAR TABEL
Halaman Tabel 1. Data Personil Lafi Ditkesad Bulan September 2008
Berdasarkan Jenjang Pendidikannya... 41 2. Baku Mutu Limbah Cair untuk Industri Farmasi
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Struktur Organisasi Direktorat Kesehatan Angkatan Darat 84
2. Struktur Organisasi Lembaga Farmasi Ditkesad Berdasarkan Eselon dan Jabatan (Peraturan Kasad Nomor Perkasad/219/XII/2007 Tanggal 10-12-2007) ... 85
3. Blanko Hasil Pengujian Laboratorium ... 86
4. Blanko Catatan Pengujian Tablet dan Kapsul ... 87
5. Blanko Laporan Hasil Pengujian Larutan/ Sirup/ Injeksi .. 88
6. Blanko Laporan Hasil Pengujian Salep/ Krim ... 89
7. Alur Proses Produksi Tablet Biasa/Salut Secara Granulasi Basah ... 90
8. Alur Produksi Tablet Biasa/ Salut dengan Metode Cetak Langsung ... 91
9. Alur Produksi Kapsul ... 92
10. Alur Proses Produksi Sirup kering ... 93
11. Alur Produksi Salep ... 94
12. Alur Proses Produksi Sediaan Cairan Obat Luar ... 95
BAB I
PENDAHULUAN
1.1 Latar Belakang
Salah satu sarana pelayanan kesehatan untuk melayani kebutuhan akan obat adalah industri farmasi. Menurut SK Menkes No. 245/Menkes/SK/V/1990 industri farmasi adalah industri obat jadi dan industri bahan baku obat. Industri obat jadi adalah industri yang memproduksi suatu produk yang telah melalui seluruh tahap proses pembuatan. Obat jadi ini dapat berupa sediaan atau paduan bahan yang siap digunakan untuk mempengaruhi sistem fisiologi atau keadaan patologi dalam rangka penetapan diagnosa, pencegahan, penyembuhan, pemulihan, peningkatan kesehatan dan kontrasepsi. Industri farmasi merupakan salah satu tempat dimana apoteker melakukan pekerjaan kefarmasian terutama menyangkut pengadaan, pengolahan dan pengemasan, pengendalian mutu sediaan farmasi, penyimpanan, pendistribusian dan pengembangan obat.
Sasaran utama industri farmasi adalah memproduksi obat jadi dengan mengutamakan keamanan, keefektifan, kualitas dan harga yang terjangkau oleh masyarakat. Untuk menghasilkan obat jadi yang memenuhi persyaratan yang telah ditetapkan sesuai dengan tujuan penggunaannya, setiap industri farmasi harus menerapkan CPOB (Cara Pembuatan Obat yang Baik).
00.05.3.02152 tahun 2001 tentang CPOB yang mengharuskan pembuatan obat yang baik untuk menjamin mutu obat yang dihasilkan industri farmasi dalam seluruh aspek dan serangkaian kegiatan produksi sehingga obat jadi yang dihasilkan memenuhi syarat mutu yang ditentukan dan sesuai dengan tujuan penggunaannya. Pedoman CPOB hendaklah diperbaiki secara berkesinambungan mengikuti perkembangan ilmu pengetahuan dan teknologi untuk mengantisipasi era globalisasi dan harmonisasi di bidang farmasi terutama pemenuhan terhadap persyaratan dan standar produk farmasi global terkini. Oleh karena itu, pedoman CPOB edisi 2001 direvisi kembali menjadi pedoman CPOB yang dinamis edisi tahun 2006, berdasarkan Surat Keputusan Kepala Badan Pengawas Obat dan Makanan No: HK. 00.06.0511 tanggal 24 Januari 2006. Hal yang perlu diperhatikan untuk menjamin mutu obat yang dihasilkan antara lain pengadaan bahan baku, proses pembuatan dan pengawasan mutu, bangunan, peralatan yang digunakan serta personel yang terlibat dalam proses pembuatan obat tersebut.
Pelaksanaan pedoman CPOB di industri farmasi membutuhkan peranan apoteker, sehingga seorang apoteker dituntut memiliki pengetahuan dan keterampilan yang memadai. Tuntutan tersebut dapat diperoleh salah satunya melalui praktek kerja di industri farmasi yang telah melaksanakan produksi sesuai dengan pedoman CPOB.
bagi calon apoteker untuk mengenal lingkungan kerja dan memperluas pengetahuan tentang industri farmasi melalui program Praktek Kerja Profesi Apoteker.
1.2 Tujuan Praktek Kerja Profesi
Adapun tujuan praktek kerja profesi apoteker yang dilakukan di Lafi Ditkesad, sebagai berikut:
1. Mengetahui dan memahami bagaimana pengelolaan industri farmasi secara profesional serta melihat tentang penerapan aspek CPOB di industri farmasi. 2. Mengetahui dan memahami tentang pendelegasian tugas dan tanggung jawab
serta wewenang apoteker di industri, sehingga dapat dijadikan bekal guna mempersiapkan diri dalam menghadapi dunia kerja sesungguhnya.
3. Mengetahui perencanaan dan pelaksanaan produksi di industri farmasi khususnya di Lafi Ditkesad yang merupakan perusahaan non profit oriented.
1.3 Metodologi Praktek Kerja Profesi Apoteker
Metodologi Praktek Kerja Profesi Apoteker yang dilakukan di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat adalah :
a. Melakukan kunjungan langsung ke instalasi-instalasi di lingkungan Lafi Ditkesad.
b. Interaksi langsung mahasiswa dengan pihak-pihak terkait. c. Diskusi dengan para pembimbing dan antar mahasiswa.
d. Belajar mandiri melalui data perpustakaan Lafi Ditkesad, website farmasi, data-data primer dan sekunder lainnya.
1.4 Waktu dan Tempat Pelaksanaan Praktek Kerja Profesi Apoteker
BAB II
TINJAUAN PUSTAKA
2.1 Industri Farmasi
2.1.1 Pengertian Industri Farmasi
Industri farmasi menurut Surat Keputusan Menteri Kesehatan Republik Indonesia Nomor 245/Menkes/SK/V/1990 terdiri dari industri obat jadi dan industri bahan baku obat. Industri obat jadi adalah industri yang memproduksi suatu produk obat yang telah melalui seluruh tahap proses pembuatan, dimana obat jadi tersebut dapat berupa sediaan atau bahan-bahan yang sering digunakan untuk mempengaruhi atau menyelidiki sistem fisiologis atau keadaan patologi dalam rangka penetapan diagnosis, pencegahan, penyembuhan, pemulihan, peningkatan kesehatan dan kontrasepsi. Industri bahan baku adalah industri yang memproduksi bahan baku dimana bahan baku tersebut adalah seluruh bahan, baik berkhasiat ataupun tidak berkhasiat yang digunakan dalam proses pengolahan obat.
2.1.2 Persyaratan Industri Farmasi
− Industri farmasi merupakan suatu perusahaan umum, badan hukum
berbentuk Perseroan Terbatas atau Koperasi.
− Memiliki rencana investasi.
− Memiliki Nomor Pokok Wajib Pajak (NPWP).
− Industri farmasi obat jadi dan bahan baku wajib memenuhi persyaratan
CPOB sesuai dengan ketentuan SK Menteri Kesehatan No. 43/Menkes/SK/II/1988.
− Industri farmasi obat jadi dan bahan baku, wajib mempekerjakan secara
tetap sekurang-kurangnya dua orang apoteker warga Negara Indonesia, masing-masing sebagai penanggung jawab produksi dan penanggung jawab pengawasan mutu sesuai dengan persyaratan CPOB.
− Obat jadi yang diproduksi oleh industri farmasi hanya dapat diedarkan
setelah memperoleh izin edar sesuai dengan ketentuan perundang-undangan yang berlaku.
2.1.3 Izin usaha industri farmasi
Izin usaha industri farmasi diberikan oleh Menteri Kesehatan dan wewenang pemberian izin dilimpahkan kepada Badan Pengawasan Obat dan Makanan (BPOM). Izin ini berlaku seterusnya selama industri tersebut berproduksi dengan perpanjangan izin setiap 5 tahun, sedangkan untuk industri farmasi Penanaman Modal Asing (PMA) masa berlakunya sesuai dengan ketentuan dalam Undang-Undang No. 1 Tahun 1967 tentang Penanaman Modal Asing dan pelaksanaannya.
CPOB merupakan pedoman yang harus diterapkan dalam seluruh rangkaian proses di industri farmasi dalam pembuatan obat jadi, sesuai dengan keputusan Menteri Kesehatan RI No. 43/Menkes/SK/II/1988 tentang Cara Pembuatan Obat yang Baik. Pedoman CPOB bertujuan untuk menghasilkan produk obat yang senantiasa memenuhi persyaratan mutu yang telah ditetapkan sesuai dengan tujuan penggunaannya.
Obat yang berkualitas adalah obat jadi yang benar-benar dijamin bahwa obat tersebut :
- Mempunyai potensi atau kekuatan untuk dapat digunakan sesuai tujuannya. - Memenuhi persyaratan keseragaman, baik isi maupun bobot.
- Memenuhi syarat kemurnian.
- Memiliki identitas dan penandaan yang jelas dan benar.
- Dikemas dalam kemasan yang sesuai dan terlindung dari kerusakan dan kontaminasi.
- Penampilan baik, bebas dari cacat atau rusak.
Perkembangan yang sangat pesat dalam teknologi farmasi menyebabkan perubahan-perubahan yang sangat cepat pula dalam konsep serta persyaratan CPOB. Konsep CPOB yang bersifat dinamis yang memerlukan penyesuaian dari waktu ke waktu mengikuti perkembangan teknologi di bidang farmasi Aspek-aspek yang merupakan cakupan CPOB tahun 2006 meliputi 12 Aspek-aspek yang dibicarakan, yaitu :
Industri farmasi harus membuat obat sedemikian rupa agar sesuai dengan tujuan penggunaannya, memenuhi persyaratan yang tercantum dalam dokumen izin edar (registrasi) dan tidak menimbulkan resiko yang membahayakan penggunanya karena tidak aman, mutu rendah atau tidak efektif. Manajemen bertanggung jawab untuk mencapai tujuan ini melalui suatu “kebijakan mutu” yang memerlukan partisipasi dan komitmen dari semua jajaran di semua departemen di dalam perusahaan, para pemasok dan para distributor. Untuk mencapai tujuan mutu secara konsisten dan dapat diandalkan, diperlukan manjemen mutu yang didesain secara menyeluruh dan diterapkan secara benar.
Unsur dasar manajemen mutu adalah :
1. Suatu infrastruktur atau sistem mutu yang tepat mencakup struktur organisasi, prosedur, proses dan sumber daya; dan
2. Tindakan sistematis diperlukan untuk mendapatkan kepastian dengan tingkat kepercayaan yang tinggi, sehingga produk (atau jasa pelayanan) yang dihasilkan akan selalu memenuhi persyaratan yang telah ditetapkan. Keseluruhan tindakan tersebut disebut Pemastian Mutu.
Semua bagian sistem pemastian mutu hendaklah didukung dengan tersedianya personil yang kompeten, bangunan dan sarana serta peralatan yang cukup dan memadai. Tambahan tanggung jawab hukum hendaklah diberikan kepada kepala bagian manajemen mutu (Pemastian Mutu).
dengan tujuan untuk memastikan bahwa obat dihasilkan dengan mutu yang sesuai dengan tujuan pemakaiannya.
2.2.2 Personalia
Jumlah personil di semua tingkat harus memadai serta memiliki pengetahuan, keterampilan dan kemampuan yang sesuai dengan tanggung jawabnya. Kesehatan mental dan fisik yang baik harus dimiliki personil agar mampu melaksanakan tugas secara profesional. Selain itu, para personil hendaklah memiliki sikap dan kesadaran tinggi untuk mewujudkan CPOB. Hal-hal yang harus diperhatikan dalam aspek personalia adalah :
1. Organisasi, kualifikasi, dan tanggung jawab
a. Struktur organisasi perusahaan bagian produksi dan pengawasan mutu harus dipimpin oleh apoteker yang berbeda, yang tidak saling bertanggung jawab satu dengan yang lain. Keduanya tidak boleh mempunyai kepentingan di luar organisasi perusahaan, yang dapat menghambat atau membatasi tanggung jawabnya.
b. Manajer produksi hendaklah seorang apoteker yang terlatih serta memiliki pengalaman yang memadai, diberikan wewenang dan tanggung jawab penuh untuk mengelola produksi obat.
d. Manajer produksi dan pengawasan mutu bersama-sama bertanggung jawab dalam penyusunan dan pengesahan prosedur-prosedur tertulis, pemantauan dan pengawasan lingkungan pembuatan obat, kebersihan pabrik dan validasi proses produksi, kalibrasi alat-alat pengukur, pelatihan personalia, pemberian persetujuan terhadap pemasok bahan dan kontraktor, pengamanan produk dan bahan terhadap kerusakan serta kemunduran mutu dan dalam penyimpanan dokumen.
e. Tersedianya tenaga yang terampil dalam jumlah memadai untuk melaksanakan supervisi langsung di bagian produksi dan pengawasan mutu obat. Setiap supervisor tersebut hendaklah terlatih dan memiliki keterampilan teknis, pengalaman dan bertanggung jawab kepada manajer produksi dan pengawasan mutu.
f. Tersedianya tenaga yang terlatih secara teknis dalam jumlah memadai untuk melaksanakan kegiatan produksi dan pengawasan mutu sesuai prosedur dan spesifikasi yang telah ditentukan.
g. Tanggung jawab yang diberikan pada setiap personil hendaklah tidak terlalu berlebihan yang dapat menimbulkan resiko terhadap mutu obat.
h. Tugas dan tanggung jawab hendaklah diberikan dengan jelas serta dapat dipahami dengan baik oleh setiap personil.
2. Pelatihan
b. Pelatihan hendaklah diberikan oleh orang yang ahli. Perhatian khusus diberikan bagi mereka yang bekerja di daerah steril dan daerah bersih atau yang bekerja dengan bahan yang beresiko tinggi atau yang menimbulkan sensitifitas.
c. Pelatihan mengenai CPOB dilakukan secara berkesinambungan dengan frekuensi yang memadai untuk menjamin agar personil terbiasa dengan persyaratan CPOB.
d. Pelatihan CPOB dilaksanakan menurut program tertulis yang disetujui oleh manajer produksi dan pengawasan mutu.
e. Catatan pelatihan mengenai CPOB kepada personil hendaklah disimpan dan efektivitas program pelatihan dan prestasi personil hendaklah dinilai secara berkala untuk menentukan apakah mereka telah memiliki kualifikasi yang memadai untuk melaksanakan tugas yang diberikan.
2.2.3 Bangunan dan Fasilitas
Bangunan untuk pembuatan obat hendaklah memiliki ukuran, rancangan, konstruksi serta letak yang memadai agar memudahkan pelaksanaan kerja, pembersihan dan pemeliharaan, tiap sarana kerja hendaklah memadai, sehingga setiap resiko terjadi kekeliruan, pencemaran silang dan berbagai kesalahan lain yang dapat menurunkan mutu obat dapat dihindarkan. Hal hal yang perlu diperhatikan antara lain:
2. Bangunan dirancang dengan baik sehingga dapat terpelihara dan berfungsi sebagaimana mestinya :
a. Permukaan bagian dalam haruslah licin, bebas dari keretakan dan sambungan terbuka serta mudah dibersihkan dan didesinfeksi. Lantai terbuat dari bahan kedap air, permukaan rata yang memudahkan proses pembersihan secara cepat dan efisien. Dinding kedap air dan mudah dicuci. Sudut sudut dinding hendaklah berbentuk lengkungan.
b. Bangunan hendaklah mendapatkan penerangan yang efektif dan mempunyai ventilasi yang sesuai.
c. Penataan ruangan disesuaikan dengan tujuan penggunaan, seperti ruang untuk steril dipisahkan dari ruang produksi lain serta dirancang secara khusus. Ruangan ruangan khusus diperlukan bagi kegiatan kegiatan pembukaan kemasan, pencucian, pengolahan dan penutupan wadah, ruangan penyangga udara dan pergantian pakaian steril.
d. Pemisahan produksi obat Betalaktam dengan non Betalaktam dilakukan dengan isolasi yang efektif terhadap kegiatan dalam satu gedung melalui sistem pengolahan udara yang terpisah. Adanya perbedaan kelas pemisahan ruang di dalam bangunan produksi, misalnya ruang untuk bahan baku, kamar ganti pakaian dan pengolahan produksi.
f. Kondisi bangunan diperiksa secara teratur dan dilakukan perbaikan bila diperlukan.
g. Lubang pemasukan dan pengeluaran udara serta pipa dipasang sedemikian rupa untuk mencegah timbulnya pencemaran produk.
3. Saluran air limbah hendaklah cukup besar dan mempunyai bak kontrol serta ventilasi yang baik.
4. Tenaga listrik, suhu, kelembaban dan ventilasi harus tepat supaya tidak mengakibatkan dampak yang merugikan baik secara langsung ataupun tidak langsung terhadap produk selama proses pembuatan dan penyimpanan.
2.2.4 Peralatan
Peralatan yang digunakan dalam pembuatan obat hendaklah memiliki rancangan bangunan dan konstruksi yang tepat, ukuran yang memadai serta ditempatkan dengan tepat sehingga mutu setiap produk obat terjamin secara seragam dari bets ke bets serta untuk memudahkan pembersihan dan perawatannya
1. Rancang Bangun dan Konstruksi
a. Peralatan yang digunakan tidak bereaksi atau menimbulkan akibat terhadap bahan yang diolah.
b. Peralatan hendaklah mudah dibersihkan baik bagian dalam maupun bagian luarnya.
menurut program dan prosedur yang tepat, hasil pemeriksaannya dicatat dan disimpan dengan baik.
d. Penyaring untuk cairan tidak boleh melepaskan serat ke dalam produk dan tidak boleh mengandung asbes.
2. Pemasangan dan Penempatan
a. Peralatan hendaklah ditempatkan pada posisi yang tepat untuk memperkecil pencemaran silang antar bahan.
b. Peralatan ditempatkan dengan jarak yang cukup renggang untuk memberikan keleluasaan kerja.
c. Peralatan utama diberi nomor pengenal yang dipakai pada semua perintah dan catatan pembuatan bets untuk menunjukkan unit atau alat tertentu.
d. Semua pipa, tangki, selubung hendaknya diberikan pelekat untuk memperkecil kehilangan energi.
e. Saluran pipa yang menggunakan uap bertekanan hendaknya dilengkapi dengan peralatan uap dan saluran pembuangan yang berfungsi dengan baik.
f. Sistem penunjang hendaknya divalidasi untuk memastikan fungsinya sesuai tujuannya.
3. Pemeliharaan
a. Peralatan hendaknya dirawat sesuai jadwal yang tepat agar berfungsi dengan baik dan mencegah pencemaran.
c. Catatan pelaksanaan pemeliharaan pemakaian peralatan utama hendaklah dicatat dalam buku harian dan catatan untuk peralatan yang digunakan khusus untuk satu produk saja dapat dimasukkan ke catatan produksi bets produk tertentu.
2.2.5 Sanitasi dan Higiene
Tingkat sanitasi dan higiene yang tinggi hendaklah diterapkan pada setiap aspek pembuatan obat. Ruang lingkup sanitasi dan higiene meliputi personalia, bangunan, peralatan dan perlengkapan, bahan produksi serta wadahnya dan setiap hal yang merupakan sumber pencemaran produk. Sumber pencemaran hendaknya dihilangkan melalui suatu program sanitasi dan higiene yang menyeluruh dan terpadu.
2.2.6 Produksi
Produksi hendaklah dilaksanakan dengan mengikuti prosedur yang telah ditetapkan; dan memenuhi ketentuan CPOB yang menjamin senantiasa menghasilkan produk yang memenuhi persyaratan mutu serta memenuhi ketentuan izin pembuatan dan izin edar (registrasi).
Produksi baiknya dilakukan dan diawasi oleh personil yang kompeten. Mutu suatu obat tidak hanya ditentukan oleh hasil analisa terhadap produk akhir, melainkan juga oleh mutu yang dibangun selama tahapan proses produksi sejak pemilihan bahan awal, penimbangan, proses produksi, personalia, bangunan, peralatan, kebersihan dan higiene sampai dengan pengemasan.
Prinsip utama produksi adalah :
− Proses produksi dan pengemasan senantiasa menghasilkan produk
yang seidentik mungkin (dalam batas syarat mutu) baik bagi bets yang sudah diproduksi maupun yang akan diproduksi.
Prosedur produksi dibuat oleh penanggung jawab produksi bersama dengan penanggung jawab pengawasan mutu yang dapat menjamin obat yang dihasilkan memenuhi spesifikasi yang dibutuhkan. Pada proses produksi, mutu produk yang dihasilkan sangat ditentukan oleh bahan awal, proses produksi, personil, dan sistem tervalidasi.
Penyimpanan tergantung dari kestabilan bahan awal. Untuk penyimpanan hendaklah tersedia ruangan dengan suhu yang berbeda-beda. CPOB mempersyaratkan klasifikasi ruangan berdasarkan suhu menjadi 5 jenis, yaitu :
− Suhu ruangan : 15-30oC
− Suhu ruangan yang dikendalikan : ≤ 25oC
− Sejuk : 8-15oC
− Dingin : 2-8oC
− Beku : dibawah 0oC
arus udara ke arah ruang yang beresiko lebih rendah untuk menghindarkan pencemaran balik ke ruang steril.
2.2.7 Pengawasan Mutu
Pengawasan mutu merupakan bagian yang esensial dari cara pembuatan obat yang baik untuk memberikan kepastian bahwa produk secara konsisten mempunyai mutu yang sesuai dengan tujuan pemakaiannya.
Pengawasan mutu hendaklah mencakup semua kegiatan analitis yang dilakukan di laboratorium, termasuk pengambilan sampel, pemeriksaan dan pengujian bahan awal, produk antara, produk ruahan dan produk jadi. Kegiatan ini juga mencakup juga uji stabilitas, program pemantauan lingkungan, pengujian yang dilakukan dalam rangka validasi, penanganan sampel pertinggal, menyusun dan memperbaharui spesifikasi bahan, produk serta metode pengujiaannya.
Bagian pengawasan mutu dalam suatu pabrik obat bertanggung jawab untuk memastikan bahwa :
− Bahan awal untuk produksi obat memenuhi spesifikasi yang ditetapkan
untuk identitas, kekuatan, kemurnian, kualitas, dan keamanannya;
− Tahapan produksi obat telah dilaksanakan sesuai prosedur yang ditetapkan
dan telah divalidasi sebelumnya antara lain melalui evaluasi, dokumentasi, produksi terlebih dahulu;
− Semua pengawasan selama proses dan pemeriksaan laboratorium terhadap
− Suatu bets obat memenuhi persyaratan mutunya selama waktu peredaran
yang ditetapkan.
Laboratorium pengawasan mutu hendaklah terpisah secara fisik dari ruang produksi. Selain itu bagi suatu laboratorium untuk pengawasan selama proses mungkin lebih memudahkan apabila letaknya di daerah tempat pemprosesan atau pengemasan dimana dilakukan pengujian fisik seperti penimbangan, dan uji monitoring lainnya secara periodik.
Dokumentasi dan prosedur pelulusan yang diterapkan bagian pengawasan mutu hendaklah menjamin bahwa pengujian yang diperlukan telah dilakukan sebelum bahan digunakan dalam produksi dan produk disetujui sebelum didistribusikan. Personil pengawasan mutu hendaklah memiliki akses ke area produksi untuk melakukan pengambilan sampel dan investigasi bila diperlukan.
2.2.8 Inspeksi Diri dan Audit Mutu
2.2.8.1 Inspeksi Diri
2.2.8.2 Audit Mutu
Penyelenggaraan audit mutu berguna sebagai pelengkap inspeksi diri. Audit mutu meliputi pemeriksaan dan penilaian semua atau sebagian dari sistem manajemen mutu dengan tujuan spesifik untuk meningkatkan mutu.
Audit mutu umumnya dilaksanakan oleh spesialis dari luar atau independen atau tim yang dibentuk khusus untuk hal ini oleh manajemen perusahaan. Audit mutu juga dapat diperluas terhadap pemasok dan penerima kontrak.
2.2.9 Penanganan Keluhan Terhadap Produk, Penarikan Kembali Produk
dan Produk Kembalian
Penarikan kembali produk adalah suatu proses penarikan kembali dari satu atau beberapa bets atau seluruh bets produk tertentu dari rantai distribusi karena keputusan bahwa produk tidak layak lagi untuk diedarkan.
Produk kembalian adalah obat jadi yang telah keluar dari industri atau beredar, yang kemudian dikembalikan ke industri karena kerusakan, daluwarsa, atau alasan lain misalnya kondisi wadah atau kemasan yang dapat menimbulkan keraguan akan identitas, mutu, keamanan obat serta kesalahan administratif yang menyangkut jumlah dan jenis.
Semua keluhan dan informasi lain yang berkaitan dengan kemungkinan terjadi kerusakan obat, dapat bersumber dari dalam maupun dari luar industri, dan memerlukan penanganan serta pengkajian secara teliti.
pemasaran, sementara dari luar industri antara lain dapat berasal dari pasien, dokter, paramedik, klinik, rumah sakit, apotek, distributor dan Otoritas Pengawasan Obat (OPO).
2.2.10 Dokumentasi
Dokumentasi adalah bagian dari sistem informasi manajemen dan dokumentasi yang baik yang merupakan bagian yang esensial dari pemastian mutu. Sistem dokumentasi yang dirancang atau digunakan hendaklah mengutamakan tujuannya, yaitu menentukan, memantau dan mencatat seluruh aspek produksi serta pengendalian dan pengawasan mutu. Dokumentasi sangat penting untuk memastikan bahwa setiap petugas mendapat instruksi secara rinci dan jelas mengenai bidang tugas yang harus dilaksanakannya sehingga memperkecil resiko terjadinya kekeliruan yang biasanya timbul karena mengandalkan komunikasi lisan.
2.2.11 Pembuatan dan Analisis Berdasarkan Kontrak
2.2.12 Kualifikasi dan Validasi
2.2.12.1 Kualifikasi
Kualifikasi adalah “kegiatan pembuktian” bahwa perlengkapan, fasilitas atau sistem yang digunakan dalam suatu proses/sistem akan selalu bekerja sesuai dengan kriteria yang diinginkan dan konsisten.
Validasi/kualifikasi mesin, peralatan produksi dan sarana penunjang terdiri dari 4 tingkatan, yaitu :
a. Kualifikasi Rancangan (Design Qualification)
Kualifikasi rancangan adalah unsur pertama dalam melakukan validasi terhadap fasilitas, sistem atau peralatan baru. Tujuannya adalah untuk menjamin dan mendokumentasikan bahwa sistem atau peralatan atau bangunan yang akan dipasang atau dibangun sesuai dengan ketentuan atau spesifikasi yang diatur dalam ketentuan CPOB yang berlaku. Kualifikasi ini dilakukan sebelum instalasi (pemasangan) alat/mesin/prasarana produksi.
b. Kualifikasi Instalasi (Installation Qualification)
Tujuannya adalah untuk menjamin dan mendokumentasikan bahwa sistem atau peralatan yang diinstalasi sesuai dengan spesifikasi yang tertera pada dokumen pembelian, manual alat yang bersangkutan dan pemasangannya dilakukan memenuhi spesifikasi yang telah ditetapkan. Kualifikasi instalasi dilakukan pada waktu instalasi (pemasangan baru), modifikasi atau pemindahan alat yang bersangkutan.
Tujuannya adalah untuk menjamin dan mendokumentasikan bahwa sistem atau peralatan yang telah diinstalasi bekerja (beroperasi) sesuai dengan spesifikasi yang diinginkan. Kualifikasi operasional dilakukan setelah kualifikasi instalasi (pemasangan baru), modifikasi atau pemindahan alat yang bersangkutan.
d. Kualifikasi Kinerja (Performance Qualification)
Tujuannya adalah untuk menjamin dan mendokumentasikan bahwa sistem atau peralatan yang telah diinstalasi bekerja sesuai dengan spesifikasi yang diinginkan dengan cara menjalankan sistem sesuai dengan tujuan penggunaan.
2.2.12.2 Validasi
CPOB mensyaratkan industri farmasi untuk mengidentifikasi validasi yang perlu dilakukan sebagai bukti pengendalian terhadap aspek kritis dari kegiatan yang dilakukan. Seluruh kegiatan validasi hendaklah direncanakan. Unsur utama program validasi hendaklah dirinci dengan jelas dan didokumentasikan di dalam Rencana Induk Validasi (RIV) atau dokumen setara.
Dokumen RIV memuat antara lain :
− Kebijakan validasi.
− Struktur organisasi kegiatan validasi (komite validasi).
− Ringkasan fasilitas, sistem, peralatan, dan proses yang akan divalidasi.
− Format dokumen: format protokol dan laporan validasi, perencanaan dan
jadwal pelaksanaan validasi.
− Pengendalian perubahan.
a. Validasi Metode Analisa
Tujuannya adalah untuk membuktikan bahwa semua metode analisa (cara/prosedur pengujian) yang digunakan dalam pengujian maupun pengawasan mutu, senantiasa mencapai hasil yang diinginkan secara konsisten (terus-menerus). Dalam validasi metode analisa yang diuji atau divalidasi adalah Protap atau Prosedur Tetap pengujian yang bersangkutan. Protap tersebut bisa dibuat oleh bagian pengawasan mutu. Apabila protap belum tersedia maka harus dibuat terlebih dahulu, baru divalidasi.
Cakupan (ruang lingkup) :
− Validasi metode analisa dilakukan untuk semua metoda analisa yang
digunakan untuk pengawasan kegiatan produksi.
− Dilakukan dengan semua peralatan yang telah dikalibrasi dan diuji
kesesuaian sistemnya (alat atau sistem sudah dikualifikasi).
− Menggunakan bahan baku pembanding yang sudah dibakukan atau
disimpan ditempat yang sesuai.
b. Validasi Proses Produksi
Tujuannya adalah:
− Untuk memberikan dokumentasi secara tertulis bahwa prosedur
produksi yang berlaku dan digunakan dalam proses produksi rutin (batch processing record), senantiasa mencapai hasil yang diinginkan secara terus-menerus.
− Mengidentifikasi dan mengurangi masalah yang terjadi selama proses
− Meningkatkan efektifitas dan efisiensi proses produksi.
c. Validasi Proses Pengemasan
Tujuannya adalah:
− Memberikan dokumentasi secara tertulis bahwa prosedur pengemasan
yang berlaku dan digunakan dalam proses pengemasan rutin (batch packaging record) sesuai dengan persyaratan rekonsiliasi yang telah ditentukan, secara konsisten.
− Operator yang melakukan proses pengemasan kompeten serta
mengikuti prosedur pengemasan yang telah ditentukan.
− Proses pengemasan yang dilakukan, tidak terjadi peristiwa mix-up
(campur baur) antar produk maupun antar bets.
d. Validasi Pembersihan
Tujuannya adalah:
− Memberikan dokumentasi secara tertulis bahwa prosedur pembersihan
yang berlaku dan digunakan sudah tepat dan dapat dilakukan berulang-ulang (reliable and reproducible).
− Peralatan/mesin yang dibersihkan tidak terdapat pengaruh yang negatif
karena efek pembersihan.
− Operator yang melakukan pembersihan kompeten, mengikuti prosedur
pembersihan dan peralatan pembersihan yang telah ditentukan.
− Cara pembersihan menghasilkan tingkat kebersihan yang telah
BAB III
TINJAUAN KHUSUS LEMBAGA FARMASI
DIREKTORAT KESEHATAN ANGKATAN DARAT
3.1. Sejarah Perkembangan Lafi Ditkesad
Lembaga Farmasi Direktorat Kesehatan Angkatan Darat (Lafi Ditkesad) berasal dari MSL (Militaire Scheikundig Laboratorium). Lembaga ini berfungsi sebagai tempat pemeriksaan obat-obatan bagi kebutuhan tentara Belanda.
Pada tanggal 23 Januari 1950 dibentuk panitia pengalihan, dan selanjutnya pada tanggal 1 Juni 1950 dilakukan serah terima dari MSL kepada TNI AD yang menjadi dasar dalam penetapan hari jadi Lafi Ditkesad melalui SK No. Kep/23/I/1997 tanggal 31 Januari 1997. Setelah proses serah terima pada tanggal 1 Juni 1950 MSL terbagi menjadi dua bagian yaitu:
1. Laboratorium Kimia Tentara (LKT) yang kemudian berkembang menjadi Laboratorium Kimia Angkatan Darat (LKAD).
2. Depot Obat Tentara Pusat (DOTP) yang berkembang menjadi Depot Obat Angkatan Darat (DOAD).
Berdasarkan SK Dirkesad No. Kpts/61/10/IX/1960 tanggal 13 September 1960 terhitung mulai tanggal 8 Juni 1960 LKAD dan DOAD disatukan menjadi Lembaga Farmasi Angkatan Darat (LAFIAD). Pada tanggal 15 Oktober 1970 LAFIAD dipisah kembali menjadi:
2. Depot Obat Angkatan Darat (DOAD) berkembang menjadi Depot Alat Peralatan Kesehatan (Dopalkes) dan berakhir menjadi Depot Pusat Perbekalan Kesehatan (Dopusbekkes) Jankesad
Selanjutnya tahun 1985 antara Lafi Jankesad dan Dopusbekkes Jankesad disatukan kembali menjadi Lafi Ditkesad hingga 31 Maret 2005 dan mulai 1 April 2005 dipisah lagi menjadi Lafi Ditkesad dan Gudang Pusat II Ditkesad.
3.2 Visi, Misi dan Tujuan Lafi Ditkesad
3.2.1 Visi
Visi Lafi Ditkesad adalah menjadi salah satu lembaga produksi yang mampu memenuhi kebutuhan obat yang bermutu bagi prajurit dan PNS TNI Angkatan Darat serta keluarganya
3.2.2. Misi
Lafi Ditkesad mempunyai misi sebagai berikut :
− Memberikan jasa dan informasi yang terbaik terhadap penggunaan obat
(rational use of drug).
− Membantu fungsi pelayanan kesehatan atas ketersediaan obat atau produk
kesehatan lainnya untuk prajurit dan PNS TNI Angkatan Darat serta keluarganya.
− Terlibat secara aktif dalam fungsi dukungan kesehatan pada penggunaan
kekuatan untuk prajurit tugas operasi.
− Memanfaatkan kapabilitas atau kemampuan produksi untuk kepentingan
3.2.3 Tujuan
− Terwujudnya kesehatan yang optimal bagi prajurit, PNS Angkatan Darat
serta keluarganya.
− Terwujudnya satuan kesehatan lapangan yang tangguh dalam dukungan
kesehatan.
− Terwujudnya instalasi kesehatan yang prima dalam pelayanan kesehatan.
− Meningkatnya kemampuan lembaga produksi dalam mendukung bekal
kesehatan.
− Meningkatnya kemampuan penelitian dan pengembangan dalam
mendukung pembinaan kesehatan melalui kaidah-kaidah ilmiah.
− Meningkatnya pelaksanaan fungsi organik di satuan kesehatan.
3.3 Kedudukan, Tugas Pokok dan Fungsi Lafi Ditkesad
Lafi Ditkesad adalah badan pelaksana di tingkat Ditkesad yang berkedudukan langsung di bawah Direktur Kesehatan Angkatan Darat (Dirkesad) struktur organisasi Direktorat Kesehatan Angkatan Darat dapat dilihat pada Lampiran 1. Tugas pokok Lafi Ditkesad adalah membantu Dirkesad dalam menyelenggarakan pembinaan dan melaksanakan produksi, penelitian dan pengembangan obat dalam rangka mendukung tugas pokok Ditkesad.
3.4 Struktur Organisasi Lafi Ditkesad
pengetahuan dan teknologi. Struktur organisasi Lafi Ditkesad dapat dilihat pada lampiran 2.
Susunan organisasi adalah sebagai berikut:
3.4.1 Eselon Pimpinan
1. Kepala Lembaga Farmasi, disingkat Kalafi
Kalafi dijabat oleh seorang TNI Angkatan Darat berpangkat Kolonel CKM, dalam melaksanakan tugas kewajibannya bertanggung jawab kepada Direktur Kesehatan Angkatan Darat.
2. Wakil Kepala Lembaga Farmasi, disingkat Wakalafi
Wakalafi dijabat oleh seorang TNI Angkatan Darat, berpangkat Letnan Kolonel CKM, dalam melaksanakan tugas kewajibannya bertanggung jawab langsung kepada Kalafi.
3.4.2 Eselon Pembantu Pimpinan
1. Perwira Ahli Lembaga Farmasi, disingkat Pa Ahli Lafi
Pa Ahli Lafi dijabat oleh TNl Angkatan Darat berpangkat Letnan Kolonel CKM, dalam melaksanakan tugas dan kewajibannya bertanggung jawab langsung kepada Kalafi.
2. Bagian Administrasi Logistik atau Bagminlog.
3.4.3 Eselon Pelayanan (Seksi Tata Usaha dan Urusan Dalam atau Si
TUUD)
Kepala seksi atau Kasi TUUD dijabat oleh seorang TNI Angkatan Darat berpangkat Mayor CKM dalam melaksanakan tugas dan kewajibannya bertanggung jawab kepada Kalafi.
3.4.4 Eselon Pelaksana
Eselon pelaksana dijabat oleh lima Kepala Instalasi (Ka. Instal), yaitu : 1. Instalasi Penelitian dan Pengembangan, disingkat Installitbang
Kainstallitbang dijabat oleh seorang Pamen TNI Angkatan Darat berpangkat Letnan Kolonel CKM, dalam melaksanakan tugasnya dibantu oleh dua Kepala Seksi (Kasi) yang masing-masing dijabat oleh Pamen TNI Angkatan Darat berpangkat Mayor CKM, terdiri dari:
a. Kepala Seksi Penelitian dan Pengembangan Produksi, disingkat Kasilitbangprod.
b. Kepala Seksi Penelitian dan Pengembangan Sistem Metode dan Personel, disingkat Kasilitbangsistodapers.
Kainstallitbang dalam pelaksanaan tugas kewajibannya bertanggung jawab kepada Kalafi.
2. Instalasi Produksi atau Instalprod.
3. Instalasi Pengawasan Mutu atau Instalwastu
Kainstalwastu dijabat oleh seorang TNI Angkatan Darat berpangkat Letnan Kolonel CKM (berkualifikasi Apoteker) dan dalam pelaksanaan tugas kewajibannya bertanggung jawab kepada Kalafi.
4. Instalasi Pemeliharaan dan sistem penunjang atau Instalhar dan Sisjang. Kainstalhar dan Sisjang dijabat oleh TNI Angkatan Darat berpangkat Mayor CKM dan dalam pelaksanaan tugas kewajibannya bertanggung jawab kepada Kalafi.
5. Instalasi Penyimpanan atau Instalsimpan
Kainstalsimpan di.jabat oieh TNI Angkatan Darat berpangkat Mayor CKM dan dalam pelaksanaan tugas kewajibannya bertanggung jawab kepada Kalafi.
3.5 Kualifikasi Tenaga Kerja Lafi Ditkesad
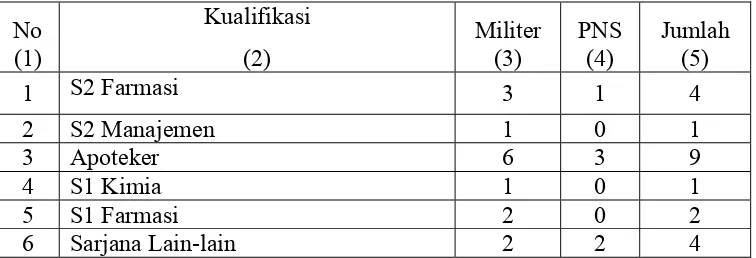
Berdasarkan statusnya, personil Lafi Ditkesad terdiri dari militer dan Pegawai Negeri Sipil (PNS). Adapun data personil Lafi Ditkesad Bulan Agustus 2009 berdasarkan jenjang pendidikannya dapat dilihat pada Tabel 1.
7 SM Kimia 1 0 1 8 D3 Analis Medis / Kesehatan/ Komp 2 1 3
9 Asisten Apoteker 2 6 8
10 Analis 0 2 2
11 Perawat Umum/Bidan 1 0 1
12 STM Alkes 0 1 1
13 SLTA (SMA, SMEA, STM, MAN) 22 71 93
14 SLTP (SMP, SMEP, ST) 1 19 20
15 SD 0 3 3
Jumlah 44 109 153
3.6 Sertifikasi CPOB Lafi Ditkesad
Lembaga Farmasi merupakan salah satu badan pelaksana di tingkat Ditkesad yang bertugas melaksanakan fungsi penelitian, pengembangan dan produksi obat-obatan, yang mengharuskan lembaga ini mengikuti peraturan pemerintah melalui keputusan MenKes RI No. 43/MenKes/SK/II/1988 tentang Cara Pembuatan Obat Yang Baik.
Pembangunan dan pekerjaan yang sudah dilaksanakan Lafi Ditkesad pada saat ini adalah :
1. Bangunan
a. Bangunan Produksi Betalaktam.
b. Sebagian bangunan Produksi Non Betalaktam. c. Bangunan Instalasi Pengawasan Mutu.
d. Fasilitas sumber air PDAM dan air baku farmasi untuk seluruh kebutuhan Instalasi Produksi (Betalaktam dan non Betalaktam), Instalasi Pengawasan Mutu dan perkantoran.
e. Fasilitas gardu listrik mencakup seluruh kebutuhan Instalasi Produksi, Instalasi Pengawasan Mutu dan perkantoran.
f. Fasilitas Instalasi Pengolahan Air Limbah (IPAL) yang mampu mengolah limbah pabrik.
g. Unit ketel uap yang mencakup kebutuhan seluruh pabrik.
h. Kompresor udara bertekanan yang mampu mendukung seluruh kebutuhan pabrik.
i. Air Handling System (AHS) untuk unit produksi Betalaktam, ruang laboratorium mikrobiologi dan Instalasi Pengawasan Mutu dan sebagian unit produksi Non Betalaktam sudah terpasang dan memenuhi syarat CPOB.
2. Peralatan
3. Dokumen Prosedur Tetap (Protap)
Dokumen protap untuk sediaan Betalaktam dan non Betalaktam yang telah dibuat sudah dilaksanakan sesuai aturan CPOB
4. Pelatihan CPOB
Pelatihan CPOB umum dan khusus baik untuk Betalaktam dan Non Beta laktam telah dilaksanakan secara berkala.
5. Sertifikasi CPOB
Sertifikasi CPOB yang telah diterima oleh Lafi Ditkesad sampai bulan Februari 2007 ditujukan untuk sediaan Betalaktam dan non Betalaktam.
a. Sertifikat CPOB untuk Sediaan Betalaktam: 1) Tablet Antibiotika Penisilin dan turunannya 2) Tablet salut Antibiotika Penisilin dan turunannya 3) Kapsul keras Antibiotika Penisilin dan turunannya
4) Suspensi kering oral Antibiotika Penisilin dan turunannya 5) Serbuk steril injeksi Antibiotika Penisilin dan turunannya b. Sertifikat CPOB untuk Sediaan non Betalaktam:
1) Tablet biasa non Antibiotik 2) Tablet salut non Antibiotik 3) Kapsul keras non Antibiotik 4) Serbuk oral non Antibiotik 5) Cairan obat luar non Antibiotik
3.7 Kegiatan Lafi Ditkesad
Kegiatan Lafi Ditkesad dalam melaksanakan tugas dan fungsi produksi obat-obatan meliputi perencanaan dan pengadaan barang, penyimpanan barang, proses produksi, pengawasan mutu, penelitian dan pengembangan, pemeliharaan dan kegiatan administrasi.
3.7.1 Kegiatan Bagminlog
Perencanaan dan pengadaan barang untuk produksi obat Lafi Ditkesad dilakukan berdasarkan data dari Sub Direktorat Pembinaan Pelayanan Kesehatan (Subditbinyankes) yang disusun berdasarkan masukan pola penyakit dari daerah dan laporan dari masing-masing Kesehatan Daerah Militer (Kesdam), Satuan Kesehatan (Satkes) dan Rumah Sakit Pusat Angkatan Darat (RSPAD). Rencana pengadaan obat kemudian dibuat dengan melakukan penyesuaian antara daftar kebutuhan obat dengan anggaran yang tersedia dan selanjutnya dianalisa dan dievaluasi oleh Subditbinyankes yang dilakukan setahun sebelum pelaksanaan.
Bagminlog membuat rencana kebutuhan produksi obat Lafi Ditkesad yang terdiri dari rencana kebutuhan bahan aktif, bahan pembantu dan bahan pengemas (embalage). Perencanaan tersebut disusun berdasarkan formula dan spesifikasi obat yang telah ditentukan oleh Lafi Ditkesad, disamping itu Bagminlog juga menyusun rencana dan anggaran untuk pemeliharaan sarana operasional yang digunakan di tiap instalasi atau bagian di Lafi Ditkesad.
Laporan Hasil Pengujian (LHP) dan Berita Acara (BA) penerimaan. Bila barang yang dikirim tidak sesuai dengan spesifikasi diminta atau tidak memenuhi syarat, maka barang akan dikembalikan untuk diganti, kemudian barang yang lolos administrasi dan uji mutu dikirim ke Gudang Pusat II yang disertai dengan surat Perintah Penerimaan Material (PPnM).
3.7.2 Kegiatan Instalasi Pengawasan Mutu (Instalwastu)
Pengawasan mutu merupakan bagian integral dari suatu produksi obat. Instalwastu bertanggung jawab terhadap setiap hal yang menyangkut kualitas bahan baku obat, bahan pembantu, bahan pengemas, produk antara, produk ruahan, dan obat jadi yang dihasilkan sampai dengan pemantauan kualitas setelah didistribusikan (dengan standar waktu kadaluarsa). Selain itu Instalwastu juga bertanggung jawab terhadap kualitas lingkungan kerja yang meliputi pengawasan bangunan, ruangan dan peralatan serta fasilitas penunjang lainnya seperti pemeriksaan sirkulasi udara, pengendalian mutu air dan pemeriksaan limbah. Pelaksanaan kegiatan di Instalwastu ditunjang oleh fasilitas Instrumen HPLC, spektrofotometer dengan sistem terkomputerisasi, Laminar Air Flow, Read Biotic
(pembaca hambatan bakteri), Climatic Chamber, Dissolution Tester serta berbagai fasilitas penunjang lainnya.
Dalam menjalankan tugasnya, Instalwastu didukung oleh personil yang terdiri dari apoteker dan analis yang terlatih dan berpengalaman dalam menjalankan tugasnya.
Beberapa kegiatan Instalwastu diantaranya:
1. Menyiapkan metode pemeriksaan, pengujian dan validasi metoda analisa yang sesuai dengan acuan standar resmi seperti Farmakope Indonesia. 2. Menyiapkan prosedur pengambilan sampel untuk pemeriksaan dan
pengujian, dimana setiap sampel yang diambil dicatat dan didokumentasikan.
3. Menyiapkan dan menyimpan baku pembanding kerja untuk pengujian. 4. Menyimpan contoh pertinggal setiap bets produk jadi dan bahan baku serta
Catatan Pengujian atau Pemeriksaan.
5. Meluluskan atau menolak bahan yang akan digunakan dalam produksi meliputi bahan baku obat, bahan baku pembantu dan bahan pengemas. Hasilnya dapat dicatat pada Laporan Hasil Pengujian (Lampiran 3).
6. Melaksanakan In Process Control (IPC) selama proses produksi dan memberikan keputusan atas diluluskan atau tidaknya hasil suatu tahap produksi sampai hasil produk akhir.
7. Melaksanakan pengujian terhadap hasil jadi suatu sediaan yang diperoleh. Dicatat pada Catatan Pengujian sediaan jadi (Blanko Hasil Pengujian Laboratorium dapat dilihat pada Lampiran 4,5,6).
8. Meneliti dokumen produksi (Catatan Pengolahan Bets dan Catatan Pengemasan Bets) sebelum obat diluluskan.
10. Membantu pelaksanaan validasi proses produksi.
11. Memantau stabilitas produk-produk yang telah dikeluarkan atau didistribusikan sampai beberapa waktu setelah batas kadaluarsa terutama untuk sediaan antibiotika.
Hasil pengujian laboratorium yang dilaksanakan diringkas, dicatat dan didokumentasikan dalam lembaran yang disebut Laporan Hasil Pengujian.
Bangunan Instalwastu terdiri dari : 1. Laboratorium kimia
Ruang laboratorium kimia memiliki peralatan kimia yang menunjang pemeriksaan mutu secara kimia, lemari asam dan climatic chamber.
2. Laboratorium mikrobiologi
Laboratorium mikrobiologi dilengkapi dengan ruangan steril dan Laminar Air Flow dan alat pembaca daya hambat bakteri (Read Biotic).
3. Laboratorium fisika
Peralatan yang terdapat di ruang fisika antara lain adalah alat uji kekerasan tablet, keregasan tablet, waktu hancur tablet dan alat uji kebocoran strip. 4. Ruang Instrumen
Peralatan yang terdapat di ruang Instrumen adalah spektrofotometer UV– Vis, alat uji disolusi dan HPLC.
5. Ruang Uji Coba 6. Ruang timbang
Ruang ini sebagai tempat penyimpanan contoh Bets dari tiap item yang diproduksi Lafi dengan masa simpan satu tahun setelah masa kadaluarsa. 8. Gudang reagen
9. Perpustakaan 10. Ruang staff
3.7.3 Kegiatan Instalasi Penelitian dan Pengembangan (Installitbang)
Dalam menjalankan perannya, Installitbang melakukan penelitian terhadap produk baru dan pengembangan produk lama untuk memperoleh kualitas yang lebih baik. Pelaksanaan kegiatan dimulai dengan pengajuan rencana penelitian dan pengembangan produk Lafi Ditkesad yang meliputi :
1. Membuat spesifikasi teknis bahan baku obat, bahan pembantu dan bahan pengemas (embalage).
2. Mencari dan meneliti formula yang dapat dikembangkan sebagai produk Lafi Ditkesad.
3. Merevisi ulang suatu formula yang sudah ditetapkan bila suatu saat terjadi perubahan alat, bahan baku dan komponen produksi lainnya.
4. Mengadakan evaluasi terhadap keluhan yang terjadi dan obat kembalian.
3.7.4 Kegiatan Instalasi Produksi (Instalprod)
Betalaktam, seksi sediaan sefalosporin dan seksi kemas. Masing-masing seksi dikepalai oleh seorang Apoteker.
Obat-obat yang diproduksi oleh Lafi Ditkesad tidak diperdagangkan bagi masyarakat umum, dan belum memiliki nomor registrasi, namun demikian proses produksinya tetap dilaksanakan sesuai dengan Pedoman CPOB yang dikeluarkan oleh Badan POM.
Seluruh proses produksi yang dilaksanakan, dicatat dan didokumentasikan dalam Catatan Pengolahan Bets dan Catatan Pengemasan Bets (Batch Record)
yang disusun oleh tim CPOB dan disetujui oleh Kainstalprod dan Kainstalwastu, kemudian didistribusikan dan didokumentasikan. Hal yang diuraikan dalam catatan pengolahan bets dan catatan pengemasan bets adalah kode produk, nama produk, nomor bets, besar bets, bentuk sediaan, kemasan, tanggal dan cara pengolahan serta tanggal dan cara pengemasan.
Selain itu dalam catatan pengolahan bets diuraikan mengenai komposisi, spesifikasi, peralatan, penimbangan bahan, prosedur pengolahan dan rekonsiliasi. Pada catatan pengemasan bets di cantumkan tentang penerimaan bahan pengemas, prosedur pengemasan primer, prosedur pengemasan sekunder pelulusan oleh pengawasan mutu, rekonsiliasi pengemasan dan pengiriman obat jadi ke Instalsimpan.
seksi produksi, yaitu seksi sediaan non Betalaktam, seksi sediaan Betalaktam, seksi sediaan Sefalosporin.
1. Seksi Sediaan Non Betalaktam (Sidia Non Betalaktam)
Seksi sediaan Non Betalaktam dipimpin oleh seorang Apoteker yang bertanggung jawab kepada Kepala Instalasi produksi. Pada seksi ini memproduksi obat-obatan yang terdiri dari: sediaan tablet, sediaan kapsul, salep, sirup basah dan cairan obat luar.
2. Seksi Sediaan Betalaktam
Seksi sediaan betalaktam dikepalai oleh seorang kepala seksi yang bertanggung jawab kepada Kepala Instalasi Produksi. Produksi Betalaktam di Lafi Ditkesad telah mendapatkan sertifikat CPOB pada tanggal 1 Juni 2000. Proses produksi Betalaktam dilakukan pada gedung yang terpisah dengan produksi Non Betalaktam untuk menghindari terjadinya pencemaran silang. Gedung produksi Betalaktam telah dilengkapi dengan sistem pengaturan udara (Air Handling System), air washer, air shower, dan ruang penyangga (air lock). Lantai, dinding dan langit-langit dilapisi oleh bahan epoksi untuk memudahkan pembersihan.
kelas III wanita dan pria. Ruang kelas IV meliputi ruang coding, ruang kemas, ruang karantina obat jadi, ruang gudang sejuk, ruang gudang botol/vial, ruang cuci botol, ruang simpan alat, ruang laundry dan loker kelas IV wanita dan pria.
Sistem pengaturan udara (Air Handling System/AHS) untuk ruang kelas I dan kelas II dilakukan dengan sistem recycle (udara dari kelas II disaring kemudian ditambah udara segar 10-20%), kemudian udara yang masuk disaring dengan HEPA filter. Sementara untuk ruang kelas III dengan sistem pengolahan udara terbuka (udara segar yang masuk disaring dengan pre-filter
dan medium filter). Kondisi ruangan di Betalaktam selalu diukur secara berkala untuk mengukur pertukaran udara, suhu udara, kelembaban dan jumlah partikel. Setiap personel yang masuk ke ruangan Betalaktam diharuskan menggunakan pakaian khusus lengkap dengan aksesorisnya yang berupa masker, sepatu dan sarung tangan. Sebelum memasuki ruangan dan saat keluar dari ruangan diharuskan melewati air shower yang dimaksudkan untuk menghilangkan partikel-partikel pengotor yang melekat. Setelah selesai melaksanakan kegiatan produksi, setiap personil diharuskan untuk membersihkan diri dengan mandi.
Produk yang dihasilkan saat ini oleh Seksi sediaan Betalaktam Lafi Ditkesad yaitu:
d. Sirup kering Amoksisillin 60 ml e. Kaplet Amoksisillin 500 mg f. Kaplet Ampisillin 500 mg
3. Seksi Sediaan Sefalosporin
Seksi sediaan sefalosporin dikepalai oleh seorang Kasi yang bertanggung jawab kepada Kepala Instalasi Produksi. Produksi Sefalosporin belum dimulai karena bangunan produksi untuk sefalosporin belum siap untuk melaksanakan kegiatan produksi.
4. Seksi Kemas
Pengemasan dilakukan pada produk ruahan tablet, kaplet, kapsul, sirup, salep, dan cairan obat luar. Pengemasan tablet dilakukan setelah proses
stripping. Tablet yang sudah distrip, dipilih yang baik kemudian dimasukkan ke dalam sak plastik dilengkapi dengan brosur lalu diseal, setiap sak plastik berisi 25 strip, tiap-tiap strip berisi 10 tablet. Hasil seal kemudian dimasukkan ke dalam dus dilengkapi dengan identitas berupa slip pak dimana setiap dus isinya berbeda sesuai dengan ukuran diameter tablet yaitu:
a. Untuk tablet dengan diameter 6,5-7,5 mm, setiap dus berisi 50 sak plastik.
b. Untuk tablet dengan diameter 10-13 mm, setiap dus berisi 30 sak plastik.
c. Untuk kaplet dan kapsul, setiap dus berisi 20 sak plastik.
label released di kemasan sekunder dan setelah diperiksa oleh tim komisi seksi kemas membuat laporan administrasi yang terdiri dari laporan bulanan dan bukti penyerahan obat jadi yang dikirim ke Instalasi Penyimpanan.
3.7.5. Kegiatan Instalasi Penyimpanan (Instalsimpan)
Instalasi Penyimpanan (Instalsimpan) bertanggung jawab terhadap penyimpanan barang- barang yang berkaitan dengan setiap proses kerja yang berlangsung di Lafi Ditkesad yaitu produksi, pengawasan mutu, administrasi dan logistik serta proses pendukung lainnya. Barang- barang yang disimpan di gudang Instalsimpan disusun berdasarkan jenis dan sifat barang. Adapun penyelenggaraan administrasi yang menyertai pemindahan tanggung jawab dari Instalsimpan ke Gudang Pusat II dan sebaliknya adalah sebagai berikut:
1. Perintah Pengiriman Material (PPM) 2. Perintah Penerimaan Material (PPnM) 3. Berita Acara Penyerahan Barang (BAPB) 4. Bukti Pengeluaran (BP)
5. Blanko Kartu Gudang 6. Surat Keluar Barang (SKB) 7. Kartu Gantung
8. Kartu Kendali
9. Buku Harian Penerimaan Barang
10. Buku Besar Penerimaan dan Pengeluaran Barang Kegiatan yang dilakukan oleh Instalsimpan meliputi :
2. Menyerahkan bahan baku, bahan pengemas, reagensia, dan bahan lain serta peralatan kepada bagian dan Instalasi yang membutuhkan.
3. Menerima obat jadi dari Instalasi Produksi 4. Menyerahkan obat jadi ke Gudang Pusat II.
Instalsimpan mempunyai 2 gudang terpisah untuk material non betalaktam dan betalaktam. Material non betalaktam disimpan di instalsimpan yang memiliki ruang-ruang dengan 2 kelas yang berbeda tingkat kebersihannya yaitu kelas III dan IV terdiri dari ruang timbang, ruang stagging yang digunakan untuk penyimpanan bahan baku obat yang sudah ditimbang, dan ruang sampling. Kelas IV terdiri dari ruang administrasi, gedung bahan baku, gudang bahan pendukung, gudang bahan kemas, gudang cairan, gudang sejuk untuk menyimpan bahan baku obat dan bahan pendukung yang memerlukan kondisi penyimpanan khusus dan gudang obat jadi.
Material untuk produksi betalaktam disimpan tersendiri di gedung produksi betalaktam. Penyimpanannya juga dibagi menjadi 2 kelas yaitu kelas III (ruang timbang dan ruang stagging) dan kelas IV (ruang sejuk, ruang bahan baku zat aktif, ruang bahan pendukung produksi, dan ruang obat jadi).
3.7.6 Kegiatan Instalasi Pemeliharaan dan Sisjang
pemeliharaan dan perbaikan. Seluruh kegiatan pemeliharaan dan perbaikan dilaporkan kepada Kalafi.
Fasilitas pendukung (utility) yang ada di Lafi Ditkesad adalah: pengolahan air baku farmasi, instalasi listrik, instalasi boiler (steam), instalasi udara bertekanan, Instalasi Pengolahan Air Limbah (IPAL) dan sistem pengaturan udara (AHS). Penanggung jawab pengolahan fasilitas utility ini adalah Kepala Instalasi Pemeliharaan dan Sistem Penunjang (Kainstalhar & Sisjang).
Fasilitas utility terdiri dari: 1. Listrik
Sumber listrik Lafi Ditkesad berasal dari PLN dengan daya sebesar 1000 kW. Pada saat ini belum digunakan generator karena beberapa pertimbangan antara lain karena jarang terjadi pemadaman listrik dari PLN dan penggunaan generator terdapat delayed bila listrik dari PLN padam. Tetapi pada produksi steril diperlukan adanya aliran listrik secara terus-menerus sehingga dipertimbangkan untuk menggunakan generator.
2. Pengolahan Air Demineralisata
Pemilihan PDAM sebagai sumber air oleh Lafi Ditkesad adalah karena banyaknya kandungan logam pada air tanah.
Jenis-jenis air di Industri Farmasi, terdiri dari : a. Raw Water
Merupakan air yang berasal dari 3 sumber, antara lain : air tanah, air sungai dan PDAM.
b. Drinking Water
Merupakan air yang telah mengalami proses pengolahan, yang dapat digunakan untuk air minum.
c. Purified Water
Merupakan air yang telah mengalami atau melalui proses penyaringan, penukaran ion, dan penyaringan kembali. Tahap-tahap pengolahan air hingga menjadi purified water dengan cara demineralisasi, antara lain:
1) Saringan Pasir (sand filter)
Menyaring secara fisik menggunakan pasir silika dan berfungsi untuk mengikat partikel-partikel yang terbawa oleh air selama pengolahan air di PDAM.
2) Saringan Karbon (carbon filter)
Resin kation berfungsi untuk menghilangkan ion-ion positif pada air dan kemudian akan digantikan dengan ion hidrogen.
4) Resin Anion
Resin anion berfungsi untuk menghilangkan ion-ion negatif dan ditukar dengan ion hidroksida, sehingga menghasilkan air dengan kandungan Total Dissolved Solid (TDS) kurang dari 8 ppm dan silika kurang dari 0,1 ppm. Setelah mengalami beberapa tahap pemurnian, air demineralisata dialirkan ke ruangan-ruangan produksi dan laboratorium untuk digunakan.
5) Tanki penampung
Setelah mengalami beberapa tahap pemurnian, air demineralisata ditampung dalam tangki penampung untuk dialirkan ke ruangan-ruangan produksi untuk digunakan sesuai dengan keperluan.
d. High Purified Water
Merupakan air yang diperoleh dari hasil penyaringan Purified Water, yang difilter dengan Cartridge Filter 0,2-0,3 µm.
e. Water for Injection
f. Sterile Water for Injection
Merupakan air yang telah mengalami destilasi kemudian disterilkan. Air ini digunakan untuk sediaan akhir yang tidak dapat disterilisasi akhir (untuk zat berkhasiat yang tidak tahan terhadap pemanasan).
1. Boiller (Steam)
Air baku untuk menghasilkan uap panas adalah aqua demineralisata yang diberi tekanan melalui pompa air masuk ke filter kemudian ditampung di dalam tangki stainless steel untuk mensuplai steam. Air dipanaskan melalui boiler hingga menjadi uap. Alat ini bekerja secara semi otomatik dengan alat-alat pengaman yang lengkap. Udara panas yang dihasilkan dialirkan melalui pipa ke ruang-ruang produksi yang membutuhkannya.
2. Udara Bertekanan
Udara bertekanan diperoleh dengan menggunakan alat kompresor yang bekerja secara otomatis dengan alat pressure switch. Kompresor juga dilengkapi dengan air dryer, main line filter, mist separator dan micro mist separator. Instalasi kompresor ini digunakan hanya pada peralatan yang memerlukan udara bertekanan seperti mesin stripping (udara bertekanan digunakan untuk menggerakkan pisau pemotong strip).
3. Instalasi Pengolahan Air Limbah (IPAL)
lingkungan di sekitar industri tersebut. Limbah Lafi Ditkesad berasal dari proses produksi dan proses pengujian yang terbagi atas limbah padat dan limbah cair.
Pada produksi obat non betalaktam, pengolahan limbah padat dilakukan dengan menggunakan dust collector dimana limbah berupa debu disedot dari ruang produksi dengan blower kemudian dikumpulkan dalam kantong penampung dan dibakar. Khusus untuk limbah dari proses penyalutan tablet, terlebih dahulu diolah dengan air washer. Sedangkan limbah cair produksi non betalaktam langsung dialirkan ke Instalasi Pengolahan Air Limbah (IPAL).
Pada produksi betalaktam, pengolahan limbah terlebih dahulu diolah melalui air washer, dimana limbah padat (debu-debu) disedot oleh blower
dari ruangan yang berdebu seperti ruang strip, isi kapsul, cetak, coating, campur dan ruang isi sirup kering, kemudian disemprot dengan air bertekanan 4 bar sehingga debu akan jatuh di bak penampungan. Air dialirkan ke bak destruksi yang dilengkapi dengan dozing pump dan pH meter. Cairan ini didestruksi untuk memecah cincin Betalaktam dengan menggunakan larutan NaOH 0,1 N yang diteteskan secara otomatis sampai diperoleh pH 9. Sedangkan limbah cair produksi obat Non Betalaktam tidak mengalami proses destruksi. Selanjutnya, limbah hasil produksi betalaktam dialirkan ke IPAL untuk dilakukan pengolahan lebih lanjut.
bak pengendap. Cara kimia dilakukan dengan menambahkan koagulan
Poly Aluminium Chloride pada bak koagulasi dan polimer anionik pada bak flokulasi. Cara mikrobiologi dilakukan dengan mengembangbiakkan bakteri aerobik pada bak aerasi agar dapat menghancurkan zat organik. Untuk menjaga pertumbuhan bakteri ditambahkan pupuk urea sebagai nutrisi untuk bakteri.
Tahapan pengolahan air limbah di IPAL Lafi Ditkesad melibatkan proses fisika, kimia dan biologi. Tahapan tersebut adalah sebagai berikut:
a. Bak Penampungan Awal
Air limbah yang masuk dari produksi Betalaktam yang telah mengalami destruksi akan ditampung dan pengotornya diendapkan dalam bak ini. Kemudian dialirkan ke bak pengendapan (sedimentasi pertama).
b. Bak Sedimentasi Pertama
Disini terjadi proses pengendapan kembali. Di dalam bak ini terdapat sekat-sekat yang menghambat laju aliran air sehingga reaksi pengendapan berlangsung lama. Air limbah dari bak ini mengalir ke bak equalisasi.
c. Bak Equalisasi
dilengkapi dengan pompa untuk mengendalikan fluktuasi jumlah air kotor yang tidak merata, yaitu pada jam kerja dan di luar jam kerja. Bak ini juga terdapat pengaduk untuk mengaduk bahan organik agar tidak mengendap.
d. Bak Aerasi dan Stabilisasi
Air limbah masuk ke dalam bak ini dengan menggunakan pompa secara kontinyu. Di dalam bak ini limbah diolah menggunakan bakteri aerob (jenis SGP-50) yang berguna untuk menghancurkan zat-zat organik. Bak ini dilengkapi dengan aerator untuk memasukkan oksigen dari udara yang dihasilkan oleh blower dan ditransfer ke dalam air limbah, sehingga mikroorganisme mampu melanjutkan sintesis dan dekomposisi bahan pencemar menjadi gas yang tidak mencemari. Di dalam bak ini dilakukan juga pengadukan untuk menjamin seluruh material yang ada di dalam limbah cair dalam kondisi tersuspensi.
e. Bak Sedimentasi Kedua (Clarifier)
Air limbah dari bak aerasi mengalir ke dalam bak sedimentasi kedua. Dalam bak ini air mengalami penjernihan. Bak ini memiliki dinding pemisah bergerigi untuk menahan pengotor dan dasar yang berbentuk kerucut untuk mengendapkan sedimen sehingga air yang mengalir ke bak koagulasi hanya cairannya saja.
Cairan dari bak sedimentasi kedua masuk ke dalam bak koagulasi. Di dalam bak ini ditambahkan koagulan PAC (Poly Aluminium Chloride) dengan menggunakan dozing pump yang disertai dengan pengaduk, dimana koagulasi berfungsi untuk mengikat protein berantai panjang. Konsentrasi PAC yang diteteskan dalam larutan yaitu 50 kg PAC dalam 1000 L air. Bak koagulasi berfungsi sebagai bak penampung koagulan.
g. Bak Flokulasi
Dari bak koagulasi cairan dialirkan ke bak flokulasi yang berfungsi untuk mengendapkan endapan yang masih terbawa. Di dalam bak ini air limbah mengalami penambahan flokulan berupa polimer elektrolit sebagai polianionik dengan konsentrasi 1 kg polianionik dalam 1000 L air sehingga terbentuk flok-flok yang kemudian diendapkan di bak sedimentasi kedua. Untuk air yang sudah jernih akan langsung menuju ke bak penampungan akhir melalui bidang miring.
h. Bak Pengendapan akhir (Bak Sedimentasi Ketiga)
2) Bak Penampung Cairan, cairan yang masih mungkin mengandung limbah dialirkan kembali ke bak sedimentasi pertama untuk diolah kembali sampai limbah tersebut benar-benar bersih dari senyawa kimia yang berbahaya.
i. Bak Bidang Miring
Bak bidang miring berbentuk miring ke satu arah yang menghubungkan bak flokulasi dan bak kontrol yang gunanya untuk menahan endapan dan partikel lain yang masih terdapat dalam air limbah dari bak flokulasi. Melalui bak bidang miring, air dari bak flokulasi mengalir ke bak kontrol.
j. Bak Kontrol (Bak Pembuangan Akhir)
Cairan yang sudah jernih dialirkan ke bak kontrol yang berisi ikan sebagai kontrol biologi untuk diperiksa kadar COD dan BOD serta TDS (jumlah total zat padat yang tidak larut), dan pH. Jika hasilnya memenuhi syarat air dapat dibuang ke saluran pembuangan umum. Parameter yang harus dipantau untuk limbah cair adalah :
1. pH 2. Suhu
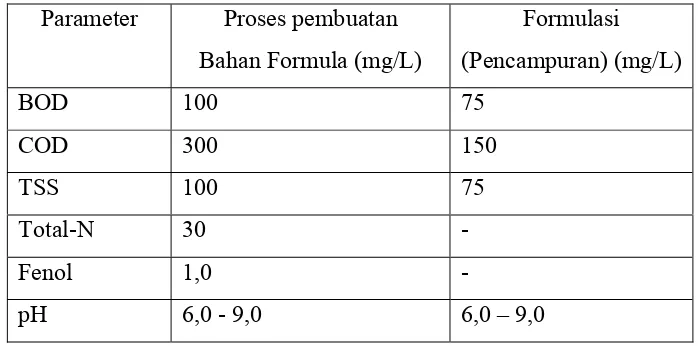
Tabel 2. Baku Mutu Limbah Cair untuk Industri Farmasi (kep- 51/menlh/10/1995)
Parameter Proses pembuatan Bahan Formula (mg/L)
Formulasi (Pencampuran) (mg/L)
BOD 100 75
COD 300 150
TSS 100 75
Total-N 30 -
Fenol 1,0 -
pH 6,0 - 9,0 6,0 – 9,0
4. Air Handling System (AHS)
Air Handling System (AHS) adalah sistem pengaturan udara yang berfungsi mengkondisikan udara dalam ruangan produksi yang dilengkapi dengan sarana pengatur suhu dan kelembaban. Parameter ini dapat mempengaruhi kualitas produk dari industri farmasi, selain itu juga terdapat parameter lainnya antara lain air change (pertukaran udara), tekanan udara, kontaminasi mikroba dan cemaran partikel. Tujuan dari sistem ini adalah untuk menyediakan aliran udara kering dan dingin yang tepat untuk tiap-tiap ruangan produksi.
dari tekanan udara pada ruang koridor. Sebaliknya, untuk ruang produksi sirup cair tekanan udara di ruang produksi akan lebih positif dibandingkan koridor. Hal ini dimaksudkan untuk mencegah kontaminasi debu, karena aliran udara bergerak dari tekanan yang tinggi ke yang lebih rendah. Pada ruang produksi betalaktam, tekanan udara di dalam ruang produksi harus lebih rendah daripada koridor supaya tidak terjadi pencemaran partikel betalaktam ke daerah koridor yang dilewati personil.
Berikut pengendalian udara di beberapa ruang produksi Lafi Ditkesad: a. Pengendalian udara di ruang kelas III
Ukuran partikel : 0,5 μm maksimum 100.000/feet3
Relative humidity : 40 – 60 %
Filter : Primer filter (efisiensi 30 - 60 %)
Secondary filter (efisiensi 80 – 95 %)
Sirkulasi udara : ≥ 20 kali per jam Asal udara : fresh air
b. Pengendalian udara di ruang kelas II
Ukuran partikel : 0,5 μm maksimum 10.000/feet3
Relative humidity : 45 – 50 %
Filter : Secondary filter (efisiensi 80 – 95 %)
HEPA filter (efisiensi 99,999 %) Sirkulasi udara : > 20 kali per jam