Wan Risa Puspita Baros : Laporan Praktek Kerja Profesi Farmasi Industri Di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat Bandung, 2009.
LAPORAN PRAKTEK KERJA PROFESI
FARMASI INDUSTRI
di
Lembaga Farmasi Direktorat Kesehatan
Angkatan Darat
Bandung
Disusun Oleh :
Wan Risa Puspita Baros, S.Farm 083202090
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
Wan Risa Puspita Baros : Laporan Praktek Kerja Profesi Farmasi Industri Di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat Bandung, 2009.
KATA PENGANTAR
Puji dan syukur penulis ucapkan kehadirat Tuhan Yang Maha Esa yang telah
memberikan rahmat dan karuniaNya sehingga penulis dapat menyelesaikan
laporan ini sebagai hasil Praktek Kerja Profesi Apoteker di Lembaga Farmasi
Direktorat Kesehatan Angkatan Darat (Lafi Ditkesad) Bandung, yang
dilaksanakan pada tanggal 2 Februari – 27 Februari 2009.
Praktek Kerja Profesi di Lembaga Farmasi Direktorat Kesehatan Angkatan
Darat telah memperluas wawasan penulis tentang gambaran sebuah industri
farmasi bagaimana cara mengelola dan manajemen dari suatu industri farmasi.
Pelaksanaan Praktek Kerja Profesi Apoteker ini beserta penyusunan
laporannya tidak terlepas dari dukungan dan bantuan berbagai pihak, untuk itu
penulis mengucapkan terima kasih kepada semua pihak yang telah memberikan
bantuan, dukungan, petunjuk, bimbingan, saran serta berbagai fasilitas dan
kemudahan bagi penulis.
Pada kesempatan ini izinkanlah penulis mengucapkan rasa terima kasih kepada :
1. Bapak Letkol CKM Drs. Sambas Setiawan, Apt, selaku Kepala Lembaga
Farmasi Direktorat Kesehatan Angkatan Darat.
2. Bapak Letkol CKM Drs.Yan Suryana Ilham, Apt, M.M selaku kepala
Instalasi Penelitian dan Pengembangan Lembaga Farmasi Direktorat
Kesehatan Angkatan Darat.
3. Ibu Letkol CKM. (K). Dra.Nur Laila, Apt, M.Si. selaku Kepala Instalasi
Wan Risa Puspita Baros : Laporan Praktek Kerja Profesi Farmasi Industri Di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat Bandung, 2009.
4. Bapak Mayor CKM Drs. Abdul Azis, MM selaku Kepala Bagian
Administrasi dan Logistik Lembaga Farmasi Direktorat Kesehatan
Angkatan Darat.
5. Bapak Mayor CKM Drs. Junaedi, Apt. selaku Lakhar Kepala Instalasi
Produksi Lembaga Farmasi Direktorat Kesehatan Angkatan Darat.
6. Ibu Mayor CKM. (K). Dra. Emmy Winarni, Apt. selaku Kepala Instalasi
Penyimpanan Lembaga Farmasi Direktorat Kesehatan Angkatan Darat.
7. Bapak Mayor CKM Drs. Agoes Imam Nugroho, Apt. selaku Kepala
Instalasi Pemeliharaan Lembaga Farmasi Direktorat Kesehatan Angkatan
Darat.
8. Bapak Mayor CKM Drs. T.P. Simorangkir, M.Si., Apt. selaku Koordinator
Mahasiswa Praktek Kerja Profesi di Lembaga Farmasi Direktorat Kesehatan
Angkatan Darat dan sebagai Pembimbing.
9. Ibu Dra. Neneng Cahyati, Apt. selaku Kepala Seksi Kemas Instalasi simpan
dan sebagai Pembimbing..
10. Ibu Dra. Lisa Olii, Apt, M.Si. selaku Wakil Koordinator Mahasiswa Praktek
Kerja Profesi di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat.
11. Ibu Dra. Tuti Sunarti, Apt. selaku Kepala Seksi Sediaan Cair dan Steril
Instalasi Produksi dan sebagai pembimbing.
12. Ibu Dra. Weni Widaningsih, Apt. selaku Kepala Seksi Kimia Fisika Instalasi
Pengawasan Mutu dan sebagai Pembimbing.
13. Seluruh Staf dan Karyawan Lembaga Farmasi Direktorat Kesehatan
Wan Risa Puspita Baros : Laporan Praktek Kerja Profesi Farmasi Industri Di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat Bandung, 2009.
Semoga Tuhan membalas budi baik Bapak dan Ibu dengan balasan yang
berlipat ganda. Penulis berharap semoga tulisan ini dapat memberikan manfaat
bagi kita semua.
Bandung, Februari 2009
Wan Risa Puspita Baros : Laporan Praktek Kerja Profesi Farmasi Industri Di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat Bandung, 2009.
DAFTAR ISI
Halaman
JUDUL ... i
LEMBAR PENGESAHAN ... ii
KATA PENGANTAR... .... iii
DAFTAR ISI ... vi
DAFTAR TABEL ... viii
DAFTAR LAMPIRAN ... ix
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang... 1
1.2 Tujuan Praktek Kerja Profesi Apoteker ... 3
1.3 Metodologi Praktek Kerja Profesi Apoteker ... 3
1.4 Lokasi dan Lama Praktek Kerja Profesi Apoteker ... 3
BAB II TINJAUAN PUSTAKA ... 4
2.1 Industri Farmasi ... 4
2.1.1 Pengertian Industri Farmasi ... 4
2.1.2 Persyaratan Industri Farmasi ... 4
2.2 Cara Pembuatan Obat yang Baik ... 5
2.2.1 Ketentuan Umum ... 7
2.2.2 Personalia ... 8
2.2.3 Bangunan dan Fasilitas ... 10
2.2.4 Peralatan ... 16
2.2.5 Sanitasi dan Higiene ... 16
Wan Risa Puspita Baros : Laporan Praktek Kerja Profesi Farmasi Industri Di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat Bandung, 2009.
2.2.7 Pengawasan Mutu ... 26
2.2.8 Inspeksi Diri ... 31
2.2.9 Penanganan Keluhan Terhadap Obat, Penarikan Kembali Obat dan Obat Kembalian ... 32
2.2.10 Dokumentasi ... 34
2.2.11 Pembuatan dan Analisis Berdasarkan Kontrak ... 35
2.2.12 Kualifikasi dan Validasi ... 35
BAB III TINJAUAN KHUSUS LEMBAGA FARMASI DIREKTORAT KESEHATAN ANGKATAN DARAT ... 36
3.1 Sejarah ... 36
3.2 Visi, Misi ... 37
3.2.1 Visi ... 37
3.2.2 Misi ... 37
3.3 Kedudukan, Tugas Pokok dan Fungsi Lafi Ditkesad ... 37
3.4 Struktur Organisasi Lafi Ditkesad ... 39
3.4.1 Eselon Pimpinan ... 39
3.4.2 Eselon Pembantu Pimpinan ... 40
3.4.3 Eselon Pelayanan (Seksi Tata Usaha Urusan Dalam) ... 40
3.4.4 Eselon Pelaksana ... 41
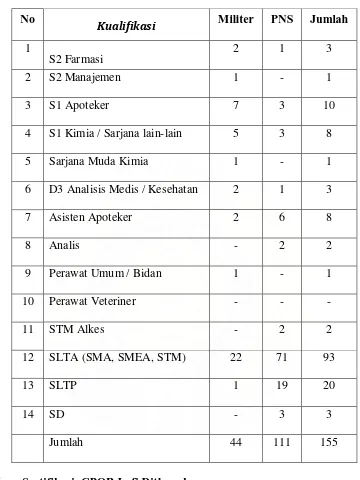
3.5 Kualifikasi Tenaga Kerja Lafi Ditkesad ... 43
3.6 Sertifikasi CPOB Lafi Ditkesad ... 44
3.7 Kegiatan Lafi Ditkesad ... 47
3.7.1 Perencanan dan Pengadaan Barang ... 47
Wan Risa Puspita Baros : Laporan Praktek Kerja Profesi Farmasi Industri Di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat Bandung, 2009.
3.7.3 Kegiatan Instalasi Pengawasan Mutu ... 49
3.7.4 Kegiatan Instalasi Penelitian dan Pengembangan .. . 51
3.7.5 Kegiatan Instalasi Produksi ... 52
3.7.6 Kegiatan Instalasi Simpan ... 65
3.7.7 Kegiatan Instalasi Pemeliharaan ... 66
3.8 Pengolahan Dokumen ... 74
BAB IV PEMBAHASAN ... 76
BAB V KESIMPULAN DAN SARAN ... 86
5.1 Kesimpulan... 86
5.2 Saran ... 86
DAFTAR PUSTAKA ... 87
Wan Risa Puspita Baros : Laporan Praktek Kerja Profesi Farmasi Industri Di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat Bandung, 2009.
DAFTAR TABEL
Tabel Halaman
1. Data Personil Lafi Ditkesad 2009
Berdasarkan Jenjang Pendidikannya ... . 44
Wan Risa Puspita Baros : Laporan Praktek Kerja Profesi Farmasi Industri Di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat Bandung, 2009.
DAFTAR LAMPIRAN
Lampiran Halaman
1. Struktur Organisasi Direktorat Kesehatan Angkatan Darat ... 88
2. Blanko Hasil Pengujian Bahan Baku ... ... 89
3. Blanko Hasil Pengujian Laboratorium ... 90
4. Alur Proses Produksi Tablet ... 91
a. Alur Proses Produksi Tablet Biasa/Salut dengan Metode Granulasi Basah ... ... 91
b. Alur Produksi Tablet Biasa/ Salut dengan Metode Cetak Langsung ... 92
5. Alur Produksi Kapsul ... 93
6. Alur Proses Salep ... 94
7. Alur Proses Produksi Sirup ……… 95
a. Alur Proses Produksi Sirup Basah ... 95
b. Alur Proses Produksi Sirup Kering ... 96
Wan Risa Puspita Baros : Laporan Praktek Kerja Profesi Farmasi Industri Di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat Bandung, 2009.
BAB I
PENDAHULUAN
1.1 Latar Belakang
Kesehatan merupakan salah satu indikator tingkat kesejahteraan manusia
sehingga senantiasa menjadi prioritas dalam pembangunan nasional suatu bangsa.
Hal ini terkait dengan upaya untuk meningkatkan kualitas sumber daya manusia
dari bangsa tersebut. Dengan sumber daya manusia yang berkualitas maka akan
semakin meningkat pula daya saing bangsa tersebut dalam kancah persaingan
global saat ini.
Obat merupakan kebutuhan pokok manusia dalam menangani berbagai
masalah kesehatan yang mereka hadapi. Obat dapat didefenisikan sebagai suatu
zat kimia yang dalam takaran tertentu dan dengan penggunaan yang tepat dapat
dimanfaatkan untuk mencegah penyakit (preventif), menyembuhkan (kuratif),
memulihkan (rehabilitatif), dan meningkatkan kesehatan (promotif).
Dengan semakin meningkatnya pengetahuan masyarakat mengenai
kesehatan, menyebabkan adanya kecendrungan untuk melakukan pengobatan
sendiri (self medication) di kalangan masyarakat. Hal ini menyebabkan
permintaan dikalangan masyarakat menjadi meningkat, sehingga dapat
mendorong perkembangan industri farmasi. Oleh karena itu, industri farmasi
berusaha menyediakan obat yang bermutu baik, aman, berkhasiat dengan harga
yang terjangkau dan tersebar secara merata diseluruh lapisan masyarakat.
Pemerintah Indonesia melalui Departemen Kesehatan dengan Keputusan
Wan Risa Puspita Baros : Laporan Praktek Kerja Profesi Farmasi Industri Di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat Bandung, 2009.
yang Baik) disetiap industri farmasi untuk menjamin mutu obat yang dihasilkan
oleh industri farmasi dalam seluruh aspek dan serangkaian kegiatan produksi,
sehingga obat jadi yang dihasilkan memenuhi syarat mutu yang ditentukan dan
sesuai dengan tujuan penggunaannya. Hal yang perlu diperhatikan untuk
menjamin mutu obat yang dihasilkan antara lain adalah pengadaan bahan baku,
proses pembuatan dan cara pengawasan mutu, bangunan, peralatan yang
digunakan serta personel yang terlibat dalam proses pembuatan obat tersebut.
Pelaksanaan pedoman CPOB di industri farmasi memerlukan peranan
apoteker, sehingga seorang apoteker dituntut memiliki pengetahuan dan
ketrampilan yang memadai. Tuntutan tersebut dapat diperoleh salah satunya
melalui praktek kerja di industri farmasi yang telah melaksanakan produksi sesuai
dengan CPOB. Penerapan CPOB (Cara Pembuatan Obat yang Baik) pada industri
farmasi yang menyangkut seluruh aspek produksi dan pengendalian mutu,
bertujuan untuk menjamin bahwa produk obat senantiasa memenuhi persyaratan
mutu yang telah ditentukan. Selain itu, penerapan CPOB tersebut dimaksudkan
untuk memperluas akses pasar import, karena CPOB termasuk dalam salah satu
persyaratan internasional.
Universitas Sumatera Utara sebagai salah satu perguruan tinggi yang
menghasilkan tenaga Apoteker mengadakan kerja sama dalam bentuk Praktek
Kerja Profesi Apoteker dengan Lembaga Farmasi Direktorat Kesehatan TNI
Angkatan Darat (Lafi Ditkesad), yaitu lembaga produksi yang bernaung dibawah
Direktorat Kesehatan TNI Angkatan Darat (Ditkesad) yang telah memperoleh
Wan Risa Puspita Baros : Laporan Praktek Kerja Profesi Farmasi Industri Di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat Bandung, 2009.
27 februari 2009. Dengan adanya kegiatan ini diharapkan calon Apoteker dapat
menambah wawasan dan pengalaman praktis di Industri farmasi.
1.2 Tujuan Praktek Kerja Profesi Apoteker
1. Mempunyai kemampuan yang lebih dalam menganalisa permasalahan
yang terjadi dilapangan berdasarkan ilmu yang telah didapat di
perkuliahan serta menumbuh kembangkan dan memantapkan
keterampilan sebagai suatu modal kerja
2. Mengetahui aspek-aspek CPOB dalam suatu industri farmasi
3. Meningkatkan, memperluas dan memantapkan pengaplikasian yang
telah diperoleh selama belajar dalam lapangan kerja.
4. Mempersiapkan para calon apoteker untuk menjalankan profesinya
secara professional.
1.4. Metodologi Penelitian
1. Diskusi
Yaitu pengumpulan data dengan melakukan Tanya jawab secara langsung
dengan para pembimbing mengenai materi dalam penyusunan laporan
2. Study Pustaka
Yaitu pengumpulan data dengan cara mempelajari beberapa buku sumber
yang berhubungan dalam penyusunan laporan.
1.5 Lokasi dan lama Praktek Kerja Profesi Apoteker (PKPA)
Lokasi yang diambil penulis untuk pengambilan data PKPA ini dilakukan
di LAFI DITKESAD (Lembaga Farmasi Direktorat Kesehatan Angkatan Darat)
yang beralamat di jalan Gudang Utara No 25- 26 Bandung. PKPA ini dimulai dari
Wan Risa Puspita Baros : Laporan Praktek Kerja Profesi Farmasi Industri Di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat Bandung, 2009.
BAB II
TINJAUAN PUSTAKA
2.1 Industri Farmasi
2.1.1 Pengertian Industri Farmasi
Industri farmasi menurut SK Menkes No. 245/Menkes/SK/V/1990 adalah
industri obat jadi dan industri bahan baku obat. Industri obat jadi adalah industri
yang memproduksi suatu produk yang telah melalui seluruh tahap proses
pembuatan. Obat jadi ini dapat berupa sediaan atau paduan bahan yang siap
digunakan untuk mempengaruhi sistem fisiologi atau keadaan patologi dalam
rangka penetapan diagnosa, pencegahan, penyembuhan, pemulihan, peningkatan
kesehatan dan kontrasepsi. Industri bahan baku adalah industri yang memproduksi
semua bahan baku baik berkhasiat maupun yang tidak berkhasiat dan digunakan
dalam proses pembuatan obat. Industri farmasi mempunyai peranan dalam
melengkapi pengadaan kebutuhan obat nasional. Pengadaan dan produksi obat
bertujuan untuk menjamin tersedianya obat yang dibutuhkan dengan jenis dan
jumlah yang cukup, mutu yang baik dan terjangkau oleh masyarakat.
2.1.2 Persyaratan Industri Farmasi
Perusahaan industri farmasi wajib memperoleh izin usaha industri farmasi,
karena itu industri tersebut wajib memenuhi persyaratan yang telah ditetapkan
oleh Menteri Kesehatan.
Persyaratan industri farmasi tercantum dalam Surat Keputusan Menteri
Wan Risa Puspita Baros : Laporan Praktek Kerja Profesi Farmasi Industri Di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat Bandung, 2009.
1. Industri farmasi merupakan suatu perusahaan umum, badan hukum
berbentuk Perseroan Terbatas atau Koperasi.
2. Memiliki rencana investasi.
3. Memiliki Nomor Pokok Wajib Pajak (NPWP).
4. Industri farmasi obat jadi dan bahan baku wajib memenuhi persyaratan
CPOB sesuai dengan ketentuan SK Menteri Kesehatan
No.43/Menkes/SK/II/1988.
5. Industri farmasi obat jadi dan bahan baku, wajib mempekerjakan
secara tetap sekurang-kurangnya dua orang apoteker warga Negara
Indonesia, masing-masing sebagai penanggung jawab produksi dan
penanggung jawab pengawasan mutu sesuai dengan persyaratan
CPOB.
6. Obat jadi yang diproduksi oleh industri farmasi hanya dapat diedarkan
setelah memperoleh izin edar sesuai dengan ketentuan
perundang-undangan yang berlaku.
Izin usaha industri farmasi diberikan oleh Menteri Kesehatan dan
wewenang pemberian izin dilimpahkan kepada Badan Pengawasan Obat dan
Makanan (BPOM). Izin ini berlaku seterusnya selama industri tersebut
berproduksi dengan perpanjangan izin setiap 5 tahun.
2.2 Cara Pembuatan Obat yang Baik
CPOB merupakan pedoman yang harus diterapkan dalam seluruh
Wan Risa Puspita Baros : Laporan Praktek Kerja Profesi Farmasi Industri Di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat Bandung, 2009.
keputusan Menteri Kesehatan RI No. 43/Menkes/SK/II/1988 tentang Cara
Pembuatan Obat yang Baik.
Pedoman CPOB bertujuan untuk menghasilkan produk obat yang
senantiasa memenuhi persyaratan mutu yang telah ditetapkan sesuai dengan
tujuan penggunaannya.
Pengawasan menyeluruh pada pembuatan obat sangat penting untuk
menjamin bahwa konsumen menerima obat yang bermutu tinggi, tidak cukup bila
obat jadi hanya sekedar lolos dari serangkaian pengujian, tetapi sangat penting
bahwa mutu obat harus dibentuk dalam produk obat tersebut. Semua obat
hendaknya dibuat dalam kondisi yang dikendalikan dan dipantau, oleh karena itu
industri farmasi harus memiliki sistem pengawasan mutu yang efisien, yang
sepenuhnya dapat menjamin mutu obat jadi yang dihasilkan. Untuk menjamin
mutu obat jadi adalah dengan cara penerapan CPOB dalam seluruh aspek dan
rangkaian kegiatan produksi.
Obat yang berkualitas adalah obat jadi yang benar-benar dijamin bahwa
obat tersebut : Mempunyai potensi atau kekuatan untuk dapat digunakan sesuai
tujuannya. Memenuhi persyaratan keseragaman, baik isi maupun bobot
memenuhi syarat kemurnian. Memiliki identitas dan penandaan yang jelas dan
benar. Dikemas dalam kemasan yang sesuai dan terlindung dari kerusakan dan
kontaminasi.Penampilan baik, bebas dari cacat atau rusak.
Pedoman CPOB merupakan statu pedoman bagi industri farmasi mengenai
semua aspek-aspek dalam suatu industri farmasi untuk menjamin mutu obat jadi
Pedoman CPOB tahun 2006, meliputi 12 aspek antara lain: ketentuan umum,
Wan Risa Puspita Baros : Laporan Praktek Kerja Profesi Farmasi Industri Di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat Bandung, 2009.
pengawasan mutu, inspeksi diri, penanganan terhadap keluhan dan penarikan
kembali obat dan obat kembalian, dokumentasi, pembuatan dan analisa
berdasarkan kontrak, kulifikasi dan validasi.
2.2.1 Ketentuan Umum
CPOB menyangkut seluruh aspek produksi dan pengendalian mutu serta
bertujuan untuk menjamin bahwa produk obat dibuat, senantiasa memenuhi
persyaratan mutu yang telah ditentukan sesuai dengan tujuan penggunaannya.
Landasan umum CPOB antara lain:
1. Pada pembuatan obat, pengawasan menyeluruh adalah sangat essensial
untuk menjamin bahwa konsumen menerima obat yang bermutu tinggi.
2. Tidaklah cukup obat jadi hanya sekedar lulus dari serangkaian pengujian,
tetapi yang sangat penting adalah bahwa mutu harus dibentuk ke dalam
produk tersebut. Mutu obat tergantung pada bahan awal, proses pembuatan
dan pengawasan mutu, bangunan, peralatan yang dipakai dan personalia
yang terlibat dalam pembuatan obat.
3. Untuk menjamin mutu suatu obat jadi tidak hanya mengandalkan pada
satu pengujian tertentu saja. Semua obat hendaklah dibuat dalam kondisi
yang dikendalikan dan dipantau dengan cermat.
4. CPOB merupakan pedoman yang bertujuan untuk memastikan agar sifat
dan mutu obat yang dihasilkan sesuai dengan yang dikehendaki, bila perlu
dapat dilakukan penyesuaian dengan syarat bahwa standar mutu obat yang
Wan Risa Puspita Baros : Laporan Praktek Kerja Profesi Farmasi Industri Di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat Bandung, 2009.
2.2.2 Personalia
Jumlah personil pada tiap tingkatan harus memadai dan memiliki
pengetahuan, keterampilan serta kemampuan sesuai dengan tugasnya. Personil
juga harus memiliki kesehatan mental dan fisik yang baik, sehingga mampu
melakukan tugasnya secara profesional, memiliki sifat dan kesadaran yang tinggi
untuk mewujudkan CPOB.
Aspek personalia meliputi:
1. Organisasi, Kualifikasi dan Tanggung jawab
a. Struktur organisasi perusahaan hendaklah sedemikian rupa sehingga
bagian produksi dan bagian pengawasan mutu dipimpin oleh orang
yang berlainan yang tidak saling bertanggung jawab satu terhadap
yang lain.
b. Manajer produksi hendaklah seorang apoteker yang cakap, terlatih
dan memiliki pengalaman praktis yang memadai di bidang industri
farmasi dan keterampilan dalam kepemimpinan sehingga
memungkinkan melaksanakan tugas secara profesional, memiliki
tanggung jawab bersama dalam mutu obat, baik dengan manajer
pengawasan mutu maupun manajer teknik.
c. Manajer pengawasan mutu hendaklah seorang apoteker yang cakap,
terlatih dan memiliki pengalaman praktis yang memadai untuk
memungkinkan melaksanakan tugasnya secara profesional.
d. Manajer produksi dan manajer pengawasan mutu bersama-sama
prosedur-Wan Risa Puspita Baros : Laporan Praktek Kerja Profesi Farmasi Industri Di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat Bandung, 2009.
prosedur tertulis, pemantauan dan pengawasan lingkungan
pembuatan obat, kebersihan pabrik dan validasi proses produksi,
kalibrasi alat-alat pengukur, latihan personalia, pemberian
persetujuan terhadap pemasok bahan dan kontraktor, pengamanan
produk dan bahan terhadap kerusakan dan kemunduran mutu dan
dalam penyimpanan catatan-catatan.
2. Pelatihan
Seluruh karyawan yang langsung ikut serta dalam kegiatan pembuatan
obat dan yang karena tugasnya mengharuskan mereka masuk ke daerah
pembuatan obat, diberikan pelatihan mengenai kegiatan tertentu yang sesuai
dengan tugasnya maupun mengenai prinsip CPOB.
a. Pelatihan diberikan oleh tenaga yang kompeten khususnya bagi
mereka yang bekerja di daerah steril dan daerah bersih atau bagi
mereka yang bekerja menggunakan bahan yang mempunyai resiko
tinggi, toksik atau yang menimbulkan sensitisasi.
b. Pelatihan mengenai CPOB dilakukan secara berkesinambungan dan
dengan frekuensi yang memadai untuk menjamin agar para karyawan
terbiasa dengan persyaratan CPOB yang berkaitan dengan tugasnya.
c. Pelatihan dilaksanakan menurut program tertulis yang telah disetujui
oleh Manajer Produksi dan Pengawasan Mutu.
d. Catatan pelatihan personil mengenai CPOB, hendaknya disimpan dan
Wan Risa Puspita Baros : Laporan Praktek Kerja Profesi Farmasi Industri Di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat Bandung, 2009.
2.2.3 Bangunan dan Fasilitas
Bangunan untuk pembuatan obat hendaklah memiliki ukuran dan rancang
bangun konstruksi serta letak yang memadai agar memudahkan dalam
pelaksanaan kerja, pembersihan dan pemeliharaan yang baik. Tiap sarana kerja
hendaklah memadai sehingga setiap resiko terjadinya kekeliruan, pencemaran
silang dan berbagai kesalahan lain yang dapat menurunkan mutu obat dapat
dihindarkan.
Jumlah partikel di udara untuk pembagian kelas menurut CPOB tahun 2006
Kelas Jumlah maksium partikel/m3 yang dibolehkan untuk kelas setara
atau lebih tinggi dari
Non-operasional Operasional
0,5µm 5 µm 0,5 µm 5 µm
A 3.500 1 3.500 1
B 3.500 1 350.000 2.000
C 350.000 2.000 3.500.000 20.000
D 3.500.000 20.000 Tidak
ditetapkan
Tidak
ditetapkan
Hal-hal yang perlu dipertimbangkan dalam menentukan rancang bangun
dan penataan gedung adalah kesesuaian dengan kegiatan produksi, luasnya ruang
kerja, pencegahan terjadinya penggunaan kawasan produksi sebagai lalu lintas
Wan Risa Puspita Baros : Laporan Praktek Kerja Profesi Farmasi Industri Di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat Bandung, 2009.
1. Lokasi bangunan hendaklah sedemikian rupa untuk mencegah terjadinya
pencemaran dari lingkungan sekelilingnya, seperti pencemaran dari udara,
tanah, dan air maupun dari kegiatan di dekatnya.
2. Gedung hendaklah dibangun dan dipelihara agar terlindung dari pengaruh
cuaca, banjir, rembesan melalui tanah serta masuk dan bersarangnya
binatang.
3. Dalam menentukan rancang bangun dan tata letak ruang hendaklah
dipertimbangkan hal-hal sebagai berikut:
a. Kesesuaian dengan kegiatan lain, yang mungkin dilakukan dalam
sarana yang sama atau dalam sarana yang berdampingan.
b. Tata letak ruang yang sedemikian rupa untuk memungkinkan kegiatan
produksi dilaksanakan di daerah yang letaknya diatur secara logis dan
berhubungan mengikuti urutan tahap produksi dan menurut kelas
kebersihan yang disyaratkan.
c. Luas ruang kerja memungkinkan penempatan peralatan secara teratur
untuk memungkinkan terlaksananya kegiatan, kelancaran arus kerja,
komunikasi dan pengawasan yang efektif maupun untuk mencegah
kesesakan dan ketidakteraturan.
d. Pencegahan terjadinya penggunaan kawasan produksi sebagai lalu
lintas umum bagi karyawan, bahan-bahan atau tempat penyimpanan
kecuali untuk bahan-bahan yang sedang dalam proses.
4. Rancang bangun dan tata letak ruang harus memenuhi
Wan Risa Puspita Baros : Laporan Praktek Kerja Profesi Farmasi Industri Di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat Bandung, 2009.
a. Dicegah resiko tercampurnya obat atau komponen obat yang berbeda,
kemungkinan terjadinya kontaminasi silang oleh obat atau bahan lain,
serta terlewatnya salah satu langkah dalam proses produksi. Untuk
bahan yang sangat beracun atau bahan yang dapat menimbulkan
sensitisasi seperti hormon, bahan sitotoksik dan antibiotika tertentu
hendaklah diberi perhatian khusus dalam pengolahannya. Dalam hal
ini perlu pemisahan bangunan untuk pembuatan obat yang
mengandung bahan tersebut.
b. Obat yang mengandung golongan penisilin hendaklah diproduksi
dalam suatu bangunan terpisah dengan pengendalian udara khusus
untuk produksi tersebut.
c. Obat yang mengandung golongan sefalosporin dapat diproduksi di
ruang terpisah dalam satu bangunan dengan pengendalian udara dan
peralatan termasuk lini pengemasan khusus untuk produk tersebut.
Produksi dapat dilakukan juga dengan cara produksi beberapa bets
secara berurutan di daerah terpisah yang dibersihkan dan
didekontaminasi menurut prosedur yang sudah divalidasi.
d. Kegiatan pengolahan bahan bagi produk bukan obat dipisahkan dari
ruang produksi obat.
e. Disediakan ruangan terpisah untuk membersihkan alat yang dapat
dipindah-pindahkan dan ruang untuk menyimpan bahan pembersih.
f. Kamar ganti pakaian berhubungan langsung dengan daerah pengolahan
Wan Risa Puspita Baros : Laporan Praktek Kerja Profesi Farmasi Industri Di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat Bandung, 2009.
g. Toilet tidak terbuka langsung ke daerah produksi dan dilengkapi
dengan ventilasi yang baik.
h. Hewan ditempatkan dalam gedung terpisah atau setidak-tidaknya
dalam ruang yang terisolasi dengan baik.
5. Kegiatan-kegiatan yang memerlukan daerah khusus antara lain:
penerimaan bahan, karantina barang masuk, penyimpanan bahan awal,
penimbangan dan penyerahan, pengolahan, penyimpanan produk ruahan,
pengemasan, karantina obat jadi selama menunggu pelulusan akhir,
penyimpanan obat jadi, pengiriman barang dan laboratorium serta
pencucian peralatan.
6. Daerah pengolahan produk steril hendaklah dipisahkan dari daerah
produksi lain serta dirancang dan dibangun secara khusus. Ruang-ruang
terpisah diperlukan bagi kegiatan-kegiatan berikut: pembukaan kemasan
komponen, pencucian peralatan serta wadah, pengolahan, pengisian dan
penutupan wadah langsung, ruang penyangga udara yang menghubungkan
antara ruang ganti pakaian dengan ruang pengisian dan ruang ganti
pakaian steril sebelum memasuki ruang steril.
7. Permukaan bagian dalam ruangan (dinding, lantai dan langit-langit)
hendaklah licin, bebas dari keretakan dan sambungan terbuka serta mudah
dibersihkan dan bila perlu mudah didesinfeksi. Lantai di daerah
pengolahan hendaklah dibuat dari bahan kedap air, permukaannya rata dan
memungkinkan pembersihan secara cepat dan efisien. Dinding juga
Sudut-Wan Risa Puspita Baros : Laporan Praktek Kerja Profesi Farmasi Industri Di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat Bandung, 2009.
sudut antara dinding, lantai dan langit-langit dalam daerah-daerah kritis
hendaklah berbentuk lengkungan.
8. Saluran air limbah hendaklah cukup besar dan mempunyai bak kontrol
serta sirkulasi udara yang baik. Saluran yang terbuka hendaklah sedapat
mungkin dicegah tetapi bila diperlukan hendaklah cukup dangkal untuk
memudahkan pembersihan dan desinfeksi.
9. Lubang pemasukan dan pengeluaran udara serta pipa-pipa dan salurannya
hendaklah dipasang sedemikian rupa untuk mencegah timbulnya
pencemaran terhadap produk.
10. Bangunan hendaklah mendapat penerangan yang efektif dan mempunyai
ventilasi dengan fasilitas pengendali udara (termasuk suhu, kelembaban
dan penyaring) yang sesuai untuk kegiatan dalam bangunan maupun
dengan lingkungan sekitarnya.
11. Pipa, fiting lampu, titik ventilasi dan instalasi lain di daerah produksi
hendaklah dipasang sedemikian rupa untuk menghindari terbentuknya
ceruk yang tidak dapat dibersihkan. Instalasi seperti ini sedapat mungkin
dipasang di luar daerah pengolahan.
12. Pemasangan tulang atap, pipa dan saluran udara di dalam ruangan
hendaklah dicegah. Apabila tidak bisa dihindari, maka suatu prosedur tetap
dan penjadwalan khusus mengenai pembersihan terhadap yang dipasang
tersebut hendaklah dibuat dan diikuti.
13. Pipa yang terpasang di dalam ruangan tidak boleh menempel di dinding
tetapi di gantungkan dengan menggunakan siku-siku pada jarak yang
Wan Risa Puspita Baros : Laporan Praktek Kerja Profesi Farmasi Industri Di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat Bandung, 2009.
14. Tenaga listrik hendaklah memadai untuk menjamin kelancaran produksi
dan laboratorium.
15. Seluruh bangunan termasuk daerah produksi, laboratorium, gudang, gang
dan daerah sekeliling gedung hendaklah dirawat, agar senantiasa dalam
keadaan bersih dan rapi. Kondisi bangunan hendaklah diperiksa secara
teratur dan dilakukan perbaikan dimana perlu. Perhatian khusus perlu
diberikan untuk menjamin agar perbaikan atau kegiatan perawatannya
tidak akan mengakibatkan pengaruh negatif terhadap produk.
16. Gudang penyimpanan bahan hendaklah cukup luas, terang serta ditata dan
dilengkapi sedemikian rupa untuk memungkinkan penyimpanan bahan dan
produk dalam keadaan kering, bersih dan teratur.
a.Daerah penyimpanan hendaklah cocok untuk melaksanakan
pemisahan bahan dan produk yang dikarantina secara efektif.
Daerah khusus dan terpisah hendaklah tersedia untuk penyimpanan
bahan mudah terbakar, bahan mudah meledak dan bahan yang
sangat beracun, narkotika dan obat berbahaya lain.
b. Bila diperlukan hendaklah disediakan sarana gudang dengan
kondisi khusus, misalnya suhu, kelembaban dan keamanan
tertentu.
c. Gudang penyimpanan hendaklah ditata sedemikian rupa untuk
memungkinkan pemisahan yang efektif dan teratur terhadap
berbagai kelompok bahan yang di simpan serta untuk memudahkan
Wan Risa Puspita Baros : Laporan Praktek Kerja Profesi Farmasi Industri Di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat Bandung, 2009.
d. Hendaklah disediakan tempat penyimpanan terpisah bagi
barang-barang yang ditolak, ditarik kembali atau dikembalikan.
e. Penyimpanan hendaklah ditata sedemikian rupa sehingga
masing-masing label yang berbeda dan bahan cetak lain disimpan terpisah
untuk mencegah terjadinya pencampuran.
17. Pintu yang membuka langsung ke lingkungan luar dari ruang produksi
seperti pintu bahaya kebakaran hendaklah selalu ditutup rapat untuk
mencegah masuknya cemaran. Peraturan hendaklah dibuat untuk
menjamin bahwa pintu tersebut hanya digunakan dalam situasi darurat.
Pintu-pintu di dalam gedung yang difungsikan sebagai perintang terhadap
kontaminasi silang hendaklah selalu dalam keadaan tertutup apabila
sedang tidak digunakan.
2.2.4 Peralatan
Peralatan yang digunakan dalam pembuatan obat hendaklah memiliki
rancang bangun dan konstruksi yang tepat, ukuran yang memadai serta
ditempatkan dengan tepat, sehingga mutu yang dirancang bagi tiap produk obat
terjamin secara seragam dari bets ke bets, serta untuk memudahkan pembersihan
dan perawatannya.
2.2.5 Sanitasi dan Higiene
Tingkat sanitasi dan higiene yang tinggi hendaklah diterapkan pada setiap
aspek pembuatan obat. Ruang lingkup sanitasi dan higiene meliputi personalia,
bangunan, peralatan dan perlengkapan, bahan produksi serta wadahnya dan setiap
Wan Risa Puspita Baros : Laporan Praktek Kerja Profesi Farmasi Industri Di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat Bandung, 2009.
1. Personalia
a. Semua personil hendaklah menjalani pemeriksaan kesehatan, baik
sebelum diterima menjadi personil maupun selama bekerja.
b. Semua personil hendaklah menerapkan higiene perorangan yang baik.
c. Tiap personil yang mengidap suatu penyakit atau menderita luka
terbuka yang dapat merugikan kualitas produk, hendaklah dilarang
menangani bahan baku, bahan pengemas, bahan yang sedang dalam
proses dan obat jadi, sampai ia sembuh kembali.
d. Untuk keamanan sendiri dan untuk menjamin produk terlindung dari
pencemaran, personil hendaklah mengenakan pakaian pelindung badan
yang bersih termasuk penutup rambut yang bersih sesuai dengan tugas
yang mereka laksanakan.
e. Merokok, makan, minum, mengunyah, meletakkan tanaman atau
menyimpan makanan, minuman, dan obat pribadi hanya diperbolehkan
di daerah tertentu dan dilarang dalam daerah produksi, laboratorium,
daerah gudang dan daerah lainnya yang mungkin merugikan mutu
produk.
2. Bangunan
a. Gedung yang digunakan untuk pembuatan obat harus dirancang dan
dibangun dengan tepat untuk memudahkan pelaksanaan sanitasi yang
baik.
b. Toilet tersedia dalam jumlah yang cukup dengan ventilasi yang baik
dan tempat cuci kaki bagi personil yang letaknya mudah dicapai dari
Wan Risa Puspita Baros : Laporan Praktek Kerja Profesi Farmasi Industri Di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat Bandung, 2009.
c. Hendaklah disediakan fasilitas yang memadai untuk penyimpanan
pakaian personil dan milik pribadinya di tempat yang tepat.
d. Harus ada prosedur tertulis yang menunjukkan penanggungjawab
sanitasi.
3. Peralatan
a. Setelah digunakan, peralatan hendaklah dibersihkan baik bagian luar
maupun bagian dalam sesuai dengan prosedur yang ditetapkan, serta
dijaga dan disimpan dalam kondisi bersih.
b. Harus ada prosedur tertulis yang cukup rinci untuk pembersihan dan
sanitasi peralatan dan wadah yang digunakan dalam pembuatan obat.
4. Kualifikasi dan Validasi Prosedur Sanitasi dan Higiene
Prosedur sanitasi dan higiene hendaklah divalidasi dan dievaluasi
secara berkala untuk memastikan bahwa hasil penerapan prosedur yang
bersangkutan cukup efektif dan selalu memenuhi persyaratan.
2.2.6 Produksi
Produksi harus dilaksanakan mengikuti prosedur yang telah ditetapkan
sehingga menjamin obat yang dihasilkan sesuai dengan spesifikasi yang telah
ditentukan.
1. Bahan awal
a. Setiap bahan awal, sebelum dinyatakan lulus untuk digunakan, harus
memenuhi spesifikasi bahan awal yang sudah ditetapkan dan diberi
Wan Risa Puspita Baros : Laporan Praktek Kerja Profesi Farmasi Industri Di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat Bandung, 2009.
b. Setiap penerimaan bahan awal hendaklah dilakukan pemeriksaan
secara visual tentang kondisi umum, keutuhan kemasan, kebocoran
dan kerusakan, serta contoh untuk pengujian diambil oleh petugas
dengan menggunakan metode yang telah disetujui oleh manajer
pengawasan mutu.
c. Bahan awal yang baru tiba, harus dikarantina, sampai disetujui dan
diluluskan untuk digunakan oleh penanggung jawab pengawasan mutu.
d. Label yang menunjukkan status bahan awal hanya boleh dipasang oleh
petugas yang ditunjuk oleh penanggung jawab bagian pengawasan
mutu.
e. Semua bahan awal yang tidak memenuhi syarat hendaklah ditandai
secara jelas, tersimpan terpisah dan secepatnya dimusnahkan atau
dikembalikan kepada pemasok.
2. Validasi proses
a. Semua prosedur produksi hendaklah divalidasi dengan tepat.
b. Perubahan yang berarti dalam proses, peralatan atau bahan hendaklah
disertai dengan tindakan validasi ulang.
3. Pencemaran
Pencemaran kimiawi atau mikroba terhadap suatu obat yang dapat
merugikan kesehatan, mengurangi daya terapeutik atau mempengaruhi
kualitas suatu produk tidak dapat diterima. Perhatian khusus harus
diberikan pada masalah pencemaran silang, karena sekalipun sifat dan
Wan Risa Puspita Baros : Laporan Praktek Kerja Profesi Farmasi Industri Di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat Bandung, 2009.
menunjukkan pelaksanaan pembuatan obat yang tidak sesuai dengan
CPOB.
4. Sistem penomoran bets dan lot.
a. Sistem yang menjabarkan cara penomoran bets dan lot secara rinci
diperlukan, untuk memastikan bahwa produk antara, produk ruahan
atau obat jadi suatu bets atau lot dapat dikenali dengan nomor bets atau
lot tertentu.
b. Sistem penomoran bets atau lot harus menjamin bahwa nomor bets
atau lot yang sama tidak digunakan secara berulang.
5. Penimbangan dan penyerahan
a. Bahan baku, bahan pengemas, produk antara dan produk ruahan yang
boleh diserahkan hanyalah yang telah diluluskan oleh bagian
pengawasan mutu.
b. Sebelum dilakukan penimbangan hendaklah dilakukan pemeriksaan
terhadap kebenaran penandaan bahan baku termasuk label pelulusan
dari bagian pengawasan mutu.
c. Setiap penimbangan atau pengukuran hendaknya dilakukan
pembuktian kebenaran, ketepatan identitas, dan jumlah bahan yang
ditimbang dan diukur oleh dua petugas secara terpisah.
d. Bahan baku, produk antara, dan produk ruahan hendaknya diperiksa
ulang kebenarannya dan ditandatangani oleh supervisor produksi
Wan Risa Puspita Baros : Laporan Praktek Kerja Profesi Farmasi Industri Di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat Bandung, 2009.
6. Pengembalian
a. Semua bahan baku, bahan pengemas, produk antara dan produk ruahan
yang dikembalikan ke tempat penyimpanan hendaklah
didokumentasikan.
b. Bahan baku, bahan pengemas, produk antara dan produk ruahan tidak
boleh dikembalikan ke gudang kecuali bila memenuhi spesifikasi yang
ditetapkan.
7. Pengolahan
a. Semua bahan yang dipakai dalam pengolahan hendaklah diperiksa
terlebih dahulu sebelum digunakan.
b. Kondisi daerah pengolahan hendaklah dipantau dan dikendalikan
sampai tingkat yang disyaratkan untuk kegiatan yang akan dilakukan.
Sebelum pengolahan dimulai, ditempuh langkah yang menjamin
bahwa daerah pengolahan dan peralatan bebas dari bahan, produk atau
dokumen yang tidak diperlukan untuk pengolahan yang bersangkutan.
c. Semua peralatan yang digunakan dalam pengolahan hendaklah
diperiksa sebelum digunakan. Peralatan hendaklah dinyatakan bersih
secara tertulis sebelum digunakan.
d. Semua kegiatan pengolahan hendaklah dilaksanakan mengikuti
prosedur tertulis yang telah ditentukan. Tiap penyimpanan hendaklah
dilaporkan dengan menyertakan alasan dan penjelasan.
e. Semua produk antara atau produk ruahan harus diberi label yang tepat
Wan Risa Puspita Baros : Laporan Praktek Kerja Profesi Farmasi Industri Di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat Bandung, 2009.
8. Produk steril
a. Cara produksi ada dua kategori yaitu aseptis dan sterilisasi akhir.
b. Semua produk steril dibuat dengan kondisi terkendali dan dipantau
dengan teliti serta diperlukan tindakan khusus untuk meyakinkan
sterilitas produk steril yang dibuat.
c. Untuk membuat produk steril diperlukan ruang terpisah yang
dirancang khusus.
d. Pembuatan produk steril memerlukan tiga kualitas ruangan yang
berbeda, yakni: ruang ganti pakaian, ruang bersih untuk persiapan
komponen dan penyiapan larutan dan ruangan steril untuk kegiatan
steril
e. Kontaminasi jasad renik tidak boleh melebihi nilai batas.
f. Personel yang bekerja dipilih dengan seksama dan harus
memperhatikan standar higiene dan kebersihan perorangan serta
mendapatkan pelatihan sesuai dengan bidangnya.
g. Personel memakai pakaian khusus untuk daerah bersih dan steril serta
ditangani secara terpisah pemakaian dan pencuciannya. Arloji,
perhiasan dan kosmetik tidak boleh dipakai dalam ruangan bersih dan
steril.
h. Bangunan untuk ruangan steril dirancang khusus, diberi aliran udara
bertekanan positif secara efektif melalui saringan. Permukaan ruangan
harus kedap air dan tidak retak. Tidak boleh ada bagian yang dapat
Wan Risa Puspita Baros : Laporan Praktek Kerja Profesi Farmasi Industri Di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat Bandung, 2009.
dan saluran pembuangan dipasang terpisah serta tidak boleh ada bak
pencucian.
i. Peralatan dirancang dan dipasang dengan tepat dan mudah dibersihkan.
j. Pengolahan bahan awal dan produk hendaklah dihindari dari
pencemaran jasad renik, baik sebelum dan sesudah sterilisasi. Wadah,
pembersih, jarak waktu sterilisasi, pembuatan larutan dan sumber air
selalu dipantau dengan baik.
k. Sterilisasi dapat dilakukan dengan cara panas basah, panas kering,
saring, etilen oksida atau radiasi sesuai dengan masing-masing cara
yang efektif.
9. Pengemasan
a. Kegiatan pengemasan berfungsi untuk membagi-bagi dan mengemas
produk ruahan menjadi obat jadi. Proses pengemasan hendaklah
dilaksanakan di bawah pengawasan ketat untuk menjaga identitas,
keutuhan dan kualitas barang yang sudah dikemas.
b. Sebelum kegiatan pengemasan dimulai hendaklah dilakukan
pemeriksaan untuk memastikan bahwa peralatan dan ruang kerja
dalam keadaan bersih dan bebas dari produk, sisa produk lain atau
dokumen yang tidak diperlukan untuk kegiatan yang dilakukan.
c. Setiap penyerahan produk ruahan dan bahan pengemas hendaklah
diperiksa dan diteliti kesesuaiannya dengan prosedur pengemasan
Wan Risa Puspita Baros : Laporan Praktek Kerja Profesi Farmasi Industri Di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat Bandung, 2009.
10. Bahan atau produk pulihan
Bahan atau produk dapat diolah ulang atau dipulihkan asalkan
bahan atau produk tersebut layak untuk diolah ulang melalui prosedur
tertentu yang disahkan, serta hasilnya masih memenuhi persyaratan
spesifikasi yang ditentukan dan tidak terjadi perubahan berarti terhadap
mutunya.
11. Obat kembalian
a. Obat jadi yang dikembalikan dari gudang pabrik misalnya karena label
atau kemasan luar yang kotor dapat diberi label kembali dan harus
hati-hati untuk menghindari campur baur dengan produk lain atau
terjadinya kesalahan pemberian label.
b. Obat jadi yang dikembalikan dari peredaran dan sudah lepas dari
pengawasan pabrik pembuat, setelah dievaluasi secara kritis oleh
petugas pengawasan mutu dan ternyata memenuhi standar, spesifikasi
dan karakteristik yang ditetapkan maka, dapat dipertimbangkan untuk
dijual kembali, diberi label kembali atau diolah ulang ke bets
berikutnya. Bilamana ada keraguan terhadap mutu, produk ini tidak
boleh dipertimbangkan untuk didistribusikan kembali atau diolah
ulang.
12. Karantina obat jadi merupakan titik akhir pengawasan sebelum obat jadi
diserahkan ke gudang dan siap untuk didistribusikan. Sebelum obat jadi
Wan Risa Puspita Baros : Laporan Praktek Kerja Profesi Farmasi Industri Di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat Bandung, 2009.
memastikan bahwa produk dan catatan menyeluruh tentang bets yang
bersangkutan memenuhi persyaratan yang ditetapkan.
13. Pengawasan distribusi obat jadi
a. Sistem distribusi hendaklah dirancang dengan tepat sehingga
menjamin bahwa obat jadi yang pertama masuk didistribusikan
terlebih dahulu.
b. Sistem tersebut mencakup pula cara pencatatan yang tepat sehingga
distribusi tiap bets dapat segera diketahui untuk mempermudah
penyelidikan dan penarikan kembali jika diperlukan.
c. Prosedur tertulis mengenai distribusi obat hendaklah dibuat dan
dipatuhi.
d. Penyimpangan terhadap prinsip pertama masuk pertama keluar hanya
diperbolehkan untuk jangka waktu pendek dan hanya atas persetujuan
pimpinan yang bertanggungjawab.
14. Penyimpanan bahan awal, produk antara, produk ruahan dan obat jadi
Semua bahan hendaklah disimpan secara rapi dan teratur untuk
mencegah resiko tercampur baur atau pencemaran serta memudahkan
pemeriksaan dan pemeliharaan.
15. Pembuatan obat berdasarkan kontrak
a. Pembuatan obat berdasarkan kontrak berarti pembuatan sebagian atau
keseluruhan dari suatu obat oleh satu atau lebih pabrik pembuat
(disebut penerima kontrak) untuk kepentingan pihak lain (disebut
Wan Risa Puspita Baros : Laporan Praktek Kerja Profesi Farmasi Industri Di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat Bandung, 2009.
b. Pemberi kontrak hendaklah memastikan bahwa penerima kontrak telah
memiliki izin operasional dan sertifikat CPOB yang sesuai dengan
bentuk sediaan obat yang akan dikontrakkan.
2.2.7 Pengawasan Mutu
Pengawasan mutu adalah bagian yang esensial dari cara pembuatan obat
yang baik untuk memastikan tiap obat yang dibuat senantiasa memenuhi
persyaratan mutu yang sesuai dengan tujuan penggunaannya.
1. Ketentuan umum
Bagian pengawasan mutu melaksanakan tugas pokok antara lain
sebagai berikut :
a. Menyusun dan merevisi prosedur pengawasan dan spesifikasi
b. Menyiapkan instruksi tertulis yang rinci untuk tiap pemeriksaan,
pengujian dan analisis
c. Menyimpan contoh pertinggal untuk rujukan di masa mendatang
d. Meluluskan atau menolak setiap bets bahan awal, produk antara,
produk ruahan dan obat.
e. Mengevaluasi dan menyetujui prosedur pengolahan ulang suatu
produk.
2. Laboratorium pengujian
a. Bangunan laboratorium hendaklah terpisah dari ruangan produksi dan
terpisah antar masing-masing laboratorium. Ruang instrumen juga
Wan Risa Puspita Baros : Laporan Praktek Kerja Profesi Farmasi Industri Di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat Bandung, 2009.
yang berlebihan atau instrumen tersebut perlu diisolasi dari peralatan
lainnya.
b. Personalia, setiap personil yang bertugas mengawasi atau yang
langsung melakukan pekerjaan laboratorium hendaklah mempunyai
pendidikan, pelatihan dan pengalaman yang sesuai untuk menjalankan
tugasnya serta mendokumentasikan segala tugas dan tanggungjawab
yang diberikan. Dalam bekerja personil hendaklah memakai pakaian
pelindung dan alat pengaman seperti respirator atau masker, kaca mata
pelindung dan sarung tangan yang tahan terhadap asam atau alkali.
c. Peralatan serta instrumen laboratorium pengujian hendaklah cocok
untuk prosedur pengujian yang dilakukan serta prosedur tetap untuk
pengoperasian tiap instrumen dan peralatan hendaklah tersedia dan
diletakkan di dekat instrumen atau peralatan yang bersangkutan.
d. Pereaksi dan media biakan bakteri yang diterima hendaklah dicatat,
serta dibuat sesuai dengan prosedur pembuatan tertulis dan diberi label
yang sesuai. Untuk memastikan kecocokan media pembiakan yang
dipakai digunakan kontrol positif dan kontrol negatif.
e. Baku pembanding dipegang oleh seorang yang telah ditunjuk. Baku
pembanding terdiri atas baku pembanding primer yang digunakan
untuk tujuan tertentu yang sesuai dalam monografi, dan baku
pembanding sekunder atau baku pembanding kerja dapat dibuat dan
dipakai setelah dilakukan pengujian yang sesuai secara periodik.
f. Spesifikasi dan prosedur pengujiaan hendaklah divalidasi dengan
Wan Risa Puspita Baros : Laporan Praktek Kerja Profesi Farmasi Industri Di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat Bandung, 2009.
digunakan dalam pengujian rutin, dan hendaklah mengikuti instruksi
yang tercantum dalam prosedur pengujian untuk masing-masing bahan
atau produk jadi.
g. Catatan analisis mencakup nama dan nomor bets, nama petugas yang
mengambil contoh, metoda analisa yang digunakan, semua data
analisa, perhitungan data analisa, pernyataan toleransi yang
diperbolehkan yaitu pernyataan yang memenuhi syarat atau tidak
memenuhi syarat, tanggal dan tanda tangan petugas yang melakuka n
pengujian dan perhitungan, nama pemasok, jumlah keseluruhan dan
jumlah bahan awal yang diterima, jumlah wadah, bahan baku, bahan
pengemas, produk antara, produk ruahan dan obat jadi dari bets atau
lot yang dianalisa.
h. Contoh pertinggal dengan identitas yang jelas dan mewakili setiap bets
bahan baku berkhasiat yang diterima hendaklah disimpan untuk jangka
waktu tertentu. Jumlah contoh pertinggal sekurang-kurangnya dua kali
dari jumlah contoh yang dibutuhkan untuk pengujian lengkap kecuali
untuk uji sterilitas.
3 Validasi
Bagian pengawasan mutu hendaklah melakukan validasi terhadap prosedur
penetapan kadar dan kalibrasi instrumen.
a. Pengawasan terhadap bahan awal, produk antara, produk ruahan
dan obat jadi
1) Tiap spesifikasi hendaklah disetujui terlebih dahulu dan
Wan Risa Puspita Baros : Laporan Praktek Kerja Profesi Farmasi Industri Di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat Bandung, 2009.
2) Pengambilan contoh merupakan operasi penting karena
hanya sebagian kecil saja dari suatu bets yang diambil
untuk pengujian mutu.
b. Pengolahan ulang
1) Pengolahan ulang tidak boleh dilakukan sebelum
prosedurnya diperiksa dan disetujui oleh bagian
pengawasan mutu.
2) Pengolahan ulang suatu bets produk dapat dipertimbangkan
hanya apabila resiko yang mungkin sekali terjadi akibat
pengolahan ulang telah dilakukan eveluasi secara
meyakinkan dan dinilai dapat diabaikan.
3) Uji stabilitas lanjut hendaklah dilakukan terhadap obat jadi
hasil pengolahan ulang bila diperlukan.
c. Evaluasi bagian pengawasan mutu terhadap prosedur produksi
1) Bagian pengawasan mutu hendaklah ikut serta dalam
pembuatan prosedur pengolahan induk dan prosedur
pengemasan induk untuk setiap ukuran bets suatu produk
untuk menjamin keseragaman dari bets ke bets yang
diproduksi.
2) Bagian pengawasan mutu hendaklah memberikan
persetujuan atas prosedur pembersihan dan sanitasi
Wan Risa Puspita Baros : Laporan Praktek Kerja Profesi Farmasi Industri Di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat Bandung, 2009.
d. Peninjauan catatan bets produksi
1) Semua catatan produksi dan pengawasan tiap bets obat jadi
hendaklah diteliti oleh bagian pengawasan mutu untuk
menentukan apakah pembuatan bets bersangkutan
memenuhi semua prosedur yang telah ditetapkan sebelum
diluluskan untuk produksi.
2) Tiap bets yang menyimpang atau gagal dalam memenuhi
spesifikasinya hendaklah diselidiki secara tuntas.
e. Penelitian stabilitas
1) Hendaklah dirancang program pengujian stabilitas untuk
mengetahui stabilitas obat jadi untuk menentukan kondisi
penyimpanan yang cocok serta tanggal daluarsa.
2) Penelitian stabilitas dilakukan dalam hal produk baru,
memiliki kemasan baru yang berbeda dengan standar yang
telah ditetapkan, perubahan formula, perubahan metoda
pengolahan dan sumber bahan baku.
f. Keluhan terhadap obat
1) Hendaklah dirancang suatu sistem penanganan terhadap
keluhan obat yang mencakup prosedur tetap dan
penunjukan petugas yang bertanggung jawab menerima
keluhan.
2) Hendaklah dibuat catatan keluhan terhadap obat dan juga
Wan Risa Puspita Baros : Laporan Praktek Kerja Profesi Farmasi Industri Di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat Bandung, 2009.
g. Obat kembalian
Bagian pengawasan mutu hendaklah bertanggung jawab atas
pemeriksaan produk yang dikembalikan karena adanya keluhan,
kerusakan, daluarsa atau hal lain yang menimbulkan keraguan atas mutu
produk tersebut.
h. Penilaian terhadap pemasok
Bagian pengawasan mutu hendaklah ikut bertanggung jawab
bersama departemen yang relevan untuk memilih pemasok yang mampu
dan dapat dipercaya dalam penyediaan bahan awal yang memenuhi
spesifikasi yang telah ditetapkan.
2.2.8 Inspeksi Diri
Inspeksi diri bertujuan untuk melakukan penilaian apakah seluruh aspek
produksi dan pengendalian mutu selalu memenuhi CPOB. Program inspeksi diri
dirancang untuk mencari kelemahan dalam pelaksanaan CPOB dan untuk
menetapkan tindakan perbaikannya. Inspeksi diri harus dilakukan secara teratur
dan dibuat prosedur serta pencatatannya. Tindakan perbaikan yang disarankan
sebaiknya dilaksanakan. Untuk pelaksanaan inspeksi diri ditunjuk tim yang
mampu menilai secara objektif pelaksanaan CPOB.
Hal-hal yang diinspeksi meliputi karyawan, bangunan termasuk fasilitas
untuk karyawan, penyimpanan bahan awal dan obat jadi, peralatan, produksi,
Wan Risa Puspita Baros : Laporan Praktek Kerja Profesi Farmasi Industri Di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat Bandung, 2009.
Inspeksi diri dapat dilakukan bagian demi bagian sesuai dengan kebutuhan
pabrik yang bersangkutan. Inspeksi diri yang menyeluruh dilakukan
sekurang-kurangnya sekali dalam setahun.
2.2.9 Penanganan Keluhan Terhadap Obat, Penarikan Kembali Obat, dan
Obat Kembalian
1. Keluhan dan Laporan
Keluhan dan laporan dapat menyangkut kualitas, efek samping
yang merugikan, dan masalah medis lainnya. Keluhan dan laporan
ditangani secara:
a. Hendaklah dibuat catatan tertulis mengenai semua keluhan dan laporan
yang diterima.
b. Keluhan dan laporan hendaklah ditangani oleh bagian yang
bersangkutan sesuai dengan jenis keluhan dan laporan yang diterima.
c. Terhadap tiap keluhan dan laporan dilakukan penelitian dan evaluasi
secara seksama, termasuk meninjau seluruh informasi yang masuk
tentang pemeriksaan atau pengujian terhadap contoh yang diterima.
Bila perlu dilakukan pemeriksaan terhadap contoh pertinggal bets yang
bersangkutan dan meneliti kembali semua data serta dokumentasi yang
berkaitan.
Tindak lanjut terhadap keluhan dan laporan:
1) Tindakan perbaikan yang diperlukan termasuk penarikan kembali
bets obat jadi atau seluruh obat jadi yang bersangkutan dan
Wan Risa Puspita Baros : Laporan Praktek Kerja Profesi Farmasi Industri Di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat Bandung, 2009.
2) Hasil pelaksanaan penanganan keluhan dan laporan termasuk
evaluasi penelitian dan tindak lanjut yang diambil hendaklah
dicatat dan dilaporkan kepada bagian yang bersangkutan dan
kepada pejabat pemerintah yang berwenang.
2. Penarikan Kembali Obat Jadi
Penarikan kembali obat jadi dapat berupa penarikan kembali satu
atau beberapa bets atau seluruh obat jadi tertentu dari semua mata rantai
distribusi. Penarikan kembali dilakukan apabila ditemukan adanya produk
yang tidak memenuhi persyaratan kualitas atau atas dasar pertimbangan
adanya efek samping yang tidak diperhitungkan yang merugikan
kesehatan.
Penarikan kembali dapat dilakukan atas prakarsa produsen sendiri
atau instruksi instansi pemerintah yang berwenang. Keputusan untuk
melakukan penarikan kembali obat jadi adalah tanggung jawab apoteker
penanggung jawab pabrik dan pimpinan perusahaan. Penarikan kembali
obat jadi dapat pula sekaligus merupakan penghentian pembuatan obat jadi
yang bersangkutan.
Pelaksanaan penarikan kembali obat jadi:
a. Tindakan penarikan kembali dilakukan segera setelah diketahui
adanya obat jadi yang tidak memenuhi persyaratan atau
mempunyai efek samping yang tidak diperhitungkan
sebelumnya dan membahayakan kesehatan.
b. Obat jadi yang mempunyai resiko besar terhadap kesehatan
Wan Risa Puspita Baros : Laporan Praktek Kerja Profesi Farmasi Industri Di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat Bandung, 2009.
khusus agar obat yang bersangkutan dikenakan embargo untuk
tidak digunakan. Dalam hal ini penarikan dilakukan sampai ke
tingkat konsumen.
Sistem dokumentasi pabrik dapat mendukung pelaksanaan
penarikan kembali dan embargo secara efektif, cepat, dan tuntas.
3. Obat Kembalian
Obat kembalian adalah obat jadi yang telah beredar dan kemudian
dikembalikan ke produsen karena adanya keluhan kadaluarsa, masalah
keabsahan, atau sebab lain mengenai kondisi obat, wadah, atau kemasan
sehingga menimbulkan keraguan akan keamanan, identitas, kualitas, dan
kuantitas obat jadi yang bersangkutan.
Pabrik hendaklah membuat prosedur untuk menahan, menyelidiki,
dan menganalisa obat yang dikembalikan, serta menetapkan apakah obat
tersebut dapat diproses kembali atau harus dimusnahkan. Terhadap obat
kembalian dilakukan evaluasi yang seksama untuk menentukan apakah
obat jadi yang bersangkutan dapat diolah kembali atau dimusnahkan.
2.2.10 Dokumentasi
Dokumentasi pembuatan obat merupakan bagian dari sistem informasi
manajemen yang meliputi spesifikasi bahan baku dan produk, prosedur, metode
dan instruksi, perencanaan, pelaksanaan, pembersihan, pemeliharaan,
penyimpanan dan distribusi, pengendalian serta evaluasi seluruh rangkaian
kegiatan pembuatan obat.
Dokumentasi sangat penting untuk memastikan bahwa setiap petugas
Wan Risa Puspita Baros : Laporan Praktek Kerja Profesi Farmasi Industri Di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat Bandung, 2009.
dilaksanakannya sehingga memperkecil resiko terjadinya salah tafsir dan
kekeliruan yang biasanya timbul karena hanya mengandalkan komunikasi lisan.
Sistem dokumentasi hendaklah menggambarkan riwayat lengkap dari
setiap bets atau lot suatu produk sehingga memungkinkan penyelidikan serta
penelusuran terhadap bets atau lot untuk produk yang bersangkutan. Sistem
dokumentasi digunakan juga dalam pemantauan dan pengendalian seperti pada
kondisi lingkungan, perlengkapan dan personalia.
2.2.11 Pembuatan dan Analisis Berdasarkan Kontrak
Pembuatan dan analisis berdasarkan kontrak harus dibuat secara benar,
disetujui dan dikendalikan untuk menghindari kesalahpahaman yang dapat
menyebabkan produk atau pekerjaan dengan mutu yang tidak memuaskan.
Kontrak tertulis antara pemberi kontrak dan penerima kontrak harus dibuat secara
jelas menentukan tanggung jawab dan kewajiban masing-masing pihak. Kontrak
harus menyatakan secara jelas prosedur pelulusan tiap bets produk untuk
diedarkan yang menjadi tanggung jawab penuh kepala bagian Managemen Mutu
(pemastian mutu).
2.2.12 Kualifikasi dan Validasi
CPOB mensyaratkan industri farmasi untuk mengidentifikasi validasi yang
perlu dilakukan sebagai bukti pengendalian terhadap aspek kritis dari kegiatan
yang dilakukan. Perubahan signifikan terhadap fasilitas, peralatan dan proses yang
dapat mempengaruhi mutu produk hendaklah divalidasi. Pendekatan dengan
kajian resiko hendaklah digunakan untuk menentukan ruang lingkup dan cakupan
Wan Risa Puspita Baros : Laporan Praktek Kerja Profesi Farmasi Industri Di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat Bandung, 2009.
BAB III
TINJAUAN KHUSUS LEMBAGA FARMASI DIREKTORAT KESEHATAN ANGKATAN DARAT
3.1 Sejarah
Lembaga Farmasi Direktorat Kesehatan Angkatan Darat (Lafi
Ditkesad) berasal dari MSL (Militaire Scheikundig Laboratorium). Lembaga
ini berfungsi sebagai tempat pemeriksaan obat-obatan bagi kebutuhan tentara
Belanda.
Pada tanggal 23 Januari 1950 dibentuk panitia pengalihan, sehingga
pada tanggal 1 Juni 1950 dilakukan serah terima dari MSL kepada TNI AD
yang menjadi dasar dalam penetapan hari jadi Lafi Ditkesad melalui SK No.
Skep/23/I/1997 tanggal 31 Januari 1997. Setelah serah terima pada tanggal 1
Juni 1950 MSL terbagi menjadi dua:
1. Laboratorium Kimia Tentara (LKT) yang kemudian berkembang menjadi
Laboratorium Kimia Angkatan Darat (LKAD).
2. Depot Obat Tentara Pusat (DOTP) yang berkembang menjadi Depot Obat
Angkatan Darat (DOAD).
Berdasarkan SK Ditkesad No. Kpts/61/10/IX/1960 tanggal 13
September 1960 terhitung mulai tanggal 8 Juni 1960 LKAD dan DOAD
disatukan menjadi Lembaga Farmasi Angkatan Darat (LAFIAD). Pada tanggal
15 Oktober 1970 LAFIAD dipisah kembali menjadi:
1. LAFIAD yang akhirnya menjadi Lembaga Farmasi Jawatan Kesehatan
Angkatan Darat (Lafi Jankesad).
2. Depot Obat Angkatan Darat (DOAD) berkembang menjadi Depot Alat
Peralatan Kesehatan (Dopalkes) dan berakhir menjadi Depot Pusat
Wan Risa Puspita Baros : Laporan Praktek Kerja Profesi Farmasi Industri Di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat Bandung, 2009.
Selanjutnya tahun 1985 antara Lafi Jankesad dan Dopusbekkes Jankesad
disatukan kembali menjadi Lafi Ditkesad hingga 31 Maret 2005 dan mulai 1 April
2005 dipisah lagi menjadi Lafi Ditkesad dan Gudang Pusat II Ditkesad.
3.2 Visi dan Misi
3.2.1 Visi
Visi Lafi Ditkesad adalah menjadi salah satu lembaga produksi yang
mampu memenuhi kebutuhan obat bermutu dan aman bagi prajurit, PNS TNI AD
dan keluarganya. Adapun visi dari Lafi Dikesad yaitu ” Menjadi penyelenggara
pemberian kesehatan Angkatan Darat yang dipercaya dengan dilandasi
profesionalisme, disiplin, bermoral dan solidaritas “.
3.2.2 Misi
Misi Lafi Ditkesad adalah menjadi salah satu lembaga produksi yang
mampu memenuhi kebutuhan obat bermutu dan aman bagi prajurit, PNS TNI AD
dan keluarganya. Adapun Misi dari Lafi Dikesad yaitu:
1. Menyelenggarakan hubungan kesehatan yang handal
2. Menyelenggarakan pelayanan kesehatan yang prima
3. Menyelenggarakan fungsi organik dan sesama.
3.3 Kedudukan, Tugas Pokok dan Fungsi Lafi Ditkesad
Lembaga Farmasi Direktorat Kesehatan Angkatan Darat (Lafi Ditkesad)
adalah badan pelaksana di tingkat Ditkesad yang berkedudukan langsung di
Wan Risa Puspita Baros : Laporan Praktek Kerja Profesi Farmasi Industri Di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat Bandung, 2009.
pokok membantu Dirkesad dalam menyelenggarakan pembinaan dan
melaksanakan fungsi produksi, penelitian dan pengembangan obat.
Dalam melaksanakan tugas pokok tersebut Lafi Ditkesad
menyelenggarakan fungsi-fungsi sebagai berikut:
1. Melaksanakan fungsi utama
1. Fungsi produksi; meliputi segala usaha, pekerjaan dan kegiatan di bidang
produksi obat.
2. Fungsi pengawasan mutu; meliputi segala usaha, pekerjaan dan kegiatan
pemeriksaan fisik, kimiawi, mikrobiologi, terhadap bahan baku, bahan
pembantu, sarana pendukung, produk antara, produk ruahan dan produk
jadi yang dilaksanakan sebelum, selama dan sesudah proses produksi.
3. Fungsi penelitian dan pengembangan; meliputi segala usaha, pekerjaan,
kegiatan di bidang penelitian dan pengembangan metode produksi,
pengawasan mutu, formulasi, uji produk, alat utama atau bantu dan
pengembangan kemampuan personil.
4. Fungsi pemeliharaan; meliputi segala usaha, pekerjaan, kegiatan di bidang
pemeliharaan, perawatan, perbaikan, pengembangan peralatan produksi,
pengawasan mutu dan utilitas.
5. Fungsi penyimpanan; meliputi segala usaha, pekerjaan, dan kegiatan di
bidang penerimaan, penyimpanan dan pengeluaran bahan baku, bahan
penolong, peralatan untuk proses produksi dan produk jadi serta
Wan Risa Puspita Baros : Laporan Praktek Kerja Profesi Farmasi Industri Di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat Bandung, 2009.
2. Melaksanakan Fungsi Organik
a. Fungsi Organik Militer
Meliputi segala usaha, pekerjaan dan kegiatan di bidang pengamanan,
personil, logistik dan urusan dalam.
b. Fungsi Organik Pembinaan
Meliputi segala usaha, pekerjaan dan kegiatan di bidang perencanaan
anggaran, pengawasan dan pengendalian kegiatan.
3.4 Struktur Organisasi Lafi Ditkesad
Keputusan Kepala Staf TNI AD No. Kep/11/I/2004 tanggal 30
Januari
2004 tentang organisasi dan tugas Lafi Ditkesad telah mengalami
perkembangan mengenai struktur organisasi yang bertujuan untuk lebih
mengoptimalkan kinerja personil dalam menghadapi kemajuan ilmu
pengetahuan dan teknologi. Struktur organisasi Lafi Ditkesad dapat dilihat
pada lampiran 1. Struktur tersebut telah diterapkan sejak bulan April 2005,
dengan susunan organisasi sebagai berikut:
3.4.1 Eselon Pimpinan
1. Kepala Lembaga Farmasi, disingkat Kalafi
Kalafi dijabat oleh seorang Pamen TNI Angkatan Darat berpangkat
Letnan Kolonel CKM, dalam melaksanakan tugas kewajibannya
bertanggung jawab kepada Dirkesad.
2. Wakil Kepala Lembaga Farmasi, disingkat Wakalafi
Wakalafi dijabat oleh seorang Pamen TNI Angkatan Darat, berpangkat
Letnan Kolonel CKM, dalam melaksanakan tugas kewajibannya
Wan Risa Puspita Baros : Laporan Praktek Kerja Profesi Farmasi Industri Di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat Bandung, 2009.
3.4.2 Eselon Pembantu Pimpinan
1. Perwira Ahli Lembaga Farmasi, disingkat Pa Ahli Lafi
Pa Ahli Lafi dijabat oleh Pamen TNl Angkatan Darat berpangkat Letnan
Kolonel CKM, dalam melaksanakan tugas kewajibannya bertanggung
jawab kepada Kalafi. Pa Ahli terdiri dari:
a. Perwira Ahli Madya Manajemen Industri, disingkat Pa Ahli Madya
Jemen In.
b. Perwira Ahli Madya Teknologi Farmasi, disingkat Pa Ahli Madya
Tekfi.
c. Perwira Ahli Madya Analisis Mengenai Dampak Lingkungan,
disingkat Pa Ahli Madya Amdal.
2. Bagian Administrasi Logistik, disingkat Bagminlog.
Kabagminlog dijabat oleh Pamen TNI Angkatan Darat berpangkat
Letnan Kolonel CKM, dalam pelaksanaaan tugas kewajibannya
bertanggung jawab kepada Kalafi. Kabagminlog dalam melaksanakan
tugasnya dibantu oleh dua kepala seksi yang masing-masing dijabat oleh
Pamen TNI Angkatan Darat berpangkat Mayor CKM, terdiri dari:
a. Kepala Seksi Perencanaan Anggaran dan Pengadaan,
disingkat Kasirengar Ada.
b. Kepala Seksi Pengendalian Materiil, disingkat Kasidalmat.
3.4.3 Eselon Pelayanan
(Seksi Tata Usaha dan Urusan Dalam, disingkat Si TUUD)
Kasi TUUD dijabat oleh seorang Pamen TNI Angkatan Darat
Wan Risa Puspita Baros : Laporan Praktek Kerja Profesi Farmasi Industri Di Lembaga Farmasi Direktorat Kesehatan Angkatan Darat Bandung, 2009.
jawab kepada Kalafi. Kasi TUUD dalam melaksanakan tugasnya dibantu oleh
tiga kepala urusan yang masing-masing dijabat oleh Pamen TNI Angkatan Darat
berpangkat Kapten CKM dan PNS golongan tiga serta satu perwira urusan yang
dijabat oleh Pamen TNI Angkatan Darat berpangkat Letnan CKM terdiri dari:
1. Kepala Urusan Administrasi Personil dan Logistik, disingkat
Kaurminperslog.
2. Kepala Urusan Tata Usaha, disingkat Kaurtu.
3. Kepala Urusan Dalam, disingkat Kaurdal.
4. Perwira Urusan Pengamanan, disingkat Paurpam.
3.4.4 Eselon Pelaksana
1. Instalasi Penelitian dan Pengembangan (Instal. Litbang)
Ka Instal. Litbang dijabat oleh seorang Pamen TNI Angkatan Darat
berpangkat Letnan Kolonel CKM, dalam melaksanakan tugasnya dibantu oleh
dua Kepala Seksi yang masing-masing dijabat oleh Pamen TNI Angkatan
Darat berpangkat Mayor CKM, terdiri dari:
a. Kepala Seksi Penelitian, disingkat Kasilit.
b. Kepala Seksi Pengembangan, disingkat Kasibang.
Ka Instal. Litbang dalam pelaksanaan tugas kewajibannya bertanggung
jawab kepada Kalafi.
2. Instalasi Produks i (Instal. Prod.)
Ka Instal. Prod dijabat oleh Pamen TNI Angkatan Darat berpangkat Letnan