PENGARUH PEMBERIAN VITAMIN E TERHADAP
LAJU PRODUKSI DAN KUALITAS ERITROSIT
MENCIT YANG DIPAPARI TUAK
TESIS
Oleh
NORONG PERANGIN ANGIN
087008016/BM
PROGRAM MAGISTER ILMU BIOMEDIK
FAKULTAS KEDOKTERAN
PENGARUH PEMBERIAN VITAMIN E TERHADAP
LAJU PRODUKSI DAN KUALITAS ERITROSIT MENCIT
YANG DIPAPARI TUAK
TESIS
Diajukan Sebagai Salah Satu Syarat untuk Memperoleh Gelar
Magister Biomedik dalam Program Studi Magister Ilmu Biomedik
Fakultas Kedokteran Universitas Sumatera Utara
Oleh
NORONG PERANGIN ANGIN
087008016/BM
PROGRAM MAGISTER ILMU BIOMEDIK
FAKULTAS KEDOKTERAN
Telah diuji pada
Tanggal : 14 Mei 2011
PANITIA PENGUJI TESIS
Ketua : Prof.Dr.Drs. Herbert Sipahutar, MS, M.Sc
Anggota : 1. DR. Marline Nainggolan, MS, Apt
2. Dr. Mary Margaret Thomas
ABSTRAK
Vitamin E merupakan salah satu vitamin yang larut dalam lemak dan berperan sebagai antioksidan serta dapat melindungi aksi kerusakan membran biologis akibat radikal bebas dan melindungi asam lemak tidak jenuh pada membran fosfolipid. Radikal bebas adalah molekul-molekul reaktif dan dapat merusak yang mempunyai elektron yang tidak berpasangan. Pemberian asupan antioksidan berupa vitamin E diusulkan dapat menurunkan efek radikal bebas dalam tubuh.
Penelitian ini bertujuan untuk mengetahui tentang pengaruh pemberian vitamin E terhadap jumlah retikulosit, jumlah eritrosit, morpologi eritrosit abnormal, jumlah hemaglobin dan jumlah hematokrit mencit (Mus musculus L.) jantan yang dipapari Tuak. Penelitian ini adalah merupakan studi eksperimental laboratorik denngan menggunakan mencit jantan (Mus musculus L.) strain DD Webster dewasa sehat dan berumur 2-3 bulan dengan berat 25-35 g sebanyak 30 ekor dibagi dengan 6 kelompok perlakuan. Kelompok 1 (P0) = kontrol terdiri dari 5 ekor mencit dewasa jantan yang diberi akuades 0,5 ml selama 30 hari. Kelompok 2 (P1) = kelompok perlakuan I terdiri dari 5 ekor mencit jantan dewasa yang diberi tuak pasaran (alkohol 20%) 0,5 ml/hari/ekor secara oral selama 15 hari, kemudian 15 berikutnya dilanjutkan dengan pemberian akuades 0,5 ml. Kelompok 3 (P2) = Kelompok perlakuan II terdiri dari 5 ekor mencit dewasa yang diberi tuak pasaran (alkohol 20%) 0,5 ml/hari/ekor secara oral selama 30 hari. Kelompok 4 (P3) = Kelompok perlakuan III terdiri 5 ekor mencit dewasa yang diberi tuak pasaran (alkohol 20%) 0.5 ml/hari/ekor selama 15 hari pertama dan 15 hari berikutnya pemberian tuak dihentikan diganti dengan pemberian vitamin E 0,33 mg/hari/ekor/mencit secara oral. Kelompok 5 (P4) = Kelompok perlakuan IV teridiri 5 ekor mencit dewasa yang diberi tuak pasaran (alkohol 20%) 0,5 ml/hari/ekor selama 30 hari dan hari ke 16 berikutnya pemberian vitamin E 0,33 mg/ekor/hari secara oral. Kelompok 6 (P5) = Kelompok perlakuan V terdiri dari 5 ekor mencit dewasa yang diberi tuak dipasaran (alkohol 20%) 0,5 ml dan pemberian vitamin E 0,33 mg/ekor/hari selama 30 hari secara oral. Mencit ditempatkan ke dalam kelompok random. Penelitian ini telah mendapatkan persetujuan dari komite etik penelitian USU. Hasil yang didapat dalam pemberian vitamin E 0,33 mg/hari/mencit sejalan dengan pemaparan tuak selama 30 hari dapat meningkatkan jumlah retikulosit, meningkatkan jumlah eritrosit, memperbaiki kerusakan morpologi eritrosit, meningkatkan kadar hemaglobin dan meningkatkan jumlah hematokrit mencit.
ABSTRACT
Vitamin E is one of vitamins soluble in fat and plays a role of antioxidant and even can keep biological membrane from the destructive action due to free radicals and keep unsaturated fatty acids from phospholipids membrane. The free radicals includes reactive molecules and can damage with the unpaired electrons. Administration of antioxidant intake in vitamin E is suggested to be able of reducing the free radical effect of the body.
The present study intends to know the effect of vitamin E on the amounts of reticulocyte, erythrocyte, morphology of abnormal erythrocyte, hemoglobin, and hematocrite male mice (Mus musculus L) exposed to the fermented palm wine. It is an experimental study using 30 male mice (Mus musculus L), strain of adult and healthy DD Webster ranging 2-3 months of age with the weight ranging 25-35 gs of divided into 6 groups of treatment. Group I (Po) is control consisting of 5 male mice given by 0.5 ml aquades for 30 days. Group II (P1) is treatment-1 consisting of 5 adult male mice exposed to the commercial fermented palm wine (20% alcohol) 0.5 ml /day /mice orally for 15 days, and then given by 0.5 ml aquades for next 15 days. Group III (P2) is treatment 2 consisting of 5 adult male mice exposed to the commercial fermented palm wine ( alcohol 20%) 0.5 ml/day/mice orally for 30 days. Group IV (P3) is treatment 3 consisting of 5 adult male mice exposed to the commercial fermented palm wine (alcohol 20%) 0.5 ml/day/mice for first 15 days and for next 15 days, the supplementation of fermented palm wine is stopped and changed by vitamin E 0.33 mg /day/mice orally. Group V (P4) is treatment 4 consisting of 5 adult male mice exposed to the commercial fermented palm wine (alcohol 20%) 0.5 ml/day/mice for 30 days and followed by vitamin E 0.33 mg /mice /day orally in the 16th day. Group VI (P5) is treatment 5 consisting of 5 adult male mice exposed to the commercial fermented palm wine (alcohol 20%) 0.5 ml and vitamin E 0.33 mg /mice /day for 10 days orally. The mice were classified randomized. The study has been accepted by the ethical committee of study, USU. The result of vitamin E 0.33 mg/day/mice is in coincidence with the exposure of fermented palm wine for 30 days that can increase in the amounts of reticulocyte, erythrocyte, correcting the destructed morphology of erythrocyte, increasing in hemaglobin level and increasing in the amount of mice hematocrite.
KATA PENGANTAR
Pertama-tama marilah kita ucapkan Puji dan Syukur Kehadirat Tuhan
Yang Maha Kuasa atas berkat dan rahmat-Nya, maka saya dapat menyusun tesis
ini. Penulisan tesis ini merupakan salah satu persyaratan dalam memperoleh
Gelar Magister pada Program Magister Studi Ilmu Biomedik Fakultas
Kedokteran Universitas Sumatera Utara Medan. Adapaun judul dari penelitian
adalah Pengaruh Pemberian Vitamin E Terhadap laju produksi dan kualitas
eritrosit mencit yang papari tuak.
Terima kasih yang tak terhingga dan penghargaan yang
setinggi-tingginya penulis ucapkan kepada
1. Bapak Prof. Dr. Drs. Herbert Sipahutar, MS, Msc yang telah bersedia
menjadi Ketua Komisi Pembimbing yang telah banyak memberikan
masukan-masukan dan penuh perhatian dalam penulisan tesis ini.
2. Ibu Dr. Marline Nainggolan, MS, Apt yang telah bersedia menjadi Anggota
Komisi Pembimbing yang selalu tabah dan sabar dalam membimbing dan
memberikan masukan-masukan demi kesempurnaan dalam penulisan tesis
ini.
3. Ibu Dr. Mary Margaret Thomas yang telah bersedia menjadi komisi
pembanding untuk memberikan masukan-masukan pada seminar tesis demi
kesempurnaan dalam penulisan tesis ini.
4. dr. Darion Gatot, SpPD, KHOM yang telah bersedia menjadi komisi
pembanding pada seminar tesis demi kesempurnaan dalam penulisan tesis
ini.
5. Prof. dr. Gontar A. Siregar, SpPD, KGEH selaku Dekan Fakultas
Kedokteran Universitas Sumatera Utara yang telah memberi izin penelitian.
6. Ibu dr. Yahwardiah Siregar, Ph.D selaku Ketua Program Studi Magister
Ilmu Biomedik Fakultas Kedokteran Universitas Sumatera Utara Medan
7. Pimpinan dan staf laboratorium FMIPA, Pimpinan dan staf laboratorium
Histologi Fakultas Kedokteran, Pimpinan dan satf laboratorium Penelitian
Fakultas Farmasi Universitas Sumatera Utara Medan dan Laboratorium
Paramita cabang Medan yang menyediakan tempat dan tenaga laboran
yang membantu saya dalam penelitian tesis ini.
8. Direktur Akademi Keperawatan Kesdam I BB Pematangsiantar dan
seluruh rekan-rekan kerja di Akademi Keperawatan Kesdam I BB
Pematangsiantar yang dengan penuh perhatian dan kasih memberikan
dukungan dan semangat pada penulis selama mengikuti pendidikan.
9. Terima kasih yang tulus penulis ucapkan kepada istri tercinta Ujianna Br
Sembiring, S.Kep, Ners, yang selalu memberikan dukungan sehingga
penulis dapat menyelesaikan pendidikan pada Program Studi Magister Ilmu
Biomedik Fakultas Kedokteran Universitas Sumatera Utara Medan.
10. Persembahan kepada anak saya tercinta Roy Aditia, Prina Margaret dan
Juna Alkana yang telah memberi dukungan dan semangat kepada penulis.
11. Persembahan terimakasih yang tulus kepada ayahanda N. Peangin angin
(alm) dan ibu N, Br Ginting (alm) yang telah membesarkan dengan penuh
kasih sayang dan dengan jasa mereka penulis dapat menjalani pendidikan
hingga pascasarjana.
12. Terima kasih juga buat seluruh teman-teman seperjuangan mahasiswa/i
Biomedik Angkatan 2008 yang selalu bersedia berdiskusi demi
kesempurnaan penulisan tesis ini.
Akhirnya, penulis menyadari bahwa hasil penelitian ini masih belum
sempurna. Oleh sebab itu penulis berharap adanya kritik dan saran yang
membangun demi perbaikan tulisan ini. Semoga tesis ini bermanfaat bagi kita
semua.
Medan, Juni 2011
RIWAYAT HIDUP
Nama : Norong Perangin angin
Tempat/Tanggal Lahir : Kacinambun (Karo) 1 Mei 1965
Agama : Kristen Protestan
Status : Menikah
Alamat : Jln. Pelindung No. 20 Pematangsiantar
Tel/Hp : 081296960609
Pendidikan :
SD Negeri Kubu : 1972-1979
SMP Negeri 1 Kabanjahe : 1979-1982
SPK Kesdam I BB Pematangsiantar : 1983-1986
Akademi Keperawatan Pajajaran Bandung : 1993-1996
Akta Mengajar III IKIP Bandung : 1996-1996
Diploma IV Perawat Pendidik USU : 2000-2001
Program Magister Studi Ilmu Biomedik FK-USU Medan : 2008-2011
Riwayat Pekerjaan :
Perawat Turwatun : 1987-1992
Staf Pengajar Pada SPK Ksdam I BB P. Siantar : 1997-2006
Pembantu Direktur I Pada AKPER Kesdam I BB P. Siantar :
DAFTAR ISI
1.2. Perumusan Masalah... 3
1.3. Kerangka Konsep ... 4
1.4. Tujuan Penelitian... 5
1.5. Hipotesis... 5
1.6. Variabel Penelitian……….……….………. 5
1.7. Manfaat Penelitian... 5
BAB II TINJAUAN PUSTAKA 2.1. Tuak………... 7
2.2. Absorbsi dan Distribusi Alkohol………... 7
2.3. Metabolisme Alkohol……….... ... 8
2.4. Kerusakan Akibat Radikal Bebas ………...……… 11
2.5. Antioksidan Vitamin E... 13
2.6. Komponen Darah... 15
2.7 Pembentukan Sel Darah …..……….... 16
2.8. Laju Produksi Eritrosit...…… 18
2.9. Retikulosit ……...………. 19
2.10. Morpologi Eritrosit ……….………..……….. 19
2.11. Fungsi Eritrosit ...……… 20
2.12. Gambaran Hematologi Mencit... 21
BAB III METODE PENELITIAN
4.2.3. Kualitas Eritrosit...……… 45
4.2.3.1. Eritrosit...……… 45
4.2.3.2. Morpologi Eritrosit.……… 46
4.2.3.3. Hemaglobin... 47
4.2.3.4. Hematokrit... 48
BAB V KESIMPULAN DAN SARAN 5.1. Kesimpulan ………..……….. 49
5.2. Saran ………...……… 49
DAFTAR PUSTAKA……….... 50
DAFTAR TABEL
DAFTAR GAMBAR
1. Gambar 1. Kerangka Konsep ………...……… 4
2. Gambar 2. Metabolisme Alkohol ………...………. 10
3. Gambar 3. Perkembangan Sel Darah ………...……...………… 18
4. Gambar 4. Marfologi Eritrosit Normal………...….…………... 20
5. Gambar 5. Desain Penelitian... 24
6. Gambar 6. Garafik Jumlah Retikulosit …………..………...………… 36
7. Gambar 7. Grafik Jumlah Eritrosit….. ………....……… 37
8. Gambar 8. Grafik Morpologi Abnormal….……….…………....…… 39
9. Gambar 9.Gambar Morpologi Eritrosit... 40
10. Gambar 10. Grafik Kadar Hemaglobin ...……….…………..…… 41
ABSTRAK
Vitamin E merupakan salah satu vitamin yang larut dalam lemak dan berperan sebagai antioksidan serta dapat melindungi aksi kerusakan membran biologis akibat radikal bebas dan melindungi asam lemak tidak jenuh pada membran fosfolipid. Radikal bebas adalah molekul-molekul reaktif dan dapat merusak yang mempunyai elektron yang tidak berpasangan. Pemberian asupan antioksidan berupa vitamin E diusulkan dapat menurunkan efek radikal bebas dalam tubuh.
Penelitian ini bertujuan untuk mengetahui tentang pengaruh pemberian vitamin E terhadap jumlah retikulosit, jumlah eritrosit, morpologi eritrosit abnormal, jumlah hemaglobin dan jumlah hematokrit mencit (Mus musculus L.) jantan yang dipapari Tuak. Penelitian ini adalah merupakan studi eksperimental laboratorik denngan menggunakan mencit jantan (Mus musculus L.) strain DD Webster dewasa sehat dan berumur 2-3 bulan dengan berat 25-35 g sebanyak 30 ekor dibagi dengan 6 kelompok perlakuan. Kelompok 1 (P0) = kontrol terdiri dari 5 ekor mencit dewasa jantan yang diberi akuades 0,5 ml selama 30 hari. Kelompok 2 (P1) = kelompok perlakuan I terdiri dari 5 ekor mencit jantan dewasa yang diberi tuak pasaran (alkohol 20%) 0,5 ml/hari/ekor secara oral selama 15 hari, kemudian 15 berikutnya dilanjutkan dengan pemberian akuades 0,5 ml. Kelompok 3 (P2) = Kelompok perlakuan II terdiri dari 5 ekor mencit dewasa yang diberi tuak pasaran (alkohol 20%) 0,5 ml/hari/ekor secara oral selama 30 hari. Kelompok 4 (P3) = Kelompok perlakuan III terdiri 5 ekor mencit dewasa yang diberi tuak pasaran (alkohol 20%) 0.5 ml/hari/ekor selama 15 hari pertama dan 15 hari berikutnya pemberian tuak dihentikan diganti dengan pemberian vitamin E 0,33 mg/hari/ekor/mencit secara oral. Kelompok 5 (P4) = Kelompok perlakuan IV teridiri 5 ekor mencit dewasa yang diberi tuak pasaran (alkohol 20%) 0,5 ml/hari/ekor selama 30 hari dan hari ke 16 berikutnya pemberian vitamin E 0,33 mg/ekor/hari secara oral. Kelompok 6 (P5) = Kelompok perlakuan V terdiri dari 5 ekor mencit dewasa yang diberi tuak dipasaran (alkohol 20%) 0,5 ml dan pemberian vitamin E 0,33 mg/ekor/hari selama 30 hari secara oral. Mencit ditempatkan ke dalam kelompok random. Penelitian ini telah mendapatkan persetujuan dari komite etik penelitian USU. Hasil yang didapat dalam pemberian vitamin E 0,33 mg/hari/mencit sejalan dengan pemaparan tuak selama 30 hari dapat meningkatkan jumlah retikulosit, meningkatkan jumlah eritrosit, memperbaiki kerusakan morpologi eritrosit, meningkatkan kadar hemaglobin dan meningkatkan jumlah hematokrit mencit.
ABSTRACT
Vitamin E is one of vitamins soluble in fat and plays a role of antioxidant and even can keep biological membrane from the destructive action due to free radicals and keep unsaturated fatty acids from phospholipids membrane. The free radicals includes reactive molecules and can damage with the unpaired electrons. Administration of antioxidant intake in vitamin E is suggested to be able of reducing the free radical effect of the body.
The present study intends to know the effect of vitamin E on the amounts of reticulocyte, erythrocyte, morphology of abnormal erythrocyte, hemoglobin, and hematocrite male mice (Mus musculus L) exposed to the fermented palm wine. It is an experimental study using 30 male mice (Mus musculus L), strain of adult and healthy DD Webster ranging 2-3 months of age with the weight ranging 25-35 gs of divided into 6 groups of treatment. Group I (Po) is control consisting of 5 male mice given by 0.5 ml aquades for 30 days. Group II (P1) is treatment-1 consisting of 5 adult male mice exposed to the commercial fermented palm wine (20% alcohol) 0.5 ml /day /mice orally for 15 days, and then given by 0.5 ml aquades for next 15 days. Group III (P2) is treatment 2 consisting of 5 adult male mice exposed to the commercial fermented palm wine ( alcohol 20%) 0.5 ml/day/mice orally for 30 days. Group IV (P3) is treatment 3 consisting of 5 adult male mice exposed to the commercial fermented palm wine (alcohol 20%) 0.5 ml/day/mice for first 15 days and for next 15 days, the supplementation of fermented palm wine is stopped and changed by vitamin E 0.33 mg /day/mice orally. Group V (P4) is treatment 4 consisting of 5 adult male mice exposed to the commercial fermented palm wine (alcohol 20%) 0.5 ml/day/mice for 30 days and followed by vitamin E 0.33 mg /mice /day orally in the 16th day. Group VI (P5) is treatment 5 consisting of 5 adult male mice exposed to the commercial fermented palm wine (alcohol 20%) 0.5 ml and vitamin E 0.33 mg /mice /day for 10 days orally. The mice were classified randomized. The study has been accepted by the ethical committee of study, USU. The result of vitamin E 0.33 mg/day/mice is in coincidence with the exposure of fermented palm wine for 30 days that can increase in the amounts of reticulocyte, erythrocyte, correcting the destructed morphology of erythrocyte, increasing in hemaglobin level and increasing in the amount of mice hematocrite.
BAB I PENDAHULUAN
1.1. Latar Belakang
Tuak merupakan minuman tradisional yang dijumpai pada beberapa
daerah di Sumatera Utara, yang diperoleh dari hasil fermentasi nira aren dan
nira kelapa. Tuak sebagai minuman tradisional telah menjadi turun-temurun,
dimana konsumsi tuak sangat sulit dihilangkan dari kebiasaan masyarakat.
Sampai sekarang tuak masih menjadi kegemaran pada daerah ini yang dipakai
sebagai minuman untuk penghangat tubuh dan di waktu adanya pesta-pesta di
malam hari. Selain di Sumatera Utara, daerah lain sebagai penghasil dan
pengkonsumsi tuak yang cukup tenar, adalah Jawa Tengah, Jawa Timur dan
Bali (Ikegami,1997).
Tuak yang diproduksi secara tradisional, sehingga sulit untuk
mengetahui dan mengkontrol kadar alkohol yang ada dalam minuman tersebut.
Tetapi secara umum Sunanto (1993) melaporkan bahwa tuak hasil fermentasi
nira aren yang diperdangangkan dan dikonsumsi di Sumatera Utara rata-rata
mengandung alkohol 4 %.). Menurut Keputusan Menteri Kesehatan No.
151/A/SK/V/81 bahwa minuman atau obat tradisional yang tergolong dalam
minuman keras mengandung alkohol > 1 %. Dengan demikian tuak merupakan
minuman beralkohol yang tidak jauh berbeda dengan minuman keras lainnya.
Berdasarkan konsentrasi alkohol yang terkandung dalam tuak tersebut maka
diduga bahwa mayarakat yang mengkonsumsi secara terus menerus akan dapat
menimbulkan gangguan kesehatan. Penelitian sebelumnya menyatakan bahwa
dapat menyebabkan terjadinya hemolisis darah mencit (Nordina, 2010). Begitu
juga menurut Kamisah (2009) menyebutkan bahwa alkohol secara langsung
dapat merusak sumsum tulang terutama prekursor eritrosit sehingga
menimbulkan gangguan pembentukan eritrosit dan anemia. Konsumsi alkohol
kronis, akan menyebabkan terbentuknya radikal bebas, yang akan bereaksi
dengan lemak, protein, asam nukleat seluler sehingga terjadi kerusakan lokal
dan disfungsi organ termasuk struktur eritrosit dan fungsinya (Toykuni, 1999).
Alkohol akan menginduksi sitokrom P450 sehingga enzim tersebut meningkat,
yang dapat meningkatkan radikal bebas secara langsung dengan membentuk
radikal superoksid (Bacman and Ames 1998)
Di Amerika Serikat, kira-kira 75% dari populasi dewasanya
mengkonsumsi minuman beralkohol secara teratur, dan sekitar 10% dari
populasi umum di Amerika Serikat mereka tidak mampu membatasi konsumsi
etanol, yang dikenal sebagai penyalahgunaan alkohol. Individu-individu yang
terus meminum alkohol tanpa mempedulikan adanya konsekuensi yang dapat
merugikan secara medis dan sosial yang berkaitan langsung dengan konsumsi
alkohol akan menderita alkoholisme.Orang alkoholisme sulit untuk menentukan
jumlah alkohol yang dikonsumsi tetapi dapat diketahui jika kebiasaan tersebut
dibiarkan dalam beberapa waktu, dan ini akan mempengaruhi kehidupan
seseorang secara bertolak belakang. Alkoholisme dapat menyebabkan gangguan
fungsi sosial dan pekerjaan, dan meningkatkan toleransi terhadap efek alkohol
serta ketergantungan fisiologik (Chandrasoma dan Taylor, 2005).
Terdapat 200.000 orang kematian di dunia yang berhubungan dengan
tertinggi adalah usia antara 20 - 35 tahun. Sedangkan jenis klamin, laki-laki
secara bermakna lebih banyak menggunakan alkohol dari pada wanita
(Harimurti, 2009)
Vitamin E merupakan antioksidan atau penangkap radikal bebas (Free
scavenger) terutama pada membran sel. Beberapa penelitian yang telah
menunjukkan bahwa vitamin E dapat melindungi dan mempertahankan fungsi
sel dari serangan radikal bebas yang disebabkan alkohol (Machlin dan
Bendiech, 1997). Pemberian vitamin E dapat mencegah kerusakan sel darah
merah yang disebabkan oleh radikal bebas, dan apabila vitamin E pada
membran sel telah menurun atau habis, maka radikal bebas akan mengoksidasi
membran sel sehingga menyebabkan terjadinya peroksidasi lipid yang
mengakibatkan hemolisis sel darah merah (Machlin dan Bendiech 1997).
Vitamin E memiliki kemampuan untuk menghentikan peroksidasi lipid
dengan cara menyumbangkan satu atom hydrogennya dari gugus OH kepada
lipid piroksil yang bersifat radikal sehingga kurang reaktif dan tidak merusak
(Wahyuningsih 2009)
Berdasarkan uraian di atas terlihat bahwa alkohol sangat memberi
pengaruh terhadap sel darah. Maka penelitian ini untuk mengetahui pengaruh
pemberian vitamin E terhadap laju produksi dan kualitas sel darah merah mencit
yang dipapari dengan tuak.
1.2. Perumusan Masalah
1. Apakah vitamin E dapat mempengaruhi jumlah retikulosit mencit yang
2. Apakah vitamin E dapat mempengaruhi jumlah eritrosit dan gambaran
morpologi eritrosit pada mencit yang diberi tuak
3. Apakah vitamin E dapat mempengaruhi kadar hemoglobin dan nilai
hematokrit darah mencit yang diberi tuak
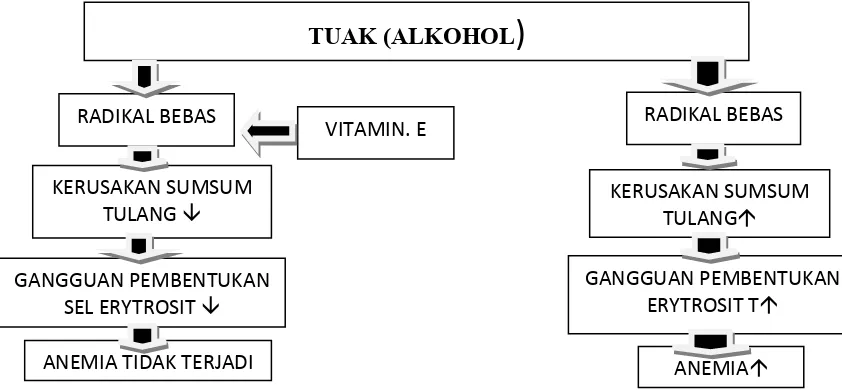
1.3. Kerangka Konsep
Tuak atau alkohol akan masuk kedalam sumsum tulang melalui saluran
pencernaan yang kemudian akan berakumulasi dengan darah. Toksikasi yang
ditimbulkan tuak/alhohol akan menyebabkan kerusakan jaringan ditingkat yang
ringan (proses biokimia normal) sampai pada kematian sel. Perubahan proses
biokimia akan merusak sumsum tulang terutama prekursor eritrosit sehingga
menimbulkan gangguan pembentukan eritrosit. Pemberian vitamin E sebagai
antioksidan berperan untuk meminimalisir dampak yang ditimbulkan tuak.
ANEMIA TIDAK TERJADI
1.4. Tujuan Penelitian
Penelitian eksperimental ini dilakukan dengan tujuan :
1. Untuk mengetahui pengaruh vitamin E terhadap jumah retikulosit
pada mencit yang diberi tuak
2. Untuk mengetahui pengaruh pemberian vitamin E terhadap jumlah
eritrosit dan gambaran morpologi eritrosit mencit yang diberi tuak
3. Untuk mengetahui pengaruh pemberian vitamin E terhadap kadar
hemoglobin dan nilai hematokrit darah mencit yang diberi tuak
1.5. Hipotesis
Berdasarkan rumusan permasalahan tersebut, dikemukakan hipotesis
sebagai berikut :
a. Ho ;
1. Tidak ada pengaruh vitamin E terhadap jumlah retikulosit pada
mencit yang diberi tuak
2. Tidak ada pengaruh vitamin E terhadap jumlah eritrosit dan gambaran
morpologi eritrosit pada mencit yang diberi tuak
3. Tidak ada pengaruh vitamin E terhadap kadar hemoglobin dan nilai
hematokrit pada mencit yang diberi tuak
b. Ha :
1. Ada pengaruh vitamin E terhadap jumlah retikulosit pada mencit yang
2. Ada pengaruh vitamin E terhadap jumlah eritrosit dan gambaran
morpologi eritrosit pada mencit yang diberi tuak
3. Ada pengaruh vitamin E terhadap kadar hemoglobin dan nilai
hematokrit pada mencit yang diberi tuak
1.6. Variabel Penelitian
1.6.1. Variabel bebas
a. Tuak (alkohol)
b. Vitamin E
1.6.2. Variabel tergantung
a. Jumlah retikulosit
b. Jumlah eritrosit
c. Morpologi eritrosit
d. Kadar hemoglobin
e. Nilai hematokrit
1.7. Manfaat Penelitian.
Bagi ilmu kedokteran, hasil penelitian ini dapat dijadikan sebagai salah satu
acuan untuk menjadi status kesehatan dan mencegah penyakit-penyakit yang
disebabkan oleh kerusakan eritrosit terutama karena radikal bebas akibat
BAB II
TINJAUAN PUSTAKA
2.1. Tuak
Tuak sering juga disebut arak, yaitu produk yang mengandung alkohol.
Bahan baku yang biasa dipakai adalah: cairan yang diambil dari tanaman
seperti nira dari pohon kelapa, aren dan pohon siwalan atau tal. Kadar alkohol
pada tuak berbeda-beda tergantung daerah pembuatnya. Arak yang dibuat di
pulau Bali dikenal dengan nama Brem Bali, mengandung alkohol yang
kadarnya cukup tinggi.
Tuak, disamping sebagai minuman juga merupakan bahan baku untuk
pembuatan gula dengan berbagai sebutan seperti gula aren atau gula merah atau
gula jawa karena orang Jawa memang lebih banyak memproses tuak menjadi
gula. Tuak merupakan sejenis minuman yang beralkohol yang berasal dari
fermentasi nira aren mengandung alkohol dengan kadar 4 % (Sunanto, 1993).
2.2. Absorbsi dan Distribusi alkohol
Alkohol yang masuk ke dalam saluran pencernaan akan diabsorbsi
melalui mukosa mulut dan epitel gastrointestinal dan sebagian besar (80%)
diabsorbsi di usus halus, sisanya diabsorbsi di kolon. Kecepatan absorbsi
tergantung pada takaran dan konsentrasi alkohol dalam minuman yang mengisi
lambung dan usus. Bila konsentrasi optimal alkohol diminum dan dimasukkan
dalam lambung yang kosong maka kadar puncak dalam darah telah dapat
Setelah diabsorbsi, alkohol akan didistribusikan ke semua jaringan dan
cairan tubuh serta cairan jaringan. Sekitar 90 - 98% alkohol yang diabsorbsi
dalam tubuh akan mengalami oksidasi, sedangkan 2 - 10%nya diekskresikan
tanpa mengalami perubahan, baik melalui paru-paru maupun ginjal. Sebagian
kecil akan dikeluarkan melalui keringat, air mata, empedu dan air ludah
(Darmono, 2000 ).
Alkohol mudah berdifusi dan distribusinya dalam jaringan sesuai
dengan kadar air jaringan tersebut. Semakin hidrofil jaringan semakin tinggi
kadar alkoholnya. Biasanya dalam 12 jam telah tercapai keseimbangan kadar
alkohol dalam darah, usus, dan jaringan lunak ( Zakhari, 2006 ).
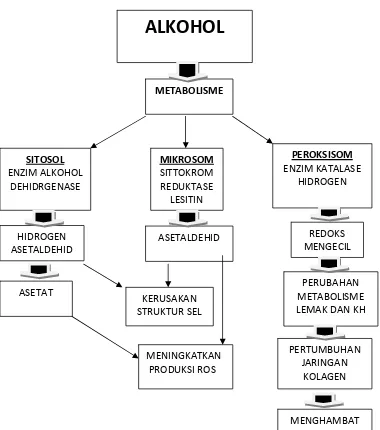
2.3. Metabolisme Alkohol
Alkohol yang masuk ke dalam tubuh akan mengalami serangkaian
proses biokimia. Alkohol yang dikomsumsi 90%, diantaranya akan
dimetabolisme oleh tubuh terutama hati oleh enzim alkoholdehirogenase (ADH)
dan koenzim nikotinamid-adenin-dinokleotida (NAD) menjadi asetaldehid dan
kemudian oleh enzim aldehida dehidrogenase (ALDH) diubah menjadi asam
asetat. Asam asetat dioksidasi menjadi CO2 dan H2O. Piruvat, levulosa
(fruktosa), gliseraldehida dan alanin akan mempercepat metabolism alkohol
(Lieber, 1994)
Metabolisme alkohol melibatkan 3 jalur, yaitu jalur sitosol, jalur
a. Jalur Sitosol/Lintasan Alkohol Dehidrogenase.
Jalur ini adalah proses oksidasi dengan melibatkan enzim alkohol
dehidrogenase (ADH). Proses oksidasi dengan menggunakan alkohol
dehidrogenase terutama terjadi di dalam hepar. Metabolisme alkohol oleh
ADH akan menghasilkan asetaldehid yang merupakan produk yang sangat
reaktif dan sangat beracun sehingga menyebabkan kerusakan beberapa
jaringan atau sel (Zakhari, 2006)
b. Jalur Peroksisom/Sistem Katalase
Melalui enzim katalase yang terdapat dalam peroksisom (peroxysome)
hidrogen yang dihasilkan dari metabolism alkohol dapat mengubah keadaan
redoks, dan pada pemakaian alkohol yang lama dapat mengecil. Perubahan ini
dapat menimbulkan perubahan metabolisme lemak dan karbohidrat, yang
menyebabkan bertambahnya jaringan kolagen dan dalam keadaan tertentu dapat
menghambat sintesa protein ( Zakhari, 2006)
c. Jalur Mikrosom
Jalur ini juga sering disebut dengan sistem SOEM (Sistem Oksidasi
Etanol Mikrosom). yang terletak dalam retikulum endoplasma. Dengan
pertolongan 3 komponen mikrosom ( sitokrom P-450, reduktase dan lesitin)
ALKOHOL
Gambar 2. Metabolisme alkohol
Alkohol akan diubah menjadi asetaldehid, kemudian akan diubah
menjadi asetat oleh aldehid dehidrogenase di dalam mitokondria. Pemakaian
alkohol yang lama akan menimbulkan perubahan pada metokondria, yang
menyebabkan berkurangnya kapasitas untuk oksidasi lemak. Semua yang
Sistem Oksidasi Etanol Mikrosom yang disebabkan pemakaian alkohol
berlangsung lama dapat menginduksi dan meningkatkan metabolisme
obat-obatan, meningkatkan lipoprotein dan menyebabkan hyperlidemia (Lieber,
1994)
Reaktive Oxygen Species (ROS) dihasilkan secara alami dalam jumlah
kecil selama reaksi metabolisme tubuh dan dapat bereaksi dengan molekul
seluler dan kerusakan kompleks seperti lemak, protein, atau DNA. Alkohol
mempromosikan generasi dari ROS dan mengganggu mekanisme normal
pertahanan tubuh terhadap senyawa ini melalui berbagai proses, terutama di
hati. Alkohol juga merangsang aktivitas enzim yang disebut sitokrom P450,
yang berkontribusi pada produksi ROS. Lebih lanjut, alkohol dapat
mengubah tingkat logam tertentu dalam tubuh, sehingga memudahkan
produksi ROS ( Defeng, 2001)
2.4. Kerusakan Akibat Radikal Bebas
Penelitian yang ekstensif dengan menggunakan sistem model, dan dengan
material biologis in vitro, secara jelas menunjukkan bahwa radikal bebas dapat
menimbulkan perubahan kimia dan kerusakan terhadap protein, lemak,
karbohidrat dan nukleotida. Bila radikal bebas diproduksi in vivo atau in vitro
di dalam sel melebihi mekanisme pertahanan normal, maka akan terjadi
berbagai gangguan metabolik dan seluler. Jika posisi radikal bebas yang
terbentuk dekat dengan DNA, maka bisa menyebabkan perubahan struktur
nukleotida sehingga menyebabkan perubahan yang bermakna pada komponen
biologi sel. Bila radikal bebas merusak grup thiol maka akan terjadi perubahan
aktivitas enzim. Radikal bebas dapat merusak sel dengan cara merusak
membran sel tersebut. Kerusakan pada membran sel ini dapat terjadi dengan
cara:
a. Radikal bebas berikatan secara kovalen dengan enzim dan/atau reseptor
yang berada di membran sel, sehingga merubah aktivitas
komponen-komponen yang terdapat pada membran sel tersebut.
b. Radikal bebas berikatan secara kovalen dengan komponen membran
sel, sehingga merubah struktur membran dan mengakibatkan perubahan
fungsi membran dan/atau mengubah karakter membran menjadi seperti
antigen.
c. Radikal bebas mengganggu proses transportasi melalui ikatan kovalen,
mengoksidasi kelompok thiol, atau dengan merubah asam lemak
polyunsaturated
Radikal bebas menginisiasi peroksidasi lipid secara langsung terhadap
asam lemak polyunsaturated dinding sel. Peroksidasi ini akan mempengaruhi
fluiditas membran, cross-linking membran, serta struktur dan fungsi membran
(Slater, 1984). Sebagai tambahan adaptasi perubahan terhadap proteksi
enzim-enzim, stress oksidatif atau stress lain yang diketahui menyebabkan
meningkatnya produksi stress atau heat shock protein (HSP). Protein ini
adalah komponen penting dari respon proteksi seluler, Ini terjadi dalam sel-sel
2.5. Antioksidan Vitamin E
Antioksidan adalah substansi yang diperlukan tubuh untuk menetralisir
radikal bebas dan mencegah kerusakan yang ditimbulkan oleh radikal bebas
terhadap sel normal, protein, dan lemak. Antioksidan menstabilkan radikal
bebas dengan melengkapi kekurangan elektron yang dimiliki radikal bebas, dan
menghambat terjadinya reaksi berantai dari pembentukan radikal bebas yang
dapat menimbulkan stres oksidatif. Antioksidan yang dikenal ada yang berupa
enzim dan ada yang berupa mikronutrien. Enzim antioksi yang dibentuk dalam
tubuh, yaitu super oksida dismutase (SOD), glutation peroksida, katalase, dan
glutation reduktase. Sedangkan antioksidan yang berupa mikronutrien dikenal
tiga yang utama, yaitu β-karoten, vitamin C dan vitamin E. β-karoten
merupakan scavengers, vitamin C penangkap superoksida dan radikal bebas
yang lain, sedangkan vitamin E merupakan pemutus rantai peroksida lemak
pada membran dan low density lipoprotein. Vitamin E yang larut dalam lemak
merupakan antioksidan yang melindungi poly unsaturated faty acids (PUFA)
dan komponen sel serta membran sel dari oksidasi oleh radikal bebas
(Hariyatmi 2007).
Berdasarkan fungsinya, antioksidan dapat dibagi menjadi 4 tipe
(Hariyatmi 2007)
a. Tipe pemutus rantai reaksi pembentuk radikal bebas, dengan
menyumbangkan atom H, misalnya vitamin E
b. Tipe pereduksi, dengan mentransfer atom H atau oksigen, atau bersifat
c. Tipe pengikat logam, mampu mengikat zat peroksidan, seperti Fe2+,
misalnya flavonoid
d. Antioksidan sekunder, mampu mendekomposisi hidroperoksida menjadi
bentuk stabil, pada manusia dikenal SOD, katalase, glutation peroksidase.
Mekanisme kerja antioksidan seluler adalah sebagai berikut:
a. Berinteraksi langsung dengan oksidan, radikal bebas atau oksigen tunggal
b. Mencegah pembentukan jenis oksigen reaktif
c. Mengubah jenis oksigen reaktif menjadi kurang toksik
d. Mencegah kemampuan oksigen reaktif
e. Memperbaiki kerusakan yang timbul.
Vitamin E (tokoferol), adalah vitamin yang larut baik dalam lemak yang
melindungi tubuh dari radikal bebas. Vitamin E sebagai antioksidan banyak
terlibat dalam proses tubuh dan beroprasi sebagai antioksidan alami yang
membantu melindungi struktur sel penting terutama membran sel termasuk sel
eritrosit dari kerusakan akibat adanya radikal bebas. Dalam melaksanakan
fungsinya sebagai antioksidan dalam tubuh, vitamin E bekerja dengan caara
mencari, bereaksi dan merusak rantai reaksi radikal bebas (Frei 1994).
Vitamin E berada di dalam lapisan fosfolipid membran sel dan berfungsi
melindungi asam lemak jenuh ganda dan komponen membran sel lain dari
oksidasi radikal bebas dengan memutuskan rantai peroksida lipid yang banyak
muncul karena adanya reaksi antara lipid dan radikal bebas dengan cara
menyumbangkan satu atom hidrogen dari gugus OH pada cincinnya ke radikal
Mekanisme kerja vitamin E dalam mendonorkan ion hidrogen untuk
menetralkan atau mengurangi kadar lemak peroksida darah dimulai dengan
kerja α-tokoferol radikal yang kemudian berubah menjadi α-tokoferol
peroksida. Dari dua α tocoferol radikal berubah menjadi α tocoferol dimer dan
akhirnya menjadi α tokokuinone yang oleh vitamin C dapat diregenerasi
kembali menjadi α-tokoferol (Hariyatmi 2007).
2.6.Komponen Darah
Darah merupakan gabungan dari cairan plasma, sel-sel dan partikel
menyerupai sel, mengalir dalam arteri, kapiler, dan berfungsi untuk
mengirimkan oksigen dan zat-zat gizi ke jaringan dan membawa karbon
dioksida dan hasil limbah lainnya.
Lebih dari separuh bagian dari darah merupakan cairan (plasma) yang
sebagian besar mengandung garam-garam terlarut dan protein. Protein utama
dalam plasma adalah albumin,protein lainnya adalah antibodi (immunoglobulin)
dan protein pembeku. Plasma juga mengandung hormon-hormon, elektrolit,
lemak, gula, mineral dan vitamin.
a. Sel darah merah (eritrosit)
Merupakan sel darah yang paling banyak jumlahnya dibanding dengan dua
jenis sel lainnya dan dalam keadaan normal mencapai hampir separuh volume
darah. Sel darah merah mengandung hemoglobin, yang memungkinkan sel
jaringan tubuh dan mengangkut karbon dioksida dari jaringan untuk dikeluarkan
melalui paru-paru.
b. Sel darah putih (leukosit)
Jumlahnya lebih sedikit, dengan perbandingan satu sel darah putih untuk
660 sel darah merah. Terdapat lima jenis utama dari sel darah putih yang
bekerja sama untuk membangun mekanisme utama tubuh dalam melawan
infeksi, termasuk menghasilkan antibodi diantaranya, neutropil, limposit,
monosit, eosinofil dan basofil.
c. Platelet (trombosit)
Merupakan partikel yang menyerupai sel, dengan ukuran lebih kecil dari
pada sel darah merah atau sel darah putih. Sebagai bagian dari mekanisme
perlindungan darah untuk menghentikan perdarahan, trombosit berkumpul pada
daerah yang mengalami perdarahan dan selanjutnya akan mengalami
pengaktivan. Setelah mengalami pengaktivan, trombosit akan melekat satu
sama lain dan menggumpal untuk membentuk sumbatan dan menutup
pembuluh darah dan menghentikan perdarahan. (Guyton, 2006)
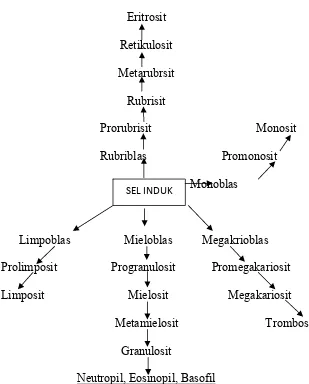
2.7. Pembentukan Sel Darah
Pada manusia, sel darah dibuat di sumsum tulang belakang, lalu
membentuk kepingan bikonkaf (Snyder dan Gregory , 1999). Sel darah merah,
sel darah putih dan trombosit dibuat di dalam sumsum tulang. Selain itu,
limfosit juga dibuat di dalam kelenjar getah bening dan limpa dan limfosit T
dalam sumsum tulang, semua sel darah berasal dari satu jenis sel yang disebut
sel stem (sel induk). Jika sebuah sel stem membelah, yang pertama kali
terbentuk adalah sel darah merah yang belum matang (imatur), sel darah putih
atau sel yang membentuk trombosit (megakariosit). Kemudian jika sel imatur
membelah, akan menjadi matang dan pada akhirnya menjadi sel darah merah,
sel darah putih atau trombosit. Kecepatan pembentukan sel darah dikendalikan
sesuai dengan kebutuhan tubuh. Jika kandungan oksigen dalam jaringan tubuh
atau jumlah sel darah merah berkurang, ginjal akan menghasilkan dan
melepaskan eritropoietin (hormon yang merangsang sumsum tulang untuk
membentuk lebih banyak sel darah merah). Sumsum tulang membentuk dan
melepaskan lebih banyak sel darah putih sebagai respon terhadap infeksi dan
Eritrosit
Retikulosit
Metarubrsit
Rubrisit
Prorubrisit Monosit
Rubriblas Promonosit
Monoblas
SEL INDUK
Limpoblas Mieloblas Megakrioblas
Prolimposit Progranulosit Promegakariosit
Limposit Mielosit Megakariosit
Metamielosit Trombosit
Granulosit
Neutropil, Eosinopil, Basofil
Gambar. 3. Skema Perkembangan Sel Darah (Depkes, 1989)
2.8. Laju Produksi Eritrosit
Proses pembentukan eritrosit disebut dengan eritropoiesis, yang terjadi
secara terus menerus diproduksi di dalam sumsum tulang. Laju produksi sekitar
2 juta eritrosit per detik. Eritrosit dikembangkan dari sel punca melalui
retkulosit. Untuk mendewasakan eritrosit membutuhkan waktu 7 hari dan
eritrosit terjadi pada hati yang distimulasi oleh hormon eritropoeitin yang
disintesa oleh ginjal (Cohen, 1982)
2.9. Retikulosit
Retikulosit adalah sel darah merah muda yang terdapat dalam volume
darah tertentu. Jumlah retikulosit sekitar 0,5 - 1 % dari jumlah total volume
darah. Hitung retikulosit merupakan indikator aktivitas sumsum tulang dan
digunakan untuk mendiagnosis anemia. Banyaknya retikulosit dalam darah tepi
menggambarkan eritropoesis yang hampir akurat. Peningkatan jumlah
retikulosit di darah tepi menggambarkan akselerasi produksi eritrosit dalam
sumsum tulang. Sebaliknya, hitung retikulosit yang rendah terus-menerus dapat
mengindikasikan keadaan hipofungsi sumsum tulang atau anemia aplastik
(Linda Rosita, 2006)
2.10. Morfologi Eritrosit
Sel darah merah atau yang juga disebut sebagai eritrosit berasal dari
Bahasa Yunani, yaitu erythros berarti merah dan kytos yang berarti selubung/sel
(Snyder dan Gregory, 1999). Sel darah merah, eritrosit (red blood cell, RBC,
erythrocyte), berbentuk lempeng bikonkaf dengan diameter kira-kira 7,8
mikrometer dan dengan ketebalan pada bagian yang paling tebal 2,5 mikrometer
Gambar. 4. Morfologi Eritrosit Normal pada Manusia (Depkes, 1989)
Bentuk eritrosit dapat berubah-ubah ketika sel berjalan melewati kapiler.
Karena sel normal mempunyai membran yang sangat kuat untuk menampung
banyak bahan material di dalamnya, maka perubahan bentuk tadi tidak akan
meregangkan membran secara hebat dan sebagai akibatnya tidak akan
memecahkan sel seperti yang terjadi pada sel-sel lainnya (Guyton dan Hall,
2006). Di dalam sel darah merah tidak terdapat nukleus. Sel darah merah sendiri
akan aktif selama 120 hari dan kemudian akhirnya dihancurkan (Snyder dan
Gregory , 1999).
2.11. Fungsi Eritrosit
Sel eritrosit berfungsi membawa oksigen ke jaringan-jaringan tubuh
yang dapat mengikat oksigen. Hemoglobin akan mengambil oksigen dari
paru-paru dan oksigen akan dilepaskan saat eritrosit melewati pembuluh kapiler.
Warna dari eritrosit berasal dari gugus heme yang terdapat pada
hemoglobin. Sedangkan cairan plasma darah sendiri berwarna kuning
kecoklatan, tetapi eritrosit akan berubah warna tergantung pada kondisi
hemoglobin. Ketika terikat pada oksigen, eritrosit akan berwarna merah terang
dan ketika oksigen dilepas maka warna erirosit akan berwarna lebih gelap, dan
akan menimbulkan warna kebiru-biruan pada pembuluh darah dan kulit.
Fungsi utama eritrosit adalah mengangkut oksigen dari paru-paru ke seluruh
jaringan tubuh. Selain mengandung hemoglobin, eritrosit juga mempunyai
fungsi lain. Ia mengandung banyak karbon anhidrase, yang mengkatalis reaksi
antara karbondioksida dan air, sehingga meningkatkan reaksi bolak-balik ini
beberapa ribu kali lipat. Cepatnya reaksi ini membuat air dalam darah dapat
bereaksi dengan banyak sekali karbon dioksida dan dengan demikian
mengangkutnya dari jaringan menuju paru-paru dalam bentuk ion bikarbonat
(Guyton dan Hall, 2006).
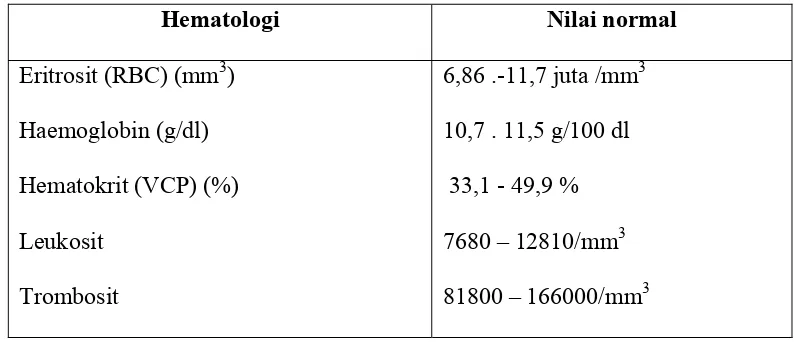
2.12. Gambaran Hematologi Mencit
Eritrosit normal merupakan bentuk cakram dengan ukuran tebal 1,5 –
2,5 μm diameter 5 – 7 μm. Dengan pewarnaan Wright, eritrosit akan berwarna
kemerah-merahan karena mengandung hemoglobin. Eritrosit normal tidak
berinti, berbentuk bulat dan tipis, bagian tengah lebih tipis daripada bagian
Makin dewasa inti sel dari eritrosit semakin kecil selanjutnya menghilang. Inti
sel muda warna selnya lebih merah (Bijanti et al., 1997).
Tabel. 1, Gambaran hematologi mencit.
Hematologi Nilai normal
Eritrosit (RBC) (mm3)
Haemoglobin (g/dl)
Hematokrit (VCP) (%)
Leukosit
Trombosit
6,86 .-11,7 juta /mm3
10,7 . 11,5 g/100 dl
33,1 - 49,9 %
7680 – 12810/mm3
81800 – 166000/mm3
(Kusumawati, Smith dan Mangkoewidjojo (1988).
2.13. Abnormalitas Morfologi Eritrosit Mencit
Abnormal morfologi eritrosit dapat terjadi oleh berbagai kondisi, termasuk
fragmentasi eritrosit, stress oksidasi dan kelaianan bawaan. Kelaianan eritrosit
bisa dilihat dari ukuran diameternya, lebih kecil dari normal atau lebih besar
dari normal, warnanya lebih pucat atau tidak pucat dan bentuknya seperti bulan
sabit dan seperti durian/ireguler.
Kelaianan yang sering terjadi adalah, poikilositosis yaitu irreguler atau
terjadinya perubahan bentuk. Indikasi ini muncul karena adanya abnormalitas
BAB III
METODE PENELITIAN
3.1.Tempat dan Waktu Penelitian
Lokasi penelitian dilakukan di Laboratorium FMIPA Biologi,
Laboratorium Penelitian Fakultas Farmasi Universitas Sumatera Utara (USU)
dan Laboratorium klinik Pramita Medan. Penelitian ini akan dilakukan selama 8
minggu, mulai dari Oktober sampai dengan November 2010
3.2. Rancangan Penelitian
Penelitian yang dilakukan merupakan penelitian eksperimen laboratorik
dengan Rancangan Acak Lengkap (RAL). Sebanyak 30 ekor mencit jantan
(Mus musculus L) strain DD Webster dewasa berumur 2-3 bulan dengan berat
badan 25-30 g, yang dibagi secara acak ke dalam 6 kelompok percobaan, 5
ekor mencit per kelompok. Jumlah ulangan ditentukan dengan menggunakan
rumus (t-1) (n-1) ≥ 15 (Federer, 1963). Dimana t adalah jumlah perlakuan
(dalam penelitian ini ada 6 kelompok perlakuan) dan n adalah jumlah ulangan
0 hari 15 hari 30
P0
P1
P2
P3
P4
P5
Tuak (alkohol 20%) 0,5 ml Larutan Akuades 0,5 ml
Tuak (alkohol 20 %) 0,5 ml
Tuak (alkohol 20%) 0,5 ml Vitamin E 0,5 ml (0,33 mg)
Tuak (alkohol 20%) 0,5 ml Tuak (alkohol 20%) 0,5 ml Vitamin E 0,5 ml (0,33mg)
Vitamin E 0,5 ml (0,33 mg) Tuak (20%) 0,5 ml Larutan Akuades 0,5 ml
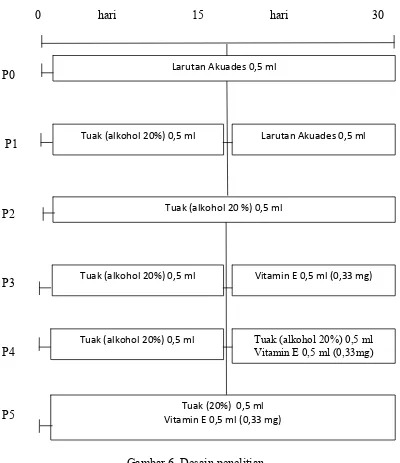
Gambar 6. Desain penelitian
Perlakuan dalam penelitian diberikan sebagai berikut
a. P0 = kelompok kontrol terdiri dari 5 ekor yang diberi akuades 0,5 ml
selama 30 hari.
b. P1 = Kelompok perlakuan I terdiri dari 5 ekor yang diberi tuak dipasaran
setiap pagi 0,5 ml/ekor secara oral selama 15 hari kemudian 15 hari
c. P2 = Kelompok perlakuan II terdiri 5 ekor yang diberi tuak dipasaran setiap
pagi 0,5 ml /ekor secara oral selama 30 hari.
d. P3 = Kelompok perlakuan III terdiri 5 ekor yang diberi tuak dipasaran setiap
pagi 0,5 ml/ekor selama 15 hari yang diberikan pada pagi hari, selanjutnya
pada hari ke 16 diberi vitamin E sebanyak 0,5 ml (0,33 mg) setiap sore hari
e. P4 = Kelompok perlakuan IV terdiri 5 ekor mencit yang diberi tuak
dipasaran setiap pagi 0,5 ml/ekor selama 30 hari selanjutnya pada hari yang
ke 16 diberikan vitamin E 0,5 ml (0,33 mg) pada sore hari.
f. P5 = Kelompok perlakuan V terdiri 5 ekor mencit yang diberi tuak
dipasaran setiap pagi 0,5 ml/ekor selama 30 hari bersama vitamin E 0,5 ml
(0,33 mg) sore hari
3.3. Alat dan Bahan
Untuk menghitung eritrosit menggunakan kamar hitung (counting
chamber), terbuat dari kaca object yang tebal, rata plat yang ditengah dipakai
untuk menghitung sel-sel darah. Kaca penutup (cover slip) tiap bilik hitung
mempunyai kaca penutup yang khusus yang dipergunakan untuk kamar hitung
tersebut. Pipet pengencer darah, terdiri dari sebuah pipa kapiler yang
mempunyai tanda (angka) ”0,5 dan 1,0” pada salah satu ujungnya membesar
dan sedikit lonjong. Didalam bulatan terdapat sebutir kaca merah untuk
menghitung eritrosit. Cairan pengencer darah, syarat utama cairan pengencer
darah adalah harus isotonis dengan darah, tidak merusak eritrosit dan yang
Untuk menghitung hemoglobin digunakan, tabung reaksi 75x10 mm,
regensia sianida, mikro pipet dan untuk menghitung hematokrit menggunakan
tabung Wintrobe, pipet kapiler dan alat pemutar. Dalam pengamatan morfologi
eritrosit digunakan , kaca objek, bak tempat pewarnaan dan larutan methanol.
3.4. Populasi Penelitian
Hewan coba yang digunakan dalam penelitian ini adalah mencit
jantan (Mus musculus) strain DD Webster, berumur 2 bulan dengan rata-rata
berat badan antara 25 – 30 gram. Hewan coba diperoleh dari unit penelitian
hewan F MIFA Biologi USU Medan. Mencit jantan dewasa merupakan hasil
perbanyakan hewan yang diperoleh sebanyak 30 ekor mencit dipilih dari hasil
perbanyakan untuk keperluan penelitian.
3.5. Dosis
3.5.1. Dosis Tuak
Bagi orang peminum tuak biasanya, meminum tuak di warung-warung
rata-rata 3 – 4 gelas ml/ hari (1000 ml) bagi orang dewasa (rata-rata berat
badan 60 kg (Ikegami, 1997), maka komsumsi rata-rata tuak oleh manusia
setiap hari rata-rata 1000 ml/ 60.000 g berat badan orang dewasa = 0,016
ml/g/ berat badan, maka dosis konversi untuk mencit dengan rata-rata berat
badan 30 g adalah : 0.016 ml x 30 g = 0,48 ml/mencit/hari. Pada penelitian
pendahuluan terhadap kadar alkohol tuak dari 4 jenis tuak diteliti kadar
alkoholnya, maka yang digunakan dalam penelitian ini adalah tuak yang
dipasarkan, yaitu tuak pada hari kedua dengan konsentrasi alkoholnya 20%
3.5.2. Dosis Vitamin E
Vitamin E murni dalam bentuk cair, penentuan dosis vitamin E berdasarkan
dosis per oral pada manusia yang aman untuk dikonsumsi orang dewasa adalah
1000 IU/hari (Baraas dan Jufri, 1999). Rata-rata berat badan orang dewasa 60
kg. Dengan asumsi bahwa 1 IU ( Karyadi 1990 ) = 0,67 mg. Dosis untuk
manusia dewasa adalah 670 mg/60.000 g berat badan =0,011 mg/g berat badan,
maka untuk dosis mencit dengan berat badan rata-rata 30 g adalah =0,011 mg x
30 g berat badan = 0,33 mg/mencit / hari. Vitamin E dilarutkan dengan larutan
akuades menjadi 0,5 ml.
3.6. Pelaksanaan Penelitian
3.6.1. Pemeliharaan Hewan Percobaan.
Mencit ditempatkan di dalam kandang yang terbuat dari bahan plastik
dengan ukuran (panjang 30 cm x lebar 20 x kedalaman10 cm) yang ditutup
dengan kain kasa. Dasar kandang dilapisi dengan sekam padi setebal 0,5 - 1 cm
dan diganti setiap dua hari. Cahaya ruangan dikontrol persis 12 jam terang
(pukul 06.00 sampai dengan pukul 18.00) dan 12 jam gelap (pukul 18.00
sampai dengan pukul 06.00), sedangkan suhu dan kelembaban ruangan
dibiarkan berada pada kisaran alamiah. Pakan (pelet komersial) dan minuman
(air PAM) disuplai setiap hari secara berlebih (ad libitum)
3.6.2. Sampel Darah
Setelah dilakukan perlakuan selama 30 hari, maka satu hari setelah
maupun kelompok perlakuan. Masing- masing hewan coba dikorbankan dengan
cara dislokasi leher, kemudian dibedah dan pengambilan darah dengan spuit 1
ml langsung ke intracardial kemudian dimasukkan ke tabung yang sebelumnya
telah diberi larutan EDTA 1 %. Kemudian disimpan dalam lemari es selama 60
menit. Kemudian dilakukan pengukuran jumlah retikulosit, jumlah eritrosit,
pengamatan morpologi eritrosit, kadar hemoglobin dan nilai hematokrit.
3.6.3. Pemeriksaan Retikulosit
Retikulosit dihitung menggunakan metode pewarnaan supravital. Sampel
darah dicampur dengan larutan brilliant cresyl blue (BCB) atau new methylene
blue maka ribosome akan terlihat sebagai filamen berwarna biru.
Sampel darah yang digunakan untuk menghitung retikulosit adalah darah arteri
dengan antikoagulan EDTA 1 %. Ke dalam tabung masukkan darah dan
pewarna dengan perbandingan 1 : 1, campur baik-baik, dibiarkan selama 15
menit agar pewarnaannya sempurna. Sediaan apus dibuat dari campuran itu,
kemudian biarkan kering di udara. Periksalah di bawah mikroskop dengan
perbesaran 100x. Eritrosit nampak biru muda dan retikulosit akan tampak
sebagai sel yang mengadung granula/filamen yang berwarna biru. Bila kurang
jelas waktu pewarnaannya diperpanjang atau dicat lagi dengan cat Wright.
Selajutnya jumlah retikulosit dalam 1000 sel eritrosit dihitung. Jika kesulitan
menghitung, dilakukan pengecilan medan penglihatan okuler dengan
perhitungan sebagai berikut : Jumlah retikulosit = (jumlah retikulosit per 1000
eritrosit : 10 ) %. (Depkes 1989)
3.6.4. Penentuan Jumlah Eritrosit
Jumlah eritrosit ditentukan dengan menggunakan metode manual. Jumlah
darah dihisap 0,5 skala dengan menggunakan pipet Thoma (pipet eritrosit)
kemudian reagensia Hayem dihisap sampai angka 101 lalu dicampur dengan
cara menggoyang pipet hingga rata. Darah yang melekat pada ujung pipet
bersihkan dengan kapas. Lalu Kamar hitung (counting chamber) ditutup
dengan cover glass. Kemudian biarkan selama 5 menit di atas kamar hitung
dan setelah itu diamati di bawah mikroskop dengan pembesaran 40 X lalu
dihitung jumlah eritrosit pada bagian kotak yang lebih kecil dari arah A, lalu
ke B, lanjut C kemudian D dan terakhir E. Setiap eritrosit yang dilihat
dihitung dengan bantuan mengklik Laboratory Counter untuk menghindari
kesalahan penghitungan dan hasilnya ditulis (Depkes 1989).
3.6.5. Pengamatan Morfologi Eritrosit
Pengamatan morfologi eritrosit ditentukan berdasarkan apusan darah .
Darah dituangkan satu tetes kecil pada kaca objek 2 - 3 mm dari ujung kaca
objek. Lalu diletakkan kaca penghapus dengan sudut 45 derajat terhadap kaca
objek di atas tetes darah. Kemudian ditarik kaca penghapus ke belakang
sehingga menyentuh tetes darah dan ditunggu sampai darah menyebar pada
sudut kiri dan kanan kaca objek tersebut. Setelah itu kaca penghapus didorong
kemudian biarkan hapusan darah hingga kering. Setelah itu sediaan hapusan
diletakkan di atas bak tempat pewarnaan. Kemudian sediaan hapusan difiksasi
dengan larutan metanol selama 2 - 3 menit. Setelah itu sediaan hapusan
digenangi dengan zat warna Giemsa 5%. Kemudian dibiarkan selama 20 -30
menit. Setelah itu dibilas dengan air keran, mula-mula dengan aliran lambat
kemudian lebih deras dengan tujuan menghilangkan semua kelebihan zat warna.
Lalu dibiarkan hingga kering dan setelah itu dilihat morfologi eritrosit di
bawah mikroskop cahaya dengan pembesaran 800 kali kemudian dihitung
jumlah eritrosit yang normal (Depkes, 1989). Dengan mikroskop eritrosit
akan tampak bulat. Pemeriksaan kelainan morfologi eritrosit meliputi
bentuknya (seperti cakram dengan ketebalan 1,5 - 2,5 µm) bagian tengah lebih
tipis daripada tepinya , ukuran diameter 5 - 7 µm dan tidak berinti (Depkes,
1989). Sampel dari setiap kelompok berjumlah 4 ekor mencit, setiap mencit
dibuat satu slide apusan darah. Untuk pengamatan morfologi dilakukan 4
lapangan pandang untuk setiap slide.
Cara penentuan hasil :
Morfologi abnormal: dihitung 100 sel eritrosit dan diantara yang 100
tersebut berapa sel yang morfologinya abnormal/100 dan dikali 100%, %
morfologi sel eritrosit abnormal = (sel eritrosit abnormal/100 sel darah merah) x
3.6.6. Pemeriksaan Kadar Hemoglobin
Pemeriksaan kadar hemaglobin dilakukan dengan menggunakan metode
sianmethomoglobin secara ringkas, diambil tabung reaksi 75 x 10 mm lalu
kedalamnya dimasukkan 5 ml regensia sianida dengan menggunakan pipet,
kemudian tambahkan 20 µl sampel darah. Setelah itu campurkan, bagian
mikropipet dibersihkan dengan tissue. Kemudian campurkan isinya hingga
merata dan biarkan pada suhu kamar selama 3- 5 menit. Setelah itu serapannya
dibaca dalam spektrofotometri pada panjang gelombang 540 nm dengan sianida
sebagai blangko, lalu kadar hemoglobin dibaca pada kurva kalibrasi (Soewoto
et al, 2001).
3.6.7. Penentuan Nilai Hematokrit
Darah dihisap dengan hematokrit kapiler dari tabung mikrotube ¾ dari
hematokrit kapiler tersebut. Setelah itu masukkan cairan pengencer
Natrium-oxalat 1,65% diisap sampai memenuhi separoh bola. Kemudian tabung ditutup
dengan ban karet yang khusus untuk itu. Lalu hematokrit kapiler dimasukkan
ke dalam hematokrit sentrifuge dengan bagian yang tersumbat mengarah ke
luar. Setelah itu hematokrit kapiler tersebut diputar selama 5 menit dengan
kecepatan 10.000 rpm. Kemudian catat tinggi volume eritrosit yang
dimaanfaatkan dan tinggi total volume darah pada pipet hematokrit. Penentuan
nilai hematokrit dibaca dengan perhitungan:
3.7. Pengukuran Kadar Alkohol Pada Tuak
Pemeriksaan ini menggunakan sampel tuak yang beredar di pasaran
yang di ambil dari satu sumber yang beredar di kota Medan. Sampel yang
diambil sebanyak 500 ml untuk setiap jenis sampel tuak yang ada kemudian di
ambil 100 ml untuk dipreparasi.
1. Preparasi sampel
Diambil 100 ml sampel menggunakan pipet volume dan dimasukkan ke
dalam labu alas bulat 250 ml di tambah 50 ml akuades, kemudian di destilasi.
Hasil destilasi ditampung pada labu ukur 100 ml hingga volume 90-95 ml
(Bowman dan Rand, 1980)
2. Validasi Metode Kromatografi Gas
a. Pembuatan seri larutan baku etanol.
Disiapkan seri baku dengan konsetrasi berikut:
Etanol p.a. (ml) n-butanol (ml) Konsentrasi akhir etanol % (v/v)
Etanol p.a. dan n-butanol dengan jumlah seperti tertulis di atas dimasukkkan
ke dalam labu ukur 100 ml.Volume 100,0 ml dicapai dengan penambahan
b. Pembuatan kurva baku etanol.
Satu mikroliter (1µl) larutan baku dari masing-masing konsentrasi
disuntikkan ke dalam kolom. Luas puncak etanol dan n-butanol dari
kromatogram dihitung,kemudian dicari rasio luas puncak etanol/n-butanol.
Kurva baku dibuat dengan memplotkan rasio luas puncak etanol/n-butanol vs
kadar etanol (% v/v). Persamaan kurva baku dicari denga regresi linear.
c. Penentuan recovery, kesalahan sistemik dan kesalahan acak.
Diambil 1 µl larutan etanol dengan kadar 0,1;0,2;0,3;dan 0,4 ml/100,0 ml
dan disuntikkan ke dalam kolom. Luas puncak etanol dan n-butanol dari
kromatogram dihitung, kemudian dicari rasio luas puncak etanol/n-butanol.
Kadar dihitung dengan persamaan regresi linier.
Recovery, kesalahan sistemik dan acak dihitung dengan rumus sebagai
berikut:
Recovery = x 100 %
Kesalahan Sistemik = 100% - recovery
Kasalahan acak = x 100 %
d. Pengukuran Kadar Etanol Dengan Metode Kromatografi Gas
Larutan sampel minuman tuak yang telah didestilasi masing-masing diambil
0,1 ml menggunakan micropipet dan dimasukkan ke dalam labu ukuran 50
ml, kemudian ditambah 0,1 ml n-butanol dan diencerkan dengan akuades.
tempat injeksi. Luas puncak etanol dan n-butanol dari kromatogram dihitung,
kemudian dicari rasio luas puncak etanol dan n-butanol. Kadar etanol dalam
minuman tuak ditentukan dengan persamaan kurva baku. Metode ini
dilakukan pada setiap sampel tuak yang telah di destilasi untuk menentukan
kadar etanolnya. Prosedur di atas dilakukan selama 3 hari berturut-turut
untuk melihat tingkat kadar etanol di dalam nira aren asli, nira + raru, tuak
asli dan tuak yang di pasaran.
3.8. Analisis Data
Semua data dipresentasikan dalam bentuk rata-rata ± simpangan baku
X SD
. Dilakukan uji normalitas dan homogenitas, dari hasil penelitian didapatkan data dengan distribusi normal dan variansi datanya tidak homogen,sehingga dilakukan uji dengan analisis Non Parametrik Kruskal Wallis. Bila
terdapat perbedaan nyata maka dilakukan uji lanjut Mann Witney untuk
melihat perbedaan masing-masing kelompok perlakuan yang ada. Bila data
berdistribusi normal dan variasi datanya homogen diuji dengan analisis
Parametrik Anova pada taraf 5% dan untuk melihat perbedaan masing-masing
perlakuan dilakukan uji lanjut post hoc Bonferroni.
BAB IV
HASIL DAN PEMBAHASAN
4.1. Hasil Penelitian
Hasil penelitian ditampilkan dalam bentuk grafik histogram dari
rata-rata data hasil analisis yang dilakukan selama 30 hari. Urutan tampilan hasil
dan pembahasan dari penelitian ini adalah : (1) Persentase retikulosit, (2)
Jumlah eritrosit, (3) Persentase morpologi eritrosit abnormal, (4) kadar
hemaglobin, (5) nilai hematokrit pada darah mencit yang diberi tuak.
4.1.1. Sel Darah Merah Muda ( Retikulosit)
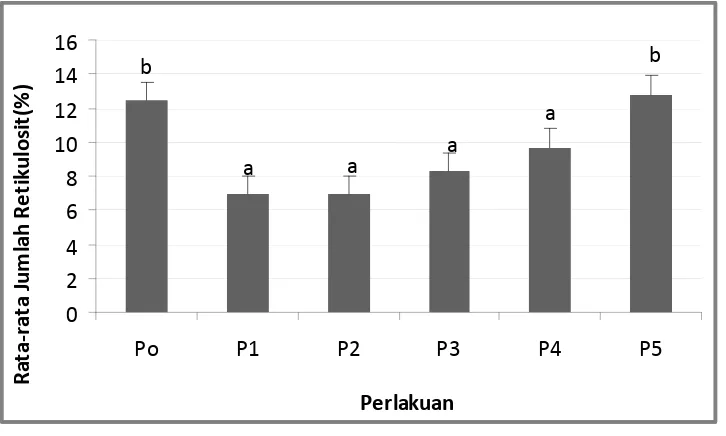
Hasil pengukuran jumlah retikulosit mencit setelah perlakuan terdapat
pada Gambar 7. Setelah dilakukan uji normalitas dan homogenitas data rata-rata
jumlah eritrosit mencit, maka didapatkan bahwa data tidak berdistribusi normal
dan variansi datanya tidak homogen. Oleh sebab itu dilakukan transformasi
data dan diuji kembali distribusi dan variansi datanya. Tetapi distribusi dan
variansi datanya masih tetap tidak homogen. Maka data tersebut diuji dengan
analisis non parametrik Kruskal Wallis. Hasilnya menunjukkan bahwa ada
perbedaan yang nyata (p<0,05; antara perlakuan dalam penelitian (P0, P1, P2,
P3, P4 dan P5). Sehingga dilakukan uji lanjut Mann Whitney untuk menentukan
perbedaan pada antara masing-masing perlakuan. Perbedaan tersebut kemudian
dilambangkan dengan notasi huruf kecil. Apabila terjadi perbedaan yang nyata
berarti notasinya dilambangkan dengan huruf kecil yang berbeda. Sedangkan
b
Gambar 7. Rata-rata jumlah (±SD) retikulosit darah mencit jantan setelah perlakuan. Huruf yang berbeda di atas histogram menunjukkan berbeda secara signifikan (Distribusi, homogenitas non parametrik Kruskal Wallis dan Mann Whitney).
Keterangan:
P0 = diberi akuades 0,5 ml selama 30 hari,
P1 = diberi tuak (alkohol 20%) 0,5 ml selama 15 hari pertama dan diberi akuades 0,5 ml pada 15 hari berikutnya
P2 = diberi tuak (alkohol 20%) 0,5 ml selama 30 hari.
P3 = diberi tuak (alkohol 20%) 0,5 ml selama 15 hari pertama dan 15 hari selanjutnya diberi vitamin E 0,33 ml
P4 = diberi tuak (alkohol 20%) 0,5 ml selama 30 hari dan hari ke 16 sampai
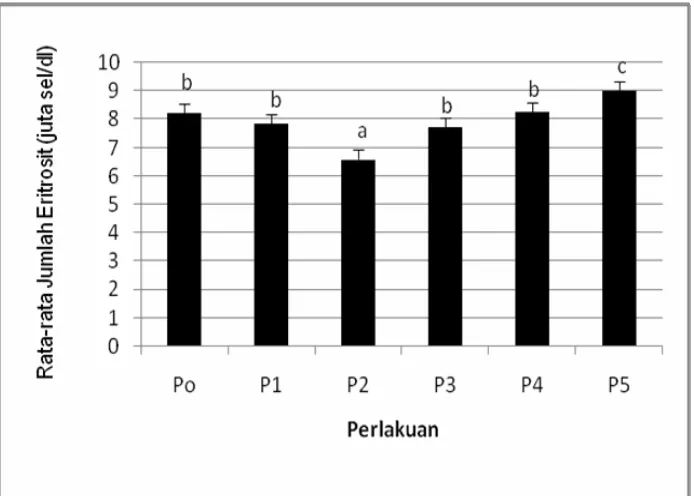
Hasil rata-rata jumlah eritrosit mencit jantan (Mus musculus L.) strain
DD Webster setelah diberi perlakuan pemberian tuak 0,5 ml dan Vitamin E
0,33 mg selama 15 dan 30 hari ditunjukkan pada Gambar 8. Hasil analisis
terhadap rata-rata retikulosit menunjukkan retikulosit berdistribusi normal dan
parametrik Anova pada taraf 5%. Hasilnya menunjukkan bahwa ada perbedaan
yang nyata (p<0,05), antara tiap perlakuan penelitian (P0, P1, P2, P3, P4 dan
P5). Sehingga dilakukan uji lanjut post hoc Bonferroni untuk menentukan
perbedaan antara masing-masing perlakuan.
Gambar 8. Rata-rata jumlah (±SD) eritrosit darah mencit jantan setelah perlakuan. Huruf yang berbeda di atas histogram menunjukkan berbeda secara signifikan (Analisis parametrik Anova pada taraf 5% dan post hoc Bonferroni).
Keterangan:
P0 = diberi akuades 0,5 ml selama 30 hari,
P1 = diberi tuak (alkohol 20%) 0,5 ml selama 15 hari pertama dan diberi akuades 0,5 ml pada 15 hari berikutnya
P2 = diberi tuak (alkohol 20%) 0,5 ml selama 30 hari.
P3 = diberi tuak (alkohol 20%) 0,5 ml selama 15 hari pertama dan 15 hari selanjutnya diberi vitamin E 0,33 ml
P4 = diberi tuak (alkohol 20%) 0,5 ml selama 30 hari dan hari ke 16 sampai ke 30 ditambah vitamin E 0,33 mg
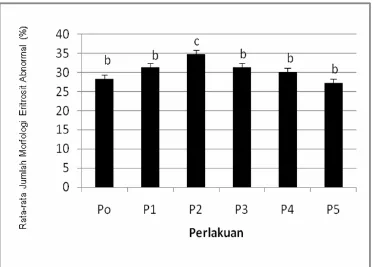
4.1.3. Jumlah Morfologi Abnormal
Hasil rata-rata persentase morfologi eritrosit abnormal pada mencit
jantan (Mus musculus L.) strain DD Webster setelah diberi perlakuan
pemberian tuak 0,5 ml dan Vitamin E 0,33 mg selama 15 dan 30 hari
ditunjukkan pada Gambar 9. Hasil analisis terhadap rata-rata persentase
morfologi abnormal, menunjukan bahwa berdistribusi normal dan memiliki
varian homogen. Oleh karena itu data tersebut diuji dengan analisis parametrik
Anova pada taraf 5%. Hasilnya menunjukkan bahwa ada perbedaan yang nyata
(p<0,05), antara tiap perlakuan penelitian (P0, P1, P2, P3, P4 dan P5). Sehingga
dilakukan uji lanjut uji post hoc Bonferroni untuk melihat perbedaan
masing-masing perlakuan, terlihat bahwa semua perlakuan berpengaruh signifikan
terhadap rata-rata persentase morfologi abnormal. Membuktikan bahwa
persentase morpologi eritrosit abnormal setelah perlakuan pemberian vitamin E
lebih rendah dari sebelum pemberian vitamin E. Perbedaan tersebut kemudian
dilambangkan dengan notasi huruf kecil. Apabila terjadi perbedaan yang nyata
berarti notasinya dilambangkan dengan huruf kecil yang berbeda. Sedangkan
Gambar 9. Rata-rata jumlah (±SD) morfologi abnormal darah mencit jantan setelah perlakuan. Huruf yang berbeda di atas histogram menunjukkan berbeda secara signifikan (Analisis parametrik Anova pada taraf 5% dan post hoc Bonferroni).
Keterangan:
P0 = diberi akuades 0,5 ml selama 30 hari,
P1 = diberi tuak (alkohol 20%) 0,5 ml selama 15 hari pertama dan diberi akuades 0,5 ml pada 15 hari berikutnya
P2 = diberi tuak (alkohol 20%) 0,5 ml selama 30 hari.
P3 = diberi tuak (alkohol 20%) 0,5 ml selama 15 hari pertama dan 15 hari selanjutnya diberi vitamin E 0,33 ml
P4 = diberi tuak (alkohol 20%) 0,5 ml selama 30 hari dan hari ke 16 sampai ke 30 ditambah vitamin E 0,33 mg
P5 = diberi tuak (alkohol 20%) 0,5 ml dan vitamin E 0,33 mg selama 30 hari.
c
b
a
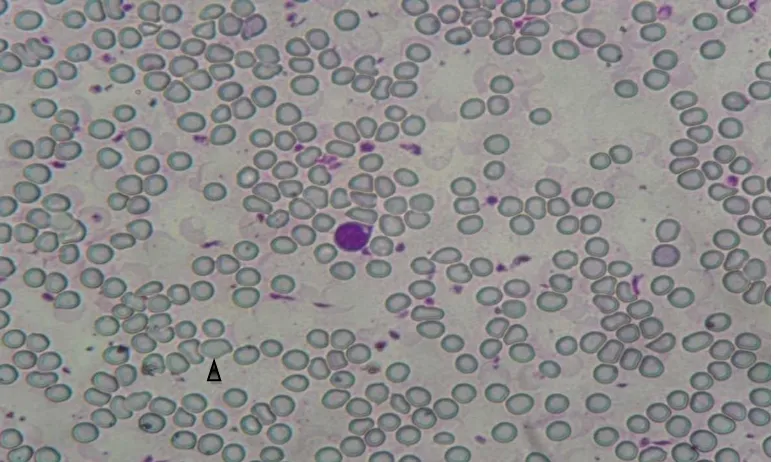
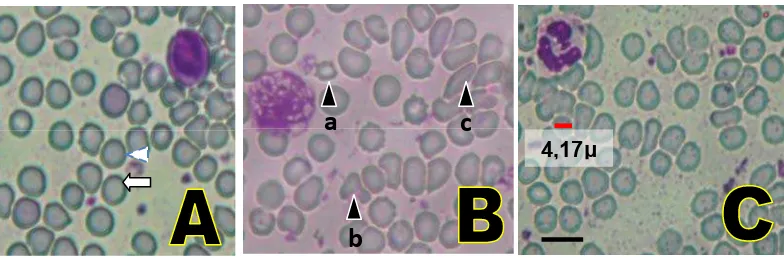
Gambar 10. Gambar morfologi dan ukuran sel darah merah dengan pembesaran 800x dengan pewarnaan Giemsa pada mencit jantan setelah perlakuan, (A) Bentuk darah yang normal, oval ( ) dari slide Po sebagai kontrol; (B) bentuk darah yang abnormal; a. bulat atau oval dengan diameter <5 μm), b. tidak beraturan, c. pipih (▲)dari slide P2; (C) Contoh ukuran yang tidak normal ( = 4,17 μm) dari slide P3.
4,17μ
4.1.4. Kadar Hemoglobin
Data pengukuran kadar hemaglobin pada mencit jantan (Mus musculus
L.) strain DD Webster setelah diberi perlakuan pemberian tuak 0,5 ml dan
Vitamin E 0,33 mg selama 15 dan 30 hari ditunjukkan pada Gambar 11. Setelah
dilakukan uji normalitas dan homogenitas data rata-rata kadar hemaglobin,
maka didapatkan bahwa data berdistribusi normal dan variansi datanya
homogen. Oleh sebab itu data tersebut dapat diuji dengan analisis parametrik
Anova pada taraf 5 %. Hasilnya menunjukkan bahwa ada perbedaan yang nyata
(p<0,05), antara perlakuan dalam penelitian (P0, P1, P2, P3, P4 dan P5).
Sehingga dilakukan post hoc Bonferroni untuk melihat perbedaan
masing-masing perlakuan penelitian. membuktikan bahwa semua perlakuan
berpengaruh signifikan terhadap kualitas hemoglobin mencit jantan. Dengan
demikian dapat disimpulkan bahwa pemberian vitamin E berpengaruh secara
Gambar 11. Rata-rata kadar hemoglobin (±SD) pada mencit jantan setelah perlakuan. Huruf yang berbeda di atas histogram menunjukkan berbeda secara signifikan (Analisis parametrik Anova pada taraf 5% dan post hoc Bonferroni).
Keterangan:
P0 = diberi akuades 0,5 ml selama 30 hari,
P1 = diberi tuak (alkohol 20%) 0,5 ml selama 15 hari pertama dan diberi akuades 0,5 ml pada 15 hari berikutnya
P2 = diberi tuak (alkohol 20%) 0,5 ml selama 30 hari.
P3 = diberi tuak (alkohol 20%) 0,5 ml selama 15 hari pertama dan 15 hari selanjutnya diberi vitamin E 0,33 ml
P4 = diberi tuak (alkohol 20%) 0,5 ml selama 30 hari dan hari ke 16 sampai ke 30 ditambah vitamin E 0,33 mg
P5 = diberi tuak (alkohol 20%) 0,5 ml dan vitamin E 0,33 mg selama 30 hari.
4.1.5. Nilai Hematokrit
Hasil pengukuran jumlah hematokrit mencit setelah perlakuan terdapat
pada Gambar 12. Setelah dilakukan uji normalitas dan homogenitas data
rata-rata jumlah eritrosit mencit, maka didapatkan bahwa data tidak berdistribusi
normal dan variansi datanya tidak homogen. Oleh sebab itu dilakukan
transformasi data dan diuji kembali distribusi dan variansi datanya. Tetapi