M
PRO
MARGARE
OGRAM M F UNIVE
TESI
Oleh ETTA JUL
127001003
MAGISTER FAKULTAS ERSITAS S
M E 2 IS
h :
LIANA TA 3/AET
R AGROEK S PERTAN SUMATER E D A N
2015
ARIGAN
KOTEKNO NIAN RA UTARA
OLOGI
Amplified Polymorphism DNA) Nama Mahasiswa : Margaretta Juliana Tarigan
NIM : 127001003
Program Studi : Magister Agroekoteknologi
Menyetujui Komisi Pembimbing
Dr. Ir. Lollie Agustina P. Putri, MSi Ketua
Ir. Revandy I. M. Damanik, MSi, MSc, Ph.D. Anggota
Ketua Program Studi
Prof. Dr. Ir. Abdul Rauf,MP
Dekan
Prof. Dr. Ir. Darma Bakti, MS
PANITIA PENGUJI TESIS
Ketua : Dr. Ir. Lollie Agustina P. Putri, Msi
Anggota : 1. Ir. Revandy I. M. Damanik, MSi, MSc, Ph.D. 2. Prof. Dr. Ir. Rosmayati Tanjung, MS.
ANALISIS KERAGAMAN BEBERAPA GENOTIPE TANAMAN TEBU (Saccharum spp.) di SUMATERA UTARA BERDASARKAN MARKA
RAPD (Random Amplified Polymorphism DNA)
Dengan ini penulis menyatakaan bahwa tesis ini disusun sebagai syarat untuk memperoleh gelar Magister Pertanian pada Program Studi Magister Agroekoteknologi Fakultas Pertanian Universitas Sumatera Utara adalah benar merupakan karya penulis sendiri.
Adapun pengutipan – pengutipan yang penulis lakukan pada bagian – bagian tertentu dari hasil karya orang lain dalam penulisan tesis ini, telah penulis cantumkan sumbernya secara jelas sesuai denga norma, kaidah dan etika penulisan ilmiah.
Apabila di kemudian hari ternyata ditemukan seluruh atau sebagian tesis ini bukan hasil karya penulis sendiri atau adanya plagiat dalam bagian – bagian tertentu, penulis bersedia menerima sanksi – sanksi lainnya sesuai dengan peraturan perundang – undangan yang berlaku.
Medan, 4 Pebruari 2015 Penulis
MARGARETTA JULIANA TARIGAN. Analisis Keragaman Beberapa Genotipe Tanaman Tebu (Saccharum spp.) di Sumatera Utara Berdasarkan Marka RAPD (Random Amplified Polymorphism DNA). Dibimbing oleh LOLLIE AGUSTINA P. PUTRI dan REVANDY I. M. DAMANIK.
Tujuan penelitian adalah untuk mengetahui keragaman genetik dan pola kekerabatan beberapa genotipe tebu di Sumatera Utara berdasarkan marka RAPD. Penelitian ini dilaksanakan pada bulan April sampai dengan bulan Oktober 2014 di Laboratorium Terpadu Fakultas Kedokteran Universitas Sumatera Utara Medan. Hasil penelitian menunjukkan bahwa ada 30 aksesi tanaman tebu di Sumatera Utara yang dianalisis keragaman dan kekerabatan materi genetiknya berdasarkan marka RAPD. Berdasarkan skrining primer yang digunakan sebanyak 13, ternyata 10 primer dapat mengamplifikasi template DNA dan menghasilkan fragmen DNA yang reproduktif. Dihasilkan total pita sebanyak 64 dan diskoring dengan menggunakan 10 primer dimana pita polimorfik diperoleh sebanyak 61 pita. Jumlah pita yang dihasilkan per primer berkisar 4 – 9 pita sedangkan ukuran pita berkisar antara 218 -2931 bp. Rataan persentase polimorphik dan Polymorphic Information Content (PIC) ke-10 primer yang digunakan masing – masing adalah 95,14 % dan 0,392. Analisa jarak genetik dan dendogram menggunakan Software Darwin 5.05. Koefisien kemiripan Dice digunakan untuk membentuk dendogram. Dari hasil analisis jarak genetik dan dendogram, 30 aksesi tebu Sumatera Utara dikelompokkan menjadi 3 cluster. Koefisien jarak genetik berkisar 0,063 (BZ 134 Tanjung Jati dan BZ 134 Hamparan Perak) - 0,778 (Berastagi Berastagi dan Cenning).
MARGARETTA JULIANA TARIGAN. North Sumatra’s Diversity Analysis of Some Sugarcane (Saccharum spp.) Genotypes Based on RAPD Markers (Random Amplified Polymorphism DNA). Supervised by LOLLIE AGUSTINA P. PUTRI and REVANDY IM DAMANIK.
The objective of research was to determine the genetic diversity and patterns of genetic relationship several genotypes of sugarcane in North Sumatra based on RAPD markers . This study was conducted from April to October 2014 in Integrated Laboratory Faculty of Medicine, University of North Sumatra, Medan. The results showed that there were 30 accessions of sugarcane in North Sumatra diversity and analyzed genetic material based on RAPD markers. Total number of primers used are 13 primers but only 10 primers can amplify the DNA template and produce reproductive DNA fragments. Total band produced is 64 and scored by using 10 primers which obtained 61 polymorphic bands . The number of bands produced per primer ranged 4-9 and the band size ranges between 218 -2931 bp. Polymorphic percentage mean and Polymorphic Information Content (PIC) of - 10 primers used respectively is 95.14 % and 0.392 .Analysis of genetic distance and dendogram using Software Darwin 5.05. Dice similarity coefficient is used to form the dendogram. From the analysis of genetic distance and dendogram, 30 accessions of sugarcane North Sumatra grouped into 3 clusters . The coefficient of genetic distances ranging from 0.063 (BZ 134 Tanjung Jati and BZ 134 Hamparan Perak) - 0.778 ( Berastagi Berastagi and Cenning).
Keywords : Sugarcane, Genotype, RAPD, DNA , Diversity.
Puji dan syukur penulis ucapkan kehadirat Tuhan Yang Maha Kuasa atas berkat dan karuniaNya sehingga penulis dapat menyelesaikan tesis program studi Agroekoteknologi, Sekolah Pascasarjana Pertanian Universitas Sumatera Utara, Medan.
Pada kesempatan ini penulis mengucapkan terima kasih yang sebesar besarnya kepada:
1. Ibu Dr. Ir. Lollie Agustina P.Putri, M.Si selaku ketua komisi pembimbing dan Bapak Ir. Revandy I.M. Damanik, MSi, MSc, Ph.D. selaku anggota komisi pembimbing yang telah banyak memberikan motivasi, masukan, bimbingan dan saran baik sewaktu penelitian maupun saat penyelesaian tesis ini.
2. Ibu Prof. Dr. Ir. Rosmayati, MS dan Bapak Luthfi A.M. Siregar,SP. MSc. Ph.D. selaku komisi penguji pada ujian akhir tesis, serta dosen Program Studi Agroekoteknologi atas ilmu dan pengetahuan yang diberikan selama menempuh pendidikan.
3. Rektor Universitas Sumatera Utara Bapak Prof. Dr. dr. Syahril Pasaribu, DTM&H,M.Sc (CTM),SP.A (K)., Direktur Pasca Sarjana USU Bapak Prof. Dr. Ir. A. Rahim Matondang, MSIE, Dekan Fakultas Pertanian USU Bapak Prof. Dr. Ir. Darma Bakti, MS dan Ketua Program Studi Agroekoteknologi Bapak Prof. Dr. Ir. Abdul Rauf, MP atas kesempatan yang diberikan untuk mengikuti studi di program pasca Sarjana Pertanian di USU.
6. PT. Perkebunan Nusantara II Riset Pengembangan Tebu Sei Semayang atas izin untuk pengambilan sampel bahan tanaman di Kebun Koleksi Sei Semayang dan Tanjung Jati.
7. Ibu dr. Tetty Aman Nasution selaku Kepala Laboratorium Terpadu Fakultas Kedokteran USU beserta staf (Bu Mardiyah, Pak Indra, Bu Eli) yang telah memberikan izin serta bantuan didalam pelaksanaan praktek penelitian
8. Ayahanda Alm. Tuah Naman Tarigan dan Ibunda Renda Sembiring atas kasih sayang, doa, dan dukungan serta abang, adik dan keponakan saya yang menjadi penyemangat selama ini.
9. Ayah mertua Ir. W. Kaban dan Ibu mertua E. Tarigan, kakak dan adik ipar serta keponakan atas doa dan dukungannya bagi penulis.
10. Suamiku tercinta Mahaenca Cio Kaban, ST yang telah memberi izin dan kesempatan serta dukungan bagi penulis untuk melanjutkan pendidikan Program Pascasarjana (S2).
11. Teman-teman AET angkatan 2012 (Cimoth, Dame, Ariani, Deden, Nani, Rini, Makruf, Hadi, Lentina, dll) dan semua pihak yang telah membantu dalam penyelesaian pendidikan, penelitian dan penulisan tesis ini yang tidak dapat penulis sebutkan satu persatu.
Kiranya tesis ini bermanfaat bagi kemajuan ilmu pengetahuan dan pengembangan tebu di Sumatera Utara.
Medan, Pebruari 2015
Penulis dilahirkan di Pematangsiantar pada tanggal 19 Juli 1979, merupakan anak kedua dari empat bersaudara dari pasangan Alm. Bapak Tuah Naman Tarigan dan Ibu Renda Sembiring.
Penulis menyelesaikan pendidikan Sekolah Dasar (SD) di SD Kalam Kudus P. Siantar pada tahun 1992 dan Sekolah Menengah Pertama di SMP Sultan Agung P. Siantar pada tahun 1995. Pada tahun 1998 penulis menyelesaikan pendidikan Sekolah Menengah Umum di SMU Sultan Agung P. Siantar. Selanjutnya pada tahun 1998 melanjutkan kuliah Strata I di Fakultas Pertanian Universitas Sumatera Utara jurusan Ilmu Tanah dan selesai pada tahun 2003.
Pada tahun 2005 penulis diterima sebagai staf Pengawas Benih Tanaman di Direktorat Jenderal Perkebunan, Kementerian Pertanian dan ditempatkan di Balai Besar Perbenihan dan Proteksi Tanaman Perkebunan Surabaya dan mutasi ke instansi yang sama di Medan pada tahun 2008 hingga berkesempatan melanjutkan pendidikan Pasca Sarjana di Fakultas Pertanian Universitas Sumatera Utara pada bulan September 2012.
Puji dan syukur Penulis ucapkan kepada Tuhan Yang Maha Esa dimana atas berkat dan rahmatNyalah Penulis dapat menyelesaikan Usulan Penelitian Tesis ini tepat pada waktunya.
Adapun judul dari Tesis ini adalah “Analisis Keragaman Beberapa Genotipe Tanaman Tebu (Saccharum spp.) di Sumatera Utara Berdasarkan Marka RAPD (Random Amplified Polymorphism DNA) ” yang merupakan salah satu syarat untuk mendapatkan gelar Magister Pertanian di Sekolah Pasca Sarjana Fakultas Pertanian Universitas Sumatera Utara Medan.
Pada kesempatan ini Penulis mengucapkan terimakasih kepada Ibu Dr. Ir. Lollie Agustina P. Putri, Msi selaku ketua pembimbing dan Bapak Ir. Revandy I. M. Damanik, MSi, MSc, Ph.D selaku anggota pembimbing saya yang telah banyak memberikan masukan dan membimbing saya untuk menyelesaikan tesis ini. Penulis juga tidak lupa mengucapkan terimakasih kepada pihak yang telah membantu Penulis dalam menyelesaikan tesis ini.
Akhir kata Penulis mengucapkan banyak terimakasih dan semoga Tesis ini dapat bermanfaat bagi kita semua.
Medan, Pebruari 2015
PERNYATAAN……….. i
ABSTRAK………... ii
UCAPAN TERIMA KASIH ………... iv
RIWAYAT HIDUP ……… vi
KATA PENGANTAR... vii
DAFTAR ISI... viii
DAFTAR TABEL ... x
DAFTAR GAMBAR ... xi
DAFTAR LAMPIRAN ... xii
PENDAHULUAN... 1
Latar Belakang... 1
Tujuan Penelitian... 3
Hipotesis Penelitian………. 3
Manfaat Penelitian... 3
TINJAUAN PUSTAKA …... 4
Tanaman Tebu (Saccharum officinarum L.)... 4
Daerah Asal ... 11
Keragaman Genetik Tebu ... 12
Kultivar Tebu di Sumatera Utara ... 14
Varietas dan Klon Tebu di Sumatera Utara...……….. 16
Marka Molekuler…... 17
Polimerase Chain Reaction (PCR) Berbasis Marka... 18
Marker Randomly Amplified Polymorphic DNA (RAPD)... 19
Marka Molekuler RAPD pada Tebu (Saccharum officinarum L.)……….. 21 BAHAN DAN METODE PENELITIAN ...
Tempat dan Waktu ... Bahan dan Alat... Pelaksanaan Penelitian... Pengkoleksian Sampel ………... Isolasi DNA………... Uji Kualitas DNA………... Amplifikasi/Genotyping………... Elektroforesis………...
Hasil……… 32
Pembahasan………. 44
KESIMPULAN DAN SARAN ... 49
Kesimpulan………... 49
Saran……… 50
DAFTAR PUSTAKA... 51
HAL.
HAL.
Gambar 1. Batang tebu ... 5
Gambar 2. Akar tebu ... 5
Gambar 3. Daun tebu ... 6
Gambar 4. Bunga tebu ... 6
Gambar 5. Biji tebu ... 7
Gambar 6. Profil kualitas DNA genotip tebu dengan gel agarose sebesar 0.8% ……….. 32
Gambar 7. Profil PCR primer OPA-02……….. 35
Gambar 8. Profil PCR primer OPA-08……….. 35
Gambar 9. Profil PCR primer OPB-11……….. 36
Gambar 10. Profil PCR primer OPB-17……… 36
Gambar 11. Profil PCR primer OPC-07……….... 37
Gambar 12. Profil PCR primer OPC-15……….... 37
Gambar 13. Profil PCR primer OPD-05..……….. 38
Gambar 14. Profil PCR primer OPE-04…..……….. 38
Gambar 15. Profil PCR primer OPH-06…..……….. 39
Gambar 16. Profil PCR primer OPI-20……….. 39 Gambar 17. Dendrogram 30 tanaman tebu hasil analisis kelompok
berdasarkan pola pita DNA dari sepuluh marka RAPD. Angka – angka pada garpu merupakan persentase tingkat kepercayaan pengelompokan dengan analisis bootstrap 1000 kali dengan program DARwin …………
41
Gambar 18. Faktorial analisis (Principal Coordinate Analysis) aksis 1 (horizontal) dan aksis 2 (vertikal) dengan 10 marka RAPD ………
42 Gambar 19. Profil Radial Neighbour-Joining dari 30 aksesi tebu yang
berasal dari varietas, tebu lokal, tipe liar dan klon di daerah Sumatera Utara yang dianalisis berdasarkan
Matrix Dissimilarity Simple Matching ………..
HAL.
Lamp. 1. Data ketidaksamaan 30 aksesi Saccharum spp. Sumatera
Utara ..……….……….. 57
Lamp. 2. Deskripsi pembuatan larutan stok………...……… 58
Lamp. 3. Peta pengambilan sampel tanaman tebu……...……… 62
MARGARETTA JULIANA TARIGAN. Analisis Keragaman Beberapa Genotipe Tanaman Tebu (Saccharum spp.) di Sumatera Utara Berdasarkan Marka RAPD (Random Amplified Polymorphism DNA). Dibimbing oleh LOLLIE AGUSTINA P. PUTRI dan REVANDY I. M. DAMANIK.
Tujuan penelitian adalah untuk mengetahui keragaman genetik dan pola kekerabatan beberapa genotipe tebu di Sumatera Utara berdasarkan marka RAPD. Penelitian ini dilaksanakan pada bulan April sampai dengan bulan Oktober 2014 di Laboratorium Terpadu Fakultas Kedokteran Universitas Sumatera Utara Medan. Hasil penelitian menunjukkan bahwa ada 30 aksesi tanaman tebu di Sumatera Utara yang dianalisis keragaman dan kekerabatan materi genetiknya berdasarkan marka RAPD. Berdasarkan skrining primer yang digunakan sebanyak 13, ternyata 10 primer dapat mengamplifikasi template DNA dan menghasilkan fragmen DNA yang reproduktif. Dihasilkan total pita sebanyak 64 dan diskoring dengan menggunakan 10 primer dimana pita polimorfik diperoleh sebanyak 61 pita. Jumlah pita yang dihasilkan per primer berkisar 4 – 9 pita sedangkan ukuran pita berkisar antara 218 -2931 bp. Rataan persentase polimorphik dan Polymorphic Information Content (PIC) ke-10 primer yang digunakan masing – masing adalah 95,14 % dan 0,392. Analisa jarak genetik dan dendogram menggunakan Software Darwin 5.05. Koefisien kemiripan Dice digunakan untuk membentuk dendogram. Dari hasil analisis jarak genetik dan dendogram, 30 aksesi tebu Sumatera Utara dikelompokkan menjadi 3 cluster. Koefisien jarak genetik berkisar 0,063 (BZ 134 Tanjung Jati dan BZ 134 Hamparan Perak) - 0,778 (Berastagi Berastagi dan Cenning).
MARGARETTA JULIANA TARIGAN. North Sumatra’s Diversity Analysis of Some Sugarcane (Saccharum spp.) Genotypes Based on RAPD Markers (Random Amplified Polymorphism DNA). Supervised by LOLLIE AGUSTINA P. PUTRI and REVANDY IM DAMANIK.
The objective of research was to determine the genetic diversity and patterns of genetic relationship several genotypes of sugarcane in North Sumatra based on RAPD markers . This study was conducted from April to October 2014 in Integrated Laboratory Faculty of Medicine, University of North Sumatra, Medan. The results showed that there were 30 accessions of sugarcane in North Sumatra diversity and analyzed genetic material based on RAPD markers. Total number of primers used are 13 primers but only 10 primers can amplify the DNA template and produce reproductive DNA fragments. Total band produced is 64 and scored by using 10 primers which obtained 61 polymorphic bands . The number of bands produced per primer ranged 4-9 and the band size ranges between 218 -2931 bp. Polymorphic percentage mean and Polymorphic Information Content (PIC) of - 10 primers used respectively is 95.14 % and 0.392 .Analysis of genetic distance and dendogram using Software Darwin 5.05. Dice similarity coefficient is used to form the dendogram. From the analysis of genetic distance and dendogram, 30 accessions of sugarcane North Sumatra grouped into 3 clusters . The coefficient of genetic distances ranging from 0.063 (BZ 134 Tanjung Jati and BZ 134 Hamparan Perak) - 0.778 ( Berastagi Berastagi and Cenning).
Keywords : Sugarcane, Genotype, RAPD, DNA , Diversity.
PENDAHULUAN
Latar Belakang
Tebu adalah tanaman yang ditanam untuk bahan baku gula. Tanaman ini
hanya dapat tumbuh di daerah beriklim tropis. Tanaman ini termasuk jenis
rumput-rumputan. Umur tanaman sejak ditanam sampai bisa dipanen mencapai
kurang lebih 1 tahun. Di Indonesia tebu banyak dibudidayakan di pulau Jawa dan
Sumatera. Untuk pembuatan gula, batang tebu yang sudah dipanen diperas dengan
mesin pemeras (mesin press) di pabrik gula. Sesudah itu, nira atau air perasan tebu
tersebut disaring, dimasak, dan diputihkan sehingga menjadi gula pasir yang kita
kenal. Dari proses pembuatan tebu tersebut akan dihasilkan gula 5%, ampas tebu
90% dan sisanya berupa tetes (molasse) dan air (Balitbangtan, 2007).
Gula merupakan salah satu komoditas strategis dalam perekonomian
Indonesia. Dengan luas areal sekitar 350 ribu ha, industri gula berbasis tebu
merupakan salah satu sumber pendapatan bagi sekitar 900 ribu petani dengan
jumlah tenaga kerja yang terlibat mencapai sekitar 1,3 juta orang (Balitbangtan,
2007).
Menurut Toharisman (2007), Sumatera Utara merupakan salah satu daerah
penghasil gula di luar pulau Jawa, setiap tahunnnya mengalami penurunan
produksi akibat menurunnya luas areal yang dapat ditanami tebu dan tingkat
produktivitas gula PTPN II (Sumatera Utara) hingga Oktober 2007 hanya 2,83
ton/ha. Penurunan produktivitas gula juga terkait dengan berbagai faktor seperti
penggunaan dan penataan varietas unggul, kultur teknis dan masa tanam yang
Masyarakat di Sumatera Utara banyak memanfaatkan hasil tanaman tebu
sebagai minuman segar. Beberapa klon dan kultivar yang di tanam masyarakat
Sumatera Utara baik di pekarangan rumah atau pun di kebun mereka yaitu klon
BZ 134, kultivar tebu kuning, tebu gelaga, tebu gambas, tebu berastagi dan tebu
merah. Tebu klon BZ 134 merupakan tebu yang dibudidayakan secara luas baik
oleh petani maupun oleh pihak PTP. Nusantara II (Persero). Klon ini merupakan
klon yang sangat disukai oleh petani dan PTP. Nusantara II (Persero) walaupun
belum dirilis sebagai benih bina dan kandungan rendemannya yang rendah. Hal
ini dikarenakan klon tersebut tahan terhadap serangan hama penggerek batang
raksasa (Pragmatoeceae hubner), hama yang hanya terdapat di Sumatera Utara.
Selain itu disukai karena sangat memudahkan petani ataupun pekerja tebang
angkut dalam panen dimana klon ini tidak mudah roboh dan performanya yang
tegak. Kultivar, klon dan varietas yang dibudidayakan oleh petani dan pihak PTP.
Nusantara II (Persero) banyak ditemukan di daerah Kabupaten Deliserdang,
Kabupaten Langkat dan Kabupaten Karo.
Balai Besar Perbenihan dan Proteksi Tanaman Perkebunan (BBPPTP)
Medan merupakan salah satu UPT Teknis Kementerian Pertanian dibawah
Direktorat Jenderal Perkebunan yang memiliki tugas pokok dan fungsi yang harus
didukung dengan adanya penelitian terutama dalam hal pengawasan pelestarian
plasma nutfah tingkat nasional (keragaman genotipe klon dan kultivar),
pelaksanaan pengembangan teknik (pemanfaatan molekuler) dan metode
pengujian mutu benih perkebunan dan uji acuan (referee test) (Deptan, 2013).
Berdasarkan latar belakang diatas penulis tertarik untuk melakukan
potensi mengenai keragaman dan kekerabatan beberapa klon dan kultivar tebu
yang ada di Sumatera Utara.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui keragaman genetik dan pola
kekerabatan beberapa aksesi tebu di Sumatera Utara berdasarkan marka RAPD
(Random Amplified Polymorphism DNA).
Hipotesis Penelitian
Terdapat keragaman genotipe beberapa aksesi tebu di Sumatera Utara.
Manfaat Penelitian
1. Tersedianya informasi mengenai keragaman dan kekerabatan beberapa aksesi
tebu (Saccharum spp.) yang ada di Sumatera Utara berdasarkan analisis
RAPD (Random Amplified Polymorphism DNA).
2. Tersedianya primer RAPD yang dapat dijadikan sebagai standar dalam
analisis genetik varietas, klon dan kultivar tebu di Sumatera Utara.
3. Inventarisasi kultivar lokal sebagai sumber plasma nutfah yang bermanfaat
TINJAUAN PUSTAKA
Tanaman Tebu (Saccharum spp.) Biologi Tanaman
Klasifikasi
Tanaman tebu tergolong tanaman perdu dengan nama latin Saccharum
officinarum L. Di daerah Jawa Barat disebut Tiwu, di daerah Jawa Tengah dan
Jawa Timur disebut Tebu atau Rosan. Sistematika tanaman tebu adalah:
Divisi : Spermatophyta
Subdivisi : Angiospermae
Kelas : Monocotyledone
Ordo : Graminales
Famili : Graminae
Genus : Saccharum
Species : Saccharum spp.
Morfologi
1. Batang
Batang tanaman tebu berdiri lurus dan beruas-ruas yang dibatasi dengan
buku-buku (Gambar 1). Pada setiap buku terdapat mata tunas. Batang tanaman
tebu berasal dari mata tunas yang berada dibawah tanah yang tumbuh keluar dan
berkembang membentuk rumpun. Diameter batang antara 3-5 cm dengan tinggi
2. Akar Ak cincin tun akar dibag 3. Daun Da berpelepah berlekuk. (Gambar 3 kar tanaman nas anakan
gian yang le
aun tebu be
h seperti da
Tepi dau
3).
Ga
n tebu terma
(Gambar 2
ebih atas aki
G
erbentuk bu
aun jagung
un kadang
ambar 1. Ba
asuk akar se
). Pada fas
ibat pember
Gambar 2. A
usur panah
dan tak ber
g-kadang
atang tebu
erabut tidak
e pertumbu
rian tanah s
Akar tebu
seperti pita
rtangkai. Tu
bergelomba
k panjang y
4. Bunga Bu pada tahap tandan den dua kepala 5. Biji Bij biji (Gamb jenis baru (Indrawan
unga tebu be
p pertama
ngan dua bu
a putik dan
ji tebu sepe
bar 5). Biji
hasil persil
nto, et al. 20
Ga
erupa malai
berupa kar
ulir panjang
bakal biji (G
Ga
erti padi, me
tebu dapat
langan yang
010).
ambar 3. Da
i dengan pa
rangan bung
g 3-4 mm. T
Gambar 4).
ambar 4. Bu
emiliki satu
t ditanam di
g lebih ungg
aun Tebu
anjang antar
ga dan pad
Terdapat pu
unga Tebu
biji dengan
i kebun per
gul
ra 50-80 cm
da tahap sel
ula benangsa
n besar lemb
rcobaan unt
m. Cabang b
lanjutnya b
ari, putik de
baga 1/3 pan
Syarat Tum
Ta
isoterm 20
tebu adala
tanaman t
pengairan kedalaman unsur hara musim ke manyalurk yang dapa dalam tana Di jenis tanah
antara 0 –
adalah ku
1200 m d mbuh
anaman tebu
00C yaitu an
ah yang tid
tebu sangat
dan draina
n sekitar 1
a pada lapi
emarau tida
kan kelebiha
at mengham
ah.
lihat dari je
h seperti tan
– 1400 m d
urang dari 5
diatas permu
G
u tumbuh di
ntara 190LU
dak terlalu
t sensitif te
ase harus s
meter mem
isan yang le
ak tergangg
an air dimu
mbat pertu
enis tanah,
nah alluvial
diatas permu
500 m diata
ukaan laut p
Gambar 5. B
idaerah trop
U – 350 LS.
kering dan erhadap kek sangat dipe mberikan pe ebih dalam gu. Draina usim penghu umbuhan ta tanaman te l, grumosol, ukaan laut. as permukaa pertumbuha Biji Tebu
pika dan sub
Kondisi tan
n tidak ter
kurangan ud
erhatikan. D
eluang akar
sehingga p
se yang ba
ujan sehingg
anaman kar
ebu dapat t
, latosol dan
Akan tetap
an laut. Sed
an tanaman
b tropika sa
nah yang ba
rlalu basah,
dara dalam
Drainase ya
tanaman m
pertumbuha
aik dan da
ga tidak terj
rena berkur
tumbuh bai
n regosol de
pi lahan ya
dangkan pa
relatif lam
ampai batas
aik bagi tan
, selain itu
m tanah seh
ang baik de
menyerap ai
an tanaman
alam juga
adi genanga
rangnya ok
ik pada ber
engan ketin
ng paling s
lahan sebaiknya kurang dari 8%, meskipun pada kemiringan sampai 10% dapat
juga digunakan untuk areal yang dilokalisir. Kondisi lahan terbaik untuk tebu
adalah berlereng panjang, rata dan melandai sampai 2% apabila tanahnya ringan
dan sampai 5 % apabila tanahnya lebih berat (Indrawanto et al., 2010).
Tanah
1. Sifat fisik tanah
Struktur tanah yang baik untuk pertanaman tebu adalah tanah yang gembur
sehingga aerasi udara dan perakaran berkembang sempurna, oleh karena itu upaya
pemecahan bongkahan tanah atau agregat tanah menjadi partikel-partikel kecil
akan memudahkan akar menerobos. Sedangkan tekstur tanah, yaitu perbandingan
partikelpartikel tanah berupa lempung, debu dan liat, yang ideal bagi pertumbuhan
tanaman tebu adalah tekstur tanah ringan sampai agak berat dengan kemampuan
menahan air cukup dan porositas 30 %.
Tanaman tebu menghendaki solum tanah minimal 50 cm dengan tidak ada
lapisan kedap air dan permukaan air 40 cm. Sehingga pada lahan kering, apabila
lapisan tanah atasnya tipis maka pengolahan tanah harus dalam. Demikian pula
apabila ditemukan lapisan kedap air, lapisan ini harus dipecah agar sistem aerasi,
air tanah dan perakaran tanaman berkembang dengan baik.
2. Sifat kimia tanah
Tanaman tebu dapat tumbuh dengan baik pada tanah yang memiliki pH 6 -
7,5, akan tetapi masih toleran pada pH tidak lebih tinggi dari 8,5 atau tidak lebih
rendah dari 4,5. Pada pH yang tinggi ketersediaan unsur hara menjadi terbatas.
tanaman, oleh karena itu perlu dilakukan pemberian kapur (CaCO3) agar unsur Fe
dan Al dapat dikurangi.
Bahan racun utama lainnya dalam tanah adalah klor (Cl), kadar Cl dalam
tanah sekitar 0,06 – 0,1 % telah bersifat racun bagi akar tanaman. Pada tanah
ditepi pantai karena rembesan air laut, kadar Cl nya cukup tinggi sehingga bersifat
racun.
Iklim
Pengaruh iklim terhadap pertumbuhan tebu dan rendemen gula sangat
besar. Dalam masa pertumbuhan tanaman tebu membutuhkan banyak air,
sedangkan saat masak tanaman tebu membutuhkan keadaan kering agar
pertumbuhan terhenti. Apabila hujan tetap tinggi maka pertumbuhan akan terus
terjadi dan tidak ada kesempatan untuk menjadi masak sehingga rendemen
menjadi rendah.
1. Curah hujan
Tanaman tebu dapat tumbuh dengan baik didaerah dengan curah hujan
berkisar antara 1.000 – 1.300 mm per tahun dengan sekurang-kurangnya 3 bulan
kering. Distribusi curah hujan yang ideal untuk pertanaman tebu adalah: pada
periode pertumbuhan vegetatif diperlukan curah hujan yang tinggi (200 mm per
bulan) selama 5-6 bulan. Periode selanjutnya selama 2 bulan dengan curah hujan
125 mm dan 4 – 5 bulan dengan curah hujan kurang dari 75 mm/bulan yang
merupakan periode kering. Periode ini merupakan periode pertumbuhan generatif
dan pemasakan tebu.
Ditinjau dari kondisi iklim yang diperlukan, maka wilayah yang dapat
Syarifudin (1977) adalah tipe B2, C2, D2 dan E2. Sedangkan untuk tipe iklim
B1C1D1dan E1 dengan 2 bulan musim kering, dapat diusahakan untuk tebu
dengan syarat tanahnya ringan dan berdrainase bagus. Untuk tipe iklim D3, E3
dan D4 dengan 4 bulan kering, dapat pula diusahakan dengan syarat adanya
ketersediaan air irigasi.
2. Suhu
Pengaruh suhu pada pertumbuhan dan pembentukan sukrosa pada tebu
cukup tinggi. Suhu ideal bagi tanaman tebu berkisar antara 24 0 C–34 0C dengan
perbedaan suhu antara siang dan malam tidak lebih dari 100C. Pembentukan
sukrosa terjadi pada siang hari dan akan berjalan lebih optimal pada suhu 30 0 C.
Sukrosa yang terbentuk akan ditimbun/disimpan pada batang dimulai dari ruas
paling bawah pada malam hari. Prosespenyimpanan sukrosa ini paling efektif dan
optimal pada suhu 150C.
3. Sinar Matahari
Tanaman tebu membutuhkan penyinaran 12-14 jam setiap harinya. Proses
asimilasi akan terjadi secara optimal, apabila daun tanaman memperoleh radiasi
penyinaran matahari secara penuh sehingga cuaca yang berawan pada siang hari
akan mempengaruhi intensitas penyinaran dan berakibatpada menurunnya proses
fotosintesa sehingga pertumbuhan terhambat.
4. Angin
Kecepatan angin sangat berperan dalam mengatur keseimbangan
kelembaban udara dan kadar CO2 disekitar tajuk yang mempengaruhi proses
fotosintesa. Angin dengan kecepatan kurang dari 10 km/jam disiang hari
melebihi 10 km/jam akan mengganggu pertumbuhan tanaman tebu bahkan
tanaman tebu dapat patah dan roboh (Indrawanto et al., 2010).
Daerah Asal
Genus Saccharum mungkin sebelumnya berasal dari benua yang
diasumsikan berdasarkan bentuk dan lokasinya saat ini. Genus tersebut terdiri dari
35-40 spesies dan memiliki dua daerah asal keragaman yaitu dunia lama (Asia dan
Afrika) dan dunia baru (Amerika Utara, Tengah dan Selatan). Asia memiliki
sekitar 25 spesies asli, Amerika Utara memiliki enam spesies asli dan 4 – 5
spesies telah dikenali, Amerika tengah memiliki tiga atau empat spesies asli dan
beberapa diantaranya telah dikenal (Webster dan Shaw 1995). Afrika memiliki
dua spesies asli dan Australia memiliki satu spesies naturalisasi (Darke 1999;
Bonnett et al. 2008).
Spesies Saccharum Brasil belum dikarakterisasi dengan baik. Hanya
survei floristik daerah yang telah melaporkan keberadaan spesies ini. Suatu studi
menggambarkan spesies asli S. asperum, S.angustifolium, S. purpureum, S.
biaristatum, S.glabrinodis, S. clandestinus dan S. villosum, tetapi penulis
berkomentar bahwa spesies tersebut sangat terbatas sehingga ada kemungkinan
bahwa semuanya bisa jadi dari keragaman satu spesies (Smith et al. 1982).
Bahkan, dari spesies yang terdaftar pada penelitian ini, hanya S. asperum, S.
angustifolium dan S. villosum yang diterima nama ilmiahnya (daftar tanaman
2010). Pada studi lain, spesies asli yang diidentifikasi adalah S. villosum, S.
Spesies Saccharum berperan dalam pengembangan kultivar tebu modern
yang berasal dari Asia Tenggara (Roach dan Daniels 1987) karena S. officinarum
dan S. spontaneum adalah penyumbang utama genom varietas modern.
S. officinarum telah dibudidayakan sejak zaman prasejarah (Sreenivasan
et al. 1987). Hal ini diyakini bahwa daerah asalnya adalah Polinesia dan bahwa
spesies ini disebar luaskan ke seluruh Asia Tenggara, di mana daerah
keanekaragaman modern adalah di Papua Nugini dan Jawa (Indonesia), ini adalah
daerah di mana sebagian besar bahan percobaan dikumpulkan di akhir abad ke-19
(Roach dan Daniels 1987).
Daerah asal dan keanekaragaman S. spontaneum adalah daerah yang lebih
beriklim subtropis seperti India. Namun, karena S. spontaneum dapat tumbuh di
berbagai habitat dan ketinggian (di kedua daerah tropis dan subtropis), yang saat
ini tersebar di garis lintang mulai dari 8°S sampai 40°N dalam tiga zona geografis
yaitu : a) bagian timur, di Selatan Kepulauan Pasifik, Filipina, Taiwan, Jepang,
Cina, Vietnam, Thailand, Malaysia dan Myanmar, b) bagian tengah, di India,
Nepal, Bangladesh, Sri Lanka, Pakistan, Afghanistan, Iran dan Timur Tengah,
dan c) bagian barat, di Mesir, Kenya, Sudan, Uganda, Tanzania, dan
negara-negara Mediterania lainnya. Zona ini kira-kira mewakili cluster sitogeografikal
alami karena S. spontaneum cenderung memiliki jumlah kromosom yang berbeda
pada masing-masing lokasi (Daniels dan Roach 1987).
Keanekaragaman Genetik Tebu (Saccarum officinarum L.)
Keragaman genetik memainkan peran yang sangat penting dalam
gen yang kecil diperlukan agar spesies dapat bertahan hidup dan beradaptasi
(Salisbury dan Ross, 1995). Spesies yang memiliki derajat keragaman genetik
yang tinggi pada populasinya akan memiliki lebih banyak variasi alel yang dapat
diseleksi (Elfrod dan Stansfield, 2007).
Tebu, Saccharum officinarum (2n = 70-140), disebut juga "noble cane"
karena batangnya yang manis dan berair, merupakan spesies rumput tahunan
tropis, (famili Poaceae; suku Andropogoneae). Kultivar modern memperlihatkan
berbagai jumlah kromosom (2n = 100-130) dan urutan genom ~ 10 Gb berasal
dari hibridisasi interspesifik yang rumit karena peristiwa hilangnya sebagian
kromosom (aneuploidisasi) dan polyploidisasi (8-10x). Meskipun demikian,
haplotype dasar tebu (X = 10; 930 Mb) adalah sangat kecil dan syntenic untuk
model rumput, seperti sorgum (Scortecci et al, 2012).
Di China dan India, S. officinarum disilangkan dengan S. barberi (tebu
India, 2n = 60-140) dan S. sinense (tebu Cina, 2n = 104-128) untuk menghasilkan
hibrida, yang nantinya akan menjadi hybrid antara S. officinarum dan S.
spontaneum (2n = 36-128). Selama abad XIX, persilangan menggunakan spesies
liar S. spontaneum (2n = 36-128) dilakukan untuk meningkatkan hasil sukrosa dan
ketahanan terhadap penyakit (Roach, 1972, 1989). Dengan demikian, kultivar tebu
modern sesuai dengan introgresi dari spesies liar S. spontaneum dan S. robustum
(2n = 66-170) ke spesies budidaya S. officinarum, S. sinense dan S. barberi
(D'Hont et al., 2008, Grivet et al, 2006;. Irvine, 1999). S. edule (2n = 60, 70, 80)
dianggap budidaya ornament di New Guinea dan Kepulauan Fiji, dimana tidak
ada kontribusi terhadap kultivar modern. Portugis memperkenalkan
hibrida antara S. officinarum dan S. barberi yang berasal dari India dan Persia
(Daniels dan Daniels, 1975).
Tanaman tebu (Saccharum spp. hibrid) merupakan tanaman rerumputan
yang kompleks secara genetis karena daerah asal multi spesiesnya yang
menghasilkan kromosom mosaik (umumnya 2n = 100 – 130). Disebabkan
tingginya tingkat ploidi dan genom yang kompleks, maka perkembangan dalam
pemecahan genetik tebu dirasakan lambat. Marka morfologi sering digunakan
dalam analisa keragaman genetik, tetapi belakangan ini lebih banyak
menggunakan teknik penanda molekuler dan telah berkembang menjadi suatu
sarana yang sangat penting untuk menganalisa genotipe tebu terhadap
ekploitasinya secara komersil dan seleksi khusus berbagai tetua secara genetis
untuk keperluan pemuliaan (Kawar, et al, 2009)
Evaluasi keragaman genetik berdasarkan karakter morfologi sangat
terbatas dan dipengaruhi oleh dampak lingkungan (Afghan et al., 2005). Oleh
karena itu, teknik yang dapat mengukur hubungan genetik tanpa pengaruh faktor
lingkungan dan sifat fenotip adalah kebutuhan program pemuliaan masa depan.
Analisis marka molekuler menawarkan penilaian hubungan genetik yang efisien
berdasarkan karakteristik genetik (Hussain et al, 2010).
Pencarian berbagai tetua secara genetik dapat didasarkan pada asal
geografis, karakter agronomi, dan data silsilah atau data penanda molekuler
(Melchinger, 1999).
Kultivar Tebu di Sumatera Utara
Hasil eksplorasi yang telah dilakukan oleh Sinaga dan Susanto (2009), saat
1. Kultivar tebu kuning
Tebu ini diperoleh dari kebun masyarakat di Desa Helvetia Kecamatan
Marelan Medan utara. Jenis tebu ini banyak dijumpai di daerah – daerah
lain di Sumatera Utara. Masyarakat biasanya menanam di pekarangan
rumah atau kebun dalam jumlah yang tidak banyak dengan maksud untuk
dikonsumsi karena rasanya yang manis, segar dan teksur batang rapuh
sehingga mudah untuk digigit. Jenis tebu ini sangat mudah tumbuh dan
bertunas terutama pada tanah yang tidak terlalu basah dan tidak terlalu
kering.
2. Kultivar tebu gelaga
Sebaran tebu ini di Sumatera Utara tidak seluas tebu kuning. Tebu jenis ini
banyak dijumpai di wilayah Medan, Deliserdang dan Langkat. Tebu ini
dapat dikonsumsi masyarakat secara langsung karena rasanya manis dan
mudah tumbuh pada tanah yang cukup air.
3. Kultivar tebu Berastagi
Jenis tebu ini sangat baik tumbuh di daerah Kabupaten Karo, Dairi dan
Phak – Phak Barat. Tebu ini memiliki rasa nira yang sangat manis namun
tekstur batangnya sangat keras sehingga menyebabkan cara konsumsinya
harus diperas/digiling untuk memperoleh niranya. Tebu ini sulit untuk
bertunas dibandingkan dengan jenis lainnya. Munculnya tunas dari mata
tunas relatif lebih lama dan cenderung akan mati apabila kondisi tanah
terlalu basah.
4. Kultivar tebu gambas
Jenis tebu ini hampir dapat dijumpai di seluruh wilayah Propinsi Sumatera
tebu yang dikonsumsi adalah bagian batang tua. Tebu ini kurang diminati
masyarakat dibanding dengan tebu jenis kuning dan tebu hijau besar
karena rasanya yang kurang manis dan agak keasam – asaman. Jenis tebu
ini sangat mudah tumbuh sebagaimana yang terlihat di kebun masyarakat
terutama pada tanah yang ketersediaan airnya cukup.
5. Kultivar tebu merah
Tebu ini memiliki batang yang berwarna merah dan daun yang agak
kemerah – merahan. Kultivar ini banyak dibudidayakan masyarakat di
pekarangan rumah dan ada yang tumbuh liar di kebun. Tebu jenis ini
banyak digunakan masyarakat sebagai obat (Sinaga dan Susanto, 2009).
Varietas dan Klon Tebu di Sumatera Utara
Teknologi varietas merupakan salah satu input budidaya tanaman. Dampak
masukan dengan menggunakan varietas unggul sudah banyak dilaporkan oleh
kalangan praktisi maupun peneliti, yaitu mampu meningkakan produksi secara
signifikan. Upaya P3GI (Pusat Penelitian Perkebunan Gula Indonesia) pada KP
(Kebun Percobaan) Medan mencari varietas unggul seri PS (Pasuruan) sudah
berlangsung cukup lama sejalan dengan usia berdirinya industri gula di Sumatera
Utara. Untuk mendapatkan satu jenis varietas memerlukan ± 3 tahun, melalui
tahap SJT I (screening jenis tebu) sampai dengan SJT III. Tahap berikutnya
dilakukan Orientasi Varietas (Orvar) dan Warteb (Warung Tebu) pada skala demo
(Mulyadi, et al., 1997).
Sejak tahun 1982 – 1996 ± 1136 jenis varietas telah diuji adaptasikan
baik di kedua Pabrik Gula ± ada 7 varietas atau sebesar 0,6 %. Selain varietas
yang direkomendasikan P3GI, ada juga varietas introduksi dari luar negeri yaitu
F 156 (BZ 134) yang sekarang dikenal sebagai varietas unggul lokal dan
mendominasi pertanaman tebu di Sumatera Utara (Mulyadi, et al., 1997).
Beberapa varietas tebu yang dikembangkan oleh PTP. Nusantara II saat ini
untuk Kebun Benih Induk (KBI) tahun tahun tanam 2014/2015 di Kebun T. Jati
adalah BZ 134, PS 862, TLH 2, Kentung, GMP 2, VMC 76-16, PS. 921, PS. 864,
PS. 951, PS. 851, PS. 881, PSJT. 941, PSBM 901, TLH 1, GMP 1, Kidang
Kencana, Cenning. (Risbang Tebu, 2013).
Marka Molekuler
Pada awal abad ke-20 ilmuwan menemukan bahwa faktor Mendel
mengendalikan warisan (gen) yang terletak dalam urutan linear pada struktur
sitogenetik yang jelas dan disebut dengan kromosom. Hal tersebut menunjukkan
bahwa kombinasi gen dapat diwariskan dalam kelompok (yaitu gen yang terkait
bersama) karena dekat satu sama lain pada kromosom yang sama. Gen individu
yang mengapit, dalam menentukan interval terdekat dikenal sebagai penanda
molekuler DNA. Penanda molekuler adalah urutan DNA yang dapat diidentifikasi
dan ditemukan pada lokasi genom tertentu dan terkait dengan pewarisan sifat atau
gen linked (FAO, 2004).
Penanda harus polimorfik yaitu harus ada perbedaan bentuk sehingga
kromosom pembawa gen mutan dapat dibedakan dengan membawa bentuk
penanda kromosom gen normal. Polimorfisme dapat dideteksi pada tiga tingkatan
fingerprinting DNA digunakan untuk menggambarkan penggunaan kombinasi
beberapa sistem deteksi lokus tunggal dan digunakan sebagai alat serbaguna untuk
menyelidiki berbagai aspek genom tanaman. Hal ini berisi karakterisasi
variabilitas genetik, fingerprinting genom, pemetaan genom, lokalisasi gen,
analisis evolusi genom, genetika populasi, taksonomi, peternakan dan diagnostik
tanaman (Joshi et al, 2011). Menurut Joshi et al (2011), seorang peneliti DNA
yang ideal harus dapat menunjukkan ciri - ciri berikut : (i) pewarisan kodominan-
bentuk marker yang berbeda harus terdeteksi dalam organisme diploid untuk
memungkinkan diskriminasi homozigot dan heterozigot. (ii) Selalu terjadi dalam
genom (iii) Selektif dalam perilaku netral (urutan DNA organisme netral untuk
lingkungan kondisi atau penerapan pelaksanaan) (iv) Dapat diakses (data
tersedia) (v) Mudah dan pengujiannya cepat (vi) Dapat digandakan dan (vii)
pertukaran data antar laboratorium mudah.
Polymerase Chain Reaction (PCR) Berbasis Marka
Satu dekade setelah munculnya AFLP, ada terobosan lain yang melibatkan
penggunaan PCR pada tahun 1990 (Farooq dan Azam, 2002). PCR adalah metode
in vitro asam nukleat sintesis dimana segmen tertentu dari DNA dapat khusus
direplikasi (Mullis dan Faloona, 1987). Proses tersebut melibatkan dua primer
oligonukleotida yang mengapit fragmen DNA yang diinginkan dan amplifikasi
diperoleh dengan serangkaian siklus berulang panas denaturasi DNA, annealing
primer kepada urutan komplementernya, dan perpanjangan primer anneal dengan
polimerase DNA termofilik. Karena produk ekstensi sendiri juga melengkapi
DNA target yang disintesis pada siklus sebelumnya dan hasilnya adalah
akumulasi eksponensial dari target fragmen spesifik.
DNA genom dari dua individu yang berbeda sering menghasilkan
amplifikasi yang berbeda dan fragmen khusus yang dihasilkan dari satu individu
tetapi tidak untuk lainnya merupakan polimorfisme DNA dan dapat digunakan
sebagai penanda genetik. Pola pita diamplifikasi sehingga bisa digunakan untuk
genom fingerprint (Welsh dan McClelland 1990 ).
PCR didasarkan pada amplifikasi enzimatik fragmen DNA dengan
menggunakan dua oligonuleotida primer yang komplementer dengan ujung 5’ dari
kedua untaian sekuens target. Oligonukleotida ini digunakan sebagai primer
(primer PCR) untuk memungkinkan DNA template dikopi oleh DNA polimerase.
Untuk mendukung terjadinya annealing primer ini pada template pertama kali
diperlukan untuk memisahkan DNA substrat melalui pemanasan. Suhu reaksi
selanjutnya diturunkan untuk membiarkan terjadinya perpasangan sekuens dan
akhirnya reaksi polimerisasi dilakukan oleh DNA polimerase untuk membentuk
untaian komplementer (Nasir, 2002).
Marker Randomly Amplified Polymorphic DNA (RAPD)
Marka Randomly Amplified Polymorphic DNA (RAPD) merupakan suatu
teknik untuk mendeteksi polimorfisme urutan nukleotida DNA dengan
menggunakan primer tunggal urutan nukleotida (primer oligonukleotida, RAPD),
(William et al, 1991 dalam Jonah, 2011). Dalam reaksi ini, satu primer spesies
anneal ke DNA genom di dua lokasi yang berbeda pada komplementer untaian
Keuntungan analisis RAPD meliputi:
(i) Menggunakan sedikit DNA sehingga mampu bekerja dengan
populasi yang tidak dapat diakses dengan RFLP. Lebih cepat dan
efisien dalam analisis pemetaan genetik dan memiliki kepadatan
yang tinggi seperti pada banyak spesies tanaman alfafa (Kiss et al,
1993), kacang fabean (Torress et al, 1993) dan apple (Hammat et al,
1994)
(ii) Tidak berhubungan dengan uji radioaktif (Kiss et al,1993)
(iii) Tidak membutuhkan penyelidikan spesies spesifik
(iv) Tidak terkait dalam blotting atau hibridisasi.
(v) Sederhana, biaya rendah dan tidak membutuhkan informasi urutan DNA sebelumnya untuk aplikasi
(Stammers M, et al, 1995).
Kekurangan penanda RAPD adalah :
(i) polimorfisme diwariskan sebagai karakter dominan atau resesif menyebabkan hilangnya informasi relatif terhadap penanda yang
menunjukkan kodominasi .
(ii) Primer relatif singkat, bahkan ketidakcocokan nukleotida tunggal sering dapat mencegah primer dari proses annealing yang
menyebabkan hilangnya band.
(iii) Susah dalam pengulangan pada banyak sistem, terutama ketika mentransfer antara populasi atau laboratorium sehingga sering
Marka Molekuler RAPD pada Tebu (Saccharum spp.)
Tabasum et al., (2010) dalam penelitiannya dengan 40 tebu genotipe
termasuk S. officinarum dan S. barberi, menunjukkan bahwa tingkat polimorfisme
terdeteksi tinggi dengan menggunakan 30 penanda RAPD, karena lebih dari satu
alel yang berbeda dapat di identifikasi oleh setiap penanda sedangkan Hussain. A,
(2005) dalam penelitiannya menyatakan bahwa dari dari 50 primer yang
digunakan ternyata primer OPB3, OPB5, OPB8, OPB10, OPB11, OPB14,
OPB15, OPB3 tingkat polimorfiknya terdeteksi sebesar 16 %.
Terdapat 20 primer RAPD yang digunakan dalam penelitian Pandey, et al.
(2012) dan menghasilkan 110 amplikon dengan rata-rata 5,5 band per primer. Pola
Amplifikasi organogenesis langsung mengangkat planlet tebu menggunakan
RAPD primer OPA 13. Jumlah fragmen RAPD (110) yang diperoleh dalam
penelitian ini sudah cukup untuk mengungkapkan variasi genetik pada tanaman
tebu. Polimorfisme dalam profil amplifikasi terdeteksi pada 5 Gy dengan primer
OPJ 13 dan 0PJ17 dan perlakuan 200 mM NaCl dengan primer 0PJ18. Band
polimorfik merupakan perubahan genetik yang terjadi akibat stres garam dan
iradiasi (Asad et.al., 1996)
Penilaian keragaman dan identifikasi plasma nutfah yang ada merupakan
komponen penting dari program perbaikan tanaman. Teknik RAPD-PCR telah
berhasil digunakan dalam hal ini. Pola amplikasi RAPD-PCR menjelaskan
berbagai tingkat polimorfisme antara tiga genotipe tebu. Terdapat 44 fragmen
pada tiap genotipe dan penanda yang dikemukakan oleh Ahmed dan Khaled
(2008) dengan menggunakan 7 (tujuh) primer yaitu : OPA-01, OPA-04, OPA-07,
Beberapa primer dengan teknik RAPD yang digunakan Ullah et.al (2013)
untuk menganalisa keragaman genetis varietas tebu yang dikonsumsi/dimakan
meliputi : OPA-01, OPA-02, OPA-03, OPA-06, OPA-08, OPA-12, OPB-05,
OPB-09, OPB-11, OPB-15, OPB-18, OPB-20, 01, 02, 03,
OPC-04, OPD-01, OPD-03, OPE-02, OPE-04.
Dari total 40 primer yang digunakan untuk menilai keragaman genetis 17
kultivar tebu hanya 7 primer yang menghasilkan spesifik band. Primer tersebut
adalah : OPA-04, OPA-17, OPAB-17, OPC-08, OPA-16, OPG-05, OPG-17
BAHAN DAN METODE PENELITIAN
Tempat dan Waktu
Penelitian ini dilaksanakan dari bulan April – Oktober 2014 di
Laboratorium Terpadu Fakultas Kedokteran Universitas Sumatera Utara Medan,
sedangkan pengoleksian sampel dilakukan di daerah Sumatera Utara bulan Maret
- April 2014 dimana tempat pengambilan sampel dilakukan di beberapa lokasi di
wilayah Sumatera Utara yaitu : Kabupaten Deliserdang, Langkat dan Karo.
Bahan dan Alat Di Lapangan
Bahan yang digunakan dalam pengoleksian sampel di lapangan adalah air
untuk membersihkan sampel daun dan es untuk menjaga kesegaran daun.
Sedangkan alat-alat yang digunakan adalah kantung plastik, karet gelang, kotak
ice cooler, tissue, GPS, dan alat-alat tulis.
Di Laboratorium
Bahan yang digunakan untuk penelitian ini adalah daun yang berasal dari
Tabel 1. Bahan varietas, klon dan kultivar tebu yang digunakan
No Bahan Tanaman Genotype SK
Mentan
Sampel ke..
1. R 579 / Bululawang Kebun T. Jati √ 1 2. PS 861 Kebun T. Jati √ 2 3. PS 863 Kebun T. Jati √ 3 4. PS 921 Kebun T. Jati √ 4 5. PS 881 Kebun T. Jati √ 5 6. PS 951 Kebun T. Jati √ 6 7. GMP 1 Kebun T. Jati √ 7 8. Cenning Kebun T. Jati √ 8 9. Kentung Kebun T. Jati √ 9 10 PSBM 901 Kebun T. Jati √ 10 11. PSCO 902 Kebun T. Jati √ 11 12. VMC 76 - 16 Kebun T. Jati √ 12 13. BZ 134 Hamparan Perak Hamparan Perak - 13
14. BZ 134 Sunggal Sunggal - 14 15. BZ 134 Tanjung Jati Kebun T. Jati - 15 16. Gambas Hamparan Perak Hamparan Perak - 16 17. Gambas Sunggal Sunggal - 17 18. Gambas Stabat Stabat - 18 19. Kuning Hamparan Perak Hamparan Perak - 19 20. Kuning Sunggal Sunggal - 20 21. Kuning Tanjung Jati Kebun T. Jati - 21 22. Gelagah Karo Kabanjahe - 22 23. Gelagah Sunggal Sunggal - 23 24. Gelagah Helvetia Helvetia - 24 25. Merah Binjai Timur Kota Binjai Timur - 25 26. Merah Kabanjahe Kabanjahe - 26 27. Merah Hamparan Perak Hamparan Perak - 27 28. Berastagi Sibolangit Sibolangit - 28 29. Berastagi Berastagi Berastagi - 29 30. Berastagi Kabanjahe Kabanjahe - 30
Bahan kimia yang digunakan dalam penelitian ini adalah Nitrogen cair,
CTAB (promega H6269), Go Taq (R) Green Master Mix, buffer CTAB, buffer
TAE, buffer TE, Kloroform Isoamilalkohol 24:1 (KIAA), NaCl, NaOH,
Na-EDTA, HCl p.a, alcohol 100% dan 70%, Isopropanol dingin, aquadest,
ß-mercaptoetanol 2%, agarose (promega V3121), primer oligonukleotida (OPA-02,
OPA-08, OPB-05, OPB-11, OPB-17, OPC-07, OPC-15, OPD-01, OPD-05,
menunjukkan polimorfisme, maka selanjutnya akan dilakukan seleksi primer
kembali sampai terbentuk polimorfisme, Master mix (promega M7122), DNA
ladder (G210A), kertas tissue.
Sedangkan alat yang digunakan dalam penelitian ini adalah gunting,
timbangan digital, hot plate (Biosan), mortar, centrifuge (eppendorf 5415), vortex,
frezer, tabung eppendorf 2.0 ml, 1.5 ml, dan 50 ul, mikropipet ukuran 1-50 µl,
100-500 µl, dan 200-1000 µl, pinset, sarung tangan karet, tip pipet (warna putih,
kuning, dan biru), autoklaf, kamera, penangas air (water bath, BIOSAN), oven,
pH meter, pengaduk magnetic, alat-alat gelas (gelas ukur, baker glass,
Erlenmeyer, dll), UV-transilluminator (UV Tec Cambridge 20 UV), elektroforesis
(Power PAC 3000, BIO RAD), PCR (Therma Cycler), Gel-Doc (U Cambridge),
power supply.
Pelaksanaan Penelitian
Pengoleksian Sampel
Sampel daun yang digunakan adalah daun yang berasal dari genotip tebu yang
berumur 3 – 8 bulan. Tiap genotip tebu diambil langsung dari lapangan. Untuk
kultivar tebu kuning diambil dari Sei Semayang, Hamparan perak dan Binjai.
Kultivar gelagah diambil dari Helvetia, Kutalimbaru dan Sunggal. Kultivar
berastagi diambil dari Kabanjahe, Merek dan Berastagi. Kultivar gambas diambil
dari Hamparan Perak, Labuhan Deli dan Stabat. Kultivar tebu merah diambil dari
Hamparan Perak, Stabat dan Sunggal. Klon dan varietas tebu yang ada di
Sumatera Utara diambil dari lokasi budidaya dan kebun koleksi PTP. Nusantara II
yaitu kabupaten Deliserdang dan Langkat. Daun yang diambil sebanyak dua daun
menggunakan GPS. Setelah sampel dikoleksi kemudian dicuci bersih, dilap pakai
tissue dan dimasukkan ke dalam kantong plastik yang ditambahkan es batu
sebagai pengawet di lapangan. Selanjutnya dibawa ke Laboratorium Terpadu
Fakultas Kedokteran Universitas Sumatera Utara Medan untuk dilakukan isolasi
atau ekstraksi DNA.
Isolasi DNA
Daun tebu yang berasal dari masing – masing klon dan kultivar yang
berbeda ditimbang masing-masing 0,2 – 0,3 g. Daun dipotong halus dengan
gunting secara melintang. Kemudian daun dimasukkan kedalam mortar untuk
digerus. Potongan daun yang ada dalam mortar ditambah nitrogen cair. Daun
digerus sampai halus berlawanan arah jarum jam. Kedalam mortar ditambah
Polyvinil Polypirolidone (PVPP) 0,1 g, kemudian digerus kembali hingga
benar-benar lumat seperti tepung. Hasil gerusan daun dipindahkan kedalam tabung
mikro 2 ml, masing-masing tabung diberi tanda sesuai dengan genotip yang
digunakan. Ke dalam tube ditambah 1 ml buffer ekstrak CTAB dan 10 µl
ß-mercapthoehtanol, kemudian divortex hingga rata 5 – 10 menit.. Tabung tersebut
diinkubasi kedalam penangas air bersuhu 650C selama 30 menit, setiap 10 menit
tabung dikocok perlahan secara regular. Setelah selesai dipanaskan dimasukkan
larutan KIAA 1 ml kedalam tabung. Kemudian tabung divortex lagi hingga
homogen. Tabung disentrifugasi selama 10 menit dengan kecepatan 13.000 rpm.
Bila sentrifugasi berhasil maka supernatant akan terpisah berdasarkan
berat jenisnya. Kemudian fase atas dipindahkan ke tabung mikro lain 2 ml dan
ditambah larutan KIAA 1 ml, di vortex sampai larutan terlihat seperti kristal dan
dipindahkan ke tabung mikro 1.5 ml dan ditambah isopropanol dingin 1 ml.
Tabung dikocok perlahan dan diperhatikan adanya benang-benang halus putih
yang muncul. Bila benang-benang halus putih sudah tampak jelas disimpan pada
suhu 40C selama 30 menit. Setelah 30 menit cairan isopropanol dibuang dan
benang-benang halus dalam tabung ditinggalkan lalu dikering anginkan.
Kemudian kedalam tabung ditambahkan 100 µl buffer TE dan dispin manual agar
terbentuk suspense antara pellet dengan buffer TE (Orozco-Castillo et.al, 1994).
Bila masa inkubasi selesai, ke dalam tabung ditambahkan 1 ml etanol
dingin 100% yang berisi suspense DNA dalam buffer TE dan dikocok kembali
secara perlahan dan disimpan pada suhu 40C selama 30 menit. Tabung
disentrifugasi kembali selama 5 menit pada kecepatan 13.000 rpm. Selanjutnya
fase atas dibuang, tabung dikeringanginkan kemudian ditambah 100 µl buffer TE
dan pellet DNA disuspensikan ke dalam buffer. Stock DNA yang diperoleh
disimpan pada suhu - 200C bila tidak digunakan (Orozco-Castillo et.al, 1994).
Uji Kualitas DNA
Uji kualitas DNA dilakukan dengan elektroforesis metode standar dengan
cara memasukkan 5 µl stok DNA ditambah 1 µl loading dye kedalam sumur gel
agarose 0.8%.
Sebelum dilakukan elektroforesis disiapkan gel agarose konsentrasi 0,8%
(b/v). Agarose ditimbang 1,04 g kemudian dilarutkan kedalam 130 ml buffer TAE
1x. Larutan tersebut dimasukkan kedalam Erlenmeyer kemudian dipanaskan dan
diaduk dengan pengaduk magnetik hingga larutan menjadi bening kemudian
Setelah larutan agak dingin (suhu ± 600C), ditambahkan 1 µl etidium
bromida, diaduk sambil dipanaskan kembali ± 2 menit dan didinginkan sampai
± 600C kemudian larutan dimasukkan dalam cetakan agar yang telah dipasang
sisir pembuat lubang dan dibiarkan memadat selama ± 40 menit. Gel yang telah
memadat dimasukkan kedalam elektroforesis dan diberi larutan TAE 1x ± 670 ml
(hingga terendam). Contoh DNA yang telah disiapkan dimasukkan kedalam
sumur gel. Setelah semua lubang sumur gel berisi selanjutnya dielektroforesis.
Running elektroforesis dilakukan pada kondisi 70 volt selama 60 menit.
Visualisasi DNA yang telah dielektroforesis dilakukan dengan UV transluminator
dan didokumentasikan.
Kualitas DNA dinyatakan baik bila hasil elektroforesis menunjukkan pola
pita yang terang dan fokus. Artinya DNA yang dihasilkan cukup solid, utuh dan
mempunyai konsentrasi yang tinggi.
Amplifikasi/ Genotyping
Amplifikasi mengikuti prosedur baku analisis RAPD, sesuai prosedur
William et al., (1990). Amplifikasi dilakukan dengan menggunakan beberapa
primer acak RAPD polimorfik yang digunakan berasal dari Operon Technologies,
Inc. (USA).
Persiapan awal amplifikasi adalah mencairkan komponen untuk running
PCR yaitu paket PCR produksi Promega (M7122) dalam kotak berisi pecahan es.
Kemudian dibuat larutan master yang terdiri atas : ddH2O 9,5 µl x 31 = 294,5 µl,
Go Green Tag 12,5 µl x 31 = 387,5 µl, Primer 1 µl x 31 = 31 µl. Dari tube master
mix diambil 23 µl dan dipindahkan ke tube yang lain sebanyak 30 tube untuk PCR
tabung dispin manual. Tabung berisi stok DNA dan campuran master dimasukkan
dalam blok sampel di mesin PCR dengan annealing 37 0 C. Reaksi amplifikasi
Gene Amp PCR Applied Biosystems di desain waktu, suhu, dan jumlah siklus
termal 45 kali (3 jam 51 menit). Proses amplifikasi PCR dapat dilihat pada tabel 2.
Setelah reaksi PCR selesai DNA hasil amplifikasi disimpan dalam suhu
[image:46.612.144.475.284.381.2]40C bila sedang tidak digunakan.
Tabel 2. Proses amplifikasi PCR
No Tahapan Suhu Waktu Jumlah Siklus 1 Denaturasi awal 940C 2 menit 1
2 Denaturasi 940C 1 menit 45
3 Annealing 370C 1 menit 45
4 Ekstension 720C 2 menit 45 5 Ekstension akhir 720C 10 menit 1 6 Kondisi akhir PCR 40C Tak terbatas 1
(Setiyo, 2001)
Bila tidak ditemukan band DNA yang jelas/terang maka akan dicobakan
optimasi proses amplifikasi PCR kembali terutama dalam waktu denaturasi awal
sampai dengan ekstension akhir. Pada penelitian ini dilakukan optimasi
pengenceran stok DNA dengan perbandingan 1 : 3 dimana 1 µl stok DNA dan 3
µl ddH2O.
Elektroforesis
Sebelum dilakukan elektroforesis disiapkan gel agarose konsentrasi 1,5%
(b/v). Agarose ditimbang 1,525 g kemudian dilarutkan dengan menambahkan 35
ml buffer TAE 1x. . Larutan tersebut dimasukkan kedalam Erlenmeyer kemudian
kemudian didinginkan dengan cara dialirkan tabung tersebut pada air yang
mengalir.
Setelah larutan agak dingin (suhu ± 600C), ditambahkan 1 µl etidium
bromida, diaduk sambil dipanaskan kembali ± 2 menit dan didinginkan sampai
± 600C kemudian larutan dimasukkan dalam cetakan agar yang telah dipasang
sisir pembuat lubang dan dibiarkan memadat selama ± 40 menit. Gel yang telah
memadat dimasukkan kedalam elektroforesis dan diberi larutan TAE 1x ± 670 ml
(hingga terendam). Hasil running PCR dimasukkan kedalam sumur gel
masing-masing 8 µl. Setelah semua lubang sumur gel berisi selanjutnya dimasukkan
marker 5 µl ditambah loading dye 1 µl kedalam sumur gel terakhir kemudian
dielektroforesis. Running elektroforesis dilakukan pada kondisi 70 volt selama 80
menit. Visualisasi DNA yang telah di elektroforesis dilakukan dengan UV
transluminator dengan cara meletakkan gel pada UV transluminator dan jika pita/
band molekul DNA kelihatan terang maka didokumentasikan.
Analisis Data
Penentuan Skoring Marka RAPD
RAPD merupakan marker dominan sehingga sulit dibedakan antara
individu homozigot dan heterozigot dominan. Untuk menentukan keragaman
genetik, produk PCR-RAPD diskoring berdasarkan muncul tidaknya pita DNA.
Pita yang muncul pada gel diasumsikan sebagai alel RAPD. Berdasarkan ada atau
tidaknya pita, profil pita diterjemahkan kedalam data biner. Pita yang muncul
Penentuan Ukuran Pasangan Basa
Matriks ketidaksamaan (
dissimilarity
) tiap kombinasi pasangan dihitung
berdasarkan
Dissmilarity Index Simple Matching
pada bootsraps 1000, sesuai
rumus :
djj =1-
∑
dengan
djj
ketidaksamaan antara i dan j, L jumlah lokus,
π
merupakan tingkat
ploidi dan m1 merupakan jumlah alel yang umum diantara I dan j untuk lokus l.
Matriks jarak atau ketidaksamaan genetik untuk semua kombinasi pasangan
individu dapat dilakukan dengan dua tipe analisis deskriptif dari keragaman : (i)
Principal Coordinates Analysis
(PCoA), suatu jenis analisis faktorial pada tabel
ketidaksamaan untuk mendapatkan group origin utama, dan (ii)
Neighbour-Joining Tree
(NJtree) berdasarkan Saitou dan Nei (1978) untuk memperoleh
gambaran dari kekerabatan diantara individu-individu. Perhitungan dan analisis
deskriptif ini menggunakan software DARwin5.05 (Perrier dan
Jacquemoundd-Collet, 2009).
PIC
(Polymorphic Information Content)
Untuk menentukan tingkat keinformatifan primer, dilakukan
penghitunganPolymorphic Information Content (PIC). PIC dihitung dengan rumus
PIC
i
= 2
fi
(1 -
fi
), dimana PIC
i
adalah PIC dari penanda i,
fi
merupakan frekuensi
pita yangmuncul, dan (1 -
fi
) merupakan frekuensi pita yang tidak muncul. Nilai
PIC untuk pita penanda dominan seperti penanda RAPD adalah 0.5 untuk
fi =
0.5
Uji Kuali
Uj
running e
tersebut da
Ha
yang teba
[image:49.595.115.516.348.528.2]sehingga d
Gambar 6. P
Sa
CTAB ya
nitrogen c
tas DNA
i kualitas
electrophore
apat dilihat
asil pengam
al dan men
dapat dianal
Profil kualita 579/BL; 2.P 9.Kentung; Perak; 14.B Sunggal; 18 T.Jati; 22.G Binjai Tim 29.Berastagampel yang
ang dimodi
cair pada sa
HASIL
DNA yang
esis
pada g
pada Gamb
matan kualita
nunjukkan
lisa dengan
s DNA genot PS 861; 3.PS 10.PSBM 90 BZ 134 Sung 8.Gambas Sta Gelagah Kar mur; 26.Mera
gi Berastagi; 3
diuji adalah
ifikasi deng
aat proses p
L DAN PEM
Hasil
g menggun
gel agarose
bar 6.
as DNA pad
bahwa pad
menggunak
tip tebu deng 863; 4.PS 92 01; 11.PSCO ggal; 15.BZ abat; 19. Kuni ro; 23.Gelaga ah K.Jahe; 2 30.Berastagi K
h sebanyak
gan penggu
penggerusan
MBAHASA
l
nakan nitrog
e 0.8%. Ha
da Gambar 6
da pita ter
kan PCR.
gan gel agaro 21; 5.PS 881; 902; 12.VM 134 T.Jati; 1 ing H.Perak; ah Sunggal; 27.Merah H.P Kabanjahe.
k 30 (tiga pu
unaan
β
-me
n (Toruan d
AN
gen cair d
asil
running
6. memperl
rsebut terda
ose sebesar 0. 6.PS 951; 7. MC 76-16; 13 16.Gambas H
20. Kuning S 24.Gelagah H Perak; 28.Be
uluh) meng
ercaptoetha
dan Hutabar
dinilai dari
g electropho
ihatkan pol
apat DNA
.8 % dimana GMP 1; 8.Ce .BZ 134 Ham H.Perak; 17.G
Sunggal; 21. K Helvetia; 25. erastagi Sibo
ggunakan m
anol, PVPP
rat, 1997).
hasil
oresis
a pita
tebu
: 1. R enning; mparan Gambas Kuning Merah olangit;
metode
P
dan
hasil gel agarose 0.8 % diperoleh 30 DNA tanaman tebu yang dapat digunakan
dalam proses PCR.
Profil Pita DNA Hasil Amplifikasi PCR
Hasil screening terhadap 13 primer menunjukkan bahwa hanya 10 primer
yang memberikan hasil yang polimorfik pada tanamantebu
(Saccharum spp.).
Primer-primer lain yang diujikan adalah OPB-05, OPD-01, OPH-09 (sampel tidak
teramplifikasi semua). Dari hasil uji coba didapatkan masing-masing primer
(OPA-02, OPA-08, OPB-11, OPB-17,OPC-07, OPC-15, OPD-05, OPE-04,
OPH-06, OPI-20) menunjukkan adanya pita-pita dengan ukuran yang bervariasi dan
pita polimorfik. Profil pita-pita yang dihasilkan dari ke-10 (sepuluh) primer yang
telah diuji, dapat digunakan untuk tujuan analisis variasi genetik dan
kekerabatantebu
(Saccharum spp.)
karena pita-pita yang dihasilkan cukup jelas
(Gambar 6). Penggunaan teknik RAPD sebagai penanda molekuler pada
penelitian ini, memperlihatkan polimorfisme yang cukup besar. Dari ke-10
(sepuluh) primer yang digunakan, semuanya menunjukkan polimorfisme lebih
dari 70% (Tabel 5).
Tingginya polimorfisme pita pada penelitian ini menunjukkan tingginya
keragaman genetik pada tanaman tebu
(Saccharum spp.)
yang diamati. Menurut
Lynch dan Milligan (1994), secara umum, RAPD dapat memberikan data
berharga tentang variasi genetik di dalam dan antara populasi spesies, mengingat
data diperlakukan secara benar. Berikut urutan primer yang digunakan dan hasil
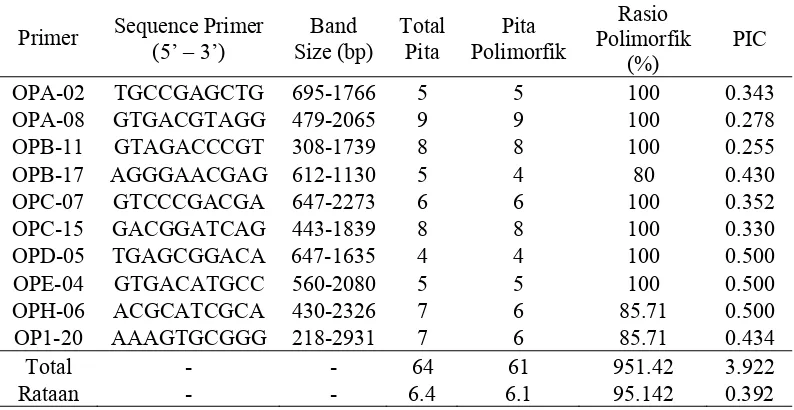
Tabel 3. Urutan primer dan hasil amplifikasi
Primer Sequence Primer (5’ – 3’)
Band Size (bp)
Total Pita
Pita Polimorfik
Rasio Polimorfik
(%)
PIC
OPA-02 TGCCGAGCTG 695-1766 5 5 100 0.343 OPA-08 GTGACGTAGG 479-2065 9 9 100 0.278 OPB-11 GTAGACCCGT 308-1739 8 8 100 0.255 OPB-17 AGGGAACGAG 612-1130 5 4 80 0.430 OPC-07 GTCCCGACGA 647-2273 6 6 100 0.352 OPC-15 GACGGATCAG 443-1839 8 8 100 0.330 OPD-05 TGAGCGGACA 647-1635 4 4 100 0.500 OPE-04 GTGACATGCC 560-2080 5 5 100 0.500 OPH-06 ACGCATCGCA 430-2326 7 6 85.71 0.500 OP1-20 AAAGTGCGGG 218-2931 7 6 85.71 0.434
Total - - 64 61 951.42 3.922
Rataan - - 6.4 6.1 95.142 0.392
Ket. PIC =
Polymorphic information content
Ukuran pita hasil amplifikasi bekisar antara 218-2931 bp dengan 4 – 9 pita
per primer. Total pita polimorfik dengan RAPD adalah 64 yang berasal dari 10
primer dengan rataan 6.4 pita per primer. Persentase polimorfik bervariasi antara
85.71 % sampai 100% dengan rataan sebesar 95.14 % untuk setiap primer. Dari
hasil menunjukkan bahwa tanaman tebu memiliki tingkat keragaman genetis yang
tinggi dan variasi genetis yang berlimpah. Nilai PIC dari tiap primer bervariasi
dari 0,255 (OPB – 11) sampai 0,500 (OPD-05, OPE 04 dan OPH-06) dengan rata
– rata 0.392.
Amplifikasi primer OPA-02 menghasilkan 5 fragmen DNA dan 5 pita
polimorfis dengankisaran ukuran 695-1766 bp. Semua fragmen(100 %) adalah
Gambar 7. Profil PCR primer OPA-02 dengan marker (DNA ladder 1 kb Amresco). Lajur paling kiri adalah marker dan angka secara berurutan adalah tanaman tebu 1. R 579/BL; 2.PS 861; 3.PS 863; 4.PS 921; 5.PS 881; 6.PS 951; 7. GMP 1; 8.Cenning; 9.Kentung; 10.PSBM 901; 11.PSCO 902; 12.VMC 76-16; 13.BZ 134 Hamparan Perak; 14.BZ 134 Sunggal; 15.BZ 134 T.Jati; 16.Gambas H.Perak; 17.Gambas Sunggal; 18.Gambas Stabat; 19. Kuning H.Perak; 20. Kuning Sunggal; 21. Kuning T.Jati; 22.Gelagah Karo; 23.Gelagah Sunggal; 24.Gelagah Helvetia; 25.Merah Binjai Timur; 26.Merah K.Jahe; 27.Merah H.Perak; 28.Berastagi Sibolangit; 29.Berastagi Berastagi; 30.Berastagi Kabanjahe.
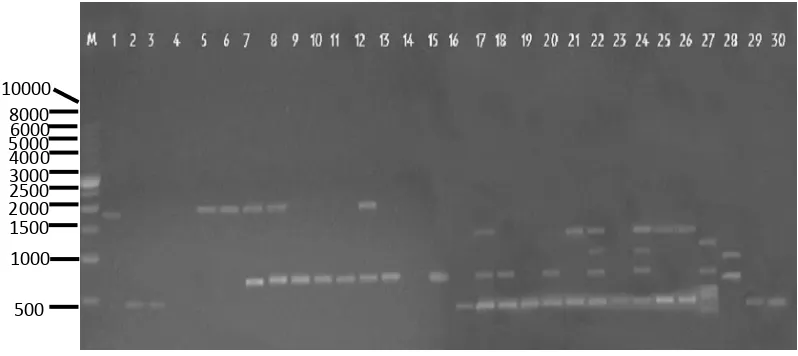
Amplifikasi primer OPA-08 menghasilkan 9 fragmen DNA dan 9 pita
polimorfis dengan kisaran ukuran 479-2065 bp. Semua fragmen(100 %) adalah
polimorfis (Gambar 8).
Gambar 8. Profil PCR primer OPA-08 dengan marker (DNA ladder 1 kb Amresco). Lajur paling kiri adalah marker dan angka secara berurutan adalah tanaman tebu 1. R 579/BL; 2.PS 861; 3.PS 863; 4.PS 921; 5.PS 881; 6.PS 951; 7. GMP 1; 8.Cenning; 9.Kentung; 10.PSBM 901; 11.PSCO 902; 12.VMC 76-16; 13.BZ 134 Hamparan Perak; 14.BZ 134 Sunggal; 15.BZ 134 T.Jati; 16.Gambas H.Perak; 17.Gambas Sunggal; 18.Gambas Stabat; 19. Kuning H.Perak; 20. Kuning Sunggal; 21. Kuning T.Jati; 22.Gelagah Karo; 23.Gelagah Sunggal; 24.Gelagah Helvetia; 25.Merah Binjai Timur; 26.Merah K.Jahe; 27.Merah H.Perak; 28.Berastagi Sibolangit; 29.Berastagi Berastagi; 30.Berastagi Kabanjahe
1500 2000 2500 3000 4000 5000 6000 8000 10000
500 1000
1500 2000 2500 3000 4000 5000 6000 8000 10000
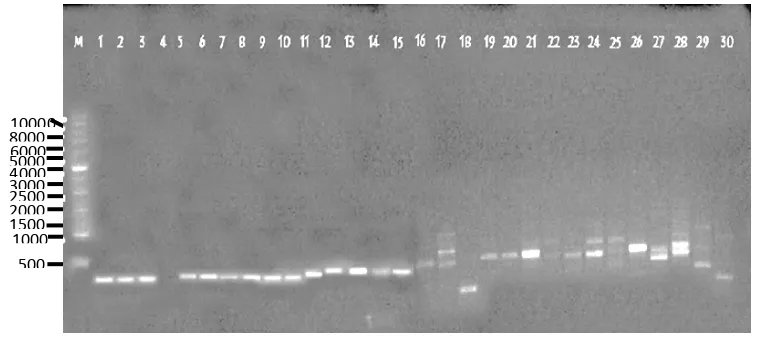
[image:52.595.111.510.464.642.2]Amplifikasi primer OPB-11 menghasilkan 8 fragmen DNA dan 8 pita
polimorfis dengan kisaran ukuran 308 – 1739 bp. Semua fragmen(100 %) adalah
[image:53.595.119.499.160.333.2]polimorfis (Gambar 9).
Gambar 9. Profil PCR primer OPB-11 dengan marker (DNA ladder 1 kb Amresco). Lajur paling kiri adalah marker dan angka secara berurutan adalah tanaman tebu 1. R 579/BL; 2.PS 861; 3.PS 863; 4.PS 921; 5.PS 881; 6.PS 951; 7. GMP 1; 8.Cenning; 9.Kentung; 10.PSBM 901; 11.PSCO 902; 12.VMC 76-16; 13.BZ 134 Hamparan Perak; 14.BZ 134 Sunggal; 15.BZ 134 T.Jati; 16.Gambas H.Perak; 17.Gambas Sunggal; 18.Gambas Stabat; 19. Kuning H.Perak; 20. Kuning Sunggal; 21. Kuning T.Jati; 22.Gelagah Karo; 23.Gelagah Sunggal; 24.Gelagah Helvetia; 25.Merah Binjai Timur; 26.Merah K.Jahe; 27.Merah H.Perak; 28.Berastagi Sibolangit; 29.Berastagi Berastagi; 30.Berastagi Kabanjahe
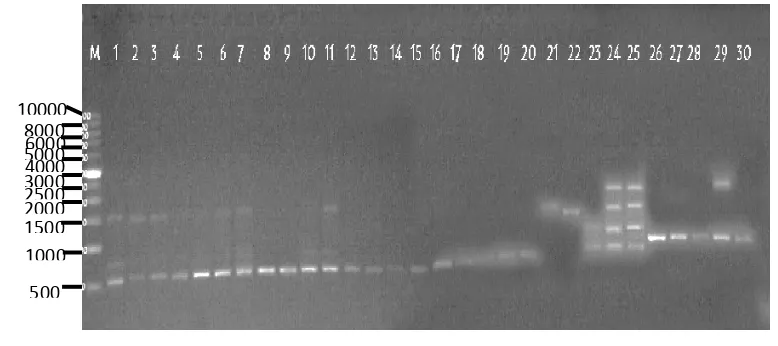
Amplifikasi primer OPB-17 menghasilkan 5 fragmen DNA dan 4 pita
polimorfis dengan kisaran ukuran 612 – 1130 bp. Semua fragmen(80 %) adalah
polimorfis (Gambar 10).
Gambar 10. Profil PCR primer OPB-17 dengan marker (DNA ladder 1 kb Amresco). Lajur paling kiri adalah marker dan angka secara berurutan adalah tanaman tebu 1. R 579/BL; 2.PS 861; 3.PS 863; 4.PS 921; 5.PS 881; 6.PS 951; 7. GMP 1; 8.Cenning; 9.Kentung; 10.PSBM 901; 11.PSCO 902; 12.VMC 76-16; 13.BZ 134 Hamparan Perak; 14.BZ 134 Sunggal; 15.BZ 134 T.Jati; 16.Gambas H.Perak; 17.Gambas Sunggal; 18.Gambas Stabat; 19. Kuning H.Perak; 20. Ku