LAMPIRAN
PARAMETER SATUAN KELAS KETERANGAN
Keterangan :
mg = miligram
ug = mikrogram ml = militer
L = liter
Bq = Bequerel
MBAS = Methylene Blue Active Substance ABAM = Air Baku untuk Air Minum Logam berat merupakan logam terlarut
Nilai di atas merupakan batas maksimum, kecuali untuk pH dan DO. Bagi pH merupakan nilai rentang yang tidak boleh kurang atau lebih dari nilai yang tercantum. Nilai DO merupakan batas minimum.
Arti (-) di atas menyatakan bahwa untuk kelas termasuk, parameter tersebut tidak dipersyaratkan
DAFTAR PUSTAKA
Anonim. Peraturan Pemerintah Nomor 82 Tahun 2001 tanggal 14 Desember 200 tentang Pengelolaan Kualitas Air dan Pengendalian Pencemaran Air.
Arceivala, S.J. 2000. Wastewater Treatment for Pollution Control. Second Edition. New Delhi : McGraw – Hill Publishing Company Limited.
Bender, G.T. 1987. Principle of Chemical Instrumentation. London : W.B. Saunders Company.
Effendi, H. 2003. Telaah Kualitas Air. Yogyakarta : Penerbit Kanisius.
Fifield, F.W. 1987. Principle And Practice Of Analytical Chemistry. Second edtion. New York : Intenational Textbook Company Limited.
Gandjar, I.G. dan Abdul Rohman. 2008. Kimia Farmasi Analisis. Cetakan ketiga. Yogyakarta : Pustaka Belajar.
Khopkar, S.M. 2008. Konsep Dasar Kimia Analitik. Jakarta : Penerbit UI-PRESS Linsley, R.K. 1979. Teknik Sumber Daya Air. Jakarta : Erlangga.
Maria, S. 2009. Penentuan Kadar Logam Besi (Fe) Dalam Tepung Gandum Dengan Cara Destruksi Basah Dan Kering Dengan Spektrofotometri Serapan Atom Sesuai Standar Nasional Indonesia (SNI) 01-3751-2006.
Diakses pada tanggal 4 Mei 2012.
Panduan Tatacara Penulisan Tugas Akhir. 2010. Dokumen Nomor Akad/05/2005. Medan : Fakultaas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara
Sutrisno, C.T 2006. Teknologi Penyediaan Air Bersih. Cetakan Keenam. Jakarta : PT Rineka Cipta.
BAB III
METODOLOGI PERCOBAAN
3.1 Desain Penelitian
Sampel diambil dengan metode purpose composite sampling pada pagi hari ketika debit air tidak begitu besar berkisar 5 – 150 m3/detik. Sampel diambil pada tiga titik, masing – masing pada jarak ⅓ dan ⅔ lebar sungai pada kedalaman ½ x kedalam sungai kemudian kedua sampel itu dicampurkan menjadi satu. Sampel kemudian dimasukan ke dalam botol kaca berwarna gelap tanpa gelembung. Sampel diambil di kawasan penduduk berpemukiman di sekitar sungai dimana masih banyak warga sekitar yang memanfaatkan air tersebut untuk keperluan sehari – hari. Sampel kemudian di bawa pada hari itu juga ke laboratorium untuk di destruksi dan kemudian dianalisis dengan spektrofotometer serapan atom. (Effendi, 2003)
3.2 Alat – alat
3.2 Bahan – bahan
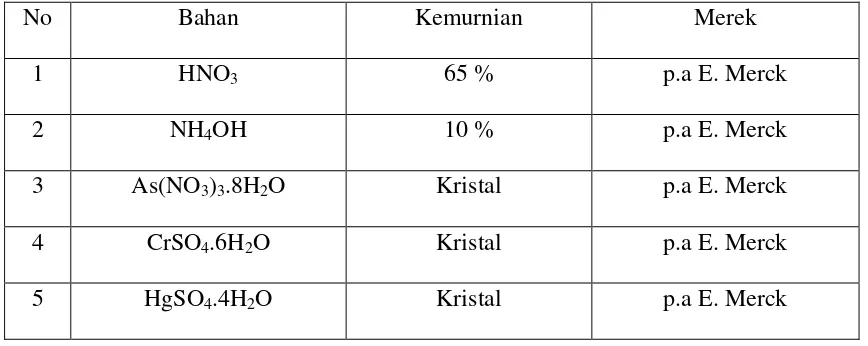
Adapun bahan – bahan yang dibutuhkan dalam analisis antara lain dapat dilihat pada tabel sebagai berikut :
Tabel 3.1. Bahan – bahan yang diperlukan untuk analisis
No Bahan Kemurnian Merek
1 HNO3 65 % p.a E. Merck
2 NH4OH 10 % p.a E. Merck
3 As(NO3)3.8H2O Kristal p.a E. Merck
4 CrSO4.6H2O Kristal p.a E. Merck
5 HgSO4.4H2O Kristal p.a E. Merck
3.3 Prosedur Percobaan
3.3.1 Pembuatan Larutan Standar
I. Larutan Standar Arsenik (As)
a. Pembuatan larutan induk As 1000 mg/L
Ditimbang dengan teliti 0,7857 g kristal As(NO3)2.8H2O p.a dalam
labu takar 250 ml larutkan dengan lebih kurang 1 ml HNO3 pekat,
b. Pembuatan larutan standar As 100 mg/L
Dipipet 10 ml larutan induk As 1000 mg/L kemudian dimasukkan ke dalam labu takar 100 ml lalu diencerkan dengan akuades hingga garis tanda dan dihomogenkan.
c. Pembuatan larutan standar As 10 mg/L
Dipipet 10 ml larutan standar As 100 mg/L kemudian dimasukkan ke dalam labu takar 100 mL lalu diencerkan dengan akuades hingga garis tanda dan dihomogenkan.
d. Pembuatan larutan seri standar As 1,0 ; 2,0 ; 3,0 ; 4,0 ; 5,0 mg/L
Dipipet masing – masing 5 mL, 10 mL, 15 mL, 20 mL dam 25 mL dari larutan standar As 10 mg/L dan dimasukkan masing – masing ke dalam labu ukur 50 mL, lalu diencerkan dengan akuades hingga garis tanda dan dihomogenkan.
II. Larutan Standar Kromium (Cr) a. Pembuatan larutan induk Cr 1000 mg/L
Ditimbang dengan teliti 0,7695 g kristal CrSO4.6H2O p.a lalu
c. Pembuatan larutan standar Cr 10 mg/L
Dipipet 10 ml larutan standar Cr 100 mg/L kemudian dimasukkan ke dalam labu ukur 100 mL lalu diencerkan dengan akuades hingga garis tanda dan dihomogenkan.
d. Pembuatan larutan standar Cr 1 mg/L
Dipipet 10 ml larutan standar Cr 10 mg/L kemudian dimasukkan ke dalam labu takar 100 mL lalu diencerkan dengan akuades hingga garis tanda dan dihomogenkan.
e. Pembuatan larutan seri standar Cr 0,1 mg/L
Dipipet 10 ml larutan standar Hg 1 mg/L kemudian dimasukkan ke dalam labu takar 100 mL lalu diencerkan dengan akuades hingga garis tanda dan dihomogenkan.
f. Pembuatan larutan seri standar Cr 0,2 ; 0,4 ; 0,6 ; 0,8 mg/L
Dipipet masing – masing 10 mL, 15 mL, 20 mL dam 25 mL dari larutan standar Cr 1 mg/L dan dimasukkan masing – masing ke dalam labu takar 50 mL, lalu diencerkan dengan akuades hingga garis tanda dan dihomogenkan.
III. Larutan Standar Merkuri (Hg)
a. Pembuatan larutan induk Hg 1000 mg/L
Ditimbang dengan teliti 1,0038 g kristal HgSO4.4H2O p.a lalu
dimasukkan ke dalam labu takar 250 ml lalu dilarutkan dengan kurang lebih 1 ml HNO3 pekat dan ditambahkan akuades hingga garis tanda
b. Pembuatan larutan standar Hg 100 mg/L
Dipipet 10 ml larutan induk Hg 1000 mg/L kemudian dimasukkan ke dalam labu takar 100 mL lalu diencerkan dengan akuades hingga garis tanda dan dihomogenkan.
c. Pembuatan larutan standar Hg 10 mg/L
Dipipet 10 ml larutan standar Hg 100 mg/L kemudian dimasukkan ke dalam labu ukur 100 mL lalu diencerkan dengan akuades hingga garis tanda dan dihomogenkan
d. Pembuatan larutan seri standar Hg 20 ; 30 ; 40 ; 50 mg/L
Dipipet masing – masing 10 mL, 15 mL, 20 mL dam 25 mL dari larutan standar Hg 1 mg/L dan dimasukkan masing – masing ke dalam labu takar 50 mL, lalu diencerkan dengan akuades hingga garis tanda dan dihomogenkan.
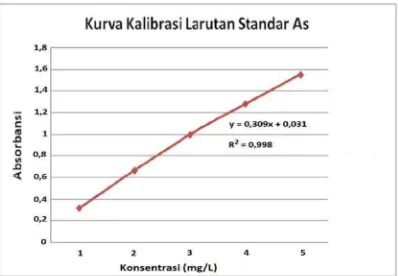
3.3.2. Pembuatan Kurva Standar
a. Kurva standar Arsenik (As)
c. Kurva standar Merkuri (Hg)
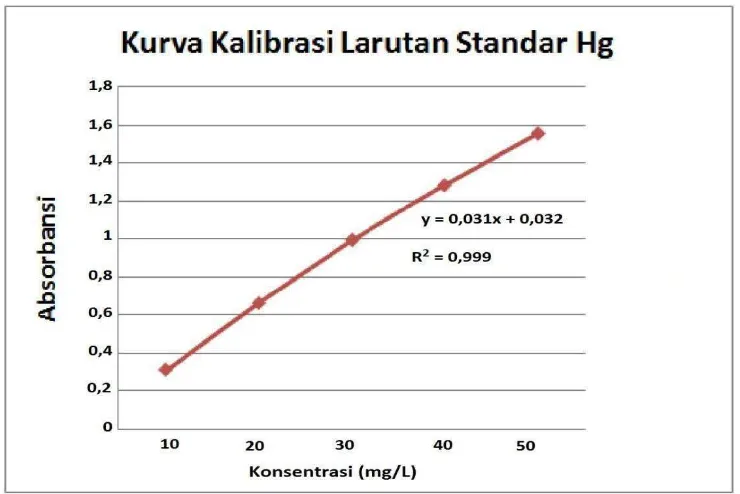
Diukur masing – masing absorbansi larutan seri standar Hg 10 ; 20 ; 30 ; 40 dan 50 mg/L dengan spektrofotometer serapan atom pada panjang gelombang (λ) = 288,4 nm.
3.3.3. Preparasi Sampel
a. Dipipet 100 mL sampel ke dalam erlenmeyer b. Dikeringkan di atas hot plate
c. Dilarutkan dengan HNO3 pekat ± 10 mL
d. Dipanaskan hingga ± ½ volum awal di atas hot plate e. Dibiarkan hingga suhu kamar
f. Ditambahkan akuades secukupnya g. Diatur pH 3 – 4 dengan NH4OH
h. Disaring dengan kertas saring Whatman 42 ke dalam labu takar 100 mL
i. Diencerkan dengan akuades hingga garis tanda
3.3.4. Pengukuran Absorbansi Sampel
Hasil preparasi sampel diukur nilai absorbansinya dengan spektrofotometer serapan atom pada panjang gelombang (λ) = 335,5 nm untuk analisis kadar logam As, panjang gelombang (λ) = 234,6 nm untuk analisis kadar logam Cr, dan panjang
3.4. Perhitungan
Untuk menentukan persamaan garis regresi dari kurva kalibrasi dapat ditentukan dengan metode Least Square sebagai berikut :
3.4.1. Konsentrasi As pada sampel
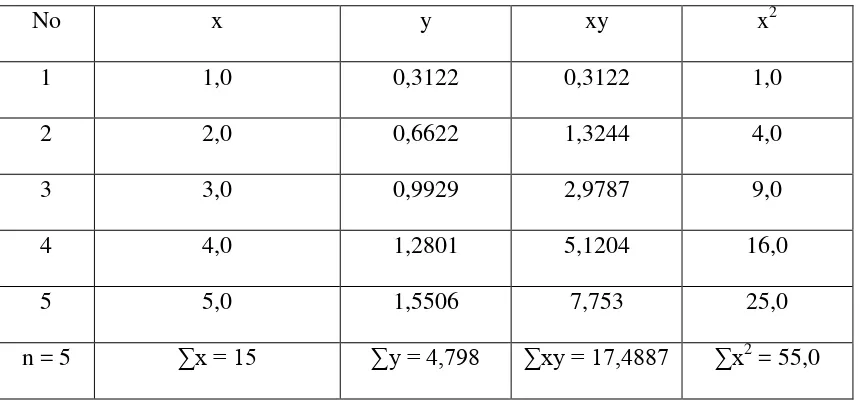
Tabel 3.1. Data perhitungan persamaan garis regresi untuk analisis As dengan Spektrofotometri Serapan Atom
No x y xy x2
1 1,0 0,3122 0,3122 1,0
2 2,0 0,6622 1,3244 4,0
3 3,0 0,9929 2,9787 9,0
4 4,0 1,2801 5,1204 16,0
5 5,0 1,5506 7,753 25,0
n = 5 ∑x = 15 ∑y = 4,798 ∑xy = 17,4887 ∑x2 = 55,0
Keterangan : x = konsentrasi larutan seri standar y = absorbansi
��= ∑ � 5 =
4,798
5 = 0,9596
�= �(Ʃ��)− (Ʃ�)(Ʃ�)
�(Ʃ�2)−(Ʃ�)2
= 5(17,4887)− (15)(4,798) 5(55)−(15)2
= 87,4435−71,97
275−225 = 0,3095
�=�� − ��̅
= 0,9596 – (0,3095 x 3,0) = 0,0311
Konsentrasi sampel dapat dihitung dengan menggunakan persamaan garis regresi yaitu :
�= � − �
� … … … … (2)
Keterangan : x = konsentrasi sampel y = absorbansi
a = kemiringan b = garis potong
Berdasarkan persamaan (2), maka konsentrasi As pada sampel adalah : Air Limbah Industri perulangan I
Campuran antara Air Limbah Industri dan Air Sungai Perulangan I
Campuran antara Air Limbah Industri dan Air Sungai Perulangan II
�=0,0546−0,0311
0,3095 = 0,075 ��/�
0,8588 – 0,075
% ralat = x 100% = 91,27 % 0,8588
Air Sungai Perulangan I
�=0,0360−0,0311
0,3095 = 0,015 ��/�
0,5407 – 0,015
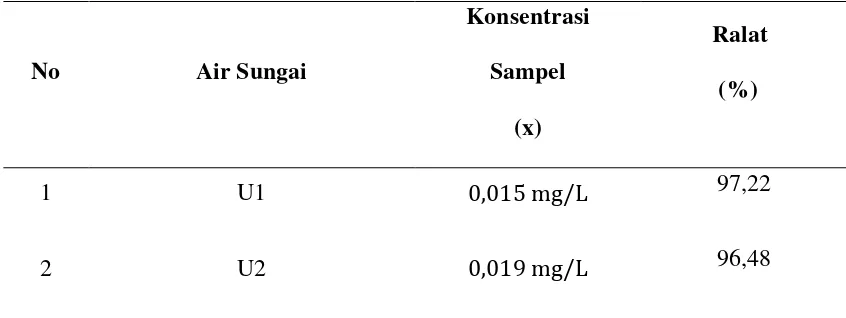
% ralat = x 100% = 97,22 % 0,5407
Air Sungai Perulangan II
�=0,0372−0,0311
0,3095 = 0,019 ��/�
0,5407 – 0,019
Konsentrasi dan % Ralat Air Limbah Industri ditunjukkan pada tabel 3.1.1, 3.1.2 dan 3.1.3 sebagai berikut :
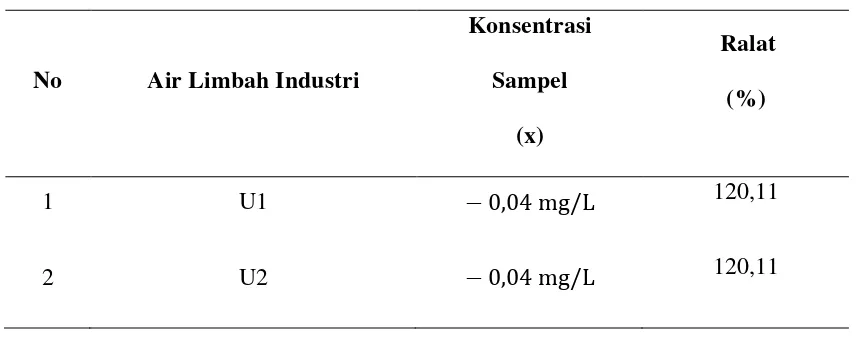
Tabel 3.1.1. Konsentrasi dan % Ralat Air Limbah Industri Untuk Logam Arsenik (As)
No Air Limbah Industri
Konsentrasi Sampel
(x)
Ralat (%)
1 U1 − 0,04 mg/L 120,11
2 U2 − 0,04 mg/L 120,11
Keterangan :
U1 = Perulangan I U2 = Perulangan I
Tabel 3.1.2. Konsentrasi dan % Ralat Campuran Antara Air Limbah Industri dan Air Sungai Untuk Logam Arsenik (As)
Keterangan :
U1 = Perulangan I U2 = Perulangan II
Tabel 3.1.3. Konsentrasi dan % Ralat Air Sungai Untuk Logam Arsenik (As)
No Air Sungai
Konsentrasi Sampel
(x)
Ralat (%)
1 U1 0,015 mg/L 97,22
2 U2 0,019 mg/L 96,48
Keterangan :
3.4.2. Konsentrasi Cr pada sampel
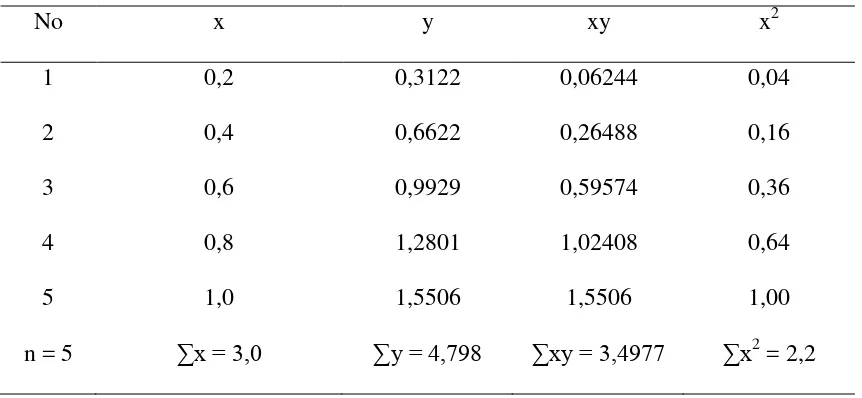
Tabel 3.2. Data perhitungan persamaan garis regresi untuk analisis Cr dengan Spektrofotometri Serapan Atom
No x y xy x2
1 0,2 0,3122 0,06244 0,04
2 0,4 0,6622 0,26488 0,16
3 0,6 0,9929 0,59574 0,36
4 0,8 1,2801 1,02408 0,64
5 1,0 1,5506 1,5506 1,00
n = 5 ∑x = 3,0 ∑y = 4,798 ∑xy = 3,4977 ∑x2 = 2,2
Keterangan : x = konsentrasi larutan seri standar y = absorbansi
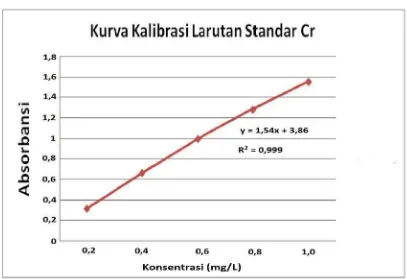
Persamaan garis regresi untuk kurva kalibrasi adalah :
y = ax + b (1) Keterangan : a = kemiringan ; b = garis potong
�̅= ∑ �
� =
3,0
5 = 0,6
= 17,4885−14,394
11−29 = 1,5472
�=�� − ��̅
= 4,798 – (1,5472 x 0,6) = 3,8697
3.4.3. Konsentrasi Hg pada sampel
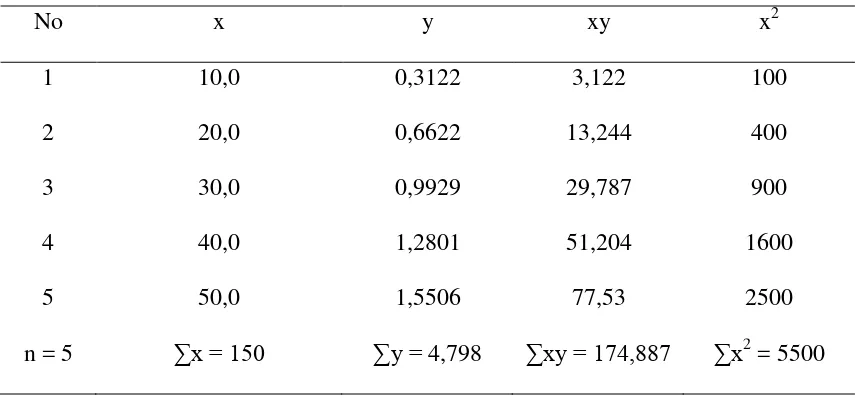
Tabel 3.3. Data perhitungan persamaan garis regresi untuk analisis Hg dengan Spektrofotometri Serapan Atom
Keterangan : x = konsentrasi larutan seri standar y = absorbansi
Persamaan garis regresi untuk kurva kalibrasi adalah :
= 874,435−719,7
27500−22500 = 0,0309
�=�� − ��̅
= 0,9596 – (0,0309 x 30) = 0,0326
BAB 4
HASIL DAN PEMBAHASAN
4.1. Hasil Analisis 4.1.1. Logam Arsenik (As)
Dari percobaan yang telah dilakukan untuk logam arsenik (As) dapat dilihat pada tabel 4.1, 4.2 dan 4.3 berikut :
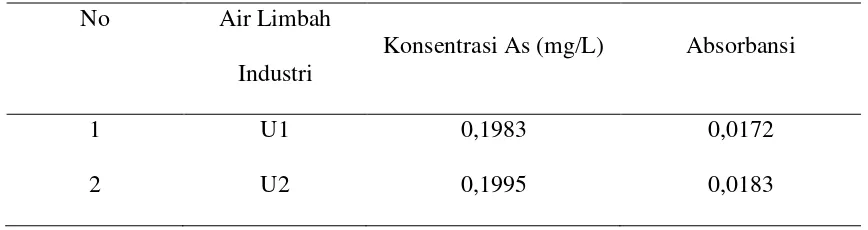
Tabel 4.1. Data hasil pengukuran absorbansi sampel air limbah industri PT. SMART (SINARMAS GROUP) untuk analisis logam As.
No Air Limbah
Industri
Konsentrasi As (mg/L) Absorbansi
1 U1 0,1983 0,0172
2 U2 0,1995 0,0183
Tabel 4.2. Data hasil pengukuran absorbansi sampel campuran antara air limbah industri PT. SMART Tbk (SINARMAS GROUP) dengan air sungai Sei Pallau di kelurahan Belawan II kecamatan Medan Belawan untuk analisis logam As.
No Air Sungai Konsentrasi As (mg/L) Absorbansi
1 U1 0,8544 0,0538
2 U2 0,8632 0,0546
Keterangan : U1 : perulangan I U2 : perulangan II
Tabel 4.3. Data hasil pengukuran absorbansi sampel air sungai Sei Pallau di kelurahan Belawan II kecamatan Medan Belawan untuk analisis logam As.
No Air Sungai Konsentrasi As (mg/L) Absorbansi
1 U1 0,5353 0,0360
2 U2 0,5462 0,0372
4.1.2. Logam Kromium (Cr)
Untuk analisis logam kromium (Cr) diperoleh hasil yang tersaji dalam tabel 4.4, 4.5 dan 4.6 di bawah ini :
Tabel 4.4. Data hasil pengukuran absorbansi sampel air limbah industri PT. SMART (SINARMAS GROUP) untuk analisis logam Cr.
No Air Limbah
Industri
Konsentrasi Cr (mg/L) Absorbansi
1 U1 0,0000 0,0002
2 U2 0,0000 0,0005
Tabel 4.5. Data hasil pengukuran absorbansi sampel campuran antara air limbah industri PT. SMART Tbk (SINARMAS GROUP) dengan air sungai Sei Pallau di kelurahan Belawan II kecamatan Medan Belawan untuk analisis logam Cr.
No Air Sungai Konsentrasi Cr (mg/L) Absorbansi
1 U1 0,0000 0,0005
2 U2 0,0000 0,0006
Keterangan : U1 : perulangan I U2 : perulangan II
Tabel 4.6. Data hasil pengukuran absorbansi sampel air sungai Sei Pallau di
kelurahan Belawan II kecamatan Medan Belawan untuk analisis logam Cr. No Air Sungai Konsentrasi As (mg/L) Absorbansi
1 U1 0,0000 0,0007
2 U2 0,0000 0,0009
4.1.3. Logam Merkuri (Hg)
Tabel 4.7, 4.8 dan 4.9 di bawah ini menunjukkan hasil dari analisis logam Hg yang terdapat dalam sampel air limbah industri dan air sungai :
Tabel 4.7. Data hasil pengukuran absorbansi sampel air limbah industri di PT. SMART (SINARMAS GROUP) untuk analisis Hg.
No Air Sungai Konsentrasi Hg (mg/L) Absorbansi
1 U1 0,0000 0,0017
2 U2 0,0000 0,0019
Tabel 4.8. Data hasil pengukuran absorbansi sampel campuran antara air limbah industri PT. SMART Tbk (SINARMAS GROUP) dengan air sungai Sei Pallau di kelurahan Belawan II kecamatan Medan Belawan untuk analisis logam Hg.
No Air Sungai Konsentrasi Hg (mg/L) Absorbansi
1 U1 0,0000 0,0006
2 U2 0,0000 0,0008
Keterangan : U1 : perulangan I U2 : perulangan II
Tabel 4.9. Data hasil pengukuran absorbansi sampel air sungai Sei Pallau di
kelurahan Belawan II kecamatan Medan Belawan untuk analisis logam Hg. No Air Sungai Konsentrasi Hg (mg/L) Absorbansi
1 U1 0,0000 0,0027
2 U2 0,0000 0,0029
4.2. Pembahasan
Pada hasil penelitian diatas dapat dilihat bahwa kandungan Arsenik (As) pada air limbah industri PT. SMART Tbk (SINARMAS GROUP) berkisar antara 0,1983 – 0,1995 mg/L, sedangkan untuk Kromium (Cr) adalah 0,0000 mg/L dan untuk kadar Merkuri (Hg) adalah 0,0000 mg/L. Kandungan Arsenik (As) pada campuran antara air limbah industri PT. SMART Tbk (SINARMAS GROUP) dan air sungai Sei Pallau di kelurahan Belawan II kecamatan Medan Belawan berkisar antara 0,8544 - 0,8632 mg/L, sedangkan untuk Kromium (Cr) berkisar adalah 0,0000 mg/L dan untuk kadar Merkuri (Hg) adalah 0,0000 mg/L. Kandungan Arsenik (As) pada air sungai Sei Pallau di kelurahan Belawan II kecamatan Medan Belawan (berkisar antara 0,5353 - 0,5462 mg/L, sedangkan untuk kadar Kromium (Cr) berkisar adalah 0,0000 mg/L dan untuk Merkuri (Hg) adalah 0,0000 mg/L.
BAB 5
KESIMPULAN DAN SARAN
5.1. Kesimpulan
Berdasarkan analisis yang telah dilakukan, dapat disimpilkan beberapa hal antara lain adalah :
2. Berdsarkan Peraturan Pemerintah Nomor 82 Tahun 2001 tanggal 14 Desember 2001 tentang Pengelolaan Kualitas Air dan Pengendalian Pencemaran Air, maka sungai Sei Pallau kelurahan Belawan II kecamatan Medan Belawan termasuk air kelas empat (IV). Yaitu air yang diperuntukannya dapat digunakan untuk mengairi peternakan, pertanaman, dan atau peruntukann lain yang mempersyratkan mutu air yang sama dengan kegunaan tersebut, berdasarkan kandungan logam arsenik (As), kromium (Cr), dan merkuri (Hg)
5.2. Saran
BAB 2
TINJAUAN PUSTAKA
2.1 Air
Semua makhluk hidup ini memerlukan air, karena air merupakan kebutuhan dasar bagi kehidupan. Khususnya manusia, air diperlukan untuk berbagai keperluan, antara lain rumah tangga, industri, pertanian, dan sebagainya. Dalam memenuhi kebutuhan air, manusia selalu memperhatikan kualitas dan kuantitas air. Kualitas yang cukup diperoleh dengan mudah karena adanya siklus hidrologi, yakni siklus ilmiah yang mengatur dan memungkinkan tersedianya air permukaan dan air tanah. Namun demikian, pertambahan penduduk dan kegiatan manusia menyebabkan pencemaran sehingga kualitas air yang baik dan memenuhi persyaratan tertentu sulit diperoleh.
berbagai cara itu, dapat diidentifikasi masalah secara kasar yang menjadi titik tolaknya melakukan penelitian (Sutrisno, 2006).
Pengembangan sumber daya air (water resources) memerlukan adanya konsepsi, perencanaan, perancangan, konstruksi, dan operasi fasilitas - fasilitas untuk pengendalian dan pemanfaatan air. Pada dasarnya hal – hal tersebut merupakan tugas para insinyur sipil, tetapi jasa – jasa para ahli di bidang lain juga dibutuhkan. Masalah sumber daya air juga merupakan urusan para ahli ekonomi, politik, geologi, insinyur listrik dan mesin, ahli kimia, biologi, setiap para ahli di bidang ilmu pengetahuan alam maupun ilmu pengetahuan sosial lainnya. Setiap proyek pengembangan sumber daya air akan menghadapi seperangkat kondisi fisik yang unik yang harus di atasi secara khusus ; sehingga desain baku (standar) yang menuju kepada penyelesaian yang sederhana.
Air dikendalikan dan diatur guna memenuhi berbagai tujuan yang luas. Pengendalian banjir, drainasi lahan, pembuangan limbah, serta desain – desain untuk gorong – gorong jalan raya merupakan penerapan teknik sumber daya air pada pengendalian air (control of water), sehingga tidak menimbulkan kerusakan yang berlebihan terhadap harta benda, gangguan terhadap masyarakat , atau kehilangan nyawa. Penyediaan air, irigasi, pengembangan tenaga - hidroelektrik, serta penyempurnaan alur pelayaran adalah contoh – contoh dari pemanfaatan air (utilitization of water) untuk tujuan – tujuan yang berguna. Pencemaran mengancam
air (water-quality management) telah menjadi tahapan yang penting dalam teknik sumber daya (Linsley, R.K. 1979).
Pada prinsipnya, jumlah air di alam ini tetap dan mengikuti suatu aliran yang dinamakan siklus hidrologi (cyclus hydrologie). Dengan adanya penyinaran matahari, maka air yang ada di permukaan bumi akan menguap dan membentuk uap air. Karena adanya angin, maka uap air ini akan bersatu dan berada di tempat yang tinggi yang sering dikenal dengan nama awan. Oleh angin, awan ini akan terbawa makin lama makin tinggi di mana temperatur di atas makin rendah, yang menyebabkan titik – titik air jatuh ke bumi sebagai hujan. Air hujan ini sebagian mengalir ke dalam tanah, jika menjumpai lapisan rapat air akan berkurang, dan sebagian air akan mengalir di atas lapisan rapat ini. Jika air ini ke luar pada permukaan bumi, maka air ini disebut mata air. Air permukaan yang mengalir di permukaan bumi, umumnya adalah berbentuk sungai – sungai dan jika melalui suatu tempat rendah (cekung) maka air akan berkumpul, membentuk suatu danau atau telaga. Tetapi banyak diantarnya yang mengalir ke laut dan kemudian akan mengikuti siklus hidrologi ini :
1. Air laut
2. Air atmosfer, air meteorologik
Dalam keadaan murni, sangat bersih, karena dengan adanya pengotoran udara yang disebabkan oleh kotoran – kotoran industri / debu dan lain sebagainya. Maka untuk menjadikan hujan sebagai sumber air minum hendaknya pada waktu menampung air hujan jangan dimulai pada saat hujan mulai turun karena masih mengandung banyak kotoran.
Selain itu air hujan mempunyai sifat agresif terutama terhadap pipa – pipa penyalur maupun bak – bak reservoir (tandon), sehingga hal ini akan mempercepat terjadinya korosi (karatan). Juga air hujan ini mempunyai sifat lunak, sehingga akan boros terhadap pemakaian sabun.
3. Air Permukaan
Adalah air hujan yang mengalir di permukaan bumi. Pada umunya air permukaan ini akan mendapat pengotoran selama pengalirannya, misalnya yang diperoleh dari lumpur, batang – batang kayu, daun – daun, kotoran industri kota dan sebagainya. Beberapa pengotoran ini , untuk masing – masing air permukaan akan berbeda – beda, tergantung pada daerah pengaliran air permukaan ini. Jenis pengotorannya adalah merupakan kotoran fisik, kimia dan bakteriologi.
Setelah memahami suatu pengotoran, pada suatu air permukaan itu akan mengalami suatu proses pembersihan sendiri yang dapat dijelaskan sebagai berikut :
Udara yang mengandung oksigen atau gas O2 akan membantu mengalami proses
Panjangnya daerah perusakan ini tergantung pada :
• Sifat dan banyak pengotoran - Aliran sungai (cepat atau lambat) - Suhu/temperatur
• Kadar oksigen yang terlarut
Air permukaan ada 2 macam yaitu : a. Air sungai
b. Air rawa/danau
a. Air Sungai
Dalam penggunaanya sebagai air minum, haruslah mengalami suatu pengolahan yang sempurna, mengingat bahwa air sungai ini pada umumnya mempunyai derajat pengotoran yang tinggi sekali. Debit yang tersedia untuk memenuhi kebutuhan pada umumnya dapat mencukupi.
b. Air rawa/danau
Jadi untuk pengambilan air, sebaiknya pada kedalaman tertentu di tengah – tengah agar endapan – endapan Fe dan Mn tak terbawa, demikian pula dengan lumut yang ada pada permukaan rawa/telaga.
4. Air Tanah
Air tanah terbagi atas :
a. Air Tanah Dangkal
Terjadi karena daya proses peresapan air dari permukaan tanah. Lumpur akan tertahan, demikian pula dengan sebagian bakteri, sehingga air tanah akan jernih tetapi lebih banyak mengandung zat kimia (garam – garam yang terlarut) karena melalui lapisan tanah yang mempunyai unsur – unsur kimia tertentu untuk masing – masing lapisan tanah. Lapisan tanah disini berfungsi sebagai saringan. Disamping penyaringan, pengotoran juga masih terus berlangsung, terutama pada muka air yang dekat dengan muka tanah, setelah menemui lapisan rapat air, air akan terkumpul merupakan air tanah dangkal dimana air tanah ini dimanfaatkan untuk sumber air minum melalui sumur – sumur dangkal.
b. Air Tanah Dalam
5. Mata Air
Mata air adalah air tanah yang keluar dengan sendirinya ke permukaan tanah. Mata air yang berasal dari tanah dalam, hampir tidak terpengaruh oleh musim dan kualitasnya sama dengan keadaan air dalam (Sutrisno, 2006).
2.2 Sifat - Sifat Air
Air memiliki karateristik yang khas yang tidak dimiliki oleh senyawa kimia yang lain. Karateristik tersebut adalah sebagai berikut :
1. Pada kisaran suhu yang sesuai bagi kehidupan, yakni 00C (320F) – 1000C, air berwujud cair. Suhu 00C merupakan titik beku (freezing point) dan suhu 1000C merupakan titik didih (boiling point) air. Tanpa sifat tersebut, air yang terdapat di dalam jaringan tubuh makhluk hidup maupun air yang terdapat di laut, sungai, danau dan badan air yang lain akan berada dalam bentuk gas atau padatan; sehingga tidak akan terdapat kehidupan di muka bumi ini, karena sekitar 60% - 90% bagian sel makhluk hidup adalah air.
Proses ini memerlukan energi panas dalam jumlah yang besar. Sebaliknya, proses perubahan uap air menjadi uap air menjadi cairan (kondensasi) melepaskan energi yang besar.
4. Air merupakan pelarut yang baik. Air mampu melarutkan berbagai jenis senyawa kimia. Air hujan mengandung senyawa kimia dalam jumlah yang sangat sedikit, sedangkan air laut dapat mengandung senyawa kimia hingga 35.000/liter.
5. Air memiliki tegangan permukaan yang tinggi. Suatu cairan dikatakan memiliki tegangan permukaan yang tinggi jika tekanan antar-molekul cairan tersebut tinggi. Tegangan permukaan yang tinggi meyebabkan air memiliki sifat membasahi suatu bahan secara baik (higher wetting ability) (Effendi, 2003).
2.4 Parameter Fisika Air
Parameter – parameter fisika yang biasa digunakan untuk menentukan kualiatas air meliputi cahaya, suhu, kecerahan dan kekeruhan, dan warna.
a. Cahaya
Cahaya matahari yang mencapai permukaan perairan tersebut sebagian diserap dan sebagian direfleksikan kembali.
b. Suhu
Suhu suatu badan air dipengaruhi oleh musim, lintang (latitude), ketinggian dari permukaan laut (altitude), waktu dalam hari, sirkulasi udara, penutupan awan, dan aliran serta kedalaman badan air. Perubahan suhu berpengaruh terhadap proses fisika, kimia, dan biologi badan air. Suhu juga sangat berperan mengendalikan kondisi ekosistem perairan.
Peningkatan suhu mengakibatkan peningkatan viskositas, reaksi kimia, evaporasi, dan volatilisasi. Peningkatan suhu juga menyebabkan penurunan kelarutan gas dalam air, misalnya gas O2, CO2, N2, CH4, dan sebagainya. Selain itu, peningkatan suhu juga
menyebabkan peningkatan kecepatan metabolisme dan respirasi organisme air, dan selanjutnya mengakibatkan peningkatan konsumsi oksigen.
c. Kecerahan dan Kekeruhan
yang hanya disebabkan oleh bahan – bahan tersuspensi yang dapat menyebabkan kekeruhan dipisahkan terlebih dahulu. Warna tampak adalah warna yang hanya tidak disebabkan oleh bahan terlarut, tetapi juga oleh bahan tersuspensi (Effendi, 2003).
2.5 Parameter Kimia Air
Beberapa defenisi kimia yang sering digunakan dalam penentuan parameter kimia adalah :
1. Berat atom, yaitu berat atom dari suatu unsur yang didasarkan pada berat atom isotop C12 sebagai standar.
2. Berat molekul, yaitu berat atom total dari semua atom yang terdapat dalam molekul.
3. Berat ekuivalen, yaitu perbandingan antara berat molekul dan jumlah mol dari ion H+ . Perhitungan berat ekuivalen ditunjukkan dalam persamaan :
BM
Jika kadar suatu mineral mencapai 7.000 ppm, maka konversi menjadi mg/liter harus mengikuti persamaan :
mg/liter
ppm = (1,2) densitas (spesific gravity)
5. Milli-mol/liter (mmol/liter), yaitu satuan yang sering digunakan untuk menyatakan kelarutan gas dalam air. Satuan ini ditentukan dengan persamaan :
berat
mmol/liter = (1,3) berat molekul
Dalam hal kualitas air, lebih baik menggunakan satuan mg/liter dan ug/liter daripada ppm dan ppb, meskipun keduanya setara. Satuan mg/liter dan ug/liter dengan jelas menunjukkan bahwa terdapat sejumlah bobot (berat) tertentu yang dinyatakan dengan satuan mg dan g, di dalam sejumlah volume cairan yang dinyatakan dengan satuan liter. Satuan ppm dan ppb tidak dapat menggambarkan dengan jelas kadar bahan yang dimaksud ; bobot per volume atau bobot per bobot atau volume per volume dan sebagainya.
b. Kesadahan
Kesadahan (hardness) adalah gambaran kation logam divalen (valensi dua). Kation – kation ini dapat bereaksi dengan sabun (soap) membentuk endapan (prespitasi) maupun dengan anion-anion yang terdapat di dalam air membentuk endapan atau karat pada peralatan logam.
Pada perairan tawar, kation divalen yang paling berlimpah adalah kalsium dan magnesium, sehingga kesadahan pada dasarnya ditentukan oleh jumlah kalsium dan magnesium. Kalsium dan magnesium berikatan dengan anion penyusun alkalinitas, yaitu bikarbonat dan karbonat.
c. Kesadahan Oksigen Biokimiawi atau Biochemical Oxygen Demand (BOD) Dekomposisi bahan organik pada dasarnya terjadi melalui dua tahap. Pada tahap pertama, bahan organik diuraikan menjadi bahan anorganik. Pada tahap kedua, bahan anorganik yang lebih stabil, misalnya amonia mengalami oksida menjadi nitrit dan nitrat (nitrifikasi). Pada penentuan nilai BOD, hanya dekomposisi tahap pertama yang berperan, sedangkan oksidasi bahan anorganik (nitrifikasi) dianggap sebagai pengganggu.
2.3 Air Limbah
Air limbah dapat berasal dari berbagai sumber, antara lain dari rumah tangga, kota, industri, pertanian, dan sebagainya. Dan seperti telah disebutkan di atas, bahwa air limbah ini dapat mengakibatkan kematian bagi organisme air. Perlu diketahui, bahwa pengukuran dampak air limbah pada sistem perairan dapat diperoleh dengan berbagai macam cara, antara lain dengan menggunakan toxicity biossay. Biossay ini dilakukan untuk memperkirakan dampak air limbah pada organisme air. Dalam hal ini parameter yang diukur adalah median lethal concentration (LC50), yaitu
pada konsentrasi mana 50 % dari organisme yang diuji mengalami kematian. Banyak cara untuk menentukan LC50, dan salah satu diantaranya adalah menggunakan
beberapa akuarium kecil dengan berbagai konsentrasi air limbah, dan sebagian tanpa adanya air limbah sebagai kontrol. Organisme yang diuji dipilih ikan muda yang merupakan populasi terbesar di perairan (Sutrisno, 2006).
dari kota ke kota tapi juga dari musim ke musim dari waktu yang sama ke waktu dalam kota.
Jarak atau selisih dari harga yang diberikan adalah sejenis untuk air limbah kota yang dimana adalah karakter domestik yang lebih banyak. Limbah pada umumnya adalah organik yang alami, mengandung “nutrisi” seperti karbon, nitrogen dan pospor diantara lainnya, yang mempengaruhi kerelatifan tinggi dari mikroorganisme. Secara cepat, penambahan unsur – unsur biologi dari unsur – unsur organik yang bertindak sama sebagai aliran limbah yang menuju parit pembuangan dalam tanah, oleh karena itu diperlukan suatu pengubahan beberapa karateristik yang berdasarkan aliran waktu. Selanjutnya semua nilai tersebut didapatkan dalam bentuk gram perkapita untuk fasilitas yang digunakan dalam tujuan perancangan dan juga digunakan sebagai perbandingan dari tempat yang berbeda. Nilai ini diberikan pada batas milligram perliter yang sesuai dengan kenyataan bahwa air tersebut digunakan secara bervariasi yang dapat menarik perhatian masyarakat, khususnya antara pengembangan daerah - daerah dan yang sedang dikembangkan.
Pada kantor – kantor, pabrik – pabrik, sekolah – sekolah, dan sebagainya. Harga BOD secara umum diguanakan setengah dari 54 gram perorang atau sama. Untuk restauran dan kafe makanan dari masing – masing dapat dikontribusikan oleh satu – empat 54 gram BOD. Teater dan bioskop dikontribusikan satu – enam dari 54 gram BOD perbangku. Hotel dan rumah sakit yang ditangani oleh yang lainnya, dapat dikontribusikan dalam waktu 1,5 ke 2,5 lebih daripada biasanya 54 gram dari BOD perorang dan perhari. Air limbah domestik adalah mula – mula dari sumber nutrisi sebagai nitrogen dan fosfor, paling banyak limbah industri yang sumbernya mempunyai kerelatifan sedikit pada air limbah perkotaan.
Penggunaan air limbah yang jaraknya dari 180 ke 300 1 orang paling banyak dikelompokkan pada kelompok bagian limbah dari penggunaan secara terus menerus dibeberapa kota dari daerah yang dikembangkan dapat lebih tinggi di 500 1 orang. Terakhir 80 – 85 % dari pensuplaian pensuplaian air yang dikembalikan sebagai air limbah. Kemudian, jika pensuplaiannya adalah 180 1 perorang dan perhari, aliran air limbah Q – 80 % yang diberikan oleh :
Q = (180) (0,8) = 144 = 150 1 perorang dan perhari 54 gram perorang dan perhari x 103
Air mempunyai sifat melarutkan bahan kimia. Abel Wolman menyatakan bahwa air rumusnya adalah : H2O + X, dimana X merupakan zat – zat yang dihasilkan
air buangan manusia selama beberapa tahun. Dengan bertambahnya aktivitas manusia, maka faktor X tersebut dalam air akan bertambah dan merupkan masalah.
Faktor X merupakan zat – zat kimia yang mudah larut dalam air dan dapat menimbulkan masalah sebagai berikut :
a. Toksisitas
b. Reaksi – reaksi kimia yang menyebabkan : 1. Pengendapan yang berlebihan.
2. Timbulnya busa yang menetap, yang sulit untuk dihilangkan. 3. Timbulnya respon fisiologis yang tidak diharapkan terhadap rasa 4. Perubahan perwujudan fisik air.
Zat – zat kimia yang larut dalam air yang dapat mengganggu atau membahayakan kesehatan manusia antara lain :
a. Arsen
- Kadar maksimum yang masih dibolehkan dalam air 0,05 mg/l. - Dikenal sebagai racun.
b. Merkuri (air raksa)
- Kadar maksimum yang masih dibolehkan dalam air minum 0,02 mg/l. - Dikenal sebagai racun pada pekerja dan ikan.
- Terdapat di dalam air alam kurang 1 mg/l. - Terdapat di dalam makanan 10 – 70.
c. Kromium
- Kadar maksimum yang masih dibolehkan dalam air 0,05 mg/l. - Karsinogenik pada pernafasan.
- Bersifat komulatif dalam daging tikus pada kadar mg/l (Sutrisno, 2006).
2.3 Proses Pengolahan Air
Yang dimaksud dengan pengolahan adalah usaha – usaha teknis yang dilakukan untuk mengubah sifat – sifat suatu zat. Hal ini penting artinya bagi air minum, karena dengan adanya pengolahan ini, maka akan didapatkan suatu air minum yang memenuhi standar air minum yang telah ditetapkan.
pasir, serta mengurangi kadar zat – zat organik yang ada dalam air yang akan diolah.
2. Pengolahan kimia, yaitu suatu tingkat pengolahan dengan menggunakan zat – zat kimia untuk membantu proses pengolahan selanjutnya. Misalnya : dengan pembubuhan kapur dalam proses pelunakan dan sebagainya.
3. Pengolahan bakteriologi, yaitu suatu tingkat pengolahan untuk membunuh/memusnahkan bakteri – bakteri yang terkandung dalam air minum yakni dengan cara/jalan membubuhkan kaporit.
Pengolahan sebagian atau partial treatment , misalnya diadakan pengolahan kimiawi dan/atau pengolahan bakteri logik saja.
Pengolahan ini pada umumnya dilakukan untuk : a. Mata air bersih
b. Air dari sumur yang dangkal/dalam
2.3.1 Unit – Unit Pengolahan Air Minum
1. Bangunan Penangkap Air
Bangunan penangkap air ini merupakan suatu bangunan untuk menangkap/mengumpulkan air dari suatu sumber asal air, untuk dapat dimanfaatkan. Fungsi dari bangunan penangkap air ini sangat penting artinya untuk menjaga kontinuitas pengaliran.
2. Bangunan Pengendap Pertama
Bangunan pengendap pertama dalam pengolahan ini berfungsi untuk mengendapkan partikel – partikel padat dari air sungai dengan gaya gravitasi.
3. Pembubuhan Koagulant
Koagulant adalah bahan kimia yang dibutuhkan pada air untuk membantu proses pengendapan partikel – partikel kecil yang tak dapat mengendapkan dengan sendirinya (secara gravimetris). Sesuai dengan nama dari unit ini, maka unit ini berfungsi untuk membubuhkan koagulant secara teratur sesuai dengan kebutuhan (dengan dosis yang tepat).
Alat pembubuh koagulant yang banyak kita kenal sekarang, dapat dibedakan dari cara pembubuhannya :
Bahan/zat kimia yang dipergunakan sebagai koagulant. - Alumminium Sulfat
Biasanya disebut sebagai tawas. Bahan ini banyak dipakai karena efektif untuk menurunkan kadar karbonate. Bahan ini paling ekonomis (murah) dan mudah didapat pada pasaran serta mudah disimpan.
Bentuk : serbuk, kristal, koral.
4. Banguanan Pengaduk Cepat
Unit ini untuk meratakan bahan/zat kimia (koagulant) yang ditambahkan agar dapat bercampur dengan air secara baik, sempurna dan cepat.
Cara pengadukan :
- Alat mekanis : motor dengan alat pengadukannya. - Penerjun air : dengan bantuan udara bertekanan.
5. Bangunan Pembentuk Floc
Unit ini berfungsi untuk membentuk partikel padat yang lebih besar supaya dapat diendapkan dari hasil reaksi partikel kecil (koloid) dengan bahan/zat koagulant yang kita bubuhkan.
Faktor – faktor yang mempengaruhi bentuk floc – floc (= partikel yang lebih besar dan bisa mengendap dengan gravitasi).
- Kekeruhan pada baku air - Tipe dari suspensi koloid - pH
- Bahan koagulant yang dipakai - Lamanya pengadukan
Pada unit ini kita usahakan supaya tidak terbentuk endapan floc.
6. Bangunan Pengendap Kedua
Unit ini berfungsi untuk mengendapkan floc yang terbentuk pada unit pembentuk floc. Pengendapan disini dengan gaya berat floc sendiri (gravitasi). Penanganan bak pengendap kedua sama dengan pada unit bak pengendapan pertama.
Aliran pada unit dijaga sedemikian rupa sehingga tetap tenang. Dengan teknologi modern :
- Unit pengaduk cepat - Unit pengaduk lambat - Unit pengendap kedua
Unit – unit tersebut diatas digabungkan menjadi satu unit sendiri yang kompak. Kita kenal :
- Accelerator Clarifier - Pulsator Clarifier
Dari bentuk bangunannya saringan, dikenal dua macam : - Saringan yang bangunannya terbuka (gravity filter) - Saringan yang bangunannya tertutup (pressure filter)
8. Reservoir (Tandon)
Air yang telah melalui filter sudah dapat dipakai untuk air minum. Air tersebut telah bersih dan bebas dari bakteriologis dan ditampung pada bak reservoir (tandon) untuk diteruskan pada konsumen.
2.4 Kandungan Logam
2.4.1 Arsenik (As)
Arsenik adalah zat padat yang berwarna abu – abu seperti baja, getas dan memiliki kilap logam. Jika dipanaskan, arsenik bersublimasi dan timbul bau seperti bawang putih yang khas ; ketika dipanaskan dalam aliran udara yang bebas, arsenik terbakar dengan nyala biru, menghasilkan asap putih arsenik (III) oksida, As4O6. Semua
senyawa arsenik beracun. Unsur ini tak larut dalam asam klorida, dan asam sulfat encer: tetapi larut dengan mudah dalam asam nitrat encer, menghasilkan ion arsenit, dan dalam asam nitrat pekat atau dalam air raja atau dalam natrium hipoklorit, membentuk arsenat :
As + 4 H+ + NO3- As3+ + NO + 2H2O
3As + 5HNO3 (p) + 2H2O 3AsO43- + 5 NO + 9H+
Ada dua deret senyawa arsenik yang umum : yaitu dari arsenik (III) dan arsenik (V). Senyawa – senyawa arsenik (III) dapat diturunkan dari arsenik trioksida amfoter, As2O3, yang menghasilkan garam, baik dengan asam kuat (misalnya arsenik (III)
klorida, AsCl3), maupun dengan basa kuat (misalnya, natrium arsebit, Na3AsO3).
Maka dalam larutan yang sangat asam, ion arsenik (III), As3+, adalah yang stabil. Senyawa – senyawa arsenik (V) diturunkan dari arsenik pentoksida, As2O5. Ini adalah
anhidrida dari asam arsenat H3AsO4, yang membentuk garam – garam seperti natrium
arsenat Na3AsO4. Maka arsenik (V) terdapat dalam larutan terutama sebagai ion
arsenat AsO43- (Vogel, 1979).
Arsen yang terdapat dalam air bisa berasal dari persenyawaan – persenyawaan arsen yang banyak digunakan sebagai insektisida (lead arsenate, calcium arsenate). Persenyawaan arsen termasuk salah satu di antara racun sistemik yang paling penting, dan dapat berakumulasi dalam tubuh manusia. Arsen dapat menyebabkan gangguan pada sistem pencernaan dan kemungkinan dapat menyebabkan kanker kulit, hati dan empedu.
2.4.2 Kromium (Cr)
Kromium adalah logam kristalin yang putih, tak begitu liat dan tak dapat ditempa dengan berarti. Ia melebur pada 17650C. Logam ini larut dalam asam klorida encer atau pekat. Jika tak terkena udara, akan terbentuk ion kromium – kromium (II) :
Cr + 2H+ Cr2+ + H2
Cr + 2HCl Cr2+ + 2Cl- + H2
Dengan adanya oksigen dari atmosfer, kromium sebagian atau seluruhnya menjadi teroksidasi atau seluruhnya menjadi teroksidasi ke keadaan tervalen :
4Cr2+ + O2 + 4H+ 4Cr3+ + 2H2O
Asam sulfat encer menyerang kromium perlahan – lahan, dengan membentuk hidrogen. Dalam asam sulfat pekat panas, kromium melarut dengan mudah, pada mana ion – ion kromium (II) dan kromium (III) dan anion kromat (dan dikromat), dalam mana keadaan oksidasi kromium adalah +6.
Ion kromium (III) (atau kromo, Cr2+) diturunkan dari kromium (II) oksida, CrO. Ion ini membentuk larutan yang berwarna biru. Ion kromium (II) agak tidak stabil, karena merupakan zat pereduksi yang kuat – ion ini bahkan menguraikan air perlahan – lahan dengan membentuk hidrogen. Oksigen dari atmosfer dengan mudah mengoksidasinya menjadi ion kromium (III). Karena ion ini jarang ditemui dalam analisis kualitatif anorganik. Ion kromium (III) (atau kromi, Cr3+) adalah stabil, dan diturunkan dari dikromium trioksida (atau kromium trioksida), Cr2O3. Dalam larutan,
Kromium sebagai ion bervalensi enam bersifat karsinogenik pada saluran pernapasan kumulatif pada tingkat konsentrasi mg/l dalam air minum. Tidak ada efek yang dapat diamati pada efek yang dapat diamati pada pemeriksaan tunggal terhadap 4 keluarga dalam 3 tahun yang diberi air dengan konsentrasi Cr sampai 1 mg/l. Unsur ini tidak penting dan tidak menguntungkan. Konsentrasi unsur ini dalam air minum yang melebihi standar maksimum yang ditetapkan kemungkinan dapat menyebabkan kanker kulit dan alat – alat pernapasan. Konsentrasi maksimal chromium dalam air minum yang ditetapkan sebagai standar oleh Departemen Kesehatan R.I. adalah sebesar 0,05 mg/l. Angka ini sesuai dengan angka standar yang ditetapkan baik oleh US Public Health Service, maupun WHO European, maupun WHO International (Sutrisno, 2006).
2.4.3 Merkuri (Hg)
Merkuri adalah satu – satunya mineral yang biasa dari air raksa adalah “cinabar” (HgS). Hg terjadi dari senyawa ini dengan melalui pembakaran udara :
HgS (Solid) + O2 Hg + SO2
celebral palsy pada bayi. Konsentrasi maksimum yang diperbolehkan sebagai standar yang ditetapkan oleh Dep. Kes. R.I. untuk unsur ini dalam air adalah sebesar 0,001 mg/l. US Public Health Service maupun WHO tidak memasukkan unsur Hg ini di dalam standar persyaratan air minum (Sutrisno, 2006).
Reaksi – reaksi ion merkuri (II) dapat dipelajari dengan larutan merkuri (II) nitrat encer (0,05 M).
1. Hidrogen sulfida (gas atau larutan jenuh) : Dengan adanya asam klorida encer,
mula-
mula akan terbentuk endapan putih merkuri (II) klorosulfida yang terurai bila ditambahkan hidrogen sulfida lebih lanjut, dan akhirnya terbentuk endapan hitam merkuri (II) sulfida.
3Hg2+ + 2Cl- + 2H2S Hg3S2Cl2 + 4H+
Hg3S2Cl2 + H2S 3HgS + 2H+ + 2Cl-
Merkuri (II) sulfida merupakan salah satu endapan yang paling sedikit (Ks = 4 x 10-54).
Endapan ini tak larut dalam air, asam nitrat dalam air, asam nitrat encer panas, hidroksida, alkali atau amonium sulfida (tak berwarna). Natrium sulfida (2M) melarutkan endapan, pada mana ion kompleks disulfomerkurat (II) terbentuk :
HgS + S2- [HgS2]2-
Dengan menambahkan amonium klorida pada larutan, merkurium (II) sulfida mengendap lagi. Air raja melarutkan endapan :
Merkuri (II) klorida praktis tak berdisosiasi pada kondisi – kondisi ini. Belerang tetap tertinggal sebagai endapan putih, tetapi dengan mudah melarut jika dipanaskan, dengan membentuk asam sulfat :
2HNO3 + S SO42- + 2H+ + 2NO
2. Larutan amonia : endapan putih dengan komposisi tercampur; pada dasarnya
terdiri dari
merkuri (II) oksida dan merkuri (II) amidonitrat :
2Hg2+ + NO3- + 4NH3 + H2O HgO. Hg(NH2)NO3 + 3NH4+
Garam ini, seperti kebanyakan senyawa – senyawa merkuri, bersublimasi pada tekanan atmosfer (Vogel, 1979).
2.5 Spektrofotometri Serapan Atom
saja terjadi. Sedangkan dengan nyala, eksitasi unsur – unsur dengan tingkat tingkat energi eksitasi yang rendah dapat dimungkinkan. Tentu saja perbandingan benyaknya atom yang tereksitasi terhadap atom yang berada pada tingkat dasar harus cukup besar, karena metode serapan atom hanya tergantung pada perbandingan ini dan tidak bergantung pada temperatur. Metode serapan sangatlah spesifik. Logam – logam yang membentuk campuran kompleks dapat dianalisis dan selain itu tidak selalu diperlukan sumber energi yang besar (Khopkar, 2008).
2.5.1 Teori Spektrofotometri Serapan Atom
2.5.2 Instrumentasi Spektrofotometer Serapan Atom
Skema komponen – komponen pada sebuah spektrofotometri serapan atom secara umum dapat dilihat pada gambar 2.1 di bawah ini :
Gambar 2.1 : Skema komponen – komponen Spektrofotometri Serapan Atom Keterangan Gambar :
1 : Sumber Cahaya 6 : Elektronik / Amplifier
2 : Penukar 7 : Pembaca Keluar
3 : Nyala atau Dapur Api 4 : Monokromator
5 : Detektor
A. Lampu katoda berongga
A. Nyala
Nyala yang digunakan pada SSA harus mampu memberikan suhu ≥ 2000 K. Untuk mencapai suhu setinggi ini biasanya digunakan gas pembakar dalam suatu gas pengoksida (oksidan) seperi misalnya udara dan nitrogen oksida (N2O). Suhu
maksimum yang dihasilkan pada pembakaran berbagai campuran gas pembakar dengan gas pengoksida adalah sebagai berikut :
Tabel 2.1 : Jenis – jenis gas pembakar pada SSA
Gas pembakar Gas oksidan Temperatur (K)
Asitilena Udara 2400 – 2700
Asitilena Dinitrogen oksida 2900 – 3100
Asitilena Oksigen 3300 – 3400
Hidrogen Udara 2300 – 2400
Hidrogen Oksigen 2800 – 3000
Sianoen Oksigen 4800
B. Monokromator
C. Detektor
Dalam spektrofotometer serapan atom, mengingat kepekaan spektral yang lebih baik yang diperlakukan, digunakan penggandaan foton. Keluaran dari detektor diumpankan ke suatu sistem peragaan yang sesuai, dan dalam hubungan ini hendaknya diingat bahwa radiasi yang diterima oleh detektor berasal tidak hanya dari garis resonansi yang telah diseleksi tetapi dapat juga timbul dari emisi dalam nyala. Emisi ini dapat disebabkan oleh emisi atom yang timbul dari atom – atom yang sedang diselidiki, dan dapat juga dari emisi pita molekul.
D. Amplifier
Amplifier berfungsi untuk memperkuat sinyal yang diterima dari detektor sebelum sampai ke rekorder.
E. Rekorder
2.5.3 Pembagian Spektroskopi Serapan Atom
Instrumen spektroskopi serapan atom terbagi atas dua jenis yaitu : 1.
Instrumen spektroskopi serapan atom mempunyai pengelompokkan yaitu spektroskopi serapan atom cahaya tunggal. Bentuk atau bagannya dapat dilihat pada gambar 2.2 dibawah ini :
Spektrokopi Serapan Atom Cahaya Tunggal (Single-Beam)
Gambar 2.2: Skema Spektroskopi Serapan Atom Cahaya Tunggal (Single Beam)
Keterangan Gambar :
1 : Sumber Lampu Katoda 11 : Kisi
2 : Lensa 12 : Cermin
3 : Nyala 13 : Irisan Keluar
Lampu katoda. Hampir semua instrumen penyerapan atom menggunakan lampu katoda sebagai sumber energi radiasi. Lampu katoda merupakan sumber garis atomik untuk emisi yang baik. Lampunya dirancang oleh pemesinan atau pembuatan lampu katoda dari analisa logam – logam yang penting. Katoda ditempatkan pada gelas pembungkus yang mengandung logam – logam anoda. Ketika lampu katoda dihubungkan dengan pensuplaian energi, maka akan mengeluarkan energi radiasi. Energi radiasi merupakan karateristik dari elemen katoda dan neon. Menggunakan kalsium sebagai sampelnya, mari kita lihat alur garis emisi kalsium sebagai lampu. Prosesnya dapat dituliskan sebagai berikut :
elektrikal
Ne Ne+ + e energi
Pensuplaian dapat ditetapkan sebagai katoda yang mempunyai energi negatif. Elektron dipercepat ke arah anoda. Energi tersebut diperoleh dari prosesnya. Karena energi, elektron lanjutan menggunakan ion neon yang lebih dan digunakan sebagai anoda. Pembakar dan nyala. Komponen selanjutnya adalah pembakar dan nyala. Nyala, pembakar dan nebulizer pada instrumen spektroskopi serapan atom dalam pengukurannya mempunyai tujuan yang sama dan digunakan pada spektroskopi emisi nyala. Nyala merupakan tempat penyelesaian kation untuk menghasilkan atom – atom logam.
Detektor. Peralatan yang terakhir yang digunakan dalam instrumen spekroskopi serapan atom adalah pipa “photo multiplier”.
2.
Spektroskopi serapan atom cahaya ganda mempunyai keadaan yang lebih stabil. Spektroskopi cahaya ganda mempunyai komponen yang baru seperti cermin sektor, pada bagian tengahnya terdapat cermin silver yang digambarkan pada gambar 2.3 dibawah ini :
Spektroskopi Serapan Atom Cahaya Ganda “Double Beam”
Gambar 2.3 : Skema Spektroskopi Serapan Atom Cahaya Ganda (Double Beam)
Keterangan Gambar :
1 : Sumber Lampu Katoda 2 : Lensa
11 : Kisi 12 : Cermin 13 : Irisan Keluar 14 : Penguat Elektronik 15 : Penguat Elektronik
16 : Elektronik dan Pembaca Keluar
2.5.4 Pengukuran Kuantitatif
garis absorbansi. Radiasi yang tidak terserap dapat dijangkau detektor banyaknya sumber, termasuk garis emisi dari unsur katoda mendekati garis resonansi yang terpilih atau gas pengisi, sebaran radiasi dalam monokromator dan radiasi yang melewati nyala atau penguapan sampel. (Fifield, 1987)
2.5.5 Interferensi
Yang dimaksud dengan gangguan – gangguan (interference) pada SSA adalah peristiwa – peristiwa yang menyebabkan pembacaan absorbansi unsur yang dianalisis menjadi lebih kecil atai lebih besar dari nilai yang sesuai dengan konsentrasinya dalam sampel. Gangguan – gangguan yang dapat terjadi dalam SSA adalah sebagai berikut :
3. Gangguan oleh absorbansi yang disebabkan bukan oleh absorbansi atom yang dianalisis; yakni absorbansi oleh molekul – molekul yang tidak terdisosiasi di dalam nyala. Gangguan ini dapat diatasi dengan cara sebagai berikut :
a. Penggunaan nyala / suhu atomisasi yang lebih tinggi b. Penambahan senyawa penyangga
c. Pengekstrasian unsur yang akan dianalisis d. Pengekstrasian ion atau gugus pengganggu
BAB 1
PENDAHULUAN
1.1 Latar Belakang
Air merupakan suatu sarana utama untuk meningkatkan derajat kesehatan masyarakat, karena air merupakan salah satu media dari berbagai macam penularan, terutama seperti yang telah kita ketahui bahwa penyakit perut adalah penyakit yang paling banyak terjadi di Indonesia. Oleh karena itu sumber daya air harus dilindungi agar tetap dimanfaatkan dengan baik oleh manusia serta makhluk hidup lain. Pemanfaatan air untuk berbagai kepentingan generasi mendatang.
Air sungai Sei Pallau di Kelurahan Belawan II Kecamatan Medan Belawan merupakan kawasan yang mendapat tekanan berat dari aktivitas industri PT. Smart Tbk (SINARMAS GROUP). Disepanjang alirang sungai terdapat aktivitas manusia seperti pertanian, pemukiman warga, petambakan, gudang – gudang penyimpanan barang dan lalu lintas kapal nelayan kecil. Ditambah lagi dengan banyaknya industri seperti pabrik karet, pabrik baja, pabrik semen, pabrik kaca, pabrik kelapa sawit, dan pabrik es (cold storage) menambah daftar penyebab tercemarnya air sungai tersebut. Begitu juga dengan air limbah industri PT. SMART Tbk (SINARMAS GROUP), diperkirakan banyak kandungan logam – logam berat yang terkandung dalam air limbah tersebut yang akan diteliti.
Tidak saja berasal dari buangan limbah industri domestik seperti yang berada dan limbah pertanian yang ada disepanjang daerah aliran sungai, tetapi juga kurangnya kesadaran sebagian masyarakat yang membuang sampah dan kotoran ke dalam sungai. Sehingga kehadiran unsur Cr, Hg, As, Cd, Cu, Zn, Pb, Ni, Al dan Sn merupakan sekian dari sejumlah logam berat yang umum berada mungkin telah mencemari sungai tersebut. Logam – logam tersebut merupakan toksik bagi tubuh dan dapat mengganggu kesehatan apabila terkonsumsi.
peneliti tertarik untuk melakukan penelitian terhadap tingkat pencemaran yang terjadi berdasarkan peraturan pemerintah tentang klasifikasi mutu air.
1.2 Permasalahan
Air sungai Sei Pallau merupakan air yang masih banyak digunakan masyarakat sekitar untuk berbagai kebutuhan. Apakah kandungan logam arsenik, kromium dan merkurium yang terdapat pada sungai Sei Pallau di Kelurahan Belawan II Kecamatan Medan Belawan memenuhi persyaratan yang telah ditetapkan untuk air bersih atau tidak. Dan juga air limbah industri PT. SMART Tbk (SINARMAS GROUP) merupakan air yang diperkirakan banyak kandugan logam – logam yang terdapat didalamnya yang dapat mencemari air sungai Sei Pallau yang mempunyai lokasi disamping industri PT. SMART Tbk (SINARMAS GROUP) tersebut.
1.3Pembatasan Masalah
b. Untuk mengetahui kadar logam arsenik (As), kromium (Cr), dan merkuri (Hg) pada air sungai Sei Pallau Belawan.
c. Untuk mengetahui tingkat pencemaran yang terjadi di air limbah industri PT. SMART Tbk (SINARMAS GROUP) berdasarkan kadar logam arsenik (As), kromium (Cr), dan merkuri (Hg) yang terkandung didalamnya. d. Untuk mengetahui tingkat pencemaran yang terjadi di sungai Sei Pallau di
kelurahan Belawan II kecamatan Medan Belawan berdasarkan kadar logam arsenik (As), kromium (Cr), dan merkuri (Hg) yang terkandung di dalamnya.
1.5 Manfaat
ABSTRAK
DETERMINATION OF THE CONCENTRATION METALS OF ARSENIC, CHROMIUM AND MERCURY BASED SAMPLING POINT ON THE
LOCATION OF WASTEWATER DISCHARGE PT. SMART Tbk (SINARMAS GROUP) USING ATOMIC ABSORPTION
SPECTROFOTOMETRY METHOD ABSTRACT
Concentration of arsenic (As), chromium (Cr) and mercury (Hg) have been analyzed in the wastewater of PT. SMART Tbk (SINARMAS GROUP) and water of Sei Pallau’s river in Medan Belawan using atomic absorption spectrofotometer at
wavelength (λ) respectively were 335,5 nm, 234,6 nm and 288,8 nm. The results of
PENENTUAN KONSENTRASI KANDUNGAN LOGAM
ARSENIK, KROMIUM DAN MERKURI BERDASARKAN
SAMPLING POINT (LOKASI) PENGELUARAN AIR LIMBAH
PT. SMART Tbk (SINARMAS GROUP) DENGAN METODE
SPEKTROFOTOMETRI SERAPAN ATOM
KARYA ILMIAH
Diajukan untuk melengkapi tugas akhir dan memenuhi syarat mencapai
gelar ahlimadya
CHRISYANTI ELISTA SIAHAAN
102401069
PROGRAM STUDI DIPLOMA 3 KIMIA
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Nama : CHRISYANTI ELISTA SIAHAAN
Nomor Induk Mahasiswa : 102401069 Program Studi : D3 KIMIA
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN
PERNYATAAN
PENENTUAN KONSENTRASI KANDUNGAN LOGAM ARSENIK,
KROMIUM DAN MERKURI BERDASARKAN SAMPLING POINT
(LOKASI) PENGELUARAN AIR LIMBAH PT. SMART
Tbk (SINARMAS GROUP) DENGAN METODE
SPEKTROFOTOMETRI SERAPAN ATOM
KARYA ILMIAH
Saya mengakui bahwa tugas akhir ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dari ringkasan yang masing – masing disebutkan sumbernya
Medan, Juni 2013
PENGHARGAAN
Puji syukur saya ucapkan kepada Tuhan Yang Maha Esa atas Rahmat dan Karunia-Nya yang telah diberikan kepada penulis, sehingga penulis dapat menyelesaikan Tugas Akhir ini dengan baik.
Tugas Akhir ini disusun sebagai salah satu syarat dalam rangka menyelesaikan program Diploma 3 Kimia FMIPA USU Medan yang ditulis berdasarkan pengamatan dan analisa penulis dengan judul “Penentuan Konsentrasi Kandungan Logam Arsenik, Kromium dan Merkuri Berdasarkan Sampling Point (Lokasi) Pengeluaran Air Limbah Industri PT. SMART Tbk (SINARMAS GROUP) dengan Metode Spektrofotometri Serapan Atom”.
Tugas Akhir ini dapat ditulis dan terwujud atas bantuan dan bimbingan dari berbagai pihak secara langsung maupun secara tidak langsung. Oleh karena itu, dengan segala kerendahan hati penulis mengucapkan terima kasih kepada :
1. Kedua orang tua saya yang sangat saya sayangi yang telah banyak memberikan bantuan berupa doa dan dukungan moril maupun materil selama penulisan Tugas Akhir ini.
2. Bapak Dr. Sutarman, M.Sc selaku Dekan FMIPA USU.
3. Ibu Dr. Rumondang Bulan, MS selaku Ketua Departemen Kimia FMIPA USU. 4. Ibu Dra. Emma Zaidar Nst, M.Si selaku ketua program studi D3 Kimia FMIPA
USU.
5. Ibu Dra. Tirena B. Siregar, ST, M.Eng selaku Dosen Pembimbing penulis yang telah banyak membimbing, memberikan masukan dan petunjuk sehingga penulis dapat menyelesaikan Tugas Akhir ini.
Saya menyadari karya ilmiah ini masih jauh dari kesempurnaan. Oleh karena itu saya mengharapkan kritik dan saran yang bersifat membangun demi perbaikan karya ilmiah ini. Semoga karya ilmiah ini dapat berguna bagi para pembaca umumnya, dan bagi penulis khususnya.
Saya berharap apa yang saya sajikan sekarang ini tidak hanya menjadi sebuah persyaratan saja, tetapi juga bisa menjadi referensi untuk rekan – rekan mahasiswa.
Medan, Juni 2013
ABSTRAK
DETERMINATION OF THE CONCENTRATION METALS OF ARSENIC, CHROMIUM AND MERCURY BASED SAMPLING POINT ON THE
LOCATION OF WASTEWATER DISCHARGE PT. SMART Tbk (SINARMAS GROUP) USING ATOMIC ABSORPTION
SPECTROFOTOMETRY METHOD ABSTRACT
Concentration of arsenic (As), chromium (Cr) and mercury (Hg) have been analyzed in the wastewater of PT. SMART Tbk (SINARMAS GROUP) and water of Sei Pallau’s river in Medan Belawan using atomic absorption spectrofotometer at
wavelength (λ) respectively were 335,5 nm, 234,6 nm and 288,8 nm. The results of
BAB IV. HASIL DAN PEMBAHASAN
4.1. Hasil Analisis 60
4.1.1. Logam Arsenik (As) 60 4.1.2. Logam Kromium (Cr) 62 4.1.3. Logam Merkuri (Hg) 64
4.2. Pembahasan 66
BAB V. KESIMPULAN DAN SARAN
5.1. Kesimpulan 68
5.2. Saran 69
DAFTAR TABEL
Nomor Judul Halaman Tabel Tabel 2.1. : Jenis – jenis gas pembakar pada Spektrofotometri Serapan 34 Atom
Tabel 3.1. : Data perhitungan persamaan garis regresi untuk analisis As 49 dengan Spektrofotometri Serapan Atom
Tabel 3.1.1. : Konsentrasi dan % ralat air limbah industri untuk logam 48 Arsenik (As)
Tabel 3.1.2. : Konsentrasi dan % ralat campuran air sungai dan air lim 48 bah Industri Untuk Logam Arsenik (As)
Tabel 3.1.3. : Konsentrasi dan % ralat air sungai untuk logam arsenik 49 (As)
Tabel 3.2. : Data perhitungan persamaan garis regresi untuk analisis Cr 53 dengan Spektrofometri Serapan Atom
Tabel 3.3. : Data perhitungan persamaan garis regresi untuk analisis Hg 56 dengan Spektrofometri Serapan Atom
Tabel 4.1. : Data hasil pengukuran absorbansi sampel air limbah industri 60 PT. SMART Tbk (SINARMAS GROUP) untuk analisis logam
As
Tabel 4.2 : Data hasil pengukuran absorbansi sampel campuran antara air 61 limbah industri PT. SMART Tbk (SINARMAS GROUP)
dengan air sungai Sei Pallau Kelurahan Belawan II Kecamatan Medan Belawan untuk analisis logam As
Tabel 4.3. : Data hasil pengukuran absorbansi sampel air sungai Sei Pallau 61 Kelurahan Belawan II Kecamatan Medan Belawan untuk
analisis logam As
Tabel 4.9. : Data hasil pengukuran absorbansi sampel air sungai Sei Pallau 65 Kelurahan Belawan II Kecamatan Medan Belawan untuk
DAFTAR GAMBAR
Nomor Judul Halaman Gambar
DAFTAR LAMPIRAN
Nomor Judul Halaman Lampiran
Lampiran I : Peraturan Pemerintah Nomor 82 Tahun 2001 Tanggal 71 14 Desember 2001 Tentang Pengelolaan Kualitas Air