EFEK EKSTRAK ETANOL DAUN PUGUH TANOH
(Curanga fel-terrae Merr.) TERHADAP KADAR NITROGEN
MONOOKSIDA PLASMA DARAH TIKUS SEBAGAI
TERAPI PENDAMPING PADA PENGGUNAAN
DOKSORUBISIN
SKRIPSI
OLEH:
FENNIE SJAHRIAL NIM 091501067
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
EFEK EKSTRAK ETANOL DAUN PUGUH TANOH
(Curanga fel-terrae Merr.) TERHADAP KADAR NITROGEN
MONOOKSIDA PLASMA DARAH TIKUS SEBAGAI
TERAPI PENDAMPING PADA PENGGUNAAN
DOKSORUBISIN
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk memperoleh Gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
FENNIE SJAHRIAL NIM 091501067
PROGRAM STUDI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
PENGESAHAN SKRIPSI
EFEK EKSTRAK ETANOL DAUN PUGUH TANOH
(Curanga fel-terrae Merr.) TERHADAP KADAR NITROGEN
MONOOKSIDA PLASMA DARAH TIKUS SEBAGAI
TERAPI PENDAMPING PADA PENGGUNAAN
DOKSORUBISIN
OLEH:
FENNIE SJAHRIAL NIM 091501067
Dipertahankan di Hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal: 27 Agustus 2013
Pembimbing I, Panitia Penguji,
Pembimbing II,
Medan, Oktober 2013 Fakultas Farmasi
Universitas Sumatera Utara Dekan,
Prof. Dr. Sumadio Hadisahputra, Apt. NIP 195311281983031002
Prof. Dr. Urip Harahap, Apt. NIP 195301011983031004 Aminah Dalimunthe, S.Si., M.Si., Apt.
NIP 197806032005012004
Poppy Anjelisa Z. Hasibuan, S.Si, M.Si., Apt. NIP 197506102005012003
Drs. Suryadi Achmad, M.S., Apt. NIP 195109081985031002
Aminah Dalimunthe, S.Si., M.Si., Apt. NIP 197806032005012004
KATA PENGANTAR
Puji dan syukur kepada Tuhan Yang Maha Kuasa yang telah
melimpahkan anugerah dan kemurahan-Nya sehingga penulis dapat
menyelesaikan skripsi yang berjudul “Efek ekstrak etanol daun puguh tanoh
(Curanga fel-terrae Merr.) terhadap kadar nitrogen monooksida plasma
darah tikus sebagai terapi pendamping pada penggunaan Doksorubisin”.
Skripsi ini diajukan sebagai salah satu syarat guna memperoleh gelar Sarjana
Farmasi dari Fakultas Farmasi Universitas Sumatera Utara.
Pada kesempatan ini penulis hendak menyampaikan rasa hormat dan
terima kasih yang sebesar-besarnya kepada Bapak Prof. Dr. Sumadio
Hadisahputra, Apt., selaku Dekan Fakultas Farmasi Universitas Sumatera
Utara yang telah memberikan fasilitas dan bantuan selama masa pendidikan
dan penelitian, kepada Ibu Aminah Dalimunthe, S.Si., M.Si., Apt., dan Ibu
Poppy Anjelisa Z. Hasibuan, S.Si., M.Si., Apt., selaku dosen pembimbing yang
telah banyak memberikan bimbingan, arahan dan bantuan selama masa
penelitian hingga selesainya penulisan skripsi ini. Penulis juga menyampaikan
ucapan terima kasih kepada Bapak Prof. Dr. Urip Harahap, Apt., Ibu Marianne,
S.Si., M.Si., Apt. dan Bapak Drs. Suryadi Achmad, M.Sc., Apt. selaku dosen
penguji yang telah memberikan masukan dalam penyusunan skripsi ini serta
kepada Ibu Aswita Hafni Lubis, M.Si., Apt., selaku dosen pembimbing
Ucapan terima kasih serta penghargaan yang tulus dan tak terhingga
penulis sampaikan kepada orangtua tersayang Ayahanda Herry Sjahrial dan
Ibunda Nina Tandiono, kakak Lannie Sjahrial dan adik Jovian Sjahrial serta
kakek (Alm.) Herman Sjahrial atas doa dan dukungan baik moril maupun
materiil kepada penulis selama masa perkuliahan hingga selesainya
penyusunan skripsi ini.
Penulis juga mengucapkan terima kasih kepada seluruh staf pengajar,
asisten laboratorium, kakak-kakak, abang-abang dan teman-teman
seperjuangan angkatan 2009 khususnya Masinis 09 dan Farmasi B’09 atas
motivasi dan segala bantuan selama perkuliahan dan penyelesaian skripsi ini.
Semoga Tuhan Yang Maha Kuasa memberikan balasan yang berlipat
ganda kepada semua pihak yang telah membantu dalam penulisan skripsi ini.
Tiada gading yang tak retak, begitu juga halnya dengan skripsi ini. Penulis
menyadari bahwa skripsi ini masih banyak kekurangan. Oleh karena itu,
dengan kerendahan hati, penulis menerima kritik dan saran yang bersifat
membangun dari semua pihak untuk menyempurnakan skripsi ini. Akhir kata
penulis berharap semoga skripsi ini bermanfaat bagi ilmu pengetahuan
khususnya bidang farmasi.
Medan, Agustus 2013
Penulis,
EFEK EKSTRAK ETANOL DAUN PUGUH TANOH (Curanga fel-terrae Merr.) TERHADAP KADAR NITROGEN MONOOKSIDA PLASMA DARAH TIKUS SEBAGAI TERAPI
PENDAMPING PADA PENGGUNAAN DOKSORUBISIN
ABSTRAK
Doksorubisin adalah agen kemoterapi golongan antrasiklin yang digunakan pada pengobatan kanker, namun penggunaannya terbatas karena menyebabkan kardiotoksisitas yang diduga akibat peningkatan nitrogen monooksida yang diinduksi oleh Doksorubisin. Penelitian ini bertujuan untuk mengetahui efek pemberian ekstrak etanol daun puguh tanoh terhadap kadar NO plasma darah yang diinduksi Doksorubisin.
Penelitian ini meliputi karakterisasi simplisia dan ekstrak, skrining fitokimia simplisia dan ekstrak, pengujian pada hewan, dan pengukuran kadar NO plasma darah hewan. Kadar NO plasma diukur dalam bentuk nitrit dan nitrat menggunakan pereaksi Griess secara spektrofotometri UV-Vis pada panjang gelombang 540 nm. Penelitian ini menggunakan 5 kelompok perlakuan, yaitu kelompok blanko (tanpa perlakuan), kelompok kontrol ( CMC 0,5%), kelompok Doksorubisin, kelompok EEDPT, dan kelompok EEDPT+Doksorubisin.
Hasil pemeriksaan karakteristik simplisia dan ekstrak secara berturut-turut diperoleh kadar air 5,99% dan 18,43%, kadar sari larut air 15,68% dan 59,40%, kadar sari larut etanol 12,38% dan 70,93%, kadar abu total 9,77% dan 7,29% serta kadar abu tidak larut asam 0,72% dan 0,58%. Hasil skrining fitokimia simplisia dan ekstrak menunjukkan adanya senyawa golongan flavonoid, glikosida, saponin dan steroid/triterpenoid. Hasil pengukuran dengan spektrofotometer UV-Vis menunjukkan peningkatan kadar nitrit dan nitrat plasma darah secara signifikan (n = 3, p < 0,05) kelompok yang diinduksi Doksorubisin (kadar nitrit 6,47883 ± 0,46676 μg/ml dan kadar nitrat 6,60247 ± 0,29809 μg/ml) dibandingkan dengan kelompok blanko (kadar nitrit 3,35680 ± 0,19305 μg/ml dan kadar nitrat 3,94413 ± 0,16062 μg/ml). Pemberian ekstrak etanol daun puguh tanoh menunjukkan penurunan kadar nitrit dan nitrat plasma darah yang signifikan (n = 3, p < 0,05) pada kelompok yang diberikan ekstrak etanol daun puguh tanoh+Doksorubisin (kadar nitrit 4,37688 ± 0,05355 μg/ml dan nitrat 4,59327 ± 0,24537 μg/ml) dibandingkan dengan kelompok yang diinduksi dengan Doksorubisin.
Dari hasil penelitian dapat disimpulkan bahwa pemberian ekstrak etanol daun puguh tanoh pada tikus yang diinduksi Doksorubisin dapat menurunkan kadar nitrit dan nitrat plasma darah tikus.
EFFECT OF ETHANOL EXTRACT OF PUGUH TANOH (Curanga fel-terrae Merr.) LEAVES ON BLOOD NITRIC OXIDE
LEVEL AS ADJUVANT THERAPY IN DOXORUBICIN
ABSTRACT
Doxorubicin is an anthracycline class of chemotherapeutic agents used in cancer treatment, but its use is limited due to its cardiotoxicity that is caused by increased nitric oxide level. This study aimed to determine the effect of ethanol extract of puguh tanoh leaves on blood NO level in Doxorubicin-induced rat.
This research included the characterization of simplex and extract, phytochemical screening of simplex and extract, animal testing, and measurement of blood plasma NO level. Plasma NO level were measured in the form of nitrite and nitrate using the Griess reagent by UV-Vis spectrophotometry at wavelength 540 nm. This study used 5 groups, blank group (without treatment), control group (0.5% CMC), Doxorubicin group, EEDPT group, and EEDPT + Doxorubicin group.
Results of the examination showed characteristic of simplex and extract respectively were water content 5.99% and 18.43%, water-soluble extract 15.68% and 59.40%, ethanol-soluble extract 12.38% and 70.93% , total ash content 9.77% and 7.29% and acid- insoluble ash 0.72% and 0.58%. Phytochemical screening results indicated the presence of flavonoid, glycosides, saponins and steroids / triterpenoids compounds in both simplex and extract. Measurement results by UV-Vis spectrophotometer showed significant increased of blood plasma nitrite and nitrate level (n = 3, p < 0.05) in Doxorubicin-induced group (nitrite level 6.47883 ± 0.46676 μg/ml and nitrate levels 6.60247 ± 0.29809 μg/ml) compared to the blank group (nitrite level 3.35680 ± 0.19305 μg/ml and nitrate level 3.94413 ± 0.16062 μg/ml). Ethanol extract of puguh tanoh leaves showed significant decreased of blood plasma nitrite and nitrate level (n = 3, p < 0.05) in group given with ethanol extract of puguh tanoh + Doxorubicin (nitrite level 4.37688 ± 0.05355 μg/ml and nitrate level 4.59327 ± 0.24537 μg/ml) compared with the group induced by Doxorubicin.
From the research it can be concluded that ethanol extract of puguh tanoh leaves can decrease blood plasma nitrite and nitrate level in Doxorubicin-induced rats.
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN JUDUL ... ii
LEMBAR PENGESAHAN ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
DAFTAR LAMPIRAN ... xiv
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian ... 4
1.5 Manfaat Penelitian ... 4
1.6 Kerangka Pikir Penelitian ... 5
BAB II TINJAUAN PUSTAKA ... 6
2.1 Uraian Tumbuhan ... 6
2.1.1 Sistematika Tumbuhan ... 6
2.1.3 Nama Asing ... 7
2.1.4 Morfologi Tumbuhan ... 7
2.1.5 Khasiat Tumbuhan ... 7
2.2 Kandungan Kimia ... 8
2.2.1 Flavonoid ... 8
2.2.2 Fenilpropanoid ... 8
2.3 Ekstraksi ... 9
2.4 Doksorubisin ... 11
2.5 Nitrogen Monooksida (NO) ... 13
2.6 Spektrofotometri UV-Vis ... 15
2.7 Pereaksi Griess ... 17
BAB III METODE PENELITIAN ... 18
3.1 Alat-alat ... 18
3.2 Bahan-bahan ... 19
3.3 Prosedur Pembuatan Simplisia ... 19
3.3.1 Pengumpulan Bahan Tumbuhan ... 19
3.3.2 Identiikasi Tumbuhan ... 19
3.3.3 Pembuatan Simplisia ... 20
3.4 Pemeriksaan Karakteristik Simplisia dan Ekstrak ... 20
3.4.1 Pemeriksaan Makroskopik dan Organoleptik ... 20
3.4.2 Pemeriksaan Mikroskopik ... 20
3.4.3 Penetapan Kadar Air ... 21
3.4.5 Penetapan Kadar Sari Larut dalam Etanol ... 22
3.4.6 Penetapan Kadar Abu Total ... 22
3.4.7 Penetapan Kadar Abu Tidak Larut dalam Asam ... 23
3.5 Skrining Fitokimia Simplisia dan Ekstrak ... 23
3.5.1 Pemeriksaan Flavanoid ... 23
3.5.2 Pemeriksaan Alkaloid ... 24
3.5.3 Pemeriksaan Saponin ... 25
3.5.4 Pemeriksaan Tanin ... 25
3.5.5 Pemeriksaan Glikosida ... 25
3.5.6 Pemeriksaan Steroid / Triterpenoid ... 26
3.6 Pembuatan Ekstrak Etanol Daun Puguh Tanoh ... 26
3.7 Pembuatan Pereaksi ... 27
3.7.1 Pembuatan Suspensi Na-CMC 0,5% ... 27
3.7.2 Pembuatan Suspensi Ekstrak Etanol Daun Puguh Tanoh (EEDPT) 5% ... 27
3.7.3 Pembuatan Pereaksi TCA 20% b/v ... 27
3.7.4 Pembuatan Larutan Asam Asetat Glasial 15% v/v ... 27
3.7.5 Pembuatan Pereaksi Griess ... 27
3.7.5.1 Pembuatan Pereaksi Asam Sulfanilat 1% b/v .. 28
3.7.5.2 Pembuatan Pereaksi NED 0,1% b/v ... 28
3.8 Penyiapan Hewan Percobaan ... 28
3.9 Perlakuan Hewan Percobaan ... 28
3.10 Penyiapan Plasma Darah Tikus ... 29
3.11.1 Pembuatan Larutan Induk Baku Nitrit ... 29
3.11.2 Penentuan Panjang Gelombang Maksimum Nitrit Baku ... 30
3.11.3 Penentuan Waktu Kerja Nitrit Baku ... 30
3.11.4 Penentuan Kurva Kalibrasi Nitrit Baku ... 30
3.11.5 Pengukuran Kadar Nitrit dalam Plasma ... 31
3.11.6 Pengukuran Kadar Nitrat dalam Plasma ... 31
3.12 Analisis Data ... 31
BAB IV HASIL DAN PEMBAHASAN ... 32
4.1 Hasil Karakterisasi Simplisia dan Ekstrak ... 32
4.2 Hasil Skrining Fitokimia Simplisia dan Ekstrak ... 34
4.3 Hasil Pengukuran Kadar Nitrit dan Nitrat dalam Plasma Darah ... 35
BAB V KESIMPULAN DAN SARAN ... 40
5.1 Kesimpulan ... 40
5.2 Saran ... 40
DAFTAR PUSTAKA ... 41
DAFTAR TABEL
Halaman
Tabel 4.1 Hasil Karakterisasi Simplisia dan Ekstrak ... 33
Tabel 4.2 Hasil Skrining Fitokimia Simplisia dan Ekstrak ... 34
DAFTAR GAMBAR
Halaman
Gambar 1.1 Kerangka Pikir Penelitian ... 5
Gambar 2 .1 Skema Reaksi Diazotasi ... 17
DAFTAR LAMPIRAN
Halaman
Lampiran 1 Bagan Kerja Penelitian ... 44
Lampiran 2 Hasil Identifikasi Tumbuhan ... 45
Lampiran 3 Gambar Tumbuhan dan Daun Puguh Tanoh ... 46
Lampiran 4 Gambar Simplisia Daun Puguh Tanoh ... 47
Lampiran 5 Hasil Pemeriksaan Mikroskopik Daun Puguh Tanoh 48 Lampiran 6 Alat – alat Yang Digunakan ... 49
Lampiran 7 Perhitungan Hasil Penetapan Kadar Air Serbuk Simplisia Daun Puguh Tanoh ... 51
Lampiran 8 Perhitungan Hasil Penetapan Kadar Sari Larut dalam Air Serbuk Simplisia Daun Puguh Tanoh ... 52
Lampiran 9 Perhitungan Hasil Penetapan Kadar Sari Larut dalam Etanol Serbuk Simplisia Daun Puguh Tanoh .. 53
Lampiran 10 Perhitungan Hasil Penetapan Kadar Abu Total Serbuk Simplisia Daun Puguh Tanoh ... 54
Lampiran 11 Perhitungan Hasil Penetapan Kadar Abu Tidak Larut Asam Serbuk Simplisia Daun Puguh Tanoh . 55 Lampiran 12 Perhitungan Hasil Penetapan Kadar Air Ekstrak Etanol Daun Puguh Tanoh ... 56
Lampiran 13 Perhitungan Hasil Penetapan Kadar Sari Larut dalam Air Ekstrak Etanol Daun Puguh Tanoh ... 57
Lampiran 14 Perhitungan Hasil Penetapan Kadar Sari Larut dalam Etanol Ekstrak Etanol Daun Puguh Tanoh .... 58
Lampiran 15 Perhitungan Hasil Penetapan Kadar Abu Total Ekstrak Etanol Daun Puguh Tanoh... 59
Lampiran 17 Contoh Perhitungan Volume Suspensi Ekstrak dan Larutan Doksorubisin yang Diberikan
pada Hewan ... 61
Lampiran 18 Kurva Panjang Gelombang Maksimum Natrium Nitrit Baku ... 62
Lampiran 19 Tabel Operating Time Natrium Nitrit Baku ... 63
Lampiran 20 Kurva Kalibrasi Natrium Nitrit Baku ... 64
Lampiran 21 Perhitungan Persamaan Regresi Kurva Kalibrasi Nitrit ... 65
Lampiran 22 Contoh Perhitungan dan Tabel Kadar Nitrit dalam Plasma ... 66
Lampiran 23 Contoh Perhitungan dan Tabel Kadar Nitrat dalam Plasma ... 67
Lampiran 24 Hasil Analisis ANAVA ... 68
Lampiran 25 Data Orientasi Kadar Nitrit ... 71
EFEK EKSTRAK ETANOL DAUN PUGUH TANOH (Curanga fel-terrae Merr.) TERHADAP KADAR NITROGEN MONOOKSIDA PLASMA DARAH TIKUS SEBAGAI TERAPI
PENDAMPING PADA PENGGUNAAN DOKSORUBISIN
ABSTRAK
Doksorubisin adalah agen kemoterapi golongan antrasiklin yang digunakan pada pengobatan kanker, namun penggunaannya terbatas karena menyebabkan kardiotoksisitas yang diduga akibat peningkatan nitrogen monooksida yang diinduksi oleh Doksorubisin. Penelitian ini bertujuan untuk mengetahui efek pemberian ekstrak etanol daun puguh tanoh terhadap kadar NO plasma darah yang diinduksi Doksorubisin.
Penelitian ini meliputi karakterisasi simplisia dan ekstrak, skrining fitokimia simplisia dan ekstrak, pengujian pada hewan, dan pengukuran kadar NO plasma darah hewan. Kadar NO plasma diukur dalam bentuk nitrit dan nitrat menggunakan pereaksi Griess secara spektrofotometri UV-Vis pada panjang gelombang 540 nm. Penelitian ini menggunakan 5 kelompok perlakuan, yaitu kelompok blanko (tanpa perlakuan), kelompok kontrol ( CMC 0,5%), kelompok Doksorubisin, kelompok EEDPT, dan kelompok EEDPT+Doksorubisin.
Hasil pemeriksaan karakteristik simplisia dan ekstrak secara berturut-turut diperoleh kadar air 5,99% dan 18,43%, kadar sari larut air 15,68% dan 59,40%, kadar sari larut etanol 12,38% dan 70,93%, kadar abu total 9,77% dan 7,29% serta kadar abu tidak larut asam 0,72% dan 0,58%. Hasil skrining fitokimia simplisia dan ekstrak menunjukkan adanya senyawa golongan flavonoid, glikosida, saponin dan steroid/triterpenoid. Hasil pengukuran dengan spektrofotometer UV-Vis menunjukkan peningkatan kadar nitrit dan nitrat plasma darah secara signifikan (n = 3, p < 0,05) kelompok yang diinduksi Doksorubisin (kadar nitrit 6,47883 ± 0,46676 μg/ml dan kadar nitrat 6,60247 ± 0,29809 μg/ml) dibandingkan dengan kelompok blanko (kadar nitrit 3,35680 ± 0,19305 μg/ml dan kadar nitrat 3,94413 ± 0,16062 μg/ml). Pemberian ekstrak etanol daun puguh tanoh menunjukkan penurunan kadar nitrit dan nitrat plasma darah yang signifikan (n = 3, p < 0,05) pada kelompok yang diberikan ekstrak etanol daun puguh tanoh+Doksorubisin (kadar nitrit 4,37688 ± 0,05355 μg/ml dan nitrat 4,59327 ± 0,24537 μg/ml) dibandingkan dengan kelompok yang diinduksi dengan Doksorubisin.
Dari hasil penelitian dapat disimpulkan bahwa pemberian ekstrak etanol daun puguh tanoh pada tikus yang diinduksi Doksorubisin dapat menurunkan kadar nitrit dan nitrat plasma darah tikus.
EFFECT OF ETHANOL EXTRACT OF PUGUH TANOH (Curanga fel-terrae Merr.) LEAVES ON BLOOD NITRIC OXIDE
LEVEL AS ADJUVANT THERAPY IN DOXORUBICIN
ABSTRACT
Doxorubicin is an anthracycline class of chemotherapeutic agents used in cancer treatment, but its use is limited due to its cardiotoxicity that is caused by increased nitric oxide level. This study aimed to determine the effect of ethanol extract of puguh tanoh leaves on blood NO level in Doxorubicin-induced rat.
This research included the characterization of simplex and extract, phytochemical screening of simplex and extract, animal testing, and measurement of blood plasma NO level. Plasma NO level were measured in the form of nitrite and nitrate using the Griess reagent by UV-Vis spectrophotometry at wavelength 540 nm. This study used 5 groups, blank group (without treatment), control group (0.5% CMC), Doxorubicin group, EEDPT group, and EEDPT + Doxorubicin group.
Results of the examination showed characteristic of simplex and extract respectively were water content 5.99% and 18.43%, water-soluble extract 15.68% and 59.40%, ethanol-soluble extract 12.38% and 70.93% , total ash content 9.77% and 7.29% and acid- insoluble ash 0.72% and 0.58%. Phytochemical screening results indicated the presence of flavonoid, glycosides, saponins and steroids / triterpenoids compounds in both simplex and extract. Measurement results by UV-Vis spectrophotometer showed significant increased of blood plasma nitrite and nitrate level (n = 3, p < 0.05) in Doxorubicin-induced group (nitrite level 6.47883 ± 0.46676 μg/ml and nitrate levels 6.60247 ± 0.29809 μg/ml) compared to the blank group (nitrite level 3.35680 ± 0.19305 μg/ml and nitrate level 3.94413 ± 0.16062 μg/ml). Ethanol extract of puguh tanoh leaves showed significant decreased of blood plasma nitrite and nitrate level (n = 3, p < 0.05) in group given with ethanol extract of puguh tanoh + Doxorubicin (nitrite level 4.37688 ± 0.05355 μg/ml and nitrate level 4.59327 ± 0.24537 μg/ml) compared with the group induced by Doxorubicin.
From the research it can be concluded that ethanol extract of puguh tanoh leaves can decrease blood plasma nitrite and nitrate level in Doxorubicin-induced rats.
BAB I
PENDAHULUAN
1.1 Latar Belakang
Doksorubisin (DOX) adalah obat antikanker golongan antrasiklin yang
sangat efektif dan telah digunakan selama lebih dari empat dekade untuk
mengobati berbagai neoplasma pada manusia. Efek samping kardiotoksik dari
doksorubisin yang paling dikenal yaitu dilatasi kardiomiopati yang ireversibel
dan gagal jantung telah menjadi dilema bagi para onkologis dan kardiologis di
seluruh dunia sehingga penggunaan obat ini sangat terbatas pada pasien kanker
(Xi, et al., 2011).
Kardiotoksisitas yang diinduksi doksorubisin sebagian besar
disebabkan oleh terjadinya stres oksidatif tetapi mekanisme yang tepat belum
jelas. Beberapa hipotesis mekanisme kardiotoksisitas doksorubisin antara lain
tingginya konsentrasi nitrogen monooksida yang merupakan hasil dari induksi
iNOS dan pembentukan peroksinitrit bertanggung jawab pada toksisitas
doksorubisin (Andreadou, et al., 2007), pembentukan reactive oxygen species
(ROS) dan degradasi dari doksorubisin menjadi metabolit toksis doksorubisinol
(Raheem, et al., 2009) dan juga dilaporkan bahwa nitrogen monooksida adalah
radikal bebas yang berperan dalam etiologi kardiotoksisitas yang diinduksi
doksorubisin (Guerra, et al., 2005).
Tekanan oksidatif (oxidative stress) adalah suatu kondisi di mana
Pemberian antioksidan menunjukkan adanya pengaruh yang positif pada
kondisi ini (Silalahi, 2006).
Nitrogen monooksida (NO), radikal bebas diatomik dikenal berperan
terhadap tekanan vaskular dan mempunyai banyak peran pada fungsi dan
penyakit jantung, serta diketahui berperan penting pada patofisiologi berbagai
penyakit kardiovaskular. Kadar nitrogen monooksida pada plasma dapat
digunakan sebagai biomarker kerusakan miokard pada penggunaan
doksorubisin (Guerra, et al., 2005) dan penggunaan senyawa yang mempunyai
aktivitas antioksidan dan kemampuan untuk memodulasi kelebihan produksi
nitrogen monooksida dapat bersifat proteksi terhadap kardiotoksisitas yang
diinduksi doksorubisin (Raheem, et al., 2009).
Pugun tanoh (Curanga fel-terrae Merr.), oleh masyarakat Desa Tiga
Lingga, Kabupaten Dairi, Provinsi Sumatera Utara dikenal dengan nama pugun
tanoh, pugun tana dan pagon tanoh serta digunakan sebagai obat untuk
mengobati berbagai macam penyakit seperti rematik, asam urat dan diabetes
(Juwita, 2009). Beberapa penelitian menunjukkan penggunaan daun puguh
tanoh sebagai antiinflamasi (Juwita, 2009) dan antidiabetes (Sitorus, 2012).
Thuan, et al. (2007) menyatakan bahwa glikosida fenilpropanoid adalah
konstituen mayor dari Picria fel-terrae dan tumbuhan ini dapat bermanfaat
terhadap pengobatan penyakit pada manusia yang berhubungan dengan stres
Berdasarkan uraian tersebut, maka diperlukan pengujian efek ekstrak
daun puguh tanoh terhadap kadar nitrogen monooksida pada tikus yang
diinduksi doksorubisin.
1.2 Perumusan Masalah
Berdasarkan uraian pada latar belakang, maka perumusan masalah pada
penelitian ini adalah:
a. apakah parameter karakteristik serbuk simplisia dan ekstrak daun puguh
tanoh dapat ditentukan sehingga bisa dijadikan sebagai acuan untuk
standardisasi simplisia karena tumbuhan ini belum tercantum di dalam
Materia Medika Indonesia (MMI)?
b. apakah golongan senyawa kimia yang terkandung di dalam serbuk simplisia
dan ekstrak daun puguh tanoh?
c. apakah pemberian ekstrak etanol daun puguh tanoh dapat menurunkan kadar
nitrogen monooksida pada plasma darah tikus yang diinduksi oleh
Doksorubisin?
1.3 Hipotesis
Berdasarkan perumusan masalah di atas, maka hipotesis pada penelitian
ini adalah:
a. parameter karakteristik serbuk simplisia daun puguh tanoh dapat ditentukan,
sehingga bisa dijadikan sebagai acuan untuk standardisasi simplisia karena
b. golongan senyawa kimia yang terdapat pada daun puguh tanoh adalah
alkaloid, flavonoid, glikosida, saponin, steroid/triterpenoid dan tanin.
c. pemberian ekstrak etanol daun puguh tanoh dapat menurunkan kadar
nitrogen monooksida pada plasma darah tikus.
1.4 Tujuan Penelitian
Tujuan penelitian ini adalah untuk mengetahui:
a. karakteristik serbuk simplisia daun puguh tanoh sehingga dapat dijadikan
acuan untuk standardisasi simplisia dalam Materia Medika Indonesia
(MMI).
b. golongan senyawa kimia yang terkandung dalam daun puguh tanoh.
c. efek pemberian ekstrak etanol daun puguh tanoh terhadap kadar nitrogen
monooksida plasma darah tikus yang diinduksi Doksorubisin.
1.5 Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi karakteristik dan
skrin fitokimia mengenai daun puguh tanoh sehingga dapat menambah
inventaris tanaman obat berkhasiat dan juga memberikan informasi
penggunaan daun puguh tanoh sebagai terapi pendamping untuk mengurangi
efek samping kardiotoksisitas pada penggunaan doksorubisin.
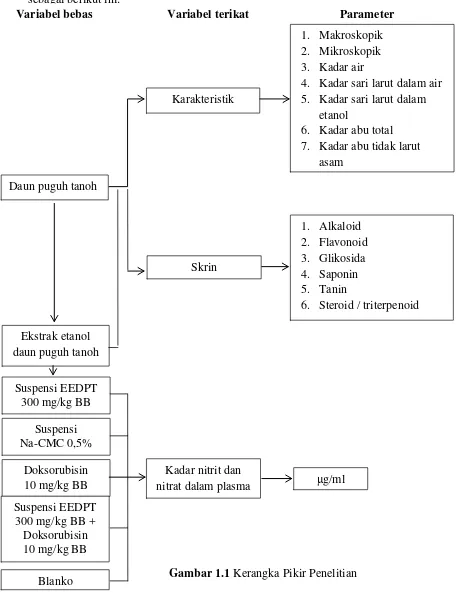
1.6 Kerangka Pikir Penelitian
Penelitian ini dilaksanakan berdasarkan kerangka pikir penelitian
sebagai berikut ini:
Gambar 1.1 Kerangka Pikir Penelitian Karakteristik
Variabel bebas Variabel terikat Parameter
1. Makroskopik 2. Mikroskopik 3. Kadar air
4. Kadar sari larut dalam air 5. Kadar sari larut dalam
etanol
6. Kadar abu total 7. Kadar abu tidak larut
asam
Daun puguh tanoh
Skrin 1. Alkaloid 2. Flavonoid 3. Glikosida 4. Saponin 5. Tanin
6. Steroid / triterpenoid
Ekstrak etanol daun puguh tanoh
Suspensi Na-CMC 0,5%
μg/ml Doksorubisin
10 mg/kg BB
Kadar nitrit dan nitrat dalam plasma Suspensi EEDPT
300 mg/kg BB
Suspensi EEDPT 300 mg/kg BB +
Doksorubisin 10 mg/kg BB
BAB II
TINJAUAN PUSTAKA
2.1 Uraian Tumbuhan
Uraian tumbuhan meliputi sistematika tumbuhan, nama daerah, nama
asing, morfologi tumbuhan, dan khasiat tumbuhan.
2.1.1 Sistematika Tumbuhan
Sistematika tumbuhan pugun tanoh menurut Tjitrosoepomo (2001)
adalah sebagai berikut:
Subdivisi : Angiospermae
Subkelas
Famili
: Curanga
Spesies : Curanga fel-terrae Merr.
Sinonim : Curanga amara Vahl., Curanga amara Juss., Curania
amara R&S., Gratiola amara Roxb., Picria fel-terrae
2.1.2 Nama Daerah
Nama daerah dari tumbuhan ini adalah pugun tanoh, pugun tana, pagon
tanoh (Dairi), tamah raheut (Sunda), daun kukurang (Maluku), papaita
(Ternate) (Anonimb, 2009). 2.1.3 Nama Asing
Pada beberapa negara lain tumbuhan ini dikenal dengan namahempedu
tanah, gelumak susu, rumput kerak nasi (Malaysia), sagai-uak (Filipina), kong
saden (Laos), dan thanh (Vietnam) (Anonimc, 2007). 2.1.4 Morfologi Tumbuhan
Herba tahunan, tinggi lebih dari 40 cm, batang dengan cabang yang
jarang, tegak atau melata, segiempat, berakar di buku-buku, berbulu halus yang
padat. Daun tunggal, berhadapan, bundar telur, pangkal daun membaji sampai
membundar, ujung daun agak melancip, tepi daun beringgit, berbulu halus.
Pembungaan berupa tandan di ujung atau di batang, jumlah bunga 2-16, daun
gagang kecil, melanset, mahkota bunga menabung, berbibir rangkap, gundul
bagian luar, bagian dalam ada kelenjar bulu, bibir atas berwarna coklat
kemerah-merahan, bibir bagian bawah berwarna putih. Buah kapsul lonjong,
padat, berkatup dua, dengan beberapa biji. Biji membulat, diameter sekitar 0,6
mm (Anonimb, 2009). 2.1.5 Khasiat Tumbuhan
Tumbuhan ini digunakan sebagai obat cacing untuk anak-anak,
mengobati kolik (mulas mendadak dan hebat), malaria, menyembuhkan
sebagai tonik (untuk menguatkan badan dan meningkatkan nafsu makan)
(Anonimb, 2009).
2.2 Kandungan Kimia
Daun puguh tanoh mengandung alkaloid, flavonoid, glikosida, saponin,
tanin, steroid/triterpenoid (Juwita, 2009; Sitorus, 2012), dan glikosida
fenilpropanoid (Thuan, et. al., 2007).
2.2.1 Flavonoid
Flavonoida merupakan salah satu golongan fenol alam yang tersebar
luas pada tumbuhan hijau dan mengandung 15 atom karbon dalam inti
dasarnya, yang tersusun dalam konfigurasi C6-C3-C6 yaitu dua cincin aromatik yang dihubungkan oleh satuan tiga karbon yang dapat atau tidak dapat
membentuk cincin ketiga (Markham, 1988).
Umumnya senyawa flavonoida dalam tumbuhan terikat dengan gula
disebut sebagai glikosida dan aglikon flavonoida yang berbeda-beda mungkin
saja terdapat pada satu tumbuhan dalam beberapa bentuk kombinasi glikosida.
Oleh karena itu dalam menganalisis flavonoida biasanya lebih baik memeriksa
aglikon yang telah dihidrolisis dibandingkan dalam bentuk glukosida dengan
kerumitan strukturnya. Flavonoida berkhasiat sebagai antioksidan, antibakteri,
dan inflamasi (Harbone, 1987).
2.2.2 Fenilpropanoid
Senyawa fenilpropanoid merupakan salah satu kelompok senyawa fenol
utama yang berasal dari jalur shikimat. Senyawa fenol ini mempunyai
ujung rantai karbon propana (C3) (Lenny, 2006). Secara biosintesis senyawa ini turunan asam amino protein aromatik, yaitu fenilalanina dan fenilpropanoid
dapat mengandung satu sisa C6-C3 atau lebih. Yang paling tersebar luas ialah asam hidrosisinamat, suatu senyawa yang penting, bukan saja sebagai
bangunan dasar lignin, tetapi juga berkaitan dengan pengaturan tumbuh dan
pertahanan terhadap penyakit (Harbourne, 1987).
2.3 Ekstraksi
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut
sehingga terpisah dari bahan yang tidak dapat larut dengan pelarut cair
(Ditjen POM, 2000).
Hasil dari ekstraksi disebut dengan ekstrak yaitu sediaan kental yang
diperoleh dengan mengekstraksi zat aktif dari simplisia nabati atau simplisia
hewani menggunakan pelarut yang sesuai, kemudian semua atau hampir semua
pelarut diuapkan dan massa atau serbuk yang tersisa diperlakukan sedemikian
sehingga memenuhi baku yang telah ditetapkan (Ditjen POM, 1995).
Untuk ekstraksi Farmakope Indonesia menetapkan bahwa sebagai
cairan penyari adalah air, etanol, dan etanol-air atau eter. Penyarian pada
perusahaan obat tradisional masih terbatas pada penggunaan penyari air,
etanol, atau etanol-air (Ditjen POM, 1986).
Ekstraksi dengan menggunakan pelarut terdiri dari 2 cara, yaitu:
a. Cara dingin
i. Maserasi
Maserasi adalah proses pengekstrakan simplisia dengan menggunakan
pelarut dengan beberapa kali pengocokan atau pengadukan pada temperatur
ruangan.
ii. Perkolasi
Perkolasi adalah ekstraksi dengan pelarut yang selalu baru sampai
sempurna yang umumnya dilakukan pada temperatur ruangan. Proses
terdiri dari tahapan pengembangan bahan, tahap maserasi antara, tahap
perkolasi sebenarnya (penetesan/penampungan ekstrak), terus-menerus
sampai diperoleh ekstrak (perkolat).
b. Cara panas
Ekstraksi menggunakan pelarut dengan cara panas terdiri dari:
i. Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya,
selama waktu tertentu dan jumlah pelarut terbatas yang relatif konstan
dengan adanya pendingin balik.
ii. Sokletasi
Sokletasi adalah ekstraksi menggunakan pelarut yang selalu baru yang
umumnya dilakukan dengan alat khusus sehingga terjadi ekstraksi kontinu
dengan jumlah pelarut relatif konstan dengan adanya pendingin balik.
iii. Digesti
Digesti adalah maserasi kinetik (dengan pengadukan kontinu) pada
iv. Infus
Infus adalah ekstraksi dengan pelarut air pada temperatur penangas air
(bejana infus tercelup dalam penangas air mendidih, temperatur terukur
96-98oC) selama waktu tertentu (15-20 menit). v. Dekok
Dekok adalah infus pada waktu yang lebih lama (30 menit) dan
temperatur sampai titik didih air (Ditjen POM, 2000).
2.4 Doksorubisin
Doksorubisin adalah salah satu agen antikanker penting dalam
penggunaan klinis, terutama pada kanker payudara, endometrium, ovarium,
testikel, tiroid, hati, paru-paru, sarkoma pada jaringan halus, dan beberapa
kanker pada anak-anak, termasuk neuroblastoma, Ewing’s sarcoma,
osteosarkoma, dan rhabdomiosarkoma. Doksorubisin juga mempunyai aktivitas
klinis pada gangguan hematologi, termasuk leukemia limfoblastik akut,
multipel myeloma, dan limfoma Hodgkin dan non-Hodgkin. Secara umum
digunakan dalam kombinasi dengan agen antikanker lain (contohnya
siklofosfamid, cisplatin, dan 5-FU) dan aktivitas klinis meningkat pada
penggunaan dengan kombinasi dibandingkan dengan penggunaan tunggal
(Chu, 2009).
Antibiotik antrasiklin ini diisolasi dari Streptomyces peucetius var
caesius, adalah obat antikanker yang paling luas digunakan (Nafrialdi, 2007).
Antrasiklin memberikan kemampuan sitotoksik melalui empat mekanisme
DNA melalui interkalasi, dengan terus menerus menghambat sintesis DNA dan
RNA dan rantai DNA (c) menghasilkan radikal bebas semikuinon dan radikal
bebas oksigen melalui proses reduksi yang bergantung pada besi dan dimediasi
oleh enzim (d) mengikat pada membrane selular untuk mengubah ion transpor
(Chu, 2009; Ewer, 2010). Namun mekanisme yang tepat bagaimana antrasiklin
memberikan efek sitotoksik masih harus diinvestigasi dan sedang
dikembangkan bahwa mekanisme radikal bebas adalah penyebab
kardiotoksisitas yang berkaitan dengan antrasiklin (Chu, 2009).
Pada penggunaan klinis, antrasiklin diadministrasi secara intravena.
Antrasiklin dimetabolisme pada hati secara reduksi dan hidrolisis pada cincin
substituen. Metabolit terhidroksilasi adalah spesies aktif sementara aglikon
bersifat inaktif. Hampir 50% dari obat ini dieliminasi dalam bentuk feses
melalui ekskresi bilier dan pengurangan dosis diperlukan pada keadaan
disfungsi hati (Chu, 2009).
Toksisitas utama dari penggunaan antrasiklin adalah mielosupresi,
dengan neutropenia lebih sering diobservasi dibandingkan trombositopenia.
Dua bentuk kardiotoksisitas yang diamati, yaitu akut dan kronik. Bentuk akut
muncul dalam 2-3 hari berupa aritmia dan abnormalitas konduksi, perubahan
elektrokardiografi, perikarditis, dan miokarditis. Bentuk ini sementara dan
dalam kebanyakan kasus bersifat asimptomatik. Bentuk kronik disebabkan oleh
pengaruh dosis, dilatasi kardiomiopati yang berkaitan dengan gagal jantung.
Toksisitas kronik muncul sebagai hasil peningkatan produksi radikal bebas
(ICRF-187) untuk sementara disetujui penggunaanya untuk mengurangi
insidens toksisitas pada jantung (Chu, 2009).
Miokardium mudah terserang radikal bebas karena kurangnya substansi
biokimia untuk menangkal radikal bebas seperti superoksid dismutase,
glutathion peroksidase, dan enzim katalase dibandingkan organ hati dan ginjal.
Doksorubisin juga diketahui mempunyai afinitas yang tinggi terhadap
kardiolipin, suatu komponen fosfolipid pada membran mitokondrial di otot
jantung (Ewer, 2010; Ashrafi, 2012).
2.5 Nitrogen Monooksida (NO)
Nitrogen monooksida, radikal bebas berupa gas yang telah lama dikenal
sebagai polutan udara dan toksin yang potensial, adalah molekul pengsignal sel
endogen yang mempunyai peran penting secara fisiologi (Brunton, 2008) dan
secara langsung dapat berdifusi melalui membran sel dan meregulasi sejumlah
proses fisiologis dan patofisiologis termasuk kardiovaskular, inflamasi, sistem
imun, dan fungsi neuronal (Jaffrey, 2009).
NO, ditulis sebagai NO* untuk mengindikasikan struktur kimia dengan elektron tak berpasangan, atau ditulis NO, adalah molekul pengsignal yang
sangat reaktif yang dihasilkan oleh satu atau lebih dari tiga isoenzim NO
sintase (NOS) yang berhubungan erat, yang masing-masing dikode oleh gen
yang berbeda dan diberi nama berdasarkan tipe sel pertama yang diisolasi.
Enzim tersebut adalah neuronal NOS (nNOS atau NOS-1), makrofag atau
indusibel NOS (iNOS atau NOS-2), dan endothelial NOS (eNOS atau NOS-3).
distribusi overlapping. Isoform ini menghasilkan NO dari asam amino
L-arginin melalui reaksi yang bergantung pada O2- dan NADPH+. Reaksi enzimatis ini menggunakan kofaktor yang berikatan dengan enzim termasuk
heme, tetrahidrobiopterin, dan flavin adenine dinukleotida (FAD). Pada nNOS
dan eNOS, sintesis dipicu oleh proses yang meningkatkan konsentrasi kalsium
sitosolik. Kalsium sitosolik membentuk kompleks dengan kalmodulin, protein
pengikat kalsium dalam jumlah banyak, yang kemudian berikatan dan
mengaktifkan eNOS dan nNOS. Sebaliknya, iNOS tidak diregulasi oleh
kalsium, tetapi aktif secara konstitutif. Dalam makrofag dan beberapa jenis sel,
mediator inflamasi menginduksi aktivasi gen iNOS, menghasilkan akumulasi
iNOS dan peningkatan jumlah NO (Jaffrey, 2009).
Toksisitas NO sebagian berhubungan dengan oksidasi lanjut dari NO
menjadi NO2. Selama terapi NO, sangat penting untuk mempertahankan pembentukan NO2 dalam kadar yang sangat rendah menggunakan filter dan
scavenger yang tepat dan campuran gas kualitas tinggi. Dosis rendah NO
selama penggunaan kronis menyebabkan inaktivasi surfaktan dan pembentukan
peroksinitrit melalui interaksi dengan superoksida. Kemampuan NO untuk
menginhibisi atau mengubah fungsi dari sejumlah protein yang mengandung
besi dan heme menjadi penting untuk dilakukan investigasi lanjut mengenai
potensial toksik dari NO dalam terapi. Pembentukan methemoglobinemia
adalah komplikasi signifikan dari penghirupan NO dalam konsentrasi tinggi
dan kematian telah dilaporkan akibat overdosis NO. Kadar
dapat menginhibisi fungsi platelet dan telah menunjukkan peningkatan waktu
perdarahan dalam beberapa studi. Pada pasien dengan gangguan fungsi
ventrikel kiri, NO berpotensi untuk memperparah fungsi ventrikel kiri dengan
mendilatasi sirkulasi pulmonal dan meningkatkan aliran darah ke ventrikel kiri
sehingga meningkatkan tekanan atrium kiri dan pembentukan edema pulmonal
(Brunton, 2008).
2.6 Spektrofotometri UV-Visible
Ada beberapa hal yang harus diperhatikan dalam analisis dengan
spektrofotometri UV-Vis terutama untuk senyawa yang semula tidak berwarna
yang akan dianalisis dengan spektrofotometri visibel karena senyawa tersebut
harus diubah terlebih dahulu menjadi senyawa yang berwarna. Berikut adalah
tahapan-tahapan yang harus diperhatikan :
a.Pembentukan molekul yang dapat menyerap sinar UV-Vis
Hal ini diperlukan jika senyawa yang dianalisis tidak menyerap pada daerah
tersebut. Cara yang digunakan adalah dengan merubah menjadi senyawa lain
atau direaksikan dengan pereaksi tertentu. Pereaksi yang digunakan harus
memenuhi persyaratan yaitu :
i. reaksinya selektif dan sensitif
ii. reaksinya cepat, kuantitatif dan reprodusibel
iii. hasil reaksi stabil dalam jangka waktu yang lama
b.Waktu operasional (operating time)
Cara ini biasa digunakan untuk pengukuran hasil reaksi atau pembentukan
Waktu operasional ditentukan dengan mengukur hubungan antara waktu
pengukuran dengan absorbansi larutan.
c. Pemilihan panjang gelombang
Panjang gelombang yang digunakan untuk analisis kuantitatif adalah
panjang gelombang yang mempunyai absorbansi maksimal. Untuk memilih
panjang gelombang maksimal, dilakukan dengan membuat kurva hubungan
antara absorbansi dengan panjang gelombang dari suatu larutan baku pada
konsentrasi tertentu. Ada beberapa alasan mengapa harus menggunakan
panjang gelombang maksimal, yaitu :
i. pada panjang gelombang maksimal tersebut, perubahan absorbansi
untuk setiap satuan konsentrasi adalah yang paling besar.
ii. Di sekitar panjang gelombang maksimal, bentuk kurva absorbansi datar
dan pada kondisi tersebut hukum Lambert - Beer akan terpenuhi.
iii. Jika dilakukan pengukuran ulang maka kesalahan yang disebabkan oleh
pemasangan ulang panjang gelombang akan kecil sekali, ketika
digunakan panjang gelombang maksimal.
d. Pembuatan kurva baku
Dibuat seri larutan baku dari zat yang akan dianalisis dengan berbagai
konsentrasi. Masing-masing absorbansi larutan dengan berbagai konsentrasi
diukur, kemudian dibuat kurva yang merupakan hubungan antara absorbansi
dengan konsentrasi. Bila hukum Lambert - Beer terpenuhi maka kurva baku
berupa garis lurus. Penyimpangan dari garis lurus biasanya disebabkan
e. Pembacaan absorbansi sampel atau cuplikan
Absorban yang terbaca pada spektrofotometer hendaknya antara 0,2 sampai
0,8 atau 15% sampai 70% jika dibaca sebagai transmitans. Anjuran ini
berdasarkan anggapan bahwa kesalahan dalam pembacaan T adalah 0,005 atau
0,5% (kesalahan fotometrik) (Gandjar, 2007).
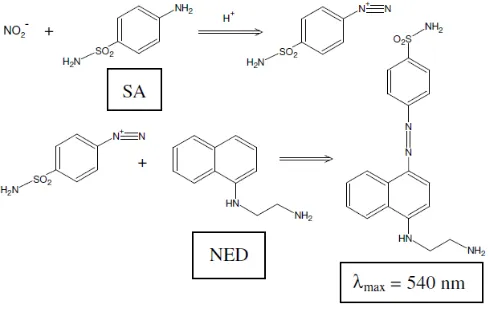
2.7 Pereaksi Griess
Reaksi Griess pertama kali dideskripsikan pada 1879. Karena
kemudahannya, reaksi Griess telah digunakan secara luas pada analisa sampel
biologis seperti plasma, serum, urin, cairan serebrospinal, dan saliva. Pada
metode ini, nitrit ditambahkan dengan reagen pendiazotasi seperti sulfanilamid
dalam media asam untuk membentuk garam diazonium sementara. Hasil antara
ini kemudian direaksikan dengan reagen pengkopel, N-naftil-etilendiamin
(NED), untuk membentuk senyawa azo yang stabil. Reaksi selengkapnya dapat
dilihat pada Gambar 2.1. Warna ungu yang dihasilkan memungkinkan untuk
[image:34.595.184.429.549.705.2]analisa nitrit dengan tingkat sensitivitas yang tinggi (Sun, 2003).
BAB III
METODE PENELITIAN
Penelitian ini dilakukan dengan metode eksperimental, meliputi
pengumpulan bahan tumbuhan, pembuatan simplisia, karakterisasi dan skrining
fitokimia simplisia, pembuatan ekstrak etanol daun puguh tanoh, karakterisasi
dan skrining fitokimia ekstrak, penyiapan hewan percobaan, perlakuan pada
hewan percobaan, pengukuran kadar nitrit dan nitrat plasma darah. Data hasil
penelitian dianalisis dengan metode analisis variansi (ANAVA) dengan tingkat
kepercayaan 95%, dilanjutkan dengan metode uji Duncan untuk melihat
perbedaan nyata antar perlakuan menggunakan program SPSS (Statistical
Product and Service Solution) versi 17. Penelitian ini dilakukan di
Laboratorium Farmakognosi, Laboratorium Farmakologi, dan Laboratorium
Penelitian Fakultas Farmasi Universitas Sumatera Utara pada bulan Agustus
2012 sampai Maret 2013.
3.1 Alat – alat
Alat-alat yang digunakan pada penelitian ini meliputi blender (Philip),
lemari pengering (Memmert), neraca listrik (Mettler Toledo), neraca hewan
(GW-1500), rotary evaporator (Heidolph WB 2000), perkolator, water bath,
hotplate, tanur (Nabertherm), vortex V1 plus (Boeco Germany), alat
sentrifugasi (Dynamica), spektrofotometer UV-Visible (Shimadzu), spuit, oral
3.2 Bahan-Bahan
Bahan-bahan yang digunakan dalam penelitian ini meliputi bahan
tumbuhan dan bahan kimia. Bahan tumbuhan yang digunakan adalah daun
puguh tanoh (Curanga fel-terrae Merr.). Bahan kimia yang digunakan adalah
etanol 96% (teknis), pereaksi bouchardat, dragendorff, mayer, besi (III) klorida
4,5% b/v, molish, timbal (II) asetat 0,4 M, asam sulfat 6 N, asam klorida 2 N,
Lieberman-Burchard, toluen, kloroform, asam klorida, kloralhidrat, Na-CMC
(Natrium-Carboxy Methyl Cellulose), larutan Doksorubisin HCl, asam asetat
glasial 15%, asam sulfanilat, N-(1-naftil) etilendiamina dihidroklorida (NED),
dan akuades (teknis).
3.3 Prosedur Pembuatan Simplisia
3.3.1 Pengumpulan Bahan Tumbuhan
Bahan tumbuhan yang digunakan adalah daun puguh tanoh (Curanga
fel-terrae Merr.) yang segar. Pengambilan bahan tumbuhan dilakukan secara
purposif tanpa membandingkan dengan tumbuhan yang sama dari daerah lain.
Bahan tumbuhan diambil dari Desa Tiga Lingga, Kabupaten Dairi, Provinsi
Sumatera Utara.
3.3.2 Identifikasi Tumbuhan
Identifikasi tumbuhan dilakukan di “Herbarium Bogoriense”, Bidang
Botani Pusat Penelitian Biologi - LIPI Bogor. Identifikasi dilakukan oleh
3.3.3 Pembuatan Simplisia
Bahan tumbuhan daun puguh tanoh yang masih segar dikumpulkan,
dicuci bersih di bawah air mengalir, ditiriskan, dan ditimbang berat basahnya
(2,935 kg). Daun puguh tanoh selanjutnya dikeringkan di lemari pengering
hingga kering, dibuang benda-benda asing atau pengotoran-pengotoran lain
yang masih tertinggal pada simplisia (sortasi kering), ditimbang berat
keringnya ( 427 gram) kemudian diserbuk dan disimpan dalam wadah plastik
yang tertutup rapat.
3.4 Pemeriksaan Karakteristik Simplisia dan Ekstrak
Pemeriksaan karakteristik simplisia dan ekstrak meliputi pemeriksaan
makroskopik, mikroskopik, penetapan kadar air, penetapan kadar sari larut
dalam air, penetapan kadar sari larut dalam etanol, penetapan kadar abu total,
dan penetapan kadar abu tidak larut dalam asam (WHO, 1998; Ditjen POM,
1995).
3.4.1 Pemeriksaan Makroskopik dan Organoleptik
Pemeriksaan makroskopik dan organolepik dilakukan dengan
mengamati bentuk, bau, dan rasa dari daun puguh tanoh segar dan simplisia
daun puguh tanoh.
3.4.2 Pemeriksaan Mikroskopik
Pemeriksaan mikroskopik dilakukan terhadap serbuk simplisia daun
puguh tanoh. Daun puguh tanoh dipotong melintang lalu diletakkan di atas
kaca objek yang telah ditetesi dengan larutan kloralhidrat dan ditutup dengan
3.4.3 Penetapan Kadar Air
Penetapan kadar air dilakukan menurut metode Azeotropi (destilasi
toluena). Alat terdiri dari labu alas bulat 500 ml, pendingin, tabung
penyambung, tabung penerima 5 ml berskala 0,05 ml, alat penampung, dan
pemanas listrik.
Cara kerja :
Dimasukkan 200 ml toluena dan 2 ml air suling ke dalam labu alas
bulat, lalu didestilasi selama 2 jam. Setelah itu, toluena dibiarkan mendingin
selama 30 menit, dan dibaca volume air pada tabung penerima dengan
ketelitian 0,05 ml. Kemudian ke dalam labu tersebut dimasukkan 5 g serbuk
simplisia yang telah ditimbang seksama, labu dipanaskan hati-hati selama 15
menit. Setelah toluena mendidih, kecepatan tetesan diatur lebih kurang 2 tetes
tiap detik sampai sebagian besar air terdestilasi, kemudian kecepatan tetesan
dinaikkan hingga 4 tetes tiap detik. Setelah semua air terdestilasi, bagian dalam
pendingin dibilas dengan toluena. Destilasi dilanjutkan selama 5 menit,
kemudian tabung penerima dibiarkan mendingin pada suhu kamar. Setelah air
dan toluena memisah sempurna, volume air dibaca dengan ketelitian 0,05 ml.
Selisih kedua volume air yang dibaca sesuai dengan kandungan air yang
terdapat dalam bahan yang diperiksa. Kadar air dihitung dalam persen (WHO,
3.4.4 Penetapan Kadar Sari Larut dalam Air
Sebanyak 5 g serbuk simplisia dan ekstrak dimaserasi selama 24 jam
dalam 100 ml air-kloroform (2,5 ml kloroform dalam air suling sampai 1 liter)
dalam labu bersumbat sambil dikocok sesekali selama 6 jam pertama,
kemudian dibiarkan selama 18 jam, lalu disaring. Sejumlah 20 ml filtrat
pertama diuapkan sampai kering dalam cawan penguap yang berdasar rata
yang telah ditara dan sisa dipanaskan pada suhu 105oC sampai bobot tetap. Kadar dalam persen sari yang larut dalam air dihitung terhadap bahan yang
telah dikeringkan (WHO, 1998; Ditjen POM, 1995).
3.4.5 Penetapan Kadar Sari Larut dalam Etanol
Sebanyak 5 g serbuk simplisia dan ekstrak dimaserasi selama 24 jam
dalam 100 ml etanol 96% dalam labu bersumbat sambil dikocok sesekali
selama 6 jam pertama, kemudian dibiarkan selama 18 jam. Kemudian disaring
cepat untuk menghindari penguapan etanol. Sejumlah 20 ml filtrat diuapkan
sampai kering dalam cawan penguap yang berdasar rata yang telah dipanaskan
dan ditara. Sisa dipanaskan pada suhu 105oC sampai bobot tetap. Kadar dalam persen sari yang larut dalam etanol 96% dihitung terhadap bahan yang telah
dikeringkan (WHO, 1998; Ditjen POM, 1995).
3.4.6 Penetapan Kadar Abu Total
Sebanyak 2 g serbuk simplisia dan ekstrak dimasukkan dalam krus
porselin yang telah dipijar dan ditara, kemudian diratakan. Krus dipijar
perlahan-lahan sampai arang habis, jika arang masih tidak dapat dihilangkan,
dan kertas saring dalam krus yang sama. Masukkan filtrat ke dalam krus,
uapkan, pijarkan hingga bobot tetap, timbang. Kadar abu dihitung terhadap
bahan yang telah dikeringkan (WHO, 1998; Ditjen POM, 1995).
3.4.7 Penetapan Kadar Abu Tidak Larut dalam Asam
Abu yang diperoleh dalam penetapan kadar abu dididihkan dalam 25 ml
asam klorida encer selama 5 menit, bagian yang tidak larut dalam asam
dikumpulkan, disaring melalui kertas saring bebas abu, cuci dengan air panas,
dipijarkan, kemudian didinginkan dan ditimbang sampai bobot tetap. Kadar
abu yang tidak larut dalam asam dihitung terhadap bahan yang telah
dikeringkan (WHO, 1998; Ditjen POM, 1995).
3.5 Skrining Fitokimia Simplisia dan Ekstrak
Skrining fitokimia serbuk simplisia dan ekstrak meliputi pemeriksaan
senyawa golongan flavonoid, alkaloid, saponin, tanin, glikosida, dan
steroid/triterpenoid.
3.5.1 Pemeriksaan Flavanoid
Serbuk simplisia dan ekstrak masing-masing ditimbang 0,5 g, lalu
ditambahkan 10 ml metanol, direfluks selama 10 menit, disaring panas-panas
melalui kertas saring. Filtrat diencerkan dengan 10 ml air suling, setelah
dingin ditambahkan 5 ml petroleum eter, dikocok hati-hati, lalu didiamkan
sebentar. Lapisan metanol diambil, diuapkan pada temperatur 40oC, sisanya dilarutkan dalam 5 ml etilasetat, disaring. Filtratnya digunakan untuk uji
a. sebanyak 1 ml filtrat diuapkan sampai kering, sisa dilarutkan dalam 2 ml
etanol 96%, lalu ditambah 0,5 g serbuk Zn dan 2 ml asam klorida 2 N.
Didiamkan selama 1 menit. Kemudian ditambahkan 10 tetes asam klorida
pekat. Jika dalam waktu 2-5 menit terjadi warna merah intensif
menunjukkan adanya flavonoid (glikosida-3-flavonol).
b. sebanyak 1 ml filtrat diuapkan sampai kering, sisa dilarutkan dalam 1-2 ml
etanol 96%, lalu ditambah 0,1 g serbuk Mg dan 10 tetes asam klorida pekat.
Jika terjadi warna merah jingga sampai warna merah ungu menunjukkan
adanya flavonoid. Jika terjadi warna kuning jingga menunjukkan adanya
flavon, kalkon dan auron (Ditjen POM, 1995).
3.5.2 Pemeriksaan Alkaloid
Serbuk simplisia dan ekstrak masing-masing ditimbang sebanyak 0,5 g
kemudian ditambahkan 1 ml asam klorida 2 N dan 9 ml air suling, dipanaskan
di atas penangas air selama 2 menit, didinginkan dan disaring. Filtrat yang
diperoleh dipakai untuk tes alkaloid. Diambil 3 tabung reaksi, lalu ke dalamnya
dimasukkan 0,5 ml filtrat. Pada masing-masing tabung reaksi :
a. ditambahkan 2 tetes pereaksi Mayer
b. ditambahkan 2 tetes pereaksi Bouchardat
c. ditambahkan 2 tetes pereaksi Dragendorff
Alkaloid positif jika terjadi endapan atau kekeruhan pada dua dari tiga
3.5.3 Pemeriksaan Saponin
Serbuk simplisia dan ekstrak masing-masing ditimbang sebanyak 0,5 g
dan dimasukkan ke dalam tabung reaksi, lalu ditambahkan 10 ml air panas,
didinginkan, kemudian dikocok kuat-kuat selama 10 menit. Jika terbentuk busa
setinggi 1-10 cm yang stabil tidak kurang dari 10 menit dan buih tidak hilang
dengan penambahan 1 tetes asam klorida 2 N menunjukkan adanya saponin
(Ditjen POM,1995).
3.5.4 Pemeriksaan Tanin
Sebanyak 0,5 g serbuk simplisia dan ekstrak disari dengan 10 ml air
suling lalu disaring, filtratnya diencerkan dengan air suling sampai tidak
berwarna. Diambil 2 ml larutan dan ditambahkan 1-2 tetes pereaksi besi (III)
klorida 1%. Jika terjadi warna biru kehitaman atau hijau kehitaman
menunjukkan adanya tanin (Ditjen POM, 1995).
3.5.5 Pemeriksaan Glikosida
Serbuk simplisia dan ekstrak masing-masing ditimbang sebanyak 3 g,
lalu disari dengan 30 ml campuran etanol 96%-air (7:3) dan 10 ml asam klorida
2 N, direfluks selama 2 jam, didinginkan dan disaring. Diambil 20 ml filtrat,
ditambahkan 25 ml air suling dan 25 ml timbal (II) asetat 0,4 M, dikocok,
didiamkan selama 5 menit, lalu disaring. Filtrat disari dengan 20 ml campuran
kloroform-isopropanol (3:2) sebanyak 3 kali. Pada kumpulan sari lapisan
isopropanol diuapkan pada suhu tidak lebih dari 50oC. Sisanya dilarutkan dengan 2 ml metanol untuk larutan percobaan. 0,1 ml larutan percobaan
Molish, kemudian ditambahkan hati-hati 2 ml asam sulfat, terbentuk cincin
berwarna ungu pada batas cairan, menunjukkan adanya ikatan gula (Ditjen
POM, 1995).
3.5.6 Pemeriksaan Steroid / Triterpenoid
Serbuk simplisia dan ekstrak masing-masing ditimbang sebanyak 1 g,
dimaserasi dengan 20 ml n-heksan selama 2 jam, disaring. Filtrat diuapkan
dalam cawan penguap dan pada sisanya ditambahkan pereaksi
Liebermann-Burchard melalui dinding cawan. Apabila terbentuk warna ungu atau merah
yang berubah menjadi biru ungu atau biru hijau menunjukkan adanya
triterpenoid/steroid (Harborne, 1987).
3.6 Pembuatan Ekstrak Etanol Daun Puguh Tanoh
Sebanyak 300 g serbuk simplisia dimasukkan ke dalam bejana tertutup
dan dibasahi dengan etanol 96%, kemudian dimaserasi selama 3 jam. Massa
dipindahkan sedikit demi sedikit ke dalam perkolator sambil tiap kali ditekan
hati-hati, kemudian cairan penyari dituangkan secukupnya sampai cairan mulai
menetes dan di atas simplisia masih terdapat selapis cairan penyari, perkolator
ditutup dan dibiarkan 24 jam. Cairan dibiarkan menetes dengan kecepatan 1 ml
tiap menit, cairan penyari ditambahkan berulang-ulang secukupnya dengan
memasang botol cairan penyari di atas perkolator dan diatur kecepatan
penetesan cairan penyari sama dengan kecepatan menetes perkolat, sehingga
selalu terdapat selapis cairan penyari di atas simplisia. Perkolasi dihentikan jika
perkolat yang keluar telah jernih. Perkolat yang diperoleh dipekatkan dengan
3.7 Pembuatan Pereaksi
Pembuatan pereaksi mencakup pembuatan suspensi Na-CMC 0,5%,
pembuatan suspensi EEDPT 5%, pembuatan larutan TCA 20%, pembuatan
larutan asam asetat glasial 15%, pembuatan pereaksi Griess (larutan asam
sulfanilat 1% dan larutan NED 0,1%).
3.7.1 Pembuatan Suspensi Na-CMC 0,5%
Sebanyak 0,5 g Na-CMC ditaburkan dalam lumpang yang berisi ±20 ml
air suling panas. Didiamkan selama 15 menit lalu digerus hingga diperoleh
massa yang transparan, lalu digerus sampai homogen, diencerkan dengan air
suling, dihomogenkan, dan dimasukkan ke labu tentukur 100 ml, dicukupkan
volumenya dengan air suling hingga 100 ml.
3.7.2 Pembuatan Suspensi Ekstrak Etanol Daun Puguh Tanoh (EEDPT) 5%
Sejumlah 1,25 g ekstrak etanol daun puguh tanoh dimasukkan ke dalam
lumpang dan ditambahkan suspensi Na-CMC 0,5% b/v sedikit demi sedikit
sambil digerus sampai homogen hingga 25 ml.
3.7.3 Pembuatan Pereaksi TCA 20% b/v
Sebanyak 20 g TCA dicukupkan dengan air suling hingga 100 ml.
3.7.4 Pembuatan Larutan Asam Asetat Glasial 15% v/v
Sebanyak 15 ml asam asetat glasial dicukupkan dengan air suling
hingga 100 ml.
3.7.5 Pembuatan Pereaksi Griess
Pereaksi Griess terdiri dari pereaksi asam sulfanilat 1% dan pereaksi
3.7.5.1 Pembuatan Pereaksi Asam Sulfanilat 1% b/v
Sebanyak 1 g asam sulfanilat dilarutkan ke dalam 100 ml asam asetat
glasial 15% v/v.
3.7.5.2 Pembuatan Pereaksi NED 0,1% b/v
Sebanyak 0,1 g NED dilarutkan ke dalam 100 ml asam asetat glasial
15%v/v.
3.8 Penyiapan Hewan Percobaan
Hewan percobaan yang digunakan dalam penelitian adalah tikus putih
jantan galur Wistar dengan berat badan 200 – 250 g. Sebelum perlakuan,
hewan percobaan dikondisikan terlebih dahulu selama 1 minggu dengan
kondisi lingkungan, makanan, suhu, dan minuman yang sama. Setelah 1
minggu, dipilih tikus yang sehat ditandai dengan berat badan yang stabil atau
meningkat.
3.9 Perlakuan Hewan Percobaan
Tikus jantan galur Wistar sebanyak 15 ekor dengan berat badan
200-250 g ditimbang berat badannya, dikelompokkan secara acak menjadi 5
kelompok, sehingga setiap kelompok terdiri dari 3 ekor tikus dan diberi
perlakuan sebagai berikut:
Kelompok I : Tikus tidak diberikan perlakuan (blanko)
Kelompok II : Tikus diberikan suspensi 0,5% CMC-Na dosis 1% BB secara
Kelompok III : Tikus diberikan suspensi EEDPT dosis 300 mg/kg BB secara
oral
Kelompok IV : Tikus diberikan larutan Doksorubisin HCl 2 mg/ml dosis
10 mg/kg BB secara intraperitonial
Kelompok V : Tikus diberikan suspensi EEDPT dosis 300 mg/kg BB secara
oral dan pada hari kelima, 1 jam setelah pemberian suspensi
EEDPT tikus diberikan larutan Doksorubisin HCl 2 mg/ml
dosis 10 mg/kg BB secara intraperitonial
Semua hewan percobaan dikorbankan pada hari ketujuh dengan cara dislokasi
leher, kemudian diambil cuplikan darah melalui jantung tikus (cardiac
puncture) (Raheem, 2009).
3.10 Penyiapan Plasma Darah Tikus
Diambil 1,5 ml cuplikan darah dimasukkan ke dalam tabung sentrifuge.
Ditambahkan 1,5 ml TCA 20% kemudian divortex dan disentrifugasi dengan
kecepatan 4000 rpm selama 10 menit. Diambil supernatan, dimasukkan ke
dalam vial, dan disimpan dalam lemari pembeku.
3.11 Pengukuran Kadar Nitrit dan Nitrat Pada Plasma
3.11.1 Pembuatan Larutan Induk Baku Nitrit
Serbuk natrium nitrit dikeringkan pada suhu 110° C selama satu jam,
kemudian didinginkan dalam desikator. Ditimbang 100 mg natrium nitrit yang
telah dikeringkan dan didinginkan, kemudian dipindahkan dalam labu tentukur
volumenya sampai garis tanda (C = 1000,0 μg/ml) (LIB I). Dipipet 1 ml LIB I
di atas dan dimasukkan ke dalam labu tentukur 100 ml lalu diencerkan dengan
air suling sampai garis tanda (C = 10,0 μg/ml) (LIB II).
3.11.2 Penentuan Panjang Gelombang Maksimum Nitrit Baku
Dipipet 4 ml LIB II dan dimasukkan dalam labu tentukur 50 ml,
ditambahkan 2,5 ml pereaksi asam sulfanilat 1% b/v dan dikocok. Setelah 5
menit, ditambahkan 2,5 ml pereaksi NED 0,1% b/v dan dicukupkan dengan air
suling sampai garis tanda kemudian dihomogenkan. Diukur serapan pada
panjang gelombang 400-800 nm dengan blanko air suling (C = 0,8 μg/ml).
3.11.3 Penentuan Waktu Kerja Nitrit Baku
Dipipet 4 ml LIB II dan dimasukkan dalam labu tentukur 50 ml,
ditambahkan 2,5 ml pereaksi asam sulfanilat 1% b/v dan dikocok. Setelah 5
menit, ditambahkan 2,5 ml pereaksi NED 0,1% b/v dan dicukupkan dengan air
suling sampai garis tanda kemudian dihomogenkan. Diukur serapan pada
panjang gelombang maksimum 540 nm dalam selang waktu 1 menit selama 60
menit.
3.11.4 Penentuan Kurva Kalibrasi Nitrit Baku
Dari LIB II (C = 10,0 μg/ml), dipipet masing-masing sebanyak 0,25;
0,5; 0,75; 1; 2; 3; 4; 5 dan 6 ml (0,05 μg/ml; 0,1 μg/ml; 0,15 μg/ml; 0,2 μg/ml;
0,4 μg/ml; 0,6 μg/ml; 0,8 μg/ml; 1,0 μg/ml; 1,2 μg/ml). Masing-masing
dimasukkan ke dalam labu tentukur 50 ml. Ditambahkan 2,5 ml pereaksi asam
sulfanilat 1% b/v pada setiap labu tentukur kemudian dikocok. Setelah 5 menit,
garis tanda dengan air suling dan dihomogenkan. Diukur serapan setelah menit
ke-12 dimana warna stabil pada panjang gelombang maksimum 540 nm.
3.11.5 Pengukuran Kadar Nitrit dalam Plasma
Sebanyak 1 ml plasma dimasukkan ke dalam labu tentukur 50 ml.
Ditambahkan 2,5 ml pereaksi asam sulfanilat 1% b/v kemudian dikocok.
Setelah 5 menit, ditambahkan 2,5 ml pereaksi NED 0,1% b/v, dikocok, dan
diencerkan sampai garis tanda dengan air suling dan dihomogenkan. Diukur
serapan setelah menit ke-12 dimana warna stabil pada panjang gelombang
maksimum 540 nm.
3.11.6 Pengukuran Kadar Nitrat dalam Plasma
Sebanyak 1 ml plasma dimasukkan ke dalam labu tentukur 50 ml.
Ditambahkan 10 mg serbuk Zn kemudian dikocok. Setelah 10 menit,
ditambahkan 2,5 ml pereaksi asam sulfanilat 1% b/v kemudian dikocok.
Setelah 5 menit, ditambahkan 2,5 ml pereaksi NED 0,1% b/v, dikocok, dan
diencerkan sampai garis tanda dengan air suling dan dihomogenkan. Diukur
serapan setelah menit ke-12 dimana warna stabil pada panjang gelombang
maksimum 540 nm.
3.12 Analisis Data
Data hasil penelitian dianalisis dengan metode analisis variansi
(ANAVA) dengan tingkat kepercayaan 95% dan dilanjutkan dengan uji post
hoc Duncan untuk melihat perbedaan nyata antar perlakuan. Analisis statistik
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Karakterisasi Simplisia dan Ekstrak
Hasil identifikasi tumbuhan dilakukan di “Herbarium Bogoriense”,
Bidang Botani Pusat Penelitian Biologi - LIPI Bogor menyebutkan bahwa
tumbuhan yang digunakan adalah tumbuhan puguh tanoh (Curanga fel-terrae
Merr.) famili Scrophulariaceae. Hasil identifikasi tumbuhan dapat dilihat pada
Lampiran 2 halaman 44.
Hasil pemeriksaan makroskopik daun puguh tanoh segar dicirikan
dengan daun berwarna hijau muda sampai hijau tua, berbentuk bulat telur, tepi
daun beringgit, ukuran daun dengan panjang 4 - 6 cm dan lebar 2 - 4 cm,
dengan tekstur permukaan daun yang kasar, berkerut-kerut, dan berbulu.
Gambar dapat dilihat pada Lampiran 3 halaman 45.
Hasil pemeriksaan makroskopik simplisia daun puguh tanoh dicirikan
dengan daun berwarna hijau muda sampai hijau tua yang lebih pudar
dibandingkan dengan daun segar dan tepi daun mengerut. Gambar dapat dilihat
pada Lampiran 4 halaman 46.
Hasil pemeriksaan mikroskopik pada serbuk simplisia mempunyai
fragmen pengenal berupa trikoma uniseluler, berkas pembuluh angkut bentuk
spiral, kristal kalsium oksalat bentuk prisma, dan stomata dengan dua tipe yaitu
tipe diasitik dan anomositik. Gambar dapat dilihat pada Lampiran 5
Hasil pemeriksaan karakteristik simplisia dan ekstrak dari daun puguh
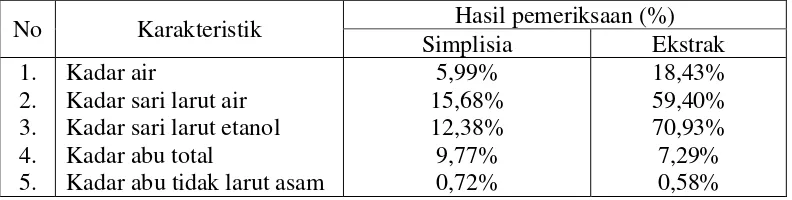
[image:50.595.108.504.182.282.2]tanoh dapat dilihat pada Tabel 4.1.
Tabel 4.1. Hasil karakterisasi simplisia dan ekstrak daun puguh tanoh
No Karakteristik Hasil pemeriksaan (%)
Simplisia Ekstrak
1. 2. 3. 4. 5. Kadar air
Kadar sari larut air Kadar sari larut etanol Kadar abu total
Kadar abu tidak larut asam
5,99% 15,68% 12,38% 9,77% 0,72% 18,43% 59,40% 70,93% 7,29% 0,58%
Pengeringan simplisia dilakukan untuk mendapatkan simplisia yang
tidak mudah rusak sehingga dapat disimpan dalam waktu yang lebih lama.
Penurunan mutu atau kerusakan simplisia dapat dicegah dengan mengurangi
kadar air dan penghentian reaksi enzimatik. Reaksi enzimatik tidak
berlangsung lagi bila kadar air dalam simplisia kurang dari 10% (BPOM RI,
2005; Trease dan Evans, 1983).
Karakterisasi simplisia lain seperti penetapan kadar sari yang larut
dalam etanol, penetapan kadar sari yang larut dalam air, penetapan kadar abu
total, dan penetapan kadar abu yang tidak larut dalam asam khusus untuk
simplisia daun puguh tanoh belum ada literatur yang mencantumkannya
sehingga tidak mempunyai standarisasi.
Penetapan kadar sari yang larut dalam air dan dalam etanol dilakukan
untuk mengetahui jumlah senyawa yang dapat tersari dalam air dan dalam
etanol dari suatu simplisia. Senyawa yang bersifat polar dan larut dalam air
akan tersari oleh air. Sedangkan senyawa-senyawa yang tidak larut dalam air
Penetapan kadar abu dimaksudkan untuk mengetahui kandungan
mineral internal yang terdapat di dalam simplisia yang diteliti serta senyawa
organik yang tersisa selama pembakaran.
Abu total terbagi dua yang pertama abu fisiologis adalah abu yang
berasal dari jaringan tumbuhan itu sendiri dan abu non fisiologis adalah sisa
setelah pembakaran yang berasal dari bahan-bahan dari luar yang terdapat pada
permukaan simplisia. Kadar abu tidak larut asam untuk menentukan jumlah
silika, khususnya pasir yang ada pada simplisia dengan cara melarutkan abu
total dalam asam klorida (WHO, 1998).
4.2 Hasil Skrining Fitokimia Simplisia dan Ekstrak
Skrining fitokimia dilakukan untuk mengetahui golongan senyawa yang
terkandung dalam serbuk simplisia dan ekstrak daun puguh tanoh. Hasil
[image:51.595.109.501.497.628.2]skrining dapat dilihat pada Tabel 4.2.
Tabel 4.2. Hasil skrining fitokimia serbuk simplisia dan ekstrak daun puguh tanoh
No. Golongan senyawa Hasil
Simplisia Ekstrak
1. Alkaloid - -
2. Flavonoid + +
3. Glikosida + +
4. Saponin + +
5. Tanin + +
6. Steroid/Triterpenoid + +
Keterangan: (+) positif : mengandung golongan senyawa (-) negatif : tidak mengandung golongan senyawa
Hasil skrining menunjukkan bahwa serbuk simplisia dan ekstrak daun
puguh tanoh mengandung senyawa golongan flavonoid, glikosida, saponin,
4.3 Hasil pengukuran kadar nitrat dan nitrit dalam plasma darah
Pengukuran nitrit dan nitrat, produk akhir yang stabil dari oksidasi
nitrogen oksida, adalah metode tidak langsung yang umum digunakan utuk
memonitor kadar nitrogen monooksida (NO) pada berbagai cairan tubuh.
Produksi NO endogen mempunyai hubungan yang erat dengan kadar
nitrit/nitrat di serum, plasma, dan urin. Oleh karena itu, perkiraan kadar
nitrit/nitrat adalah suatu pengukuran relatif terhadap produksi NO secara in
vivo (Sastry, et al., 2002).
Di dalam darah nitrat dibentuk secara langsung dari reaksi dioksigenasi
NO antara NO dan oksihemoglobin. NO bereaksi dengan oksihemoglobin
membentuk nitrat dan methemoglobin dengan persamaan NO + Fe+2 — O2 NO3- + Fe+3 . Nitrit juga dibentuk secara langsung pada darah melalui autooksidasi NO antara dua molekul NO dengan oksigen. Reaksi ini dikatalisis
oleh protein plasma ceruloplasmin dengan persamaan : 4 NO* + O2 + H2O 4 NO2- + 4H+ (Lundberg, et al., 2011).
Pengukuran kadar nitrit dan nitrat secara spektrofotometri UV-Vis pada
panjang gelombang 540 nm dengan pereaksi Griess (terdiri dari 1% asam
sulfanilat dan 0,1% NED dengan perbandingan 1:1) menggunakan prinsip
diazotasi nitrit dengan asam sulfanilat pada suasana asam menjadi senyawa azo
dan dengan penambahan NED akan membentuk warna ungu yang dapat diukur
pada panjang gelombang 540 nm. Kurva kalibrasi yang diperoleh yaitu
linieritas antara kadar (X) dengan absorbansi (Y). Operating time pada
penelitian ini adalah 12 menit.
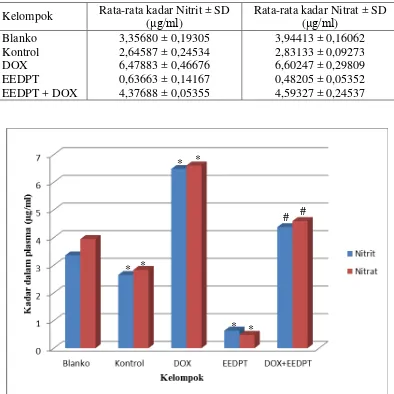
Hasil pengukuran kadar nitrit dan nitrat dalam plasma darah dapat
[image:53.595.107.501.235.629.2]dilihat pada Tabel 4.3 dan Gambar 4.1.
Tabel 4.3 Kadar Nitrit dan Nitrat dalam Plasma Darah
Kelompok Rata-rata kadar Nitrit ± SD (μg/ml)
Rata-rata kadar Nitrat ± SD (μg/ml)
Blanko 3,35680 ± 0,19305 3,94413 ± 0,16062
Kontrol 2,64587 ± 0,24534 2,83133 ± 0,09273
DOX 6,47883 ± 0,46676 6,60247 ± 0,29809
EEDPT 0,63663 ± 0,14167 0,48205 ± 0,05352
EEDPT + DOX 4,37688 ± 0,05355 4,59327 ± 0,24537
Keterangan : * : mempunyai perbedaan signifikan terhadap kelompok blanko
# : mempunyai perbedaan signifikan terhadap kelompok DOX Gambar 4.1. Grafik Kadar Nitrit dan Nitrat dalam Plasma
* *
* *
* *
Penelitian ini menggunakan 5 kelompok yaitu kelompok I (blanko),
kelompok II (kontrol), kelompok III (DOX), kelompok IV (EEDPT), dan
kelompok V (EEDPT+DOX). Penggunaan kelompok blanko pada penelitian
bertujuan untuk mengetahui kadar nitrit dan nitrat plasma darah pada tikus
normal (tidak diberikan perlakuan). Hasil pengukuran pada kelompok blanko
diperoleh kadar nitrit 3,35680 ± 0,19305 μg/ml dan kadar nitrat 3,94413 ±
0,16062 μg/ml.
Hasil pengukuran pada kelompok II (kontrol), yang diberikan larutan
pembawa Na-CMC 0,5%, diperoleh kadar nitrit 2,64587 ± 0,24534 μg/ml dan
kadar nitrat 2,83133 ± 0,09273 μg/ml. Hasil ini menunjukkan bahwa
pemberian larutan pembawa Na-CMC 0,5% dapat menurunkan kadar nitrit dan
nitrat plasma secara signifikan dibandingkan dengan kelompok blanko (p <
0,05). Karboksimetilselulosa (CMC) adalah turunan selulosa yang digunakan
dalam formulasi pemberian obat dan menunjukkan aktivitas antioksidan berupa
resistensi terhadap degradasi OH* dan mampu menangkap ROS dan menghambat pembentukan O2- (Trombino, et al., 2012).
Hasil pengukuran pada kelompok III, yang diberikan Doksorubisin
dosis tunggal 10 mg/kg BB, diperoleh kadar nitrit 6,47883 ± 0,46676 μg/ml
dan nitrat 6,60247 ± 0,29809 μg/ml. Hasil ini menunjukkan bahwa pemberian
Doksorubisin dosis tunggal 10 mg/kg BB dapat meningkatkan kadar nitrit dan
nitrat pada plasma secara signifikan dibandingkan dengan kelompok blanko
(p < 0,05) dan kelompok kontrol (p < 0,05). Adanya peningkatan kadar NO