CAIRAN RUMEN SAPI
INDRA SAPUTRA
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
CAIRAN RUMEN SAPI
INDRA SAPUTRA
Skripsi
sebagai salah satu syarat memperoleh gelar
Sarjana Sains pada
Program Studi Biokimia
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
NIM
: G44104010
Disetujui
Komisi Pembimbing
Dr. Ir. I Made Artika, M.App, Sc. Ir. H. A.E. Zainal Hasan, M.Si.
Ketua Anggota
Diketahui
Dr. drh. Hasim, DEA
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam
penelitian yang dilaksanakan dari bulan April 2008 ini ialah
growth promoter
(pemacu pertumbuhan), dengan judul Aktivitas Antibakteri Mikrokapsulasi
Propolis
Trigona
spp. Pandeglang setelah Terpapar Cairan Rumen Sapi
Terima kasih penulis ucapkan kepada Bapak Dr. Ir. I Made Artika, M.App,
Sc. sebagai pembimbing utama, Ir. H. A.E. Zainal Hasan, M.Si. sebagai anggota,
dan seluruh staf laboratorium Biokimia (Pak Yadi, Pak Nana, Pak Arya, Ibu Is,
Ibu Mery, Ibu Tuti) atas kenangan indah kepada penulis selama penelitian. Di
samping itu, terima kasih penulis ucapkan kepada teman seperjuangan laskar
propolis (Intan, Dedy, Fitri, Dian, Datasena, Desy) yang selalu memberi
dukungan, perhatian, dan semangatnya. Terima kasih juga penulis sampaikan
kepada teman satu kos (Nanda RP, Syahrul F, Aji P, Harry W, Aris K, Miko A)
dan teman satu perjuangan Biokimia angkatan 2004 atas kebersamaannya selama
ini. Ucapan terima kasih pun tak lupa penulis ucapkan kepada orang tua, adik
yang selalu memberi perhatian, dukungan, dan bantuan baik moril maupun
materil, serta seluruh pihak yang tidak bisa penulis sebutkan satu persatu. Penulis
menyadari masih banyak kekurangan dalam penelitian ini. Oleh karena itu,
penulis berharap semoga skripsi ini mampu memberikan manfaat bagi yang
membacanya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Januari 2009
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 24 Februari 1986 dari ayah Juan
Mukri dan ibu Yusnainah. Penulis merupakan putra pertama dari dua bersaudara.
Tahun 2004 penulis lulus dari SMA Negeri 65 Jakarta Barat dan pada
tahun yang sama lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk
(USMI) IPB. Penulis memilih Program Studi Biokimia, Fakultas Matematika dan
Ilmu Pengetahuan Alam.
ABSTRAK
INDRA SAPUTRA. Aktivitas Antibakteri Mikrokapsulasi Propolis
Trigona
spp.
Pandeglang setelah Terpapar Cairan Rumen Sapi. Dibimbing oleh I MADE
ARTIKA dan ZAINAL HASAN.
ABSTRACT
INDRA SAPUTRA. Antibacterial Activity of Microencapsulation of
Trigona
spp.
Propolis Pandeglang after Following Exposure to Cattle Rumen Fluid. Under the
direction of I MADE ARTIKA and ZAINAL HASAN.
DAFTAR ISI
Halaman
DAFTAR TABEL ... ix
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... x
PENDAHULUAN ... 1
TINJAUAN PUSTAKA
Lebah Madu
Trigona
spp
. ...
1
Propolis ... 2
Pemacu Pertumbuhan ... 3
Rumen Sapi ... 4
Mikrob Rumen Sapi ... 5
Kapsul... 5
Mikrokapsulasi ... 6
Escherichia coli ...
7
BAHAN DAN METODE
Bahan dan Alat ... 7
Metode ... 7
HASIL DAN PEMBAHASAN
Rendemen Ekstrak Propolis ... 9
Mikrokapsulasi Propolis
Trigona
spp. ... 10
Uji Ketahanan Mikrokapsulasi Propolis
Trigona
spp. ... 11
Residu Aktivitas Antibakteri Propolis
Trigona
spp ... 12
Residu Aktivitas Antibakteri Propolis Ukuran Kapsul 00 ... 12
Residu Aktivitas Antibakteri Propolis Ukuran Kapsul 1 ... 14
Interaksi Konsentrasi, Waktu Kontak, dan Ukuran Kapsul
terhadap Aktivitas Antibakteri Propolis ... 16
Efektivitas Penghambatan Ekstrak Propolis terhadap Kapsul Ampisilin ... 16
Efektivitas Penghambatan Ekstrak Propolis terhadap Propolis Merk-X ... 17
SIMPULAN DAN SARAN ... 17
DAFTAR PUSTAKA ... 18
DAFTAR TABEL
Halaman
1 Komposisi propolis ... 3
2 Aktivitas biologis komponen propolis ... 3
3 Proses mikrokapsulasi dan ukuran kapsul yang dihasilkan ... 6
DAFTAR GAMBAR
Halaman
1
Trigona
spp
.
... 2
2 Propolis dalam sarang lebah ... 3
3 Jalur pencernaan ruminansia ... 5
4 Hasil mikrokapsulasi propolis
Trigona
spp. 2% dan 4% ... 11
5 Diameter zona bening semua perlakuan konsentrasi ukuran kapsul 00 ... 13
6 Diameter zona bening konsentrasi mikrokapsul propolis dengan kapsul
2% dan 4% ukuran kapsul 00 ... 13
7 Diameter zona bening mikrokapsulasi dengan atau tanpa kapsul
konsentrasi 2% dan 4% ukuran kapsul 00 ... 13
8 Diameter zona bening semua perlakuan konsentrasi ukuran kapsul 1... 14
9 Diameter zona bening konsentrasi mikrokapsul propolis dengan kapsul
2% dan 4% ukuran kapsul 1 ... 15
10 Diameter zona bening mikrokapsulasi dengan atau tanpa kapsul
konsentrasi 2% dan 4% ukuran kapsul 1 ... 15
11 Efektivitas penghambatan ekstrak propolis terhadap kapsul ampisilin ... 17
DAFTAR LAMPIRAN
Halaman
1 Tahapan penelitian ... 22
2 Ekstraksi propolis... 22
3 Perhitungan rendemen ... 23
4 Formulasi campuran A dan B dalam pembuatan mikrokapsul
propolis asal Pandeglang ... 24
5 Tahapan pembuatan mikrokapsul propolis ... 24
6 Diameter daerah bening kapsul ukuran 00 ... 25
7 Diameter zona bening kapsul ukuran 1 ... 27
8 Diameter zona bening kontrol ... 29
9 Hasil pengukuran zona bening ukuran kapsul 1 ... 30
10 Hasil pengukuran zona bening kapsul 00 ... 31
11 Zona bening kontrol ... 32
12 Hasil ANOVA menggunakkan SAS 9.1 ... 33
13 Hasil two-way ANOVA menggunakkan Minitab 14 ... 34
14 Berbagai ukuran kapsul gelatin keras yang sudah diisikan
hasil mikrokapsulasi ... 35
15 Desain alat uji ketahanan mikrokapsul propolis ... 35
16 Efektivitas antibakteri ekstrak propolis ... 36
CAIRAN RUMEN SAPI
INDRA SAPUTRA
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
CAIRAN RUMEN SAPI
INDRA SAPUTRA
Skripsi
sebagai salah satu syarat memperoleh gelar
Sarjana Sains pada
Program Studi Biokimia
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
NIM
: G44104010
Disetujui
Komisi Pembimbing
Dr. Ir. I Made Artika, M.App, Sc. Ir. H. A.E. Zainal Hasan, M.Si.
Ketua Anggota
Diketahui
Dr. drh. Hasim, DEA
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam
penelitian yang dilaksanakan dari bulan April 2008 ini ialah
growth promoter
(pemacu pertumbuhan), dengan judul Aktivitas Antibakteri Mikrokapsulasi
Propolis
Trigona
spp. Pandeglang setelah Terpapar Cairan Rumen Sapi
Terima kasih penulis ucapkan kepada Bapak Dr. Ir. I Made Artika, M.App,
Sc. sebagai pembimbing utama, Ir. H. A.E. Zainal Hasan, M.Si. sebagai anggota,
dan seluruh staf laboratorium Biokimia (Pak Yadi, Pak Nana, Pak Arya, Ibu Is,
Ibu Mery, Ibu Tuti) atas kenangan indah kepada penulis selama penelitian. Di
samping itu, terima kasih penulis ucapkan kepada teman seperjuangan laskar
propolis (Intan, Dedy, Fitri, Dian, Datasena, Desy) yang selalu memberi
dukungan, perhatian, dan semangatnya. Terima kasih juga penulis sampaikan
kepada teman satu kos (Nanda RP, Syahrul F, Aji P, Harry W, Aris K, Miko A)
dan teman satu perjuangan Biokimia angkatan 2004 atas kebersamaannya selama
ini. Ucapan terima kasih pun tak lupa penulis ucapkan kepada orang tua, adik
yang selalu memberi perhatian, dukungan, dan bantuan baik moril maupun
materil, serta seluruh pihak yang tidak bisa penulis sebutkan satu persatu. Penulis
menyadari masih banyak kekurangan dalam penelitian ini. Oleh karena itu,
penulis berharap semoga skripsi ini mampu memberikan manfaat bagi yang
membacanya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Januari 2009
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 24 Februari 1986 dari ayah Juan
Mukri dan ibu Yusnainah. Penulis merupakan putra pertama dari dua bersaudara.
Tahun 2004 penulis lulus dari SMA Negeri 65 Jakarta Barat dan pada
tahun yang sama lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk
(USMI) IPB. Penulis memilih Program Studi Biokimia, Fakultas Matematika dan
Ilmu Pengetahuan Alam.
ABSTRAK
INDRA SAPUTRA. Aktivitas Antibakteri Mikrokapsulasi Propolis
Trigona
spp.
Pandeglang setelah Terpapar Cairan Rumen Sapi. Dibimbing oleh I MADE
ARTIKA dan ZAINAL HASAN.
ABSTRACT
INDRA SAPUTRA. Antibacterial Activity of Microencapsulation of
Trigona
spp.
Propolis Pandeglang after Following Exposure to Cattle Rumen Fluid. Under the
direction of I MADE ARTIKA and ZAINAL HASAN.
DAFTAR ISI
Halaman
DAFTAR TABEL ... ix
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... x
PENDAHULUAN ... 1
TINJAUAN PUSTAKA
Lebah Madu
Trigona
spp
. ...
1
Propolis ... 2
Pemacu Pertumbuhan ... 3
Rumen Sapi ... 4
Mikrob Rumen Sapi ... 5
Kapsul... 5
Mikrokapsulasi ... 6
Escherichia coli ...
7
BAHAN DAN METODE
Bahan dan Alat ... 7
Metode ... 7
HASIL DAN PEMBAHASAN
Rendemen Ekstrak Propolis ... 9
Mikrokapsulasi Propolis
Trigona
spp. ... 10
Uji Ketahanan Mikrokapsulasi Propolis
Trigona
spp. ... 11
Residu Aktivitas Antibakteri Propolis
Trigona
spp ... 12
Residu Aktivitas Antibakteri Propolis Ukuran Kapsul 00 ... 12
Residu Aktivitas Antibakteri Propolis Ukuran Kapsul 1 ... 14
Interaksi Konsentrasi, Waktu Kontak, dan Ukuran Kapsul
terhadap Aktivitas Antibakteri Propolis ... 16
Efektivitas Penghambatan Ekstrak Propolis terhadap Kapsul Ampisilin ... 16
Efektivitas Penghambatan Ekstrak Propolis terhadap Propolis Merk-X ... 17
SIMPULAN DAN SARAN ... 17
DAFTAR PUSTAKA ... 18
DAFTAR TABEL
Halaman
1 Komposisi propolis ... 3
2 Aktivitas biologis komponen propolis ... 3
3 Proses mikrokapsulasi dan ukuran kapsul yang dihasilkan ... 6
DAFTAR GAMBAR
Halaman
1
Trigona
spp
.
... 2
2 Propolis dalam sarang lebah ... 3
3 Jalur pencernaan ruminansia ... 5
4 Hasil mikrokapsulasi propolis
Trigona
spp. 2% dan 4% ... 11
5 Diameter zona bening semua perlakuan konsentrasi ukuran kapsul 00 ... 13
6 Diameter zona bening konsentrasi mikrokapsul propolis dengan kapsul
2% dan 4% ukuran kapsul 00 ... 13
7 Diameter zona bening mikrokapsulasi dengan atau tanpa kapsul
konsentrasi 2% dan 4% ukuran kapsul 00 ... 13
8 Diameter zona bening semua perlakuan konsentrasi ukuran kapsul 1... 14
9 Diameter zona bening konsentrasi mikrokapsul propolis dengan kapsul
2% dan 4% ukuran kapsul 1 ... 15
10 Diameter zona bening mikrokapsulasi dengan atau tanpa kapsul
konsentrasi 2% dan 4% ukuran kapsul 1 ... 15
11 Efektivitas penghambatan ekstrak propolis terhadap kapsul ampisilin ... 17
DAFTAR LAMPIRAN
Halaman
1 Tahapan penelitian ... 22
2 Ekstraksi propolis... 22
3 Perhitungan rendemen ... 23
4 Formulasi campuran A dan B dalam pembuatan mikrokapsul
propolis asal Pandeglang ... 24
5 Tahapan pembuatan mikrokapsul propolis ... 24
6 Diameter daerah bening kapsul ukuran 00 ... 25
7 Diameter zona bening kapsul ukuran 1 ... 27
8 Diameter zona bening kontrol ... 29
9 Hasil pengukuran zona bening ukuran kapsul 1 ... 30
10 Hasil pengukuran zona bening kapsul 00 ... 31
11 Zona bening kontrol ... 32
12 Hasil ANOVA menggunakkan SAS 9.1 ... 33
13 Hasil two-way ANOVA menggunakkan Minitab 14 ... 34
14 Berbagai ukuran kapsul gelatin keras yang sudah diisikan
hasil mikrokapsulasi ... 35
15 Desain alat uji ketahanan mikrokapsul propolis ... 35
16 Efektivitas antibakteri ekstrak propolis ... 36
PENDAHULUAN
Keseimbangan mikroflora di dalam usus sapi sangat penting karena berpengaruh terhadap pertumbuhan sapi. Keseimbangan yang bernilai negatif, yang berarti bakteri patogen berjumlah lebih besar daripada bakteri tidak patogen merupakan penyebab diare yang banyak terjadi pada sapi. Salah satu bakteri yang dapat menyebabkan diare adalah Escherichia coli. E. coli merupakan bakteri tidak patogen yang dapat menyebabkan diare ketika jumlah populasinya di dalam usus melebihi jumlah populasi normal. Masalah diare yang terjadi menyebabkan penurunan bobot sapi, yang berdampak pada menurunnya harga sapi di pasaran. Hal ini sangat merugikan para peternak sapi yang ada. Solusi yang ada adalah dengan menambahkan pada pakan beberapa antibiotika yang telah memenuhi syarat seperti basitrasin dan virginiamisin (Sutisna 2008). Antibiotika yang ditambahkan ke dalam pakan ternak sering disebut dengan pemacu pertumbuhan (growth promoter).
Menurut Ulfah (2007), pemakaian antibiotika yang pada awalnya untuk mengatasi masalah diare pada sapi, ternyata menimbulkan masalah baru, yaitu ditemukannya resistensi mikrob dan residu antibiotika pada produk ternak. Resistensi mikrob dapat ditransfer dari ternak ke tubuh manusia melalui kontak langsung manusia dengan ternak maupun secara tidak langsung melalui konsumsi produk hewani (termasuk hewan laut), dan bahan-bahan makanan yang diawetkan dengan antibiotika. Pernyataan ini pun diperkuat oleh Naim (2003), penggunaan antibiotika pada pakan hewan sebagai pemacu pertumbuhan telah mengakibatkan pertumbuhan bakteri yang resisten terhadap antibiotika yang umum digunakan untuk terapi infeksi pada manusia.
Propolis yang dihasilkan oleh lebah madu
Trigona spp. terbukti mampu berperan sebagai agen antibakteri pada beberapa bakteri uji seperti Bacillus subtilis, Staphylococcus aureus, Escherichia coli, dan Pseudomonas aeruginosa (Anggraini 2006). Penelitian selanjutnya, yaitu Lasmayanty (2007) telah mengujikan propolis Trigona spp. pada
Streptococcus mutans, penyebab karies gigi. Fatoni (2008) menyatakan bahwa ekstrak propolis pada konsentrasi 2.04% dan 5.90% berturut-turut dapat menghambat beberapa bakteri patogen dan tidak patogen di usus sapi potong dewasa.
Hipotesis penelitian, yaitu bahwa mikrokapsul propolis yang telah terpapar cairan rumen sapi akan tetap aktif. Penelitian bertujuan mempelajari waktu pelepasan propolis setelah terpapar cairan rumen sapi. Adanya resistensi mikrob dan ditemukannya residu antibiotika pada produk ternak menjadi alasan utama diperlukannya alternatif antibiotika yang bersifat alami dan aman untuk manusia.
Pencarian alternatif antibiotika sebagai pemacu pertumbuhansudah banyak dilakukan di antaranya Ulfah (2007) melaporkan bahwa minyak esensial berpotensi sebagai alternatif antibiotika pemacu pertumbuhan. Akan tetapi, penelitian mengenai uji mengetahui sifat ketahanan propolis yang telah dimikrokapsul dengan bahan penyalut maltodekstrin di dalam cairan rumen sapi belum dilakukan. Oleh karena itu, uji ketahanan mikrokapsulasi propolis Trigona spp. Pandeglang dalam cairan rumen sapi in vitro perlu dilakukan. Hasil penelitian diharapkan dapat memberikan informasi tentang waktu pelepasan propolis yang dimikrokapsul setelah terpapar cairan rumen sapi.
TINJAUAN PUSTAKA
Lebah Madu Trigona spp.
Lebah madu Trigona spp. merupakan serangga yang hidup berkelompok dan membentuk suatu koloni. Lebah madu
Trigona spp. termasuk ke dalam golongan
stingless bee. Lebah madu Trigona spp. Juga sering disebut dengan Melipona. Golongan
stingless bee adalah golongan lebah yang menggigit akan tetapi tidak menyengat. Lebah ini mudah dijumpai di daerah tropis dan subtropis di Amerika Selatan, setengah bagian Afrika Selatan, dan Asia Tenggara. Koloninya terdiri atas 300-80.000 ekor lebah (Free 1982). Lebah Trigona spp. diklasifikasikan dalam divisi Animalia, filum Arthopoda, kelas Insecta, ordo Hymenoptera, famili Apidae, genus Trigona, dan species Trigona spp. (Sihombing 1997). Menurut Singh (1962) kandungan madu pada Trigona lebih sedikit daripada golongan lebah lokal seperti Apis. Madu yang terdapat pada Trigona juga sulit untuk diekstrak. Akan tetapi, kandungan propolis pada Trigona lebih banyak daripada golongan Apis. Lebah madu Trigona spp. dapat dilihat pada Gambar 1.
Perhutani 1986). Jumlah madu yang dihasilkan lebih sedikit dan lebih sulit diekstrak, namun jumlah propolisnya lebih banyak dibandingkan dengan lebih jenis lain (Singh 1962). Trigona spp. memiliki sengat sisa akan tetapi tidak digunakan sebagai alat pertahanan. Lebah ini akan menggigit musuhnya atau membakar kulit musuhnya dengan larutan basa. Lebah ini juga dilengkapi dengan sistem kekebalan untuk menyerang serangga penggangu lain (Free 1982). Trigona
spp. lebih banyak mencari makanan pada pagi hari dibandingkan dengan sore hari. Hal ini dipengaruhi oleh intensitas cahaya matahari. Ukuran tubuh sangat mempengaruhi jarak terbang lebah mencari makanan. Makin besar tubuh lebah maka makin jauh jarak terbangnya. Trigona spp. dengan ukuran 5 cm mempunyai jarak terbang sekitar 600 m (Amano et al. 2000 dalam Nelli 2004).
Koloni lebah madu terdiri atas dua golongan, yaitu golongan reproduktif (lebah jantan dan ratu) dan golongan nonreproduktif (lebah pekerja). Satu sama lainnya dapat dibedakan dari bentuk, rupa, warna, dan tingkah laku. Satu koloni lebah hanya memiliki satu ekor ratu, ratusan ekor lebah jantan, dan ribuan ekor lebah pekerja (Sumoprastowo 1980). Ratu memiliki ukuran paling besar dan paling menarik di antara lebah lainnya dalam koloni. Ratu hanya bertugas menghasilkan telur dan lebah jantan bertugas mengawini lebah ratu. Semua pekerjaan dilakukan oleh lebah pekerja, baik pekerjaan di dalam sarang maupun di luar sarang. Semua pembagian tugas dilakukan dengan teratur berdasarkan tingkatan usia (Sumoprastowo 1980).
Gambar 1 Lebah madu Trigona spp.
Propolis
Propolis merupakan produk selain madu yang dihasilkan lebah yang digunakan sebagai pertahanan ataupun bahan pengisi retakan pada struktur sarang (Munstest & Zygmut dalam Haddadin 2008 ; Krell 2004). Propolis sering disebut dengan bee glue atau lem lebah (Iraz et al. 2005). Propolis merupakan resin lengket yang dikumpulkan oleh lebah pekerja dari kuncup, kulit kayu,
dan dari bagian tumbuhan lain (Gojmerac 1983). Resin-resin yang diperoleh dari bermacam-macam tumbuhan kemudian dicampur dengan saliva dan enzim lebah sehingga berbeda dari resin tumbuhan asalnya. Propolis di dalam sarang lebah dapat dilihat pada Gambar 2.
Propolis berwarna kuning sampai coklat tua, bahkan ada yang transparan. Perbedaan warna tersebut dipengaruhi oleh kandungan flavonoidnya. Pada suhu di bawah 15°C, propolis keras dan rapuh, tetapi kembali lebih lengket pada suhu 25-45°C. Propolis umumnya meleleh pada suhu 60-69°C dan beberapa sampel mempunyai titik leleh di atas 100°C (Woo 2004).
Propolis sangat diperlukan bagi kelangsungan kehidupan lebah madu, yaitu sebagai antimikrob (Dharmayanti 2000) dan digunakan untuk mengisi celah dan retakan serta menghaluskan permukaan yang kasar pada sarang lebah madu (Gojmerac 1983). Lebah madu sangat memerlukan propolis karena lebah madu sangat rentan dengan infeksi bakteri dan virus (Chinthalapally et al. 1993). Propolis mampu menghambat pertumbuhan beberapa bakteri seperti Bacillus subtilis, Staphylococcus aureus, Escherichia coli, dan Pseudomonas aeruginosa (Anggraini 2006). Lasmayanty (2007) telah menguji efek ekstrak propolis Trigona spp. terhadap bakteri
Streptococcus mutans penyebab karies gigi. Propolis Trigona spp. asal Pandeglang dan Bukittinggi diketahui bahwa pada tingkat konsentrasi tertentu lebih menghambat bakteri patogen daripada bakteri tidak patogen di usus sapi (Fatoni 2008 ; Tukan 2008).
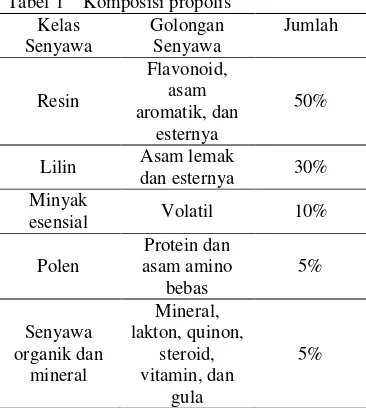
Gojmerac (1983) menyatakan bahwa propolis mengandung bahan campuran kompleks malam, resin, balsam, minyak, dan sedikit polen (Tabel 1). Unsur aktif yang penting dalam bidang farmakologi adalah flavonoid (flavon, flavonol, flavonon), senyawa fenolat, serta senyawa aromatik. Flavonoid berperan dalam pewarnaan tumbuhan. Senyawa flavonoid yang ada di antaranya adalah flavonol (galangin, kaemferol, quersetin), flavonon (pinocembrin
dan pinosrobin), serta falvon (chrysin,
kecil seperti vitamin A, B1, B2, B6, C, dan E (Khismatulina 2005).
Komposisi kimia propolis sangat kompleks dan tergantung vegetasi lingkungan tempat pengumpulannya. Pada daerah beriklim sedang seperti Eropa, Asia, dan Amerika Utara, sumber utama propolis adalah kuncup pohon poplar. Aktivitas biologis propolis dapat dilihat pada Tabel 2.
Kelebihan propolis sebagai antibiotika alami dibandingkan dengan bahan sintetik adalah lebih aman serta dengan efek samping yang relatif kecil. Satu-satunya efek samping yang terjadi dan itu pun jarang terjadi, yaitu timbulnya reaksi alergi. Selain itu, propolis sebagai antibiotika mempunyai selektivitas yang tinggi. Propolis hanya membunuh bakteri penyebab penyakit sedangkan mikrob yang berguna seperti flora usus tidak terganggu (Winingsih 2004).
Gambar 2 Propolis dalam sarang lebah. Tabel 1 Komposisi propolis
Kelas Senyawa Golongan Senyawa Jumlah Resin Flavonoid, asam aromatik, dan esternya 50%
Lilin Asam lemak
dan esternya 30% Minyak
esensial Volatil 10% Polen Protein dan asam amino bebas 5% Senyawa organik dan mineral Mineral, lakton, quinon, steroid, vitamin, dan gula 5% (Khismatullina 2005)
Tabel 2 Aktivitas biologis komponen propolis
(Bankova et al. 2000)
Pemacu Pertumbuhan
Pemacu pertumbuhan (growth promoter) adalah zat aditif yang ditambahkan ke dalam pakan ternak untuk mempercepat pertumbuhan dan meningkatkan produktivitas (Sutisna 2008). Zat-zat yang biasa digunakan sebagai pemacu pertumbuhan adalah antibiotika, hormon, dan acidifier. Menurut
National Office of Animal Health (NAOH 2001 dalam Tukan 2008), antibiotic growth Promoter (AGP) meningkatkan efisiensi pencernaan makanan pada hewan sehingga pertumbuhannya cepat dan kondisi tubuhnya sehat. Antibiotic growth promotor adalah antibiotika yang berfungsi sebagai pemacu pertumbuhan. Dosis antibiotika sebagai pemacu pertumbuhan, yaitu subteurapetik (di bawah dosis pengobatan). Sifat pemberian pemacu pertumbuhan lebih bersifat suplemen.
Selain bahan-bahan tersebut terdapat bahan-bahan lain seperti obat herbal, imunomodulator, probiotik dan prebiotik. Ketiga bahan tersebut memang memiliki fungsi yang mirip dengan (antibiotika dan hormon) tetapi memiliki cara kerja yang berbeda, yaitu melalui penyehatan saluran pencernaan atau penguatan sistem kekebalan tubuh yang bertujuan meningkatkan kesehatan sehingga mampu mempercepat
No Jenis aktivitas Senyawa
1 Antibakteri Prenylated
p-coumaric acids Lignans Diterpenic
acids
2 Sitotoksik Flavonoid
Prenylated p-coumaric acids Lignans Diterpenic acids
3 imunomodulasi Caffeoulquini
c acids
4 antihepatotoksik Caffeoulquini
pertumbuhan dan meningkatkan produktivitas hewan ternak.
Masyarakat telah lama mengenal dan menerapkan antibiotika sebagai pemacu pertumbuhan pada ternak. Akan tetapi, penggunaan antibiotika dinilai banyak memiliki kekurangan. Salah satu yang penting adalah penggunaan antibiotika pada pakan hewan sebagai pemacu pertumbuhan telah mengakibatkan pertumbuhan bakteri yang resisten terhadap antibiotika yang umum digunakan untuk terapi infeksi pada manusia (Naim 2003; Ulfah 2007).
Mekanisme resistensi pada bakteri meliputi mutasi, penghambatan aktivitas antibiotika secara enzimatik, perubahan protein yang merupakan target antibiotika, perubahan jalur metabolik, efluks antibiotika, perubahan pada saluran porin, dan perubahan permeabilitas membran (Naim 2003). Ada beberapa syarat antibiotika sebagai pemacu pertumbuhan antara lain 1) antibiotika yang digunakan harus aman buat manusia, hewan dan lingkungan, 2) antibiotika memiliki keampuhan yang tinggi, 3) antibiotika bermutu bagus, 4) antibiotika yang digunakan pada ternak adalah yang tidak digunakan pada manusia, khususnya untuk mencegah resistensi bakteri pada manusia, 5) sifat antibiotika harus tidak diserap oleh usus, 6) dosis penggunaannya sangat kecil antara 1 dan 2 ppm atau 1-2 kg per ton pakan, 7) sifat antibiotika harus mudah terdegradasi (Sutisna 2008). Oleh sebab itu, hanya beberapa jenis antibiotika saja yang boleh digunakan sebagai pemacu pertumbuhan dari sekian banyak antibiotika, sebagai contoh basitrasin, dan virginiamisin.
Obat-obatan herbal, probiotik, dan imunomodulator mempunyai cara kerja yang berbeda dengan antibiotika. Obat herbal menurut Sutisna (2008) seperti kunyit, jahe, temulawak dapat memberi khasiat secara empiris sebagai peningkat nafsu makan pada ternak. Hal ini diperkuat dengan pernyataan dari (Kandou 2008 dalam Sutisna 2008) bahwa produk herbal dari ekstrak Curcuma domestica (kunyit), Curcuma xanthorrhizae
(temulawak) berdasarkan penelitian tim riset independen memang memiliki keunggulan mampu memperbaiki pencernaan ayam, mencegah defisiensi vitamin, membentuk jaringan tubuh yang sehat, dan menjaga daya tahan tubuh ayam tetap tinggi. Imunomodulator dapat berfungsi meningkatkan kekebalan hewan ternak sedangkan probiotik berfungsi menyeleksi
pertumbuhan bakteri yang baik dalam saluran pencernaan (Sutisna 2008).
Rumen Sapi
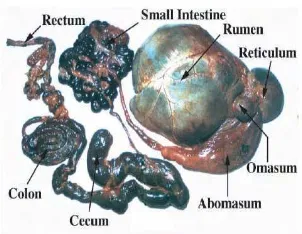
Rumen sapi adalah kompartemen terbesar dari penyusun perut sapi. Rumen mengandung miliaran bakteri, protozoa, dan fungi. Mikroorganisme tersebut bersimbiosis dengan sapi. Rumen sapi menyediakan substrat penting untuk mikrob sedangkan mikrob membantu sapi dalam mencerna makanannya (Caert 2006). Hal ini menjadi alasan yang membuat sapi dapat makan makanan dalam jumlah besar. Jalur pencernaan hewan ruminansia dapat dilihat pada Gambar 3.
Hungate (1966) menyebutkan bahwa terdapat beberapa cara pengambilan cairan rumen antara lain (1) pengambilan langsung dari tempat penjagalan, (2) menggunakan tabung perut, dan (3) melalui fistula. Ketiga metode tersebut memiliki kelebihan dan kekurangan masing-masing. Metode pengambilan langsung dari tempat penjagalan dilakukan apabila kita ingin melihat aktivitas rumen. Kekurangan metode ini adalah tercampurnya mikrob dengan pakan, kondisi aerobik, kontaminan dari luar, dan perubahan suhu rumen sampai 20-23°C. Pengambilan rumen memakai tabung perut digunakan untuk diagnosis. Pengambilan melalui fistula dilakukan dengan melubangi bagian perut hewan ruminansia.
Mikrob rumen membantu dalam pencernaan. Bakteri, protozoa dan fungi mengubah nutrien pakan secara fermentatif menjadi senyawa lain yang berbeda dari molekul asalnya, misalnya protein dirombak menjadi amoniak, karbohidrat diubah menjadi asam lemak terbang, CO2, dan gas metana.
Gas metana dan CO2 merupakan komposisi
gas terbesar hasil fermentasi mikrob di dalam rumen sapi (Dehority 2003). Volatile Fatty Acids (VFA) yang paling banyak dihasilkan adalah asam asetat, diikuti oleh asam propionat, butirat, dan valerat (Hungate 1966). Nilai pH rumen merupakan salah satu faktor yang sangat penting dalam mempengaruhi lingkungan rumen sapi. Nilai pH rumen sangat mempengaruhi fermentasi mikrobial. Kisaran nilai pH normal rumen sapi, yaitu antara 5.5 sampai 7.0 dengan suhu normal antara 38-40°C pada pakan normal (Dehority 2003). Nilai pH rumen sangat dipengaruhi oleh kandungan serat pakan yang diberikan dan kandungan pengeluaran saliva
(Rychlik & Russell 2001). Kelenjar saliva
fermentasi mikrob. Saliva ruminansia banyak mengandung anion bikarbonat dan fosfat dengan nilai pH 8 atau lebih. Saliva akan menetralkan pH ketika produk asam hasil fermentasi dihasilkan. Produksi saliva lebih besar saat hewan makan daripada tidak makan (Dehority 2003). Produksi saliva per hari yang dihasilkan tergantung pada tipe hewan ruminansia dan jumlah pakan, misalkan pada kambing sekitar 5-15 L dan 75-190 L untuk sapi (Hungate 1966).
Proses pencernaan makanan pada rumen merupakan proses kombinasi antara motoris dan biologis. Beberapa istilah penting dalam pencernaan yang terjadi di dalam sapi, yaitu ingesi, ruminansi, dan eruktasi. Ingesi adalah teknik mengunyah awal makanan yang dilakukan di mulut dan biasanya hanya untuk mencampurkan makanan dengan saliva. Ruminansi adalah teknik mengunyah dan menelan kembali makanan. Teknik ruminansi dapat membantu fermentasi oleh mikrob dengan mengurangi partikel pakan (luas permukaan semakin besar) sehingga meningkatkan kontak pakan dengan mikrob, menambah kandungan saliva, dan meningkatkan laju pencampuran (Al-Bagdadi 2008). Ruminansi adalah proses pencernaan yang di awali dari mulut, retikulum, mulut, rumen, omasum, abomasum, usus halus, usus besar, dan rektum. Eruktasi adalah teknik mengeluarkan gas hasil fermentasi mikrob seperti CO2 dan metana (Hungate 1966).
Gangguan dalam eruktasi dapat menyebabkan perut yang membesar pada sapi akibat berkumpulnya gas yang tidak bisa dikeluarkan.
Rumen dalam mencerna makanan melakukan kontraksi 2 sampai 3 kali tiap menit. Proses ruminansi terjadi 8-12 jam setiap hari dan selama proses ruminansi tersebut dilepaskan gas 30-50 L tiap jam (Dana 2008). Menurut Dehority (2003) dalam 24 jam, hewan ruminansia menghabiskan 6 jam makan, 9 jam ruminansi, dan 9 jam bermalas-malasan. Ada beberapa alasan mengapa hewan ruminansia melakukan proses ruminansi, yaitu menghindari predator, menyediakan oksigen, meningkatkan laju pemasukan makanan ke dalam omasum, dan mengurangi ukuran partikel pakan yang diasup. Proses fermentasi juga terjadi di dalam rumen sapi. Sistem fermentasi yang terletak di dalam rumen mempunyai beberapa keuntungan, yaitu bakteri dalam rumen dapat menggunakan senyawa nitrogen bukan protein menjadi protein tubuhnya yang akhirnya dapat tersedia bagi induk semang (Dehority 2003).
Gambar 3 Jalur pencernaan ruminansia.
Mikrob Rumen Sapi
Mikrob rumen dapat dibagi dalam tiga grup utama, yaitu bakteri, protozoa, dan fungi. Kehadiran fungi di dalam rumen diakui sangat bermanfaat bagi pencernaan pakan serat karena fungi dapat membentuk koloni pada jaringan selulosa pakan. Rhizoid fungi tumbuh jauh menembus dinding sel tanaman sehingga pakan lebih terbuka untuk dicerna oleh enzim bakteri rumen. Berbeda dengan mikrob usus sapi, mikrob rumen bermanfaat karena dapat menghasilkan asam lemak terbang yang dapat dipakai sebagai sumber energi (Hungate 1966). Bakteri tidak patogen banyak berada di dalam saluran pencernaan sapi dan membantu proses pencernaan. Bakteri-bakteri rumen dapat digolongkan menjadi bakteri selulolitik, proteolitik, lipolitik, dan bakteri probiotik (Hungate 1966).
Jumlah bakteri di dalam rumen sapi sekitar >1010 sel bakteri per gram (Russell & Rychlik 2001). Bakteri rumen dapat diklasifikasikan berdasarkan substrat utama yang digunakan, karena sulit mengklasifikasikan berdasarkan morfologinya. Kebalikannya klasifikasi protozoa didasarkan pada morfologinya sebab mudah dilihat berdasarkan penyebaran silianya. Beberapa jenis bakteri yang ada adalah (a) bakteri pencerna selulosa (Bakteroidessuccinogenes, Ruminococcus flavafaciens, Ruminococcus albus,
Butyrifibriofibrisolvens), (b) bakteri pencerna hemiselulosa (Butyrivibrio fibrisolvens,
Bakteroides ruminocola, Ruminococcus sp.), (c) bakteri pencerna pati (Bakteroides acmylophilus, Streptococcus bovis,
Succinnimonas amylolytica), (d) bakteri pencerna gula (Triponema bryantii,
Lactobasilus ruminus), dan (e) bakteri pencerna protein (Clostridium sporogenus,
Kapsul
Kapsul adalah bentuk padat sediaan obat berbahan lembam yang dilapisi oleh gelatin. Pelindung kapsul dari gelatin dapat bersifat keras dan lembut tergantung komposisinya. Pelindung kapsul gelatin kosong terdiri atas gelatin, gula, air, dan pewarna. Kapsul digunakan untuk melindungi zat atau senyawa aktif yang ingin dimasukkan ke dalam tubuh makhluk hidup. Ukuran kapsul bermacam-macam tergantung pada dosis yang akan dimasukkan dan densitasnya. Ukuran kapsul yang sudah banyak dikenal, yaitu 000, 00, 0, 1, 2, 3, 4, dan 5. Ukuran tersebut berturut-turut dari yang terbesar 000 dan terkecil 5 (Ansel 1989).
Kapsul gelatin keras biasa digunakan untuk kebutuhan media dan klinis. Biasanya, kapsul gelatin keras mengandung 13-16% campuran bahan. Pelindung kapsul gelatin keras terdiri atas 2 bagian, yaitu badan kapsul dan tutup kapsul. Contoh kapsul gelatin keras yaitu kapsul tetrasiklin. Kapsul gelatin lunak dibuat dari gelatin, gliserin, sorbitol, dan air. Keuntungan kapsul gelatin lunak dibandingkan dengan kapsul gelatin keras adalah dapat digunakan dalam bidang farmasi dan mudah ditelan. Komponen penyusun kapsul gelatin lunak, yaitu gelatin, gliserin, air atau bahan pelembab, bahan pengawet, pewarna, penanda, perasa, dan pemanis (5% sukrosa).
Mikrokapsulasi
Mikrokapsulasi adalah suatu cara penggunaan matriks penyalut yang relatif tipis pada partikel-pertikel zat padat atau tetesan cairan dan dispersi. Ukuran partikel yang dimikrokapsulasi dari puluhan mikron sampai 5000 mikron (Lachman 1994). Mikrokapsulasi juga merupakan suatu teknik untuk menyalut suatu senyawa (dapat berupa padatan, cairan, dan gas) dengan suatu polimer penyalut yang berukuran sangat kecil (mikron) (Yoshizawa 2004). Keuntungan mikrokapsulasi adalah melindungi suatu senyawa dari penguraian dan mengendalikan pelepasan suatu senyawa aktif sehingga mampu mencegah peningkatan konsentrasi obat dalam saluran pencernaan secara mendadak (Babstov et al. 2002). Beberapa komponen penting dalam mikrokapsulasi, yaitu bahan inti dan penyalut.
Bahan inti atau core (Yoshizawa 2004) adalah bahan spesifik yang akan disalut dapat berupa cairan dan padatan (Lachman 1994). Penyalut adalah bahan yang menyalut bahan inti. Polimer yang dapat digunakan sebagai
penyalut dalam mikrokapsulasi contohnya adalah etilselulosa (Sutriyo 2004), alginat (Rosalita 2008), kitosan, PLA (poli asam laktat) (Robbani 2004 dalam Prihatiningsih 2008), pektin, gelatin (Rahmawati 2000), CMC-kitosan (Yundhana 2008), dan maltodekstrin (Anwar 2004 & Pratiwi 2005 ). Syarat polimer yang digunakan dalam mikrokapsulasi, yaitu biodegradable (mudah terurai), biocompatible (dapat diterima), tidak toksik, murah, dan stabil dalam bentuk tunggal dan dalam larutannya (Lachman 1994). Bahan lain selain penyalut yaitu perekat, pelincir, perekat, dan pewarna. Bahan pelincir yang digunakan dalam penelitian adalah magnesium stearat. Magnesium stearat digunakan untuk memudahkan mengalirnya bahan obat keluar dari matriks dan memudahkan dalam pencetakan bentuk tablet. Menurut Lachman (1994) metode mikrokapsulasi yang dapat dilakukan dalam bidang farmasi antara lain suspensi udara, pemisahan fase koaservasi (melalui pencampuran melalui tiga tahap reaksi), pengeringan semprot dan pembekuan, penyalutan di dalam panci, serta teknik penguapan pelarut. Penelitian menggunakan proses penguapan pelarut melalui teknik
vaccum drying. Ukuran partikel yang dihasilkan dan bahan inti yang digunakan dalam mikrokapsulasi dapat dilihat pada Tabel 3.
Tabel 3 Proses mikrokapsulasi dan ukuran partikel yang dihasilkan
Proses mikrokapsulasi Bahan inti Ukuran partikel Suspensi udara Padat 35-5000 Pemisahan fase koaservasi Padat dan cair 2-5000 Sentrifugal lubang ganda Padat dan cair 1-5000 Penyalutan di dalam panci
Padat 600-5000
Escherichia coli
Escherichia coli adalah penghuni normal saluran pencernaan manusia dan hewan berdarah panas (Fardiaz 1983; Pelczar & Chan 1988). Bakteri ini biasanya bersifat tidak patogen tetapi dapat menyebabkan infeksi. E. coli merupakan bakteri Gram negatif bersifat anaerob fakultatif dan tidak dapat membentuk spora. Bakteri ini dapat hidup pada berbagai substrat dengan melakukan fermentasi anaerobik menghasilkan asam laktat, suksinat, asetat, etanol, dan karbondioksida (Anonim 2008). E. coli termasuk famili
Enterobacteriaceae, bentuknya batang atau koma, terdapat tunggal atau berpasangan dalam rantai pendek (Fardiaz 1983; Pelczar & Chan 1988). E. coli juga bersifat nonmotil dan hidup secara anaerob fakultatif (Holt et al. 1994 dalam Anggraini 2006).
E. coli yang terdapat pada usus sapi terdiri atas lima kelas, yaitu enterotoxigenicE. coli (ETEC), enteroinvasive E. coli (EIEC),
enterohemorrhagic E. coli (EHEC),
enteropathogenic E. coli (EPEC), and
enteroaggregative E. coli (EAEC) (Anonim 2008). Jenis E. coli yang menghasilkan toksin stabil dan labil (ST dan LT) adalah ETEC. Salah satu contoh ETEC adalah E. coli K-99 dan K-88. Senyawa toksin yang dihasillkan dapat mengakibatkan cairan tubuh dipompa dengan hebat ke dalam usus sehingga dapat menyebabkan kematian tanpa diare terlebih dahulu. Berbeda dengan ETEC, EIEC tidak menghasilkan ST dan LT. EIEC bersifat patogen karena dapat menghancurkan jaringan usus besar dan menyebabkan demam. EIEC lebih ditemukan menginfeksi manusia. Jenis yang ketiga adalah EPEC, yang merupakan penyebab diare berdarah di beberapa negara contohnya di Meksiko dan Afrika Selatan. Diare oleh EPEC disebabkan serangan bakteri pada sel inang usus yang mempengaruhi tranduksi sinyal sel (Anonim 2008).
Jenis E. coli mempunyai kemampuan menyerang jaringan usus dan biasa menyebabkan diare pada anak-anak adalah. EAEC, yang memproduksi toksin EAST (EnteroAggregative ST). Jenis E. coli penyebab utama diare berdarah (hemorrhagic colitis) yaitu EHEC. Hemorrhagic colitis
lebih sering menyerang anak kecil dan orang tua. Penyakit ini dicirikan dengan kram perut yang parah dan diare yang pada awalnya berair tetapi kemudian mengandung banyak darah. Kadang-kadang penderita penyakit ini juga muntah-muntah. Dapat terjadi demam ringan atau tidak ada demam sama sekali. Penyakit ini biasanya sembuh sendiri dan
berlangsung selama rata-rata 8 hari (Anonim 2008). Beberapa orang hanya mengalami diare berair. Efek fatal dari EHEC adalah
hemolytic uremic syndrome (HUS). Salah satu contoh bakteri jenis EHEC adalah O157:H7. EHEC juga memproduksi shiga toksin tetapi tidak memproduksi LT dan ST (Anonim 2008).
BAHAN DAN METODE
Alat dan Bahan
Alat-alat yang digunakan adalah autoklaf, oven, wisebath, shaker, rotavapor, spektrofotometer UV, laminar air flow cabinet, cawan petri, jarum ose, beberapa alat gelas, jangka sorong, mikropipet, inkubator, sarung tangan karet, neraca analitik, kain kasa, dan kertas saring.
Bahan-bahan yang digunakan adalah sarang lebah Trigona spp. asal Pandeglang, bakteri Escherichia coli, NA (Nutrient Agar) dan NB (Nutrient Broth), TSA (Trypton Soy Agar) dan TSB (Trypton Soy Broth), EMB (Eosyn Methylene Blue), etanol 70%, cairan rumen sapi, akuades, kapsul dengan ukuran (00, 1), maltodektsrin, dan magnesium stearat.
Metode Penelitian
Ekstraksi Propolis Trigona spp.
Propolis Trigona spp. diekstraksi menggunakan metode Harbone (1987) dan Matienzo dan Lamorena (2004). Metode ekstraksi yang digunakan adalah maserasi dengan pelarut etanol 70%. Sebanyak kira-kira 150 gram sarang lebah madu Trigona
spp. direndam dengan 500 mL etanol 70% pada gelas piala 1 L. Suspensi tersebut ditutup dan dikocok di ruang gelap selama satu minggu. Setelah satu minggu, suspensi tersebut disaring, filtratnya diambil, dan residunya dimaserasi kembali setiap hari dengan volume etanol 70% yang ditambahkan 50 mL sampai filtrat yang didapatkan jernih.
Seluruh filtrat yang terkumpul kemudian dipekatkan dengan rotavapor pada suhu 40°C. Ekstrak pekat yang diperoleh kemudian ditimbang untuk mendapatkan nilai rendemennya. Selanjutnya, ekstrak pekat propolis disimpan dalam botol gelap pada suhu ruang.
Pengambilan Rumen Sapi
Pengambilan cairan rumen dilakukan secara aerobik menggunakan kain kasa. Cairan rumen ditempatkan di wadah bersih. Cairan rumen yang diambil sekitar 1.5-2 L.
Mikrokapsulasi Propolis
Mikrokapsulasi propolis dilakukan dengan membuat dua konsentrasi mikrokapsul propolis, yaitu 2% dan 4%. Formulasi yang digunakan dapat dilihat pada Lampiran 4. Diagram alir mikrokapsulasi propolis dapat dilihat pada Lampiran 5. Pembuatan mikrokapsul 2% dilakukan dengan mencampurkan 93 gram maltodekstrin dengan akuades dengan perbandingan 1: 1 (campuran A). Selanjutnya sebanyak dua gram ekstrak pekat propolis dicampurkan dengan propilen glikol dengan perbandingan 1:1 (campuran B). Kemudian, kedua campuran A dan B dicampurkan sampai larut. Setelah larut, campuran tersebut dikeringkan melalui proses vaccum drying di PAU IPB selama tiga jam dengan suhu 40-50°C dan kecepatan pengadukan 120 rpm.
Pengisian Hasil Mikrokapsulasi ke dalam Kapsul Ukuran 00 dan 1
Hasil mikrokapsulasi propolis ditimbang sesuai takaran masing-masing ukuran kapsul. Untuk kapsul 00, hasil mikrokapsul yang ditimbang sekitar 390 mg dan 270 mg untuk kapsul 1 (Ansel 1989) masing-masing untuk konsentrasi mikrokapsul 2 dan 4%.
Pengisian kapsul dilakukan secara manual. Sarung tangan karet dipakai ketika memasukkan serbuk mikrokapsul propolis ke kapsul gelatin keras. Setiap serbuk mikrokapsul yang dimasukkan harus ditekan-tekan sampai memenuhi keseluruhan isi kapsul. Kemudian, kapsul yang telah diisi mikrokapsul ditempatkan ke dalam wadah plastik tertutup.
Regenerasi Bakteri Escherichia coli. Bakteri E. coli dari kultur primer mula-mula dibiakkan ke dalam TSA slant 4%. Sebanyak satu ose bakteri digoreskan ke dalam TSA slant lalu diinkubasi pada suhu 37ºC selama 24 jam. Selanjutnya, biakan ini menjadi stok awal bakteri yang disimpan pada suhu 4-5ºC. Bakteri E. coli yang akan digunakan pada uji aktivitas, diinokulasikan kembali pada TSB 4% sebanyak dua ose lalu diinkubasi pada suhu 37 ºC selama 24 jam.
Uji Pendahuluan Aktivitas Antibakteri.
Uji pendahuluan dilakukan dengan metode difusi sumur. Sebanyak satu ose
bakteri E. coli dari stok biakan diambil lalu diinkubasi di dalam 10 ml media NB kemudian diinkubasi shaker pada suhu 24 jam pada suhu 37 ºC. Setelah itu, dari biakan diambil sejumlah bakteri yang disebarkan di dalam cawan petri, lalu dituangkan 20 mL media NA bersuhu 45 ºC, kemudian cawan digoyangkan agar bakteri tersebar rata. Selanjutnya didiamkan pada suhu kamar sampai media agar memadat. Setelah media padat, agar dilubangi dengan diameter 5 mm. Ke dalam lubang tersebut dimasukkan ekstrak propolis Trigona spp. Sebanyak 50 µL lalu kultur diinkubasi pada suhu 37 ºC selama 24 jam.
Zona bening yang terlihat disekeliling lubang, menandakan adanya aktivitas antibakteri pada sampel. Volume bakteri yang diambil berdasarkan hasil absorbannya. Jika nilai absorban kurang dari satu, maka diambil 100 µL, sedangkan jika nilai absorban lebih satu, maka diambil 50 µL (Hadioetomo 1990).
Uji Ketahanan Mikrokapsul Propolis Trigona spp.
Bentuk sediaan kapsul propolis yang digunakan, yaitu 00 dan 1. Sediaan kapsul propolis tersebut direaksikan dengan cairan rumen sapi. Langkah pertama, berbagai bentuk sediaan kapsul propolis dimasukkan ke dalam keranjang kapsul Labu Erlenmeyer 125 mL yang telah disi dengan cairan rumen sapi kemudian bagian atas Labu Erlenmeyer ditutup sumbat kapas. Tahap kedua adalah semua labu Labu Erlenmeyer yang telah diisikan berbagai bentuk sediaan kapsul propolis kemudian dikocok dan dikondisikan pada suhu 37ºC dan 120 rpm. Tahap terakhir adalah dilakukan pengamatan pecah atau tidaknya sediaan kapsul propolis tiap 3 jam sekali, yaitu 0, 3, 6, 9, 12, dan 24 jam.
Uji Residu Aktivitas Antibakteri Mikrokapsul Propolis dalam Kapsul
Uji aktivitas antibakteri menggunakan metode difusi sumur melalui pengukuran zona bening. Kontrol positif yang dipakai adalah kapsul ampisilin 500 mg. Kontrol negatif yang dipakai adalah akuades. Pembanding yang dipakai, yaitu propolis merk-X. Kontrol pelarut yang dipakai adalah etanol 70% dan propilen glikol.
Berbagai bentuk mikrokapsul propolis
ekstrak propolis Trigona spp. dimasukkan ke dalam lubang. Media yang digunakan adalah
eosin methylene blue, yang sudah diinokulasikan dengan bakteri E. coli Setelah semua residu ekstrak propolis Trigona spp. dimasukkan ke dalam lubang, semua cawan petri diinkubasi pada suhu 37ºC selama 24 jam. Aktivitas antibakteri dari ekstrak propolis dari Trigona spp. diperoleh dengan mengukur zona bening disekeliling lubang sampel dengan jangka sorong.
Analisis Statistik
Rancangan percobaan yang digunakan dalam percobaan adalah rancangan percobaan acak lengkap dua faktor. Berikut ini merupakan model rancangannya (Mattjik dan Sumertajaya 2002).
Yijk = µ + αi+ βj+ αβij + ijk
Yijk = Pengamatan perlakuan ke-i, perlakuan ke-j, dan ulangan ke-k
αi = Pengaruh konsentrasi (%)
βj = Pengaruh waktu kontak (jam)
αβi j= Pengaruh acak pada perlakuan ke-i,
ke-j, dan ulangan ke-k
ijk = Galat perlakuan
Rancangan percobaan ini digunakan pada pengukuran zona bening ekstrak propolis terhadap bakteri Escherichia coli. Data yang diperoleh akan dianalisis dengan ANOVA (Analysis of variance) pada selang kepercayaan 95% dan taraf 0.05. Uji Duncan dilakukan juka hasil penelitian berbeda nyata. Seluruh data dianalisis dengan menggunakan program SAS 9.1.
HASIL DAN PEMBAHASAN
Rendemen Ekstrak Propolis
Maserasi adalah metode yang digunakan untuk mengekstrak propolis. Propolis diekstrak dari sarang lebah Trigona spp. asal Pandeglang, Jawa Barat. Maserasi merupakan teknik ekstraksi yang dilakukan untuk bahan yang tidak tahan panas. Pemanasan pada suhu tinggi akan merusak komponen aktif di dalam propolis seperti flavonoid yang berfungsi sebagai agen antimikrob.
Pelarut yang digunakan dalam ekstraksi propolis adalah etanol 70%. Etanol 70% dapat digunakan untuk mengekstrak flavonoid (Harborne 1987). Flavonoid merupakan komponen aktif terbanyak dan terpenting di dalam propolis (Chinthapally 1993). Etanol merupakan golongan alkohol dengan jumlah atom karbon dua dan mempunyai nilai
kepolaran 0.68 (Moyler dalam Ashurst 1995). Keuntungan penggunaan etanol sebagai pelarut adalah mempunyai titik didih yang rendah sehingga lebih mudah menguap. Oleh karena itu, jumlah etanol yang tertinggal di dalam ekstrak propolis sangat sedikit. Krell (2004) menyatakan bahwa etanol 70% merupakan pelarut terbaik ekstraksi propolis untuk digunakan sebagai agen antibakteri dan fungisida.
Penggunaan etanol 70% dapat memperkecil jumlah lilin lebah yang ikut terekstrak. Lilin lebah merupakan suatu ester asam lemak dan alkohol dengan rantai karbon yang panjang (Fearnley 2005). Rantai karbon panjang membuat lilin lebah bersifat nonpolar dan tidak larut dalam pelarut polar seperti etanol 70%. Hasil ekstraksi menunjukkan nilai rendemen propolis yang didapatkan sebesar 8.81%.
Nilai kandungan ekstrak propolis asal Pandeglang yang didapatkan Anggraini (2006) sebesar 8.20%, Lasmayanty (2007) 8.52%, dan Tukan (2008) 25.8417%. Nilai kandungan propolis yang berbeda-beda bergantung pada jenis tumbuhan tempat lebah Trigona spp. mendapatkan bahan baku propolis, musim, dan lokasi geografi tempat pengambilan propolis (Bankova et al. 2007 dalam Fatoni 2008).
Ekstraksi oleh Bankova (1999) terhadap propolis asal Brazil dan Bulgaria dengan pelarut etanol 70% menghasilkan rendemen 58% dan 62%. Nilai yang jauh berbeda dengan ekstraksi penelitian ini disebabkan perbedaan iklim dan perlakuan awal terhadap sarang lebah. Penelitian ini tidak memotong sarang lebah madu Trigona spp. menjadi bagian yang kecil-kecil setelah dimasukkan ke dalam freezer seperti yang dilakukan Bankova (1999). Kestabilan propolis dan senyawa aktif yang terkandung menjadi alasan utama.
kekuningan, berbau gula aren, dan berasa pahit. Propolis dengan warna yang lebih gelap menghasilkan rendemen yang lebih tinggi dibandingkan dengan warna yang lebih muda (Woo 2004).
Ekstrak propolis Pandeglang yang diperoleh disimpan di dalam botol gelap pada suhu tidak kurang dari 10-12 °C, dan dihindari dari pemanasan langsung karena akan merusak komponen aktif propolis (Krell 2004).
Mikrokapsulasi Propolis
Mikrokapsulasi adalah metode yang digunakan untuk mengubah pasta ekstrak propolis menjadi bentuk padat. Tujuan mikrokapsulasi propolis adalah melindungi senyawa aktif propolis dari cairan rumen sapi, dapat meningkatkan penyerapan pada usus sapi, dan menghindari iritasi saluran pencernaan akibat pelepasan obat yang tak terkendali (Babstov 2002). Pelepasan komponen aktif propolis dirumen sapi dihindari karena dapat menghambat pertumbuhan mikrob penghasil asam lemak terbang. Asam lemak terbang dapat digunakan menjadi sumber energi. Salah satu asam lemak terbang, yaitu asam propionat. Asam propionat dapat dipakai sebagai sumber energi melalui pengubahannya menjadi glukosa melalui proses glukoneogenesis. Jalur masuk yang digunakan melalui suksinil-KoA. Mikrokapsul propolis asal Pandeglang dibuat dengan melarutkan dua campuran A dan B. Campuran A (maltodekstrin dan akuades) sedangkan campuran B (ekstrak propolis dan Propilen glikol).
Bahan penyalut yang digunakan adalah maltodekstrin. Maltodekstrin adalah suatu produk hidrolisis pati yang mengandung -D-glukosa unit yang sebagian besar terikat 1,4-glikosidik dengan nilai DE (dextrose equivalent) kurang dari 20 (Kennedy 1995 et al. dalam Simanjuntak 2007), DE adalah perbandingan dekstrosa total dengan jumlah total bahan kering. Alasan pemilihan maltodekstrin sebagai bahan penyalut adalah larut dalam air, murah, tidak mempunyai sifat lipofilik, tidak higroskopis, mempunyai daya rekat, dan dapat membentuk matriks hidrogel (Kennedy 1995 et al. dalam Simanjuntak 2007). Penggunaan akuades dalam campuran A adalah untuk melarutkan maltodekstrin. Maltodekstrin akan melindungi komponen aktif propolis dari cairan rumen sekaligus mencegah pelepasan propolis dari maltodekstrin ke dalam cairan rumen.Campuran B dibuat dengan melarutkan
propilen glikol dan ekstrak pekat propolis dengan perbandingan 1:1. Propilen glikol digunakan untuk melarutkan ekstrak pekat propolis Pandeglang sehingga dalam pencampuran dengan campuran A lebih mudah. Propilen glikol merupakan salah satu pelarut yang biasa digunakan untuk melarutkan propolis di dalam dunia farmasi dan kosmetik (Tosi et al. dalam Fatoni 2008).
Keseragaman pencampuran menjadi faktor penting dalam pembuatan mikrokapsul. Campuran yang belum melarut dengan sempurna akan menyebabkan ukuran mikrokapsul yang terbentuk tidak seragam dan menyebabkan bahan inti atau komponen aktif tidak tersalut sempurna oleh bahan penyalut. Pemanasan digunakan hanya untuk mempercepat kelarutan campuran A dan B. Suhu pemanasan tidak melebihi 50-60°C. Pemanasan yang terlalu tinggi akan merusak komponen aktif agen antimikrob propolis seperti flavonoid.
Setelah kedua campuran A dan B bercampur, tahap berikutnya adalah teknik pengeringan. Teknik pengeringan yang digunakan adalah vacuum drying
(pengeringan vakum). Alat yang dipakai dalam proses vacuum drying adalah vaccum pan evaporator yang terdapat di PAU IPB. Spesifikasi komponen alat yang dipakai, yaitu pemanas listrik 14.000 watt, pompa vakum 750 watt, kecepatan pengaduk 125 rpm, panjang rotor satu cm, diameter baling-baling 20 cm, suhu 40-50°C, dan tekanan vakum 72 cmHg. Alasan pemilihan teknik vacuum drying adalah teknik ini cocok untuk melindungi senyawa aktif propolis seperti flavonoid, yang berperan sebagai antimikrob. Hal ini dikarenakan suhu yang digunakan pada proses ini tidak akan merusak komponen aktif propolis.
mikrokapsulasi baik konsentrasi 2% maupun 4% dapat dilihat pada Gambar 4.
Metode yang digunakan dalam pembuatan mikrokapsul adalah penguapan pelarut (Lachman 1994). Teknik pengeringan yang dilakukan adalah teknik pengeringan vakum (vacuum drying). Pengeringan dilakukan untuk menghilangkan akuades dan propilen glikol yang terlarut. Prinsip teknik
vacuum drying adalah dengan menarik propilen glikol dan akuades keluar dari campuran menggunakan suhu sekitar 40°C. Mikrokapsul yang telah dimikrokapsul terdiri atas komponen aktif propolis sebagai bahan inti di dalam maltodekstrin sebagai bahan penyalut. Ukuran mikrokapsulasi propolis 4% diduga akan lebih besar daripada mikrokapsulasi propolis 2%. Semakin bertambah konsentrasi penyalut etilselulosa pada formulasi maka ukuran mikrokapsul yang dihasilkan akan semakin besar (Sutriyo 2004). Penelitian tidak menguji hasil
Scanning Electron Micrograph (SEM) formula mikrokapsulasi propolis dengan maltodekstrin.
Gambar 4 Hasil mikrokapsulasi propolis
Trigona spp. 2% (a) dan 4% (b).
Uji Ketahanan Mikrokapsulasi Propolis Trigona spp.
Uji ketahanan mikrokapsulasi propolis asal Pandeglang, Jawa Barat dilakukan secara
in vitro, yaitu pada kondisi rumen sapi dewasa asal Lampung. Pengambilan cairan rumen sapi dilakukan pada jam 03.00-05.00 WIB di Rumah Potong Hewan terpadu Bogor. Suhu cairan rumen segar yang terukur 34°C dan suhu cairan rumen 3 jam setelah pengambilan turun menjadi 26°C sedangkan nilai pH terukur berkisar 7-8 menggunakan indikator universal. Nilai pH dan suhu cairan rumen sapi sebagai media uji ketahanan sangat berpengaruh terhadap kelarutan hasil mikrokapsulasi propolis atau kapsulnya. Hasil penelitian Yundhana (2008) menyatakan bahwa pelepasan ketoprofen sebagai bahan aktif obat lebih besar pada pH asam daripada pH basa. Semakin tinggi suhu maka laju pelepasan propolis dari penyalut maltodekstrin akan semakin besar.
Uji ketahanan mikrokapsulasi propolis pada penelitian menggunakan alat uji ketahanan yang berbentuk keranjang. Desain alat ini merupakan alat disolusi tipe pertama. Penggunaan rumen menjadi alasan utama tidak dipakainya alat disolusi tipe pertama (keranjang) tersebut. Keranjang digunakan untuk menyanggah kapsul yang berisi komponen hasil mikrokapsulasi propolis Pandeglang. Desain keranjang uji dapat dilihat pada Lampiran 15. Media uji ketahanan yang digunakan adalah 100 mL cairan rumen sapi segar di dalam Labu Erlenmeyer 125 mL. Kondisi uji ketahanan diusahakan mendekati dengan kondisi di dalam rumen sapi hidup, yaitu dengan menggunakan wisebath pada suhu 37°C dan 120 rpm.
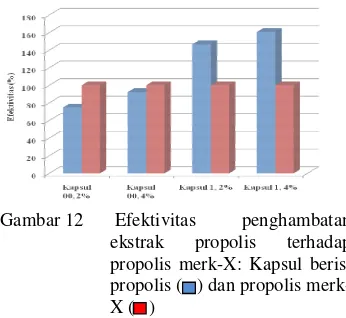
Sampel uji ketahanan terdiri atas dua macam konsentrasi mikrokapsulasi propolis Pandeglang, yaitu 2 dan 4%. Tiap-tiap ukuran kapsul diisikan dengan hasil mikrokapsulasi 2 dan 4% baik kapsul ukuran 00 maupun 1. Propolis merk-X digunakan sebagai pembanding. Kontrol yang digunakan, yaitu akuades, propilena glikol, etanol 70%, kapsul ampisilin, dan rumen normal. Akuades dipakai sebagai kontrol negatif, propilena glikol dan etanol 70% dipakai sebagai kontrol pelarut, ampisilin dipakai sebagai kontrol positif, dan propolis merk X dipakai sebagai pembanding. Alasan pemakaian kapsul ampisilin sebagai kontrol positif karena ampisilin mempunyai spektrum yang luas terhadap berbagai bakteri Gram positif dan negatif. Kontrol pelarut dipakai untuk mengetahui pengaruh pelarut dalam ekstrak pekat propolis.
Kapsul yang digunakan berasal dari PT Kapsulindo Nusantara berasal dari gelatin sapi. Kapsul yang digunakan dalam penelitian termasuk kapsul tipe B, yaitu kapsul yang berasal dari kulit dan tulang sapi. Penggunaan keranjang kapsul hanya pada sampel. Pengamatan dilakukan untuk melihat ketahanan hasil mikrokapsul dalam masing-masing ukuran kapsul. Parameter pertama yang diamati adalah waktu leburnya semua ukuran kapsul sedangkan parameter kedua pengukuran zona bening dilakukan dengan menggunakan metode difusi sumur. Pengamatan pada jam ke-0, semua kapsul baik kapsul 00 dan 1 belum melebur. Semua kapsul baru melebur pada jam ke-3. Hal ini ditandai dengan berubahnya warna cairan rumen akibat bercampur dengan pewarna kapsul yang ikut terurai. Warna cairan rumen yang telah bercampur dengan pewarna kapsul lebih gelap daripada rumen awal.
Ansel (1989) menyatakan bahwa kapsul gelatin dalam udara bersifat stabil akan tetapi mudah mengalami penguraian oleh mikrob dan apabila disimpan dalam larutan berair. Pecahnya kapsul gelatin diakibatkan masuknya air dari cairan rumen sehingga kapsul gelatin mengembang dan pada akhirnya pecah. Penyusun kapsul gelatin keras biasanya adalah gelatin yang terdiri atas kombinasi beberapa asam amino seperti glisin, prolin, dan hidroksiprolin (Poppe 1992 dalam Nurhasanah 2005). Kombinasi asam-asam amino tersebut dapat diuraikan oleh mikrob pendegradasi asam amino dan protein dalam rumen sapi sehingga gelatin penyusun kapsul akan hancur. Kestabilan gelatin juga sangat dipengaruhi oleh suhu, Rahmawati (2000) melaporkan bahwa gelatin dapat membentuk gel pada media berair suhu 30-45°C.
Residu Aktivitas Antibakteri Propolis Trigona spp.
Metode yang digunakan adalah metode difusi sumur. Pengukuran aktivitas antibakteri propolis dilakukan dengan mengukur zona bening yang dihasilkan. Media uji yang digunakan adalah media EMB. Media EMB adalah media spesifik yang digunakan untuk isolasi dan diferensiasi bakteri Enteric basilli
(Holt 2004). Komposisi media EMB, yaitu enzim pemecah gelatin, kalium fosfat, pewarna (eosin Y dan biru metilena), laktosa, sukrosa, dan agar. Gelatin digunakan sebagai sumber nitrogen. Bakteri Gram positif dihambat pada media EMB. Pada pH asam, bakteri yang dapat memfermentasi laktosa seperti E. coli mampu menghasilkan koloni berwarna hijau metalik, tetapi tidak semua strain E. coli. Koloni E. coli pada penelitian tidak terlihat hijau. Hal ini disebabkan tidak mampunya koloni E. coli pada penelitian ini memfermentasi laktosa menjadi produk asam organik. Eosin Y dan biru metilena hanya dapat membentuk kompleks pada nilai pH asam (Holt 2004).
Segera setelah kapsul melebur pada jam ke-3, mikrokapsul propolis Pandeglang terpapar dengan cairan rumen. Zona bening yang diukur merupakan parameter berdifusinya komponen aktif propolis melewati matriks penyalut maltodekstrin. Pelepasan propolis dari matriks maltodekstrin dikontrol oleh proses difusi propolis melalui matriks dan penyebaran propolis di dalam maltodekstrin. Propolis yang berada di permukaan maltodekstrin akan berdifusi
terlebih dahulu dibandingkan dengan propolis di rongga bagian dalam maltodekstrin.
Residu Aktivitas Antibakteri Propolis Ukuran Kapsul 00
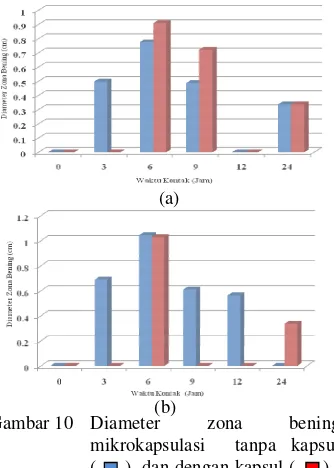
Bobot hasil mikrokapsul yang dimasukkan ke dalam kapsul 00 sekitar 390 mg. Hasil pengamatan zona bening kapsul ukuran 00. Zona bening mulai muncul pada jam ke-12 dan ke-24. Pada jam ke-0 sampai jam ke-9 zona bening tidak muncul. Hal ini dapat disebabkan komponen aktif masih berada di dalam matriks maltodekstrin. Kecepatan pelepasan yang relatif lambat dapat disebabkan ketidakseragaman penyebaran komponen propolis di dalam matriks maltodekstrin pada saat mikrokapsulasi propolis.
Komponen aktif propolis yang berada dekat dengan permukaan matriks akan berdifusi pertama kali (Sutriyo et al. 2004). Di duga pada jam ke-0 sampai ke-9, komponen aktif propolis tersebar di bagian dalam matriks maltodekstrin sehingga laju difusi keluarnya lambat. Penggunaan kapsul juga akan memperlambat laju pelepasan komponen aktif propolis Pandeglang pada jam-jam awal uji ketahanan terhadap rumen sapi.
Grafik (Gambar 5) memperlihatkan rerata semua perlakuan pada kapsul ukuran 00. Secara umum nilai rerata zona bening akan meningkat seiring dengan bertambahnya waktu kontak kecuali ampisilin. Nilai rerata zona bening tertinggi jam ke-12, yaitu pada sampel propolis merk-X. Nilai rerata zona bening tertinggi pada jam ke-24 terjadi pada sampel mikrokapsulasi 4% tanpa kapsul sebesar 1.155 cm. Nilai rerata zona bening mikrokapsulasi 4% tanpa kapsul 1.155 cm lebih tinggi daripada nilai rerata zona bening mikrokapsulasi 4% dengan kapsul sebesar 1.030 cm. Aktivitas antibakteri yang berbeda disebabkan adanya perlindungan kapsul gelatin keras terhadap komponen aktif propolis pada jam-jam awal perlakuan. Kecenderungan penurunan aktivitas antibakteri dari komponen aktif propolis seperti flavonoid untuk ukuran kapsul 00 (390 mg) tidak terjadi. Akan tetapi, apabila waktu kontak diperpanjang, diduga pada jam lebih tinggi dari jam ke-24 akan terjadi penurunan daya antibakteri komponen aktif propolis. Hal ini ditandai dengan menurunnya rerata zona bening yang dihasilkan. Hasil uji pengukuran zona bening dapat dilihat pada Lampiran 10.
waktu kontak pada cairan rumen sapi tidak mempengaruhi perubahan aktivitas antibakteri propolis. Hal ini dapat dilihat dari nilai P> 0.05 nilai P = 0.8776.
Gambar 5 Diameter zona bening semua perlakuan konsentrasi: mikrokapsulasi propolis dengan kapsul 2% ( ) dan 4% ( ), mikrokapsulasi propolis tanpa kapsul 2% ( ) dan 4% ( ), propolis merk-X ( ), dan kapsul ampisilin ( ).
Pengaruh Konsentrasi Mikrokapsul Propolis pada Kapsul Ukuran 00
Konsentrasi mikrokapsul propolis yang digunakan, yaitu 2% dan 4%. Rerata diameter zona bening untuk konsentrasi 2% mengalami kenaikan dari 0.3682 menjadi 0.7610 cm. begitupula dengan konsentrasi 4% naik dari 0.3387 menjadi 0.9390 cm (Gambar 6). Kenaikan nilai rerata diameter zona bening menandakan adanya aktivitas difusi komponen aktif propolis keluar dari matriks maltodekstrin yang akan semakin bertambah seiiring dengan bertambahnya waktu dan konsentrasi zat aktifnya. Hal ini mendukung penelitian Anggraini (2006) bahwa semakin besar konsentrasi propolis yang dipakai maka nilai diameter zona bening yang dihasilkan semakin besar (Pelczar & Chan 1988).
Konsentrasi propolis 2% dan 4% digunakan berdasarkan nilai konsentrasi hambat tumbuh minimum propolis terhadap bakteri patogen dan tidak patogen di usus sapi berturut-berturut 2.04% dan 5.90% (Fatoni 2008; Tukan 2008). Zona bening yang dihasilkan oleh mikrokapsul propolis 2% lebih sedikit dengan mikrokapsul propolis 4%. Akan tetapi, berdasarkan nilai statistik yang diperoleh, pengaruh konsentrasi tidak berbeda nyata atau tidak berpengaruh terhadap perubahan rerata diameter zona bening yang dihasilkan. Hal ini dapat dilihat dari nilai P = 0.726 (P>0.05). Interaksi antara faktor waktu perlakuan dengan konsentrasi mikrokapsulasi
[image:33.612.136.303.130.364.2]yang digunakan juga tidak berpengaruh terhadap zona bening yang digunakan P= 0.836.
Gambar 6 Diameter zona bening konsentrasi mikrokapsul propolis dengan kapsul: 2% ( ) dan 4% ( ) ukuran kapsul 00.
Pengaruh Kapsul Gelatin Keras pada Kapsul Ukuran 00
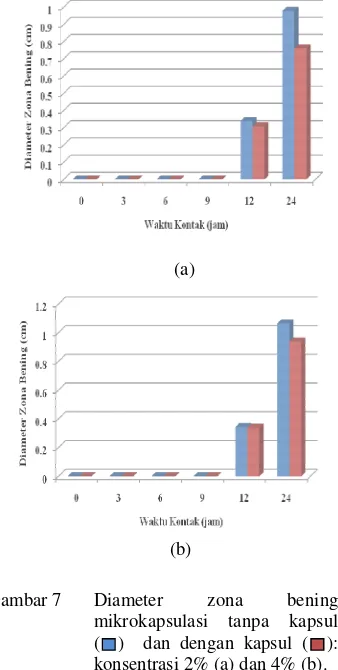
Ukuran kapsul gelatin keras yang dipakai adalah 00. Ukuran 00 lebih besar daripada ukuran kapsul 1. Kapasitas kapsul ukuran 00 adalah 390 mg. Dosis yang dimasukkan ke dalam kapsul 00 lebih banyak dengan kapsul 1. Nilai rerata zona bening yang dihasilkan semakin tinggi dengan bertambahnya waktu kontak. Akan tetapi, berdasarkan uji statistik interaksi antara faktor perlakuan waktu kontak dengan perlindungan kapsul tidak berbeda nyata P = 0.795. Nilai rerata diameter zona bening mikrokapsulasi 2% naik dari 0.3388 menjadi 0.9789 cm begitupula dengan mikrokapsulasi 2% dalam kapsul naik dari 0.3082 menjadi 0.7610 cm (Gambar 7).
Pelepasan komponen aktif propolis pada ukuran kapsul 00 diduga baru terjadi di jam ke-12, hal ini terlihat dari nilai rerata zona bening yang masih kecil. Kapsul berperan menghambat komponen aktif keluar lebih cepat. Hal ini dapat dilihat dari nilai rerata zona bening mikrokapsul 2% tanpa kapsul yang lebih tinggi pada jam ke-12 maupun jam ke-24. Pengaruh perlakuan kapsul pada mikrokapsul 2% tidak memberikan pengaruh yang nyata P = 0.690.
kapsul. Akan tetapi, berdasarkan nilai statistik yang diperoleh, pengaruh perlakuan kapsul tidak berbeda nyata atau tidak berpengaruh terhadap perubahan rerata diameter zona bening yang dihasilkan. Hal ini dapat dilihat dari nilai P = 0.859 (P>0.05). Interaksi faktor perlakuan pengkapsulan dan waktu kontak juga tidak berpengaruh terhadap perubahan daya aktivitas antibakteri propolis P = 0.873. Hal ini dipertegas dari uji ketahanan penelitian ini bahwa semua kapsul gelatin keras akan melebur pada jam ke-3.
Gambar 7 Diameter zona bening mikrokapsulasi tanpa kapsul ( ) dan dengan kapsul ( ): konsentrasi 2% (a) dan 4% (b).
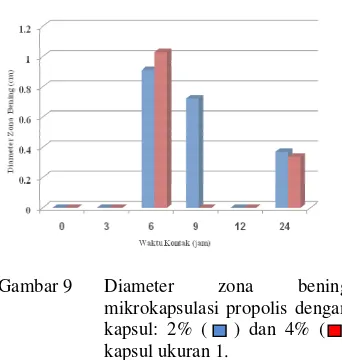
Residu Aktivitas Antibakteri Propolis Ukuran Kapsul 1
Kapasitas ukuran kapsul 1 227 mg. Pelepasan zona bening untuk semua perlakuan pada kapsul ukuran 1 terjadi mulai pada jam ke-3 sampai jam ke-24 (Gambar 8). Hasil pengamatan jam ke-3 pada kapsul ukuran 1 menunjukkan hanya mikrokapsulasi 2 dan 4% saja yang mempunyai zona bening, yaitu sebesar 4.99 cm dan 6.89 cm. Tidak munculnya zona bening pada kapsul 2% dan 4% diakibatkan pengaruh perlindungan dari
kapsul gelatin keras yang meminimalkan kontak mikrokapsulasi propolis dengan cairan pada jam-jam awal perlakuan. Propolis merk-X pada jam ke-3 pun tidak ada zona bening yang terbentuk. Hal ini disebabkan oleh adanya perlindungan dari kapsul gelatin lunak terhadap isi dari propolis merk-X.
Zona bening pada jam ke-6 untuk mikrokapsul propolis dengan kapsul konsentrasi 2% dan 4% berturut-turut 0.910 cm dan 0.103 cm. Hal ini menandakan mikrokapsul propolis konsentrasi 2% dan 4% yang berdifusi keluar semakin besar. Sehingga, nilai zona bening yang terbentuk semakin besar. Akan tetapi, hal ini sangat tergantung keseragaman cara pengambilan sampel dari Labu Erlenmeyer. Peningkatan diameter zona bening jam