POTENSI PEMANFAATAN ABOMASUM DOMBA LOKAL
UMUR DEWASA MUDA SEBAGAI PENGHASIL RENNET
SKRIPSI
ARIE BOWO YUDI KRISTIANTO
DEPARTEMEN ILMU PRODUKSI DAN TEKNOLOGI PETERNAKAN FAKULTAS PETERNAKAN
POTENSI PEMANFAATAN ABOMASUM DOMBA LOKAL
UMUR DEWASA MUDA SEBAGAI PENGHASIL RENNET
ARIE BOWO YUDI KRISTIANTO D14202049
Skripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Peternakan pada
Fakultas Peternakan Institut Pertanian Bogor
DEPARTEMEN ILMU PRODUKSI DAN TEKNOLOGI PETERNAKAN FAKULTAS PETERNAKAN
POTENSI PEMANFAATAN ABOMASUM DOMBA LOKAL
UMUR DEWASA MUDA SEBAGAI PENGHASIL RENNET
Oleh
ARIE BOWO YUDI KRISTIANTO D14202049
Skripsi ini telah disetujui dan disidangkan di hadapan Komisi Ujian Lisan pada tanggal 7 September 2006
Pembimbing Utama Pembimbing Anggota
Dr. Ir. Rarah R. A. Maheswari DEA Dr. drh. Chairun Nisa’ MSi. NIP 131 671 595 NIP 131 841 722
Mengetahui,
Dekan Fakultas Peternakan Institut Pertanian Bogor
RINGKASAN
A. B. Y. KRISTIANTO. D 14202049. 2006. Potensi Pemanfaatan Abomasum Domba Lokal Umur Dewasa Muda sebagai Penghasil Rennet. Skripsi. Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan, Institut Pertanian Bogor.
Pembimbing Utama : Dr. Ir. Rarah R. A. Maheswari DEA. Pembimbing Anggota : Dr. Drh. Chairun Nisa’ MSi.
Keju merupakan salah satu produk olahan susu yang mulai digemari masyarakat. Industri keju yang berkembang di Indonesia membutuhkan suplai koagulan rennet untuk memenuhi kuota produksinya. Rennet yang digunakan selama ini untuk memproduksi keju masih diimpor yang dapat berasal dari lambung sapi muda atau rennet microbial. Rennet impor asal sapi muda tersebut, disamping mahal, juga akan berdampak pada penurunan populasi hewan tersebut. Domba lokal dengan populasi yang relatif tinggi di Indonesia merupakan sumber potensial sebagai penghasil rennet. Kekerabatan yang dekat antara domba dengan sapi sebagai hewan ruminansia, diharapkan akan menghasilkan rennet yang juga memberikan kemampuan koagulasi serupa dengan rennet yang berasal dari sapi.
Penelitian yang bertujuan untuk mempelajari potensi abomasum domba lokal sebagai sumber penghasil rennet dilaksanakan selama lima bulan, dimulai pada bulan Juli hingga Oktober 2005. Abomasum yang digunakan pada penelitian ini merupakan abomasum domba lokal dewasa muda (6-12 bulan) yang diambil dari tempat pemotongan hewan. Rennet kasar yang diperoleh diuji kemampuan koagulasinya pada susu pasteurisasi yang didapatkan dari Bagian IPT Perah dan Rumah Sakit Hewan IPB. Rancangan percobaan yang digunakan dalam penelitian ini ialah rancangan acak lengkap faktorial serta rancangan acak lengkap searah yang diuji menggunakan analisa sidik ragam, kemudian diuji lanjut menggunakan Uji Duncan Multiple Range Test apabila hasil sidik ragam berbeda nyata. Perlakuan yang diujikan sebanyak 12 macam perlakuan berdasarkan pada asal rennet, bentuk dan konsentrasi ekstrak. Pelet fundus dan pilorus konsentrasi 1%, 2%, dan 3% menggunakan rancangan acak lengkap faktorial. Supernatan fundus dengan konsentrasi 1,5%, 2%, dan 2,5%, serta supernatan pilorus dengan konsentrasi 3%, 4%, dan 5% menggunakan rancangan acak lengkap searah, masing-masing perlakuan dilakukan tiga kali pengulangan. Hasil yang diperoleh menunjukkan bahwa rennet asal fundus maupun pilorus mampu menggumpalkan susu, khususnya rennet asal fundus memberikan pengaruh nyata terhadap waktu koagulasi susu, sedangkan rennet asal pilorus memberikan respon tidak berbeda nyata. Waktu koagulasi terbaik didapatkan dari ekstrak yang berasal dari jaringan fundus baik dalam bentuk pelet maupun supernatan, yaitu pada konsentrasi 2,5 % (waktu koagulasi 188,3 detik) untuk supernatan dan pada taraf 3% (waktu koagulasi 87,0 detik) untuk pelet. Abomasum domba lokal umur dewasa muda memiliki potensi untuk dijadikan sebagai sumber rennet, khususnya pada daerah yang menghasilkan rennet dengan aktifitas koagulasi terbaik.
ABSTRACT
The Potention of Mucose Membrane of Young Adult Lamb Abomasums as The Source of Rennet
Kristianto, Maheswari, and Nisa’
Cheese is one of milk product that people like to consume. At present, cheese industries in Indonesia maintain rennet supply by importing it from other country, so the price was expensive. Lamb as a small ruminant is a potential source of rennet. This research aim is to study the potential of mucose membrane from young adult lamb abomasums (age 6-12 month) as the source of animal rennet. This study was held at The Department of Anatomy Physiology and Pharmacology Faculty of Veterinary and Medicine IPB. Young adult lamb abomasums were taken from animal slaughtery house, and the milk which is used as a media, was collected from IPT Perah Laboratory and IPB Animal Hospital. The experimental design used in this research was factorial completely randomize resign and one way completely randomize design. The complete data were analyzed using ANOVA which was followed by Duncan Multiple Range Test, if the results show any significant value. This study was divided into twelve variances, each of them divided into several group based on the major mucose membrane area and the concentration. Pellet taken from fundic and pyloric region using factorial completely randomize experimental design; and the enzyme concentration was 1%, 2%, and 3%. The supernatant extract of fundic region was 1,5%, 2%, and 2,5%, and the supernatant extract from pyloric region was 3%, 4%, and 5%, both of supernatant using one way completely randomize experimental design. The results showed that crude enzyme from different region of abomasums gave different effect especially rennet taken from fundic region (P<0,05). The most significant value gave by crude enzyme from fundus tissue with 3% (87 second) concentration for the pellet and 2,5% (188,3 second) for the supernatant. Even tough the extract that had been taken from pyloric region gave no significant effect, but generally, abomasums from young adult lamb was potential as the resource of rennet.
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 12 Juni 1984 di Magetan Jawa Timur. Penulis adalah anak pertama dari dua bersaudara dari pasangan Bapak Lilik Suhanto dan Ibu Yudi Ekowati.
Pendidikan dasar penulis diselesaikan pada tahun 1996 di SDN Pengadilan 3 Bogor. Penulis selanjutnya menyelesaikan pendikan lanjutan tingkat pertama pada tahun 1999 di SLTPN 1 Bogor dan pendidikan lanjutan menengah umum pada tahun 2002 di SMUN 2 Bogor.
Penulis diterima sebagai mahasiswa IPB pada tahun 2002 melalui program Seleksi Penerimaan Mahasiswa Baru (SPMB). Penulis terdaftar sebagai mahasiswa program Studi Teknologi Hasil Ternak, Departemen Ilmu Produksi Ternak, Fakultas Peternakan, Institut Pertanian Bogor.
KATA PENGANTAR
Bismillahirrohmanirrahim.
Sesungguhnya dalam penciptaan langit dan bumi, dan silih bergantinya
malam dan siang terdapat tanda-tanda bagi orang-orang yang berakal, (yaitu)
orang-orang yang mengingat Allah sambil berdiri atau duduk atau dalam keadaan
berbaring dan mereka memikirkan tentang penciptaan langit dan bumi (seraya
berkata): “Ya Tuhan kami, tidaklah Engkau menciptakan ini dengan sia-sia. Maha
Suci Engkau, maka peliharalah kami dari siksa api neraka.”
QS. Ali ’Imran : 191-191 Segala puji dan syukur kepada sumber ilmu pengetahuan, Allah Subhanahu Wa Ta’ala. Raab yang menjadi sumber segala kebenaran dan kebaikan yang terindah, sumber segala pencahayaan dan kasih sayang pada umat-Nya.
Penyusunan skripsi ini dilatar belakangi pada mendesaknya kebutuhan pangan hewani yang murah dan berkualitas, khususnya keju serta terbatasnya ketersediaan rennet sebagai unsur penting dalam pengolahan keju. Secara khusus skripsi ini akan membahas mengenai proses ekstraksi enzim protease dari abomasum domba lokal serta aspek-aspek yang mempengaruhi koagulasi susu. Konsep-konsep pemikiran yang tertuang di dalam skripsi ini berusaha penulis sampaikan dalam bentuk yang sederhana dan mudah dipahami disertai dengan pemikiran empiris serta bukti-bukti ilmiah berdasarkan literatur terkait, dengan harapan skripsi ini dapat dengan mudah diambil intisarinya serta manfaatnya oleh pembaca yang berkepentingan.
Penulis menyadari dengan segala kerendahan hati bahwa skripsi ini masih jauh dari sempurna, karena hanya Allah-lah yang memiliki segala kesempurnaan. Semoga karya ilmiah ini dapat bermanfaat.
Bogor, Juli 2006
DAFTAR ISI
Halaman
RINGKASAN ………... i
ABSTRACT ………. ii
RIWAYAT HIDUP ……….. iii
KATA PENGANTAR ………. iv
DAFTAR ISI ……… v
DAFTAR TABEL ………... vii
DAFTAR GAMBAR ………... viii
DAFTAR LAMPIRAN ………... ix
PENDAHULUAN ………... 1
Latar Belakang ………. 1
Tujuan ……….. 1
TINJAUAN PUSTAKA ……….. 2
Lambung Ruminansia………..……….. 2
Daerah Kelenjar Kardia ……..……….. 3
Daerah Kelenjar Fundus ...………... 3
Daerah Kelenjar Pilorus ………. 4
Enzim Protease Lambung ……….…... 4
Ekstraksi Rennet ………... 5
Definisi dan Komposisi Susu……… 6
Protein Susu ……….. 7
Koagulasi Susu ...……… 8
METODE ……… 11
Lokasi dan Waktu ……… 11
Materi ……….. 11
Rancangan ………... 12
Peubah ……….. 12
Analisis Data……… 12
Prosedur ………….………... 13
Pembuatan Ekstrak dan Pengujian Aktivitas ...………. 13
Penelitian Pendahuluan .. ………. 14
Penelitian Utama ………... 15
HASIL DAN PEMBAHASAN ………... 16
Ekstraksi Enzim Khimosin ……….. 16 Pengaruh Perbedaan Konsentrasi Enzim
terhadap Waktu Koagulasi Susu...
Pengaruh Perbedaan Jaringan terhadap
Aktivitas Koagulasi Susu... 26
KESIMPULAN DAN SARAN ………... 32
Kesimpulan ………. 32
Saran ……… 32
UCAPAN TERIMAKASIH ……… 33
DAFTAR PUSTAKA ……….. 34
DAFTAR TABEL
Nomor Halaman
1. Komposisi Kimia Susu ……..………...………. 7 2. Perbandingan Berat dan Ukuran Rata-rata Daerah Kelenjar
Fundus dan Pilorus Abomasum Domba Lokal Umur
Dewasa Muda ... 16 3. Waktu Koagulasi Susu sebagai Respon Perbedaan Konsentrasi
Pellet yang Diberikan ... ... 19 4. Waktu Koagulasi Susu sebagai Respon Perbedaan Konsentrasi
Supernatan Fundus yang Diberikan ... 22 5. Waktu Koagulasi Susu sebagai Respon Perbedaan Konsentrasi
DAFTAR GAMBAR
Nomor Halaman
1. Lambung Ruminansia Berserta Bagian-Bagiannya ... 2
2. Struktur Tiga Dimensi Enzim Khimosin ... 5
3. Curd yang telah Menggumpal Sempurna... 8
4. Pemotongan Rantai k-Kasein oleh Enzim Khimosin ... 9
5. Alur Penelitian Pendahuluan ... 14
. 6. Alur Penelitian Utama ... 15
7. Hasil Kelupasan Mukosa Fundus (A) dan (B) Pilorus serta Pellet Hasil Sentrifugasi Mukosa Fundus (C) dan Pellet Hasil Sentrifugasi Mukosa Pilorus (D) ... 17
8. Plot Hubungan Regresi antara Waktu Koagulasi Susu- Pelet Fundus ... 23
9. Plot Hubungan Regresi antara Waktu Koagulasi Susu- Supernatan Fundus ... 24
10. Plot Hubungan Regresi antara Waktu Koagulasi Susu- Pelet Pilorus ... 24
11. Plot Hubungan Regresi antara Waktu Koagulasi Susu- Supernatan Pilorus ... 25
12. Abomasum Domba Lokal Umur Dewasa Muda (F : Fundus, P : Pilorus) ……… 26
13. Struktur Umum Kelenjar Fundus (A) dan Pilorus (B) Abomasum Domba Menggunakan Pewarnaan HE ………….. 27
14. Hubungan Konsentrasi Ekstrak Enzim Khimosin asal Daerah Kelenjar Fundus terhadap Waktu Koagulasi Susu ……… 28
15. Hubungan Konsentrasi Ekstrak Enzim Khimosin asal Daerah Kelenjar Pilorus terhadap Waktu Koagulasi Susu ……… 29
DAFTAR LAMPIRAN
Nomor Halaman 1. Analisis Ragam Waktu Awal Koagulasi Susu Ekstrak Mukosa
Abomasum dalam Bentuk Pelet ... 38 2. Analisis Ragam Waktu Akhir Koagulasi Susu Ekstrak Mukosa
Abomasum dalam Bentuk Pelet ... 38 3. Analisis Ragam Waktu Koagulasi Susu Ekstrak Mukosa
Abomasum dalam Bentuk Pelet ... 38 4. Analisis Ragam Waktu Awal Koagulasi Susu Ekstrak Mukosa
Abomasum dalam Bentuk Supernatan Fundus ... 38 5. Analisis Ragam Waktu Akhir Koagulasi Susu Ekstrak Mukosa
Abomasum dalam Bentuk Supernatan Fundus ... 39 6. Analisis Ragam Waktu Koagulasi Susu Ekstrak Mukosa
Abomasum dalam Bentuk Supernatan Fundus ... 39 7. Analisis Ragam Waktu Awal Koagulasi Susu Ekstrak Mukosa
Abomasum dalam Bentuk Supernatan Pilorus ... 39 8. Analisis Ragam Waktu Akhir Koagulasi Susu Ekstrak Mukosa
Abomasum dalam Bentuk Supernatan Pilorus ... 39 9. Analisis Ragam Waktu Koagulasi Susu Ekstrak Mukosa
Abomasum dalam Bentuk Supernatan Pilorus ... 40 10. Analisis Duncan Multiple Range Test terhadap Waktu
Awal Koagulasi Susu Ekstrak Mukosa Abomasum
dalam Bentuk Pelet ... 40 11. Analisis Duncan Multiple Range Test terhadap Waktu
Akhir Koagulasi Susu Ekstrak Mukosa Abomasum
dalam Bentuk Pelet ... 40 12. Analisis Duncan Multiple Range Test terhadap Waktu
Koagulasi Susu Ekstrak Mukosa Abomasum
PENDAHULUAN
Latar Belakang
Susu beserta produk olahannya merupakan bahan pangan dengan kandungan
nutrisi seimbang dan gizi sempurna. Direktorat Jenderal Peternakan (2003)
melaporkan, bahwa konsumsi susu sapi nasional mencapai 958,9 ribu ton, jauh lebih
tinggi daripada produksinya yaitu 577,5 ribu ton. Namun, konsumsi per kapita
menunjukkan jumlah yang sangat memprihatinkan yaitu kurang dari 100 mililiter per
hari per kepala. Keju sebagai produk olahan susu merupakan pangan yang bernilai
nutrisi tinggi. Tumbuh dan berkembangnya industri keju di Indonesia dipicu oleh
peningkatan konsumsi masyarakat terhadap keju. Indonesia mempertahankan suplai
rennet asal sapi melalui impor. Pengimporan rennet secara terus-menerus, selain
mahal, akan memberikan kontribusi pada pengurangan devisa negara serta dapat
mengurangi populasi sapi sebagai sumber utama rennet.
Populasi domba lokal sebagai fauna asli Indonesia dinilai cukup tinggi.
Badan Pusat Statistika Indonesia (2004) mencatat dalam tahun 2004 populasi domba
lokal Indonesia mencapai angka 8.245,8 ribu ekor. Populasi yang tinggi selama ini
belum dioptimalkan pemanfaatannya. Jumlah pemotongan yang tinggi terhadap
domba muda, khususnya di Jawa Barat, yaitu sebanyak 542.693 ekor (Badan Pusat
Statistika Jawa Barat, 2004) memberikan hasil ikutan pemotongan ternak dalam
jumlah besar. Abomasum merupakan salah satu produk ikutan pemotongan hewan,
khususnya domba, yang selama ini belum dimanfaatkan secara optimal. Penelitian
mengenai abomasum domba lokal sebagai sumber rennet diharapkan dapat
memberikan informasi tentang kualitas rennet yang dihasilkan, yang diharapkan
setara dengan kualitas rennet asal sapi muda, mengingat domba memiliki
kekerabatan dekat dengan sapi. Oleh karena itu, penelitian ini penting dilakukan
sebagai upaya dalam menjawab permasalahan pangan yang sedang dihadapi Bangsa
Indonesia.
Tujuan
Penelitian ini bertujuan untuk mempelajari dan menentukan potensi
pemanfaatan abomasum domba lokal umur dewasa muda (6-12 bulan) yang
merupakan produk ikutan pemotongan ternak sebagai bahan baku pembuatan rennet
TINJAUAN PUSTAKA
Lambung Ruminansia
Lambung merupakan organ eksokrin-endokrin campuran yang mencerna
makanan dan mensekresikan hormon (Junqueira et al., 1998). Domba sebagai hewan
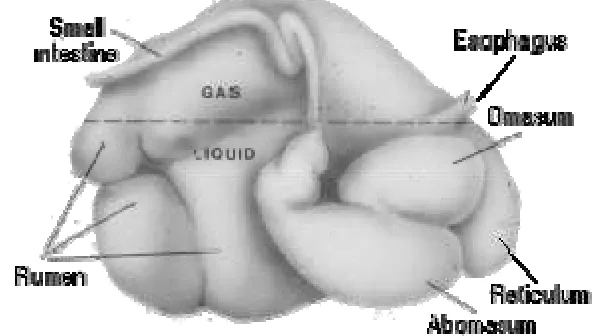
ruminansia, mempunyai lambung majemuk yang terdiri atas rumen, retikulum,
omasum, dan abomasum (Dyce et al., 1996) seperti dapat dilihat pada Gambar 1.
Gambar 1. Lambung Ruminansia Beserta Bagian-Bagiannya
Sumber : Coleman, 2006.
Abomasum merupakan lambung kelenjar yang berfungsi melakukan reaksi
enzimatis dan hidrolisis terhadap bahan makanan sebelum masuk ke duodenum.
Abomasum memiliki tiga daerah kelenjar yang berbeda, yaitu kardia, fundus, dan
pilorus (Stevens dan Hume, 1995). Seperti halnya struktur umum pada saluran
pencernaan, masing-masing bagian tersebut tersusun dari mukosa, submukosa,
tunika muskularis dan serosa.
Mukosa lambung tersusun dari lamina epitelia, lamina propria dan lamina
muskularis mukosa. Submukosa tersusun oleh jaringan ikat kolagen dan terdapat
buluh-buluh darah, limfe serta serabut syaraf dengan plexus ganglion Meissner yang
merupakan sistem syaraf otonom, yang disebut sistem syaraf enferikus (Bergman et
al., 1996). Tunika muskularis terdiri atas tiga lapisan, yaitu lapisan paling dalam,
lapisan tengah yang tersusun sirkuler dan lapisan luar yang susunannya memanjang,
buluh-buluh darah, limfe dan serabut syaraf otonom dengan plexus ganglion auerbach.
Tunika serosa terdiri atas jaringan ikat longgar yang mengandung pembuluh darah,
pembuluh limfatik dan sel-sel sistem kekebalan tubuh, seperti makrofag dan sel mast
(Bergman etal., 1996).
Daerah Kelenjar Kardia
Daerah kelenjar kardia merupakan daerah sempit antara esofagus dan daerah
kelenjar fundus. Kelenjar kardia berbentuk tubulus sederhana atau bercabang. Ujung
kelenjar, relatif pendek dan lumennya lebih luas dibanding kelenjar fundus dan
pilorus (Banks, 1986). Kelenjar kardia tersusun terutama oleh sel sekresi yang
menghasilkan mukus dan lisozim (Junqueira et al., 1998). Kelenjar kardia bersama
dengan epitel permukaan dan sel leher (mucous neck cells) di daerah fundus
menghasilkan mukus lambung yang berfungsi melindungi mukosa lambung dari
autodigesti (Banks, 1986).
Daerah Kelenjar Fundus
Menurut Ham dan Leeson (1961), Banks (1986) dan Bergman et al. (1996),
daerah fundus pada lambung merupakan daerah paling luas. Daerah fundus utamanya
dibagi dalam tiga daerah, yaitu
a) daerah apikal, banyak mengandung sel mukus (surfarce epithelial cells dan
mucous neck cells), sedikit sel utama (chieff cells) dan beberapa sel parietal
(parietal cells);
b) daerah badan, diisi oleh sel utama dan sel parietal;
c) daerah basal, mengandung sel utama, sel parietal dan beberapa sel
enteroendokrin;
Sel utama merupakan sel yang dominan menyusun kelenjar fundus. Sel utama
memiliki bentuk yang tidak beraturan, kubus atau piramidal dan memiliki semua ciri
sel penghasil protein dan sel pengekspor (Junqueira et al., 1998). Sel utama berwarna
biru dengan pewarnaan HE dan inti bulat terletak agak basal.
Kelenjar fundus diketahui menghasilkan enzim-enzim protease, terutama
pepsin dan khimosin. Kedua enzim tersebut dihasilkan oleh sel-sel utama yang
menyusun kelenjar fundus dalam bentuk tidak aktif, yaitu prokhimosin dan
sel parietal menjadi khimosin dan pepsin (Telford dan Bridgman, 1995). Khimosin
yang dominan ditemukan pada hewan muda dan memiliki sifat sangat khas dalam
mengkatalisa reaksi hidrolisis kappa-kasein (protein susu), sehingga mengakibatkan
koagulasi susu yang spesifik (Andrén et al., 1982; Andrén, 1991). Sekresi khimosin
akan menurun setelah tergantikan oleh adanya sekresi pepsin sebagai enzim protease.
Daerah Kelenjar Pilorus
Menurut Bergman et al. (1996) dan Banks (1986), secara histologi, daerah
kelenjar pilorus hampir sama dengan daerah kelenjar kardia. Kelenjar pilorus
berbentuk tubular sederhana dan pendek atau tubular bercabang. Sel ujung
kelenjarnya berbentuk silinder, sitoplasma beraspek basofil lemah dengan posisi inti
basal dan mirip dengan sel leher kelenjar fundus. Sel-sel tersebut menghasilkan
mukus pelindung, sedikit protease dan gastrin. Daerah pilorus memiliki ‘gastric pits‘
yang lebih dalam dibanding daerah abomasum lainnya. Daerah tersebut merupakan
tempat bermuara kelenjar-kelenjar pilorus tubular.
Enzim Protease Lambung
Sel-sel utama dari lambung menghasilkan tiga macam enzim protease, yaitu
pepsin, khimosin, dan gastricsin. Pepsin menghidrolisis tidak hanya protein yang
ditelan tetapi juga tambahan pepsinogen. Kerja autokatalitik ini mempermudah
perubahan pepsinogen menjadi pepsin. Pepsin menggunakan aksi hidrolitik pada
bagian tertentu dari rantai polipeptida dengan sangat efisien, terutama pada ikatan –
c-terminal asam amino tertentu seperti tiroksin, fenilalanin, dan triptofan (Kimball,
1992).
Khimosin (EC 3.4.23.4), biasa dikenal dengan rennin, merupakan enzim
proteolitik yang disintesis oleh sel utama pada abomasum sapi muda. Peranannya
ialah untuk mengkoagulasikan susu. Apabila susu tidak dikoagulasikan maka susu
dengan cepat akan melewati lambung tanpa sempat dicerna oleh tubuh. Sekresi
maksimal khimosin terjadi selama masa-masa awal setelah kelahiran, kemudian
sekresinya menurun dan digantikan dengan pepsin sebagai protease dominan
lambung. Ekstrak mukosa abomasum dengan kandungan khimosin yang tinggi
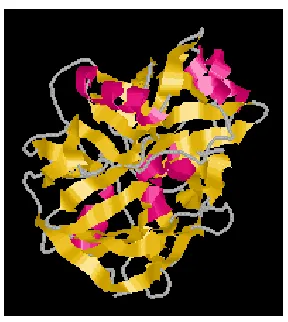
diperdagangkan dengan nama rennet (Suhartono, 1991). Struktur tiga dimensi enzim
Gambar 2. Struktur Tiga Dimensi Enzim Khimosin Sumber : Hill, 2006
Khimosin merupakan enzim protease yang telah melalui berbagai rangkaian
proteolisis. Khimosin dalam bentuk tidak aktif memiliki berat molekul sebesar 36
kilodalton dan dalam bentuk aktif sebesar 31 kilodalton. Prokhimosin berubah
menjadi khimosin melalui proses hidrolisis parsial yang terjadi pada pH asam. Proses
ini dipengaruhi konsentrasi garam dan pH. Enzim khimosin memiliki titik isoelektrik
sekitar pH 4,5 dan stabil pada pH 5,3-6,3 (Suhartono, 1991).
Ekstraksi Rennet
Khimosin merupakan enzim protease intraseluler. Enzim ini bersifat asam,
termasuk golongan endopeptidase dan aktif pada pH asam (Suhartono, 1991). Enzim
intraseluler menurut Naz (2002), dapat dibagi menjadi beberapa kategori berdasarkan
letaknya di dalam sel, yaitu
a) enzim yang terlarut sitoplasma tergolong kepada enzim yang mudah untuk
diekstraksi. Pemberian sedikit gangguan pada struktur sitoplasma sudah
cukup untuk memberikan jalan bagi enzim untuk keluar dari sel dan
melarutkan diri pada medium ekstraksi;
b) enzim yang terikat dengan plasma membran yang hanya dapat diekstraksi
dengan metode yang mampu mendisosiasikan kompleks lipoprotein;
c) enzim yang terikat dengan organel sel yang biasanya terikat dalam dua
kondisi, yaitu terikat dengan materi membran dari organel, serta enzim terikat
pada materi tidak terlarut dari lipoprotein;
Berdasarkan hal tersebut, proses ekstraksi harus memperhatikan kondisi enzim, yaitu
Menurut Naz (2002), ekstraksi enzim intraseluler dilakukan dalam dua
tahapan, meliputi :
a) Tahap pemecahan dinding sel dan membran sel. Pemecahan dinding sel dan
organel sel dapat dengan mudah dilakukan dengan homogenisasi media
ekstraksi bersama-sama dengan cacahan halus jaringan penghasil enzim; dan
b) Tahap ekstraksi. Material yang telah dicacah dicampurkan kembali ke dalam
media ekstraksi yang jumlahnya tiga kali material yang dicacah. Penentuan
pH media bergantung pada pH aktivasi enzim yang ingin diekstraksi. Enzim
dipisahkan dari jaringan penghasil melalui sentrifuge pada suhu rendah untuk
menjaga aktivitas proteolisis enzim. Bagian supernatan merupakan bagian
yang kaya akan enzim, karena diharapkan sebagian besar enzim telah
terekstraksi dari sel jaringan.
Metode ekstraksi enzim khimosin, menurut Suhartono (1991), dapat
dilakukan dengan cara memisahkan bagian fundus abomasum. Abomasum sebaiknya
tidak diawetkan dengan garam karena akan mengakibatkan dehidrasi berlebihan pada
mukosa sehingga enzim sukar keluar karena terikat dengan material garam. Asam
asetat 10% dapat digunakan dengan cara merendam abomasum cacahan selama 24
jam pada suhu 270C-390C sebanyak 5 kali berturut-turut. Ekstraksi dilakukan dengan
melakukan sentrifuge pada 2750 rpm selama 15 menit. Keasaman hasil ekstraksi
disesuaikan dengan kondisi optimal kinerja enzim melalui penambahan NaOH 1M.
Ekstrak dikumpulkan, kemudian dipekatkan pada 400C dengan tekanan vakum untuk
mendapatkan ekstrak khimosin pekat.
Definisi dan Komposisi Susu
Definisi susu segar, seperti tercantum dalam SNI 01-3141-1998 adalah cairan
yang berasal dari ambing sapi sehat, diperoleh dengan cara pemerahan yang benar
tidak mengalami penambahan atau pengurangan suatu komponen apapun dan tidak
mengalami proses pemanasan (Badan Standarisasi Nasional, 1998). Istilah susu,
mempunyai pengertian sebagai susu yang berasal dari sapi kecuali bila dinyatakan
Komposisi utama susu sering diartikan sebagai kandungan lemak, protein,
laktosa, abu dan padatan total. Susu juga mengandung sejumlah kecil komponen
lainnya seperti garam mineral, pigmen, enzim, vitamin, dan leukosit (Widodo, 2003).
Komposisi utama susu dapat dilihat pada Tabel 1 .
Tabel 1. Komposisi Kimia Susu
Komposisi Kandungan (%)
Air 87,0
Padatan Total 13,0
Padatan Bukan Lemak 9,0
Lemak 4,0
Laktosa 4,7
Protein 3,5
Mineral 0,8
Sumber : Walstra et al. (1999)
Protein Susu
Protein susu 95% terdapat dalam bentuk nitrogen. Komponen individual
penyusun susu relatif sukar untuk dipisahkan karena terbuat dari campuran kompleks
yang saling berikatan satu sama lainnya. Perbedaan mobilitas elektroforesis
komponen saat separasi ditentukan oleh variansi genetik (Walstra et al., 1999).
Protein susu dapat dibedakan menjadi kasein, protein whey, dan protein yang
terdisosiasikan dengan fase lipida (Hill, 2006).
Kasein merupakan protein utama susu (± 80% dari protein susu) atau sekitar
2,8% dari komposisi kimia susu. Kasein murni berwarna putih dan tidak larut dalam
air, tetapi larut dalam pelarut basa atau asam kuat (Widodo, 2003). Kasein terdiri atas
empat komponen utama, yaitu : αs1-kasein, αs2 -kasein, β -kasein dan κ -kasein (Fiat
dan Jolles, 1989). Kasein dalam susu biasanya terdapat dalam bentuk misel kasein.
Misel kasein memiliki diameter sebesar 500Å-3000Å. Ion kalsium dan fosfat
memiliki peranan penting dalam menjaga stabilitas misel kasein. Ion tersebut biasa
dikenal dengan koloidal kalsium-fosfat (Hill, 2006). Pembentukan dan
pengembangan misel kasein terhenti bila seluruh permukaan misel mengandung κ
Koagulasi Susu
Koagulasi susu adalah proses perubahan bentuk dari susu cair menjadi
padatan berbentuk gel. Koagulasi terjadi karena adanya penggumpalan dari kasein
yang terdapat di dalam susu. Gumpalan kasein yang terbentuk juga mengandung
lemak, bakteri, koloid kalium fosfat dan partikel-partikel lain yang disebut curd atau
dadih. Selain itu, curd juga mengandung air dan bahan-bahan yang terlarut dalam air
(Daulay, 1990). Curd yang telah menggumpal dengan sempurna dapat dilihat pada
Gambar 3.
Gambar 3. Curd yang telah Menggumpal Sempurna
Pembentukan curd pada proses pembuatan keju, menurut Johnson (1984),
dapat terjadi melalui dua cara, yaitu koagulasi secara enzimatis dan koagulasi asam.
Koagulasi dengan menggunakan asam dapat dilakukan dengan cara langsung
menambahkan asam (biasanya asam laktat) ke dalam susu, atau dengan penambahan
bakteri asam laktat yang akan memfermentasikan laktosa menjadi asam laktat.
Netralisasi muatan negatif dari kasein oleh ion H+ dari asam laktat akan
menyebabkan tercapainya pH isoelektrik kasein, yaitu pada 4,6, yang mengakibatkan
protein terkoagulasi. Penggumpalan akan sempurna bila semua muatan kasein
menjadi netral.
Agregasi kasein pada susu normal dicegah oleh adanya rambut-rambut pada
misel kasein, serta muatan negatif dari misel yang mencegah misel saling berdekatan.
Koagulasi enzimatis merupakan proses yang ditujukan untuk memecah ikatan
Koagulasi susu secara enzimatis terbagi kedalam tiga tahapan. Tahap pertama
merupakan tahap awal penggumpalan, sebanyak 80% molekul kasein terpecah untuk
mempercepat agregasi misel kasein. Tahap kedua merupakan tahap agregasi, misel
kasein memerangkap air untuk membentuk struktur tiga dimensi yang memicu
terbentuknya gel. Ion kalsium pada tahapan kedua saling berinteraksi dengan misel
kasein sehingga mempercepat pembentukan struktur gel dan mempercepat waktu
koagulasi susu. Tahapan ketiga, merupakan tahapan terakhir, yaitu pada tahapan ini
kasein telah selesai teragregasi dan membentuk struktur gel atau yang biasa dikenal
dengan nama curd (Hill, 2006). Koagulasi susu oleh khimosin sangat dipengaruhi
oleh pH dan proses tersebut sensitif pada perubahan pH, terutama pada selang
6,5-7,0 (Shalabi dan Fox, 1981).
Khimosin merupakan koagulan yang telah lama digunakan dalam industri
keju dan tampaknya merupakan enzim tertua yang dikenal dalam aplikasi pembuatan
keju. Sejarah menggambarkan bahwa khimosin didapat dengan mengekstraknya dari
abomasum ruminansia. Khimosin bekerja pada ikatan k-kasein, pecahnya ikatan
tersebut akan menyebabkan susu menggumpal (Johnson dan Law, 1999).
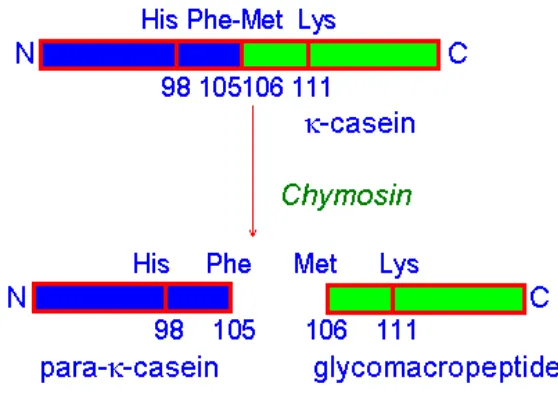
Khimosin bekerja pada sekuens asam amino mulai dari His 98 hingga Lys
111, kemudian memotong ikatan tersebut antara Phe 105 dan Met 106 pada rantai
molekul kappa-casein. Mekanisme pemotongan kappa kasein oleh enzim khimosin
dapat dilihat pada Gambar 4.
Gambar 4. Pemotongan Rantai k-Kasein oleh Enzim Khimosin
Rennet bereaksi dengan k-kasein melalui tiga fase. Pada fase pertama enzim
ini memecah misel kasein. Pemecahan ini mengasilkan para-k-kasein dan
glikomakropeptida. Pada fase kedua atau fase penjendalan, misel kasein yang sudah
dipecah, dengan pengaruh ion kalsium, melakukan penggabungan dengan komponen
susu lain membentuk koagulan. Biasanya satu koagulan dapat dihasilkan dalam
waktu 30 menit-40 menit setelah penambahan renin (Kloosterman, 1991). Fase
ketiga dari aktivitas rennet dimulai jika curd sudah terbentuk dan fase ini berkaitan
dengan proteolisis alfa dan beta kasein. Pada fase ini sekitar 6% rennin yang
ditambahkan akan tetap terdapat di dalam curd (Widodo, 2003).
Curd yang baik bersifat lembut, dikarenakan minimnya interaksi antara
komponen kasein. Kekompakan curd, menurut Marshall et al. (1981) diukur
menggunakan viskometer dan pressure transmission system (PTS). Viskometer
mengukur viskositas curd, sedangkan PTS mengukur rigiditas curd melalui
kemampuannya dalam mentransmisikan gelombang tekanan. Penggumpalan susu
dengan khimosin (rennin) akan menghasilkan curd yang bersifat elastis, lembut,
homogen dan dapat diiris tanpa serabut. Penggumpalan susu menggunakan asam
saja (misal, asam laktat), akan menghasilkan curd yang rapuh dan mudah patah
METODE
Lokasi dan Waktu
Penelitian ini dilaksanakan di Laboratorium Riset Anatomi Departemen
Anatomi Fisiologi dan Farmakologi, Fakultas Kedokteran Hewan, Institut Pertanian
Bogor pada tahun akademik 2004/2005 selama 5 bulan, di mulai dari bulan Juni
sampai Oktober 2005.
Materi
Bahan-bahan yang diperlukan untuk penelitian ini meliputi abomasum dari
domba lokal umur dewasa muda (6-12 bulan). Sampel diperoleh dengan membeli
abomasum dari tempat pemotongan hewan di Ciampea. Pengambilan sampel
abomasum dilakukan segera setelah hewan dipotong, kemudian dibersihkan dengan
garam fisiologis 0,9% dan disimpan dalam kondisi dingin untuk mempertahankan
aktivitas enzim tetap tinggi. Susu sapi segar yang digunakan sebagai bahan baku
pembuatan curd (uji koagulasi) berasal dari Bagian IPT Perah Fakultas Peternakan
dan Rumah Sakit Hewan IPB. Bahan-bahan kimia yang digunakan selama penelitian
adalah NaCl fisiologis, aquadestilata, CH3COOH (asam asetat) 10%, alkohol 70%,
NaOH 1N, spiritus dan teepol.
Peralatan yang diperlukan untuk pengambilan sampel abomasum adalah
skalpel, pinset, termos, plastik PE. Peralatan lainnya yang digunakan untuk
penanganan sampel hingga tahap ekstraksi meliputi cawan Petri, Bunsen, pipet
volumetrik (1ml, 2,5ml, 5ml, dan 10ml), pinset, skalpel, styrofoam, baki, gelas ukur
(125ml, 500ml, 1000ml, dan 10 ml), gelas piala (125 ml), labu Erlenmeyer 100ml,
tabung sentrifuge, tabung supernatan, tabung reaksi 20ml, magnetic stirrer,
sentrifuge, oven, autoklaf, stopwatch, kompor, panci, pengaduk, termometer, dan
Rancangan
Model
Penelitian ini menggunakan dua rancangan percobaan dengan tiga kali
ulangan. Perlakuan yang diberikan ialah perbedaan jaringan asal rennet, perbedaan
konsentrasi ekstrak rennet, serta perbedaan bentuk ekstrak rennet. Faktor yang
diamati ialah respon waktu koagulasi susu sebagai pengaruh penambahan ekstrak
rennet kasar dari berbagai bagian abomasum domba lokal umur dewasa muda.
Kelompok perlakuan pertama menggunakan rancangan acak lengkap
faktorial. Perlakuan yang diberikan meliputi pemberian ekstrak rennet dalam bentuk
pelet yang berasal dari jaringan fundus dan pilorus, masing-masing dengan
konsentrasi 1%, 2%, dan 3%.. Apabila analisa sidik ragam menunjukkan interaksi
yang berbeda nyata, maka dilanjutkan dengan uji Least Squares Means (LSM) dan
apabila interaksi tidak berbeda nyata sedangkan masing-masing faktor perlakuan
menunjukkan pengaruh yang berbeda nyata, maka dilanjutkan dengan uji Jarak
Berganda Duncan. Model matematika rancangan percobaan yang digunakan
mengacu pada Steel dan Torrie (1995) sebagai berikut :
Y
ijk=
μ
+
α
i+
β
j+(
αβ
)
ij+
ε
ijkKeterangan :
Yijk = Respon yang didapat (waktu koagulasi) dari pengaruh perlakuan taraf ke-i
dan taraf ke-j serta ulangan ke-k
μ = Nilai rataan umum
αi = Pengaruh perlakuan pertama taraf ke-i
βj = Pengaruh perlakuan kedua taraf ke-j
(
αβ
)
ij= Pengaruh interaksi dari pengaruh perlakuan pertama taraf ke-i dan
perlakuan kedua taraf ke-j
εijk = Galat percobaan untuk taraf ke-i, taraf ke-j dan ulangan ke-k i = Asal jaringan (fundus dan pilorus)
j = Konsentrasi (1%, 2%, dan 3%)
Kelompok perlakuan kedua dan ketiga menggunakan rancangan acak lengkap
searah. Kelompok perlakuan kedua meliputi pemberian ekstrak rennet kasar dalam
bentuk supernatan fundus dengan konsentrasi 1,5%, 2%, dan 2,5%. Kelompok
perlakuan ketiga meliputi pemberian ekstrak rennet kasar dalam bentuk supernatan
pilorus dengan konsentrasi 3%, 4%, dan 5%. Apabila analisa sidik ragam
menunjukkan respon yang berbeda nyata, maka dilanjutkan dengan uji lanjut
menggunakan uji Jarak Berganda Duncan. Model matematika rancangan percobaan
yang digunakan mengacu pada Steel dan Torrie (1995) sebagai berikut :
Y
ijk=
μ
+
α
i+
β
j+(
αβ
)
ij+
ε
ijkKeterangan :
Yijk = Respon yang didapat (waktu koagulasi) dari pengaruh perlakuan taraf ke-i
dan ulangan ke-j
μ = Nilai rataan umum
αi = Pengaruh perlakuan pemberian konsentrasi ekstrak rennet taraf ke-i
βj = Pengaruh ulangan taraf ke-j
εijk = Galat percobaan untuk taraf ke-i dan ulangan ke-j
i = Konsentrasi (1%, 2%, dan 3%)
j = Ulangan 1, 2, dan 3
Peubah
Peubah yang diamati selama penelitian ini ialah waktu koagulasi susu, yaitu
waktu yang diperlukan oleh rennet dalam menggumpalkan susu. Waktu koagulasi
susu ditentukan segera setelah terjadi penggumpalan hingga curd telah menggumpal
Prosedur
Penelitian ini terbagi ke dalam dua tahapan utama, yaitu penelitian
pendahuluan dan penelitian utama. Penelitian pendahuluan meliputi pembuatan
ekstrak mukosa abomasum dan penentuan konsentrasi ekstrak rennet kasar yang
dapat digunakan untuk mengkoagulasikan susu. Penelitian utama bertujuan untuk
menentukan konsentrasi terbaik ekstrak rennet kasar dalam menggumpalkan susu.
Pembuatan Ekstrak dan Pengujian Aktivitas
Metode yang digunakan untuk membuat ekstrak rennet kasar adalah dengan
cara pengaktifan enzim menggunakan asam asetat 10%. Mukosa abomasum dari
daerah fundus dan pilorus masing-masing dipisahkan dari lapisan dinding lambung
dengan cara dikelupas, lalu dicincang halus menggunakan pisau steril untuk
kemudian ditimbang. Hasil cincangan mukosa dimasukkan kedalam gelas piala dan
diekstraksi menggunakan asam asetat 10% dengan perbandingan 100 gr mukosa :
200 ml asam asetat 10%. Ekstraksi dipercepat dengan mengaduk campuran selama
24 jam menggunakan pengaduk magnet (magnetic stirrer) pada suhu ruang.
Selanjutnya, dilakukan pemisahan endapan dari larutan hasil ekstraksi dengan cara
sentrifusi pada kecepatan 2750 putaran per menit selama 15 menit. Endapan
dipisahkan dari supernatan dengan cara memipet supernatan dan memindahkannya
ke gelas piala. Supernatan hasil ekstraksi dinetralkan dengan cara menambahkan
NaOH 1M sedikit demi sedikit hingga pH mencapai 5,4. Supernatan yang diperoleh
merupakan enzim aktif yang siap dipakai untuk uji aktivitas. Pelet yang terpisah dari
supernatan diencerkan dengan aquadestilata dengan perbandingan 1:1. Pengujian
aktivitas enzim dilakukan pada konsentrasi yang berbeda, dengan cara menambahkan
filtrat sebanyak konsentrasi yang diinginkan (ekstrak pelet fundus dan pilorus
diberikan sebanyak 1%, 2%, dan 3%, ekstrak supernatan fundus diberikan sebanyak
1,5%, 2%, dan 2,5%, serta ekstrak supernatan pilorus diberikan sebanyak 3%, 4%,
dan 5%) sesuai dengan hasil penelitian pendahuluan ke dalam susu sapi pasteurisasi,
sehingga didapatkan total larutan sebanyak 100 ml. Pengadukan dilanjutkan perlahan
hingga tampak adanya gumpalan susu dengan jelas. Waktu koagulasi diukur dari saat
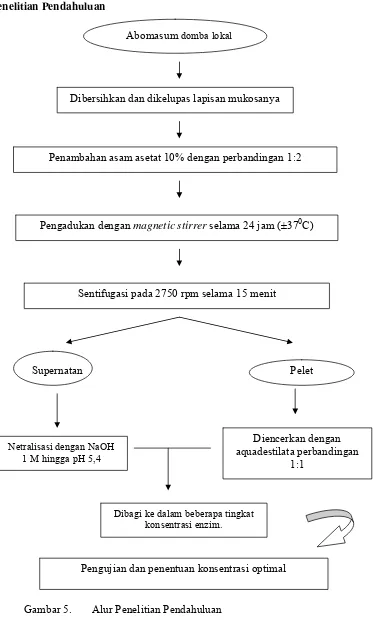
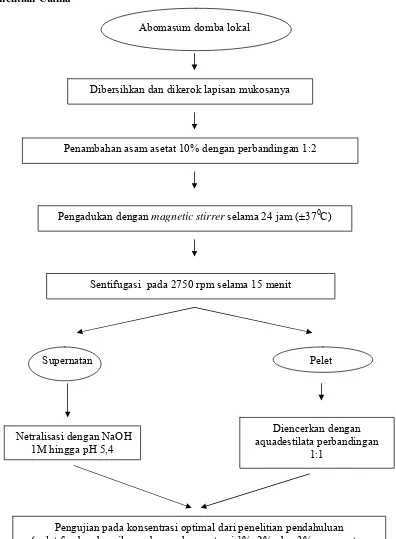
Penelitian Pendahuluan
Gambar 5. Alur Penelitian Pendahuluan Abomasum domba lokal
Dibersihkan dan dikelupas lapisan mukosanya
Penambahan asam asetat 10% dengan perbandingan 1:2
Pengadukan dengan magnetic stirrer selama 24 jam (±370C)
Sentifugasi pada 2750 rpm selama 15 menit
Supernatan Pelet
Netralisasi dengan NaOH 1 M hingga pH 5,4
Diencerkan dengan aquadestilata perbandingan
1:1
Dibagi ke dalam beberapa tingkat konsentrasi enzim.
Penelitian Utama
Gambar 6. Alur Penelitian Utama
Pengujian pada konsentrasi optimal dari penelitian pendahuluan (pelet fundus dan pilorus dengan konsentrasi 1%, 2%, dan 3%, supernatan fundus dengan konsentrasi 1,5%, 2%, dan 2,5%, kemudian supernatan pilorus
dengan konsentrasi 3%, 4%, dan 5%. Abomasum domba lokal
Dibersihkan dan dikerok lapisan mukosanya
Penambahan asam asetat 10% dengan perbandingan 1:2
Pengadukan dengan magnetic stirrer selama 24 jam (±370C)
Sentifugasi pada 2750 rpm selama 15 menit
Supernatan Pelet
Netralisasi dengan NaOH 1M hingga pH 5,4
Diencerkan dengan aquadestilata perbandingan
HASIL DAN PEMBAHASAN
Enzim khimosin (EC 3.4.23.4) atau dikenal dengan rennet merupakan enzim
protease yang diekstraksi dari abomasum ruminansia. Sifat khimosin yang paling
menonjol adalah kemampuannya untuk menggumpalkan susu. Sebagian besar enzim
protease telah diketahui mampu menggumpalkan susu, namun enzim khimosin
merupakan protease yang memiliki kemampuan paling tinggi dalam menggumpalkan
susu (Suhartono, 1991).
Ekstraksi Enzim Khimosin
Abomasum dijadikan sebagai bahan baku utama penghasil khimosin
didasarkan kepada fakta bahwa sel-sel penghasil enzim protease terdapat pada
mukosa abomasum. Junqueira et al. (1998), menegaskan bahwa sel utama pada
bagian fundus dominan menghasilkan enzim-enzim protease. Perbandingan berat
mukosa dari daerah fundus dan pilorus dapat dilihat pada Tabel 2.
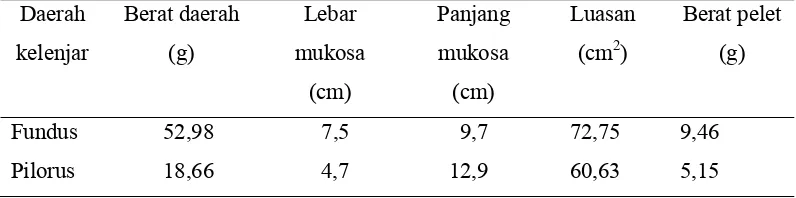
Tabel 2. Perbandingan Berat dan Ukuran Rata-rata Daerah Kelenjar Fundus dan Pilorus Abomasum Domba Lokal Umur Dewasa Muda
Daerah kelenjar Berat daerah (g) Lebar mukosa (cm) Panjang mukosa (cm) Luasan
(cm2)
Berat pelet
(g)
Fundus 52,98 7,5 9,7 72,75 9,46
Pilorus 18,66 4,7 12,9 60,63 5,15
Daerah kelenjar fundus merupakan daerah yang lebih luas bila dibandingkan
dengan daerah kelenjar pilorus. Daerah kelenjar fundus mempunyai luasan rata-rata
sebesar 72,75 cm2, sedangkan daerah kelenjar pilorus memiliki kisaran luasan
sebesar 60,63 cm2. Daerah kelenjar fundus dengan luasan yang lebih besar
menghasilkan pelet seberat 9,46 gram, lebih banyak bila dibandingkan dengan
jumlah pelet yang berhasil diekstraksi dari daerah kelenjar pilorus, yaitu seberat 5,15
gram. Data pada Tabel 2 memberikan gambaran bahwa luasan daerah kedua kelenjar
Daerah kelenjar fundus (Gambar 12) memiliki ciri khas berupa daerah yang
tersusun oleh lipatan-lipatan mukosa. Lipatan-lipatan mukosa tersebut menyebabkan
berat daerah kelenjar fundus (52,98 gram) lebih dari dua kali lipat daripada berat
kelenjar pilorus yang hanya seberat 18,66 gram. Lipatan-lipatan mukosa tersebut
juga menyebabkan luas permukaan daerah kelenjar fundus menjadi lebih besar bila
dibandingkan dengan luasan mukosa rata-ratanya. Daerah kardia tidak diekstraksi
karena belum dapat teridentifikasi pada saat penelitian oleh karena penampang
luasan daerah kelenjar kardia terlampau sempit untuk dapat diidentifikasi dan
[image:30.612.152.475.271.487.2]diekstraksi.
Gambar 7. Hasil Kelupasan Mukosa (A) Fundus dan (B) Pilorus serta Pelet Hasil Sentrifugasi Mukosa Fundus (C) dan Pelet Hasil Sentrifugasi Mukosa Pilorus (D)
Sel utama pada daerah kelenjar fundus mensekresikan pepsin dan khimosin,
sedangkan sel-sel pada kelenjar pilorus dominan mensekresikan mukus disertai
sedikit enzim protease (Junqueira et al., 1998). Warna mukosa fundus lebih gelap
daripada mukosa pilorus, seperti ditampilkan pada Gambar 7 A, karena sel-sel pada
mukosa fundus yang menghasilkan protease bertugas untuk mencerna makanan,
sedangkan sebagian besar sel kelenjar pilorus bekerja mensintesis mukus.
Lipatan-lipatan mukosa ikut menjadikan mukosa fundus lebih gelap sebagai dampak
pencernaan makanan.
Khimosin merupakan enzim intraseluler yang bekerja secara ekstraseluler,
oleh karena itu diperlukan metode ekstraksi yang lebih rumit untuk dapat
mengekstrak enzim tersebut (Sadikin, 2002). Mukosa abomasum dicacah dengan
tujuan untuk merusak dinding sel mukosa, sehingga sebagian sel penghasil enzim
protease akan rusak dan membebaskan enzim yang diinginkan. Penggunaan garam
fisiologis sebelum jaringan diekstraksi bertujuan untuk mengawetkan jaringan agar
tidak rusak. Komposisi garam fisiologis terdiri atas ion-ion yang hampir serupa
dengan kondisi isotonis jaringan, sehingga penggunaan garam fisiologis sebagai
pengawet jaringan sebelum ekstraksi tidak berpengaruh terhadap hasil akhir
ekstraksi.
Khimosin memiliki pH stabil antara 5,3-6,3, oleh karena itu khimosin akan
teraktivasi pada pH rendah (Ernstrom, 1974). Asam asetat merupakan asam lemah
yang berfungsi untuk mengaktivasi enzim khimosin. Enzim khimosin yang telah
teraktivasi dipisahkan dari sel melalui sentrifugasi. Sel secara teoritis memiliki massa
yang lebih berat daripada massa enzim sehingga enzim akan terpisah dan terdapat
didalam supernatan, sedangkan sel akan mengendap dalam bentuk pelet.
Penambahan basa seperti NaOH bertujuan untuk menetralisasi kondisi
keasaman larutan ke dalam kondisi keasaman optimal khimosin (5,3-6,3) sebelum
dilakukan uji kemampuan aktivitas mengkoagulasikan susu. Meskipun khimosin
aktif pada pH rendah, namun aktivitasnya akan menurun apabila terus berada pada
pH rendah. Penambahan NaOH juga ditujukan untuk mencegah penggumpalan susu
yang diakibatkan oleh asam, oleh karena itu terlebih dahulu supernatan dinetralkan.
Pengaruh Perbedaan Konsentrasi Enzim terhadap Waktu Koagulasi Susu
Konsentrasi khimosin yang ditambahkan ke dalam susu secara natural akan
meningkatkan kecepatan koagulasi susu. Koagulasi susu akibat agregasi kasein
hanya dapat berlangsung apabila sebagian besar k-kasein telah terpecah, sehingga
misel kasein dapat membentuk struktur yang iregular, yang pada akhirnya akan
membentuk struktur teratur berupa gel. Kepadatan gel akan segera terbentuk apabila
kontak antara setiap molekul misel kasein semakin meningkat. Pengaruh konsentrasi
ekstrak khimosin yang ditambahkan pada susu dalam bentuk pelet terhadap waktu
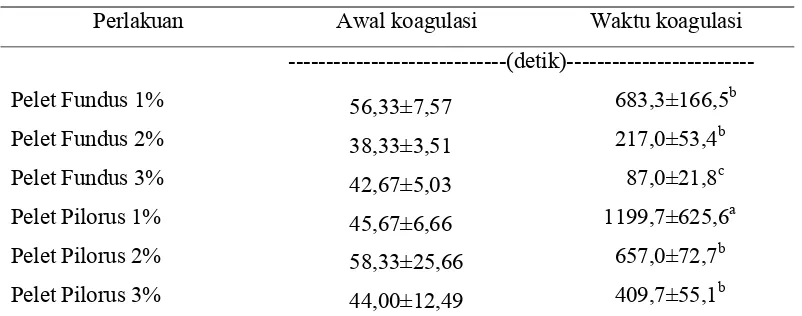
Tabel 3. Waktu Koagulasi Susu sebagai Respon Perbedaan Konsentrasi Pelet yang Diberikan
Perlakuan Awal koagulasi Waktu koagulasi
---(detik)---
Pelet Fundus 1% 56,33±7,57 683,3±166,5b
Pelet Fundus 2% 38,33±3,51 217,0±53,4b
Pelet Fundus 3% 42,67±5,03 87,0±21,8c
Pelet Pilorus 1% 45,67±6,66 1199,7±625,6a
Pelet Pilorus 2% 58,33±25,66 657,0±72,7b
Pelet Pilorus 3% 44,00±12,49 409,7±55,1b
Keterangan : superskrip yang berbeda pada kolom yang sama menunjukkan perbedaan nyata (P<0,05)
Hasil sidik ragam menunjukkan bahwa interaksi antara konsentrasi ekstrak
rennet yang berbeda-beda dengan asal jaringan tidak berpengaruh nyata terhadap
awal koagulasi dan juga waktu koagulasi susu. Faktor perlakuan memberikan
pengaruh yang berbeda nyata terhadap waktu koagulasi susu (P<0,05), namun
perlakuan tidak memberikan pengaruh nyata terhadap awal koagulasi susu. Waktu
koagulasi tercepat adalah 87,0 detik yang ditunjukkan oleh ekstrak rennet pelet
fundus dan 409,7 detik untuk ekstrak rennet pelet pilorus.
Hasil penelitian menunjukkan bahwa ekstrak rennet yang berasal dari daerah
fundus memiliki kemampuan paling baik dalam mengkoagulasikan susu.
Berdasarkan Andren et al. (1982) jaringan fundus diketahui menghasilkan enzim
khimosin yang memiliki sifat khas yaitu hanya mengkatalisa hidrolisis kappa kasein,
sehingga mengakibatkan koagulasi susu yang spesifik.
Waktu koagulasi susu memiliki hubungan yang erat dengan konsentrasi
enzim protease yang ditambahkan. Waktu koagulasi susu dihitung sejak pertama kali
khimosin ditambahkan pada susu, sejak saat itu laju koagulasi akan berlangsung
semakin cepat. Koagulasi sempurna ditandai dengan meningkatnya viskositas susu.
Koagulasi susu terjadi dalam beberapa tahapan. Tahapan pertama merupakan
tahap awal penggumpalan susu. Berdasarkan Tabel 3, terjadi peningkatan proses
agregasi misel kasein searah dengan peningkatan konsentrasi enzim. Peningkatan
tersebut berdasarkan analisa sidik ragam awal koagulasi yang menunjukkan
Tahapan kedua hingga tahapan akhir koagulasi susu merupakan tahapan
agregasi misel kasein hingga proses agregasi telah berjalan sempurna. Respon waktu
akhir koagulasi pada Tabel 3 memperlihatkan bahwa penambahan enzim khimosin
memberikan pengaruh yang sangat berbeda nyata (P<0,01). Konsentrasi ion kalsium
merupakan salah satu faktor yang mempengaruhi kecepatan koagulasi susu, karena
ion kalsium akan berikatan dengan struktur molekul misel kasein yang terpecah
(Widodo, 2003).
Aktifitas enzimatis yang semakin meningkat sebagai dampak kinerja enzim
khimosin didukung oleh adanya ikatan ion kalsium susu dengan misel kasein yang
telah pecah. Ion kalsium memiliki peranan untuk meningkatkan sifat hidrofobik
misel kasein, sehingga k-kasein yang telah terpecah oleh enzim khimosin semakin
cepat beragregasi dengan molekul kasein lainnya membentuk struktur gel sempurna.
Ketersediaan ion kalsium di dalam susu mempercepat proses agregasi tersebut,
dikarenakan ion kalsium dapat berikatan dengan misel kasein pada bagian interior
misel. Pendapat ini didukung oleh Lucey et al. (2003) yang menyatakan bahwa misel
kasein memiliki beberapa situs tempat ion kalsium dapat berikatan, oleh karena itu
apabila dilakukan penambahan ion kalsium pada susu untuk mempercepat koagulasi
ion kalsium yang ditambahkan masih dapat berikatan dengan misel kasein tanpa
adanya kejenuhan ion kalsium dalam larutan.
Berdasarkan hasil uji lanjut terhadap respon waktu akhir kogulasi pada Tabel
3, pengaruh nyata antar perlakuan ditunjukkan oleh pemberian ekstrak pelet pilorus
dengan konsentrasi 2%, sedangkan pemberian pelet fundus tidak memberikan respon
berbeda nyata antar perlakuan. Pengaruh beda nyata berhubungan dengan kejenuhan
ikatan enzim substrat pada media. Sadikin (2002), berpendapat kejenuhan terjadi
akibat molekul enzim khimosin telah seluruhnya berikatan dengan substrat.
Peningkatan konsentrasi pelet pilorus yang diberikan tidak mengakibatkan
kejenuhan pada medium dikarenakan persentase enzim khimosin yang terkandung
dalam ekstrak pelet pilorus lebih rendah, sehingga sebagian besar substrat belum
berikatan dengan enzim khimosin. Peningkatan konsentrasi ekstrak pelet pilorus
masih dimungkinkan untuk meningkatkan kecepatan koagulasi, meskipun
peningkatan konsentrasi hingga pada taraf 3% memberikan pengaruh yang tidak
Waktu koagulasi yang diukur dengan melakukan pengurangan waktu akhir
koagulasi terhadap waktu awal koagulasi menunjukkan adanya perbedaan sangat
nyata akibat adanya pengaruh perlakuan (P<0,01). Respon yang didapatkan pada
Tabel 3 berupa waktu mulai koagulasi dan waktu selesai koagulasi menunjukkan
bahwa penambahan konsentrasi enzim khimosin berpengaruh nyata terhadap waktu
koagulasi susu sebagai respon terhadap kinerja enzim khimosin. Peningkatan
konsentrasi enzim khimosin yang ditambahkan mempercepat waktu koagulasi awal
susu, yaitu selisih waktu antara enzim khimosin pertama kali ditambahkan hingga
koagulasi pertama terdeteksi. Koagulasi awal yang dipercepat akibat peningkatan
konsentrasi enzim khimosin, memicu peningkatan kecepatan koagulasi pada tahapan
selanjutnya, sebagaimana telah disebutkan diatas, bahwa tahapan tersebut ikut
dipengaruhi oleh ketersediaan ion kalsium dalam susu.
Hasil uji lanjut terhadap waktu koagulasi pada Tabel 3 menunjukkan hasil
yang tidak jauh berbeda dengan hasil uji lanjut untuk respon waktu selesainya
koagulasi susu. Berdasarkan hasil uji lanjut, diperjelas bahwa konsentrasi optimal
penambahan enzim khimosin yang berasal dari daerah fundus ke dalam susu ialah
sebesar 2%. Peningkatan konsentrasi diatas 2% akan menurunkan waktu koagulasi,
serta penurunannya memberikan dampak yang berbeda nyata terhadap waktu
koagulasi susu. Peningkatan konsentrasi pemberian ekstrak enzim khimosin yang
diekstraksi dari daerah pilorus menunjukkan adanya perbedaan nyata antar
perlakuan. Peningkatan konsentrasi diatas 2% akan memberikan pengaruh tidak
berbeda nyata antar perlakuan, namun tidak sampai meningkatkan waktu koagulasi,
dikarenakan konsentrasi enzim khimosin dalam ekstrak pilorus lebih rendah daripada
ekstrak fundus, sehingga kejenuhan belum terjadi pada tingkat konsentrasi yang
sama.
Penambahan konsentrasi enzim khimosin dalam bentuk supernatan
memberikan pengaruh terhadap waktu koagulasi susu, pengaruh tersebut terlihat
pada kedua sumber ekstrak, baik ekstrak fundus maupun supernatan yang diekstraksi
dari daerah kelenjar pilorus. Pengaruh peningkatan konsentrasi enzim khimosin
terhadap waktu koagulasi susu dalam bentuk supernatan dari daerah fundus yang
ditambahkan ke dalam susu dapat dilihat pada Tabel 4. Konsentrasi supernatan yang
diekstraksi dari daerah kelenjar pilorus diberikan pada tingkat konsentrasi yang lebih
konsentrasi yang sama dengan konsentrasi supernatan fundus belum menunjukkan
adanya respon koagulasi. Respon koagulasi akibat penambahan ekstrak khimosin
[image:35.612.116.513.185.274.2]dari daerah pilorus disajikan pada Tabel 5.
Tabel 4. Waktu Koagulasi Susu sebagai Respon Perbedaan Konsentrasi Supernatan Fundus yang Diberikan
Perlakuan Awal koagulasi Akhir koagulasi Waktu koagulasi
--- (detik) ---
Supernatan Fundus 1,5% 124,8±5,63 602,6±361,7 477,8±346,9
Supernatan Fundus 2% 83,2±23,76 400,8±257,0 318,6±253,5
Supernatan Fundus 2,5% 64,8±12,11 286,6±147,6 211,2±141,8
Tabel 5. Waktu Koagulasi Susu sebagai Respon Perbedaan Konsentrasi Supernatan Pilorus yang Diberikan
Perlakuan Awal koagulasi Akhir koagulasi Waktu koagulasi
--- (detik) ---
Supernatan Pilorus 3% 272,4±198,2 920,6±454,4 648,2±357,6
Supernatan Pilorus 4% 214,0±136,7 735,2±405,9 521,2±281,5
Supernatan Pilorus 5% 179,8±134,4 500,2±250,0 320,4±164,6
Pengaruh peningkatan konsentrasi lebih terlihat pada ekstrak dalam bentuk
pelet. Berdasarkan Tabel 4, pemberian enzim khimosin dalam bentuk supernatan
fundus memberikan pengaruh yang berbeda nyata terhadap waktu awal koagulasi
(P<0,05), namun menunjukkan respon yang tidak berbeda nyata terhadap waktu
akhir koagulasi serta waktu koagulasi susu. Penambahan ekstrak supernatan pilorus
(Tabel 5) memberikan efek yang tidak berbeda nyata untuk ketiga respon waktu.
Respon beda nyata terhadap waktu awal koagulasi dipengaruhi oleh
konsentrasi enzim khimosin di dalam supernatan fundus. Enzim khimosin yang
tidak tersentrifusi dengan sempurna, sebagian kecil darinya akan mengendap pada
pelet, kemudian sisa enzim khimosin yang tidak mengendap akan terlarut di dalam
supernatan. Konsentrasi ekstrak khimosin di dalam supernatan pilorus berada pada
tingkat yang lebih rendah daripada tingkat konsentrasi supernatan fundus, sehingga
memberikan pengaruh yang tidak berbeda nyata. Berbeda dengan susu yang diberi
[image:35.612.115.513.330.419.2]konsentrasi 2% belum menunjukkan kejenuhan dan peningkatan waktu koagulasi
akibat konsentrasi khimosin yang lebih rendah daripada pelet.
Pemecahan sel dan separasi molekul merupakan kunci dari proses ekstraksi,
apabila pemecahan sel tidak sempurna, maka sebagian dari enzim masih terdapat
pada padatan sel. Suhartono (1991) menyatakan, supernatan merupakan fraksi cairan
sisa organel sel, yang telah dipecah dan diduga mengandung sebagian besar dari
enzim khimosin yang telah diekstraksi. Fraksi pelet merupakan bentuk padatan sisa
organel sel yang telah dipecah dan diduga masih mengandung sebagian kecil enzim
terekstraksi. fundus pelet w a k tu k o a g u la s i 3,0 2,5 2,0 1,5 1,0 900 800 700 600 500 400 300 200 100 0 S 260,399 R-Sq 20,2% R-Sq(adj) 14,1%
Fitted Line Plot
waktu koagulasi = 628,9 - 149,5 fundus pelet
[image:36.612.144.484.268.492.2]fundus supernat an w a k tu k o a g u la s i 2,50 2,25 2,00 1,75 1,50 900 800 700 600 500 400 300 200 100 0 S 251,340 R-Sq 17,8% R-Sq(adj) 11,5%
Fitted Line Plot
waktu koagulasi = 869,1 - 266,6 fundus supernatan
Gambar 9. Plot Hubungan Regresi Antara Waktu Koagulasi Susu-Supernatan Fundus pilorus pelet w a k tu k o a g u la s i 3,0 2,5 2,0 1,5 1,0 2000 1500 1000 500 0 S 382,470 R-Sq 23,6% R-Sq(adj) 17,7%
Fitted Line Plot
[image:37.612.155.472.79.284.2]waktu koagulasi = 1099 - 242,5 pilorus pelet
[image:37.612.158.471.356.558.2]pilorus supernat an w a k tu k o a g u la s i 5,0 4,5 4,0 3,5 3,0 1000 800 600 400 200 0 S 269,140 R-Sq 22,2% R-Sq(adj) 16,2%
Fitted Line Plot
[image:38.612.162.472.90.299.2]waktu koagulasi = 1152 - 163,9 pilorus supernatan
Gambar 11. Plot Hubungan Regresi Antara Waktu Koagulasi Susu-Supernatan Pilorus
Berdasarkan hasil regresi pada Gambar 8-11 yang menyatakan hubungan
antara respon waktu koagulasi susu terhadap penambahan konsentrasi enzim (Tabel
3, Tabel 4 dan Tabel 5) dapat ditegaskan bahwa kandungan enzim khimosin lebih
banyak terdapat pada ekstrak dalam bentuk pelet, meskipun secara teoritis enzim
khimosin akan terdapat dalam supernatan setelah proses ekstraksi. Kemiringan
pada grafik menunjukkan bahwa pada asal daerah yang sama slope kemiringan pelet
lebih curam daripada slope kemiringan supernatan. Slope kemiringan yang lebih
curam menggambarkan pengaruh ekstrak yang diberikan dalam bentuk pelet
terhadap waktu koagulasi susu lebih tinggi daripada pengaruh ekstrak yang diberikan
dalam bentuk supernatan.
Enzim intraseluler membutuhkan ekstraksi yang kompleks karena lokasinya
terletak di dalam sel. Enzim hanya dapat dikeluarkan dari dalam sel apabila terlebih
dahulu dinding sel yang mengandung enzim dipecah, oleh karena itu dibutuhkan
pencacahan dan sentrifugasi dengan kecepatan tinggi (sentrifugasi dengan kecepatan
diatas 3000 rpm) untuk dapat mengekstraksi enzim dari selnya (Naz, 2002).
Kecepatan sentrifugasi serta kesempurnaan proses pemecahan berpengaruh terhadap
kandungan enzim khimosin yang terdapat pada ekstrak. Pemecahan dinding sel yang
tidak sempurna akan mengganggu keluarnya enzim dari dalam organel sel, serta akan
Enzim dipisahkan berdasarkan bobot molekulnya, karena enzim memiliki
bobot yang lebih ringan daripada sel penghasilnya, oleh karena itu setelah
sentrifugasi enzim akan terlarut pada supernatan, sedangkan organel sel akan
mengendap dalam bentuk pelet, namun apabila kecepatan sentrifugasi yang
digunakan rendah terdapat kemungkinan sebagian enzim tidak tersentrifugasi dengan
sempurna karena enzim tidak sepenuhnya terpisah dari padatan sel yang rusak,
sehingga enzim akan kembali mengendap bersama pelet.
Pengaruh Perbedaan Jaringan terhadap Aktivitas Koagulasi Susu
Abomasum merupakan organ pencernaan ruminansia yang dijadikan sebagai
sumber penghasil enzim. Abomasum terbagi kedalam tiga daerah kelenjar, yaitu
fundus, pilorus dan kardia, adapun pembagian daerah kelenjar abomasums dapat
dilihat pada gambar 12, sedangkan tampilan mikroskopis mukosa abomasum dapat
dilihat pada Gambar 13. Daerah kelenjar fundus merupakan daerah paling luas yang
ditandai dengan adanya lipatan-lipatan mukosa. Daerah kelenjar fundus merupakan
penghasil utama enzim-enzim pencernaan. Daerah kelenjar pilorus dicirikan oleh
adanya penebalan dinding kelenjar dan lapisan mukosanya tidak lagi membentuk
lipatan-lipatan, sebagian besar produksi daerah kelenjar pilorus ialah mucus.
[image:39.612.137.490.433.643.2]
Gambar 12. Abomasum Domba Lokal Umur Dewasa Muda (F : Fundus, P : pilorus)
A
[image:40.612.185.441.74.493.2]B
Gambar 13. Struktur Umum Kelenjar Fundus (A) dan Pilorus (B)
Abomasum Domba Menggunakan Pewarnaan HE
Kelenjar fundus domba lokal umur dewasa muda secara mikroskopis disusun
atas sel-sel parietal, sel-sel utama, dan sel-sel penghasil mukus yang tersebar mulai
dari daerah leher hingga mencapai daerah permukaan. Sel utama berbentuk tidak
beraturan dan terdistribusi terutama pada bagian basal kelenjar, sedangkan sel
parietal berbentuk bulat atau piramid, dengan inti ditengah, dan terdistribusi mulai
dari bagian basal hingga leher kelenjar. Kelenjar pilorus secara mikroskopis dicirikan
oleh bentuknya yang berupa kelenjar tubular dan hanya disusun atas sel-sel penghasil
Enzim khimosin terutama dihasilkan oleh kelenjar fundus abomasum
ruminansia, oleh karena itu ekstrak enzim khimosin yang diekstraksi dari daerah
kelenjar fundus dapat menggumpalkan susu lebih cepat dibandingkan dengan ekstrak
yang diambil dari daerah kelenjar pilorus. Ekstrak yang diambil dari daerah kelenjar
fundus bila dibandingkan dengan ekstrak yang berasal dari daerah kelenjar pilorus,
memberikan pengaruh yang berbeda nyata terhadap waktu koagulasi susu. Hasil
tersebut didasarkan dari data respon waktu koagulasi susu. Hubungan antara variabel
waktu koagulasi susu dengan asal daerah kelenjar penghasil enzim dapat diplotkan
ke dalam grafik sebagaimana ditunjukkan oleh plot data Tabel 3, 4, dan 5 yang dapat
dilihat pada gambar 14 dan 15. Plot data pada grafik dapat digunakan untuk
memberikan gambaran kecenderungan aktifitas enzimatis dari masing-masing
ekstrak pada berbagai tingkat konsentrasi.
Hubungan Konsentrasi Ekstrak Enzim Khimosin Asal Fundus dengan Waktu Koagulasi
0
200
400
600
800
1000
0
1
2
3
4
Konsentrasi Enzim
W
a
k
tu K
o
agu
lasi
Su
su
pelet supernatan
[image:41.612.142.492.375.595.2]A
Hubungan Konsentrasi Ekstrak Khimosin
Pilorus dengan Waktu Koagulasi Susu
0
500
1000
1500
2000
0
2
4
6
Konsentrasi Ekstrak
Wakt
u
K
o
ag
u
lasi
S
u
su
pelet
supernatan
[image:42.612.132.495.95.355.2]B
Gambar 15. Hubungan Konsentrasi Ekstrak Enzim Khimosin Asal Daerah Kelenjar Pilorus terhadap Waktu Koagulasi Susu
Aktifitas enzimatis koagulasi susu pada tingkat konsentrasi yang sama
menunjukkan nilai yang lebih tinggi, seperti ditunjukkan oleh plot data pada Gambar
14 dan 15, pada tingkatan konsentrasi ekstrak yang sama, ekstrak yang berasal dari
daerah kelenjar fundus memberikan aktifitas yang lebih tinggi, artinya daerah
kelenjar fundus menghasilkan enzim khimosin dalam jumlah yang lebih besar bila
dibandingkan dengan produksi enzim khimosin dari daerah kelenjar pilorus. Hal ini
didukung oleh pendapat Banks (1986), yang menyatakan bahwa sel utama kelenjar
fundus menghasilkan pro-khimosin dan pepsinogen yang nantinya akan diubah
menjadi khimosin dan pepsin oleh HCl dari sel parietal. Ditambahkan pula oleh
Andren et al. (1991) bahwa enzim khimosin ditemukan pada hewan muda dan
memiliki karakteristik yang khas dalam menghidrolisis k-kasein. Sel penghasil enzim
khimosin tidak hanya ditemukan pada sel-sel utama, tetapi juga pada sel-sel leher
Kelenjar pilorus yang tersusun oleh sel-sel penghasil mukus masih dapat
menghasilkan ekstrak yang dapat mengkoagulasikan susu, walaupun aktifitasnya
sangat rendah. Sekreta utama kelenjar pilorus adalah mukus yang berfungsi untuk
menetralkan keasaman makanan sebelum makanan masuk kedalam lambung, tetapi
sebagian kecil sel masih memproduksi enzim protease, oleh karena itu ekstrak pelet
yang didapatkan dari daerah pilorus masih mungkin memiliki kandungan protease.
Gambar 16 menampilkan bentuk curd sebagai hasil koagulasi susu akibat kinerja
protease dalam ekstrak yang didapatkan dari kedua daerah kelenjar.
Gambar 16. Curd Hasil Kinerja Enzim Protease yang Berasal dari Ekstrak Daerah Kelenjar Fundus (A), dan Daerah Kelenjar Pilorus (B)
Curd yang dihasilkan dengan penambahan ekstrak yang diperoleh dari daerah
kelenjar fundus menunjukkan tekstur yang lebih kompak bila dibandingkan dengan
curd yang dikoagulasikan menggunakan ekstrak yang berasal dari daerah kelenjar
pilorus. Enzim khimosin memiliki ciri khas menghasilkan curd yang bersifat elastis,
lembut, homogen dan kompak sehingga dapat diiris tanpa serabut, dikarenakan
enzim khimosin memutus rantai peptida pada ikatan yang spesifik.
Domba umur dewasa muda sudah mulai untuk mengkonsumsi rerumputan,
hal ini dapat dilihat dari warna lapisan mukosa abomasum yang berwarna
kekuningan pada Gambar 12. Konsumsi rerumputan oleh domba akan berpengaruh
pada konsentrasi enzim khimosin yang dihasilkan oleh saluran pencernaan. Proporsi
[image:43.612.122.503.244.469.2]konsentrasi enzim khimosin dengan pepsin yang diproduksi berbanding terbalik
dengan usianya, sehingga jumlah enzim pepsin akan semakin bertambah seiring
dengan kedewasaan umur domba.
Ekstrak enzim pepsin biasanya digunakan untuk memproduksi keju segar
(Spreer, 1998). Enzim hasil ekstraksi merupakan ekstrak kasar sehingga
kemungkinan masih bercampur dengan pepsin. Enzim pepsin yang diekstraksi dari
hewan dewasa memberikan efek koagulasi yang lebih lemah dan proteolisis yang
nonspesifik. Proteolisis nonspesifik merupakan pemutusan rantai peptida tertentu
pada kasein di luar yang terjadi pada koagulasi normal dan terkadang menimbulkan
rasa pahit yang tidak diharapkan. Menurut Kilara dan Iya (1984), pepsin merupakan
protease yang umum digunakan sebagai pengganti khimosin, namun penggunaan
optimalnya dinilai paling baik apabila digabungkan dengan khimosin dengan
perbandingan 1:1. Law dan Wigmore (1981), menyatakan bahwa sebagian besar
protease memiliki aktivitas proteolitik yang lebih tinggi daripada khimosin,
seringkali pemanfaatan protease selain khimosin dalam pembuatan keju
menghasilkan sensori yang lebih pahit karena adanya produk sampingan berupa NH3
sebagai hasil sampingan aktifitas proteolitik yang berlebihan. Disamping lebih pahit
penggunaan protese selain khimosin memberikan tekstur yang lembek dan kurang
kompak dikarenakan pemutusan rantai peptida pada misel kasein yang tidak bersifat
spesifik.
Hasil yang berbeda nyata akibat pengaruh perlakuan mengindikasikan bahwa,
abomasum domba lokal umur dewasa muda masih berpotensi untuk memproduksi
enzim khimosin. Curd hasil koagulasi enzim khimosin memberikan tekstur yang
kompak dan kokoh, sebagaimana dapat dilihat pada Gambar 17 A. Tekstur curd yang
kompak terjadi akibat aktivitas enzimatis khimosin yang meningkatkan komponen
nitrogen terlarut (misel kasein yang terpecah). Tahapan berikutnya terjadi agregasi
misel yang telah terubah secara enzimatis oleh khimosin sehingga terbentuk struktur
gel yang lebih kompak dan kenyal. Perlakuan terbaik berdasarkan hasil uji lanjut
Duncan didapat dari pelet fundus konsentrasi 2 % dengan waktu koagulasi 151,4
sekon, sedangkan untuk supernatan didapatkan dari ekstrak fundus dengan
KESIMPULAN DAN SARAN Kesimpulan
Daerah kelenjar asal jaringan enzim serta konsentrasi enzim sangat
mempengaruhi aktivitas koagulasi susu. Semakin tinggi konsentrasi enzim maka
waktu koagulasi yang didapat akan lebih cepat. Hasil koagulasi terbaik didapatkan
dari ekstrak yang berasal dari jaringan fundus baik dalam bentuk pelet maupun
supernatan, yaitu pada konsentrasi 2,5 % untuk supernatan dan pada taraf 2% untuk
pelet. Sedangkan, ekstrak yang berasal dari daerah kelenjar pilorus masih dapat
digunakan sebagai penghasil enzim, meskipun respon koagulasi yang dihasilkan
kurang memuaskan. Berdasarkan hasil respon koagulasi maka dapat ditarik
kesimpulan bahwa abomasum domba lokal umur dewasa muda masih berpotensi
untuk dijadikan sebagai penghasil rennet.
Saran
Penelitian lebih lanjut mengenai ekstraksi enzim rennet disarankan untuk
melakukan pengujian pada ekstrak yang telah melalui pemekatan dan purifikasi
sehingga hasil yang didapatkan tidak bias dengan adanya kemungkinan tercemar
oleh pepsin. Proses ekstraksi sebaiknya menggunakan sentrifuge dengan kecepatan
UCAPAN TERIMAKASIH
Puji dan syukur penulis panjatkan ke hadirat Allah SWT sumber pengetahuan
dan kebenaran yang mulia, tempat berasalnya segala nikmat dan bimbingan yang
tiada henti. Hanya dengan karunia dan kasih sayang-Nya, serta dengan
pertolongan-Nya, skripsi ini dapat diselesaikan. Shalawat serta salam teruntuk Nabi Muhammad
SAW, yang telah menyampaikan ajarannya dan semakin terus terbukti kebenarannya
dalam kehidupan yang modern ini.
Ucapan terima kasih penulis sampaikan terutama kepada Dr. Ir. Rarah R. A.
Maheswari DEA. dan Dr. drh. Chairun Nisa’, MSi., yang telah membimbing,
mengarahkan, dan membantu penyusunan usulan penelitian hingga tahap akhir
penulisan skripsi ini. Kemudian ibunda yang tegar dan penuh kasih sayang serta
ayahanda yang senantiasa menurunkan kebijakan dalam bimbingannya.
Ucapan terima kasih juga disampaikan kepada Sriduresta, A. Gustrina, Fitri
I., Renitasari dan Devi M. atas motivasi serta dukungan doa yang tiada henti kepada
penulis. Kemudian, teman-teman THT angkatan 39 dan 40 terutama sahabat-sahabat
di lab IPT Perah (Joni S., Slamet M., Arie R., Ria W., Gria S., Panca, Susapta, Yudis,
Rizky, Dian, dll.) atas semangatnya, tim penelitian enzim (Shanti, Putut, dan Nur)
atas dukungan materi yang telah diberikan, serta pihak-pihak lain yang namanya
tidak dapat disebutkan satu persatu yang banyak memberikan kontribusi dalam
proses penelitian hingga terselesaikannya skripsi ini.
Terakhir penulis ucapkan terima kasih banyak kepada civitas akademika
Fakultas Peternakan IPB. Semoga skripsi ini bermanfaat bagi yang membacanya.
Bogor, Juli 2006