UNTUK PELA
Merr.) DENGA
DEPARTEM
IN
LAPISAN BENIH KEDELAI (Glycine
GAN CENDAWAN MIKORIZA ARB
SITI KHODIJAH
A24051110
MEN AGRONOMI DAN HORTIKU
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
2009
ine max (L.)
BUSKULA
SITI KHODIJAH. Evaluasi Efektivitas Bahan Perekat dan Pelapis untuk Pelapisan Benih Kedelai (Glycine max (L.) Merr) dengan Cendawan Mikoriza Arbuskula. (Dibimbing oleh SATRIYAS ILYAS dan YENNI BAKHTIAR).
Penelitian ini bertujuan untuk mendapatkan bahan perekat dan pelapis
yang kompatibel dengan cendawan mikoriza arbuskula (CMA) terhadap pelapisan
benih kedelai. Penelitian ini dilaksanakan pada bulan April hingga Agustus 2009
di Laboratorium Agromikrobiologi dan di rumah kaca Balai Pengkajian
Bioteknologi, BPPT PUSPIPTEK Serpong, Tangerang.
Rancangan percobaan yang digunakan dalam penelitian ini adalah
Rancangan Kelompok Lengkap Teracak (RKLT) dengan dua faktor. Faktor
pertama adalah bahan perekat yang terdiri atas: kontrol (tanpa bahan perekat),
tapioka 5 % (b/v), dan molases 90 % (v/v). Faktor kedua adalah bahan pelapis
gambut dan gipsum yang terdiri atas beberapa perbandingan: 0:0; 0:100; 25:75;
50:50; 75:25; 100:0 (b/v). Inokulum CMA yang digunakan berupa spora yang
diperoleh dari hasil produksi Balai Pengkajian Bioteknologi BPPT dilapisi dengan
bahan perekat dan bahan pelapis. Proses pelapisan dilakukan dalam drum
granulator. Benih yang telah terlapisi kemudian ditanam pada media tanam
campuran tanah, kompos dan pasir (1 : 1 : 1), dan diamati perkembangannya di
rumah kaca.
Hasil penelitian ini menunjukkan bahwa pengaruh bahan perekat tapioka 5
% secara umum lebih baik daripada bahan perekat molases 90 % terhadap
beberapa parameter yang diamati. Benih yang diberi bahan perekat maupun tanpa
bahan perekat masih memiliki nilai daya tumbuh yang tinggi (92.6-98.1 %). Daya
tumbuh tertinggi ditunjukkan oleh bahan pelapis gambut:gipsum dengan
perbandingan 50:50. Kombinasi tanpa bahan perekat (kontrol) dengan bahan
pelapis gambut:gipsum 0:100 menghasilkan tinggi tanaman yang tertinggi pada 2
MST, sedangkan tinggi tanaman terendah pada kombinasi tanpa bahan perekat
dengan bahan pelapis gambut:gipsum 100:0. Hal ini diduga karena sifat gipsum
selain berfungsi sebagai bahan pelapis, gipsum juga dapat berfungsi sebagai bahan
yang sangat nyata terhadap jumlah daun pada 2 MST. Kombinasi tanpa bahan
perekat dan bahan pelapis gambut:gipsum (100:0) menghasilkan jumlah daun
terendah. Bahan perekat tapioka 5 % mampu meningkatkan bobot kering tajuk,
jumlah dan bobot kering bintil akar, persentase infeksi CMA serta jumlah spora
CMA. Bahan pelapis gambut:gipsum 50:50 mampu meningkatkan jumlah spora
inokulum CMA. Kombinasi bahan perekat tapioka 5 % dan bahan pelapis
gambut:gipsum 50:50 menghasilkan tinggi tanaman 3 MST, jumlah dan bobot
UNTUK PELAPISAN BENIH KEDELAI (Glycine max (L.)
Merr.) DENGAN CENDAWAN MIKORIZA ARBUSKULA
Skripsi sebagai salah satu syarat
untuk memperoleh gelar Sarjana Pertanian
pada Fakultas Pertanian Institut Pertanian Bogor
SITI KHODIJAH
A24051110
DEPARTEMEN AGRONOMI DAN HORTIKULTURA
FAKULTAS PERTANIAN
PELAPIS UNTUK PELAPISAN BENIH KEDELAI (Glycine
max (L.) Merr) DENGAN CENDAWAN MIKORIZA
ARBUSKULA
Nama : SITI KHODIJAH
NIM : A24051110
Menyetujui
Pembimbing I, Pembimbing II,
Prof. Dr. Ir. Satriyas Ilyas, MS Dra. Yenni Bakhtiar, M.Ag. Sc
NIP : 19590225 198203 2 001 NIP : 19660826 199203 2 001
Mengetahui :
Ketua Departemen Agronomi dan Hortikultura,
Dr. Ir. Agus Purwito, M.Sc. Agr NIP : 19611101 198703 1 003
Penulis adalah anak kelima dari lima bersaudara pasangan Bapak Gopalit
Gurukinayan dan Ibu Aman Kembaren yang dilahirkan di Kabupaten Karo,
Sumatera Utara pada tanggal 25 Desember 1985. Penulis menempuh jenjang
pendidikan dasar di SD Negeri 048 Suka Ramai, Kabupaten Kampar Riau pada
tahun 1998. Pada tahun 2002 penulis berhasil menyelesaikan pendidikan lanjutan
tingkat pertama di SLTP Budi Murni Lau Baleng Kabupaten Karo, Sumatera
Utara. Penulis menamatkan pendidikan menengah umumnya di SMU Negeri 1
Tualang Kabupaten Siak, Riau pada tahun 2005. Pada tahun yang sama, penulis
diterima sebagai mahasiswa Institut Pertanian Bogor melalui jalur BUD
(Beasiswa Utusan Daerah) Kabupaten Siak, Riau, dan tercatat sebagai mahasiswa
Departemen Agronomi dan Hortikultura, Fakultas Pertanian, IPB.
Selama masa perkuliahan di Institut Pertanian Bogor penulis adalah
penerima Beasiswa Utusan Daerah dari Kabupaten Siak. Tahun 2008, penulis
melaksanakan Kuliah Kerja Profesi (KKP) di Kabupaten Kuningan, Jawa Barat.
Penulis juga pernah menjadi Asisten Praktikum Mata Kuliah Dasar-dasar Ilmu
dan Teknologi Benih pada tahun 2008/2009. Penulis melakukan penelitian dan
menyusun skripsi sebagai salah satu syarat untuk memperoleh gelar Sarjana
Pertanian pada Fakultas Pertanian, Institut Pertanian Bogor dengan judul
“Evaluasi Efektivitas Bahan Perekat dan Pelapis untuk Pelapisan Benih Kedelai
Puji syukur penulis sampaikan kepada Allah SWT yang telah memberi
rahmat dan hidayah sehingga penulis dapat menyelesaikan skripsi ini. Skripsi ini
berjudul “Evaluasi Efektivitas Bahan Perekat dan Pelapis untuk Pelapisan
Benih Kedelai (Glycine max (L.) Merr.) dengan Cendawan Mikoriza Arbuskula”. Skripsi ini dibuat sebagai salah satu syarat untuk memperoleh gelar
Sarjana Pertanian di Fakultas Pertanian, Institut Pertanian Bogor.
Penulis mengucapkan terima kasih sebesar-besarnya kepada semua pihak
yang telah membantu dalam pelaksanaan penelitian dan penulisan skripsi ini.
Ucapan terima kasih penulis tujukan kepada:
1. Prof. Dr. Ir. Satriyas Ilyas, MS selaku pembimbing skripsi pertama yang
telah memberikan arahan dan bimbingan selama penyusunan tugas akhir
penulis.
2. Dra. Yenni Bakhtiar, M.Ag. Sc selaku pembimbing skripsi kedua yang
telah memberikan arahan dan bimbingan selama penyusunan tugas akhir
penulis.
3. Dr. Ir. Memen Surachman, M.Sc yang telah bersedia menjadi penguji,
terima kasih atas saran dan masukan yang diberikan.
4. Prof. Dr. Ir. H. M. H. Bintoro, M. Agr. sebagai pembimbing akademik
yang telah membimbing penulis selama studi di IPB.
5. Dr. Bambang Marwoto, Apt, M.Eng sebagai kepala Balai Pengkajian
Bioteknologi BPPT Serpong Tangerang, yang telah memberi izin dan
tempat bagi penulis untuk melaksanakan penelitian.
6. Farida RM, Ph.D dan para personil Laboratorium Agromikrobiologi Balai
Pengkajian Bioteknologi BPPT, pak Wahid, pak Firman, pak Asep, pak
Mahmud, terima kasih atas fasilitas dan bantuan yang diberikan selama
pelaksanaan penelitian.
7. Bapak, ibu, dan seluruh keluarga atas doa, cinta, motivasi dan kasih
Kabupaten Siak Sri Indrapura dan jajarannya, atas pemberian beasiswa
yang diberikan kapada penulis selama perkuliahan di IPB.
9. Teman-teman pringgoners (Neneng, Supatmi, Nani, Helni, Novia, Santi, Dyah, Putri, Vivi, Dede, Didin, Dibo) atas segala dukungan dan
kebersamaannya.
10.Warno, Shandra, Ratih, Yunus, dan para asisten Dastekben 2008/2009
serta teman-teman AGH’42 atas kebersamaan yang tak terlupakan.
11.Teman seperjuangan Anita Nurjanah selama penelitian di Serpong, terima
kasih atas semua bantuan yang diberikan.
Semoga hasil penelitian ini berguna bagi semua pihak yang memerlukan.
Bogor, Desember 2009
Halaman
Invigorasi Benih Kedelai... 5
Cendawan Mikoriza Arbuskula... 6
Nomor Halaman
1. Rekapitulasi Sidik Ragam Pengaruh Bahan Perekat dan
Bahan Pelapis serta Interaksinya terhadap Beberapa
Parameter Tanaman Kedelai ... 25
2. Pengaruh Bahan Perekat terhadap Daya Tumbuh Kedelai
pada 1 MST ... 26
3. Pengaruh Bahan Pelapis terhadap Daya Tumbuh Kedelai
pada 1 MST ... 26
4. Pengaruh Interaksi Bahan Perekat dan Bahan Pelapis terhadap
Tinggi Tanaman pada 2 MST ... 27
5. Pengaruh Interaksi Bahan Perekat dan Bahan Pelapis terhadap
Tinggi Tanaman pada 3 MST ... 27
6. Pengaruh Interaksi Bahan Perekat dan Bahan Pelapis terhadap
Jumlah Daun per Tanaman pada 2 MST ... 29
7. Pengaruh Bahan Perekat dan Bahan Pelapis terhadap
Bobot Kering Tajuk dan Bobot Kering Akar pada 7 MST ... 31
8. Pengaruh Interaksi Bahan Perekat dan Bahan Pelapis terhadap
Jumlah Bintil Akar pada 7 MST ... 32
9. Pengaruh Interaksi Bahan Perekat dan Bahan Pelapis terhadap
Bobot Kering Bintil Akar pada 7 MST ... 32
10. Pengaruh Bahan Perekat terhadap Persentase Infeksi Akar
Kedelai pada 12 MST ... 33
11. Pengaruh Bahan Perekat terhadap Jumlah Spora CMA
pada 12 MST ... 35
12. Pengaruh Bahan Pelapis terhadap Jumlah Spora CMA
pada 12 MST ... 35
13. Pengaruh Bahan Perekat dan Bahan Pelapis terhadap
Panjang Hifa Spora CMA ... 36
14. Pengaruh Bahan Perekat dan Bahan Pelapis terhadap
Nomor Halaman
1. Perekat Molases ... 12
2. Bagan Alir Penelitian ... 16
3. Drum Granulator yang Dimodifikasi ... 19
4. Benih Kedelai yang Diberi Bahan Perekat Tanpa Pelapis ... 19
5. Benih Kedelai yang Telah Diberi Bahan Perekat dan Pelapis ... 19
6. Tanaman Kedelai di Rumah Kaca ... 24
7. Pengaruh Bahan Perekat terhadap Jumlah Daun ... 28
8. Pengaruh Bahan Pelapis terhadap Jumlah Daun ... 29
9. Infeksi CMA pada Akar Kedelai 12 MST ... 34
Nomor Halaman
1. Sidik Ragam Pengaruh Bahan Perekat dan Bahan Pelapis
terhadap Daya Tumbuh Kedelai... 47
2. Sidik Ragam Pengaruh Bahan Perekat dan Bahan Pelapis
terhadap Tinggi Tanaman ... 47
3. Sidik Ragam Pengaruh Bahan Perekat dan Bahan Pelapis
terhadap Jumlah Daun per Tanaman ... 48
4. Sidik Ragam Pengaruh Bahan Perekat dan Bahan Pelapis
terhadap Bobot Kering Tajuk ... 49
5. Sidik Ragam Pengaruh Bahan Perekat dan Bahan Pelapis
terhadap Bobot Kering Akar ... 49
6. Sidik Ragam Pengaruh Bahan Perekat dan Bahan Pelapis
terhadap Jumlah Bintil Akar ... 49
7. Sidik Ragam Pengaruh Bahan Perekat dan Bahan Pelapis
terhadap Bobot Kering Bintil Akar ... 50
8. Sidik Ragam Pengaruh Bahan Perekat dan Bahan Pelapis
terhadap Persentase Infeksi CMA ... 50
9. Sidik Ragam Pengaruh Bahan Perekat dan Bahan Pelapis
Terhadap Jumlah Spora CMA ... 50
10. Sidik Ragam Pengaruh Bahan Perekat dan Bahan Pelapis
terhadap Bobot Basah Polong Hampa... 51
11. Metode Wet Sieving Berdasarkan Sylvia (1998) ... 51
PENDAHULUAN
Latar Belakang
Kedelai merupakan salah satu tanaman pangan penting di Indonesia dan
sebagai salah satu sumber protein nabati. Konsumsi kedelai masyarakat Indonesia
saat ini mencapai 2 juta ton per tahunnya, tetapi berdasarkan data BPS (2007)
rata-rata produksi kedelai dalam negeri hanya 608.263 ton, sehingga dibutuhkan
impor kedelai sebesar 1.4 juta ton (Deptan, 2008). Tingginya kebutuhan kedelai
tersebut mendorong perlunya peningkatan produksi kedelai di Indonesia. Produksi
kedelai dapat ditingkatkan melalui salah satu teknologi alternatif yaitu penyediaan
benih bermutu dengan teknik pelapisan benih.
Benih kedelai cepat sekali menurun mutunya. Benih yang telah mengalami
penurunan mutu dapat ditingkatkan vigornya melalui invigorasi. Salah satu
perlakuan invigorasi yang efektif adalah matriconditioning. Penelitian pada benih kedelai menunjukkan bahwa matriconditioning menggunakan arang sekam lebih baik dalam meningkatkan viabilitas dan vigor benih kedelai dibandingkan dengan
serbuk gergaji. Matriconditioning menggunakan bubuk arang sekam plus inokulan Bradyrhizobium japonicum dan Azospirillum lipoferum selama 12 jam terbukti dapat meningkatkan pertumbuhan tanaman dan hasil kedelai (Ilyas et al., 2003).
Cendawan mikoriza arbuskula (CMA) adalah suatu cendawan yang
bersimbiosis secara mutualisme dengan akar tanaman yang memiliki peranan
penting dalam siklus hara dan ekosistem. Cendawan mikoriza arbuskula sangat
bermanfaat bagi tanaman terutama dalam meningkatkan penyerapan unsur hara
fosfor (P), nitrogen (N), kalium (K) dan hara mikro seperti seng (Zn),
molybdenum (Mo), dan tembaga (Cu). Di samping itu CMA juga dapat
meningkatkan ketahanan tanaman terhadap kekeringan dan serangan patogen
akar, serta memperbaiki status hara tanah (Menge, 1984).
Bakhtiar et al. (2005) menyatakan bahwa tanaman yang diinokulasi dengan CMA memiliki perbedaan respon pertumbuhan dengan tanaman yang
tidak diinokulasi. Pertumbuhan tanaman memerlukan unsur hara dan air, salah
satu unsur yang terpenting adalah P. Tanpa adanya penambahan unsur P dalam
yang diinokulasi dengan CMA pertumbuhannya lebih tinggi dan daunnya
berwarna lebih hijau. Hal ini diduga karena adanya peningkatan penyerapan P
akibat meningkatnya aktivitas CMA.
Setiadi (2000) merinci berbagai peran CMA sebagai berikut : 1) perbaikan
nutrisi tanaman dan peningkatan pertumbuhan, 2) sebagai pelindung hayati ( bio-protection), 3) meningkatkan resistensi tanaman terhadap kekeringan, 4) terlibat dalam siklus bio-geo-kimia, 5) sinergis dengan mikroorganisme lain, dan 6)
mempertahankan keanekaragaman tumbuhan. Setiadi (2003) menambahkan
bahwa CMA sangat berperan dalam meningkatkan toleransi tanaman terhadap
kondisi lahan kritis, yang berupa kekeringan dan banyak terdapat logam-logam
berat. Selain perbaikan nutrisi (terutama fosfat) CMA juga mampu meningkatkan
daya tahan tanaman terhadap serangan patogen tular tanah. Cendawan mikoriza
arbuskula dapat membantu pertumbuhan tanaman pada tanah-tanah yang tercemar
logam berat seperti halnya pada lahan-lahan pasca tambang. Dengan demikian
CMA selain dapat digunakan sebagai bio-protection, juga berfungsi penting sebagai bio-remediator bagi tanah-tanah yang tercemar logam berat.
Cara aplikasi CMA yang biasa diterapkan di lapangan adalah dengan
memberikan inokulum spora CMA pada daerah akar tanaman yang sedang aktif
tumbuh atau menambahkan inokulum CMA secara langsung pada lubang tanam.
Cara aplikasi tersebut dinilai kurang efisien karena inokulum CMA hanya dapat
diaplikasikan pada tanaman yang sudah tumbuh aktif. Selain itu, cara
mengaplikasikannya di lapangan membutuhkan lebih banyak waktu, tenaga dan
biaya yang lebih tinggi. Oleh karena itu, diperlukan suatu penelitian mengenai
cara aplikasi CMA yang dapat menyediakan benih bermikoriza sebelum ditanam
sehingga mempermudah dalam proses transportasi.
Salah satu alternatif cara aplikasi yang dilakukan pada penelitian ini
adalah memanfaatkan bahan perekat dan bahan pelapis benih sebagai agens
pembawa inokulum spora CMA. Bahan perekat yang digunakan adalah tapioka
dan molases. Bahan perekat tersebut digunakan sebagai binding agent antara benih kedelai dan spora CMA. Selain itu, tapioka dan molases mudah diperoleh
dan harganya relatif murah. Bahan pelapis yang digunakan adalah gambut dan
(2003), gambut mempunyai karakteristik yang khas yang tidak dimiliki oleh jenis
tanah yang lain. Sifat fisik yang dimiliki adalah mampu menyerap air yang sangat
tinggi dan sebaliknya apabila dalam kondisi yang kering gambut sangat ringan
dengan berat volume yang sangat rendah. Sementara itu, menurut Purwadi (1993),
gipsum berfungsi sebagai sumber mineral dan sebagai lapisan pelindung.
Tujuan
Penelitian ini bertujuan untuk mendapatkan bahan perekat dan bahan
pelapis yang kompatibel dengan CMA terhadap pelapisan benih kedelai.
Hipotesis
1. Terdapat bahan perekat yang efektif dan kompatibel dengan CMA terhadap
pelapisan benih kedelai.
2. Terdapat bahan pelapis yang efektif dan kompatibel dengan CMA terhadap
pelapisan benih kedelai.
3. Terdapat interaksi antara bahan perekat dan bahan pelapis yang efektif dan
TINJAUAN PUSTAKA
Botani Tanaman Kedelai
Kedelai termasuk tanaman kacang-kacangan dengan klasifikasi lengkap
tanaman kedelai adalah sebagai berikut, divisi Spermatophyta, subdivisi
Angiospermae, kelas Dicotyledoneae, ordo Rasales, famili Leguminosae, genus
Glycine, spesies Glycine max (L.) Merril. Sistem perakaran kedelai terdiri atas dua macam, yaitu akar tunggang dan akar sekunder (serabut) yang tumbuh dari
akar tunggang. Selain itu, kedelai juga seringkali membentuk akar adventif yang
tumbuh dari bagian bawah hipokotil. Pada umumnya, akar adventif terjadi karena
cekaman tertentu, misalnya kadar air tanah yang terlalu tinggi (Adisarwanto,
2007).
Biji kedelai berkeping dua yang terbungkus oleh kulit biji. Embrio terletak
di antara keping biji. Warna kulit biji bermacam-macam ada yang kuning, hitam,
hijau dan cokelat. Bentuk biji kedelai pada umumnya bulat lonjong, ada yang
bundar atau bulat agak pipih. Besar biji bervariasi, tergantung varietas. Di
Indonesia besar biji bervariasi 6-30 g (Suprapto, 2001).
Adisarwanto (2007) menyatakan bintil akar dapat mengikat nitrogen dari
udara saat berumur 10-12 hari setelah tanam, tergantung kondisi tanah dan suhu.
Kelembaban tanah yang cukup dan suhu tanah sekitar 25 0C sangat mendukung
pertumbuhan bintil akar. Bintil akar dapat terbentuk pada tanaman kedelai muda
setelah ada akar rambut pada akar utama atau akar cabang. Bintil akar dibentuk
oleh Rhizobium japonicum. Batang berasal dari poros embrio. Selama perkecambahan, hipokotil merupakan bagian batang kedelai, mulai dari pangkal
akar hingga kotiledon. Hipokotil dan dua kotiledon yang masih melekat pada
hipokotil akan menembus permukaan tanah.
Menurut Sumarno (1985), tanaman kedelai termasuk tanaman hari panjang
bila ditanam di Amerika Serikat. Varietas yang beradaptasi di daerah yang
panjang harinya lebih dari 12 jam, umumnya akan lebih cepat berbunga bila
ditanam di daerah yang panjang harinya 12 jam. Sebaliknya, kedelai dari daerah
tropik akan berbunga lebih lambat bila ditanam di daerah beriklim sedang yang
mempersingkat pertumbuhan vegetatif dan mempercepat waktu berbunga serta
waktu panen. Inilah yang menyebabkan varietas unggul dari Amerika Serikat akan
rendah hasilnya bila ditanam di Indonesia, karena adanya pemendekan
fotoperiode. Di negara-negara sub-tropik panjang hari berkisar 13-15 jam,
sedangkan di negara tropik hanya 12 jam.
Toleransi kemasaman tanah bagi kedelai adalah 5.8-7.0. Pada pH kurang
dari 5.5, pertumbuhan akan terhambat karena adanya keracunan aluminium, serta
pertumbuhan bakteri dan proses nitrifikasi berjalan kurang baik. Jenis tanah yang
baik untuk kedelai antara lain alluvial, regosol, grumosol, latosol, dan andosol.
Pada tanah podsolik merah kuning dan tanah yang mengandung pasir kwarsa,
pertumbuhan kedelai kurang baik, kecuali jika tanah diberi pupuk organik atau
kompos dalam jumlah yang cukup (Purwono dan Purnamawati, 2007).
Invigorasi Benih Kedelai
Menurut Khan dalam Ilyas (2005), invigorasi adalah upaya
memperlakukan benih sebelum tanam dengan cara menyeimbangkan potensial air
benih untuk merangsang kegiatan metabolisme di dalam benih sehingga benih
siap berkecambah tetapi struktur penting embrio yaitu radikula belum muncul.
Selama proses invigorasi, terjadi peningkatan kecepatan dan keserempakan
perkecambahan serta mengurangi tekanan lingkungan yang kurang
menguntungkan. Salah satu perlakuan invigorasi yang telah terbukti efektif pada
berbagai jenis benih adalah matriconditioning. Matriconditioning adalah perlakuan hidrasi benih terkontrol dengan media padat lembab yang didominasi
oleh kekuatan matriks untuk memperbaiki pertumbuhan bibit. Perlakuan
peningkatan mutu benih seperti matriconditioning dapat diintegrasikan dengan hormon untuk meningkatkan perkecambahan, atau dengan pestisida, biopestisida,
dan mikroba yang menguntungkan untuk melawan penyakit benih dan bibit
selama awal penanaman, atau untuk memperbaiki status hara, pertumbuhan dan
hasil tanaman.
Menurut Fadhilah (2003), inkorporasi minyak cengkeh 0.05 % atau
dan Phoma sp. yang terbawa benih kedelai serta meningkatkan persentase kecambah non fitotoksik dibandingkan dengan kontrol. Hasil penelitian
Suhartiningsih (2003), perlakuan matriconditioning plus inokulan Bradyrhizobium japonicum dan Azospirilum lipoferum pada suhu kamar dapat meningkatkan daya berkecambah, indeks vigor, jumlah nodul, bobot kering akar dan bobot tajuk
tanaman kedelai. Selanjutnya Faisal (2005) melaporkan perlakuan
matriconditioning plus inokulan B. japonicum dan A. lipoferum selama 12 jam mampu meningkatkan daya berkecambah, indeks vigor benih, laju pertumbuhan
kecambah dan bobot kering kecambah normal masing-masing sebesar 2.8 %, 9.5
%, 7.9 %, 7.6 % dan 15.1 %.
Cendawan Mikoriza Arbuskula
Cendawan mikoriza arbuskula (CMA) merupakan struktur perakaran yang
terbentuk sebagai manifestasi adanya simbiosis mutualisme antara cendawan
(myces) dan perakaran (rhiza). Cendawan mikoriza arbuskula adalah simbion
obligat dari filum Glomeromycota (secara formal dijelaskan sebagai ordo Glomales) yang diperkirakan ditemukan sekitar 400-500 juta tahun yang lalu.
Cendawan mikoriza arbuskula dapat dilihat dari ciri-ciri utamanya, yaitu adanya
arbuskula dan atau vesikel di dalam korteks akar (Kirk et al., 2005).
Hampir sebagian besar tanaman darat di dunia pada kondisi alami,
bersimbiosis dengan mikoriza. Namun demikian CMA adalah tipe mikoriza yang
paling umum, karena dijumpai pada sekitar 80 % spesies tanaman. Cendawan
mikoriza arbuskula dalam asosiasinya dengan tanaman, membentuk organ baik di
dalam maupun di luar akar tanaman. Cendawan mikoriza arbuskula memiliki
beberapa struktur yaitu : 1) arbuskula adalah percabangan dikotomus yang intensif
dari hifa intraseluler, berperan dalam transfer nutrisi antara cendawan dan
tanaman inang, 2) vesikula adalah struktur yang berdinding tipis berisi lipid yang
biasanya terbentuk dalam ruang interseluler, berfungsi sebagai cadangan makanan
dan juga sebagai propagul reproduktif, 3) sel-sel auksilar yang terbentuk di dalam
tanah dan dapat membentuk coiled, 4) spora aseksual yang berasal dari diferensiasi hifa vegetatif, berupa spora reproduktif yang dapat dibentuk baik di
Cendawan mikoriza arbuskula tidak dapat menghasilkan karbon sendiri
tanpa tanaman. Oleh karena itu, peran CMA dalam fotosintesis dapat memberikan
efek tidak langsung pada tanaman, kontaminan, dan sistem tanah. Cendawan
mikoriza arbuskula diketahui dapat meningkatkan daya tahan tanaman terhadap
berbagai macam stres termasuk hara, kekeringan, logam, salinitas, dan patogen,
yang semuanya dapat mempengaruhi keberhasilan hidup tanaman (Khan, 2006).
Menurut Muin (2003), kolonisasi akar dipengaruhi oleh suhu, eksudat akar
dan kondisi fisiologis propagul, tetapi suhu merupakan faktor utama yang
mempengaruhi perkecambahan spora, pertumbuhan hifa, kolonisasi, dan
sporulasi. Sieverding (1991) menyatakan, kolonisasi CMA dipengaruhi oleh
ketersediaan unsur P yang tinggi, yaitu gangguan terhadap sporulasi dan
penurunan kecepatan pemanjangan akar. Cahaya terutama intensitasnya
mempengaruhi CMA karena berhubungan dengan suplai karbon yang dibutuhkan
oleh cendawan. Tumbuhan dengan kecepatan berfotosintesis tinggi yang
dibutuhkan cenderung memperbaiki suplai karbon bagi CMA. Respon tanaman
bermikoriza terhadap suhu berbeda-beda menurut spesies cendawan yang
mengkoloninya. Pada suhu tinggi mengakibatkan penurunan viabilitas spora dan
bahkan kematian spora.
Menurut Setiadi (2003), cendawan mikoriza arbuskula mempunyai
berbagai peran penting baik dalam peningkatan produktivitas tanaman melalui
peningkatan penyerapan unsur hara maupun toleransi terhadap kondisi stres air
dan toksisitas logam berat. Pada tanaman yang bermikoriza, respon tanaman yang
mengalami cekaman kekeringan cenderung lebih dapat bertahan dari kerusakan
korteks dibanding tanaman tanpa mikoriza. Gangguan terhadap perakaran akibat
cekaman kekeringan pengaruhnya tidak akan permanen pada akar-akar yang
bemikoriza. Akar yang bermikoriza akan cepat kembali pulih setelah periode
kekeringan berlalu. Peranan langsung mikoriza adalah membantu akar dalam
meningkatkan penyerapan air. Hal ini karena hifa cendawan masih mampu
menyerap air dari pori-pori tanah pada saat akar tanaman sudah mengalami
kesulitan mengabsorbsi air. Kemampuan menyerap air dari pori-pori tanah ini
dikarenakan hifa utama cendawan mikoriza di luar akar membentuk percabangan
m. Berdasarkan kepada banyaknya peranan CMA dalam peningkatan
produktivitas tanaman, maka CMA dapat merupakan salah satu alternatif
teknologi berupa pupuk hayati (biofertilizer) untuk pengembangan tanaman pertanian pada umumnya. Pemanfaatan pupuk hayati tersebut adalah berupa
inokulasi cendawan mikoriza arbuskula dari isolat yang telah terbukti efektif
dalam meningkatkan produktivitas tanaman.
Inokulasi berarti mengintroduksi propagul cendawan mikoriza arbuskula
yang telah terpilih ke daerah rizosfer dari tanaman target. Cara yang paling umum
adalah dengan menempatkan inokulum cendawan mikoriza arbuskula di bawah
biji atau semai sebelum penanaman atau dengan cara lain yaitu melalui
penyelimutan biji (Sylvia, 1998). Beberapa penelitian menunjukkan bahwa
simbiosis CMA dengan tanaman dapat meningkatkan serapan P tanaman dan hara
lainnya, meningkatkan ketahanan tanaman terhadap patogen tanah, dan
kekeringan. Cendawan mikoriza arbuskula dapat menggantikan sebagian dari
kebutuhan pupuk bagi anakan tanaman yang ditanam pada kondisi tanah yang
buruk. Cendawan mikoriza arbuskula dapat menggantikan kira-kira 50 % dari
kebutuhan fosfor, 40 % dari kebutuhan nitrogen dan 25 % dari kebutuhan kalium
untuk jenis Leucaena leucocephala (De La Cruz, 1981).
Menurut Santosa dalam Oktavia et al. (2000), pertumbuhan kedelai sangat tergantung pada mikoriza ini, karena ketersediaan P dalam jumlah optimal dapat
mempercepat pematangan dan pengangkutan nutrisi dari bagian lain ke biji,
sehingga pembentukan polong dan biji dapat sempurna. Secara tidak langsung
CMA berpengaruh terhadap pengikatan N, yang ditunjukkan dengan sumbangan P
oleh CMA untuk penambatan N pada simbiosis akar dengan rhizobium, di lain
pihak bintil akar menyediakan N untuk pertumbuhan dan perkembangan CMA.
Penambatan N hanya berjalan jika tersedia P dalam jumlah yang cukup
diperakaran. Menurut Bakhtiar et al. (2005), inokulasi CMA meningkatkan bobot kering akar dan daun bibit tanaman kelapa sawit. Bobot kering akar tertinggi 1.22
g dicapai ketika bibit kelapa sawit ditanam pada media tanah : pasir : kompos (1:
6: 3) dan diinokulasikan dengan CMA Gigaspora sp. Sementara untuk bobot kering daun, media tanah : pasir : kompos (1: 5: 4) memberikan bobot tertinggi
Pelapisan Benih (Seed Coating)
Menurut Mugnisyah dan Setiawan (2004), sebelum dikemas benih dapat
diperlakukan dan atau dirawat. Perlakuan dan perawatan benih meliputi : (1)
desinfeksi benih yang bertujuan memberantas hama dan penyakit terbawa benih,
(2) proteksi benih yang bertujuan untuk melindungi benih terhadap hama dan
penyakit yang mungkin terjangkit dari dalam tanah atau dari udara ketika bibit
muncul.
McDonald dan Kwong (2005) menyatakan bahwa priming, pelleting, dan coating merupakan teknologi yang telah diaplikasikan pada benih tanaman sayuran dan tanaman hias dalam skala komersial. Copeland dan McDonald (2001)
mengemukakan bahwa pelapisan benih merupakan salah satu metode seed enhancement, yaitu suatu metode untuk memperbaiki mutu benih menjadi lebih baik melalui penambahan bahan kimia pada lapisan luar benih yang dapat
mengendalikan dan meningkatkan perkecambahan benih. Ada dua tipe pelapisan
benih yang telah dikomersialkan, yaitu seed coating dan seed pelleting. Rushing dalam Copeland dan McDonald (2001) menyatakan bahwa polimer untuk pelapis
benih idealnya memiliki karakter sebagai berikut: (1) water-based polymer, (2) nilai viskositas yang rendah, (3) memiliki konsentrasi yang tinggi pada saat padat,
(4) memiliki pengaturan keseimbangan antara hidrofilik dengan hidrofobik, (5)
membentuk lapisan tipis keras selama pengeringan.
Kuswanto (2003) menyatakan bahwa pelapisan benih merupakan proses
pembungkusan benih dengan zat tertentu, yang bertujuan sebagai berikut:
meningkatkan kinerja benih pada waktu benih dikecambahkan, melindungi benih
dari gangguan atau pengaruh kondisi lingkungan selama dalam penyimpanan atau
dalam rantai pemasaran. Selain itu, pelapisan benih juga dapat mempertahankan
kadar air benih, menyeragamkan ukuran benih, dalam meningkatkan efisiensi
pemakaian alat penanaman benih sehingga dapat digunakan untuk menanam
berbagai jenis benih dan meningkatkan ketelitian pada waktu penanaman secara
langsung (direct seeding), memudahkan penyimpanan benih dan mengurangi dampak kondisi tempat penyimpanan, serta memperpanjang daya simpan benih.
Mugnisyah dan Setiawan (2004) menyatakan bahwa manfaat pelapisan
menjadi teratur sehingga memungkinkannya disemai dengan jarak tanam yang
tepat. Panie (2005) dalam penelitiannya menyatakan bahwa formula coating meningkatkan keseragaman penampilan fisik benih cabai. Benih coating dengan formula 0.5 g/ml arabic gum + pewarna hijau memiliki penampilan fisik yang lebih baik, yaitu permukaan yang mengkilap.
Kuswanto (2003) menyatakan bahwa ada beberapa syarat bahan pelapis
benih yaitu dapat mempertahankan kadar air benih selama penyimpanan, dapat
menghambat laju respirasi seminimal mungkin, tidak bersifat toksik terhadap
benih, bersifat mudah pecah dan larut apabila terkena air, bersifat porus, tidak
mudah mencair, bersifat higroskopis, bersifat sebagai bahan perambat dan
penyimpan panas yang rendah, dan harga relatif murah sehingga dapat menekan
harga benih.
Tapioka
Tapioka merupakan hasil pengolahan dari ubi kayu yang banyak
digunakan dalam berbagai industri sebagai bahan pengental, bahan pengisi dan
bahan pengikat. Tapioka adalah pati yang berasal dari hasil ekstraksi singkong
yang telah mengalami pencucian dan pengeringan. Pati tapioka mempunyai sifat
yang menguntungkan dalam pengolahan pangan, kemurnian larutan yang tinggi,
kekuatan gel yang baik, dan daya rekat tinggi sehingga banyak digunakan sebagai
bahan perekat. Komposisi pati yang tinggi memungkinkan pati yang digunakan
sebagai sumber karbohidrat, kadar amilosa tepung tapioka sekitar 23 %
menjadikan alasan yang kuat sebagai bahan pengikat karena amilosa berperan
besar dalam gelatinisasi (Raharjo, 1997).
Prinsip pengolahan tepung tapioka melalui beberapa tahap antara lain: (1)
pemecahan sel dan pengambilan granula pati dari bagian lain yang tidak larut, (2)
pengambilan pati dengan penambahan air, (3) penghilangan air, (4) penepungan
agar mendapatkan tepung yang dikehendaki. Komposisi kimia pati tapioka (per
100 gram bahan) adalah energi 307 kalori, kadar air 9.1 %, karbohidrat 88.2 %,
protein 1.1 %, lemak 0.5 %, fosfor 125 mg, kalsium 84 mg, dan besi 1 mg
Tapioka merupakan bahan yang sering digunakan sebagai perekat karena
mudah didapat dan harganya yang relatif murah. Kelemahan penggunaan tapioka
sebagai perekat yaitu akan sedikit berpengaruh pada penurunan nilai kalor produk
dibandingkan bahan bakunya. Selain itu, produk yang dihasilkan kurang tahan
terhadap kelembaban. Hal ini disebabkan tapioka memiliki sifat dapat menyerap
air dari udara. Penambahan optimal perekat sebaiknya tidak lebih dari 5 %
(Sudrajat dan Soleh, 1994).
Tepung tapioka merupakan hasil ekstraksi pati ubi kayu yang telah
mengalami proses pencucian secara sempurna serta dilanjutkan dengan
pengeringan. Proses ekstraksi relatif mudah, karena kandungan protein dan
lemaknya yang rendah. Tepung tapioka hampir seluruhnya terdiri dari pati.
Ukuran granula pati tapioka berkisar antara 5-35 mikron. Pati ubi kayu terdiri atas
molekul amilosa dan amilopektin yang jumlahnya berbeda-beda tergantung jenis
patinya. Tepung tapioka yang baik adalah tepung yang tidak menggumpal dan
memiliki kehalusan yang baik (Makfoeld, 1982).
Fleche (1985) menyatakan bahwa granula pati tidak larut dalam air di
bawah 50 0C, dan apabila suspensi pati dipanaskan di bawah suhu kritis maka
granula akan menyerap air dan mengembang membentuk pasta kental.
Kemampuan pati menghasilkan pasta kental ketika dipanaskan dalam air, yang
disebut dengan sifat hidrokoloid, membuatnya sesuai untuk berbagai aplikasi
seperti pada pembuatan makanan, kertas, tekstil, perekat, dan obat-obatan.
Molases
Molases merupakan cairan kental, rasanya agak manis dan berwarna
cokelat gelap hasil buangan dari pabrik pembuatan gula tebu. Menurut Paturau
(1982), molases adalah keluaran terakhir yang diperoleh dari pembuatan gula tebu
setelah melalui kristalisasi berulang dan merupakan sisa sirup yang tidak dapat
mengkristal lagi dengan perlakuan yang sederhana. Molases dapat digunakan
secara langsung atau dapat dijadikan bahan baku pembuatan produk-produk yang
bernilai ekonomis tinggi, misalnya untuk kecap, pupuk, pakan ternak, ataupun
industri fermentasi seperti alkohol, turunan alkaloid, asam asetat, butanol, asam
bahan organik, anorga
rganik dan air. Sekitar 52 % dari molases meru
ktosa dan glukosa, 10 % atau lebih garam or
ebihnya bahan organik non gula (Baikow, 1982
Gambar 1. Perekat Molases
turau (1982), molases merupakan sumber ener
an gula pereduksi 10-30 %. Beberapa contoh
manosa, fruktosa, laktosa, dan maltosa.
a yang mudah dicerna dan dapat langsung diser
memperoleh energi. Menurut Oktavia (20
un murbei dapat meningkatkan absorpsi
sa menyebabkan energi lebih siap pakai un
nyerapan lebih efisien untuk proses pertumbu
hasil analisis komposisi molases Indonesia ter
89 %, air 20.33 %, abu 13.09 %, dan total gula
Gambut
ndriesse (1988), gambut adalah tanah organ
h organik adalah tanah gambut. Sebagian pe
an istilah tanah hitam, karena warnanya hita
lainnya. Tanah gambut telah mengalami per
bagian tumbuhan aslinya tidak dikenali lagi
disebut tanah bergambut. Perbedaan diantara
i (dan karena itu lebih terdekomposisi), denga
ndisi berawal dengan kondisi anaerobik yang
karbohidrat nampak terdekomposisi semp
yai kandungan yang rendah untuk senyawa org
Gambut merupakan material atau bahan organik yang tertimbun secara
alami dalam keadaan basah berlebih dan mengalami dekomposisi secara lambat
dalam keadaan anaerobik. Komposisi penyusun bahan organik gambut lebih
didominasi oleh lignin, sedangkan kandungan selulosa dan hemiselulosa terdapat
dalam jumlah yang sedikit bahkan tidak terukur karena senyawa-senyawa tersebut
mudah terdekomposisi (Dohong, 2001). Jenis gambut yang dapat digunakan untuk
pelapisan benih adalah gambut berserat (fibrous/sedge peat) yaitu gambut yang terdiri atas campuran tanaman sphagnum dan rumputan. Gambut yang berasal dari serat-seratan tergolong gambut yang subur (eutropik) dan kaya akan hara mineral (Andriesse, 1988).
Gambut mempunyai karakteristik yang khas yang tidak dimiliki oleh jenis
tanah yang lain. Sifat fisik yang dimiliki adalah mampu menyerap air yang sangat
tinggi. Sebaliknya apabila dalam kondisi yang kering (kering berkelanjutan),
gambut sangat ringan dengan berat volume yang sangat rendah (0.1-0.2 g/cm2)
dan mempunyai sifat yang hidrofobik (sulit menyerap air) dan akan mengambang
apabila terkena air. Sedangkan sifat kimianya, gambut sangat tergantung pada
jenis tumbuhan yang membentuk gambut, keadaan tanah dasarnya, pengaruh luar
(seperti endapan sungai/banjir, endapan vulkanis) dan sebagainya (Budianta, 2003).
Wahyunto et al. (2005) menyatakan bahwa tanah gambut memegang peranan penting dalam sistem hidrologi lahan rawa. Gambut pada kondisi rawa,
dicirikan oleh kandungan lignin dan selulosa yang tinggi. Salah satu sifat gambut yang berperan dalam sistem hidrologi adalah kemampuan gambut menahan air
hingga 300-800 % dari bobotnya. Selain kemampuan tersebut, gambut juga
mempunyai kemampuan lepas air yang juga besar. Gambut Indonesia memiliki
karbohidrat yang sangat rendah, dan sifatnya berbeda dengan gambut yang berada
di daerah subtropis.
Gipsum
Gipsum adalah suatu mineral alam yang ditambang pertama kalinya pada
tahun 1770 di daerah Montmart (bagian dari Paris) oleh karenanya gipsum
berwarna putih (Soempeno, 1984). Menurut Memed et al. (1992), gipsum memiliki sifat paling umum yaitu mudah mengikat dan melepas air. Gipsum
terdiri atas dua molekul hidrat dengan rumus kimia CaSO4.2H2O. Gipsum dalam
bentuk murni berupa kristal berwarna putih dan berwarna abu-abu, kuning, jingga
atau hitam bila kurang murni. Selanjutnya Memed et al. (1992) menyebutkan bahwa dalam penggunaannya gipsum dapat digolongkan menjadi dua macam
seperti dijelaskan berikut ini :
1. Gipsum yang belum mengalami proses kalsinasi, gipsum ini dipergunakan
dalam pembuatan semen Portland dan sebagai pupuk. Jenis ini meliputi 28
% dari seluruh volume perdagangan.
2. Gipsum yang mengalami proses kalsinasi, sebagian besar gipsum ini
digunakan sebagai bahan bangunan, plaster of Paris, bahan dasar untuk pembuatan kapur, badak, cetakan alat keramik, tuangan logam, gigi dan
sebagainya. Jumlah tersebut meliputi 72 % dari seluruh volume
perdagangan.
Gipsum yang dikenal dalam perdagangan adalah gips yang telah
mengalami pemanasan yang akan menghasilkan hemyhidrat atau lebih dikenal dengan rumus CaSO4.1/2H2O (Balai Penelitian dan Pengembangan Industri, 1981).
Gipsum berfungsi sebagai sumber mineral dan sebagai lapisan pelindung. Gipsum
mempunyai waktu pengerasan yang relatif pendek yaitu sekitar 10 menit. Waktu
pengerasan gipsum bervariasi tergantung pada kandungan bahan dan airnya
(Purwadi, 1993).
Gipsum sebagai perekat mineral mempunyai sifat yang lebih baik
dibandingkan dengan perekat organik lainnya karena tidak menimbulkan
pencemaran udara, murah, tahan api, tahan deteriorasi oleh faktor biologis dan
tahan terhadap zat kimia (Purwadi, 1993). Gipsum cepat mengeras, sehingga
dalam pembuatan papan gipsum harus digunakan bahan kimia untuk
memperlambat proses pengerasan tanpa mengubah sifat gipsum sebagai perekat
BAHAN DAN METODE
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan April hingga Agustus 2009 di
Laboratorium Agromikrobiologi dan di rumah kaca Balai Pengkajian
Bioteknologi, BPPT PUSPIPTEK Serpong, Tangerang.
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini adalah benih kedelai varietas
Wilis yang dipanen pada bulan Maret 2009 yang diperoleh dari Balai Penelitian
Bioteknologi dan Sumberdaya Genetik Pertanian, Bogor. Bahan lain yang
digunakan adalah gambut, gipsum, molases, tapioka, spora CMA produksi Balai
Pengkajian Bioteknologi BPPT, media agar, 10 % KOH, larutan trypan blue,
larutan lactogliserol, gentamycin, streptomycin, alkohol 70 %, membran sterilisasi
spora, tanah, kompos, pasir steril, polibag, dan kertas label.
Alat-alat yang digunakan antara lain cawan petri, gelas beker, erlenmeyer,
stirer, gelas ukur, pinset, bunsen, otoklaf, gunting, aluminium foil, laminar air flow, timbangan analitik, oven 105 0C, desikator, alat penyaring, alat pengaduk, tabung vacum, mikroskop stereo, mikroskop konfokal, inkubator, modifikasi
drum granulator,alat tulis dan alat-alat penunjang lainnya.
Metode Penelitian
Rancangan percobaan yang digunakan dalam penelitian ini adalah
Rancangan Kelompok Lengkap Teracak (RKLT) dengan dua faktor. Faktor
pertama adalah bahan perekat yang terdiri atas: kontrol (tanpa bahan perekat),
tapioka 5 % (b/v), dan molases 90 % (v/v). Faktor kedua adalah bahan pelapis
berupa campuran gambut dan gipsum yang terdiri atas beberapa perbandingan:
0:0; 0:100; 25:75; 50:50; 75:25; 100:0.
Kedua faktor perlakuan tersebut dikombinasikan sehingga dalam
penelitian ini terdapat 3 x 6 x 3 = 18 kombinasi perlakuan, yang masing-masing
Penelitian ini terdiri atas percobaan pendahuluan yang meliputi penentuan
konsentrasi bahan perekat, persiapan bahan perekat tapioka dan molases,
persiapan bahan pelapis gambut dan gipsum, proses pelapisan benih. Percobaan
dilanjutkan dengan pelaksanaan di lapangan yang meliputi persiapan media tanam
tanah : kompos : pasir dengan perbandingan 1 : 1 : 1, penanaman benih yang telah
terlapisi pada media tanam, pemeliharaan, dan pemanenan.
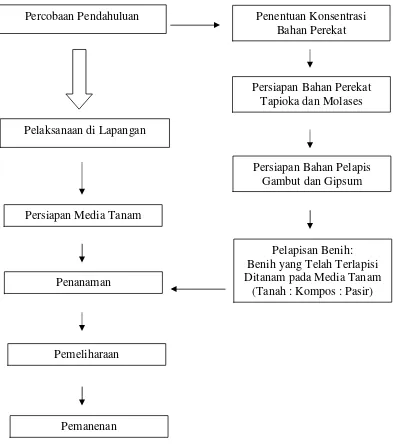
Gambar 2. Bagan Alir Penelitian Percobaan Pendahuluan
Persiapan Bahan Perekat Tapioka dan Molases
Persiapan Bahan Pelapis Gambut dan Gipsum
Pelapisan Benih: Benih yang Telah Terlapisi Ditanam pada Media Tanam
(Tanah : Kompos : Pasir) Pelaksanaan di Lapangan
Persiapan Media Tanam
Penanaman
Pemeliharaan
Pemanenan
Model linier dari rancangan percobaan yang digunakan adalah sebagai
αi = pengaruh perlakuan bahan perekat taraf ke-i
βj = pengaruh perlakuan bahan pelapis taraf ke-j
(αβ)ij = pengaruh interaksi perlakuan bahan perekat taraf ke-i dan pengaruh
perlakuan bahan pelapis taraf ke-j
γk = pengaruh ulangan ke-k (k = 1, 2, 3)
εijk = pengaruh galat percobaan terhadap bahan perekat taraf ke-i, bahan pelapis
taraf ke-j dan ulangan ke-k
Data yang diperoleh diuji dengan uji F dan apabila menunjukkan pengaruh
nyata maka dilakukan uji lanjut dengan Duncan Multiple Range Test (DMRT) taraf 5 %.
Pelaksanaan Penelitian
Percobaan pendahuluan
Kegiatan awal yang dilakukan sebelum pelapisan benih adalah
menentukan konsentrasi bahan perekat tapioka dan molases yang optimal untuk
digunakan selanjutnya sebagai bahan perekat. Bahan perekat optimal artinya,
apabila penambahan tapioka lebih dari 5 % maka akan menyebabkan kekentalan,
dan penggunaan molases kurang dari 90 % akan menyebabkan terlalu encer untuk
pelapisan benih. Konsentrasi bahan perekat yang diuji dimulai dari konsentrasi
tapioka 5 %, tapioka 10 %, molases 5 % hingga 100 % (b/v). Hasil pengujian
menunjukkan, konsentrasi yang optimal yaitu konsentrasi tapioka 5 % (b/v) dan
molases 90 % (v/v). Perbandingan benih : perekat : pelapis adalah 10 : 1 : 1.
a. Persiapan bahan perekat
Bahan perekat yang digunakan adalah tapioka dengan konsentrasi 5 %
(b/v) dan molases 90 % (v/v). Bahan perekat tersebut dimasukkan ke dalam gelas
b. Persiapan bahan pelapis gambut dan gipsum
Bahan gambut yang digunakan adalah gambut dari Rawapening, karena
tidak semua jenis gambut dapat digunakan sebagai bahan pelapis benih. Gambut
ini mengandung hemiselulosa, selulosa, lignin, kutin, bitumens, dan asam humik.
Gambut ini termasuk jenis gambut berserat yang subur dan kaya akan hara
mineral dengan kisaran pH 6-7. Sebelum digunakan gambut digiling halus hingga
lolos saringan 100 mesh. Bahan lain yang digunakan sebagai campuran untuk
pelapis benih adalah gipsum. Gipsum yang digunakan berukuran 100 mesh yang
terlebih dahulu disterilisasi dengan oven pada suhu 100 0C selama 2 jam. Gambut
dan gipsum kemudian dicampur dalam ruang semi steril dengan perbandingan:
0:0; 0:100; 25:75; 50:50; 75:25; 100:0.
c. Pelapisan benih
Terlebih dahulu benih dicuci dengan air bersih, ditiriskan dan kemudian
dikering-anginkan. Benih kemudian dilapisi dengan bahan perekat dalam
modifikasi drum granulator karena benih yang digunakan jumlahnya sedikit.
Inokulum CMA berupa spora yang diperoleh dari hasil produksi Balai Pengkajian
Bioteknologi BPPT dicampur dengan bahan perekat. Sebelum inokulum spora
CMA dicampur dengan bahan perekat terlebih dahulu dilakukan perhitungan
kerapatan jumlah spora CMA sehingga ditentukan 50 spora per satu butir benih.
Setelah bahan perekat terlapisi dengan baik pada benih, dengan segera
benih dimasukkan ke dalam bahan pelapis gambut dan gipsum. Pencampuran ini
juga dilakukan dalam modifikasi drum granulator (Gambar 3). Akhirnya, setelah
benih terlapisi oleh bahan pelapis, benih segera dilapisi dengan bahan pelindung
berupa gipsum sehingga terbentuk lapisan pelindung. Proses pelapisan dilakukan
selama ± 5 menit dan dihentikan setelah permukaan butiran granul benih berwarna
putih. Gambar 4 menunjukkan benih kedelai yang diberi perekat tetapi tanpa
pelapis, sedangkan Gambar 5 benih diberi perekat dan pelapis. Kemudian butiran
granul dikering-anginkan selama satu minggu. Benih yang telah terlapisi tersebut
Gambar 3. Drum Granulator yang Dimodifikasi
Gambar 4. Benih Kedelai yang Diberi Bahan Perekat Tanpa Pelapis
Gambar 5. Benih Kedelai yang Telah Diberi Bahan Perekat dan Pelapis
Keterangan :
S0G0 = benih tanpa bahan perekat dan tanpa pelapis gambut:gipsum (0:0)
S0G1 = benih tanpa bahan perekat dan dengan pelapis gambut:gipsum (0:100)
S1G0 = benih dengan bahan perekat tapioka 5 % dan tanpa pelapis gambut:gipsum (0:0)
S1G1 = benih dengan bahan perekat tapioka 5 % dan pelapis gambut:gipsum (0:100)
S2G0 = benih dengan bahan perekat molases 90 % dan tanpa pelapis gambut:gipsum (0:0)
Pelaksanaan di lapangan
a. Persiapan media tanam
Media tanam yang digunakan adalah campuran tanah podsolik merah
kuning, kompos dan pasir dengan perbandingan 1 : 1 : 1. Tanah podsolik merah
kuning digunakan sebagai gambaran tanah marginal yang miskin hara, namun
pada penelitian ini tidak dilakukan pemupukan. Hal ini dilakukan agar pengaruh
CMA lebih terlihat peranannya dalam meningkatkan penyerapan unsur hara.
Sebelum media tanam digunakan terlebih dahulu diayak dengan ayakan berukuran
5 mm dan disterilisasi dengan otoklaf pada suhu 121 0C selama 20 menit.
Campuran media tanam tersebut kemudian dimasukkan ke dalam polibag
berukuran 25 cm x 30 cm sebanyak 2.5 kg/polibag.
b. Penanaman
Sebelum media tanam digunakan terlebih dahulu disiram dengan air
sampai kapasitas lapang dan diletakkan di dalam rumah kaca. Lubang tanam
dibuat dengan cara tugal. Benih ditanam sebanyak dua butir benih per polibag
pada kedalaman sekitar 7 cm. Setelah umur satu minggu setelah tanam, satu
tanaman digunting, satu tanaman yang ditinggalkan adalah tanaman yang
pertumbuhannya paling bagus sehingga memudahkan dalam pengamatan
berikutnya. Setiap perlakuan diulang sebanyak tiga kali, tiap ulangan terdapat tiga
polibag, masing-masing polibag ada satu tanaman sehingga terdapat sembilan
tanaman tiap perlakuan. Polibag diletakkan di rumah kaca selama 2 minggu
sebelum dipindahkan ke lapang. Jarak antar polibag 40 cm x 20 cm.
c. Pemeliharaan
Pemeliharaan yang dilakukan meliputi penyiraman pada sore hari yang
dilakukan setiap hari, pengendalian gulma dilakukan secara manual dengan cara
mencabut langsung dan pengendalian hama belalang dilakukan dengan
menangkap belalang secara manual.
d. Pemanenan
Panen pertama dilakukan pada umur 7 minggu setelah tanam (MST) untuk
pengamatan bobot basah dan bobot kering tajuk, akar, dan bintil akar. Panen
kedua dilakukan pada umur 12 MST untuk pengamatan persentase infeksi akar
Pengamatan
Pengamatan terhadap perkembangan tanaman dilakukan dengan
mengamati parameter-parameter sebagai berikut:
1. Daya tumbuh (DT)
Pengamatan terhadap daya tumbuh benih dilakukan pada hari ke-7.
Perhitungan dilakukan terhadap tanaman yang telah tumbuh normal. Jika ada satu
tanaman saja yang tumbuh dalam satu polibag, maka dianggap tumbuh. Daya
tumbuh dihitung dengan rumus :
DT (%) = ∑ benih yang tumbuh x 100 % ∑ benih yang ditanam
2. Tinggi tanaman
Tinggi tanaman diukur dari leher akar sampai titik tumbuh tanaman
tertinggi. Pengamatan terhadap tinggi tanaman dilakukan setiap satu minggu
sekali, mulai 2 MST sampai 10 MST.
3. Jumlah daun
Jumlah daun dihitung dari daun yang telah membuka sampai daun
terbawah, mulai 2 MST sampai 10 MST.
4. Bobot basah dan bobot kering tajuk, akar dan bintil akar
Bobot basah dan bobot kering tajuk, akar dan bintil akar ditetapkan dengan
memisahkan bagian tajuk, akar, dan bintil akar. Kemudian tajuk, akar dan bintil
akar dioven pada suhu 105 0C selama ± 24 jam. Bobot kering tajuk, akar dan bintil
akar tersebut ditimbang secara terpisah. Bobot kering tajuk, akar dan bintil akar
dihitung setelah tanaman berumur 7 MST.
5. Uji perkecambahan spora
Uji perkecambahan spora dilakukan berdasarkan modifikasi metode
Azon-Aguiler. Sebagian benih yang sudah diberi perlakuan pelapisan CMA diamati
dari benih. Spora CMA disterilisasi dengan dua tahap yaitu (1) sterilisasi spora di
dalam larutan chloramine-T 2 % dan Tween 20 selama dua menit, dan (2)
sterilisasi spora di dalam larutan streptomycin (200 mg/L) dan gentamycin (100
ml/L) selama sepuluh menit. Setelah spora disterilisasi, spora ini diletakkan di atas
media bacto agar dalam cawan petri. Kemudian cawan petri yang mengandung
spora CMA diinkubasi dalam inkubator pada suhu 25 0C dalam keadaan gelap.
Inkubasi dilakukan selama 16 hari. Pengamatan terhadap germinasi spora
dilakukan selang 4 hari dan diukur panjang hifa yang tumbuh. Pengamatan untuk
percobaan ini dilakukan dengan menggunakan mikroskop konfokal yang
dilengkapi dengan software NIS-Elements pada perbesaran 40X.
6. Persentase infeksi CMA
Perhitungan persentase infeksi CMA dilakukan dengan cara sebagai
berikut: sebanyak 0.1 g akar dari hasil panen dipotong kira-kira 1 cm dan
dimasukkan ke dalam botol vial yang telah berisi larutan 10 % KOH untuk
membersihkan inti akar yang mengandung lignin sehingga penetrasi zat warna
lebih mudah. Kemudian dibiarkan selama 3 hari, dan larutan KOH dibuang.
Setelah itu dibilas dengan air dan direndam dalam larutan 0.1 N HCl untuk
menetralkan KOH selama 10 menit. Larutan HCl dibuang, ditambahkan larutan
trypan blue yang digunakan untuk mewarnai bagian-bagian CMA (0.01 % dalam lactogliserol). Larutan trypan blue dibuang, kemudian dicuci akar dengan air dan
direndam di dalam larutan lactogliserol (berfungsi untuk mengikat larutan trypan blue) untuk perhitungan infeksi di bawah mikroskop. Infeksi dihitung dengan metode Gridline intersect method (Giovannetti and Mouse, 1980).
Pada metode ini, setiap potongan akar yang mengenai gridline dihitung sebagai infeksi jika salah satu hifa atau gabungan dari struktur arbuskula dan
vesikel ditemukan. Persen kolonisasi dan panjang akar dihitung sebagai berikut;
% kolonisasi ∑ infeksi
∑ interseksi x100 %
Kolonisasi (cm) = ∑ infeksi x Line Grid x 11/14. Panjang akar (cm) = ∑ total
7. Jumlah spora
Perhitungan jumlah spora dilakukan berdasarkan metode wet sieving dan teknik sentrifugase (Sylvia, 1998) yang dilakukan pada akhir penelitian dengan
cara pengamatan pada sampel media tanam sebanyak 100 g untuk masing-masing
perlakuan. Sampel media tanam dimasukkan ke dalam gelas beker 500 ml dan
direndam dengan air selama 2 jam, kemudian diaduk, pasir dibiarkan mengendap,
dan larutan tanah dituang ke dalam saringan (710-50 m). Hal tersebut dilakukan
sampai air bersih. Hasil saringan terkecil dipindahkan ke dalam tabung
sentrifugase 50 ml, ditambahkan air dan ditimbang. Selanjutnya, hasil saringan
larutan tanah terkecil kemudian disentrifugase selama 5 menit pada kecepatan
5000 rpm untuk memisahkan tanah dari kotoran. Supernatan dibuang dan
ditambahkan air kembali sampai setengah, ditambahkan larutan gula 75 % sampai
penuh. Setelah itu, ditimbang dan disentrifugase kembali pada kecepatan 6000
rpm selama 20 detik. Spora dikumpulkan dengan menuangkan supernatan ke
dalam saringan 50 m. Spora kemudian dicuci dengan air dan dituangkan ke
dalam cawan petridan dihitung jumlah spora di bawah mikroskop (Lampiran 11).
Total jumlah spora per pot dapat dihitung seperti berikut:
Total jumlah spora per pot = ∑ spora/100 g tanah x 2500 g tanah/100.
8. Komponen panen per tanaman pada 12 MST
Pengamatan jumlah polong, bobot basah dan bobot kering polong isi dan
polong hampa per tanaman dilakukan pada saat panen. Panen dilakukan pada 12
MST. Panen dilakukan bila lebih dari 95 % polong kedelai sudah berwarna
cokelat kekuningan dan jumlah daun tersisa pada tanaman hanya sekitar 5-10 %
HASIL DAN PEMBAHASAN
Kondisi Umum
Penanaman dilakukan di rumah kaca selama 2 MST, selanjutnya tanaman
kedelai dipindahkan ke luar rumah kaca karena tanaman kekurangan sinar
matahari yang menyebabkan etiolasi pada kedelai. Setelah kedelai dipindahkan ke
luar rumah kaca, maka tanaman kedelai ditempatkan di samping rumah kaca yang
diberi penutup seperti paranet berwarna hijau agar melindungi tanaman dari
serangan hama belalang. Selain itu, tanaman kedelai diberi ajir bambu agar tidak
rebah. Hama penyakit yang mengganggu saat penelitian adalah hama belalang dan
penyakit busuk batang, namun hanya menyerang beberapa tanaman. Tindakan
pengendalian yang dilakukan adalah menangkap belalang secara manual dan
mencabut tanaman yang terserang busuk batang.
Gambar 6. Tanaman Kedelai di Rumah Kaca
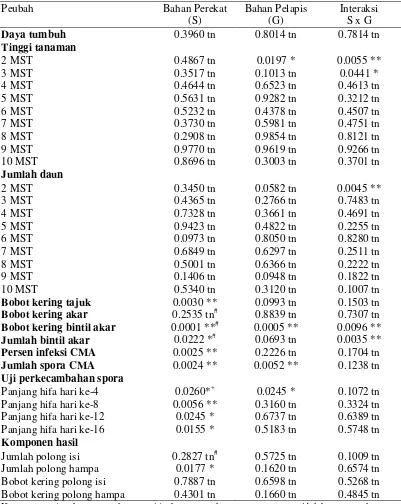
Berdasarkan hasil uji F menggunakan program olah data SAS 6.12
menunjukkan bahwa bahan perekat berpengaruh nyata terhadap bobot kering
tajuk, bobot kering bintil akar, jumlah bintil akar, persentase infeksi CMA, jumlah
spora CMA, dan panjang hifa hari ke-4 sampai hari ke-16. Bahan pelapis
berpengaruh nyata terhadap tinggi tanaman 2 MST, bobot kering bintil akar,
jumlah spora CMA, dan panjang hifa hari ke-4. Interaksi bahan perekat dan bahan
daun 2 MST, bobot kering bintil akar dan jumlah bintil akar. Secara rinci
rekapitulasi sidik ragam ditunjukkan pada Tabel 1.
Tabel 1. Rekapitulasi Sidik Ragam Pengaruh Bahan Perekat dan Bahan Pelapis serta Interaksinya terhadap Beberapa Parameter Pengamatan Tanaman Kedelai
Daya tumbuh 0.3960 tn 0.8014 tn 0.7814 tn
Tinggi tanaman
2 MST 0.4867 tn 0.0197 * 0.0055 **
3 MST 0.3517 tn 0.1013 tn 0.0441 *
4 MST 0.4644 tn 0.6523 tn 0.4613 tn
5 MST 0.5631 tn 0.9282 tn 0.3212 tn
6 MST 0.5232 tn 0.4378 tn 0.4507 tn
7 MST 0.3730 tn 0.5981 tn 0.4751 tn
8 MST 0.2908 tn 0.9854 tn 0.8121 tn
9 MST 0.9770 tn 0.9619 tn 0.9266 tn
10 MST 0.8696 tn 0.3003 tn 0.3701 tn
Jumlah daun
2 MST 0.3450 tn 0.0582 tn 0.0045 **
3 MST 0.4365 tn 0.2766 tn 0.7483 tn
4 MST 0.7328 tn 0.3661 tn 0.4691 tn
5 MST 0.9423 tn 0.4822 tn 0.2255 tn
6 MST 0.0973 tn 0.8050 tn 0.8280 tn
7 MST 0.6849 tn 0.6297 tn 0.2511 tn
8 MST 0.5001 tn 0.6366 tn 0.2222 tn
9 MST 0.1406 tn 0.0948 tn 0.1822 tn
10 MST 0.5340 tn 0.3120 tn 0.1007 tn
Bobot kering tajuk 0.0030 ** 0.0993 tn 0.1503 tn
Bobot kering akar 0.2535 tn# 0.8839 tn 0.7307 tn
Bobot kering bintil akar 0.0001 **# 0.0005 ** 0.0096 **
Jumlah bintil akar 0.0222 *# 0.0693 tn 0.0035 **
Persen infeksi CMA 0.0025 ** 0.2226 tn 0.1704 tn
Jumlah spora CMA 0.0024 ** 0.0052 ** 0.1238 tn
Uji perkecambahan spora
Panjang hifa hari ke-4 0.0260*+ 0.0245 * 0.1072 tn
Panjang hifa hari ke-8 0.0056 ** 0.3160 tn 0.3324 tn
Panjang hifa hari ke-12 0.0245 * 0.6737 tn 0.6389 tn
Panjang hifa hari ke-16 0.0155 * 0.5183 tn 0.5748 tn
Komponen hasil
Jumlah polong isi 0.2827 tn# 0.5725 tn 0.1009 tn
Jumlah polong hampa 0.0177 * 0.1620 tn 0.6574 tn
Bobot kering polong isi 0.7887 tn 0.6598 tn 0.5268 tn
Bobot kering polong hampa 0.4301 tn 0.1660 tn 0.4845 tn
Daya Tumbuh
Perlakuan bahan perekat dan bahan pelapis serta interaksinya terhadap
daya tumbuh benih tidak berpengaruh nyata (Lampiran 1). Tabel 2 menunjukkan
bahwa benih yang diberi bahan perekat maupun tanpa bahan perekat masih
memiliki nilai daya tumbuh yang tinggi (92.6-98.1 %). Daya tumbuh tertinggi
ditunjukkan oleh bahan pelapis gambut:gipsum dengan perbandingan 50:50 (b/v)
(Tabel 3). Tingginya nilai daya tumbuh benih menunjukkan bahwa viabilitas
benih belum mengalami penurunan.
Tabel 2. Pengaruh Bahan Perekat terhadap Daya Tumbuh Benih Kedelai pada 1 MST
Bahan Perekat Daya Tumbuh (%)
Kontrol 92.6
Tapioka 5 % (b/v) 98.1
Molases 90 % (v/v) 96.3
Tabel 3. Pengaruh Bahan Pelapis terhadap Daya Tumbuh Benih Kedelai pada 1 MST
Bahan Pelapis Daya Tumbuh (%)
Gambut:gipsum (0:0) 92.6
Gambut:gipsum (0:100) 96.3
Gambut:gipsum (25:75) 96.3
Gambut:gipsum (50:50) 100.0
Gambut:gipsum (75:25) 92.6
Gambut:gipsum (100:0) 96.3
Tinggi Tanaman
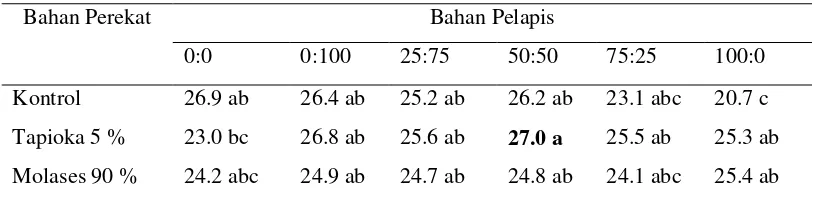
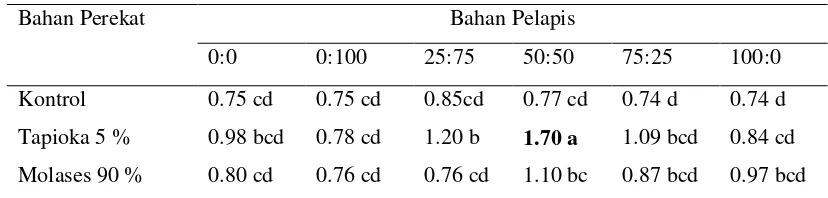
Interaksi antara bahan perekat dengan bahan pelapis terhadap tinggi
tanaman berpengaruh nyata pada 2 dan 3 MST (Lampiran 2). Kombinasi tanpa
bahan perekat (kontrol) dengan bahan pelapis gambut:gipsum (0:100)
menghasilkan tinggi tanaman yang tertinggi pada 2 MST dan tinggi tanaman
terendah pada kombinasi tanpa bahan perekat dengan bahan pelapis
% dengan bahan pelapis gambut:gipsum (50:50) menghasilkan tinggi tanaman
yang tertinggi, dan kombinasi tanpa bahan perekat dengan bahan pelapis
gambut:gipsum (100:0) menghasilkan tinggi tanaman yang terendah (Tabel 5).
Pengamatan tinggi tanaman pada minggu berikutnya (3-10 MST), menunjukkan
bahwa perlakuan bahan pelapis tidak berpengaruh nyata.
Tabel 4. Pengaruh Interaksi Bahan Perekat dan Bahan Pelapis terhadap Tinggi Tanaman (cm) pada 2 MST
Bahan Perekat Bahan Pelapis
0:0 0:100 25:75 50:50 75:25 100:0
Kontrol 14.1 abc 15.6 a 13.8 abc 14.6 ab 11.6 bc 8.4 d
Tapioka 5 % 12.0 bc 14.1 abc 13.5 abc 14.2 abc 14.0 abc 12.7 abc
Molases 90 % 13.2 abc 13.3 abc 13.4 abc 11.6 bc 11.0 cd 13.8 abc
Keterangan : angka-angka pada kolom yang sama diikuti oleh huruf yang sama menunjukkan tidak berbeda nyata berdasarkan uji DMRT 5 %
Tabel 5. Pengaruh Interaksi Bahan Perekat dan Bahan Pelapis terhadap Tinggi Tanaman (cm) pada 3 MST
Bahan Perekat Bahan Pelapis
0:0 0:100 25:75 50:50 75:25 100:0
Kontrol 26.9 ab 26.4 ab 25.2 ab 26.2 ab 23.1 abc 20.7 c
Tapioka 5 % 23.0 bc 26.8 ab 25.6 ab 27.0 a 25.5 ab 25.3 ab
Molases 90 % 24.2 abc 24.9 ab 24.7 ab 24.8 ab 24.1 abc 25.4 ab
Keterangan : angka-angka pada kolom yang sama diikuti oleh huruf yang sama menunjukkan tidak berbeda nyata berdasarkan uji DMRT 5 %
Hal ini dapat dijelaskan karena sifat gipsum selain berfungsi sebagai bahan
pelapis, gipsum juga dapat berfungsi sebagai bahan perekat. Purwadi (1993),
menyatakan bahwa gipsum berfungsi sebagai lapisan pelindung dan sebagai
perekat mineral yang mempunyai sifat lebih baik dibandingkan dengan perekat
organik lainnya. Bahan pelapis gipsum tersebut menyebabkan spora CMA tetap
dapat menempel pada benih. Keberadaan spora CMA dapat membantu tanaman
dalam meningkatkan kemampuan penyerapan unsur hara terutama hara fosfor.
(Darmawan dan Baharsjah, 1983). Dengan demikian apabila kadar P meningkat
maka aktivitas meristem pada ujung batang pun meningkat sehingga batang
bertambah tinggi. Selanjutnya Anas (1993), menambahkan bahwa CMA pada akar
tanaman dapat menghasilkan sejumlah hormon pengatur tumbuh seperti giberelin
dan sitokinin sehingga keberadaan CMA pada akar tanaman dapat berperan dalam
proses pemanjangan batang.
Jumlah Daun
Jumlah daun pada setiap minggunya mengalami peningkatan, walaupun
secara statistik tidak berpengaruh nyata, baik pada perlakuan bahan perekat
tapioka 5 % maupun bahan perekat molases 90 % (Gambar 7). Begitu juga dengan
perlakuan bahan pelapis, tidak berpengaruh nyata terhadap jumlah daun pada
semua perbandingan (0:0; 0:100; 25:75; 50:50; 75:25; 100:0 (Gambar 8).
Gambar 8. Pengaruh Bahan Pelapis terhadap Jumlah Daun
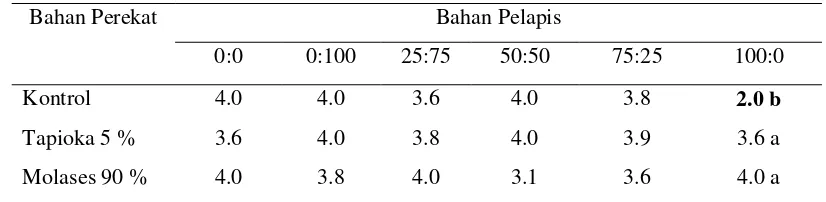
Interaksi antara bahan perekat dan bahan pelapis menunjukkan pengaruh
yang sangat nyata terhadap jumlah daun pada 2 MST (Lampiran 3). Kombinasi
tanpa bahan perekat (kontrol) dan bahan pelapis gambut:gipsum (100:0)
menghasilkan jumlah daun terendah (Tabel 6). Ini menunjukkan bahwa tidak
adanya bahan perekat dan bahan pelapis gipsum sebagai lapisan pelindung
menyebabkan spora CMA tidak melekat pada benih kedelai. Penelitian
Wicaksono et al. (2000) melaporkan bahwa jumlah daun tanaman kentang tidak meningkat pada perlakuan tanpa CMA. Peningkatan jumlah daun disebabkan
karena adanya penambahan CMA sehingga dapat menyerap lebih banyak unsur
hara makro (N, P, K, Ca, dan Mg), juga unsur mikro (Cu, Mn dan Zn) yang
dibutuhkan tanaman sehingga pertumbuhan tanaman menjadi lebih baik, salah
satunya ditandai dengan banyaknya jumlah daun yang dihasilkan.
Tabel 6. Pengaruh Interaksi Bahan Perekat dan Bahan Pelapis terhadap Jumlah Daun (helai) per Tanaman pada 2 MST
Bahan Perekat Bahan Pelapis
0:0 0:100 25:75 50:50 75:25 100:0
Kontrol 4.0 4.0 3.6 4.0 3.8 2.0 b
Tapioka 5 % 3.6 4.0 3.8 4.0 3.9 3.6 a
Molases 90 % 4.0 3.8 4.0 3.1 3.6 4.0 a
Bobot Kering Tajuk dan Bobot Kering Akar 7 MST
Perlakuan bahan perekat menunjukkan pengaruh yang sangat nyata pada
peubah bobot kering tajuk, tetapi perlakuan bahan pelapis serta interaksi antara
bahan perekat dan bahan pelapis tidak terdapat pengaruh yang nyata terhadap
bobot kering tajuk (Lampiran 4). Bahan perekat tapioka 5 % mampu
meningkatkan bobot kering tajuk pada 7 MST (Tabel 7). Hal ini menunjukkan
bahwa tapioka mempunyai kekuatan gel yang baik dan daya rekat tinggi sehingga
inokulum CMA banyak yang menempel pada benih. Inokulum CMA mampu
menghasilkan bobot tajuk lebih tinggi dibandingkan dengan yang tidak
diinokulasikan dengan CMA. Hal ini karena terjadinya peningkatan penyerapan
unsur hara pada tanaman yang bermikoriza. Adanya bantuan hifa dari akar yang
luas, akar dapat menyerap lebih banyak unsur-unsur yang dibutuhkan tanaman
untuk pertumbuhan organ vegetatifnya, terutama daun yang berfungsi dalam
proses fotosintesis. Apabila proses fotosintesis berjalan dengan sempurna, maka
pertumbuhan dan produksi tanaman juga akan baik. Seiring dengan itu bobot
kering tajuk juga akan meningkat. Berdasarkan penelitian Vejsadova et al. (1992) infeksi CMA telah meningkatkan bobot kering tajuk tanaman kedelai 25 % lebih
tinggi dibandingkan dengan tanaman tanpa CMA. Bakhtiar et al. (2005) menyatakan bahwa inokulasi CMA meningkatkan bobot kering daun bibit
tanaman kelapa sawit. Bobot kering daun pada media tanah : pasir : kompos (1: 5:
4) memberikan bobot kering daun tertinggi baik ketika diinokulasi dengan
Gigaspora sp maupun oleh Glomus sp.
Analisis ragam menunjukkan bahwa interaksi antara bahan perekat dan
bahan pelapis tidak terdapat pengaruh nyata terhadap bobot kering akar pada 7
MST (Lampiran 5). Perlakuan bahan perekat tapioka 5 % dan molases 90 % tidak
berbeda nyata terhadap bobot kering akar pada 7 MST. Bobot kering akar
tertinggi diperoleh pada perlakuan bahan perekat tapioka 5 % (1.02 g) (Tabel 7).
Perlakuan bahan pelapis tidak berbeda nyata terhadap bobot kering akar tanaman.
Ini menunjukkan bahwa perlakuan bahan pelapis pada semua perbandingan (0:0;
0:100; 25:75; 50:50; 75:25; 100:0) tidak meningkatkan bobot kering akar