NESTI F. SIANIPAR A361020201
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa disertasi Karakterisasi Abnormalitas Embrio Somatik Kelapa Sawit (Elaeis guineensis Jacq) adalah karya saya sendiri dengan bimbingan dari Komisi Pembimbing dan belumdiajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, Januari 2008
guineensis Jacq) Somatic Embryos. GUSTAAF A. WATTIMENA, MAGGY T. SUHARTONO, HAJRIAL ASWIDINNOOR and NURITA TORUAN-MATHIUS.
Oilpalm is the most important vegetable oil producing plant in Indonesia. A mass production of oilpalm transplants to support new oilpalm estate can be conducted through tissue culture. However, the primary problem of tissue culture generated transplants is increasingly reproductive abnormalities postulated due to the genetic and/or epygenetic changes during somatic embryo (SE) formation. The objectives of this research were (1) to characterize abnormality of somatic embryos at several growth stages, (2) to study the genetic change of SEs at several growth stages and their plantles, and (3) to study the relationship of cytosine methylation of genomic DNA and abnormality at several SE growth stages and plantlets. Genetic characterization was accomplished by RAPD and RAF technique. Epigenetic characterization was conducted by RP-HPLC and RAF-methylation sensitive technique. The results showed that morphological characterization on SE at globular, heart form scutellar, and cotyledon resulted that there were morphological variations. The most obvious variations were observed at heart form scutellar stage and cotyledon. Histologically, the procambial strand of SE abnormal cotyledon of clone 638 and 558 was disperse and their protoderm cell layer was not clear. Meanwhile, at clone 636 the abnormal SE cotyledon was morphologically different from the normal one, but anatomically was similar to the normal one. The RAPD techniques distinguish the SE normal cotyledon to the abnormal at clone 638 by 5 primers (OPE-14,OPC-9, W-15, AP-20 and SC10-19), while at clone 558 by 3 primers (OPE-14, W-15 and AP-20). Among the five primers there were 3 primers differing the normal and abnormal SE cotyledon at clone 638, at a specific band of 1750 bp, those were OPE-14, W-15 and AP-20 primers. The RAF technique detected the changes of genomic DNA genom at 90 – 358 bp. There were 3 among the 6 primers (AO-12, BB-18, W-15) detecting the sequence of genomic DNA at 150 bp. The genomic DNA slicing by RAF technique with MspI and Hpa2 enzymes could detect the location of cytosine methylation. The Hpa2 enzyme cut the mCCGG, but if both the Cs were methylated, the sequence was not cut. The MspI enzyme would cut the genomic DNA sequence when the cytosine experiencing an internal methylation (CmCGG). The RAF technique could detect methylation location of internal, external, and fully methylated at 124-457 bp of genomic DNA. The RP-HPLC analysis showed very litle changes of cytosine (0.25 – 2.72%) at clone 638 and 636. The cytosine methylation changes of normal and abnormal SE were due to hipomethylation and hipermethylation at clon 638 and 558, respectively. The cytosine methylation change was too small to affect mophological change from normal to abnormal. Abnormality of SE at cotyledon stage was due to the change of genomic DNA sequence or mutation.
sawit (Elaeis guineensis Jacq). GUSTAAF A. WATTIMENA, MAGGY T. sangat besar. Salah satu cara penyediaan bibit kelapa sawit dapat melalui kultur jaringan. Kelebihan melalui kultur jaringan adalah mampu menghasilkan bibit dalam jumlah yang banyak dalam waktu yang relatif singkat. Namun demikian, kendala utama bibit hasil kultur jaringan adalah masalah abnormalitas pada organ reproduktif yang diduga terkait dengan perubahan genetik dan epigenetik selama masa pembentukan embrio somatik (ES).
Tujuan penelitian ini adalah: (1) untuk mengkarakterisasi abnormalitas embrio somatik dari beberapa perkembangan, (2) mempelajari perubahan genetik ES dari beberapa tahap perkembangan ES dan planlet, dan (3) mempelajari hubungan metilasi sitosin DNA genom dengan abnormalitas pada beberapa tahap perkembangan ES dan planlet. Pendekatan yang dilakukan untuk mencapai tujuan tersebut adalah melalui karakterisasi morfologi, histologi, genetik dan epigenetik.
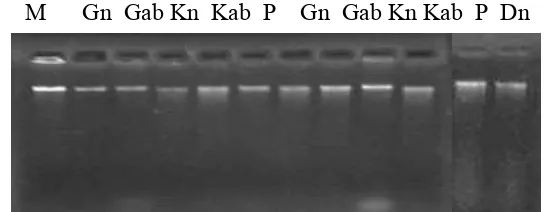
Bahan tanaman yang digunakan adalah kalus embrio somatik (ES) Tenera unggul hasil seleksi (ortet terpilih) klon MK638, MK636 dan MK558 dari Balai Penelitian Marihat. ES normal dan abnormal yang telah dikarakterisasi pada dilakukan dalam bentuk sediaan anatomi berdasarkan metode Nakamura (1995). Karakterisasi genetik dilakukan dengan teknik Random Amplified Polymorphism DNA (RAPD) dan Randomly Amplified DNA Fingerprinting (RAF). Karakterisasi berdasarkan epigenetik dilakukan dengan teknik Riverse-Phase Performance Liquid Chromatography (RP-HPLC) dan RAF-Sensitif Metilasi (RAF-SM).
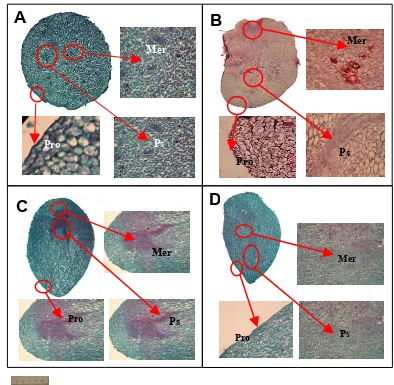
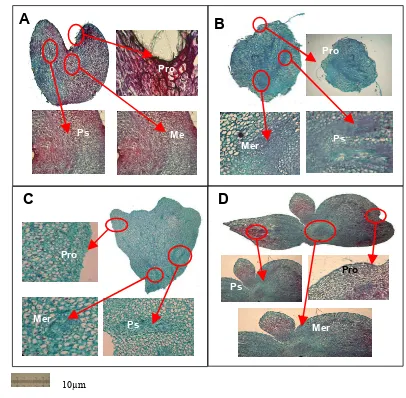
Hasil penelitian menunjukkan bahwa karakterisasi secara morfologi embrio somatik dari tahap globular, scuttelar berbentuk hati, dan kotiledon menghasilkan keragaman secara morfologi. Keragaman morfologi terlihat jelas pada tahap scutellar berbentuk hati dan kotiledon. Hasil histologi terlihat perbedaan pada ES kotiledon abnormal pada procambial strand menyebar dan lapisan sel protoderm tidak jelas pada klon 638 dan 558, sedangkan pada klon 636 ES kotiledon abnormal secara morfologi tetapi secara anatomi terlihat tidak berbeda dengan normal.
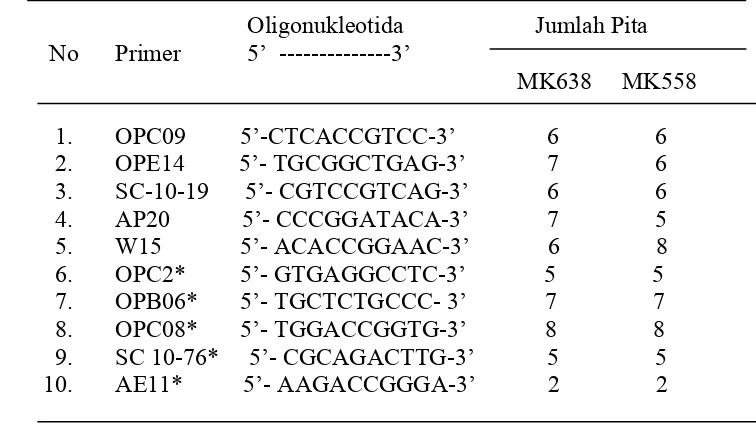
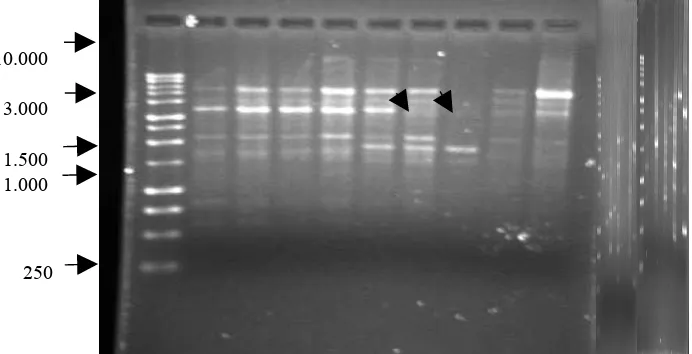
Dengan Teknik RAF hanya menganalisis klon 638, ada 6 dari 8 primer yang dapat membedakan antara ES kotiledon normal dan abnormal, planlet dan daun tanaman induk normal. Dengan analisis RAF dapat diketahui perubahan sekuen DNA genom berada disekitar 90 – 358 bp. Ada 3 dari 6 primer (AO-12, BB-18, W-15) yang menunjukkan perubahan sekuens DNA genom pada fragmen spesifik disekitar 150 bp.
Hasil pemotongan DNA genom dengan enzim MspI dan HpaII yang dapat dideteksi lokasi terjadinya metilasi sitosin dengan teknik RAF. Enzim HpaII memotong sekuen mCCGG tetapi jika C keduanya mengalami metilasi sekuen tersebut tidak terpotong. Msp1 akan memotong bila sitosin internal termetilasi (CmCGG). Teknik RAF ini dapat mendeteksi lokasi metilasi internal, metilasi eksternal dan metilasi penuh (fully-metilated ) yang terjadi sekitar 124- 457 bp pada DNA genom. Hasil analisis RP-HPLC menunjukkan perubahan metilasi sitosin sangat kecil sekitar 0,25 – 2,72 % pada klon 638 dan klon 636. Perubahan metilasi sitosin antara ES normal dan abnormal terjadi hipometilasi pada klon 638 dan terjadi hipermetilasi pada klon 558. Perbedaan kandungan metilasi sitosin sangat kecil, sehingga metilasi sitosin tidak berpengaruh langsung terhadap perubahan morfologi dari normal menjadi abnormal. Abnormalitas yang terjadi pada embrio somatik pada tahap kotiledon akibat terjadinya perubahan sekuens DNA genom atau mutasi.
Berdasarkan hasil penelitian ada beberapa informasi yang baru yaitu : (1) terdapat keragaman abnormal pada tingkat morfologi dan histologi pada fase skutelar berbentuk hati dan kotiledon, (2) terjadi perubahan sekuens DNA berbeda pada ES kotiledon normal dan abnormal dengan teknik RAPD dan RAF, (3) terdapat mutasi pada fase ES kotiledon abnormal yang dideteksi dengan teknik RAF, (4) terdapat perubahan pola situs metilasi sitosin pada ES kotiledon abnormal dengan tanaman induk normal, (5) morfologi dan histologi abnormal berhubungan dengan perubahan genetik dan epigenetik dan (6) Perubahan kandungan metilasi sitosin DNA genom tidak berdampak langsung terhadap perubahan morfologi embrio somatik.
Hak cipta dilindungi undang-undang
1. Dilarang mengutipsebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber.
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah.
b. Pengutipan tidak merugikan kepentingan yang wajar IPB.
NESTI F. SIANIPAR
Desertasi
Sebagai salah satu syarat untuk memperoleh gelar
Doktor
Pada Program Studi Agronomi Institut Pertanian Bogor
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Nama : Nesti F. Sianipar
Nomor Pokok : A361020201
Program Studi : Agronomi
Disetujui Komisi Pembimbing
(Prof. Dr. Ir. G. A. Wattimena M.Sc) (Prof. Dr. Ir. Maggy T. Suhartono) Ketua Anggota
(Dr. Ir. Hajrial Aswidinnoor, M.Sc) (Dr. Nurita Toruan-Mathius, M. S) Anggota Anggota
Diketahui
Ketua program Studi Agronomi Dekan Sekolah Pascasarjana
(Dr. Ir Munif Ghulamahdi, M.S) (Prof. Dr. Ir. Khairil Anwar Notodiputro, M.S )
Penguji pada Ujian Terbuka : 1. Prof. Dr. Endang Sukara
(Deputi Bidang Ilmu Pengetahuan Hayati LIPI)
2. Dr. Ir. Endah Retno Palupi, M.Sc
(Staf Pengajar Departemen Agronomi dan Hortikultura, FAPERTA IPB)
Maha Kuasa atas segala karunia-Nya sehingga karya ilmiah ini dapat diselesaikan. Disertasi ini membuat 6 bab, beberapa bab merupakan pengembangan dari naskah artikel yang diajukan ke jurnal ilmiah. Satu bab yang telah terbit dijurnal ilmiah yaitu dengan judul “Karakterisasi secara Morfologi Abnormalitas Embrio Somatik Kelapa Sawit (Elaeis guineensis Jacq) dari Eksplan Daun” (Jurnal AgroBiogen No. 1, April 2007).
Ucapan terima kasih dan penghargaan disampaikan kepada Komisi Pembimbing, Prof. Dr. Ir. Gustaaf A. Wattimena selaku ketua serta , Prof. Dr. Ir. Maggy T. Suhartono, Dr. Ir. Hajrial Aswidinnoor, M.Sc. dan Dr. Nurita Toruan-Mathius, M.S., masing-masing sebagai anggota yang memberikan waktu untuk berdiskusi sejak penetapan topik penelitian hingga akhir penyelesaian studi.
Ucapan terima kasih juga disampaikan kepada :
1. Ketua Yayasan SDM-IPTEK The Habibie Center atas kesempatan dan kepercayaan beasiswa yang diberikan kepada penulis selama mengikuti pendidikan S3.
2. Dekan Sekolah Pascasarjana beserta staf, ketua Progran Studi Agronomi Sekolah Pascasarjana IPB, dan seluruh staf pengajar yang telah membekali dan memperkaya penulis dengan berbagai ilmu.
3. Dr. Ir. Sobir M.S selaku Penguji Luar Komisi pada Ujian Tertutup serta Prof. Dr. Endang Sukara dan Dr. Ir. Endah Retno Palupi, M.Sc, selaku Penguji Luar Komisi pada Ujian Terbuka.
4. Rekan-rekan mahasiswa S3 Program Studi Agronomi, Sekolah Pascasarjana IPB atas kerjasamanya dalam proses penyelesaian studi dan desertasi ini.
5. Rekan-rekan dilaboratorium Biologi Molekuler Biotrop, laboratorium Kultur Jaringan BPBPI, laboratorium Biologi IPB, laboratorium
7. Dr. Rudy Lukman, S.P., M.Si. atas bantuan deteksi genetik dengan teknik RAF yang dilaksanakan di laboratorium PT.BISI International, Kediri. berat dalam pendidikan ini. Terima kasih tak terhingga penulis sampaikan kepada bapak Ranap Sianipar dan mama Helena Simanjuntak, berkat cinta dan kasih sayang, doa serta didikan beliau penulis mampu menempuh pendidikan formal hingga jenjang tertinggi
Penulis dilahirkan di Pematang Siantar, Sumatera Utara pada tanggal 14 April 1971 sebagai anak ketiga dari pasangan Ranap Sianipar dan Helena Simanjuntak. Pada tahun 1990, penulis diterima di Fakultas Pertanian Universitas Islam Sumatera Utara, Medan dan lulus tahun 1995. Tahun 1996, penulis mendapat kesempatan untuk melanjutkan pendidikan S2 pada Program Studi Agronomi Bidang Bioteknologi Tanaman di Institut Pertanian Bogor dan lulus tahun 1998.
Pada tahun 1999, penulis mendapat kesempatan mengikuti ”Training Course on Molecular Techniques at the technical University of Muenchen di German. Pada tahun 2002, penulis melanjutkan S3 di Progran Studi Agronomi, Institut Pertanian Bogor dengan pendalaman minat pada Biologi Molekuler Tanaman melalui beasiswa The Habibie Center. Pada tahun 2003, penulis menjadi pengajar di Universitas Kristen Krida Wacana, Jakarta. Pada tahun 2005, penulis terpilih menjadi 7 wanita ilmuan yang diselenggarakan oleh Komisi nasional Indonesia untuk UNESCO dan didukung oleh L’oreal Indonesia for women in Science 2005.
RAMDOMLY AMPLIFIED DNA FINGERPRINTING (RAF)
Abstrak ... 43
Pendahuluan ... 43
Bahan dan Metode ... 47
Hasil dan Pembahasan ... 51
Analisis Random Amplified Polymorphism DNA (RAPD) ... 51
Analisis Randomly Amplified DNA Fingerprinting (RAF ) ... 57
Simpulan ... 62
5. DETEKSI METILASI DNA EMBRIO SOMATIK KELAPA SAWIT (Elaeis guineensis Jacq.) DENGAN TEKNIK RANDOMLY AMPLIFIED DNA FINGERPRINGING (RAF) DAN RP-HPLC Abstrak ... 63
Pendahuluan ... 63
Bahan dan Metode ... 66
Hasil dan Pembahasan ... 69
Deteksi Lokasi Metilasi Sitosin dengan Teknik RAF ... 69
Kuantifikasi Metilasi Sitosin dengan Teknik RP-HPLC ... 76
Simpulan ... 84
6. PEMBAHASAN UMUM ... 82
7. SIMPULAN DAN SARAN ... 91
DAFTAR PUSTAKA ... 92
Halaman
1. Karakteristik abnormalitas embrio somatik secara morfologi ... 31
2. Hasil karakterisasi abnormalitas embrio somatik secara histologi... 40
3. Pengambilan sampel untuk isolasi DNA ... 47
4. Komposisi reaksi PCR dengan primer RAPD ... 49
5. Komposisi reaksi PCR dengan primer RAF ... 50
6. Jenis, susunan oligonukleotida, jumlah pita DNA genom dari primer terseleksi ... 52
7. Data pola pita polimorfik hasil analisis RAPD Klon 638 dan 558 kelapa sawit ... 55
8. Jenis, susunan oligonukleotida, jumlah fragmen, jumlah fragmen polimorfik DNA yang terseleksi ... 58
9. Data fragmen polimorfik hasil analisis RAF klon 638 kelapa sawit ... 59
10. Perbandingan teknik analisis RAPD dan RAF pada kotiledon dan planlet ... 60
11. Hasil deteksi lokasi metilasi sitosin DNA genom dengan metode RAF pada klon 638 ... 72
Halaman
1. Alir penelitian, tujuan dan output pada setiap data penelitian ... 8
2. Morfologi abnormal embrio somatik tahap globular N (Normal), Ab (Abnormal) ... 31
3. Morfologi abnormal embrio somatik tahap skutellar berbentuk hati N (Normal), Ab (Abnormal) ... 34
4. Morfologi abnormal embrio somatik tahap kotiledon N (Normal), Ab (Abnormal) ... 34
5. Perkembangan struktur anatomi embrio somatik abnormal pada tiga klon kelapa sawit fase globular ... 37
6. Perkembangan struktur anatomi embrio somatik abnormal pada tiga klon kelapa sawit fase skutellar berbentuk hati ... 38
7. Perkembangan struktur anatomi embrio somatik abnormal pada tiga klon kelapa sawit fase skutellar berbentuk hati ... 39
8. DNA embrio somatik klon 638 dan klon 558 ... 51
9a. Primer W-18. M (marker 1kb) klon 558 dan klon 638 ... 53
9b. Primer SC 10-19. M (marker 1kb) klon 558 dan klon 638 ... 54
10. Deteksi fluorescent dengan elektroferogram RAF. Primer AB-16 (5’-CCCGGATGGT-3’) yang dilebel dengan 6-carboxy-fluorecein (FAM) ... 61
11. DNA Genom Klon 638 (A): Marker DNA 100 ng (M), (B): ES kotiledon dipotong dengan Msp 1 dan Hpa II ... 67
12. Deteksi fluoresen teknik RAF dengan primer AB-16 (5’-CCCGGAT GGT-3’).yang dilabel dengan FAM (6-canboxy-fluorecein) Tanaman Kelapa Sawit klon 638 ... 75
Halaman 1. Profil pita DNA hasil RAPD ... 103 2. Profil fragmen DNA hasil RAF ... 107 3. Profil fragmen DNA hasil RAF dengan pemotongan enzim
Hpa2 dan Msp1 ... 112 4. Profil elusi RP-HPLC DNA genom embrio somatik dan daun
planlet kelapa sawit ... 116
5. Tabel Susunan Sekuens Primer ... 123 6.1 Hasil Analisis RAF Penyimpangan Genetik dengan NTSYS ... 123 6.2 Hasil Analisis RAPD Penyimpangan Genetik dengan NTSYS ... 124
PENDAHULUAN
Latar Belakang
Kelapa Sawit merupakan salah satu tanaman penghasil minyak nabati
terpenting di Indonesia. Ditinjau dari segi ekonomi, kelapa sawit memegang
peranan penting untuk memenuhi kebutuhan minyak , menghasilkan penerimaan
negara terbesar disektor perkebunan, meningkatkan pendapatan negara dan
menggerakkan pembangunan, khususnya di luar pulau jawa (Tondok 1988).
Peningkatan permintaan kelapa sawit sejalan dengan meningkatnya kebutuhan
hasil olahan kelapa sawit berupa crude palm oil (CPO) dan produk derivat
lainnya. Volume produksi CPO di Indonesia pada tahun 2003 10 juta ton (Price
et al. 2007). Potensi kebutuhan minyak sawit dunia tahun 1996 sebesar 15,5 juta
ton, sedangkan pada tahun 2005 diperkirakan sekitar 25,6 juta ton (ICBS 1997).
Salah satu usaha untuk memenuhi permintaan pasar dunia, Indonesia
melakukan peningkatan produksi kelapa sawit dengan cara pembukaan lahan
baru. Luas areal perkebunan kelapa sawit pada tahun 2002 diperkirakan telah
mencapai 4.1 juta ha dengan laju pertumbuhan per tahun sekitar 10% selama 5
tahun terakhir (Direktorat Jenderal Bina Produksi Perkebunan 2002). Untuk
perluasan areal tanam dan peremajaan tanaman, perkiraan kebutuhan bibit kelapa
sawit dalam periode tahun 2000 - 2009 berdasarkan perhitungan 9m x 9m adalah
sebanyak 547.837.800 bibit (Kemala & Wahyudin 2000; Lubis 1992). Permintaan
benih kelapa sawit secara langsung berhubungan dengan agenda perluasan dan
penanaman kembali kebun kelapa sawit, jadi Indonesia memerlukan 70 juta benih
berkecambah setiap tahun.
Penyediaan bibit kelapa sawit dapat dilakukan dengan dua cara, yaitu secara
generatif dan vegetatif. Penyediaan bibit secara generatif menghasilkan bibit
dengan keragaman genetik yang cukup besar karena merupakan hasil persilangan
diharapkan adalah bibit yang seragam dalam pertumbuhan, perkembangan dan
produktivitasnya.
Untuk mengatasi permasalahan tersebut dilakukan penyediaan bibit
menggunakan teknik kultur jaringan. Keunggulan teknik kultur jaringan adalah
mampu menghasilkan bibit dalam jumlah yang banyak dan dalam waktu yang
relatif singkat. Perbanyakan kultur jaringan pada tanaman kelapa sawit melalui
proses embryogenesis dengan pembentukan embrio somatik. Perbanyakan melalui
embrio somatik pada kelapa sawit dimulai dengan pemilihan pohon induk atau
ortet yang sesuai dengan karakter-karakter yang diinginkan, selanjutnya dilakukan
perbanyakan secara klonal. Pembentukan embrio somatik pada kelapa sawit
dikembangkan melalui embriogenesis somatik dalam kultur cair dengan tujuan
otomatisasi dan produksi plantlet serta meningkatkan pertumbuhan dan
keseragaman kultur (Touchet et al. 1991).
Perbanyakan tanaman kelapa sawit melalui embrio somatik telah dilakukan
di beberapa laboratorium. Pusat Penelitian Marihat sejak tahun 1980 telah
merintis perbanyakan tanaman kelapa sawit dengan embrio somatik dan sudah
menghasilkan klon yang unggul yaitu MK 638, 636 dan 558 (Ginting et al. 1991).
Teknologi kultur jaringan kelapa sawit telah dikembangkan di Balai Penelitian
Bioteknologi Perkebunan Indonesia melalui embriogenesis somatik dalam
medium cair (Sumaryono et al. 1994; Tahardi 1998a, 1999). Ada dua mekanisme
yang penting dalam pembentukan embriogenik yaitu, pembelahan sel asimetrik
dan pemanjangan sel kontrol (de Jong et al. 1993). Pembelahan sel asimetrik
berkembang oleh zat pengatur tumbuh yang mengubah polaritas sel melalui
interfensi dengan gradien pH di sekitar sel (Smith dan Krikorian 1990).
Embriogenesis somatik adalah proses dimana struktur bipolar berkembang
membentuk embrio zigotik dari sel nonzigotik tanpa hubungan vascular dengan
jaringan asal. Embriogenesis somatik terjadi melalui rangkaian dari beberapa
tahapan karakteristik embriogenesis somatik. Embrio somatik dapat
berdiferensiasi secara langsung melalui kalus atau tanpa fase kalus (Williams &
Maheswaran 1986).
Embrio somatik yang dihasilkan melalui kultur jaringan menunjukkan
abnormalitas secara sitologi dan mutasi fenotip secara kualitatif dan kuantitatif,
perubahan karyotipe dan perubahan sekuens DNA ( Duncan 1997 ; Kaeppler et
al. 2000). Keragaman somaklonal disebabkan oleh proses kultur jaringan yang
diinduksi dari lingkungan dengan pemberian 2,4 D (Deambrogio & Dale 1980).
Keragaman somaklonal adalah keragaman genetik tanaman yang dihasilkan
melalui kultur jaringan (Larkin & Scowcroft 1981). Keragaman genetik yang
terjadi didalam kultur jaringan disebabkan oleh penggandaan jumlah kromosom
(fusi, endomitosis), perubahan struktur kromosom karena peristiwa delesi,
duplikasi, translokasi dan inversi, perubahan kromatid, perubahan gen dan
perubahan sitoplasma (Griffith et al. 1993; Kumar 1995). Menurut van Harten
(1998) variasi somaklonal kemungkinan disebabkan oleh ketidakteraturan
pembelahan mitotik yang berperan dalam terjadinya ketidakstabilan kromosom
dan aplifikasi atau delesi gen.
Perubahan dalam kultur jaringan sering terjadi melalui mekanisme
stress-response. Mekanisme yang berhubungan dengan kehilangan program kontrol
seluler. Ada beberapa perubahan dalam kultur jaringan yaitu perubahan susunan
kromosom atau mutasi, metilasi DNA. Mutasi yang terjadi pada kultur jaringan
dengan fenomena mutasi salient yang disebut mutasi repeat-induced point (RIP)
yang terjadi saat premeotik, pertama kali ditemukan pada fungi filamentous
(Selker & Steven 1985).
Abnormalitas pembungaan pada tanaman kelapa sawit asal kultur jaringan
dikenal dengan istilah mantel (Corley et al. 1986) terjadi pada rata-rata 5-10 %
dari populasi bibit asal kultur jaringan (Jaligot et al. 2000), bahkan dapat
mencapai 40% (Subronto et al. 1995) bergantung pada klon tanaman.
Masing-masing tanaman dapat menunjukkan keragaman abnormalitas pembungaan dan
kadangkala terjadi pemulihan ke fenotipe normal seiring dengan waktu, karena
kelainan ini bersifat epigenetik (Tregear et al. 2002). Abnormalitas yang terjadi
pada bunga dan buah mungkin disebabkan oleh fitohormon (Jones 1991;
Paranjothy et al. 1993), struktur kalus (Pannetier et al. 1981; Duran-Grasselin
et al. 1993), lama subkultur dan umur kalus (Paranjothy et al. 1993), tekanan
seleksi, jenis eksplan, level ploidi dan kecepatan proliferasi kalus (Skirvin et al.
Keragaman somaklonal diduga berhubungan erat dengan perubahan pola
metilasi DNA selama dalam kultur (Phillips et al. 1990). Hasil penelitian Jaligot
et al. (2000) dan Matthes et al. (2001) menunjukkan adanya korelasi yang nyata
antara hipometilasi dengan keragaman somaklonal pembungaan mantlet pada
bibit kelapa sawit asal kultur jaringan. Untuk mengetahui apakah abnormalitas
tersebut bersifat genetik atau bukan, perlu dilakukan pengamatan genetik pada
tingkat DNA klon kelapa sawit. Analisis tingkat DNA dapat digunakan untuk
deteksi dini pada embrio somatik yang dihasilkan melalui kultur jaringan. Pada
penelitian ini dilakukan deteksi fenotipik dan genetik. Deteksi fenotipik
dilakukan dengan karakterisasi embrio somatik secara morfologi dan histologi.
Deteksi genetik dilakukan dengan teknik Ramdom amplified Polymorphism DNA
(RAPD) dan Randomly Amplified DNA Fingerprinting (RAF).
Beberapa penelitian yang dilakukan dengan teknik RAPD dapat
mendeteksi adanya perbedaan diantara klon-klon kelapa sawit hasil kultur
jaringan pada pola pita polimorfik yang dihasilkan tetapi pola pita yang
dihasilkan tidak spesifik (Wilde et al. 1992). Paranjothy et al. (1993) menyatakan
dari 10 primer yang digunakan untuk analisis abnormalitas klon-klon kelapa sawit
hasil kultur jaringan dengan teknik RAPD, dihasilkan polimorfisme klon normal
dan abnormal, tetapi belum dapat digunakan untuk membedakan klon normal dan
abnormal.Analisis RAPD mempunyai keterbatasan, yaitu sangat sensitif terhadap
kondisi reaksi dan profil suhu. Selain itu, penanda RAPD tidak dapat
membedakan individu homozigot dominan dan heterozigot karena keduanya
sama-sama menghasilkan pita DNA pada pola pita yang dihasilkan (Ronning
et al. 1995).
Analisis DNA dengan RAPD dapat digunakan untuk menentukan penciri
gen atau kromosom dan sidik jari genom dan juga dapat digunakan untuk
membuat peta genom (Miklas et al. 1996). Toruan-Mathius et al. (2002, 2004)
melaporkan bahwa tingkat protein pada buah dan bunga hanya mampu
mengungkapkan perbedaan abnormalitas pada beberapa klon. Hal ini
menunjukkan bahwa abnormalitas pada kelapa sawit hasil kultur jaringan terjadi
Dugaan bahwa keragaman somaklonal pada tanaman kelapa sawit
disebabkan oleh terjadinya perubahan pola metilasi DNA (Joligot et al 2000)
semakin kuat sehingga dalam analisis abnormalitas perlu digunakan teknik yang
lebih sensitif terhadap perubahan tersebut. Deteksi perubahan metilasi DNA
dalam penelitian ini dengan teknik RAF dan RP-HPLC. Bauren et al. (2003)
dilakukan ada tiga metode yang tersedia untuk mempelajari metilasi sitosin pada
genom yaitu (1) pengukuran jumlah sitosin yang termetilasi pada tingkat genom,
(2) DNA digest dengan endonuklease isoschizomers sensitif/insentif metilasi dan
(3) bisulfida genom sequensing assays.
Teknik RAF dengan metode Waldron et al. (2002) dapat digunakan untuk
deteksi lokasi terjadinya metilasi sitosin. RAF yaitu teknik yang
mengkombinasikan antara teknik RFLP dan DAF. Pada teknik RAF, pertama
dilakukan teknik (RLFP) yaitu DNA genom dipotong enzim restriksi yaitu Msp1
atau Hpa II. Tahap kedua, DNA yang telah terpotong diamplifikasi dengan teknik
RAF. Dua enzim yang sering digunakan untuk mendeteksi metil sitosin adalah
MspI dan Hpa II. McClelland et al. (1994) menyatakan bahwa kedua enzim
tersebut mengenal sekuens tetranukleotida 5’-CCGG-3’. Hpa II tidak aktif apabila
kedua sitosin termetilasi secara penuh (kedua utas DNA termetilasi) tetapi dapat
memotong sekuens tersebut dalam keadaan hemimelitasi (hanya satu utas
termetilasi), sebaliknya MspI dapat memotong C5mCGG tetapi tidak memotong
pada kondisi 5mCCGG (Bellucci et al. 2002).
Pengukuran jumlah sitosin yang termetilasi pada tingkat genom dapat
dilakukan dengan teknik RP-HPLC. Menurut Bellucci et al. (2002) metoda
deteksi terjadinya metilasi dilakukan dengan analisis DNA melalui biokimia
seperti HPLC (High Performance Liquid Chromatography) yaitu untuk
mengetahui persentase nukleotida yang termetilasi. Kubis et al. (2003)
membuktikan bahwa Reverse Phase - High Performance Liquid Chromatography
(RP-HPLC) mampu mengidentifikasi tiap nukleotida termasuk metilsitosin dan
Perumusan Masalah
Masalah yang dihadapi dalam pengembangan teknik kultur jaringan untuk
perbanyakan tanaman kelapa sawit adalah:
(1) Terjadi abnormalitas organ reproduktif tanaman yang ada hubungannya
dengan teknik perbanyakan melalui kultur jaringan.
(2) Belum diketahui apakah abnormalitas sudah terjadi pada fase
perkembangan embrio somatik (ES).
(3) Belum diketahui hubungan tingkat dan posisi metilasi sitosin DNA dengan
berbagai tipe abnormalitas pada fase ES.
(4) Belum tersedianya teknik deteksi abnormalitas pada fase ES pada tanaman
kelapa sawit.
Tujuan Penelitian
Penelitian ini bertujuan untuk :
(1) Mengkarakterisasi secara morfologi dan histologi abnormalitas pada tiap
fase perkembangan embrio somatik (ES).
(2) Menganalisis perubahan DNA genom ES yang normal dan abnormal pada
tiap fase perkembangan dengan teknik RAPD dan RAF.
(3) Menganalisis tingkat metilasi sitosin DNA genom ES yang normal dan
abnormal dari tiap fase perkembangan dengan teknik RP-HPLC.
(4) Menganalisis lokasi metilasi sitosin DNA genom ES fase kotiledon yang
Hipotesis Penelitian
(1) ES dari berbagai fase perkembangan, yang normal dan abnormal dapat
dibedakan berdasarkan karakter bentuk morfologi dan histologi.
(2) Terjadi perubahan sekuens DNA genom pada ES yang mengalami
abnormalitas.
(3) Terjadi metilasi eksternal dan metilasi penuh pada sitosin DNA genom ES
yang abnormal.
(4) Tidak ada hubungan langsung antara tingkat metilasi sitosin DNA genom ES
dari berbagai tingkat perkembangan dengan abnormalitas.
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat digunakan untuk :
(1) Menetapkan abnormalitas pada berbagai fase perkembangan ES berdasarkan
bentuk morfologi dan histologi, sehingga dapat menurunkan tingkat
abnormalitas secara dini.
(2) Informasi hubungan perubahan DNA genom pada berbagai bentuk
abnormalitas dari beberapa fase perkembangan ES.
(3) Informasi lokasi terjadinya metilasi sitosin DNA genom ES yang normal dan
abnormal dari tiap fase perkembangan.
(4) Informasi tingkat metilasi sitosin DNA genom ES yang normal dan abnormal
dari tiap fase perkembangan
Peta Alir Penelitian
Pencapaian tujuan penelitian in dilakukan dalam beberapa seri percobaan
I. Karakterisasi abnormalitas embrio somatik kelapa sawit berdasarkan morfologi dan histologi
Tujuan : Mengkarakterisasi abnormalitas ES dari beberapa fase perkembangan, secara morfologi dan histologi
Output : Karakter morfologi dan histologi ES yang normal dan abnormal
II. Analisis abnormalitas embrio somatik dan planlet kelapa sawit dengan teknik Random Amplified Polymorfphism DNA(RAPD) dan Randomly Amplified DNA Fingerprinting (RAF)
Tujuan : Menganalisis perubahan DNA genom dari berbagai tingkat abnormalitas pada setiap fase perkembangan ES dengan teknik RAPD dan RAF.
Output : Informasi hubungan perubahan DNA genom pada berbagai bentuk abnnormalitas dari setiap fase perkembangan ES.
Gambar 1.Alir penelitian, tujuan dan output dari setiap tahap penelitian.
S A W I T (E l a e i s g u i n e e n s i s J a c q )
Tujuan :
Mengkarakterisasi abnormalitas embrio somatik dari beberapa fase perkembangan secara morfologi dan histologi.
2. Menganalisis perubahan DNA genom dari berbagai tingkat abnormalitas pada setiap fase perkembangan ES dengan teknik RAPD dan RAF.
3. Menganalisis tingkat metilasi sitosin DNA ES yang normal dan abnormal dari tiap fase perkembangan.
TINJAUAN PUSTAKA
Tanaman Kelapa Sawit (Elaeis guineensis Jacq.)
Kelapa sawit merupakan tanaman asli Afrika Barat yang selanjutnya
menyebar ke Amerika Selatan dan sampai ke semenanjung Indo-Malaysia. Kelapa
sawit pertama kali diintroduksi ke Indonesia oleh pemerintah kolonial Belanda
pada tahun 1848, tepatnya di kebun Raya Bogor. Tanaman kelapa sawit mulai
dikenal di Indonesia dan dibudidayakan secara komersil dalam bentuk perusahaan
perkebunan pada tahun 1911. Pada mulanya hanya berkembang di Sumatera Utara
dan Riau yang kemudian berkembang di seluruh Indonesia (Hartley 1977).
Kelapa sawit (Elaeis guineensis Jacq) merupakan tanaman monokotil
anggota keluarga Arecaceae (Jones 1994) yang banyak dibudidayakan di
Indonesia (Hartley 1977). Tanaman kelapa sawit termasuk dalam divisi
Tracheophyta, subdivisi Pteropsida, kelas Angiospermae, subkelas
Monocotyledoneae, ordo Cocoidea, famili Arecaceae, genus Elaeis dan spesies
Elaeis guineensis Jacq, Elaeis oleifera (H.B.K) Cortes dan Elaeis odora (Pahan
2006).
Kelapa Sawit merupakan tanaman menyerbuk silang sehingga di alam akan
dihasilkan keturunan yang heterozigot heterogen. Menurut Madon dan Clyde
(1995) tanaman kelapa sawit mengandung 32 kromosom. Tipe pembungaan
tanaman kelapa sawit adalah berumah satu dengan bunga betina dan bunga jantan
ada dalam satu tanaman, tetapi berbeda tandan bunga. Bunga akan tumbuh pada
setiap ketiak pelepah daun setiap tanaman dapat menghasilkan bunga jantan atau
bunga betina saja dan masing-masing mempunyai polinasi yang berbeda-beda.
Hal ini menyebabkan terjadinya penyerbukan silang (Lubis 1992).
Berdasarkan warna buah maka spesies Elaeis guineensis Jacq
dikelompokkan atas : (1) Nigrescens yaitu memiliki warna buah violet sampai
hitam waktu muda dan menjadi merah kuning (orange) setelah matang, (2)
berwarna orange, (3) Albescens yaitu buah muda berwarna kuning pucat, tembus
cahaya karena mengandung sedikit karoteindan, (4) Poissoni yaitu tipe buah
abnormal bersayap yang disebut buah mantel. Buah bersayap yaitu stamen yang
rudimenter berkembang menjadi karpel tambahan pada bunga betina ( Price et al.
2007).
Menurut Hartley et al. (1977), kelapa sawit dibedakan ke dalam tiga tipe
berdasarkan ketebalan cangkang buahnya yaitu dura, pisifera dan tenera. Dura
memiliki tebal cangkang 2 – 8 mm, kandungan mesokarp rendah sekitar 35-55 %.
Tenera memiliki tebal cangkang 0,5 - 4 mm, kandungan mesokarp sekitar 60- 96
%. Pisifera memiliki cangkang yang lebih tipis. Ketebalan cangkang dikendalikan
oleh gen tunggal. Tipe buah alami ini dikontrol oleh monogenik yang menjadi
dasar untuk klasifikasi minyak sawit yaitu: Dura (ShSh), Tenera (Shsh) dan
Pisifera (shsh).
Buah kelapa sawit tersusun dalam satu tandan yang merupakan buah batu
dan terdiri atas kulit buah, daging buah, cangkang dan inti. Minyak sawit
diekstrak dari bagian kulit buah dan daging buah yang disebut bagian perikarp
sebanyak 20 % - 27 % sedangkan bagian inti hanya mengandung minyak 4-6%.
Varietas tanaman kelapa sawit cukup banyak dan dapat diklassifikasikan
berdasarkan berbagai hal, antara lain tipe buah, bentuk luar, tebal cangkang dan
warna buah (Pahan 2006).
Perakaran serabut tanaman kelapa sawit sangat dangkal (15 cm - 30cm),
yaitu dekat dengan permukaan tanah. Batang tegak dan tidak bercabang dengan
diameter 40 - 75 cm. Tinggi batang sangat bervariasi, tinggi tanaman kelapa sawit
yang dibudidayakan 15 m - 18 m, berdaun majemuk dengan pelepah daun
majemuk dengan pelepah daun tersusun melingkari batang berbentuk spiral.
Panjang pelepah daun kira-kira 9 m, lengan panjang helai daun mencapai 1,2 m
Media Kultur Jaringan
Keberhasilan kultur jaringan tanaman untuk perbanyakan tergantung pada
media yang digunakan. Media kultur jaringan tidak hanya mengandung unsur
makro dan mikro, tetapi juga karbohidrat (sukrosa) sebagai sumber karbon. Hasil
yang lebih baik dapat dicapai apabila ke dalam media ditambahkan komponen
organik seperti vitamin, asam amino dan zat pengatur tumbuh. Beberapa
komponen media yang komposisinya tidak jelas (undifined component) misalnya
juice buah, ekstrak ragi, dan kasein hidrolisa, sering ditambahkan dalam media
dan dapat memberikan hasil yang baik (George & Sherrington 1984).
Pemilihan komposisi media tergantung pada jenis tanaman yang
dikulturkan (Pierik 1987). Saat ini terdapat banyak formulasi media yang biasa
digunakan untuk kultur in vitro. Beberapa macam media yang banyak digunakan
untuk menunjang perbanyakan tanaman secara in vitro adalah formulasi
Murashige dan Skoog (MS), Vasin dan Went, Nitsch dan Nitsch, White dan
Knudson C (Gunawan 1988). Sampai saat ini, regenerasi kelapa sawit melalui
embriogenesis telah dicapai dengan menggunakan media Murashige dan Skoog
(MS) (Tahardi 1988a ; Ginting & Fatmawati 1997; Sumaryono et al. 1994).
Unsur hara anorganik tersebut terdiri atas unsur hara makro yang meliputi
N,P,K,Ca,Mg dan S serta unsur mikro yang meliputi Fe, Mn, Zn, B, Cu dan Mo
(George & Sherington 1984). Vitamin yang sering digunakan dalam media kultur
jaringan adalah tiamin (B1), asam nikotin (niacin) dan piridoksin (B6). Vitamin
ini berperan dalam reaksi enzimatik yang penting bagi pertumbuhan jaringan
tanaman (George & Sherington 1984). Selain itu penambahan mio-inositol ke
dalam media juga diketahui dapat memperbaiki pertumbuhan bahan tanaman yang
dikulturkan.
Gula merupakan komponen penting dalam media kultur untuk pertumbuhan
dan perkembangan in vitro, sebab gula merupakan sumber energi yang biasa
didapat tanaman dari atmosfer melalui proses fotosintesis. Sukrosa merupakan
sumber karbon terbaik diikuti glukosa, maltosa dan rafinosa. Sedangkan fruktosa,
galaktosa, manosa dan laktosa kurang efektif digunakan (George & Sherington
1984). Agar sebagai bahan pemadat merupakan polisakarida yang diperoleh dari
sehingga kontak antara eksplan dengan media dengan udara terpenuhi (Pierik
1987). Umumnya konsentrasi agar yang ditambahkan dalam media kultur berkisar
antara 0.6 - 1 % (Gunawan 1988).
Derajad asam (pH) media merupakan faktor penting yang mempengaruhi
fungsi membran sel dan pH sitoplasma. Pengaruh pH juga harus
mempertimbangkan berbagai faktor, seperti kelarutan garam-garam penyusun
media. Serapan dari zat pengatur tumbuh oleh eksplan, serta efisiensi pembekuan
agar (Gunawan 1988). Sel-sel tanaman biasanya membutuhkan pH sedikit asam
yang berkisar antara 5.5 - 5.8 (Gamborg & Shyluk 1981).
Auksin yang biasa digunakan dalam kultur jaringan adalah IAA
(3indoleacetic acid), 3indolebutyric acid (IBA), 1asam naftalenat (NAA) dan 2,4
-asam dikloro penoksiacet (2,4-D) (George & Sherington 1984). Penggunaan
bermacam-macam auksin ini sangat tergantung pada tipe pertumbuhan yang
dikehendaki, kandungan auksin endogen, kemampuan jaringan mensintesis auksin
dan zat pengatur tumbuh lain yang ditambahkan (Davies 1995). Senyawa 2.4-D,
2.4.5 T dan 4-CPA adalah jenis herbisida fenoksi yang dalam konsentrasi rendah
berfungsi sebagai auksin (Davies 1995). Auksin yang banyak digunakan untuk
induksi kalus adalah 2.4-D, 2.4.5-T dan picloram. Auksin 2,4 D yang paling
sering digunakan untuk mendorong pembentukan embrio somatik. Embriogenesis
sangat memerlukan zat pengatur tumbuh auksin maupun sitokinin (Wattimena,
1992).
Auksin adalah zat pengatur tumbuh yang berperan dalam pertumbuhan akar,
kalus, penghambatan pembentukan tunas adventif dan tunas aksilar serta
diferensiasi sel (Pierik 1987). Griffith et al. (1993), mengatakan bahwa pada
beberapa tanaman, auksin dapat mengendalikan RNA dan sintesis protein dengan
cara berperan sebagai pengaktif mRNA (messenger RNA). Dalam sintesis protein,
terjadi proses transkripsi mRNA dari DNA template (cetakan) kemudian tRNA
menerjemahkan sandi yang dibawa oleh mRNA menjadi asam amino. Sintesis
protein terjadi di ribosom dan rRNA (ribosom RNA) berfungsi mengenali mRNA
Pengaruh zat pengatur tumbuh dapat merangsang, menghambat atau
mengubah pola pertumbuhan dan perkembangan tanaman (Moore 1979). Zat
pengatur tumbuh ini mempengaruhi pertumbuhan dan morfogenesis dalam kultur
sel, jaringan dan organ. Interaksi dan perimbangan antara zat pengatur tumbuh
yang diberikan dalam media dan yang diproduksi oleh sel secara endogen,
menentukan arah perkembangan suatu kultur (Gunawan 1988).
Zat pengatur tumbuh 2,4 D pada konsentrasi rendah akan menginduksi
terbentuknya kalus, tetapi pada konsentrasi tinggi akan menyebabkan timbulnya
mutasi karena 2,4 D bersifat herbisida dan akan menyebabkan perubahan jaringan
tanaman (Goldsworty & Mina 1991). Konsentrasi 2,4 D yang tinggi didalam
media dapat meningkatkan jumlah metilasi DNA pada sel tanaman wortel
(LoSchiavo et al. 1989). Total persentase residu metilasi sitosin dari sel
embriogenik 16 %, embrio somatik preglobular 14% dan embrio somatik dewasa
19%.
Embrio Somatik
Embriogenesis somatik adalah perkembangan embrio dari sel somatik
sampai struktrur yang menyerupai embrio zigotik yang dapat terjadi secara
langsung maupun tidak langsung (Pierik 1989). Embrio somatik yang dapat
berdiferensiasi secara langsung yaitu pembentukan embrio dari sel atau jaringan
tanpa melalui pembentukan kalus dan ada yang secara tidak langsung melalui
kalus (Williams & Maheswaran 1986). Eksplan yang mengandung sel
embriogenik dapat langsung memperbanyak diri dan berkembang menjadi embrio
somatik berbentuk globular, hati, torpedo dan kotiledon pada tanaman dikotil
(Jurgens et al. 1991). Pada tanaman monokotil tahap perkembangaan embrio
somatik melalui fase globular, skutellar berbentuk hati dan kotiledon.
Pembentukan embrio somatik pada kelapa sawit dikembangkan melalui
embriogenesis somatik dalam kultur cair dengan tujuan otomatisasi dan produksi
planlet serta meningkatkan pertumbuhan dan keseragaman kultur (Touchet et al.
1991 ; Duval et al. 1993; Sumaryono et al. 1994; Teixeira et al. 1995; Ginting &
Regenerasi planlet kelapa sawit dengan teknik kultur jaringan adalah
melalui proses embriogenesis somatik tidak langsung (indirect somatic
embryogenesis). Dalam proses ini jaringan atau sel pada eksplan mengalami
dediferensiasi membentuk kalus yang selanjutnya berdiferensiasi untuk
membentuk embrio somatik. Ada dua tipe kalus kelapa sawit, yaitu nodullar
compact callus (NCC) dan fast growing callus (FGC). Kedua kalus ini dapat
menghasilkan embrio somatik, namun diduga embrio somatik yang berasal dari
FGC akan menghasilkan tanaman dengan bunga abnormal (Ginting & Samosir
1996).
Perbanyakan tanaman kelapa sawit dengan kultur jaringan meliputi
beberapa tahap, yaitu inisiasi kalus embriogenik (EC), proliferasi dari kalus
embriogenik (EG), dan pembentukan tunas dan akar. Inisiasi kalus embriogenik
dilakukan dengan suspensi sel yang berlangsung kira-kira 3 bulan, kemudian
disubkultur agar terjadi proliferasi dari kalus embriogenik tersebut. Setelah terjadi
proliferasi embriogenik, dilanjutkan dengan pembentukan embrioid yang
membutuhkan waktu kira-kira dua bulan yang selanjutnya disubkultur pada media
padat untuk pembentukan tunas dan perakaran sehingga terbentuk plantlet (Wong
et al. 1999).
Untuk menginisiasi kalus embriogenik yang di proliferasi menjadi embrio
somatik diperlukan zat pengatur tumbuh 2,4-D. Pemakaian auksin tersebut pada
tanaman dikotil harus dalam konsentrasi lebih rendah dari pada tanaman
monokotil. Pada tanaman dikotil konsentrasi auksin 2.4-D, 2.4.5-T dan picloram
yang digunakan berkisar 4.0 – 14 uM. Pada tanaman monokotil terutama
tanaman serelia konsentrasi 2.4-D yang digunakan 9.0 – 45.0 uM (2.0 – 10.0
mg/l), kadang-kadang dibutuhkan sitokinin dalam konsentrasi rendah
(Wattimena, 1992), sedangkan pada tanaman kelapa sawit sekitar 10 – 100 mg/l.
Pannetier et al., (1991) menyatakan untuk menginduksi kalus yang embriogenik
pada tanaman kelapa sawit dibutuhkan konsentrasi 2,4-D 80 - 100 mg/l.
Deambrogio dan Dale (1980) menyatakan konsentrasi 2,4-D yang tinggi
sangat terkait dengan peningkatan variabilitas pada tanaman Hordeum vulgare.
Shepard (1981) juga melaporkan bahwa penggunaan 2,4-D bersama-sama
tanaman kentang. Zat pengatur tumbuh 2,4-D pada konsentrasi rendah akan
menginduksi terbentuknya kalus, tetapi pada konsentrasi tinggi sering dianggap
sebagai penyebab timbulnya mutasi karena bersifat herbisida dan akan
menyebabkan perubahan jaringan tanaman untuk mempertahankan diri dengan
mengubah sistem metabolismenya sehingga akan terjadi perubahan genetik atau
epigenetik atau hanya perubahan fisiologi saja (Meins & Beinns 1977 ;
Suryowinoto 1996). Penggunaan konsentrasi 2,4-D yang tinggi dapat
menimbulkan keragaman somaklonal pada klon-klon kelapa sawit hasil kultur
jaringan.
Keragaman Somaklonal Hasil Kultur Jaringan
Keragaman somaklonal adalah keragaman genetik tanaman yang dihasilkan
melalui kultur jaringan (Larkin & Scowcroft 1981). Keragaman ini berasal dari
keragaman genetik eksplan dan keragaman genetik yang terjadi di dalam kultur
jaringan. Dengan demikian perubahan genetik tersebut bukan disebabkan oleh
peristiwa segregasi maupun rekombinasi gen seperti biasa terjadi akibat proses
hibridisasi.
Keragaman pada eksplan disebabkan adanya sel-sel bermutasi maupun
adanya polisomik dari jaringan tertentu (Wattimena 1992). Keragaman
somaklonal tidak muncul sebagai fenomena yang sederhana, dan mungkin
merefleksikan perbedaan-perbedaan "pre-existing cellular genetic" atau
keragaman yang di iduksi oleh kultur jaringan (Thorpe 1990). Keragaman genetik
yang terjadi di dalam kultur jaringan disebabkan oleh penggandaan jumlah
kromosom (fusi, endomitosis), perubahan struktur kromosom, perubahan gen dan
perubahan sitoplasma (Griffith et al. 1993; Kumar 1995). Menurut van Harten
(1998) keragaman somaklonal kemungkinan disebabkan oleh ketidakaturan
mitotik yang berperan dalam terjadinya ketidakstabilan kromosom dan amplifikasi
atau delesi gen.
Melalui teknik kultur jaringan ini terdapat dua hal yang berbeda
kepentingannya bagi pemuliaan tanaman yaitu mempertahankan kestabilan
genetik atau merangsang keragaman genetik. Kestabilan genetik dapat dicapai
berdiferensiasi, sedangkan keragaman genetik dapat dicapai dengan fase tidak
berdiferensiasi yang relatif panjang (Wattimena & Mattjik 1992).
Keragaman somaklonal pada dasarnya terjadi akibat peristiwa mutasi, yaitu
perubahan suatu karakter yang diwariskan yang disebabkan oleh berubahnya
pembawa sifat menurun (inherited trait) baik pada tingkat morfologi, sitologi
(jumlah dan struktur kromosom), sitokimia (ukuran genom), biokimia (protein
dan isoenzim), dan tingkat molekuler (genom) (Rani & Raina 2000; D'Amato
1986). Faktor-faktor yang mempengaruhi terjadinya keragaman somaklonal
adalah : (1) genotipa, (2) lingkungan kultur, (3) sumber eksplan, dan (4) lama fase
kalus, (5) lama durasi kultur (Evans et al. 1986; Koornneef 1991 ; Ignacimuthu
1997).
Pada tanaman yang berasal dari kultur jaringan dapat timbul keragaman
yang disebabkan perubahan genetik atau epigenetik (faktor genetik tidak berubah
tetapi ekspresi berubah). Keragaman somaklonal pada klon-klon kelapa sawit
yang terjadi pada hasil kultur jaringan kelapa sawit yang muncul antara lain
berupa keragaman bentuk buah yang abnormal (mantel) dan rasio bunga jantan/
betina yang meningkat sehingga menyebabkan penurunan produksi minyak.
Muluk (1990) mengamati sifat pembungaan dari beberapa klon kelapa sawit hasil
kultur jaringan yaitu terjadi bentuk bunga hermaprodit dan buah mantel yang
banyak. Mantel diduga disebabkan oleh epigenetik yaitu hipometilasi.
Keragaman somaklonal tanaman diduga berhubungan erat dengan
perubahan pola metilasi DNA selama dalam kultur (Phillips et al. 1990). Hasil
penelitian Jaligot et al. (2000) dan Matthes et al. (2001) menunjukkan adanya
korelasi yang nyata antara hipometilasi DNA dengan keragaman somaklonal
pembungaan mantel pada bibit kelapa sawit hasil kultur jaringan.
Abnormalitas Tanaman Kelapa Sawit Hasil Kultur Jaringan
Abnormalitas pada pembungaan kelapa sawit asal kultur jaringan
disebabkan oleh keragaman somaklonal atau epigenetik. Meins dan Binns (1977)
mengemukakan dua hipotesis mengenai variasi somaklonal yang menyebabkan
gejala abnormalitas pada tingkat sel berkaitan dengan sumber jaringan tanaman
merespon kondisi kultur dan adanya proliferasi dari klon yang bersifat chimera.
Pembentukan tumor pada suatu jaringan akibat pelukaan dapat meyebabkan
terjadinya epigenetic cellular sehingga perubahan hanya bersifat seluler saja tidak
seluruh bagian tanaman.
Abnormalitas pembungaan pada tanaman kelapa sawit asal kultur jaringan
dikenal dengan istilah mantel, hal ini berkaitan dengan lamanya waktu subkultur
(Corley et al, 1986). Menurut Paranjothy et al. (1993) menyatakan abnormalitas
yang terjadi berhubungan erat dengan frekuensi subkultur yang kontinyu dan
umur kalus. Semakin sering frekuensi sub-kultur, semakin besar kemungkinan
terjadinya abnormalitas.
Abnormalitas pembungaan terjadi pada rata-rata 5 - 10 % dari populasi bibit
asal kultur jaringan (Jaligot et al. 2000), bahkan dapat mencapai 40 % (Subronto
et al. 1995) bergantung pada klon tanaman. Masing-masing tanaman dapat
menunjukkan keragaman abnormalitas pembungaan dan kadangkala terjadi
pemulihan ke fenotipe normal seiring dengan waktu, karena kelainan ini bersifat
epigenetik (Tregear et al. 2002). Perubahan ekspresi gen ini mungkin disebabkan
oleh fitohormon (Jones 1991; Paranjothy et al. 1993), struktur kalus (Pannetier
et al. 1981; Duran-Grasselin et al. 1993), lama subkultur dan umur kalus
(Paranjothy et al. 1993), tekanan seleksi, jenis eksplan, tingkat ploidi dan
kecepatan proliferasi kalus (Skirvin et al. 1984 ; Karp 1995).
Metilasi DNA pada Tanaman Hasil Kultur Jaringan
Metilasi adalah penambahan kelompok metil ke nukleotida DNA dan asam
amino pada protein. Metilasi DNA pada tanaman diimplikasikan pada pengaturan
ekspresi gen (Antequera & Bird 1988) yaitu berpengaruh langsung terhadap
transkripsi DNA atau tidak langsung melalui perubahan struktur kromatin
(Adams 1990; Razin & Cedar 1991). Bentuk metilasi yang umum adalah metilasi
pada basa sitosin yang dikatalisis oleh enzim metiltransferase dengan
menambahkan kelompok metil kebasa sitosin (Martienssen & Colot 2001).
Kalisz dan Purugganan (2004) bahwa dua tipe utama metilasi yang
dihubungkan dengan perubahan epigenetik adalah metilasi DNA dan metilasi
dengan metilasi tinggi maka ekspresi gen rendah atau sebaliknya dan adanya pola
metilasi jaringan spesifik pada beberapa kasus (Gardner et al. 1991). Muncul
beberapa pendapat bahwa regulasi ekspresi gen terjadi melalui perubahan struktur
kromatin lokal (Davey et al. 1997). Metilasi dan demetilasi sitosin pada daerah
promotor merupakan mekanisme yang penting meregulasi ekspresi gen pada sel
dan jaringan spesifik (Boyes & Bird 1991; Renkens et al. 1992).
Fraga dan Esteller (2002) menyatakan bahwa metilasi sitosin pada posisi 5
dari cincin pirimidin merupakan epigenetik yang sangat penting pada tanaman,
metil sitosin umumnya ditemukan pada sitosin yang terikat pada basa guanin
dengan sekuens trinukleotida (CpNpG). Ehrlich dan Ehrlich (1998)
mengemukakan bahwa adanya 5 metilsitosin pada promoter gen spesifik akan
mengubah pelekatan faktor transkripsional dan protein lainnya pada DNA. Di
samping itu dapat juga terjadi penarikan metil-DNA-binding protein dan histon
deasetilase yang akan mengubah struktur kromatin di sekitar daerah awal
trasnkripsi pada gen. Kedua mekanisme tersebut menghambat transkripsi dan
menyebabkan gen.
Pada tanaman tingkat tinggi 5m-C ditemukan pada beberapa sekuens
genom nuklear yang lebih sering pada dinukleotida CG dan trinukleotida CNG.
Metilasi sitosin pada nukleotida CG dan CNG ditemukan sepanjang kromosom
dan bertindak meregulasi ekspresi gen yang terjadi pada level gen atau secara
regional yang mempengaruhi daerah kromosom. Fungsi metilasi regional untuk
menginaktifkan heterokromatin dan elemen pada atau dekat heterokromatin
menyebabkan frekuensi metilasi pada daerah heterokromatin lebih besar (Bird,
1986). Struktur heterokromatin memperlambat transkripsi sedangkan struktur
eukromatin mengaktivasi ekspresi gen (Richards & Elgin 2002).
Kelapa sawit yang berasal dari kultur jaringan mengalami abnormalitas pada
bunga dan buah. Abnormalitas bunga meliputi bunga jantan tidak menghasilkan
serbuk sari dan atau serbuk sarinya steril serta terjadi feminisasi organ jantan
(Corley et al. 1986). Abnormalitas ini dapat disebabkan keragaman somaklonal
pada masa kultur. Keragaman somaklonal diduga berhubungan erat dengan
perubahan pola metilasi DNA selama dalam kultur (Phillips et al. 1990). Hasil
korelasi yang nyata antara hipometilasi dengan keragaman somaklonal
pembungaan mantlet pada bibit kelapa sawit asal kultur jaringan. Demetilasi
terjadi selama kondisi kultur jaringan menunjukkan bahwa gen-gen dapat
diaktifkan melalui proses kultur jaringan (Finnegan et al. 1998).
Menurut Kakutani et al. (1996) hipometilasi DNA yang terjadi dapat
meningkatkan laju mutasi disebabkan terjadinya peningkatan transposisi elemen
atau peningkatan laju rekombinasi yang dimediasi pengaturan genom kembali dan
mengakibatkan tanaman arabidopsis menderita cacat atau penyimpangan lain.
Kaeppler (1992) mengemukakan terjadinya hipometilasi DNA memiliki frekuensi
yang sangat tinggi pada kultur jaringan. Akan tetapi pada kultur jaringan tidak
selalu terjadi penurunan metilasi siotosin. Menurut Smulders et al. (1995)
mendeteksi terjadi peningkatan metilasi pada kalus tomat dibandingkan dengan
daun induk, sama halnya terjadi pada kacang hasil turunan dari kultur jaringan
menunjukkan terjadi proses hipermetilasi (Cecchini et al. 1992), perubahan
metilasi DNA pada tanaman kultur jaringan kentang (Hardining 1994), pisang
(peraza-Echeverria et al. 2001).
Tanaman dengan penurunan metilasi sitosin memperlihatkan sejumlah
fenotip dan perkembangan abnormal meliputi menurun dominasi apikal, ukuran
tanaman lebih kecil, ukuran dan bentuk daun berubah, fertilisasi menurun dan
waktu pembungaan berubah (Finnegan et al. 1996). Woffe et al. (1999) metilasi
pada C dalam DNA genomik memainkan peran kunci dalam regulasi ekspresi
gen. Sebagian besar hipotesis mengatakan bahwa pola metilasi yang terbentuk
selama perkembangan mengalami demetilasi pada jaringan spesifik dimana
kelompok metil dilepaskan dari tempat kritis dari suatu gen yang telah
dijadwalkan terekspresi pada tipe sel tertentu.
Analisis Genotipik Embrio Somatik dengan Marka Molekuler
Potensi penggunaan marka sebagai alat untuk melakukan karakterisasi
genetik dalam program pemuliaan telah dikenal sejak puluhan tahun yang lalu.
Marka dapat dikategorikan sebagai marka morfologi, sitologi dan yang terbaru
adalah marka molekuler (Sessions 1996). Saat ini, kemajuan dalam biologi
cabang ilmu yang mempelajari organisme ditingkat DNA. Teknik ini sangat
membantu dalam melakukan studi genetik dengan ketepatan yang lebih akurat.
Untuk mendapatkan informasi genetik dapat dilakukan dengan menggunakan
marka molekuler, seperti isozim, RFLP, RAPD, SSR, AFLP (Powell et al. 1996;
Vos et al. 1995 ; Karp et al. 1995), DAF dan RAF (Waldron et al. 2002).
Marka RAPD yang dikembangkan oleh William et al. (1990) dihasilkan
melalui amplifikasi DNA secara in vitro dengan menggunakan teknik PCR. PCR
yang ditemukan Mullis (1980) berkembang sangat cepat sebagai teknik dalam
biologi molekuler. RAPD-PCR adalah metode sintesis DNA secara in vitro atau
teknik memperbanyak molekul DNA dengan menggunakan sekuen acak primer
oligonukleotida (10 basa primer) dan DNA polymerase tahan panas yang dapat
mempertahankan aktivitas sampai suhu 94 oC. Prosedur dalam teknik PCR terdiri
dari proses : (1) denaturasi yaitu DNA cetakan menjadi DNA utas tunggal dengan
suhu sekitar 94oC, (2) penempelan primer ke ujung utas DNA dengan suhu sekitar
55oC, dan (3) pemanjangan DNA atau amplifikasi DNA yang dimulai dari primer
diujung 5’ ke ujung 3’ dengan suhu sekitar 72oC.
PCR membutuhkan DNA polymerase, dNTPs, DNA cetakan, primer dan
buffer reaksi. DNA polymerase yang digunakan Taq polimerase yang diperoleh
dari bakteri yang tahan suhu tinggi yaitu Thermus aquaticus. DNA cetakan,
diperoleh dari hasil isolasi DNA yang akan diamplifikasi. Primer, merupakan
beberapa nukleotida yang berfungsi sebagai inisiasi proses sintesis DNA. Dalam
PCR dibutuhkan 2 primer yaitu leftprimer (forward) dan right primer (reverse),
sedangkan apabila menggunakan satu primer, teknik ini disebut RAPD-PCR (Hoy
1994). Hallden et al. (1996) menyatakan reaksi PCR sangat dipengaruhi oleh
komponen reaksi (MgCl2, buffer, enzim, DNA cetakan, primer, nukleotida dan
H2O), suhu denaturasi, suhu penempelan primer pada DNA cetakan, suhu
pemanjangan, jumlah siklus serta keutuhan dan kemurnian DNA cetakan.
Teknik RAPD lebih sederhana dibandingkan dengan marka RFLP yaitu (1)
DNA tidak dipotong dengan enzim restriksi, (2) contoh DNA yang diperlukan
relatif sedkit, (3) tidak memerlukan prosedur penanda, (4) tidak memerlukan
hibridisasi DNA, dan (5) tidak memerlukan pemindahan DNA ke membran nilon
polimorfisme, yang dapat mempercepat identifikasi dan isolasi fragmen DNA
yang spesifik (Williams et al. 1990)
Toruan-Mathius dan Hutabarat (1997) menyatakan analisis DNA dapat
mengevaluasi klon, varietas atau hibrida dan kestabilan genetik. Rongwen et al.
(1995); Akagi et al. (1996) dan Ayeres et al. (1997) menyatakan bahwa
amplifikasi penanda molekuler telah berkembang dan ditujukan untuk mengatasi
masalah, melengkapi atau menguatkan penanda lainnya misalnya penanda
morfologi, sitologi, histologi, isoenzim dan biokimia. Analisis RAPD mempunyai
keterbatasan, yaitu sangat sensitif terhadap kondisi reaksi dan profil suhu. Selain
itu, penanda RAPD tidak dapat membedakan individu homozigot dominan dan
heterozigot karena keduanya sama-sama menghasilkan pita DNA pada pola pita
yang dihasilkan (Ronning et al. 1995). Analisis DNA dengan RAPD dapat
digunakan untuk penciri gen atau kromosom dan sidik jari genom dan juga dapat
digunakan untuk membuat peta genom (Miklas et al. 1996).
Abnormalitas pada kelapa sawit dapat terjadi akibat perubahan
oligonukleotida atau metilasi DNA. Metilasi adalah suatu proses epigenetik yang
mempengaruhi ekspresi DNA tanpa merubah sekuens DNA. Jaligot et al. (2000)
menduga bahwa keragaman somaklonal pada tanaman kelapa sawit disebabkan
oleh terjadinya perubahan pola metilasi DNA. Methylation-Sensitive Amplified
Polymorphism merupakan suatu teknik baru mengenai DNA finger printing yang
didasarkan pada fragmen PCR yang selektif dari sebuah total genom. Teknik
MSAP menggunakan primer semi-arbitrary untuk melakukan annealing lebih
spesifik pada fragmen DNA hasil restriksi dari suatu total genom DNA. Sebelum
amplifikasi PCR, DNA genom mengalami pemotongan dengan dua enzim
restriksi HpaII dan MspI sehingga dihasilkan potongan fragmen yang digunakan
sebagai DNA cetakan dalam PCR untuk proses amplifikasi (Xiong at al. 2000).
Isozomer HpaII dan MspI digunakan menggantikan MseI sebagai enzim
restriksi. Teknik Methylation-Sensitive Amplified Polymorphism merupakan
teknik AFLP standar (Vos et al. 1995) dimodifikasi untuk mengkorporasi
penggunaan enzim restriksi sensitif terhadap metilasi (Portis et al. 2004). Teknik
digunakan untuk tujuan deteksi abnormalitas pada variasi somaklonal hasil kultur
jaringan pada tanaman kelapa sawit (Matthes et al. 2000).
Polimorfisme DNA yang diidentifikasi melalui MSAP memiliki pola yang
mengikuti model pewarisan segregasi Mendel sehingga hal ini bermanfaat untuk
typing dan identifikasi pertautan penanda molekuler untuk lokus yang
bertanggung jawab pada suatu karakter tertentu, misalnya perubahan pola metilasi
DNA yang menyebabkan tanaman abnormalitas hasil kultur jaringan (Portis et al.
2004 ; Joligot et al. 2000).
Di samping itu dapat juga digunakan teknik RAF- sensitif metilasi untuk
deteksi situs terjadinya metilasi sitosin pada DNA genom. Teknik RAF–sensitif
metilasi adalah modifikasi dari metode Waldron et al.(2002). Teknik RAF-sensitif
yaitu teknik yang mengkombinasikan antara teknik RFLP dan DAF. Pada teknik
RAF, pada tahap awal dilakukan teknik (RLFP) yaitu DNA genom dipotong
enzim restriksi yaitu MspI ataua Hpa II. Tahap kedua, DNA yang telah terpotong
diamplifikasi dengan teknik DAF yang dimodifikasi yang disebut RAF–sensitif
metilasi. Menurut Lewin (1997) enzim HpaII memotong sekuen CCGG tetapi
jika C keduanya mengalami metilasi sekuen tersebut tidak terpotong. MspI tidak
memotong bila C eksternal termetilasi (mCCGG) tetapi akan memotong bila
memiliki primer oligonukleotida 10-mer dengan konsentrasi yang tinggi, suhu
penempelan (annealing) yang tinggi pada 53 – 59 oC dan menggunakan fragmen
DNA polymerase Soffel; (2) primer dilabel dengan radioaktif atau fluoresens; (3)
pemisahan fragmen dan deteksi hasil amplifikasi dengan sekuensing gel
poliakrilamid atau mesin DNA sekuensing (Waldron et al. 2002).
Berbagai analisis digunakan untuk mengungkapkan kejadian abnormalitas
bunga dan buah kelapa sawit yang berasal dari kultur jaringan. Studi ploidi (Rival
hubungan abnormalitas buah bersayap dengan perbedaan ploidi dan aktivitas
transposon tetapi berhubungan dengan perubahan pola metilasi. Penelitian
mengenai metilasi DNA dapat didekati melalui beberapa cara dan teknik untuk
mengetahui keberadaan dan daerah lokasi terjadinya metilsitosin dalam genom
(Grigg & Clark 1994; Rein et al. 1998; Saluz & Jost 1993). Sedang tingkat
metilsitosin dalam DNA genomik dapat diukur dengan Reverese Phase High
Performance Liquid Chromatography (RP-HPLC) atau dengan sistem enzim
maupun kimiawi (Fraga et al. 2000). Matthes et al. (2001) membuktikan
penurunan metilasi diperoleh pada situs CCGG.
Pengukuran jumlah sitosin yang termetilasi pada tingkat genom dapat
dilakukan dengan teknik RP-HPLC. Menurut Bellucci et al. (2002) metode
deteksi terjadinya metilasi yaitu dengan analisis DNA melalui biokimia seperti
HPLC yaitu untuk mengetahui persentase nukleotida yang termetilasi. Kubis et al.
(2003) membuktikan bahwa RP-HPLC mampu mengidentifikasi tiap nukleotida
BAB 3
KARAKTERISASI MORFOLOGI DAN HISTOLOGI ABNORMALITAS EMBRIO SOMATIK KELAPA SAWIT (Elaeis guineensis Jacq)
ABSTRAK
Pembentukan planlet dalam kultur jaringan kelapa sawit terjadi melalui kalus yang berkembang secara embriogenesis somatik. Proses perkembangan embrio somatik (ES) dalam medium dapat menimbulkan abnormalitas khususnya organ reproduktif pada tanaman dewasa. Abnormalitas pada fase ES belum banyak diketahui. Penelitian ini bertujuan untuk mengkarakterisasi abnormalitas ES dari beberapa fase perkembangan secara morfologi dan histologi. Bahan tanam yang digunakan adalah kalus embrioid klon MK558, MK 636, dan MK638. Hasil yang diperoleh menunjukkan bahwa perkembangan morfologi ES terdiri dari fase globular, skutelar berbentuk hati, dan kotiledon. Tampak adanya keragaman morfologi yang menunjukkan adanya penyimpangan atau abnormalitas dalam setiap fase perkembangan ES. ES fase globular, yang normal berbentuk bulat dan bipolar, sedangkan yang abnormal berbentuk oval dan kehilangan sifat polaritasnya. ES fase skutelar berbentuk hati, yang normal tampak memiliki polarisasi yang simetri, sedangkan yang abnormal memiliki bidang polarisasi yang tidak simetri. ES fase kotiledon, yang normal memiliki satu kotiledon, sedangkan yang abnormal memiliki lebih dari satu kotiledon. Histologi ES fase globular, skutelar berbentuk hati, dan kotiledon masing-masing memiliki sel meristematik, jaringan prokambial dan protoderm. Tidak tampak adanya perbedaan histologi yang jelas antar ES fase globular yang normal dengan yang abnormal. ES fase skutelar berbentuk hati dan ES fase kotiledon yang normal, masing-masing memiliki jaringan prokambial tunggal yang tidak bercabang. Sedang protodermnya memiliki lapisan sel yang tersusun secara teratur. Histologi penampang melintang ES skutelar berbentuk hati yang abnormal menunjukkan adanya jaringan prokambial yang menyebar, sedang lapisan protoderm tidak terlihat jelas. Hal ini disebabkan terjadinya de-differensiasi sel yang sangat aktif.
---Kata kunci :Elaeis guineensis, embrio somatik,embrio somatik - normal, embrio somatik – abnormal, morfologi-embrio somatik, histologi -embrio somatik.
PENDAHULUAN
Kelapa sawit (Elaeis guineensis Jacq.) merupakan tanaman monoecious dan
tidak dapat diperbanyak secara vegetatif dengan metode konvensional.
Embriogenesis somatik digunakan sebagai alat untuk perbanyakan vegetatif.
Perkembangan embrio somatik yang tidak seragam, perkecambahan yang rendah