MUTASI INDUKSI Caladiumbicolor (W.Ait)Vent. MENGGUNAKAN SINAR ULTRAVIOLET
SKRIPSI
Diajukan sebagai salah satu syarat untuk memperoleh gelar sarjana Sains
SITI ROSALINA GINTING 050805061
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PENGESAHAN
JUDUL :
MUTASI INDUKSI
Caladium bicolor
(W.Ait) Vent.
MENGGUNAKAN SINAR ULTRAVIOLET
NAMA : SITI ROSALINA GINTING NIM : 050805061
No. Nama Keterangan Tanggal Tanda
Tangan
1. Dra. Elimasni, M.Si.
NIP. 196505 241991 032001
Dosen
Pembimbing 1
2. Drs. Kiki Nurtjahja, M.Sc. NIP. 196212 111998 031001
Dosen
Pembimbing 2
3. Dra. Nunuk Priyani, M.Sc. NIP. 196404 281996 032001
Dosen Penguji 1
4. Riyanto Sinaga, S.Si. M.Si. NIP. 197108 311997 021002
PERSETUJUAN
Judul : MUTASI INDUKSI Caladium bicolor (W.Ait) Vent. MENGGUNAKAN SINAR ULTRAVIOLET
Kategori : SKRIPSI
Nama : SITI ROSALINA BR GINTING Nomor Induk Mahasiswa : 050805061
Program Studi : SARJANA (S1) BIOLOGI Departemen : BIOLOGI
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN ALAM (FMIPA) UNIVERSITAS SUMATERA
UTARA Diluluskan di Medan, 2010
Komisi Pembimbing :
Pembimbing 2 Pembimbing 1
Drs. Kiki Nurtjahja, M.Sc Dra. Elimasni, M.Si
NIP. 196212 111998 031001 NIP. 196505 241991 032001
Diketahui/Disetujui oleh
Departemen Biologi FMIPA USU Ketua,
NIP. 196404 091994 031003
PERNYATAAN
MUTASI INDUKSI Caladium bicolor (W.Ait) Vent. MENGGUNAKAN SINAR ULTRAVIOLET
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, 2010
PENGHARGAAN
Puji dan syukur penulis panjatkan kepada Tuhan yang Maha Pengasih Lagi Maha Penyayang atas limpahan rahmat kekuatan dan kemudahan sehingga penulis dapat menyelesaikan skripsi
dengan judul “MUTASI INDUKSI Caladium bicolor (W.Ait) Vent. MENGGUNAKAN
SINAR ULTRAVIOLET”dalam waktu yang telah ditentukan.
Ucapan terima kasih penulis sampaikan kepada Dra. Elimasni, M.Si selaku Dosen Pembimbing I dan Drs. Kiki Nurtjahja, M.Sc. selaku Dosen Pembimbing II atas bimbingan, arahan dan bantuannya dalam pembuatan skripsi ini. Penulis juga mengucapkan terima kasih kepada Dra. Nunuk Priyani, M.Sc dan Riyanto Sinaga, S.Si, M.Si sebagai tim Penguji I dan II atas arahan dan saran dalam penyempurnaan penulisan skripsi ini. Ucapan terima kasih juga penulis sampaikan kepada Prof. Dr. Dwi Suryanto, M.Sc sebagai Ketua Departemen Biologi FMIPA USU dan Dra. Nunuk Priyani, M.Sc sebagai Sekretaris Departemen Biologi FMIPA USU sekaligus sebagai Dosen Penasehat Akademik, seluruh staf pengajar Departemen Biolgi FMIPA USU. Bapak Sukirmanto, Ibu Nurhasni Muluk, Ibu Roslina Ginting dan Abang Raswin selaku Staf pegawai Departemen Biologi FMIPA USU.
Ungkapan terima kasih yang tak ternilai penulis ucapkan kepada Kedua Orang tua, Ayahanda M. Ginting dan Ibunda M. BR Pinem atas doa dan dukungan kepada penulis. Kepada abangku Jambormbelin Ginting S.Pt yang telah banyak memberi bantuan baik dalam bentuk moral maupun materil, juga kakakku Sri Ulina Br Ginting, Amd (Alm), Rupana Br Ginting, Saksi Br Ginting, terima kasih atas dukungannya selama ini. Tak lupa kepada keponakannku Ricky, Rendy, dan Christa yang selalu memberiku semangat dan dorongan sehingga penulis dapat menyelesaikan skipsi ini.
Terima kasih juga penulis ucapkan kepada teman–teman Asisten Laboratorium Genetika Kalista, Julita, Riris, Delni, Ruth, Simlah, serta teman-teman stambuk 2005 yang lain seperti, Santi, Eri, Fatimah, Dwi, Masrayanti, Nalverta, Andini, Irfan, Efendi, Winda, Maysarah, Kurnia, Sarmut, Kabul, Elfrida, Gustin, Mustika, Diana, Dini, Umi, Rico, Andi, Misran, Toberni, Valentina, Fitria, Rosida, Sarah, Erna, Erni, Rebecca, Nikma, Widya, Wulan, Susi, Sidahin, Nurzaidah, Fifi, Taripar, Rahmad, Juned atas semangat dan kebersamaannya. Kepada para senior dan adek junior Jane, Hilda, Desmina, Tety, Jayana, Septy, dan teman satu kost, Sari, Ema, dan semua pihak yang telah banyak membantu dalam penyelesaian skripsi ini yang tidak dapat penulis sebutkan namanya satu per satu. Semoga Tuhan Yang Maha Esa akan membalasnya.
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan. Oleh karena itu penulis mengharapkan kritik dan saran yang bersifat membangun demi kesempurnaan skipsi ini. Akhir kata semoga skripsi ini bermanfaat bagi kita semua. Tuhan memberakati.
Medan, 2010
ABSTRAK
ABSTRACT
DAFTAR ISI
1.3 Tujuan Penelitian 3
1.4 Hipotesis 3
1.5 Manfaat Penelitian 3
Bab 2 Tinjauan Pustaka 4
2.1 Morfologi Caladium 4
2.2 Penyebaran 5
2.3 Perbanyakan Caladium 6
2.4 Media Tanam 7
3.3 Metodologi Penelitian 13
3.4 Pengambilan Sampel 14
3.5 Penanaman Umbi 14
3.6 Mutasi Induksi UV 14
3.7 Parameter pengamatan 15
3.8 Pengukuran Kadar Klorofil 16
3.9 Analisa Data 16
Bab 4 Hasil dan Pembahasan 17
4.1 Pengamatan Deskriptif 17
4.2 Pengamatan Morfologi 22
4.2.1 Tinggi Tanaman 23
4.2.2 Panjang dan Lebar Daun 24
4.2.3 Jumlah Daun 26
4.2.4 Berat Basah dan Berat Kering
Tanaman 28
4.3 Kandungan Klorofil 30
Bab 5 Kesimpulan dan Saran 34
5.1 Kesimpulan 34
5.2 Saran 34
DaftaPustaka 35
DAFTAR TABEL
DAFTAR GAMBAR
Halaman
Gambar 2.1 Caladium bicolor 4
Gambar 4.1 Tanaman Caladium Normal dan yang Abnormal 18-20 Gambar 4.2.1 Hubungan Tinggi Tanaman Terhadap besarnya
Energi Lampu UV dan Waktu Penyinaran 23 Gambar 4.2.2 Hubungan Panjang dan Lebar Daun Terhadap
Besarnya Energi Lampu dan Waktu Penyinaran 25 Gambar 4.2.3 Hubungan Jumlah Daun Terhadap Besarnya Energi
Lampu dan Waktu Penyinaran 27
Gambar 4.2.4 Hubungan Berat Basah dan Berat Kering Terhadap
Besarnya Energi Lampu dan Waktu Penyinaran 28-29 Gambar 4.3 Hubungan Kandungan a,
Klorofil-bTerhadap Besarnya Energi Lampu
DAFTAR LAMPIRAN
Lampiran A Frekuensi Tanaman Abnormal Pada Setiap
Perlakuan 39 Lampiran B Data Rataan Pertambahan Tinggi Tanaman
(cm) Tiap Minggu Pengamatan 39 Lampiran C Data Tinggi Tanaman (cm) Minggu Terakhir 40 Lampiran D Data Rataan Pertambahan Panjang Daun
Tanaman (cm) Tiap Minggu Pengamatan 41 Lampiran E Data Panjang Daun Tanaman Minggu
Terakhir 42
Lampiran F Data Rataan Pertambahan Lebar Daun
Tanaman (cm) Tiap Minggu Pengamatan 43 Lampiran G Data Lebar Daun Tanaman (cm) Minggu
Terakhir 44
Lampiran H Data Rataan Pertambahan Jumlah Daun
Tanaman (cm) Tiap Minggu Pengamatan 45 Lampiran I Data Jumlah Daun Tanaman (cm) Minggu
Terakhir 46
Lampiran J Data Berat Basah Tanaman Minggu Terakhir 47 Lampiran K Data Berat Kering Tanaman Minggu Terakhir 48 Lampiran L Data Nilai Adsorbansi Ekstrak Klorofil 49
Lampiran M Data Kadar Klorofil-a 50
Lampiran N Data Kadar Klorofil-b 51
Lampiran O Data Kadar Klorofil Total 52
ABSTRAK
ABSTRACT
BAB 1
PENDAHULUAN
1.1Latar Belakang
Sebagai tanaman hias, daya tarik Caladium terletak pada bentuk, dan warna daunnya. Bunga dari Caladium berbentuk bulat memanjang dan tertutup oleh seludang
umumnya hanya dimanfaatkan untuk perkembangbiakan, bukan untuk keindahannya. Bentuk dan keindahan warnanya membuat tanaman ini sangat cocok digunakan sebagai tanaman indoor penghias ruangan (Yuliarti, 2008).
Tanaman hias daun dipilih karena penampilan aneka ragam daunnya. Mulai dari yang berwarna tunggal merah, hijau, kuning, orange, perak, dan warna kombinasi. Daya tarik lainnya adalah penampilan bentuk tajuknya, batang, daun, dan teksturnya. Di samping daya tariknya karena keindahannya, tanaman hias daun disukai orang karena persyaratan tumbuh dan perawatannya mudah dan tahan lama dibandingkan dengan tanaman hias bunga (Sudarmono, 1997). Keindahan tanaman hias daun dapat timbul karena bentuk dasar tanaman, tekstur, warna, atau karakteristik yang khas lainnya (Prihmantoro, 1997).
Mutasi dapat juga disebut perubahan genetik pada tingkat genom, kromosom dan DNA atau gen sehingga menyebabkan terjadinya keragaman genetik. Dari sejumlah mutasi yang dihasilkan terdapat peluang untuk mendapatkan genotipe yang lebih baik daripada plasma nutfah (Herison et al., 2008). Upaya pemuliaan genetik
Pemuliaan tanaman melalui mutasi induksi merupakan suatu percobaan trial and error. Hasil penelitian Silvy Et Miteau (1985) dan Soertini (1992) dalam Lubis (2005) menunjukkan bahwa persentase mutan yang dihasilkan pada tanaman Teluki (Dianthus caryophyllus) dan Gladiol (Gladiolus hybridus) meningkat bila diberi
radiasi sinar gamma yang diulang atau ganda dari dosis rendah, kemudian setelah 24 jam diradiasi kembali dengan dosis tinggi, tetapi perlakuan radiasi tunggal yang dilakukan Soertini (1992) dalam Lubis (2005) terhadap bibit Alpinia purpurata
mempunyai pengaruh yang lebih positif dibandingkan dengan radiasi yang diulang. Mutan yang dihasilkan berupa tanaman dengan warna dan ukuran rata-rata yang sama dengan kontrol, tetapi warna merah menjadi putih dan putih dengan pinggir merah.
DNA dapat dirusak oleh ultraviolet pada panjang gelombang 254-260 nm, sehingga ultraviolet dapat menginduksi secara langsung akibat penyerapan oleh purin dan pirimidin. Pirimidin umumnya sangat kuat menyerap pada 254 nm dan menjadi aktif (Lewis, 1997). Secara umum mutagen genetik menyebabkan meningkatnya frekuensi mutasi sehingga jumlahnya nyata pada organisme yang bermutasi. Sinar UV digunakan sebagai agen mutagenik karena sinar UV selain efektif sebagai agen mutagenik juga lebih murah dibanding agen mutagenik lain (Zul et al., 2003) Mutagenesis radiasi UV membuka jalan untuk penemuan bentuk perbaikan alami kerusakan DNA (Cummings & Klug, 1994).
Hingga saat ini belum banyak dilakukan penelitian untuk mendapatkan variasi warna Caladium melalui teknik mutasi dengan induksi sinar UV. Teknik hibridisasi pada Caladium membutuhkan waktu yang relatif lama, dan jarang ditemukan tanaman
Caladium yang memiliki bunga. Oleh karena itu melalui penelitian teknik mutasi ini
diharapkan akan didapatkan variasi warna dari daun Caladium yang lebih menarik.
1.2Permasalahan
morfologi dan meningkatkan produksi (Vasudevan & Jos 1988). Efek radiasi sinar –X
telah dipelajari oleh Atkinson (1979) dalam Harten (1998) yang mengirradiasi daun
Caladium, bunga Begonia dan biji-bijian yang lain dan ternyata radiasi tersebut merusak aktivitas klorofil dan memperlambat pertumbuhan setelah diberi perlakuan. Nasir (2002), menyatakan bahwa penggunaan sinar UV juga telah dilakukan oleh para
peneliti untuk memperbaiki morfologi tumbuhan, dan penggunaan sinar ini terbukti berpengaruh terhadap pertumbuhan dan perkembangan tumbuhan. Walaupun demikian, penggunaan sinar UV pada umbi Caladium bicolor (W. Ait) Vent, belum dilakukan, padahal tanaman ini memiliki potensi pasar yang cukup tinggi apabila memiliki corak morfologi daun yang lebih bervariasi. Berdasarkan hal tersebut, maka perlu dilakukan penelitian ”mutasi induksi Caladium bicolor menggunakan sinar ultraviolet”.
1.3Tujuan
Tujuan penelitian ini adalah untuk mengetahui pengaruh dan lama penyinaran sinar UV pada perubahan fenotip daun, pertumbuhan serta kadar klorofil Caladium bicolor.
1.4Hipotesis
Pengaruh dan lama penyinaran UV berpengaruh terhadap perubahan fenotip daun, pertumbuhan serta kadar klorofil Caladium bicolor.
1.5Manfaat Penelitian
BAB 2
TINJAUAN PUSTAKA
2.1 Morfologi Tanaman Caladium
Caladium bicolor merupakan herba tahunan, daun berukuran besar, berbentuk hati, ditopang oleh pelepah yang panjangnya 30 cm atau lebih, warnanya beragam, ada yang putih kehijauan dengan tulang daun hijau, ada yang hijau di tepi dan merah menyala di tengahnya, ada yang hijau di tepi dan tengahnya pink dibayangi putih, dan lain-lain. Batang biasanya tumbuh horizontal seperti umbi kentang atau umbi famili Zingiberaceae (Prihmantoro, 1997).
Gambar 2.1: Caladium bicolor
Daun Caladium ada yang berbentuk hati, bulat, panjang, seperti daun bambu, dan daun ganda. Sedangkan daunnya memiliki warna dasar merah, kuning, hijau,
sudah dewasa. Corak daun Caladium bisa berupa titik, bulat, bergaris, atau bentuk
yang tidak beraturan dengan jumlah dan ukuran yang bervariasi (Yuliarti, 2008). 2.2 Penyebaran
Menurut Yuliarti (2008), Caladium berasal dari hutan Amazon serta kawasan
Amerika Selatan yang berikilim tropis seperti Argentina, Brazil, Peru, Kolombia, dan Venezuela. Walaupun berasal dari Benua Amerika, budidaya Caladium untuk pertama kalinya dilakukan di Benua Eropa pada tahun 1700-an. Amerika sendiri baru memulai membudidayakan Caladium pada awal abad ke-20. Selain di Eropa dan Amerika
Caladium juga dibudidayakan di Thailand, Cina, dan Indonesia.
Menurut Tjitrosoepomo (2004), Caladium merupakan genus dari famili Araceae, klasifikasi lengkap dari Caladium berdasarkan sistem klasifikasi tumbuhan adalah sebagai berikut:
Kingdom : Plantae
Divisi : Spermatophyta Sub Divisi : Angiospermae Kelas : Monocotyledoneae Ordo : Arales
Famili : Araceae Genus : Caladium
Spesies : Caladium bicolor
Caladium di Indonesia lebih dikenal dengan sebutan keladi hias. Variasi keindahan bentuk, corak, dan warna daunnya yang sangat beragam, serta perawatannya yang mudah menjadi daya tarik tersendiri bagi orang untuk
membudidayakan Caladium. Caladium secara alami tumbuh di hutan-hutan tropis yang rindang, subur, dan lembab. Lokasi tumbuhnya antara lain di pinggir sungai, di bawah pohon besar, dan tempat-tempat berongga yang lembab pada ketinggian 0-1000 m dpl. Tanaman ini menyukai suhu 21-31oC. pada suhu di bawah 15oC
Caladium akan mati secara perlahan-lahan dan pada suhu diatas 32oC umbinya akan tumbuh menciut. Sementara itu intensitas cahaya matahari yang dibutuhkan Caladium
Caladium akan memucat. Sebaliknya, jika intensitas cahaya matahari yang diterima
lebih dari 70%, daun Caladium akan terbakar sehingga daunnya berubah menjadi kuning atau kecoklatan (Yuliarti, 2008).
2.3 Perbanyakan Caladium
Perbanyakan tanaman Caladium biasanya dilakukan dengan dua cara, yaitu secara vegetatif dan generatif.
Perbanyakan Secara Vegetatif. Dilakukan dengan cara memisahkan rumpun, karena tanaman ini memiliki umbi batang. Pemisahan dilakukan dengan cara memotong bagian tanaman dengan menyertakan satu atau bagian akar rimpangnya, selanjutnya tanaman yang dipisahkan dapat langsung ditanam. Perbanyakan dengan pencacahan umbi merupakan cara yang sering dilakukan oleh para pemilik nurseri. Dengan cara ini akan didapat anakan Caladium dalam jumlah banyak Prihmantoro (1997).
Perbanyakan tanaman dilakukan dengan mengambil sebagian atau seluruh umbi pada tanaman keladi yang telah dewasa dan telah memiliki umbi yang cukup besar. Umbi yang telah diambil tersebut selanjutnya dapat di belah-belah (dicacah) dan di letakan di media tanam yang lembab/basah. Dalam jangka waktu 1-2 bulan, setiap cacahan umbi tersebut akan bertunas dan tumbuh menjadi tanaman baru Agustus 2009).
Perbanyakan Secara Generatif. Dilakukan dengan cara mengawinkan antara bunga jantan dan bunga betina tanaman Caladium dan biasanya dibantu oleh tangan manusia. Biji yang dihasilkan lalu disemai sehingga dihasilkan tanaman baru.
Memperbanyak secara generatif sangat jarang dilakukan karena biji keladi jarang terbentuk tanpa bantuan manusia dan waktu yang dibutuhkan bagi masaknya biji
2.4 Media Tanam
Menurut Yuliarti (2008), media tanam Caladium ada dua macam yaitu media tunggal dan media campuran.
a. Media Tunggal
Yang dimaksud dengan media tunggal adalah penggunaan satu jenis media tanpa dicampur dengan media tanam jenis lain. Media tanam tunggal yang dapat digunakan untuk Caladium antara lain coco peat, humus andam, atau sekam mentah.
b. Media Campuran
Penggunaan media tanam campuran dilakukan untuk mengatasi kelemahan yang dimiliki oleh satu jenis media tanam. Beberapa komposisi media tanam campuran yang biasa digunakan untuk Caladium, yaitu:
1. Media tanam berupa campuran tanah, humus, coco peat, sekam bakar dan kompos dengan perbandingan 1:1:1:1. Komposisi campuran ini sangat baik untuk
Caladium. Coco peat menjamin media tanam tetap lembab sehingga Caladium
dapat tumbuh optimal. Kompos dan humus menyediakan nutrisi untuk pertumbuhan. Sementara itu, sekam bakar membuat aerasi media tanam berjalan dengan baik.
2. Media tanam campuran tanah dan kompos yang berasal dari daun kacang-kacangan. Media tanam campuran ini memiliki drainase dan aerasi baik sehingga
mampu membuat Caladium tumbuh subur, dengan perbandingan 2:1.
3. Media tanam berupa campuran sekam mentah, sekam bakar, dan humus daun bambu dengan perbandingan 1:1:1. Sekam mentah dan sekam bakar membuat aerasi media tanam berjalan baik, sedangkan humus dan daun bambu dapat
menahan air dalam jumlah banyak sehingga media tanam bersifat porosus.
4. Media tanam berupa campuran kompos atau humus dan pasir kasar perbandingan 2:1.
6. Media tanam berupa sekam bakar, coco peat, cacahan pakis, bambu, pupuk
organik (kompos atau pupuk kandang), pasir dengan perbandingan 2:2:2:2:1,5:0,5.
2.5Mutasi
Mutasi adalah perubahan yang terjadi secara struktural pada material genetik yang merupakan bagian dari fenomena dasar kehidupan. Berdasarkan sejarah, mutasi telah terjadi secara spontan, yang disebabkan oleh sejumlah fenomena alamiah seperti radiasi kosmik atau sinar ultraviolet (Nasir, 2002). Mutasi spontan terjadi dengan laju yang rendah, tetapi dapat diukur, pada semua organisme, mungkin disebabkan oleh kesalahan yang terpaut pada replikasi dan transmisi genom (Goodenough, 1988). Sedangkan mutasi induksi adalah mutasi yang diakibatkan oleh pengaruh agen-agen non-alamiah terhadap sel-sel, seperti radiasi senjata nuklir dan pengggunan biomedis dari isotop-isotop radioaktif (Pai, 1992). Mutasi merupakan salah satu metode pemuliaan untuk meningkatkan keragaman genetik tanaman, salah satu teknologi alternatif untuk mendapatkan genotipe-genotipe baru (Priyono, 2002).
Menurut Broetjes (1982), Bhatnagar dan Tiwai (1991), Micke et al., (1993)
dalam Soedjono (2003) faktor yang mempengaruhi terbentuknya mutan antara lain adalah dosis irradiasi. Perlakuan dosis tinggi akan mematikan bahan yang dimutasi atau mengakibatkan sterilitas. Pada umumnya dosis rendah dapat mempertahankan
daya hidup atau tunas, dapat memperpanjang waktu kemasakan pada buah-buhan dan sayuran, serta meningkatkan kadar pati, protein, dan kadar minyak pada biji jagung dan bunga matahari. Tanaman mutan juga memiliki daya tahan yang lebih baik terhadap serangan patogen dan kekeringan. Warna bunga atau daun dapat berubah
secara vegetatif memiliki siklus reproduksi seksual yang lebih lama, bila ada,
2.5.1Pembagian Mutasi
Berdasarkan efeknya pada protein (kodon) Elrod & Stansfield (2006) membagi mutasi kedalam:
a. Mutasi bisu (silent)-perubahan pada sebuah kodon (biasanya pada posisi ketiga)
yang tidak mempengaruhi asam amino yang dikodekan.
b. Mutasi nonsense-perubahan pada sebuah kodon dari pengkode asam amino menjadi kodon stop; mengakibatkan terminasi prematur rantai asam amino saat translasi.
c. Mutasi salah-makna (misense)-perubahan sebuah kodon yang mengubah spesifiknya sebuah asam amino yang berbeda; mengubah sekuens primer rantai polipeptida dan mengubah fungsi protein.
d. Mutasi netral-perubahan pada kodon sedemikian rupa sehingga dispesifikasikan sebuah asam amino yang berbeda; akan tetapi, asam amino yang baru itu berlaku serupa dengan asam amino yang asli (misalnya, memiliki gugus fungsional yang mirip) dan tidak mengubah fungsi protein.
e. Mutasi bergeser kerangka (frameshift)-pergeseran bingkai pembacaan yang disebabkan oleh delesi atau insersi dari satu atau beberapa nukleotida; menghasilkan banyak kodon misense dan nosense ke arah hilir peristiwa mutasional.
Menurut Nasir (2002), ada sejumlah agensia yang dapat menimbulkan efek
mutasi pada tanaman. Agensia-agensia tersebut disebut dengan mutagen dan beberapa diantaranya terdapat di alam dan dapat menimbulkan mutasi “spontan”. Mutagen secara umum dikelompokkan dalam mutagen kimia dan mutagen fisik.
1. Mutagen fisik
lain. Daerah-daerah ini, yang sering disebut target radiosensitif, secara umum
berhubungan dengan lokasi DNA dalam sel. Irradiasi dapat mempengaruhi baik 1 (satu) sel atau kedua untai DNA dalam heliks gandanya. Bila patahan DNA terdiri dari 1(satu) untai tunggal, maka integritas linier molekul DNA masih tetap utuh dan perbaikan patahan tersebut membentuk DNA normal kembali. Bila patahan
melibatkan kedua untaian, maka perbaikannya tidak dapat terjadi dengan cepat. Hal ini merupakan efek radiasi yang paling penting yang menimbulkan kerusakan DNA yang membentuk mutasi yang dapat diamati.
2. Mutagen Kimia
Di antara 40 (empat puluh) kategori mutagen kimia, beberapa diantaranya merupakan mutagen yang cukup berguna dan handal, antara lain etil metanasulfonat (EMS), dietilsulfat (DES), etilinimin (EI), N-metil uretan (NMUT), dan N-nitro-N-etil urea (NEU). Perhatian yang saksama dalam penggunaan senyawa-senyawa ini perlu dilakukan, karena senyawa-senyawa ini ternyata diketahui memberi efek karsinogen.
Meskipun secara eksperimen telah dibuktikan bahwa zat-zat kimia dapat menyebabkan mutasi, namun tidak ada perlindungan yang serupa terhadap zat-zat kimia yang akan melindungi individual dari kemungkinan terjadinya mutagen. Dan analisis kuantitatif terhadap zat-zat kimia tersebut sangat sulit dilakukan. Sumber-sumber mutagenesis kimiawi ini tidak terbatas, karena berbagai macam zat-zat kimia yang masuk dalam lingkungan dan sengaja dimakan sebagai obat yang terus
meningkat secara tetap (Pai, 1992) .
2.6Radiasi
Ada banyak macam radiasi, seperti sinar-X dan sinar gamma, yang merupakan radiasi elektromagnetis (Pai, 1992). Menurut Crowder (1990), tipe-tipe radiasi adalah sebagai berikut:
2. Sinar gamma, dipancarkan dari isotop radioaktif, panjang gelombang lebih pendek
dari sinar-X, lebih kuat daya tembusnya, dikenal sebagai sinar kuat, penting untuk menginduksi perubahan genetik.
3. Sinar ultraviolet, panjang gelombang berbeda-beda (3800-150 Ao), terletak antara sinar-X (150-0,15 Ao) dan cahaya yang terlihat (7.800-3.800 Ao), daya tembus
rendah; menyebabkan perangsangan elektron (perubahan susunan atom dalam orbitnya). Panjang gelombang yang paling efektif untuk membuat mutasi adalah 2.600 Ao). Panjang gelombang ini sama dengan penyerapan maksimum oleh DNA.
2.6.1 Radiasi Ultraviolet
Radiasi digunakan untuk penelitian genetika, keperluan medis dan juga untuk streilisasi karena dapat membunuh bakteri. Ultraviolet banyak dijumpai pada sinar matahari, tetapi sinar ultraviolet ini dipancarkan keluar oleh ozon di atmosfer (Snustad & Gardner, 1984). Semua radiasi (sinar ultraviolet) mengionisasi atom dalam jaringan dengan melepaskan elektron dari atom tersebut (Nasir, 2002). Radiasi sinar ultraviolet tidak memiliki cukup energi untuk menginduksi ionisasi seperti sinar-X, walaupun demikian ultraviolet dapat menyerap substansi tertentu seperti basa purin dengan derivatnya guanine dan sitosin, dan pirimidin dengan derivatnya adenine dan timin. Karena energi ultraviolet rendah, maka hanya dapat menembus bagian permukaan sel
pada organisme multiseluler. Namun ultraviolet mempunyai kemampuan sebagai mutagen dan pada dosis tinggi dapat membunuh sel (Lewis, 1997).
Radiasi sinar UV pada panjang gelombang dibawah 280 nm (termasuk kedalam
yang pendek, maka lama penyinarannya harus panjang (Harm, 1980). Mutasi akibat
sinar ultraviolet umumnya berupa pergantian basa, adisi basa, pertukaran atau delesi satu atau lebih basa (Freifelder, 1987).
Keseluruhan atau bagian dari suatu tanaman dapat diperlakukan dengan radiasi.
Namun demikian, karena ada kendala fisik, maka diperlukan instalasi khusus untuk mengirradiasi keseluruhan tanaman atau bagian tanaman yang relatif besar. Butiran serbuk sari seringkali diirradiasi dengan radiasi ionisasi dan sinar ultraviolet. Keuntungan utama irradiasi butiran serbuk sari dibandingkan dengan radiasi biji atau tanaman yang sedang tumbuh adalah bahwa serbuk sari jarang sekali menghasilkan kimera atau sektor yang termutasi. Sedangkan kelemahannya adalah biasanya viabilitas serbuk sari relatif singkat. Sejumlah besar studi telah dilakukan terhadap berbagai faktor biologis, lingkungan dan kimia yang dapat memodifikasi pengaruh perlakuan radiasi. Faktor-faktor ini dapat memodifikasi efektivitas mutagenik (jumlah mutasi per unit dosis) dan efisiensi mutagenik (rasio jumlah mutasi terhadap kerusakan, seperti sterilitas, pertumbuhan kerdil, dan lain-lain) dari mutagen fisik dan kimia pada sel tanaman tingkat tinggi (Nasir, 2002). Selain itu dosis radiasi yang diberikan untuk mendapatkan mutan tergantung pada jenis tanaman, fase tumbuh, ukuran, kekerasan, dan bahan yang akan di mutasi (Soedjono, 2003). Umumnya pengaruh perlakuan radiasi pada suatu karakteristik tanaman telah stabil secara genetik setelah generasi MV3, sehingga proses seleksi dan hasilnya dapat diperoleh lebih cepat jika dibandingkan pemuliaan secara konvensional (Handayati, 2008).
Walaupun bukan radiasi yang mengionisasi pada panjang gelombang yang umum digunakan untuk mutasi, sinar UV sering digunakan sebagai mutagen untuk memperlakukan biji-bijian dan serbuk sari (Nasir, 2002). Tipe keragaman yang timbul
BAB 3
BAHAN DAN METODE
3.1 Waktu dan Tempat
Penelitian ini dilaksanakan mulai April s/d November 2009 di Laboratorium Genetika dan Laboratorium Fisiologi Tumbuhan, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara, Medan.
3.2 Bahan
Bahan yang digunakan adalah umbi Caladium bicolor, fungisida merek Benlate, zat pengatur tumbuh (Routon F), pupuk daun merek Bayfolan, aquadest, dan aseton 80%.
3.3 Metodologi Penelitian
Penelitian ini menggunakan metode Rancangan acak lengkap (RAL) Faktorial dengan 2 faktor, yaitu besarnya energi lampu UV yang digunakan dan lamanya penyinaran, dimana panjang gelombang sinar UV adalah 254 nm dengan jarak 30 cm.
a. Besarnya energi lampu UV yang digunakan
Terdiri dari 4 taraf yaitu:
W0 : 0 Watt (tanpa perlakuan) W1 : 40 Watt
b. Waktu penyinaran UV
Terdiri dari 4 taraf yaitu: T1 : 1 jam
T2 : 2 jam T3 : 3 jam
T4 : 4 jam
Sehingga diperoleh 16 kombinasi perlakuan, yaitu:
W0T1 (kontrol) W1T1 W2T1 W3 T1 W0T2 (kontrol) W1T2 W2T2 W3 T2 W0T3 (kontrol) W1T3 W2T3 W3 T3 W0T4 (kontrol) W1T4 W2T4 W3T4 Setiap kombinasi perlakua n terdiri dari 3 ulangan.
3.4 Pengambilan Sampel
Sampel yang digunakan adalah umbi Caladium bicolor yang diambil dari Simpang PERUMNAS Simalingkar Medan. Adapun ciri-ciri Caladium bicolor yang digunakan adalah: umbi berwarna putih kekuningan seukuran bola pingpong, pelepah daun berwarna hijau kecoklatan, daun warna dasarnya hijau dengan totol-totol putih dan merah, pada sekitar pangkal daun di dominasi oleh warna merah, urat daun berwarna merah.
3.5 Penanaman Umbi
Umbi Caladium kemudian direndam lagi dalam larutan Routon F selama 1
jam. Potongan umbi lalu ditanam pada pot penyemaian yang berisi media tanam. Media yang digunakan adalah humus, kompos, sekam bakar, dan coco peat dengan perbandingan 1:1:1:1, kemudian pot penyemaian ditutup dengan plastik bening untuk mempertahankan agar media tetap lembab dan ditunggu sampai tunasnya tumbuh.
3.6 Mutasi Induksi UV
Setelah muncul tunas, umbi kemudian diradiasi dengan dosis yang telah ditentukan, yaitu dengan daya lampu 0, 40, 50 dan 60 Watt dan dengan durasi waktu 1, 2, 3, dan 4 jam untuk setiap perlakuan dan dilakukan sebanyak 3 kali ulangan untuk masing-masingnya. Setelah di mutasi, dibiarkan selama 15 menit dalam kotak UV, kemudian ditempatkan selama satu minggu dalam tempat gelap. Setelah itu pot dipindahkan di tempat teduh (tidak terkena sinar matahari secara langsung). Pengamatan dilakukan 2 minggu setelah perlakuan dan dilakukan setiap minggu. Setiap dua minggu sekali dilakukan pemupukan dengan pemberian pupuk kompos dan pupuk daun merek Bayfolan dan dilakukan penyiraman 3 kali seminggu.
3.7 Parameter Pengamatan
Tanaman yang ditanam dalam pot diamati pertumbuhan dan perkembangannya secara rutin setiap minggu, dengan parameter pengamatan:
Frekuensi Tanaman abnormal/mutan. Diamati perubahan warna daun yang terjadi baik dari segi warna dan perubahan bentuk daun yang berbeda dengan tanaman
normal, untuk mengetahui frekuensi tanaman yang mutan.
Tinggi Tanaman (cm). Diukur mulai dari pangkal umbi sampai pada pucuk tanaman, dilakukan dengan menggunakan rol.
Panjang Daun (cm). Diukur helaian daun terpanjang sejajar terhadap tulang daun utama, dilakukan dengan menggunakan rol.
Jumlah Daun (helai). Dihitung jumlah daun yang sepenuhnya sudah terbuka. Berat basah (g). Dihitung pada akhir penelitian dengan cara menimbang tanaman segar dengan menggunakan neraca analitik.
Berat Kering (g). Dihitung pada akhir penelitian dengan cara mengeringkan tanaman yang telah diketahui berat basahnya dengan oven selama 2 x 24 jam kemudian
ditimbang neraca analitik dan dilakukan sampai beratnya konstan.
3.8 Pengukuran Kadar Klorofil
Ekstraksi Daun Segar. Ekstraksi jaringan daun segar dilakukan dengan cara, 2,5 mg daun segar digerus dengan mortar sampai halus, kemudian ditambahkan aseton 80% sebanyak 25 ml sampai semua warna terlepas dari jaringan. Ekstrak lalu disaring dengan kertas saring.
Pengukuran Kadar Klorofil dengan Metode Spektrofotometer. Pengukuran kandungan klorofil a dan b dilakukan dengan menggunakan Spektrofotometer. Ekstrak daun dimasukkan ke dalam kuvet dan di ukur adsorbansinya pada panjang gelombang 663 dan 645 nm (Harbone, 1974). Penghitungan kadar klorofilnya dilakukan berdasarkan Hendry dan Grime (1993) dalam (Anggarwulan dan Solichatun 2007) adalah sebagai berikut:
Klorofil- a µg /g daun : 12,7 x A663 – 2,69 x A645 x 10-1 Klorofil-b µg/ g daun : 22,9 x A645 – 4, 68 x A663 x 10-1
Klorofil total µg/ daun : 20, 2 x A645 + 8,02 x A645 x 10-1
Dimana A 663 dan A645 merupakan serapan pada panjang gelombang 663 dan 645 nm, g adalah berat daun yang digunakan, sedangkan mL adalah jumlah aseton yang dipakai.
3.9 Analisis Data
BAB 4
HASIL DAN PEMBAHASAN
4.1 Pengamatan Deskriptif
Dari penelitian yang telah dilakukan didapat beberapa perubahan fenotipe dari daun
Caladium sewaktu tanaman tersebut masih anakan.
4.1. 1 Fenotipe Daun Tanaman Caladium bicolor
Data mengenai persentase tanaman Caladium yang abnormal dapat dilihat pada Lampiran A. hal. 39. Dari lampiran tersebut diketahui bahwa terdapat sekitar 16,67% tanaman yang abnormal. Berdasarkan data tersebut diketahui bahwa hanya sedikit tanaman yang mengalami perubahan morfologi, baik dari segi bentuk dan juga warna daunnya, meskipun penelitian ini telah dilakukan sebanyak empat kali yaitu penelitian pertama dengan menggunakan energi lampu UV sebesar 0, 10, 20 dan 30 Watt, dengan lama waktu penyinaran 1, 2 dan 3 menit untuk masing-masing perlakuan.
Penelitian kedua dengan menggunakan energi lampu UV sebesar 0, 20, 40 dan 60 Watt, dengan lama waktu penyinaran 4, 6, 8 dan 10 menit, penelitian ketiga dengan menggunakan energi lampu UV sebesar 30, 40, 50 dan 60 Watt dengan lama waktu penyinaran 30, 60 dan 90 menit. Dimana sangat sedikit sekali didapat tanaman yang
mengalami perubahan morfologi dan fenotipe. Dengan ini diketahui juga bahwa mutasi dengan induksi sinar UV tidak terlalu berpengaruh terhadap perubahan morfologi tanaman Caladium. Gambar perbandingan fenotipe daun tanaman
daun yang lancip sedangkan tanaman yang dikategorikan mutan adalah tanaman yang
memiliki ciri-ciri yang berbeda dengan tanaman kontrol tersebut. Adapun ciri tanaman berdasarkan Gambar 4.1.1b-e adalah: daun menjadi kerdil, tidak terdapat bintik putih, dan daun agak tebal (Gambar 4.1.1b, terdapat lipatan lipatan pada permukaan daun (Gambar 4.1.1c), daun berwarna hijau polos, permukaan daun mengkilap, bentuk daun
membulat dan ujung daun tidak lancip (Gambar 4.1.1d), daun berwarna hijau polos dan bentuk daun tidak simetris (Gambar 4.1.1e).
(a). Caladium tanpa perlakuan (normal) (W0T1)
(b). Caladium penyinaran 60 Watt (c). Caladium penyinaran 60 Watt selama 1 jam (W3T1) selama 1 jam (W3T1)
(d). Caladium penyinaran 60 Watt (e). Caladium penyinaran 60 Watt selama 3 jam (W3T3) selama 3 jam (W3T4)
Gambar 4.1.1 Perbandingan fenotipe daun Caladium umur 14 hari normal (a), dengan mutan penyinaran dengan UV 60 Watt 1 jam (b dan c),
48
Adapun gambar perubahan fenotipe pada daun tanaman Caladium setelah 21
hari penyinaran ditampilkan pada Gambar 4.1.2 berikut ini.
(a). Caladium tanpa perlakuan (normal) (W0T1)
(b) Caladium penyinaran 40 Watt (c) Caladium penyinaran 40 Watt
selama 1 Jam (W1T1) selama 2 jam (W1T2)
(d) Caladium penyinaran 40 Watt (e) Caladium penyinaran 40 Watt selama 3 jam (W1T3) selama 3 jam (W1T3)
Gambar 4.1.2 Perbandingan fenotipe daun Caladium umur 21 hari normal (a), dengan mutan penyinaran dengan UV 40 Watt 1 jam (b) 2 jam
( c), 3 jam (d dan e).
19
waktu penyinaran yang berbeda antara lain adalah: bentuk daun melengkung dan
ujung daun yang tidak acutus serta terjadi pengerasan pada tulang daun (Gambar 4.1.2b), tidak adanya bintik putih, permukaan daun mengkilap, bentuk daun yang tidak simetris dan daun berwarna hijau muda (Gambar 4.1.2c), daun menggulung ke bawah dan bintik putih yang sangat kecil serta permukaan daun yang mengkilap
(Gambar 4.1.2d), ujung daun tidak acutus, daun agak keriting dan warnanya hijau pucat (Gambar 4.1.2e). Untuk lebih jelasnya mengenai perbedaan antara fenotipe
Caladium normal dan Caladium yang mutan disajikan dalam Tabel 4.1 berikut ini.
i
No Perbedaan fenotipe Caladium normal dengan yang mutan
Caladium normal Caladium mutan
1
Bentuk daun seperti hati dan simetris
Ujung acutus
Permukaan daun tidak terlalu mengkilap
Warna daun hijau polos, tidak ada bintik putih atau sangat sedikit
Pangkal dan tulang daun hijau atau hanya sedikit berwarna merah
Bentuk daun bulat, tidak simetris
Ujung daun non acutus, permukaan daun mengkilap
Berdasarkan Tabel 4.1 telah diketahui perbedaan dari fenotip Caladium normal dengan yang mutan, dimana setiap perlakuan menghasilkan penampakan morfologi yang berbeda. Irawan (2008), menyatakan bahwa mutasi morfologi adalah mutasi yang mudah diamati karena terjadinya pada susunan kimia DNA-nya yang mengakibatkan perubahan pada karakter fisik seperti: mutasi pada gen yang mengkode SBEI sehingga biji ercis (Pisum sativum) dapat menjadi keriput.
Dari semua perlakuan yang telah dilakukan diketahui bahwa perlakuan dengan penggunaan energi lampu UV sebesar 50 Watt tidak didapati tanaman yang dapat diamati kelainan morfologinya. Demikian juga dengan perlakuan dengan besar energi
lampu UV 40 dan 60 Watt, tidak semua perlakuan menghasilkan tanaman yang abnormal yang dapat diamati perubahan morfologinya. Hal ini mungkin disebabkan oleh kemampuan tanaman dalam memperbaiki kerusakan yang ditimbulkan oleh radiasi UV, dimana biasanya dosis dari radiasi juga berpengaruh terhadap kerusakan yang ditimbulkan.
ii
Sering kali mutasi tidak sampai menyebabkan perubahan morfologi, melainkan hanya
berakibat pada perubahan metabolisme atau biokimia, bila mutasi ini menyangkut metabolisme nutrisi biasanya disebut mutasi nutrisional. Walaupun akibat mutasi ini sering tidak tampak secara morfologi, mutasi biokimia juga dapat berakibat fatal.
Warna daun tanaman anakan yang abnormal tidak berlangsung lama karena setelah dewasa warna tanaman tersebut kembali lagi ke warna yang normal, namun bentuk daunnya tetap hal ini mungkin disebabkan oleh kemampuan tanaman
Caladium untuk memperbaiki kerusakan yang ditimbulkan oleh sinar ultraviolet, selain itu dapat juga disebabkan karena sel yang dimutasi adalah sel somatis (tunas tanaman Caladium) bukan sel gamet (biji), sehingga mutasi yang terjadi tidak permanen dan juga tidak diwariskan pada keturunannya.
Irawan (2008), menyatakan bahwa mutasi yang terjadi di jaringan somatik disebut mutasi somatik, dan yang terjadi di jaringan gametik disebut mutasi gametik. Karena itu mutasi somatik tidak dapat diwariskan ke keturunannya, sedang mutasi gametik akan diwariskan. Mutasi somatik yang menghasilkan alel resesif jarang menimbulkan akibat yang nampak nyata pada individu sebab ekspresinya tertutup oleh alel normal yang dominan, atau terjadi di kromosom X. Mutasi somatik akan memiliki dampak lebih nyata bila terjadi pada awal perkembangan embrio, ketika sel belum mengalami diferensiasi. Bila terjadi pada masa awal ini maka berarti banyak jaringan yang akan memiliki sel mutan, dan kemungkinan diwariskan bila ada sel
mutan, dan kemungkinan diwariskan bila ada sel mutan yang menjadi sel gametik. Mutasi somatik yang terjadi pada individu dewasa biasanya juga tidak tampak sebab tertutupi oleh ratusan sel normal.
4.2. Pengamatan morfologi
iii
4.2.1 Tinggi Tanaman
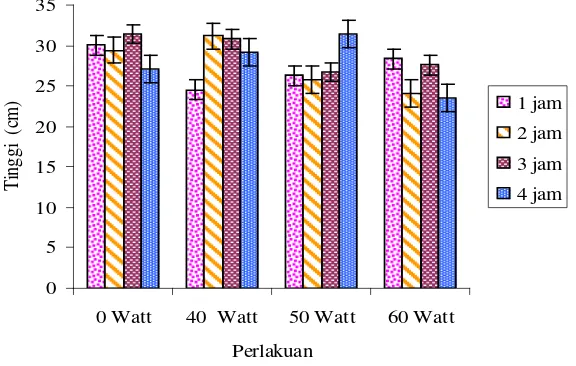
Berdasarkan pengamatan tinggi tanaman akibat penyinaran lampu UV dan waktu penyinaran maka diketahui faktor tersebut tidak berpengaruh nyata dan begitu pula interaksi terhadap tingginya tanaman (Lampiran B, hal. 40). Hubungan tinggi tanaman
Caladium terhadap energi lampu UV dan waktu penyinaran dapat dilihat pada Gambar 4.2.1 di bawah ini:
0
Gambar 4.2.1 Hubungan tinggi tanaman terhadap energi lampu UV dan waktu penyinaran
Berdasarkan Gambar 4.2.1 diketahui bahwa waktu penyinaran 1 jam cenderung meningkatkan tinggi tanaman seiring bertambahnya Watt Lampu UV yang digunakan namun masih dibawah tanaman kontrol. Sedangkan penyinaran 2, 3 dan 4 jam cenderung menurunkan tinggi tanaman seiring dengan bertambahnya Watt lampu UV yang digunakan. Walaupun ada tanaman yang tingginya sudah diatas tanaman kontrol. Dari sini diketahui bahwa induksi sinar UV tidak terlalu berpengaruh pada
pertumbuhan tanaman, apabila dosis yang diberikan tidak terlalu tinggi karena tanaman tersebut mampu untuk memperbaiki kerusakan yang ditimbulkan oleh sinar UV. Sedangkan pada dosis yang lebih tinggi sinar UV dapat memperlambat pertumbuhan.
iv
indikator yang baik untuk perlakuan biji karena biji tetap berkecambah setelah
diperlakukan dengan dosis radiasi yang dapat membunuh bibit atau tanaman dewasa sekalipun. Studi dasar dan praktek induksi mutasi pada tanaman tingkat tinggi menunjukkan bahwa tidak ada aspek morfologi atau fisiologi tanaman yang immun dari peran mutagenik. Sedangkan menurut Widido et al., (2007), menyatakan bahwa
tinggi tanaman dipengaruhi oleh radiasi UV dan lamanya waktu terpapar UV, juga interaksi keduanya. Paparan radiasi UV cenderung meningkatkan tinggi tanaman sedangkan lamanya waktu terpapar UV cenderung menurunkan tinggi tanaman. Kombinasi radiasi UV-A selama waktu terpapar 3 jam pada Gynura procumbens
adalah waktu terbaik untuk meningkatkan tinggi tanaman.
Mutasi sering juga menimbulkan gejala pertumbuhan kerdil (dwarf growth), perubahan morfologi bunga dan penyimpangan morfologi lainnya, dan ketahanan terhadap herbisida, yang biasanya disandikan oleh gen mitokondria (Harten, 2007). Pengaruh terbesar yang ditimbulkan oleh iradiasi sinar UV adalah terbentuknya pirimidin dimer, khususnya timin dimer, yaitu saling terikatnya dua molekul timin yang berurutan pada sebuah untai DNA. Dengan adanya timin dimer, replikasi DNA akan terhalang pada posisi terjadinya timin dimer tersebut. Namun, kerusakan DNA ini pada umumnya dapat diperbaiki melalui salah satu di antara tiga macam mekanisme, yaitu fotoreaktivasi, eksisi, rekombinasi
4.2.2 Panjang dan Lebar Daun
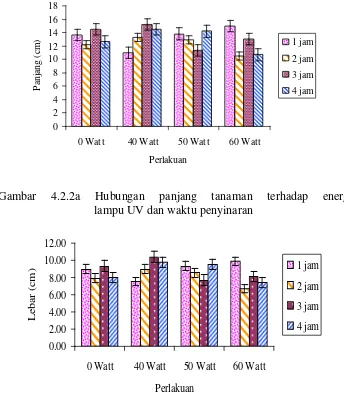
Berdasarkan pengamatan terhadap panjang dan lebar daun tanaman akibat lamanya penyinaran dan besarnya Watt UV yang digunakan maka diketahui ternyata perbedaan panjang dan lebar daun tidak berbeda nyata sebagaimana hasil analisis sidik ragam (Lampiran D-F, hal, 41-44). Hubungan Panjang dan lebar daun tanaman
v
Gambar 4.2.2a Hubungan panjang tanaman terhadap energi lampu UV dan waktu penyinaran
Berdasarkan Gambar 4.2.2a dan Gambar 4.2.2b kita ketahui bahwa penyinaran
vi
Radiasi UV yang berlebih memiliki efek negatif bagi pertumbuhan hampir semua tanaman, ketika mempengaruhi pengurangan ukuran daun, membatasi ketersediaan area untuk penangkapan energi selama fotosintesis. Sinar UV juga berpengaruh terhadap kandungan nutrisi tanaman dan berpengaruh tidak langsung
bagi perkecambahan dan kesuburan tanaman 2009).
Krissou (2005), menyatakan bahwa penggunaan radiasi, di antaranya sinar UV, telah banyak diteliti untuk mendapatkan fenotip baru yang lebih menarik pada tanaman hias. Namun radiasi sinar UV juga dapat berdampak pada kerusakan sel tumbuhan. Soedjono, (2003) menyatakan bahwa perlakuan dosis tinggi akan mematikan bahan yang dimutasi atau mengakibatkan sterilitas.
4.2.3 Jumlah daun
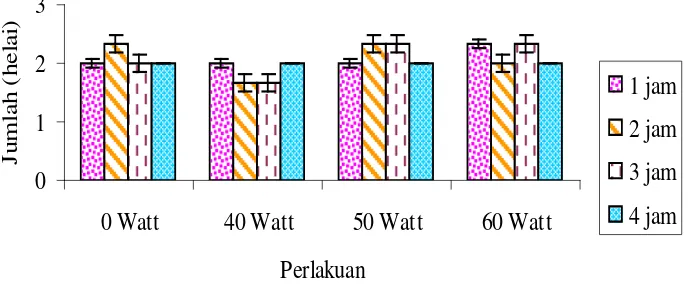
Berdasarkan pengamatan yang dilakukan terhadap jumlah daun tanaman akibat penyinaran lampu UV dan lamanya waktu penyinaran adalah tidak berpengaruh hal ini sesuai juga dengan daftar sidik ragam yang menunjukkan bahwa interaksi antara energi lampu dan lamanya penyinaran terhadap jumlah daun adalah tidak berbeda
nyata, (tidak berpengaruh) (Lampiran H, hal. 44-45). Hubungan jumlah daun
vii
Gambar 4.2.3 Hubungan jumlah daun tanaman terhadap energi lampu UV dan waktu penyinaran
Berdasarkan Gambar 4.2.3 diketahui bahwa perlakuan lamanya waktu penyinaran 1, 2 dan 3 jam cenderung meningkatkan jumlah daun tanaman seiring
dengan peningkatan Watt kecuali perlakuan dengan waktu penyinaran 4 jam, dimana jumlah daunnya konstan.
Maka dapat disimpulkan bahwa sinar UV tidak terlalu berpengaruh pada jumlah daun tanaman karena hampir sama jumlah daun dari tanaman yang tanpa perlakuan (kontrol) dengan tanaman yang diberi perlakuan, hal ini juga dapat disebabkan karena tanaman dapat memperbaiki kerusakan sel yang disebabkan oleh sinar UV sebab sinar mungkin hanya berpengaruh pada tumbuhan yang masih sensitif, misalnya tunas karena pada tahap tersebut tanaman masih dalam proses diferensiasi sehingga rentan terhadap perubahan lingkungan terutama dalam hal ini adalah sinar UV dan setelah masa diferensiasi selesai maka tanaman tersebut sudah mampu untuk memperbaiki kerusakan yang disebabkan oleh sinar UV sehingga kerusakan yang disebabkan oleh UV tidak akan berpengaruh lagi seiring dengan pertambahan umur tanaman.
Menurut Prassad (1994) dalam Djajanegara et al.,(2007) menyatakan bahwa biasanya sel yang dimutasi dipilih sel yang masih belum terdiferensiasi karena
viii
menyebabkan penurunan kadar klorofil, jumlah daun, tinggi taruk, berat basah serta
panjang akar tanaman Chrysanthemum morifolium. Penurunan tersebut terutama diperoleh pada kultur tanaman yang diberi perlakuan pada tahap awal pertumbuhan. Setelah dua bulan aklimatisasi, hampir semua tanaman dapat tumbuh dengan baik dengan persentase kelulushidupan sebesar 100%, kecuali tanaman yang diberi
perlakuan sinar UV diikut i dengan penggelapan (UV-G) dengan persentase kelulushidupan sebesar 93,33%. Semua tanaman mampu berbunga pada waktu yang hampir bersamaan. Berdasarkan hasil yang diperoleh tersebut maka dapat disimpulkan bahwa perlakuan sinar UV menghambat pertumbuhan dan perkembangan tanaman kri san selama kultur invitro, akan tetapi tanaman tersebut mampu untuk memperbaiki pe ngaruh negatif UV sehingga tumbuh dengan baik setelah aklimatisasi.
Hasil penelitian Saputri (2004) yang meneliti tentang pengaruh radiasi sinar ultraviolet (UV) terhadap perkembangan protoplas kacang hijau (Vigna radiata) melaporkan bahwa irradiasi sinar UV tidak mempengaruhi viabilitas dan regenerasi dinding sel, tetapi merusak inti sel dan menghambat perkembangan kultur protoplas kacang hijau.
4.2.4 Berat Basah dan Berat Kering Tanaman
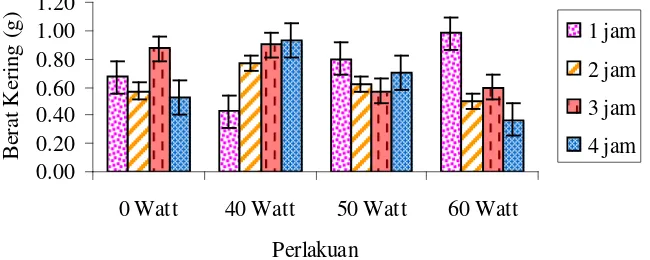
Berdasarkan pengukuran yang dilakukan terhadap berat basah dan berat kering
tanaman akibat penyinaran lampu UV dan lamanya waktu penyinaran adalah tidak berpengaruh, hal ini sesuai juga dengan daftar sidik ragam yang menunjukkan bahwa interaksi antara energi lampu dan lamanya penyinaran terhadap berat basah dan berat kering tanaman adalah tidak berbeda nyata, (Lampiran J, hal. 46-47). Hubungan berat
ix Gambar 4.2.4a Hubungan berat basah tanaman terhadap energi lampu
UV dan waktu penyinaran
Gambar 4.2.4b Hubungan berat kering tanaman terhadap energi lampu UV dan waktu penyinaran
Berdasarkan pada Gambar 4. 2.4a dan Gambar 4.2.4b diketahui bahwa penyinaran selama 1 jam cenderung meningkatkan berat basah dan berat kering tanaman seiring dengan peningkatan Watt lampu UV yang digunakan sedangkan waktu penyinaran 2, 3 dan 4 jam cenderung menurunkan berat basah dan berat kering tanaman, seiring dengan peningkatan Watt lampu UV yang digunakan.
x
Menurut Afza (2004) bahwa sinar ultraviolet menurunkan jumlah tunas, panjang tunas, berat basah planlet dan kadar klorofil tanaman anyelir yang dikultur secara invitro. Ackerman (1988), menyatakan bahwa sinar UV merupakan sinar non-ionisasi, tidak memiliki cukup energi untuk induksi non-ionisasi, walaupun demikian sinar UV sangat baik digunakan sebagai mutagen dan sel. Jadi penyinaran UV ini merupakan rangsangan yang penting yang dapat merusak sel.
4.3 Kandungan Klorofil
Panjang gelombang yang digunakan untuk mengukur absorbansi ekstrak daun
Caladium adalah 663 dan 645 nm. Harborne dan Dey (1990) menyatakan bahwa, absorbsi yang terbesar pada klorofil-a diperoleh antara panjang gelombang 390 nm– 400 nm dan 650 nm-700 nm, sedangkan klorofil-b mempunyai absorbsi terbesar pada panjang gelombang antara 400 nm-450 nm dan 620 nm-670 nm. Tjitrosomo (1985), menyatakan bahwa perbandingan kadar klorofil a dan klorofil b dalam suatu tumbuhan tinggi adalah 3 : 1. Pada tanaman tingkat tinggi ada 2 macam klorofil yaitu klorofil-a (C55H72O5N4Mg) yang berwarna hijau tua dan klorofil-b
(C55H70O6N4Mg) yang berwarna hijau muda. Kandungan klorofil pada daun juga sangat dipengaruhi oleh usia daun, dimana daun tua akan mengandung klorofil jauh lebih banyak dibanding dengan daun yang masih muda.
Berdasarkan pengukuran yang dilakukan terhadap kadar klorofil daun tanaman Caladium akibat penyinaran lampu UV dan lamanya waktu penyinaran adalah tidak berpengaruh, hal ini sesuai juga dengan daftar sidik ragam menunjukkan bahwa interaksi antara energi lampu dan lamanya penyinaran terhadap klorofil-a adalah berbeda sedangkan pada klorofil-b adalah tidak berbeda nyata (Lampiran M dan N, hal. 48-50). Berikut disajikan Tabel 4.3 pengaruh kadar klorofil tanaman
xi
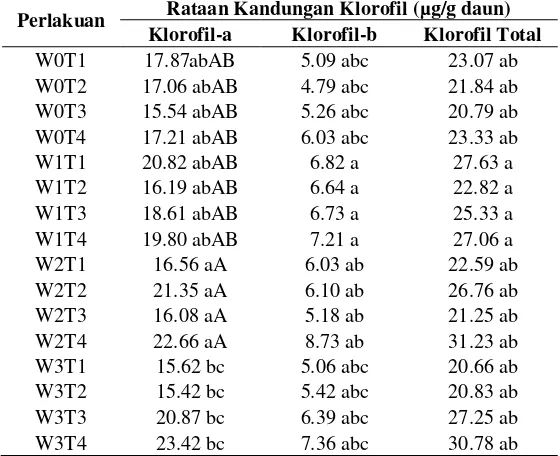
Tabel 4.3 Pengaruh Kadar Klorofil Tanaman Caladium Terhadap Penyinaran Perlakuan Rataan Kandungan Klorofil (µg/g daun)
Klorofil-a Klorofil-b Klorofil Total W0T1 17.87abAB 5.09 abc 23.07 ab
Ket: Angka-angka yang diikuti pada kolom yang sama menyatakan perbedaan nyata pada P.0,05 menurut uji Duncan
Hubungan kandungan klorofil-a dan klorofil-b daun Caladium terhadap
xii
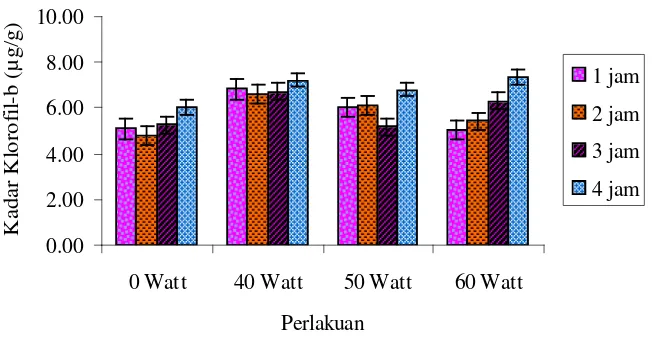
Gambar 4.3.1a Hubungan klorofil-b terhadap energi lampu UV dan waktu penyinaran
Berdasarkan Gambar 4.3.1a dan Gambar 4.3.1b diketahui bahwa penyinaran dengan waktu 1, 2 dan 3 jam cenderung menurunkan kadar klorofil-a dan kadar klorofil–b seiring dengan peningkatan Watt lampu UV yang digunakan walaupun kadar klorofil-a dan klorofil-b lebih tinggi dibandingkan dengan kadar klorofil tanaman kontrol. Sedangkan penyinaran dengan waktu 4 jam cenderung meningkatkan kadar klorofil-a dan klorofil-b seiring dengan meningkatnya ener
(Watt) lampu UV yang digunakan. Kandungan klorofil dari daun Caladium tiap perlakuan juga berbeda, perbedaan kandungan klorofil kemungkinan berhubungan dengan faktor genetik.
Menurut Balsubramanian et al., (2000) dalam Rahayu dan Limnantara (2005) bahwa warna hijau daun sangat berkorelasi dengan kandungan klorofil. Pada umumnya semakin hijau warna daun akan semakin tinggi kandungan klorofilnya. Selanjutnya perbedaan kandungan klorofil setiap tanaman dipengaruhi oleh adanya perbedaan massa jenis tanaman, varietas, status nutrisi, musim serta stress biotik dan abiotik.
xiii
berbanding terbalik dengan penelitian ini karena justru tanaman yang diberi perlakuan
dengan UV yang memiliki kadar klorofil yang lebih tinggi. Keadaan ini mungkin disebabkan juga oleh beberapa faktor lain seperti kandungan hara tanah, dan banyaknya cahaya matahari yang diterima oleh tanaman serta naungan, karena selama penelitian berlangsung tanaman tidak dibiarkan terpapar langsung dibawah sinar
matahari.
Beberapa tanaman juga lebih baik dalam melindungi dirinya dari sinar UV dibandingkan yang lain, dengan cara mengembangkan pigmen-pigmen yang akan mengabsorbsi beberapa sinar, membuat daunnya lebih tebal atau perbaikan kerusakan yang diinduksi oleh UV bagi jaringan dan DNA 2009). Sedangkan Widido et al., (2007), melaporkan bahwa terdapat kecenderungan paparan UV-C meningkatkan tebal daun dengan semakin bertambahnya lama waktu paparan radiasi terhadap tanaman Gynura procumbens dimana peningkatan lama waktu ekspose UV-C dan UV-A cenderung menurunkan ratio klorofil b.
Sedangkan Djukri (2003), menyatakan bahwa pada kondisi kekurangan cahaya, tanaman berupaya untuk mempertahankan agar fotosintesis tetap berlangsung dalam kondisi intensitas cahaya rendah, selain itu kemampuan tanaman untuk beradaptasi terhadap lingkungan ditentukan oleh sifat genetik tanaman. Secara genetik, tanaman yang toleran terhadap naungan mempunyai kemampuan adaptasi
yang tinggi terhadap perubahan lingkungan. Sedangkan Harahap (1994) menyatakan bahwa perubahan fisik yang diikuti perubahan kimia merupakan petunjuk adanya efek biologis dari radiasi ultraviolet yang dapat menggangu keseimbangan biologis yang sangat sensitif terhadap radiasi, sehingga menyebabkan perubahan fisiologis dan
morfologi. Selain dipengaruhi oleh faktor-faktor internal, klorofil dapat juga dipengaruhi oleh faktor lain seperti intensitas cahaya, naungan, morfologi seperti luas permukaan daun.
xiv
sedangkan tanaman di tempat terbuka atau tempat tidak ternaung, kandungan
klorofilnya lebih kecil dan luas daunnya lebih sempit tetapi lebih tebal. Daun ternaungi mengandung lebih banyak klorofil agar tetap dapat menyerap cahaya lebih efektif. Hal ini juga sesuai dengan yang dinyatakan oleh Anggarwulan et al.,(2008), yang menyatakan bahwa intensitas cahaya yang tinggi akan menghambat biosintesis
xv
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Dari penelitian yang telah dilakukan diperoleh kesimpulan sebagai berikut:
a. Besarnya energi (Watt) lampu UV dan lama penyinaran tidak berpengaruh nyata pada perubahan fenotip daun Caladium bicolor, karena mutan yang dihasilkan tidak permanen (dapat berubah).
b. Peningkatan energi lampu UV sampai 40 Watt tidak menyebabkan penurunan tinggi tanaman, panjang dan lebar daun, tetapi menyebabkan penurunan jumlah daun.
c. Peningkatan energi lampu UV sampai 50 Watt tidak menyebabkan terjadinya perubahan fenotipe pada daun Caladiumbicolor.
d. Peningkatan energi lampu UV sampai energi tinggi 60 Watt seiring dengan peningkatan waktu penyinaran (3 jam) menyebabkan penurunan tinggi tanaman panjang dan lebar daun, berat basah dan berat kering tanaman tetapi tidak
berpengaruh dengan penurunan jumlah daun bahkan justru berpengaruh terhadap peningkatan kadar klorofil.
5.2 Saran
a. Perlu dilakukan lagi penelitian lebih lanjut mengenai pengaruh dari sinar UV terhadap perubahan struktur dan komposisi DNA Caladium bicolor
xvi
DAFTAR PUSTAKA
Ackerman, E. & Ellis, L. B. M., 1988. Ilmu Biofisika. Penerbit Universitas Airlangga. Jakarta: hal: 283-284.
Afza, H. 2004. Pengaruh radiasi ultraviolet terhadap multiplikasi tunas aksiler Anyelir
(Dianthus caryophyllus L.) Secara invitro. Diakses 4 Desember 2009. http:/www.terranet.or.id.
Alatas, Z. 2006. Efek pewarisan akibat radiasi pengion. Buletin Alara 8 (2): 1-9.
Anggarwulan, E. & Solichatun. 2007. Kajian klorofil dan karotenoid Plantago major L. dan Phaseolus vulgaris L. sebagai bioindikator pencemaran udara.
Biodiversitas 8 (4): 279-282.
Anggarwulan, E., Solichatun & W. Mudyantini. (2008). Karakter fisiologi Kimpul (Xanthosoma sagittifolium (L.) Schott) pada variasi naungan dan ketersediaan air. Biodiversitas 9 (4): 264-268.
Crowder, L. V. 1990. Genetika Tumbuhan. Cetakan Ketiga, Yogyakarta: Gadjah Mada University Press. hal: 324, 328, 337.
Cummings, M. R. & Klug W. S. 1994. Concepts of Genetics. Fourth Edition. USA: Macmillan Publishing company. pp: 341-343.
Djajanegara, I, P. Wahyudi, D. Tjokrokusumo, N. Widyastuti & Harsoyo. 2007. Pengaruh mutasi dengan radiasi sinar gamma (Co60) terhadap produktivitas jamur tiram abu-abu (Pleorotus Sajurcaju). Berkas Penelitian Hayati (13):57-61.
Djukri, & B. S. Purwoko. 2003. Pengaruh naungan paranet terhadap sifat toleransi tanaman talas (Colocasia esculenta L. (Schoot). Ilmu Pertanian 10 (2): 17-25.
Dwimahyani, I. 2006. Galur mutan krisan toleran terhadap fotoperiodisitas. Buletin Penelitian (10): 47-56.
Elrod S. L & W. D. Stansfield. 2006. Genetika. Edisi Keempat. Jakarta: Erlangga. hal: 68.
Freifelder, D. 1987. Molecular Biology. Second Edition. Boston: Jones And Bartlett Publisher. pp: 293.
xvii
Handayati, W. 2006. Keragaman genetik mawar mini dengan iradiasi sinar gamma. Warta penelitian dan Pengembangan Pertanian 28 (40): 17-62.
Handayati, W. 2008. Ketahanan mawar bunga potong terhadap penyakit embun tepung. Agrivita 30 (3): 242-249.
Harahap, U. 1994. Radiasi, Efek Biologis, dan Penggunaannya Dalam Bidang Farmasi. Medan: Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara.
Harborne, J. B & P. M. Dey. 1990. Methods in Plant Biochemistry. Academic Press Inc., San Diego. pp. 354.
Harm, W. 1980. Biological Effect of Ultraviolet Radiation. Cambridge: Cambridge University Press. pp:79.
Harten, A. M. V. 1998. Mutation Breeding Theory and Practical Applications.
Cambridge: Cambridge University Press. pp:45.
Herison, C. Rustikawati, S. H. Sutjahjo & S. I. Aisyah 2008. Induksi mutasi melalui sinar gamma terhadap benih untuk meningkatkan keragaman populasi dasar jagung (Zea mays L.). Jurnal Akta Agrosai 11 (1): 57-62.
Irawan, B. 2008. Genetika Molekuler. Surabaya: Airlangga University Press. hal: 36, 206, 212.
Krissou, A. A. 2005. Pengaruh sinar ultraviolet terhadap pertumbuhan dan perkembangan kultur invitro krisan (Chrysanthemum Morifolium Ram.). SITH ITB.
Lewis, R. 1997. Human Genetics Concepts and Application. Second Edition. USA: WEB. pp: 189-191.
xviii
Marjenah, 2001. Pengaruh perbedaan naungan terhadap pertumbuhan dan respon morfologi dua jenis semai meranti. Jurnal Ilmiah Kehutanan Rimba Kalimantan. 6 (2): 17-24.
Nasir, M. 2002. Bioteknologi Molekuler Teknik Rekayasa Genetik Tanaman. Bandung: PT Citra Aditya Bakti. hal: 59, 62, 65-69, 91-92.
Pai, A. C. 1992. Dasar-Dasar Genetika. Edisi Kedua. Jakarta: Erlangga. hal: 264, 277, 285.
Prihmantoro, 1997. Tanaman Hias Daun. Cetakan Pertama. Jakarta: Penebar Swadaya. hal: 31, 39, 55.
Priyono & A. W. Susilo. 2002. Respon regenerasi invitro eksplant sisik mikro kerk lily (Lilium longiflorum) terhadap Ethyl Metane Sulfonate(EMS). Jurnal Ilmu Dasar 3 (2): 74-79.
Rahayu, P. & Limnantara, L. 2005. Studi Lapangan Kandungan Klorofil Beberapa Spesies Tumbuhan Hujan Di Salatiga dan Sekitarnya. Seminar Nasional FMIPA Depok: Universitas Indonesia
Saputri, D.A. 2004. Pengaruh irradiasi sinar ultraviolet terhadap viabilitas, kerusakan inti sel dan perkembangan kultur protoplas kacang hijau (Vigna
radiata). Sekolah Ilmu dan Teknologi Hayati.
Soedjono, S. 2003. Aplikasi mutasi somaklonal dan variasi somaklonal dalam pemuliaan tanaman. Jurnal Litbang Pertanian (22) 2: 71-72.
Snustad, E. J & Gardner. 1984. Principles of Genetics. Seventh Edition. New York: John Wiley & Sons Inc. pp: 311-312.
Sudarmono, A. S. 1997. Mengenal dan Merawat Tanaman Hias Ruangan. Cetakan Ketujuh. Yogyakarta: Penerbit Kanisius. hal: 5-16, 71-72.
Tjitrosoepomo, G. 2004. Taksonomi Tumbuhan (Spermatophyta). Cetakan Kedelapan. Yogyakarta: Gadjah Mada University Press. hal: 264.
Tjitrosomo, H.S. 1985. Botani Umum 2. Bandung: Penerbit Angkasa. hal: 42.
Valtonen, E. J. 1961. The Effect of Ultraviolet Radiation of Some Spectral Wavetands on the Mast Cell in the Skin. Copenhagen: Ejnar Munksgaard. pp: 41.
Vasudevan, K. & J. S. Jos. 1988. Gamma Ray induced Mutants in Colocasia.
Mutation Breeding Newsl 32. pp: 4.
Widido, W. D., A. Kurniawati, E. & D. Purwakusumah. 2007. Metode adaptasi tanaman sambung nyawa terhadap cahaya UV untuk meningkatkan produksi flavonoid. Pelaksana Penelitian Agronomi dan Hortikultura
xix
Yuliarti, N. 2008. Caladium Pesona Sang Sayap Bidadari. Cetakan Pertama. Jakarta: PT Agomedia Pustaka.hal: 1-6, 39, 41-42,77, 81.
xx
Lampiran A. Persentase (%) Tanaman Abnormal Pada Setiap Perlakuan Perlakuan Ulangan Tanaman
Mutan
Lampiran B. Data Rataan Tinggi Tanaman (cm) Tiap Minggu Pengamatan
Perlakuan Tinggi Tanaman Tiap Minggu Pengamatan
xxi
Lampiran C. Data Tinggi Tanaman (cm) Minggu Terakhir sebelum ditransformasi
Perlakuan Ulangan Total Rataan
1 2 3
Data Tinggi Tanaman Setelah Ditransformasi ke (Y+0,5)0,5
Perlakuan Ulangan Total Rataan
1 2 3
Daftar sidik ragam Tinggi Tanaman
xxii
Lampiran D. Data Rataan Pertambahan Panjang Daun Tanaman (cm) Tiap Minggu Pengamatan
Perlakuan Panjang Daun Tanaman Tiap Minggu Pengamatan
1 2 3 4 5 6
xxiii
Lampiran E. Data Panjang Daun (cm) Minggu Terakhir sebelum ditransfrmasi
Data Panjang Daun Setelah Ditransformasi ke (Y+0,5)0,5
Perlakuan Ulangan Total Rataan
1 2 3
Daftar sidik ragam Panjang Daun Tanaman
SK DB JK KT F hitung 5% 1%
Keterangan : tn = tidak berbeda nyata
Perlakuan Ulangan Total Rataan
xxiv
Lampiran F. Data Rataan Pertambahan Lebar Daun Tanaman (cm) Tiap Minggu Pengamatan
Perlakuan Lebar Daun Tanaman Tiap Minggu Pengamatan
1 2 3 4 5 6
W0T1 0 4.87 7.77 8.77 8.93 9
W0T2 0 4.83 6.1 7.3 7.43 7.93
W0T3 0 5.17 8.07 8.92 9.17 9.33
W0T4 0 5.53 6.8 7.73 7.77 8.03
W1T1 0 4.03 6.23 6.87 7.27 7.53
W1T2 0 3.57 6.1 7.63 8.27 9
W1T3 0 2.97 6.87 8.17 9.43 10.4
W1T4 0 3.73 4.8 8.93 9.57 9.77
W2T1 0 4.73 7.93 7.53 8.7 9.33
W2T2 0 3.93 6.7 6.87 8.27 8.53
W2T3 0 3.4 4.4 6.37 7.53 7.7
W2T4 0 1.5 6.53 8.43 9.37 9.53
W3T1 0 4.4 6.7 7.63 9.77 9.87
W3T2 0 0.83 4.92 5.27 6.27 9.73
W3T3 0 3.77 5.3 4.92 7.57 8.1
xxv
Lampiran G. Data Lebar Daun Tanaman Minggu Terakhir (cm) Sebelum Ditransformasi
Perlakuan Ulangan Total Rataan
1 2 3
Data Lebar Daun Setelah Ditransformasi ke (Y+0,5)0,5
Perlakuan Ulangan Total Rataan
1 2 3
Daftar Sidik Ragam Lebar Daun Tanaman
SK DB JK KT Fhitung 5% 1%
xxvi
Lampiran H. Data Rataan Pertambahan Lebar Daun Tanaman (cm) Tiap Minggu Pengamatan
Perlakuan Jumlah Daun Tanaman Tiap Minggu Pengamatan
1 2 3 4 5 6
W0T1 0 1 1 1.67 2 2
W0T2 0 1 1.33 1.67 2 2.33
W0T3 0 1 1 2 2 2.33
W0T4 0 1 1 1.67 2 2
W1T1 0 0.67 1.33 1.33 1.67 2
W1T2 0 1.67 1.33 1.33 1.33 1.67
W1T3 0 0.33 1 1.33 1.33 1.67
W1T4 0 1 1.33 1.33 1.67 2
W2T1 0 1 1.33 2 2 2
W2T2 0 1 1 2 2.33 2.33
W2T3 0 0.67 1.33 1.67 1.67 2.33
W2T4 0 0.67 1 1.33 1.33 2
W3T1 0 1 1.33 2 2 2.33
W3T2 0 0.33 1.33 1.33 1.67 2
W3T3 0 1 1.33 2 2 2.33
xxvii
Lampiran I. Data Jumlah DaunTanaman (helai) Minggu Terakhir SebelumDitransformasi
Perlakuan Ulangan Total Rataan
1 2 3
Data Jumlah Daun Setelah Ditransformasi ke (Y+0,5)0,5
Perlakuan Ulangan Total Rataan
1 2 3
Daftar sidik ragam Jumlah Daun Tanaman
SK DB JK KT F 5% 1%
xxviii
Lampiran J. Data Berat BasahTanaman (g) Minggu Terakhir Sebelum Ditransformasi
Perlakuan Ulangan Total Rataan
1 2 3
Data Berat Basah Tanaman Setelah Ditransformasi ke (Y+0,5)0,5
Perlakuan Ulangan Total Rataan
1 2 3
Daftar Sidik Ragam Berat Basah Tanaman
SK DB JK KT F 5% 1%
xxix
Lampiran K. Data Berat Kering Tanaman (g) Minggu Terakhir Sebelum Ditransformasi
Perlakuan Ulangan Total Rataan
1 2 3
Data Berat Kering Tanaman Setelah Ditransformasi ke (Y+0,5)0,5
Perlakuan Ulangan Total Rataan
1 2 3
Daftar Sidik Ragam Berat Kering Tanaman
SK DB JK KT F 5% 1%
xxx
Lampiran L. Data Nilai Absorbansi Ekstrak Klorofil pada panjang gelombang 663 dan 645 nm Sebelum Dimasukkan Ke Rumus Penghitungan Klorofil
Perlakuan
Ulangan
1 2 3
663 645 663 645 663 645
xxxi
Lampiran M. Data Kadar Klorofil-a (µg/g) Sebelum Ditransformasi
Perlakuan Ulangan Total Rataan
1 2 3
Data Berat Kadar Klorofil-a Setelah ditranformasi ke(Y+0,5)0,5
Perlakuan Ulangan Total Rataan
1 2 3
Daftar Sidik Ragam Kandungan Klorofil-a Daun Tanaman
xxxii
Lampiran N. Data Kadar Klorofil-b (µg/g) Sebelum Ditransformasi
Perlakuan Ulangan Total Rataan
1 2 3
Data Berat Kadar Klorofil-b Setelah ditranformasi ke(Y+0,5)0,5
Perlakuan Ulangan Total Rataan
1 2 3
Daftar sidik ragam Kadar Klorofil-b
xxxiii
Lampiran O. Data Kadar Klorofil Total (µg/g) Sebelum ditransformasi
Perlakuan Ulangan Total Rataan
1 2 3
Lampiran : Data Kadar Klorofil Total setelah ditransformasi ke(Y+0,5)0,5
Perlakuan Ulangan Total Rataan
1 2 3
Daftar sidik ragam Kadar Klorofil Total