BIOSENSOR ANTIOKSIDAN BERBASIS SUPEROKSIDA
DISMUTASE
Deinoccus radiodurans
DIIMOBILISASI PADA
NANOKOMPOSIT ZEOLIT ALAM INDONESIA
WENIARTI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini menyatakan bahwa tesis Biosensor Antioksidan Berbasis Superoksida Dismutase Dari Mikroba Indonesia Yang Diimobilisasi Dalam Nanokomposit Zeolit Alam Indonesia adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka dibagian akhir disertasi ini.
Bogor, Juli 2011
ABSTRACT
WENIARTI. Antioxidant Biosensor based Superoxide Dismutase from
Deinococcus radiodurans Immobilized on Natural Zeolite Nanocomposite from Indonesia. Under direction of DYAH ISWANTINI PRADONO, NOVIK NURHIDAYAT and ZAENAL ABIDIN
The immobilization superoxide dismutase extract from D. radioduras on a zeolite nanocomposite modified electrode were studied. Cyclic voltammetry (CV) are employed to investigate the catalytic behavior of the biosensor. The superoxide radical was produced in solution using the xantine/xanthine oksidase system.
Antioxidant activity vitamin C was determined by 2, 2-diphenil-2-picrylhydrazyl (DPPH) free radical scavenging method and comparing with biosensor SOD. Optimum conditions for SOD activity was at pH 9, temperature 300 C, zeolite 137.5mg, and SOD 3 U/ml for pure SOD and 9, temperature 300 C, zeolite 137.5mg, and SOD 1500µg/mL for D. radiodurans SOD. Dismutation reaction kinetics of superoxide catalyzed by SOD followed the Lineweaver-Burk kinetics with D. radiodurans SOD Kmapp value was higher than pure SOD. Antioxidant capacity for Vitamin C was 19.49 ppm using DPPH method and value 0,7 for relative antioxidant capacity using biosensor SOD. In conclusion, D radiodurans
SOD immobilized on a zeolite nanocomposite had a great potential as biological recognition component for antioxidant biosensor.
Radiodurans Diimobilisasi Pada Nanokomposit Zeolit Alam Indonesia. Dibimbing oleh DYAH ISWANTINI PRADONO, NOVIK NURHIDAYAT dan ZAENAL ABIDIN
Antioksidan diperlukan tubuh untuk melawan radikal bebas. Oleh karena itu, sangat dibutuhkan suatu metode yang tepat untuk mengukur sifat-sifat antioksidan pada berbagai jenis sampel baik antioksidan alami maupun sintesis. Metode yang banyak digunakan untuk mengukur kapasitas dan aktivitas antioksidan adalah spektrofotometri, fluoresensi dan kromatografi. Pengukuran antioksidan menggunakan metode spektrofotometeri seringkali terkendala terhadap preparasi sampel. Pengukuran kapasitas antioksidan selain terkendala masalah preparasi sampel juga ada beberapa pengukuran yang memerlukan peralatan yang mahal, seperti ORAC-FL dan HPLC. Biosensor elektrokimia merupakan alternatif metode yang dikembangkan untuk mengukur kapasitas antioksidan karena dapat mengukur dengan cepat, valid dan biayanya rendah. Biosensor untuk mengukur kapasitas antioksidan berbasis enzim SOD untuk memonitor radikal superoksida menunjukkan hasil yang lebih baik hal ini dikarenakan enzim SOD adalah enzim yang spesifik bereaksi dengan ion superoksida. Penggunaan enzim pada biosensor terkendala oleh harganya yang mahal oleh sebab itu untuk menekan biaya digunakan bakteri penghasil SOD yaitu Deinococcus radiodurans. Penelitian ini bertujuan untuk mendapatkan ekstrak protein enzim SOD dari D. radiodurans untuk diimobilisasi dalam nanokomposit zeolit alam Indonesia dan mengukur aktivitas ekstrak SOD dalam nanokomposit zeolit alam yang diimobilisasi pada permukaan elektrode pasta karbon dan menentukan parameter kinetikanya dengan metode elektrokimia.
Penelitian ini terdiri dari beberapa tahap percobaan yaitu: penumbuhan sel
Deinococus radiodurans dan ektraksi SOD, pembuatan elektrode, imobilisasi enzim, optimasi aktivitas SOD dan bakteri terimobilisasi, penentuan parameter kinetika pengukuran kapasitas antioksidan vitamin C dengan metode DPPH dan biosensor. Penumbuhan D. radiodurans dilakukan dengan menggunakan metode LB cair dan ekstraksi dilakukan dengan cara sonikasi pada pulse 50% dan output 5 untuk memecahkan sel bakteri yaitu dengan interval 10 x 2 menit dan interval berhenti 1 menit. Elektrode yang dibuat adalah elektrode Ag/AgCl sebagai elektrode rujukan, elektrode pasta karbon termodifikasi ferosena sebagai elektrode kerja. Modifikasi metode imobilisasi yang dilakukan terdiri dari 4 jenis. yaitu SOD di imobilisasi dengan zeolit, kemudian diteteskan pada permukaan pasta karbon termodifikasi ferosena (SOD/Zeolit/PCf), SOD di imobilisasi pada permukaan pasta karbon termodifikasi ferosena (SOD/PCf), zeolit di imobilisasi pada permukaan pasta karbon termodifikasi ferosena (Zeolit/PCf) dan terakhir SOD di imobilisasi pada permukaan zeolit (SOD/Zeolit). Radikal superoksida dihasilkan dari reaksi xantina/xantina oksidase. Optimasi aktivitas SOD terimobilisasi menggunakan Response Surface Method dimana yang divariasikan adalah suhu, pH, jumlah zeolit, konsentrasi enzim dan bakteri. Penentuan Km dan
diaplikasikan untuk mengukur kapasitas antioksidan dari vitamin C yang ditunjukkan sebagai nilai relative antioxidant activity (RAC) yang merupakan perbandingan slope dari tanpa penambahan dan penambahan vitamin C dalam larutan. Sebagai perbandingan dilakukan juga pengukuran kapasitas antioksidan dengan menggunakan metode DPPH.
Bakteri D. radiodurans ditumbuhkan dalam media LB cair selama 48 jam dengan suhu 30 0C. Protein yang terkestrak memiliki konsentrasi sebesar 3100 µg/ml dengan rendemen ekstrak protein adalah 2,41% dari bobot basah. Pada pembuatan elektroda pembanding Ag/AgCl dilakukan karakterisasi dengan cara diaplikasikan mengukur arus puncak K3[Fe(CN)6] dalam larutan elektrolit
pendukung KCl 0,1 M menggunakan teknik voltametrik siklik. n yang dihasilkan adalah 1,1 dan ∆Ep
Optimasi enzim dan bakteri terimobilisasi dengan menggunakan metode respon permukaan menghasilkan daerah optimum untuk enzim SOD adalah pada pH 9, suhu 30
= 66 mV. Berdasarkan hasil pengukuran ini maka elektrode Ag/AgCl dapat digunakan sebagai elektrode pembanding. Untuk pemilihan metode imobilisasi yang akan digunakan, dapat dilihat dari data puncak arus dan potensial pada voltamogram siklik yang dihasilkan. Dari data terlihat bahwa, SOD di imobilisasi dengan zeolit, kemudian diteteskan pada permukaan pasta karbon termodifikasi ferosena (SOD/Zeolit/PCf) menghasilkan puncak arus yang lebih tinggi dibandingkan dengan yang lain yaitu sebesar 1,02, sehingga SOD/Zeolit/PCf yang digunakan pada penelitian ini.
0
C, zeolit 137,5 mg dan konsentrasi SOD 3 unit/ml. Daerah optimum untuk ekstrak kasar enzim SOD D.radiodurans adalahpH 9, suhu 300
Penentuan K
C, zeolit 137,5 mg dan konsentrasi SOD yaitu 1500 µg/ml. Sedangkan penggunaan bakteri tidak dihasilkan nilai puncak yang maksimum. Hal ini disebabkan karena
D. radiodurans memiliki dinding sel yang tebal dan juga strukturnya yang tetrad kemungkinan ekskresi SOD tidak terjadi, karena tidak adanya SOD yang bereaksi dengan radikal superoksida tidak ada transfer elekron yang terjadi oleh sebab itulah arus tidak dihasilkan. Sehingga dapat disimpulan sel bakteri D. radiodurans
utuh sebagai komponen pengenal hayati biosensor antioksidan kurang berpotensi.
m dan Imaks dilakukan dengan metode Lineweaver-Burk
menghasilkan Km dan Imaks untuk enzim SOD adalah 1,096 mM dan 0,989 μA
sedangkan untuk ekstrak kasar enzim SOD adalah 2,978 mM dan 0,878 μA. Perbedaan nilai Km
Aktivitas antioksidan vitamin C ditentukan dengan menggunakan metode biosensor dan DPPH. Kapasitas antioksidan dengan menggunakan biosensor SOD dinyatakan sebagai relative antioxidant capacity (RAC). Nilai (RAC) merupakan perbandingan dua slope dari kurva dengan dan tanpa penambahan sampel antioksidan. Jika sampel memiliki kandungan antioksidan maka arus yang dihasilkan akan lebih rendah dibandingan dengan larutan yang hanya mengandung radikal superoksida. Dengan membandingakan dua slope ini maka dapat ditentukan kapasitas antioksidan dari sampel. RAC vitamin C yang didapatkan adalah 0,76 dengan konsentrasi vitamin C sebesar 0,05 M. Sedangkan dengan metode DPPH diperoleh kapasitas antioksidan vitamin C adalah sebesar 19,49 ppm. Dari kedua metode yang digunakan kita dapat melihat bahwa,
diperlukan inkubasi karena super radikal adalah senyawa yang tidak stabil sehingga harus segera diukur. Dari sini dapat disimpulkan bahwa penggunaan biosensor lebih cepat, akurat dan sensitif dibandingkan dengan spektrofotometri.
Penggunaan zeolit sebagai material pendukung untuk enzim SOD yang diimobilisasi pada permukaan elektrode pasta karbon yang dimodifikasi dengan ferosena sebagai mediator dapat meningkatkan aktivitas SOD dalam biosensor antioksidan. Nilai Km enzim SOD lebih besar daripada nilai Km
Kata Kunci: Biosensor antioksidan, superoksida dismutase (SOD), Deinococcus radiodurans, nanokomposit zeolit, Kinetika enzim.
© Hak Cipta milik IPB, tahun 2011
Hak Cipta dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya.
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah;
b. Pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
BIOSENSOR ANTIOKSIDAN BERBASIS SUPEROKSIDA
DISMUTASE
Deinoccus radiodurans
DIIMOBILISASI PADA
NANOKOMPOSIT ZEOLIT ALAM INDONESIA
WENIARTI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Kimia
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Nanokomposit Zeolit Alam Indonesia Nama : Weniarti
NIM : G451090011 Program Studi : Kimia
Disetujui
Komisi Pembimbing
Dr. Dyah Iswantini Pradono, M.Agr Ketua
Novik Nurhidayat Ph.D Dr. Zaenal Abidin
Anggota Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana IPB
Kimia
Prof. Dr. Purwantiningsih S, M.Si Dr. Ir. Dahrul Syah, MSc.Agr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga proposal penelitian ini berhasil diselesaikan. Judul penelitian ini adalah Biosensor Antioksidan Berbasis Superoksida Dismutase Dari Mikroba Indonesia Yang Terimobilisasi Dalam Nanokomposit Zeolit Alam Indonesia.
Terimakasih penulis ucapkan kepada Dr. Dyah Iswantini Pradono, M.Agr, Ir. Novik Nurhidayat Ph.D dan Dr. Zaenal Abidin selaku komisi pembimbing, Trivadila M.Si yang telah banyak mengajarkan dan memberi saran pada penulisan tesis. Terimakasih saya ucapkan juga untuk Dosen di lingkungan Departemen Kimia yang telah memberikan bimbingan dan ilmu selama menempuh pendidikan. Disamping itu penghargaan penulis sampaikan kepada DEPAG yang telah memberikan beasiswa. Pak Nano, Bu Ai, dan pak Mail, Staf laboraturium Kimia Fisik. Ibu Nunung dan Pak Eman dari Kimia Analitik, Bu Neri, Mbak Ratih, dan pak Encun di PUSLIT Biologi LIPI. Ungkapan terimakasih juga disampaikan kepada, Ayahnda, Ibunda, Suamiku tercinta Darmawansyah SE atas dukungan dan pengorbananya, ananda tercinta Waffiyah Qonitha Ariqoh serta seluruh keluarga dan teman-teman seperjuangan di mayor Kimia angkatan 2009.
Semoga karya ilmiah ini bermanfaat.
Bogor, Juli 2011
Penulis dilahirkan di Nanti Giri, Sumatera Selatan pada tanggal 30 Mei 1980 dari ayah A. Fauzi manaf dan ibu Sri Sutiarni. Penulis merupakan anak ketiga dari empat bersaudara.
Tahun 1998 penulis lulus dari SMA Negeri 1 Pagar Alam Sumatera Selatan dan pada tahun yang sama lulus seleksi masuk Universitas Bengkulu melalui jalur Seleksi Penerimaan Mahasiswa Baru. Penulis memilih mayor Kimia, Fakultas Pendidikan dan Ilmu Pengetahuan Alam. Pada tahun 2009, penulis diterima di Program Studi Kimia pada Program Pascasarjana IPB. Beasiswa pendidikan pascasarjana diperoleh dari Departemen Agama Republik Indonesia.Penulis bekerja di Madrasah Aliyah Negeri 2 Kota Bengkulu sejak tahun 2005.
Selama mengikuti program S2, penulis menjadi anggota Himpunan Mahasiswa Muslim pascasarjana (HIMMPAS)-IPB. Karya Ilmiah berjudul Toxicity Level, Antifeedant And Antioxidant Activity Of Curcuma zedoaria
DAFTAR ISI
Immobilisasi Enzim SOD dalam Matrik nanokomposit Zeolit….. Kinetika enzim………. Optimasi aktivitas SOD dan bakteri terimobilisasi ………. Kinetika Enzim Superoksida Dismutase Immobilisasi……… Pengukuran Aktivitas……….………..SIMPULAN DAN SARAN………. 40
DAFTAR PUSTAKA……….. 41
LAMPIRAN………. 42
Halaman
1 Kombinasi pH, suhu, zeolit dan enzim SOD untuk
pengoptimuman aktivitas SOD D. radiodurans immobilisasi……….
2
16
Puncak arus dan potensial SOD terimmobilisasi dalam pasta
Karbon dan zeolit……….………
17
3 Nilai parameter kinetika enzim SOD immobilisasi……….…… 18
4 Puncak arus dan potensial modifikasi metode imobilisasi………….. 24
5 Nilai parameter kinetika enzim SOD imobilisasi………..….. 34
DAFTAR GAMBAR
Halaman
1 Voltamogram siklik pada pengukuran larutan K3Fe (CN)6
0.01M…..
22
2 Puncak arus anode dan katode SOD di imobilisasi dengan zeolit, kemudian diteteskan pada permukaan pasta karbon termodifikasi ferosena (SOD/Zeolit/PCf), SOD di imobilisasi pada permukaan pasta karbon termodifikasi ferosena (SOD/PCf), dan SOD di
imobilisasi pada permukaan zeolit (SOD/Zeolit)………... 24
3 Puncak arus anode dan katode SOD zeolit di imobilisasi pada
permukaan pasta karbon termodifikasi ferosena (ZPf)……… 25
4 Proses transfer dari reaksi enzimatis SOD terimobilisasi dalam nankomposit zeolit kepermukaan elektrode pasta karbon yang dimediasi oleh ferosena………
26
5 Plot kontur hubungan antara zeolit dan konsentrasi SOD terhadap puncak arus oksidasi (a), pH dan konsentrasi SOD terhadap puncak arus oksidasi (b), pH dan zeolit terhadap puncak arus oksidasi (c), suhu dan konsentrasi SOD terhadap puncak arus oksidasi (d), Suhu dan zeolit terhadap puncak arus oksidasi (e),
suhu dan pH terhadap puncak arus oksidasi (f)…..………. 28
6 Plot kontur hubungan antara pH dan konsentrasi SOD terhadap puncak arus oksidasi (a), pH dan zeolit terhadap puncak arus oksidasi (b), suhu dan konsentrasi SOD terhadap puncak arus oksidasi (c), suhu dan zeolit terhadap puncak arus oksidasi (d), Suhu dan pH terhadap puncak arus oksidasi (e), zeolit dan konsentrasi
7 Plot kontur hubungan antara suhu dan pH terhadap puncak arus oksidasi, suhu dan konsentrasi SOD terhadap puncak arus oksidasi, suhu dan zeolit terhadap puncak arus oksidasi, pH dan zeolit
terhadap puncak arus oksidasi ……….. 31
8 Hubungan konsentrasi xantina dan aktivitas SOD………... 32
9 Linearitas konsentrasi xantina dan aktivitas SOD………... 33
10 Plot Lineweaver-Burk enzim SOD immobilisasi………. 34
11 Struktur enzim Cu/Zn-SOD (a) (Donnelly et al.1989) dan Mn-SOD (b) ….. 35
12 Puncak arus dengan tanpa (blanko) dan penambahan vitamin .…… 37
13 Nilai RAC Vitamin C dengan berbagai konsentrasi……… 37
14 % inhibisi vitamin C terhadapa DPPH………. 37
DAFTAR LAMPIRAN
Halaman
1 Diagram alir penelitian……… 432 Ekstraksi SOD………. 44
3 Potensial dan arus pada puncak anodik dan katodik pada pengukuran K3Fe (CN)6 0.01M ……….. 45
4 Pengoptimuman enzim Murni ………... 46
5 Pengoptimuman ekstrak SOD ……….……..… 47
6 Pengoptimuman Bakteri D.radiodurans……….. 48
7 Kinetika Enzim superoksida dismutase……….…. 49
8 Pengukuran kapasitas antioksidan vitamin C dengan menggunakan
biosensor………..…………
9
50 Pengukuran Kapasitas antioksidan vitamin C dengan metode DPPH. 51
PENDAHULUAN
Latar Belakang
Spesi oksigen reaktif adalah kelas radikal bebas yang sangat berbahaya
dalam tubuh karena dapat menyebabkan kerusakkan pada sel (Cortina-Puig et al.
2007). Spesi oksigen reaktif akan mencari pasangan elektron dari sel manusia
yang sehat akibatnya sel akan mengalami kerusakan dan memicu kerusakan pada
tingkat organ yang akan menyebabkan penyakit jantung, kanker, stroke, diabetes
dan gejala penuaan dini (Ignatov et al. 2002). Untuk melawan radikal bebas,
sebenarnya tubuh memiliki antioksidan endogen yaitu enzim katalase,
peroksidase, superoksida dismutase (SOD), dan glutationa S-transferase. Jika
terjadi paparan radikal yang berlebih dalam tubuh diperlukan antioksidan
eksogen yang biasanya bersumber dari makanan. Selain untuk kesehatan
manusia antioksidan juga digunakan secara luas dalam industri makanan, industri
petroleum, industri karet dan sebagainya. Oleh karena itu, sangat dibutuhkan
suatu metode yang tepat untuk mengukur sifat-sifat antioksidan pada berbagai
jenis sampel baik antioksidan alami maupun sintesis.
Metode yang banyak digunakan untuk mengukur kapasitas dan aktivitas
antioksidan adalah spektrofotometri, fluoresensi dan kromatografi (Cortina-Puig
et al. 2007). Pengukuran antioksidan menggunakan metode spektrofotometeri
seringkali terkendala terhadap preparasi sampel. Sebagai contoh, metode DPPH
memang tidak memerlukan substrat sehingga memiliki keuntungan, yaitu lebih
sederhana dan waktu analisis yang lebih cepat, tapi metode ini sangat peka
terhadap cahaya. Preparasi sampel harus dilakukan dalam kondisi gelap selain
itu tidak dapat digunakan untuk sampel yang memiliki konsentrasi tinggi.
Demikian halnya dengan ABTS dan FRAP juga sangat sensitif terhadap cahaya,
bahkan pembentukan ABTS.
-Pengukuran kapasitas antioksidan selain terkendala masalah preparasi
sampel juga ada beberapa pengukuran yang memerlukan peralatan yang mahal,
seperti metode ORAC-FL (Du et al. 2009) dan kromatografi. Liu et al. (2000)
menggunakan HPLC untuk menentukan kapasitas antioksidan golongan memerlukan waktu inkubasi selama 12-16 jam
polifenol dari ekstrak teh hijau. Metode ini didasarkan atas kemampuan
menangkap radikal yang dihasilkan dari peroksidasi low density lipoprotein
manusia. Wijngaard et al. (2009) menentukan kapasitas antioksidan dari jeruk
Irlandia dan sayuran sisa olahan produk menggunakan HPLC-DAAD dengan
menggunakan metode pelarut bergradient yang diatur mulai dari 0-70 menit, volume injeksi 10μL. Penggunaan HPLC dalam mengukur kapasitas antioksidan memerlukan preparasi sampel dan waktu pendeteksian yang lama.
Biosensor merupakan metode yang banyak dikembangkan untuk
mengatasi permasalah-permasalahan yang muncul dalam penentuan kapasitas
antioksidan. Pengukuran aktivitas antioksidan dengan menggunakan biosensor
tidak dipengaruhi oleh cahaya dan juga tingkat kekeruhan dari sampel karena
yang diukur adalah arus yang dihasilkan. Selain itu, biosensor juga dapat
menenentukan dan memonitor kapasitas antioksidan pada sampel yang kompleks
tanpa memerlukan pemisahan komponen terlebih dahulu (Mello & Kubota 2007).
Biosensor elektrokimia merupakan alternatif metode yang dikembangkan
untuk mengukur kapasitas antioksidan karena dapat mengukur dengan cepat,
valid dan biayanya rendah (Campanella et al. 2004). Ada dua tipe biosensor
elektrokimia yang digunakan untuk mengukur sifat-sifat antioksidan yaitu
biosensor amperometri untuk mengukur mono dan poliefenol berbasis enzim
tirosinase (Busch et al. 2006), lakase (Roy et al. 2005) dan peroksidase, serta
biosensor untuk menguji kapasitas antioksidan berdasarkan aktivitas
penangkapan radikal bebas berbasis sitokrom c (Cortina-Puig et al. 2007), DNA
(Kamel et al. 2008 ) dan SOD (Campanella et al. 2005). Biosensor untuk
mengukur kapasitas antioksidan berbasis enzim SOD untuk memonitor radikal
superoksida menunjukkan hasil yang lebih baik dibandingankan sitokrom c hal
ini dikarenakan enzim SOD adalah enzim yang spesifik bereaksi dengan ion
superoksida (Di et al. 2004). Enzim SOD adalah enzim yang melindungi
organisme dari efek racun ion superoksida dengan mengkatalisis secara efisien
dismutasi O2.- menghasilkan O2 dan H2O2
2O
melalui mekanisme transfer elektron
reaksi oksidasi - reduksi (Emregül 2005).
Biosensor berbasis SOD sudah terbukti dapat mengukur kapasitas
antioksidan berbagai jenis contoh seperti teh, minuman teh, produk herbal
(Campanella et al. 2003a), anggur merah dan anggur putih (Campanella et al.
2004) dan alga (Campanella et al. 2005). Pada pengukuran yang dilakukan
terhadap contoh minuman anggur merah dan anggur putih, dengan menggunakan
metode spektrometri dan fluorometri menghasilkan perbedaan kapasitas
antioksidan yang sangat besar dibandingkan dengan menggunakan metode
biosensor. Hal ini menunjukkan metode biosensor lebih sensitif dibandingkan
dengan menggunakan kedua metode lainnya. Salah satu kelemahan penggunaan
enzim SOD dalam biosensor adalah harga enzim ini sangat mahal, oleh sebab itu
penggunaan mikroba yang menghasilkan enzim tersebut adalah salah satu solusi
untuk menekan biaya karena tidak diperlukan suatu pemurnian enzim.
Penggunaan sel bakteri utuh E. coli telah dilakukan oleh Iswantini et al. (1998)
sebagai komponen pengenal pada biosensor glukosa. Dimana pemanfaatan E.
coli sebagai komponen pengenal menghasilkan hasil yang cukup sensitif, akurat
dan praktis.
Salah satu bakteri yang menghasilkan enzim SOD adalah bakteri
Deinococcus radiodurans. Organisme ini tahan terhadap banyak agen yang
dapat menyebabka
D radiodurans merupakan
bakteri yang dapat bertahan hidup terhadap radiasi yang sangat tinggi karena
bakteri ini mempunyai mekanisme perbaikan DNA yang cepat dan mempunyai
banyak salinan dari genomenya sendiri. Selain itu bakteri ini mudah berkembang
dan tidak menimbulkan penyakit. Kemampuan bakteri ini yang tahan terhadap
lingkungan ekstrim diperkirakan karena bakteri ini memiliki sistem antioksidan
yang tinggi dimana di dalamnya terdapat enzim SOD dan katalase (Yuan et al.
2007). Berdasarkan hal ini maka bakteri D. radiodurans memiliki potensi yang
besar sebagai komponen pengenal hayati pada biosensor antioksidan.
Perkembangan biosensor antioksidan berbasis enzim SOD saat ini telah
mencapai generasi ketiga dan pengembangan juga diarahkan ke arah material
nano. Biosensor generasi ketiga diantaranya dibuat dengan mengimobilisasi
pada permukaan elektroda emas (Di et al. 2004). Salah satu bahan yang
berpotensi digunakan sebagai matriks imobilisasi SOD adalah zeolit, karena
zeolit memiliki struktur yang sebagian besar tersusun dari silikon tetrahedral
yang terhubung satu sama lain dengan atom oksigen membentuk pori yang khas
dengan ukuran nano. Pori adalah tempat masuknya molekul gas maupun cairan
dan menjerapnya dengan kuat.
Indonesia merupakan salah satu negara yang memiliki potensial zeolit
alam tapi pemanfaatannya masih perlu dioptimalkan di segala bidang. Penelitian tentang pemanfaatan zeolit untuk sensor telah banyak dilakukan. Dai et al.
(2004) mengimobilisasi sitokrom c menggunakan matrik zeolit jenis NaY.
Selain itu zeolit yang telah dikalsinasi juga dimanfaatkan sebagai matrik
pengimobilisasi peroksidase dan metilena hijau (Liu et al. 1999). Elektroda
pasta karbon yang termodifikasi FeCl3
Penelitian ini merupakan lanjutan dari penelitian Trivadila (2011) yaitu
pemanfaatan SOD Deinococcus radiodurans yang diimobilisasi pada elektroda
pasta karbon sebagai biosensor antioksidan. Penelitian yang dilakukan oleh
Trivadila (2011) memiliki beberapa kekurangan yaitu spesifiksitas dan
sensitivitas yang masih rendah. Oleh sebab itu perlu dilanjutkan untuk
menentukan metode imobilisasi dan juga pengembangan ke arah material nano
agar didapatkan hasil yang lebih baik lagi.
dan zeolit ternyata dapat meningkatkan
arus yang dihasilkan dibandingkan dengan tanpa menggunakan zeolit (Balal et
al. 2009). Tapi sejauh ini belum ada laporan penggunaan nanokomposit zeolit
alam Indonesia sebagai material pengimobilisasi untuk enzim SOD D.
radiodurans. Sehingga penelitian ini menarik untuk dilakukan karena
penggunaan nanokomposit zeolit alam dan bakteri D. radiodurans yang berasal
dari Indonesia belum banyak yang melakukan.
Tujuan Penelitian
Penelitian ini bertujuan untuk mendapatkan ekstrak protein enzim SOD
dari D. radiodurans untuk diimobilisasi dalam nanokomposit zeolit alam
Indonesia dan mengukur aktivitas ekstrak SOD dalam nanokomposit zeolit alam
yang diimobilisasi pada permukaan elektroda pasta karbon dan menentukan
parameter kinetikanya dengan metode elektrokimia.
Hipotesis
Ekstrak protein enzim SOD dari D. radiodurans dalam nanokomposit
zeolit alam Indonesia dan diimobilisasi pada permukaan elektroda pasta karbon
TINJAUAN PUSTAKA
Pengukuran Kapasitas Antioksidan
Metode pengukuran kapasitas antioksidan baik secara in vitro maupun
secara in vivo telah banyak diperkenalkan. Kapasitas antioksidan tidak dapat
diukur secara langsung, melainkan melalui efek antioksidan dalam mengontrol
proses oksidasi. Pada pengukuran aktivitas antioksidan perlu diperhatikan sumber
radikal bebas dan substrat.
Metode yang digunakan untuk mengukur sifat-sifat antioksidan adalah
spektrometri, fluorosensi, kromotografi gas, kromatografi cairan (Prieto-Simon
et al. 2008), voltametri siklik (Kilmartin 2001), dan biosensor (Tian et al. 2005;
Campanella et al. 2005; Kamel et al. 2008). Metode-metode yang sering
digunakan saat ini memiliki kelemahan diantaranya biaya yang mahal karena
membutuhkan bahan kimia yang bermacam-macam dengan jumlah yang banyak,
waktu yang lama karena membutuhkan preparasi contoh, dan kurang sensitif
terutama dalam menguji contoh berwarna.
Biosensor berbasis enzim banyak dikembangkan untuk mengukur
kapasitas antioksidan karena aktivitasnya tinggi, selektif dan spesifikasi reaksi
yang dikatalisnya (Mateo et al. 2007). Tranduser elektrokimia saat ini
mendominasi pada penggunaan biosensor berbasis enzim, sebab kebanyakan
reaksi enzimatis merupakan suatu reaksi redoks, sehingga elektron yang
dihasilkan dari reaksi tersebut dapat dideteksi oleh elektroda pada transduser
elektrokimia yang selanjutnya akan diubah menjadi arus. Arus yang dihasilkan
sebanding dengan konsentrasi antioksidan pada sampel.
Pembuatan biosensor berbasis enzim untuk menentukan kapasitas
antioksidan sangat dipengaruhi oleh radikal yang digunakan. Radikal superoksida
merupakan salah satu radikal yang banyak digunakan karena mudah didapatkan,
seperti dari reaksi enzimatis xantina /xantina oksidase dan reaksinya juga dapat
dikontrol. Terdapat dua jenis biosensor elektrokimia untuk mendeteksi radikal
superoksida yaitu biosensor berbasis sitokrom c (Cortina-Puig et al. 2007) dan
SOD (Campanella et al. 2005). Biosensor untuk mengukur kapasitas antioksidan
yang lebih baik dibandingankan sitokrom c hal ini dikarenakan enzim SOD
adalah enzim yang spesifik bereaksi dengan ion superoksida (Di et al. 2004).
Perkembangan biosensor berbasis SOD dibagi menjadi 3 tahap yaitu biosensor
generasi pertama yaitu biosensor SOD yang mendeteksi O2 atau H2O2
Campanella et al. telah melakukan penelitian untuk pengembangan
biosensor berbasis enzim SOD. Penelitian yang mereka lakukan terfokus pada
imobilisasi SOD pada gel kappa-carragenan dan penggunaan tranduser
amperometri untuk mendeteksi H
, biosensor
generasi kedua adalah biosensor yang memanfaatkan mediator yang digunakan
untuk membawa elektron, dan biosensor generasi ketiga adalah sensor yang
berdasarkan transfer elektron langsung tanpa menggunakan mediator (Trivadila
2011).
2O2
Biosensor untuk mendeteksi radikal superoksida telah dikembangkan
dengan cara mengimobilisasi SOD dalam gelatin yang di taut silang dengan
glutardehida pada permukaan elektroda Pt (Emregul 2005). Biosensor ini
diaplikasikan untuk menentukan kapasitas antioksidan asetilsalisilat, aspirin dan
aspirin yang mengandung vitamin C. Hasil penelitian Trivadila (2011)
membuktikan enzim SOD yang diimobilisasi pada permukaan elektroda pasta
karbon yang termodifikasi ferosena sebagai mediator pada elektroda pasta lebih
baik dibandingkan dengan menggunakan mediator Q
. Biosensor ini telah digunakan untuk
mengukur kapasitas antioksidan minuman anggur merah dan anggur putih
(Campanella et al. 2004), teh dan produk herbal (Campanella et al. 2003)
dimana data kapasitas antioksidan yang diperoleh menunjukkan hasil yang lebih
baik dibandingkan dengan metode spektrofotometri, metode flourosensi dan
biosensor tirosinase.
0
Pengembangan biosensor untuk mengukur kapasitas antioksidan berbasis
SOD secara langsung telah dilakukan oleh Di et al. (2004), dimana SOD
diimobilisasi pada sol-gel thin film pada permukaan elektroda emas. Struktur
pori yang seragam dari matrik silika–PVA sol–gel menghasilkan respon yang
cepat dan sangat efisien untuk menstabilkan enzim. Wang et al. (2009)
menggunakan partikel nano emas untuk mengimobilisasi SOD yang dimodifikasi
pada permukaan indium tin oksida (ITO).
Enzim Superoksida dismutase
Superoksida dismutase (SOD) bertindak sebagai enzim intraseluler utama
yang melindungi kerusakan sel akibat radikal superoksida dengan cara
mengkatalis radikal O2 .- menjadi hidrogen peroksida (H2O2) dan oksigen (O2)
(Kobayashi et al. 1991, Kankofer 2002
2O
).
2- + 2 H+ O2+H2O2
Enzim superoksida dismutase merupakan suatu metaloenzim
. Berdasarkan
kandungan logamnya, superoksida dismutase dibagi dalam empat kelas yaitu
enzim Cu/Zn-SOD, Enzim Mn-SOD, Enzim Fe-SOD, dan Ni-SOD
(Buyukuslu et al. 2006). Pemanfaatan SOD untuk biosensor antioksidan telah
banyak dilakukan. Hal ini dikarenakan beberapa kelebihan yang dimiliki oleh
SOD yaitu enzim ini spesifik mengkatalis radikal superoksida menjadi oksigen
dan peroksida (Donnely et al. 1989). Selain itu juga dilaporkan bahwa SOD pada
makanan memiliki ketahanan terhadap panas, SOD dari susu sapi bisa bertahan
pada suhu 630C, SOD dari ekstrak kol bisa bertahan pada suhu 450C, ekstrak kasar kecambah Brussels aktivitasnya menurun pada saat dipanaskan selama 30
menit dengan suhu 800
SOD telah disiolasi dari bakteri hipertermofilik dari genus Sulfolobus
dan Pyrobaculum, dan dari Aquifex pyrophilus, Thermothrix sp, Rhodothermus
sp, Bacillus sp. MHS47 (Areekit et al. 2011) dan Deinococcus radiophilus (Yun
et al. 2004). Bakteri
C (Donnely et al. 1989). Penggunaan enzim SOD murni
dalam biosensor terkendala pada harga enzim yang mahal. Oleh sebab itu
pemanfaatan bakteri penghasil SOD merupakan solusi untuk menekan biaya.
Deinococcus radiodurans merupakan salah satu penghasil
SOD. Bakteri Deinococcus radiodurans
Aktivitas spesifik Mn-SOD yang dihasilkan dari D radiodurans adalah
sebesar 9191 U/mg (Seatovic et al. 2004). Aktivitas ini lebih besar dibandingkan termasuk dalam filum Deinococci, ordo
Deinococcales, famili Deionococcuceae, genus Deinococcus, spesies
radiodurans. Bakteri ini merupakan gram positif, aerob dan non patogen yang
sangat resistan terhadap radiasi ultraviolet, ionisasi, desikasi dan ROS.
Kemampuan D. radiodurans ini dikarenakan di dalam bakteri ini terdapat
Mn-SOD dan katalase yang merupakan sistem antioksidan yang dapat melindungi
dengan Mn-SOD yang dihasilkan dari udang Macrobrachium nipponerse yaitu
96,29/mg (Yao et al. 2004) dan juga aktivitas Mn-SOD dari Bacillus sp. MHS47
dimana aktivitas spesifiknya sebesar 3537.75 U/mg (Areekit et al. 2011) jauh
lebih kecil. Berdasarkan aktivitas spesifik yang didapatkan maka D. radiodurans
memiliki potensi untuk digunakan sebagai komponen pengenal pada biosensor
antioksidan.
Imobilisasi enzim SOD dalam matrik nanokomposit zeolit
Enzim redoks banyak digunakan dalam biosensor elektrokimia karena
enzim ini dapat menghasilkan atau menggunakan elektron dalam mengkatalis
suatu substrat menjadi produk, di mana elektron ini yang akan dideteksi
(Grieshaber et al. 2008). Ada beberapa permasalahan yang muncul dalam
penggunaan enzim dalam biosensor yaitu pemulihan enzim, stabilitas enzim,
selektivitas enzim dan reduksi inhibisi oleh medium atau produk (Mateo et al.
2007)
Permasalahan di atas dapat diatasi dengan melakukan imobilisasi enzim
pada material tertentu. Fungsi dari imobilisasi enzim adalah agar enzim dapat
digunakan dan diolah kembali sehingga biaya lebih murah, desain menjadi
sederhana karena tidak membutuhkan reaktor dan dapat mengontrol reaksi.
Selama imobilisasi enzim harus dijaga dan ditingkatkan stabilitasnya. Salah satu
metode yang dapat digunakan untuk menjaga kestabilan enzim adalah dengan
melakukan imobilisasi pada material yang memiliki pori dan untuk meningkatkan
selektivitas dapat digunakan nano material (Mateo et al. 2007).
Nanokomposit merupakan suatu substansi yang tersusun dari kombinasi
dua atau lebih material yang berbeda dalam ukuran nanometer. Sifat mekanik,
termal, elektrik, dan optik nanokomposit zeolit lebih baik dibandingkan dengan
makro ataupun mikropartikelnya (Hadiyawarman et al. 2008). Zeolit alam
merupakan mineral alam berbentuk kristal yang terbentuk dari bahan vulkanik
dan mempunyai struktur pori dalam ukuran nano (Hamdan 2005). Struktur pori
pada zeolit terbentuk karena adanya silikon tetrahedral yang terhubung satu sama
lain dengan atom oksigen (Valdes et al. 2006). Rumus umum komposisi zeolit
Mx/n[(AlO2)x(SiO2)y]m H2
Dimana n = valensi kation M (alkali/alkali tanah) 0
x,y = jumlah tetrahedron perunit sel
m = jumlah molekul air perunit sel
M =Kation alkali/alkali tanah
Pori yang berukuran nanometer ini merupakan tempat masuknya gas
maupun cairan dan menjadi ciri khas dan unik pada berbagai jenis zeolit. Hal ini
disebabkan oleh penyusunan struktur dasar zeolit untuk setiap jenis zeolit
memiliki cara pengaturan yang berbeda satu dengan lain sehingga menyebabkan
beragamnya ukuran pori yang dihasilkan. Luas permukaan zeolit meliputi pori
dan bagian luar dari zeolit dimana bagian pori ini akan dapat menjerap molekul
dalam bentuk cairan maupun gas dengan kuat dibandingkan pada bagian luarnya. Luas permukaan yang besar ini memungkinkan zeolit dapat difungsikan sebagai
penjerap. Ukuran rongga atau pori dalam zeolit yang bervariasi
memungkinkannya memerangkap molekul atau ion dengan berbagai ukuran atau
sebaliknya meloloskan molekul atau ion lainnya yang ukurannya lebih kecil dari
ukuran pori atau rongganya.
Dai et al. (2004) telah mengimobilisasi enzim sitokrom c pada zeolit
NaY. Interaksi antara zeolit NaY dengan sitokrom c diamati dengan
menggunakan spektroskopi UV-Vis dan voltametri siklik. Spektrum UV-Vis
memperlihatkan bahwa partikel zeolit NaY tidak merusak struktur dan
lingkungan enzim. Balal et al. (2009) menggunakan zeolit yang termodifikasi
FeCl3 sebagai mediator pada elektroda pasta karbon untuk menentukan dopamine
dan triptopan. Elektroda pasta karbon termodifikasi zeolit menghasilkan arus
yang lebih tinggi dibandingkan dengan yang hanya menggunakan FeCl3
Nanokomposit zeolit yang digunakan dalam penelitian ini berasal dari
daerah Bayah dan merupakan hasil penelitian yang telah dilakukan sebelumnya
(Iswantini 2010). Berdasarkan hasil analisis menggunakan XRD, zeolit Bayah
adalah jenis klinoptilolit [
sebagai
mediator.
2-(Al2Si1O)].
Nanokomposit zeolit dibuat dengan cara melarutkan zeolit dengan basa kuat pada
mengalami pengendapan kembali dalam bentuk material amorf. Perlakuan suhu
tinggi pada contoh tersebut akan membuat re-kristalisasi dari material amorf
untuk menjadi zeolit jenis lain yaitu NaP1 dengan sifat dan karakteristik kimia
yang berbeda dari zeolit modernite.
Kinetika Enzim
Sifat enzim terimobilisasi berbeda dari enzim bebas dikarenakan adanya
pengaruh dari material penyangga, matriks, perubahan konformasi enzim yang
berasal dari interaksi enzim dengan material penyangga dan modifikasi kovalen
dari residu asam amino. Perubahan konformasi pada struktur protein sekunder
dan tersier mungkin terjadi disebabkan modifikasi kovalen atau karena efek
elektrostatik, ikatan hidrogen, interaksi hidrofobik dengan material penyangga.
Sifat yang teramati selama imobilisasi enzim ialah aktivitas spesifik, pH
optimum, Konstanta Michaelis-Menten (Km), selektivitas, dan stabilitas..
Aktivitas spesifik dari enzim pada imobilisasi hampir menurun dan nilai laju
kecepatan maksimum substrat menjadi produk (Vmaks) menjadi turun sedangkan
Km
Aktivitas suatu enzim dapat dilihat dari parameter kinetika enzim yaitu
V
meningkat. Untuk itu diperlukan pengukuran kinetika enzim yang
terimobilisasi.
maks dan Km. Laju reaksi enzimatis akan berbanding lurus dengan konsentrasi
substart. akan tetapi setelah konsentrasi substrat meningkat lebih lanjut akan
sampai pada kecepatan yang tetap. Pada konsentrasi enzim tetap (tertentu) harga
V hampir linier dengan konsentrasi substrat. Pada kondisi di mana V tidak dapat
bertambah lagi dengan bertambahnya konsentrasi substrat disebut kecepatan
maksimum (Vmaks). Km merupakan konsentrasi substrat yang diperlukan oleh
suatu enzim untuk mencapai ½ Vmaks. Nilai Km menunjukkan ukuran afinitas
enzim-substrat (E-S), yang merupakan suatu indikator kekuatan ikatan kompleks
E-S atau suatu tetapan keseimbangan untuk disosiasi kompleks E-S menjadi E
dan S. Nilai Km kecil berarti kompleks E-S mantap, afinitas enzim tinggi
terhadap substrat, sedangkan bila Km besar afinitas enzim rendah terhadap
BAHAN DAN METODE
Bahan dan alat
Alat dan instrumen yang akan digunakan adalah eDAQ Potensiostat –
Galvanostat yang dilengkapi perangkat lunak Echem v2.1.0, laminar air flow,
inkubator, High Speed Refrigated Centrifuge KUBOTA 6500, Centrifuge 5415
R, autoklaf, Ultrasonic Homogenizer UH-150, DNA/Protein/Enzyme Analyzer
Biospec-1601 Shimadzu, Spektroscopy UV-Pharmaspec 1700 (Shidmazu, Kyoto,
Japan), pipet mikro, batang gelas, sel elektrokimia serta alat-alat gelas lainnya.
Bahan yang digunakan dalam penelitian ini adalah enzim SOD murni, sel bakteri
D. radiodurans, nanokomposit zeolit alam dari Bayah, DPPH dan vitamin C,
media untuk pertumbuhan bakteri D. radiodurans, grafit, ferosena, parafin cair,
dimetil sulfoksida (DMSO), larutan buffer fosfat, membran dialisis, xantina
oksidase, xantina, bufer larutan HCl 0.1 M dan kalium ferrisianida (K3Fe(CN)6.
Metode
Penelitian ini terdiri dari beberapa tahap percobaan yaitu: penumbuhan
sel Deinococus radiodurans dan ektraksi SOD, pembuatan elektroda, imobilisasi
enzim, optimasi aktivitas SOD dan bakteri terimobilisasi, penentuan parameter
kinetika pengukuran kapasitas antioksidan vitamin C dengan metode DPPH dan
biosensor. Bagan alir penelitian secara umum dilampirkan pada Lampiran 1.
Penumbuhan sel Deinococcus radiodurans dan ekstraksi enzim SOD
Deinococcus radiodurans ditumbuhkan pada media yang mengandung
tripton 1%, yeast extract 0,5%, glukosa 0,2%, NaCl 0,5% dan alkohol,
selanjutnya diinkubasi selama 48 jam pada 300C. Selanjutnya sel dipanen dengan sentrifugasi kecepatan 7000 x G, 40C selama 10 menit untuk memisahkan sel bakteri dengan media. Selanjutnya sel (pelet) dicuci beberapa kali dengan larutan
buffer posfat pH 7,0 dan disuspensikan kembali dalam larutan bufer fosfat pH
7,0. Suspensi sel di sonikasi dengan pulsa 50% dan output 5 untuk memecahkan
sel bakteri yaitu dengan interval 10 x 2 menit dan interval berhenti 1 menit.
disentrifugasi 10000 x G, 40C selama 30 menit untuk memisahkan supernatan dan pelet. Ekstrak kasar (crude extract) enzim berada disupernatan. Ekstrak
selanjutnya diukur nilai serapannya pada panjang gelombang 260 nm dan 280nm
untuk mengetahui konsentrasi protein dan perbandingan protein terhadap DNA.
Pembuatan elektroda
Pembuatan Elektroda Ag/AgCl
Elektroda yang akan dibuat adalah elektroda Ag/AgCl sebagai elektroda
rujukan, elektroda pasta karbon termodifikasi ferosena sebagai elektroda kerja.
Elektroda Ag/ AgCl dibuat dengan cara kawat perak dipotong sepanjang 4 cm
sebanyak 2 buah. Kawat perak ini ujungnya disambung dengan kawat tembaga
yang telah dibentuk sedemikian rupa. Larutan NaCl 3M disiapkan di dalam
beaker gelas sebanyak 50ml. Baterai 1,5V sebanyak 2 buah dirangkai seri
kemudian di sambung ujung-ujung kutubnya dengan kabel yang ujungnya telah
diberi penjepit buaya. Kawat perak dihubungkan pada masing-masing kutub
baterei kemudian dicelupkan ke dalam larutan NaCl 3M selama 1,5 menit. Kawat
diangkat dan dikeringkan. AgCl akan menempel pada kawat yang dihubungkan
pada kutub negatif baterai. Kawat Ag/AgCl akan berwarna hitam keabu-abuan.
Elekktroda Ag/AgCl dari hasil elektrolisis selanjutnya disambungkan dengan
kawat tembaga dan dimasukkan ke dalam badan elektroda yang terbuat dari kaca,
dimana terdapat selubung kuarsa pada ujungnya dan telah diisi larutan KCl
3M.
Pengukuran elektrokimia dilakukan dengan menggunakan alat
Potensiostat E-DAQ. Elektroda kerja yang digunakan adalah emas, elektroda
Ag/AgCl sebagai elektroda pembanding, dan platina sebagai elektroda bantu.
Karakterisasi elektroda Ag/AgCl dilakukan dengan mengukur Larutan 0.01M
K3[Fe(CN)6] dalam 0,1 M KCl alam sel elektrokimia. Ketiga elektroda dipasang
pada sel elektrokimia. Potensiostat dioperasikan dengan parameter voltametri
siklis (CV), pada potensial 0 mV sampai 800 mV, kecepatan sapuan 100
mV/detik, 10 kali perulangan. Voltamogram yang diperoleh menunjukkan
Pembuatan Elektroda Pasta Karbon
Metode yang digunakan untuk pembuatan elektroda pasta karbon
mengacu pada Trivadila (2011). Elektroda dibuat dengan cara melarutkan 3 mg
ferosena dalam 1 mL DMSO dan ke dalam larutan tersebut ditambahkan 100
mg grafit. Campuran didiamkan selama 2 jam. Setelah 2 jam pelarut dikeringkan
menggunakan pengering vakum, sehingga diperoleh grafit termodifikasi
mediator. Kemudian grafit dicampur dengan 35μL paraffin cair hingga membentuk pasta. Kemudian pasta karbon dimasukkan ke dalam badan
elektroda. Permukaan elektroda dihaluskan dan dibersihkan dengan amplas dan
kertas minyak.
Imobilisasi enzim
Matrik nanokomposit zeolit yang digunakan dibuat bervariasi 250 mg,
100mg, 50 mg, 25 mg disuspensikan kedalam larutan 5 ml bufer fosfat yang
mengandung ekstrak kasar enzim SOD, campuran selanjutnya didiamkan selama
24 jam dan diaduk secara konstan pada suhu 40C. Campuran selanjutnya disentrifugasi dan dipisahkan suspensinya. Pelet dicuci dengan NaCl 0,9%
beberapa kali dan disentrifugasi kembali. Pelet selanjutnya dikeringkan pada
suhu 40C. 5 mikroliter pelet enzim SOD yang telah di imobilisasi dalam matiks zeolit selanjutnya diteteskan pada permukaan elektroda, dilapisi dengan membran
dialisis, ditutup dengan jaring nilon dan diikat dengan parafilm. Imobilisasi ini
dilakukan juga terhadap enzim SOD murni dan sel bakteri Deinococcus
radiodurans.
Selain cara di atas juga dilakukan modifikasi imobilisasi SOD pada
permukaan elektroda zeolit dibuat dengan cara melarutkan 100 mg zeolit dengan
akuades sehingga membentuk pasta. Kemudian pasta karbon dimasukkan ke
dalam badan elektroda. Selain itu elektroda juga dibuat dengan menggunakan
zeolit yang terimobilisasi enzim, sebanyak 100 mg zeolit ditambahkan 5 unit
SOD dalam 5 ml larutan buffer posfat. Campuran didiamkan selama 24 jam dan
diaduk secara konstan pada suhu 40C. Campuran selanjutnya disentrifugasi dan dipisahkan suspensinya. Selanjutnya pelet yang dihasilkan dimasukkan kedalam
Pengukuran Elektrokimia
Pengukuran elektrokimia dilakukan dengan metode voltametri siklik
dengan menggunakan
Mode : Cyclic
eDAQ potensiostat–Galvanostat yang dilengkapi perangkat
lunak Echem v2.1.0. Elektroda yang digunakan adalah elektroda Ag/AgCl
sebagai elektroda rujukan, platina sebagai counter dan elektroda pasta karbon dan
zeolit sebagai elektroda kerja. Parameter pengukuran dibuat sebagai berikut
Initial : 0 mV
Radikal superoksida dihasilkan melalui reaksi enzimatis xantina-xantina
oksidase (XO).
xantina + H2O + O2 XOD Asam urat + 2H+ + O•−
Larutan bufer fosfat sebanyak 1.9 mL dan 100 μL larutan XO 0,1 U/mL ditambahkan kedalam sel pengukuran dan puncak arus anoda yang terbentuk
diamati sebagai blangko. Selanjutnya ditambahkan 1 mL larutan xantina 2,1 mM
dan diukur kembali perubahan atau kenaikkan puncak arus anoda yang terjadi.
Optimasi aktivitas SOD dan Bakteri terimobilisasi
Optimasi yang dilakukan adalah optimasi suhu (20-40 0C), pH(7-11), konsentrasi SOD dan konsentrasi zeolit (25-250mg). Metode yang digunakan
untuk pengoptimuman aktivitas SOD adalah Response Surface Method. Metode
ini dilakukan dengan cara memasukkan kombinasi faktor-faktor peubah bebas
pada perangkat lunak statistika Minitab. Selanjutnya percobaan dilakukan sesuai
dengan kombinasi yang dihasilkan untuk mendapatkan nilai aktivitas
optimumnya. Tabel 1 dan 2 menampilkan kombinasi faktor-faktor peubah bebas
untuk pengoptimuman aktivitas SOD D. radiodurans dan enzim SOD murni.
Sedangkan tabel 3 menampilkan kombinasi faktor-faktor peubah bebas untuk
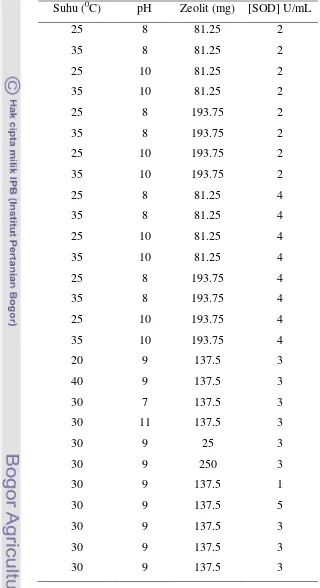
Tabel 1 Kombinasi pH, suhu, zeolit dan enzim SOD untuk pengoptimuman aktivitas SOD murni imobilisasi
Suhu (0C) pH Zeolit (mg) [SOD] U/mL
25 8 81.25 2
35 8 81.25 2
25 10 81.25 2
35 10 81.25 2
25 8 193.75 2
35 8 193.75 2
25 10 193.75 2
35 10 193.75 2
25 8 81.25 4
35 8 81.25 4
25 10 81.25 4
35 10 81.25 4
25 8 193.75 4
35 8 193.75 4
25 10 193.75 4
35 10 193.75 4
20 9 137.5 3
40 9 137.5 3
30 7 137.5 3
30 11 137.5 3
30 9 25 3
30 9 250 3
30 9 137.5 1
30 9 137.5 5
30 9 137.5 3
30 9 137.5 3
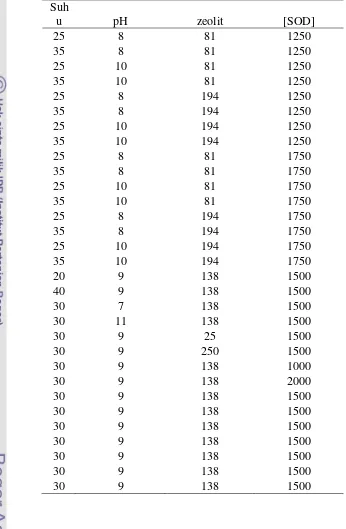
Tabel 2 Kombinasi pH, suhu, zeolit dan enzim SOD untuk pengoptimuman aktivitas SOD D. radiodurans imobilisasi
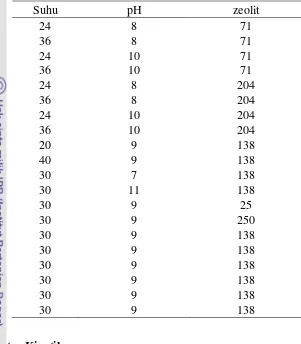
Tabel 3 Kombinasi pH, suhu dan zeolit untuk pengoptimuman aktivitas SOD D.
Penentuan parameter kinetika dilakukan setelah diperoleh kondisi
optimum aktivitas SOD. Parameter kinetika ekstrak enzim SOD D. radiodurans
yang diimobilisasi ditentukan dengan menggunakan persamaan Michaelis–
Menten:
(1)
dengan adalah respon arus maksimal yang terukur (apparent), adalah
konstanta Michaelis–Menten (apparent) dan [xantina] adalah konsentrasi xantina.
Persamaan Michaelis-Menten yang didapat dibuat turunannya, yaitu plot
Lineweaver-Burk. Prosedur pengukuran adalah sama, namun pada uji kinetika
ini, konsentrasi substrat radikal superoksida divariasikan, yaitu dengan
Pengukuran Kapasitas Antioksidan
Elektroda yang telah dimodifikasi dengan enzim SOD selanjutnya
digunakan untuk mengukur kapasitas antioksidan vitamin C. Pengukuran
dilakukan pada kondisi optimum. Elektroda ditempatkan dalam sel pengukuran
yang mengandung enzim 100 μL xantin oksidase 0,1 Unit/mL, kemudian 1 mL xantina
RAC = 1 – m
ditambahkan secara bertahap dan setiap penambahan diukur perubahan
arus yang dihasilkan, sehinggga akan diperoleh garis lurus dengan nilai
kemiringan tertentu. Selanjutnya pengukuran diulang dengan penambahan 0,5
mL vitamin C dengan variasi konsentrasi 0,005-0.05 M, akan diperoleh garis
lurus dan kemiringan yang baru. Konsentrasi Kapasitas antioksidan diukur dalam
relative antioxidant capacity (RAC):
c/mx
dengan m
(2)
x adalah slope garis lurus yang dihasilkan tanpa senyawa antioksidan
sedangkan mc
Pengukuran kapasitas antioksidan vitamin C juga dilakukan dengan
metode DPPH. Vitamin C dibuat dengan konsetrasi 1, 5, 10, 15 dan 20 ppm.
Sebanyak 2 mL DPPH 125 µM ditambahkan kedalam 2 mL masing-masing
sampel tersebut. Selanjutnya, dilakukan inkubasi selama 30 menit dalam suhu
ruang. Diukur pada panjang gelombang 517 nm. Hasil pembacaan absorbans
kemudian diplotkan terhadap konsentrasi dari kurva yang terbentuk dapat
dihitung IC
slope garis lurus yang dihasilkan dengan penambahan senyawa
antioksidan (Campanella et.al. 2005).
HASIL DAN PEMBAHASAN
Penumbuhan sel D. radiodurans dan Ekstraksi SOD
Bakteri D. radiodurans ditumbuhkan dalam media LB cair selama 48
jam dengan suhu 300
Rendemen yang dihasilkan lebih besar dibandingkan dengan hasil yang
didapatkan oleh Trivadila (2011) dimana rendemen yang didapatkan adalah
sebesar 0,07% dalam media yang sama. Tapi hasil yang didapat lebih kecil
dibandingkan dengan Mn-SOD yang dihasilkan dari udang Macrobrachium
nipponerse dimana ekstrak kasar yang dihasilkan adalah sebanyak 17100 mg
(Yao et al. 2004). Seatovics et al. (2004) mendapatkan ekstrak kasar Mn-SOD
dari bakteri Thermotherix sp sebanyak 53 mg/17,5 mL. Dalam penelitian ini
bakteri Thermotherix sp diisolasi dari pemandian air hangat di Serbia kemudian
dibiakkan dalam media nutrien broth (pepton 1,5%, meat extract 0,5%, NaCl 0,5
%, dan K
C. Setelah 48 jam bakteri dapat dipanen untuk mengambil
enzim SOD. Sel bakteri dipecah untuk mengekstrak protein sitoplasma yang
mengandung enzim SOD dengan menggunakan ultrasonic homogenizer. Protein
yang terkestrak memiliki konsentrasi sebesar 3100 µg/ml. Rendemen ekstrak
protein adalah 2,41% dari bobot basah (lampiran 2).
2HPO4 pH 7,2). Kecilnya rendemen ekstrak yang dihasilkan
dibandingkan dengan yang lain diduga karena D. radiodurans memiliki dinding
sel yang lebih tebal dibandingkan dengan bakteri yang lain, selain itu bentuknya
yang tetrad dan besar menyebabkan sulit untuk memecah dinding sel D.
radiodurans dan mengekstrak sitoplasmanya (Trivadila 2011).
Pembuatan Elektroda
Elektroda rujukan adalah elektroda yang diketahui kestabilannya dan
potensial setengah selnya, dan tidak sensitif terhadap analat yang diukur. Ada
beberapa elektroda yang biasa digunakan sebagi elektroda rujukan yaitu
Elektroda Hidrogen Standar (SHE), Elektroda Kalomel Jenuh (SCE), Elekroda
Merkuri/Merkuri Sulfat dan Elektroda Ag/AgCl. Elektroda Ag/AgCl adalah
elektroda yang terdiri dari logam perak yang dilapisi dengan perak klorida dalam
terhadap kawat perak (Ag) dalam larutan NaCl 3M (Hattu 2009). Reaksi
elektrokimia elektroda Ag/AgCl adalah sebagai berikut:
AgCl (s) + e- Ag(s) + Cl- ; E0
Pengukuran arus puncak K
= +0.222 V (3)
3
(4) [Fe(CN)6] dalam larutan elektrolit pendukung
KCl 0,1 M menggunakan teknik voltametrik siklik yang dicantumkan dalam
Lampiran 3 memperlihatkan bahwa arus puncak anodik pada potensial 315 dan
arus puncak katodik diperoleh pada potensial 249 mV untuk elektroda komersil
sedangkan untuk elektroda buatan adalah 320 dan 244 mV. Berdasarkan nilai
potensial puncak anodik dan katodik, jumlah elektron (n) yang terlibat dalam
reaksi dapat ditentukan dengan persamaan Nerst sebagai berikut:
dimana ΔEp = |Epa- Epa
Dari persamaan diatas maka jumlah elektron yang terlibat untuk elektroda
komersil adalah :
| (5)
(6)
Jumlah elektron yang terlibat untuk elektroda buatan sendiri adalah
(7)
n yang didapat adalah 1 hal ini sesuai dengan nilai n pada reaksi oksidasi reduksi
[Fe(CN)6]
3-Reaksi reduksi [Fe(CN)
yang hanya melibatkan satu elektron, seperti reaksi dibawah ini:
6]3- + e- [Fe(CN)6]
4-Reaksi Oksidasi [Fe(CN)
(8)
6]4- [Fe(CN)6]3- + e-
Berdasarkan perbandingan arus puncak anodik dan katodik yang
diperoleh maka dapat juga ditentukan elektron yang terlibat
(9)
(10)
Dari hasil perhitungan nilai n untuk elektroda komersial dan buatan berturut-turut
adalah 1.11 dan 1.27 ini mengidentifikasikan jika jumlah elektron yang terlibat bersesuain dengan nilai n pada oksidasi reduksi [Fe(CN)6]
3-Kualifikasi kinerja elektroda pembanding menggunakan sistem voltametri
elektrokimia untuk (Fe(CN)6]3-/[Fe(CN)6]
4-[Fe(CN)
yang sudah diketahui adalah sebagai
berikut:
6]3- + e- [Fe(CN)6]4- E0= 0,3610 Vvs E0ENH
Maka nilai E (11)
0’
(12) adalah
(13)
vs Ag/AgCl (14)
Jika [KCl]= 3M dan E0Ag/AgCl = 0,222 V vs E0ENH maka E0’ untuk [Fe(CN)6]
3-/[Fe(CN)6]4- adalah 0,5014 V vs E0ENH maka E0
(15) hasil percobaan adalah:
Dalam menentukan kekuatan ion, spesi yang memberikan sumbangan besar
adalah dan KCl. Sementara dianggap memberikan
sumbangan yang kecil, sehingga ≅ maka E0 ≅
(0,5014 V).
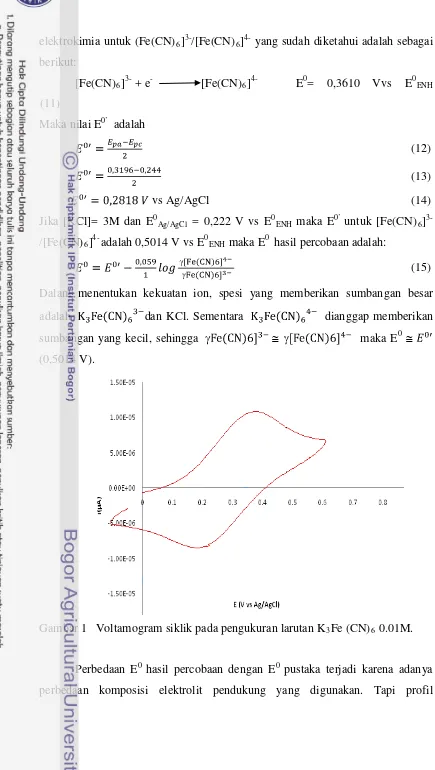
Gambar 1 Voltamogram siklik pada pengukuran larutan K3Fe (CN)6 0.01M.
voltamogram yang ditunjukkan oleh Gambar 1, (Fe(CN)6]3-/[Fe(CN)6]4- dalam
KCl 0,1 M) menunjukkan hasil yang didapatkan tidak berbeda jauh dengan yang
dihasilkan oleh Hattu (2009) dimana elektron yang terlibat adalah 0,9187 dan ∆Ep sebesar 59 mV dengan sistem Fe(CN)6]3-/[Fe(CN)6]4- dalam NaClO4 0,1 M.
Perbedaan yang dihasilkan kemungkinan disebabkan oleh adanya perbedaan
komposisi elektrolit pendukung yang digunakan. Selain itu, hasil yang didapatkan
juga tidak jauh berbeda dibandingkan dengan elektroda pembanding komersil
dimana n yang terlibat 1,11 dan ∆E p sebesar 66 mV. Jumlah elektron yang
terlibat dalam penelitian ini adalah 1,27 ∆E p sebesar 75,6 mV berdasarkan hasil
yang diperoleh maka dapat dikatakan bahwa elektroda yang dibuat memiliki
kriteria yang baik dan dapat digunakan untuk pengukuran selanjutnya.
Imobilisasi Enzim
Enzim memiliki selektivitas dan sensitivitas yang tinggi jika dalam
kondisi normal, tapi sangat sensitive terdenaturasi oleh pH dan suhu yang
ekstrem, pelarut organik dan deterjen (Takahashi et al. 2001). Untuk menjaga
fungsi katalitik enzim pada kondisi ekstrem maka dilakukan imobilisasi pada
permukaan material penyangga padat seperti nanokomposit zeolit.
Selektivitas dan stabilitas suatu enzim terimobilisasi selain dipengaruhi
oleh substrat juga dipengaruhi oleh metode immbolisasi dan material penyangga
yang digunakan (Zhao et al. 2008). Oleh karena itu perlu dilakukan pemilihan
metode imobilisasi yang tepat agar menghasilkan respon arus yang tinggi.
Modifikasi metode imobilisasi yang dilakukan terdiri dari 4 jenis. yaitu SOD di
imobilisasi dengan zeolit, kemudian diteteskan pada permukaan pasta karbon
termodifikasi ferosena (SOD/Zeolit/PCf), SOD di imobilisasi pada permukaan
pasta karbon termodifikasi ferosena (SOD/PCf), zeolit di imobilisasi pada
permukaan pasta karbon termodifikasi ferosena (Zeolit/PCf) dan terakhir SOD di
imobilisasi pada permukaan zeolit (SOD/Zeolit). Tabel 4 menunjukkan puncak
arus dan potensial dari 4 modifikasi metode imobilisasi. Tabel 4 memperlihatkan
bahwa SOD/Zeolit/PCf memiliki puncak arus anodik yang lebih tinggi
dibandingkan dengan SOD/PCf, Zeolit/PCf dan SOD/Zeolit, dengan nilai
-4,00E-06
-4,00E-01-2,00E-010,00E+00 2,00E-01 4,00E-01 6,00E-01 8,00E-01 1,00E+00
I(
A)
E (V) vs Ag/AgCl
SZPf SPf SZ
Tabel 4 Puncak arus dan potensial modifikasi metode imobilisasi
Modifikasi Arus Puncak I(μA) E (mV) Vs Ag/AgCl) (mV)
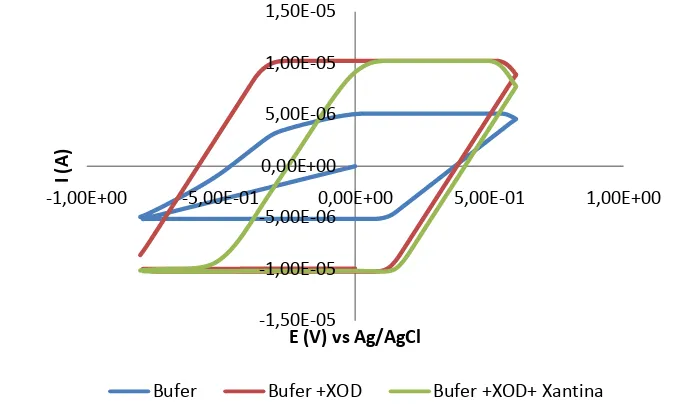
Gambar 2 menampilkan voltamogram siklik SOD/Zeolit/PCf, SOD/PCf
dan SOD/Zeolit. Voltamogram siklik tersebut memperlihatkan puncak anode dan
katode yang terbentuk karena proses reaksi oksidasi. Puncak anode yang
dihasilkan untuk SOD/Zeolit/PCf pada potensial +426 mV dengan arus 1,02 mA
dan puncak katode pada potensial +290 mV dengan besar arus 1,71 mA. Arus
yang dihasilkan lebih tinggi dibandingkan dengan SOD/PCf dimana potensial
anodik dan katodik berturut-turut adalah +465 dan +330V dengan puncak arus
0.054 dan 0.01mA. Sedangkan nilai untuk SOD/Zeolit lebih rendah dari
keduanya. Nilai puncak arus anodik dan katodik SOD/Zeolit adalah 0,0012 dan
0,00 mA dengan potensial anodik -100 mV dan katodik 115 mV.
pasta karbon termodifikasi ferosena (SOD/PCf), dan SOD di imobilisasi pada permukaan zeolit (SOD/Zeolit)
Gambar 3 Puncak arus anode dan katode SOD zeolit di imobilisasi pada permukaan pasta karbon termodifikasi ferosena (ZPf)
Gambar 3 memperlihatkan modifikasi imobilisasi SOD dalam
permukaan zeolit tanpa menggunakan pasta karbon termodifikasi ferosena
menghasilkan voltamogram yang tidak simetrik sehingga sulit menentukan
puncak arus anodik dan katodiknya. Dari data Puncak arus dan potensial
modifikasi metode imobilisasi dan voltamogram siklik yang dihasilkan maka
dapat disimpulkan SOD di imobilisasi dengan zeolit, kemudian diteteskan pada
permukaan pasta karbon termodifikasi ferosena (SOD/Zeolit/PCf) lebih baik
dibandingakan dengan yang lain.
Puncak anodik dan katodik SOD/Zeolit/PCf yang lebih tinggi
dibandingkan dengan yang lain, menunjukkan bahwa terjadi proses transfer
elektron dari reaksi enzimatis dismutase superoksida oleh SOD dalam
nanokomposit zeolit permukaan elektroda pasta karbon termodifikasi ferosena
(Gambar 4).
Kemampuan zeolit untuk meningkatkan puncak arus yang dihasilkan
telah diperlihatkan oleh penelitian yang dilakukan oleh Dai et al. (2004) di mana
enzim yang digunakan adalah sitokrom c dan NaY zeolit yang digunakan untuk
mendeteksi H2O2. Penggunaan Fe (III) yang ditambahkan ke dalam zeolit
-1,50E-05
sebagai mediator pada pasta karbon dapat meningkatkan puncak oksidasi dan
reduksi untuk mendeteksi dopamin dan triptopan (Balal et al. 2009).
Gambar 4 Proses transfer dari reaksi enzimatis SOD terimobilisasi dalam nankomposit zeolit kepermukaan elektroda pasta karbon yang dimediasi oleh ferosena
Elektroda pasta karbon telah digunakan secara luas untuk biosensor,
karena beberapa keunggulan yang dimilikinya seperti memungkinkan untuk
mengimobilisasi berbagai jenis substansi (enzim, ligan, mediator redoks, dan
jaringan biologi), dapat diaplikasikan dengan rentang potensial yang lebar,
mudah dimodifikasi, aman, dan murah (Luo et al. 2006). Pasta karbon
termodifikasi zeolit menghasilkan arus yang lebih tinggi dibandingkan dengan
menggunakan elektroda glassy carbon electrode (GCE) termodifikasi
mikroperoksidase-11 (MP-11) dalam nanokomposit 1-oktil-3-metillimidazolium
hexafluorophosphate (OMIMPF6) yang digunakan untuk mendeteksi H2O2 di
mana puncak arus oksidasi yang dihasilkan adalah 0,1 mA pada potensial -0.260
and -0.235 V (Wan et al. 2009). Puncak arus juga menunjukkan hasil yang
lebih besar dibandingkan dengan SOD terimobilisasi langsung pada elektroda
emas dengan perbandingan arus puncak katodik dan anodik adalah 0,7 (Ipc/Ipa =
0.7 pada 100mV) dengan beda potensial antara katodik dan anodik adalah 0.15 V
(Ep = Epa − Epc = 0.15V) (Di at al. 2004). Arus yang dihasilkan juga lebih tinggi dibandingkan dengan penelitian yang dilakukan oleh Trivadila (2011),
SOD terimobilisasi pada elektroda pasta karbon tanpa zeolit menghasilkan
Kemampuan zeolit dalam meningkatkan puncak arus ini bisa disebabkan
karena sifatnya yang hidrofilik karena adanya gugus –OH disekitar pori sehingga
sangat cocok untuk imobilisasi enzim (Valdes et al. 2006). Selain itu, karena
karakteristiknya yang unik diantaranya stabil pada temperatur tinggi, tahan
terhadap pelarut organik dan sifatnya yang keras sehingga lebih stabil terhadap
tekanan mekanik yang tinggi akan menyebabkan enzim yang terjerab akan lebih
stabil. Sedangkan rangka dan pori dari struktur zeolit yang seragam menyebabkan
selektivitas dan reprodusibilitasnya yang dihasilkan tinggi (Valdes et al. 2006).
Disamping itu, zeolit selain dapat digunakan sebagai material penyangga,
keunikan yang dimiiliki zeolit adalah memiliki kemampuan katalitik yang dapat
membantu mempercepat reaksi (Dai et al. 2004).
Optimasi aktivitas SOD terimobilisasi
Pengoptimuman Aktivitas SOD murni
Parameter–paramater yang dioptimumkan pada aktivitas SOD D.
radiodurans dilakukan dengan menggunakan rancangan percobaan metode
permukaan respon seperti terlihat dalam Lampiran 4. Parameter-parameter yang
dioptimumkan adalah pH (7-11), suhu (20-400C), massa zeolit (25-250mg) dan konsentrasi SOD (1-5 unit/ml).
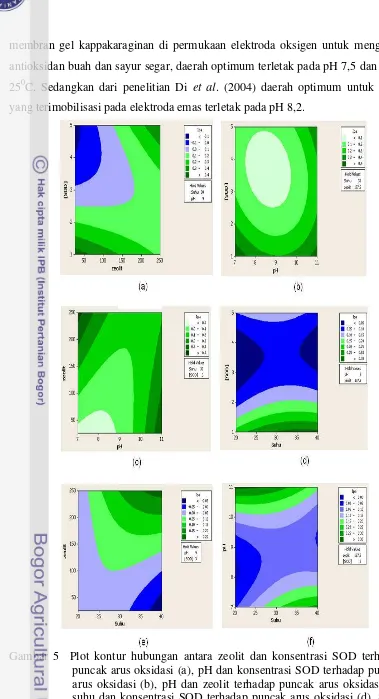
Gambar 5 memperlihatkan plot kontur hubungan antara zeolit dan
konsentrasi SOD terhadap puncak arus oksidasi (a), pH dan konsentrasi SOD
terhadap puncak arus oksidasi (b), pH dan zeolit terhadap puncak arus oksidasi
(c), suhu dan konsentrasi SOD terhadap puncak arus oksidasi (d), suhu dan zeolit
terhadap puncak arus oksidasi (e), suhu dan pH terhadap puncak arus oksidasi (f).
Berdasarkan hasil pengoptimuman ini, maka kondisi optimum bagi aktivitas SOD
murni adalah pada pH 9, suhu 300C, zeolit 137,5 mg dan konsentrasi SOD 3 unit/ml.
Hasil ini sedikit berbeda dengan hasil yang telah dilakukan oleh
peneliti-peneliti sebelumnya. Trivadila (2011) mengimobilisasi enzim SOD pada
elektroda pasta karbon dengan mediator ferosen, aktivitas optimum SOD pada
membran gel kappakaraginan di permukaan elektroda oksigen untuk mengukur
antioksidan buah dan sayur segar, daerah optimum terletak pada pH 7,5 dan suhu
250C. Sedangkan dari penelitian Di et al. (2004) daerah optimum untuk SOD yang terimobilisasi pada elektroda emas terletak pada pH 8,2.
dan zeolit terhadap puncak arus oksidasi (e), suhu dan pH terhadap puncak arus oksidasi (f) aktivitas enzim murni.
Dari hasil ini dapat disimpulkan bahwa puncak arus optimum yang
dihasilkan sangat dipengaruhi oleh proses imobilisasi yang dilakukan.
Parameter-parameter yang sangat berpengaruh adalah pH dan suhu. Pergeseran
pH terjadi karena enzim diimobilisasi pada matrik yang memiliki perbedaan
muatan, sedangkan pergeseran suhu disebabkan oleh ketidakhomogenan karena
imobilisasi enzim (Trivadila 2011).
Pengoptimuman Aktivitas Ekstrak SOD dan Bakteri D. radiodurans
Parameter-parameter yang dioptimumkan pada ekstrak SOD dari D.
radiodurans sama dengan optimasi yang dilakukan pada enzim murni tapi
berbeda konsentrasi SOD (1000-2000µg/ml) (Lampiran 5). Gambar 12
menampilkan plot kontur hubungan antara pH dan konsentrasi SOD terhadap
puncak arus oksidasi (a), pH dan zeolit terhadap puncak arus oksidasi (b), suhu
dan konsentrasi SOD terhadap puncak arus oksidasi (c), suhu dan zeolit terhadap
puncak arus oksidasi (d), Suhu dan pH terhadap puncak arus oksidasi (e), zeolit
dan konsentrasi SOD terhadap puncak arus oksidasi (f).
Dari plot kontur kita dapat melihat bahwa daerah optimum dari SOD D.
radiodurans tidak berbeda dengan daerah optimum dari enzim SOD murni yaitu
pH 9, suhu 300C, zeolit 137,5 mg. Disini yang berbeda adalah konsentrasi SOD yaitu 1500µg/ml, hal ini disebabkan karena ekstrak enzim SOD masih memiliki
jenis protein lain selain protein enzim SOD. Hasil ini hampir sama dengan
penelitian yang telah dilakukan oleh Trivadila (2011), dimana daerah optimum
ekstrak enzim SOD adalah pH 9, suhu 27,50C.
Kondisi optimum pH, suhu dan jumlah zeolit antara SOD murni dan
ekstrak adalah sama, sedangkan jumlah enzim yang berbeda, hal ini disebabkan
karena kemurnian ekstrak SOD masih sangat rendah, masih terdapat protein lain
selain protein SOD. Penelitian Trivadila (2011) menghasilkan kondisi optimum
yang berbeda antara SOD murni dan ekstrak. Aktivitas optimum SOD pada suhu
kekuatan ionik dan nilai pI bersihnya, sehingga menggeser nilai pH optimumnya.
Sehingga dapat diambil kesimpulan bahwa dengan adanya zeolit, keberadaan
protein-protein lain dalam ekstrak diduga tidak mempengaruhi kekuatan ionik
dan nilai pI bersihnya sehingga tidak menggeser nilai pH optimumnya. pH
optimum yang didapatkan bersesuain dengan kondisi pH optimum untuk
Cu/Zn-SOD berkisar 5-10 sedangkan untuk Mn-Cu/Zn-SOD pH diatas 8 akan menurunkan
aktivitasnya (Donnely et al. 1989).
Gambar 6 Plot kontur hubungan antara pH dan konsentrasi SOD terhadap puncak arus oksidasi (a), pH dan zeolit terhadap puncak arus oksidasi (b), suhu dan konsentrasi SOD terhadap puncak arus oksidasi (c), suhu dan zeolit terhadap puncak arus oksidasi (d), Suhu dan pH terhadap puncak arus oksidasi (e), zeolit dan konsentrasi SOD terhadap puncak arus oksidasi (f) aktivitas ekstrak SOD D.radiodurans.
Pengoptimuman Aktivitas Bakteri D. radiodurans
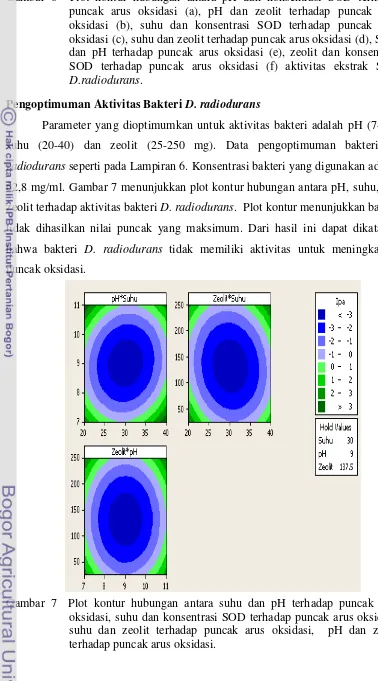
Parameter yang dioptimumkan untuk aktivitas bakteri adalah pH (7-11),
suhu (20-40) dan zeolit (25-250 mg). Data pengoptimuman bakteri D.
radiodurans seperti pada Lampiran 6. Konsentrasi bakteri yang digunakan adalah
62,8 mg/ml. Gambar 7 menunjukkan plot kontur hubungan antara pH, suhu, dan
zeolit terhadap aktivitas bakteri D. radiodurans. Plot kontur menunjukkan bahwa
tidak dihasilkan nilai puncak yang maksimum. Dari hasil ini dapat dikatakan
bahwa bakteri D. radiodurans tidak memiliki aktivitas untuk meningkatkan
puncak oksidasi.
0
SOD Murni (µA) Ekstrak SOD (µA)
Deinococcus radiodurans merupakan bakteri Gram positif dengan
diameter 1,5-
berkembang dan tidak menimbulkan penyakit. Koloninya halus, cembung, dan
berwarna pink kemerahan. Superoksida dismutase merupakan antioksidan
enzimatik intrasel atau juga dikenal dengan istilah antioksidan endogen (Sunarno
2009). Karena D. radiodurans memiliki dinding sel yang tebal dan juga
strukturnya yang tetrad kemungkinan ekskresi SOD tidak terjadi, karena tidak
adanya SOD yang bereaksi dengan radikal superoksida tidak ada transfer elekron
yang terjadi oleh sebab itulah arus tidak dihasilkan. Sehingga dapat disimpulan
sel bakteri D. radiodurans utuh sebagai komponen pengenal hayati biosensor
antioksidan kurang berpotensi.
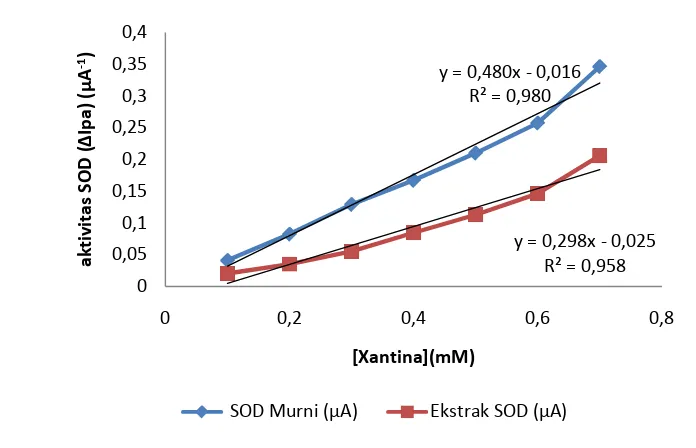
Kinetika Enzim Superoksida Dismutase Imobilisasi
Untuk melihat kespesifikan suatu enzim maka dilakukan penentuan
parameter kinetika enzim yaitu konstanta Michaelis-Menten nyata (KMapp) dan
laju reaksi nyata (Vmaks app) yang dianalogikan dengan arus maksimum nyata
(Imaks app). Parameter kinetika enzim ini dilakukan pengukuran aktivitas SOD
dengan variasi konsentrasi substrat xanitna 0,1-1,00 mM pada kondisi optimum
masing-masing enzim. Data pengukuran aktivitas enzim SOD terlihat pada
Lampiran 7. Gambar 8 dan 9 menunjukkan hubungan antara konsentrasi substrat