AKTIVITAS ANTIOKSIDAN DAN PENGHAMBATAN
α
-GLUKOSIDASE EKSTRAK DAN NANOPARTIKEL
EKSTRAK KULIT KAYU MAHONI
(
Swietenia macrophylla
King)
AN-NISA ROSIYANA
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
King). Dibimbing oleh SYAMSUL FALAH dan DIMAS ANDRIANTO.
Kulit kayu mahoni (Swietenia macrophylla King) merupakan salah satu
limbah industri pengolahan kayu. Kulit kayu mahoni memiliki kandungan
senyawa katekin, epikatekin, dan swietemakrofilanin yang memiliki aktivitas
antioksidan dan antidiabetes pada tikus yang diinduksi aloksan. Penelitian ini
bertujuan menentukan aktivitas antioksidan dan penghambatan
α
-glukosidase
pada sampel ekstrak dan nanopartikel ekstrak kulit kayu mahoni. Metode ekstraksi
dengan menggunakan akuades sebagai pelarut, pengujian aktivitas antioksidan
menggunakan metode 2,2-difenil-1
–
pikrilhidrazil (DPPH) dan daya reduksi.
Pengujian penghambatan
α
-glukosidase diukur dengan metode spektrofotometer.
Kadar air kulit kayu mahoni yang diuji adalah 4.87%. Rendemen ekstrak 9.462%
dan nanopartikel 51.11%. Hasil uji antioksidan terhadap senyawa rutin, ekstrak,
dan nanopartikel dengan metode DPPH didapatkan IC
50secara berurutan 17.33 ±
1.17 ppm, 9.62 ± 0.72 ppm, dan lebih dari 2500 ppm. Daya reduksi senyawa rutin
tertinggi sebesar 67.03% pada 25 ppm, ekstrak tertinggi sebesar 67.41% pada 20
ppm, dan nanopartikel 31.47% pada 20 ppm. Nilai IC
50dari penghambatan
α
-glukosidase ekstrak 17.25 ppm, nanopartikel lebih dari 200 ppm, dan akarbosa
0.37 ppm. Hasil uji menunjukan bahwa ekstrak mampu berperan sebagai
antioksidan dan antidiabetes berdasarkan nilai IC
50. Sementara untuk nanopartikel
ekstrak kulit kayu mahoni belum mampu untuk berperan sebagai antioksidan
berdasarkan metode DPPH dan daya reduksi, dan antidiabetes.
ABSTRACT
AN-NISA ROSIYANA. Activity Antioxidants and Inhibition of
α
-Glucosidase
Extract and Nanoparticles Extract Mahogany (Swietenia macrophylla King) Bark.
Supervised by SYAMSUL FALAH and DIMAS ANDRIANTO.
Mahogany (Swietenia macrophylla King) bark is waste disposal industry
manufacture of bark. Mahogany bark have catechin, epicatechin, and
swietemacrophyllanin contents which useful as an antioxidants and antidiabetic of
rats induced alloxan. This study aimed to determine the antioxidant activity and
inhibition of α
-glucosidase in the extract and nanoparticle extract of mahogany
bark. Extraction method use aquades as solution, antioxidant activity assays was
caried using 2,2-diphenyl-1-picrilhidrazyl (DPPH) and reducing power. Inhbition
of
α
-glucosidase was measured with a spectrophotometric method. Mahogany
moisture content was 4.87%. Extract yield of 9.46% and yield of nanoparticle
51.11% were obtained. The DPPH resulted that of the rutin compound, extract,
and nanoparticles obtained by IC
50DPPH method sequentially 17.33 ± 1.17 ppm,
9.62 ± 0.72 ppm, and more than 2500 ppm. Respectively, power reduction of the
rutin compound has a 67.03% at 25 ppm, the extract 67.41% at 20 ppm, and
nanoparticle 31.47% at 20 ppm. IC
50values inhibition of
α
-glucosidase extract
was 17.25 ppm, nanoparticles were more than 200 ppm, and acarbose was 0.37
ppm. The test results showed that the extract capable of acting as antioxidant and
antidiabetic based on IC
50values. As for nanoparticles mahogany bark extract did
not able to act as antioxidants and antidiabetics based on the method tested.
(
Swietenia macrophylla
King)
AN-NISA ROSIYANA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Aktivitas Antioksidan dan Penghambatan
α
-Glukosidase
Ekstrak dan Nanopartikel Ekstrak Kulit Kayu Mahoni
(Swietenia macrophylla King)
Nama
: An-Nisa Rosiyana
NIM
: G84080038
Disetujui
Komisi Pembimbing
Dr. Syamsul Falah, S.Hut, M.Si
Ketua
Dimas Andrianto, S.Si, M.Si
Anggota
Diketahui
Dr. Ir. I Made Artika, M.App.Sc
Ketua Departemen Biokimia
Penghambatan
α
-Glukosidase Ekstrak dan Nanopartikel Ekstrak Kulit Kayu
Mahoni (Swietenia macrophylla
King)” sehingga bisa selesai tepat waktu.
Penelitian ini berlangsung selama enam bulan mulai bulan Maret
–
Agustus 2012.
Tempat pelaksanaan penelitian ini di Laboratorium Penelitian Biokimia dan
Laboratorium Pusat Studi Biofarmaka Institut Pertanian Bogor (LPSB-IPB).
Penulis mengucapkan terima kasih kepada Dr. Syamsul Falah, S.Hut. M.Si
dan Dimas Andrianto, S.Si. M.Si selaku pembimbing, atas bimbingan dan arahan
yang diberikan dalam pengusulan penelitian ini. Penulis juga mengucapkan terima
kepada staf Laboratorium Biokimia atas bantuan serta kemudahan dalam
menjalankan penelitian ini. Selain itu, penulis mengucapkan terima kasih kepada
kedua orang tua dan keluarga besar Sittunnisa atas dukungannya. Ucapan terima
kasih penulis sampaikan kepada Lusianawati, Dita Meisyara, Satriaji Hartamto,
Yuanita, Nina Bin Hatim, Rian Triana, Annisa Utami, Nur
’
aeni, Banda Gunarsa,
M. Iqbal Syukri, M.Faris Fathin, Egi Mariah Nurpagi, Didit Haryadi, Reza Wisnu
Kusuma, Dyah Kenyar, Rahmi Maydina, NLP Eka Kartika, Gita Wahyu
Arifiyanti, Yuliana, Derry Riskawati, Fitria Shofi Utami, Tri Novita Sari, dan
Raizumi Fil
’
aini atas dukungan morilnya. Penulis berharap semoga penelitian ini
bisa bermanfaat, baik bagi penulis pribadi maupun pembaca.
Bogor, Nopember 2012
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 04 Mei 1990 di Tasikmalaya, Jawa Barat
dari ayahanda Udin Samsudin dan Ibunda Yati Suryati. Penulis merupakan anak
ketiga dari enam bersaudara. Penulis menempuh pendidikan di Tasikmalaya, SDN
Sukamulya lulus tahun 2002, MTs Cempakawarna lulus tahun 2005, SMA Negeri
9 Tasikmalaya lulus tahun 2008, dan diterima di Institut Pertanian Bogor melalui
Undangan Seleksi Masuk IPB (USMI) pada tahun 2008. Penulis tercatat sebagai
mahasiswa Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan
Alam.
Selama mengikuti perkuliahan penulis aktif di beberapa organisasi dan
kegiatan kampus. Pengurus sempat aktif dalam kepengurusan Himpunan
Mahasiswa Tasikmalaya (HIMALAYA). Penulis juga aktif di organisasi Dewan
Perwakilan Mahasiswa FMIPA (DPM FMIPA) tahun 2009-2010 sebagai anggota
komisi 3, Majelis Perwakilan Mahasiswa Keluarga Mahasiswa IPB (MPM KM
IPB) tahun 2009-2010 sebagai bendahara BP PEMIRA, anggota FIKSI IPB pada
tahun 2010, dan Dewan Perwakilan Mahasiswa FMIPA (DPM FMIPA) tahun
2010-2011 sebagai bendahara umum. Selain aktif berorganisasi, penulis juga
bergabung dengan beberapa kepanitiaan di IPB, diantaranya LKIP ” Lomba Karya
Ilmiah Populer” (2009), PEMIRA Crebs (2009), Lokakarya KM IPB (2010), dan
Sidang Umum Keluarga Mahasiswa IPB (2010). Penulis juga tercatat sebagai
penerima beasiswa Yayasan Toyota dan Astra tahun 2011-2012. Selain itu,
penulis pernah menjadi peserta Latihan Kepemimpinan dan Manajemen
Mahasiswa 2011 yang diadakan oleh Direktorat Kemahasiswaan IPB.
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... x
PENDAHULUAN ... 1
TINJAUAN PUSTAKA
Mahoni ... 2
Nanopartikel ... 3
Kitosan ... 3
Antioksidan ... 4
Diabetes Mellitus ... 5
α
- Glukosidase ... 5
BAHAN DAN METODE
Bahan dan Alat ... 6
Metode ... 7
HASIL DAN PEMBAHASAN
Kadar air dan Rendemen Ekstrak ... 8
Nanopartikel Ekstrak Kulit Kayu Mahoni... 9
Aktivitas Antioksidan dengan Metode DPPH ... 9
Aktivitas Antioksidan dengan Metode Daya Reduksi ... 10
Penghambatan Enzim α
-Glukosidase ... 11
SIMPULAN DAN SARAN
Simpulan ... 12
Saran ... 12
DAFTAR PUSTAKA ... 12
DAFTAR TABEL
Halaman
1 Nilai IC
50rata-rata seluruh sampel ... 10
2
Penghambatan enzim α
-glukosidase ... 11
DAFTAR GAMBAR
Halaman
1 Mahoni (Swietenia macrophylla King.) ... 2
2 Hidrolisis pNP
G oleh enzim α–
glukosidase ... 6
3 Struktur akarbosa ... 6
4 Ekstrak kulit kayu mahoni ... 9
5 Nanopartikel ekstrak kulit kayu mahoni ... 9
DAFTAR LAMPIRAN
Halaman
1 Alur penelitian ... 18
2 Kadar air simplisia kulit kayu mahoni ... 19
3 Rendemen ekstrak ... 19
4 Rendemen nanopartikel ekstrak kulit kayu mahoni ... 19
5 Data absorbansi uji aktivitas antioksidan dengan metode DPPH ... 20
6 Hubungan antara % penghambatan antioksidan dan konsentrasi ... 21
7 Uji aktivitas antioksidan dengan metode daya reduksi ... 23
8
Penghambatan enzim α
- glukosidase dengan ekstrak kulit kayu mahoni ... 24
9 Aktivitas penghambatan ekstrak kulit kayu mahoni terhadap
α
-glukosidase ... 25
10
Penghambatan enzim α
-glukosidase dengan nanopartikel ekstrak kulit kayu
mahoni ... 26
11 Aktivitas penghambatan nanopartikel ekstrak kulit kayu mahoni terhadap
α
-glukosidase ... 27
12
Penghambatan enzim α
- glukosidase dengan akarbosa ... 28
13
Aktivitas penghambatan akarbosa terhadap α
-glukosidase ... 29
14 Nilai IC50 antidiabetes ... 29
PENDAHULUAN
Diabetes melitus (DM) merupakan suatu penyakit kronis akibat adanya kekacauan
dalam sistem metabolisme yang
dikarakterisasi karena bawaan (DM tipe 1) atau yang diperoleh dari ketidakmampuan untuk mentransfer glukosa kedalam sel aliran darah (DM tipe 2) (Puteri & Kawabata 2010). Kondisi ini terjadi dengan adanya peningkatan
glukosa dalam darah (hiperglikemia).
Penyakit diabetes melitus merupakan empat besar penyakit penyebab kematian terbanyak setelah kanker, jantung, dan paru-paru di Indonesia. Sebanyak 25.8 juta orang di Amerika Serikat terkena diabetes dan terdiagnosis sekitar 18.8 juta orang. Sisanya yang tidak terdiagnosis sebanyak 7 juta orang
(CDC 2011). Menurut data dari World Health
Organization (WHO) sekitar 346 juta penduduk dunia terkena diabetes pada tahun 2010 dan 21.3 juta orang merupakan penderita dari Indonesia. Sebanyak 80% kasus kematian diabetes terjadi di negara miskin dan berkembang (WHO 2010).
Secara klinis, diabetes mellitus dibagi menjadi dua tipe yaitu diabetes tipe 1 atau insulin-dependent diabetes mellitus (IDDM), dan diabetes tipe 2 atau non-insulin-dependent diabetes mellitus (NIDDM) juga disebut sebagai diabetes resistensi insulin. Diabetes tipe 1 merupakan diabetes yang disebabkan oleh defisiensi insulin dan ketidakmampuan sel β- pankreas memproduksi insulin. IDDM membutuhkan terapi insulin secara rutin. Diabetes tipe 2 terjadi karena rusaknya sistem pengaturan aktivitas insulin. Insulin mampu untuk diproduksi tetapi ada kerusakan pada sistem respon insulinnya sehingga terjadi resistensi insulin (Nelson & Michael 2004).
Diabetes melitus terjadi karena tingginya konsentrasi glukosa dalam darah. Glukosa dapat teroksidasi sebelum berikatan dengan protein dan juga setelah berikatan dengan
protein (glycated protein) menghasilkan
reactive oxygen species (ROS) (Widowati
2008). Pembentukan ROS ini akan
menurunkan pembentukan antioksidan
gluthatione (GSH) yang merupakan antioksidan enzimatis yang dihasilkan tubuh
(Halliwel et al. 1999). Antioksidan ini
berfungsi sebagai senyawa yang mampu menghambat reaksi oksidasi dengan mengikat radikal bebas dan molekul reaktif sehingga mampu mencegah kerusakan sel (Winarsi 2007).
Senyawa antioksidan memiliki potensi sebagai antidiabetes yang mampu mencegah
terjadinya oksidasi glukosa dalam darah, sehingga banyak inovasi untuk pengembangan antioksidan yang juga sekaligus sebagai
penghambat α-glukosidase. Pengembangan
inovasi ini berkembang ke penggunaan tanaman herbal. Salah satu tanaman herbal yang berpotensi sebagai antioksidan dan penghambat α-glukosidase adalah kulit kayu mahoni.
Kulit kayu mahoni mengandung senyawa kimia seperti katekin, epikatekin, dan swietermakrofilanin yang berperan sebagai antioksidan (Falah et al. 2008). Kandungan senyawa antioksidan yang tinggi bisa mencegah terjadinya oksidasi yang terjadi dalam tubuh. Ekstrak air kulit kayu mahoni memiliki aktivitas antioksidan yang tinggi (Maydina 2012).
Tingginya kemampuan ekstrak sebagai antioksidan sehingga dilakukan modifikasi teknologi. Salah satu modifikasi teknologi dengan membuat ukuran ekstrak menjadi lebih kecil yaitu dalam bentuk nanopartikel. Pembuatan nanopartikel dapat dilakukan
dengan penyalut. Nanopartikel dengan
penyalut dapat melindungi nutrien dari sistem pencernaan dan dari kemungkinan terbuang tanpa proses penyerapan (Winarno & Fernandez 2010). Penyalut yang digunakan adalah kitosan. Kitosan memiliki kemampuan antibakteri (Maiti et al. 2007) sehingga ekstrak yang disalut dapat dilindungi. Ukuran nanopartikel mampu untuk menghantar pada sel target. Pengurangan atau pengecilan ukuran partikel akan meningkatkan luas permukaaan yang menyebabkan kelarutan tinggi.
Berdasarkan penelitian sebelumnya
pengujian antioksidan nanopartikel kulit kayu mahoni dan nanokitosan memiliki aktivitas antioksidan yang rendah. Nanopartikel kulit kayu mahoni memiliki IC50 lebih dari 100
ppm (Maydina 2012). Pengujian pada nanopartikel ini dilakukan kembali dengan menggunakan metode pembuatan nanopartikel yang berbeda dan pengujian antioksidan metode daya reduksi. Selain itu, untuk uji antidiabetes in vitro belum dilakukan pada penelitian sebelumnya.
Penelitian ini bertujuan menentukan potensi ekstrak dan nanopartikel ekstrak kulit kayu mahoni sebagai antioksidan dan
penghambatan α-glukosidase. Hipotesis
penelitian ekstrak dan nanopartikel ekstrak
kulit kayu mahoni memiliki potensi
antioksidan serta menghambat α-glukosidase.
ekstrak sebagai antioksidan dan antidiabetes, serta memberikan inovasi teknologi berupa nanopartikel ekstrak kulit kayu mahoni sebagai antioksidan dan antidiabetes, serta pemanfaatan kulit kayu mahoni yang merupakan limbah industri pengolahan kayu.
TINJAUAN PUSTAKA
Mahoni
Mahoni secara taksonomi memiliki nama Swietenia macrophylla King dengan subfamili swietenoideae dan tergolong ke dalam famili meliacea yaitu suatu kelompok tanaman yang memiliki aktivitas sebagai insektisida dan dapat digunakan sebagai obat herbal (Krisnawati et al. 2011). Mahoni merupakan tumbuhan yang mudah beradaptasi dan tumbuh dengan cepat, sehingga telah ditumbuhkan sebagai penghasil kayu dan juga regenerasi hutan di daerah tropis termasuk di Indonesia (Falah et al. 2008). Tanaman ini secara ektensif ditanam di wilayah Asia Selatan dan Asia Pasifik termasuk di India, Indonesia, Filipina, dan Sri Lanka. Selain itu, mulai diperkenalkan pada daerah Afrika Barat (Krisnawati et al. 2011).
Mahoni merupakan pohon yang tumbuh tahunan, dan memiliki tinggi lebih dari 30 m. Batang pohon lurus dan silinder, sedikit berlekuk dengan perkembangan taji yang baik. Mahkota pohon yang masih muda lebih sempit sedangkan pada pohon yang sudah tua lebih luas, padat, dan bercabang. Bagian kulit luar pohon yang sudah tua bersisik, kusut, dan berwarna coklat keabuan (Krisnawati et al. 2011). Daun bertandan dan menyirip yang lebarnya berkisar 35-50 cm. Bunganya kecil berwarna putih dengan panjang 10-20 cm. Buah mahoni berbentuk kapsul, keras, dan memiliki panjang 12-15 cm, berwarna abu-abu coklat (Joker 2001).
Mahoni secara alami dapat ditemukan pada daerah tropis kering dan tropis basah. Mahoni merupakan pohon yang dapat hidup pada curah hujan 1000 dan 2500 mm dengan periode kering 0-4 bulan (Lamb 1966). Di Indonesia, mahoni tumbuh pada ketinggian 0-1500 m di atas permukaan laut pada area suhu 20-28ºC. Pada suhu dingin 11-22 ºC dan pada suhu panas 22-30ºC (Soerianegara & Lemmens 1993).
Mahoni dapat digunakan sebagai penyejuk jalanan di kota-kota besar. Pemanfaatan kayu mahoni dikenal sebagai bahan baku industri properti seperti meubel, bingkai, dan papan (Suhesti 2007). Daunnya dapat digunakan sebagai agen pewarna (Mahele et al. 2006).
Gambar 1. Mahoni (Swietenia macrophylla
King)
Mahoni juga dapat digunakan sebagai
bahan ramuan jamu-jamuan untuk
menyembuhkan berbagai penyakit. Beberapa penelitian mengenai biji mahoni yang telah
diteliti sebelumnya berfungsi sebagai
antiinflamasi, antimutagenik, dan antitumor (Guevera et al. 1996), antimikrobial (Maiti et al. 2007), dan aktivitas antidiare secara in vivo
(Mandal et al. 2007). Mahoni digunakan
sebagai obat diare karena mampu
menghambat peristaltik usus kecil dan meningkatkan penyerapan air dan konsistensi feses. Limonoid dan turunannya merupakan komponen utama dalam tumbuhan ini. Penggunaan biji mahoni ini telah digunakan secara komersial dalam bidang kesehatan yaitu untuk meningkatkan sirkulasi darah dan menjaga kesehatan kulit (Goh & Habsah 2011).
Kulit kayu mahoni mengandung katekin,
epikatekin, dan switenemakrofilanin.
Ekstraknya dapat digunakan untuk
pengobatan luka dan sebagai zat warna merah (Falah et al. 2008). Aktivitas antioksidan dari tiga komponen tersebut telah diuji dengan menggunakan metode DPPH dan hasilnya
menunjukkan bahwa swietemakrofilanin
memiliki aktivitas antioksidan tertinggi dibandingkan dengan katekin, epikatekin, dan trolox. Senyawa-senyawa tersebut diketahui
mempunyai aktivitas antioksidan secara in
3
Nanopartikel
Nanoteknologi adalah teknologi yang memungkinkan suatu objek dalam ukuran nano. Pengembangan nanoteknologi ini meliputi beberapa tahap yaitu materi, pengaturan, dan sistem. Nanoteknologi diharapkan dapat membuka beberapa aspek baru untuk menyembuhkan dan mencegah penyakit dengan menggunakan ukuran skala nano. Sekarang ini, nanoteknologi digunakan sebagai sensor, mengantarkan obat pada target, dan pengantar sistem gen (Singh et al. 2008).
Nanopartikel terdiri dari materi
makromolekular dan bisa digunakan terapi sebagai pembantu dalam vaksin atau pembawa obat bahan aktif yang dilarutkan, dijebak, dikemas, diadsorpsi, atau zat kimia yang dilekatkan. Ada dua jenis nanopartikel yang tergantung pada proses persiapannya
yaitu nanosphere dan nanocapsules.
Nanospheres memiliki struktur tipe monolitik (matriks) obat yang didispersikan atau
terabsorpsi ke permukaan. Nanokapsul
menunjukan struktur dinding membran dan obat terperangkap dalam inti atau terabsorpsi ke eksterior. Nanopartikel ini diadaptasi karena sangat sulit menentukan partikel-partikel ini dari matriks atau jenis membran (Mohanraj & Chen 2005). Objek sistem penghantaran obat langsung menuju sel target atau reseptor dalam tubuh (Mishra et al. 2008).
Nanoteknologi mempunyai cabang yang panjang pada bidang sains. Penelitian dispesialisasikan seperti pada nanooptik, nanobioteknologi, nanomedis, nanoelektronik, dan nanomaterial. Beberapa contoh aplikasi penelitian nanopartikel telah diaplikasikan dalam bidang industri. Pembuatan suspensi bubuk nanopartikel silikon oksida, alumunium oksida, dan serium oksida yang digunakan
dalam industri elektronik (NanoCare
Consortium 2009). Nanoprtikel Ag, CuO, dan ZnO digunakan untuk beberapa tujuan misalnya pada modifikasi tekstil, kosmetik, semprotan, plastik, dan cat. Penggunaan nanopartikel ZnO pada tenunan katun mempunyai kemampuan sebagai antimikroba (Anita et al. 2010).
Penerapan nanopartikel dilakukan di
bidang medis. Nanopartikel dalam bidang
medis memiliki potensi penting dalam pencegahan, penanganan yang cepat, dan tepat dalam diagnosis serta sebagai perawatan pada suatu penyakit (Mishra et al. 2008).
Nanopartikel dapat digunakan sebagai
penghantar obat yang baik dan tepat. Hal ini dikarenakan nanopartikel termasuk golongan
Solid Colloidal Drug Delivery System, dan merupakan dari sistem penghantar obat yang dapat diuraikan oleh tubuh dan tidak toksik (Pankhurst et al. 2003). Nanopartikel mampu menghantarkan obat sampai ke target dan mengontrol pelepasan obat (Manikandan & Kamaraguru 2010). Menurut Poulain & Nakache (1998) juga menyebutkan bahwa enkapsulasi dengan menggunakan partikel ukuran nano menyebabkan ekstrak lebih akurat dalam mencapai target. Nanopartikel dapat disimpan dalam bentuk padat. Sediaan nanopartikel ini setelah melalui proses penyimpanan selama satu tahun masih dapat diencerkan kembali menjadi larutan koloidial yang baik dan mempunyai sifat-sifat in vivo dan in vitro yang tidak berubah (Wiraatmaja
1984). Menurut BarathManiKanth et al.
(2010), nanopartikel emas dapat digunakan sebagai antioksidan dan antihiperglikemia.
Karakterisasi nanopartikel dapat dilakukan dengan karakteristik fisik. Karakteristik nanopartikel fisik yang umumnya dilakukan dengan teknik mikroskop elektron [TEM,
SEM], mikroskop atomic [AFM],
penghamburan cahaya dinamik [DLS], x-ray mikroskop fotoelekron [XPS], bubuk x-ray
difraktometri [XRD], fourier transform
infrared (FTIR), spektroskopi UV-Vis.
(Siregar 2009). Penentuan ukuran
nanopartikel dengan particle size analyzer (PSA).
Kitosan
Kitosan adalah polimer hidrofilik
bermuatan positif yang diperoleh dari hasil deasetilasi kitin dan merupakan komponen utama dari cangkang krustasea (López-León et al. 2005). Biopolimer alami kedua terbanyak setelah selulosa, yang banyak terdapat pada serangga, krustasea, dan fungi (Dutta el al. 2004). Kitosan secara luas diaplikasikan pada fungsional biopolimer dalam makanan dan farmasi. Kitosan
diketahui memiliki bermacam-macam
aktivitas biologi termasuk efek meningkatkan kekebalan, antitumor, antijamur, dan aktivitas antibakteri (Qin et al. 2002; Roller et al. 1999; Zheng et al. 2003).
Oligomer kitosan dapat dihasilkan dengan iradiasi sonik, hydrodynamic shearing, dan hidrolisis secara kimiawi. Akan tetapi cara-cara tersebut menghasilkan oligomer dengan derajat polimerisasi (DP) yang rendah karena efesiensi yang rendah dan pemotongan yang acak. Degradasi kitosan secara enzimatis
mendapatkan oligomer kitosan dengan derajat polimerisasi yang tinggi (Meidina et al. 2005).
Parameter mutu kitosan biasanya dilihat dari nilai derajat deasetilasi, kadar air, kadar abu, bobot molekul, konsentrasi pelarut, dan suhu. Gel kitosan terjadi karena terbentuknya jaringan tiga dimensi antara molekul kitosan yang rentang pada seluruh volume gel yang terbentuk dengan menangkap sejumlah air. Sifat jaringan serta interaksi molekul yang
mengikat keseluruhan gel menentukan
kekuatan, stabilitas, dan tekstur gel. Untuk memperkuat jaringan di dalam gel biasanya digunakan molekul lain yang berperan sebagai pembentuk ikatan silang (Keuteur 1996).
Antioksidan
Antioksidan merupakan senyawa pemberi elektron (electron donor) atau reduktan. Senyawa ini memiliki berat molekul yang
kecil, tetapi mampu menginaktivasi
berkembangnya reaksi oksidasi, dengan cara mencegah terbentuknya radikal. Antioksidan juga merupakan senyawa yang mampu menghambat reaksi oksidasi, dengan mengikat radikal bebas dan molekul yang sangat reaktif sehingga dapat menghambat kerusakan sel (Winarsi 2007).
Keseimbangan oksidan dan antioksidan sangat penting berkaitan dengan fungsi sistem imunitas tubuh. Kondisi ini untuk menjaga integritas dan beberapa fungsi lipid, protein sel, dan asam nukleat, serta mengontrol tranduksi sinyal dan ekspresi gen dalam sel imun. Ketidakseimbangan akan menyebabkan terjadinya kerusakan terhadap sel karena adanya proses oksidasi. Secara umum, antioksidan dikelompokan menjadi dua yaitu antioksidan enzimatis dan antioksidan non-enzimatis. Antioksidan enzimatis misalnya enzim superoksida dismutase (SOD), katalase, dan glutation peroksidase. Antioksidan
non-enzimatis dibagi menjadi dua yaitu
antioksidan larut lemak seperti tokoferol, karetenoid, flavonoid, quinon, dan bilirubin; dan antioksidan larut air seperti asam askorbat, asam urat, protein pengikat logam, dan protein pengikat heme (Winarsi 2007).
Berdasarkan aktivitasnya, antioksidan
digolongkan menjadi dua bagian yaitu antioksidan primer dan sekunder. Antioksidan primer disebut dengan tipe 1 atau antioksidan yang dapat memecah rantainya karena molekul kimia laminya dapat berperan sebagai penangkap radikal bebas. Selain itu dapat menghambat tahap inisiasi atau mengganggu
tahap propogasi pada autooksidasi.
Antioksidan primer tidak dapat menghambat
oksidasi fotosensitis atau penangkapan
oksigen tunggal (Wanasundara & Shahidi 2005). Antioksidan sekunder sebagai antioksidan pencegahan dengan mengurangi laju inisiasi rantai. Antioksidan sekunder ini misalnya katalase dan peroksida lainnya yang bereaksi dengan ROOH dan ion logam kelat seperti etilendiaminatetraasetat (EDTA) dan
dietilentriaminpentaasetat (DTPA)
(Wanasundara & Shahidi 2003; Murray et al. 2003).
Ada beberapa metode uji antioksidan yang dapat digunakan untuk mengukur aktivitas antioksida baik berupa in vitro maupun in vivo. Metode in vitro memberikan hasil aktivitas antioksidan yang lebih maksimal tetapi data yang didapat melalui metode ini sulit diaplikasikan pada manusia. Sebaliknya,
pengukuran in vivo sulit mengetahui
antioksidan yang diambil oleh sel dan proses transpornya. Metode penentuan aktivitas
antioksidan memiliki beberapa prinsip
pengujian yaitu uji stabilitas yang dipercepat, pengukuran nilai peroksida, konjugasi diena,
penentuan senyawa reaktif asam
tiobarbioturat, pengukuran heksanal, dan produk akhir yang berhubungan, dan pengukuran melalui radikal bebas (Antolovich et al 2002).
Metode 2,2-difenil-1–pikrilhidrazil (DPPH) merupakan metode yang sederhana, cepat, dan murah untuk penapisan aktivitas penangkap radikal beberapa senyawa. DPPH digunakan secara luas untuk percobaan kemampuan komponen dalam menangkap senyawa radikal bebas atau donor hidrogen, dan menentukan aktivitas antioksidan makanan. Selain itu juga
dapat digunakan untuk kuantifikasi
antioksidan dalam sistem biologi kompleks. Metode DPPH dapat digunakan untuk sampel padatan atau cairan dan tidak spesifik untuk komponen antioksidan tertentu. Metode ini untuk semua aplikasi aktivitas antioksidan (Prakash et al. 2001)
Radikal DPPH merupakan suatu senyawa organik yang mengandung nitrogen yang tidak stabil dengan absorbansi kuat pada panjang gelombang 517 nm dan berwarna ungu gelap.
Analisis kualitatif aktivasi antioksidan
menggunakan DPPH sebagai uji dalam mencari kemampuan menangkap radikal suatu senyawa dalam ekstrak tumbuhan yang
umumnya dilakukan. Prinsip metode
5
yang memiliki aktivitas antioksidan yang tinggi (Pokorni 2001).
Senyawa DPPH merupakan senyawa yang sensitif terhadap beberapa basa Lewis, jenis pelarut, serta oksigen. Prinsipnya didasarkan pada penurunan nilai absorbansi akibat
perubahan warna larutan. Perubahan
warnanya dari ungu yang berubah menjadi kuning. Hal ini terjadi pada saat penangkapan DPPH oleh antioksidan yang melepas atom hidrogen untuk menangkap DPPH-H stabil (Ozcelik et al. 2003).
Daya reduksi merupakan metode yang ditentukan oleh Oyaizu (1986) untuk melihat
kemampuan mereduksi. Pengujian ini
dilakukan dengan menambahkan kalium ferisianida 1% yang akan mereduksi ion Fe3+
dalam larutan menjadi ion Fe2+. Reaksi ini terjadi pada suasana pH 6.6 (Katja et al. 2009). Reaksinya sebagai berikut:
K3[Fe(CN6)] K4[Fe(CN6)]
Fe3+ + e- Fe4+
Kalium ferosianida diendapkan dan dipisahkan dengan menambahkan asam trikloroasetat 10%. Proses pemisahan juga dilakukan dengan sentrifugasi. Supernatan
diujikan dengan ditambahkan dengan FeCl3
0.1% untuk membentuk warna biru. Sehingga dapat terbaca pada panjang gelombang 700 nm (Manisha et al. 2009).
Ion logam transisi terutama besi bisa merangsang lipid peroksidasi dengan reaksi Fenton. Selain itu, juga dapat mempercepat lipid peroksida dengan dekomposisi lipid hidroperoksida menjadi radikal peroksil dan alkosil akan terjadi secara terus menerus pada rantai reaksi (Mohan et al. 2012).
H2O2 + Fe+2 Fe+3 + OH- + OH-)
Diabetes Mellitus
Diabetes melitus adalah suatu penyakit kelainan metabolik kronis yang secara serius memiliki dampak terhadap kesehatan yang ditandai dengan tingginya kadar gula darah. Diabetes melitus dapat disebabkan oleh beberapa penyebab yaitu seperti kelebihan asupan glukosa dalam tubuh, kurangnya olahraga, kehamilan, defisiensi insulin, obesitas, dan berbagai penyebab lainnya. Salah satu penyebab umum diabetes melitus yaitu menurunnya produksi hormon insulin
oleh sel β Pulau Langerhans dalam kelenjar
pankreas. Insulin merupakan hormon yang
berperan dalam metabolisme glukosa
khususnya sebagai perantara masuknya glukosa di dalam darah ke sel-sel jaringan tubuh lainnya seperti otot dan jaringan lemak (Garrett & Grisham 2002).
Toleransi glukosa adalah kemampuan tubuh untuk mengatur kadar glukosa darah setelah pemberian glukosa dengan dosis uji (normalnya 1 mg/Kg berat badan). Diabetes secara umum terdapat dua tipe yaitu tipe 1 dan
tipe 2. Diabetes tipe 1 atau Insuline
Dependent Diabetes mellitus (IDDM) ditandai oleh berkurangnya toleransi glukosa akibat
berkurangnya sekresi insulin karena
kerusakan progresif sel-sel β pulau pankreas. Toleransi glukosa juga terganggu pada diabetes tipe 2 atau Non Insulin Dependent Diabetes Mellitus (NIDDM) akibat gangguan sensitivitas jaringan terhadap kerja insulin. Resistensi insulin yang berkaitan dengan
obesitas (terutama obesitas abdomen)
menyebabkan hiperlipidemia, kemudian
aterosklerosis dan penyakit jantung koroner serta diabetes nyata (overt diabetes) yang
disebut sindrom metabolik (Murray et al.
2009).
Individu penderita diabetes biasanya mengalami gejala seperti hiperglikemia (peningkatan glukosa darah) dan gangguan
metabolisme karbohidrat yang bisa
mengakibatkan efek seperti glukosuria (urin mengandung glukosa). Hal ini disebabkan gangguan reabsorbsi ginjal. Beberapa gejala lainnya seperti poliuria dan polidipsia karena penurunan volume darah dapat mengaktivasi pusat rasa haus di hipotalamus, polifagia terjadi karena kekurangan karbohidrat dalam sel-sel tubuh, ketonemia, dan ketonuria terjadi akibat katabolisme abnormal lemak sebagai sumber energi (Sloane 2003).
α- Glukosidase
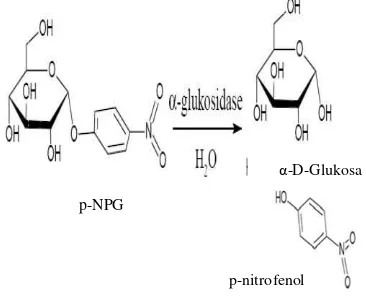
Enzim α-glukosidase atau dengan nama
lain α-D-glukosida glukohidrolase (EC
3.2.1.20) merupakan enzim yang berperan dalam sel usus halus mamalia. Enzim tersebut merupakan enzim kunci pada proses akhir
pemecahan karbohidrat. Enzim α–glukosidase
mengkatalisis hidrolisis terminal residu glukosa non pereduksi yang berikatan α-1,4
pada berbagai substrat dan dihasilkan α–
D-glukosa. α–Glukosidase menghidrolisis ikatan
α–glikosidik pada oligosakarida dan α– D-glikosida (Gao et al. 2007).
Fungsi α-glukosidase dalam sistem
pencernaan di usus sebagai katalis tahap terakhir dalam proses pemecahan karbohidrat.
-glukosidase dalam proses penyerapan makanan di usus harus dicegah. Kadar glukosa dalam darah penderita diabetes akan semakin tinggi akibat banyaknya pemecahan karbohidrat menjadi glukosa. Oleh karena itu, kerja enzim tersebut dalam usus harus dihambat, baik dengan menggunakan obat alami maupun obat komersil (Murray et al.
2009). Penghambatan enzim α-glukosidase
dapat menggunakan akarbosa, miglitol, dan voglibosa yang diketahui mampu mengurangi
hiperglikemia setelah makan melalui
penghambatan kerja enzim pencerna
karbohidrat dan menunda absorpsi glukosa (Hsieh et al. 2010). Pengunaan obat ini biasa digunakan untuk penyakit diabetes mellitus tipe 2.
Pengujian aktivitas penghambatan enzim α–glukosidase dapat dilakukan dengan cara in vitro dan in vivo. Pengujian secara in vitro biasanya banyak dilakukan dengan metode
spektrofotometer dengan menggunakan
panjang gelombang 400 nm. Pengujian ini
menggunakan pseudo-substrat, seperti
p-nitrofenil-α-D-glukopiranosida (p-NPG) dan
enzim α- glukosidase. Secara in vivo dapat
dilakukan dengan menggunakan sel pankreas
penghasil enzim α-glukosidase. Pengujian in
vivo dilakukan dengan memberikan inhibitor pada dosis tertentu pada hewan coba yang menderita diabetes dan kadar glukosa dalam hewan percobaan tersebut diamati secara berkala. Pengujian terbaru yang saat ini
sedang dikembangkan adalah metode
menggunakan biosensor, tetapi metode spektrofotometrik lebih sering digunakan karena kemudahan dan waktu pengujian yang relatif singkat (Matsumoto et al. 2002).
Daya hambat terhadap aktivitas enzim α -glukosidase dipelajari secara pseudosubstrat
dengan mengetahui kemampuansampel untuk
menghambat reaksi hidrolisis glukosa pada
substrat p-nitrofenil-α-D-glukopiranosida (p-NPG). Setelah mengalami hidrolisis substrat
akan terhidrolisis menjadi α-D-glukosa dan
p-nitrofenol yang berwarna kuning. Warna
kuning yang dihasilkan oleh p-nitrofenol menjadi indikator kemampuan inhibitor untuk menghambat reaksi yang terjadi. Semakin
besar kemampuan inhibitor untuk
menghambat maka produk yang dihasilkan
semakin sedikit atau warna larutan setelah
inkubasi lebih cerah dibandingkan dengan
larutan tanpa inhibitor(Sugiwati 2005).
Akarbosa merupakan inhibitor enzim α
-glukosidase yang digunakan secara komersial. Senyawa ini digunakan untuk terapi pasien diabetes tipe 2 (NIDDM). Akarbosa berkerja
secara perlahan pada pemecahan makanan menjadi glukosa di dalam darah (NLM-NIH 2010). Mekanisme inhibisi akarbosa termasuk dalam inhibitor kompetitif (Bintang 2010). Penggunaan akarbosa mempunyai efek samping seperti kembung, diare, dan perut menjadi tidak nyaman.
Gambar 2. Hidrolisis p-NPG oleh enzim α–
glukosidase (Sugiwati et al. 2009)
Gambar 3. Struktur akarbosa (Roxane 2008)
BAHAN DAN METODE
Bahan dan Alat
Sampel yang digunakan berasal dari Penelitian Strategis Unggulan PT atas nama Dr. Syamsul Falah S.Hut., M.Si. et al. pada tahun 2012. Dalam penelitian tersebut kulit kayu mahoni yang digunakan berasal dari daerah Sumedang, Jawa Barat. Umur kulit kayu mahoni yang digunakan sekitar 30 - 35 tahun.
Bahan-bahan yang digunakan untuk uji antioksidan dan penghambatan α-glukosidase adalah akuades, metanol absolut, 2,2-difenil-1-pikrilhidrazil (DPPH), asam asetat 0.2%, senyawa rutin, buffer fosfat 0.1 M pH 7, asam asetat 50%, sodium tripolifosfat (STPP), buffer fosfat 0.2 M pH 6.6, kalium ferisianat
p-NPG
α-D-Glukosa
7
1%, trikloroasetat (TCA), besi (III) klorida
(FeCl3) 0.1%, enzim α-glukosidase,
p-nitrofenil-α-D-glukopiranosida (p-NPG),
larutan bufer fosfat (pH 7.4), bovine serum albumin (BSA), acarbose (glukobay), asam klorida (HCl) 2N, dan natrium karbonat (Na2CO3).
Alat yang digunakan spektrofotometer UV-VIS, penangas air, neraca analitik, pipet mikro, pipet volumetrik, pipet tetes, labu Erlenmeyer, tabung reaksi, gelas piala, gelas
ukur, bulb, batang pengaduk, sudip,
microplate, microplate reader, corong gelas, kapas, stopwatch, dan sentrifus.
Metode
Ekstraksi Kulit Kayu Mahoni
Ekstraksi kulit kayu mahoni pada penelitian ini menggunakan metode rebusan dengan pelarut air. Metode rebusan dilakukan dengan merebus serbuk kulit kayu mahoni dan akuades. Hal ini mengikuti metode yang dilakukan oleh Mardisadora (2010). Kulit kayu mahoni dibuat serbuk berukuran 40-60 mesh dengan Wiley Mill. Serbuk kulit kayu mahoni sebanyak 500 g ditambahkan akuades 5 L mengikuti perbandingan 1:10 (b/v). Ekstraksi dengan air panas dilakukan pada temperatur 100oC selama 2 jam. Selanjutnya larutan ekstrak air panas disaring dan filtratnya dikeringkan dengan menggunakan rotary vaccum evaporator pada suhu 60ºC hingga diperoleh ekstrak kasar kering.
Pembuatan Nanopartikel Ekstrak Kulit Kayu Mahoni (modifikasi Rachmania 2011). Sebanyak 1 gram kitosan ditambahkan dengan asam asetat 1% kemudian dilarutkan menggunakan magnetic stirer selama 1 jam dengan kecepatan 1000 rpm. Setelah itu tambahkan Tween 80 0.1% sebanyak 50 µL dan dilarutkan selama 30 menit. Sebanyak 50 mL sodium tripolifosfat (STPP) 1.5% dalam akuades ditambahkan sedikit demi sedikit ke dalam larutan yang masih dalam keadaan
dilarutkan dengan magnetic stirer. Lalu
dilarutkan lagi selama 30 menit. Pada menit ke-30 ditambahkan 1 mL ekstrak 5% dan dilarutkan sampai 15 menit. Terakhir dilakukan pengering semprot, pada suhu 173ºC sehingga diperoleh sampel dalam bentuk serbuk.
Uji Aktivitas Antioksidan
Metode DPPH (modifikasi dari Falah et al. 2008). Sampel ekstrak dilarutkan dalam
metanol absolut dengan konsentrasi yang berbeda yaitu 0, 5, 12.5, 20, dan 25 ppm yang diambil dari stok 100 ppm. Sebanyak 0.1 mL larutan ekstrak 100 ppm yang akan diuji ditambahkan dengan 0.5 mL DPPH (4 mg/10 mL dalam metanol) dan ditambahkan dengan metanol absolut sampai volumenya 2 mL (konsentrasi 5 ppm). Konsentrasi 12.5, 20, dan 25 ppm dibuat dari stok 100 ppm dengan penambahan 0.5 mL DPPH dan ditambahkan metanol absolut sampai volumenya 2 mL. Sedangkan untuk nanopartikel ekstrak kulit kayu mahoni dengan konsentrasi 500, 1250, 2000, dan 2500 ppm yang diambil dari stok 5000 ppm. Kontrol positif yang digunakan adalah senyawa rutin. Campuran tersebut kemudian dihomegenasikan dengan vorteks, lalu diinkubasi selama 30 menit untuk senyawa rutin dan ekstrak kulit kayu mahoni, sedangkan 90 menit untuk nanopartikel ekstrak kulit kayu mahoni. Kemudian, diukur absorbansinya dengan spektrofotometri pada panjang gelombang 517 nm. Pengujian juga dilakukan terhadap blanko (Larutan DPPH dengan pelarutnya). Nilai absorbansi yang
diperoleh selanjutnya digunakan untuk
mendapatkan persen penangkapan radikal dan digunakan untuk mendapatkan persamaan regresi Y = a + b ln x. Nilai IC50 dihitung
dengan menggunakan rumus persamaan regresi tersebut. Nilai IC50 paling rendah
menunjukkan aktivitas antioksidan yang paling tinggi. Adapun aktivitas persen penangkapan radikal DPPH (%) dihitung dengan rumus:
%Penghambatan = ABlanko - ASampel x 100
ABlanko
Metode Daya Reduksi (Li et al. 2011).
Daya reduksi ekstrak ditentukan dengan metode Oyaizu (1986) dan dimodifikasi Li et al. (2011). Larutan ekstrak dilarutkan dalam air destilata kemudian dicampur dengan 1.25 mL buffer fosfat 0.2 M pH 6.6 dan 1.25 mL kalium ferisianat 1%. Campuran diinkubasi pada suhu 50ºC selama 20 menit. Setelah diinkubasi segera didinginkan secara cepat dan ditambah dengan 1.25 mL asam trikloroasetat lalu divorteks. Selanjutnya disentrifugasi dengan kecepatan 3000 rpm selama 10 menit. Sebanyak 2.5 mL lapisan atas dari larutan tersebut ditambah dengan 2.5 mL air destilata dan ditambah dengan 0.5 mL besi (III) klorida (FeCl3) 0.1%. Absorbansi
reduksi. Persentase daya reduksi sampel dihitung dengan formula:
%Daya Reduksi = (As/Am) x 100.
Am = Absorbansi maksimum yang diujikan
As = absorbansi sampel.
Uji Daya Hambat α-Glukosidase (Sancheti et al. 2009)
Uji daya hambat aktivitas enzim α
-glukosidase menggunakan substrat
p-nitrofenil α–D-glukopiranosida (p-NPG) dan enzim α-glukosidase. Larutan enzim dibuat
dengan melarutkan 1.0 mg α-glukosidase
dalam larutan buffer fosfat (pH 7.4) yang mengandung 200 mg serum bovine albumin. Sebelum digunakan sebanyak 1 mL enzim diencerkan 25 kali dengan buffer fosfat (pH 7.4).
Sistem reaksi disiapkan pada microplate. Campuran reaksi terdiri atas 25 µL
p-nitrofenil α-D-glukopiranosida (p-NPG) 20
mM sebagai substrat, dan 49 μL larutan buffer fosfat (pH 7.4) 100 mM yang mengandung BSA dan 1 µL larutan sampel dalam buffer fosfat pH 7.4. Sampel terdiri atas ekstrak, nanopartikel ekstrak kulit kayu mahoni dan kontrol negatif (ekstrak tanpa penambahan enzim). Campuran tersebut diinkubasi 37°C selama 5 menit. Setelah itu, ditambahkan
enzim α-glukosidase sebanyak 25 μL. Reaksi
enzim dihentikan dengan menambahkan 100 μL Na2CO3 200 mM. Nilai absorbansi diukur
pada panjang gelombang 400 nm dengan spektrofotometer.
Tablet akarbosa (glukobay) digunakan
sebagai kontrol positif. Akarbosa dilarutkan dalam buffer dan HCl 2N (1:1) dengan konsentrasi 1% (b/v) kemudian disentrifugasi.
Supernatan diambil sebanyak 1 μL dan
dimasukkan ke dalam campuran reaksi seperti dalam sampel.
Hasil campuran tersebut diukur dengan microplate reader pada panjang gelombang 400 nm. Percobaan dilakukan sebanyak 3 kali ulangan. Selanjutnya dilakukan penghitungan % peghambatan untuk menentukan nilai IC50.
Analisis Data (Mattjik 2002)
Rancangan percobaan pada penelitian ini adalah rancangan acak lengkap (RAL) satu faktor dengan tiga kelompok perlakuan dan tiga kali ulangan. Analisis data menggunakan analysis of variance (ANOVA) dengan model rancangan sebagai berikut:
Yij = μ + αi + εij
Keterangan:
μ = Pengaruh rataan umum
αi = Pengaruh perlakuan ke-I, i = 1,2,3,4,5 εij = Pengaruh galat perlakuan ke-i dan
ulangan ke-j, j = 1,2,3,4
HASIL DAN PEMBAHASAN
Kadar Air dan Rendemen Ekstrak
Sampel kulit kayu mahoni yang digunakan berupa simplisia yang sudah dihaluskan dengan ukuran 40-60 mesh. Hasil pengukuran kadar air simplisia berdasarkan penelitian didapatkan 4.87% (Lampiran 2). Sedangkan, pengukuran kadar air yang dilakukan Mardisadora (2010) yaitu 7.5%. Rendahnya persen kadar air sampel menunjukan bahwa kulit kayu mahoni yang digunakan dapat disimpan dalam waktu panjang tanpa adanya kerusakan. Sampel yang baik untuk disimpan dalam jangka panjang memiliki kadar air kurang dari 10% (Deptan 2007). Rendahnya kadar air dapat mencegah pencemaran mikroorganisme sehingga mutu simplisia terjaga (Suharmiati & Maryani 2003).
Penentuan kadar air dilakukan untuk mengetahui ketahanan suatu bahan dalam
penyimpanan dan untuk menghitung
rendemen pada kondisi kering oven. Air yang terikat secara fisik dapat dihilangkan dengan
pemanasan pada suhu 100-105oC (Harjadi
1993). Kandungan air pada sampel kulit kayu mahoni dihilangkan dengan pemanasan fisik
menggunakan oven pada suhu 105oC selama 3
jam. Selanjutnya satu jam dioven lagi sampai pada bobot yang stabil.
Tahap ekstraksi kulit kayu mahoni menggunakan metode rendaman air panas. Metode ini dilakukan mengacu pada penelitian Mardisadora (2010). Pemilihan metode ini dilakukan karena mudah dan praktis. Selain itu, metode rebusan merupakan
metode yang banyak dilakukan oleh
masyarakat dalam pengolahan tanaman obat. Penggunaan pelarut air karena air memiliki sifat polar sehingga dapat berikatan dengan senyawa yang bersifat polar juga misalnya senyawa fenolik atau polifenol.
Hasil ekstraksi dari 476.65 gram dengan 3 kali ulangan dihasilkan ekstrak 45.01 gram dengan rendemen 9.46% (Lampiran 3). Rendemen penelitian yang dilakukan oleh
Maydina (2012) sebesar 5.86% dan
9
dan Mardisadora (2010) sekitar 20-25 tahun. Perbedaan umur dan lingkungan hidup mempengaruhi metabolit sekunder yang dihasilkan tanaman tersebut (Nurcholis 2008).
Gambar 4. Ekstrak kulit kayu mahoni
Nanopartikel Ekstrak Kulit Kayu Mahoni
Sebagian ekstrak dibuat nanopartikel
dengan menggunakan metode magnetic stirer.
Kelebihan dari metode magnetic stirer ini mampu mendistribusikan ukuran partikel yang lebih homogen. Selain itu, rendemen yang
dihasilkan dengan menggunakan magnetic
stirer lebih besar dari pada dengan metode ultrasonikasi dan homogenizer (Rachmania 2011).
Pembuatan nanopartikel ini menggunakan variasi kitosan 1% dan STPP 1.5%.
Penggunaan STPP bertujuan untuk
membentuk ikatan silang ionik antar molekul kitosan sehingga dapat menyerap dan memperkuat ikatan silang nanopartikel kitosan (Wahyono 2010). ). STTP dianggap sebagai zat pengikat silang yang paling baik (Mohanraj & Chen 2006).
Sebanyak 302 mL larutan nanopartikel ekstrak kulit kayu mahoni setelah dilakukan semprot kering didapatkan 5.10 g dengan rendemen sebesar 51.11%. Berdasarkan
penelitian Maydina (2012) serbuk
nanopartikel 30 menit dan 60 menit ultrasonikasi sebanyak 0.2915 g dan 0.3968 g. Rendemen metode ultrasonikasi larutan kitosan 2% dan STPP 0.5% didapat nilai rendemen ultrasonikasi 30 dan 60 menit yaitu 3.104% dan 4.149%.
Gambar 5. Nanopartikel ekstrak kulit kayu mahoni
Aktivitas Antioksidan dengan Metode DPPH
Pengujian aktivitas antioksidan dilakukan pada sampel ekstrak air kulit kayu mahoni, serbuk nanopartikel ekstrak kulit kayu mahoni, dan standar senywa rutin dengan
menggunakan metode DPPH. DPPH
merupakan radikal sintetik yang larut dalam pelarut polar seperti metanol dan etanol. DPPH dapat diukur intensitasnya pada panjang gelombang 517 nm. Menurut Marxen (2007), penggunaaan metode ini karena mudah, cepat, dan sangat baik untuk sampel dengan polaritas tertentu.
Pengujian dilakukan dengan menghitung nilai IC50. IC50 yaitu konsentrasi sampel yang
mampu memberikan persen penangkapan radikal sebanyak 50% dibanding kontrol melalui suatu persamaan garis. Semakin kecil
nilai IC50 berarti semakin kuat daya
antioksidannya (Rohman & Riyanto 2005). Hasil pengujian menunjukkan nilai IC50
rata-rata ekstrak air kulit kayu mahoni sebesar 9.62 ppm, senyawa rutin sebesar 17.33 ppm dan nanopartikel ekstrak kulit kayu mahoni lebih dari 2500 ppm. Nilai IC50 ekstrak lebih kecil
dari penelitian yang dilakukan Maydina (2012) yaitu sebesar 18.148 ppm. Menurut Mardisadora (2010) daya hambat ekstrak pada 50 ppm sebesar 68.04%. Nilai ini dapat dipengaruhi oleh umur sampel dan kondisi lingkungan yang memang berbeda.
Nanopartikel ekstrak kulit kayu mahoni diuji metode DPPH dengan waktu inkubasi 90 menit. Penggunaan waktu inkubasi yang lebih lama diharapkan ekstrak yang tersalut dapat keluar dari penyalutnya. Namun berdasarkan hasil uji, penggunaan waktu inkubasi 90 menit belum dapat meningkatkan kemampuan penangkapan radikal bebas. Hasil ini hampir sebanding dengan waktu inkubasi 30 menit yang dilakukan oleh Maydina (2012) dengan nilai IC50 lebih dari 1000 ppm. Hal ini, dapat
dipengaruhi oleh derajat deasetilasi sampel kitosan dan bobot molekul kitosan. Kitosan yang digunakan memiliki derajat deasetilasi 89. Rata-rata dari daya hambat konsentrasi 500 ppm dapat menghambat sebesar 2.95%, 1250 ppm menghambat 4.48%, 2000 ppm menghambat 12.87%, dan 2500 ppm
menghambat 17.15%. Nilai IC50 dari
nanopartikel ekstrak kulit kayu mahoni lebih dari 2500 ppm. Nilai IC50 dari nanopartikel
masih tidak terlalu kuat.
Berdasarkan penelitian Hanani et al.
kurang dari 200 ppm. Penangkapan radikal bebas DPPH dipengaruhi oleh besarnya konsentrasi sampel. Peningkatan penangkapan radikal bebas seiring dengan kenaikan konsentrasi dari sampel sampai batas tertentu (Elmastaş et al. 2006). Aktivitas penangkapan radikal bebas akan turun dengan penambahan konsentrasi tertentu (Lai et al. 2001). Berdasarkan nilai IC50 rata-rata semua
sampel pada Tabel 1 menunjukkan bahwa ekstrak air kulit kayu mahoni dan senyawa rutin memiliki aktivitas antioksidan yang tinggi sedangkan untuk nanopartikel ekstrak kulit kayu mahoni memiliki aktivitas yang
sangat rendah. Hal ini, menunjukan
nanopartikel kulit kayu mahoni belum mampu berperan sebagai antioksidan sedangkan ekstrak telah mampu berperan sebagai antioksidan.
Tabel 1. Nilai IC50 rata-rata seluruh sampel
Sampel IC50 rata-rata (ppm)
Senyawa rutin 17.33 ± 1.17
Ekstrak kulit kayu mahoni
9.62 ± 0.28 Nanopartikel ekstrak
kulit kayu mahoni
>2500
Gambar 6. Hubungan antara sampel dengan konsentrasi 25 ppm dan daya hambatnya.
Aktivitas Antioksidan dengan Metode Daya Reduksi
Pengujian antioksidan ini dengan metode Oyaizu (1986) yang telah dimodifikasi oleh Li et al. (2011). Pengujian ini dilakukan dengan melihat kemampuan mereduksi dari sampel yang digunakan pada konsentrasi yang berbeda-beda. Daya reduksi komponen
bioaktif berhubungan dengan aktivitas
antioksidan. Dalam penentuan daya reduksi, reduktor (antioksidan) dalam sampel akan mereduksi Fe3+ (Kompleks kalium ferisianida [K3Fe(CN)6] ) menjadi Fe2+ (bentuk fero).
Menurut Ebrahimzadeh et al. (2010)
warna yang terbentuk pada reaksi ini adalah berwarna biru. Semakin pekat intensitas warna biru yang terbentuk semakin tinggi nilai absorbansinya. Nilai absorbansi yang tinggi menunjukkan tingginya daya reduksi suatu sampel. Sampel dengan daya reduksi yang tinggi merupakan donor elektron yang bagus karena memiliki kemampuan untuk menghentikan reaksi berantai radikal dengan cara mengubah radikal bebas menjadi produk yang lebih stabil .
Gambar 7 merupakan hasil dari daya reduksi beberapa sampel. Senyawa rutin
sebagai standar semakin bertambah
konsentrasinya semakin meningkat daya reduksinya. Daya reduksi ini meningkat seiring dengan bertambahnya konsentrasi. Senyawa rutin merupakan flavonol glikosida yang terdiri dari kuarsetin dan disakarida rutinosa (Hussain et al. 2009). Mekanisme
dari flavonoid ini mampu menekan
pembentukan radikal bebas atau ROS dengan cara menghambat enzim, pengkelatan ion logam (metal ion chelating) yang terlibat produksi radikal bebas (Halliwel & Gutteridge 1999).
Ekstrak kulit kayu mahoni memiliki kemampuan yang paling tinggi dalam mereduksi. Hal ini terlihat seperti pada Gambar 7. Daya reduksi yang tinggi dapat dipengaruhi oleh adanya senyawa berperan sebagai antoksidan seperti switemakrofilanin, katekin dan epikatekin. Switemakrofilanin,
epikatekin, dan katekin merupakan
antioksidan yang masing-masing mempunyai nilai IC50 56 µg/ml, 59 µg/ml dan 70 µg/ml
(Falah et al. 2008). Katekin merupakan
senyawa yang mampu menghambat aktivitas superoksida in vitro dengan efektivitas yang
sama dengan asam askorbat (Grimm et al.
2004). Ion superoksida ini berpotensi merusak tubuh. Superoksida di dalam tubuh akan dibersihkan oleh superoksida dismutase yang
merupakan golongan metaloenzim (Murray et
al. 2009). Kemampuan penangkapan
superoksida oleh katekin dapat dihubungkan
dengan aktivitas antimutagenik dan
antikarsinogenik. Fenolik ini juga mampu mereduksi Fe+3 membentuk radikal hidroksil
oleh Fe+2 dengan hidrogen peroksida
(Rohdiana & Widiantara 2003). Ekstrak pada konsentrasi 25 ppm terdapat penurunan daya reduksi. Kemampuannya untuk mereduksi
90.48 65.81 0 0 20 40 60 80 100
Konsentrasi 25 ppm
% pe ng ha m ba ta n Ekstrak mahoni Standar senyawa Rutin
11
tidak sampai 100%. Penurunan ini dapat disebabkan senyawa aktif yang ada di dalam ekstrak tidak dapat mereduksi logam secara sempurna atau dapat terjadi karena adanya senyawa lain yang mengganggu.
Sampel nanopartikel ekstrak kulit kayu mahoni pada Gambar 7 memiliki daya reduksi yang meningkat seiring dengan bertambahnya konsentrasi. Namun, daya reduksinya masih dibawah senyawa rutin dan ekstrak kulit kayu mahoni. Daya reduksi yang rendah ini bisa disebabkan oleh ekstrak yang tersalut tidak mampu keluar dari penyalut, sehingga daya reduksi dari nanopartikel kulit kayu mahoni
belum mampu mencapai 50% daya
reduksinya. Berdasarkan penelitian yang dilakukan Maydina (2012), nanokitosan merupakan penyalut yang memiliki aktivitas antioksidan yang rendah yaitu lebih dari 100 ppm. Selain itu, dapat disebabkan derajat deasetilasi dari kitosan yang digunakan. Daya reduksi dapat dipengaruhi oleh derajat deasetilasi karena semakin tinggi derajat
deasetilasi semakin tinggi kemurnian
kitosannya. Nilai derajat deasetilasi
merupakan presentasi gugus asetil yang berhasil dihilangkan selama proses deasetilasi kitin (Rachmania 2011).
Pengujian daya reduksi pada ekstrak kulit
kayu mahoni menunjukan aktivitas
antioksidan yang baik. Sedangkan, sampel nanopartikel kulit kayu mahoni belum mampu untuk mereduksi sampai 50% daya reduksinya, sehingga nanopartikel kulit kayu mahoni tidak memiliki aktvitas antioksidan. Pengujian ini sebanding dengan pengujian DPPH, ekstrak memiliki kemampuan sebagai antioksidan sedangkan nanopartikel ekstrak belum mampu berperan sebagian antioksidan.
Gambar 7. Persentase Daya reduksi
Ekstrak kulit kayu mahoni
Senyawa rutin
Nanopartikel kulit kayu mahoni.
Penghambatan Enzim α-Glukosidase
Uji penghambatan enzim α-glukosidase
dengan menggunakan ekstrak kulit kayu mahoni dan nanopartikel kulit kayu mahoni
dengan berbagai konsentrasi. Variasi
konsentrasi untuk menentukan IC50 dari
masing-masing sampel. Nilai persen
penghambatan yang terjadi menunjukan bahwa semakin tinggi konsentrasi sampel maka nilai penghambatan juga semakin tinggi. Sampel ditambahkan pada campuran enzim-pseudo substrat, senyawa pada sampel
diharapkan dapat berkompetisi dengan
substrat untuk menempel pada sisi katalitik enzim sehingga tidak terbentuk. Berkurangnya produk yang terbentuk ditandai dengan intensitas warna larutan yang tidak pekat. Semakin kurang intensitas warna yang dihasilkan maka semakin sedikit pula produk yang terbentuk (Irawan 2011).
Tabel 2 menunjukan hasil penelitian
bahwa aktivitas penghambatan kerja enzim α–
glukosidase ekstrak kulit kayu mahoni memiliki nilai IC50 sebesar 17.25 ppm dan
IC50 nanopartikel kulit kayu mahoni lebih dari
200 ppm. Daya penghambatan akarbosa sebagai kontrol positif memiliki IC50 sebesar
0.37 ppm. Nilai IC50 dari akarbosa lebih kecil
46.62 kali dari nilai IC50 ekstrak dan sangat
rendah lagi jika dibandingkan dengan nanopartikel kulit kayu mahoni. Hal ini menunjukan kemampuan akarbosa dalam menghambat enzim lebih efektif. Efektivitas akarbosa ditunjukan oleh nilai IC50 yang
menyebabkan akarbosa digunakan sebagai obat diabetes secara komersial. Namun Penggunaan obat sintetik ini menyebabkan efek samping kembung, diare, dan kram usus (Hartika 2009).
Ekstrak kulit kayu mahoni memiliki
kemampuan menghambat α-glukosidase
paling tinggi. Hal ini terlihat pada nilai IC50
ekstrak kulit kayu mahoni. Berdasarkan penelitian Falah et al. (2008) menyatakan kulit kayu mahoni mengandung epikatekin. Menurut Quine (2005) epikatekin mampu menurunkan kadar glukosa darah karena epikatekin mampu meningkatkan glutation peroksidase pada tikus. Glutation peroksidase merupakan antioksidan alami yang terdapat di dalam tubuh.
Tabel 2. Penghambatan enzim α-glukosidase
Sampel IC50 rata-rata (ppm)
Akarbosa 0.37±0.14
Ekstrak 17.25±0.65
Nanopartikel >200
0 10 20 30 40 50 60 70 80
0 10 20 30
Nanopartikel ekstrak kulit kayu mahoni memiliki daya hambat yang rendah karena pada nanopartikel telah ada penambahan senyawa lainnya yang dapat menurunkan kemampuan ekstrak yang tersalut kitosan. Ekstrak tidak mampu untuk keluar atau menjadi tidak aktif karena adanya reaksi yang terjadi pada saat pembuatan nanopartikel. Kitosan dengan nilai derajat deasetilasi yang tinggi mampu memberikan penyerapan yang lebih tinggi (Rachmania 2011).
Beberapa tanaman obat yang telah diteliti memiliki kemampuan untuk menghambat
kerja enzim α–glukosidase. Besarnya daya
hambat terhadap kerja enzim berbeda-beda.
Perbedaan tersebut disebabkan adanya
perbedaan senyawa metabolit sekunder yang terdapat di dalam suatu tanaman obat, adanya pengganggu, perbedaan metode ekstraksi, dan perbedaan jenis pelarut yang digunakan (Kardono 2003). Menurut Ichsan (2011), ekstrak air kulit kayu suren memiliki nilai IC50 3.32 ppm, dan ekstrak etanol 70% 0.66
ppm. Penelitian terhadap berbagai jenis kulit
kayu raru menunjukan aktivitas
penghambatan sebesar 88-97% (Pasaribu 2011). Beberapa jenis ekstrak kulit kayu yang telah diteliti memiliki kemampuan yang sama dengan ekstrak kulit kayu mahoni untuk
menghambat kerja enzim α-glukosidase.
Sedangkan, nanopartikel ekstrak kulit kayu mahoni belum mampu berperan sebagai penghambat α-glukosidase.
SIMPULAN DAN SARAN
Simpulan
Pengujian antioksidan ekstrak kulit kayu mahoni dengan menggunakan metode DPPH memiliki nilai IC50 9.62 ppm dan nanopartikel
ekstrak kulit kayu mahoni lebih dari 2500 ppm. Pengujian dengan metode daya reduksi ekstrak lebih tinggi daya reduksinya daripada nanopartikel ekstrak kulit kayu mahoni.
Ekstrak mampu menghambatan enzim α
-glukosidase pada nilai IC50 17.25 ppm
sedangkan untuk nanopartikel lebih dari 200
ppm. Ekstrak kulit mahoni memiliki
kemampuan sebagai antioksidan dan
penghambat α-glukosidase. Namun demikian
pada nanopartikel ekstrak kulit kayu mahoni belum terlihat aktivitas antioksidan dan penghambatan α-glukosidase.
Saran
Perlu dilakukan pengujian daya reduksi dengan konsentrasi nanopartikel ekstrak kulit kayu mahoni yang lebih tinggi. Selain itu,
dapat dilakukan dengan menggunakan metode antioksidan lainnya. Untuk uji penghambatan
α-glukosidase pada sampel nanopartikel dapat
diuji dengan menambah waktu inkubasi.
DAFTAR PUSTAKA
Anita S, Ramachandran T, Koushik CV, Rajendran R, Mahalakhsmi M. 2010. Preparation and characterization of zinc oxide nanoparticles and a study of the anti-microbial property of cotton fabric treated with the particles. Journal of Textile and Apparel Technology and Management 6: 1-7.
Antolovich M, Prenzler PD, Patsalides E, McDonald S, dan Robards K. 2002. Metods. For testing antioxidant activity. Analist 127:183-198.
BarathManiKanth S et al. 2010. Anti-oxidant effect of gold nanoparticles restains hyperglycemic conditions in diabetic mice. Journal of Nanobiotechnology 8: 16.
Bintang M. 2010. Biokimia Teknik Penelitian.
Jakarta: Erlangga.
[CDC] Centres for Diasease Control and Prevention. 2011. National diabetes fact and sheet: national estimates dand general information on diabetes and prediabetes in
the United States 2011. Atlanta:
Departement of Health and Human Services.
Cing JM. 2010. Potensi antihiperglikemia
ekstrak kulit kayu mahoni (Swietenia
macrophylla King) pada tikus yang diinduksi aloksan. [Skripsi]. Bogor:
Departemen Biokimia, Fakultas
Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Darminto B. 2010. Khasiat antihiperurisemia ekstrak kulit batang mahoni (Swietenia macrophylla King) pada tikus putih galur Sprague Dawley. [Skripsi]. Bogor:
Departemen Biokimia, Fakultas
Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
[Deptan] Departemen Pertanian. 2007. Teknologi Penyiapan Simplisia Terstandar Tanaman Obat. (terhubung berkala). http://balittro.litbang.deptan.go.id/ [16 September 2012]
13
applications. Journal of Scientific & Industrial Research 63: 20-31.
Ebrahimzadeh MA, Nabavi SM, Nabavi SF, Bahramian F, Bekhradnia AR. 2010. Antioxidant and free radical scavenging
activity of H. Officinalis L. Var.
Angustifolius, V. Odorata, B.hyrcana and C. speciosum. Pak. J.Pharm.Sci 23: 29-34. Elmastaş M, Gülçin İ, Işildak Ö,
Küfrevioğlu Öİ, İbaoğlu K, Aboul-Enein HY. 2006. Radical scavenging activity and antioxidant capacity of bay leaf exstracts. Journal of The Iranian Chemical Society 3: 258-266. Falah S, Suzuki T, Katayama T. 2008.
Chemical constituents from Swietenia
macrophylla bark and antioxidant activity. Pakistan Journal of Biological Sciences 11 (16): 2007-2012.
Gao H. Huang YN, Xu PY, Kawabata J. 2007. Inhibitory effect on α-glucosidase by the fruits of Terminalia chebula Retz. Food Chemistry 105: 628-634.
Garret RH, Grisham CM. 2002. Biochemistry
and Molecular Biology Education. New Orleans: Wiiley Intersci.
Goh BH, Habsah AK. 2011. In vitro cytotoxic
potencial of Swietenia macrophylla King seeds against human carcinoma cell lines. Journal of Medicine Plants Research. 5:1395-1404.
Guevera AP, Apilado A, Sakarai H, Kozuka M, Tokunda H. 1996. Antiinflammatory, antimutagenecity and antitumor activity of
mahagony seeds Swietenia macrophylla
(Meliaceae). Phill J. Sc., 125: 271-278. Grimm T, Schafer A, Hogger P. 2004.
Antioxidant activity and inhibition of matrix metalloproteinases by metabolites of maritime pine bark extract (pycnogenol). Free Radic Biol Med, 36:811-822.
Halliwel B, Gutteridge JMC. 1999. Free
Raadical in Biology and Medicine. New York: Oxpord University Press.
Hanani E, Munim A, Sekarini R. 2005. Identifikasi senyawa antioksidan dalam
spons Callyspongia sp dari Kepulauan
Seribu. Majalah Ilmu Kefarmasian 3:127-133.
Hartika R. 2009. Aktivitas inhibisi α
-glukosidase ekstrak senyawa golongan
flavonoid buah mahkota dewa. [Skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Haryadi. 1993. Ilmu Kimia Analitik Dasar. Jakarta: Gramedia.
Hussain MT, Verm AR, Vijayakumar A, Sharma A, Mathela CS, Rao CH. 2009. Rutin, a natural flavonoid, protects against gastric mucosal damage in experimental
animals. Asian Journal of Traditional
Medicine. 4 (5):188-198.
Hsieh PC et al. 2010. Activities of
antioxidants, α-glukosidase inhibitors and aldose reductase inhibitors of the aqueous extracts of four Flemingia species in Taiwan. Botanical Studies 51: 293-302. Ichsan Sitha Arilah. 2011. Aktivitas ekstrak kulit kayu suren (Toona sinensis Merr.) sebagai antioksidan dan antidiabetes
secara in vitro. [Skripsi]. Bogor:
Departemen Biokimia, Fakultas
Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Irawan F. 2011. Aktivitas antidiabetes dan analisis fitokimia ekstrak air dan etanol daun wungu (Graptophyllum pictum (L.) Griff). [Skripsi]. Bogor : Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Joker D.2001. Informas Singkat Benih.
Bandung : Direktorat Perbenihan Tanaman Hutan.
Kardono LBS. 2003. Kjian kandungan kimia mahkota dewa (Phaleria marcocarpa). Di
dalam: Prosididng Pameran Obat
Tradisional dan Seminar Sehari Mahkota
Dewa. Jakarta: Pusat Penelitian dan
Pengembangan Farmasi dan Obat
Tradisional Departemen Kesehatan, hlm 72-76.
Katja DG, Suryanto E. Wehantouw F. 2009. Potensi daun alpukat (Persea Americana Mill) sebagai sumber antioksidan alami. Chem Prog. 2: 58-64.
Keuteur J. 1996. Perlakuan sonikasi terhadap kitosan: viskositas dan bobot molekul
kitosan [skripsi]. Bogor: Fakultas
Matematika dan Ilmu Pengetahuan Alam, Insatitut Pertanian Bogor.
silviculture, and productivity. Bogor: CIFOR
Kumar S, Kumar D. 2009. Antioxidant and free radical scavenging activities of edible weeds. Ajfand online :1174-1190.
Lamp FB. 1966. Swietenia macrophylla of
tropical America: its ecology and managenent. Michigan: University of Michigan Press.
Lai LS, Chou ST, Chao. Studies on the antioxidative activities of hsian-tsao (Mesona procumbens Hemsl) leaf gum. J. Agric. Food Chem. 49:963-968.
Lavenia A. 2010. Potensi ekstrak batang
mahoni (Swietenia macrophylla King)
sebgai antioksidan pada tikus
hiperuresemia [Skripsi]. Bogor:
Departemen Biokimia, Fakultas
Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
[NLM-NIH] National Library of Medicine National Institutes of Health. 2010.
Acarbose. (terhubung berkala)
http://www.nlm.nih.gov/medlineplus/drugi nfo/meds/a696015.html .[15 September 2012]
Li X, Wang X, Chen D, Chen S. 2011. Antioxidant activity and mechanism of protocatechuic acid in vitro. Functional Food in Health and Disease, 7: 232-244. López-León T, Carvalho ELS, Seijo B,
Ortega-Vinuesa JL, Bastos-González D. 2005. Physicochemical characterization of chitosan nanoparticles: electrokinetic and stability behavior. Journal of Colloid and interface Science 283: 344-351.
Maiti A, Dewanjee S, Mandal SC, Annadurai S. 2007. Exploration of antimicrobial potential of methanol and water extract of seeds of Swietenia macrophylla (Family: Meliaceae), to substantiate folklore claim. Iranian J. Pharmacol. Therapeut, 6: 99-102.
Mahele G, Medha H, Goudar I. 2006. Dyeing silk with mahogany leave extract . ATA J 17: 72-75.
Mandal CS, Maiti A, Dewanjee S. 2007. In vivo Evaluation of antidiarrhoeal activity of the seed of Swietenia macrophylla King (Meliaceae). Trop. J. Pharm. Res., 6(2): 712-716.
Manikandan Manoj S, Kumaraguru. 2010. Nanoparticles : a new technology with
wide applications. Res. J. Nanosci.
Nanotechnol. 1996-5044.
Manisha P, Kanchan S, Jovita K, Koshy MK, A Shubhini S. 2009. Sida veronicacaefolia as a source of natural antioxidant. International Journal of Pharmaceutical Sciences and Drugs Research 1(3): 180-182.
Mardisadora O. 2010. Identifikasi dan potensi antioksidan flavonoid kulit kayu mahoni (Swietenia macrophylla King). [Skripsi]. Bogor: Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Marxen et al. 2007. Determination of DPPH radical antioxidant caused by methanolic extract of some microalgal species by
linear regression analysis of
spectrophotometric measurements.
Sensors 7:2080-2095.
Matsumoto K et al. 2002. A novel method fo
the assay of glukosidase inhibitory activity using a multichannel oxygen sensor. J Anal Sci 18:1315-1319.
Mattjik AA. 2002. Rancangan Percobaan.
Bogor : IPB Press.
Maydina R. 2012. Karakterisasi dan aktivitas antioksidan nanopartikel ekstrak kulit katu
mahoni (Swietenia macrophylla King.).
[Skripsi]. Bogor: Departemen Biokimia,
Fakultas Matematika dan Ilmu
Pengetahuan Alam, Institut Pertanian Bogor.
Meidina SB, Sri LJ, Suhartono MT. 2005 Aktivitas antibakteri oligomer kitosan yang diproduksi menggunakan kitonase dari is