Lampiran 1. Data Pengamatan Umur Munculnya Tunas (hari)
Perlakuan
ULANGAN
Total Rataan
1 2 3 4 5 6 7
C1G1 21 28 28 28 21 21 28 175 25
C1G2 21 28 28 21 28 28 21 175 25
C1G3 28 21 28 21 21 21 21 161 23
C1G4 21 21 21 28 28 28 21 168 24
C2G1 21 21 28 28 28 28 28 182 26
C2G2 28 28 21 21 21 21 28 168 24
C2G3 28 21 21 28 28 21 21 168 24
C2G4 21 21 21 28 21 28 28 168 24
C3G1 28 21 0 21 21 28 21 161 23
C3G2 21 28 28 28 28 21 28 182 26
C3G3 21 21 28 21 28 21 21 161 23
C3G4 28 28 21 28 21 21 21 168 24
TOTAL 287 287 294 301 294 287 287 2037
Lampiran 2. Data Pengamatan Persentase Munculnya Tunas (%)
Perlakuan
ULANGAN
Total Rataan
1 2 3 4 5 6 7
C1G1 100 100 100 100 100 100 100 700 100 C1G2 100 100 100 100 100 100 100 700 100 C1G3 100 100 100 100 100 100 100 700 100 C1G4 100 100 100 100 100 100 100 700 100 C2G1 100 100 100 100 100 100 100 700 100 C2G2 100 100 100 100 100 100 100 700 100 C2G3 100 100 100 100 100 100 100 700 100 C2G4 100 100 100 100 100 100 100 700 100 C3G1 100 100 0 100 100 100 100 600 85,71 C3G2 100 100 100 100 100 100 100 700 100 C3G3 100 100 100 100 100 100 100 700 100 C3G4 100 100 100 100 100 100 100 700 100
Total 1200 1200 1100 1200 1200 1200 1200 8300
Lampiran 3. Data Transformasi Persentase Munculnya Tunas Arcsin √P
Perlakuan ULANGAN
Total Rataan
1 2 3 4 5 6 7
C1G1 90 90 90 90 90 90 90 630 90
C1G2 90 90 90 90 90 90 90 630 90
C1G3 90 90 90 90 90 90 90 630 90
C1G4 90 90 90 90 90 90 90 630 90
C2G1 90 90 90 90 90 90 90 630 90
C2G2 90 90 90 90 90 90 90 630 90
C2G3 90 90 90 90 90 90 90 630 90
C2G4 90 90 90 90 90 90 90 630 90
C3G1 90 90 0,41 90 90 90 90 540,41 77,20
C3G2 90 90 90 90 90 90 90 630 90
C3G3 90 90 90 90 90 90 90 630 90
C3G4 90 90 90 90 90 90 90 630 90
TOTAL 1080 1080 990,405 1080 1080 1080 1080 7470,41
RATAAN 90 90 82,5338 90 90 90 90 88,93
Lampiran 4. Daftar Sidik Ragam Persentase Munculnya Tunas
SK db JK KT F.Hit 0,05 Ket
C 2 191,12 95,56 1,37 3,15 tn
G 3 286,69 95,56 1,40 2,76 tn
CxG 6 573,37 95,56 1,43 2,25 tn
Galat 72 5829,30 95,56
Total 83 7931,68
FK 664368,48
Lampiran 5. Data Pengamatan Jumlah Tunas (tunas)
Perlakuan ULANGAN
Total Rataan
1 2 3 4 5 6 7
C1G1 1,00 1,00 1,00 1,00 1,00 1,00 1,00 7,00 1,00 C1G2 1,00 1,00 1,00 1,00 1,00 1,00 1,00 7,00 1,00 C1G3 1,00 1,00 1,00 1,00 1,00 1,00 1,00 7,00 1,00 C1G4 1,00 1,00 1,00 1,00 1,00 1,00 1,00 7,00 1,00 C2G1 1,00 1,00 1,00 1,00 1,00 1,00 1,00 7,00 1,00 C2G2 1,00 1,00 1,00 1,00 1,00 1,00 1,00 7,00 1,00 C2G3 1,00 1,00 1,00 1,00 1,00 1,00 1,00 7,00 1,00 C2G4 1,00 1,00 1,00 1,00 1,00 1,00 1,00 7,00 1,00 C3G1 1,00 1,00 0,00 1,00 1,00 1,00 1,00 6,00 0,86 C3G2 1,00 1,00 1,00 1,00 1,00 1,00 1,00 7,00 1,00 C3G3 1,00 1,00 1,00 1,00 1,00 1,00 1,00 7,00 1,00 C3G4 1,00 1,00 1,00 1,00 1,00 1,00 1,00 7,00 1,00 TOTAL 12,00 12,00 11,00 12,00 12,00 12,00 12,00 83,00
Lampiran 6. Data Transformasi Jumlah Tunas √x+ 0,5
Perlakuan ULANGAN
Total Rataan
1 2 3 4 5 6 7
C1G1 1,22 1,22 1,22 1,22 1,22 1,22 1,22 8,57 1,22 C1G2 1,22 1,22 1,22 1,22 1,22 1,22 1,22 8,57 1,22 C1G3 1,22 1,22 1,22 1,22 1,22 1,22 1,22 8,57 1,22 C1G4 1,22 1,22 1,22 1,22 1,22 1,22 1,22 8,57 1,22 C2G1 1,22 1,22 1,22 1,22 1,22 1,22 1,22 8,57 1,22 C2G2 1,22 1,22 1,22 1,22 1,22 1,22 1,22 8,57 1,22 C2G3 1,22 1,22 1,22 1,22 1,22 1,22 1,22 8,57 1,22 C2G4 1,22 1,22 1,22 1,22 1,22 1,22 1,22 8,57 1,22 C3G1 1,22 1,22 0,71 1,22 1,22 1,22 1,22 8,06 1,15 C3G2 1,22 1,22 1,22 1,22 1,22 1,22 1,22 8,57 1,22 C3G3 1,22 1,22 1,22 1,22 1,22 1,22 1,22 8,57 1,22 C3G4 1,22 1,22 1,22 1,22 1,22 1,22 1,22 8,57 1,22 TOTAL 14,70 14,70 14,18 14,70 14,70 14,70 14,70 102,36
RATAAN 1,22 1,22 1,18 1,22 1,22 1,22 1,22 1,22 Lampiran 7. Data Sidik Ragam Jumlah Tunas
ANOVA
SK db JK KT F.Hit 0,05 Ket
C 2 0,01 0,003 1,37 3,15 tn
G 3 0,01 0,003 1,40 2,76 tn
CxG 6 0,02 0,003 1,43 2,25 tn
Galat 72 0,19 0,003
Total 83 0,26
Lampiran 8. Data Pengamatan Panjang Tunas (cm)
Perlakuan ULANGAN
Total Rataan
1 2 3 4 5 6 7
C1G1 1,50 1,80 1,00 0,20 0,20 0,20 0,10 5,00 0,71 C1G2 2,10 1,80 0,90 0,50 0,50 1,60 0,20 7,60 1,09 C1G3 2,50 1,50 1,80 0,60 1,00 0,70 0,50 8,60 1,23 C1G4 2,20 1,20 0,70 0,60 0,40 0,20 0,30 5,60 0,80 C2G1 0,20 0,10 0,50 0,60 1,50 1,30 0,10 4,30 0,61 C2G2 3,40 1,50 0,50 0,20 0,50 0,70 0,30 7,10 1,01 C2G3 0,80 0,60 0,10 0,20 0,50 0,20 0,50 2,90 0,41 C2G4 0,20 0,20 0,20 0,50 0,20 0,30 0,20 1,80 0,26 C3G1 0,20 0,10 0,00 0,20 0,20 0,20 0,80 1,70 0,24 C3G2 0,20 0,20 0,10 0,80 0,20 0,20 0,20 1,90 0,27 C3G3 0,20 0,30 0,20 0,20 0,20 0,30 0,30 1,70 0,24 C3G4 0,20 0,20 0,30 0,20 0,30 0,30 0,30 1,80 0,26 TOTAL 13,70 9,50 6,30 4,80 5,70 6,20 3,80 50,00
Lampiran 9. Data Transformasi Panjang Tunas √x+ 0,5
Perlakuan ULANGAN
Total Rataan
1 2 3 4 5 6 7
C1G1 1,41 1,52 1,22 0,84 0,84 0,84 0,77 7,44 1,06 C1G2 1,61 1,52 1,18 1,00 1,00 1,45 0,84 8,60 1,23 C1G3 1,73 1,41 1,52 1,05 1,22 1,10 1,00 9,03 1,29 C1G4 1,64 1,30 1,10 1,05 0,95 0,84 0,89 7,77 1,11 C2G1 0,84 0,77 1,00 1,05 1,41 1,34 0,77 7,19 1,03 C2G2 1,97 1,41 1,00 0,84 1,00 1,10 0,89 8,22 1,17 C2G3 1,14 1,05 0,77 0,84 1,00 0,84 1,00 6,64 0,95 C2G4 0,84 0,84 0,84 1,00 0,84 0,89 0,84 6,08 0,87 C3G1 0,84 0,77 0,71 0,84 0,84 0,84 1,14 5,97 0,85 C3G2 0,84 0,84 0,77 1,14 0,84 0,84 0,84 6,10 0,87 C3G3 0,84 0,89 0,84 0,84 0,84 0,89 0,89 6,03 0,86 C3G4 0,84 0,84 0,89 0,84 0,89 0,89 0,89 6,09 0,87 TOTAL 14,54 13,17 11,84 11,31 11,67 11,85 10,78 85,15
RATAAN 1,21 1,10 0,99 0,94 0,97 0,99 0,90 1,01 Lampiran 10. Data Sidik Ragam Panjang Tunas
ANOVA
SK db JK KT F.Hit 0,05 Ket
C 2 1,34 0,67 12,86 3,15 **
G 3 0,24 0,08 1,52 2,76 tn
CxG 6 0,34 0,06 1,12 2,25 tn
Galat 72 1,83 0,03
Total 83 5,69
FK 86,30755
Lampiran 11. Data Pengamatan Jumlah Terbentuk bakal daun
Perlakuan ULANGAN
Total Rataan
1 2 3 4 5 6 7
C1G1 1 1 1 0 0 0 0 3 0,43
C1G2 1 1 1 0 1 1 0 5 0,71
C1G3 1 1 1 1 1 1 1 7 1,00
C1G4 1 1 1 1 1 0 0 5 0,71
C2G1 0 0 1 1 1 1 0 4 0,57
C2G2 1 1 0 0 0 1 0 3 0,43
C2G3 1 1 0 0 0 0 0 2 0,29
C2G4 0 0 0 1 0 0 0 1 0,14
C3G1 0 0 0 0 0 0 0 0 0,00
C3G2 0 0 0 1 0 0 0 1 0,14
C3G3 0 0 0 0 0 0 0 0 0,00
C3G4 0 0 0 0 0 0 0 0 0,00
TOTAL 6 6 5 5 4 4 1 31
Lampiran 12. Data Transformasi Terbentuknya Bakal Daun
Perlakuan ULANGAN
Total Rataan
1 2 3 4 5 6 7
C1G1 1,22 1,22 1,22 0,71 0,71 0,71 0,71 6,50 0,93 C1G2 1,22 1,22 1,22 0,71 1,22 1,22 0,71 7,54 1,08 C1G3 1,22 1,22 1,22 1,22 1,22 1,22 1,22 8,57 1,22 C1G4 1,22 1,22 1,22 1,22 1,22 0,71 0,71 7,54 1,08 C2G1 0,71 0,71 1,22 1,22 1,22 1,22 0,71 7,02 1,00 C2G2 1,22 1,22 0,71 0,71 0,71 1,22 0,71 6,50 0,93 C2G3 1,22 1,22 0,71 0,71 0,71 0,71 0,71 5,99 0,86 C2G4 0,71 0,71 0,71 1,22 0,71 0,71 0,71 5,47 0,78 C3G1 0,71 0,71 0,71 0,71 0,71 0,71 0,71 4,95 0,71 C3G2 0,71 0,71 0,71 1,22 0,71 0,71 0,71 5,47 0,78 C3G3 0,71 0,71 0,71 0,71 0,71 0,71 0,71 4,95 0,71 C3G4 0,71 0,71 0,71 0,71 0,71 0,71 0,71 4,95 0,71 TOTAL 11,59 11,59 11,07 11,07 10,56 10,56 9,00 75,44
RATAAN 0,97 0,97 0,92 0,92 0,88 0,88 0,75 0,90 Lampiran 13. Data Sidik Ragam Terbentuknya Bakal Daun
ANOVA
SK db JK KT F.Hit 0,05 Ket
C 2 1,73 0,86 20,84 3,15 **
G 3 0,09 0,03 0.90 2,76 tn
CxG 6 0,44 0,07 1.67 2,25 tn
Galat 72 0,73 0,01
Total 83 5,24
FK 67,75904
Lampiran 14. Data Pengamatan Jumlah Daun (helai)
Perlakuan ULANGAN
Total Rataan
1 2 3 4 5 6 7
C1G1 3,00 5,00 2,00 0,00 0,00 0,00 0,00 10,00 1,43 C1G2 8,00 3,00 6,00 0,00 3,00 2,00 0,00 22,00 3,14 C1G3 5,00 4,00 8,00 1,00 5,00 4,00 0,00 27,00 3,86 C1G4 6,00 4,00 3,00 1,00 2,00 0,00 0,00 16,00 2,29 C2G1 0,00 0,00 2,00 2,00 4,00 0,00 0,00 8,00 1,14 C2G2 9,00 3,00 0,00 0,00 0,00 1,00 0,00 13,00 1,86 C2G3 2,00 2,00 0,00 0,00 0,00 0,00 0,00 4,00 0,57 C2G4 0,00 0,00 0,00 1,00 0,00 0,00 0,00 1,00 0,14 C3G1 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 C3G2 0,00 0,00 0,00 3,00 0,00 0,00 0,00 3,00 0,43 C3G3 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 C3G4 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 0,00 TOTAL 33,00 21,00 21,00 8,00 14,00 7,00 0,00 104,00
Lampiran 15. Data Transformasi Jumlah Daun √x+ 0,5
Perlakuan ULANGAN
Total Rataan
1 2 3 4 5 6 7
C1G1 1,87 2,35 1,58 0,71 0,71 0,71 0,71 8,63 1,23 C1G2 2,92 1,87 2,55 0,71 1,87 1,58 0,71 12,20 1,74 C1G3 2,35 2,12 2,92 1,22 2,35 2,12 0,71 13,78 1,97 C1G4 2,55 2,12 1,87 1,22 1,58 0,71 0,71 10,76 1,54 C2G1 0,71 0,71 1,58 1,58 2,12 0,71 0,71 8,11 1,16 C2G2 3,08 1,87 0,71 0,71 0,71 1,22 0,71 9,01 1,29 C2G3 1,58 1,58 0,71 0,71 0,71 0,71 0,71 6,70 0,96 C2G4 0,71 0,71 0,71 1,22 0,71 0,71 0,71 5,47 0,78 C3G1 0,71 0,71 0,71 0,71 0,71 0,71 0,71 4,95 0,71 C3G2 0,71 0,71 0,71 1,87 0,71 0,71 0,71 6,11 0,87 C3G3 0,71 0,71 0,71 0,71 0,71 0,71 0,71 4,95 0,71 C3G4 0,71 0,71 0,71 0,71 0,71 0,71 0,71 4,95 0,71 TOTAL 18,59 16,15 15,45 12,08 13,58 11,29 8,49 95,62
RATAAN 1,55 1,35 1,29 1,01 1,13 0,94 0,71 1,14 Lampiran 16. Data Sidik Ragam Jumlah Daun
ANOVA
SK db JK KT F.Hit 0,05 Ket
C 2 11,00 5,50 17,25 3,15 **
G 3 1,25 0,42 1,31 2,76 tn
CxG 6 1,99 0,33 1,04 2,25 tn
Galat 72 8,68 0,14
Total 83 37,16
FK 108,8381
Lampiran 17. Komposisi Media MurashigedanSkoog (MS)
(Sumber: Gunawan, 1995)
Bahan Kimia Konsentrasi Media (mg/l)
Makro Nutrien (Stok I)
NH4 NO3 1650,000
KNO3
CaCl2.2H2O
MgSO4.7H2O
1900,000 440,000 370,000
KH2PO4 170,000
Mikro Nutrien (Stok II) MnSO4.H2O
ZnSO4.7H2O
H3BO3
6,900 8,600 6,200
KI 0,830
Na2MoO4.2H20 0,250
CuSO4.5H2O 0,025
CoCl2.6H2O
Iron (Stok III)
0,025
FeSO4.7H2O 27,800
Na2.EDTA 37,200
Vitamin (Stok IV)
Nikotinic acid 0,500
Pyridoxin HCL 0,500
Thiamine HCL 0,100
Myo-inositol 100,000
Sukrosa Agar
Lampiran 18. Bagan Penelitian
I II III IV V VI VII
C1G1 C1G4 C1G2 C2G2 C1G1 C2G3 C1G3
C2G3 C2G2 C3G1 C2G4 C3G1 C2G1 C3G1
C3G2 C1G2 C2G3 C1G2 C3G2 C1G4 C3G3
C1G3 C2G1 C3G3 C3G2 C2G2 C2G4 C2G2
C3G1 C3G2 C1G1 C3G3 C1G3 C3G1 C1G1
C1G4 C3G1 C2G4 C1G4 C2G4 C3G2 C3G2
C2G4 C1G3 C2G1 C3G4 C1G4 C1G2 C3G3
C2G3 C2G3 C3G2 C1G2 C3G4 C3G3 C1G4
C1G1 C1G1 C3G1 C2G2 C2G4 C2G2 C2G3
C3G3 C2G2 C1G2 C2G3 C1G1 C3G4 C2G1
C1G2 C2G4 C3G4 C3G4 C2G1 C1G4 C1G2
Lampiran 19. Kegiatan Penelitian
Jenis Kegiatan Minggu ke –
1 2 3 4 5 6 7 8
Sterilisasi Alat X
Pembuatan Media X
Pengambilan Bahan Tanaman X
Sterilisasi Bahan Tanaman X
Persiapan Ruang Tanam X
Penanaman X
Pemeliharaan Eksplan X X X X X X
Peubah amatan
- Persentase Munculnya Tunas (%) X
- Umur Munculnya Tunas (hari) X
- Jumlah Tunas (tunas) X
- Panjang Tunas (cm) X
- Jumlah Terbentuknya Bakal Daun X
- Jumlah Daun (helai) X
- Kehadiran Kalus (visual) X
- Warna Kalus X
Lampiran 20. Lampiran Foto Penelitian
C1G1 C1G2
C2G1 C2G2
C3G1 C3G2
DAFTAR PUSTAKA
Abbas, B.S., S. Ginting. 1981. Influence of Rootstock and Scion on Girth Increment in Rubber Trees. Buletin Balai Penelitian Perkebunan Medan12, 145-152.
Abo , M.M. 1977. Organogenesis and Organogenesis and Embryogenesis in Callus Culture of Garlic (Allium sativum L) . Plant Sci. Letter. 9:259-264. Altman, A., B. Loberant. 1998. Micropropagation: clonal plant propagation in
vitro, p. 19-34. In: A. Altman (Ed.) Agricultural Biotechnology. Marcel Dekker Inc. New York.
Anwar. 2006. Perkembangan Pasar dan Prospek Agribisnis Karet di Indonesia. Lokakarya Budidaya Tanaman Karet. Pusat Penelitian Karet. Medan. 2p. Ariany, S. P., Nirwan, S., Abdul, S. 2013. Pengaruh Kuantitas Cahaya Terhadap
Pertumbuhan Dan Kadar Antosianin Daun Dewa (Gynura pseudochina (L.) DC) Secara In Vitro. e-J. Agrotekbis 1 (5) : 413 – 420.
Armini, N. M., G. A. Wattimena ., L. Gunawan. 1991. Bioteknologi Tanaman. Tim Laboratorium Kultur Jaringan. Pusat Antar Universitas Bioteknologi. IPB. Bogor. 455 hal.
Benny, Lahmuddin, L., Syahrial, O., Zaidah, F.2013. Uji Dosis Dan Cara
Aplikasi Biofungisida Bacillus sp. Terhadap Penyakit Jamur Akar Putih (Rigidoporus lignosus) Pada Tanaman Karet
Di Pembibitan. Fakultas Pertanian Universitas Sumatera Utara, Medan. Bewley, J. D., M. Black. 1982. Seeds: Physiology of Development and
Germination. Plenum Press. London. 418 p.
Budiman, H., 2012. BudidayaKaretUnggulProspekJituInvestasiMasaDepan. PustakaBaru Press, Yogyakarta.
Carron, M.P.dan F. Enjalric. 1983. Perspectives du micro bouturage de l’Hevea brasiliensis. Caoutchoucs et Plastiques 627-628, 65-68.
Cresswell, R D, Bouiary, M ., Franclet A (1982). Vegetative propagation of Eucalyptus.In: Tissue culture in Forestry, pp. 150-180 (Eds. J M Bonga and D J Durzon).Martinus Nijhott/Dr.W Junk publishers.
Djumat, J. L. 2014. Multiplikasi In Vitro Samama (Anthocephalus macrophyllus (ROBX).HAVIL) Melalui Tunas Pucuk Dan Tunas Aksilar. Fakultas Kehutanan UNIDAR, Ambon.
Gunawan, L.W., 1995. Teknik Kultur Jaringan In Vitro dalam Hortikultura. Penebar Swadaya. Jakarta.
George, E. F., P. D. Sherrington. 1984. Plant Propagation by Tissue Culture. Exegetics Limited. England.
Gunnatilleke, I.D., Samaranayake. C.. 1988. Shoot Tip Culture as a Method of Micropropagation of Hevea. Rubber Research Institute Agalawatta. Journal of the Rubber Research Institute of Sri Lanka. 68pp. 33-34.
Harahap, P. S., L. A. M. Siregar ., Y. Husni. 2015. Kajian Awal : Respon Eksplan Nodus dalam Inisiasi Tunas Mikro Tanaman Karet (Hevea brasiliensis Muell Arg.) dalam Medium MS. Jurnal Online Agroekoteknologi. Vol.3(1) : 229 – 237.
Haris, N. 2013. Batang Bawah Klonal : Apakah Mungkin Pada Tanaman Karet ?. www.ibriec.org.juli 2013 1(1)
Haris, N., Sumaryono ., M.P. Carron., 2009. Pengaruh Bahan pra-sterilan, Tutup Tabung Kultur, dan Terhadap Tingkat Kontaminasi Eksplan pada Kultur Microcutting Karet. Menara Perkebunan, 2009 77(2), Hal 89-99.
Hendaryono, D. P. S ., A. Wijayani. 1994. Teknik Kultur Jaringan, Pengenalan dan Petunjuk Perbanyakan Secara Vegetatip. Kanisius, Yogyakarta.
Hoesen, D. S. H. 2009. Pembentukan Tunas Lilium sp. Secara Ex Vitro Dan In Vitro. J. Tek. Ling Vol. 10 No. 2 Hal. 183 - 193 Jakarta, Mei 2009 ISSN 1441-318X.
Hooley, R. 1994. Gibberellins : perception, transduction and responses. Plant Molecular Biology 26: 1529-1555.
Jumroh, P.H. 2013. Pengaruh Periode Subkultur Terhadap Mikropropagasi Puar Tenangau (Elettariopsis sp.).Fakultas Pertanian. Universitas Sumatera Utara, Medan.
Kosmiatin, M., A. Husni, I. Mariska. 2005. Perkecambahan dan perbanyakan Gaharu secara In Vitro. Jurnal Agrobiogen 1(2). Oktober 2005.
Kurilcik, A., Dapkuniene, S., Kurilcik, G., Zilinskaite, S., Zukauskas, A., P. Duchovskis. 2008. Effect Of The Photoperiod Duration On The Growth Of Chrysanthemum Plantlets In Vitro. Scientific Works Of The Lithuanian Institute Of Horticulture And Lithuanian University Of Agriculture. 27(2). Lawalata, I.J. 2013. Application of GA3 and Sucrose on Vegetative Growth of
Mitrovic1, A., Giba, Z ., L. Culafic. 2007. The Photoperiodic Control Of Growth And Development of Chenopodium Rubrum L. Plants In Vitro. Arch. Biol. Sci., Belgrade, 59 (3), 203-208.
Montoro P, MP Carron, L Lardet, A Clement-Demange, J Leclercq. 2010. Biotechnologies of rubber tree (Hevea brasiliensis). Aus Pac J Mol Biol Biotechnol 18(1), 81-83.
Muslihatin, W. 2009. Pertumbuhan dan Keragaan Planlet Sagu (Metroxylon sagu Rottb)pada Medium dengan Berbagai Sumber Karbohidrat dan Intensitas Cahaya yangBerbeda. Tesis Sekolah Pascasarjana, Institut Pertanian Bogor.
Nayanakantha NMC., P Seneviratne (2007). Tissue culture of rubber: past, present and future prospects. Ceylon J Sci 36(2), 116-125.
Padilla, I. M. G. , C. L. Encina. 2002. In vitro germination of cherimoya (Annona cherimola Mill.) seeds.
Pancholi, N., A. Wetten, P. D. S. Caligari. 1995. Germination of Musa veluntia seeds: comparison of in vivo and in vitro systems. In vitro cellular and developmental biology 31: 127-130.
Pieterse, A. H. 1981. Germination of Orobanche crenata Forsk. seeds in vitro. Weed Research 26(6): 279-287.
Rahmawati, M.S. 2008. Pengaruh BAP DAN GA3 Terhadap Perkecambahan Heliconia caribaea Lam. Secara In Vitro. Fakultas Pertanian Institut Pertanian Bogor.
Salisbury, F. B., C. W. Ross. 1992. Plant Physiology. 4th edition. Belmont, California : Wadsworth Publishing Company.
Santoso, U., F. Nursandi, 2001. Kultur Jaringan Tanaman. Penerbit UMM, Malang.
Seneviratna, P., G. A. S. Wijesekera. 1997. Effect Of GA3, On The Growth Of
Axillary Buds Of Hevea Brasilliensis In Vitro. Journal Of Yhe Rubber Research Institute Of Sri Lanka, 80, 37-44.
Setiawan, H.D. ,A Andoko. 2005. Petunjuk Lengkap Budidaya Karet(edisi revisi). Agromedia Pustaka. Jakarta.
Setyamidjaja, D., 1993. Karet Budidaya dan Pengelolaan. Kanisius, Yogyakarta.
Siburian, O. 2012. Analisis Faktor-Faktor Yang Mempengaruhi Ekspor Karet Alam Indonesia Ke Singapura Tahun 1980-2010. Fakultas Ekonomi Universitas Negeri Semarang.
Steel, R.G., J.H. Torrie, 1993. Prinsip Dan Prosedur Statiska (Pendekatan Biometric) Penerjemah B. Sumantri. Gramedia Pustaka Utama, Jakarta. Steenis, C. G. G. K. 2005. Flora. PT. Pradnya Paramita. Jakarta.
Sundari, L., Siregar, L. A. M.,Hanafiah, D. S. 2015. Kajian Awal : Respon
Eksplan Nodus dalam Inisiasi Tunas Mikro Tanaman Karet (Hevea brasiliensis Muell Arg.) dalam Medium WPM. Jurnal Online
Agroekoteknologi. 3(1): 4-5.
Syamsulbahri. 1996. Bercocok Tanam Tanaman Perkebunan Tahunan. Fakultas Pertanian Universitas Brawijaya. Malang.
Thomas, T. D. 2006. Effect of sugars, gibberellic acid and somatic embryogenesis in Tylophora indica (Burm. f.) Merrill. Chinese Journal of Biotechnology 22(3):465-471.
Wattimena, G.A;L.W. Gunawan; N. A. Mattjik; Endang. S; N.M. A. Wiendi., Andri. E. 1992. Bioteknologi Tanaman. Penerjemah Ahmad Sukarti Abidin. Pusat Antar Universitas Bioteknologi IPB: Bogor.
Wetherell, D. F. 1982. Pengantar Propagasi Tanaman secara In Vitro Seri KulturJaringan Tanaman. Avery Publishing Group, Inc. Wayne – NewJersey.
Widyastuti, N. 2002. Pengaruh Intensitas Cahaya Terhadap Multiplikasi Kultur Tanaman Secara In Vitro. Seminar Nasional Penerapan Teknologi Kendali dan Instrumentasi Pertanian.
Yusnita., 2003. Kultur Jaringan. Cara Memperbanyak Tanaman Secara Efisisen. Cetakan Ketiga. Agro Media Pustaka. Jakarta.
Yuwono, T. 2008. Bioteknologi Pertanian. Gadjah mada University Press: Yogyakarta.
BAHAN DAN METODE Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Microcutting Tanaman Karet PT. Perkebunan Nusantara III Kebun Gunung Pamela Tebing Tinggi, Sumatera Utara, Indonesia. Penelitian ini dimulai pada bulan April 2015 sampai dengan Juli 2015.
Bahan dan Alat Penelitian
Bahan eksplan yang digunakan dalam penelitian ini adalah tunas dari bahan tanaman karet yang di tanam di rumah kasa, komposisi media yang digunakan larutan stok media WPM sebagai media tumbuh tanaman dengan BAP dan GA3 sebagai zat pengatur tumbuh (ZPT) yang digunakan, eksplan yang digunakan berasal dari beberapa klon yang merupakan koleksi PTPN III dengan satu jenis klon dengan panjang 1,5 – 2 cm. Pada media WPM ditambahkan dengan 0,5 mg/l BAP, agar, aquadest steril, dan bahan lainnya yang mendukung penelitian ini.
Alat yang digunakan dalam penelitian ini adalah Laminar Air Flow Cabinet (LAFC), tabung uji, autoklaf, steri box, timbangan analitik, rak kultur,
hot plate dengan magnetik stirer, erlenmeyer, gelas ukur, kaca tebal, pipet ukur, pinset, gunting, scalpel, lampu bunsen, pH meter, oven, kertas plano, aluminium foil, kompor gas, minisar, mikropipet, tip, pipet tetes, dan alat-alat lainnya yang mendukung penelitian ini.
Metode Penelitian
Faktor I : Lama penyinaran dengan 3 taraf C1 : 12 jam terang, 12 jam gelap C2 : 24 jam terang
C3 : 24 jam gelap
Faktor II : Perendaman nodus sebelum pengkulturan dengan 4 taraf selama dua setengah jam
G1 : 0 mg/lGA3
G2 : 5 mg/lGA3
G3 : 10 mg/lGA3
G4 : 15 mg/lGA3
Sehingga diperoleh kombinasi perlakuan sebagai berikut: C1G1 C2G1 C3G1
C1G2 C2G2 C3G2 C1G3 C2G3 C3G3 C1G4 C2G4 C3G4
Jumlah perlakuan : 12
Jumlah ulangan : 6
Jumlah eksplan tiap tabung uji : 1 Jumlah seluruh eksplan : 72 Jumlah seluruh tanaman : 72
Adapun model liner dari sidik ragam penelitian sebagai berikut: Yijk = µ + αi + βj + (αβ)ij + ε ijk
Yijk = Nilai pengamatan unit percobaan pada perlakuan lama penyinaran ke-i,
konsentrasi perendaman giberelin sebelum pengkulturan ke-j, dan ulangan ke-k
µ = Nilai tengah umum
αi = Pengaruh lama penyinaran ke-i
βj = Pengaruh konsentrasi perendaman giberelin sebelum pengkulturan ke-j (αβ)ij = Nilai tambah pengaruh interaksi lama penyinaran ke-i dankonsentrasi
perendaman giberelin ke-j Εijk = Galat percobaan
PELAKSANAAN PENELITIAN Sterilisasi Alat-Alat
Sebelum semua alat-alat disterilisasi dan alat-alat kaca digunakan untuk kultur in vitro maka terlebih dahulu dicuci dan dikeringkan. Kemudian bungkus tabung dengan plastik tahan panas atau letakkan pada rak tabung, sedangkan untuk botol biasanya bisa langsung diletakkan pada autoklaf. Disterilkan tabung/botol dengan autoklaf pada suhu 121oC dengn tekanan 17,5 psi selama 60 menit. Setelah itu sterilkan secara kering tabung/botol di dalam oven pada suhu 150oC selama 1-2 jam.
Pembuatan Media
Media yang digunakan dalam penelitian ini adalah mediaWoody Plant Medium (WPM). Sebelum dilakukan pembuatan media WPM, dilakukan pembuatan larutan stok hormon BAP dan GA3. Larutan stok hormon
masing-masing dibuat 100mg/100ml. Kemudian larutan stok BAP dan GA3 disaring
menggunakan minisar guna meningkatkan sterilitas dari hormon tersebut dan dilakukan di Laminar Air Flow Cabinet (LAFC).
ditepatkan menjadi 3200ml dengan menambahkan akuades. Keasaman diukur dengan pH meter. pH yang dikehendaki adalah 5,8, untuk mengatur pH yaitu menaikkan atau menurunkan pH dapat digunakan larutan KOH dan HCl 0,1 N. Ditambahkan agar biotek dan dimasak di atas kompor gas sampai larutan mendidih dan bening (semua agar telah larut). Larutan dipindahkan ke erlenmeyer berukuran 5000ml dan ditutup dengan aluminium foil dan diikat dengan tali plastik. Kemudian media WPM di sterilisasi dengan tekanan 17,5 psi pada suhu 121°C selama 20 menit di autoklaf. Setelah proses sterilisasi selesai, media dimasukkan ke ruang kultur dan dimasukkan keLaminar Air Flow Cabinet (LAFC). Teteskan BAP dan GA3 ke masing-masing tabung uji sesuai perlakuan.
Dituangkan media ke dalam tabung uji berisikan 13ml/tabung dan ditutup kain kasa steril yang dibalut dan diikat benang. Sehingga diperoleh ± 246 tabung uji. Tabung uji diberi label sesuai dengan perlakuan. Selanjutnya disimpan dalam ruang kultur sebelum digunakan.
Pembuatan Media Perendaman Nodus
Pada pembuatan media perendaman nodus, dimasukkan akuades 2500ml kedalam erlenmeyer. Kemudian media disterilisasi dengan tekanan 17,5 psi pada suhu 1210C selama 20 menit diautoklaf. Setelah proses sterilisasi selesai, media dimasukkan keruang kultur dan dimasukkan ke Laminar Air Flow Cabinet (LAFC). Larutan dipindahkan ke 4 erlenmeyer berukuran 2000ml yang masing-masing erlenmeyer berisi 625ml dan ditutup dengan almunium foil dan diikat dengan karet. Teteskan GA3 ke masing-masing tabung uji sesuai perlakuan.
dari setiap perlakuannya. Tabung uji diberi label sesuai dengan perlakuan. Selanjutnya disimpan dalam ruang kultur sebelum digunakan.
Sterilisasi Bahan Tanaman di Lapangan
Bahan tanaman berasal dari rumah kasa tanaman karet PT. Perkebunan Nusantara III, Kebun Gunung Pamela. Sterilisasi lapangan ialah dengan memberikan fungisida (dithane) yang dicampurkan dengan air, kemudian dioleskan pada bahan tanaman yang akan dijadikan eksplan di rumah kaca dengan menggunakan kuas. Ditunggu selama 1 malam untuk fungisida bereaksi mencegah jamur pada bahan tanaman. Dipotong bahan tanaman yang akan dijadikan eksplan keesokan paginya dan diberi label.
Pengambilan Bahan Tanaman
Bahan tanaman yang digunakan ialah yang telah diberikan fungisida dithane. Bahan tanaman yang digunakan ialah bibit karet yang telah latern(daun terbuka sempurna) dan berwarna hijau terang, batang tanaman kokoh dan berwarna hijau, serta berpayung dua. Batang bawah dari tanaman karet itu sendiri berasal dari seedling karet pendukung klon tertentu yang selanjutnya diokulasi Bagian yang diambil ialah nodus yang terdapat dari setiap batang tersebut. Pengambilan dilakukan pada pagi hari dengan menggunakan gunting.
Sterilisasi Bahan Tanaman di Laboratorium
selama 20 menit. Setelah selesai larutan tersebut dibuang, tabung toples diisi akuades dan diguncang selama 1 menit dan dibuang kembali. Rendam kembali eksplan dengan akuades di dalam tabung toples selama 2 x 15 menit. Kemudian air tersebut dibuang dari tabung toples. Eksplan sudah siap untuk ditanam.
Persiapan Ruang Tanam
Seluruh permukaan laminar air flow cabinet sebelumnya dibersihkan terlebih dahulu dengan di lap menggunakan alkohol 96% lalu di sterilkan dengan sinar Ultra Violet selama 1 jam sebelum proses penanaman dilakukan. Semua alat dan bahan yang akan dipakai harus disemprot dengan alkohol 96% dan beberapa alat seperti pinset, gunting, scalpel setelah disemprot lalu dibakar di dalam ke dalam laminar air flow cabinet selama 1 menit. Hal ini dilakukan untuk menghindari resiko bahan penelitian terkontaminasi. Steri box dihidupkan dan disediakan alkohol 70% untuk membersihkan alat yang telah digunakan.
Perendaman Nodus
Perendaman nodus dilakukan sebelum penanaman. Nodus diambil kemudian dimasukkan ke tabung uji masing-masing perlakuan perendaman yang berisi akuades dengan penambahan GA3 sesuai konsentrasi setiap masing-masing
perlakuan ke dalam tabung uji. Lama perendaman nodus sebagai perlakuan dilakukan selama 2 jam 30 menit.
Penanaman
berisikan media sebanyak 13ml/tabung uji. Eksplan yang digunakan berukuran1,5-2 cm, apabila ukuran eksplan belum sesuai maka dipotong menggunakan gunting steril dan tajam. Eksplan yang akan dikulturkan ke dalam media tanam diletakkan di piringan kaca tebal dengan alas kertas plano. Kemudian eksplan ditanamkan ke dalam tabung uji sesuai dengan perlakuan, setiap tabung uji terdiri dari 1 eksplan. Kemudian ujung tabung uji ditutup dengan menggunakan kain kasa steril yang dibalut dan diikat benang. Kegiatan penanaman dilakukan di dalam Laminar Air Flow Cabinet (LAFC) dan di bawah api bunsen. Tabung uji diletakkan di rak kultur di bawah cahaya dan ruangan memiliki air conditioner dengan suhu 18oC.
Pemeliharaan Eksplan
Peubah Amatan
Umur Muncal Tunas (hari)
Umur muncul tunas dihitung dari awal penanaman hingga terbentuknya tunas dalam satuan hari.
Persentase Terbentuknya Tunas (%)
Persentase terbentuknya tunas dihitung pada akhir penelitian (6 MST) dengan rumus:
Persentase terbentuknya tunas = jumlah tunas yang terbentuk x 100% jumlah eksplan seluruhnya (perperlakuan) Jumlah Tunas (tunas)
Dihitung pada akhir penelitian dengan menghitung banyaknya tunas baru yang terbentuk dari setiap eksplan
Panjang Tunas (cm)
Panjang tunas diukur pada tunas tertinggi dengan menggunakan kertas milimeter yang diukur dari tempat munculnya tunas (pangkal) sampai ujung tunas tertinggi. Pengukuran dilakukan pada akhir penelitian.
Jumlah Terbentuk Bakal Daun
Jumlah daun dihitung dari bakal daun yang terbentuk pada eksplan. Pengamatan dilakukan pada akhir penelitian. Jumlah terbentuknya bakal daun dihitung pada akhir penelitian dengan rumus:
Persentase terbentuknya daun = jumlah bakal daun yang terbentuk jumlah eksplan seluruhnya (per perlakuan) Jumlah Daun (helai)
Kehadiran Kalus (visual)
Kehadiran kalus dilihat dari ada atau tidaknya kemunculan kalus dari tunas-tunas samping yang bersifat positif atau negatif bagi penelitian. Dilihat pada akhir percobaan.
Warna Kalus (visual)
Kehadiran warna kalus dilihat dari ada atau tidaknya kemunculan warna yang berbeda atau tidak dari kalus. Dilihat pada akhir percobaan.
Morfogenesis
HASIL DAN PEMBAHASAN Hasil
Berdasarkan hasil analisis data yang dilakukan, diperoleh bahwa perlakuan lama penyinaran memberikan pengaruh sangat nyata terhadap panjang tunas, jumlah terbentuk bakal daun, dan jumlah daun. Pada perlakuan perendaman dengan GA3 dan interaksi antara lama penyinaran dan GA3 belum memberikan pengaruh yang nyata terhadap terhadap persentase munculnya tunas, jumlah tunas, panjang tunas, jumlah terbentuk bakal daun, dan jumlah daun.
Umur Munculnya Tunas (hari)
Hasil pengamatan terhadap parameter umur munculnya tunas pada perlakuan lama penyinaran dan GA3 (Lampiran 1). Rataan umur munculnya tunas dari perlakuan lama penyinaran dan GA3 dapat dilihat pada Tabel 1.
Tabel 1. Pengaruh perlakuan lama penyinaran dan GA3 terhadap umur munculnya tunas (hari) 6 MST.
Perlakuan GA3 Rataan
G1 G2 G3 G4
C1 25,00 25,00 23,00 24,00 24,25
C2 26,00 24,00 24,00 24,00 24,50
C3 23,00 26,00 23,00 24,00 24,00
Rataan 24,67 25,00 23,33 24,00 24,25
Keterangan: Perlakuan C1=12 jam terang 12 jam gelap; C2=24 jam terang; C3=24 jam gelap. Perlakuan G1: 0 mg/l GA3, G2: 5 mg/l GA3, G3: 10 mg/l GA3, G4: 15 mg/l GA3.
Persentase Munculnya Tunas (%)
Hasil pengamatan serta sidik ragam pada perlakuan lama penyinaran dan GA3 serta interaksi antara perlakuan lama penyinaran dan GA3 (Lampiran 2-4) belum memberikan pengaruh yang nyata terhadap persentase munculnya tunas pada 6 MST.
Tabel 2. Pengaruh perlakuan lama penyinaran dan GA3 terhadap persentase munculnya tunas (%) 6 MST.
Pencahayaan GA3 Rataan
G1 G2 G3 G4
C1 100,00 100,00 100,00 100,00 100,00
C2 100,00 100,00 100,00 100,00 100,00
C3 85,71 100,00 100,00 100,00 96,43
Rataan 95,24 100,00 100,00 100,00 98,81
Keterangan: Perlakuan C1=12 jam terang 12 jam gelap; C2=24 jam terang; C3=24 jam gelap. Perlakuan G1: 0 mg/l GA3, G2: 5 mg/l GA3, G3: 10 mg/l GA3, G4: 15 mg/l GA3.
[image:33.595.112.516.115.213.2]Gambar eksplan sesudah membentuk tunas pada salah satu perlakuan dapat dilihat pada Gambar 1.
Gambar 1. Eksplan setelah membentuk tunas ( 6 MST )
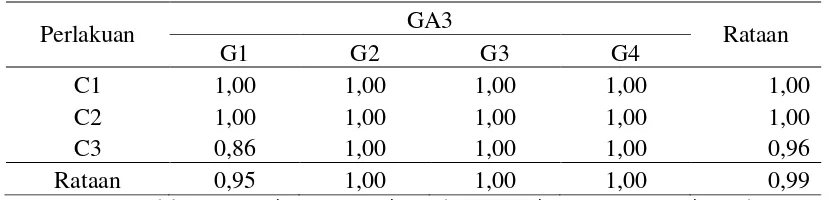
Jumlah Tunas ( Tunas )
Hasil pengamatan terhadap parameter jumlah tunas pada perlakuan lama penyinaran dan GA3 serta interaksi antara perlakuan lama penyinaran dan GA3 (Lampiran 5-7) belum memberikan pengaruh yang nyata pada 6 MST
Rataan jumlah tunas dari perlakuan lama penyinaran dan GA3 dapat dilihat pada Tabel 3.
[image:33.595.235.392.299.523.2]tunas (tunas) 6 MST.
Perlakuan GA3 Rataan
G1 G2 G3 G4
C1 1,00 1,00 1,00 1,00 1,00
C2 1,00 1,00 1,00 1,00 1,00
C3 0,86 1,00 1,00 1,00 0,96
Rataan 0,95 1,00 1,00 1,00 0,99
Keterangan: Perlakuan C1=12 jam terang 12 jam gelap; C2=24 jam terang; C3=24 jam gelap. Perlakuan G1: 0 mg/l GA3, G2: 5 mg/l GA3, G3: 10 mg/l GA3, G4: 15 mg/l GA3.
Panjang Tunas (cm)
Hasil pengamatan serta sidik ragam terhadap parameter panjang tunas pada perlakuan lama penyinaran (Lampiran 8-10) menunjukkan pengaruh sangat nyata, sedangkan GA3 serta interaksi antara perlakuan lama penyinaran dan GA3 belum memberikan pengaruh yang nyata terhadap panjang tunas.
Rataan panjang tunas lama penyinaran dan GA3 dapat dilihat pada Tabel 4. Tabel 4. Pengaruh perlakuan lama penyinaran dan GA3 terhadap panjang tunas
(cm) 6 MST.
Perlakuan GA3 Rataan
G1 G2 G3 G4
C1 0,71 1,09 1,23 0,80 0,96a
C2 0,61 1,01 0,41 0,26 0,58b
C3 0,24 0,27 0,24 0,26 0,25c
Rataan 0,52 0,79 0,63 0,44 0,60
Keterangan : Angka-angka yang diikuti huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata pada Uji Jarak Berganda Duncan pada taraf 5%.
Perlakuan C1=12 jam terang 12 jam gelap; C2=24 jam terang; C3=24 jam gelap. Perlakuan G1: 0 mg/l GA3, G2: 5 mg/l GA3, G3: 10 mg/l GA3, G4: 15 mg/l GA3.
[image:34.595.105.519.100.200.2] [image:34.595.110.520.427.542.2]Gambar panjang tunas eksplan pada salah satu perlakuan dapat dilihat pada Gambar 2.
Gambar 2. Panjang Tunas ( 6 MST ) pada C2G2 (24 jam terang +5 mg/l GA3)
Jumlah Terbentuk Bakal Daun
Hasil pengamatan serta sidik ragam terhadap parameter jumlah terbentuk bakal daun pada perlakuan lama penyinaran (Lampiran 11-13) menunjukkan pengaruh sangat nyata, sedangkan GA3 serta interaksi antara perlakuan lama penyinaran dan GA3 belum memberikan pengaruh yang nyata terhadap jumlah terbentuk bakal daun.
[image:35.595.232.392.139.364.2]Gambar 3. Eksplan Membentuk Bakal Daun pada C1G2 (12 jam terang 12 jam gelap +5 mg/l GA3)
[image:36.595.109.518.444.539.2]Rataan jumlah terbentuk bakal daun dari perlakuan lama penyinaran dan GA3 dapat dilihat pada Tabel 5.
Tabel 5. Pengaruh perlakuan lama penyinaran dan GA3 terhadap jumlah terbentuk bakal daun6 MST.
Perlakuan GA3 Rataan
G1 G2 G3 G4
C1 0,43 0,71 1,00 0,71 0,71a
C2 0,57 0,43 0,29 0,14 0,36b
C3 0,00 0,14 0,00 0,00 0,04c
Rataan 0,33 0,43 0,43 0,29 0,37
Keterangan : Angka-angka yang diikuti huruf yang sama pada baris dan kolom yang sama menunjukkan berbeda nyata pada Uji Jarak Berganda Duncan pada taraf 5%. Perlakuan C1=12 jam terang 12 jam gelap; C2=24 jam terang; C3=24 jam gelap. Perlakuan G1: 0 mg/l GA3, G2: 5 mg/l GA3, G3: 10 mg/l GA3, G4: 15 mg/l GA3.
Jumlah Daun (helai)
[image:37.595.265.404.241.424.2]Hasil pengamatan serta sidik ragam terhadap parameter jumlah daun pada perlakuan lama penyinaran (Lampiran 14-16) menunjukkan pengaruh sangat nyata, sedangkan GA3 serta interaksi antara perlakuan lama penyinaran dan GA3 belum memberikan pengaruh yang nyata terhadap jumlah daun. Gambar eksplan membentuk daun dapat dilihat pada Gambar 4.
Gambar 4. Eksplan Membentuk Daun pada C1G1 (12 jam terang 12 jam gelap +5 mg/l GA3)
Rataan jumlah daun dari perlakuan lama penyinaran dan GA3 dapat dilihat pada Tabel 6.
Tabel 6. Pengaruh perlakuan lama penyinaran dan GA3 terhadap jumlah daun (helai) 6 MST.
Perlakuan GA3 Rataan
G1 G2 G3 G4
C1 1,43 3,14 3,86 2,29 2,68a
C2 1,14 1,86 0,57 0,14 0,93b
C3 0,00 0,43 0,00 0,00 0,11c
Rataan 0,86 1,81 1,48 0,81 1,24
Keterangan : Angka-angka yang diikuti huruf yang sama pada baris dan kolom yang sama menunjukkan berbeda nyata pada Uji Jarak Berganda Duncan pada taraf 5%. Perlakuan C1=12 jam terang 12 jam gelap; C2=24 jam terang; C3=24 jam gelap. Perlakuan G1: 0 mg/l GA3, G2: 5 mg/l GA3, G3: 10 mg/l GA3, G4: 15 mg/l GA3.
[image:37.595.107.519.557.657.2]rataan (0,96) cm dan terendah pada perlakuan C3 (24 jam gelap) dengan rataan (0,25) cm. Perlakuan lama penyinaran dengan perlakuan C1 berbeda nyata dengan perlakuan C2 dan C3 (Lampiran 17-19).
[image:38.595.117.515.335.533.2]Data pada Tabel 7, menunjukkan rangkuman berdasarkan hasil penelitian. Lama penyinaran memberikan pengaruh sangat nyata terhadap panjang tunas, jumlah terbentuk bakal daun, dan jumlah daun. Pada perlakuan perendaman dengan GA3 dan interaksi antara lama penyinaran dan GA3 belum memberikan pengaruh yang nyata terhadap semua peubah amatan.
Tabel 7. Tabel 7. Rekapitulasi Peubah Amatan Sidik Ragam pada Induksi Tunas Mikro Tanaman Karet Pada Lama Penyinaran dan GA3 6 MST.
Peubah Amatan Perlakuan
C G C x G
Umur Muncul tunas (hari)a tn tn tn
Persentase Munculnya Tunas (%)a tn tn tn
Jumlah Tunas (tunas)a tn tn tn
Panjang Tunas (cm)a ** tn tn
Jumlah terbentuk bakal Dauna ** tn tn
Jumlah Daun (helai)a ** tn tn
Kehadiran Kalus Tidak ada Tidak ada Tidak ada
Warna Kalus Tidakkada Tidak ada Tidak ada
Morfogenesis Tidak ada Tidak ada Tidak ada
Keterangan: C = Lama Penyinaran **= sangat nyata pada taraf 5 %
G = GA3 tn = tidak nyata
CxG = interaksi lama penyinaran dengan GA3 a = transformasi data
Kehadiran Kalus
Pada semua kultur yang dilakukan tidak ada satu pun yang menunjukkan kehadiran kalus. Ketidakhadiran kalus pada tunas mikro tanaman karet merupakan hal yang diharapkan dalam penelitian ini, sebab microcutting pada tahap primary culture merupakan tahapan awal sehingga tidak diharapkan kehadiran kalus dan hingga akhir penelitian tidak ditemukan kehadiran kalus.
Karena tidak ada kalus yang terbentuk hingga akhir penelitian menyebabkan tidak adanya warna kalus yang diamati secara visual.
Morfogenesis
Berdasarkan kemunculan tunas mikro tanaman karet, maka tidak diperoleh kemunculan tunas diluar jaringan meristem aksilar (pangkal batang, ujung batang, atau bagian lain dari eksplan).
Pembahasan
Pengaruh Lama Penyinaran terhadap Induksi Tunas Mikro Tanaman Karet Berdasarkan hasil analisis data secara statistik diperoleh bahwa perlakuan lama penyinaran memberikan pengaruh sangat nyata terhadap panjang tunas, jumlah terbentuk bakal daun, dan jumlah daun tetapi belum memberikan pengaruh yang nyata terhadap persentase munculnya tunas, umur muncul tunas, dan jumlah tunas.
kultur jaringan terhadap morfogenesis mungkin dapat juga digantikan dengan penambahan zat pengatur tumbuh ke dalam medium. Di dalam morfogenesis, lama penyinaran berkaitan dengan energi yang diterima oleh jaringan. Pemindahan kultur dari penyinaran pendek juda dapat mendorong terjadinya embryogenesis dari kultur karet.
Jumlah terbentuk bakal daun tertinggi pada perlakuan lama penyinaran terdapat pada perlakuan C1 (12 jam terang 12 jam gelap) dengan rataan (0,71) dan terendah pada perlakuan C3 (24 jam gelap) dengan rataan (0,04). Hal ini menunjukkan bahwa pembentukan bakal daun diduga didorong oleh lama penyinaran yang sesuai yaitu 12 jam terang 12 jam gelap. Penyinaran yang sesuai membantu eksplan untuk melakukan pembelahan sel untuk membentuk daun. Hal ini didukung oleh penelitian Mitrovic et al. (2007) yang menyatakan bahwa lama penyinaran yang berbeda juga mempengaruhi jumlah daun. Lama penyinrana yang panjang akan merangsang perkembangan daun pada tanaman Chinopodium rubrum L. Hal ini sesuai dengan pernyataan Abo (1977) yang menyatakan bahwa
pembentukan dan pertumbuhan tunas aksiler menjadi daun diperngaruhi oleh lingkungan, terutama faktor fisik pencahayaan, lama penyinaran (fotoperiodisme) dan suhu ruang inkubasi. menurut Rahmawati (2008) menyatakan pertumbuhan organ atau jaringan tanaman dalam kultur in vitroumumnya tidak dihambat oleh cahaya, namun pertumbuhan kalus umumnya dihambat oleh cahaya.
mendorong eksplan mengalami pembelahan sel sehingga eskplan dapat membentuk daun. Hal ini didukung oleh Kurilcik et al. (2008) yang menyatakan bahwa morfogenesis daun baru dan akumulasi DW/FW tertinggi terdapat pada 24 jam penyinaran. Hal ini sesuai dengan literatur Salisbury dan Ross (1992) yang menyatakan bahwa cahaya dalam kultur jaringan tidak diutamakan digunakan untuk berfotosintesis, namun digunakan untuk morfogenesis seperti pembentukan tunas, pembentukan akar, pembentukan daun, dan sebagainya.
Pengaruh GA3 terhadap Induksi Tunas Mikro Tanaman Karet
Berdasarkan hasil penelitian diketahui bahwa GA3 belum memberikan pengaruh yang nyata terhadap pembentukan tunas. Hal ini dapat disebabkan oleh respon pertumbuhan dan perkembangan eksplan yang sama akibat pemberian GA3. GA3 merupakan zat pengatur tumbuh yang berfungsi dalam pembelahan sel dan pematahan dormansi eksplan dengan cara perendaman sehingga mata tunas yang mengalami dormansi dapat tumbuh dan berkembang untuk membentuk tunas baru yang seterusnya akan mengalami pembelahan dan pemanjangan sel. Hal ini didukung oleh penelitian Seneviratna dan Wijesekera (1997) yang menyatakan bahwa jumlah tunas tertinggi pada tanaman karet terdapat pada konsentrasi 2,5 dan 12,5 ppm GA3 yang dikombinasikan dengan 25 ppm 2ip. Sedangkan untuk panjang tunas tertinggi terdapat pada 0,5 dan 2,5 ppm GA3. Menurut George dan Sherrington (1984) penambahan GA3 pada media in vitro bersama auksin dan sitokinin meningkatkan morfogenesis.
menyebabkan penurunan jumlah daun total. Jumlah daun total tertinggi diperoleh dari perlakuan GA3 6 mg/l.
Pengaruh Interaksi Lama Penyinaran dan GA3 terhadap Induksi Tunas Mikro Tanaman Karet
Dari hasil analisis data secara statistik diperoleh bahwa interaksi lama penyinaran dan GA3 belum memberikan pengaruh yang nyata terhadap semua peubah amatan. Hal ni diduga kerja hormon GA3 terhambat oleh adanya cahaya. Penghambatan ini diduga karena adanya peningkatan inhibitor zat pengatur tumbuh GA3 yang terdapat dalam eksplan itu sendiri sehingga menyebabkan pertumbuhan eksplan tidak optimal. Hal ini juga didukung oleh pernyataan Widyastuti(2002) yang menyatakan bahwa penyinaran dalam kultur in vitro oleh beberapa peneliti dianggap tidak perlu karena sudah diberikan karbohidrat sebagai sumber energi kedalam medium. Tetapi dari hasil pengamatan beberapa peneliti dilaporkan bahwa kultur yang diinkubasikan dalam gelap morfogenesisnya terhambat, meskipun telah diberi karbohidrat. Demikian juga dengan kultur yang diberi udara tanpa CO2 atau diberi senyawa kimia penghambat fotosintesis maka
morfogenesis akan terhambat.
Berdasarkan hasil penelitian yang diperoleh memperlihatkan bahwa dalam induksi tunas mikro tanaman karet, tidak ada kalus yang terbentuk. Hal ini menunjukkan bahwa perlakuan lama penyinaran dan GA3 tidak mendorong pembentukan kalus. Hal ini didukung oleh Wattimena et al. (1992) yang menyatakan bahwa penghambatan pertumbuhan kalus dan pembelahan sel juga dilaporkan disebabkan oleh intensitas cahaya yang tinggi, pertumbuhan kalus juga terhambat pada medium dengan 0,1 mg/l giberelin.
Hasil penelitian yang dilakukan bahwa dalam induksi tunas mikro tanaman karet, sehingga tidak ada peubah amatan warna kalus. Hal ini disebabkan oleh penambahan zat pengatur tumbuh yang dapat menghambat pembentukan kalus serta lama penyinaran yang tak sesuai sehingga kalus tidak terbentuk seperti yang diharapkan. Hal ini didukung oleh Wattimena et al. (1992) yang menyatakan bahwa dari pengujian yang dilakukan ditemukan bahwa kemampuan jaringan membentuk kalus dan laju pertumbuhan kalus tergantung pada medium, zat pengatur tumbuh yang digunakan dan faktor lingkungan lainnya.
KESIMPULAN DAN SARAN Kesimpulan
Perlakuan GA3 belum menunjukkan pengaruh yang nyata terhadap semua peubah amatan. Lama penyinaran 12 jam terang 12 jam gelap merupakan lama penyinaran terbaik pada peubah amatan panjang tunas, jumlah terbentuk bakal daun, dan jumlah daun.
Saran
TINJAUAN PUSTAKA Botani Tanaman
Tanaman karet dalam dunia tumbuhan tersusun dalam sistematika sebagai berikut:Divisio : Spermathophyta; Sub divisio : Angiospermae; Klasis : Dicotyledonae; Ordo: Euphorbiales;Familia : Euphorbiceae;Genus : Hevea; Spesies : Hevea brasiliensis (Steenis, 2005).
Akar tanaman karet berupaakar tunggang yang mampu menopang batang tanaman yang tumbuh tinggi ke atas. Dengan akar seperti itu pohon karet dapat
berdiri kokoh, meskipun tingginya mencapai 25 meter (Setiawan dan Andoko, 2006).
Tanaman karet merupakan tanaman yang tumbuh tinggidan berbatang cukup besar. Tinggi pohon dewasa 15-25meter. Batang biasanya tumbuh lurus dan memiliki percabangan tinggi di atas. Batang tanaman ini mengandung getah atau lateks (Syamsulbahri, 1996).
Daun karet berselang-seling, tangkai daunnya panjang dan terdiri dari 3 anak daun yang licin berkilat. Petiola tipis, hijau, berpanjang 3,5-30 cm. Helaian anak daun bertangkai pendek dan berbentuk lonjong-oblong atau oblong-obovate, pangkal sempit dan tegang, ujung runcing, sisi atas daun hijau tua dan sisi bawah agak cerah, panjangnya 5-35 cm dan lebar 2,5-12,5 cm (Sianturi, 2001).
Buah beruang tiga, jarang yang beruang 4 hingga 6 diameter buah3-5 cm dan terpisah 3, 4, 6. Coci bekatup dua, pericarp berbentuk endokarp berkayu. Biji besar, bulat persegi empat, tertekan pada satu atau dua sisinya, berkilat, berwarna coklat muda, dengan noda-noda cokelat tua, panjang2-3,5 cm dan lebar 1,5–3 cm dan tebal 1,5-2,5 cm (Sianturi, 2001).
Karet merupakan tanaman berbuah polong (diseliputi kulit yang keras) yang sewaktu masih muda buahnya berpaut erat dengan rantingnya. Buah karet dilapisi oleh kulit tipis berwarna hijau dan di dalamnya terdapat kulit yang keras dan berkotak. Tiap kotak berisi sebuah biji yang dilapisi tempurung, setelah tua warna kulit buah berubah menjadi keabu-abuan dan kemudian mengering. Pada waktunya pecah dan matang, bijinya tercampak lepas dari kotaknya. Tiap buah tersusun atas 2-4 kotak biji (Budiman, 2012).
Kultur Jaringan
Kultur jaringan merupakan teknik menumbuh kembangkan bagian tanaman, baik berupa sel, jaringan atau organ dalam kondisi aseptik secara in vitro. Yang dicirikan oleh kondisi kultur yang aseptik, pengunaan media kultur buatan dengan kandungan nutrisi lengkap dan zat pengatur tumbuh, serta kondisi ruang kultur yang suhu dan pencahayaannya terkontrol (Yusnita, 2003).
Microcutting merupakan salah satu teknik mikropropagasi tanaman berbasis kultur in vitro dan telah berhasil diaplikasikan untuk perbanyakan tanaman karet asal biji (seedling) dengan menggunakan tunas aksilar sebagai eksplan. Keuntungan teknik tersebut adalah terbukanya peluang untuk menghasilkan batang bawah klonal yang selama ini belum pernah ada pada tanaman karet. Penggunaan batang bawah klonal akan meningkatkan keseragaman pertanaman karet di lapang, karena klon batang atas didukung oleh batang bawah yang sama dan lebih seragam, dibandingkan dengan batang bawah asalbiji yang digunakan saat ini. Di samping itu, teknologi perbanyakan tersebut juga membuka peluang untuk melakukan seleksit erhadap batang bawah sesuai dengan karakter yang diinginkan, misalnya batang bawah dengan karakter tahan terhadap penyakit atau toleran terhadap kondisi lahan kering. Material bahan tanam tersebut kemudian dapat diperbanyak secara klonal. Penggunaan batang bawah unggul dan klonal berpeluang besar untuk meningkatkan produksi lateks dari batang atas karena potensi produksi dapat ditampilkan secara optimal (Haris et al., 2009).
Perbanyakan tanaman secara in vitro dengan menggunakan kultur tunas pucuk merupakan salah satu teknik mikropropagasi yang dilakukan dengan mengkulturkan eksplan yang mengandung meristem pucuk dengan tujuan perangsangan dan perbanyakan tunas- tunas/cabang-cabang aksilar sedangkan kultur tunas aksilar adalah kultur mata tunas untuk merangsang munculnya tunas-tunas aksilar dari mata tunas-tunas yang dikulturkan. Wattimena (1992) menyatakan salah satu faktor yang menentukan keberhasilan kultur jaringan adalah zat pengatur tumbuh(ZPT). 6-Benzil Aminopurine (BAP) adalah zat pengatur tumbuh golongan sitokinin yang berperan terhadap pembelahan sel dan multiplikasi tunas (Djumat, 2014).
Kultur in vitro tanaman karet (Hevea brasiliensis Muell. Arg.) dapat
dilakukan dengan microcutting dan embriogenesis somatik (Nayanakantha & Seneviratne, 2007; Montoro et al., 2010). Teknologi in vitro
Eksplan
Eksplan merupakan bagian dari suatu organisme yang digunakan dalam kultur jaringan. Prinsip dasar dari kultur jaringan adalah adanya teori totipotensi yang menyatakan bahwa di dalam masing-masing sel mengandung informasi genetik dan atau sarana fisiologis tertentu yang mampu membentuk tanaman lengkap bila ditempatkan dalam lingkungan yang sesuai (Wetherell, 1982).
Dalam perbanyakan tanaman secara kultur jaringan, eksplan merupakan faktor penting penentu keberhasilan. Umur fisiologis, umur ontogenetik, ukuran eksplan, serta bagian tanaman yang diambil merupakan hal-hal yang harus dipertimbangkan dalam memilih eksplan yang akan digunakan sebagai bahan awal kultur. Umumnya, bagian tanaman yang digunakan sebagai eksplan adalah jaringan muda yang sedang tumbuh aktif. Jaringan tanaman yang masih muda mempunyai daya regenerasi lebih tinggi, sel-sel masih aktif membelah diri, dan relatif lebih bersih (mengandung lebih sedikit kontaminan) (Yusnita, 2003).
Beberapa hal yang perlu diperhatikan dalam pemilihan bahan tanaman untuk eksplan, yaitu sumber eksplan yang sehat, memilih jaringan yang muda dan cukup besar (Wetherell 1982). Organ yang biasa digunakan adalah tunas pucuk, tunas aksilar, akar, mata tunas, daun, embrio dan bakal biji. Namun tingkat keberhasilan masing-masing organ tidak sama tergantung dari ukuran, umur, teknik dan waktu pengambilan (Wattimena et al. 1992).
tanaman yang sedang istirahat, lebih sulit berproliferasi daripada mata tunas yang diperoleh dari tanaman yang sedang aktif tumbuh (Zulkarnain, 2009).
Menurut Gunawan (1995), ukuran eksplan yang dikulturkan turut menentukan keberhasilan dari suatu teknik kultur jaringan. Ukuran eksplan yang terlalu kecil akan kurang daya tahannya bila dikulturkan. Sedangkan bila ukurannya terlalu besar akan sulit didapatkan eksplan yang steril. Mariska dan Sukmadjaja (2003) juga menambahkan bahwa ukuran eksplan yang dapat digunakan dalam teknik kultur jaringan bervariasi dari ukuran mikroskopik (±0,1 mm) hingga 5 cm (Jumroh, 2013).
Media Kultur
Media kultur jaringan adalah media tanam yang terdiri dari berbagai komposisi dan macam unsur hara dan sebagainya. Media tanam pada kultur jaringan berisi kombinasi dari asam amino essensial, garam-garam anorganik, vitamin-vitamin, larutan buffer, dan sumber energi (glukosa). Media kultur jaringan merupakan salah satu faktor penentu keberhasilan dalam perbanyakan tanaman secara in vitro (Yusnita, 2003)
Medium yang digunakan untuk kultur in vitro tanaman dapat berupa medium padat atau cair. Medium padat digunakan untuk menghasilkan kalus yang selanjutnya diinduksi membentuk tanaman yang lengkap (disebut sebagai planlet), sedangkan medium cair biasanya digunakan untuk kultur sel. Medium yang digunakan mengandung lima komponen utama yaitu senyawa anorganik, sumber karbon, vitamin, zat pengatur tumbuh dan suplemen organik (Yuwono, 2008). Lingkungan In Vitro
Secara umum agar kegiatan kultur jaringan berjalan dengan baik dan bahan tanaman dapat tumbuh berkembang seperti yang diharapkan, maka pada tahap inkubasi di ruang kultur pengendalian suhu, cahaya, tingkat kelembaban, dan beberapa faktor lingkungan lain yang menunjang adalah merupakan hal penting yang perlu mendapat perhatian (Santoso dan Nursandi, 2003).
optimum, pertumbuhan eksplan lebih lambat, namun pada suhu diatas optimum pertumbuhan tanaman juga terhambat abibat tingginya laju respirasi eksplan. RH yang umum dibutuhkan ialah 98-100%. Beberapa tanaman lebih efektif pada RH 88-94%. Ruangan kultur dengan RH <40% menyebabkan desikasi (kekeringan) media, meningkatnya kadar garam dalam media, dan bahan menjadi kering (Rahmawati, 2008).
Zat Pengatur Tumbuh
Zat pengatur tumbuh sangat diperlukan sebagai komponen medium bagi pertumbuhan dan diferensiasi. Tanpa penambahan zat pengatur tumbuh dalam medium, pertumbuhan sangat terhambat bahkan mungkin tidak tumbuh sama sekali. Pembentukan kalus dan organ-organ ditentukan oleh penggunaan yang tepat dari zat pengatur tumbuh (Hendaryono dan Wijayani, 1994). Dalam aktivitas kultur jaringan, auksin sangat dikenal sebagai hormon yang mampu berperan menginduksi kalus, menghambat kerja sitokinin dalam membentuk klorofil dalam kalus, mendorong proses morfogenesis kalus membentuk akar atau tunas, mendorong proses embriogenesis, dan auksin juga dapat mempengaruhi kestabilan genetik sel tanaman (Santoso dan Nursandi, 2004).
Zat pengatur tumbuh (ZPT) didefinisikan sebagai senyawa organik bukan nutrisi yang aktif dalam jumlah kecil (10-6-10-5 mM) yang disintesiskan pada bagian tertentu tanaman dan pada umumnya diangkut ke bagian lain tanaman dimana zat tersebut menimbulkan tanggapan secara biokimia, fisiologis dan morfologis (Wattimena, et al., 1992).
sejumlah besar giberelin dengan struktur kimia dan kegiatan biologis yang diperlukan terdapat secara alami, dan banyak diisolasi dari bakteri, fungi, lumut, paku dan dan diidentifikasi sebagai substansi seperti GA. Menurut Gardner et al. (1991) semua organ tanaman mengandung berbagai macam GA pada tingkat yang berbeda-beda, tetapi sumber terkaya dan mungkin tempat sintesisnya ditemukan pada buah, biji, tunas, daun muda, dan ujung akar. Menurut Bewley dan Black (1982) sebagian besar giberelin ditemukan di dalam biji. Menurut Armini et al. (1991) giberelin yang banyak digunakan dalam kultur jaringan tanaman ialah GA3. GA3 merupakan giberelin sintetik yang sangat aktif dan mudah ditemukan di pasaran. GA3 mempunyai berat molekul 346.38 dengan rumus molekul C19H22O6 . Penambahan GA3 meningkatkan persentase meristem yang membentuk tunas berakar. Gardner et al. (1991) melaporkan bahwa pembebasan α-amilase yang hasilnya berupa hidrolisis tepung dan perkecambahan
Dua golongan zat pengatur tumbuh dalam kultur jaringan yang sangat penting adalah sitokinin dan auksin (Gunawan, 1995). NAA (Naftaleine Asetat Acid) adalah zat pengatur tumbuh yang tergolong auksin. Pengaruh auksin
terhadap perkembangan sel menunjukkan bahwa auksin dapat meningkatkan sintesa protein. Dengan adanya kenaikan sintesa protein, maka dapat digunakan sebagai sumber tenaga dalam pertumbuhan. Adapun kinetin (6-furfury amino purine) tergolong zat pengatur tumbuh dalam kelompok sitokinin. Kinetin adalah
kelompok sitokinin yang berfungsi untuk pengaturan pembelahan sel dan morfogenesis. Dalam pertumbuhan jaringan, sitokinin bersama-sama dengan
auksin memberikan pengaruh terhadap deferensiasi jaringan (Hendaryono dan Wijayani, 1994).
Multiplikasi tunas yang diinduksi dari benih steril dengan cara mengkulturkan benih steril pada media yang mengandung sitokinin dapat menghasilkan laju multiplikasi yang cukup tinggi. Pertumbuhan tunas in vitro dan daya tahan tanaman Asparagus plomusus jauh lebih baik menggunakan 2ip dan zeatin daripada kintein dan BAP. Pada umumnya di dalam suatu percobaan kultur jaringan dipergunakan BAP dan kinetin yang jauh lebih murah dan tahan terhadap degradasi (Armini et al., 1991). Menurut Wattimena, et al., (1992) BAP merupakan ZPT yang tergolong sitokinin sintetik yang memiliki berat molekul sebesar 225.26 dengan rumus molekul C12H11N5 , yang dalam penggunaannya dipengaruhi oleh ZPT lainnya. Kosmiatin et al. (2005) melaporkan bahwa media kultur yang berisi 1 mg/l BAP menghasilkan induksi dan multiplikasi tunas
Kajian Kultur Jaringan Tanaman Karet
Pemanfaatan lain teknik in vitro microcutting adalah untuk perbanyakan batang bawah secara klonal karena sistem perakaran tanaman yang diperbanyak melalui teknologi tersebut menyerupai sistem perakaran tanaman seedling. Dalam hal ini berarti bibit karet yang dihasilkan tetap merupakan kombinasi dua individu, yakni batang atas dan batang bawah, namun batang bawahnya diperbanyak secara klonal. Keuntungan batang bawah klonal antara lain adalah tingkat keseragaman lebih tinggi serta penyediaan batang bawah tidak tergantung musim biji. Namun yang tidak kalah pentingnya adalah terbukanya peluang untuk melakukan seleksi terhadap batang bawah sesuai dengan karakter yang diinginkan, misalnya batang bawah dengan karakter tahan terhadap penyakit akar atau toleran terhadap kondisi lahan kering, dan kemudian diperbanyak secara klonal dengan teknik in vitro microcutting tersebut (Haris, 2013)
Pemberian kombinasi konsentrasi BAP dan NAA pada media WPM berpengaruh terhadap persentase eksplan membentuk tunas. Persentase eksplan
hidup tertinggi jugaterdapat pada perlakuan 0.5 mg/l BAP + 0.25 mg/l NAA. Persentase ekplan membentuk tunas tertinggi
PENDAHULUAN Latar Belakang
Karet merupakan salah satu komoditas unggulan Indonesia. Pada tahun 2010 produksi karet alam Indonesia adalah sebesar 2.736.000 ton dan merupakan produsen karet terbesar setelah Thailand yang memproduksi karet alam sebanyak 3.252.100 ton. Tingginya kapasitas produksi karet alam di Indonesia disebabkan oleh lahan yang digunakan untuk tanaman karet cukup luas, selain itu iklim tropis yang ada di Indonesia sesuai dengan penanaman pohon karet. Dibandingkan dengan produksi komoditas unggulan lainnya seperti kopi, teh, dan coklat, produksi karet alam Indonesia sangat besar(Siburian, 2012).
Luas area perkebunan karet tahun 2005 tercatat mencapai lebih dari 3.2 juta ha yang tersebar di seluruh wilayah Indonesia. Diantaranya 85% merupakan perkebunan karet milik rakyat, dan hanya 7% perkebunan besar negara serta 8% perkebunan besar milik swasta. Produksi karet secara nasional pada tahun 2005 mencapai 2.2 juta ton (Anwar, 2006 ; Benny et al., 2013).
Salah satu perbanyakan yang dapat dilakukan adalah dengan kultur in vitro. Penggunaan teknik in vitro, bahan tanam yang dihasilkan akan mempunyai
Meningkatnya kebutuhan batang bawah menyebabkan ketersediaan biji tidak mencukupi lagi karena tergantung pada beberapa klon karet penghasil biji batang bawah dan pada musim biji yang hanya berlangsung satu kali dalam setahun. Di samping itu, kelemahan lain dari penggunaan bibit asal biji sebagaibatang bawah adalah adanya keragaman batang bawah dan kekurang-mampuan kombinasi batang atas dan batang bawah menampilkan potensi produksi dan karakter unggul
lain secara maksimal karena perbedaan tingkat juvenilitas (Abbas dan Ginting, 1981).
Cahaya dapat mempengaruhi perkembangan tumbuhan secarain vitro dan in vivo. Keadaan suatu kultur dipengaruhi oleh fotoperioditas, kualitas dan
intensitas cahaya. Cahaya mempengaruhi pengaturan produksi bahan metabolit dalam kultur jaringan, termasuk metabolit primer seperti enzim, karbohidrat, lipida dan asam amino sedangkan metabolit sekunder seperti antosianin, flavonol dan karotenoid.Penelitian yang telah dilakukan oleh Muslihatin (2009) membuktikan intensitas cahaya 20 dan 10 µmol/m2/detik berpengaruh terhadap pertambahan tinggi plantlet sagu yaitu (0.15) dan (0.14), sedangkan tinggi terkecil pada 40 µmol/m2/detik (0.07) cm (Ariani, et al., 2013).
Penggunaan asam giberelin (GA3) dapat meningkatkan persentase perkecambahan secara in vitro. Persentase benih yang berkecambah dengan penggunaan GA3 lebih tinggi pada perkecambahan bijiOrobanche crenataForsk. secara in vitro (Pieterse, 1981). Pada perkecambahan in vitro biji Annona cherimolla Mill. cv. Fino de Jete dihasilkan lebih dari 80% benih yang
berkecambah dengan penambahan 8,67 μM GA3 dalam media
Menurut Bewley dan Black (1982) terdapat ± 80 jenis giberelin yang diketahui saat ini.Bahwa sejumlah besar giberelin dengan struktur kimia dan kegiatan biologis yang diperlukan terdapat secara alami, dan banyak diisolasi dari bakteri, fungi, lumut, paku dan dan diidentifikasi sebagai substansi seperti GA. Semua organ tanaman mengandung berbagai macam GA pada tingkat yang berbeda-beda, tetapi sumber terkaya dan mungkin tempat sintesisnya ditemukan pada buah, biji, tunas, daun muda, dan ujung akar (Rahmawati, 2008).
Menurut Creswell et al (1982) bahwa peningkatan konsentrasi GA3 1ppm
sampai 10 ppm menyebabkan perpanjangan tunas. Perpanjangan internodel meningkat dari 1 mm sampai 15 mm dalam waktu kurang dari 15 hari. Tapi setelah itu tanaman menjadi mati dan rapuh dan daunnya mengalami keguguran. Akan tetapi media yang mengandung GA3 sebanyak 0,5 ppm menghasilkan tunas
dan akar yang lebih baik dan lebih sehat meskipun tidak mengalami perpanjangan tunas (Seneviratna and Wijasekera, 1997).
Berdasarkan uraian diatas penulis tertarik untuk melakukan penelitian tentang pengaruh lama penyinaran dan GA3 terhadap induksi tunas mikro pada tanaman karet ( Hevea brasiliensis Muell. Arg).
Tujuan Penelitian
Untuk mengetahui pengaruh lama penyinaran dan teknik aplikasi GA3
terhadap pembentukan tunas mikro pada tanaman karet. Hipotesis Penelitian
- Ada perbedaan pertumbuhan dan perkembangan tunas mikro tanaman
- Ada perbedaan pertumbuhan dan perkembangan tunas mikro tanaman
karetterhadap aplikasi beberapa konsentrasi GA3.
- Ada interaksiantara lama penyinaran dengan aplikasi GA3 terhadap
pertumbuhan dan perkembangan tunas mikro tanaman karet. Kegunaan Penelitian
ABSTRACT
IRFANSYAH, 2015 : Effect of photoperiode and GA3 for micro shooting
induction of rubber tree (Hevea brasiliensis Muell. Arg.) supervised by Luthfi A. M Siregar and Diana Sofia Hanafiah.
The aimed of the research to know the influence photoperiode and GA3 for micro shooting induction of rubber tree (Hevea brasiliensis Muell. Arg.). The research was carried out in the Microccuting Laboratory, PT. Perkebunan Nusantara III Kebun Gunung Pamela Tebing Tinggi, Sumatera Utara, Indonesia,from March to July 2015. The research used completely randomized design with two factors, i.e.: photoperiode, consist of 3 levels ; C1 : 12 h light 12 h dark); C2 : 24 h light; C3 : 24 h dark, and GA3 consist of four levels ; G1 : 0 mg/l GA3, G2 : 5 mg/l GA3, G3 : 10 mg/l GA3, G4 : 15 mg/l GA3 with seven replications.
The results showed that photoperiode gave significantly effect to shoot length and number of leaves. GA3 and interaction photoperiode and GA3 not gave significantly affected the whole parameters. The photoperiode of 12 h light 12 h dark (C1) was the best photoperiode to micro shoot induction.
ABSTRAK
IRFANSYAH, 2015 : Pengaruh Lama Penyinaran dan GA3 Terhadap Induksi Tunas Mikro Pada Tanaman Karet (Hevea brasiliensis Muell.Arg.), dibimbing oleh Luthfi A. M. Siregar dan Diana Sofia Hanafiah.
Penelitian ini bertujuan untuk mengetahui pengaruh lama penyinaran dan teknik aplikasi GA3 terhadap pembentukan tunas mikro pada tanaman karet
(Hevea brasiliensis Muell. Arg.). Penelitian ini dilaksanakan Laboratorium Kultur Microcutting Tanaman Karet PT. Perkebunan Nusantara III Kebun Gunung Pamela, Tebing Tinggi, Sumatera Utara, Indonesia. Penelitian ini dimulai pada bulan April 2015 sampai dengan Juli 2015. Rancangan yang digunakan adalah rancangan acak lengkap dengan 2 faktor perlakuan yaitu lama penyinaran yang terdiri dari 3 kategori yaitu C1 : 12 jam terang 12 jam gelap ; C2 : 24 jam terang ; C3 : 24 jam gelap sedangkan konsentrasi GA3 terdiri dari 4 taraf yaitu G1 : 0 mg/l GA3, G2 : 5 mg/l GA3, G3 : 10 mg/l GA3, G4 : 15 mg/l GA3 dengan 7 ulangan.
Hasil penelitian menunjukkan bahwa perlakuan lama penyinaran memberikan pengaruh sangat nyata terhadap panjang tunas, jumlah terbentuk bakal daun, dan jumlah daun. Konsentrasi GA3 serta interaksi antara lama peny