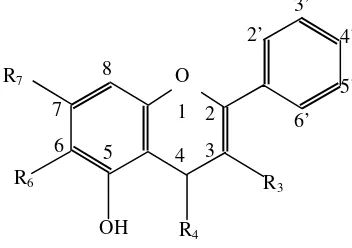
PENGARUH PENAMBAHAN EKSTRAK
ANTIOKSIDAN KULIT PISANG (Musa paradisiaca)
PADA MINYAK IKAN TERHADAP STABILITAS
OKSIDASI DENGAN KATALIS PANAS DAN
CAHAYA
RINDHIRA HUMAIRANI Z.
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis yang berjudul Pengaruh Penambahan Ekstrak Antioksidan Kulit Pisang (Musa paradisiaca) pada Minyak Ikan Terhadap Stabilitas Oksidasi dengan Katalis Panas dan Cahaya adalah karya saya sendiri dengan bimbingan Prof. Dr. Ir. C. Hanny Wijaya, M.Agr dan Dr. Ir. Nuri Andarwulan, MS serta belum pernah diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain, telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Mei 2007
Rindhira Humairani Z.
ABSTRAK
RINDHIRA HUMAIRANI Z. Pengaruh Penambahan Ekstrak Antioksidan Kulit Pisang (Musa paradisiaca) pada Minyak Ikan Terhadap Stabilitas Oksidasi dengan Katalis Panas dan Cahaya. Dibimbing oleh C. HANNY WIJAYA dan NURI ANDARWULAN.
Minyak ikan maupun daging ikan memiliki kadar PUFA (Polyunsaturated Fatty Acid) yang sangat tinggi dan sangat sensitif terhadap reaksi oksidasi sehingga mudah mengalami ketengikan. Akibat reaksi oksidasi tersebut, minyak ikan maupun daging ikan mengalami penurunan nilai gizi, terjadi pembentukan flavor yang tidak diinginkan serta senyawa yang bersifat racun. Faktor panas dan cahaya merupakan faktor inisiasi yang paling umum terlibat dalam reaksi oksidasi selama pengolahan dan pengawetan ikan. Proses oksidasi ini dapat diminimalkan salah satunya dengan penambahan antioksidan. Penggunaan antioksidan sintetis dikhawatirkan memiliki efek samping terhadap kesehatan. Oleh karena itu, perlu digali pemanfaatan sumber-sumber antioksidan alami yang dapat digunakan untuk pengawetan bahan pangan yang salah satunya dapat diperoleh dengan memanfaatkan kulit pisang.
Berdasarkan hal tersebut, maka dilakukan penelitian dasar yang bertujuan untuk mempelajari pengaruh penambahan senyawa antioksidan yang diperoleh dari kulit pisang kepok dalam menghambat reaksi oksidasi minyak ikan yang disebabkan katalis panas dan cahaya.
Senyawa antioksidan dari kulit pisang kepok diekstraksi menggunakan pelarut air, kloroform dan etil asetat. Ekstrak menghasilkan rendemen sebesar 0,02 % dengan total fenolik yang terkandung sebesar 123,09 mg/g ekstrak kering. Ekstrak menunjukkan adanya senyawa polifenol dan flavonoid setelah diuji secara kualitatif dengan menggunakan metode fitokimia. Uji TLC (Thin Layer Chromatography) dan
scanning absorbansi ekstrak pada panjang gelombang 350-750 nm memperlihatkan bahwa ekstrak juga mengandung klorofil .
Ekstrak kemudian ditambahkan pada minyak ikan dengan konsentrasi 0; 114,30; 145,04; 285,75; 362,38; 571,50; 724,75 ppm dan dioksidasi dengan pemanasan 40 oC menggunakan oven dan dengan mengekspose sampel terhadap cahaya yang dihasilkan oleh lampu fluoresen (1500-2000 lux) sehingga dihasilkan panas sebesar 40 oC. Sampel dioksidasi selama 24 jam dan masing-masing perlakuan diasumsikan sebagai proses pengeringan dengan alat dan sinar matahari. Pengukuran produk oksidasi dilakukan dengan metode diene terkonjugasi, nilai peroksida, bilangan TBA (Thiobarbituric Acid) dan analisis profil asam lemak.
Hasil pengukuran dengan beberapa parameter oksidasi menunjukkan bahwa ekstrak kulit pisang kepok menghambat pembentukan nilai diene terkonjugasi, nilai peroksida dan nilai TBA serta dapat mempertahankan kadar asam lemak jika dibandingkan dengan kontrol. Minyak ikan yang dioksidasi dengan katalis cahaya memiliki nilai diene terkonjugasi dan nilai peroksida yang tinggi jika dibandingkan dengan minyak ikan yang dioksidasi dengan katalis panas. Sebaliknya bilangan TBA lebih rendah pada sampel yang dioksidasi dengan katalis cahaya. Selanjutnya oksidasi dengan katalis cahaya lebih merusak asam lemak jenuh dan asam lemak tak jenuh tunggal jika dibandingkan dengan oksidasi dengan katalis panas. Tetapi pada asam lemak tak jenuh jamak, baik oksidasi dengan katalis panas dan cahaya dapat merusak asam lemak tak jenuh jamak dengan tingkat kerusakan yang hampir sama.
PENGARUH PENAMBAHAN EKSTRAK
ANTIOKSIDAN KULIT PISANG (Musa paradisiaca)
PADA MINYAK IKAN TERHADAP STABILITAS
OKSIDASI DENGAN KATALIS PANAS DAN
CAHAYA
RINDHIRA HUMAIRANI Z
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada Program Studi Ilmu Pangan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Pengaruh Penambahan Ekstrak Antioksidan Kulit Pisang (Musa paradisiaca) pada Minyak Ikan terhadap Stabilitas Oksidasi dengan Katalis Panas dan Cahaya
Nama : Rindhira Humairani Z
NIM : F251030141
Disetujui
Komisi Pembimbing
Prof. Dr. Ir. C. Hanny Wijaya, M.Agr Dr. Ir. Nuri Andarwulan, MS.
Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana
Ilmu Pangan
Prof. Dr. Ir. Betty Sri Laksmi Jenie, MS. Prof. Dr. Ir. Khairil A.Notodiputro, MS
PRAKATA
Puji dan syukur ke hadirat Allah SWT karena dengan rahmat dan hidayah-Nya penulis dapat menyelesaikan penelitian dan penulisan tesis yang berjudul Pengaruh Penambahan Ekstrak Antioksidan Kulit Pisang (Musa paradisiaca) pada Minyak Ikan Terhadap Stabilitas Oksidasi dengan Katalis Panas dan Cahaya. Penelitian ini berlangsung sejak Januari 2005 hingga Desember 2006.
Pada kesempatan ini penulis menyampaikan ucapan terima kasih yang sebesar-besarnya kepada Ibu Prof. Dr. Ir. C. Hanny Wijaya, MAgr dan Ibu Dr. Ir. Nuri Andarwulan, MS selaku komisi pembimbing atas dukungan dan arahan yang diberikan baik selama proses penelitian hingga selesainya penulisan tesis ini. Tidak lupa saya ucapkan terima kasih kepada Ibu Prof. Dr. Ir. Betty Sri Laksmi Jenie, MS selaku ketua Program Studi Ilmu Pangan beserta staf Ilmu Pangan yang telah banyak membantu dalam proses studi di Ilmu Pangan, serta para laboran di SEAFAST Center dan Departemen ITP FATETA IPB yang telah membantu dalam memberikan dukungan dan fasilitas selama penelitian.
Penulis juga menyampaikan terima kasih kepada Ayahanda Zahrum Zain Hamid dan Ibunda tercinta Indriyani Z. Tahir, adik-adikku Zazri Hakam, Ardhly Ma’ruf, Zaky Arqam, Ibnu Zariri dan Adinda Humaira, serta Ahmad Saufi, SPi, Ibu Fortuna Zain Hamid, SE, MSi dan Ibu Dra. Farida Hanum yang tidak henti memberi dorongan, motivasi dan doa. Serta kepada Bapak Drs. Sunaryono dan Ibu Nurmasita atas kesediannya dalam membantu pembiayaan selama studi hingga penulisan tesis ini dapat terselesaikan. Kepada teman-temanku, Ibu Yuspi, Kak Lina, Kak Tri, Mba’ Era, Indri, Akhyar dan kepada semua pihak yang tidak dapat disebutkan satu persatu.
Akhir kata, penulis mohon maaf atas segala kekurangan yang terdapat dalam penulisan tesis ini. Semoga tesis ini dapat memberikan manfaat bagi pembaca.
Bogor, Mei 2007
RIWAYAT HIDUP
Penulis dilahirkan di Medan pada tanggal 21 Oktober 1979, sebagai anak pertama dari enam bersaudara, dari pasangan Zahrum Zain Hamid dan Indriyani Z. Tahir.
DAFTAR ISI
Halaman
DAFTAR TABEL... x
DAFTAR GAMBAR ... xi
DAFTAR LAMPIRAN... xiii
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan Penelitian ... 3
Hipotesis... 3
TINJAUAN PUSTAKA ... 4
Botani Pisang Kepok (Musa paradisiaca) ... 4
Minyak Ikan ... 7
Lemak dan Mekanisme Oksidasi Lemak ... 9
Senyawa Antioksidan... 13
BAHAN DAN METODE PENELITIAN... 20
Tempat dan Waktu Penelitian ... 20
Bahan dan Alat... 20
Metode Penelitian ... 20
Karakterisasi dan Ekstraksi Antioksidan dari Kulit Pisang serta Karakterisasi Ekstrak Antioksidan Kulit Pisang ... 21
Proses Pemurnian Minyak Ikan ... 25
Uji Stabilitas Oksidasi Minyak Ikan dengan Katalis Panas dan Cahaya ... 27
HASIL DAN PEMBAHASAN... 31
Karakterisasi dan Ekstraksi Antioksidan dari Kulit Pisang serta Karakterisasi Ekstrak Antioksidan Kulit Pisang ... 31
Hasil Uji Stabilitas Oksidasi Minyak Ikan dengan Katalis Panas dan Cahaya ... 37
SIMPULAN DAN SARAN ... 59
Simpulan ... 59
Saran ... 60
DAFTAR PUSTAKA ... 61
DAFTAR TABEL
Halaman
1. Komposisi asam lemak jenuh minyak ikan nila merah
(Turon et al. 2005) ... 9
2. Karakteristik kulit pisang dan ekstrak antioksidan kulit pisang... 31
3. Hasil uji kualitatif golongan senyawa fenolik... 35
4. Tingkat penurunan kadar asam lemak minyak ikan karena oksidasi
DAFTAR GAMBAR
Halaman
1. Pisang kepok ... 4
2. Tahap-tahap pembuatan minyak ikan (Bockisch 1998)... 8
3. Reaksi autooksidasi (Wong 1989) ... 10
4. Proses oksidasi asam lemak tak jenuh pada ikan ... 11
5. Aktivasi dan deaktivasi sensitizer (Choe dan Min 2006) ... 12
6. Struktur umum flavonoid ... 15
7. Struktur flavonoid yang terkandung dalam biji anggur (Shi et al. 2003)... 16
8. Diagram proses ekstraksi antioksidan kulit pisang ... 23
9. KromatogramTLC (Thin Layer Chromatography) ekstrak antioksidan kulit pisang kepok dengan plat selulose untuk uji kualitatif klorofil dan hasil scanning ekstrak ... 36
10. Pengaruh penambahan ekstrak kulit pisang pada minyak ikan yang dioksidasi oleh panas dan cahaya terhadap pembentukan diene terkonjugasi. (a) Kurva kuadratik nilai diene terkonjugasi. (b) Kurva linier nilai ln diene terkonjugasi ... 38
11. Mekanisme pembentukan diene terkonjugasi dari asam linoleat (Wander 2001) ... 40
12. Pengaruh penambahan ekstrak kulit pisang pada minyak ikan yang dioksidasi oleh panas dan cahaya terhadap nilai peroksida. (a) Kurva kuadratik nilai peroksida. (b) Kurva linier nilai ln kadar peroksida ... 41
13. Hubungan struktur dan aktivitas flavonoid sebagai antioksidan ( Shi et al. 2001)... 42
14. Pengaruh penambahan ekstrak kulit pisang pada minyak ikan yang dioksidasi oleh panas dan cahaya terhadap bilangan TBA. (a) Kurva kuadratik bilangan TBA. (b) Kurva linier nilai ln bilangan TBA... 45
16. Komposisi asam lemak jenuh minyak ikan yang
ditambahkan ekstrak antioksidan kulit pisang yang dioksidasi
dengan (a) katalis panas (b) katalis cahaya ... 50
17. Komposisi asam lemak tak jenuh tunggal minyak ikan yang ditambahkan ekstrak antioksidan kulit pisang
yang dioksidasi dengan (a) katalis panas (b) katalis cahaya ... 54
18. Komposisi asam lemak tak jenuh ganda minyak ikan yang ditambahkan ekstrak antioksidan kulit pisang
DAFTAR LAMPIRAN
Halaman
1. Kurva standar asam tanat ... 69
2. Total fenol pada sampel kulit pisang berdasarkan berat basah ... 70
3. Total fenol pada sampel kulit pisang berdasarkan berat kering... 70
4. Volume ekstrak yang dipipet setara dengan 2 mg sampel untuk perhitungan total phenol ekstrak ... 71
5. Total fenol pada ekstrak berdasarkan berat kering ... 71
6. Hasil perhitungan rendemen ... 72
7. Hasil perhitungan efisiensi ekstraksi... 72
8. Volume larutan ekstrak yang dipipet setara dengan mg ekstrak untuk pembuatan konsentrasi ekstrak yang akan diuji ... 72
9. Pembentukan warna pada uji kualitatif golongan senyawa fenolik ... 73
10. Hasil uji ragam diene terkonjugasi sampel kontrol... 73
11. Hasil uji ragam diene terkonjugasi sampel yang dioksidasi oleh panas... 73
12. Hasil uji Duncan diene terkonjugasi sampel yang dioksidasi oleh panas... 74
13. Hasil uji ragam diene terkonjugasi sampel yang dioksidasi oleh cahaya... 74
14. Hasil uji Duncan diene terkonjugasi sampel yang dioksidasi oleh cahaya... 74
15. Hasil uji ragam nilai peroksida sampel kontrol... 75
16. Hasil uji ragam nilai peroksida sampel yang dioksidasi oleh panas... 75
17. Hasil uji Duncan nilai peroksida sampel yang dioksidasi oleh panas... 75
18. Hasil uji ragam nilai peroksida sampel yang dioksidasi oleh cahaya... 75
20. Hasil uji ragam bilangan TBA sampel kontrol ... 76
21. Hasil uji ragam bilangan TBA sampel yang dioksidasi
oleh panas... 76
22. Hasil uji Duncan bilangan TBA sampel yang dioksidasi oleh panas... 77
23. Hasil uji ragam bilangan TBA sampel yang dioksidasi
oleh cahaya... 77
24. Hasil uji Duncan bilangan TBA sampel yang dioksidasi oleh cahaya.... 77
25. Perhitungan RF Asam-asam Lemak Standar Eksternal
FAME Mix C8-C22 ... 78
26. Kromatogram gas chromatography untuk standar asam lemak
campuran ... 79
27. Kromatogram gas chromatography untuk standar asam lemak EPA... 80
28. Kromatogram gaschromatography untuk standar asam lemak DHA.... 81
29. Hasil perhitungan komposisi asam lemak yang dioksidasi
dengan katalis panas... 82
30. Hasil perhitungan komposisi asam lemak yang dioksidasi
PENDAHULUAN
Latar Belakang
Minyak ikan maupun daging ikan memiliki kadar PUFA (Polyunsaturated Fatty Acid) yang sangat tinggi, khususnya kandungan EPA (Eicosapentaenoic Acid) dan DHA (Docosahexaenoic Acid) yang diketahui bermanfaat untuk mencegah arthtritis, menurunkan kadar kolesterol dan mencegah penyakit jantung. PUFA sangat sensitif terhadap reaksi oksidasi sehingga mudah mengalami penguraian melalui terjadinya reaksi berantai radikal bebas yang menghasilkan senyawa hidroperoksida sebagai produk oksidasi primer dan selanjutnya terurai lagi menjadi produk oksidasi sekunder seperti aldehid dan heksanal. Akibat proses penguraian tersebut, minyak ikan maupun daging ikan mengalami penurunan nilai gizi serta menimbulkan flavor dan odor yang tidak diinginkan dan terjadi pembentukan senyawa yang bersifat racun.
Reaksi oksidasi dapat terjadi oleh adanya beberapa faktor yang menginisiasi, diantaranya panas, cahaya, enzim, kandungan logam dan mikroorganisme. Dalam proses pengolahan dan pengawetan ikan, faktor panas dan cahaya merupakan faktor yang paling umum terlibat. Pengalengan ikan, pengasapan dan pengeringan adalah proses pengolahan dan pengawetan yang tidak luput dari penerapan panas, sedangkan proses pengeringan dengan sinar matahari selain melibatkan adanya panas juga melibatkan cahaya matahari. Kedua faktor ini diketahui memiliki mekanisme dan produk hasil oksidasi yang berbeda (Tomotaro 1961; Akoh dan Min 2002).
Diketahui bahwa proses oksidasi lemak dapat diminimalkan, salah satunya dengan penambahan antioksidan. Peran antioksidan dalam mengikat radikal bebas dan oksigen aktif serta rendahnya reaktifitas antioksidan untuk menghasilkan radikal bebas baru, menyebabkan antioksidan dapat menghambat terbentuknya hidroperoksida dan mencegah reaksi lanjutan yang menyebabkan terjadinya flavor dan odor yang tidak diinginkan.
antioksidan sintetis dikawatirkan memiliki efek samping terhadap kesehatan, maka terus dilakukan penelitian untuk menggali sumber-sumber antioksidan alami yang dapat dimanfaatkan untuk pengawetan bahan pangan.
Salah satu jenis antioksidan alami yang telah diujikan dalam pengolahan dan pengawetan minyak ikan maupun daging ikan, berasal dari golongan fenolik yang diekstrak dari daun teh (Wanasundara dan Shahidi 1998, Tang et al. 2001, Lin dan Lin 2005). Selain itu, antioksidan alami juga dapat diperoleh dari berbagai tanaman seperti sayuran, buah-buahan, serta rempah-rempah (Shyamala
et al. 2005, Mielnik et al. 2005) dan mempunyai potensi untuk digunakan sebagai antioksidan alami dalam pengolahan dan pengawetan bahan pangan.
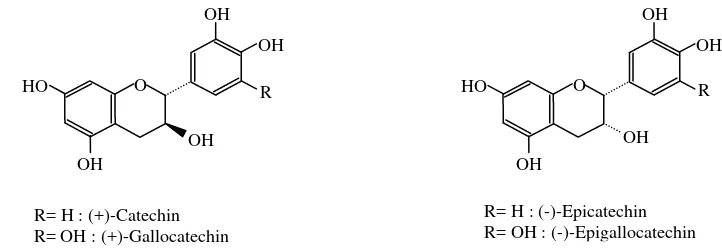
Berdasarkan studi literatur yang dilakukan, senyawa antioksidan juga dapat diperoleh dari kulit pisang, yang antara lain mengandung katekin, epikatekin, galokatekin yang merupakan senyawa fenolik (Someya et al. 2002) serta dopamin (Kanazawa dan Sakakibara 2000). Ekstrak polifenol kulit pisang memiliki aktivitas antioksidan yang cukup potensial namun belum pernah diteliti potensinya dalam mencegah terjadinya reaksi oksidasi lemak pada produk pangan.
Senyawa katekin, epikatekin dan galokatekin yang terkandung pada kulit pisang merupakan senyawa fenolik yang juga terdapat pada daun teh dan telah diteliti memiliki aktivitas penghambatan yang cukup tinggi pada minyak ikan (Wanasundara dan Shahidi 1998). Sehubungan dengan kadar PUFA yang tinggi pada minyak ikan yang hampir memiliki kesamaan dengan daging ikan, serta terlibatnya faktor panas dan cahaya dalam proses pengawetan dan pengolahan ikan yang merupakan salah satu faktor inisiasi reaksi oksidasi, maka sebagai awal untuk melihat pengaruh penambahan antioksidan dari kulit pisang terhadap oksidasi minyak ikan dengan katalis panas dan cahaya dirasa sangat perlu untuk diteliti. Penelitian ini dapat mengetahui apakah senyawa antioksidan dari kulit pisang mampu menghambat terjadinya kerusakan lemak selama proses pengawetan dan pengolahan yang melibatkan panas dan cahaya pada produk hasil perikanan yang memiliki kadar PUFA yang sangat tinggi.
oleh enzim polifenoloksidase. Dalam hal ini pisang yang dipilih adalah pisang kepok yang banyak dimanfaatkan untuk pembuatan keripik pisang dalam industri rumah tangga dan dalam pembuatan tepung pisang, sehingga kulitnya diharapkan dapat dimanfaatkan. Kriteria pisang yang digunakan yaitu pisang telah matang petik, masih hijau dengan sedikit warna kuning yaitu sekitar 10 % dari luas permukaan (Dewan Ilmu Pengetahuan, Teknologi dan Industri Sumatera Barat, 2002; BPPHP 2004).
Tujuan Penelitian
Penelitian ini bertujuan untuk mempelajari pengaruh penambahan ekstrak antioksidan yang diperoleh dari kulit pisang kepok dalam menghambat reaksi oksidasi minyak ikan yang disebabkan katalis panas dan cahaya.
Hipotesis
TINJAUAN PUSTAKA
Botani Pisang Kepok (Musa Paradisiaca Normalis)
Pisang merupakan tumbuhan monokotil yang termasuk dalam famili
Musaceae. Pohonnya menyerupai tumbuhan hijau dengan tinggi dua hingga sembilan meter, akar rhizoma berada dalam tanah dan pelepahnya terdiri dari lembaran daun dan mahkota terminal daun tempat munculnya bakal buah (Seymour 1993).
Klasifikasi pisang adalah sebagai berikut : Divisi : Spermatophyta
SubDivisi : Angiospermae
Kelas : Monocotyledonae
Famili : Musaceae
Genus : Musa
Spesies : Musa spp.
Sedangkan jenisnya dapat dibagi atas empat kelompok yaitu : Pisang yang dimakan buahnya tanpa dimasak, yaitu M. paradisiaca var. Sapientum, M. nana
atau disebut juga M. cavendishii, M. sinensis. Contohnya: pisang ambon, pisang susu, pisang raja, pisang cavendish, pisang barangan dan pisang mas. Pisang yang dimakan setelah buahnya dimasak, yaitu M. paradisiaca Typica atau disebut juga
M. paradisiaca Normalis. Contohnya: pisang nangka, pisang tanduk, dan pisang kepok yang digunakan pada penelitian (Gambar 1).
Kelompok ketiga yaitu termasuk pisang berbiji, seperti M. brachycarpa yang di Indonesia dimanfaatkan daunnya. Contonya: pisang batu dan pisang klutuk. Sedangkan kelompok keempat yaitu pisang yang diambil seratnya, contohnya pisang Manila (Abaca) (Pusat Kajian Buah-Buahan Tropika, LPPM IPB 2005). Selanjutnya Freiberg (1966) menyatakan bahwa varietas pisang bervariasi menurut tinggi, bentuk daun, warna tandan (hitam, hijau, merah, beraneka warna), karakter sisir pada tandan dan karakteristik buah seperti bentuk, warna dan kandungan lilin.
Pisang merupakan buah klimaterik yang artinya memiliki fase perkembangan yang selama itu ukuran buah meningkat dan karbohidrat terakumulasi dalam bentuk pati. Pertumbuhan terhenti saat buah telah benar-benar matang dan fase pematangan buah terhambat. Selama fase pematangan, kekerasan buah menurun, pati berubah menjadi gula, warna kulit berubah dari hijau menjadi kuning dan kekelatan pada buah hilang, berkembang menjadi flavor dengan karakteristik yang khas (Thompson dan Burden 1995).
Pemilihan jenis pisang didasarkan pada pendugaan kandungan fenolik pada pisang. Dimana dari hasil penelitian Simmonds (1954) dalam Harborne (1967) pola distribusi antosianidin berbeda-beda pada setiap spesies pisang. Begitu juga pola distribusi pigmen glikosidat dan flavones menunjukkan perbedaan menurut genus dan taksonomi pada pisang serta tingkat kematangan pisang.
Kandungan fenolik bertanggung jawab terhadap kekelatan pada pisang sebelum pisang pisang matang serta terhadap beberapa reaksi pencoklatan. Fenolik terutama terdapat pada pembuluh getah pada daging buah dan kulit buah. Pada saat panen, kulit buah mengandung total fenol dua kali lipat dari daging buah (John dan Marchal 1995)
coklat mengindikasikan bahwa buah tersebut telah sangat matang.
Mendez et al. (2003) meneliti kandungan fenolik bebas pada pisang yang berasal dari dua wilayah berbeda. Senyawa polifenol yang teridentifikasi pada pisang adalah katekin dan asam galat. Kandungan senyawa polifenol pada pisang yang varietasnya sama bervariasi tergantung pada tempat tumbuhnya, di dalam rumah kaca atau di tempat terbuka, cara penanamannya secara konvensional maupun organik dan wilayah produksinya.
Ada beberapa jenis senyawa antioksidan yang dapat diisolasi dari kulit pisang, yaitu asam amino dan peptida, flavonoid, katekolamin, dopamin dan polimer dopamin. Dilihat dari potensi antioksidannya, senyawa flavonoid, katekolamin dan dopamin yang dihasilkan dari elusi asam asetat hasil pemisahan dengan kromatografi alumina, memperlihatkan potensi yang paling baik jika dibandingkan dengan komponen asam amino dan peptida serta polimer dopamin. Sedangkan setelah dilakukan isolasi hasil elusi asam asetat tersebut, potensi antioksidan dopamin adalah yang tertinggi, diikuti oleh flavonoidnya dan katekolamin. Jenis flavonoid yang teridentifikasi adalah naringenin dan rutin (Kanazawa dan Sakakibara 2000).
Menurut Vinson et al. (2001), total fenolik pada pisang adalah sekitar 3,35 mg/g berat segar yang dikonsumsi. Fenol bebas yang terdapat pada pisang kurang menunjukkan kualitas antioksidan yang baik, tetapi secara keseluruhan, total fenol pisang mempunyai kualitas antioksidan yang baik. Perbandingan antara konsentrasi fenol dengan kualitas antioksidannya juga menunjukkan bahwa pisang termasuk yang memiliki nilai tertinggi dari beberapa jenis buah yang diteliti. Someya et al. (2002) mempelajari senyawa antioksidan flavonoid yang terdapat pada daging dan kulit pisang, senyawa yang teridentifikasi yaitu katekin, galokatekin dan epikatekin. Pengujian aktivitas antioksidan terhadap oksidasi lemak yang dilakukan memperlihatkan bahwa ekstrak kulit pisang memiliki aktivitatas antioksidan yang tinggi. Hal ini disebabkan kandungan total fenolik pada ekstrak kulit pisang lebih besar (9,07 mg/g berat kering, data diolah) dibandingkan yang terdapat pada ekstrak daging buahnya (2,32 mg/g berat kering, data diolah).
terhadap stabilitas oksidatif dan keamanan pangan dari adanya mikroba. Beberapa jenis fenol memiliki kemampuan untuk menghambat metagenesis dan karsinogenesis serta memiliki aktivitas antioksidan yang potensial untuk digunakan pada pengawetan makanan (Shahidi dan Naczk 1995). Lewis et al. (1999) melakukan penelitian terhadap kandungan flavonoid alami pada daging buah pisang pati yang teridentifikasi sebagai leukosianidin dan memiliki aktivitas
anti-ulcerogenik.
Lim et al. (2006) mempelajari perbandingan sifat antioksidan beberapa jenis buah tropis. Dari penelitiannya tersebut diketahui bahwa walaupun pisang tidak memiliki kadar total fenol dan asam askorbat yang tinggi, tetapi mengandung antioksidan sekunder yang potensial karena kemampuannya untuk mengikat ion logam adalah yang paling tinggi dibandingkan beberapa jenis buah lainnya. Sedangkan menurut hasil penelitian yang dilakukan oleh Someya et al. (2002) dan Kanazawa dan Sakakibara (2000), kulit pisang memiliki kadar senyawa fenolik yang jauh lebih tinggi daripada yang terkandung pada daging buahnya. Ekstrak kulit pisang juga tidak memiliki aktivitas sitotoksisitas sehingga ekstrak kulit pisang aman untuk diterapkan sebagai antioksidan alami pada pangan atau minuman (Okonogi et al. 2006). Oleh karena itu, kulit pisang memiliki potensi yang cukup baik untuk dimanfaatkan sebagai sumber antioksidan pada bahan pangan.
Minyak Ikan
Lemak hewan dan minyak ikan diambil dari jaringan berlemak melalui proses pemasakan yang diketahui sebagai rendering. Bahan mentah pembuatan minyak ikan berasal dari ikan-ikan yang tidak dapat dipasarkan dan sisa-sisa pengolahan serta limbah hasil pengalengan ikan. Wet rendering merupakan cara lama dan melibatkan proses pemasakan (dengan adanya air) dengan pemanasan (steam) di bawah tekanan [172-516 kPa (25-75 psi)] selama 90-150 menit. Air akan menguraikan protein dan bahan padatan lainnya turun, sementara lemak dengan densitas yang rendah mengapung pada permukaan cairan. Lemak yang dihasilkan dari proses tersebut harus disentrifusa dan disaring (Johnson 2002).
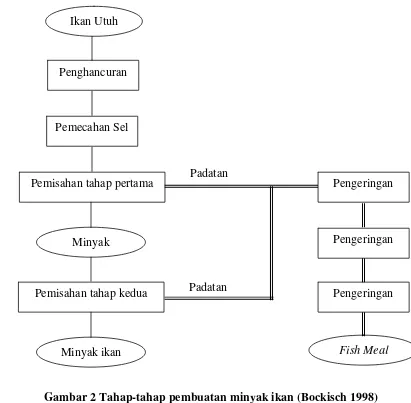
pelepasan minyak. Secara tradisional, pemecahan sel dilakukan secara mekanis atau dengan pemanasan cairan dalam sel. Pada Gambar 2 dapat dilihat tahap-tahap dalam proses pembuatan minyak ikan.
Gambar 2 Tahap-tahap pembuatan minyak ikan (Bockisch 1998)
Minyak ikan berbeda dari minyak lainnya karena mengandung berbagai jenis asam lemak jika dibandingkan dengan minyak dan lemak lainnya. Minyak ikan mengandung sejumlah besar asam lemak dengan panjang rantai karbon 20 atau 22 dan jenis asam lemak PUFA dengan lima atau enam ikatan ganda dan kandungan asam lemak omega-3 yang lebih tinggi dibandingkan asam lemak omega-6. Minyak ikan yang berasal dari spesies yang berbeda memperlihatkan sifat-sifat yang sangat berbeda. Asam lemak rantai panjang, khususnya rantai karbon 20 dan 22 secara umum berjumlah 1/4 hingga 1/3 komposisi asam lemak
Padatan Padatan Ikan Utuh
Penghancuran
Pemecahan Sel
Pemisahan tahap pertama
Minyak
Pemisahan tahap kedua
Minyak ikan
Pengeringan
Pengeringan
Pengeringan
keseluruhan. Pada beberapa spesies dapat mencapai hingga ½ dari kandungan asam lemak total (Martin et al. 1982).
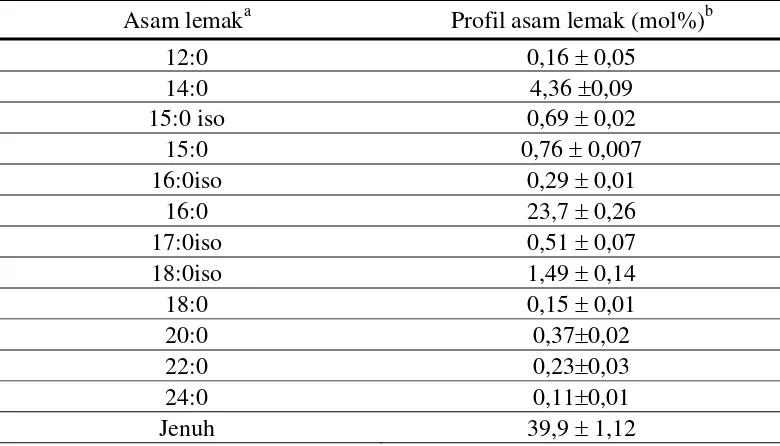
Turon et al. (2005) meneliti komposisi asam lemak minyak yang diekstrak dari ikan nila merah dan memperlihatkan bahwa komponen asam lemak yang paling tinggi adalah asam palmitat (C 16:0) yaitu sekitar 60 % dari total asam lemak jenuh yang terkandung Tabel 1.
Tabel 1 Komposisi asam lemak jenuh minyak ikan nila merah (Turon et al. 2005)
a
Seluruh ikatan etilen pada konfigurasi cis;
b
Nilai rata-rata standar deviasi dari dua sampel analisis kromatografi gas dari empat percobaan
Karakteristik dari minyak ikan yang teroksidasi berbeda-beda tergantung derajat oksidasi dan faktor yang menyebabkan oksidasi. Secara umum, gravitas tertentu, indeks refraksi, viskositas, bilangan asam dan bilangan saponifikasi untuk minyak ikan yang teroksidasi lebih tinggi dari minyak ikan segar, tetapi nilai iodin dan kandungan bromida yang tidak terlarut dalam eter lebih rendah pada minyak ikan yang telah teroksidasi dibandingkan minyak ikan segar (Tomotaro 1961).
Lemak dan Mekanisme Oksidasi Lemak
Lemak merupakan salah satu senyawa penyusun yang utama pada bahan pangan dan sistem biologis yang dapat diklasifikasikan ke dalam tiga kelompok, yaitu lemak sederhana (trigliserida, steryl ester dan ester wax), senyawa lemak (phospholipid, glikolipid, spingolipid dan lipoprotein) dan turunan lemak (asam
Asam lemaka Profil asam lemak (mol%)b
12:0 0,16 ± 0,05
14:0 4,36 ±0,09
15:0 iso 0,69 ± 0,02
15:0 0,76 ± 0,007
16:0iso 0,29 ± 0,01
16:0 23,7 ± 0,26
17:0iso 0,51 ± 0,07
18:0iso 1,49 ± 0,14
18:0 0,15 ± 0,01
20:0 0,37±0,02
22:0 0,23±0,03
24:0 0,11±0,01
Inisiasi RH → R• (1)
R′ -CH=CH-R″ + O2 → ROOH (2)
Propagasi R• + O2 → ROO• (3)
ROO• + RH → ROOH + R• (4)
ROOH → RO• + OH• (5)
Terminasi R• + R• → Produk non radikal (6) 2 ROO• → R1-CO-R2 + R1-CHOH-R2 + O2 (7) Radikal bebas lainnya
lemak, vitamin dan provitamin larut lemak, sterol, terpenoid dan eter). Lemak yang terdapat pada jaringan hewan dan tumbuhan sebagai simpanan lemak yang dapat digunakan sebagai sumber energi dan sebagai komponen membran sel. Lemak hewan memiliki kadar lemak jenuh yang rendah dibandingkan dengan lemak tumbuhan, tetapi kaya akan asam lemak tak jenuh. Ketidakjenuhan asam lemak membuat lemak sangat mudah untuk berikatan dengan oksigen sehingga menyebabkan perubahan kimia yang kompleks yang akhirnya menyebabkan terjadinya off flavor pada bahan pangan (Jadhav et al. 1996).
Komposisi kimia lemak pada ikan berbeda dengan lemak dan minyak alami lainnya karena mengandung asam lemak tak jenuh dengan kadar yang cukup tinggi, memiliki asam lemak rantai panjang lebih dari 18 atom carbon dengan kuantitas sangat tinggi, memiliki asam lemak tak jenuh jamak terutama famili omega-3 lebih banyak dari famili omega-6 dan secara umum memiliki kandungan lemak yang sangat bervariasi (Bligh et al. 1988).
Reaksi antara oksigen dan lemak tak jenuh atau disebut dengan oksidasi lemak dapat terjadi melalui dua jalur, yaitu autooksidasi dan oksidasi fotosensitif. Autooksidasi merupakan reaksi rantai radikal bebas yang mekanismenya diawali oleh proses inisiasi yang menyebabkan lepasnya gugus H sehingga membentuk radikal lemak, diikuti dengan propagasi dimana radikal lemak bereaksi dengan oksigen untuk membentuk radikal peroksida yang selanjutnya dapat bereaksi lagi dengan lemak tak jenuh sehingga terbentuk hidroperoksida dan radikal lemak yang dapat bereaksi lagi dengan oksigen untuk membentuk radikal peroksida dan begitu seterusnya seperti yang terlihat pada Gambar 3.
Reaksi autoksidasi diakhiri dengan proses terminasi karena terbentuknya senyawa tidak radikal. Sedangkan oksidasi fotosensitif dapat terjadi oleh karena adanya senyawa yang sensitif terhadap cahaya seperti klorofil melalui reaksi pembentukan ‘ene’, reaksi ini dapat dihambat oleh senyawa pengikat oksigen tunggal seperti beta karoten dan tokoferol (Wong 1989).
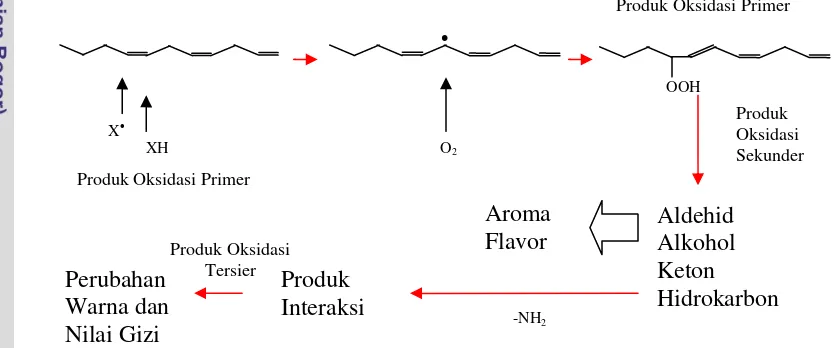
Oksidasi asam lemak tak jenuh ganda membutuhkan bentuk aktif oksigen karena reaksinya dengan oksigen dalam bentuk stabil merupakan reaksi yang terbatas. Reaksi yang terbatas dipicu oleh reaksi aktifasi (inisiasi) yang melibatkan katalis untuk mengawali reaksi rantai radikal bebas (propagasi). Hidroperoksida lemak yang terbentuk tidak stabil dan kemudian terpecah untuk membentuk senyawa volatil yang berkaitan dengan terjadinya ketengikkan (Gambar 4). Senyawa volatil yang terbentuk selama penyimpanan telah sepenuhnya terkarakterisasi pada sejumlah spesies ikan berlemak termasuk ikan teri, salmon Atlantik dan mackerel (Ashton 2002).
Gambar 4 Proses oksidasi asam lemak tak jenuh pada ikan
Reaksi oksidasi lemak dapat dipercepat oleh cahaya, panas, peroksida lemak atau hidroperoksida, logam-logam berat seperti Cu, Fe, Co dan Mn, logam porfirin seperti hematin, hemoglobin, mioglobin, klorofil dan enzim-enzim lipoksigenase. Oksidasi ini menyebabkan terjadinya ketengikan oleh karena pemecahan senyawa hidroperoksida oleh adanya radiasi energi tinggi, energi panas, katalis logam dan enzim membentuk senyawa dengan rantai karbon yang
lebih pendek seperti asam-asam lemak, aldehid dan keton yang bersifat volatil (Winarno 2002).
Inisiator lainnya pada proses oksidasi lemak adalah oksigen singlet yang merupakan oksigen molekul yang tereksitasi. Oksigen singlet dapat terbentuk melalui reaksi fotosensitif. Beberapa jenis molekul dapat berfungsi sebagai
sensitizer yang memiliki kemampuan untuk menyerap cahaya dan mengubahnya menjadi bentuk eksitasi energi tinggi. Molekul sensitizer yang tereksitasi dapat bereaksi dengan molekul oksigen sehingga menghasilkan oksigen singlet. Oksigen singlet berinteraksi langsung dengan ikatan ganda asam lemak sehingga menghasilkan produk oksidasi yang berbeda dari yang dihasilkan pada proses autooksidasi yang melibatkan pemutusan hidrogen (Hultin 1994).
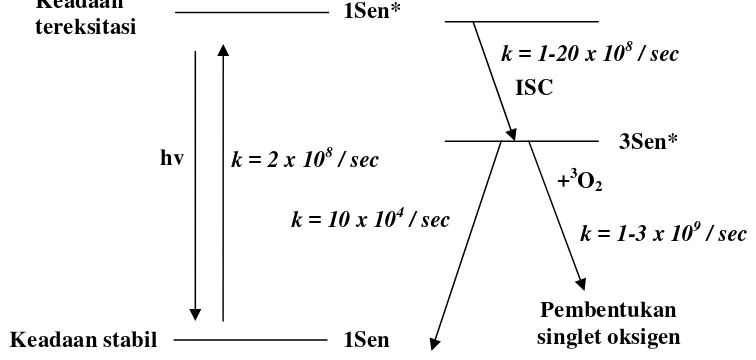
Choe dan Min (2006) menyatakan bahwa oksidasi minyak yang diakselerasi oleh cahaya khususnya terjadi dengan adanya sensitizer seperti klorofil. Sensitizer yang berada dalam keadaan singlet menyerap energi cahaya dengan sangat cepat dalam hitungan picosecond sehingga menjadi tereksitasi.
Sensitizer yang tereksitasi akan bereaksi dengan oksigen triplet sehingga menghasilkan oksigen singlet yang dapat bereaksi dengan sangat cepat membentuk hidroperoksida. Mekanisme pembentukan oksigen singlet dari
sensitizer yang tereksitasi dapat dilihat pada Gambar 5.
Gambar 5 Aktivasi dan deaktivasi sensitizer (Choe dan Min 2006) k = 1-20 x 108 / sec
ISC
k = 2 x 108 / sec Keadaan
tereksitasi
Keadaan stabil
Pembentukan singlet oksigen 1Sen*
1Sen
3Sen* hv
k = 1-3 x 109 / sec k = 10 x 104 / sec
Pada otot ikan terdapat sejumlah katalis yang potensial dan mekanismenya kemungkinan adalah melalui reaksi aktifasi untuk menghasilkan spesies oksigen aktif yang dapat menyebabkan oksidasi lemak. Oksidasi lemak oleh reaksi non-enzimatis lebih disebabkan oleh protein heme dan ion besi bebas yang berperan dalam reaksi transfer elektron dengan molekul oksigen sehingga memindahkan arah spin oksigen yang tadinya tidak reaktif. Sedangkan protein heme yang mengandung besi mampu mempropagasi oksidasi lemak melalui reaksi redoks dengan hidroperoksida lemak dan hidrogen peroksida yang sudah terbentuk (Ashton 2002).
Mekanisme inisiasi oksidasi lipid juga dapat disebabkan oleh adanya enzim pada daging ikan. Salah satu enzim yang banyak berperan adalah lipoksigenase yang dapat mengoksidasi asam lemak tak jenuh jamak yang mengandung 1,4-cis,cis-pentadiene menghasilkan hidroperoksida yang tidak stabil (Saeed dan Howell 2001; Wong 1989). Lipoksigenase yang terlepas dari daging ikan bersama dengan oksigen akan merubah 1,4-diene menjadi 1,3-hidroperoksida yang kemudian akan terurai lagi dan akhirnya menyebabkan perubahan bau pada otot ikan (German dan Kinsella 1985). Aktivitas enzim lipoksigenase ini dapat dihambat oleh penambahan beberapa senyawa, diantaranya adalah senyawa antioksidan alami seperti vitamin C, vitamin E, senyawa fenolik dan flavonoid (Saeed dan Howell 2001; Ashton 2002). Pada minyak ikan, reaksi oksidasi enzimatis tidak ikut berperan karena senyawa-senyawa protein telah dipisahkan dari minyak ikan.
Ackman (1994) menyebutkan bahwa ada beberapa cara untuk menghambat oksidasi lemak pada seafood, antara lain dengan membatasi kontak terhadap oksigen, menggunakan senyawa antioksidan alami, meminimalkan peningkatan prooksidan, memberikan perlindungan awal dari reaksi oksidasi, memelihara suhu tetap rendah, melindungi dari pengaruh NaCl, menghilangkan lemak yang tidak stabil dan membuang otot gelap.
Senyawa Antioksidan
mendonorkan hidrogen atau elektron pada rantai radikal bebas dan merubahnya menjadi produk yang lebih stabil. Disamping itu, juga dapat bereaksi dengan radikal lemak membentuk kompleks lipid-antioksidan. Sedangkan antioksidan sinergis secara luas dapat diklasifikasikan sebagai penangkap oksigen dan pengkelat, fungsi sinergisnya bisa dengan berbagai mekanisme. Antioksidan sinergis bisa juga berperan sebagai donor pada radikal peroksi sehingga dapat memelihara antioksidan primer. Sedangkan antioksidan sekunder bekerja dengan mendekomposisi peroksida lemak menjadi produk akhir yang lebih stabil. Selain itu ada juga yang disebut sebagai antioksidan dengan fungsi beragam, yaitu berfungsi sebagai antioksidan primer dan antioksidan sinergis. Flavonoid dan senyawa turunannya termasuk ke dalam golongan ini (Rajalakshmi dan Narasimhan 1996). Flavonoid juga dapat bekerja secara sinergis dengan penambahan asam askorbat (Coppen 1983; Shi 2001).
Antioksidan merupakan senyawa kimia yang mampu mendonor radikal hidrogen sehingga dapat mengurangi radikal primer menjadi non radikal dan kemudian berubah menjadi radikal antioksidan teroksidasi. Struktur molekul antioksidan tidak hanya mendonor atom hidrogen tetapi juga membentuk radikal dengan reaktivitas rendah sehingga tidak ada kemungkinan untuk bereaksi lebih jauh dengan lemak dan oksigen (Wong 1989; Jadhaf et al. 1996).
Berdasarkan sumbernya, antioksidan dapat dibagi menjadi dua, yaitu antioksidan sintetis dan alami. Penggunaan antioksidan sintetis seperti BHA, BHT (Butylate Hydroxyltoluene) dan TBHQ sangat dibatasi oleh karena sifatnya yang dapat menyebabkan karsinogenik sehingga alternatif untuk penggunaan antioksidan alami untuk mencegah oksidasi pada bahan pangan banyak diteliti (Ramanathan dan Das 1992; Wanasundara dan Shahidi 1998; Tang et al. 2001; Shyamala et al. 2005)
Polifenol
yang sangat luas dan dikarakterisasi oleh adanya rangka karbon C6-C3-C6 yang terdiri dari dua cincin standard yang dihubungkan oleh tiga rantai karbon alifatik (Shahidi dan Naczk 1995). Struktur umum flavonoid dapat dilihat pada Gambar 6.
Gambar 6 Struktur umum flavonoid
Flavonoid dapat dijumpai hampir diseluruh bagian spesies tanaman terutama pada biji, kulit buah, batang dan bunga. Kombinasi yang beragam pada gugus hidroksil, gula, oksigen dan gugus metil yang melekat pada struktur umum flavonoid membagi flavonoid menjadi beberapa kelas, yaitu flavanol, flavanon, flavon, flavan-3-ol (katekin), antosianin dan isoflavon. Flavonoid diketahui merupakan antioksidan yang potensial yang mampu menangkap radikal hidroksil, anion superoksida dan radikal peroksi lemak (Miller 1996).
Adanya senyawa fenolik pada bahan pangan kemungkinan memiliki pengaruh penting terhadap stabilitas oksidatif dan keamanan produk dari mikroba. Selain itu, banyaknya fenolik dalam bahan pangan memiliki aktifitas biologis penting yang berhubungan dengan pengaruh penghambatannya terhadap mutagenik dan karsinogenik. Kebanyakan bahan pangan nabati seperti padi-padian, minyak biji-bijian, tumbuhan polong, sama halnya dengan jamu-jamuan, bumbu dan teh, mengandung fenolik dengan aktivitas antioksidan yang potensial (Shahidi dan Wanasundara 1992 diacu dalam Shahidi dan Naczk 1995). Hal ini yang menyebabkan proses ekstraksi dan penggunaan antioksidan dari tumbuh-tumbuhan alami dalam pengolahan pangan meningkat (Shahidi dan Naczk 1995).
Fenolik mengandung gugus hidroksil (-OH) múltiple dan merupakan antioksidan yang mendonor hidrogen dan meredam oksigen singlet. Hal ini membuat polifenol digolongkan sebagai senyawa pereduksi. Polifenol juga sangat berpotensi sebagai senyawa pengkelat logam. Polifenol dapat menangkap dan
meredam radikal dan memutuskan rantai reaksi. Potensi antioksidannya 4 hingga 5 kali vitamin C atau E (Shi et al. 2003).
Polifenol biji anggur sangat sensitif terhadap oksigen, cahaya, asam dan alkalin, tetapi lebih tahan terhadap panas. Fenolik yang tidak berwarna seperti katekin dan epikatekin sangat mudah teroksidasi pada buah-buahan dan sayuran karena adanya polifenoloksidase yang bertanggung jawab terhadap kerusakan atau memar pada buah-buahan (seperti apel, pir dan persik) serta sayur-sayuran dan pencoklatan pada jus (Shi et al. 2003). Struktur flavonoid yang terkandung dalam biji anggur dapat dilihat pada Gambar 7.
Gambar 7 Struktur flavonoid yang terkandung dalam biji anggur
(Shi et al. 2003)
Senyawa fenolik juga bertanggung jawab terhadap kualitas sensori bahan pangan. Astringency (kelat) dan rasa pahit yang timbul pada bahan pangan tergantung pada konsentrasi senyawa fenolik yang terdapat pada bahan pangan tersebut. Secara umum, daun-daunan, bunga, buah dan jaringan hidup tumbuhan mengandung glikosida sementara jaringan kayu mengandung aglikon, sedangkan biji-bijian bisa mengandung fenolik dalam kedua macam bentuk tersebut (Shahidi dan Naczk 1995).
Aktivitas Antioksidan Polifenol
Ramanathan dan Das (1992) meneliti tentang pengaruh beberapa senyawa polifenol alami untuk mengontrol oksidasi lemak pada daging ikan yang digiling dan disimpan pada suhu 4 ºC dan –20 ºC. Dari hasil penelitian tersebut diketahui bahwa quercetin pada konsentrasi 200 ppm, myricetin pada konsentrasi 200 ppm, asam tanat pada konsentrasi 30 dan 200 ppm dan asam elargat pada konsentrasi
R R= OH : (+)-Gallocatechin
30 dan 200 ppm merupakan antioksidan yang potensial. Sementara rutin, baik pada konsentrasi 30 dan 200 ppm dan α-tokoferol pada konsentrasi 30 ppm kurang efektif dalam mengontrol oksidasi lemak daging ikan.
Wanasundara dan Shahidi (1998) melakukan penelitian terhadap aktivitas antioksidan dan pro-oksidan ekstrak teh hijau pada minyak ikan, dimana pada mulanya ekstrak teh hijau memperlihatkan efek prooksidan pada minyak ikan yang diduga akibat adanya klorofil pada ekstrak teh hijau. Pada percobaan berikutnya ekstrak dideklorofilasi untuk menghilangkan kandungan klorofil. Aktivitas antioksidan ekstrak teh hijau diteliti pada konsentrasi 100, 200, 500 dan 1000 ppm dan dibandingkan dengan antioksidan yang biasa digunakan seperti BHA, BHT, TBHQ pada 200 ppm dan α-tokoferol pada 500 ppm. Hasil penelitian menunjukkan bahwa ekstrak teh hijau pada konsentrasi lebih besar dari 200 ppm memperlihatkan aktivitas antioksidan yang baik dan sangat manjur dibandingkan BHA, BHT pada konsentrasi 200 ppm dan α-tokoferol pada konsentrasi 500 ppm, tetapi aktivitasnya lebih rendah jika dibandingkan dengan TBHQ pada konsentrasi 200 ppm.
Tang et al. (2001) melakukan penelitian terhadap pengaruh antioksidatif katekin teh terhadap oksidasi lemak pada pastel daging, unggas dan ikan. Penambahan katekin teh sebanyak 300 mg/kg hancuran otot memperlihatkan efek penghambatan terhadap pembentukan malonaldehid yang disimpan selama 10 hari pada suhu 4 ºC dan kekuatan iluminasi 616 lux.
Ekstrak teh juga dapat digunakan untuk meningkatkan masa simpan filet
bonito dengan cara glassing. Kandungan katekin dari tiga jenis ekstrak teh (teh hijau, teh pouchong dan teh hitam) memiliki kadar yang berbeda-beda dengan aktivitas penghambatan yang berbeda pula yang disebabkan oleh proses fermentasi alami yang berbeda pada ketiga jenis teh. Teh hijau dan teh pouchong
memiliki kemampuan penghambatan oksidasi filet yang lebih tinggi dari teh hitam. Kombinasi antara ekstrak teh hijau dan teh pouchong pada konsentrasi 5 % untuk glasing filet memperlihatkan efek sinergis terhadap pembentukan hidroperoksida dan produk dekomposisinya (Medina et al. 1999).
oksidasi lemak pada bahan pangan. Medina et al. (2003) meneliti sistem pangan yang diperkaya dengan asam lemak tak jenuh jamak, yaitu emulsi otot ikan, emulsi minyak ikan dan minyak ikan yang ditambahkan senyawa antioksidan fenolik alami yang berasal dari ekstrak daun rosemary dan extra virgin olive oil. Kedua ekstrak ini mampu untuk menurunkan oksidasi lemak pada masing-masing sistem pangan tersebut.
Antioksidan polifenol alami yang diekstrak dari extra virgin olive oil juga dapat menghambat terjadinya oksidasi lemak pada tuna kaleng. Konsentrasi 400 ppm polifenol extra virgin olive oil yang ditambahkan pada tuna yang dioksidasi pada 40 ºC dan 100 ºC, memperlihatkan hasil yang efektif dibandingkan dengan penambahan 1:1 campuran antioksidan sintetis (BHT dan BHA) sebanyak 100 ppm. Tetapi pada konsentrasi di bawah 100 ppm, senyawa polifenol extra virgin olive oil memperlihatkan efek sinergis atau memicu terjadinya pembentukan hidroperoksida dan produk dekomposisinya ( Medina et al. 1999).
Bonilla et al. (1999) melakukan ekstraksi senyawa fenolik dari hasil distilasi residu fermentasi anggur merah untuk digunakan sebagai antioksidan pada lemak bahan pangan. Ekstraksi senyawa fenolik dengan etil asetat menghasilkan kadar fenolik yang lebih tinggi jika dibandingkan dengan hasil ekstraksi dengan air. Kemudian senyawa-senyawa yang telah dipisahkan dengan HPLC (High-Performance Liquid Chromatography), diuji aktivitas antioksidannya terhadap minyak zaitun yang telah direfinisasi dan dibandingkan dengan antioksidan sintetis (BHA, BHT dan propil galat dan standar murni asam galat yang terdapat pada ekstrak). Hasilnya menunjukkan bahwa asam galat memperlihatkan aktivitas tertinggi setelah propil galat. Katekin dan epikatekin memperlihatkan aktivitas yang hampir sama dengan BHA dan BHT berturut-turut, diikuti dengan quercetin dan ekstrak fenolik dengan etil asetat yang diperoleh dari hancuran residu hasil fermentasi anggur merah.
polifenol anggur lebih efektif digunakan pada minyak dibandingkan dengan polimernya. Oligomer flavanol (prosianidin) merupakan penghambat yang paling potensial terhadap oksidasi emulsi dan otot ikan beku. Baik pada minyak dan emulsi, monomer flavanol (katekin) lebih efektif jika dibandingkan monomer glikosilasi flavonol.
1
BAHAN DAN METODE PENELITIAN
Tempat dan Waktu Penelitian
Ekstraksi dan analisis sampel dilaksanakan di Laboratorium Kimia Pangan Pusat Studi Pangan dan Gizi, serta Laboratorium Kimia Pangan Jurusan Teknologi Pangan dan Gizi, Fakultas Teknologi Pertanian Institut Pertanian Bogor. Penelitian ini dilakukan mulai bulan Januari 2006 sampai dengan Desember 2006.
Bahan dan Alat
Bahan baku yang digunakan adalah kulit pisang kepok sebanyak 1,5 kg dan minyak ikan. Bahan kimia yang digunakan untuk analisis antara lain air distilasi, kloroform, etil asetat, reagen Folin-Ciocalteu, Na2CO3, asam galat 0,5 mM, etanol, asam linoleat, dietil eter, air distilasi diionisasi, 0,02 M TBA (Thiobarbituric Acid) dan bahan-bahan lain yang diperlukan untuk analisis.
Alat yang digunakan dalam pengolahan antara lain pisau dan talenan. Alat yang digunakan untuk analisis yaitu gelas ukur, gelas piala, erlenmeyer, cawan porselein, timbangan analitik, penangas air, rotary evaporator, oven, desikator, spektrofotometer, GC-FID (Gas Chromatography-Flame Ionization Detector) dan alat-alat lain yang digunakan dalam analisis.
Metode Penelitian
2
Karakterisasi dan Proses Ekstraksi Antioksidan dari Kulit Pisang serta Karakterisasi Ekstrak Antioksidan Kulit Pisang
Sebelum dilakukan proses ekstraksi antioksidan, terlebih dahulu dilakukan pengukuran total fenol dan kadar air yang terkandung di dalam kulit pisang. Hal ini dilakukan untuk perhitungan rendemen dan efisiensi ekstraksi.
Perhitungan Kadar Air (Sudarmadji et al. 2003)
Cawan porselin yang sudah bersih dikeringkan dalam oven selama 1 jam pada suhu 110 ºC, kemudian didinginkan dalam desikator selama 30 menit dan ditimbang (A gram). Sampel ditimbang sebanyak ± 3 gram dalam cawan porselin (B gram) dan dikeringkan dalam oven pada suhu 110 ºC selama 8 jam. Kemudian didinginkan dalam desikator, lalu dilakukan penimbangan sampai beratnya tetap (C gram).
Kadar air dihitung dengan rumus : Kadar air = 100% )
Pembuatan Kurva Standard Asam Tanat
Larutan asam tanat dibuat dengan melarutkan 5 mg asam tanat dalam 50 ml aquades untuk memperoleh konsentrasi 0,1 mg/1 ml sebagai larutan stok. Dari larutan stok tersebut dipipet 0; 0,5; 1; 1,5; 2; 2,5; 3; 4; 5; 6 ml. Masing-Msing ditambahkan 2 ml reagen Folin-Ciocalteau dan ditunggu selama 5 menit. Ditambahkan 5 ml Na2CO3 5%. Volume ditepatkan menjadi 100 ml dengan aquades dan ditunggu selama 40 menit. Kemudian Absorbansi diukur pada panjang gelombang 725 nm.
Nilai absorbansi (X) pada setiap konsentrasi larutan standar asam tanat diplotkan terhadap konsentrasi standard asam tanat (Y) sehingga diperoleh sebuah persamaan
Analisis Total Fenolik (AOAC 1995)
3
dipipet sebanyak 2 ml dan ditambahkan pereaksi Folin-Ciocalteau 2 ml didiamkan selama 5 menit. Ditambahkan 5 ml larutan Na2CO3 5% dan ditambahkan aquades hingga volume menjadi 100 ml, diaduk rata dan didiamkan selama 40 menit di ruang gelap. Kemudian dianalisis dengan spektrofotometer double beam pada panjang gelombang 725 nm. Absorbansi yang terbaca merupakan nilai y,dimasukkan ke dalam persamaan garis yang didapat dari pembuatan kurva standard asam tanat, sehingga diperoleh konsentrasi fenol (mg/ml) yang merupakan nilai X. Untuk menghitung kadar fenol sampel, nilai X (konsentrasi fenol) dimasukkan dalam persamaan.
⎟⎟
Sehingga didapat total fenol dalam satuan mg per gram sampel.
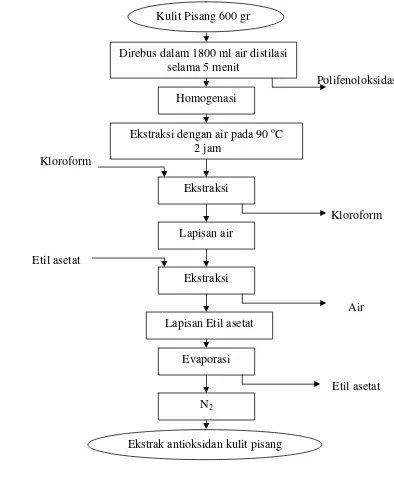
Proses Ekstraksi Antioksidan Kulit Pisang Menurut Someya et al. (2002)
Kulit pisang yang masih segar dipotong-potong kecil berbentuk kubus dan ditimbang sebanyak 600 gr. Kulit pisang didihkan dalam 1800 ml air distilasi selama 5 menit untuk menginaktifkan polifenoloksidase (Jimenez dan Garcia-Carmona dalam Kanazawa dan Sakakibara, 2000). Campuran kulit pisang dan air dihomogenasi dengan cara diblender, kemudian dipanaskan pada 90 ºC selama 2 jam dalam waterbath shaker. Hancuran kulit pisang disaring dengan kain saring dan dilanjutkan dengan kertas saring no.1 menggunakan penyaring vakum. Ekstrak air kemudian dipekatkan dengan vaccum rotary evaporator pada suhu 70 ºC sampai volume menjadi 600 ml.
4
dalam wadah bertutup yang telah ditimbang beratnya, kemudian ekstrak dikeringkan dengan gas nitrogen hingga pelarut benar-benar hilang dan didapat ekstrak berwarna kecoklatan dan agak berminyak. Ekstrak dan wadah ditimbang berat untuk perhitungan rendemen. Ektrak kemudian disimpan dalam freezer untuk analisis selanjutnya. Diagram alir dapat dilihat pada Gambar 8.
Gambar 8 Diagram proses ekstraksi antioksidan kulit pisang Evaporasi
Lapisan air
Direbus dalam 1800 ml air distilasi selama 5 menit
Homogenasi
Polifenoloksidase
Ekstraksi dengan air pada 90 oC 2 jam
Ekstraksi Kloroform
Kloroform
Etil asetat
Air Ekstraksi
Lapisan Etil asetat
N2
Etil asetat Kulit Pisang 600 gr
5
Uji Kualitatif Terhadap Kandungan Polifenol, Flavonoid dan Tanin
Polifenol (Harborne 1996)
Ke dalam 1 ml ekstrak (2 mg dalam 5 ml etanol) ditambahkan 2 tetes larutan FeCl3 5 %. Terbentuknya warna hijau atau hijau biru menunjukkan adanya senyawa fenol dalam bahan. Senyawa fenol kemungkinan terdapat dalam bentuk bebas atau dalam bentuk glikosidat.
Flavonoid (Harborne 1996)
Sebanyak 1 mg sampel yang telah kering dilarutkan dalam 2 ml kloroform, kemudian sebanyak 1 ml sampel cair ditetesi Pb-asetat. Hasil uji positif untuk flavon bila terbentuk warna jingga atau krem. Kalkon bila terbentuk warna jingga tua dan auron bila terbentuk warna merah.
Tanin (Harborne 1996)
Ke dalam 1 ml ekstrak (2 mg dalam 5 ml etanol) ditambahkan 2 tetes larutan FeCl3 5 %. Terbentuknya warna hijau atau hijau biru menunjukkan adanya senyawa fenol dalam bahan. Kemudian ditambahkan larutan gelatin 1 %. Jika terdapat endapan putih berarti positif tanin.
Uji Kuantitatif Total Fenolik
6
Sehingga didapat total fenol dalam satuan mg per gram sampel.
Identifikasi Klorofil dengan TLC (Thin Layer Chromatography)
Pemisahan komponen klorofil dilakukan dengan menggunakan plat TLC selulose. Larutan pengembang yang digunakan adalah petroleum eter ringan-aseton-n-propanol dengan perbandingan 90:10:0,45 (Harborne 1987 dalam Prangdimurti 2007). Plat diaktifkan dalam oven bersuhu 105 ºC selama minimal 45 menit. Ekstrak diaplikasikan pada plat sebanyak 20 µl kemudian dimigrasi dalam ruang gelap.
Pigmen ekstrak membentuk spot-spot terpisah pada plat TLC selulose. Spot kemudian dikerik dan dilarutkan dalam pelarut aseton, kemudian diidentifikasi pada panjang gelombang 350 nm hingga 750 nm yang merupakan panjang gelombang serapan komponen klorofil.
Proses Pemurnian Minyak Ikan
Minyak Ikan yang diperoleh pada penelitian ini masih membutuhkan proses pemurnian sebelum digunakan untuk uji stabilitas antioksidan. Dimana proses pemurnian dilakukan melalui tiga tahap yaitu degumming, netralisasi dan
bleaching.
Perhitungan Kadar Asam Lemak Bebas (Bilangan Asam)
Sebelum diproses, dilakukan perhitungan kadar asam lemak bebas pada minyak untuk menentukan jumlah soda kaustik yang akan ditambahkan dalam proses netralisasi.
7
Kemudian bilangan asam dihitung sebagai :
sampel
Atau sebagai kadar asam :
G
M = berat molekul asam lemak yang dominan dalam minyak/lemak (rata-rata dari campuran asam lemak); untuk minyak kelapa = 205, minyak kelapa sawit = 263, asam oleat = 282 dan DHA = 328 g/mol.
Degumming
Proses degumming dilakukan dengan menambahkan NaCl 8% sebanyak 40 % dari volume minyak. Kemudian dipanaskan selam 15 menit pada suhu 70 ºC sambil diaduk. Setelah dingin lapisan air dan minyak dipisahkan dan diambil bagian minyaknya.
Netralisasi
Bagian minyak yang telah didegumming kemudian ditimbang beratnya. Dari berat minyak tersebut dihitung kebutuhan NaOH yang akan digunakan dalam proses netralisasi dengan rumus :
% NaOH = % FFA x 0,142
dimana : % FFA = didapat dari perhitungan kadar asam
Setelah diketahui berat NaOH yanga dibutuhkan kemudian NaOH dilarutkan dalam aquades untuk menghasilkan soda kaustik 20 ºBe (16,7 kg dalam 100 ml aquades).
8
Bleaching
Minyak hasil proses netralisasi dihitung beratnya dan ditambahkan bentonit sebanyak 6% dari berat minyak. Selanjutnya minyak dipanaskan selama 15 menit pada suhu 60 ºC dan dibiarkan hingga terjadi pengendapan bentonit. Bagian minyak siap digunakan untuk uji.
Uji Stabilitas Oksidasi Minyak Ikan dengan Katalis Panas dan Cahaya
Ekstrak yang telah ditimbang beratnya, dilarutkan dalam metanol, kemudian dicampur dengan minyak ikan sebanyak 10 ml sehingga dihasilkan tujuh konsentrasi (0; 114,30; 145,04; 285,75; 362,38; 571,50; 724,75 ppm). Kemudian campuran minyak dan antioksidan distrirer sambil dihembuskan gas N2 agar pelarut metanol hilang. Cara pencampuran minyak dan ekstrak antioksidan seperti ini juga dilakukan oleh Abdalla dan Roozen (2001). Sampel dengan tujuh konsentrasi ekstrak diletakkan dalam botol gelas dan dibungkus dengan aluminium foil sebanyak 14 sampel (tujuh konsentrasi ekstrak dengan dua ulangan)dan dioksidasi dalam oven dengan menggunakan panas (40 oC) yang diasumsikan sebagai panas pengeringan ikan selama 24 jam dengan alat pengeringan. Sedangkan 14 sampel lainnya dioksidasi dengan intensitas cahaya 1500-2000 lux yang dihasilkan oleh lampu fluoroscent yang diletakkan dengan jarak ±30 cm dari sampel dalam ruangan kaca dan dibiarkan selama 24 jam yang diasumsikan sebagai pengeringan dengan sinar matahari. Kemudian diukur produk oksidasi primer dengan metode diene dan triene terkonjugasi, nilai peroksida, bilangan TBA dan analisis profil asam lemak.
Pengukuran Diene Terkonjugasi (AOAC 1995)
9
Cara menghitung konsentrasi diene: % Diene terkonjugasi = 0.91 x A
Pengukuran Nilai Peroksida (Apriyantono et al. 1989)
Pengukuran bilangan peroksida didasarkan pada jumlah iod yang dibebaskan dari potassium iodida melalui reaksi oksidasi oleh peroksida dalam lemak atau minyak pada suhu ruang di dalam medium asam asetat/ kloroform.
Sebanyak ± 0,5 gram minyak ditimbang dalam erlenmeyer 250 ml dan ditambahkan 30 ml pelarut yang terdiri dari 60 % asam asetat glasial dan 40 % kloroform, dikocok sampai semua minyak larut. Kemudian ditambahkan 0,5 ml larutan potasium iodida jenuh dan didiamkan selama 2 menit di ruang gelap sambil digoyang. Ditambahkan 30 ml air destilata. Kelebihan iod dititer dengan larutan sodium tiosulfat 0,1 N atau 0,001 N tergantung dari banyaknya jumlah iod yang dibebaskan. Blanko dibuat dengan cara yang sama.
Bilangan peroksida dinyatakan dalam miliequivalen per 1000 gram sampel minyak dengan rumus :
A x N x 1000/G
Dimana : A = ml sodium tiosulfat yang dipakai contoh – ml Sodium tiosulfat yang dipakai untuk penetapan blanko.
N= Normalitas sodium tiosulfat. G= Berat contoh minyak/lemak (gram)
Uji TBA (Tarladgis et al. diacu dalam Apriyantono et al. 1989)
2-asam tiobarbiturat bereaksi dengan malonaldehid membentuk warna merah, intensitas warna merah yang terbentuk dapat diukur pada spektrophotometer.
10
batu didih dan pencegah buih (anti foaming agent) secukupnya dan pasanglah labu distilasi pada alat distilasi. Jika ada gunakan electric mantle heater. Distilasi dijalankan dengan pemanasan tinggi sehingga diperoleh 50 ml destilat selama 10 menit pemanasan. Aduk merata distilat yang diperoleh, pipet 5 ml distilat ke dalam tabung reaksi bertutup. Tambahkan 5 ml pereaksi TBA, tutup, campur merata lalu panaskan selama 35 menit dalam air mendidih. Buat blanko dengan menggunakan 5 ml aquades dan 5 ml pereaksi, lakukan seperti penetapan sampel. Dinginkan tabung reaksi dengan air pendingin selama ± 10 menit kemudian diukur absorbansinya (D) pada panjang gelombang 528 nm dengan larutan blanko sebagai titik nol. Sampel sel yang digunakan berdiamater 1 cm. Bilangan TBA dinyatakan dalam mg malonaldehid per kg sampel.
Perhitungan TBA = 3 xabsorbansi x7,8
sampel berat
Analisis Komponen Asam Lemak pada Minyak Ikan
Sebelum analisis dilakukan, minyak ikan harus dimetilasi terlebih dahulu untuk pembentukan senyawa turunan asam lemak menjadi metil ester serta untuk memisahkan senyawa-senyawa lain. Proses metilasi dilakukan menurut metode IUPAC (1987) dalam Apriyantono (2003). Sampel minyak ditimbang ke dalam tabung reaksi bertutup dan ditambahkan satandar internal (asam margarat, C17) sebanyak 1 mg. Kemudian ditambahkan 2 ml NaOH dalam metanol 0,5 N dan dihembuskan gas N2 untuk mencegah terjadinya oksidasi lemak. Tabung reaksi dipanaskan selama 15 menit dalam waterbath dengan suhu 80 oC dan didinginkan. Kemudian ditambahkan BF3- metanol 14 % sebanyak 22 ml dan dihembuskan gas N2, dipanaskan kembali selama 15 menit dengan suhu 80 oC dan didinginkan hingga suhu 50 oC. Ditambahkan 1 ml n-heksan Chromatography Grade, dihembuskan N2 dan divortex. Selanjutnya ditambahkan NaCl jenuh sebanyak 3 ml dan divortex, dibiarkan hingga terpisah menjadi dua fase. Lapisan atas diambil (asam lemak dalam heksan) dan disaring dengan Na2SO4 anhydrous dan ditampung di vial. Metil Ester siap diinjeksikan pada gas kromatografi.
11
100 oC dengan tekanan gas helium 1 kg/cm2. Detektor dinyalakan dengan tekanan udara dan hidrogen masing-masing 0,5 kg/cm2. Suhu diprogram pada 120 oC selama 6 menit kemudian dinaikkan secara gradien linier dengan kecepatan kenaikan suhu 3 oC/ menit hingga suhu mencapai 230 oC dan ditahan selama 20 menit. Sampel diinjeksikan sebanyak 1 μl dengan teknik split ratio kira-kira 1 : 30.
Setelah conditioning selesai yang ditandai dengan base line yang lurus pada kromatogram tanpa ada muncul peak-peak tertentu, diinjeksikan standar eksternal FAME Mix C8 – C22 dan sampel yang akan dianalisis.
Kromatogram yang diperoleh dari hasil analisis asam-asam lemak diidentifikasi dengan membandingkan dengan kromatogram standar eksternal. Kemudian dihitung respon faktor dari tiap-tiap asam lemak pada standar eksternal
dengan rumus :
Asam lemak pada sampel dihitung dengan rumus :
sampel
HASIL DAN PEMBAHASAN
Karakterisasi dan Ekstraksi Antioksidan dari Kulit Pisang serta Karakterisasi Ekstrak Antioksidan Kulit Pisang
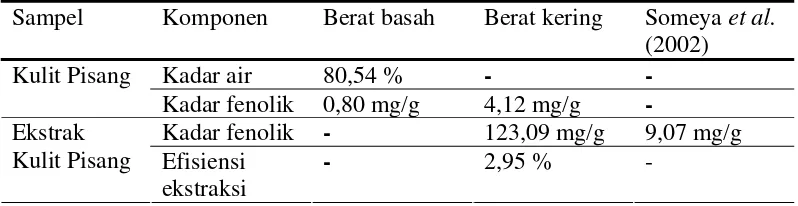
Sebelum proses ekstraksi dilakukan, terlebih dahulu diukur kadar air dan kadar fenol yang terkandung pada kulit pisang. Hal ini dilakukan untuk mempermudah perhitungan rendemen ekstrak yang dihasilkan. Pada Tabel 2 dapat dilihat hasil analisis kadar air dan kadar fenol pada kulit pisang.
Tabel 2 Karakteristik kulit pisang dan ekstrak antioksidan kulit pisang
Sampel Komponen Berat basah Berat kering Someya et al.
(2002)
Kadar air 80,54 % - -
Kulit Pisang
Kadar fenolik 0,80 mg/g 4,12 mg/g -
Kadar fenolik - 123,09 mg/g 9,07 mg/g Ekstrak
Kulit Pisang Efisiensi ekstraksi
- 2,95 % -
Kadar air yang terkandung pada kulit pisang cukup tinggi yaitu 80,54 % dari berat basahnya. Menurut komposisi kimianya, air merupakan komponen tertinggi yang terkandung pada buah pisang. Pada jenis pisang yang dapat dimakan langsung, kulit yang masih hijau mengandung 90 % air, sedangkan pada jenis pisang pati yang harus diolah terlebih dahulu sebelum dimakan, kadar air pada kulit kurang dari 86 % Turner (2001). Pisang kepok yang digunakan termasuk jenis pisang pati yang tidak dimakan langsung saat buah telah matang. Pisang kepok mengandung kadar pati yang tinggi dan kadar gula yang rendah, sehingga lebih banyak diolah menjadi penganan terlebih dahulu sebelum dimakan. Dari segi industri, pisang kepok lebih banyak digunakan untuk pembuatan keripik pisang dan tepung pisang, sehingga pemanfaatan limbah kulit pisang kepok sebagai sumber fenolik sangat memungkinkan.
kadar total fenol pada kulit pisang adalah sekitar 387,34 mg/kg berat basah (0,387 mg/g berat basah) atau 3606,55 mg/kg berat kering (3,61 mg/g berat kering). Sedangkan kadar total fenol yang diperoleh pada penelitian ini yaitu sekitar 0,80 mg/g berat basah dan sekitar 4,12 mg/g berat kering (Lampiran 2 dan 3). Perhitungan dilakukan berdasarkan persamaan yang diperoleh dari kurva standar yang dibuat untuk perhitungan kadar fenol (Lampiran 1). Perbedaan kadar total fenol dapat dipengaruhi faktor jenis pisang, tingkat kematangan, cara panen, tempat tumbuh maupun metode pemeliharaannya juga memberikan pengaruh terhadap kadar total fenol (Mendez 2001; Kanazawa dan Sakakibara 2000 dan Turner 2001).
Proses Ekstraksi
Sebelum proses ekstraksi dilakukan, kulit pisang dipotong kecil-kecil berbentuk kubus (± 1 cm) dan direbus selama 5 menit dengan perbandingan sampel dan air adalah 1 : 3. Perebusan ini dimaksudkan untuk menginaktifkan enzim polifenoloksidase yang dapat menyebabkan komponen polifenol pada kulit pisang mengalami kerusakan. Enzim ini dapat mengkatalisis terjadinya oksidasi fenol sehingga menghasilkan quinone yang sangat aktif yang dapat bereaksi dengan gugus amino dan sulfihidril pada protein dan enzim sehingga merubah karakteristik fisik, kimia dan nutrisi protein dan juga sifat sensori pangan serta menyebabkan terjadinya pencoklatan (Shahidi dan Naczk 1995).
Setelah dilakukan perebusan, kulit pisang beserta air rebusan diblender hingga hancur agar permukaan bahan lebih luas sehingga lebih mempermudah kerja pelarut selama proses ekstraksi. Kemudian kulit pisang yang telah diblender bersama air rebusan diekstrak dengan cara dipanaskan dalam waterbath shaker
selama dua jam pada suhu 90 °C. Dengan cara ini, komponen-komponen antioksidan yang pada umumnya bersifat larut air dapat terekstrak dari kulit pisang.
kertas saring akan tersumbat dengan adanya getah dan pati yang menggumpal karena panas. Diketahui bahwa pisang mengandung karbohidrat yang cukup tinggi. Pada pisang yang belum matang, konsentrasi pati yang tinggi akan berkurang seiring dengan kematangan buah (Turner 2001).
Ekstrak air kemudian dilarutkan dalam pelarut air-kloroform (1:1 v/v), dan diektraksi dengan cara dishaker selama 30 menit untuk kemudian dipisahkan pada labu pemisah. Ekstraksi dengan kloroform dimaksudkan untuk menghilangkan senyawa-senyawa lemak yang masih terikut pada ekstrak air. Fase air kemudian diambil dan diekstrak lagi dengan pelarut air-etil asetat untuk kemudian diuapkan dengan rotavary evaporator dan ditiupkan gas nitrogen.
Pelarut yang secara umum digunakan untuk untuk ekstraksi total fenolik adalah alkohol dan aseton. Prosedur ekstraksi bergantung pada karakteristik produk tumbuhan yang digunakan, seperti biji-bijian kaya akan minyak, daun kaya akan klorofil, resin dan lignin yang harus dipisahkan dengan petroleum eter ringan sebelum fraksi ekstraksi komponen fenolik diambil. Sedangkan ekstraksi dengan etil asetat dimaksudkan untuk memperoleh flavon, flavonol, leukoantosianin dan beberapa polimer rendah (Ranganna 1978).
Dalam proses ekstraksi kulit pisang digunakan metode ekstraksi bertingkat dengan tiga macam pelarut yaitu air, kloroform dan etil asetat agar senyawa-senyawa yang tidak diinginkan seperti lilin, getah, klorofil dan tanin tidak terikut dalam ekstrak. Proses ekstraksi ini dilakukan berdasarkan metode yang digunakan oleh Someya et al. (2002). Dengan metode ekstraksi tersebut diketahui bahwa komponen fenolik yang terkandung pada pisang merupakan senyawa flavonoid galokatekin, katekin dan epikatekin. Metode ekstraksi dengan pelarut yang sama juga digunakan untuk mengekstrak senyawa flavonoid katekin dan turunannya yang terkandung pada daun teh (Wanasundara dan Shahidi 1998).
Sedangkan Parejo et al. (2003) mengekstrak tumbuhan dari Famili Asteraceae yang terdapat di Bolivia dengan metode ekstraksi bertingkat. Ekstrak pertama-tama diperoleh dengan menggunakan pelarut metanol, kemudian diekstrak lagi dengan air untuk memperoleh ekstrak kasar. Ekstrak kasar dipisahkan dengan pelarut heksan sehingga diperoleh ekstrak air dan heksan. Ekstrak air yang diperoleh dari pemisahan tersebut kemudian dipisahkan kembali dengan menggunakan dietil eter dan etil asetat sehingga diperoleh ekstrak fase dietil eter, ekstrak fase etil asetat dan ekstrak fase air. Seluruh fase ekstrak yang diperoleh kemudian diuji aktivitas antioksidannya. Fase etil asetat menunjukkan aktivitas antioksidan yang paling baik jika dibandingkan dengan ekstrak lainnya.
Berat ekstrak yang dihasilkan dengan metode ekstraksi bertingkat menggunakan air, kloroform dan etil asetat pada penelitian ini sekitar 0,35 g dari 1801,83 g kulit pisang segar, atau sebesar 0,02 % dari berat basah (Lampiran 6). Berbeda dari yang dihasilkan oleh Someya et al. (2002), dimana dari 300 gram kulit pisang segar dihasilkan 3,07 gram ekstrak. Sedangkan Kanazawa dan Sakakibara (2000) mengekstrak 1050 gram kulit pisang segar sehingga menghasilkan 29,84 gram ekstrak. Perbedaan ini dapat disebabkan oleh faktor jenis pisang yang digunakan, tingkat kematangan, maupun modifikasi proses ekstraksi yang dilakukan.
diperoleh dari ekstrak etil asetat daun teh menghasilkan rendemen yang cukup kecil jika dibandingkan dengan ekstrak air panas dan ekstrak etanol daun teh, tetapi memiliki daya reduksi yang paling baik dibandingkan ekstrak air panas dan etanol. Hal ini diduga karena ekstrak etil asetat murni mengandung komponen katekin yang sangat berperan sebagai antioksidan. Pada penelitian ini, perlu dilakukan evaluasi kembali terhadap proses ekstraksi yang dilakukan apabila ekstrak akan digunakan dalam kapasitas besar karena proses ekstraksi ini menghasilkan efisiensi ekstraksi yang cukup kecil dengan bahan baku dan pelarut yang digunakan cukup tinggi.
Karakterisasi Ekstrak Antioksidan Kulit Pisang
Untuk mengetahui kadar total fenol pada ekstrak, dilakukan analisis total fenolik dengan metode yang sama dengan pengukuran total fenol pada kulit pisang. Kadar fenol pada ekstrak kulit pisang adalah sekitar 123,09 mg/g ekstrak kering (Lampiran 5). Pengukuran kandungan fenolik pada ekstrak kulit pisang dilakukan untuk mempermudah pembuatan konsentrasi ekstrak yang akan diuji aktivitasnya untuk mempertahankan stabilitas minyak ikan. Selain diukur total fenol, ektrak juga di uji golongan senyawa fenolik yang terkandung di dalamnya secara kualitatif. Hasil uji dapat dilihat pada Tabel 3 dan untuk lebih jelasnya dapat dilihat Lampiran 9.
Tabel 3 Hasil uji kualitatif golongan senyawa fenolik Jenis Uji Kualitatif Hasil
Uji Polifenol Positif Uji Flavonoid Positif
Uji Tanin Negatif
Selain dilakukan uji golongan fenolik secara kualitatif, ekstrak juga diuji komponen klorofilnya. Metode ekstraksi yang telah dilakukan oleh Wanasundara dan Shahidi (1998) terhadap daun teh, menghasilkan ekstrak etil asetat yang mengandung klorofil, walaupun metode ekstraksi telah dilakukan secara bertingkat. Oleh karena kulit pisang yang digunakan sebagai bahan baku ekstraksi adalah kulit pisang yang masih hijau, sehingga diduga ekstrak juga masih mengandung klorofil yang dapat mempengaruhi efektifitas antioksidan ekstrak. Hasil uji ekstrak terhadap komponen klorofil dengan TLC memperlihatkan bahwa spot yang terbentuk tidak terpisah dengan baik, sehingga pendugaan terhadap komponen klorofil belum dapat dijelaskan (Gambar 9). Oleh karena itu kemudian dilakukan pelarutan spot TLC dengan pelarut aseton dan dilakukan scanning pada panjang gelombang penyerapan klorofil yaitu antara 350 hingga 750 nm. Dari hasil scanning yang dilakukan, muncul dua peak pada masing masing ulangan ekstrak yaitu pada panjang gelombang 414 nm dan 659,5 nm untuk ekstrak ulangan I dan 412,5 nm dan 659 nm untuk ekstrak ulangan ke dua (Gambar 9).
Gambar 9 Kromatogram TLC (Thin Layer Chromatography) ekstrak antioksidan kulit pisang kepok dengan plat selulose untuk uji kualitatif klorofil dan hasil scanning absorbansi ekstrak pada λ 350-750 nm
Klorofil a
Klorofil b
1 2 Ekstrak daun suji
K
Klloorrooffiillaa’’&&eettiill k
klloorrooffiilliiddaa
K
Klloorrooffiilliiddaa&&eettiill k
klloorrooffiilliiddaa
3
3550 0..0 0 775500..0 0 4
Peak yang muncul pada panjang gelombang 412,5 nm dan 414 nm mendekati panjang gelombang maksimum klorofil a’ dan etil klorofilid a dalam pelarut dietil eter. Sedangkan peak yang muncul pada panjang gelombang 659 nm dan 659, 5 nm mendekati panjang gelombang klorofilid a dan etil klorofilid a dalam pelarut dietil eter (Prangdimurti 2007).
Hasil Uji Stabilitas Oksidasi Minyak Ikan dengan Katalis Panas dan Cahaya
Nilai Diene Terkonjugasi
Pengukuran diene terkonjugasi merupakan salah satu cara yang efektif untuk mengukur stabilitas oksidatif minyak (Yoon et al. dalam Iqbal dan Bhanger 2007) sehingga dapat digunakan sebagai indikator efektivitas penggunaan antioksidan. Pengukuran didasarkan pada terjadinya pergeseran posisi ikatan rangkap pada oksidasi asam lemak tidak jenuh ganda yang disebut dengan diene atau triene terkonjugasi. Konjugasi diene yang terbentuk menyerap cahaya ultraviolet pada panjang gelombang 232-234 nm ( Gordon 2001; Rosell 1983).