EKSTRAKSI DAN KARAKTERISASI KOLAGEN DARI
KULIT IKAN TONGKOL (
Euthynnus
affinis
)
ARMAN HARTONO KOMALA
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul “Ekstraksi dan Karakterisasi Kolagen dari Kulit Ikan Tongkol (Euthynnus affinis)” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juli 2015
ABSTRAK
ARMAN HARTONO KOMALA. Ekstraksi dan Karakterisasi Kolagen dari Kulit Ikan Tongkol (Euthynnus affinis). Dibimbing oleh PIPIH SUPTIJAH dan TATI NURHAYATI.
Kolagen merupakan protein paling berlimpah yang terdapat didalam tubuh makhluk hidup dan jumlahnya sekitar 30% dari total protein keseluruhan. Pemanfaatan limbah kulit ikan tongkol menjadi kolagen adalah salah satu alternatif untuk meningkatkan nilai ekonomis limbah. Proses pretreatment dalam mengekstraksi kolagen sangat berpengaruh terhadap kualitas kolagen yang dihasilkan. Pretreatment yang digunakan yaitu perbedaan konsentrasi NaOH (0,05; 0,1; dan 0,2 M) dan lama perendaman (2, 4, 6, 8, 10, dan 12 jam). Hasil pretreatment terbaik diperoleh dari perendaman kulit dalam larutan NaOH 0,05 M selama 12 jam dengan nilai konsentrasi protein non-kolagen terlarut yang paling rendah yaitu sebesar 0,140 mg/mL. Rendemen dan pH kolagen terbaik yang diperoleh yaitu 7,46% dan 5,29. Kelarutan tertinggi kolagen sebesar 90,80% pada pH 3. Analisis asam amino menunjukkan bahwa kolagen memiliki glisina, prolina, arginina, dan alanina yang dominan. Analisis FTIR menunjukkan wilayah penyerapan utama amida A, B, I, II, dan III dengan masing-masing bilangan gelombang yaitu 3395 cm-1, 2929 cm-1, 1652 cm-1, 1543 cm-1, dan 1237 cm-1.
Kata kunci: asam amino, FTIR, ikan tongkol, kolagen, rendemen
ABSTRACT
ARMAN HARTONO KOMALA. Extraction and Characterization of Collagen from the Skin of Eastern Little Tuna (Euthynnus affinis). Supervised by PIPIH SUPTIJAH and TATI NURHAYATI.
Collagen is the most abundant protein in the living body and comprising approximately 30% of the total protein content. Utilization of waste from the skin of eastern little tuna to produce collagen is one alternative to increase the economic value of its waste. Pretreatment process in extracting collagen affects the quality of collagen that obtained. The different concentration of NaOH (0.05; 0.1; and 0.2 M) and soaking time (2, 4, 6, 8, 10, and 12 hours) were used as the pretreatment step. The best result of pretreatment was obtained from soaking the skin in a solution of 0.05 M NaOH for 12 hours with the lowest of soluble non-collagen protein concentration was 0.140 mg/mL. The yield and pH of the best collagen were 7.459% and 5.29, respectively. The highest solubility of collagen was 90.80% at pH 3. Amino acid analysis showed that the collagen has a glycine, proline, arginine, and alanine were dominant. FTIR analysis showed the major absorption bands of amide A, B, I, II, and III were at wavenumber 3395 cm-1, 2929 cm-1, 1652 cm-1, 1543 cm-1, and 1237 cm-1, respectively.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
EKSTRAKSI DAN KARAKTERISASI KOLAGEN DARI
KULIT IKAN TONGKOL (
Euthynnus
affinis
)
ARMAN HARTONO KOMALA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan
pada
Departemen Teknologi Hasil Perairan
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul Skripsi : Ekstraksi dan Karakterisasi Kolagen dari Kulit Ikan Tongkol (Euthynnusaffinis)
Nama : Arman Hartono Komala
NIM : C34110009
Program Studi : Teknologi Hasil Perairan
Disetujui oleh
Dr Dra Pipih Suptijah MBA Pembimbing I
Dr Tati Nurhayati SPi MSi Pembimbing II
Diketahui oleh
Prof Dr Ir Joko Santoso MSi Ketua Departemen
KATA PENGANTAR
Puji dan syukur penulis panjatkan kepada Tuhan Yesus Kristus atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Judul yang dipilih dalam penelitian yang dilaksanakan sejak bulan Februari 2015 ini ialah “Ekstraksi dan Karakterisasi Kolagen dari Kulit Ikan Tongkol (Euthynnusaffinis)”.
Pada kesempatan ini, dengan segala kerendahan hati penulis ingin mengucapkan terima kasih kepada semua pihak yang telah memberikan bantuan dan dorongan hingga penulis dapat menyelesaikan karya ilmiah ini, yaitu:
1. Dr Dra Pipih Suptijah MBA dan Dr Tati Nurhayati SPi MSi selaku dosen pembimbing yang telah memberikan banyak bantuan serta pengarahan selama proses penelitian dan penulisan.
2. Prof Dr Ir Joko Santoso MSi selaku Ketua Departemen Teknologi Hasil Perairan.
3. Dr Mala Nurilmala SPi MSi selaku dosen penguji yang memberikan masukkan kepada penulis.
4. Staf dosen, pegawai, dan staf tata usaha Departemen Teknologi Hasil Perairan.
5. Mama Ouw Yuli, (Alm.) Papa Khouw Sin Ing, dan keluarga yang selalu memberikan semangat dan cinta yang luar biasa kepada penulis.
6. Nur Faizah, Wekson B, Iman D, Paula, dan Ayumi selaku teman seperjuangan selama penelitian ini.
7. Krisye MS, Sara CW, Lina Y, dan geng biotek lainnya yang selalu memberikan bantuan.
8. Teman-teman THP 48 untuk kebersamaan, bantuan, dan kerjasama selama menempuh studi di THP.
Semoga karya ilmiah ini bermanfaat.
Bogor, Juli 2015
DAFTAR ISI
DAFTAR TABEL ... ii
DAFTAR GAMBAR ... ii
DAFTAR LAMPIRAN ... ii
PENDAHULUAN ... 1
Latar Belakang ... 1
Perumusan Masalah ... 2
Tujuan Penelitian ... 2
Manfaat Penelitian... 2
Ruang Lingkup Penelitian ... 2
METODE PENELITIAN ... 3
Waktu dan Tempat ... 3
Bahan dan Alat ... 3
Prosedur Penelitian ... 3
Metode Analisis ... 4
HASIL DAN PEMBAHASAN ... 11
Karakteristik Ikan Tongkol ... 11
Pretreatment Kolagen ... 12
Karakteristik Kolagen Kulit Ikan Tongkol Terbaik ... 14
Rendemen kolagen terbaik ... 14
Nilai pH kolagen terbaik ... 15
Komposisi asam amino kolagen terbaik ... 15
Kelarutan kolagen terbaik ... 16
Gugus fungsi kolagen terbaik dengan FTIR ... 17
KESIMPULAN DAN SARAN ... 20
Kesimpulan ... 20
Saran ... 20
DAFTAR PUSTAKA ... 20
LAMPIRAN ... 25
DAFTAR TABEL
1 Komposisi kimia kulit ikan tongkol dan beberapa kulit ikan lainnya ... 12
2 Rendemen kolagen kulit ikan tongkol dan beberapa kulit ikan lainnya ... 15
3 Nilai pH kolagen kulit ikan tongkol dan beberapa kulit ikan lainnya ... 15
4 Komposisi asam amino kolagen dari kulit ikan tongkol dan ikan lainnya ... 16
5 Karakteristik gugus fungsi kolagen kulit ikan tongkol dan ikan lainnya ... 18
DAFTAR GAMBAR
1 Diagram alir pembuatan kolagen kulit ikan tongkol (Euthynnusaffinis) ... 52 Proporsi bagian tubuh ikan tongkol ( ) daging, ( ) jeroan, ( )tulang, ( ) kepala, ( ) kulit ... 11
3 Konsentrasi protein terlarut pada NaOH sisa perendaman kulit ikan tongkol berdasarkan hasil uji DMRT pengaruh konsentrasi NaOH ... 13
4 Konsentrasi protein terlarut pada NaOH sisa perendaman kulit ikan tongkol berdasarkan hasil uji DMRT pengaruh lama perendaman ... 13
5 Kelarutan kolagen kulit ikan tongkol pada beberapa pH ... 17
6 Spektra inframerah kolagen kulit ikan tongkol ... 18
DAFTAR LAMPIRAN
1 Morfometrik dan bobot ikan tongkol ... 262 Kurva regresi linear standar BSA... 26
3 Hasil analisis ragam (ANOVA) pretreatment kolagen kulit ikan tongkol ... 26
4 Hasil uji DMRT untuk pengaruh konsentrasi NaOH terhadap nilai konsentrasi protein larutan sisa perendaman ... 26
5 Hasil uji DMRT untuk pengaruh lama perendaman terhadap nilai konsentrasi protein larutan sisa perendaman ... 27
6 Dokumentasi kolagen kulit ikan tongkol ... 27
7 Rekapan hasil analisis asam amino kolagen ... 27
PENDAHULUAN
Latar Belakang
Ikan tongkol (Euthynnus affinis) merupakan ikan pelagis dari suku Scombridae yang bernilai ekonomis tinggi dan satu kerabat dengan ikan tuna maupun cakalang. Produksi ikan tongkol pada tahun 2014 mencapai 454.180 ton dan mengalami peningkatan dibandingkan 4 tahun sebelumnya, yaitu tahun 2010 sebesar 390.595 ton, tahun 2011 sebesar 415.331 ton, tahun 2012 sebesar 432.138 ton, dan tahun 2013 sebesar 451.048 ton (KKP 2014). Ikan tongkol banyak dimanfaatkan masyarakat Indonesia untuk diolah dagingnya. Pemanfaatan daging ikan tongkol tidak hanya sebatas dijadikan dalam bentuk pindang tongkol maupun tongkol asap, namun sudah banyak masyarakat yang mengolahnya menjadi produk olahan misalnya nugget, siomay, dan abon ikan. Pengolahan tersebut tentunya menghasilkan limbah yang berupa kepala, tulang, jeroan, dan kulit yang jumlahnya mencapai 50-70% dari total berat bahan baku (Kittiphattanabawon et al. 2005). Limbah yang dihasilkan akan benilai ekonomis jika dilakukan pengolahan lebih lanjut. Salah satu upaya untuk memanfaatkan limbah tersebut adalah mengolah kulit ikan tongkol untuk dijadikan sebagai bahan baku pembuatan kolagen.
Kolagen merupakan protein paling berlimpah yang terdapat di dalam tubuh makhluk hidup dan jumlahnya sekitar 30% dari total protein keseluruhan (Zhang et al. 2009). Lee et al. (2001) menyatakan kolagen merupakan biomaterial yang penting dalam aplikasi medis karena memiliki karakteristik khusus, yaitu bersifat biodegradable. Kolagen juga berperan penting dalam pembentukan jaringan dan organ, serta terlibat dalam berbagai ekspresi fungsional sel. Kittiphattanabawon et al. (2005) menyatakan bahwa selain untuk aplikasi medis, kolagen juga sudah dimanfaatkan untuk industri film, farmasi, kosmetik, dan makanan.
Industri kolagen sebenarnya saat ini sudah banyak dikembangkan, namun sebagian besar kolagen tersebut diproduksi dari kulit dan tulang sapi maupun babi. Kolagen dari sumber tersebut kurang sesuai dengan keyakinan agama tertentu misalnya Islam, Yahudi, dan Hindu (Choi et al. 2013). Kolagen dari kulit dan tulang sapi maupun babi juga dapat menimbulkan beberapa resiko penyakit yaitu bovine spongiform encephalopathy (BSE), transmissible spongiform encephalopathy (TSE), foot-and-mouth disease (FMD), dan flu babi (Jongjareonrak et al. 2005). Kolagen dari sumber alternatif lain diperlukan untuk mengatasi masalah ini. Kittiphattanabawon et al. (2010) menyatakan bahwa kolagen alternatif dapat bersumber dari ikan terutama dari bagian kulit dan tulang yang juga merupakan bagian dari limbah hasil pengolahan.
2
kulit, ligamen, tulang, sendi, otot, tendon, gusi, mata, pembuluh darah, kuku, dan rambut (Kumar et al. 2011).
Proses ekstraksi kolagen kulit dan tulang ikan dapat dilakukan dengan tiga metode umum yaitu neutral salt-solubilized collagen, acid-solubilized collagen, and pepsin-solubilized collagen (Aberoumand 2012). Kolagen dari kulit ikan lebih mudah untuk diekstraksi daripada kolagen dari tulang ikan. Hal ini disebabkan kulit ikan memiliki tekstur yang lebih lunak dibandingkan dengan tulang sehingga proses berlangsungnya ekstraksi lebih cepat. Proses pretreatment menggunakan NaOH juga penting dilakukan untuk menghilangkan protein non-kolagen yang terkandung dalam kulit. Proses pretreatment juga berpengaruh terhadap kualitas kolagen yang dihasilkan. Oleh karena itu, pemanfaatan limbah kulit ikan tongkol untuk dijadikan sebagai sumber kolagen alternatif memiliki potensi yang sangat baik untuk dikembangkan guna meningkatkan nilai komersial yang lebih tinggi.
Perumusan Masalah
Limbah ikan tongkol belum dimanfaatkan secara optimal. Pembuatan kolagen dari kulit ikan tongkol merupakan salah satu upaya untuk memanfaatkan limbah yang dihasilkan serta dapat meningkatkan nilai ekonomis. Kolagen dari kulit ikan tongkol juga diharapkan dapat digunakan sebagai alternatif pengganti kolagen dari sapi dan babi yang kurang sesuai dengan keyakinan agama tertentu dan memiliki resiko yang tinggi terhadap penyakit. Karakterisasi kolagen dari kulit ikan tongkol diperlukan untuk dijadikan sebagai referensi mengenai kualitas kolagen yang dihasilkan dan aplikasinya.
Tujuan Penelitian
Tujuan penelitian ini adalah menentukan proses pretreatment terbaik dalam menghilangkan protein non-kolagen yang terkandung dalam kulit ikan tongkol, mengekstraksi kolagen dari proses pretreatment terbaik, dan mengkarakterisasi kolagen terbaik yang dihasilkan.
Manfaat Penelitian
Penelitian ini diharapkan dapat menjadi upaya pemanfaatan hasil samping perikanan dan memberikan informasi mengenai karakteristik kolagen yang dihasilkan dari kulit ikan tongkol.
Ruang Lingkup Penelitian
3
METODE PENELITIAN
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Februari 2015 sampai Juni 2015. Preparasi sampel, analisis pH, analisis kelarutan, dan Uji Bradford dilakukan di Laboratorium Pengetahuan Bahan Baku Industri Hasil Perairan, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Ekstraksi kolagen dilakukan di Laboratorium Preservasi dan Diversifikasi Hasil Perairan, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Analisis proksimat dilakukan di Laboratorium Biokimia Hasil Perairan, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Analisis asam amino dilakukan di Laboratorium Saraswanti Indo Genetech, Bogor. Analisis Gugus Fungsi dilakukan di Laboratorium Pusat Studi Biofarmaka, Institut Pertanian Bogor.
Bahan dan Alat
Bahan utama yang digunakan dalam penelitian ini adalah ikan tongkol dengan rata-rata bobot dan panjang total sebesar 480,5 g dan 34,05 cm (data lengkap morfometrik ikan tongkol pada Lampiran 1). Bahan yang digunakan untuk ekstraksi kolagen adalah akuades, NaOH, asam asetat (CH3COOH), kertas saring Whatman 1, dan larutan Bradford (coomassie briliant blue, etanol 96%, dan asam fosfat 85%). Bahan-bahan lain meliputi bahan untuk analisis karakteristik kolagen.
Alat yang digunakan untuk ekstraksi kolagen yaitu timbangan digital (Sartorius TE 64), termometer, waterbath shaker, spektrofotometer UV-VIS (Hitachi UV-2500), dan freeze dryer (Eyela FDU-1200). Alat-alat yang digunakan untuk analisis adalah pH meter (Eutech Instruments), Fourier Transform InfraRed (Bruker Tensor 37), dan High Performance Liquid Chromatography (Waters Coorporation USA).
Prosedur Penelitian
Penelitian ini diawali dengan pengambilan sampel ikan tongkol di Pasar Cibinong, Kabupaten Bogor. Sampel dipreparasi dan diambil bagian kulitnya. Penelitian ini dilakukan dengan empat tahap yaitu karakterisasi ikan tongkol, penentuan proses pretreatment terbaik, ekstraksi kolagen, dan karakterisasi kolagen terbaik.
Preparasi bahan baku
4
meliputi penghitungan proporsi bagian tubuh ikan tongkol dan analisis proksimat kulit ikan tongkol.
Pretreatment kolagen (modifikasi Kittiphattanabawon et al. 2010)
Proses pretreatment kolagen dilakukan dengan perendaman kulit ikan tongkol pada larutan alkali (NaOH). Penggunaan larutan alkali bertujuan untuk menghilangkan protein non-kolagen pada sampel. Kulit ikan tongkol direndam dalam larutan NaOH konsentrasi 0,05 M; 0,1 M; dan 0,2 M dengan perbandingan 1:10 (b/v) selama 12 jam pada suhu ruang. Larutan NaOH diganti setiap 2 jam sekali, kemudian diuji kandungan protein secara kuantitatif dengan uji Bradford untuk melihat kandungan protein non-kolagen yang sudah terpisah dari kulit dan menentukan konsentrasi NaOH serta lama perendaman terbaik.
Ekstraksi kolagen (Nur’aenah 2013)
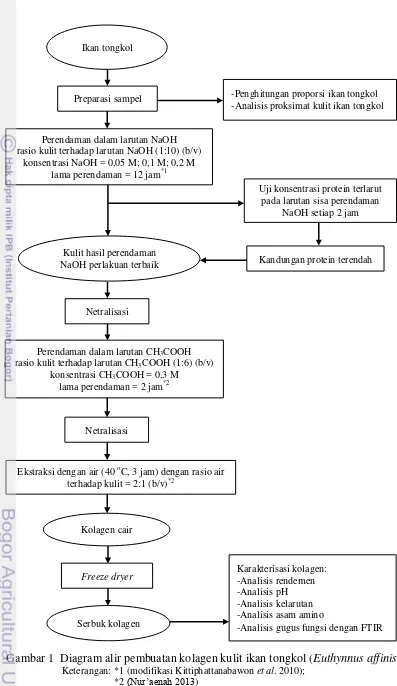
Pembuatan kolagen diawali dengan proses pretreatment dengan larutan NaOH. Hasil pretreatment terbaik kemudian dinetralisasi dengan akuades hingga netral. Proses selanjutnya yaitu hidrolisis kulit menggunakan larutan asam asetat (CH3COOH) yang dilakukan pada suhu ruang. Kulit direndam dalam larutan CH3COOH 0,3 M selama 2 jam dengan perbandingan sampel dan pelarut yaitu 1:6 (b/v). Sampel dinetralisasi menggunakan larutan akuades hingga netral. Sampel kemudian diekstraksi menggunakan akuades selama 3 jam pada suhu 40 °C dengan perbandingan sampel dan pelarut yaitu 1:2 (b/v). Hasil ekstraksi yang diperoleh merupakan kolagen cair yang selanjutnya perlu dikeringbekukan (freeze dry) agar diperoleh kolagen kering dalam bentuk lembaran, serbuk maupun kristal. Diagram alir pembuatan kolagen dari kulit ikan tongkol disajikan pada Gambar 1.
Metode Analisis
Analisis yang dilakukan untuk mengkarakterisasikan kolagen dari kulit ikan tongkol yaitu analisis proksimat, analisis protein terlarut, analisis rendemen, analisis kelarutan, analisis pH, analisis asam amino, analisis FTIR (Fourier Transform InfraRed), dan analisis data.
Analisis proksimat (SNI 01-2891-1992)
Analisis proksimat merupakan suatu analisis yang dilakukan untuk mengetahui komposisi kimia suatu bahan yang meliputi, analisis kadar air, kadar lemak, kadar protein, dan kadar abu.
1) Analisis kadar air
5
Gambar 1 Diagram alir pembuatan kolagen kulit ikan tongkol (Euthynnusaffinis) Keterangan: *1 (modifikasi Kittiphattanabawon et al. 2010);
*2 (Nur’aenah 2013) Ikan tongkol
Preparasi sampel
Perendaman dalam larutan NaOH rasio kulit terhadap larutan NaOH (1:10) (b/v)
konsentrasi NaOH = 0,05 M; 0,1 M; 0,2 M lama perendaman = 12 jam*1
-Penghitungan proporsi ikan tongkol -Analisis proksimat kulit ikan tongkol
Kulit hasil perendaman NaOH perlakuan terbaik
Uji konsentrasi protein terlarut pada larutan sisa perendaman
NaOH setiap 2 jam
Kandungan protein terendah
Netralisasi
Perendaman dalam larutan CH3COOH rasio kulit terhadap larutan CH3COOH (1:6) (b/v)
konsentrasi CH3COOH = 0,3 M lama perendaman = 2 jam*2
Ekstraksi dengan air (40 oC, 3 jam) dengan rasio air terhadap kulit = 2:1 (b/v)*2
Kolagen cair
Freeze dryer
Serbuk kolagen
Karakterisasi kolagen: -Analisis rendemen -Analisis pH -Analisis kelarutan -Analisis asam amino
6
Kadar air (%) = B–AB–C x 100%
Keterangan:
A = berat cawan kosong (g)
B = berat cawan + sampel awal (g) C = berat cawan + sampel kering (g)
2) Analisis kadar abu
Cawan porselen dikeringkan dahulu dalam oven pada suhu 105 °C selama 60 menit. Cawan porselen yang sudah kering dimasukkan dalam desikator selama 15 menit dan ditimbang hingga menunjukkan berat yang konstan. Selanjutnya sampel sebanyak 3 g ditimbang dan dimasukkan ke cawan porselen lalu dibakar di atas kompor listrik hingga tidak berasap. Setelah itu dimasukkan ke dalam tanur pengabuan dengan suhu 600 °C selama 6 jam. Cawan porselen yang berisi sampel hasil pengabuan dimasukkan ke dalam desikator selama 30 menit kemudian ditimbang hingga diperoleh berat yang konstan. Kadar abu dihitung dengan rumus:
Kadar abu (%) = C–AB–A x 100%
Keterangan :
A = berat cawan porselen kosong (g) B = berat cawan dengan sampel (g)
C = berat cawan dengan sampel setelah dikeringkan (g)
3) Analisis kadar protein
Pengukuran kadar protein dilakukan dengan metode semimikro kjeldahl. Sampel ditimbang sebanyak 0,5 g, kemudian dimasukkan ke dalam labu kjeldahl 100 mL, lalu ditambahkan setengah butir kjeltab (tablet katalis) dan 25 mL H2SO4 pekat. Sampel didestruksi pada suhu 410 °C selama kurang lebih 1 jam sampai larutan berwarna hijau jernih lalu didinginkan. Selanjutnya sampel dimasukkan ke dalam labu takar 100 mL dan ditambahkan akuades sampai dengan tanda tera. Sampel larutan tersebut dipipet 5 mL dan ditambahkan 10 mL NaOH 30% kemudian didestilasi dengan suhu destilator 100 °C. Hasil destilasi ditampung dalam labu Erlenmeyer 250 mL yang berisi 10 mL asam borat (H3BO3) 2% dan indikator campuran dari bromcherosol green 0,1% dan methyl red 0,1% dengan perbandingan 5:1. Destilasi dilakukan sampai diperoleh larutan berwarna hijau kebiruan. Destilat yang dihasilkan dititrasi dengan HCl 0,01 N sampai warna larutan berubah warna menjadi merah muda. Volume titran dibaca dan dicatat. Penetapan blanko dilakukan seperti tahapan sampel. Kadar protein dihitung dengan rumus:
7
Keterangan:
S = Volume titran sampel (mL) B = Volume titran blanko (mL)
N HCl = Normalitas HCl standar yang digunakan (mgrek/mL) 14,007 = Berat ekuivalen atom nitrogen (mg/mgrek)
FP = Faktor pengenceran W = Bobot sampel kering (mg)
Kadar protein (%) = Nitrogen (%) x faktor konversi
Keterangan: Protein mengandung rata-rata 16 % nitrogen
Faktor konversi = 100%16% = 6,25
4) Analisis kadar lemak
Labu lemak dikeringkan terlebih dahulu dalam oven bersuhu 105 °C selama 30 menit, setelah itu dimasukkan dalam desikator selama 15 menit dan ditimbang hingga berat yang konstan. Sampel ditimbang sebanyak 2 g dan dimasukkan ke dalam selongsong kertas saring yang dialasi dengan kapas (selongsong lemak) dan sumbat selongsong kertas berisi sampel tersebut dengan kapas, kemudian dimasukkan ke dalam alat ekstraksi (soxhlet) yang telah dihubungkan dengan labu lemak. Proses ekstraksi dilakukan selama 6 jam dengan pelarut heksana sebanyak 150 mL. Campuran heksana dan lemak didestilasi hingga terpisah lemak dari pelarutnya. Labu lemak yang berisi lemak hasil ekstraksi dipanaskan dalam oven pada suhu 105 °C selama 60 menit dan dimasukkan dalam desikator selama
C = Berat labu lemak + lemak hasil ekstraksi (g)
Analisis protein terlarut (Bradford 1976)
Uji Bradford dilakukan untuk menentukan konsentrasi protein pada sampel dengan Bovine Serum Albumin (BSA) sebagai standar. Larutan Bradford dibuat dengan mencampurkan 10 mg coomassie briliant blue (CBB) dengan 5 mL etanol 95%, kemudian ditambahkan 10 mL larutan asam fosfat 85%, dan akuades hingga volumenya mencapai 500 mL. Campuran dihomogenkan (dikocok kuat) kemudian disaring menggunakan kertas saring Whatman 1. Larutan Bradford selanjutnya disimpan pada botol gelap dan suhu chilling hingga akan digunakan.
8
5 mL larutan Bradford dan divortex. Sampel kemudian ditentukan absorbansinya dengan spektrofotometer UV-2500 pada ƛ = 595 nm.
Analisis rendemen
Rendemen kolagen diperoleh dari perbandingan berat kering kolagen yang dihasilkan dengan berat bahan baku kulit. Rendemen diperoleh dengan rumus:
Rendemen kolagen % = Berat bahan baku kulit (g)Berat kering kolagen (g) x 100%
Analisis pH (Apriyantono et al. 1989)
Analisis pH dilakukan dengan menggunakan pH meter digital. Alat pH meter harus dibilas dahulu menggunakan akuades dan dikeringkan dengan tisu sebelum digunakan. Kolagen kering sebanyak 0,1 g ditimbang dan dilarutkan dalam 10 mL akuades lalu dihomogenkan. Selanjutnya elektroda pada pH meter dicelupkan ke dalam sampel sampai diperoleh angka yang stabil pada proyektor pH meter.
Analisis kelarutan (modifikasi Shon et al. 2011)
Analisis kelarutan dilakukan dengan membuat larutan pada kisaran pH 2-8 masing-masing sebanyak 10 mL dengan menggunakan akuades, asam asetat, dan NaOH. Selanjutnya 0,1 g kolagen kering dilarutkan masing-masing dalam larutan pH yang telah dibuat. Sampel diaduk hingga larut selama 15 menit. Selanjutnya larutan disaring menggunakan kertas saring bebas abu (Whatman 42) kemudian dioven dengan suhu 100 °C selama 20 menit dan ditimbang. Kelarutan kolagen diperoleh dengan rumus:
Kelarutan % = Berat sampel awal (g) – (B–A)Berat sampel awal (g) x 100%
Keterangan:
A = Berat kertas saring awal (g) B = Berat kertas saring akhir (g)
Analisis gugus fungsi dengan FTIR (Muyonga et al. 2004)
9
Analisis asam amino (AOAC 1995)
Komposisi asam amino ditentukan dengan HPLC. Sebelum dipakai, perangkat HPLC harus dibilas terlebih dahulu dengan eluen yang akan digunakan selama 2-3 jam. Begitu pula dengan syringe yang akan digunakan harus dibilas dengan akuades. Analisis asam amino menggunakan HPLC terdiri dari 4 tahap, yaitu: (a) preparasi sampel kolagen; (b) pengeringan; (c) derivatisasi; dan (d) injeksi.
(a) Preparasi sampel kolagen
Preparasi sampel dilakukan dengan menimbang sebanyak 0,1 g kolagen kering dan dihancurkan, selanjutnya ditambahkan dengan larutan HCl 6 N sebanyak 5-10 mL. Larutan tersebut dipanaskan dalam oven pada suhu 100 °C selama 24 jam. Hal ini dilakukan untuk menghilangkan gas atau udara yang ada pada sampel agar tidak mengganggu kromatogram yang dihasilkan. Setelah pemanasan selesai, sampel disaring menggunakan milipore berukuran 45 mikron.
(b) Pengeringan
Hasil saringan diambil sebanyak 10 μL dan ditambahkan 30 μL larutan pengering. Larutan pengering dibuat dari campuran antara metanol, natrium asetat, dan trimetilamin dengan perbandingan 2:2:1. Sampel dikeringkan dengan alat pompa vakum yaitu untuk mempercepat proses dan mencegah terjadinya oksidasi.
(c) Derivatisasi
Larutan derivatisasi dibuat dari campuran antara larutan metanol, pikoisotiosianat, dan trimetilamin dengan perbandingan 3:3:4. Proses derivatisasi dilakukan agar detektor mudah untuk mendeteksi senyawa yang ada pada sampel. Selanjutnya dilakukan pengenceran dengan menambahkan 10 mL asetonitril 60% dan natrium asetat 1 M lalu dibiarkan selama 20 menit. Hasil pengenceran disaring kembali dengan menggunakan milipore berukuran 45 mikron. Larutan derivatisasi sebanyak 30 μL ditambahkan pada hasil pengeringan.
(d) Injeksi ke HPLC
Hasil saringan diambil sebanyak 20 μL untuk diinjeksikan ke dalam HPLC. Penghitungan konsentrasi asam amino pada bahan dilakukan dengan pembuatan kromatogram standar menggunakan asam amino standar yang telah siap pakai yang mengalami perlakuan yang sama dengan sampel. Kondisi alat HPLC saat
Fase gerak : Asetonitril 60% dan natrium asetat 1 M 40%
Detektor : UV / 254 nm
Merek : Waters Coorporation USA
10
BM = Bobot molekul dari masing-masing asam amino C = Konsentrasi standar asam amino
Fp = Faktor pengenceran
Analisis data (Steel dan Torrie 1993)
Data yang diperoleh dari penelitian tahap pendahuluan (pretreatment) dianalisis dengan menggunakan program Statistical Product and Service Solutions (SPSS) 15. Analisis statistik data penelitian diolah menggunakan Rancangan Acak Faktorial dengan 2 faktor yaitu konsentrasi NaOH sebanyak 3 taraf (0,05 M; 0,1 M; 0,2 M) dan faktor lama perendaman dengan 6 taraf (2 jam, 4 jam, 6 jam, 8 jam, 10 jam, dan 12 jam). Semua perlakuan dilakukan sebanyak 2 kali ulangan. Model rancangannya adalah:
Yijk = μ + τi+ βj+ (τ β)ij+ εijk
Keterangan:
Yijk = Nilai pengamatan dari perlakuan konsentrasi NaOH ke-i, perlakuan lama perendaman ke-j, dan ulangan ke-k
μ = Nilai rataan umum populasi
Data yang diperoleh selanjutnya diamati dan dianalisis secara statistik dengan analisis ragam (ANOVA). Apabila hasil analisis menunjukkan berpengaruh nyata, maka dilanjutkan dengan uji Duncan’s Multiple Range Test (DMRT) dengan taraf kepercayaan 95%. Hipotesis pengaruh konsentrasi NaOH:
H0 = Perbedaan konsentrasi NaOH, lama perendaman, dan interaksi antar perlakuan tidak berpengaruh nyata terhadap total protein non-kolagen terlarut.
11
HASIL DAN PEMBAHASAN
Karakteristik Ikan Tongkol
Ikan tongkol yang digunakan terlebih dahulu dikarakterisasi dengan penghitungan proporsi rendemen bagian tubuh dan analisis komposisi kimia kulit. Proporsi rendemen yang dihitung adalah bagian tulang, kepala, kulit, daging, dan jeroan. Hasil proporsi bagian tubuh ikan tongkol (Gambar 2) diperoleh bahwa daging memiliki rendemen tertinggi yaitu sebesar 54,31±0,59% (edible portion) dan rendemen terendah terdapat pada kulit yaitu sebesar 3,23±0,09%. Bagian tubuh lainnya yaitu kepala, tulang, dan jeroan memiliki proporsi rendemen sebesar 21,54±0,50%; 13,63±0,37%; dan 7,28±0,18%. Liu et al. (2012) menjelaskan bahwa kulit memang memiliki proporsi terendah dari bagian tubuh lainnya, namun dalam pemanfaatan limbah untuk dijadikan sumber kolagen, kulit memiliki prospek dan potensi yang lebih baik dibandingkan dengan bagian limbah lainnya, seperti tulang, kepala, maupun jeroan. Beberapa data sumber penelitian menunjukkan bahwa kolagen dari kulit memiliki rendemen yang lebih tinggi dibandingkan dengan tulang, misalnya kolagen dari kulit dan tulang ikan swanggi sebesar 10,9% dan 1,6% (bb) (Kittiphatanabawon et al. 2005), ikan bighead carp sebesar 17,5% dan 1,3% (bb) (Liu et al. 2012), dan ikan mas sebesar 41,3% dan 1,06% (bk) (Duan et al. 2009).
Gambar 2 Proporsi bagian tubuh ikan tongkol ( ) daging, ( ) jeroan, ( )tulang, ( ) kepala, ( ) kulit
Proses karakterisasi selanjutnya yaitu analisis komposisi kimia kulit ikan tongkol. Analisis komposisi kimia bertujuan untuk mengetahui kandungan gizi yang terkandung didalam kulit. Analisis komposisi kimia yang dilakukan pada penelitian ini meliputi kadar air, kadar protein, kadar lemak, dan kadar abu.
13,63±0,37%
21,54±0,50%
3,23±0,09% 54,31±0,59%
12
Komposisi kimia kulit ikan tongkol dan beberapa kulit ikan lainnya disajikan pada Tabel 1.
Tabel 1 Komposisi kimia kulit ikan tongkol dan beberapa kulit ikan lainnya
Sumber Kadar air
(Euthynnusaffinis) 71,66±0,01 24,63±0,12 2,72±0,24 0,17±0,00 Kulit ikan cobia
(Rachycentron canadum)1 71,79±0,49 19,02±0,21 7,09±0,18 1,36±0,16 Kulit ikan cucut bambu
(Chiloscyllium punctatum)2 58,70±1,14 29,77±0,81 0,16±0,04 14,43±0,12 Keterangan: 1Ariesta (2014); 2Mahardika (2013)
Tabel 1 menunjukkan bahwa kulit ikan tongkol memiliki kadar air, protein, lemak, dan abu sebesar 71,66%; 24,63%; 2,72%; dan 0,17%. Komposisi kimia sumber kolagen. Alfaro et al. (2013) menyatakan bahwa kadar protein pada kulit ikan sangat menentukan terhadap jumlah kolagen yang terkandung di dalam jaringan kulit. Keberadaan lemak dan abu pada kulit ikan juga akan berpengaruh terhadap karakteristik dan keefektifan kolagen yang dihasilkan sehingga perlu dihilangkan (Shon et al. 2011). Matmaroh et al. (2011) menyatakan bahwa penghilangan lemak dan abu dapat dilakukan dengan perendaman kulit pada larutan alkali dan asam asetat. Kadar lemak dan kadar abu yang rendah dari kulit ikan tongkol juga mengindikasikan sebagai bahan baku yang baik dalam ekstraksi kolagen.
Pretreatment Kolagen
13
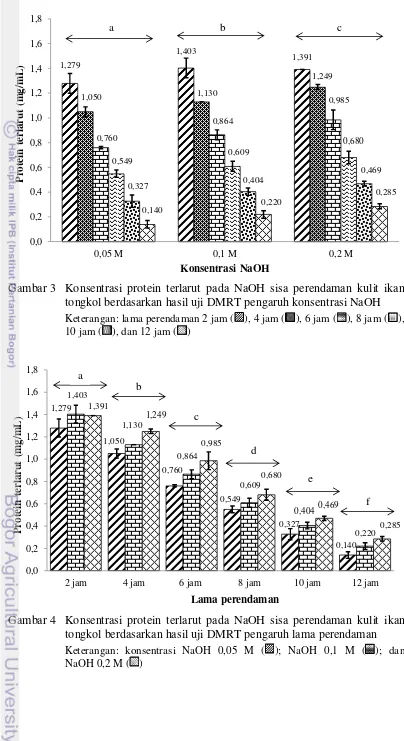
Gambar 3 Konsentrasi protein terlarut pada NaOH sisa perendaman kulit ikan tongkol berdasarkan hasil uji DMRT pengaruh konsentrasi NaOH
Keterangan: lama perendaman 2 jam ( ), 4 jam ( ), 6 jam ( ), 8 jam ( ), 10 jam ( ), dan 12 jam ( )
Gambar 4 Konsentrasi protein terlarut pada NaOH sisa perendaman kulit ikan tongkol berdasarkan hasil uji DMRT pengaruh lama perendaman
14
Gambar 3 dan Gambar 4 menunjukkan bahwa lama perendaman kulit pada berbagai konsentrasi NaOH selama 2 jam memiliki konsentrasi protein terlarut yang tinggi dan seiring bertambahnya waktu maka konsentrasi protein terlarut menjadi semakin rendah. Hal ini menunjukkan bahwa semakin lama proses perendaman, maka protein non-kolagen pada kulit ikan tongkol akan semakin berkurang. Jaswir et al. (2011) menyatakan bahwa selama perendaman dalam NaOH, kulit menjadi mengembang sehingga memudahkan masuknya air dan menyebabkan protein non-kolagen yang terjebak dalam matrik kolagen menjadi lebih mudah dilepaskan.
Hasil analisis ragam (ANOVA) menunjukkan adanya pengaruh konsentrasi NaOH dan lama perendaman terhadap total protein non-kolagen terlarut, namun interaksi keduanya tidak berpengaruh terhadap total protein non-kolagen terlarut (Lampiran 3). Berdasarkan hasil uji lanjut DMRT pada tingkat kepercayaan 95% (Lampiran 4-5), perendaman kulit dalam larutan NaOH 0,05 M selama 12 jam merupakan perlakuan terbaik karena memiliki nilai konsentrasi protein non-kolagen terlarut yang paling rendah yaitu sebesar 0,140 mg/mL. Zhang et al. (2007) menyatakan bahwa protein non-kolagen pada kulit dapat
dihilangkan dengan perendaman menggunakan larutan NaOH selama 12 jam. Zhou dan Regenstein (2005) menambahkan bahwa penghilangan protein non-kolagen dapat dilakukan dengan menggunakan larutan NaOH pada konsentrasi antara 0,01 hingga 0,1 mol/L dan penggunaan konsentrasi larutan NaOH di atas 0,1 mol/L tidak akan lebih efektif dalam menghilangkan protein non-kolagen.
Karakteristik Kolagen Kulit Ikan Tongkol Terbaik
Kolagen kulit ikan tongkol terbaik yang dihasilkan merupakan kolagen yang sudah dikeringbekukan yang diperoleh dari proses pretreatment terbaik. Kolagen terbaik yang diperoleh berbentuk lembaran berserat, berwarna putih, dan tidak beraroma. Karakterisasi kolagen terbaik diperlukan untuk mengetahui sifat fisiko-kimia dari kolagen yang dihasilkan.
Rendemen kolagen terbaik
15
Tabel 2 Rendemen kolagen kulit ikan tongkol dan beberapa kulit ikan lainnya
Sumber kolagen Rendemen (% bb)
Kulit ikan tongkol (Euthynnusaffinis) 7,46±0,33 Kulit ikan cobia (Rachycentron canadum)1 10,51±0,48 ASC kulit ikan gorara (Lutjanus vitta)2
PSC kulit ikan gorara (Lutjanus vitta)2
9,0 4,7 ASC kulit ikan patin siam (Pangasianodon hypophthalmus)3 5,1 PSC kulit ikan patin siam (Pangasianodon hypophthalmus)3 7,7 Keterangan: 1Ariesta (2014); 2Jongjareonrak et al. (2005); 3Singh et al. (2011)
Nilai pH kolagen terbaik
Nilai pH merupakan suatu parameter untuk mengukur derajat keasaman atau kebasaan suatu larutan. Nilai pH kolagen dari kulit ikan tongkol bersifat sedikit asam yaitu 5,29±0,04. Nilai pH kolagen kulit ikan tongkol lebih tinggi dibandingkan dengan kolagen kulit ikan pari yaitu 5,00 dan kolagen kulit ikan cucut bambu yaitu 4,60 namun lebih rendah dari nilai pH kolagen kulit ikan cobia yaitu 7,08±0,01. Nilai pH kolagen kulit ikan tongkol yang dihasilkan sedikit lebih rendah bila dibandingkan pH kolagen dari sisik ikan yaitu berkisar antara 5,5-6,6 (Hartati dan Kurniasari 2010). Zhou dan Regenstein (2005) menyatakan kombinasi perlakuan asam dan basa pada proses ekstraksi cenderung menghasilkan pH akhir yang netral. Proses penetralan juga berpengaruh pada pH akhir kolagen karena penetralan berfungsi mengurangi sisa-sisa larutan asam maupun basa akibat perendaman. Nilai pH kolagen kulit ikan tongkol dan beberapa kulit ikan lainnya disajikan pada Tabel 3.
Tabel 3 Nilai pH kolagen kulit ikan tongkol dan beberapa kulit ikan lainnya
Sumber kolagen Nilai pH
Kulit ikan tongkol (Euthynnusaffinis) 5,29±0,04 Kulit ikan cobia (Rachycentron canadum)1 7,08±0,01 Kulit ikan cucut bambu (Chiloscyllium punctatum)2 4,60 Kulit ikan pari (Pastinachus solocirostris)3 5,00 Keterangan: 1Ariesta (2014); 2Mahardika (2013); 3Nur’aenah (2013)
Komposisi asam amino kolagen terbaik
16
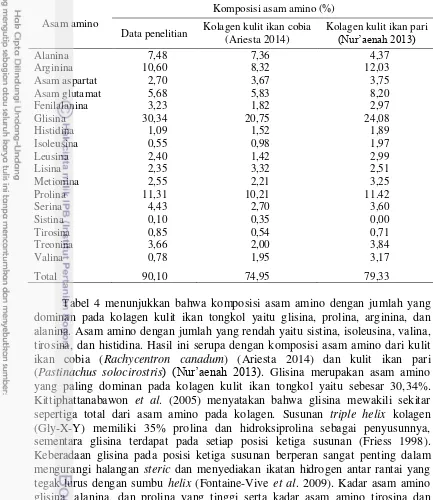
Tabel 4 Komposisi asam amino kolagen kulit ikan tongkol dan kulit ikan lainnya
Asam amino
Komposisi asam amino (%)
Data penelitian Kolagen kulit ikan cobia (Ariesta 2014) alanina. Asam amino dengan jumlah yang rendah yaitu sistina, isoleusina, valina, tirosina, dan histidina. Hasil ini serupa dengan komposisi asam amino dari kulit ikan cobia (Rachycentron canadum) (Ariesta 2014) dan kulit ikan pari (Pastinachus solocirostris) (Nur’aenah 2013). Glisina merupakan asam amino
yang paling dominan pada kolagen kulit ikan tongkol yaitu sebesar 30,34%. Kittiphattanabawon et al. (2005) menyatakan bahwa glisina mewakili sekitar sepertiga total dari asam amino pada kolagen. Susunan triple helix kolagen (Gly-X-Y) memiliki 35% prolina dan hidroksiprolina sebagai penyusunnya, sementara glisina terdapat pada setiap posisi ketiga susunan (Friess 1998). Keberadaan glisina pada posisi ketiga susunan berperan sangat penting dalam mengurangi halangan steric dan menyediakan ikatan hidrogen antar rantai yang tegak lurus dengan sumbu helix (Fontaine-Vive et al. 2009). Kadar asam amino glisina, alanina, dan prolina yang tinggi serta kadar asam amino tirosina dan histidina yang rendah mengindikasikan bahwa kolagen yang diekstrak adalah kolagen tipe I (Nalinanon et al. 2011). Silvipriya et al. (2015) menjelaskan bahwa kolagen yang diekstrak dari kulit pada umumnya merupakan kolagen tipe I.
Kelarutan kolagen terbaik
17
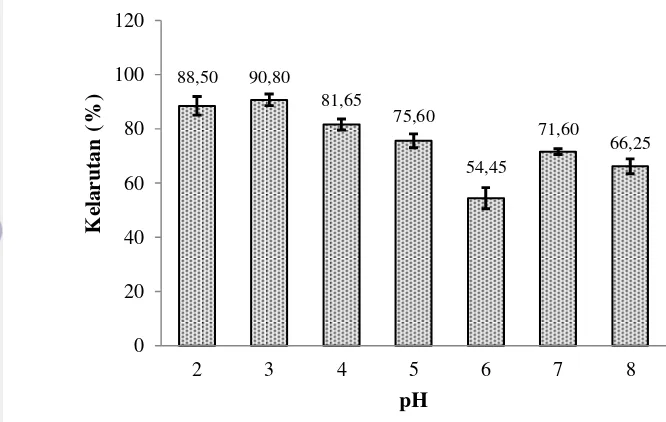
Gambar 5 Kelarutan kolagen kulit ikan tongkol pada beberapa pH (n = 2 ulangan)
Gambar 5 menunjukkan bahwa kelarutan kolagen tertinggi terdapat pada pH 3 yaitu 90,80%, sedangkan kelarutan terendah terdapat pada pH 6 yaitu 54,45%. Matmaroh et al. (2011) menjelaskan bahwa kelarutan kolagen akan tinggi pada kisaran pH 2-4 dan ketika pH di atas 4 yaitu mendekati pH netral atau basa kelarutan kolagen akan menurun. Kelarutan terendah pada pH 6 menunjukkan titik isoelektrik pada kolagen yang dihasilkan. Titik isoelektrik pada kolagen umumnya terdapat pada kisaran pH 6-9 (Shon et al. 2011). Kittiphattanabawon et al. (2005) mengatakan bahwa ketika nilai pH berada di atas dan di bawah titik isoelektrik, protein memiliki muatan positif atau negatif sehingga memiliki kemampuan berinteraksi dengan air menjadi lebih tinggi. Jongjareonrak et al. (2005) menjelaskan bahwa pada titik isoelektrik, muatan molekul protein menjadi nol sehingga interaksi hidrofobik menjadi meningkat dan menyebabkan pengendapan protein terlarut pada pH titik isolektrik tersebut.
Gugus fungsi kolagen terbaik dengan Fourier Transform Infrared (FTIR)
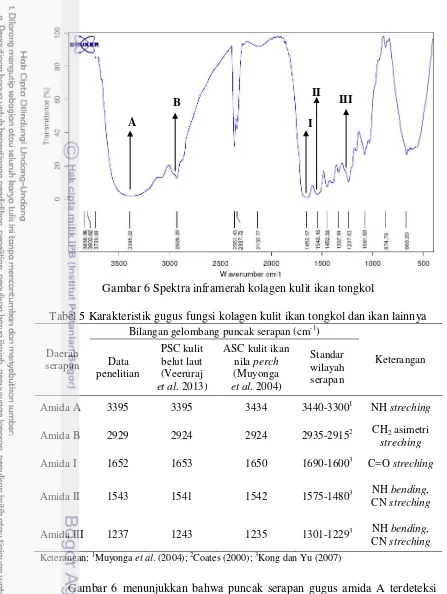
Spektroskopi FTIR merupakan teknik analisis yang sudah banyak digunakan untuk menganalisis struktur sekunder kolagen dengan cara mengetahui gugus fungsinya (Paschalis et al. 2001). Kong dan Yu (2007) menjelaskan bahwa prinsip dari spektroskopi FTIR yaitu dengan pengukuran panjang gelombang dan intensitas penyerapan radiasi inframerah oleh sampel. Penyerapan radiasi inframerah tersebut akan menimbulkan getaran yang dapat mengkarakterisasikan kelompok peptida dan rantai sampingnya sehingga memberikan informasi mengenai struktur protein (Paschalis et al. 2001). Gugus fungsi khas yang terdapat pada kolagen adalah amida A, B, I, II, dan III. Hasil spektra inframerah kolagen kulit ikan tongkol disajikan pada Gambar 6 dan karakteristik gugus fungsi kolagen kulit ikan tongkol disajikan pada Tabel 5.
18
Gambar 6 Spektra inframerah kolagen kulit ikan tongkol
Tabel 5 Karakteristik gugus fungsi kolagen kulit ikan tongkol dan ikan lainnya
Daerah serapan
Bilangan gelombang puncak serapan (cm-1)
Keterangan
19
Gugus amida B kolagen kulit ikan tongkol terdeteksi pada bilangan gelombang 2929 cm-1. Coates (2000) menyatakan bahwa wilayah serapan gugus amida B akan terdeteksi pada bilangan gelombang 2935-2915 cm-1 atau 2865-2845 cm-1. Nilai gugus amida B kolagen kulit ikan tongkol lebih tinggi dari
PSC kulit belut laut dan ASC kulit ikan nila perch yaitu 2924 cm-1. Li et al. (2013) menjelaskan dengan adanya gugus amida B pada kolagen, maka
akan berhubungan dengan sifat karakteristik CH2 asimetri streching yang dihasilkan.
Gugus amida I kolagen kulit ikan tongkol terdeteksi pada bilangan gelombang 1652 cm-1. Kong dan Yu (2007) menyatakan bahwa gugus amida I akan terdeteksi pada bilangan gelombang 1690-1600 cm-1. Nilai gugus amida I kolagen kulit ikan tongkol sedikit lebih tinggi dari ASC kulit ikan nila perch yaitu 1650 cm-1 dan sedikit lebih rendah dari PSC kulit belut laut yaitu 1653 cm-1. Shah dan Manekar (2012) menyatakan bahwa gugus amida I terkait dengan karakteristik vibrasi peregangan gugus karbonil. Gugus amida I juga merupakan
gugus fungsi khas yang dapat membedakan antara kolagen dan gelatin. Sai dan Babu (2001) menjelaskan bahwa umumnya gugus amida I pada kolagen
memiliki bilangan gelombang antara 1655-1650 cm-1. Nagarajan et al. (2012) menyatakan bahwa gugus amida I gelatin kulit luar cumi-cumi terdeteksi pada bilangan gelombang 1635-1632 cm-1. Gugus amida I pada kolagen memiliki puncak serapan bilangan gelombang yang lebih tinggi dibandingkan gugus amida I pada gelatin. Yakimets et al. (2005) menyatakan bahwa gugus amida I yang terdeteksi pada bilangan gelombang sekitar 1633 cm-1 merupakan karakteristik struktur random coiled pada gelatin. Struktur random coiled tersebut terbentuk karena adanya proses depolimerisasi termal, yaitu proses terpecahnya struktur terorganisir triple helix kolagen akibat peningkatan suhu pada saat proses ekstraksi dilakukan (Sai dan Babu 2001).
Gugus amida II kolagen kulit ikan tongkol terdeteksi pada bilangan gelombang 1543 cm-1. Kong dan Yu (2007) menyatakan bahwa gugus amida II akan terdeteksi pada bilangan gelombang 1575-1480 cm-1. Nilai gugus amida II kolagen kulit ikan tongkol sedikit lebih tinggi dari PSC kulit belut laut yaitu 1541 cm-1 dan ASC kulit ikan nila perch yaitu 1542 cm-1. Liu et al. (2012) menyatakan bahwa gugus amida II terkait dengan adanya karakteristik vibrasi NH bending disertai dengan vibrasi CN stretching.
20
KESIMPULAN DAN SARAN
Kesimpulan
Pretreatment kolagen kulit ikan tongkol diperoleh perlakuan terbaik yaitu dengan perendaman larutan NaOH 0,05 M selama 12 jam dengan nilai konsentrasi protein non-kolagen terlarut yang paling rendah yaitu sebesar 0,140 mg/mL. Karakteristik kolagen kulit ikan tongkol terbaik yang dihasilkan yaitu rendemen kolagen sebesar 7,46% (bb). Nilai pH akhir kolagen yaitu 5,29 dan kelarutan tertinggi kolagen sebesar 90,80% pada pH 3. Komposisi asam amino kolagen menunjukkan bahwa glisina, prolina, arginina, dan alanina merupakan asam amino yang paling dominan pada kolagen kulit ikan tongkol. Kolagen kulit ikan tongkol memiliki gugus fungsi khas yaitu amida A, B, I, II, dan III dengan masing-masing bilangan gelombang yaitu 3395 cm-1, 2929 cm-1, 1652 cm-1, 1543 cm-1, dan 1237 cm-1. Gugus amida I merupakan gugus pembanding yang membedakan struktur triple helix dari kolagen dengan struktur random coiled dari gelatin. Gugus amida III kolagen yang dihasilkan memiliki struktur antarmolekul yang tinggi dan struktur triple helix yang dominan dengan ikatan yang kuat.
Saran
Penelitian selanjutnya disarankan agar lama perendaman dalam larutan NaOH pada saat proses pretreatment kolagen ditambahkan guna mengoptimalkan penghilangan protein non-kolagen pada kulit. Ekstraksi kolagen pada suhu rendah (4 °C) perlu dilakukan sebagai pembanding terhadap karakteristik kolagen yang dihasilkan. Pengaplikasian kolagen kulit ikan tongkol pada bidang biomedis, farmasi, dan kosmetik perlu untuk dikembangkan.
DAFTAR PUSTAKA
[AOAC] Association of Official Analytical Chemyst. 1995. Official Method of Analysis of The Association of Official Analytical of Chemist. Arlington, Virginia (US): Published by The Association of Official Analytical Chemist, Inc.
[KKP] Kementerian Kelautan dan Perikanan. 2014. Kelautan dan Perikanan dalam Angka Tahun 2014. Jakarta (ID): Pusat Data, Statistik dan Informasi.
[SNI] Standar Nasional Indonesia. 1992. 01-2891-1992. Cara Uji Makanan dan Minuman. Jakarta (ID): Badan Standarisasi Nasional.
21
Alfaro AT, Fonseca GG, Balbinot E, Machado A, Prentice C. 2013. Physical and chemical properties of wami tilapia skin gelatin. Food Science and Technology 33(3): 592-595.
Apriyantono A, Fardiaz D, Puspitasari NL, Sedamawati Y, Budianto S. 1989. Petunjuk Laboratorium Analisis Pangan. Bogor (ID): Pusat Antar Universitas Pangan dan Gizi, Institut Pertanian Bogor.
Ariesta C. 2014. Ekstraksi dan karakterisasi kolagen dari kulit ikan cobia (Rachycentron canadum) [skripsi]. Bogor (ID): Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Bradford MM. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry 72: 248-254.
Choi JH, Behnam Sh, Kim SM. 2013. Physico-biochemical characteristics of scallop mantle collagen soluble in pepsin. Journal Agricultural Science and Technology 15: 293-302.
Coates J. 2000. Interpreration of infrared spectra, a practical approach. Di dalam: Meyers RA, editor. Encyclopedia of Analytical Chemistry. Chichester (GB): John Wiley & Sons Ltd.
Duan R, Zhang J, Du X, Yao X, Konno K. 2009. Properties of collagen from skin, scale and bone of carp (Cyprinus carpio). Food Chemistry 112: 702-706.
Fontaine-Vive F, Merzel F, Johnson MR, Kearley GJ. 2009. Collagen and component polypeptides: low frequency and amide vibrations. Chemical Physics 355: 141-148.
Friess W. 1998. Collagen-biomaterial for drug delivery. European Journal of Pharmaceutics and Biopharmaceutics 45: 113–136.
Hartati I, Kurniasari L. 2010. Kajian produksi kolagen dari limbah sisik ikan secara ekstraksi enzimatis. Momentum 6(1): 33-35.
Jaswir I, Monsur HA, Salleh HM. 2011. Nano-structural analysis of fish collagen extracts for new process development. African Journal of Biotechnology 10(81): 18847-18854.
Jongjareonrak A, Benjakul S, Visessanguan W, Nagai T, Tanaka M. 2005. Isolation and characterisation of acid and pepsin-solubilised collagens from the skin of Brownstripe red snapper (Lutjanus vitta). Food Chemistry 93: 475-484.
Kittiphattanabawon P, Benjakul S, Visessanguan W, Nagai T, Tanaka M. 2005. Characterisation of acid-soluble collagen from skin and bone of bigeye snapper (Priacanthus tayenus). Food Chemistry 89: 363–372.
22
Kong J, Yu S. 2007. Fourier transform infrared spectroscopic analysis of protein secondary structures. Acta Biochimica et Biophysica Sinica 39(8): 549–559.
Kumar MH, Spandana V, Poonam T. 2011. Extraction and determination of collagen peptide and its clinical importance from tilapia fish scales (Oreochromis niloticus). International Research Journal of Pharmacy 2(10): 97-99.
Lee CH, Singla A, Lee Y. 2001. Biomedical applications of collagen. International Journal of Pharmaceutics 221: 1-22.
Li Z, Wang B, Chi C, Zhang Q, Gong Y, Tang J, Luo H, Ding G. 2013. Isolation and characterization of acid soluble collagens and pepsin soluble collagens from the skin and bone of Spanish mackerel (Scomberomorous niphonius). Food Hydrocolloids 31: 103-113.
Lin YK, Liu DC. 2006. Comparison of physical-chemical properties of type I collagen from different species. Food Chemistry 99: 244-251.
Liu D, Liang L, Regenstein JM, Zhou P. 2012. Extraction and characterisation of pepsin-solubilised collagen from fins, scales, skins, bones and swim bladders of bighead carp (Hypophthalmichthys nobilis). Food Chemistry 133: 1441-1448.
Mahardika S. 2013. Isolasi dan karakterisasi kolagen nanopartikel dari kulit ikan cucut bambu (Chiloscyllium punctatum) [skripsi]. Bogor (ID): Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Matmaroh K, Benjakul S, Prodpran T, Encarnacion AB, Kishimura H. 2011. Characteristics of acid soluble collagen and pepsin soluble collagen from scale of spotted golden goatfish (Parupeneus heptacanthus). Food Chemistry 129: 1179-1186.
Muyonga JH, Cole CGB, Duodu KG. 2004. Characterisation of acids soluble collagen from skins of young and adult Nile perch (Lates niloticus). Food Chemistry 85: 81-89.
Nagarajan M, Benjakul S, Prodpran T, Songtipya P, Kishimura H. 2012. Characteristics and functional properties of gelatin from splendid squid (Loligo formosana) skin as affected by extraction temperatures. Food Hydrocolloids 29: 389-397.
Nalinanon S, Benjakul S, Kishimura H, Osako K. 2011. Type I collagen from the skin of ornate threadfin bream (Nemipterus hexodon): characteristics and effect of pepsin hydrolysis. Food Chemistry 125: 500-507.
Nur’aenah N. 2013. Ekstraksi dan karakterisasi kolagen dan nanopartikel kolagen dari kulit ikan pari (Pastinachus solocirostris) sebagai bahan baku kosmetik [tesis]. Bogor [ID]: Sekolah Pascasarjana, Institut Pertanian Bogor.
23
Potaros T, Raksakulthai N, Runglerdkreangkrai J, Worawattanamateekul W. 2009. Characteristics of collagen from nile tilapia (Oreochromis niloticus) skin isolated by two different methods. Kasetsart Journal 43: 584-593.
Sai KP, Babu M. 2001. Studies on Rana tigerina skin collagen. Comparative Biochemistry and Physiology Part B 128: 81-90.
Shah V, Manekar A. 2012. Isolation and characterization of collagen from the placenta of buffalo (Bovidae bubalus bubalis) for the biomaterial applications. Trend in Life Science 1(4): 26–32.
Shon J, Eo J, Hwang SJ, Eun J. 2011. Effect of processing conditions on functional properties of collagen powder from Skate (Raja kenojei) skins. Food Science Biotechnology 20(1): 99-106.
Silvipriya KS, Kumar KK, Bhat AR, Kumar BD, John A, Lakshmanan P. 2015. Collagen: animal souces and biomedical application. Journal of Applied Pharmaceutical Science 5(3): 123-127.
Singh P, Benjakul S, Maqsood S, Kishimura H. 2011. Isolation and characterisation of collagen extracted from the skin of striped catfish (Pangasianodon hypophthalmus). Food Chemistry 124: 97–105.
Stansby ME. 1963. Industrial Fishery Technology. New York (US): Reinhold Publishing.
Steel RGD, Torrie JH. 1993. Prinsip dan Prosedur Statistika, Suatu Pendekatan Biometrik. Sumantri B, penerjemah. Jakarta (ID): Gramedia Pustaka Utama. Terjemahan dari: Principles and Procedures of Statistics: A Biometrical Approach.
Veeruraj A, Arumugam M, Balasubramanian T. 2013. Isolation and characterization of thermostable collagen from the marine eel-fish (Evenchelys macrura). Process Biochemistry 48: 1592-1602.
Yakimets I, Wellner N, Smith AC, Wilson RH, Farhat I, Mitchell J. 2005. Mechanical properties with respect to water content of gelatin films in glassy state. Polymer 46: 12577-12585.
Zhang J, Duan R, Tian Y, Konno K. 2009. Characterisation of acid-soluble collagen from skin of silver carp (Hypophthalmichthys molitrix). Food Chemistry 116: 318-322.
Zhang Y, Liu W, Li G, Shi B, Miao Y, Wu X. 2007. Isolation and partial characterization of pepsin-soluble collagen from the skin of grass carp (Ctenopharyngodon idella). Food Chemistry 103: 906-912.
26
Lampiran 1 Morfometrik dan bobot ikan tongkol
Parameter Satuan Nilai
Panjang total cm 34,05±0,21
Panjang baku cm 28,75±0,07
Tinggi cm 6,85±0,35
Lebar cm 4,5±0,14
Bobot g 480,5±7,78
Lampiran 2 Kurva regresi linear standar BSA
Lampiran 3 Hasil analisis ragam (ANOVA) pretreatment kolagen kulit ikan tongkol
27
Lampiran 5 Hasil uji DMRT untuk pengaruh lama perendaman terhadap nilai konsentrasi protein larutan sisa perendaman
Lama perendaman
(jam) N
Rata-rata konsentrasi protein
terlarut (mg/mL) Notasi
2 6 1,357 a
4 6 1,143 b
6 6 0,869 c
8 6 0,612 d
10 6 0,399 e
12 6 0,215 f
Lampiran 6 Dokumentasi kolagen kulit ikan tongkol
(a) kolagen cair sebelum freeze dry (b) kolagen kering setelah freeze dry
28
29
RIWAYAT HIDUP
Penulis bernama lengkap Arman Hartono Komala dilahirkan pada tanggal 21 September 1993 di Bogor. Penulis merupakan anak ketiga dari tiga bersaudara dari pasangan (Alm.) Iing Sugihartono (Khouw Sin Ing) dan Yulianingsih (Ouw Lui Nio). Penulis memulai jenjang pendidikan formal di SD Eka Wijaya lulus pada tahun 2005, SMP Eka Wijaya lulus pada tahun 2008, dan SMA Kosgoro lulus pada tahun 2011.