DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
2014
EKSTRAKSI DAN KARAKTERISASI KOLAGEN DARI
KULIT IKAN COBIA (
Rachycentron canadum
)
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada
Departemen Teknologi Hasil Perairan
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
2014
EKSTRAKSI DAN KARAKTERISASI KOLAGEN DARI KULIT
IKAN COBIA (
Rachycentron canadum
)
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi dengan judul “Ekstraksi dan karakterisasi kolagen dari kulit ikan cobia (Rachycentron canadum)” adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2014
ABSTRAK
CHRISTY ARIESTA. Ekstraksi dan Karakterisasi Kolagen dari Kulit Ikan Cobia (Rachycentron canadum). Dibimbing oleh TATI NURHAYATI dan PIPIH SUPTIJAH.
Ikan cobia (Ranchycentron canadum) digunakan untuk tujuan konsumsi, sebagian kulit merupakan limbah. Konversi dalam bentuk produk nilai tambah berupa kolagen baik untuk manajemen pasca panen. Isolasi kolagen dari kulit ikan cobia (Rachycentron canadum) telah berhasil dilakukan dengan tiga tahap yaitu pertama perendaman dalam 0,05 M NaOH dengan rasio sampel/larutan 1:10 (b/v) selama 6 jam, tahap kedua perendaman dalam 0,1 M asam asetat dengan rasio sampel/larutan 1:6 (b/v) selama 2 jam, dan tahap ketiga yaitu ekstraksi dengan air destilasi pada suhu 40 ºC selama 3 jam. Rendemen kolagen yang diperoleh 10,508%. Kolagen memiliki pH 7,08; memiliki kandungan protein 86,46%; kadar air 11,08%; lemak 0,26%; dan abu 0,19%. Analisis asam amino menunjukkan bahwa kolagen memiliki prolin dan glisin yang tinggi. Analisis spektra FTIR menunjukkan bahwa molekul kolagen memiliki struktur heliks tiga yang kompak stabil oleh ikatan hidrogen. Spektroskopi FTIR menunjukkan wilayah penyerapan utama amida A, B, I, II, dan III masing-masing pada 3310 , 2932 , 1651 , 1543 dan 1242 cm-1.
Kata kunci: kolagen, cobia (Rachycentron canadum), ekstraksi air, FTIR
ABSTRACT
CHRISTY ARIESTA. Extraction and Characterization of cCollagen from the Skin of Cobia Fish (Rachycentron canadum). Supervised by TATI NURHAYATI and PIPIH SUPTIJAH.
Cobia fish (Ranchycentron canadum) was used for a culinary purpose, but their skin was waste part. Convert in a value added product like collagen was a good practice of post harvest management. Isolation of collagen from the skin of cobia fish (Rachycentron canadum) has been successfully conducted with three stages: first soaked in 0,05 M NaOH with a sample/solution ratio of 1:10 (w/v) for 6 hour, second soaked in 0,1 M acetic acid with a sample/solution ratio of 1:6 (w/v) for 2 hour, and third extraction with destilated water at temperature 40 ºC for 3 hour. The yield of collagen was 10,508%. The pH of collagen was 7,08; protein content 86,46%; moisture 11,08%; fat 0,26%; and ash contents 0,19%. Amino acid analysis of collagen revealed the high proline and glycine. FTIR spectra analysis revealed that collagen molecules had the compact triple helical structure stabilized mainly by the hydrogen bond. Fourier transform infrared (FTIR) spectroscopic study showed major absorption bands of amide A, B, I, II and III at 3310, 2932, 1651, 1543 and 1242 cm-1 respectively.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Judul Skripsi : Ekstraksi dan Karakterisasi Kolagen dari Kulit Ikan Cobia (Rachycentron canadum)
Nama : Christy Ariesta NIM : C34090028
Program Studi : Teknologi Hasil Perairan
Disetujui oleh
Dr Tati Nurhayati, SPi, MSi Pembimbing I
Dr Pipih Suptijah, MBA Pembimbing II
Diketahui oleh
Dr Ir Joko Santoso, MSi Ketua Departemen
KATA PENGANTAR
Penulis sangat bersyukur atas diselesaikannya karya tulis ini. Penelitian ini dilaksanakan pada bulan Maret 2013 hingga November 2013 dengan judul “Ekstraksi dan Karakterisasi Kolagen dari Kulit Ikan Cobia (Rachycentron canadum)”. Pada kesempatan ini, dengan segala kerendahan hati penulis ingin mengucapkan terima kasih kepada semua pihak yang telah memberikan bantuan dan dorongan hingga penulis dapat menyelesaikan skripsi ini, yaitu :
1. Dr Tati Nurhayati, SPi, MSi dan Dr Pipih Suptijah, MBA selaku dosen pembimbing yang telah memberikan pengarahan dalam penyusunan skripsi ini.
2. Dr Ir Wini Trilaksani, MSc selaku dosen penguji yang telah memberikan saran dan kritik untuk perbaikan skripsi ini.
3. Dr Ir Sri Purwaningsih, MSi selaku perwakilan komisi pendidikan yang telah mewakili departemen pada saat ujian dan saran perbaikan.
4. Dr. Ir. Joko Santoso, M.Si selaku ketua Departemen Teknologi Hasil Perairan.
5. Staf dosen dan tata usaha Departemen Teknologi Hasil Perairan
6. Mama, Papa dan Adik, serta seluruh keluarga yang telah memberikan motivasi kepada penulis.
7. Nani Nur’aenah, MSi atas kesediaanya membagi ilmu tentang kolagen. 8. Silvana GMF teman seperjuangan selama penelitian ini.
9. Amelia, Margaretha, Zaikanur dan teman-teman yang senantiasa memberikan bantuannya selama penelitian.
10. Teman-teman THP 46 (alto) untuk kebersamaan dan bantuannya terhadap penulis dalam menyelesaikan skripsi ini.
Penulis menyadari bahwa penulisan skripsi ini masih jauh dari sempurna. Oleh karena itu kritik dan saran yang bersifat membangun dari semua pihak sangat diharapkan. Semoga skripsi ini dapat memberikan manfaat bagi semua pihak yang memerlukannya.
DAFTAR ISI
Optimasi ekstraksi kolagen (Kittiphattanabawon et al. 2010) ... 4
Ekstraksi kolagen (modifikasi Sukkwai et al. 2011) ... 4
Analisis... 4
Analisis gugus fungsi dengan FTIR (Muyonga et al. 2004) ... 7
Analisis data (Steel dan Torrie 1993) ... 7
Komposisi Asam Amino Kolagen ... 11
Analisis Gugus Fungsi dengan Fourier Transform InfraRed (FTIR) ... 12
DAFTAR TABEL
Komposisi kimia kulit ikan cobia dan berbagai ikan ... 8
Persentasi penurunan komposisi non kolagen pada kulit ... 10
Komposisi kimia kolagen kulit ikan cobia dan berbagai ikan ... 10
Rendemen kolagen kulit ikan cobia dan beberapa kulit ikan lainnya ... 11
Nilai pH kolagen kulit ikan cobia dan ikan lainnya... 11
Komposisi asam amino kolagen dari kulit ikan cobia ... 12
Karakteristik gugus fungsi kolagen hasil deteksi dengan FTIR sebagai acuan.. 13
Karakteristik gugus fungsi kolagen kulit ikan cobia dan ikan lainnya ... 14
DAFTAR GAMBAR
Ikan cobia (Rachycentron canadum) ... 2Diagram alir pembuatan kolagen ... 5
Konsentrasi protein larutan NaOH sisa perendaman kulit ... 9
Spektra infrared kolagen ... 13
DAFTAR LAMPIRAN
Kurva regresi linear standar BSA ... 19Hasil uji Anova nilai konsentrasi protein larutan NaOH sisa perendaman kulit ... 19
Hasil uji DMRT untuk pengaruh konsentrasi NaOH terhadap nilai konsentrasi protein larutan sisa perendaman ... 19
PENDAHULUAN
Latar Belakang
Ikan cobia (Rachycentron canadum) merupakan ikan ekonomis penting di Asia dan mempunyai pertumbuhan yang sangat cepat. Ikan cobia ini termasuk ikan pelagis yang hidup di perairan tropis dan sub tropis, dan banyak ditemukan di Samudra Pasifik, Atlantik dan sebelah baratdaya Meksiko. Ikan ini sering dijumpai di sekitar perairan Pulau Bali dan telah dibudidayakan di Lampung. Ikan cobia dapat dijual dalam bentuk fillet. Produksi fillet ikan cobia menghasilkan limbah samping berupa kepala, jeroan, tulang, dan kulit. Hasil samping ini sangat potensial untuk diolah sehingga dapat meningkatkan nilai komersialnya. Salah satu upaya pengolahan yang dapat dilakukan yaitu pembuatan kolagen dari kulit ikan cobia. Ikan cobia dapat dilihat pada Gambar 1.
Lee et al. (2001) menyatakan kolagen merupakan biomaterial yang penting bagi aplikasi medis karena sifatnya yang biodegradable. Kolagen telah banyak digunakan untuk kepentingan biomedis, pharmaceutical, industri makanan, industri obat, dan industri kosmetik. Kumar et al. (2011) menyatakan bahwa kolagen mengandung 90% protein dan 18 jenis asam amino, 7 diantaranya merupakan asam amino esensial.
Kumar et al. (2011) menyatakan kolagen memiliki kemampuan untuk memberikan sifat elastis pada kulit dan dapat mengurangi keriput yang terjadi sebagai efek dari penuaan. Kolagen pada kosmetik jika digunakan pada kulit wajah akan mampu menahan air sehingga membuat kulit wajah tetap dalam keadaan lembab. Manfaat kolagen bagi kesehatan kulit yaitu mengurangi kerutan
pada wajah, menghilangkan bekas jerawat, dan menutup pori-pori. Peng et al. (2004) menyatakan bahwa sebagian besar kolagen komersial dibuat
dari kulit sapi dan kulit babi yang seringkali tidak sesuai bagi kebanyakan agama dan etnis tertentu. Pemanfaatan tulang dan kulit ikan sebagai bahan baku kolagen merupakan alternatif untuk mengatasi masalah-masalah tersebut.
Nagai dan Suzuki (2000) menyatakan bahwa kolagen dapat diekstraksi dari kulit chub mackerel (Scomber japanicus) dengan pretreatment menggunakan NaOH, deffated menggunakan butil alkohol, dan perendaman dalam asam asetat. Nagai et al. (2001) menyatakan bahwa PSC dari cuttlefish (Sepia lycidas) diekstraksi dengan cara pretreatment menggunakan NaOH, perendaman dalam asam asetat, serta penambahan pepsin. Pembuatan ASC telah dilakukan dari berbagai jenis kulit ikan, contoh: kakap mata besar (Priachantus tayenus) (Kittiphattanabawon et al. 2005); serta ballon fish (Diodon holochantus) (Huang et al. 2011). Pembuatan PSC telah dilakukan dari berbagai jenis kulit ikan, contoh: baltic cod (Gadus morhua) (Skierka dan Sadowska 2007); ballon fish (Diodon holocanthus) (Huang et al. 2011); serta stripped cathfish (Pangasianodon hypophthalamus) (Singh et al. 2011).
2
memiliki ikatan silang lebih kompleks dan padat seperti tulang dan kulit sapi. Potaros et al. (2009) menyatakan bahwa kolagen dapat diekstraksi dengan tiga metode yang umum dilakukan yaitu neutral salt-solubilized collagen, acid solubilized collagen (ASC) and pepsin solubilized collagen (PSC). Kolagen umumnya diekstraksi pada kondisi temperatur 4 °C dan disentrifugasi dengan kecepatan tinggi.
Pembuatan kolagen dari kulit ikan cobia sangat potensial untuk dikembangkan mengingat besarnya pemanfaatan kolagen bagi berbagai industri serta kurangnya pemenuhan kebutuhan kolagen di Indonesia secara lokal. Kumar et al. (2011) menyatakan bahwa kolagen yang terbuat dari kulit dan tulang ikan memiliki struktur molekul yang lebih kecil dibandingkan dengan kolagen yang terbuat dari sapi atau babi sehingga lebih mudah untuk diserap. Pembuatan kolagen dari kulit ikan cobia juga merupakan alternatif pemanfaatan limbah menjadi produk dengan nilai komersial lebih tinggi. Pembuatan kolagen degan metode lain penting untuk diupayakan untuk meningkatkan keefisienan ekstraksi serta menurunkan biaya produksi kolagen.
Gambar 1 Ikan cobia (Rachycentron canadum) (NOOA 2014)
Perumusan Masalah
Pengolahan ikan cobia berupa pemfilletan menghasilkan limbah yang belum termanfaatkan secara optimal. Pembuatan kolagen dari kulit ikan cobia sangat potensial untuk dikembangkan mengingat pemanfaatan kolagen yang besar di berbagai industri serta kurangnya pemenuhan kebutuhan kolagen di Indonesia secara lokal. Pembuatan kolagen dari kulit ikan cobia juga alternatif pemanfaatan limbah menjadi produk dengan nilai komersial lebih tinggi. Ekstraksi kolagen dari kulit ikan cobia dapat menjadi alternatif pada usaha pemanfaatan limbah hasil perikanan menjadi produk dengan nilai komersial yang lebih tinggi. Karakterisasi kolagen dari kulit ikan cobia dapat menjadi referensi mengenai kualitas kolagen yang dihasilkan.
Tujuan Penelitian
Penelitian ini bertujuan untuk melakukan ekstraksi dan karakterisasi kolagen yang berasal dari kulit ikan cobia (Rachycentron canadum).
Manfaat Penelitian
3
Ruang Lingkup Penelitian
Ruang lingkup penelitian ini adalah pengambilan sampel, preparasi sampel, analisis proksimat sampel, pembuatan kolagen dari sampel, analisis karakteristik sampel, analisis data, serta panulisan laporan.
METODE
Penelitian ini dilaksanakan mulai bulan Maret 2013 sampai November 2013. Preparasi dilakukan di Laboratorium Pengetahuan Bahan Baku Industri Hasil Perairan, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Ekstraksi kolagen dilakukan di Laboratorium Biokimia Hasil Perairan, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Analisis Gugus Fungsi dilakukan di Laboratorium Analisis Bahan, Departemen Fisika, Fakultas MIPA, Institut Pertanian Bogor. Analisis asam amino dan proksimat dilakukan di Laboratorium Saraswanti Indo Genetech.
Bahan
Bahan utama yang digunakan dalam penelitian ini adalah kulit ikan cobia (Rachycentron canadum). Ikan cobia diperoleh dari Pelabuhan Perikanan Nusantara Muara Angke (Jakarta). Bahan yang digunakan pada penentuan analisis protein kualitatif yaitu larutan Bradford. Bahan yang digunakan untuk membuat kolagen adalah akuades, NaOH, asam asetat (CH3COOH). Bahan-bahan lain meliputi bahan untuk analisis karakteristik kolagen.
Alat
Alat yang digunakan pada pembuatan kolagen dari kulit ikan cobia yaitu termometer, labu ukur (Pyrex), dan tabung reaks (Pyrex). Alat yang digunakan untuk analisis proksimat adalah, oven (Yamato), desikator (analisis kadar air); tabung kjeldahl, destilator, biuret (analisis kadar protein); tabung sokhlet, (analisis kadar lemak); tanur dan desikator (analisis kadar abu). Pengujian gusus fungsi dilakukan dengan menggunakan alat FTIR (Fourier Transform InfraRed) merk Abbmb3000. Pengujian asam amino menggunakan High Performance Liquid Chromatography (HPLC) mrek waters coorporation USA.
Prosedur Penelitian
4
Preparasi bahan baku
Preparasi dilakukan dengan memisahkan bagian kulit dari bagian ikan lainnya. Kulit ikan dipotong hingga ukurannya 0,5 x 0,5 cm. Kulit ikan disimpan pada suhu -20°C hingga akan digunakan.
Optimasi ekstraksi kolagen (Kittiphattanabawon et al. 2010)
Pembuatan kolagen diawali dengan perendaman kulit pada larutan alkali. Larutan alkali digunakan untuk menghilangkan protein non kolagen pada sampel. Kulit ikan direndam dalam larutan NaOH konsentrasi 0,05 M; 0,1 M; dan 0,2 M dengan perbandingan 1:10 (b/v) dan diaduk terus-menerus selama 6 jam pada suhu ruang. Larutan NaOH diganti setiap 2 jam sekali kemudian diuji kandungan protein secara kuantitatif dengan uji Bradford untuk menentukan konsentrasi NaOH dan lama waktu perendaman terbaik.
Ekstraksi kolagen (modifikasi Sukkwai et al. 2011)
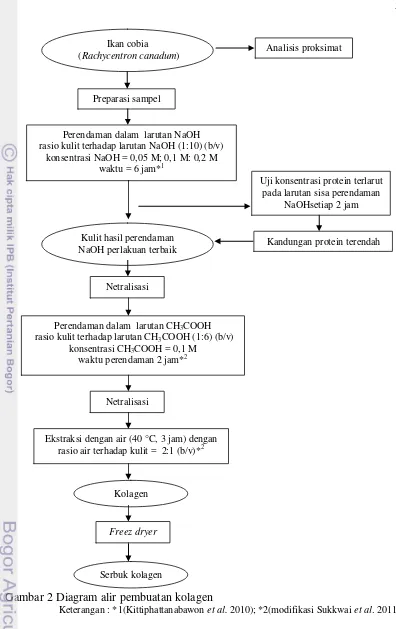
Hidrolisis diawali dengan perendaman kulit dalam larutan NaOH dengan konsentrasi dan waktu sesuai hasil praperlakuan yang diperoleh pada proses optimasi dengan perbandingan sampel dan pelarut yaitu 1:10 (b/v). Sampel kulit selanjutnya dinetralisasi dengan akuades hingga netral. Kulit yang sudah netral kemudian direndam dalam larutan CH3COOH 0,1 M selama 2 jam dengan perbandingan sampel dan pelarut yaitu 1:6 (b/v). Sampel kulit dinetralisasi menggunakan larutan akuades hingga netral. Proses dilakukan pada suhu ruang. Sampel kemudian diekstraksi menggunakan akuades selama 3 jam pada suhu 40 ºC dengan perbandingan sampel dan pelarut yaitu 1:2 (b/v). Hasil ekstraksi yang diperoleh merupakan kolagen larut air yang selanjutnya pelu dikering bekukan agar diperoleh dalam bentuk serbuk. Diagram alir pembuatan kolagen disajikan pada Gambar 1.
Analisis
Analisis yang dilakukan untuk mengarakterisasi kolagen dari kulit ikan cobia yaitu uji Bradford, analisis komposisi kimia, analisis asam amino, uji pH, uji FTIR, dan analisis data.
Uji Bradford (Bradford 1976)
Uji Bradford dilakukan untuk menentukan konsentrasi protein pada sampel dengan Bovine Serum Albumin (BSA) sebagai standar. Larutan Bradford dibuat dengan mencampurkan 10 mg Coomasive Briliant Blue (CBB) dengan 5 mL etanol 95%, kemudian ditambahkan 10 mL larutan asam fosfat 85% dan akuades hingga volumenya mencapai 500 mL. Larutan Bradford tersebut kemudian disaring menggunakan kertas saring.
Penentuan protein terlarut dengan metode Bradford dilakukan dengan menggunakan spektrofotometer. Sampel sebanyak 0,01 mL ditambah 1,99 mL akuades kemudian divortex. Larutan Bradford sebanyak 5 mL ditambahkan pada sampel dan divortex. Sampel ditentukan absorbansinya dengan spektrofotometer pada panjang gelombang 595 nm.
Analisis proksimat (AOAC 2005)
5
Gambar 2 Diagram alir pembuatan kolagen
Keterangan : *1(Kittiphattanabawon et al. 2010); *2(modifikasi Sukkwai et al. 2011)
Analisis rendemen (AOAC 1995)
Rendemen kolagen diperoleh dari perbandingan berat kering kolagen yang dihasilkan dengan berat bahan kulit. Rendemen diperoleh dengan rumus:
Uji konsentrasi protein terlarut pada larutan sisa perendaman
NaOHsetiap 2 jam
Kandungan protein terendah
Perendaman dalam larutan CH3COOH
rasio kulit terhadap larutan CH3COOH (1:6) (b/v)
konsentrasi CH3COOH = 0,1 M
waktu perendaman 2 jam*2
Ikan cobia (Rachycentron canadum)
Perendaman dalam larutan NaOH rasio kulit terhadap larutan NaOH (1:10) (b/v)
konsentrasi NaOH = 0,05 M; 0,1 M: 0,2 M waktu = 6 jam*1
Preparasi sampel
Netralisasi
Analisis proksimat
Kulit hasil perendaman NaOH perlakuan terbaik
Netralisasi
Ekstraksi dengan air (40 °C, 3 jam) dengan rasio air terhadap kulit = 2:1 (b/v)*2
Kolagen
Freez dryer
6
Rendemen kolagen (%) = Berat kering kolagen x 100% Berat bahan baku kulit
Analisis pH (AOAC 2005)
Analisis pH kolagen yaitu 1 gram sampel dilarutkan dalam 20 mL akuades, ditambahkan 50 mL akuades dan dihomogenkan. Alat pH meter dinyalakan dan dibiarkan hingga stabil terlebih dahulu, kemudian elektroda dicelupkan ke dalam sampel hingga beberapa saat sampai diperoleh angka yang stabil pada proyektor pH meter.
Analisis asam amino (AOAC 1995)
Komposisi asam amino ditentukan dengan HPLC. Sebelum dipakai, perangkat HPLC harus dibilas terlebih dahulu dengan eluen yang akan digunakan selama 2-3 jam. Begitu pula dengan syringe yang akan digunakan harus dibilas dengan akuades. Analisis asam amino menggunakan HPLC terdiri dari 4 tahap, yaitu: (a) pembuatan hidrolisat protein; (b) pengeringan; (c) derivatisasi; dan (d) injeksi.
(a) Pembuatan hidrolisat protein
Preparasi sampel dilakukan dengan membuat hidrolisat protein. Sampel ditimbang sebanyak 0,1 gram dan dihancurkan, sampel yang telah hancur ditambahkan dengan HCl 6 N sebanyak 5-10 mL. Larutan tersebut dipanaskan dalam oven pada suhu 100 °C selama 24 jam. Hal ini dilakukan untuk menghilangkan gas atau udara yang ada pada sampel agar tidak menganggu kromatogram yang dihasilkan. Setelah pemanasan selesai, hidrolisat protein disaring menggunakan milipore berukuran 45 mikron.
(b) Pengeringan
Hasil saringan diambil sebanyak 10 μL dan ditambahkan 30 μL larutan pengering. Larutan pengering dibuat dari campuran antara metanol, natrium asetat, dan trimetilamin dengan perbandingan 2:2:1. Setelah sampel dikeringkan dengan pompa vakum untuk mempercepat proses dan mencegah oksidasi.
(c) Derivatisasi
Larutan derivatisasi dibuat dari campuran antara larutan metanol, pikoiodotiosianat, dan trinetilamin dengan perbandingan 3:3:4. Proses derivatasisasi dilakukan agar detektor mudah untuk mendeteksi senyawa yang ada pada sampel. Selanjutnya dilakukan pengenceran dengan cara menambahkan 10 ml asetonitril 60 % dan natriun asetat 1 M lalu dibiarkan selama 20 menit. Hasil
pengenceran disaring kembali dengan menggunakan milipore berukuran 45 mikron. Larutan derivatatisasi sebanyak 30 μL ditambahkan pada hasil
pengeringan.
(d) Injeksi ke HPLC
Hasil saringan diambil sebanyak 20 μL untuk diinjeksikan ke dalam HPLC. Untuk perhitungan konsentrasi asam amino pada bahan, dilakukan pembuatan kromatogram standar menggunakan asam amino standar yang telah siap pakai yang mengalami perlakuan yang sama dengan sampel. Kondisi alat HPLC saat berlangsungnya analisis asam amino:
Temperatur kolom : 38 °C
7 persentase asam amino dalam 100 gram sampel :
Asam Amino (%) = AC x BS x BM x Fp x 100%
BM = Berat molekul masing-masing asam amino Fp = Faktor pengenceran
Analisis gugus fungsi dengan FTIR (Muyonga et al. 2004)
Analisis FTIR dilakukan untuk mengetahui gugus fungsi dan keberadaan kolagen nanopartikel yang dihasilkan. Kolagen sebanyak 0,2 gram dihaluskan dengan KBr dalam mortar hingga homogen, kemudian dimasukkan ke dalam cetakan pellet dan dipadatkan serta divakum dalam mesin pencetak pellet. Selanjutnya pellet dimasukkan ke dalam sel dan dimasukkan pada media penempatan sel dengan ditembakkan sinar dari spektofotometer inframerah IR-408 yang sudah dinyalakan dengan kondisi yang stabil, kemudian dilakukan pendeteksian menggunakan tombol detektor dan akan dihasilkan rekorder histogram FTIR pada monitor yang akan menampilkan puncak-puncak dari gugus fungsi yang terdapat pada sampel. Histogram yang diperoleh selanjutnya akan dianalisis untuk memperoleh data kualitatif maupun kuantitatif.
Analisis data (Steel dan Torrie 1993)
Data yang diperoleh dari penelitian tahap pendahuluan (pretreatment) dianalisis dengan menggunakan softwear Statistical Product and Service Solutions (SPSS) 17. Analisis statistik data penelitian diolah dengan Rancangan Acak Faktorial dengan 2 faktor yaitu konsentrasi NaOH sebanyak 3 taraf (0,05M; 0,1 M; 0,2 M) dan faktor lama waktu perendaman dengan 3 taraf (2 jam, 4 jam, 6 jam). Semua perlakuan dilakukan sebanyak 2 kali ulangan. Model rancangannya adalah:
Yijk = μ + τi +βj + (τβ)ij + εijk Keterangan:
Yij = Nilai pengamatan dari perlakuan ke-i konsentrasi NaOH) dan ulangan ke-j μ = Nilai rataan umum populasi
τi = Pengaruh perlakuan ke-i (konsentrasi NaOH) βj = Pengaruh lama waktu perendaman ke-j
(τβ)ij = Pengaruh interaksi perlakuan konsentrasi NaOH ke-I dengan lama waktu perendaman ke-j
8
Data yang diamati dianalisis secara statistik dengan analisis ragam (ANOVA). Apabila hasil analisis menunjukkan berpengaruh nyata, maka dilanjutkan dengan uji Duncan’s Multiple Range Test (DMRT) dengan taraf kepercayaan 95%. Hipotesis Pengaruh kosentrasi NaOH:
H0 = Perbedaan konsentrasi NaOH, waktu perendaman, dan interaksi antar perlakuan tidak berpengaruh nyata terhadap total protein non-kolagen terlarut
H1 = Perbedaan konsentrasi NaOH, waktu perendaman, dan interaksi antar perlakuan berpengaruh nyata terhadap total protein non-kolagen terlarut.
HASIL DAN PEMBAHASAN
Karakteristik Bahan Baku
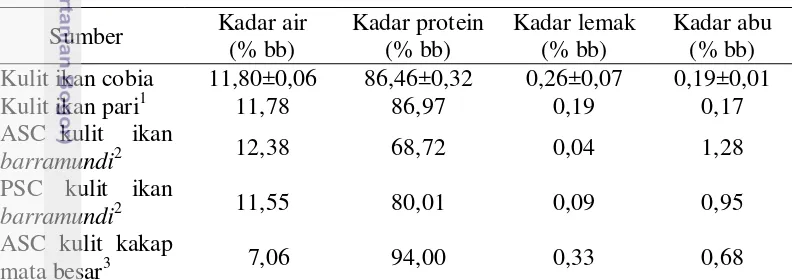
Komposisi kimia suatu bahan perlu diketahui untuk menentukan kandungan gizi yang terdapat di dalam suatu bahan. Komposisi kimia juga merupakan salah satu indikasi kualitas suatu bahan. Analisis komposisi kimia yang dilakukan pada penelitian ini meliputi kadar air, protein, lemak, dan abu. Komposisi kimia kulit ikan cobia dan beberapa kulit ikan lain disajikan pada Tabel 1.
Tabel 1 Komposisi kimia kulit ikan cobia dan berbagai ikan Sumber Kadar air
Kulit ikan cobia yang diteliti memiliki kadar air yang hampir sama dengan yang diteliti (Killekar et al. 2012). Kadar air kulit ikan cobia lebih tinggi dari kadar air pada kulit ikan pari (Nur’aenah 2013) dan kulit ikan cucut bambu (Mahardika 2013). Perbedaan komposisi kimia dipengaruhi oleh jenis spesies, habitat, genetik, serta makanan. Perbedaan komposisi kimia pada kulit ikan cobia yang diteliti dengan yang digunakan Killekar et al. (2012) dapat disebabkan oleh kondisi ikan yang digunakan. Killekar et al. (2012) menggunakan ikan cobia yang telah dibekukan. Ikan cobia yang digunakan pada penelitian ini dalam kondisi segar. Amiza dan Aishah (2011) menyatakan bahwa pembekuan bahan baku menghasilkan gelatin dengan kualitas kurang baik dibandingkan metode preservasi lainnya seperti pengeringan.
9
Optimasi Ekstraksi Kolagen
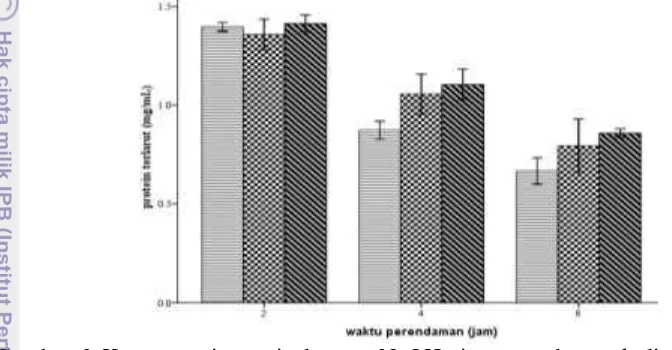
Pembuatan kolagen diawali dengan perlakuan deproteinisasi yaitu penghilangan protein non kolagen menggunakan larutan alkali. Zhou dan Regenstein (2005) menyatakan contoh dari larutan alkali yang dapat digunakan untuk menghilangkan protein non kolagen yaitu NaOH dan Ca(OH)2. Perendaman dalam alkali juga dapat menghilangkan keberadaan lemak pada bahan. Konsentrasi protein terlarut pada larutan NaOH sisa perendaman disajikan pada Gambar 3.
Gambar 3 Konsentrasi protein larutan NaOH sisa perendaman kulit ( =NaOH 0,05 M; = NaOH 0,1 M; = NaOH 0,2M)
Gambar 3 menunjukkan bahwa penggunaan NaOH 0,2 M memberikan hasil kelarutan protein tertinggi pada waktu perendaman yang sama. Zhou dan Regenstein (2005) menyatakan bahwa NaOH menyebabkan pengembangan yang signifikan pada kulit dibanding dengan jenis alkali yang lain. Pengembangan ini menyebabkan terlarutnya protein non kolagen pada kulit. Analisis varian (ANOVA) protein terlarut pada larutan NaOH sisa rendaman kulit menunjukkan perlakuan konsentrasi NaOH dan waktu perendaman berpengaruh nyata terhadap total protein non kolagen terlarut. Interaksi antar perlakuan tidak berpengaruh nyata terhadap nilai protein terlarut pada larutan sisa perendaman (Lampiran 2-4). Uji lanjut dengan DMRT pada tingkat kepercayaan 95% menunjukkan perlakuan terbaik yang diperoleh yaitu perendaman pada NaOH 0,05 M selama 6 jam (p<0,05) (Steel dan Torric 1993). Hasil ini sama dengan hasil penelitian Nur’aenah (2013) yang menyatakan bahwa penghilangan protein non kolagen dapat dilakukan pada konsentrasi NaOH 0,05 M selama 6 jam. Zhou dan Regenstein (2005) menyatakan bahwa penghilangan protein non kolagen dapat dilakukan menggunakan NaOH pada konsentrasi 0,01 hingga 0,1 mol/L. Penggunaan konsentrasi di atas 0,1 mol/L tidak berpengaruh nyata pada penghilangan protein non kolagen.
10
Tabel 2 Persentasi penurunan komposisi non kolagen pada kulit Parameter Nilai awal
Protein 19,02±0,21 9,08±0,38 52,25±1,49
Abu 1,36±0,16 0,03±0,01 97,99±0,40
Lemak 7,09±0,18 0,02±0,00 99.73±0,03
Perendaman dalam larutan NaOH 0,1 M telah mampu menghilangkan sebagian besar komponen non kolagen. Proses deproteinisasi telah mampu menghilangkan protein non kolagen sebesar 52,247±1,488% dari total protein; kadar abu sebesar 97,995±0,400%; dan kadar lemak sebesar 99,725±0,030%.
Komposisi Kimia Kolagen
Komposisi kimia kolagen merupakan parameter keefektifan proses deproteinisasi, defatting, demineralisasi, dan ekstraksi pada pembuatan kolagen. Perendaman dalam larutan alkali dan asam bertujuan menghilangkan protein non kolagen serta komponen lain yaitu lemak dan mineral. Proses ini dilakukan agar diperoleh kandungan protein kolagen yang tinggi. Komposisi kimia kolagen kulit ikan cobia dan beberapa kolagen kulit ikan lain disajikan pada Tabel 3.
Tabel 3 Komposisi kimia kolagen kulit ikan cobia dan berbagai ikan Sumber Kadar air Kulit ikan cobia 11,80±0,06 86,46±0,32 0,26±0,07 0,19±0,01
Kulit ikan pari1 11,78 86,97 0,19 0,17
Kandungan protein kolagen kulit ikan cobia hampir sama dengan kolagen ikan pari (Pastinachus solocirostris) yang dibuat dengan metode yang sama. Kandungan protein ikan cobia lebih tinggi dari ASC dan PSC kulit ikan barramundi (Lates calcarifer), namun lebih rendah dari ASC kulit ikan kakap mata besar (Priacanthus tayenus) yang kadar proteinnya mencapai 94%. Jamilah et al. (2013) menyatakan perbedaan kadar protein dapat disebabkan oleh perbedaan metode ekstraksi yang digunakan dan perbedaan spesies ikan yang digunakan.
11 (Priacanthus tayenus) yang kadar airnya 7,06%. Jamilah et al. (2013) menyatakan perbedaan kadar protein dapat disebabkan oleh perbedaan metode ekstraksi yang digunakan dan perbedaan spesies ikan yang digunakan
Rendemen Kolagen
Rendemen menunjukkan keefektifan proses ekstraksi. Hasil penelitian menunjukkan kolagen kulit ikan cobia memiliki rendemen yang lebih tinggi dari ASC kulit ikan rainbow trout (Tabarestani et al. 2012) serta ASC dan PSC ikan patin siam (Singhs et al. 2011), namun lebih rendah dari rendemen ikan tuna (Hema et al. 2013) (Tabel 4). Potaros et al. (2009) menyatakan bahwa perbedaan nilai rendemen pada kolagen yang dihasilkan dapat disebabkan oleh perbedaan metode ekstraksi yang digunakan, konsentrasi larutan yang digunakan untuk menghilangkan protein non kolagen, dan jenis bahan yang digunakan.
Tabel 4 Rendemen kolagen kulit ikan cobia dan beberapa kulit ikan lainnya
Sumber Kolagen Rendemen (% bb)
Kulit ikan cobia 10,508±0,483
ASC kulit ikan rainbow trout1 9,448
Parameter untuk mengukur derajat keasaman suatu larutan adalah nilai pH. Nilai pH kolagen kulit ikan cobia sudah netral. Zhou dan Regenstein (2005) menyatakan kombinasi perlakuan asam dan basa pada proses ekstraksi cenderung menghasilkan pH akhir kolagen yang netral. Proses penetralan berpengaruh pada pH akhir kolagen karena proses ini mengurangi sisa-sisa larutan asam atau basa akibat perendaman. Basa kuat NaOH akan terionisasi lebih dahulu menjadi Na+ dan OH‐. Ion hidroksida ini akan segera bereaksi dengan asam asetat membentuk air dan ion asetat. Nilai pH kolagen dari kulit ikan cobia disajikan pada Tabel 5.
Tabel 5 Nilai pH kolagen kulit ikan cobia dan ikan lainnya
Sumber kolagen Nilai pH
Kulit ikan cobia 7,08±0,01
Kulit ikan pari (Pastinachus solocirostris)1 5,00 Kulit ikan cucut bambu (Chiloscyllium punctatum)2 6,30
Keterangan : 1(Nura’aeni 2013) ; 2 (Mahardika 2013)
Komposisi Asam Amino Kolagen
12
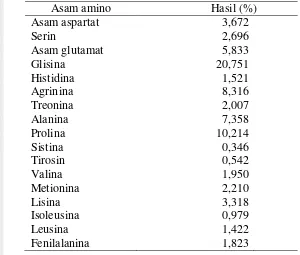
disajikan pada Tabel 6. Asam amino yang memiliki jumlah dominan pada kolagen kulit ikan cobia yaitu glisina dan prolina. Asam amino dengan jumlah terendah yaitu pada sistina, tirosina, dan isoleusina dengan jumlah masing-masing. Hasil penelitian ini serupa dengan komposisi asam amino kolagen dari beberapa jenis kulit ikan lain, contoh: pari (Pastinachus solocirostris) (Nur’aenah 2013), kakap mata besar (Priacanthus tayenus) (Kittiphattanabawon et al. 2005), dan striped catfish (Pangasianodon hypophthalmus) (Singh et al. 2011) dengan glisina dan prolina merupakan asam amino dominan. Kittiphattanabawon et al. (2010) menyatakan kandungan asam amino berkolerasi dengan habitat ikan dan stabilitas termal dari kolagen. Susunan triple heliks kolagen (Gly-X-Y) memiliki 35% prolina dan hidroksiprolina sebagai penyusunnya, sementara glisina terdapat pada setiap posisi ketiga susunan. Kelompok hidroksil pada hidroksiprolina berpengaruh pada stabilitas rantai heliks melalui ikatan hidrogen antar-rantai yang menghubungkan secara langsung molekul air dengan grup karbonil.
Tabel 6 Komposisi asam amino kolagen dari kulit ikan cobia Asam amino Hasil (%)
Nalinanon et al. (2011) menyatakan kolagen tipe I mengandung asam amino glisina, alananina, dan prolina dalam jumlah yang cukup tinggi, sedangkan asam amino histidina dan tirosina hanya terdapat dalam jumlah sedikit serta tidak mengandung sistina. Keberadaan sistina pada kolagen yang dihasilkan menunjukkan deproteinisasi belum berjalan optimal. Proses deproteinisasi bertujuan untuk menghilangkan keberadaan protein non kolagen. Pada jam ke-6 perendaman dalam larutan NaOH masih ditemukan adanya protein terlarut sebesar 0,667 mg/mL yang memungkinkan keberadaan asam amino sistina.
Analisis Gugus Fungsi dengan Fourier Transform InfraRed (FTIR)
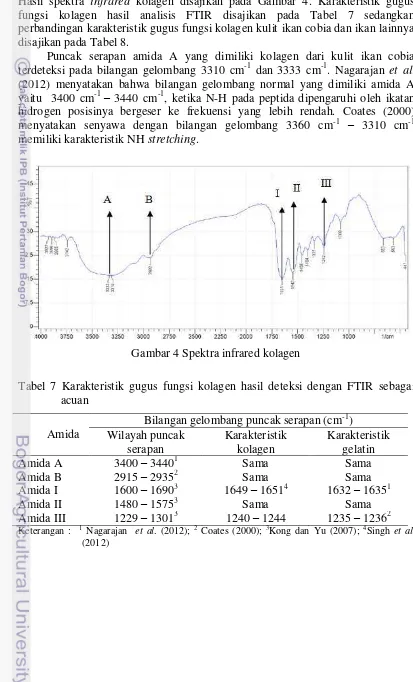
13 frekuensi IR tertentu diserap oleh sampel senyawa organik, maka akan timbul vibrasi dalam molekul senyawa tersebut (Nagarajan et al. 2012). Analisis FTIR yang dilakukan pada penelitian ini bertujuan memastikan senyawa yang dihasilkan merupakan kolagen berdasarkan gugus-gugus fungsi penyusunnya. Hasil spektra infrared kolagen disajikan pada Gambar 4. Karakteristik gugus fungsi kolagen hasil analisis FTIR disajikan pada Tabel 7 sedangkan perbandingan karakteristik gugus fungsi kolagen kulit ikan cobia dan ikan lainnya disajikan pada Tabel 8.
Puncak serapan amida A yang dimiliki kolagen dari kulit ikan cobia terdeteksi pada bilangan gelombang 3310 cm-1 dan 3333 cm-1. Nagarajan et al. (2012) menyatakan bahwa bilangan gelombang normal yang dimiliki amida A yaitu 3400 cm-1 – 3440 cm-1, ketika N-H pada peptida dipengaruhi oleh ikatan hidrogen posisinya bergeser ke frekuensi yang lebih rendah. Coates (2000) menyatakan senyawa dengan bilangan gelombang 3360 cm-1 – 3310 cm-1 memiliki karakteristik NH stretching.
Gambar 4 Spektra infrared kolagen
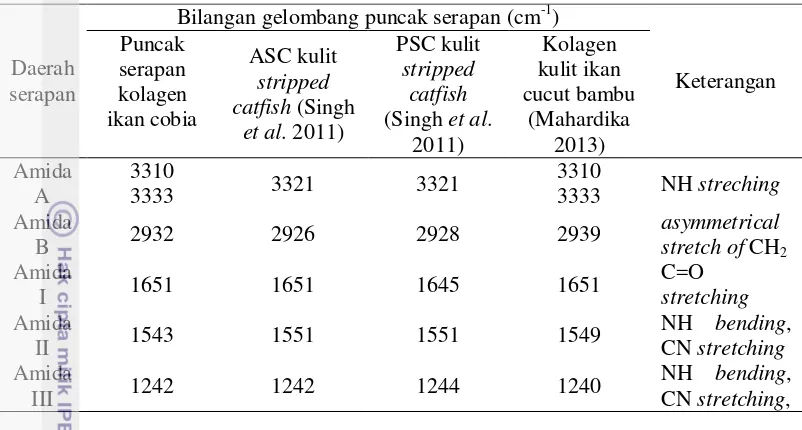
Tabel 7 Karakteristik gugus fungsi kolagen hasil deteksi dengan FTIR sebagai acuan
Amida
Bilangan gelombang puncak serapan (cm-1) Wilayah puncak
serapan
Karakteristik kolagen
Karakteristik gelatin
Amida A 3400 – 34401 Sama Sama
Amida B 2915 – 29352 Sama Sama
Amida I 1600 – 16903 1649 – 16514 1632 – 16351
Amida II 1480 – 15753 Sama Sama
Amida III 1229 – 13013 1240 – 1244 1235 – 12362
14
Tabel 8 Karakteristik gugus fungsi kolagen kulit ikan cobia dan ikan lainnya
Daerah serapan
Bilangan gelombang puncak serapan (cm-1)
Keterangan
Adanya puncak pada bilangan gelombang 2932 cm-1 mengindikasikan adanya gugus khas kolagen yaitu amida B. Coates (2000) menyatakan gugus amida B dengan wilayah serapan pada bilangan gelombang 2915cm-1 – 2935 cm-1 atau 2845 cm-1 – 2865 cm-1. Kong dan Yu (2007) menyatakan bilangan gelombang yang mengindikasikan serapan amida B terbentuk dari asymmetrical stretch of CH2.
Bilangan gelombang amida I yang terdeteksi pada kolagen dari kulit ikan cobia yaitu 1651 cm-1. Shah dan Manekar (2012) menyatakan bahwa amida I terkait dengan vibrasi peregangan gugus karbonil. Amida I merupakan gugus fungsi khas yang menyusun kolagen. Kong dan Yu (2007) menyatakan bahwa amida I terdeteksi pada kisaran bilangan gelombang 1600 cm-1 – 1690 cm-1. Nilai ini serupa dengan hasil yang diperoleh oleh Singh et al. (2012), ASC kulit ikan stripped catfish memiliki gugus amida I pada bilangan gelombang 1651 cm-1. Nilai bilangan gelombang pada PSC kulit ikan stripped catfish lebih rendah yaitu 1649 cm-1. Nagarajan et al. (2012) menyatakan bahwa nilai bilangan gelombang amida I gelatin dari kulit luar cumi-cumi yaitu 1632 cm-1 – 1635 cm-1. Bilangan gelombang pada kisaran 1633 cm-1 merupakan karakteristik random coil pada gelatin. Nikoo et al. (2011) menyatakan bahwa gugus fungsi amida I kolagen kulit ikan cobia terdeteksi pada bilangan 1651 cm-1 lebih tinggi gelatin yaitu pada kisaran 1633 cm-1. Hal ini mengindikasikan senyawa molekul yang dihasilkan dari proses ekstraksi merupakan kolagen.
Amida II yang merupakan gugus fungsi khas kolagen yang terdeteksi pada bilangan gelombang 1543 cm-1. Kong dan Yu (2007) menyatakan wilayah serapan amida II yaitu pada kisaran 1575 cm-1 – 1480 cm-1. Amida II terkait dengan adanya gugus CN stretching dan NH bending.
15 Nagarajan et al. (2012) menghasilkan gelatin dari kulit luar cumi-cumi yang memiliki gugus fungsi amida III dengan wilayah serapan 1236,86 cm-1 – 1235,79 cm-1. Nikko et al. (2011) menyatakan wilayah serapan gelatin memiliki nilai bilangan gelombang pada kisaran 1235 cm-1 yang mengindikasikan hilangnya struktur triple heliks akibat perubahan α-heliks menjadi struktur random coil (single heliks) yang disebabkan denaturasi kolagen menjadi gelatin. Hal ini mengindikasikan ekstrasi kolagen kulit ikan cobia dengan air pada suhu 40 ºC belum mengubah kolagen menjadi gelatin yang terindikasi dengan masih adanya struktur triple heliks.
KESIMPULAN DAN SARAN
Kesimpulan
Perlakuan terbaik pada proses pretreatment dengan larutan NaOH pada pembuatan kolagen dari kulit ikan cobia (Rachycentron canadum) yaitu konsentrasi 0,05 M selama 6 jam. Rendemen yang dihasilkan dari proses ekstraksi kolagen yaitu 10,508% (bb). Karakteristik proksimat kolagen dari kulit ikan cobia yaitu kadar air 11,80%; kadar protein 86,46%; kadar lemak 0,26 %; dan kadar abu 0,19%. Nilai pH akhir produk kolagen yaitu 7,08. Analisis FTIR menunjukkan adanya amida A dengan wilayah serapan 3310cm-1 dan 3333 cm-1; amida B dengan wilayah serapan 2932 cm-1; amida I pada 1651 cm-1; amida II pada 1542 cm-1; serta amida III pada 1242 cm-1. Struktur triple heliks pada amida I dan III mengindikasikan bahwa senyawa yang dihasilkan merupakan kolagen.
Saran
Penambahan waktu perendaman dalam larutan NaOH penting untuk dilakukan agar penghilangan protein non kolagen optimal. Perlu dikembangkan pengaplikasian kolagen kulit ikan cobia pada bidang farmasi maupun kosmetik. Perlu dikembangkan pembuatan nanokolagen dari kulit ikan cobia. Perlu diupayakan pengolahan kulit ikan cobia menjadi produk lain yaitu gelatin dan enzim.
DAFTAR PUSTAKA
Aberoumand A. 2012. Comparative study between different methods of collagen extraction from fish and its properties. World Applied Sciences Journal 16 (3): 316-319.
Ackman RG. 1989. Characteristics of the fatty acid composition and biochemistry of some fresh-water fish oils and lipids in comparison with marine oils and lipids. Comparative Biochemistry and Physiology 22(3): 907-922.
16
Virginia, USA : Published by The Association of Official Analytical Chemist, Inc.
Association of Official Analytical Chemyst. 2005. Official Method of Analysis of The Association of Official Analytical of Chemist. Arlington, Virginia, USA: Published by The Association of Official Analytical Chemist, Inc.
Amiza MA & Aishah DS. 2011. Effect of drying and freezing of cobia (Rachycentron canadum) skin on its gelatin properties. Insternational Food Research Journal 18: 159-166.
Bradford MM. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Analytical Biochemistry 72: 248-254.
Coates J. 2000. Interpreration of infrared spectra, a practical approach. Di dalam: Meyers RA, editor. Encyclopedia of Analytical Chemistry. Chichester [GB]: John Wiley & Sons Ltd.
Hema GS, Shyni K, Mathew S, Anandan R, Ninan G, Lakshmanan PT. 2013. A simple method for isolation of fish skin collagen-biochemical characterization of skin collgagen extracted from Albacore Tuna (Thunnus alalunga), Dog Shark (Scoliodon sorrakowah), and Rohu (Labeo rohita). Annals of Biological Research 4(1): 271-278.
Huang YR, Shiau CY, Chen HH, Huang BC. 2011. Isolation and characterization of acid and pepsin-solobilized collagen from the skin of ballon fish (Diodon holochantus). Food hydrocolloid 25:1507-1543.
Jamilah B, Hartina MU, Hashim DM, Sazili AQ. 2013. Properties of collagen from barramundi (Lates calcarifer) skin. International Food Research Journal 20(2): 835-842.
Karim AA & Bhat R. 2009. Fish gelatin, properties, challenges, and prospect as an alternative to mamalian gelatins. Food Hydrocolloids 23:536-576.
Killekar VC, Koli JM, Sharangdhar ST, Metar SY. 2012. Functional properties of gelatin extracted from skin of black kingfish (Ranchycentron canadus). Indian Journal of Fundamental and Applied Life Sciences 2(3): 106–116. Kittiphattanabawon P, Benjakul S, Visessanguan W, Nagai T, Tanaka M. 2005.
Characterisation of acid-soluble collagen from skin and bone of bigeye snapper (Priacanthus tayenus). Food Chemistry 89: 363–372.
Kittiphattanabawon P, Benjakul S, Visessanguan W, Shahidi F. 2010. Isolation and characterization of collagen from the cartilages of brownbanded bamboo shark (Chiloscyllium punctatum) and blacktip shark (Carcharhinus limbatus). Food Science and Technology 43: 792–800.
Kong J & Yu S. 2007. Fourier transform infrared spectroscopic analysis of protein secondary structures. Acta Biochim Biophys Sin 39(8): 549–559.
Kumar MH, Spandana V, and Poonam T. 2011. Extraction and determination of collagen peptide and its clinical importance from tilapia fish scales Oreochromis niloticus). International Research Journal of Pharmacy 2(10): 97-99.
Lee CH, Singla A, Lee Y. 2001. Biomedical application of collagen. International Journal of Pharmaceutics 22: 1-22.
17 Studi Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu kelautan, Institut Pertanian Bogor.
Matmaroh K, Benjakul S, Prodpran, Encarnacion AB, Kishimura H. 2011. Characteristics of acid soluble collagen and pepsin soluble collagen from scale of spotted golden goatfish (Parupeneus heptacanthus). Food Chemistry 129: 1179-1186.
Muyonga JH, Cole CGB, Duodu KG. 2004. Characterisation of acids soluble collagen from skins of young and adulti Nileperch (Lates niloticus). Food Chemistry 85(1): 81-89.
Nagai T, Suzuki N, 2000. Isolation of collagen from fish waste material – skin, bone and fins. Food Chemistry 68:227-281
Nagai T, yamashita E, Taniguchi K, Kanamori, N, Suzuki N. 2001. Isolation and characterization of collagen from the outer skin waste material of cuttlefish (Sepia lycidas). Food Chemistry 72:425-429.
Nagarajan M, Benjakul S, Prodpran T, Songtipya P, Kishimura H. 2012. Characteristics and functional properties of gelatin from splendid squid (Loligo formosana) skin as affected by extraction temperatures. Food Hydrocolloids 29: 389-397.
[NOOA] National Oceanic and Atmospheric Administration. 2014. Cobia [internet]. [diacu 7 Februari 2014] Tersedia dari: http://www.fishwatch.gov. Nikoo M, Xu X, Benjakul S, Xu G, Ramires-Suarez JC, Ehsani A, Kasankala LM,
Duan X, Abass S. 2011. Characterization of gelatin from the skin of farmed Amur sturgeon Acipenser schrenckii. International Aquatic Research 3: 135-145.
Nur’aenah N. 2013. Ekstraksi dan karakterisasi kolagen dan nanopartikel kolagen dari kulit ikan pari (Pastinachus solocirostris) sebagai bahan baku kosmetik [tesis]. Bogor [ID]: Sekolah Pascasarjana, Institut Pertanian Bogor.
Peng Y, Glattauer V, Werkmeister JA, Ramshaw JAM. 2004. Evaluation for collagen product for cosmetic application. Journal of Cosmetic Science. 55: 327-341.
Potaros T, Raksakulthai N, Runglerdkreangkrai J, and Worawattanamateekul W. 2009. Characteristics of collagen from nile tilapia (Oreochromis niloticus) skin isolated by two different methods. Kasetsart Journal 43: 584-593. Shah V & Manekar A. 2012. Isolation and characterization of collagen from the
placenta of buffalo (Bovidae bubalus bubalis) for the biomaterial applications. Trend in Life Science 1(4): 26–32.
Singh P, Benjakul S, Maqsood S, Kishimura H. 2011. Isolation and characterisation of collagen extracted from the skin of striped catfish (Pangasianodon hypophthalmus). Food Chemistry 124: 97–105.
Skierka E & Sadowska M. 2007. The influence of different acid and pepsin on the extractibility of collagen from the skin of Baltic cod (Gadus morhua). Food Chemistry 105:1032-1306.
Steel RGD & Torrie JH. 1993. Prinsip dan Prosedur Statistika, Suatu Pendekatan Biometrik. Jakarta: Gramedia Pustaka Utama.
18
Tabarestani Sh, Maghshoudlou Y, Motamedzadegan A, Mahoonak ARS, Rostamzad H. 2012. Study on some properties of acid-soluble collagens isolated from fish skin and bones of rainbow trout (Onchorhyncus mykiss). International Food Research Journal 19(1): 251-257.
19
LAMPIRAN
Lampiran 1Kurva regresi linear standar BSA
Lampiran 2 Hasil uji Anova nilai konsentrasi protein larutan NaOH sisa perendaman kulit
Source Jumlah kuadrat Db Kuadrat
tengah F Nilai-p
Konsentrasi NaOH 0,065 2 0,032 5,782 0,024
Waktu perendaman 1,160 2 0,580 103,703 0,000
Interaksi antar
perlakuan 0,035 4 0,009 1,578 0,261
Galat 0,050 9 0,006
Total 21,434 17
Lampiran 3 Hasil uji DMRT untuk pengaruh konsentrasi NaOH terhadap nilai konsentrasi protein larutan sisa perendaman
Konsentrasi NaOH N Rata-rata konsentrasi protein
terlarut (mg/mL) Notasi
0,050 M 6 0,979 A
0,100 M 6 1,069 AB
20
Lampiran 4 Hasil uji DMRT untuk pengaruh waktu perendaman terhadap nilai konsentrasi protein larutan sisa perendaman
Waktu
perendaman N
Rata-rata konsentrasi
protein terlarut (mg/mL) Notasi
6 jam 6 1,389 A
4 jam 6 1,011 B
21