EFEKTIVITAS PENAMBAHAN
GLUTATHIONE
(GSH) PADA
MEDIUM FERTILISASI DAN KULTUR TERHADAP
KOMPETENSI PERKEMBANGAN AWAL EMBRIO SAPI
SECARA
IN VITRO
ARAS PRASETIYO NUGROHO
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Efektivitas Penambahan Glutathione (GSH) pada Medium Fertilisasi dan Kultur terhadap Kompetensi Perkembangan Awal Embrio Sapi secara In Vitro adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
ARAS PRASETIYO NUGROHO. Efektivitas Penambahan Glutathione (GSH) pada Medium Fertilisasi dan Kultur terhadap Kompetensi Perkembangan Awal Embrio Sapi secara In Vitro. Dibimbing oleh MOHAMAD AGUS SETIADI dan IMAN SUPRIATNA.
Produksi embrio in vitro sapi masih mengalami kendala yang ditandai dengan rendahnya capaian tingkat blastosis. Hal tersebut dapat terjadi karena lingkungan kultur yang mempunyai konsentrasi oksigen (O2) yang tinggi. Kondisi ini menyebabkan metabolisme menghasilkan banyak reactive oxygen species (ROS) seperti hidrogen peroksida (H2O2) yang dapat bereaksi dengan unsur logam menjadi radikal bebas berupa ion hidroksil (OH•−). Radikal bebas OH•− sangat berbahaya karena dapat merusak membran dengan membentuk lipid peroksida (L-OOH). Secara alami oosit menghasilkan glutathione (GSH) yang dapat mereduksi H2O2 sebelum sempat bereaksi dengan unsur logam. Sintesis GSH diregulasikan oleh sel kumulus dengan mentransfer cysteine melalui gap junction sebagai prekusor GSH. Pada saat oosit mencapai kematangan inti, gap junction terputus oleh adanya enzim hyaluronidase sehingga suplai cysteine ke dalam oosit terhenti akibatnya sintesis GSH juga terhenti. Konsentrasi GSH yang dicapai selama pematangan inilah yang digunakan dalam pembentukan pronukleus dan blastosis.
Penelitian ini bertujuan untuk mengetahui tingkat fertilisasi dan kompetensi perkembangan awal embrio sapi dengan penambahan GSH pada medium fertilisasi dan kultur. Penelitian I, oosit sapi dimatangkan, kemudian difertilisasi dengan spermatozoa yang telah diseleksi menggunakan teknik swim up. Oosit dan spermatozoa diinkubasi pada medium fertilisasi dengan penambahan 0.25 mM, 0.50 mM, dan 1.00 mM GSH. Penelitian II, oosit sapi dimatangkan pada medium pematangan dan difertilisasi menggunakan prosedur seperti penelitian sebelumnya, kemudian dikultur pada medium kultur dengan perlakuan penambahan GSH: hanya pada medium fertilisasi (T1), hanya pada medium kultur (T2), dan kombinasi pada medium fertilisasi dan kultur (T3). Sementara itu pada kontrol tidak diberikan perlakuan penambahan GSH.
Hasil penelitian I menunjukkan bahwa penambahan 1.00 mM GSH pada medium fertilisasi dapat meningkatkan pembentukan pronukleus normal yang lebih tinggi (86.9%) dibandingkan dengan perlakuan yang lain yaitu 0.50 mM (80.3%), 0.25 mM (73.8%), dan kontrol (58.9%) (P<0.05). Penelitian II menujukkan bahwa perkembangan awal embrio sapi pada hari ke-2 kultur yang mencapai pembelahan delapan sel pada perlakukan T1 (56.0%) dan T3 (53.6%) lebih tinggi (P<0.05) dibandingkan dengan perlakuan T2 (26.2%) and T0 (kontrol) (31.3%). Selanjutnya, perkembangan awal embrio sapi pada hari ke-4 kultur yang mencapai pembelahan 16 sel pada perlakuan T1 (26.2%) dan T3 (27.4%) lebih tinggi (P<0.05) dibandingkan dengan perlakukan T2 (11.9%) dan T0 (kontrol) (10.8%). Dari hasil penelitian dapat disimpulkan bahwa penambahan 1.00 mM GSH pada medium fertilisasi lebih efektif dalam mendukung pembentukan pronukleus normal dan perkembangan awal embrio sapi dibandingkan pada medium kultur.
SUMMARY
ARAS PRASETIYO NUGROHO. Effectiveness Glutathione (GSH) Supplementation in fertilization and culture medium on Early Bovine Embryonic Development Rate. Supervised by MOHAMAD AGUS SETIADI and IMAN SUPRIATNA.
In vitro embryo production of bovine is still face obstacle which marked which resulting low blastocyst rate. Most of oocyte can’t reached blastosist because high oxygen concentration. This condition cause metabolism produce more reactive oxygen species (ROS) such as hydrogen peroxidases (H2O2) which can reacted with metal element (Fe2+ or Cu+) become free radical hydroxil (OH•−). Free radical OH•− is verry dangerous because it can destroye membrane with compose peroxidation lipid (L-OOH) which influance physiology function. Naturally, oocyte produce glutathione (GSH) which can reduce H2O2 before reacted with metal element. Synthesis of GSH dependent on cummulus cell which transfer cysteine through gap junction partly GSH precursor. At oocyte reach nuclear maturation, gap junction has disconnected by hyaluronidase enzyme caused cysteine suplay to oocyte was stopped make synthesis of GSH also stopped. Concentration of GSH which used to pronucleus and blastosist formation.
The objective of this study was to determine fertilization rate effectiveness and early embryonic development competency with glutathione (GSH) supplementation in fertilization medium and culture. In the first experiment, bovine oocytes were matured in tissue culture medium (TCM) 199 at incubator 5% CO2 with temperature 39 ºC for 24 h, then fertilized with sperm separated by swim up technique. Oocyte and sperms were incubated in fertilization medium supplemented with 0.25 mM, 0.50 mM, 1.00 mM GSH. In the second experiment, bovine oocytes were matured in maturation medium and fertilized with same procedure as mentioned before, then cultured in modified synthetic oviduct fluid (mSOF) with the following treatment: supplementation GSH only in fertilization medium (T1), supplementation GSH only in culture medium (T2), and supplementation GSH in both fertilization and culture medium. While control not supplementation GSH.
Result of the first experiment showed that supplementation 1.00 mM GSH in fertilization medium can increase higher normal pronucleus (2PN) formation (86,9%) compared to other treatments, 0.50 mM (80.3%), 0.25 mM (73.8%), dan control (58.9%) (P<0.05). In the second experiment showed that early bovine embryonic development on 2nd day cultured which reached eight cell on treatment T1 (56.0%) and T3 (53.6%) were higher (P<0.05) compared to treatment T2 (26.2%) and T0 (control) (31.3%). Result of the other were showed that early bovine embryonic development on 4th day cultured which reached 16 cell on treatment T1 (26.2%) and T3 (27.4%) were higher (P<0.05) compared to treatment T2 (11.9%) and T0 (control) (10.8%). In conclusion, 1.00 mM GSH supplementation in fertilization medium was more effective in supporting normal pronucleus formation and early bovine embryonic development compared to in culture medium.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Biologi Reproduksi
EFEKTIVITAS PENAMBAHAN
GLUTATHIONE
(GSH) PADA
MEDIUM FERTILISASI DAN KULTUR TERHADAP
KOMPETENSI PERKEMBANGAN AWAL EMBRIO SAPI
SECARA
IN VITRO
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Solawat dan salam tercurahkan kepada Rasulullah, Muhammad SAW. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Februari 2015 ini ialah Fertilisasi In Vitro, dengan judul Efektivitas Penambahan Glutathione (GSH) pada Medium Fertilisasi dan Kultur terhadap Kompetensi Perkembangan Awal Embrio Sapi secara In Vitro.
Terima kasih dan penghargaan yang setinggi-tingginya penulis sampaikan kepada Prof Dr drh Mohamad Agus Setiadi dan Prof Dr drh Iman Supriatna, selaku pembimbing yang dengan penuh ketulusan memberikan bimbingan, arahan, dan juga masukan mulai dari perancangan dan pelaksanaan penelitian hingga penulisan tesis. Terima masih juga penulis sampaikan kepada Drh Ni Wayan Kurniani Karja, MP, PhD, selaku penguji luar komisi, atas segala kritik dan saran sehingga dapat lebih memperkaya dan menyempurnakan tulisan ini.
Pada kesempatan ini penulis juga sampaikan terima kasih kepada Rektor, Dekan Pascasarjana, Dekan Fakultas Kedokteran Hewan, Ketua Departemen Klinik Reproduksi dan Patologi, Ketua Program Studi, Staf Pengajar dan Administrasi Biologi Reproduksi, serta seluruh Staf Pascasarjana IPB yang telah menerima penulis untuk melanjutkan studi di IPB dan membantu kelancaran proses penyelesaian studi. Penulis juga menyampaikan terima kasih kepada Direktorat Jenderal Perguruan Tinggi yang telah medukung studi dan penelitian melalui beasiswa program pascasarjana dalam negeri (BPPDN) 2013.
Penulis sampaikan terima kasih kepada Prof Ir Dadang Mulyadi Saleh, MS, MAgrSc, PhD, Ir Sugiatno, SU, dan Dr Ir C Rahmawati WS, SU, MAgrSc yang telah memberi rekomendasi untuk melanjutkan studi di IPB. Penulis juga mengucapkan terima kasih kepada Drh Zultinur Muttaqin, MSi, Cut Yasmin, SSi, MSi, Pratiwi, SPt, MSi, Reski Adelia, SPd, MSi, Anita Hafid, SPd, MSi,
Nur’aisyah Amrah Safitri, SPt, MSi, Masturi Muhajir, SPt, Ummul Masir, SPt,
dan rekan-rekan mahasiswa program studi Biologi Reproduksi serta berbagai pihak yang namanya tidak dapat disebutkan satu persatu, atas segala bantuan tenaga dan pikiran yang diberikan selama penelitian dan penulisan tesis. Secara khusus penulis sampaikan terima kasih kepada Kartika Ratnaningtyas, STP sebagai sahabat yang selalu memberi motivasi dan kasih sayang sehingga penulis dapat menyelesaikan karya ini.
Ungkapan terima kasih, rasa cinta, dan sayang yang sedalam-dalamnya juga penulis sampaikan kepada Ayahanda Drs Teguh Budi Sarjono dan Ibunda Erni Astuti, serta kedua adik yaitu Agita Rakhmawati dan Annas Habib Fauzan, serta seluruh keluarga yang selalu mencurahkan cinta kasih, doa, bimbingan, motivasi, dan perhatian yang tulus, serta dukungan moril dan materi kepada penulis selama ini sehingga dapat menyelesaikan karya ini.
Semoga karya ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Kerangka Pemikiran 2
Tujuan Penelitian 2
Manfaat Penelitian 2
Hipotesis 2
2 TINJAUAN PUSTAKA 2
Koleksi dan Pematangan In Vitro 2
Fertilisasi In Vitro 3
Kultur In Vitro 5
Reactive Oxygen Species (ROS) 6
Glutathione (GSH) 7
3 BAHAN DAN METODE 7 Tempat dan Waktu Penelitian 7 Metode Penelitian 8 Rancangan Penelitian 9 Analisis Data 10
4 HASIL DAN PEMBAHASAN 10
Kemampuan Fertilisasi In Vitro setelah Penambahan GSH 10 Kompetensi Perkembangan Awal Embrio Sapi setelah Penambahan GSH 11
5 SIMPULAN DAN SARAN 15
Simpulan 15
Saran 15
DAFTAR PUSTAKA 15
LAMPIRAN 16
DAFTAR TABEL
1 Kemampuan fertilisasi in vitro setelah penambahan GSH 11 2 Kompetensi perkembangan awal embrio sapi setelah penambahan 1.00
mM GSH 13
DAFTAR GAMBAR
1 Pematangan inti oosit 3
2 Aktivasi oosit oleh spermatozoa pada proses fertilisasi 4 3 Struktur zona pelusida (ZP) sebelum dan setelah fertilisasi 5 4 Pengaktivan genom embrio pada perkembangan awal embrio sapi 6 5 Pembentukan reactive oxygen species (ROS) di dalam mitokondria 6
6 Sintesis GSH di dalam sitosol 7
7 Perkembangan pronukleus (PN) setelah proses fertilisasi in vitro 11 8 Perkembangan awal embrio sapi setelah empat hari kultur 12
DAFTAR LAMPIRAN
1 Komposisi medium transportasi ovarium 21
2 Komposisi medium dulbecco phosphate buffered saline (DPBS) 21
3 Komposisi medium koleksi oosit 21
4 Komposisi medium pematangan in vitro 21
5 Komposisi medium tyrode-albumin-lactate-pyruvate (TALP) 22
6 Komposisi medium fertilisasi in vitro 22
7 Komposisi medium kultur modified synthetic oviduct fluid (mSOF) 22
1
1
PENDAHULUAN
Latar Belakang
Produksi embrio in vitro sapi masih mengalami kendala yang ditandai dengan rendahnya capaian tingkat blastosis yaitu sebesar 41.0% (Hara et al. 2013), 42.4% (Costa et al. 2013), dan 40.5% (Park et al. 2014). Hal tersebut dapat terjadi karena produksi embrio in vitro umumnya dilakukan pada lingkungan yang mempunyai kadar oksigen (O2) hampir sama dengan yang ada diatmosfer (~20%) (Karja et al. 2004; Yasmin et al. 2015), jauh lebih besar dari keadaan in vivo yang hanya berkisar 5% (Hashimoto et al. 2000). Kondisi ini menyebabkan proses metabolisme menghasilkan lebih banyak reactive oxygen species (ROS) seperti hidrogen peroksida (H2O2) yang dapat bereaksi dengan unsur logam (Fe2+ atau Cu+) menjadi radikal bebas berupa ion hidroksil (OH•−). Radikal bebas OH•− sangat berbahaya karena dapat merusak membran dengan membentuk lipid peroksida (L-OOH) sehingga dapat mengganggu fungsi fisiologis (Jezek dan Hlavata 2005). Secara alami oosit menghasilkan glutathione (GSH) yang dapat mereduksi H2O2 sebelum sempat bereaksi dengan unsur logam (Park et al. 2014).
Pada proses pematangan oosit, sintesis GSH tergantung pada ketersediaan cysteine yang sangat mudah teroksidasi menjadi cystine pada lingkungan ekstraselulernya (Lu 2013). Sel kumulus berperan sangat penting dalam mereduksi cystine menjadi cysteine (Geshi et al. 2000) dan kemudian ditransfer melalui gap junction sebagai prekusor GSH (Zhou et al. 2010). Konsentrasi GSH oosit yang tertinggi dapat dicapai pada saat kematangan inti (De Matos dan Furnus 2000). Hal tersebut terjadi bersamaan dengan terputusnya gap junction oleh enzim hyaluronidase yang disekresikan sel kumulus itu sendiri sehingga menyebabkan cysteine tidak dapat lagi ditranfer melalui gap junction ke dalam oosit (Sutton et al. 2003). Oleh sebab itu konsentrasi GSH yang dicapai selama pematangan sering dijadikan sebagai indikator kematangan oosit (You et al. 2010). Konsentrasi GSH inilah yang dipakai oleh oosit untuk mencukupi kebutuhan dalam tahapan produksi embrio in vitro selanjutnya. Apabila konsentrasi GSH yang dicapai selama pematangan tidak optimal, maka akan menyebabkan akumulasi ROS (Agarwal et al. 2005). Akumulasi ROS merupakan penyebab stres oksidasi yang berakibat terjadinya oosit aging (Lord dan Aitken 2013) dan apoptosis (Gupta et al. 2009) sehingga banyak oosit yang gagal dalam perkembangan awal embrio.
2
pengaruh penambahan GSH pada medium fertilisasi dan kultur terhadap kompetensi perkembangan awal embrio.
Kerangka Pemikiran
Sintesis GSH selama proses pematangan in vitro diregulasikan oleh sel kumulus dengan mentransfer cysteine melalui gap junction sebagai prekusor GSH. Pada saat oosit mencapai kematangan inti, gap junction terputus oleh adanya enzim hyaluronidase sehingga suplai cysteine ke dalam oosit terhenti akibatnya sintesis GSH juga terhenti. Konsentrasi GSH inilah yang digunakan dalam pembentukan pronukleus dan blastosis. Tampaknya capaian konsentrasi GSH selama pematangan in vitro belum mampu mencukupi kebutuhan dalam mendukung perkembangan awal embrio. Oleh karena itu penambahan GSH pada medium fertilisasi dan kultur diharapkan dapat memenuhi kebutuhan tersebut, sehingga akan meningkatkan jumlah oosit yang terfertilisasi normal dan mampu berkembang lebih baik.
Tujuan Penelitian
Mengetahui tingkat fertilisasi dan kompetensi perkembangan awal embrio sapi dengan penambahan GSH pada medium fertilisasi dan kultur.
Manfaat Penelitian
Memperoleh tingkat fertilisasi dan kompetensi perkembangan awal embrio sapi secara in vitro yang lebih baik.
Hipotesis
Penambahan GSH pada medium fertilisasi dan kultur dapat meningkatkan kompetensi perkembangan awal embrio sapi secara in vitro.
2
TINJAUAN PUSTAKA
Koleksi dan Pematangan In Vitro
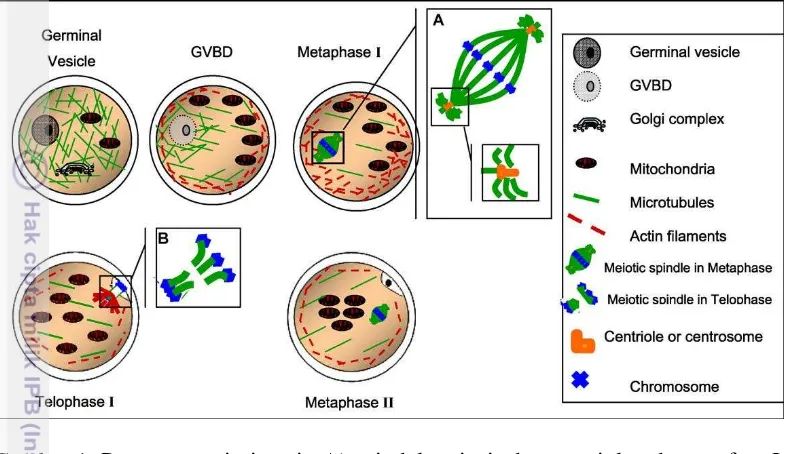
3 tahap germinal vesicle (GV) dan untuk dapat dilakukan tahap fertilisasi sampai pada akhirnya berkembang menjadi embrio, maka oosit harus mampu mencapai kematangan inti yaitu metafase II (MII) (Gordon 2003). Tahapan pematangan inti oosit dapat dilihat pada Gambar 1.
Gambar 1. Pematangan inti oosit. A) spindel meiosis dan sentriol pada metafase I. B) spindel meiosis pada telofase I (Ferreira et al. 2009).
Pematangan oosit sapi dilakukan selama 24 jam yang dapat dibagi menjadi dua fase yaitu fase induksi dan fase sintesis. Pada fase induksi puncaknya terjadi perubahan germinal vesicle (GV) ditandai dengan membran inti dan nukleous terlihat jelas dan masih menyatu di dalam vesicle menjadi germinal vesicle breakdown (GVBD) yang ditandai dengan pecahnya membran inti dan inti terlihat menyebar pada jam ke-6 pematangan oosit. Selama fase ini, oosit menjalani pemrograman kembali unsur-unsur di dalam sel oosit. Fase sintesis selama 18 jam terjadi penyusunan secara total inti dan unsur yang terdapat dalam sitoplasma. Fase ini dimulai dengan dalam tahap metafase I (MI) yang ditandai adanya kromosom homolog yang berderet dibidang ekuator terjadi pada jam ke-18 pematangan oosit. Selanjutnya tahap anafase-telofase (A/T) yang ditandai dengan terbentuknya benang-benang spindel yang menghubungkan dua kelompok kromosom yang sedang atau sudah menuju kutubnya masing-masing terjadi pada jam ke-21 pematangan oosit. Selanjutnya tahap metafase (MII) yang ditandai dengan adanya badan polar I dan susunan kromoson yang sama dengan MI terjadi pada jam ke-24 pematangan oosit (Gordon 2003).
Fetilisasi In Vitro
Oosit yang telah mencapai tahap pematangan inti difertilisasi dengan spermatozoa. Proses fertilisasi yang pertama merupakan fusi antara oosit dan spermatozoa. Pada proses fusi terjadi ikatan antara ligan spermatozoa yaitu fertilin
dengan reseptor spermatozoa (SR) yang terdiri dari CD9 dan Integrin α6 1
4
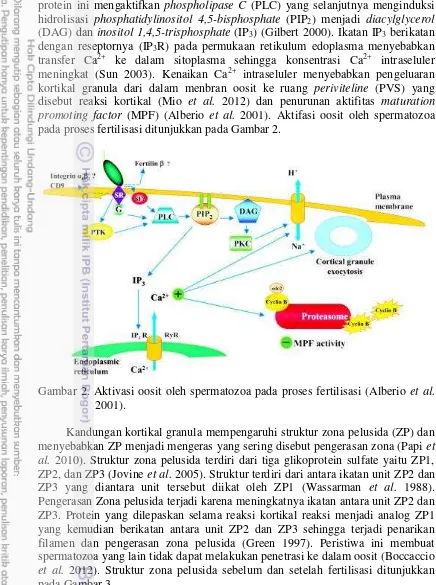
protein ini mengaktifkan phospholipase C (PLC) yang selanjutnya menginduksi hidrolisasi phosphatidylinositol 4,5-bisphosphate (PIP2) menjadi diacylglycerol (DAG) dan inositol 1,4,5-trisphosphate (IP3) (Gilbert 2000). Ikatan IP3 berikatan dengan reseptornya (IP3R) pada permukaan retikulum edoplasma menyebabkan transfer Ca2+ ke dalam sitoplasma sehingga konsentrasi Ca2+ intraseluler meningkat (Sun 2003). Kenaikan Ca2+ intraseluler menyebabkan pengeluaran kortikal granula dari dalam menbran oosit ke ruang periviteline (PVS) yang disebut reaksi kortikal (Mio et al. 2012) dan penurunan aktifitas maturation promoting factor (MPF) (Alberio et al. 2001). Aktifasi oosit oleh spermatozoa pada proses fertilisasi ditunjukkan pada Gambar 2.
Gambar 2. Aktivasi oosit oleh spermatozoa pada proses fertilisasi (Alberio et al. 2001).
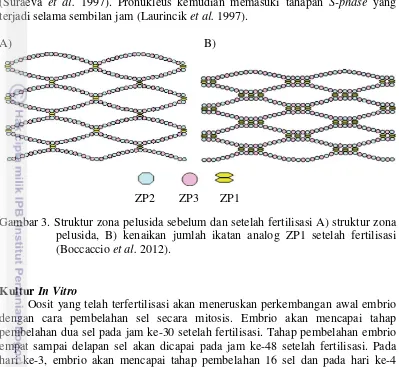
Kandungan kortikal granula mempengaruhi struktur zona pelusida (ZP) dan menyebabkan ZP menjadi mengeras yang sering disebut pengerasan zona (Papi et al. 2010). Struktur zona pelusida terdiri dari tiga glikoprotein sulfate yaitu ZP1, ZP2, dan ZP3 (Jovine et al. 2005). Struktur terdiri dari antara ikatan unit ZP2 dan ZP3 yang diantara unit tersebut diikat oleh ZP1 (Wassarman et al. 1988). Pengerasan Zona pelusida terjadi karena meningkatnya ikatan antara unit ZP2 dan ZP3. Protein yang dilepaskan selama reaksi kortikal reaksi menjadi analog ZP1 yang kemudian berikatan antara unit ZP2 dan ZP3 sehingga terjadi penarikan filamen dan pengerasan zona pelusida (Green 1997). Peristiwa ini membuat spermatozoa yang lain tidak dapat melakukan penetrasi ke dalam oosit (Boccaccio et al. 2012). Struktur zona pelusida sebelum dan setelah fertilisasi ditunjukkan pada Gambar 3.
5
ZP2 ZP3 ZP1
pronukleus. Dekondensasi kepala spermatozoa menjadi pronukleus terjadi pada jam ke-8 setelah fertilisasi. Migrasi pronukleus terjadi jam ke-10 setelah fertilisasi. Penempatan pronukleus terjadi pada jam ke-12 setelah fertilisasi (Laurincik et al. 1994). Pronukleus yang maksimal ditemukan pada jam ke-14 setelah fertilisasi (Suraeva et al. 1997). Pronukleus kemudian memasuki tahapan S-phase yang terjadi selama sembilan jam (Laurincik et al. 1997).
A) B)
Gambar 3. Struktur zona pelusida sebelum dan setelah fertilisasi A) struktur zona pelusida, B) kenaikan jumlah ikatan analog ZP1 setelah fertilisasi (Boccaccio et al. 2012).
Kultur In Vitro
6
Gambar 4. Pengaktivan genom embrio pada perkembangan awal embrio sapi (Graf et al. 2014).
Reactive Oxygen Species (ROS)
Mitokondria merupakan penghasil reactive oxygen species (ROS) terbesar di dalam sel. Asal mula terjadinya ROS dimulai dari transfer elektron (e−) kepada molekul oksigen (O2) menjadi radikal superoxide (O2•−) pada komplek I dan komplek III mitokondria (Muller et al. 2004). Pada komplek I, O2•− dihasilkan akibat kebocoran e− dari senyawa besi-sulfur dan reserve electron transfer (RET). Pada komplek III, O2•− dihasilkan oleh O2 pada membran lipid bilayer yang direduksi ubiquinol bermuatan negatif (UQ•−) (Jezek dan Hlavata 2005). Apabila akumulasi O2•−berlebihan, maka akan dikeluarkan dari mitikondria melalui inner membrane anion channel (IMAC) ke ruang intermembran (Cortassa et al. 2004). Sebagian dikeluarkan dari mitokondria melalui voltage-dependent anion channels (VDAC) (Sena dan Chandel 2012) dan sisanya direduksi oleh enzim superoxide dismutases (SOD) menjadi hidrogen peroksida (H2O2) (Fukai dan Ushio-Fukai 2011). Selain itu, Monoaminoxidase (MAO) pada membran mitokondria luar yang berfungsi mengoksidasi gugus amine menghasilkan H2O2 48 kali lebih banyak daripada komplek III (Zorov et al. 2014). Selanjutnya H2O2 dapat bereaksi dengan adanya transisi reduksi unsur logam (Fe2+ atau Cu+) yang menyebabkan perubahan bentuk H2O2 menjadi radikal bebas berupa ion hidroksil OH•− melalui rekasi fenton. Ion OH•− merupakan radikal yang paling reaktif dengan half-life ~ 10-9 S (Pastor et al. 2000). Pembentukan reactive oxygen species (ROS) di dalam mitokondria ditunjukkan pada Gambar 5.
7
Glutathione (GSH)
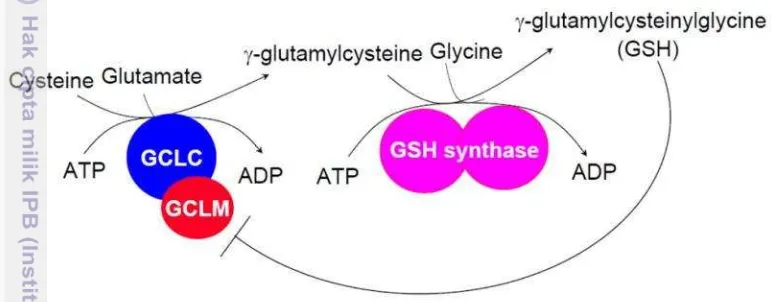
Glutathione (GSH) (C10H17N3O6S) merupakan senyawa thiol tripeptida ( -Glu-Cys-Gly) yang dapat mempengaruhi metabolisme sel (De Matos dan Furnus 2000). Sintesis GSH terjadi di dalam sitosol dengan prekusor berupa cysteine, glutamate, dan glysine (Chakravarthi et al. 2006). Prekusor cysteine berasal cystine yang tereduksi (Geshi et al. 2000). Selanjutnya, cysteine dan glutamate bergabung menjadi -glutamylcysteine dengan dikatalisasi oleh enzim glutamate-cysteine ligase (GCL) yang terdiri dari bagian katalik (GCLC) dan subunit (GCLM) , selanjutnya bergabung dengan glycine dengan dikatalisasi oleh enzim GSH-synthetase menjadi GSH (Lu 2013). Sintesis GSH di dalam sitosol ditunjukkan pada Gambar 6.
Gambar 6. Sintesis GSH di dalam sitosol (Lu 2013).
Penelitian mengenai penambahan GSH pada medium fertilisasi telah dilakukan diantaranya oleh Urdaneta et al. (2004) yang melaporkan penambahan 1.00 mM GSH dalam medium fertilisasi meningkatkan persentase blastosis oosit kambing dari 10.61% menjadi 30.20%. Selanjutnya Boquest et al. (1999) melakukan penambahan GSH ke dalam medium fertilisasi oosit babi dengan kosnentrasi 0, 0.125, dan 0.250 mM menghasilkan persentase blastosis 19%, 36%, dan 34%. Selanjutnya Li et al. (2014) melakukan penelitian pada oosit babi dengan penambahan 1.00 mM GSH pada medium pematangan dan kultur yang diinseminasi menggunakan intracytopasmic sprem injection (ICSI) meningkatkan angka pembelahan dan blastosis yaitu 74.4% menjadi 79.6% dan 15.9% menjadi 20.9%.
3
BAHAN DAN METODE
Tempat dan Waktu Penelitian
8
Metode Penelitian
Penelitian I. Kemampuan Fertiliasi In Vitro setelah Penambahan GSH. a. Koleksi dan Seleksi Oosit
Ovarium didapatkan dari rumah pemotongan hewan (RPH), dibawa ke laboratorium dalam NaCl 0,9% yang ditambahkan 100 IU/mL penicillin (Sigma, P-4687) dan 0.1 mg/mL streptomycin (Sigma, S-9137) dengan temperatur 27 ºC. Oosit dikoleksi dari folikel dengan teknik penyayatan folikel (slicing) pada cawan petri menggunakan scalpel ukuran 23. Folikel yang telah di-slicing dibilas dengan dulbecco phosphat buffered saline (DPBS) yang ditambahkan 5% fetal bovine serum (FBS) (Sigma, F-7524), 100 IU/mL penicillin, dan 0.1 mg/mL streptomycin. Oosit dikoleksi pada petri dish yang berisi 2 mL DPBS yang ditambahkan 10% FBS, 100 IU/mL penicillin, dan 0.1 mg/mL streptomycin di bawah mikroskop stereo. Oosit yang digunakan dalam penelitian ini yaitu oosit yang mempunyai sel kumulus yang kompak dengan lebih dari tiga lapis dan sitoplasma homogen.
b. Pematangan In Vitro
Oosit yang sudah dikoleksi dicuci 3 kali pada medium pematangan tissue culture medium (TCM) 199 (Gibco) yang ditambahkan 10% FBS, 10 IU/mL pregnant mare serum gonadotrophin (PMSG) (Kyoritsu Seiyaku, Japan), 10 IU/mL humman choirionic gonadotrophin (hCG) (Kyoritsu Seiyaku, Japan), dan 50 µg/mL gentamycin (Sigma, P-4687). Oosit sebanyak 10 sampai 15 kemudian ditempatkan pada medium pematangan berbentuk drop 100 µL di bawah mineral oil (Sigma, M-8410). Oosit dimatangkan pada inkubator 5% CO2 dengan temperatur 39 ºC selama 24 jam.
c. Fertilisasi In Vitro
Semen beku di-thawing dalam waterbath dengan temperatur 37 ºC selama 25 detik. Semen ditempatkan di dasar medium tyrode-albumin-lactate-pyruvate (TALP) untuk memberi kesempatan kepada spermatozoa yang motil berenang ke atas (swim up) pada inkubator 5% CO2 dengan temperatur 39 ºC selama satu jam. Sebagian supernatan diambil untuk disentrifugasi menggunakan kecepatan 702 g dengan temperatur 28 ºC selama delapan menit. Pelet hasil sentrifugasi disisakan sebanyak 200 µL, kemudian dihitung konsentrasinya dan diencerkan dengan konsentrasi akhir 2 x 106 spermatozoa/mL medium fertilisasi (Suzuki et al. 2000) yang telah diberi perlakuan penambahan GSH (Sigma, G-4251) dengan konsentrasi 0.25 mM, 0.50 mM, dan 1.00 mM. Oosit yang telah mengalami proses pematangan sebanyak 10 sampai 15 ditempatkan pada medium fertilisasi yang mengandung spermatozoa berbentuk drop 100 µL di bawah mineral oil. Oosit difertilisasi pada inkubator 5% CO2 dengan temperatur 39 ºC selama 14 jam.
d. Evaluasi Tingkat Fertilisasi In Vitro
9 perbandingan antara jumlah oosit yang terfertilisasi oleh satu spermatozoa dengan jumlah keseluruhan oosit yang difertilisasi. Persentasi polispermi merupakan perbandingan jumlah oosit yang terfertilisasi lebih dari satu spermatozoa dengan jumlah keseluruan oosit yang difertilisasi. Persentase total terfertilisasi merupakan perbandingan antara jumlah oosit yang terfertilisasi normal dan polispermi dengan jumlah keseluruan oosit yang difertilisasi.
Penelitian II. Kompetensi Perkembangan Awal Embrio Sapi setelah Penambahan GSH
a. Persiapan Kultur In Vitro
Oosit dikoleksi dan dimatangkan pada inkubator 5% CO2 dengan temperatur 39 ºC selama 24 jam seperti penelitian I.
b. Kultur In Vitro
Oosit yang telah mengalami proses pematangan kemudian difertilisasi pada medium fertilisasi dengan penambahan atau tanpa penambahan GSH. Oosit yang terfertilisasi kemudian didenudasi sel-sel kumulusnya dan dicuci sebanyak 3 kali pada medium kultur modified synthetic oviduct fluid (mSOF) yang ditambahkan 2% basal medium eagle (BME) (Sigma, B-6766), 1% minimum essential medium (MEM) (Sigma, M-7145), 0.3% bovine serum albumin (BSA) (Sigma, A-7030), dan 50 µg/mL gentamicyn (Gordon 2003). Oosit yang terfertilisasi sebanyak 10 sampai 15 ditempatkan pada medium kultur dengan penambahan atau tanpa penambahan GSH berbentuk drop 100 µL di bawah mineral oil. Oosit yang terfertilisasi dikultur pada inkubator 5% CO2 dengan temperatur 39 ºC selama 96 jam. Pembaharuan medium kultur dilakukan setelah 48 jam kultur. Konsentrasi GSH yang ditambahkan pada medium fertilisasi dan kultur pada penelitian II merupakan kosentrasi GSH yang terbaik pada penelitian I.
c. Evaluasi Tingkat Perkembangan Awal Embrio Sapi
Perkembangan awal embrio sapi diamati selama empat hari dengan mencatat kecepatan pembelahan setiap perlakuan pada hari ke-2 dan hari ke-4 kultur di bawah mikroskop (Olympus IX 70, Japan). Pembuatan preparat dan pewarnaan seperti pada penelitian I dilakukan untuk peneguhan hasil pengamatan dengan menghitung jumlah sel yang terbentuk. Persentase tingkat pembelahan merupakan perbandingan antara jumlah oosit yang membelah dengan jumlah keseluruhan oosit yang dikultur.
Rancangan Penelitian
10
medium fertilisasi dan kultur (T3). Sementara kontrol (T0) tidak diberi perlakuan penambahan GSH.
Analisis Data
Data diperoleh dalam bentuk persentase dan ditransfer ke dalam bentuk
arc.sin√%. Tingkat fertilisasi dan perkembangan awal embrio sapi secara in vitro
dianalisis dengan analysis of variance (ANOVA) pada taraf nyata 95%, apabila terdapat perbedaan yang nyata dilanjutkan dengan Duncant New Multiple Range Test (DMRT) (Steel dan Torrie 1993).
4
HASIL DAN PEMBAHASAN
Kemampuan Fertilisasi In Vitro setelah Penambahan GSH
11 Perkembangan pronukleus (PN) setelah fertilisasi in vitro ditunjukkan pada Gambar 7.
Gambar 7. Perkembangan pronukleus (PN) setelah proses fertilisasi in vitro. A. satu pronukleus (1PN), B. dua pronukleus (2PN), C. lebih dari dua pronukleus (>2PN) (perbesaran 200X, fase kontras, Olympus IX 70). Tabel 1. Kemampuan fertilisasi in vitro setelah penambahan GSH.
Perlakuan
(mM) n
Total Terfertilisasi
n(%±SD)
Fertilisasi n(%±SD) Normal (2PN) Polispermi (>2PN) Kontrol 73 45 (61.6±4.5)a 43 (58.9±3.9)a 2 (2.7±4.1) 0.25 84 64 (76.2±4.3)b 62 (73.8±5.6)b 2 (2.4±3.6) 0.50 76 63 (82.9±3.1)b 61 (80.3±4.2)c 2 (2.6±3.4) 1.00 84 78 (92.9±4.2)c 73 (86.9±4.5)d 5 (6.0±3.1) Keterangan:
n: Jumlah oosit
a,b,c,d superskrip yang berbeda pada kolom yang sama menunjukkan perbedaan yang signifikan (P<0.05).
Hasil penelitian menunjukkan peningkatan oosit yang terfertilisasi normal pada medium fertilisasi yang ditambahkan GSH dengan konsentrasi 0.25 mM, 0.50 mM, dan 1.00 mM berbeda antar perlakuan (P<0.05) yaitu 73.8%, 80.3%, dan 86.9% (Tabel 1). Data penelitian ini menunjukkan bahwa konsentrasi 1.00 mM GSH yang ditambahkan pada medium fertilisasi menghasilkan tingkat fertilisasi yang terbaik. Data pada penelitian ini mendukung hasil penelitian sebelumnya yang dilaporkan oleh Ishizuka et al. (2013). Hal ini mengindikasikan bahwa penambahan GSH dengan konsentrasi 1.00 mM lebih mencukupi kebutuhan oosit daripada penambahan dengan konsentrasi GSH yang lebih rendah selama fertilisasi.
Kompetensi Perkembangan Awal Embrio Sapi setelah Penambahan GSH
12
embrio yang sangat penting untuk menentukan potensi embrio untuk berkembang menjadi blastosis (Lonergan et al. 2000). Selain itu, embrio yang mempunyai kompetensi mencapai tahap blastosis dapat dinilai sejak dini dengan melihat kecepatan pembelahannya (Lequaere et al. 2003), terutama ketika embrio mencapai tahap pembelahan 16 sel karena telah melewati periode transisi genom maternal ke genom embrio (Graf et al. 2014). Lebih lanjut dilaporkan oleh Lim et al. (1996) bahwa selama periode transisi tersebut terjadi penurunan konsentrasi GSH. Hal tersebut dikhawatirkan menyebabkan ROS tidak dapat dinetralisir dengan baik sehingga mengganggu perkembangan awal embrio (Park et al. 2014). Oleh karena itu, dalam penelitian kedua dilakukan perlakuan kombinasi penambahan GSH pada medium fertilisasi dan kultur untuk mengetahui pengaruhnya terhadap perkembangan awal embrio. Perkembangan awal embrio sapi ditunjukkan pada Gambar 8.
Gambar 8. Perkembangan awal embrio sapi selama empat hari kultur. A. dua sel, B. empat sel, C. delapan sel, D. 16 sel, E. 32 sel (perbesaran 200X, Olympus IX 70).
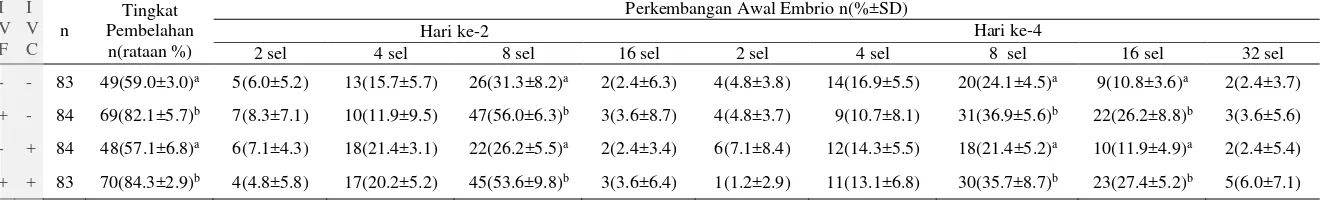
Hasil penelitian menunjukkan tingkat pembelahan perlakuan penambahan GSH hanya pada medium fertilisasi (T1) sebesar 82.1% dan perlakuan kombinasi penambahan GSH pada medium fertilisasi dan kultur (T3) sebesar 84.3% lebih tinggi (P<0.05) daripada kontrol (T0) sebesar 59.0%. Sedangkan tingkat pembelahan perlakuan penambahan GSH hanya pada medium kultur (T2) sebesar 57.1% tidak berbeda (P>0.05) jika dibandingkan dengan kontrol (T0) (Tabel 2). Hasil ini menunjukkan penambahan GSH pada medium kultur tidak meningkatkan oosit yang membelah. Banyaknya oosit yang membelah lebih dipengaruhi oleh banyaknya pronukleus normal yang terbentuk akibat penambahan GSH pada medium fertilisasi. Hal ini diduga penambahan GSH pada medium kultur tidak dapat masuk melalui membran yang telah mengalami pengerasan zona pelusida pada saat proses fertilisasi. Penyataan ini didukung oleh Boccaccio et al. (2012) bahwa pada proses pengerasan zona pelusida terjadi peningkatan resistensi terhadap agen pereduksi seperti GSH.
13
Tabel 2. Kompetensi perkembangan awal embrio sapi setelah penambahan 1.00 mM GSH.
Keterangan:
n: Jumlah oosit atau embrio
IVF: medium fertilisasi, IVC: medium kultur
T0: kontrol, T1: penambahan GSH hanya pada medium fertilisasi, T2: penambahan GSH hanya pada medium kultur, T3: kombinasi penambahan GSH pada medium fertilisasi dan kultur.
a,b Superskrip yang berbeda pada kolom yang sama menunjukkan perbedaan yang signifikan (P<0.05). Perla-
Kuan I V F
I V C
n
Tingkat Pembelahan
n(rataan %)
Perkembangan Awal Embrio n(%±SD)
Hari ke-2 Hari ke-4
2 sel 4 sel 8 sel 16 sel 2 sel 4 sel 8 sel 16 sel 32 sel
T0 - - 83 49(59.0±3.0)a 5(6.0±5.2) 13(15.7±5.7) 26(31.3±8.2)a 2(2.4±6.3) 4(4.8±3.8) 14(16.9±5.5) 20(24.1±4.5)a 9(10.8±3.6)a 2(2.4±3.7)
T1 + - 84 69(82.1±5.7)b 7(8.3±7.1) 10(11.9±9.5) 47(56.0±6.3)b 3(3.6±8.7) 4(4.8±3.7) 9(10.7±8.1) 31(36.9±5.6)b 22(26.2±8.8)b 3(3.6±5.6)
T2 - + 84 48(57.1±6.8)a 6(7.1±4.3) 18(21.4±3.1) 22(26.2±5.5)a 2(2.4±3.4) 6(7.1±8.4) 12(14.3±5.5) 18(21.4±5.2)a 10(11.9±4.9)a 2(2.4±5.4)
14
Hasil penelitian hari ke-2 kultur menunjukkan perkembangan awal embrio sapi delapan sel pada perlakuan penambahan GSH hanya pada medium fertilisasi (T1) sebesar 56.0% dan perlakuan kombinasi penambahan GSH pada medium fertilisasi dan kultur (T3) sebesar 53.6% lebih tinggi (P<0,05) daripada perlakuan penambahan GSH hanya pada medium kultur (T2) sebesar 26.2% dan kontrol (T0) sebesar 32.3%. Hasil penelitian selanjutnya pada hari ke-4 kultur yang menunjukkan perkembangan awal embrio 16 sel pada perlakuan penambahan GSH hanya pada medium fertilisasi (T1) sebesar 26.2% dan perlakuan kombinasi penambahan GSH pada medium fertilisasi dan kultur (T3) sebesar 27.4% lebih tinggi (P<0.05) daripada perlakuan penambahan GSH hanya pada medium kultur (T2) sebesar 11.9% dan kontrol (T0) sebesar 10.8% (Tabel 2). Hasil ini mengindikasikan bahwa penambahan GSH pada medium fertilisasi lebih efektif dalam mendukung perkembangan awal embrio daripada penambahan GSH pada medium kultur sehingga lebih berkompetensi untuk mencapai tahap blastosis. Menurut Asgari et al. (2012) bahwa embrio yang memiliki kompetensi menjadi blastosis akan mencapai pembelahan delapan sel pada hari ke-2 kultur dan pembelahan 16 sel sampai morula awal pada hari ke-4 kultur. Hal ini dapat dijelaskan karena pada perkembangan awal embrio delapan sampai 16 sel terjadi peningkatan sintesis GSH sejalan dengan pengaktifan genom embrio (Lim et al. 1996). Peningkatan GSH berperan sangat penting selama perkembangan awal embrio dalam menetralisir ROS (Sun et al. 2015) dan proliferasi (Lu 2013).
15
5
SIMPULAN DAN SARAN
Simpulan
Berdasarkan hasil penelitian dapat disimpulkan bahwa penambahan 1.00 mM GSH pada medium fertilisasi lebih efektif dalam mendukung pembentukan pronukleus normal dan perkembangan awal embrio sapi secara in vitro dibandingkan pada medium kultur.
Saran
16
DAFTAR PUSTAKA
Agarwal A, Gupta S, Sharma R. 2005. Oxidative stress and its implications in female infertility-a clinician’s perspective. Rep Bio Med. 11:641-650. Alberio R, Zakhartchenko V, Motlik J, dan Wolf E. 2001. Mammalian oocyte
activation: Lessons from the sperm and implications for nuclear transfer. Int J Dev Biol. 45:797-809.
Asgari V, Hosseini SM, Forouzanfar M, Hajian M, Nasr-Esfahani MH. 2012. Vitrification of in vitro produced bovine embryos: effect of embryonic block and developmental kinetics. Cryobiology. 65:278-283.
Boccaccio A, Frassanito MC, Lamberti L, Brunelli R, Maulucci G, Monaci M, Papi M, Pappalettere C, Parasassi T, Sylla L, Ursini F, De Spirito M. 2012. Nanoscale characterization of the biomechanical hardening of bovine zona pellucida. Roy Soc Inter. 1:1-12.
Boquest AC, Abeydeera LR, Wang WH, Day BN. 1999. Effect of adding reduced glutathione during insemination on the development of procine embryos in vitro. Theriogenology. 51:1311-1319.
Chakravarthi S, Jessop CE, Bulleid NJ. 2006. The role of glutathione in disulphide bond formation and endoplasmic-reticulum-generated oxidative stress. Embo Rep. 7(3):271-275.
Cortassa S, Aon MA, Winslow RL, O’rourke B. β004. A mitochondrial oscillator dependent on reactive oxygen species. Biophysical. 87:2060-2073.
Costa NN, Cordeiro MS, Silva TVG, Sastre D, Santana PPB, Sa ALA, Sampaio RV, Santos SSD, Adona PR, Miranda MS, Ohashi OM. 2013. Effect of triiodothyronine on developmental competence of bovine oocytes. Theriogenology. 30:1-7.
De Matos DG, Furnus CC, Moses DF, Baldassarre H. 1995. Effect of cysteamine on glutathione level and develomental capacity of bovine oocyte matured in vitro. Mol Reprod Dev. 42:432-436.
De Matos DG, Furnus CC. 2000. The importance of having high glutathione (GSH) level after bovine in vitro maturation on embryo development: effect of beta-mercaptoethanol, cysteine, and cystine. Theriogenology. 53:761-771. Febretrisiana A, Setiadi MA, Karja NWK. 2015. Nuclear maturation rate of sheep
oocytes in vitro: effect of storage duration and ovary temperature. Indo Trop Anim Agric. 40(2):93-99.
Ferreira EM, Vireque AA, Adona PR, Meirelles FV, Ferriani RA, Navaro PAAS. 2009. Cytoplasmic maturation of bovine oocytes: structural and biochemical modifications and acquisition of developmental campetence. Theriogenology. 71:836-848.
Finkel T. 2011. Signal transduction by reactive oxygen species. Cell Biol. 194(1):7-15.
Fukai T, Ushio-Fukai M. 2011. Superoxide dismutases: role in redox signaling, vascular function, and diseases. Antiox Red Sig. 15:1583-1606.
17 Furnus CC, de Matos DG, Picco S, Garcia PP, Inda AM, Mattioli G, Errecalde AL.
2008. Metabolic requirement associated with GSH synthesis during in vitro maturation of cattle oocytes. Anim Rep Sci. 109:88-99.
Gasparrini B, Sayoud H, Neglia G, de Matos DG, Donay I, Zicarelli L. 2003. Glutathine synthesis during in vitro maturation of buffalo (Bubalus bubalis) oocytes: effect of cysteamine on embryo development. Theriogenology. 60:943-952.
Geshi M, Takenouchi N, Yamauchi N, Nagai T. 2000. Effects of sodium pyruvate in nonserum maturation medium on maturation, fertilization, and subsequent development of bovine oocytes with or without cumulus cells. Biol Reprod. 63:1730-1734.
Gilbert. 2000. Developmental Biology. 6th ed. Sinauer Associates, Inc. Publisher. Sunderland, Massachusetts.
Gordon I. 2003. Laboratory Production of Cattle Embryos. Ed-2. London (GB): CABI Publishing.
Graf A, Krebs S, Heininen-Brown M, Zakhartchenko V, Blum H, Wolf E. 2014. Genom activation in bovine embryos: review of the literature and new insights from RNA sequencing experiments. Anim Reprod Sci. 149:46-58. Green DPL. 1997. Three-dimensional structure of the zona pellucida. Rev Reprod.
2:147-156.
Guerin P, El Mouatassim S, Menezo Y. 2001. Oxidative stress and protection against reactive oxygen species in pre-implantation embryo and its surrounding. Hum Reprod. 7:175-189.
Gupta S, Malhotra N, Sharma D, Chandra A, Agarwal A. 2009. Oxidative stress and its role in female infertility and assisted reproduction: clinical implication. Int J Fertil Steril. 2(4):147-164.
Hara H, Yamane I, Noto I, Kagawa N, Kuwayama M, Hirabayashi M, Hochi S. 2013. Microtubule assembly and in vitro development of bovine oocytes with increased intracellular glutathione level prior to vitrivication and in vitro fertilization. Zygote. 22:476 -482.
Hashimoto S, Minami N, Takakura R, Yamada M, Imai H, Kashima N. 2000. Low oxygen tension during in vitro maturation in beneficial for supporting the subsequent development of bovine cumulus-oocyte complexes. Mol Reprod Dev. 57:353-360.
Ishizuka Y, Nisihimura M, Matsumoto K, Miyashita M, Takeo T, Nakagata N, Hosoi Y, Anzai M. 2013. The influence of GSH in fertilization medium on the fertility of in vitro-mature C57BL/6 mouse oocytes. Theriogenology. 80:421-426.
Jezek P, Hlavata L. 2005. Mitochondia in homeostatis of reactive oxygen species in cell, tissues, and organism. Biochem Cell Biol. 37:2478-2503.
Jovine L, Darie CC, Litscher ES, Wassarman PM. 2005. Zona pellucida domain proteins. Annu Rev Biochem. 74:83-114.
Karja NWK, Wongsrikeao, Murakami M, Agung B, Fahrudin M, Nagai T, Otoi T. 2004. Theriogenology. 62: 1585-1595.
18
Laurincik J, Kopecny V, Hyttel P. 1994. Pronucleus development and DNA synthesis in bovine zygotes in vivo. Theriogenology. 42:1285-1293.
Luarincik J, Hyttel P, Baran V, Lucas-Hahn A, Eckert J, Pivko J, Schmoll F, Schellander. 1997. Pronucleus development and organization of intranuclear bodies during the first bovine embryonic cell cycle in vitro. Theriogenology: 326(Abstract).
Li L, Zheng P, Dean J. 2010. Maternal control of early mouse development. Development. 137:859-870.
Li XX, Lee K, Lee JH, Kim KJ, Kim EY, Han K, Park K, Yu J, and Kim MK. 2014. Glutathione and cysteine enhance porcine preimplantation embryo development in vitro after intracytoplasmic sperm injection. Theriogenology. 81:309-314.
Lim JM, Liou SS, Hansel W. 1996. Intrascytoplasmic glutathione concentration
and the role of -mercaptoethanol in preimplantation development of bovine
embryos. Theriogenology. 46:429-439.
Lu SC. 2013. Glutathione synthesis. Biochim Biophys Acta 1830(5):3143-3153. Luberda, Z. 2005. The role of glutathione in mammalian gametes. Biol Reprod.
5(1):5-17.
Lequaere AS, Marchandase J, Moreau B, Massip A, Donnay I. 2003. Cell cycle at the time of maternal zygotic. Biol Reprod. 69:1707-1713.
Lonergan P, Khatir H, Piumi F, Rieger D, Humblot P, Boland MP. 1999. Effect of time interval from insemination to first cleavage on the developmental characteristics, sex ratio and pregnancy rate after transfer of bovine embryos. Reprod Fertil. 117:159-167.
Lonergan P, Gutierrez-Adan A, Pintado B, Fair T, Ward F, Fuente JD, Boland M. 2000. Relationship between time first cleavage and the expression of IGF-I growth factor, its receptor, and two housekeeping genes in bovine two-cell embryos and blastocyst produced in vitro. Mol Reprod Dev. 7:146-152. Lord T, Aitken RJ. 2013. Oxidative stress and ageing of the post-ovulatory oocyte.
Reproduction. 146:217-227.
Memili E, First NL. 2000. Zygotic and embryonic gene expression in cow: a review of timing and mechanism of early gene expression as compared with other species. Zygote. 8:87-96.
Mio Y, Iwata K, Yumoto K, Kai Y, Sargant HC, Mizoguchi C, Ueda M, Tsuchie Y, Imajo A, Iba Y, Nishikori K. 2012. Possible mechanism of polyspermy block in human oocytes observed by time-lapse cinematography. J Assist Reprod Genet. 29:951-956.
Mondou E, Dufort I, Gohin M, Fournier E, Sirard MA. 2012. Analysis of microRNAs and their precursors in bovine early embryonic development. Mol Hum Reprod. 18:425-434.
Mukhopadhyay CS, Verma A, Dubey PP, Jain R, Singh N. 2008. Sperm nuclear chromatin decondensation test: its applicability to predict fertility of cyropreserved semen samples. Ind Anim Res. 42:285-287.
Muller FL, Liu Y, Remmen HV. 2004. Complex III release superoxide to both sides of the inner mitochondrial membrane. J Biol Chem. 279:49064-49073. Muttaqin Z, Karja NWK, Setiadi MA. 2015. Kemampuan maturasi dan fertilisasi
19 Papi M, Brunelli R, Sylla L, Parasassi T, Monaci M, Maulucci G, Missori M, Arcovito G, Ursini F, Spirito MD. 2010. Mechanical properties of zona pellucida hardening. Eur Biophys. 39:987-992.
Park SH, Cho HS, Yu IJ. 2014. Effect of bovine follicular fluid on reactive oxygen species and glutathione in oocytes, apoptosis and apoptosis-related gene expression of in vitro-produced blastocysts. Reprod Dom Anim. 1:1-8. Pastor N, Weinstein H, Jamison E, Brenowitz M. 2000. A detailed interpretation
of OH radical footprints in a TBPDNA complex reveals the role of dynamics in the mechanism of squence specific binding. Mol Biol. 304:55-68.
Sena LA, Chandel NS. 2012. Physiological roles of mitochondrial reactive oxygen species. Mol Cell. 48:158-167.
Setiadi MA, Karja NWK. 2013. Tingkat perkembangan awal embrio sapi in vitro menggunakan media tunggal berbahan dasar tissue culture medium (TCM) 199. J Ked Hewan. 7:150-154.
Sirard MA. 2010. Activation of the embryonic genome. Soc Reprod Fertil Suppl. 67:145-158.
Steel RGD, Torrie JH. 1993. Prinsip dan Prosedur Statistika. Suatu Pendekatan Biometrik. Penerjemah: B Sumantri. Jakarta (ID): Gramedia Pustaka.
Sun WJ, Pang YW, Liu Y, Hao HS, Zhao XM, Qin T, Zhu HB, Du WH. 2015. Exogenous glutathione supplementation in culture medium improve the bovine embryo development after in vitro fertilization. Theriogenology. 30:1-8.
Sun QY. 2003. Cellular and molecular mechanisms leading to cortical reaction and polyspermy block in mammalian eggs. Mic Res Tec. 61:342-348.
Suraeva N, Christjkov D, dan Prokofiev. 1997. The timing of pronuclear formation of IVM/IVF-produced bovine zygotes and their development following DNA microinjection. Theriogenology. 47:229(Abstract).
Sutovsky P, Schattan G. 1997. Depletion of glutathione during bovine oocyte maturation reversibly blocks the decondensation of the male pronucleus and pronuclear apposition during fertilization. Biol Reprod. 56:1503-1512. Sutovsky P, Moreno RD, Ramalho-Santos J, Dominko T, Simerly C, Schatten G.
2000. Ubiquitinated sperm mitochondria, selective proteolysis, and the regulation of mitochondrial inheritance in mammalian embryos. Biol Reprod. 63:582-590.
Sutton ML, Gilchrist RB, Thompson JG. 2003. Effects of in-vivo and in-vitro environments on the metabolism of the cumulus-oocyte complex and its influence on oocyte developmental capacity. Hum Reprod. 9(1):35-48. Suzuki K, Erikson B, Shimizu H, Nagai I, Rodriguez-Martinez H. 2000. Effect of
hyaluron on monospermic penetration of porcine oocyte fertilized in vitro. Int Androl. 23:13-21.
Tadros W, Lipshitz HD. 2009. The maternal-to-zigotic transition: a play in two acts. Development. 136:3033-3042.
20
Urdaneta A, Jimenez AR, Paramio MT, Izquierdo D. 2004. Cyteamine, glutathione and ionomycin treatments improve in vitro fertilization of prepubertal goat oocytes. Zygote. 12:277-284.
Wassarman PM. 1988. Zona pellucida glycoproteins. Annu Rev Biochem. 57:415-442.
Whitaker BD, Knight JW. 2010. Effects of cysteine and N-acetyl-cysteine-amide supplementation on in vitro matured porcine oocyte. Reprod Dom Anim. 45(5):755-759.
Yasmin C, Otoi T, Setiadi MA, Karja NWK. 2015. Maturation and fertilization of sheep oocytes cultured in serum-free medium containing silk protein sericin. Acta Vet Hung. 63(1): 110-117.
You J, Kim J, Lim J, Lee E. 2010. Anthocyanin stimulates in vitro development of cloned pig embryo by increasing the intracellular glutathione level and inhibiting reactive oxygen species. Theriogenology. 74:777-785.
You J, Lee J, Hyun SH, Lee E. 2012. L-carnitine treatment during oocyte maturation improves in vitro development of cloned pig embryos by influencing intracellular GSH synthesis and embryonic gene expression. Theriogenology. 78:235-243.
Zhou P, Wu YG, Wei DL, Li Q, Wang G, Zhang J. 2010. Mouse cumulus-denuded oocytes restore development capacity completely when matured with optimal supplementation of cysteamine, cystine, and cumulus cells. Biol Reprod. 82:759-768.
Zorov BZ, Juhaszova M, Sollot SJ. 2014. Mitochondrial reactive oxygen species (ROS) and ROS-induced ROS release. Physiol Rev. 94:909-950.
21 Lampiran 1. Komposisi medium transportasi ovarium
Bahan Jumlah
NaCl 9.000 g
Penicillin (100 IU/mL) dan streptomycin 1000 µL
Milli Q water 1000 mL
Total 1000 mL
Lampiran 2. Komposisi medium dulbecco phosphate buffered saline (DPBS)
Bahan Jumlah
CaCl2 0.0500 g
KCl 0.1000 g
KH2PO4 0.0500 g
MgCl2.6H2O 4.0000 g
NaCl 0.5750 g
Na2HPO4.7H2O 0.5000 g
Glucose 0.0180 g
Na Pyruvate 0.2500 g
Penicillin (100 IU/mL) dan streptomycin 500 µL
Milli Q water 500 mL
Total 500 mL
Lampiran 3. Komposisi medium koleksi oosit
Bahan Jumlah
DPBS 47.5 mL 45 mL
Fetal Bovine Serum (FBS) 5% dan 10% (v/v) 2.5 mL 5 mL Penicillin (100 IU/mL) dan streptomycin 50 µL 50 µL
Total 50 mL 50 mL
Lampiran 4. Komposisi medium pematangan in vitro
Bahan Jumlah
Tissue Culture Medium/TCM-199 1800 µL
Fetal Bovine Serum (FBS) 10% (v/v) 200 µL
Pregnant Mare Serum Gonadotropin (PMSG) 20 µL
Human Chorionic Gonadotropin (hCG) 20 µL
Gentamycin (50 µg/mL) 2 µL
22
Lampiran 6. Komposisi medium fertilisasi in vitro
Bahan Jumlah
Kafein anhydrous 0.0194 g 0.0388 g
BSA 0,5% 0.2500 g 0.5000 g
Milli Q water 50 mL 100 mL
Total 50 mL 100 mL
Lampiran 7. Komposisi medium kultur modified synthetic oviduct fluid (mSOF)
23
Glycine 0.0375 g 0.0750 g
Alanine 0.0045 g 0.0090 g
Taurine 0.0220 g 0.0440 g
Myoinositol 0.0250 g 0.0500 g
Sorbitol 0.0320 g 0.0640 g
Citric acid. H2O 0.0055 g 0.0110 g
Apo-Transferrin 0.0005 g 0.0010 g
BME (EAA) 1000 µL 2000 µL
MEM (NEAA) 500 µL 1000 µL
Sodium Lactate (60%) 23.7 µL 47.4 µL
Insulin - -
Gentamicin 50 µL 100 µL
Milli Q water 50 mL 100 mL
Total 50 mL 100 mL
Lampiran 8. Pembuatan laturutan glutathione (GSH) Larutan GSH dengan konsentrasi 0.1 mM/µL
Sebanyak 0.0307 g GSH dilarutkan dalam 1 mL medium fertilisasi atau kultur Larutan GSH dengan konsentrasi 0.05 mM/µL
Sebanyak 500 µL dari larutan GSH dengan konsentrasi 0.1 mM/µL ditambah 500 µL medium fertilisasi atau kultur
Larutan GSH dengan konsentrasi 0.025 mM/µL
24
RIWAYAT HIDUP
Aras Prasetiyo Nugroho lahir pada tanggal 11 Juni 1990 di Banyumas, Jawa Tengah dari pasangan Ayahanda Drs. Teguh Budi Sarjono dan Ibunda Erni Astuti. Penulis merupakan anak pertama dari tiga bersaudara, yaitu Agita Rakhmawati dan Annas Habib Fauzan. Pada tahun 2002 penulis lulus dari SD Negeri 1 Kembaran, Banyumas, Jawa Tengah. Selanjutnya pada tahun 2005 penulis lulus dari SMP Negeri 2 Soakraja, Banyumas, Jawa Tengah. Selanjutnya pada tahun 2008 penulis lulus dari SMA Negeri 2 Purwokerto, Banyumas, Jawa Tengah. Gelar Sarjana Peternakan (SPt) diperoleh penulis pada tahun 2012, dari Fakultas Peternakan Universitas Jenderal Soedirman dengan skripsi yang
berjudul “Motilitas dan Abnormalitas Spermatozoa Ayam Kampung dengan
Pengencer Ringer Laktat-Putih Telur dan Lama Penyimpanan yang Berbeda pada Suhu 5 ºC” yang dipublikasikan pada Jurnal Acta Veterinaria Indonesia, Fakultas Kedokteran Hewan, Institut Pertanian Bogor, Bogor. Pada tahun 2013 penulis memutuskan untuk melanjutkan studi pascasarjana pada Program Biologi Reproduksi di Sekolah Pascasarjana Institut Pertanian Bogor dengan Beasiswa Program Pascasarjana Dalam Negeri (BPPDN) dari Direktorat Pendidikan Tinggi. Selama mengikuti program magister, penulis menulis tesis dengan judul
“Efektivitas Penambahan Glutathione (GSH) pada Medium Fertilisasi dan Kultur