ISOLASI DAN APLIKASI BAKTERI PATOGEN DAN
BAKTERI BIOKONTROL ASAL PUPA SUTERA EMAS
Cricula trifenestrata
Helfer
AGNES DAME SINTA ULI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Isolasi dan Aplikasi Bakteri Patogen dan Bakteri Biokontrol Asal Pupa Sutera Emas Cricula trifenestrata Helfer adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juli 2015
Agnes Dame Sinta Uli
RINGKASAN
AGNES DAME SINTA ULI. Isolasi dan Aplikasi Bakteri Patogen dan Bakteri Biokontrol Asal Pupa Sutera Emas Cricula trifenestrata Helfer. Dibimbing oleh NISA RACHMANIA MUBARIK dan DEDY DURYADI SOLIHIN
Ulat sutera emas (Cricula trifenestrata Helfer) menghasilkan kokon berbentuk jaring dan warna keemasan. Kokon ini memiliki nilai jual tinggi. Ketersediaan kokon ulat sutera emas sepanjang tahun masih menjadi masalah. Penurunan produktivitas kokon dapat disebabkan serangan bakteri, cendawan, protozoa, dan virus. Penelitian ini mengisolasi bakteri patogen dan biokontrol dari pupa ulat sutera emas yang sehat (Healthy Pupae Cricula, HPC) dan sakit (Unhealthy Pupae Cricula/UPC). Terdapat 101 bakteri asal pupa sehat dan 104 bakteri asal pupa sakit. Seleksi bakteri patogen asal pupa ulat sutera emas dengan menggunakan media agar-agar darah menunjukkan terdapat 5 bakteri yang mampu melisiskan agar-agar darah yaitu UPC 12, UPC 51, UPC 60, UPC 80a, dan UPC 80b. Bakteri tersebut merupakan kandidat bakteri patogen. Uji antagonis seluruh koleksi bakteri terhadap 5 kandidat bakteri patogen menunjukkan terdapat 4 bakteri yang mampu membentuk zona bening. Uji patogenisitas bakteri patogen terhadap ulat sutera B. mori instar 4 menunjukkan bakteri UPC 60 merupakan bakteri yang menyebabkan mortalitas tertinggi sebesar 56.82% terhadap larva B. mori selama 4 hari. Uji keefektifan bakteri biokontrol terhadap bakteri patogen pada larva B. mori menunjukkan bakteri biokontrol UPC 40 dan UPC 71 merupakan bakteri yang mampu menyebabkan mortalitas terendah yaitu 20%. Bakteri biokontrol UPC 40 dan UPC 71 selanjutnya digunakan untuk uji pemberian tunggal terhadap B. mori dan C. trifenestrata.
Uji keefektifan bakteri biokontrol UPC 40 dan UPC 71 terhadap bakteri patogen UPC 60 secara in vivo pada larva B. mori instar 4 selama 10 hari menunjukkan pemberian bakteri UPC 60 secara tunggal menyebabkan mortalitas hingga 96%. Pemberian bakteri biokontrol UPC 40 terhadap bakteri patogen UPC 60 secara in vivo mampu menurunkan persentase mortalitas menjadi 36.67%. Pemberian bakteri biokontrol UPC 71 terhadap bakteri patogen UPC 60 secara in vivo mampu menurunkan persentase mortalitas menjadi 23.33%. Uji keefektifan bakteri biokontrol UPC 40 dan UPC 71 terhadap bakteri patogen UPC 60 secara
in vivo pada larva C. trifenestrata instar 4 selama 7 hari menunjukkan pemberian bakteri UPC 60 secara tunggal menyebabkan mortalitas hingga 100%. Pemberian bakteri biokontrol UPC 40 terhadap bakteri patogen UPC 60 mampu menurunkan persentase mortalitas menjadi 43.33%. Pemberian bakteri biokontrol UPC 71 terhadap bakteri patogen UPC 60 menurunkan angka mortalitas menjadi 56.67%. Pengamatan kerusakan usus tengah larva B. mori dan larva C. trifenestrata instar 4 menunjukkan pemberian bakteri patogen menyebabkan kerusakan seperti lisis dan pembengkakan jaringan usus tengah. Identifikasi bakteri menggunakan gen 16S rRNA menunjukkan bakteri biokontrol UPC 40 memiliki kemiripan 97% dengan Alcaligenes faecalis, bakteri biokontrol UPC 71 memiliki kemiripan 98% dengan Pseudomonas stutzuri dan bakteri patogen UPC 60 memiliki kemiripan 97% dengan Aeromonas dhakensis.
SUMMARY
AGNES DAME SINTA ULI. Isolation and Application of Pathogenic and Biological Control Bacteria from Pupae of Golden Silkworm Cricula trifenestrata
Helfer. Supervised by NISA RACHMANIA MUBARIK and DEDY DURYADI SOLIHIN.
Golden silkworm (Cricula trifenestrata Helfer) produces cocoon perforeted in shaped and golden in color. This cocoon has a high economic value. Cocoon availability throughout the year is not sufficient. The decreasing productivity of coccoon is caused by attack of bacteria, fungi, protozoa, and viruses. This research was aimed to isolate suspected pathogenic and biological control bacteria from healthy pupae Cricula (HPC) and unhealthy pupae Cricula (UPC). There are 101 bacteria from healthy pupae Cricula and 104 bacteria from unhealthy pupae Cricula. Selection of pathogenic bacteria using blood agar medium showed there were 5 suspected pathogenic bacteria capable of lysing blood agar such as UPC 12, UPC 51, UPC 60, UPC 80a, and UPC 80b. Antagonistic test of all collections bacteria against 5 suspected pathogenic bacteria showed there were 4 bacteria that are able to form clear zones. Pathogenicity test of pathogenic bacteria against instar 4th B. mori larvae showed bacteria UPC 60 due to highest mortality of up to 56.82% for 4 days.The effectiveness test of biological control bacteria against pathogenic bacteria UPC 60 against instar 4th B. mori larvae showed bacteria UPC 40 and 71 are bacteria that capable of causing the lowest morthality 20%. Biological control bacteria UPC 40 and UPC 71 used for in vivo single test of the instar 4thB. mori and C. trifenestrata larvae.
Test the effectiveness of biological control bacteria UPC 40 and UPC 71 against pathogenic bacteria UPC 60 in vivo in Instar 4th B. mori larvae for 10 days showed pathogenic bacteria UPC 60 due to morthality up to 96%. The morthality of biological control bacteria UPC 40 against pathogenic bacteria UPC 60 in-vivo becomes 36.67%. Biological control bacteria UPC 71 against pathogenic bacteria UPC 60 reduced mortality becomes 23.33%. The effectiveness test of biocontrol bacteria UPC 40 and UPC 71 against pathogenic bacteria UPC 60 in instar 4th C. trifenestrata larvae for 7 days showed pathogenic bacteria UPC 60 due to the morthality until 100%. Biological control bacteria UPC 40 against pathogenic bacteria UPC 60 reduces morthality becomes 43.33%. Biological control bacteria UPC 71 against pathogenic bacteria UPC 60 reduced mortality becomes 56.67%. Histology observation midgut tissue of instar 4th B. mori and C. trifenestrata
larvae after treatment of biological and pathogenic bacteria showed damage and lysis midgut tissue. Identification bacteria based on 16S rRNA gene showed biological control bacteria UPC 40 had 97% identity with Alcaligenes faecalis, biological control bacteria UPC 71 had 98% identity with Pseudomonas stutzuri,
and pathogenic bacteria UPC 60 had 97% identity with Aeromonas dhakensis.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Mikrobiologi
ISOLASI DAN APLIKASI BAKTERI PATOGEN DAN
BAKTERI BIOKONTROL ASAL PUPA SUTERA EMAS
Cricula trifenestrata Helfer
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2015
PRAKATA
Puji dan syukur penulis ucapkan pada Tuhan Yang Maha Esa atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Juli 2014 sampai Juli 2015 ini ialah Isolasi dan Aplikasi Bakteri Patogen dan Bakteri Biokontrol Asal Pupa Ulat Sutera Emas Cricula trifenestrata Helfer.
Penulis mengucapkan terimakasih kepada Ibu Dr Nisa Rachmania Mubarik, MSi dan Bapak Dr Dedy Duryadi Solihin, DEA selaku pembimbing yang telah banyak memberikan nasehat, saran, motivasi, dan solusi setiap permasalahan yang dihadapi penulis selama melaksanakan penelitian dan penyusunan karya ilmiah ini. Penulis mengucapkan terima kasih kepada penguji luar komisi Dr Kikin Hamzah Mutaqin, MSi dan Ketua Program Studi Mikrobiologi IPB Prof Dr Anja Meryandini, MS, yang telah memberikan masukan pada saat ujian sidang tesis. Terimakasih disampaikan kepada Direktorat Perguruan Tinggi (Dikti) yang telah memberikan kesempatan melanjutkan pendidikan S2 melalui Beasiswa Pendidikan Pascasarjana Dalam Negeri 2013.
Penulis mengucapkan terima kasih kepada Ibu Heni dan Bapak Jaka selaku laboran Mikrobiologi IPB, Ibu Tini selaku laboran Mikroteknik IPB, Bapak Winarno selaku dosen dan laboran Kandang Ternak Satwa Harapan Non Ruminansia, Bapak Albet, atas bantuannya selama penelitian ini. Terimakasih kepada Ayahku R.N Sihotang, Ibu L. Br. Situmorang, saudaraku Rosnelly Sihotang, Hendrianus Sihotang, Dorotty Sihotang SP, Damaris Betty Sihotang Amd, Juventinus Victor Sihotang ST, Paulus Wanda Sihotang dan Siska Veronika Sihotang, atas segala doa, cinta, dan dukungannya. Terima kasih untuk teman seperjuangan di Pascasarjana Mikrobiologi IPB angkatan 2013 dan teman-teman di Laboratorium Mikroteknik IPB, serta seluruh pihak yang telah memberikan bantuan, doa, dan dukungannya, penulis ucapkan terima kasih.
Semoga karya ilmiah ini bermanfaat.
Bogor, September 2015
DAFTAR ISI
DAFTAR TABEL x
DAFTAR GAMBAR x
DAFTAR LAMPIRAN xi
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
Ruang Lingkup Penelitian 2
TINJAUAN PUSTAKA 3
Klasifikasi Cricula trifenestrata Helfer 3
Siklus Hidup C. trifenestrata 3
Nilai Ekonomis Kokon Ulat Sutera Emas C. trifenestrata 5
Bakteri Patogen pada Ulat Sutera 5
METODE 5
Bahan 5
Kerangka Penelitian 6
Waktu dan Tempat 7
Isolasi Bakteri Patogen dan Bakteri Biokontrol Asal Pupa Ulat Sutera Emas C. trifenestrata
7 Seleksi dan Uji Antagonis Bakteri Patogen Asal Pupa Ulat Sutera
Emas C. trifenestrata
7 Uji Patogenisitas Bakteri Patogen terhadap Larva B. mori Instar 4 7 Uji Keefektifan Bakteri Biokontrol terhadap Bakteri Patogen pada
Larva B. mori dan C. trifenestrata Instar 4
8 Pengamatan Histologi Larva B. mori dan C. trifenestrata Instar 4 8 Penentuan Kurva Tumbuh dan Aktivitas Antagonis Bakteri Terpilih 8
Identifikasi Bakteri Terpilih 8
HASIL DAN PEMBAHASAN 9
Hasil 9
Pembahasan 20
SIMPULAN DAN SARAN 23
Simpulan 23
Saran 23
DAFTAR PUSTAKA 24
LAMPIRAN 27
DAFTAR TABEL
1 Hasil pengukuran zona hambat bakteri biokontrol terhadap bakteri patogen
1 Kerangka penelitian isolasi dan aplikasi bakteri patogen dan bakteri biokontrol asal pupa sutera emas C. trifenestrata Helfer
6 5 Sayatan melintang usus tengah larva B. mori kontrol 11 6 Sayatan melintang usus tengah larva B. mori setelah diberikan bakteri
patogen selama 4 hari perlakuan
12 7 Hasil uji keefektifan bakteri biokontrol terhadap bakteri patogen pada
larva B. mori instar 4 selama 10 hari
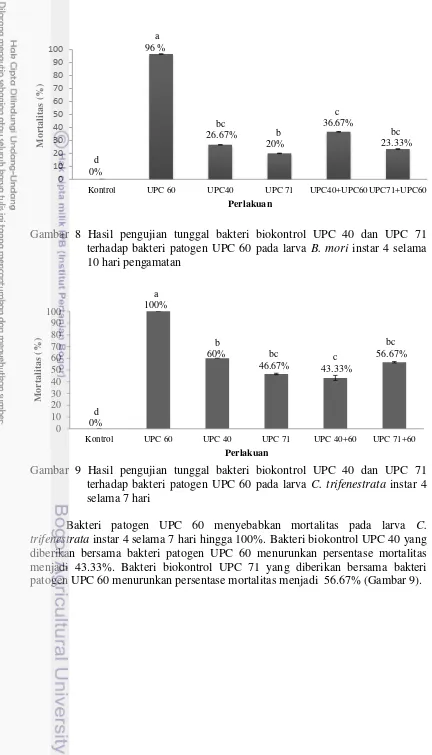
13 8 Hasil pengujian tunggal bakteri biokontrol UPC 40 dan UPC 71
terhadap bakteri patogen UPC 60 pada larva B. mori instar 4 selama 10 hari pengamatan
14
9 Hasil pengujian tunggal bakteri biokontrol UPC 40 dan UPC 71 terhadap bakteri patogen UPC 60 pada larva C. trifenestrata instar 4 selama 7 hari
14
10 Sayatan melintang usus tengah larva B. mori instar 4 15 11 Sayatan melintang usus tengah larva C. trifenestrata instar 4 16 12 Kurva letal dosis 50% bakteri patogen UPC 60 terhadap larva B. mori
instar 4 selama 7 hari perlakuan
17 13 Kurva tumbuh bakteri biokontrol UPC 40 serta bakteri patogen UPC
60 dan aktivitas antagonis bakteri biokontrol UPC 40 terhadap bakteri patogen UPC 60, Kurva tumbuh bakteri biokontrol UPC 71 serta bakteri patogen UPC 60 dan kurva aktivitas antagonis bakteri biokontrol UPC 71 terhadap bakteri patogen UPC 60
17
14 Hasil pewarnaan Gram UPC 40, UPC 60, dan UPC 71 18 15 Hasil elektroforesis amplifikasi dari tiga bakteri terpilih berdasarkan
gen 16S rRNA
18 16 Konstruksi pohon filogenetik dari tiga bakteri terpilih berdasarkan
amplifikasi gen 16S rRNA
DAFTAR LAMPIRAN
1 Identifikasi morfologi koloni 104 bakteri asal pupa sehat (HPC) 27 2 Identifikasi morfologi koloni 101 bakteri asal pupa sakit (UPC) 29 3 Hasil uji patogenisitas bakteri patogen terhadap larva B. mori 31 4 Kurva standar bakteri biokontrol UPC 40, UPC 71, dan bakteri
patogen UPC 60
31 5 Hasil uji fisiologi dengan Kit API 20 NE bakteri biokontrol UPC 40,
UPC 71, dan bakteri patogen UPC 60
33 6 Hasil kuantitas DNA bakteri biokontrol UPC 40, UPC 71, dan
bakteri patogen UPC 60
34 7 Hasil runutan nukleotida bakteri biokontrol UPC 40, UPC 71, dan
bakteri patogen UPC 60
PENDAHULUAN
Latar Belakang
Indonesia merupakan negara tropis yang memiliki kekayaan ulat sutera liar. Salah satu jenis ulat sutera liar yaitu Cricula trifenestrata. C. trifenestrata
dikenal dengan ulat alpukat atau ulat sutera emas merupakan ulat sutera liar yang hidup pada tanaman mangga, alpukat dan mete (Amin et al. 2008; Rono et al. 2008; Furry 2012; Prihatin dan Situmorang 2001). Kisaran pakan yang luas merupakan aspek yang menguntungkan dalam budidaya ulat sutera liar.
Cricula trifenestrata merupakan jenis ulat sutera liar yang mendapatkan perhatian untuk dimanfaatkan dan dikembangkan di Indonesia khususnya di Yogyakarta (Kamilatunisa 2011; Furry 2012; Tikader et al. 2014). Beberapa kelebihan C. trifenestrata sebagai penghasil serat sutera liar: (a) C. trifenestrata
bersifat endemik di beberapa pulau di Indonesia. Penanganan ulat sutera emas yang baik diharapkan dapat meningkatkan produktivitasnya (b) kerusakan pada tanaman memicu pertumbuhan generatif. Tanaman menghasilkan daun muda sekitar 2 minggu setelah ulat sutera emas C. trifenestrata memakan habis daun. Tanaman akan segera membentuk bunga dan buah yang lebih berkualitas (Furry 2012; Tikader et al. 2014) (c) kemampuan reproduksi C. trifenestrata tinggi. Seekor betina dapat menghasilkan telur ± 200-368 butir/siklus reproduksi (Rojak 2001) dan mendapatkan kokon diperlukan waktu ±30 hari. Jika potensi ini dapat dimaksimalkan dalam menghasilkan benang sutera, maka paradigma sebagai serangga hama berubah menjadi serangga menguntungkan; (d) serat yang dihasilkan oleh C. trifenestrata memiliki warna alami keemasan (Suriana 2011). (e) Kokon C. trifenestrata dihargai Rp. 180.000 per kg sedangkan harga pupa per kg dihargai Rp 50.000 (Furry 2012). Salah satu keunggulan dari sutera emas serat berwarna keemasan dan bentuk kokon berlubang-lubang dimanfaatkan pengrajin sebagai bahan aksesoris, bross pakaian, kap lampu, alat tulis, disain ruangan, kalung, kotak esklusif, vas bunga, tas pesta (Kamilatunisa 2011; Furry 2012; Tikader et al. 2014).
Potensi kokon sutera emas C. trifenestrata akan semakin optimal seiring dengan perkembangan industri kokon sutera emas di sektor hilir. Permintaan yang besar di sektor hilir akan mendorong sektor hulu untuk memenuhi permintaan pasar, sehingga budidaya ulat sutera emas C. trifenestrata semakin terdorong untuk berkembang. Oleh karena itu, kebutuhan penelitian untuk budidaya C. trifenestrata perlu dikembangkan. Berbagai penelitian mencoba mengupayakan penanganan yang tepat terhadap domestikasi ulat sutera emas seperti penelitian mengenai biologi ulat kipat C. trifenestrata pada tanaman alpukat (Sudaryanto 1986). Penelitian mengenai pakan buatan menggunakan daun jambu mete untuk ulat sutera emas Cricula trifenestrata Helf (Prihatin dan Situmorang 2001). Penelitian mengenai siklus hidup C. trifenestrata dengan pemberian pakan daun mangga (Amin et al. 2008). Penelitian deskripsi morfologi, anatomi dan perilaku ulat sutera liar (Suriana 2011). Penelitian mengenai morfometri dan siklus hidup ulat sutera liar C. trifenestrata Helfer (Andriani 2009).
2
pada bulan Februari-Mei dan Juli-Agustus, tetapi jika cuaca buruk kadang hanya satu kali panen. Rata-rata jumlah kokon yang dihasilkan saat panen berkisar 2-10 ons, dengan rata-rata 5 ons kokon per petani (Furry 2012). Zhang et al. (2013) melaporkan bahwa selain predator penurunan produktivitas kokon juga dapat disebabkan oleh bakteri. Balavenkatasubbaiah et al. (2014) melaporkan penyakit yang dapat menyerang ulat sutera antara lain Flacherie, Grasserie, Pebrine, dan
Muscardine. Penyakit tersebut dapat disebabkan oleh bakteri, cendawan, protozoa, nematoda, dan virus (Vega dan Kaya 1993; Nirupama 2014). Kelompok Lepidoptera seperti B. mori dapat terserang penyakit yang disebabkan oleh bakteri
Providencia rettgeri, Pantoea agglomerans, Klebsiella sp., Acinetobacter calcoaceticus, Serratia marcescens, Erwinia sp., dan Bacillus thuringiensis
(Zhang et al. 2013). Hal ini menyebabkan penurunan ketersediaan kokon ulat sutera emas.
Penelitian penting dilakukan untuk mengisolasi bakteri patogen yang mampu menyebabkan penurunan produktivitas kokon ulat C. trifenestrata dan mengisolasi bakteri biokontrol yang mampu menghambat pertumbuhan bakteri patogen serta aplikasi pada ulat sutera B. mori dan ulat C. trifenestrata secara in vivo.
Perumusan Masalah
Produktivitas kokon sutera emas mengalami penurunan disebabkan serangan bakteri, cendawan, protozoa, dan bakteri. Kelompok Lepidoptera dapat terserang bakteri patogen, seperti Providencia rettgeri, Pantoea agglomerans,
Klebsiella sp., Acinetobacter calcoaceticus, Serratia marcescens, Erwinia sp., dan
Bacillus thuringiensis. Hal ini menyebabkan berkurangnya ketersediaan kokon sepanjang tahun.
Tujuan Penelitian
Tujuan penelitian untuk menguji bakteri patogen dan biokontrol pada larva B. mori dan C. trifenestrata serta mengamati kerusakan jaringan usus tengah pada tahapan larva setiap perlakuan.
Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi mengenai bakteri patogen dan bakteri biokontrol pada larva B. mori dan C. trifenestrata serta pengamatan kerusakan jaringan usus tengah pada tahap larva.
Ruang Lingkup Penelitian
3 terhadap ulat sutera. Pengujian keefektifan bakteri biokontrol terhadap bakteri patogen pada larva B. mori dan C. trifenestrata. Pengamatan histologi usus tengah larva B. mori dan C. trifenestrata, penentuan kurva tumbuh dan aktivitas antagonis bakteri terpilih dan identifikasi bakteri terpilih.
TINJAUAN PUSTAKA
Klasifikasi Cricula trifenestrata Helfer
Ulat sutera emas C. trifenestrata Helfer, merupakan genus Saturniide yang menyebabkan defoliasi (penggundulan) pada tanaman bernilai ekonomi seperti alpukat, rambutan, mangga, mete dan kedondong. Klasifikasi C. trifenestrata
menurut Triplehon dan Jhonson (2005): Kingdom : Animalia Filum : Artropoda Kelas : Insecta Ordo : Lepidoptera Famili : Saturniidae Genus : Cricula
Spesies : Cricula trifenestrata
Siklus Hidup C. trifenestrata Telur
Telur C. trifenestrata berukuran panjang 0,5 mm dan lebar 0,4 mm (Suriana 2010). Salah satu ujungnya terdapat bintik transparan yang merupakan tempat larva keluar. Telur yang baru diletakkan berwarna putih mengkilap dan menjelang menetas telur berwarna kelabu (Sudaryanto 1986). Induk betina C. trifenestrata meletakkan telur dengan gerakan maju sambil mengepak-ngepakkan sayapnya untuk menjaga keseimbangan (Suriana 2011). Jumlah telur yang diletakkan imago betina berkisar antara 200-368 butir. Imago betina mampu meletakkan telur selama 1-4 hari (Amin et al. 2008). Imago yang tidak berkopulasi menghasilkan telur yang tidak dapat menetas/steril (Sudaryanto 1986).
Ulat/Larva
Tubuh ulat terdiri atas tiga ruas toraks dan sepuluh ruas abdomen. Ulat membentuk jalinan benang-benang sutera yang dilekatkan pada permukaan daun. Pergantian kulit ditandai dengan warna tubuh menjadi suram, lebih pendek dan kurang aktif makan (Amin et al. 2008). Tubuh yang berwarna suram mungkin karena terdapat lapisan kutikula rangkap, yaitu di dalam kutikula lama telah terbentuk kutikula baru (Sudaryanto 1986).
4
diikuti dengan pecahnya kulit kepala pada garis ekdisial. Ulat menggeliat mendorong kulit kepala hingga lepas. Tungkai-tungkai melepaskan kulit yang membungkusnya sehingga tinggal kulit abdomen yang belum terlepas. Ulat bergerak maju dan meninggalkan kulit pembungkusnya (Sudaryanto 1986).
Ulat instar satu yaitu ulat yang keluar dari telur berwarna kuning pucat dengan kepala berwarna coklat kehitaman. Ulat instar satu berlangsung selama 4 - 7 hari (Amin et al. 2008). Bagian dorsal ruas tubuh pertama terdapat garis coklat yang melintang sedang pada bagian dorsal ruas abdomen kedelapan terdapat dua buah bintik yang berwarna coklat. Sepanjang tubuh ulat terdapat rambut-rambut, rambut pada ruas tubuh pertama lebih panjang dibandingkan rambut pada ruas tubuh lainnya. Ulat yang baru menetas dari telur hidup bergerombol dan mulai makan dari pinggir daun. Ulat instar dua berwarna kuning terang dengan kepala berwarna merah. Setiap ruas tubuh terdapat enam buah rambut yang berwarna putih. Tiap rambut panjang dikelilingi oleh duri-duri pendek berwarna merah. Tubuh ulat instar tiga berwarna kuning terang dan terdapat bercak-bercak hitam pada bagian dorsal sedangkan kepala berwarna merah. Ulat instar tiga memiliki kemampuan makan yang lebih tinggi dan pergerakan yang lebih cepat (Amin et al. 2008). Ulat instar empat mempunyai warna dasar hitam dengan kepala berwarna merah. Warna tubuh ulat instar lima sama dengan instar ke empat. Ulat merupakan stadium serangga yang merugikan tanaman karena memakan daun hingga menimbulkan kerusakan tanaman tersebut (Sudaryanto 1986).
Prapupa dan Pupa
Ulat instar lima tidak aktif makan disebut pra-pupa. Pra-pupa membentuk kokon dengan merangkai benang-benang sutera yang dikeluarkan spineret. Ulat akan memilih permukaan daun, tulang daun untuk membentuk kokon. Kokon berbentuk seperti jala dan berwarna kuning emas. Selama masa prapupa tubuh akan mengkerut memendek berwarna kelabu serta ujung abdomen meruncing. Masa prapupa berlangsung 2-3 hari (Amin et al. 2008).
Struktur berlubang pada kokon C. trifenestrata disebabkan cara merajut kokon. Ulat sebelum merajut kokon akan membuat kerangka dasar berupa serat tunggal yang memanjang dari satu bagian substrat ke bagian yang berlawanan. Ulat merajut kokon dengan cara tubuh melengkung sambil mengeluarkan benang sutera (Suriana 2011).Tahapan pupa berkisar antara 19-21 hari. Pupa bergerak-gerak dengan teratur. Gerakan tersebut mengakibatkan pergantian kulit pada bagian kepala pupa. Imago bergerak meninggalkan kulit pupa dan keluar dari kokon. Imago berdiam diri dan secara perlahan mengembangkan sayapnya hingga menjadi ukuran yang sempurna. Imago keluar dari kokon pada malam hari (Sudaryanto 1986).
Imago
5 2008). Abdomen lebih ramping dan ujung abdomen banyak terdapat rambut-rambut halus (Sudaryanto 1986).
Nilai Ekonomis Kokon Ulat Sutera Emas C. trifenestrata
Ulat sutera C. trifenestrata menghasilkan kokon pada fase hidupnya. Kokon C. trifenestrata berbentuk jaring dan berwarna keemasan (golden silk) (Kamilatunisa 2011) sehingga tidak memerlukan pewarna tambahan untuk mengubahnya menjadi barang bernilai ekonomis (Suriana 2011). Kokon C. trifenestrata digunakan sebagai bahan pembuatan handikraft, aksesories dan pembuatan pakaian (Kamilatunisa 2011; Furry 2012; Tikader et al. 2014).
Bakteri Patogen pada Ulat Sutera
Kokon C. trifenestrata diperoleh dengan cara mengumpulkannya dari alam pada saat musimnya. Masalah yang dihadapi ialah kokon tidak ditemukan sepanjang tahun. Kelangkaan kokon di masa-masa tertentu disebabkan oleh strategi adaptasi dari serangga ini (Suriana 2011). Keberadaan C. trifenestrata di alam dibatasi oleh predator dan parasitoid. Pemeliharaan di dalam ruangan akan mengurangi resiko serangan predator dan parasitoid. Keberhasilan pemeliharaan di dalam ruangan ditentukan oleh ketepatan kondisi pemeliharaan meliputi suhu dan kelembaban ruangan (Andriani 2009). Zhang et al. (2013) melaporkan bahwa selain predator penurunan produktivitas kokon juga dapat disebabkan oleh bakteri. Andriani (2009) menyatakan kendala yang dialami dalam perubahan pupa menjadi imago adalah adanya pupa yang rentan mengalami kekeringan (untuk pupa yang tidak terbungkus kokon) dan adanya parasit. Pupa yang mengalami kekeringan dan terkena parasit akan mati dan tidak dapat keluar menjadi imago. Pupa yang mati kemungkinan diakibatkan oleh parasitoid yang telah terbawa sejak ulat atau tahap awal pupa.
Tanada dan Kaya (1993) menyatakan ciri-ciri ulat yang diserang bakteri antara lain warna kulit berubah menjadi lebih gelap dan tubuh menjadi lunak. Jaringan internal organ-organ tubuh akan menjadi hancur dan mengeluarkan bau busuk meskipun jaringan integumen masih utuh.
METODE
Bahan
6
Kerangka Penelitian
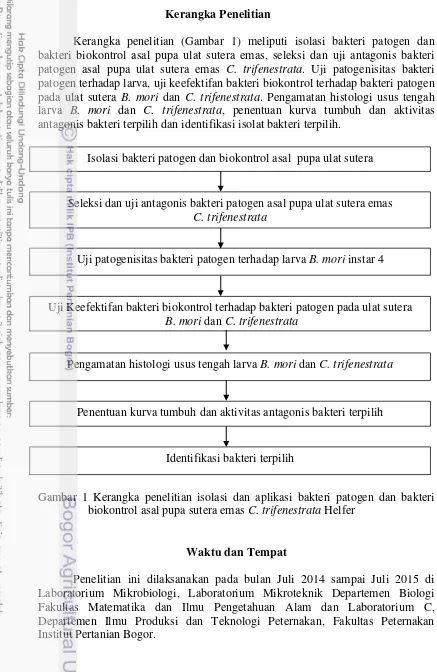
Kerangka penelitian (Gambar 1) meliputi isolasi bakteri patogen dan bakteri biokontrol asal pupa ulat sutera emas, seleksi dan uji antagonis bakteri patogen asal pupa ulat sutera emas C. trifenestrata. Uji patogenisitas bakteri patogen terhadap larva, uji keefektifan bakteri biokontrol terhadap bakteri patogen pada ulat sutera B. mori dan C. trifenestrata. Pengamatan histologi usus tengah larva B. mori dan C. trifenestrata, penentuan kurva tumbuh dan aktivitas antagonis bakteri terpilih dan identifikasi isolat bakteri terpilih.
Gambar 1 Kerangka penelitian isolasi dan aplikasi bakteri patogen dan bakteri biokontrol asal pupa sutera emas C. trifenestrata Helfer
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Juli 2014 sampai Juli 2015 di Laboratorium Mikrobiologi, Laboratorium Mikroteknik Departemen Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam dan Laboratorium C, Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan Institut Pertanian Bogor.
Isolasi bakteri patogen dan biokontrol asal pupa ulat sutera
Seleksi dan uji antagonis bakteri patogen asal pupa ulat sutera emas
C. trifenestrata
Uji patogenisitas bakteri patogen terhadap larva B. mori instar 4
Uji Keefektifan bakteri biokontrol terhadap bakteri patogen pada ulat sutera
B. mori dan C. trifenestrata
Penentuan kurva tumbuh dan aktivitas antagonis bakteri terpilih Pengamatan histologi usus tengah larva B. mori dan C. trifenestrata
7
Isolasi Bakteri Patogen dan Biokontrol Pupa Ulat Sutera Emas C. trifenestrata
Kokon dikoleksi untuk diisolasi bakteri patogen dan antagonisnya. Kokon dipisahkan berdasarkan kondisi pupa yang terdapat di dalamnya. Pupa sakit dan pupa sehat lalu dimasukkan ke dalam kantung plastik berbeda yang telah disemprot dengan alkohol 70%. Pengamatan makroskopis dilakukan untuk mengetahui pupa sehat dan pupa sakit, selanjutnya disterilisasi dengan menggunakan etanol 70% selama 2 menit dan dicuci dengan aquades. Masing-masing pupa sakit dan sehat sebanyak 3 g dihomogenkan dalam 27 mL media
Nutrient Broth (NB) lalu diencerkan hingga 10-8. Pengenceran 10-6, 10-7, dan 10-8 masing-masing diambil sebanyak 0.1 mL dan ditumbuhkan pada media Nutrient Agar (NA). Bakteri diinkubasi pada suhu 30 oC selama 2 hari. Bakteri yang diperoleh dikoleksi dan disimpan sebagai stok untuk uji lebih lanjut (Demir et al. 2012).
Seleksi dan Uji Antagonis Bakteri Patogen Asal Pupa Ulat Sutera Emas C. trifenestrata
Bakteri dari pupa sehat dan pupa sakit diuji dengan cara dititik pada agar-agar darah untuk mengetahui bakteri yang berpotensi sebagai patogen. Bakteri patogen ditunjukkan dengan kemampuan menghemolisis agar-agar darah. Bakteri patogen ditumbuhkan dalam media NB dan diinkubasi hingga mencapai densitas 108. Sebanyak 0.1 mL kultur cair bakteri patogen disebar pada media NA, selanjutnya bakteri yang diperoleh dari hasil isolasi dititik pada media NA yang telah disebar bakteri patogen dan diinkubasi. Bakteri yang membentuk zona bening berpotensi sebagai bakteri biokontrol. Bakteri patogen dan bakteri biokontrol digunakan untuk uji antagonis. Masing-masing bakteri patogen dan biokontrol ditumbuhkan pada media NB hingga densitas sel mencapai 108. Sebanyak 0.1 mL bakteri patogen disebar pada media NA sedangkan bakteri biokontrol sebanyak 30 µL diteteskan pada kertas cakram dan ditempatkan di atas media NA yang telah disebar bakteri patogen, lalu diinkubasi selama 24 jam dan diukur zona bening (Shaekh et al. 2013).
Uji Patogenisitas Bakteri Patogen terhadap Larva B. mori Instar 4
Larva instar 4 yang sehat dan umur seragam digunakan untuk pengujian patogenisitas. Pengujian dilakukan dengan memberi makan larva dengan daun yang telah diberi bakteri patogen sebanyak 4 mL. Pengamatan dilakukan dengan menghitung jumlah larva yang mati setelah aplikasi selama 4 hari (Khan et al. 2011; Fitriyanti 2013). Persentase mortalitas dikoreksi dengan formula Abbott (1925) : Mortalitas
x100%
Keterangan :
8
Uji Keefektifan Bakteri Biokontrol terhadap Bakteri Patogen pada Larva B. mori dan C. trifenestrara Instar 4
Larva instar 4 yang sehat dan umur seragam dipelihara secara berkelompok. Daun yang telah mengandung suspensi biakan bakteri biokontrol diaplikasikan pada larva instar 4 dan diamati selama 5 hari selanjutnya suspensi bakteri patogen diberikan pada hari ke-6 dan diamati hingga hari ke-10. Pengamatan mortalitas dilakukan dengan cara menghitung jumlah larva yang mati. Bakteri patogen dan biokontrol yang mampu menghasilkan persentase mortalitas terendah diaplikasikan secara tunggal terhadap larva dan digunakan untuk uji lanjut (Khan et al. 2011; Fitriyanti 2013).
Pengamatan Histologi Larva Sutera B. mori dan C. trifenestrara Instar 4
Struktur histologi usus tengah larva diamati dan dipreparasi. Larva hasil perlakuan UPC12, UPC51, UPC60, UPC80a, UPC80b dan kontrol dibedah. Saluran pencernaan khususnya usus tengah diambil dan dipotong, dicuci dengan NaCl fisiologis dan difiksasi dengan larutan FAAAC (100 mL formalin 40%, 50 mL asam asetat glasial, 850 mL akuades, 13 g (CaCl2:2H2O) selama 3 hari. Setelah difiksasi, bagian usus tengah larva didehidrasi dengan seri etanol (30, 50, 70, 80, 90 dan 100%) masing-masing selama 1 jam untuk tiap tahapan. Sampel dijernihkan bertahap dengan menggunakan perbandingan alkohol : xylol 1:1 dan dilanjutkan dengan infiltrasi untuk seterusnya dibuat preparat menggunakan miktotom dan diamati perbedaan jaringannya (Khan et al. 2011; Fitriyanti 2013).
Penentuan Kurva Tumbuh dan Aktivitas Antagonis Bakteri Terpilih
Sebanyak 1 lup kultur isolat bakteri terpilih diinokulasi ke dalam 50 mL medium NB dan diinkubasi dengan inkubator goyang hingga sel bakteri mencapai 108 sel/mL. Sebanyak 1 mL kultur 108 sel/mL diinokulasikan ke dalam 100 mL medium NB, lalu diinkubasi dengan inkubator goyang kecepatan agitasi 100 rpm pada suhu 37 oC. Setiap 6 jam dilakukan pengambilan kultur sel untuk diukur densitas selnya pada panjang gelombang 620 nm yang berlangsung selama 48 jam dan dilakukan pengujian aktivitas antagonis.
Identifikasi Bakteri Terpilih
Identifikasi morfologi sel meliputi pewarnaan Gram dan bentuk sel (Zhang
et al. 2013). Identifikasi molekuler meliputi : isolasi DNA genom bakteri,
Polymerase Chain Reaction (PCR), dan sekuensing DNA. DNA diisolasi dari bakteri yang terbukti patogen dan bakteri biokontrol. Isolasi genom menggunakan kit ekstraksi Genomic DNA Mini Kit (Blood/Cultured Cell) mengikuti protokol
9 tabung mikro dan disentrifugasi dengan kecepatan 13.000 g selama 2 menit sehingga diperoleh pelet. Langkah ini diulangi dua kali untuk membuang komponen sel bakteri (Demir et al. 2012). Pelet ditambahkan 200 µl bufer GT dan diresuspensi, lalu diinkubasi pada suhu ruang selama 5 menit. Selanjutnya pelet ditambahkan 200 µl bufer GB dan divorteks, lalu diinkubasi pada suhu 60oC selama 10 menit. DNA ditambahkan dengan 200 µl etanol absolut, divorteks selama 10 detik. Semua campuran dituang ke kolom GD, dan disentrifugasi 10.600 g selama 3 menit. Tabung koleksi dibuang dan diganti dengan tabung baru. Pelet ditambahkan 400 µl bufer W1 pada kolom GD, dan disentrifugasi 10.600 g selama 1 menit. Cairan yang terdapat pada tabung koleksi dibuang, kemudian ditambahkan 600 µl wash buffer, dan disentrifugasi 10.600 g selama 1 menit. Cairan yang terdapat pada tabung koleksi dibuang dan disentrifugasi 10.600 g selama 5 menit. Kolom dipindahkan pada mikrotube baru, kemudian ditambahkan 100 µl TE ditengah-tengah kolom, lalu diinkubasi pada suhu 37 oC selama 10 menit, dan disentrifugasi 10.600 g selama 2 menit dan diperoleh DNA.
Hasil isolasi DNA diukur kemurnian dan konsentrasinya dengan menggunakan Nanodrop 2000 Spectrophotometer (Thermo Scientific, Wilmington, De, USA). Gen 16S rRNA diamplifikasi dengan menggunakan dengan primer 63F (5’-CAGGCCTAACA-CATGCAAGTC-3’) dan 1387R (5’ -GGGCGGCGTGTACAAGGC-3’) (Marchesi et al. 1998). Total volume reaksi PCR 50 µL terdiri atas 25 µL Go Taq Green Master Mix 2X, masing-masing primer 0.5 µL (100 pmol), template 0.6 µL (250 ng) dan 23.4 µL nuclease free water. Kondisi PCR yang digunakan yaitu predenaturasi (94 oC 5 menit), denaturasi (94 oC 1 menit), annealling (55 oC 1 menit), elongation (72 oC 1 menit), dan post-elongation (72 oC 7 menit) sebanyak 30 siklus. Hasil divisualisasi dengan gel elektroforesis. Produk PCR disekuens dan dianalisis dengan menggunakan Basic Local Alignment Search Tool Nucleotide (BLASTN). Data yang diperoleh dibandingkan dengan data GenBank National Centre for Biotechnology Information (NCBI).
HASIL DAN PEMBAHASAN
Hasil
Isolasi dan seleksi bakteri patogen dan biokontrol
10
Gambar 2 Morfologi pupa. Pupa sehat (HPC) (a), Pupa sakit UPC (b)
Seleksi dan uji antagonis bakteri patogen asal pupa ulat sutera emas C. trifenestrata
Terdapat 5 bakteri patogen yang terdiri atas UPC 12, UPC 51, UPC 60, UPC 80a, dan UPC 80b mampu menghemolisa darah. Bakteri hasil isolasi diuji antagonis terhadap bakteri patogen secara in vitro. Bakteri biokontrol ditandai dengan kemampuan membentuk zona bening (Gambar 3). Sebanyak 4 bakteri diperoleh berpotensi sebagai biokontrol. Bakteri biokontrol tersebut terdiri atas UPC 40, UPC 70, UPC 71, dan UPC 72 (Tabel 1).
Gambar 3 Uji antagonis bakteri biokontrol terhadap bakteri patogen secara in vitro. zona bening (a) bakteri patogen (b), dan bakteri biokontrol (c)
Tabel 1 Hasil pengukuran zona hambat bakteri biokontrol terhadap bakteri patogen
No. Kode Bakteri Patogen Kode Bakteri Biokontrol Diameter Zona Hambat (mm)
1. UPC 12 UPC 70 8
UPC 72 2
2. UPC 51 UPC 71 1
UPC 72 1
3. UPC 60 UPC 40 7
UPC 71 8
4. UPC 80a UPC 70 10
UPC 72 3
5. UPC 80b UPC 40 10
UPC 70 4
b b
c
c a
11
Uji patogenisitas bakteri patogen terhadap larva B. mori instar 4
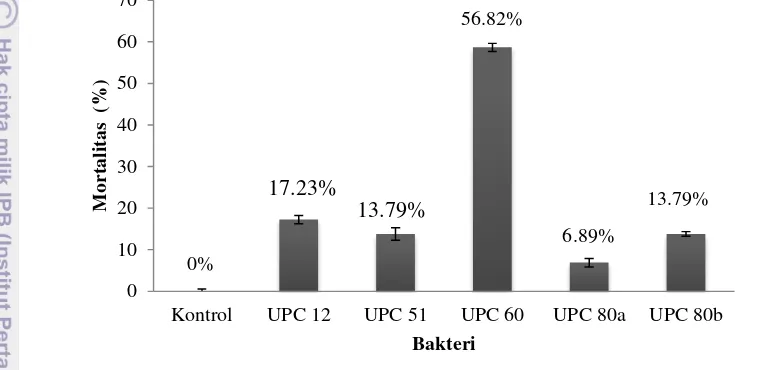
Bakteri patogen UPC 60 diberikan pada larva B. mori instar 4 menyebabkan persentase mortalitas tertinggi yaitu 56.82% (Gambar 4). Larva yang diserang bakteri patogen memiliki ciri-ciri warna kulit berubah menjadi lebih gelap dan tubuh menjadi lunak. Larva B. mori instar 4 mengalami lisis pada jaringan internal. Larva mengeluarkan bau busuk meskipun jaringan integumen masih utuh (Lampiran 3).
Gambar 4 Patogenisitas bakteri patogen usia 24 jam terhadap larva B.mori instar 4 selama 4 hari
Pengamatan usus tengah larva B. mori instar 4 akibat pemberian bakteri patogen
Bakteri patogen berpengaruh terhadap larva B. mori instar 4. Bakteri patogen masuk dalam saluran pencernaan larva. Bakteri patogen menyebabkan kerusakan pada bagian-bagian jaringan usus tengah. Bakteri patogen menyebabkan terjadinya lisis jaringan usus tengah pada saluran pencermaan.
Struktur usus tengah larva kontrol menunjukkan keadaan usus tengah tidak mengalami kerusakan (Gambar 5).
Gambar 5 Sayatan melintang usus tengah larva B. mori kontrol. Keterangan: -membran peritrofik (MP), otot longitudinal (OL), lapisan berotot (ML), sel regeneratif (SR), membran basal (MB) lumen (L)
Kontrol UPC 12 UPC 51 UPC 60 UPC 80a UPC 80b
12
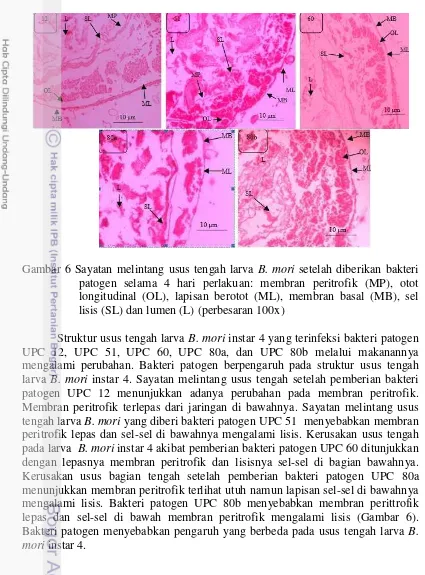
Gambar 6 Sayatan melintang usus tengah larva B. mori setelah diberikan bakteri patogen selama 4 hari perlakuan: membran peritrofik (MP), otot longitudinal (OL), lapisan berotot (ML), membran basal (MB), sel lisis (SL) dan lumen (L) (perbesaran 100x)
Struktur usus tengah larva B. mori instar 4 yang terinfeksi bakteri patogen UPC 12, UPC 51, UPC 60, UPC 80a, dan UPC 80b melalui makanannya mengalami perubahan. Bakteri patogen berpengaruh pada struktur usus tengah larva B. mori instar 4. Sayatan melintang usus tengah setelah pemberian bakteri patogen UPC 12 menunjukkan adanya perubahan pada membran peritrofik. Membran peritrofik terlepas dari jaringan di bawahnya. Sayatan melintang usus tengah larva B. mori yang diberi bakteri patogen UPC 51 menyebabkan membran peritrofik lepas dan sel-sel di bawahnya mengalami lisis. Kerusakan usus tengah pada larva B. mori instar 4 akibat pemberian bakteri patogen UPC 60 ditunjukkan dengan lepasnya membran peritrofik dan lisisnya sel-sel di bagian bawahnya. Kerusakan usus bagian tengah setelah pemberian bakteri patogen UPC 80a menunjukkan membran peritrofik terlihat utuh namun lapisan sel-sel di bawahnya mengalami lisis. Bakteri patogen UPC 80b menyebabkan membran perittrofik lepas dan sel-sel di bawah membran peritrofik mengalami lisis (Gambar 6). Bakteri patogen menyebabkan pengaruh yang berbeda pada usus tengah larva B. mori instar 4.
Uji keefektifan bakteri biokontrol terhadap bakteri patogen pada larva B. mori dan C. trifenestrata
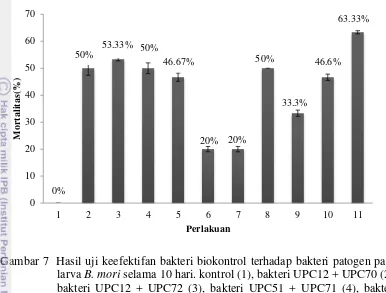
13 Bakteri biokontrol UPC 40 dan UPC 71 yang diberikan terhadap bakteri patogen UPC 60 menyebabkan mortalitas terkecil yaitu 20% (Gambar 7).
Gambar 7 Hasil uji keefektifan bakteri biokontrol terhadap bakteri patogen pada larva B. mori selama 10 hari. kontrol (1), bakteri UPC12 + UPC70 (2), bakteri UPC12 + UPC72 (3), bakteri UPC51 + UPC71 (4), bakteri UPC51 + UPC72 (5), bakteri UPC60 + UPC40 (6), bakteri UPC60 + UPC71 (7), bakteri UPC80a + UPC70 (8), bakteri UPC80a + UPC71 (9), bakteri UPC 80b + UPC 40 (10), dan bakteri UPC80b + UPC70 (11)
Bakteri biokontrol UPC 40, UPC 71 serta bakteri patogen UPC 60 diujikan secara tunggal pada larva B. mori instar 4 selama 10 hari. Bakteri biokontrol diujikan untuk melihat kelayakan sebagai agens pengendali hayati. Bakteri biokontrol UPC 40 dan UPC 71 menyebabkan mortalitas pada larva B. mori instar 4. Mortalitas dapat disebabkan jumlah bakteri biokontrol yang diberikan banyak (108).
14 trifenestrata instar 4 selama 7 hari hingga 100%. Bakteri biokontrol UPC 40 yang diberikan bersama bakteri patogen UPC 60 menurunkan persentase mortalitas menjadi 43.33%. Bakteri biokontrol UPC 71 yang diberikan bersama bakteri patogen UPC 60 menurunkan persentase mortalitas menjadi 56.67% (Gambar 9).
0
Kontrol UPC 60 UPC40 UPC 71 UPC40+UPC60 UPC71+UPC60
M
Kontrol UPC 60 UPC 40 UPC 71 UPC 40+60 UPC 71+60
15
Pengamatan histologi usus tengah larva B. mori dan C. trifenestrata instar 4 setelah perlakuan bakteri biokontrol dan bakteri patogen
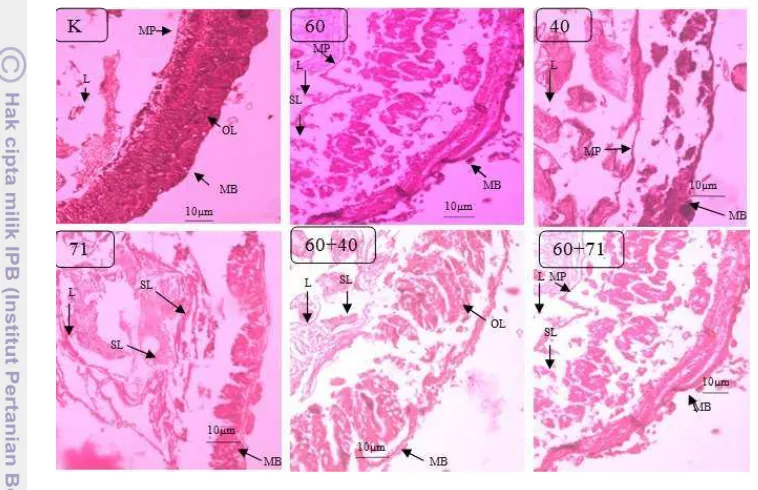
Bakteri biokontrol UPC 40, UPC 71 dan bakteri patogen UPC 60 diberikan secara tunggal pada larva B. mori instar 4 selama 10 hari pengamatan. Usus tengah larva mengalami perubahan setelah pemberian bakteri (Gambar 10).
Gambar 10 Sayatan melintang usus tengah larva B. mori instar 4. Keterangan: membran peritrofik (MP), otot longitudinal (OL), membran basal (MB), sel lisis (SL) dan lumen (L) (perbesaran 100x)
16
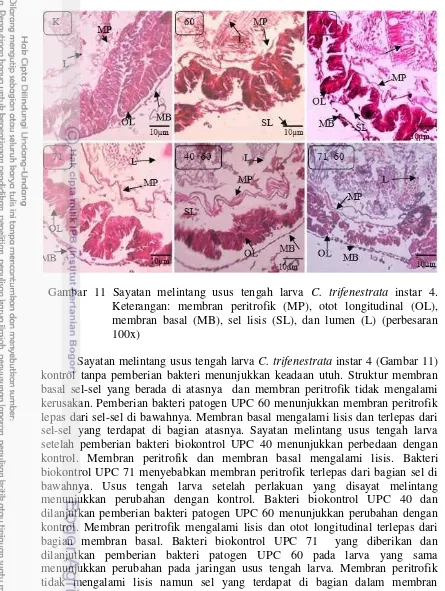
Gambar 11 Sayatan melintang usus tengah larva C. trifenestrata instar 4. Keterangan: membran peritrofik (MP), otot longitudinal (OL), membran basal (MB), sel lisis (SL), dan lumen (L) (perbesaran 100x)
Sayatan melintang usus tengah larva C. trifenestrata instar 4 (Gambar 11) kontrol tanpa pemberian bakteri menunjukkan keadaan utuh. Struktur membran basal sel-sel yang berada di atasnya dan membran peritrofik tidak mengalami kerusakan. Pemberian bakteri patogen UPC 60 menunjukkan membran peritrofik lepas dari sel-sel di bawahnya. Membran basal mengalami lisis dan terlepas dari sel-sel yang terdapat di bagian atasnya. Sayatan melintang usus tengah larva setelah pemberian bakteri biokontrol UPC 40 menunjukkan perbedaan dengan kontrol. Membran peritrofik dan membran basal mengalami lisis. Bakteri biokontrol UPC 71 menyebabkan membran peritrofik terlepas dari bagian sel di bawahnya. Usus tengah larva setelah perlakuan yang disayat melintang menunjukkan perubahan dengan kontrol. Bakteri biokontrol UPC 40 dan dilanjutkan pemberian bakteri patogen UPC 60 menunjukkan perubahan dengan kontrol. Membran peritrofik mengalami lisis dan otot longitudinal terlepas dari bagian membran basal. Bakteri biokontrol UPC 71 yang diberikan dan dilanjutkan pemberian bakteri patogen UPC 60 pada larva yang sama menunjukkan perubahan pada jaringan usus tengah larva. Membran peritrofik tidak mengalami lisis namun sel yang terdapat di bagian dalam membran peritrofik mengalami lisis.
17 patogen UPC 60 dengan jumlah 8.574 CFU/mL menyebabkan mortalitas larva hingga 43.33%. Bakteri patogen UPC 60 dengan konsentrasi 8.27 CFU/mL menyebabkan persentase mortalitas 30% (Gambar 12).
Gambar 12 Kurva letal dosis 50% bakteri patogen UPC 60 terhadap larva B. mori
instar 4 selama 7 hari perlakuan
Penentuan kurva tumbuh dan aktivitas antagonis bakteri terpilih
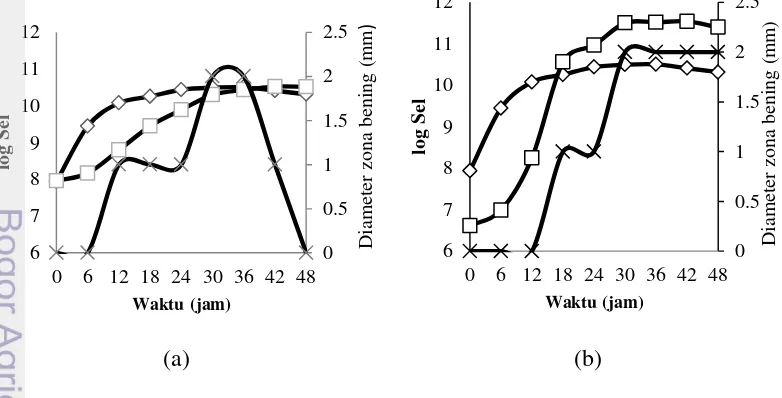
Bakteri biokontrol UPC 40 mengalami fase akhir eksponensial hingga jam ke-24, diikuti dengan fase stasioner hingga jam ke-42 dan mengalami penurunan secara perlahan (Gambar 13). Bakteri biokontrol UPC 71 mengalami fase akhir eksponensial pada jam 30, setelah itu memasuki fase stasioner hingga jam ke-36 dan mengalami penurunan pada jam ke-48. Bakteri patogen UPC 60 pada jam ke-0 hingga jam ke-12 mengalami masa eksponensial, setelah itu masuk fase stasioner pada jam ke-24 hingga jam ke-36.
(a) (b)
18
Pertumbuhan bakteri dapat diamati melalui peningkatan jumlah sel terhadap waktu. Kultur cair bakteri terpilih diukur hingga mencapai densitas 108 dengan menggunakan spektrofotometer dan dipastikan kembali dengan menumbuhkan pada media NA dengan membuat kurva standar (Lampiran 4). Pengujian aktivitas daya hambat bakteri biokontrol UPC 40 terhadap bakteri patogen UPC 60 menghasilkan zona bening 1 mm pada fase logaritmik jam 12 hingga jam ke-24, dan bertambah menjadi 2 mm saat fase stasioner dari jam ke-30 hingga 36. Bakteri biokontrol UPC 71 menunjukkan zona bening berukuran 1 mm pada fase logaritmik pada jam ke-18 hingga jam ke-24 dan bertambah menjadi 2 mm saat fase stasioner pada jam ke-36 hingga jam ke-48.
Identifikasi bakteri terpilih
Sebanyak 2 bakteri biokontrol yaitu UPC 40 dan UPC 71 dipilih berdasarkan kemampuan menghambat bakteri menghambat bakteri patogen secara
in vitro dan in vivo. Bakteri patogen UPC 60 diperoleh berdasarkan kemampuan menyebabkan mortalitas tertinggi. Ketiga isolat tersebut diidentifikasi secara morfologi dan molekuler. Pewarnaan Gram menunjukkan ketiga bakteri terpilih merupakan bakteri Gram negatif berbentuk batang (Gambar 14).
Gambar 14 Hasil pewarnaan Gram UPC 40 (a) UPC 60 (b), dan UPC 71 (c) (perbesaran 1000x)
Bakteri terpilih dilakukan isolasi genom menggunakan kit Genaid. Kualitas Genom DNA dari tiga bakteri terpilih berkisar 1.9-2.0 pada A260/A280 (Lampiran 6). Amplifikasi gen 16S rRNA dari tiga bakteri terpilih menggunakan primer 63F dan 1387R menghasilkan amplikon berukuran sekitar 1300 pb (Gambar 15).
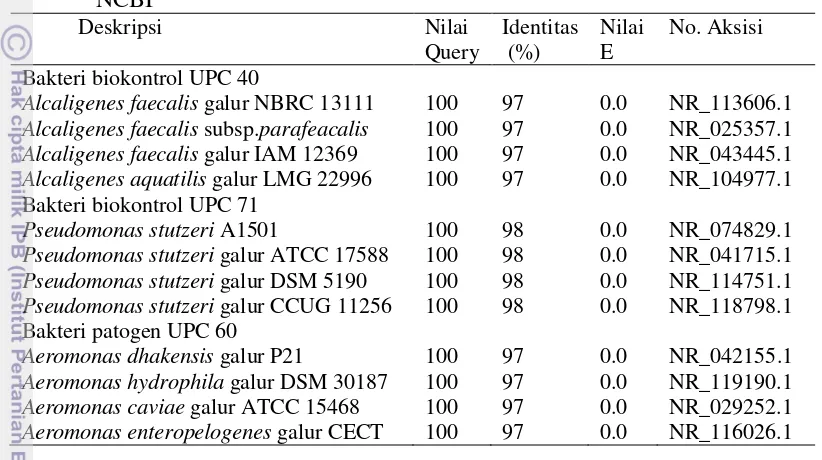
19 Bakteri biokontrol UPC 40 memiliki kemiripan 97% dengan Alcaligenes faecalis berdasarkan identifikasi gen 16S rRNA.Bakteri biokontrol UPC 71 memiliki kemiripan 98% dengan Pseudomonas stutzuri. Bakteri patogen UPC 60 memiliki kemiripan 97% dengan Aeromonas dhakensis (Tabel 2).
Tabel 2 Kesamaan runutan nukleotida bakteri biokontrol UPC 40, UPC 71, dan
Alcaligenes faecalis galur NBRC 13111 100 97 0.0 NR_113606.1
Alcaligenes faecalis subsp.parafeacalis 100 97 0.0 NR_025357.1
Alcaligenes faecalis galur IAM 12369 100 97 0.0 NR_043445.1
Alcaligenes aquatilis galur LMG 22996 100 97 0.0 NR_104977.1
Bakteri biokontrol UPC 71
Pseudomonas stutzeri A1501 100 98 0.0 NR_074829.1
Pseudomonas stutzeri galur ATCC 17588 100 98 0.0 NR_041715.1
Pseudomonas stutzeri galur DSM 5190 100 98 0.0 NR_114751.1
Pseudomonas stutzeri galur CCUG 11256 100 98 0.0 NR_118798.1
Bakteri patogen UPC 60
Aeromonas dhakensis galur P21 100 97 0.0 NR_042155.1
Aeromonas hydrophila galur DSM 30187 100 97 0.0 NR_119190.1
Aeromonas caviae galur ATCC 15468 100 97 0.0 NR_029252.1
Aeromonas enteropelogenes galur CECT 100 97 0.0 NR_116026.1
Hasil sekuens bakteri biokontrol UPC 40, UPC 70 dan bakteri patogen UPC 60 (Lampiran 7) yang diperoleh dari jasa sekuensing disejajarkan serta dikonstruksi pohon filogeninya bersama beberapa sekuen pembanding menggunakan software MEGA 6.0. (Gambar 16).
Gambar 16 Konstruksi pohon filogenetik dari tiga bakteri terpilih berdasarkan amplifikasi gen 16S rRNA
Alcaligenes faecalis subsp. phenolicus strain J UPC 40
20
Pembahasan
Hasil isolasi bakteri diperoleh 104 bakteri asal pupa sehat (Healthy Pupae Cricula, HPC) dan 101 bakteri asal pupa sakit (Unhealthy Pupae Cricula, UPC). Pupa merupakan fase istirahat pada serangga yang bermetamorfosis. Pupa dilindungi oleh kokon (Tikader et al. 2014). Pupa yang sakit dapat disebabkan infeksi saat fase larva. Bakteri berasosiasi dengan serangga dari lingkungan luar ke dalam saluran pencernaan melalui hemoecoel. Bakteri merusak usus tengah sebagai tempat penyerapan nutrisi (Klowden 2002). Saluran pencernaan merupakan organ yang tidak mengalami perubahan pada serangga (Tanada dan Kaya 1993). Bakteri yang masuk saat fase larva dapat menyebabkan mortalitas pada fase pupa.
Hasil seleksi bakteri patogen asal pupa ulat sutera emas diperoleh lima bakteri patogen yang mampu menghemolisis media agar-agar darah. Bakteri patogen mengubah warna media menjadi bening hijau atau biru yaitu bakteri patogen UPC 12, UPC 51, UPC 60, UPC 80a, dan UPC 80b. Media agar-agar darah dibuat dengan menggunakan darah domba (Skalka 1991). Terdapat 3 jenis aktivitas lisis sel darah merah antara lain: 1) alpa hemolisin yaitu hemolisis sebagian ditandai dengan perubahan media darah menjadi biru atau hijau, 2)beta hemolisin yaitu hemolisis sempurna ditandai dengan perubahan warna media darah menjadi bening, dan 3) gamma hemolisin tidak menyebabkan perubahan warna agar-agar darah (Sharma dan Gupta 2014). Bakteri patogen menyebabkan penyakit pada serangga (Tanada dan Kaya 1993).
Uji antagonis menunjukkan terdapat empat bakteri yang menghambat pertumbuhan bakteri patogen yaitu bakteri UPC 40, UPC 70, UPC 71, dan UPC 72. Bakteri umumnya menghasilkan senyawa metabolit sekunder nonesensial untuk bertahan hidup terhadap organisme lain. Bakteri menghasilkan senyawa antibiotik yang menghambat pertumbuhan organisme lain (Chellaram et al. 2012). Kandidat bakteri biokontrol dan bakteri patogen diperoleh dari pupa sakit (UPC). Sebagian besar mikroorganisme hingga saat ini masih belum dapat dikulturkan dalam media buatan di laboratorium (Madigan et al. 2009). Sebanyak 1% dari total seluruh bakteri di lingkungan dapat dikulturkan. Sebanyak 99% bakteri lainnya tidak dapat dikulturkan di laboratorium (Aslam et al. 2010). Bakteri patogen dan biokontrol memerlukan media dan teknik yang tepat untuk menumbuhkannya di laboratorium (Joint et al. 2010; Yeannes et al. 2010; Ulug et al. 2015).
Bakteri biokontrol mengendalikan pertumbuhan bakteri patogen melalui beberapa mekanisme. Bakteri merusak dinding sel sehingga mengakibatkan lisis sel. Bakteri menghambat pertumbuhan dinding sel bakteri yang sedang tumbuh. Bakteri mengubah permeabilitas membran sitoplasma yang menyebabkan kebocoran nutrien di dalam sel. Bakteri menghambat sintesis protein dan asam nukleat dengan cara mendenaturasikan protein dan asam nukleat. Bakteri menghambat kerja enzim intraselular sehingga mengganggu metabolisme sel (Pelczar dan Chan 2008).
21 internal larva dan organ-organ dalam tubuh hancur dan mengeluarkan bau busuk. Bangkai larva lembek, mengkerut, dan mengering meskipun jaringan integumen masih utuh (Tanada dan Kaya 1993).
Bakteri biokontrol diuji terhadap bakteri patogen UPC 60 pada larva sutera
B. mori. Bakteri biokontrol UPC 40 dan UPC 71 mengendalikan pertumbuhan bakteri patogen UPC 60 secara in vivo. Bakteri biokontrol UPC 40 dan UPC 71 menurunkan mortalitas hingga 20%. Formula Abbott mengoreksi angka mortalitas kecil dari 20%. Mortalitas pada kontrol tanpa perlakuan berkisar 5-20% dapat dikoreksi dengan formula Abbott (Abbott 1925; World Health Organization 2013).
Bakteri biokontrol UPC 40 dan UPC 71 mampu menyebabkan mortalitas pada larva C. trifenestrata instar 4. Bakteri biokontrol UPC 40 menyebabkan mortalitas 60% dan bakteri biokontrol UPC 71 menyebabkan persentase mortalitas 46.67%. Beberapa bakteri memiliki sifat patogen fakultatif. Bakteri patogen fakultatif memiliki tingkat patogenisitas yang tergantung jumlah patogen, kondisi lingkungan dan kondisi inang. Tekanan lingkungan mampu mengubah bakteri nonpatogen dalam saluran pencernaan inang menjadi bakteri patogen (Tanada dan Kaya 1993). Bakteri ini disebut patogen oportunistik (Madigan et al. 2009).
Struktur usus tengah larva sutera B. mori setelah pemberian bakteri patogen menunjukkan perubahan. Saluran pencernaan mengalami lisis ditandai dengan keluarnya cairan yang berbau menyengat. Larva yang mati mengalami perubahan warna tubuh menjadi coklat tua hingga hitam. Tubuh larva menjadi lembek dengan integumen yang masih utuh, lalu membengkak, mengeluarkan cairan dan menyusut. Bakteri patogen pada saluran pencernaan mengganggu keseimbangan cairan di dalam sel di saluran pencernaan. Sel-sel mengalami lisis menyebabkan berhentinya aktivitas makan (Tanada dan Kaya 1993; Vega dan Kaya 1993; Zhang et al. 2013).
Bakteri menginfeksi larva melalui mulut dan sistem pencernaan. Bakteri menghasil enzim seperti lecitinase, protease dan kitinase di dalam usus tengah larva. Enzim memampukan bakteri memasuki bagian hemocoel (Tanada dan Kaya 1993). Usus tengah terdiri atas beberapa lapisan sel epitel yang berbeda. Usus tengah berfungsi sebagai tempat penyerapan makanan. Usus tengah menghasilkan enzim-enzim pencernaan (Klowden 2002). Bakteri patogen yang masuk menghasilkan toksin menyebabkan infeksi. Bakteri yang masuk pada bagian
homocoel menyebabkan rusaknya jaringan di dalamnya (Tanada dan Kaya 1993). Kurva tumbuh bakteri biokontrol UPC 40 dan UPC 71 serta bakteri patogen UPC 60 menunjukkan kemampuan aktivitas antagonis terbesar pada fase stasioner. Fase pertumbuhan setiap bakteri memerlukan waktu yang berbeda-beda. Perbedaan ini dipengaruhi beberapa faktor, yaitu sumber energi, sumber karbon, pH, suhu, lingkungan, O2, masa inkubasi, dan sifat organisme tersebut (Pelczar dan Chan 2008).
22
identifikasi standar untuk kelompok bakteri Gram negatif Enterobacter. Kit API 20 NE menunjukkan kemampuan bakteri menggunakan senyawa yang bereaksi positif dalam jalur metabolisme.
Primer 63F dan 1387R digunakan untuk amplifikasi gen 16S rRNA ketiga bakteri terpilih (Marchesi et al. 1998). Ampilifikasi gen 16S rRNA menghasilkan amplikon berukuran 1300 pb. Gen 16S rRNA merupakan parameter baku untuk mengklasifikasikan bakteri. Gen 16S rRNA memiliki daerah yang konservatif dan daerah variatif sehingga dapat membedakan jarak antar taksa (Ntushelo 2013). Primer 63F dan 1387R merupakan primer telah didisain dan dievaluasi untuk amplifikasi gen 16S rRNA pada bakteri (Marchesi et al. 1998). Kemurnian DNA bakteri hasil isolasi diukur menggunakan Nanodrop. Bakteri biokontrol UPC 40, UPC 71 dan bakteri patogen UPC 60 memiliki kemurnian DNA berkisar 1.9-2.0 Kemurnian DNA ditentukan dengan indeks kemurnian berkisar antara 1.8-2.0 (Sambrook dan Russell 2001). Kemurnian DNA yang berada di atas kisaran DNA murni menunjukkan terkontaminasi RNA, sedangkan rasio di bawah 1,8 menunjukkan masih terkontaminasi protein (Yulinery dan Nurhidayat 2015).
Analisis BLASTN dan penyesuaian dengan data di NCBI menunjukkan bahwa bakteri biokontrol UPC 40 berkerabat dekat dengan Alcaligenes faecalis
dengan tingkat kemiripan 97%. Bakteri biokontrol UPC 71 berkerabat dekat dengan Pseudomonas stutzeri dengan tingkat kemiripan 98%. Bakteri UPC 60 berkerabat dekat dengan Aeromonas dhakensis dengan tingkat kemiripan 97%. A. faecalis menghasilkan senyawa antibiotik yang mampu menghambat pertumbuhan bakteri Gram positif dan Gram negatif (Zahir et al. 2013). A. faecalis hasil rekombinan dengan Eschericia coli mampu menghasilkan Penisilin G dalam jumlah yang tinggi (Cheng et al. 2007).
Supernatan sel bakteri Pseudomonas mampu menghambat aktivitas bakteri patogen Vibrio harveyi pada insekta seperti udang (Penaeus monodon) (Vijayan et al. 2006). Bakteri Pseudomonas dapat digunakan sebagai probiotik yang mampu menghambat aktivitas V. Harveyi pada larva P. monodon (Janakiram et al. 2014).
Pseudomonas yang diisolasi dari usus belalang mampu menghambat pertumbuhan bakteri patogen seperti Vibrio parahameolyticus, Candida albicans dan
Escherichia coli (Chellaram et al. 2012). Bakteri Pseudomonas yang diisolasi dari larva nyamuk Anopheles arabiensis berpotensi sebagai agens penyebab mortalitas larva A. Arabiensis (Omoya dan Akinyosoye 2011).
Aeromonas dhakensis merupakan bakteri patogen pada ikan (Rodriguez et al. 2013). Bakteri Aeromonas menghasilkan kitinase dan polifosfat A yang menyebabkan terbentuknya lesi pada kutikula dan saluran pencernaan serangga seperti nyamuk Anopheles annulipes. Bakteri Aeromonas menyebabkan penyakit
23
SIMPULAN DAN SARAN
Simpulan
Hasil isolasi bakteri dari pupa ulat sutera emas Cricula trifenestrata diperoleh 104 bakteri asal pupa sehat (HPC) dan 101 bakteri asal pupa sakit (UPC) yang menghasilkan lima bakteri patogen (UPC 12, UPC 51, UPC 60, UPC 80a, UPC 80b) dan empat bakteri biokontrol (UPC 40, UPC 70, UPC 71, UPC 72).
Bakteri patogen UPC 60 adalah bakteri yang menyebabkan mortalitas tertinggi. Bakteri biokontrol UPC 40 dan UPC 71 merupakan bakteri yang mampu menghambat bakteri patogen UPC 60 secara in vitro dan in vivo. Bakteri biokontrol UPC 71 merupakan bakteri yang lebih baik menurunkan persentase mortalitas dibandingkan bakteri biokontrol UPC 40 pada larva B. mori instar 4. Bakteri biokontrol UPC 40 merupakan bakteri yang lebih baik menurunkan persentase mortalitas dibandingkan bakteri biokontrol UPC 71 pada larva C. trifenestrata instar 4.
Identifikasi gen 16S rRNA menunjukkan bakteri biokontrol UPC 40 memiliki kemiripan 97% dengan Alcaligenes faecalis, biokontrol UPC 71 memiliki kemiripan 98% dengan Pseudomonas stutzuri, dan bakteri patogen UPC 60 memiliki kemiripan 97% dengan Aeromonas dhakensis.
Saran
Bakteri patogen lain, seperti UPC 12, UPC 51, UPC 80a, dan UPC 80b, serta bakteri biokontrol UPC 70 dan 72 perlu diuji terhadap larva C. trifenestrata.
Bakteri biokontrol UPC 40 dan UPC 71 perlu diuji untuk mengetahui keefektifannya terhadap serangga lainnya. Pengujian patogenisitas bakteri patogen UPC 60 terhadap larva C. trifenestrata pada pohon alpukat di lapangan dapat dilakukan dengan menggunakan jaring sebagai penutup tajuk pohon.
24
DAFTAR PUSTAKA
Abbott WS. 1925. A method of computing the effectiveness of an insecticide. J Econ Entomol. 18:265-267.
Ahmed AM, Megeed A, Alqahtani HM. 2014. A novel mosquitocial bacterium as biocontrol agent in Saudi Arabia:II-A promising larvaside agains Culex pipiens mosquito. Pakist J Zoo. 46:773-782.
Amin MR, Ahad MA, Rono MMA, Tithi DA. 2008. Life history traits of Cricula trifenestrata (Lepidoptera: Saturniidae) feeding on Mangifera indica. J Agrofor Environ. 2:1-6.
Andriani TL. 2009. Cricula trifenestrata (Lepidoptera: Saturniidae): perkembangan embrio, penundaan penetasan telur, dan pemecahan dormansi pupa. [tesis]. Bogor: Institut Pertanian Bogor.
Aslam Z, Yasir M, Khaliq A, Matsui k, Chung YR. 2010. Too much bacteria still unculturable. Mini Review Crop Evnit. 1 : 59-60.
Balavenkatasubbaiah M, Chandrasekharan SD, Sharma AR, Narasimha, Nayaka, Bindroo BB. 2014. Disinfection and hygiene technology using asthra and ankush for the management of silkworm diseases. Plant Anil Environ Sci. 4:100-106.
Chellaram C, Venkatesh S, Prem AT, Kuberan G, Alex J, Priya. 2012. Antimicrobial properties of insect gut associated bacteria. World J Med Sci.
7:260-263.
Cheng S, Song Q, Wei D, Gao B. 2007. High-level production penicillin G acylase from Alcaligenes faecalis in recombinant Escherichia coli with optimization of carbon sources. Enz Microb Technol. 41:326–330.
Demir I, Emine E, Zihni D. 2012. A study on the characterization and pathogenicity of bacteria from Lymantria dispar L. (Lepidoptera: Lymantriidae). Turk J Biol. 36:459-468.
Fitriyanti D. 2013. Pengaruh inokulum Bacillus thuringiensis terhadap perubahan struktur histologi usus tengah ulat grayak (Spodoptera Litura F.) [skripsi] Bogor: Institut Pertanian Bogor.
Furry CA. 2012. Sistem produksi dan nilai ekonomi pengusahaan ulat sutera emas (Cricula trifenestrata) di perkebunan jambu mete desa imogiri yogyakarta [skripsi] Bogor : Institut Pertanian Bogor.
Janakiram P, Kumar V, Jayasree L, Sivaprasad B. 2014. Probiotic activity of
Pseudomonas aeruginosa (PIC-4) isolated from visakhapatnam coast, bay of bengal, india, against Vibrio harveyi in Penaeus monodon. Int J. Fish Aqua Stds. 1: 199-207.
Joint I, Muhling M, Querellou J. 2010. Culturing marine bacteria – an essential prerequisite for biodiscovery. Microbiol biotech. 3: 546-575.
Kamilatunisa S. 2011. Pendugaan bobot kulit kokon ulat sutera emas (Cricula trifenestrata h.) [skripsi]. Bogor: Institut Pertanian Bogor.
Khan I. Qamar A. Mehdi SH. Shahid M. 2011. Histopathological effects of
Datura alba leaf extract on the midgut of Periplaneta americana. Biol Med.3 : 260-264.
25 Madigan MT, Martinko JM, Dunlap PV, Clark DP. 2009. Biology of Microorganism. Twelfth Edition. San Francisco (US) : Pearson Education Inc. Benjamin Cumming.
Marchesii JR, Sato T, Weigthman AJ, Martin TA, Fry JC, Hiom SJ, Wade WG. 1998. Design and evaluation of useful bacterium-spesific PCR primers that amplify genes coding for bacterial 16S sRNA. Appl Environ Microbiol. 64:795-799.
Nirupama R. 2014. Screening and identification of silkworm breeds of Bombyx mori L. for their resistant and susceptible against white Muscardine. Munis Entomo Zoo. 9:510-517.
Ntushelo K. 2013. Identifying bacteria and studying bacterial diversity using the 16S ribosomal RNA gene-based sequencing techniques: A review. Afr J Microb Res. 7:5533-5540.
Omoya FO, Akinyosoye FA. 2011. Evaluation of larvicidal potency of some entomopathogenic bacteria isolated from insect cadavars on Anopheles arabiensis larvae in Nigeria. Int J Pharm Biomed Res.2 : 145-148
Pelczar MJ Jr, Chan EC. 2008. Dasar-Dasar Mikrobiologi. Volume 1. Hadioetomo RS, Imas T, Tjitrosomo SS, Angka SL, penerjemah. Jakarta (ID): UI Pr.
Prihatin J, Situmorang J. 2001. Pakan buatan menggunakan daun jambu mete untuk ulat sutera emas Cricula trifenestrata helf (Lepidoptera : Saturniidae). Teknosains. 14 : 397-408.
Rodriguez SAS, Cabanillas R, Alcaraz1 U, Gomez B, Romalde. 2013. Identification and virulence of Aeromonas dhakensis, Pseudomonas mosselii and Microbacterium paraoxydans isolated from nile tilapia,
Oreochromis niloticus, cultivated in Mexico. Appl Microbiol. 115 : 654-662.
Rojak A. 2001. Teknik pengamatan kemampuan makan hama Cricula trifenestrta
Helf. pada daun jambu mete. Bul Tek Pertan. 7:18-20.
Rono MMA, Ahad MA, Hasan MS, Uddin MF, Islam AKMN. 2008.
Morphometrics measurement of mango defoliator Cricula trifenestrata
(f.Lepidotera: Saturniidae). Int J Sust Crop Prod. 3 : 45-48.
Sambrook J, Russell DW. 2001. Molecular Clonning: A Laboratory Manual. 3rd New York (US): Cold-Spring Harbor Laboratory Pr.
Sezen K, Demir I, Demirbag Z. 2004. Study of the bacterial flora as a biological control agent of Agelastica alni L. (Coleoptera: Chrysomelidae). Biol Bratis. 59: 327-331.
Shaekh MPE, Mondol A, Islam MM, Kabir AS, Saleh MA, Salah UM, Hoque KMF, Ekram AE. 2013. Isolation, characterization and identification of an antagonistic bacterium from Paneus monodon. Int J Sci Eng Res. 4 : 254-261.
Sharma R, Gupta A. 2014. Differentiation of oral streptococcal species by haemolysis in blood agar medium in vitro. Int J Eng Adv Techno. 3 : 143-144.
26
Sudaryanto. 1986. Biologi ulat kipat Cricula trilenestrata helf. (Lepidoptera: Saturniidae pada tanaman alpukat (Persea americana mill. 1.) [tesis]. Bogor: Institut Pertanian Bogor.
Suriana. 2011. Morfometri dan keragaman genetik ulat sutera liar Cricula trifenestrata (Lepidoptera: Saturniidae) [tesis]. Bogor: Institut Pertanian Bogor.
Tanada Y, Kaya HK. 1993. Insect Pathology. San Diego (US) : Academic Pr. Tikader A, Vijayan K,
Saratchandra B. 2014. C
ricula trifenestrata (helfer)(lepidoptera: saturniidae) - a silk producing wild insect in india. Trop lepid res. 24: 22-29.
Triplehon CA, Jhonson NE. 2005. Borror and delongs Introduction to the Study of Insect. Edisi ke-7. Washington DC (US): Thomson Brooks Cole.
Ulug D, Hazir C, Hazir S. 2015. A new and simple technique for the isolation of symbiotic bacteria associated with entomopathogenic nematodes (Heterorhabditidae and Steinernematidae). Turk J. Zoo. 39: 365-367. Vega FE, Kaya HK. 1993. Insect Pathology. Oxford (GB) : Elsevier Inc.
Vijayan KK, Singh ISB, Jayaprakash NS, Alavandi SV, Pai SS , Preetha R,
Rajan JJS, Santiago TC. 2006. A brackishwater isolate of Pseudomonas
PS-102, a potential antagonistic bacterium against pathogenic vibrios in penaeid and non-penaeid rearing systems. Aquaculture 251 : 192–200. Yeannes I, Ameztoy IM, Ramirez EE, Felix MM. 2010. Culture alternative
medium for the growth of extreme halophilic bacteria in fish products.
Cienc Tecnol Aliment Campinas. 31: 561-566
Yulinery T, Nurhidayat N. Uji aktivitas antibakteri Lactobacillus plantarum
terseleksi dari buah markisa (Passiflora edulis) dan kaitannya dengan gen plantarisin A (plnA). Pros Sem Nas Masy Biodiv Indones. 1: 270-277. [WHO] World Health Organization. 2013. Test procedures for insecticide
resistance monitoring in malaria vector mosquitoes .[diunduh 11 Sept 2015]; tersedia pada http://apps.who.int/iris/bitstream/10665/80139/1/97 89 241505154_eng.pdf.
Zahir I, Houari A, Bahafid W, Iraqui M, Ibnsouda S. 2013. A novel Alcaligenes faecalis antibacterial-producing strain isolated from a Moroccan tannery waste. Afr J Microbiol Res. 7:5314-5323.
27
LAMPIRAN
Lampiran 1 Identifikasi morfologi 104 koloni bakteri asal pupa sehat (HPC) No Kode
Isolat
Pengamatan Morfologi
29
Lampiran 2 Identifikasi morfologi 101 koloni bakteri asal pupa sakit (UPC) No Kode
Isolat
Pengamatan Morfologi
31
Lampiran 3 Hasil uji patogenisitas bakteri patogen terhadap larva B. mori instar 4
Kerusakan pada larva B. mori instar 4 setelah pemberian bakteri patogen (a) organ rusak (b) warna kehitaman (c) cairan berwarna putih
Lampiran 4 Kurva standar bakteri biokontrol UPC 40, UPC 71, dan bakteri patogen UPC 60
32
Kurva standar bakteri biokontrol UPC 71 Jumlah
33 Lampiran 5 Hasil uji fisiologi dengan Kit API 20 NE bakteri biokontrol UPC 40,
UPC 71, dan bakteri patogen UPC 60
Hasil uji fisiologi dengan Kit API 20 NE bakteri biokontrol UPC 40
No Uji Hasil
Hasil uji fisiologi dengan Kit API 20 NE bakteri UPC 71
34
Hasil uji fisiologi dengan Kit API 20 NE bakteri UPC 60
No Uji Hasil
Keterangan: (+) = reaksi positif, dan (-) = reaksi negatif
Lampiran 6 Hasil kuantitas DNA bakteri biokontrol UPC 40, UPC 71 dan
Lampiran 7 Hasil runutan nukleotida bakteri biokontrol UPC 40, UPC 71, dan bakteri patogen UPC 60
Runutan Nukleotida bakteri biokontrol UPC 40 Forward
35
Runutan nukleotida bakteri biokontrol UPC 40 Reverse
NNNGNGCACCGCGACTTCTGATCCGCGATTACTAGCGATTCCGACTTC
Runutan nukleotida bakteri biokontrol UPC 71 Forward