AKTIVITAS EKSTRAK BUAH BAKAU MERAH
(
Rhizophora stylosa
Griff.) SEBAGAI ANTIDIARE SECARA
IN VITRO
ANNISA WULANDARI
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Aktivitas Ekstrak Buah Bakau Merah (Rhizophora stylosa Griff.) sebagai Antidiare secara In Vitro adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dan karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2014
Annisa Wulandari NIM C34100056
ABSTRAK
ANNISA WULANDARI. Aktivitas Buah Bakau Rhizophora stylosa Griff. sebagai Antidiare secara In Vitro. Dibimbing oleh SRI PURWANINGSIH dan KUSTIARIYAH TARMAN
Diare merupakan masalah kesehatan utama yang disebabkan oleh bakteri. Buah bakau (R. stylosa) telah banyak dimanfaatkan oleh masyarakat sebagai obat tradisional. Penelitian ini bertujuan mengetahui efektivitas dan daya hambat ekstrak buah bakau (R. stylosa) terhadap bakteri penyebab diare. Metode penelitian yang digunakan adalah metode sumur agar. Hasil penelitian menunjukkan bahwa rendemen ekstrak metanol merupakan rendemen tertinggi dari ekstrak lainnya dengan nilai 3,45%. Ekstrak metanol memiliki aktivitas antibakteri tertinggi dengan diameter zona hambat sebesar 1-14 mm. Konsentrasi hambat minimum (KHM) bakteri Escherichia coli sebesar 0,5 mg/mL, Staphylococcus aureus sebesar 0,2 mg/mL, Pseudomonas aeruginosa dan Salmonella typhimurium masing–masing sebesar 0,7 mg/mL. Komponen aktif yang terkandung dalam ekstrak metanol adalah alkaloid, tanin, saponin, fenol hidrokuinon, flavonoid, dan triterpenoid. Bioautografi aktivitas antibakteri terhadap bakteri uji E. coli menghasilkan fraksi aktif pada nilai Rƒ 0,64 dan 0,39 sedangkan pada S. aureus nilai Rƒ sebesar 0,64 dan 0,41. Hasil identifikasi dengan pereaksi Dragendorff menunjukkan senyawa tersebut merupakan golongan senyawa alkaloid.
Kata kunci: antibakteri, antidiare, buah bakau (R. stylosa)
ABSTRACT
ANNISA WULANDARI. Activity of Rhizophora stylosa Griff. Fruit Extracts as Antidiarrhea Using In Vitro Method. Supervised by SRI PURWANINGSIH and KUSTIARIYAH TARMAN
Diarrhea is major health problem caused by bacteria. Fruits of Rhizophora stylosa have been widely used as folk medicine. This research was conducted to determine effectivity and inhibitory of Rhizophora stylosa fruit extract against diarrhea-causing bacteria. Antibacterial activity was tested using agar well diffusion method. The highest yield of the R. stylosa extract was 3.45% (methanol extract). Methanol extract showed the most active antibacterial activity with diameter inhibition zone of 1-14 mm. Minimum inhibitory concentration (MIC) of the extract was against E. coli 0.5 mg/mL, S. aureus 0.2 mg/mL, P. aeruginosa and S. typhimurium contained 0.7 mg/mL. The active compounds detected in methanol extract were alkaloid, tannins, saponin, flavonoid, phenol hydroquinone, and triterpenoid. Bioautography of antibacterial activity E. coli revealed the active fractions with Rƒof 0.64 and 0.39 while against S. aureus with Rƒof 0.64 and 0.41. Preliminary identication using Dragendorff reagent detected the active compound was alkaloid.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada
Departemen Teknologi Hasil Perairan
ANNISA WULANDARI
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
2014
AKTIVITAS EKSTRAK BUAH BAKAU MERAH
KATA PENGANTAR
Puji dan syukur penulis panjatkan kepada Allah SWT yang telah memberikan rahmat dan hidayah-Nya sehingga penulis dapat menyelesaikan skripsi dengan judul Aktivitas Ekstrak Buah Bakau Rhizophora stylosa Griff. sebagai Antidiare secara In Vitro.
Penulis mengucapkan terimakasih kepada semua pihak yang telah membantu dalam proses penulisan karya ilmiah ini, terutama kepada:
1. Dr Ir Sri Purwaningsih, MSi dan Dr Kustiariyah Tarman, SPi, MSi selaku dosen pembimbing dan pengarahan yang diberikan kepada penulis
2. Dr Desniar, SPi, MSi selaku dosen penguji atas segala masukan yang diberikan kepada penulis
3. Dr Ir Iriani Setyaningsih, MS selaku Ketua Program Studi Teknologi Hasil Perairan
4. Prof Dr Ir Joko Santoso, MSi selaku Ketua Departemen Teknologi Hasil Perairan
5. Ibu, Ayah, Kakak dan adik yang telah mendoakan dan memberikan motivasi
6. Ibu Ema Masruroh SSi, Dini Indriani AMd, Saeful Bahri AMd, dan Bapak Eman yang telah membantu penulis selama penelitian di Laboratorium 7. Teman Laboratorium Mikrobiologi dan Biokimia (Risvan, Mahisha, Dhio,
Indah, Fajri, Lolita, Feky, Nia, dan Laela), Abdul Rohim, keluarga besar THP 47, THP 48, dan THP 49 atas segala bantuan, doa, semangat, dan dukungan yang telah diberikan.
Penulis menyadari bahwa karya ilmiah ini masih memiliki kekurangan. Penulis mengharapkan saran dan kritik yang bersifat membangun untuk perbaikan. Semoga karya ilmiah ini dapat bermanfaat bagi semua pihak yang memerlukannya.
Bogor, 25 Juni 2014
DAFTAR ISI
DAFTAR TABEL... ii
DAFTAR GAMBAR... ii
DAFTAR LAMPIRAN... ii
PENDAHULUAN... 1
Latar Belakang ... 1
Perumusan Masalah ... 2
Tujuan Penelitian... 2
Manfaat Penelitian ... 2
Ruang Lingkup Penelitian ... 3
METODE PENELITIAN... 3
Bahan ... 3
Alat ... 4
Prosedur Penelitian ... 4
Karakterisasi Buah Bakau Merah (Rhizophora stylosa)... 5
Ekstraksi Buah Bakau Merah (Rhizophora stylosa)... 6
Prosedur Analisis... 6
Pengujian Ekstrak Terpilih... 8
Rancangan Percobaan ... 10
HASIL DAN PEMBAHASAN... 12
Karakteristik Buah Bakau Merah (Rhizophora stylosa) ... 12
Komposisi Kimia Buah Bakau Merah (Rhizophora stylosa)... 13
Ekstrak Buah Bakau Merah (Rhizophora stylosa) ... 14
Aktivitas Antibakteri Ekstrak Buah Bakau Merah (Rhizophora stylosa)... 15
Konsentrasi Hambat Minimum ... 17
Fraksi Aktif Ekstrak Buah Bakau Merah (Rhizophora stylosa) ... 19
Pengujian Fitokimia Ekstrak Buah Bakau (Rhizophora stylosa) ... 22
KESIMPULAN DAN SARAN... 24
Kesimpulan ... 24
Saran ... 24
DAFTAR PUSTAKA... 24
LAMPIRAN... 29
DAFTAR TABEL
1 Pengukuran morfometrik buah bakau (R. stylosa) ... 12
2 Komposisi kimia buah bakau (R. stylosa) segar ... 13
3 Rendemen ekstrak buah bakau (R. stylosa) ... 14
4 Hasil uji Konsentrasi Hambat Minimum ekstrak buah bakau ... 18
5 Konsentrasi Hambat Minimum selama 24 jam pengamatan ... 18
6 Konsentrasi Hambat Minimum antidiare ... 19
7 Hasil uji fitokimia ekstrak kasar buah bakau (R. stylosa) ... 22
DAFTAR GAMBAR
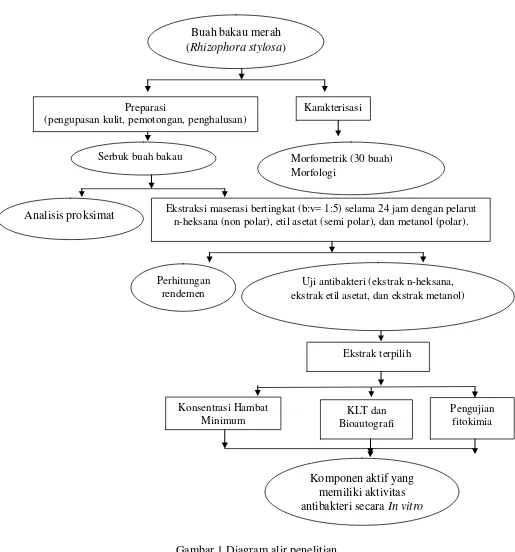
1 Diagram alir penelitian ... 5
2 Pengukuran morfometrik buah bakau... 12
3 Hasil uji antibakteri ekstrak buah bakau merah (R. stylosa) terhadap bakteri penyebab diare ( ) metanol 0,5 mg/mL, ( ) metanol 1 mg/mL, ( ) metanol 2mg/mL, ( ) etil asetat 0,5 mg/mL, ( ) etil asetat 1 mg/mL, ( ) etil asetat 2 mg/mL, ( ) n-heksana 0,5 mg/mL, ( ) n-heksana 1 mg/mL, ( ) n-heksana 2 mg/mL ... 16
4 Kromatogram ekstrak metanol (eluen kloroform:metanol (6:4)) ... 20
5 Kromatogram ekstrak metanol setelah penyemprotan ... 21
6 Profil bioautografi ... 21
DAFTAR LAMPIRAN
1 Tabel analisis ragam ... 312 Tabel uji Duncan jenis ekstrak ... 31
3 Tabel uji Duncan jenis bakteri ... 31
4 Hasil uji normalitas... 32
5 Perhitungan analisis proksimat buah bakau ... 32
6 Data zona hambat ekstrak metanol buah bakau Rhizophora stylosa... 33
7 Data zona hambat ekstrak etil asetat buah bakau Rhizophora stylosa ... 33
8 Data zona hambat ekstrak N-heksana buah bakau Rhizophora stylosa... 33
9 Hasil uji fitokimia ... 34
10 Hasil uji aktivitas antidiare ekstrak buah bakau (R. stylosa) dengan pelarut metanol terhadap mikroorganisme uji... 35
11 Hasil uji aktivitas antidiare ekstrak buah bakau (R. stylosa) dengan pelarut etil asetat terhadap mikroorganisme uji ... 36
12 Hasil uji aktivitas antidiare ekstrak buah bakau (R. stylosa) dengan pelarut N-heksana terhadap mikroorganisme uji ... 37
13 Pengujian KHM ekstrak metanol terhadap mikroorganisme uji ... 38
PENDAHULUAN
Latar Belakang
Tanaman mangrove merupakan sekelompok jenis tanaman hijau berkayu yang tumbuh pada daerah pasang surut dan toleran terhadap kadar garam yang tinggi (Mouafi et al. 2014). Aplikasi penggunaan tanaman mangrove dalam kehidupan sehari-hari sudah cukup luas. Salah satu kegunaan tanaman mangrove yang sudah banyak digunakan oleh masyarakat pesisir yaitu sebagai sumber bahan obat.
Sejauh ini penelitian mengenai ekstrak tanaman mangrove telah banyak dilakukan sebagai antioksidan dan antibakteri. Antibakteri merupakan sifat dari suatu bahan yang menunjukkan efek penghambatan terhadap pertumbuhan bakteri. Menurut Pimpliskar et al. (2011), tanaman mangrove Rhizophora apiculata dan Rhizophora mucronata mengandung banyak metabolit sekunder seperti steroid, triterpenoid, saponin, flavonoid, alkaloid dan tanin.
Metabolit sekunder inilah yang berperan penting sebagai senyawa antibakteri. Salah satu aplikasi dari pemanfaatan senyawa antibakteri dalam kehidupan sehari-hari adalah obat diare. Tanaman yang dapat digunakan untuk pengobatan penyakit diare salah satunya adalah buah bakau (Rhizophora stylosa).
Salah satu harapan sumber alternatif antidiare alami baru adalah buah bakau merah (Rhizophora stylosa). Rhizophora stylosa umumnya dikenal sebagai tanaman bakau merah yang diklasifikasikan ke dalam famili Rhizophoraceae. Tanaman ini dapat tumbuh hingga mencapai ketinggian 10 m dengan diameter batang 10-15 cm, buah yang dihasilkan berwarna merah kecoklatan dengan lentisel banyak dan menyebar. Tanaman ini juga toleran terhadap substrat berpasir dan banyak ditemukan pada daerah pasang surut air laut, khususnya di Indonesia. Tanaman bakau Rhizophora stylosa sangat efektif untuk menahan abrasi pantai dan mudah tumbuh di daerah mangrove. Jenis ini sangat mudah tumbuh dan dikembangkan (FAO 2000).
Penelitian mengenai senyawa turunan flavonoid dari Rhizophora stylosa dan aktivitas antioksidan dengan metode DPPH telah dilaporkan Li et al. (2007). Mouafi et al. (2014) menyatakan bahwa ekstrak daun Rhizophora stylosa berpotensi dalam menghambat pertumbuhan bakteri dan fungi. Hasil penelitian Mouafi et al. (2014) juga menyatakan bahwa komponen aktif yang terdapat di dalam ekstrak daun Rhizophora stylosa terdiri dari senyawa fenolik, flavonoid, alkaloid, steroid, terpenoid, tanin dan glikosida.
Diare merupakan suatu jenis penyakit yang disebabkan oleh infeksi bakteri. Menurut Meite et al. (2009), diare adalah perubahan yang terjadi di dalam pergerakan usus yang normal yang ditandai oleh meningkatnya kadar air, volume atau frekuensi defekasi yang disertai dengan perubahan konsistensi feses. Menurut Enda (2009), bakteri penyebab diare diantaranya adalah Campylobacter, Shigella sp., Salmonella sp., Pseudomonas aeruginosa, dan jenis Eschericia coli tertentu .
penggunaan β-laktam secara kontinu menyebabkan terjadinya efek samping berupa resistensi bakteri terhadap antibiotik tersebut. Efek dari resistensi bakteri ini akan menyebabkan penderita diare menjadi lebih sulit untuk diobati. Berdasarkan alasan tersebut, maka perlu dilakukan usaha penggantian antidiare sintetik menjadi antidiare alami.
Hasil penelitian ini diharapkan dapat memberikan informasi ilmiah mengenai khasiat antibakteri buah bakau merah (Rhizophora stylosa) serta dapat dijadikan dasar pengembangan tanaman buah bakau menjadi produk obat yang dapat dipakai secara luas oleh masyarakat.
Perumusan Masalah
Buah bakau spesies Rhizophora stylosa selama ini pemanfaatannya masih kurang optimal, padahal stoknya sangat berlimpah sepanjang tahun. Salah satu bentuk pemanfaatan buah bakau jenis R. stylosa oleh masyarakat pesisir adalah sebagai obat. Hal ini menimbulkan dugaan bahwa buah bakau jenis R. stylosa mengandung senyawa komponen aktif yang berperan sebagai obat, sehingga buah bakau jenis R. stylosa perlu diteliti dan diharapkan berpotensi sebagai antibakteri alami yang bisa dimanfaatkan masyarakat.
Tujuan Penelitian
Tujuan umum dari penelitian ini adalah untuk menentukan aktivitas antidiare dari tanaman bakau merah (Rhizophora stylosa) secara in vitro. Tujuan khusus yang ingin dicapai adalah mendapatkan ekstrak metanol, etil asetat dan n-heksana dari buah bakau merah (Rhizophora stylosa), menentukan rendemen dari ekstrak metanol, ekstrak etil asetat, dan ekstrak n-heksana buah bakau merah (Rhizophora stylosa), menentukan komponen aktif yang terkandung dalam ekstrak buah bakau merah (Rhizophora stylosa) melalui uji fitokimia, menentukan efektivitas dan daya hambat dari ekstrak buah bakau merah (Rhizophora stylosa) sebagai antidiare, serta menentukan Konsentrasi Hambat Minimum (KHM) penggunaan buah bakau merah (Rhizophora stylosa) sebagai antidiare secara in vitro, dan menentukan fraksi aktif ekstrak buah bakau (Rhizophora stylosa).
Manfaat Penelitian
Ruang Lingkup Penelitian
Ruang lingkup penelitian ini adalah kajian antibakteri dari buah bakau (Rhizophora stylosa) sebagai antidiare alami secara in vitro. Penelitian dilakukan dalam lima tahap. Tahap pertama yaitu karakterisasi yang terdiri dari morfometrik dan morfologi, tahap kedua yaitu preparasi untuk mendapatkan serbuk buah bakau, tahap ketiga yaitu ekstraksi dengan maserasi bertingkat, tahap keempat yaitu prosedur analisis yang terdiri dari analisis proksimat dan pengujian aktivitas antibakteri, dan tahap kelima adalah pengujian dari ekstrak terpilih yang terdiri dari konsentrasi hambat minimum, kromatografi lapis tipis dan bioautografi, dan pengujian fitokimia.
METODE PENELITIAN
Penelitian dilaksanakan pada bulan Januari hingga bulan Mei 2014. Penelitian ini dilaksanakan di Laboratorium Pengembangbiakan dan Genetika Ikan, Departemen Budidaya Perairan, Laboratorium Karakteristik Bahan Baku Hasil Perairan, Laboratorium Biokimia Hasil Perairan, Laboratorium Mikrobiologi Hasil Perairan, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Proses evaporasi ekstrak dilakukan di Laboratorium Uji Biofarmaka Pusat Studi Biofarmaka dan Laboratorium Kimia Analitik, Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam. Proses Identifikasi Rhizophora stylosa dilakukan di Herbarium Bogoriense, Lembaga Ilmu Pengetahuan Indonesia Pusat Penelitian Biologi, Cibinong.
Bahan
Alat
Alat-alat yang digunakan dalam penelitian ini meliputi timbangan analitik, blender, orbital shaker, vacuum rotator evaporator, oven, vortex, labu kjehdahl, autoklaf (Yamato SM 52 Autoclave), spektrofotometer, Laminar Air Flow (Thermo Scientific 1300 Series A2), inkubator (Thermolyne type 42000 Incubator), gelas ukur, labu Erlenmeyer, alumunium foil, kertas saring, tabung reaksi, rak tabung reaksi, pipet tetes, sudip, corong, timbangan, kertas saring, cawan petri, mikro pipet, pinset, ose, lemari pendingin, kapas, plat silika F254 60, dan eluen kloroform:metanol (6:4).
Prosedur Penelitian
Penelitian dilakukan dalam lima tahap. Tahap pertama yaitu karakterisasi yang terdiri dari morfometrik dan morfologi, tahap kedua yaitu preparasi untuk mendapatkan serbuk buah bakau, tahap ketiga yaitu ekstraksi dengan maserasi bertingkat, tahap keempat yaitu prosedur analisis yang terdiri dari analisis proksimat dan pengujian aktivitas antibakteri, dan tahap kelima adalah pengujian dari ekstrak terpilih yang terdiri dari pengujian konsentrasi hambat minimum, kromatografi lapis tipis dan bioautografi, dan pengujian fitokimia.
Karakterisasi dimulai dari pengukuran morfometrik dan morfologi. Sebanyak 30 buah sampel buah bakau diukur panjang, lebar, dan bobotnya. Preparasi dilakukan dengan cara dikupas, dipotong-potong dan diblender untuk mendapatkan serbuk buah bakau. Serbuk halus yang sudah siap kemudian digunakan untuk analisis proksimat (AOAC 2005) dan ekstraksi maserasi bertingkat (Harborne 1987 yang dimodifikasi) menggunakan pelarut n-heksana (non polar), etil asetat (semi polar), dan metanol (polar), dengan perbandingan 1:5 (b:v) selama 24 jam. Ekstrak kemudian difiltrasi dengan kertas saring. Filtrat yang dihasilkan dihilangkan pelarutnya dengan rotary vaccum evaporator pada suhu 40°C.
Gambar 1 Diagram alir penelitian
Karakterisasi Buah Bakau Merah (Rhizophora stylosa)
Tahap karakterisasi buah bakau meliputi preparasi dan pengukuran morfometrik. Sampel buah bakau merah (R. stylosa) diambil dari kawasan Konservasi Hutan Mangrove di daerah Pulau Untung Djawa.
Pengukuran morfometrik sampel buah bakau dilakukan terhadap 30 buah bakau merah (R. stylosa) yang meliputi pengukuran panjang (panjang total dan panjang hipokotil), lebar, dan bobot (bobot total dan bobot hipokotil).
Komponen aktif yang memiliki aktivitas antibakteri secara In vitro Konsentrasi Hambat
Minimum
Buah bakau merah (Rhizophora stylosa)
Karakterisasi Preparasi
(pengupasan kulit, pemotongan, penghalusan)
Morfometrik (30 buah) Morfologi
Serbuk buah bakau
Analisis proksimat Ekstraksi maserasi bertingkat (b:v= 1:5) selama 24 jam dengan pelarut n-heksana (non polar), etil asetat (semi polar), dan metanol (polar).
Perhitungan rendemen
Uji antibakteri (ekstrak n-heksana, ekstrak etil asetat, dan ekstrak metanol)
Ekstrak terpilih
KLT dan Bioautografi
Ekstraksi Buah Bakau Merah (Rhizophora stylosa)
Sampel yang sudah diukur morfometriknya selanjutnya dikupas, dipotong-potong dan diblender untuk mendapatkan serbuk buah bakau yang selanjutnya akan diekstraksi (Harborne 1987 yang dimodifikasi). Masing-masing ekstrak yang diperoleh, ditimbang beratnya. Persentase rendemen ekstrak buah bakau merah dapat dihitung dengan rumus:
Rendemen % = Berat ekstrak (g)
Berat sampel (g) × 100%
Prosedur Analisis
Prosedur analisis meliputi pengujian aktivitas antibakteri, analisis proksimat, kromatografi lapis tipis dan bioautografi, dan pengujian fitokimia.
Pengujian aktivitas antibakteri
Metode penelitian yang digunakan adalah metode eksperimental yang dilakukan secara in vitro menggunakan uji sensitivitas antibakteri dengan metode sumur agar. Hal ini dilakukan untuk mengetahui konsentrasi minimal dari suatu larutan antibakteri yang dapat menghambat pertumbuhan bakteri penyebab diare. Parameter uji yang diamati adalah diameter zona hambat (mm) dari masing-masing perlakuan ekstrak Rhizophora stylosa. Langkah yang dilakukan meliputi persiapan bakteri uji melalui peremajaan bakteri dan kultur bakteri. Kultur bakteri yang telah disiapkan kemudian digunakan dalam pengujian aktivitas antidiare menggunakan metode sumur agar.
(1) Peremajaan bakteri uji (Kusmiyati dan Agustini 2007)
Media yang digunakan adalah Nutrient Agar (NA). Media dilarutkan dalam aquades dan dipanaskan hingga larut sempurna, lalu dimasukkan ke dalam tabung reaksi sebanyak 4 mL dan disterilkan dalam autoklaf pada suhu 121 oC dengan tekanan 1 atm selama 15 menit. Tabung dimiringkan dan didiamkan hingga memadat. Sejumlah 1 ose biakan bakteri uji (E. coli, S. aureus, P. aeruginosa, dan S. typhimurium) diinokulasi ke dalam media regenerasi kemudian diinkubasi pada suhu 37 oC selama 24 jam.
(2) Kultur bakteri uji (Kusmiyati dan Agustini 2007)
Mikroorganisme (E. coli, S. aureus, P. aeruginosa, S. typhimurium) yang segar diinokulasikan sebanyak 1 ose ke media NB, diinkubasi pada suhu 37 ºC selama 18-24 jam. Kultur bakteri diukur kekeruhannya secara turbidimetri dengan menggunakan spektrofotometer pada panjang gelombang 600 nm hingga mencapai OD 0,5-0,8.
(3) Pengujian aktivitas senyawa antidiare buah bakau merah terhadap bakteri uji (Moorty et al. 2007)
Media MHA yang mengandung bakteri uji dihomogenisasi menggunakan vortex kemudian dituang pada cawan petri steril secara aseptis. Media agar yang telah memadat kemudian dibuat lubang dengan pipet Pasteur steril sebanyak 5 lubang dengan diameter 6 mm. Konsentrasi ekstrak buah bakau merah yang dimasukkan ke dalam lubang yaitu 0,5 mg/sumur, 1 mg/sumur, dan 2 mg/sumur. Perlakuan kontrol positif yaitu menggunakan antibiotik kloramfenikol dengan konsentrasi 15 mg dan perlakuan kontrol negatif menggunakan pelarut yang merupakan pelarut dari masing-masing ekstrak sebanyak 20 µL. Cawan petri diinkubasi pada suhu 37ºC selama 24 jam dan dilakukan pengukuran diameter zona hambat yang terbentuk di sekeliling lubang menggunakan penggaris. Aktivitas antidiare dinyatakan positif apabila terbentuk zona bening di sekeliling sumur dan aktivitas antidiare dinyatakan negatif apabila tidak terbentuk zona bening.
Analisis Proksimat
(1) Analisis kadar air (AOAC 2005)
Analisis kadar air dilakukan dengan mengeringkan cawan porselen dalam oven pada suhu 105oC selama 1 jam. Cawan tersebut diletakkan ke dalam desikator (kurang lebih 15 menit) dan dibiarkan sampai dingin kemudian ditimbang. Cawan tersebut ditimbang kembali hingga beratnya konstan. Sebanyak 5 gram sampel dimasukkan ke dalam cawan tersebut, kemudian dikeringkan dengan oven pada suhu 105oC selama 5 jam atau hingga beratnya konstan. Cawan tersebut kemudian dimasukkan ke dalam desikator dan dibiarkan sampai dingin dan selanjutnya ditimbang kembali.
Perhitungan kadar air:
Kadar air (%) =Berat contoh awal (gram)−Berat contoh akhir (gram)
Berat contoh awal (gram) × 100%
(2) Analisis kadar abu (AOAC 2005)
Cawan abu porselen dibersihkan dan dikeringkan di dalam oven bersuhu sekitar 105oC selama 30 menit. Cawan abu porselen tersebut dimasukkan ke dalam desikator (30 menit) dan kemudian ditimbang. Sampel sebanyak 5 gram ditimbang kemudian dimasukkan ke dalam cawan abu porselen. Cawan abu porselen yang telah berisi sampel selanjutnya dibakar di atas kompor listrik sampai tidak berasap dan dimasukkan ke dalam tanur pengabuan dengan suhu 600oC selama 7 jam. Cawan dimasukkan di dalam desikator dibiarkan sampai dingin dan kemudian ditimbang.
Perhitungan kadar abu:
Kadar abu (%) =Bobot setelah tanur gram −Cawan kosong (gram)
Berat sampel awal (gram) × 100%
(3) Analisis kadar protein (AOAC 2005)
dan 3 ml H2SO4 pekat. Sampel didestruksi pada suhu 410oC selama kurang lebih 1 jam sampai larutan jernih lalu didinginkan. Setelah dingin, ke dalam labu Kjeldahl ditambahkan 50 ml akuades dan 20 ml NaOH 40%, kemudian dilakukan proses destilasi dengan suhu destilator 100oC. Hasil destilasi ditampung dalam labu erlenmeyer 125 ml yang berisi campuran 10 ml asam borat (H3BO3) 2% dan 2 tetes indikator bromcherosol green-methyl red yang berwarna merah muda. Setelah volume destilat mencapai 40 ml dan berwarna hijau kebiruan, maka proses destilasi dihentikan. Destilat kemudian dititrasi dengan HCl 0,1 N sampai terjadi perubahan warna merah muda.Volume titran dibaca dan dicatat. Larutan blanko dianalisis seperti sampel.
(4) Analisis kadar lemak (AOAC 2005)
Sampel seberat 5 gram (W1) dimasukkan ke dalam kertas saring pada kedua ujung bungkus ditutup dengan kapas bebas lemak dan selanjutnya dimasukkan ke dalam selongsong lemak, kemudian sampel yang telah dibungkus dimasukkan ke dalam labu lemak yang sudah ditimbang berat tetapnya (W2) dan disambungkan dengan tabung Soxhlet. Selongsong lemak dimasukkan ke dalam ruang ekstraktor tabung Soxhlet dan disiram dengan pelarut lemak (n-heksana). Proses refluks dilakukan selama 6 jam. Pelarut lemak yang ada dalam labu lemak didestilasi hingga semua pelarut lemak menguap. Pada saat destilasi pelarut akan tertampung di ruang ekstraktor, pelarut dikeluarkan sehingga tidak kembali ke dalam labu lemak, selanjutnya labu lemak dikeringkan dalam oven pada suhu 105oC, setelah itu labu didinginkan dalam desikator sampai beratnya konstan (W3).
Perhitungan kadar lemak:
Kadar lemak (%) =W3−W2
W1 × 100%
(5) Analisis karbohidrat by difference
Kadar karbohidrat total ditentukan dengan metode by difference yaitu: Kadar karbohidrat (%) = 100% - (kadar air + abu + protein + lemak)
Pengujian Ekstrak Terpilih
Penentuan Konsentrasi Hambat Minimum (Mazzola et al. 2009)
Uji Konsentrasi Hambat Minimum (KHM) dilakukan untuk mengetahui konsentrasi minimum dari ekstrak yang terpilih dalam menghambat aktivitas pertumbuhan dari bakteri uji. Ekstrak buah bakau merah yang mempunyai aktivitas penghambatan yang terbaik dilanjutkan dengan penentuan KHM. Metode yang digunakan adalah metode dilusi cair (broth dilution). Tabung reaksi disiapkan sebanyak 6 buah dan diberi nomor sesuai urutan. Masing-masing tabung diisi 3 mL media cair NB. Tabung ke-1 hingga ke- 5 secara berurutan ditambahkan ekstrak antidiare terpilih dengan konsentrasi 1 mg/mL, 0,7 mg/mL, 0,5 mg/mL, 0,2 mg/mL, dan 0,05 mg/mL.
Tabung 1 hingga 6 ditambahkan 3 µL suspensi mikroba.Tabung 6 digunakan sebagai kontrol positif. Tabung diinkubasi pada suhu 37 ºC selama 18-24 jam. Pertumbuhan mikroba diamati dengan adanya kekeruhan pada media. Penentuan KHM dilakukan dengan melihat konsentrasi ekstrak terendah yang masih menunjukkan penghambatan, ditandai dengan nomor tabung terkecil yang masih jernih.
Kromatografi lapis tipis dan bioautografi (Marliana et al. (2005) yang dimodifikasi)
Pengujian kromatografi dan biautografi dilakukan masing–masing dua ulangan terhadap ekstrak metanol. Fraksinasi menggunakan plat aluminium dengan silika F254 60 dari Merck. Plat KLT kemudian dikeringkan di dalam oven bersuhu 105°C selama 10 menit. Penotolan ekstrak dilakukan menggunakan pipa kapiler hingga membentuk lingkaran kecil, kemudian plat dimasukkan ke dalam gelas yang telah berisi eluen. Eluen yang digunakan adalah campuran kloroform dan metanol (6:4). Plat disandarkan dan dibiarkan hingga eluennya naik mencapai garis batas, setelah itu plat diangkat dan dibiarkan kering. Noda yang dihasilkan dari proses elusi masing–masing diamati dibawah lampu UV pada panjang gelombang 254 nm dan 366 nm.
Uji bioautografi dilakukan dengan fraksi aktif ekstrak buah bakau merah sebanyak 0,5 mg ditotolkan pada plat silika F254 60, kemudian dikembangkan dengan fase gerak kloroform dan metanol (6:4). Kromatogram diletakkan dalam cawan petri yang telah berisi biakan E. coli dan S. aureus. Kromatogram dibiarkan menempel pada medium agar dan diinkubasi selama 24 jam. Pengujian bioautografi dilakukan dengan melihat daerah yang berwarna bening merupakan daerah senyawa aktif berada.
Pengujian Fitokimia (Harborne 1987)
Pengujian fitokimia yang dilakukan meliputi pemeriksaan senyawa alkaloid, flavonoid, saponin, tanin, fenol hidrokuinon, dan steroid/triterpenoid pada ekstrak terbaik buah bakau merah (Rhizophora stylosa).
(1) Alkaloid
dengan endapan jingga, jika terdapat endapan tersebut maka sampel dikatakan positif.
(2) Flavonoid
Sebanyak 0,05 gram sampel ditambahkan serbuk Mg sebanyak 0,05 mg, setelah itu ditambahkan 0,2 mL amil alkohol dan 4 mL alkohol. Hasil uji positif bila larutan berwarna merah, kuning atau jingga pada lapisan amil alkohol.
(3) Saponin
Sebanyak 0,05 gram sampel diletakan dalam tabung reaksi. Kemudian ditambahkan air panas, dan tabung reaksi dikocok. Diamkan selama 30 menit dan tambahkan HCl 2 N sebanyak 1 tetes. Hasil positif uji saponin ditunjukan dengan adanya busa yang stabil.
(4) Tanin
Sebanyak 0,05 gram sampel diseduh dengan air panas yang telah didihkan selama 3 menit, sampel tersebut disaring setelah itu ditetesi dengan FeCl3 1 %. Hasil uji positif jika larutan bewarna biru tua atau hijau kehitaman.
(5) Fenol hidrokuinon
Sebanyak 0,05 gram sampel dimasukkan ke dalam tabung reaksi dan dicampurkan dengan 0,25 ml etanol. Selanjutnya ditambahkan FeCl3 5 % sebanyak 2 tetes. Reaksi positif ditunjukkan dengan terbentuknya warna hijau atau hijau biru.
(6) Steroid/Triterpenoid
Sebanyak 0,05 gram sampel ditambah dengan kloroform kemudian ditetesi dengan anhidrida asam asetat sebanyak 5 tetes. Penetesan H2SO4 sebanyak 3 tetes. Larutan akan berwarna merah. Hasil uji steroid positif bila warna larutan berubah menjadi biru. Sedangkan hasil uji triterpenoid positif bila terbentuk warna merah kecoklatan pada lapisan permukaan sampel.
Rancangan Percobaan
Analisis data dilakukan pada pengujian aktivitas antibakteri. Rancangan yang digunakan adalah Rancangan Acak Lengkap Faktorial (RAF). Data dianalisis dengan ANOVA (Analysis of Varians) dan terlebih dahulu diuji kenormalan Ryan-Joiner.
Uji Kenormalan (Ryan-Joiner 1985)
Uji kenormalan adalah pengujian untuk mengetahui apakah galat data yang digunakan menyebar normal, sehingga dapat digunakan data statistika parametrik. Bila nilai Pvalue ≥ α (0,05), maka data berdistribusi normal.
Uji ANOVA (Analysis of Variant)
Data selanjutnya dianalisis menggunakan model rancangan ANOVA (Analysis of Variant). Rancangan yang digunakan adalah rancangan acak lengkap faktorial dengan dua faktor. Model matematis rancangan percobaan tersebut menurut Steel dan Torrie (1993) adalah sebagai berikut:
Keterangan:
Yijk : Pengamatan pada satuan percobaan ke-k yang memperoleh kombinasi perlakuan taraf ke-i dari faktor A dan taraf ke-j dari faktor B
µ : Mean populasi
αi : Pengaruh utama faktor jenis ekstrak βi : Pengaruh utama faktor jenis bakteri
(αβ)ij : Pengaruh interaksi faktor jenis ekstrak dengan faktor jenis bakteri Ɛijk : Pengaruh acak dari satuan percobaan ke-k yang memperoleh
kombinasi perlakuan ij
Hipotesa rancangan acak faktorial aktivitas antibakteri terhadap diameter zona hambat yang dihasilkan adalah sebagai berikut:
Pengaruh utama faktor jenis ekstrak
Pengaruh utama faktor jenis bakteri
Pengaruh interaksi faktor jenis ekstrak dengan faktor jenis bakteri
Selang kepercayaan yang digunakan adalah 95% untuk menyatakan perbedaan nyata menggunakan software Statistical Process for Social Science (SPSS) vesi 15.0. Selanjutnya data dianalisis dengan analisis ragam (univariate), Jika dari hasil analisis ragam berbeda nyata, maka dilakukan uji lanjut dengan menggunakan uji Duncan. Faktor yang digunakan adalah perbedaan jenis ekstrak dengan jenis bakteri. Rumus uji Duncan adalah:
Rp= r (∑ p;dbs;a) √� Keterangan:
Rp : Nilai kritikal untuk perlakuan yang dibandingkan P : Perlakuan
H1 : Perbedaan jenis bakteri berpengaruh terhadap diameter zona hambat bakteri yang dihasilkan
H0 : Interaksi antara faktor jenis ekstrak dengan faktor jenis bakteri tidak berpengaruh terhadap diameter zona hambat bakteri yang dihasilkan H1 : Interaksi antara faktor jenis ekstrak dengan faktor jenis bakteri
HASIL DAN PEMBAHASAN
Karakteristik Buah Bakau Merah (Rhizophora stylosa)
Buah bakau yang digunakan pada penelitian ini diperoleh dari Pulau Untung Djawa, Kepulauan Seribu, Jakarta. Buah bakau terdiri dari dua bagian yaitu kelopak dan buah bakau (hipokotil). Buah bakau mempunyai hipokotil lurus, silindris, berwarna merah kecoklatan, dan buahnya dipenuhi bintil-bintil dan bila jatuh tertancap ke dalam lumpur akan tumbuh dan membesar. Daging buah yang sudah dikupas dan dihaluskan dengan blender memiliki tekstur yang halus dan berwarna coklat. Pengukuran morfometrik buah bakau disajikan pada Gambar 2.
Lebar
Panjang hipokotil
Panjang total
Buah bakau yang digunakan sebanyak 30 buah. Hasil pengukuran morfometrik buah bakau merah (R. stylosa) disajikan dalam Tabel 1.
Tabel 1 Pengukuran morfometrik buah bakau merah (R. stylosa)
No Parameter Nilai Nilai (*)
1 Panjang hipokotil 30,51 ± 1,96 (cm) 28,75 cm 2 Panjang total 33,23 ± 1,96 (cm) 30,00 cm 3 Berat hipokotil 24,14 ± 3,67 (gram) - 4 Berat total 31,53 ± 4,07 (gram) - 5 Diameter (lebar) 0,93 ± 0,17 (cm) 0,50 cm
Keterangan: data diperoleh dari 30 sampel buah bakau *Setyawan et al. (2014)
Buah bakau yang digunakan dalam penelitian ini adalah buah bakau Rhizophora stylosa yang telah matang. Hal ini sesuai dengan hasil penelitian Setyawan et al. (2014) yang menyatakan buah bakau merah (R. stylosa) yang sudah matang memiliki panjang hipokotil 28,75 cm dan panjang total 30 cm. Menurut FAO (2000), buah bakau merah (R. stylosa) yang sudah matang memiliki hipokotil lurus dengan panjang sekitar 20-35 cm dan bisa juga mencapai 54 cm.
Komposisi Kimia Buah Bakau Merah (Rhizophora stylosa)
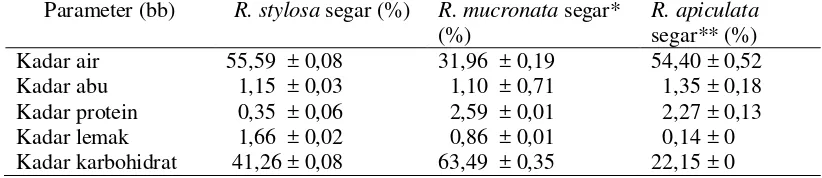
Informasi mengenai kandungan gizi yang terdapat dalam buah bakau merah (R. stylosa) dapat diketahui melalui analisis proksimat. Hasil analisis proksimat buah bakau segar disajikan pada Tabel 2.
Tabel 2 Komposisi kimia buah bakau (R. stylosa) segar Parameter (bb) R. stylosa segar (%) R. mucronata segar* bakau merah (R. stylosa) memiliki persentase yang lebih besar jika dibandingkan dengan kadar abu, protein, dan lemak.
Kadar air buah bakau merah (R. stylosa) segar tergolong tinggi, yaitu mencapai 55,59% (basis basah). Persentase kadar air tersebut didukung oleh penelitian yang telah dilakukan oleh Purwaningsih et al. (2013) dengan komposisi kadar air sebesar 31,96% (basis basah), dan penelitian yang dilakukan oleh Bunyapraphatsara et al. (2002) dengan komposisi kadar air sebesar 54,40% (basis basah). Kadar air pada bahan pangan dapat dipengaruhi oleh habitat atau lingkungan. Menurut FAO (2000), buah bakau memiliki habitat yang dekat dengan wilayah perairan dan umumnya tumbuh di pesisir pantai.
Kadar abu buah bakau merah (R. stylosa) segar, yaitu 1,15% (basis basah). Nilai tersebut tidak jauh berbeda dengan penelitian yang telah dilakukan oleh Purwaningsih et al. (2013) dengan komposisi kadar abu sebesar 1,10% (basis basah), dan penelitian yang dilakukan oleh Bunyapraphatsara et al. (2002) dengan komposisi kadar abu sebesar 1,35% (basis basah). Handayani et al. (2004), menyatakan tinggi rendahnya nilai kadar abu pada tumbuhan bergantung pada cara penyerapan hara mineralnya dan kondisi lingkungan perairan laut yang mengandung berbagai mineral dengan konsentrasi tinggi.
Kadar protein buah bakau merah (R. stylosa) segar tergolong rendah, yaitu 0,35% (basis basah). Hasil pengukuran ini cukup berbeda jauh dengan kadar protein yang telah diuji oleh Purwaningsih et al. (2013) dengan komposisi kadar protein sebesar 2,59% (basis basah), dan penelitian Bunyapraphatsara et al. (2002) dengan komposisi kadar protein sebesar 2,27% (basis basah).
Handayani (2006), menyatakan bahwa kadar protein suatu tanaman tergantung pada jenis tanaman dan periode musim tumbuh. Menurut Bunyapraphatsara et al. (2002), total protein kasar dalam tumbuhan memiliki jumlah kurang dari 4%. Hasil penelitian Bunyapraphatsara et al. (2002), juga menyebutkan bahwa kadar protein kasar untuk buah R. apiculata sebesar 2,27% (basis basah) dan buah Bruguiera gymnorrhiza sebesar 1,93% (basis basah).
kadar lemak sebesar 0,86% (basis basah), dan penelitian yang dilakukan oleh Bunyapraphatsara et al. (2002) dengan komposisi kadar lemak sebesar 0,14% (basis basah).
Handayani et al. (2004), menyatakan bahwa hampir semua tumbuhan memiliki kadar lemak yang rendah. Rendahnya kadar lemak pada tumbuhan disebabkan bentuk penyimpanan cadangan makanan pada tumbuhan dalam bentuk karbohidrat terutama polisakarida. Hal ini menyebabkan lemak nabati umumnya mempunyai persentase yang rendah.
Kadar karbohidrat by difference buah bakau merah (R. stylosa) segar sebesar 41,26% (basis basah). Nilai ini cukup berbeda jauh dengan hasil penelitian Purwaningsih et al. (2013) dengan komposisi kadar karbohidrat by difference sebesar 63,49% (basis basah), dan penelitian yang dilakukan oleh Bunyapraphatsara et al. (2002) yaitu sebesar 22,15% (basis basah). Menurut Bunyapraphatsara et al. (2002), tumbuhan mangrove memiliki kandungan serat pangan yang tinggi, yaitu berkisar dari 4,78% hingga 29,25%.
Ekstrak Buah Bakau Merah (Rhizophora stylosa)
Ekstrasi buah bakau merah (R. stylosa) menggunakan metode maserasi dengan tiga pelarut yang berbeda yaitu metanol, etil asetat, dan n-heksana. Hasil ekstraksi dari buah bakau memiliki warna yang berbeda–beda. Ekstrak metanol memiliki warna hijau kehitaman, etil asetat berwarna hijau tua, dan n-heksana berwarna hijau lebih terang. Perbedaan tersebut tidak hanya dilihat dari warna sampel, akan tetapi dari sisi jumlah rendemen. Nilai rendemen ekstrak dari masing-masing pelarut disajikan dalam Tabel 3.
Tabel 3 Rendemen ekstrak buah bakau (R. stylosa)
Jenis Pelarut Rendemen (%)
Metanol 3,45 ± 0,50 Etil Asetat 0,32 ± 0,21 N-heksana 0,14 ± 0,03
Rendemen ekstrak metanol memiliki nilai yang lebih tinggi dari kedua pelarut lainnya. Hal ini mengindikasikan bahwa senyawa–senyawa aktif pada buah bakau R. stylosa cenderung larut pada pelarut metanol. Tingginya nilai rendemen yang dihasilkan dari ekstrak metanol diduga dipengaruhi oleh sifat pelarut metanol yang polar, dimana dapat melarutkan hampir semua komponen bahan aktif. Penelitian lain yang dilakukan oleh Priyanto (2011) menyebutkan bahwa hasil ekstrak metanol buah bakau (R. mucronata) sebesar 10,95%, ekstrak etil asetat sebesar 0,25%, dan ekstrak n-heksana sebesar 0,12%. Perbedaan hasil ekstrak yang didapat diduga karena jenis sampel yang digunakan dari spesies Rhizopora yang berbeda dan perbandingan antara sampel dengan pelarut yang digunakan juga berbeda. Semakin banyak pelarut maka akan menyebabkan penyebaran partikel dalam pelarut semakin cepat, sehingga memperluas kesempatan kontak antara sampel dengan pelarut.
ekstrak merupakan faktor yang sangat penting karena menunjukkan banyaknya senyawa organik yang larut dalam pelarut tersebut sesuai dengan polaritasnya.
Perbedaan nilai rendemen yang dihasilkan ketiga pelarut disebabkan berbedanya sifat kepolaran dari pelarut yang digunakan. Hal ini sesuai dengan penelitian Salamah et al. (2008) yang menyatakan bahwa rendemen ekstrak hasil maserasi dengan pelarut yang berbeda akan menghasilkan presentase rendemen yang berbeda.
Metanol merupakan senyawa yang bersifat polar dan memiliki gugus hidroksil (alkohol). Alkohol dikenal sebagai pelarut serbaguna yang digunakan untuk mengekstraksi habis senyawa aktif. Pelarut metanol mampu mengekstrak golongan senyawa alkaloid, komponen fenolik, tanin, karotenoid, gula, asam amino dan glikosida (Harborne 1987).
Aktivitas Antibakteri Ekstrak Buah Bakau Merah (Rhizophora stylosa)
Pengujian aktivitas antibakteri ekstrak buah bakau merah (R. stylosa) menggunakan kontrol positif dan negatif sebagai pembanding aktivitas antibakteri.
Kontrol positif yang digunakan yaitu kloramfenikol. Kloramfenikol merupakan salah satu antibiotik dengan spektrum luas yang aktif terhadap banyak bakteri dari Gram-positif dan Gram-negatif (Pelczar dan Chan 2008). Kontrol negatif yang digunakan yaitu masing-masing pelarut dari ekstrak yang digunakan. Penggunaan pelarut ini adalah sebagai pembanding untuk melihat pengaruh pelarut pada proses ekstraksi terhadap diameter zona hambat yang dihasilkan ekstrak.
Hasil analisis ragam jenis ekstrak (Lampiran 1), memberikan pengaruh yang berbeda nyata terhadap diameter zona hambat (p< 0,05). Hasil uji lanjut Duncan (Lampiran 2) menunjukkan ekstrak metanol menghasilkan diameter zona hambat yang berbeda nyata dengan diameter zona hambat yang dihasilkan oleh ekstrak etil asetat dan ekstrak n-heksana. Hal ini diduga perbedaan sifat senyawa dari pelarut. Ekstrak metanol merupakan senyawa polar yang mampu menarik hampir semua senyawa-senyawa kimia yang terdapat di dalam buah bakau merah (Rhizophora stylosa). Senyawa-senyawa kimia yang ikut tertarik oleh pelarut metanol diduga berperan dalam menghambat pertumbuhan bakteri. Penelitian Mouafi et al. (2014) menunjukkan bahwa senyawa-senyawa kimia dari ekstrak daun R. stylosa yang berperan dalam menghambat pertumbuhan bakteri adalah senyawa fenolik, flavonoid, alkaloid, steroid, terpenoid, tanin, dan glikosida.
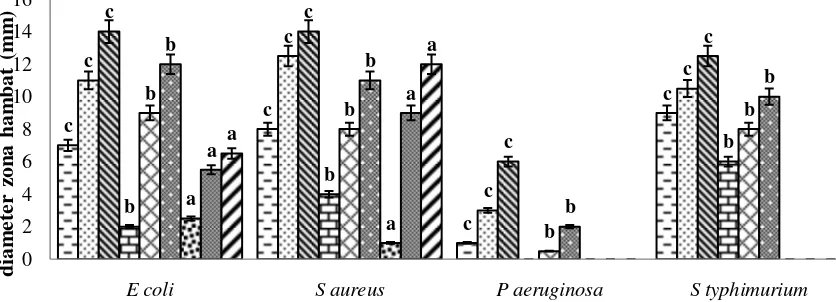
Hasil uji antibakteri pada Gambar 3 menunjukkan bahwa diameter zona hambat tertinggi terdapat pada ekstrak kasar metanol dengan nilai diameter sebesar 14 mm pada bakteri Escherichia coli dan Staphylococcus aureus. Penelitian lain yang dilakukan oleh Pimpliskar et al. (2011), pada kulit batang Rhizophora apiculata yang diekstrak dengan pelarut etanol menghasilkan diameter zona hambat sebesar 20 mm pada bakteri E. coli dan 17 mm pada bakteri S. aureus,dengan konsentrasi ekstrak sebesar 1 mg/mL.
Hasil analisis ragam jenis bakteri (Lampiran 1), memberikan pengaruh yang berbeda nyata terhadap diameter zona hambat (p< 0,05). Hasil uji lanjut Duncan (Lampiran 3) menunjukkan bahwa hasil diameter zona hambat pada bakteri Staphylococcus aureus berbeda nyata dengan diameter zona hambat yang terdapat pada jenis bakteri E. coli, P. aeruginosa, dan S. typhimurium. Hal ini diduga perbedaan sensitivitas bakteri terhadap senyawa antibakteri. Bakteri S. aureus
Gambar 3 Hasil uji antibakteri ekstrak buah bakau merah (R. stylosa) terhadap bakteri penyebab diare ( ) metanol 0,5 mg/mL, ( ) metanol 1 mg/mL, ( ) metanol
E coli S aureus P aeruginosa S typhimurium
d
merupakan bakteri yang termasuk dalam golongan bakteri Gram-positif. Bakteri Gram-positif cenderung lebih sensitif terhadap senyawa antibakteri.
Bakteri Gram-positif memiliki struktur dinding sel yang berlapis tunggal dan relatif lebih sederhana sehingga memudahkan senyawa antibakteri untuk masuk ke dalam sel (Pelczar dan Chan 2010). Tingkat sensitivitas terhadap senyawa antibakteri diduga disebabkan perbedaan komponen pada dinding sel kedua jenis bakteri, seperti jumlah peptidoglikon (adanya reseptor, pori-pori, dan lipid), sifat ikatan silang, dan aktivitas enzim autolitik. Komponen tersebut merupakan faktor yang menentukan penetrasi, pengikatan, dan aktivitas senyawa antimikroba (Jawetz 1998). etanol menghasilkan diameter zona hambat sebesar 13 mm pada bakteri S. aureus dengan konsentrasi 1 mg/mL.
Hasil analisis ragam (Lampiran 1) menunjukkan adanya interaksi antara perbedaan jenis ekstrak dan perbedaan jenis bakteri yang memberikan pengaruh berbeda nyata terhadap diameter zona hambat (p< 0,05). Grafik hasil uji antibakteri pada Gambar 3 menunjukkan bahwa interaksi antara jenis ekstrak metanol dengan bakteri S. aureus menghasilkan diameter zona hambat berturut-turut sebesar 8 mm (0,5 mg/mL), 12,5 mm (1 mg/mL), dan 14 mm (2 mg/ mL).
Bakteri Gram-negatif memiliki lapisan dinding tambahan yaitu membran luar. Membran luar ini tersusun dari kompleks lipopolisakarida (LPS). Dinding sel bakteri Gram-negatif terdiri dari 10% peptidoglikan dan sisanya berupa membran luar. Membran luar ini bersifat toksik bagi hewan. Salmonella, Shigella, dan E.coli memiliki sifat toksisitas pada membran luarnya (Pelczar dan Chan 2008).
Mekanisme penghambatan pertumbuhan bakteri oleh senyawa antibakteri dapat berupa perusakan dinding sel dengan cara menghambat pembentukannya atau mengubahnya setelah selesai terbentuk, perubahan permeabilitas membran sitoplasma sehingga menyebabkan keluarnya nutrisi dari dalam sel, perubahan molekul protein dan asam nukleat, penghambatan kerja enzim, dan penghambatan sintesis asam nukleat dan protein. Mekanisme kerja senyawa antibakteri dalam menghambat pertumbuhan dipengaruhi oleh berbagai faktor seperti zat yang terkandung di dalam antibakteri, waktu penyimpanan, suhu lingkungan, dan sifat mikroba (Pelczar dan Chan 2008)
Hasil terbaik pada pengujian aktivitas antibakteri ditunjukkan oleh ekstrak metanol buah bakau merah (R. stylosa). Ekstrak metanol menghasilkan zona hambat terbesar dibandingkan ekstrak lainnya. Ekstrak metanol selanjutnya digunakan untuk analisis penentuan konsentrasi hambat minimum, kromatografi lapis tipis dan bioautografi, dan pengujian fitokimia.
Konsentrasi Hambat Minimum
semalam (Andrews 2006). Pengamatan terhadap konsentrasi hambat minimum dilakukan tiap satu jam sekali selama 24 jam. Pengamatan ini bertujuan untuk mengetahui sifat dari senyawa antimikroba yakni bersifat bakteriosidal atau bakteriostatik.
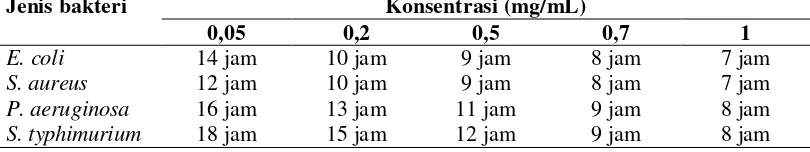
Nilai KHM diketahui berdasarkan konsentrasi senyawa antibakteri yang dapat menghambat pertumbuhan bakteri uji setelah diinkubasi 24 jam. Pertumbuhan mikroorganisme bersifat subjektif yaitu dilihat dari kekeruhan media cair. Hasil uji Konsentrasi hambat minimum disajikan pada Tabel 4.
Tabel 4 Hasil uji Konsentrasi Hambat Minimum ekstrak buah bakau (R. stylosa)
Konsentrasi
Keterangan: (+) : keruh (ada pertumbuhan) (-) : jernih (tidak ada pertumbuhan)
Tabel 4 menunjukkan konsentrasi hambat minimum ekstrak metanol buah bakau merah (R. stylosa) memiliki nilai yang bervariasi. Nilai KHM bakteri E. coli adalah 0,5 mg/mL. Bakteri S. aureus memiliki nilai KHM sebesar 0,2 mg/mL, sedangkan untuk bakteri P. aeruginosa dan S. typhimurium memiliki nilai KHM masing-masing sebesar 0,7 mg/mL. Penelitian lain yang dilakukan oleh Pimpliskar et al. (2012), pada kulit batang Rhizophora mucronata yang diekstrak dengan pelarut etanol menghasilkan nilai konsentrasi hambat minimum pada bakteri E. coli, S. aureus, S. typhimurium masing-masing sebesar 0,5 mg/mL, sedangkan pada akar napas Rhizophora mucronata yang diekstrak dengan pelarut etanol menghasilkan nilai KHM sebesar 1 mg/mL pada bakteri P. aeruginosa.
Hasil pengujian KHM mengindikasikan bahwa buah bakau merah (Rhizophora stylosa) mengandung komponen senyawa antibakteri. Pengamatan yang dilakukan setiap jam menunjukkan aktivitas penghambatan berlangsung selama beberapa jam setelah bakteri tumbuh dalam media kontrol. Hasil pengamatan selama 24 jam terhadap konsentrasi hambat minimum disajikan pada Tabel 5.
Tabel 5 Konsentrasi Hambat Minimum selama 24 jam pengamatan
Jenis bakteri Konsentrasi (mg/mL)
menghambat pertumbuhan bakteri penyebab diare yang bersifat bakteriostatik. Hasil pengujian konsentrasi hambat minimum juga menunjukkan bahwa bakteri Staphylococcus aureus merupakan bakteri yang paling rentan terhadap ekstrak metanol buah bakau merah. Berikut merupakan beberapa nilai konsentrasi hambat miminum antibiotik terhadap bakteri penyebab diare disajikan pada Tabel 6.
Tabel 6 Konsentrasi Hambat Minimum antidiare
Jenis bakteri Konsentrasi Hambat Minimum (mg/mL)
Buah R. stylosa Amoxicillin* Metronidazole* Kloramfenikol*
E. coli 0,2 0,25-128 - 0,25-128
S. aureus 0,05 0,03-128 - 2-16
P. aeruginosa 0,7 - - -
S. typhimurium 0,7 - - -
Keterangan: *Andrews 2006
Konsentrasi hambat minimum (KHM) tidak selalu konstan terhadap senyawa antibakteri yang diberikan (Negara 2013). Berdasarkan Tabel 6, jika dibandingkan dengan nilai KHM dari Amoxicillin, Metronidazole, dan Kloramfenikol, ekstrak metanol buah bakau merah (R. stylosa) berpotensi sebagai antibakteri terhadap bakteri penyebab diare. Hal ini dikarenakan nilai konsentrasi hambat minimum untuk ekstrak buah bakau R. stylosa masih berada di rentang nilai KHM dari Amoxicillin, Metronidazole, dan Kloramfenikol. Menurut Tinambunan (2012), antibakteri dikatakan mempunyai aktivitas yang tinggi terhadap mikroba apabila nilai konsentrasi hambat minimumnya rendah tetapi mempunyai daya hambat yang besar.
Menurut Madigan et al. (2006), hal-hal yang mempengaruhi nilai KHM diantaranya yaitu mikroorganisme uji, ukuran inokulum, komposisi media kultur, waktu inkubasi, serta kondisi inkubasi itu sendiri. Kondisi inkubasi yang mempengaruhi, yaitu suhu, aerasi, dan pH.
Fraksi Aktif Ekstrak Buah Bakau Merah (Rhizophora stylosa)
Kromatografi lapis tipis (KLT) adalah metode kromatografi yang relatif sederhana dan cepat digunakan. Kromatografi merupakan metode yang digunakan untuk memisahkan komponen–komponen aktif yang terdapat di dalam suatu ekstrak. Hasil fraksinasi ekstrak metanol buah bakau merah (R. stylosa) disajikan pada Gambar 4.
Hasil pengujian terhadap fraksi aktif ekstrak metanol ditunjukkan pada Gambar 4, ulangan 1 dengan menggunakan sinar UV λ 254 nm diidentifikasi memiliki 3 bercak dengan nilai Rƒ 0,39, 0,53, dan 0,78 serta dilakukan fraksinasi dengan sinar UV λ 366 nm yang menghasilkan 2 bercak yaitu Rƒ 0,41 dan 0,64. Fraksinasi terhadap metanol ulangan 2 juga diidentifikasi dengan menggunakan sinar UV λ 254 nm dan λ 366 nm. Sinar UV λ 254 nm menghasilkan 3 bercak dengan nilai Rƒ 0,31, 0,64, dan 0,76 sedangkan dengan UV λ 366 nm menghasilkan 2 bercak dengan nilai Rƒ 0,39 dan 0,72.
pemisahan komponen dengan KLT dipengaruhi oleh beberapa faktor, antara lain
Gambar 4Kromatogram ekstrak metanol (eluen kloroform:metanol (6:4))
Hasil KLT dari ekstrak metanol ulangan 1 dan ulangan 2 selanjutnya disemprot dengan pereaksi Dragendorff. Tujuan dari penyemprotan dengan pereaksi Dragendorff adalah untuk mendeteksi kandungan senyawa alkaloid yang terdapat di dalam ekstrak metanol buah bakau merah (Rhizophora stylosa). Profil penyemprotan ekstrak metanol ulangan 1 dan ulangan 2 dengan pereaksi Dragendorff disajikan pada Gambar 5.
Hasil penyemprotan dengan pereaksi Dragendorff pada Gambar 5 menghasilkan warna orange pada Rƒ 0,78, Rƒ 0,64, dan Rƒ 0,53 (ulangan 1), sedangkan ulangan 2 terdapat pada Rƒ 0,72, Rƒ 0,64, dan Rƒ 0,39. Hal ini menunjukkan bahwa fraksi ekstrak metanol mengandung senyawa golongan alkaloid karena menghasilkan warna orange setelah disemprot pereaksi Dragendorff.
Sinar UV 254 nm Sinar UV 366 nm Sinar UV 254 nm Sinar UV 366 nm
Gambar 5Kromatogram ekstrak metanol setelah penyemprotan
(Ulangan 1) Rƒ3 0,78
Rƒ2 0,64
Rƒ2 0,53
Rƒ1 0,41
Rƒ1 0,39
(Ulangan 2) Rƒ3 0,76 Rƒ
2 0,72
Rƒ2 0,64
Rƒ1 0,31
Rƒ1 0,39
Rƒ 0,64 Rƒ 0,41
(S. aureus)
Rƒ 0,39 Rƒ 0,64
(E. coli)
Bakteri yang digunakan dalam bioautografi yaitu E. coli dan S. aureus. Kedua bakteri ini digunakan karena sebagai indikator penyebab diare dan memiliki jenis Gram yang berbeda. Profil Bioautografi ekstrak metanol ulangan 1 dan ulangan 2 disajikan pada Gambar 6.
Gambar 6 menunjukkan bahwa ekstrak metanol buah bakau merah (Rhizophora stylosa) memiliki aktivitas antibakteri terhadap bakteri E. coli dan S. aureus yang ditunjukkan dengan adanya bercak hambatan pada media agar yang telah diinokulasi dengan bakteri tersebut. Senyawa pada Rƒ 0,64 dan 0,39 pada bakteri E. coli dan senyawa pada Rƒ 0,64 dan 0,41 pada bakteri S. aureus memberikan daerah hambatan pada media agar yang telah diinokulasi suspensi bakteri. Hasil pengujian KLT dan bioautografi mengindikasikan bahwa senyawa antibakteri yang berperan dalam menghambat aktivitas bakteri adalah alkaloid.
Mekanisme penghambatan bakteri oleh senyawa alkaloid diduga dengan cara mengganggu komponen penyusun peptidoglikan pada sel bakteri, sehingga lapisan dinding sel tidak terbentuk secara utuh dan menyebabkan kematian pada sel tersebut (Robinson 1995).
Pengujian Fitokimia Ekstrak Buah Bakau (Rhizophora stylosa)
Ekstrak kasar buah bakau yang diperoleh dari proses ekstraksi kemudian digunakan untuk uji aktivitas antibakteri. Berdasarkan hasil uji aktivitas antibakteri yang dilakukan, didapat ekstrak metanol sebagai ekstrak terbaik dari ekstrak lainnya. Ekstrak kasar metanol kemudian diuji kandungan komponen aktifnya menggunakan metode uji fitokimia. Uji ini menunjukkan komponen aktif apa saja yang terlarut pada metanol. Hasil pengujian analisis fitokimia disajikan pada Tabel 7.
Tabel 7 Hasil uji fitokimia ekstrak kasar buah bakau (R. stylosa) Uji Jenis Pelarut Standar (warna)
Triterpenoid + Lapisanpermukaan berwarna merah kecoklatan
Keterangan: (+) Teridentifikasi (-) Tidak teridentifikasi
buah R. mucronata mengandung komponen aktif berupa alkaloid, tanin, saponin, fenolik, flavonoid, terpenoid, dan glikosida. Senyawa aktif yang terkandung pada tanaman obat umumnya mengandung berbagai metabolit sekunder seperti fenol, tanin, alkaloid, flavonoid, steroid, dan glikosida dalam jumlah yang cukup. Kelman et al. (2000) menambahkan bahwa senyawa metabolit sekunder berfungsi untuk mencegah infeksi bakteri patogen.
Alkaloid merupakan golongan senyawa sekunder yang bersifat basa dan mengandung satu atau lebih atom hidrogen (Harborne 1987). Hasil pengujian fitokimia menghasilkan nilai positif adanya alkaloid pada ekstrak metanol. Penelitian Nurdiani et al. (2012) menunjukkan bahwa ekstrak metanol buah bakau R. mucronata mengandung senyawa alkaloid.
Alkaloid memiliki kemampuan sebagai antibakteri serta efek farmakologi sebagai analgesik dan anaestetik. Mekanisme penghambatan bakteri oleh senyawa ini diduga dengan cara mengganggu komponen penyusun peptidoglikan pada sel bakteri sehingga lapisan dinding sel tidak terbentuk secara utuh dan menyebabkan kematian sel tersebut (Robinson 1995).
Tanin merupakan substansi yang tersebar luas pada daun, buah, batang, dan kulit kayu. Tumbuhan mangrove diketahui memiliki kandungan tanin yang tinggi. Pengujian fitokimia menghasilkan nilai positif adanya tanin pada ekstrak metanol. Menurut Akiyama et al. (2001), terdapat tiga mekanisme tanin dalam menghambat aktivitas pertumbuhan bakteri. Pertama, tanin yang bersifat astringen (zat yang menciutkan bentuk sel) akan membentuk kompleks dengan enzim pada mikroba atau substrat. Kedua, toksisitas tanin masuk melalui membran mikroba dan melewati dinding sel mikroba. Ketiga, tanin selanjutnya membentuk kompleks dengan ion metal dan mereduksi kesetaraan ion metal esensial untuk mikroba.
Saponin merupakan senyawa aktif yang bersifat seperti sabun dan dapat dideteksi berdasarkan kemampuannya membentuk busa. Navarroa et al. (2001) menyatakan bahwa kandungan saponin pada tanaman dan obat–obatan memiliki beberapa macam bioaktivitas, seperti antivirus, anti-inflamasi dan antiparasit. Hasil pengujian fitokimia menghasilkan nilai positif adanya saponin yang ditunjukkan terbentuknya busa yang stabil setelah didiamkan 30 menit. Hal ini sesuai dengan penelitian Nurdiani et al. (2012) terhadap buah bakau R. mucronata bahwa ekstrak metanol buah bakau R. mucronata mengandung saponin.
Komponen fenolat merupakan struktur aromatik yang berikatan dengan satu atau lebih gugus hidroksil dan bersifat larut air (Harborne 1987). Hasil uji fitokimia ekstrak kasar buah bakau menunjukkan adanya komponen fenol hidrokuinon.
Flavonoid terdapat pada seluruh bagian tanaman termasuk pada buah, tepung sari, dan akar. Hasil pengujian fitokimia ekstrak kasar buah bakau menunjukkan adanya komponen flavonoid.
Flavonoid merupakan senyawa metabolit sekunder yang berperan sebagai faktor pertahanan alami, seperti mencegah serangan bakteri (Harborne 1987). Sifat antibakteri senyawa flavonoid adalah dapat menyebabkan terjadinya denaturasi protein di dalam sel. Gugus OH pada senyawa flavonoid akan berikatan dengan protein internal membran sel (Scheuer 1995).
mikroba. Steroid merupakan salah satu kelompok senyawa dari triterpenoid. Secara umum struktur steroid mempunyai struktur siklik dan mempunyai gugus hidroksil (Harborne 1987). Hasil pengujian fitokimia ekstrak kasar buah bakau menunjukkan adanya komponen triterpenoid. Priyanto (2012) juga menyebutkan dalam penelitiannya bahwa pada ekstrak metanol buah bakau jenis Rhizophora lainnya, yaitu R. mucronata menunjukkan adanya senyawa triterpenoid dan steroid. Menurut Cowan (1990), mekanisme penghambatan bakteri oleh senyawa steroid/triterpenoid diduga dengan cara merusak membran sel bakteri.
KESIMPULAN DAN SARAN
Kesimpulan
Rendemen ekstrak buah bakau merah (R. stylosa) yang terbesar adalah dengan pelarut metanol sebesar 3,45%. Komponen aktif yang terkandung pada ekstrak buah bakau diantaranya adalah alkaloid, flavonoid, saponin, tanin, fenol hidrokuinon, dan triterpenoid. Pemberian ekstrak metanol buah bakau dengan konsentrasi 2 mg/ mL mampu menghambat pertumbuhan bakteri E. coli, S. aureus, P. aeruginosa dan S. typhimurium. Ekstrak metanol tergolong memiliki aktivitas antibakteri yang cukup tinggi dengan diameter zona hambat sebesar 1-14 mm. Nilai Konsentrasi hambat minimum (KHM) terhadap bakteri uji E. coli, S. aureus, P. aeruginosa dan S. typhimurium masing-masing sebesar 0,5 mg/mL, 0,2 mg/mL, dan 0,7 mg/mL.
Bioautografi terhadap bakteri uji E. coli menghasilkan fraksi aktif pada nilai Rƒ 0,64 dan 0,39, sedangkan fraksi aktif pada bakteri S. aureus menghasilkan nilai Rƒ 0,64 dan 0,41. Hasil identifikasi dengan pereaksi Dragendorff menunjukkan senyawa tersebut termasuk senyawa alkaloid.
Saran
Perlu dilakukan pengujian terhadap aktivitas antidiare ekstrak metanol buah bakau merah (R. stylosa) secara in vivo, dan perlu dilakukannya pengujian terhadap toksisitas dari ekstrak buah bakau merah (R. stylosa) sebagai antidiare.
DAFTAR PUSTAKA
[AOAC] Association of Official Analytical Chemist. 2005. Official Method of Analysis of The Association of Official Analytical of Chemist. Arlington (US): The Association of Official Analytical Chemist, Inc.
Akiyama H, Kazuyasu F, Osamu Y, Takashi O, Keiji I. 2001. Antibacterial action of several tannins against Staphylococcus aureus. Journal of Antimicrobial Chemotherapy. 48: 487-491.
Bunyapraphatsara N, Srisukh V, Hutivoboonsuk A, Sornlek P, Thongbainoi W, Chuakat W, Fong HHS, Pezzuto JM, Kosmeder J. 2002. Vegetables from the mangrove areas. Thai Journal of Phytopharmacy. 9(1):1-12.
Bustan MD, Febriyani E, Halomoan P. 2008. Pengaruh waktu ekstraksi dan ukuran partikel terhadap berat oleoresin jahe yang diperoleh dari berbagai jumlah pelarut organik (methanol). Jurnal Teknik Kimia. 4(15): 16-26. Cowan MM. 1999. Plant products as antimicrobial agents.Clinical Microbiology
Review. 12(4): 564-582.
Doran JL, BK Leskiw, S aippersbarch, SE Jensen. Isolation and characterization of a beta-lactamase-inhibitory protein from Streptomyces clavuligerus and cloning and analysis of the corresponding gene. Journal of Bacteriology. 172(9): 4909-4918.
Elya B, Atiek S, Farida. 2009. Antibakteri ekstrak kulit batang manggis hutan (Garcinia rigida Miq. ). Majalah Ilmu Farmasi. 4(1): 09-17.
Enda WG.2009. Uji efek ekstrak etanol kulit batang salam (Syzgium polyanthum (Wight) Walp.) terhadap mencit jantan. [skripsi]. Medan (ID): Universitas Sumatera Utara.
[FAO] Food and Agriculture Organization. 2000. Mangrove Guide Book for Southeasst Asia, Part 2 Description-Trees & Shrubs. Rhizophoraceae: Ministry of Fisheries, Agricultural and Marine Resources. hlm: 710-711. Handayani T. 2006. Protein pada rumput laut. Oseana. 31(4):23-30.
Handayani T, Sutarno, Setyawan AD. 2004. Analisis komposisi nutrisi rumput laut Sargassum crassifolium J. Agardh. Biofarmasi. 2(2):45-52.
Harborne. 1987. Metode Fitokimia, Penuntun Cara Modern Menganalisis Tumbuhan. Terjemahan: Padmawinata K, Sudiro I. Bandung (ID): Institut Teknologi Bandung.
Hayani E, Sukmasari M. 2005. Teknik pemisahan komponen ekstrak Purwoceng secara kromatografi lapis tipis. Buletin Teknik Pertanian. 10(2): 83-85. Jawetz. 1998. Obat-obat kemoteuratika. Di dalam: Katzung BG, editor. Hartanto
H et al., penerjemah. Farmakologi Dasar dan Klinik. Jakarta (ID): EGC. Terjemahan dari: Basic and Clinical Pharmacology.
Kelman D, Benayahu Y, Kahman Y. 2000. Variation in secondary metabolite concentrations in yellow and grey morphs of the Red Sea soft coral Parerythropodium fulvum fulvum: possible ecological implication. Journal of Chemical Ecology. 26 (1) : 1123-1134.
Kusmiyati, Agustini NWS. 2007. Uji aktivitas senyawa antibakteri dari mikroalga Porphridium cruentum. Biodiversitas. 8(1): 48-53.
Madigan MT, Martinko JM, Dunlap PV, Clark DP. 2006. Brack Biology of Microorganisms 11th ed. San Francisco (US): Pearson Educating Inc. hlm: 241-248
Marliana SD, Venty S, Suyono. 2005. Skrining fitokimia dan analisis kromatografi lapis tipis komponen kimia buah labu siam (Sechium edule Jacq. Swartz.) dalam ekstrak etanol. Biofarmasi. 3(1): 1693-2242
Mazolla PG, Jozala AF, Novaes LCL, Moriel P, Penna TCV. 2009. Minimal inhibitory concentration (MIC) determination of disinfectant and/or sterilizing agent. Brazillian Journal of Pharmaceutical Science. 45(2): 241-248.
Meite S, JDN Guessan, C Bahi, HF Yapi, AJ Djaman, FG Guina. 2009. Antidiarrheal activity of the ethyl acetat extract of Morinda morindodes in rats. Tropical Journal of Pharmaceutical Research. 8(3): 201-207.
Moorty K, Srinivasan K, Subramanian, Palaniswamy M, Mohanasundari C. 2007. Phytochemical screening and antibacterial evaluation of sterm bark of Mallotus philippinensis var. Toemntosus. African Journal of Biotechnology. 6(13):1521-1523.
Mouafi F, Shadia m, Abdel A, Awatif AB, Amal AF. 2014. Phytochemical analysis and antimicrobial activity of mangrove leaves (Avicennia marina and Rhizophora stylosa) against some pathogens. World Applied Sciences Journal. 29(4):547-554.
Navarroa P, Ginera RM, Recioa MC, Máñeza S, Cerdá-Nicolás M, Ríosa JL (2001). In vivo anti-inflammatory activity of saponins from Bupleurum rotundifolium. Life Science. 68(1):1199-1206.
Negara AAAPP. 2013. Aktivitas antibakteri ekstrak daun bakau hitam Rhizophora mucronata terhadap bakteri penyebab diare. [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Nurdiani R, Firdaus M, Prihanto AA. 2012. Phytochemical screening and antibacterial activity of methanol extract of mangrove plant (Rhizophora mucronata) from Porong River Estuary. Journal Basic Science and Technology. 1(2): 27-29.
Parhusip AJN. 2006. Kajian mekanisme antibakteri ekstrak andaliman (Zanthoxylum acanthopodium DC) terhadap bakteri patogen pangan [disertasi]. Bogor (ID): Sekolah Pascasarjana, Institut Pertanian Bogor. Pelczar S, Chan ECS. 2008. Dasar-Dasar Mikrobiologi 2. Hadioetomo et al.,
penerjemah. Jakarta (ID): UI-Press. Terjemahan dari: Elements of Microbiology. hlm: 452-539.
Pelczar S, Chan ECS. 2010. Dasar-Dasar Mikrobiologi 1. Hadioetomo et al., penerjemah. Jakarta (ID): UI-Press. Terjemahan dari: Elements of Microbiology. hlm: 99-157.
Priyanto AP. 2012. Aktivitas antioksidan dan komponen bioaktif pada buah bakau (Rhizophora mucronata Lamk.). [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Purwaningsih S, Salamah E, Sukarno AYP, Deskawati E. 2013. Aktivitas antioksidan dari buah mangrove (Rhizophora mucronata Lamk.) pada suhu yang berbeda [siap terbit].
Robinson T. 1995. Kandungan Organik Tumbuhan Tinggi. Edisi keenam. Padmawinata K, penerjemah. Bandung (ID): ITB. Terjemahan dari: The organic constituents of higher plants. hlm:281-286.
Ryan BF, Joiner BL, Ryan TA Jr. (1985). Minitab Handbook. 2nd Edition. Duxburry press, Boston (US). 379 p.
Salamah E, Ayuningrat E, Purwaningsih S. 2008. Penapisan awal komponen bioaktif dari kijing taiwan (Anadonta woodiana Lea.) sebagai senyawa antioksidan. Buletin Teknologi hasil Perikanan. 11(2): 229-13.
Scheuer JS.1995. Produk Alami Lautan. Semarang (ID): IKIP Semarang Press. Setyawan AD, Yaya IU, Pandisamy R. 2014. Review: Mangrove hybrid of
Rhizophora an its parental species in Indo-Malayan region. Nusantara Bioscience. 6(1): 69-81.
Steel RGD, Torrie JH. 1991. Prinsip dan Prosedur Statistika. Sumantri B, penerjemah. Jakarta (ID): Gramedia Pustaka Utama. Terjemahan dari Principles and Procedures of Statistics.
Lampiran 1 Tabel analisis ragam
Sumber Keragaman
Jumlah
Kuadrat df
Kuadrat
rata-rata F Sig.
Jenis ekstrak 450,36 2 225,18 106,61 ,00* Jenis bakteri 639,93 3 213,31 100,99 ,00* Jenis ekstrak-
Konsentrasi 33,22 4 8,31 3,93 ,01*
Konsentrasi-jenis
bakteri 126,86 6 21,14 10,01 ,00*
Jenis ekstrak-jenis
bakteri 135,19 6 22,53 10,67 ,00*
Error 101,39 48 2,11
Total terkoreksi 1844,65 71
Keterangan: Signifikasi < 0,05 berarti berpengaruh nyata * berpengaruh nyata
Lampiran 2 Tabel uji Duncan jenis ekstrak
Lampiran 3 Tabel uji Duncan jenis bakteri
Jenis bakteri N
Subset
a b c d
P. aeruginosa 18 1,33
S. typhimurium 18 6,22
E. coli 18 7,22
S. aureus 18 9,50
Sig. 1,00 1,00 1,00 1,00
Ekstrak N
Subset
a b c
N-heksana 24 3,04
Etil asetat 24 6,00
Metanol 24 9,17
Lampiran 4 Hasil uji normalitas
Grafik uji kenormalan Ryan-Joiner Hipotesis:
H0 : Galat menyebar normal H1 : Galat tidak menyebar normal
25
Keterangan: P value ≥ 0,05 maka galat data menyebar normal Lampiran 5 Perhitungan analisis proksimat buah bakau