INDUKSI KALUS EMBRIOGENIK DAN EMBRIO
SOMATIK DURIAN (
Durio zibethinus
Murr.)
PADA BERBAGAI KOMPOSISI MEDIA
NUR ARIFIN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Induksi Kalus Embriogenik dan Embrio Somatik Durian (Durio zibethinus Murr.) pada Berbagai Komposisi Media adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
NUR ARIFIN. Induksi Kalus Embriogenik dan Embrio Somatik Durian (Durio zibethinus Murr.) pada Berbagai Komposisi Media. Dibimbing oleh DARDA EFENDI, DEWI SUKMA dan RAGAPADMI PURNAMANINGSIH.
Durian merupakan komoditas hortikultura yang disukai banyak orang dan mempunyai nilai ekonomi yang tinggi. Agribisnis durian di Indonesia masih tertinggal dari negara tetangga seperti Thailand dan Malaysia, padahal Indonesia mempunyai potensi lahan, iklim, dan sumberdaya genetik durian yang lebih baik daripada kedua negara tersebut. Kultur jaringan durian dapat dijadikan terobosan dalam perbaikan genetik untuk menghasilkan varietas unggul durian dan perbanyakan massal bibit durian guna menunjang perbaikan agribisnis durian di Indonesia. Walaupun demikian penelitian tentang kultur jaringan durian sampai sekarang masih sangat terbatas. Tujuan penelitian ini adalah untuk mendapatkan kombinasi jenis eksplan, media, dan zat pengatur tumbuh (ZPT) terbaik dalam induksi kalus dan induksi embrio somatik pada kultur jaringan durian.
Penelitian dilakukan dalam 2 percobaan berkelanjutan. Percobaan pertama adalah induksi kalus dari 4 macam eksplan dan percobaan kedua adalah induksi embriogenesis somatik dari kalus yang diperoleh dari percobaan pertama. Jenis eksplan yang digunakan pada percobaan induksi kalus adalah dasar bunga, petal, endosperm dan embrio zigotik muda durian. Percobaan induksi kalus dengan eksplan dasar bunga dan petal menggunakan Rancangan Acak Kelompok Faktorial 2 faktor. Faktor pertama adalah genotipe durian, yaitu aksesi Dramaga, varietas Matahari dan varietas Simas; dan faktor kedua adalah 14 komposisi media yang tersusun atas 2 jenis media dasar (MS dan B5) dan 7 taraf ZPT (tanpa ZPT; NAA 2, 4, 6 ppm; dan pikloram 2, 4, 6 ppm). Percobaan induksi kalus dengan eksplan endosperm dan embrio zigotik muda menggunakan 1 genotipe yaitu Otong. Percobaan pada eksplan endosperm disusun sebagai percobaan dua faktor yaitu perlakuan benziladenin (BA) 0 dan 1 ppm dan tidiazuron (TDZ) 0.0, 0.01, 0.05, 0.5 ppm pada media dasar MS + vitamin media B5 yang dilengkapi dengan glutamina 100 ppm, asparagina 100 ppm, kasein hidrolisat 500 ppm, dan pikloram 0.5 ppm. Perlakuan pada induksi kalus dari eksplan embrio zigotik muda adalah pemberian pikloram 5, 10, 15, dan 20 ppm pada media dasar MS. Percobaan kedua adalah induksi embriogenesis somatik kalus yang didapat dari eksplan petal pada percobaan pertama dengan perlakuan konsentrasi BA 0.0, 0.3, 0.5, 1.0, dan 2.0 ppm pada media dasar MS dengan vitamin media B5 yang dilengkapi dengan glutamina 100 ppm, asparagina 100 ppm, kasein hidrolisat 500 ppm, dan pikloram 0.5 ppm.
Tipe kalus yang diperoleh dari eksplan dasar bunga pada awal kemunculannya merupakan kalus remah berair (kalus tipe 3) yang sel-selnya mudah dipisahkan satu sama lain. Dalam satu sampai dua minggu setelah tumbuh kalus, kalus remah berair tersebut berubah menjadi kalus kompak berwarna putih keruh sampai agak kekuningan (kalus tipe 1) atau kalus kompak berwarna putih bersih (kalus tipe 2). Ketiga tipe kalus tersebut, dari pengamatan morfologi dan histologi diduga bukan kalus embriogenik. Tipe kalus yang tumbuh dari eksplan petal sejak awal waktu munculnya merupakan kalus tipe 1 dan kalus tipe 2. Seluruh kalus dari eksplan endosperm adalah kalus tipe 1.
Embrio somatik tahap globular telah diperoleh dari eksplan embrio zigotik muda berukuran 6 mm yang dikulturkan pada media dasar MS + pikloram 15 ppm mulai 18 hari setelah tanam (HST). Semua kalus yang tumbuh dari eksplan embrio zigotik muda selain perlakuan tersebut merupakan kalus tipe 2.
Perlakuan konsentrasi BA 0.0, 0.3, 0.5, 1.0, dan 2.0 ppm pada media dasar MS dengan vitamin media B5 yang dilengkapi dengan glutamina 100 ppm, asparagina 100 ppm, kasein hidrolisat 500 ppm, dan pikloram 0.5 ppm tidak berpengaruh nyata pada semua variabel pengamatan percobaan 2. Kalus tipe 1 asal eksplan petal genotipe Simas yang ditanam pada percobaan 2 ini tidak membentuk embrio somatik maupun kalus yang bersifat embriogenik.
SUMMARY
NUR ARIFIN. Induction of Embryogenic Callus and Somatic Embryo of Durian (Durio zibethinus Murr.) on Various Media Composition. Supervised by DARDA EFENDI, DEWI SUKMA and RAGAPADMI PURNAMANINGSIH.
Durian is a valuable tropical fruit. Durian agribusiness in Indonesia is still lags behind neighboring countries such as Thailand and Malaysia, whereas genetic, land and climatic resources for durian in Indonesia are better than those of other countries. Durian tissue culture can be applied for durian genetic improvement and mass propagation of elite varieties which finally can promote durian agribusiness in Indonesia. However, researches on durian tissue culture are still very limited. The objective of this study is to obtain the suitable type of explants, media, and plant growth regulator in embrogenic callus and somatic embryo induction of durian.
The study was conducted in 2 successive trials. The first experiment was callus induction and the second trial was somatic embryogenesis induction of callus obtained from the first experiment. There were 4 type of explants used on callus induction experiment, namely flower receptacle, petal, endosperm and immature zygotic embryo of durian. Callus induction from flower receptacle and petal explants were arranged as a factorial two factors experiment. The first factor was durian genotype, namely Dramaga, Matahari and Simas, and the seond factor was 14 media composition which were composed of two types of basal media (MS and B5) and 7 level of plant growth regulator (PGR ), i.e., without PGR, 2, 4, 6 ppm of NAA and 2, 4, 6 ppm of picloram. Callus induction with endosperm and immature zygotic embryo explants using 1 genotype, viz. Otong. Experiments on endosperm explant was arranged as a factorial two factors experiment, that is benziladenin (BA) treatment (0 and 1 ppm) and thidiazuron (TDZ) treatment (0.0, 0:01, 0:05, 0.5 ppm) in the MS basal medium + B5 media vitamin with 100 ppm glutamine, 100 ppm asparagine, 500 ppm casein hydrolysate, and 0.5 ppm picloram. The treatments on callus induction from immature zygotic embryo explant were 5, 10, 15, and 20 ppm of picloram on MS basal medium. The second experiment was the induction of somatic embryogenesis of petal explants derived calluses by treatment with 0.0, 0.3, 0.5, 1.0, and 2.0 ppm BA on MS basal medium with B5 vitamin, 100 ppm glutamine, 100 ppm asparagine, 500 ppm casein hydrolysate, and 0.5 ppm picloram.
The best medium composition on callus induction from flower receptacle explant was B5 basal medium with addition 2 ppm of NAA. The best one for petal explant was B5 basal medium with addition 2 ppm of picloram. Based on the result of percentage of explant producing calluses and callus emergence rate on petal and flower receptacle explants, it was indicated that Matahari variety was more responsive than Dramaga accession and Simas variety.
or pure white compact callus (type 2 callus). All three type of calluses, from morphological and histological observations, were supposed to be non-embryogenic ones. The type of calluses that grew from petal explants since the beginning of their emergence were of type 1 and type 2 calluses. All calluses produced from endosperm explant were of type 1 callus.
Globular stage somatic embryos have been obtained from 6 mm immature zygotic embryo explant cultured on MS basal medium + 15 ppm picloram at 18 days after culture. All calluses originated from immature zygotic embryo explants other than that medium composition were type 2 calluses.
The treatment of 0.0, 0.3, 0.5, 1.0, and 2.0 ppm of BA on MS basal medium with B5 vitamin, 100 ppm glutamine, 100 ppm asparagine, 500 ppm casein hydrolysate, and 0.5 ppm picloram did not give significant effect on all variables observed on second trial. The type 1 callus derived from petal explant of Simas genotype that were cultured on those media did not form somatic embryo or embryogenic callus.
© Hak Cipta Milik IPB, Tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Pemuliaan dan Bioteknologi Tanaman
INDUKSI KALUS EMBRIOGENIK DAN EMBRIO
SOMATIK DURIAN (
Durio zibethinus
Murr.)
PADA BERBAGAI KOMPOSISI MEDIA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis : Induksi Kalus Embriogenik dan Embrio Somatik Durian (Durio zibethinus Murr.) pada Berbagai Komposisi Media
Nama : Nur Arifin NIM : A253090111
Disetujui oleh Komisi Pembimbing
Dr. Ir. Darda Efendi, M.Si. Ketua
Dr. Dewi Sukma, S.P., M.Si. Anggota
Dr. Ir. Ragapadmi Purnamaningsih, M.Si. Anggota
Diketahui oleh
Ketua Program Studi
Pemuliaan dan Bioteknologi Tanaman
Dr. Ir. Trikoesoemaningtyas, M.Sc.
Dekan Sekolah Pascasarjana
Dr. Ir. Dahrul Syah, M.Sc.Agr.
PRAKATA
Alhamdulillah, segala puji bagi Allah SWT atas segala rahmat dan karunia-Nya sehingga tesis yang berjudul “Induksi Kalus Embriogenik dan Embrio Somatik Durian (Durio zibethinus Murr.) pada Berbagai Komposisi Media” dapat diselesaikan. Ucapan terima kasih yang tak terhingga penulis sampaikan kepada:
Dr. Ir. Darda Efendi, Msi., Dr. Dewi Sukma, SP. Msi., dan Dr. Ir Ragapadmi Purnamaningsih, Msi. selaku komisi pembimbing atas bimbingan dan arahannya selama perencanaan penelitian, pelaksanaan, hingga penulisan tesis.
Dr. Ir. Trikoesoemaningtyas, M.Sc. selaku ketua Program Studi Pemuliaan dan Bioteknologi Tanaman IPB.
Dr. Ir. Agus Purwito, M.Sc.Agr. selaku peguji luar komisi pada saat Ujian Tesis.
Seluruh tenaga pengajar, staf akademik, dan teknisi yang telah memberikan bantuan selama penulis belajar di IPB.
Dr. Diny Dinarti selaku Penanggungjawab Laboratorium Kultur Jaringan 3, Ibu Siti Kholifah, Ibu Juju Juariah dan teman-teman peneliti di Laboratorium Kultur Jaringan 1 dan 3, atas bantuan dan kebersamaannya.
Forum Mahasiswa Pascasarjana AGH-IPB (FORSCA AGH – IPB) atas kebersamaan dan dukungannya.
Universitas Tanjungpura Pontianak atas beasiswa yang diberikan.
Pimpinan dan karyawan Kebun Durian Warso Farm, Kebun Buah Mekarsari, dan Kebun Percobaan Cipaku atas bantuan bahan eksplan untuk penelitian.
Kedua orang tua, istri, dan anak tercinta atas bimbingan, doa, pengertian, dan motivasinya selama penulis menempuh pendidikan pascasarjana di IPB.
Semoga Allah melipatgandakan kebaikan yang diberikan dan semoga tesis ini bermanfaat. Aamiin Ya Robbal „aalamin.
Bogor, Juli 2013
DAFTAR ISI
DAFTAR TABEL xviii
DAFTAR GAMBAR xviii
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 3
Tujuan Penelitian 4
Hipotesis 4
Ruang Lingkup Penelitian 4
2 TINJAUAN PUSTAKA 5
Biologi durian 5
Kultur Jaringan 7
Embriogenesis Somatik 9
3 BAHAN DAN METODE 15
Waktu dan Tempat Penelitian 15
Bahan dan Alat 15
Metode Percobaan 16
Analisis Data 23
4 HASIL DAN PEMBAHASAN 23
Induksi Kalus Embriogenik Durian dari Berbagai Eksplan pada
Berbagai Komposisi Media 23
Respon Kalus Tipe 1 Durian terhadap Konsentrasi BA pada Media
Induksi Embriogenesis Somatik 34
Pembahasan Umum 36
5 KESIMPULAN DAN SARAN 37
Kesimpulan 37
Saran 38
DAFTAR PUSTAKA 38
DAFTAR TABEL
1 Produksi, impor dan ekspor durian di Indonesia tahun 2005-2011 1 2 Komposisi nutrisi daging buah durian (per 100 gr) 6 3 Komposisi berbagai media dasar kultur jaringan 8
4 Daftar komposisi media pada kultur kakao 11
5 Daftar komposisi media pada kultur nangka 12
6 Daftar komposisi media pada kultur kopi 13
7 Daftar komposisi media pada kultur jambu monyet 14
8 Daftar komposisi media pada kultur mangga. 15
9 Komposisi media percobaan induksi kalus dengan eksplan dasar
bunga dan petal 18
10 Komposisi ZPT pada media induksi untuk kultur endosperm 20 11 Pengaruh genotipe terhadap waktu muncul kalus dan persentase
eksplan berkalus pada eksplan dasar bunga 23
12 Pengaruh komposisi media terhadap persentase eksplan berkalus, waktu muncul kalus, tipe kalus dan skor ukuran kalus pada eksplan
dasar bunga 24
13 Pengaruh genotipe terhadap waktu muncul kalus dan persentase
eksplan berkalus pada eksplan petal 26
14 Pengaruh komposisi media terhadap persentase eksplan berkalus, waktu muncul kalus, tipe kalus dan skor ukuran kalus pada eksplan
petal 27
15 Hasil pengamatan terhadap pertumbuhan kalus dari eksplan
endosperm durian 32
16 Pengaruh tambahan pikloram pada media dasar MS terhadap pertumbuhan kalus dari eksplan embrio zigotik durian. 33 17 Pengaruh tambahan BA terhadap pertambahan ukuran kalus, jumlah
kalus embriogenik dan jumlah embrio somatik dari kalus tipe 1 asal
petal varietas Simas. 35
DAFTAR GAMBAR
1 Konsep hubungan komponen utama pada induksi embriogenesis
somatik 10
2 Diagram alir pelaksanaan penelitian 17
3 Eksplan dasar bunga dan petal 19
4 Kondisi kalus penampakan langsung dan mikroskopis 22 5 Embriogenesis somatik dan regenerasi tanaman pada Dianthus
caryophillus 29
6 Tipe kalus berbeda dihasilkan pada eksplan yang sama 29
7 Kalus dari eksplan endosperm 32
8 Perkembangan kalus dan embrio somatik globular dari eksplan
embrio zigotik durian 34
9 Perkembangan kondisi kalus asal eksplan petal dalam percobaan
1
PENDAHULUAN
Latar Belakang
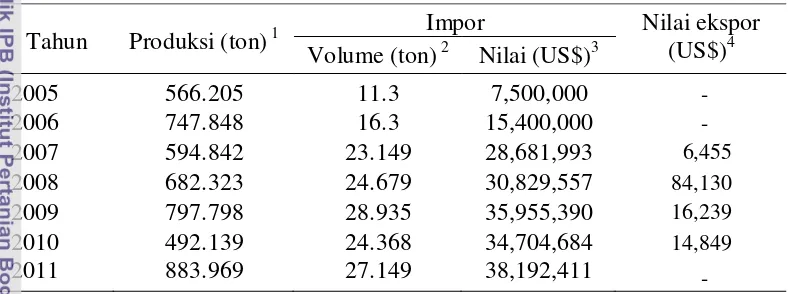
Durian merupakan komoditas hortikultura yang disukai banyak orang dan mempunyai nilai ekonomi yang tinggi. Harga durian dari tahun ke tahun cenderung meningkat. Pengembangan perkebunan durian mempunyai prospek yang baik karena masih terdapat kesenjangan antara pasokan dengan permintaan. Impor durian Indonesia cenderung meningkat baik volume maupun nilainya (Tabel 1), sementara pasokan dari produksi dalam negeri bersifat musiman dan fluktuatif, tidak dapat memenuhi permintaan konsumen yang kontinu akan buah durian dengan kualitas baik.
Tabel 1 Produksi, impor dan ekspor durian di Indonesia tahun 2005-2011 Tahun Produksi (ton) 1 Impor Nilai ekspor (US$)4
Volume (ton) 2 Nilai (US$)3
2005 566.205 11.3 7,500,000
-2006 747.848 16.3 15,400,000
-2007 594.842 23.149 28,681,993 6,455
2008 682.323 24.679 30,829,557 84,130
2009 797.798 28.935 35,955,390 16,239
2010 492.139 24.368 34,704,684 14,849
2011 883.969 27.149 38,192,411
-Sumber: 1: BPS (2013); 2: Dirjen Hortikultura (2013a); 3: Dirjen Hortikultura (2013b); 4: Dirjen Hortikultura (2013c).
Durian tersebar di Asia Tenggara dengan pusat keragaman berada di pulau Kalimantan (Subhadrabandhu dan Ketsa 2001). Indonesia mempunyai kekayaan genetik durian yang tinggi yang dapat dijadikan sumber plasma nutfah dalam pencarian dan perakitan varietas unggul baru. Tanpa upaya pencarian dan perakitan varietas unggul, keragaman genetik yang tinggi tersebut merupakan kelemahan karena akan membuat kualitas produk yang tidak seragam sehingga sering membuat konsumen kecewa. Indonesia semestinya menjadi negara eksportir durian terbesar di dunia karena selain keragaman genetik yang tinggi, Indonesia mempunyai wilayah dengan agroekosistem yang sesuai untuk budidaya durian lebih luas daripada negara-negara tetangga di Asia Tenggara. Namun kenyataannya teknologi budidaya dan agribisnis durian di Indonesia masih belum maju, tertinggal dari Thailand dan Malaysia. Produksi durian di Indonesia lebih banyak berasal dari hutan dengan kualitas yang beragam. Petani atau pengusaha yang membudidayakan durian unggul dalam skala besar sangat terbatas.
2
Pengembangan perkebunan durian oleh BUMN, perusahaan swasta maupun petani akan memerlukan berbagai sarana produksi, termasuk bibit durian unggul yang sehat dan berkualitas baik dalam jumlah yang cukup pada waktu diperlukan. Perlu dilakukan upaya pencarian dan perakitan varietas durian unggul baru serta teknologi perbanyakan bibit durian yang memungkinkan perbanyakan secara cepat dan seragam untuk mendukung ketersediaan bibit durian unggul yang sehat dan bermutu di Indonesia.
Perbanyakan bibit durian unggul selama ini umumnya dilakukan dengan penyambungan dan okulasi. Metode perbanyakan ini masih mempunyai keterbatasan untuk produksi massal, yaitu ketersediaan batang bawah yang tidak kontinu karena tergantung musim buah durian dan keterbatasan entres (batang atas) berkaitan dengan tahap perkembangan pucuk, gangguan hama dan penyakit, dan sebagainya. Keseragaman bibit yang dihasilkan juga relatif rendah. Selain itu metoda perbanyakan ini juga berpeluang menularkan organisme pengganggu tanaman baik yang berasal dari batang bawah maupun dari batang atas. Distribusi bibit dari satu daerah ke daerah lain dengan demikian berpeluang menyebarkan bibit penyakit atau hama yang tidak kita inginkan.
Teknik kultur jaringan dapat diterapkan untuk mengatasi faktor pembatas tersebut karena dengan kultur jaringan kita dapat memperoleh propagul (bahan tanam) yang banyak dengan produksi yang kontinu dalam waktu relatif singkat (Bhojwani dan Razdan 1996). Keuntungan lain perbanyakan tanaman durian menggunakan teknik kultur jaringan antara lain dapat dilakukan kapan saja tidak tergantung musim buah durian, bahan perbanyakan tidak harus banyak sehingga tidak merusak tanaman induk, kecepatan perbanyakan tinggi, bibit yang dihasilkan seragam dan bebas patogen (cendawan, bakteri, bisa juga virus). Seleksi calon batang bawah terkait ketahanan terhadap cekaman biotik dan abiotik dapat dilakukan lebih cepat dengan kultur jaringan durian melalui prosedur seleksi in vitro. Kultur jaringan durian juga dapat diterapkan untuk program pemuliaan yang sulit dilakukan dengan pemuliaan konvensional, misalnya perakitan tanaman durian triploid. Selain itu, dengan didapatkan protokol regenerasi tanaman durian secara in vitro akan membuka peluang pengembangan rekayasa genetika durian yang memungkinkan studi dan modifikasi gen pengendali sifat-sifat penting seperti pembungaan, perkembangan biji, ketahanan simpan, dan sebagainya.
Penelitian tentang kultur jaringan tanaman durian sampai sekarang masih sangat terbatas. Brown (1997) telah melaporkan keberhasilan membentuk kalus dari kultur pucuk Durio lowianus, namun belum berhasil membentuk planlet. Chartisathian (2001) telah melaporkan induksi kalus embriogenik dari eksplan nuselus durian, namun juga baru didapatkan kalus, belum didapatkan embrio somatik maupun planlet. Oleh karena itu, penelitian untuk mendapatkan teknik perbanyakan durian dengan kultur jaringan perlu terus dilakukan.
3 plasma nutfah. Embriogenesis somatik merupakan suatu proses kunci dalam perbanyakan tanaman dan produksi tanaman transgenik, serta merupakan suatu sistem model untuk memahami pertumbuhan dan differensiasi tanaman dalam penelitian dasar (Neumann et al. 2009).
Mengingat masa juvenil tanaman durian yang panjang, perbanyakan tanaman durian dengan embriogenesis somatik layak diterapkan untuk perbanyakan batang bawah durian. Planlet yang dihasilkan dari perbanyakan ini dapat digunakan untuk penyambungan mikro (micrografting) maupun penyambungan dan okulasi konvensional. Penerapan perbanyakan ini dapat mengatasi permasalahan perbanyakan batang bawah secara konvensional dari biji yang hanya dapat dilakukan pada saat musim buah durian. Bibit hasil perbanyakan dengan embriogenesis somatik tetap memiliki keunggulan seperti perbanyakan asal biji dalam hal keberadaan akar tunggang.
Penelitian tentang induksi embriogenesis somatik dan pematangan embrio somatik pada berbagai spesies tanaman telah banyak dilakukan. Pada umumnya induksi embriogenesis somatik memerlukan kandungan nutrisi media, zat pengatur tumbuh (ZPT), pencahayaan dan suhu yang sesuai. ZPT yang umum digunakan untuk menginduksi embriogenesis somatik bisa dari kelompok auksin (Pareek dan Kothari 2003), sitokinin (Singh et al. 2003; Mujib et al. 2005), atau kombinasi auksin dan sitokinin (Thomas dan Jiménez 2005; Bhattacharya et al. 2010; Lin et al. 2011). Indrianto et al. (1999) melaporkan beberapa kondisi cekaman dapat merangsang embriogenesis somatik.
Regenerasi tanaman melalui jalur embriogenesis somatik juga telah dilaporkan berhasil pada beberapa spesies tanaman berkayu, antara lain pada jambu monyet (Nadgauda dan Gogate 2005), nangka (Roy dan Debnath 2005), kopi (Etienne 2005), kakao (Maximova et al. 2005), mangga (Ara et al. 2005) dan lain-lain. Protokol regenerasi tanaman melalui jalur embriogenesis somatik yang telah berhasil tersebut dapat dijadikan acuan dalam upaya mengembangkan protokol induksi embriogenesis somatik tanaman berkayu lain yang sementara ini belum pernah dikembangkan, termasuk durian.
Perumusan Masalah
Agribisnis durian di Indonesia masih perlu ditingkatkan untuk meningkatkan kesejahteraan masyarakat dan mengejar ketertinggalan dari agribisnis durian negara-negara tetangga. Untuk itu perlu dilakukan pembangunan perkebunan durian unggul skala besar, baik oleh pemerintah, perusahaan swasta maupun petani perseorangan. Banyak faktor pendukung yang perlu disediakan, termasuk upaya untuk mendapatkan varietas durian yang lebih unggul dan penyediaan bibit durian unggul yang sehat dan bermutu dengan jumlah yang cukup pada waktu diperlukan. Teknik kultur jaringan dapat diterapkan untuk memenuhi kedua hal tersebut.
4
kombinasi keduanya merupakan media yang banyak digunakan dalam kultur jaringan berbagai spesies tanaman. ZPT yang paling banyak digunakan dalam induksi embriogenesis somatik adalah ZPT dari kelompok auksin. Maka dalam penelitian ini digunakan media dasar MS dan B5 dengan ZPT pikloram dan NAA untuk induksi embriogenesis somatik pada durian.
Jenis eksplan menentukan kemudahan pembentukan embrio somatik. Eksplan yang paling mudah membentuk embrio somatik adalah embrio zigotik muda. Walau demikian, embrio zigotik merupakan individu baru hasil rekombinasi gamet. Proses segregasi dalam pembentukan gamet dari pasangan alela tetua maupun proses rekombinasi gamet membentuk zigot terjadi secara acak sehingga konstitusi genetik maupun performa/penampilan fenotipik individu hasil kultur embrio zigotik belum diketahui. Penggunaan embrio zigotik sebagai eksplan dapat dilakukan untuk tujuan perbanyakan batang bawah untuk keperluan penyambungan mikro (micrografting) ataupun penyambungan konvensional, perbanyakan hasil persilangan terkontrol dan tujuan lain yang relevan.
Tiap bagian tanaman dapat memberikan respon berbeda terhadap regenerasi tanaman melalui jalur embriogenesis somatik in vitro. Dalam penelitian ini digunakan eksplan dasar bunga, petal, endosperm, dan embrio zigotik muda durian.
Tujuan Penelitian
Tujuan penelitian ini adalah untuk mendapatkan kombinasi media, ZPT, dan eksplan terbaik dalam induksi kalus embriogenik dan induksi embrio somatik pada kultur jaringan durian.
Hipotesis
Diduga keberhasilan induksi embriogenesis somatik pada durian tertinggi akan didapatkan pada media MS dengan ZPT pikloram dengan eksplan embrio zigotik muda.
Ruang Lingkup Penelitian
5
2
TINJAUAN PUSTAKA
Biologi durian
Durian (Durio zibethinus Murr.) merupakan tanaman buah tropika yang berasal dari Asia Tenggara, meliputi Semenanjung Malaya dan Indonesia. Buah durian mempunyai cita rasa yang khas dan nilai ekonomi yang tinggi sehingga dijuluki raja buah-buahan tropika (King of tropical fruits). Nama „Durio ‟ diambil dari bahasa melayu „duri‟ dan „zibethinus‟ diambil dari bahasa italia „zibetto‟ yang berarti berbau tajam (Nakasone dan Paul 1998). Dewasa ini pertanaman durian telah menyebar ke daerah lain, diantaranya Madagaskar, Kongo, Queensland, Australia bagian utara, Florida dan Hawaii (Subhadrabandhu dan Ketsa 2001).
Durian termasuk dalam Kingdom Plantae, Subkingdom Viridaeplantae, Infrakingdom Streptophyta, Divisi Tracheophyta, Subdivisi Spermatophytina, Infradivisi Angiospermae, Kelas Magnoliopsida, Superordo Rosanae, Ordo Malvales, Family Malvaceae, Genus Durio, Spesies Durio zibethinus Murray (ITIS 2013). Walaupun demikian dalam beberapa literatur disebutkan durian termasuk Famili Bombacaceae, subfamili Helicteroideae, tribe Durioneae (Subhadrabandhu dan Ketsa 2001; USDA 2013). Terdapat 28 spesies dalam genus Durio, 19 spesies diantaranya terdapat di Pulau Kalimantan. Dari 28 spesies tersebut hanya 8 spesies yang menghasilkan buah yang layak dimakan, yaitu Durian (Durio zibethinus Murr.), Lai (D. kutejensis (Hassk.) Becc.), Keratogan (D. oxleyanus Griffith.), Tabelak (D. graveolens Becc.), Lahong (D. Dulcis Becc.), durian kura-kura (D. testudinarum Becc.), durian monyet (D. grandiflorus (Mast.) Kosterm.) dan chaarian (D. lowianus Scort.). Hanya D. zibethinus yang dikembangkan secara komersial karena mempunyai kualitas buah dan nilai ekonomi paling tinggi. Terdapat banyak varietas D. zibethinus yang dikembangkan, diantaranya Mon Thong, Chanee, Kradum Thong dan sebagainya di Thailand; D2, D10, D24, D99, D123, MDUR78, MDUR88, dan sebagainya di Malaysia; Matahari, Petruk, Sunan, Simas, Kalapet, Aspar, Raja Mabah, dan sebagainya di Indonesia (Subhadrabandhu dan Ketsa 2001).
Durian merupakan tanaman tahunan berbentuk pohon yang dapat berumur sampai dengan 150 tahun. Tinggi tanaman dapat mencapai 40 meter atau lebih, dengan diameter batang dapat mencapai 50 sampai 120 cm. Cabang utama tumbuh dari batang utama ke segala arah. Bentuk tajuk adalah kerucut atau kubah (columnar), tergantung genotipe dan cara perbanyakan. Daun durian berupa daun tunggal, tersusun berseling, berbulu, menjuntai, bentuk oval atau elip, panjang 8 sampai 12 cm dan lebar 4 sampai 6 cm. warna permukaan atas daun adalah hijau muda sampai hijau tua, sementara permukaan bawah coklat keperakan (Subhadrabandhu dan Ketsa 2001).
6
menyerbuk silang, bahkan terdapat klon yang menunjukkan gejala ketakserasian sendiri (self incompatibility) sehingga memerlukan serbuk sari dari varietas lain untuk pembentukan buah yang normal (George et al. 1994; Nanthachay 1994). Penyerbukan yang tidak sempurna dapat menyebabkan adanya ruang buah (loculus) kosong yang berakibat bentuk buah tidak simetris dan menurunkan kualitas buah (Nanthachay dan Sapii 1994).
Buah durian berbentuk bulat sampai lonjong, ukuran bervariasi antar varietas, diameter melintang 13 sampai 16 cm dan diameter membujur 15 sampai 25 cm. Tangkai buah cukup panjang, 5 sampai 6 cm berdiameter 1 sampai 1.2 cm. Kulit buah tebal, tertutup oleh duri-duri berbentuk piramid yang runcing, keras dan tajam. Di dalam buah biasanya terdapat 5 ruang, kadang-kadang ada yang 6. Dalam tiap ruang terdapat 7 sampai 9 bakal biji. Perkembangan buah sejak penyerbukan sampai buah masak memerlukan waktu 90 sampai 115 hari (Subhadrabandhu dan Ketsa 2001). Selama perkembangan buah tersebut terdapat hubungan yang erat antara diameter tangkai buah dengan bobot kering seluruh bagian buah (Ogawa et al. 2007). Dengan demikian ukuran tangkai buah dapat dijadikan penanda tingkat perkembangan buah durian. Buah durian mempunyai kandungan nutrisi yang tinggi, walaupun terdapat variasi yang tinggi antara buah dari pohon yang berlainan (Tabel 2). Selain itu, daging buah durian juga mengandung senyawa volatil yang mencakup 22 jenis ester, 9 jenis alkana mengandung belerang, 3 jenis tioasetal, 2 jenis tioester, 2 jenis tiolana dan 1 jenis alkohol (Chin et al. 2007).
Tabel 2 Komposisi nutrisi daging buah durian (per 100 g)
Komponen a b c d e f
Sumber: a–e Nanthachay (1994); f. Subhadrabandhu dan Ketsa (2001).
7 Zappala 1994). Curah hujan optimum 1500 sampai 2500 mm per tahun yang tersebar merata sepanjang tahun, dan akan lebih baik pada daerah dengan curah hujan diatas 3000 mm per tahun.
Ketinggian tempat (altitude) yang optimum untuk durian adalah 50 sampai 500 meter dari permukaan laut. Jenis tanah yang ideal adalah tanah yang subur, lapisan tanahnya dalam dengan drainase yang baik dan pH 4.5 sampai 6.5. Topografi datar sampai berlereng dengan kemiringan sedang dibawah 35o (Subhadrabandhu dan Ketsa 2001).
Kultur Jaringan
Kultur jaringan tanaman adalah suatu metode perbanyakan vegetatif yang dilakukan dengan cara mengisolasi bagian tanaman (protoplas, sel, jaringan, organ) dan menumbuhkannya dalam wadah yang kondisinya terkontrol agar bagian tanaman tersebut memperbanyak diri dan beregenerasi kembali menjadi tanaman lengkap (Hartmann et al. 1990). Istilah kultur jaringan berlaku umum, walau yang dikulturkan sebenarnya adalah sel, protoplas, jaringan, atau organ. Kultur jaringan tanaman telah berkembang dari percobaan untuk pembuktian teori totipotensi menjadi metode perbanyakan tanaman yang mempunyai banyak keunggulan. Keuntungan perbanyakan tanaman menggunakan teknik kultur jaringan antara lain dapat dilakukan kapan saja, bahan perbanyakan tidak harus banyak sehingga tidak merusak tanaman induk, kecepatan perbanyakan tinggi, bibit yang dihasilkan seragam dan bebas patogen (cendawan, bakteri, bisa juga virus), dan dapat memperbanyak tanaman yang perbanyakannya secara alami sulit contohnya anggrek. Penerapan teknik kultur jaringan tanaman telah berkembang lebih luas lagi yakni untuk perbanyakan massal tanaman yang unik, perakitan tanaman transgenik, sebagai sistem model dalam fisiologi sel tanaman, penyelamatan tanaman langka, dan rekayasa metabolisme senyawa kimia tertentu (Loyola-Vargas dan Vázquez-Flota 2006). Dewasa ini kultur jaringan tanaman sudah menjadi salah satu bidang ilmu dalam bioteknologi tanaman, bersama dua bidang ilmu lain yaitu rekayasa genetika dan marka (penanda) molekuler tanaman (Aladele et al. 2012).
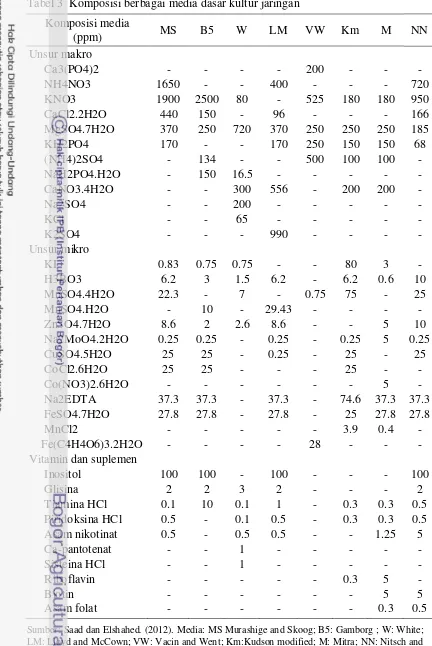
8
Tabel 3 Komposisi berbagai media dasar kultur jaringan Komposisi media
Sumber: Saad dan Elshahed. (2012). Media: MS Murashige and Skoog; B5: Gamborg ; W: White;
9 Hormon tanaman adalah sekelompok senyawa organik alami yang mempengaruhi proses-proses fisiologi tanaman dalam konsentrasi rendah (Arteca 1996; Davies 2004), sedangkan zat pengatur tumbuh (ZPT) adalah senyawa kimia sintetis yang mempunyai karakteristik yang sama dengan hormon tanaman atau senyawa kimia yang dapat mempengaruhi pertumbuhan tanaman. Ada 5 kelompok ZPT dan hormon yang telah dikenal dalam mempengaruhi dan mengatur pertumbuhan dan perkembangan tanaman, yaitu auksin, sitokinin, giberelin, asam absisat dan etilen. Perkembangan terbaru telah memasukkan brassinosteroid, asam salisilat, dan jasmonat ke dalam kelompok hormon tanaman (Davies 2004).
ZPT kelompok auksin berperan merangsang pemanjangan sel, terutama di daerah meristem, pembelahan sel dan pembentukan akar adventif. Senyawa-senyawa yang termasuk dalam kelompok auksin yang banyak digunakan dalam kultur jaringan antara lain α-naphtalenacetic acid (NAA), indole-3-acetic acid (IAA), 2,4-diclorophenoxyacetid acid (2,4-D), dan 4-amino-3,4,5, trichloro-picolinic acid (pikloram). Senyawa lain yang termasuk auksin adalah 2,4,5-triclorophenoxyacetid acid (2,4,5-T), indole-3-butyric acid (IBA) dan ρchloro -penoxyacetid acid (4-CPA) (Arteca 1996).
Sitokinin merupakan ZPT yang berperan meningkatkan pembelahan sel serta mengatur pertumbuhan dan perkembangan tanaman. Di dalam kultur jaringan, sitokinin berperan dalam proliferasi dan morfogenesis pucuk. Senyawa kelompok sitokinin yang banyak digunakan dalam kultur jaringan adalah kinetin, benziladenin atau benzilaminopurin (BA/BAP), zeatin dan 2-isopenteniladenina (2-iP). Selain itu air kelapa juga banyak dipakai sebagai sumber sitokinin alamiah dalam kultur jaringan.
Kombinasi auksin dan sitokinin dalam media akan memberikan pengaruh terhadap morfogenesis eksplan dalam kultur. Rasio auksin terhadap sitokinin yang tinggi umumnya menginduksi akar, embriogenesis dan pembentukan kalus, sementara rasio auksin yang rendah umumnya menginduksi proliferasi tunas adventif dan tunas aksilar (Van Staden et al. 2008).
Faktor lain yang berpengaruh terhadap keberhasilan kultur jaringan antara lain genotipe, jenis eksplan, dan kondisi lingkungan kultur yang meliputi suhu, kelembaban, cahaya, keasaman media (pH), dan kondisi aerasi kultur.
Embriogenesis Somatik
10
Proses pembentukan embrio somatik dari sel non embriogenik dapat dibagi menjadi 2 tahap, yaitu tahap induksi dan tahap ekspresi. Selama tahap induksi, sel-sel yang telah terdiferensiasi mengalami perubahan arah pertumbuhan dan perkembangan sehingga mendapatkan kemampuan embriogenik dan memperbanyak diri sebagai sel embriogenik. Selanjutnya pada tahap ekspresi sel-sel embriogenik menampilkan kemampuan embriogeniknya membentuk embrio somatik (Namasivayam 2007). Tahap induksi pada umumnya memerlukan auksin, yang paling banyak digunakan adalah 2,4-D. Keberadaan cekaman seperti cekaman pelukaan, cekaman ZPT, kelaparan nitrogen dan karbohidrat, dan cekaman suhu juga merupakan faktor kunci dalam menginduksi embrio somatik. Hormon/ZPT dan cekaman bersama-sama menginduksi dedifferensiasi sel dan menginisiasi embriogenesis pada genotipe yang responsif (Gambar 1, Rose et al. 2010). Perkembangan embrio somatik umumnya memerlukan penghilangan auksin berangsur-angsur atau penurunan konsentrasinya
Gambar 1 Konsep hubungan komponen utama pada induksi embriogenesis somatik
Faktor-faktor yang mempengaruhi embriogenesis somatik antara lain eksplan, genotipe, zat pengatur tumbuh (ZPT), sumber nitrogen, polyamine, kandungan oksigen terlarut, stimulasi elektrik, dan subkultur selektif (Bhojwani dan Razdan 1996). Faktor lain, seperti kandungan kalsium tinggi, antibiotik cefotaxim, inhibitor etilen, dicamba dan sebagainya telah dilaporkan dapat menginduksi embriogenesis somatik pada jenis tanaman tertentu.
Embrio zigotik muda merupakan eksplan terbaik untuk jenis tanaman yang termasuk kategori rekalsitran secara in vitro seperti serealia, biji-bijian legum dan tanaman hutan berkayu. Sejalan dengan itu, Neumann et al. (2009) menyatakan urutan eksplan dalam hal kemudahan induksi embrio somatik adalah embrio zigotik, hipokotil, tangkai daun, helaian daun, dan akar. Terdapat perbedaan respon terhadap induksi embriogenesis somatik antar genotipe (varietas, kultivar atau klon) dalam satu spesies yang sama, dan karakter ini diwariskan. ZPT yang paling umum digunakan dalam induksi embriogenesis somatik pada kebanyakan tanaman adalah 2,4-D. Kandungan nitrogen yang cukup dalam bentuk NH4+ dalam media lebih bersifat induktif, sementara media yang hanya mengandung NO3 -kurang atau tidak bersifat induktif. Keberadaan polyamine diperlukan dalam embriogenesis somatik maupun embriogenesis zigotik. Subkultur selektif yaitu hanya kalus yang bersifat embriogenik saja yang dipilih untuk dilanjutkan pada tiap tahap subkultur dapat meningkatkan keberhasilan regenerasi tanaman melalui embriogenesis somatik (Bhojwani dan Razdan 1996).
Embriogenesis somatik tanaman berkayu telah dilaporkan berhasil pada beberapa spesies. Beberapa ringkasan protokol propagasi in vitro melalui embriogenesis somatik tanaman berkayu adalah sebagai berikut:
Eksplan + cekaman + ZPT
Redeterminasi arah pertumbuhan/perkembangan
11 1. Kakao (Maximova et al. 2005)
Protokol regenerasi kakao dengan jalur embriogenesis somatik menggunakan eksplan pangkal petal dan staminodium. Eksplan ditanam pada media PCG (primary callus growth, Tabel 4) selama 2 minggu dalam keadaan gelap. Selanjutnya dipindahkan ke media SCG (secondary callus growth, Tabel 4) selama 2 minggu. Setelah dua minggu dalam media SCG kalus mulai berkembang, selanjutnya eksplan dipindahkan ke media ED (embryo development, Tabel 4).
Dua minggu setelah ditanam dalam media ED eksplan akan membengkak dan akan dijumpai dua tipe kalus. Tipe kalus pertama terdiri atas sel-sel yang memanjang dan berwarna putih. Kalus tipe pertama ini hampir tidak pernah menghasilkan embrio somatik. Tipe kalus kedua berstruktur remah, terdiri atas sel-sel berbentuk bulat, berwarna coklat muda sampai coklat tua. Kalus tipe kedua ini sering menghasilkan embrio somatik. Subkultur eksplan ke media ED yang baru dilakukan tiap 2 minggu. Embrio somatik banyak dihasilkan selama kultur pada media ED. Embrio somatik yang didapatkan tetap disubkultur pada media ED sampai tahap kotiledon dewasa berukuran ± 2 cm.
Tabel 4 Daftar komposisi media pada kultur kakao
Tahap Kultur Komposisi Media 0.328 ppm leusina + 0.456 ppm lisina + 0.511 ppm triptofan + 300 ppm KNO3+ 1.75 g/l fitagel
RD ½ DKW tanpa vitamin + 300 ppm KNO3 +10 g/l glukosa + 5 g/l sukrosa+ 1.75 g/l fitagel
Keterangan : PCG: primary callus growth; SCG: secondary callus growth; ED: embryo
development; PEC: primary embryo conversion; RD: root development.
Embrio somatik dewasa disubkultur ke media PEC (primary embryo akar sempurna dan 4 sampai 5 daun untuk aklimatisasi.
2. Nangka (Roy dan Debnath 2005)
12
dengan ukuran 0.5 sampai 0.7 cm untuk ditanam pada media induksi kalus (callus induction medium - CIM, Tabel 5). Kultur dipelihara dalam kondisi terang dengan suhu 24 oC selama 9 minggu dengan subkultur tiap 3 minggu. Dalam kultur ini akan dihasilkan kalus remah dan embrio somatik sampai tahap globular. Embrio globular selanjutnya disubkultur ke media perkembangan embrio (embryo development medium – EDM, Tabel 5) dan disubkultur pada media yang sama setiap 3 minggu hingga membentuk embrio somatik tahap kotiledon matang. Embrio tahap kotiledon selanjutnya disubkultur ke media perkecambahan embrio (embryo germination medium – EGM, Tabel 5).
Tabel 5 Daftar komposisi media pada kultur nangka
Tahapan Komposisi media
CIM MS + 2.5 ppm 2,4-D + 30 g/l sukrosa + 30 g/l sukrosa + 0.7% agar bakto
EDM MS + 30 ppm glutamina + 3 ppm BA + 1 ppm IBA + 30 g/l sukrosa + 0.7% agar bakto
EGM MS + 10% air kelapa + 1 ppm GA3 + 30 g/l sukrosa + 0.7% agar bakto
Keterangan : CIM: callus induction medium; EDM: embryo development medium; EGM:
embryo germination medium.
3. Kopi (Etienne 2005)
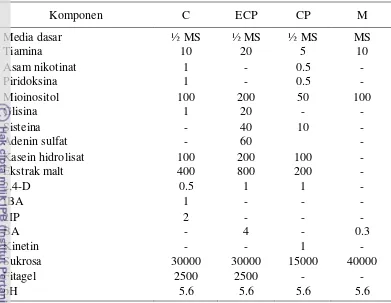
13 Tabel 6 Daftar komposisi media pada kultur kopi (satuan dalam ppm)
Komponen C ECP CP M
Media dasar ½ MS ½ MS ½ MS MS
Tiamina 10 20 5 10
Asam nikotinat 1 - 0.5 -
Piridoksina 1 - 0.5 -
Mioinositol 100 200 50 100
Glisina 1 20 - -
Sisteina - 40 10 -
Adenin sulfat - 60 -
Kasein hidrolisat 100 200 100 -
Ekstrak malt 400 800 200 -
2,4-D 0.5 1 1 -
IBA 1 - - -
2IP 2 - - -
BA - 4 - 0.3
Kinetin - - 1 -
Sukrosa 30000 30000 15000 40000
Fitagel 2500 2500 - -
pH 5.6 5.6 5.6 5.6
Keterangan : C: callus induction medium; ECP: embriogenic callus production medium; CP: callus proliferation medium; M: embryo maturation medium.
Kalus embriogenik tersebut akan berkembang menjadi embrio somatik jika disubkultur ke media pendewasaan (M, Tabel 6). Setelah embrio mencapai tahap kotiledonari matang yang ditandai dengan terbukanya kotiledon dan adanya aksis embrio yang berwarna hijau, embrio disemai pada campuran tanah, pasir dan pulp kopi yang telah disterilkan hingga berkembang menjadi planlet.
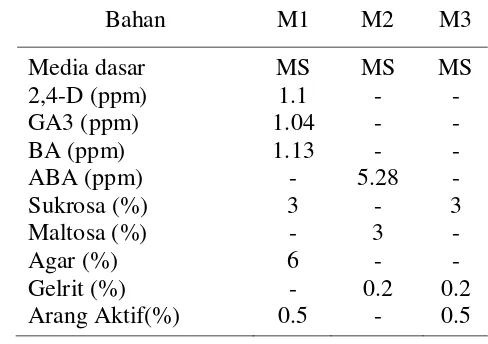
4. Jambu monyet (Nadgauda dan Gogate 2005)
14
Tabel 7 Daftar komposisi media pada kultur jambu monyet
Bahan M1 M2 M3
Eksplan yang digunakan untuk perbanyakan mangga secara in vitro melalui jalur embriogenesis somatik adalah nuselus. Buah mangga muda diambil pada 2 sampai 3 minggu setelah antesis. Setelah disterilkan, buah muda dibelah secara aseptik kemudian ambil bagian ovul, embrio zigotik dibuang, belahan ovul ditanam sedemikian sehingga jaringan nuselus menyentuh media induksi (A, Tabel 8) atau diambil jaringan nuselus saja dari belahan ovul untuk dikulturkan pada media induksi. Jika digunakan belahan ovul maka pada minggu pertama dilakukan subkultur ke media baru setiap satu atau dua hari dan minggu selanjutnya subkultur dilakukan setiap 7 sampai 10 hari. Jika digunakan jaringan nuselus maka subkultur ke media baru dilakukan setiap 7 sampai 10 hari. Kalus mulai muncul setelah 3 sampai 5 minggu eksplan dikulturkan pada media induksi. Kalus yang muncul pada mulanya basah berwarna coklat tua atau hitam. Kalus proembriogenik berwarna kuning pucat muncul hanya pada kalus basah yang berstruktur remah.
15 Tabel 8 Daftar komposisi media pada kultur mangga
Komponen A B C D E
Unsur makro ½ MS B5 B5 B5 ½B5
Unsur mikro MS MS MS MS MS
Fe-EDTA ½MS MS MS MS MS
Vitamin dan asam amino MS MS MS MS MS
Asam askorbat (ppm) 100 - - - -
L-glutamina (ppm) 400 400 400 400 400
Sukrosa (g/l) 60 60 60 60 30
Agar (g/l) 8 8 8 8 -
2,4-D (ppm) 1.0 1.0 - - -
GA3 (ppm) - - - - 1.0
ABA(ppm) - - - 0.005 -
Air kelapa (%) - - - 10 -
Keterangan : A: media inisiasi kalus dan produksi Kalus Proembrionik (KP); B: media proliferasi/pemeliharaan KP; C: media produksi embrio somatik; D: media pematangan embrio; dan E: media perkecambahan dan konversi embrio somatik.
Pengecambahan embrio somatik mangga dilakukan dengan memindahkan embrio somatik tahap kotiledonari dewasa ukuran 8 mm dengan kotiledon tebal berwarna putih kusam ke media perkecambahan (E, Tabel 8). Kultur dipelihara dalam kondisi terang 16 jam dan gelap 8 jam per hari sampai 4 minggu. Setelah 4 minggu dan embrio telah tumbuh akar tunjang, embrio dipindahkan ke media perkecambahan tanpa GA3 untuk mendorong perkembangan akar. Planlet yang normal selanjutnya diaklimatisasi dengan ditanam ke media campuran pasir dan tanah dengan perbandingan 3:1 dalam wadah yang disungkup plastik untuk mempertahankan kelembaban.
3
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian diaksanakan mulai Mei 2010 sampai Juni 2012. Kegiatan kultur jaringan dilakukan di Laboratorium Kultur Jaringan Departemen Agronomi dan Hortikultura, Fakultas Pertanian IPB. Analisis histologi dilaksanakan di Laboratorium Histologi, Fakultas Kedokteran Hewan IPB, Bogor.
Bahan dan Alat
16
varietas Simas didapatkan dari Cijeruk (Kebun Durian Warso Farm), bunga durian varietas Matahari diambil dari Cipaku (Kebun Percobaan Cipaku), Bogor. Buah durian muda didapatkan dari Cileungsi (Kebun Buah Mekarsari) dan Cijeruk (Kebun Durian Warso Farm). Media kultur yang digunakan adalah media MS (Murashige dan Skoog 1962), media B5, dan media MS dengan vitamin media B5. Zat pengatur tumbuh yang digunakan adalah pikloram, NAA, TDZ, dan BA. Bahan sterilan yang digunakan adalah cairan pemutih komersial (bleach), alkohol 96%, dan air steril. Alat yang digunakan meliputi Laminar Airflow Cabinet (LAFC), autoklaf, oven, botol kultur, lampu bunsen, petri dish, pinset, skalpel, rak kultur, dan peralatan lain yang umum untuk kultur jaringan. Mikroskop digunakan untuk pengamatan jaringan dan sel kalus.
Metode Percobaan
Gambar 2 Diagram alir pelaksanaan penelitian
Percobaan 2. Respon kalus tipe 1 durian terhadap konsentrasi BA pada media induksi embriogenesis somatik
Kalus embriogenik dan embrio somatik
Percobaan 1. Induksi kalus embriogenik durian dari berbagai eksplan pada berbagai komposisi media
18
Percobaan 1. Induksi kalus embriogenik durian dari berbagai eksplan pada berbagai komposisi media
Induksi kalus embriogenik dari eksplan dasar bunga durian
Percobaan induksi kalus dari eksplan dasar bunga disusun dalam percobaan 2 faktor. Faktor pertama adalah komposisi media (14 taraf, Tabel 9) dan faktor kedua adalah genotipe durian (aksesi Dramaga, varietas Simas, dan varietas Matahari). Percobaan menggunakan rancangan acak kelompok (RAK) dengan 4 ulangan, tiap ulangan terdiri atas 5 botol, dan tiap botol berisi 2 eksplan berasal dari satu dasar bunga yang dibelah menjadi 2 bagian. Seluruh unit percobaan diinkubasi dalam kondisi gelap pada suhu ±22 ºC.
Tabel 9 Komposisi media yang digunakan dalam percobaan induksi kalus dengan eksplan dasar bunga dan petal
Nomor Komposisi media 1 Media B5 tanpa ZPT 2 Media B5 + NAA 2 ppm 3 Media B5 + NAA 4 ppm 4 Media B5 + NAA 6 ppm 5 Media B5 + pikloram 2 ppm 6 Media B5 + pikloram 4 ppm 7 Media B5 + pikloram 6 ppm 8 Media MS tanpa ZPT 9 Media MS + NAA 2 ppm 10 Media MS + NAA 4 ppm 11 Media MS + NAA 6 ppm 12 Media MS + pikloram 2 ppm 13 Media MS + pikloram 4 ppm 14 Media MS + pikloram 6 ppm Keterangan : semua media menggunakan 30 g/l gula dan 10 g/l agar.
19
Gambar 3 Eksplan dasar bunga dan petal. a: ukuran bunga yang digunakan (tanda panah); b–h: proses sterilisasi sampai eksplan siap tanam. ca: calyx; ec: epicalyx; pt: petal, db: dasar bunga
Induksi kalus embriogenik dari eksplan petal durian
Percobaan induksi kalus dari eksplan petal disusun dalam percobaan 2 faktor. Faktor pertama adalah komposisi media (14 taraf, Tabel 9) dan faktor kedua adalah genotipe durian (aksesi Dramaga, varietas Simas, dan varietas Matahari). Percobaan menggunakan rancangan acak kelompok (RAK) dengan 4 ulangan, tiap ulangan terdiri atas 5 botol, dan tiap botol berisi 5 eksplan berasal dari satu bunga. Seluruh unit percobaan diinkubasi dalam kondisi gelap pada suhu ±22 ºC.
Bunga durian sebagai sumber eksplan diambil pada kondisi kuncup hampir mekar (ukuran panjang ±3 cm, diameter ±1.5 cm, Gambar 3a) karena bunga pada kondisi ini yang paling responsif terhadap induksi kalus (hasil percobaan pendahuluan, data tidak ditampilkan). Bunga dicuci dengan deterjen dan dibilas, direndam dalam larutan 30% pemutih selama 5 menit sambil terus dikocok, kemudian dimasukkan ke dalam alkohol 96% selama ½ sampai 1 menit. Bunga dilap dengan tisu steril, kemudian dibuang bagian epicalyx-nya, dipotong dan diambil 1/3 dari pangkal, dibuang bagian calyx, diambil bagian petal, dipotong bagian tepi yang tipis (gambar 3b sampai 3f), kemudian ditanam dalam media. Kegiatan perendaman dalam alkohol sampai penanaman dilakukan di LAFC.
Induksi kalus embriogenik dari eksplan endosperm durian
Percobaan disusun sebagai percobaan dua faktor yaitu konsentrasi BA dan TDZ pada media induksi (8 kombinasi perlakuan, Tabel 10). Komposisi media induksi adalah media dasar MS dengan vitamin media B5 yang dilengkapi dengan glutamina 100 ppm, asparagina 100 ppm, kasein hidrolisat 500 ppm, dan pikloram 0.5 ppm. Percobaan dilaksanakan dengan Rancangan Acak Kelompok (RAK) dengan jumlah ulangan 2 sampai 5 ulangan per perlakuan dan tiap ulangan terdiri atas 1 botol. Seluruh unit percobaan diinkubasi dalam kondisi gelap dengan suhu ±22ºC.
ca
b c
a d
e f g h
pt
db ec
20
Tabel 10 Komposisi ZPT pada media induksi untuk kultur endosperm No Konsentrasi BAP
Keterangan : Komposisi media induksi adalah media dasar MS dengan vitamin media B5 yang dilengkapi dengan glutamina 100 ppm, asparagina 100 ppm, kasein hidrolisat 500 ppm, pikloram 0.5 ppm, gula 30 g/l dan agar 10 g/l.
Buah muda durian varietas Otong diambil pada umur ± 2 bulan setelah antesis. Daging buah (aril) bersama biji dikeluarkan dari buah, selanjutnya aril dibuang. Biji dicuci dengan deterjen dan dibilas, direndam dalam larutan 30% pemutih selama 5 menit, kemudian ditiriskan. Tahap selanjutnya dilakukan dalam LAFC. Biji durian dimasukkan ke dalam alkohol 96% selama ½ sampai 1 menit. Selanjutnya biji dibuka untuk diambil endosperm dengan embrio didalamnya. Embrio dikeluarkan dari dalam endosperm dan ditanam langsung pada media perlakuan. Endosperm dipotong dengan ketebalan 0.3 sampai 0.5 cm kemudian ditanam pada media perlakuan.
Induksi kalus embriogenik dari eksplan embrio zigotik muda durian
Induksi kalus embriogenik dari eksplan embrio zigotik muda durian merupakan percobaan tunggal dengan perlakuan konsentrasi pikloram pada media dasar MS. Taraf konsentrasi yang digunakan adalah 5, 10, 15, dan 20 ppm. Percobaan dilaksanakan dengan Rancangan Acak Kelompok (RAK).dengan 2 ulangan dan tiap ulangan terdiri atas 1 botol. Seluruh unit percobaan diinkubasi dalam kondisi gelap pada suhu ±22 ºC.
Buah muda durian varietas Otong diambil pada umur ± 2 bulan setelah antesis. Daging buah (aril) bersama biji dikeluarkan dari buah, selanjutnya aril dibuang. Biji dicuci dengan deterjen dan dibilas, direndam dalam larutan 30% pemutih selama 5 menit, kemudian ditiriskan. Tahap selanjutnya dilakukan dalam LAFC. Biji durian dimasukkan ke dalam alkohol 96% selama ½ sampai 1 menit. Selanjutnya biji dibuka untuk diambil endosperm dengan embrio didalamnya. Embrio dikeluarkan dari dalam endosperm dan ditanam langsung pada media perlakuan. Embrio zigotik muda yang ditanam adalah embrio utuh yang panjangnya kurang dari 1 cm.
Pengamatan yang dilakukan pada percobaan induksi kalus adalah:
a. Waktu mulai terbentuk kalus dihitung dari tanggal tanam dengan satuan hari. b. Persentase eksplan membentuk kalus, yaitu jumlah eksplan yang membentuk
21 c. Ukuran kalus yang terbentuk, dibuat skor 1 sampai 5 berdasar perbandingan ukuran kalus terhadap ukuran eksplan awal, diamati pada minggu ke 4. Skor 1 = < 25%, skor 2 = 25-50%, skor 3 = 50-75%, skor 4 = 75-100%, skor 5 = lebih dari 100%.
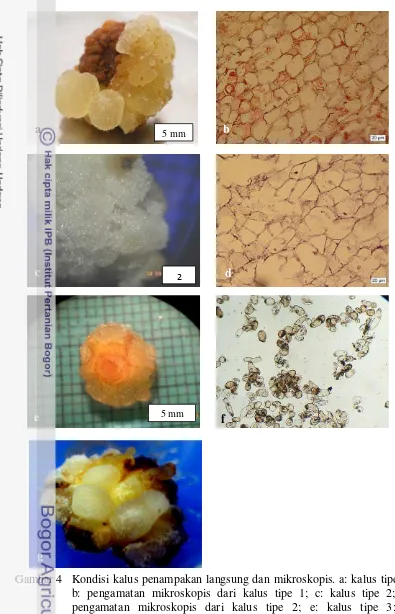
d. Pengamatan kualitatif terhadap tipe kalus yang terbentuk, (Gambar 4) meliputi pengamatan visual kalus dan pengamatan sel-sel kalus dengan mikroskop terhadap tiap tipe kalus. Pengamatan sel-sel kalus dengan mikroskop dilakukan dengan preparasi langsung untuk kalus remah dan dengan preparasi metode parafin (Lampiran 1) untuk kalus kompak.
Tipe 1: Kalus kompak, warna putih agak kekuningan, kadang-kadang bernodul. Jika sepotong kecil kalus disiapkan di atas kaca obyek, ditutup dengan kaca penutup dan ditekan sel-sel kalus akan hancur, tidak terlihat sel-sel yang berjajar.
Tipe 2: Kalus kompak, warna putih seperti kapas. Jika sepotong kalus disiapkan di atas kaca obyek, ditutup dengan kaca penutup dan ditekan, sel-sel kalus akan hancur, tidak terlihat sel-sel yang berjajar. Tipe 3: Kalus remah berair, transparan agak kecoklatan, jika sepotong kalus disiapkan di atas kaca obyek, ditutup dengan kaca penutup dan ditekan akan terlihat sel-sel yang terpisah berjajar.
Tipe 4: Muncul embrio somatik globular dan kalus agak transparan.
Percobaan 2. Respon kalus tipe 1 durian terhadap konsentrasi BA pada media induksi embriogenesis somatik
Kalus tipe 1 dari percobaan 1 eksplan petal varietas Simas disubkultur ke media induksi dengan perlakuan konsentrasi BA 0.0, 0.3, 0.5, 1.0, dan 2.0 ppm. Komposisi media induksi adalah media dasar MS dengan vitamin media B5 yang dilengkapi dengan glutamina 100 ppm, asparagina 100 ppm, kasein hidrolisat 500 ppm, dan pikloram 0.5 ppm. Percobaan disusun dengan rancangan acak kelompok dengan 7 ulangan, tiap ulangan terdiri atas 4 botol. Pengamatan meliputi jumlah kalus embriogenik dan jumlah embrio somatik yang terbentuk serta persentase pertambahan ukuran luas kalus yang dihitung dengan rumus:
Persentase pertambahan luas kalus = x 100% Luas kalus diukur menggunakan plastik transparan milimeter block. Plastik milimeter block dipasang pada bagian bawah botol kemudian dipotret dengan kamera. Ukuran luas kalus ditentukan dengan menghitung petak milimeter yang terdapat pada gambar kalus.
22
Gambar 4 Kondisi kalus penampakan langsung dan mikroskopis. a: kalus tipe 1; b: pengamatan mikroskopis dari kalus tipe 1; c: kalus tipe 2; d: pengamatan mikroskopis dari kalus tipe 2; e: kalus tipe 3; f: pengamatan mikroskopis dari kalus tipe 3; g: kalus tipe 4, merupakan kalus embriogenik dan muncul embrio somatik
c d
g
5 mm
2
a b
5 mm
23 Analisis Data
Data variabel persentase eksplan berkalus, waktu muncul kalus dan pertambahan ukuran kalus dianalisis dengan analisis ragam dan dilanjutkan dengan uji DMRT (Duncan Multiple Range Test) untuk faktor perlakuan yang berpengaruh nyata. Data skor tipe kalus (merupakan karakter kualitatif yang frekwensinya dihitung) dianalisis dengan Chi kuadrat dan Tabel Kontingensi. Data skor ukuran kalus dianalisis dengan uji Kruskal-Wallis (Zarr 2010).
4
HASIL DAN PEMBAHASAN
Induksi Kalus Embriogenik Durian dari Berbagai Eksplan pada Berbagai Komposisi Media
Induksi kalus embriogenik dari eksplan dasar bunga
Waktu muncul kalus
Analisis ragam pengaruh komposisi media dan genotipe terhadap kecepatan muncul kalus eksplan dasar bunga durian menunjukkan bahwa faktor genotipe (Tabel 11), komposisi media (Tabel 12) dan interaksi genotipe-komposisi media berpengaruh sangat nyata terhadap kecepatan muncul kalus eksplan dasar bunga. Komposisi media yang menghasilkan waktu muncul kalus yang cepat bervariasi antar genotipe. Waktu muncul kalus eksplan dasar bunga varietas Matahari dan aksesi Dramaga lebih cepat daripada varietas Simas.
Persentase eksplan berkalus
Persentase eksplan berkalus pada eksplan dasar bunga dipengaruhi oleh faktor komposisi media (Tabel 12), sementara faktor genotipe (Tabel 11) dan interaksi genotipe-komposisi media tidak berpengaruh nyata. Komposisi media yang mengandung ZPT NAA 2 sampai 6 ppm menghasilkan kalus dengan persentase 90.9 sampai 97.5 persen, sedangkan media yang mengandung ZPT pikloram 2 sampai 6 ppm menghasilkan kalus dengan persentase 65.8 sampai 77.1 persen (Tabel 12).
Tabel 11 Pengaruh genotipe terhadap waktu muncul kalus dan persentase eksplan berkalus pada eksplan dasar bunga
Genotipe Waktu muncul kalus (HST)
Eksplan berkalus (%)
Dramaga 4.49 b 80.46
Matahari 4.69 b 89.19
Simas 11.65 a 86.23
Keterangan : Angka-angka yang diikuti huruf yang sama tidak berbeda nyata pada uji DMRT
Tabel 12 Pengaruh komposisi media terhadap persentase eksplan berkalus, waktu muncul kalus, tipe kalus dan skor ukuran kalus pada eksplan dasar bunga durian
Komposisi Media
Eksplan berkalus
(%)
Waktu muncul kalus (HST) Proporsi (%) tipe kalus pada genotipe : Skor ukuran kalus
Dramaga Matahari Simas Dramaga Matahari Simas
Dramaga Matahari Simas Tipe 1 Tipe 2 Tipe 1 Tipe 2 Tipe 1 Tipe 2 Md Z Md Z Md Z
B5 tanpa ZPT 91.3 abc 4.2 c(A) 6.3(A) - 95.7 4.4 100.0 0 - - 1 -2.40 4 -0.06 -
-B5 + NAA 2 ppm 96.3 ab 4.2 c(B) 3.8(B) 9.1 cd(A) 88.7 11.3 100.0 0 82.6 17.4 2 3.12 5 1.04 3 -0.70
B5 + NAA 4 ppm 94.1 ab 4.0 c(B) 5.0(B) 9.6 cd(A) 80.9 19.2 100.0 0 86.4 13.6 3 5.40 4 -0.01 5 1.02
B5 + NAA 6 ppm 97.5 a 4.0 c(B) 4.0(B) 8.1 cd(A) 84.0 16 100.0 0 83.3 16.7 3 3.58 4 0.68 3.5 -0.46
B5 + pikloram 2 ppm 67.9 d 5.9 a(B) 4.8(B) 17.0 ab(A) 94.4 5.6 100.0 0 88.9 11.1 1 -2.81 3 -0.23 4.5 -0.2
B5 + pikloram 4 ppm 73.7 cd 6.4 a(B) 5.7(B) 11.0 cd(A) 78.4 21.6 100.0 0 95.7 4.3 1 -1.11 4 0.17 5 3.99
B5 + pikloram 6 ppm 70.8 d 6.1 a(B) 3.8(B) 9.8 cd(A) 85.7 14.3 100.0 0 100.0 0 2 -0.57 4.5 1.28 5 0.30
MS tanpa ZPT 79.7 abcd 5.0 b(A) 4.6(A) - 95.0 5.0 100.0 0 - - 3 3.29 4 -0.08 -
-MS + NAA 2 ppm 91.8 abc 3.9 c(B) 4.7(B) 7.35 d(A) 86.4 13.6 100.0 0 100.0 0 2 2.52 3.5 -0.22 4 0.77
MS + NAA 4 ppm 90.9 abc 3.8 c(B) 4.6(B) 9.18 cd(A) 83.3 16.7 100.0 0 100.0 0 2 2.18 4 -0.08 4 -0.04
MS + NAA 6 ppm 91.9 abc 3.9 c(B) 5.4(B) 13.18 cb(A) 89.8 10.2 100.0 0 100.0 0 1 -1.53 3 -1.63 5 0.32
MS + pikloram 2 ppm 73.8 cd 4.5 bc(B) 4.0(B) 20.12 a(A) 66.7 33.3 100.0 0 100.0 0 1 -5.41 3.5 -0.44 3 -1.4
MS + pikloram 4 ppm 77.1 bcd 4.1 c(B) 6.0(B) 17.12 ab(A) 45.9 54.1 85.7 14.3 94.1 5.9 1 -4.44 2 -1.32 3 0.08
MS + pikloram 6 ppm 65.8 d 4.0c(B) 2.8(B) 13.05 cb(A) 57.1 42.9 100.0 0 100.0 0 1 -4.34 4 1.19 1 -3.95
P-value 0.00 0.00 0.28 0.00 0.00 0.84 0.34 0.00 0.74 0.00
Keterangan: Angka-angka yang diikuti huruf kecil yang sama pada kolom yang sama dan angka-angka yang diikuti huruf besar yang sama pada baris yang sama tidak berbeda nyata pada uji DMRT (α = 0.05). Tipe 1: Kalus kompak, warna agak putih keruh sampai agak kekuningan; Tipe 2: Kalus kompak, warna putih bersih seperti kapas; -: data tidak tersedia. Skor 1: < 25%; skor 2: 25-50%; skor 3: 50-75%; skor 4: 75-100%; skor 5: > 100%. Md: nilai median skor ukuran kalus per perlakuan; Z: normal baku dari rerata ranking skor ukuran kalus pada tiap perlakuan.
25
Skor ukuran kalus
Analisis dengan uji Kruskal-Wallis pengaruh komposisi media terhadap skor ukuran kalus pada eksplan dasar bunga durian menunjukkan pengaruh komposisi media sangat nyata terhadap ukuran kalus pada aksesi Dramaga dan varietas Simas, sementara pada varietas Matahari tidak berpengaruh nyata. Kalus berukuran besar (skor 5) lebih banyak dijumpai pada varietas Simas (Tabel 12).
Tipe kalus
Kondisi kalus yang baru tumbuh dari eksplan dasar bunga merupakan kalus remah berair (kalus tipe 3, Gambar 4e, hal. 22) yang sel-selnya mudah dipisahkan satu sama lain dan pada pengamatan dengan mikroskop terlihat sel-sel yang berukuran relatif besar, berbentuk memanjang dan bulat, sitoplasma transparan, inti sel sangat kecil atau tidak terlihat (Gambar 4f hal. 22). Dalam satu sampai dua minggu setelah tumbuh kalus, kalus tipe 3 tersebut berkembang menjadi kalus tipe 1 atau kalus tipe 2, sehingga nilai pengamatan atas tipe kalus asal eksplan dasar bunga dibedakan menjadi tipe 1 dan tipe 2. Kalus tipe 1 berstruktur kompak keras berwarna agak putih keruh sampai agak kuning keruh. Pengamatan dengan mikroskop menunjukkan sel-sel dengan bentuk bervariasi, transparan dengan inti kecil atau tidak terlihat (Gambar 4a dan 4b hal. 22). Kalus tipe 2 berstruktur kompak berwarna putih bersih seperti kapas. Hasil pengamatan dengan mikroskop kalus tipe 2 mirip dengan kalus tipe 1 (Gambar 4c dan 4d hal. 22).
Analisis dengan Tabel Kontingensi dan Chi Kuadrat pengaruh komposisi media terhadap tipe kalus pada eksplan dasar bunga menunjukkan komposisi media berpengaruh nyata terhadap tipe kalus pada aksesi Dramaga, sementara pada varietas Simas dan Matahari tidak berpengaruh nyata. Media MS + pikloram 4 ppm menghasilkan kalus tipe 2 dengan persentase lebih tinggi daripada media lain pada aksesi Dramaga (Tabel 12).
Berdasarkan keempat variabel yang diamati pada eksplan dasar bunga, komposisi media terbaik pada induksi kalus dari eksplan dasar bunga adalah media dasar B5 dengan tambahan NAA 2 ppm. Media ini menghasilkan kalus dengan persentase tinggi (tidak berbeda nyata dengan rerata tertinggi), waktu muncul kalus yang cepat (tidak berbeda nyata dengan rerata tertinggi) pada semua genotipe, proporsi kalus tipe 1 yang relatif tinggi pada semua genotipe, dan ukuran kalus yang besar (nilai median skor 3 dari rentang 1 sampai 3 pada aksesi Dramaga, skor 4 dari rentang 1 sampai 5 pada varietas Matahari, dan skor 5 dari rentang 1 sampai 5 pada varietas Simas).
Induksi kalus embriogenik dari eksplan petal
Waktu muncul kalus
26
genotipe–media tidak berpengaruh nyata. Eksplan petal varietas Matahari menghasilkan kalus dengan persentase lebih tinggi daripada varietas Simas dan varietas Simas menghasilkan kalus dengan persentase lebih tinggi daripada aksesi Dramaga. Komposisi media yang mengandung ZPT NAA 2 sampai 6 ppm menghasilkan kalus dengan persentase 35.00 sampai 48.22 persen sedangkan komposisi media yang mengandung ZPT pikloram 2 sampai 6 ppm menghasilkan kalus dengan persentase 50.16 sampai 58.71 persen.
Persentase eksplan berkalus
Kecepatan muncul kalus eksplan petal dipengaruhi sangat nyata oleh genotipe (Tabel 13), komposisi media (Tabel 14) dan interaksi genotipe-komposisi media. Eksplan petal varietas Matahari menghasilkan kalus lebih cepat daripada varietas Simas dan varietas Simas menghasilkan kalus lebih cepat daripada aksesi Dramaga
Tabel 13 Pengaruh genotipe terhadap waktu muncul kalus dan persentase eksplan berkalus pada eksplan petal
Genotipe Waktu muncul kalus (HST)
Eksplan berkalus (%)
Dramaga 41.02 a 25.54 c
Matahari 6.28 c 92.11 a
Simas 16.44 b 76.73 b
Keterangan : Angka-angka yang diikuti huruf yang sama tidak berbeda nyata pada uji DMRT
(α = 0.05).
Skor ukuran kalus
Analisis dengan uji Kruskal-Wallis pengaruh komposisi media terhadap skor ukuran kalus pada eksplan petal durian menunjukkan bahwa komposisi media berpengaruh sangat nyata terhadap skor ukuran kalus pada varietas Simas, berpengaruh nyata pada varietas Matahari, tetapi tidak berpengaruh nyata pada aksesi Dramaga (Tabel 14). Pada varietas Simas terdapat kecenderungan media dasar B5 menghasilkan kalus berukuran lebih besar daripada media dasar MS. Nilai median skor 4 sampai 5 hanya didapatkan pada eksplan petal varietas Simas.
Tabel 14 Pengaruh komposisi media terhadap persentase eksplan berkalus, waktu muncul kalus, tipe kalus dan skor ukuran kalus pada eksplan petal durian
Komposisi Media
Eksplan berkalus
(%)
Waktu muncul kalus (HST) Proporsi (%) tipe kalus pada genotipe : Skor ukuran kalus
Dramaga Matahari Simas Dramaga Matahari Simas
Dramaga Matahari Simas Tipe
1
Tipe 2
Tipe 1
Tipe 2
Tipe 1
Tipe
2 Md Z Md Z Md Z
B5 tanpa ZPT 22.2 e 13.9e(A) 6.4b(B) - 100 0 71.4 28.6 - - 1 0.15 1.5 0.72 -
-B5 + NAA 2 ppm 35.3 de 39.1bcd(A) 6.2b(B) 19.1a(B) 100 0 89.5 10.5 100 0 1 -0.59 1 0.04 1 -1.21
B5 + NAA 4 ppm 40.0bcde 38.9bcd(A) 6.2b(B)14.9abc(B) 100 0 94.4 5.6 86.7 13.3 1 0.83 1 -0.15 5 4.88
B5 + NAA 6 ppm 35.0 de 18.4e(A) 6.2b(B) 15.4ab(A) 90.9 9.1 88.9 11.1 100 0 1 0.05 1 -0.88 4.5 2.75
B5 + pikloram 2 ppm 58.7 a 50.5bcd(A) 6.1b(C) 21.8a(B) 100 0 52 48 65.2 34.8 1 0.49 2 0.83 5 4.99
B5 + pikloram 4 ppm 50.6 abcd 54.8b(A) 6.2b(B) 15.3ab(B) 96.3 3.7 37.9 62.1 52.6 47.4 1 0.27 2 1.23 4 1.5
B5 + pikloram 6 ppm 51.6 abcd 80.8a(A) 6.2b(C) 22.5a(B) 100 0 59.1 40.9 84.6 15.4 1 0.01 1 -1.96 2 0.15
MS tanpa ZPT 27.8 e 11.4e(A) 6.0b(B) - 100 0 93.3 6.7 - - 1 -0.59 1 -0.56 -
-MS + NAA 2 ppm 37.6 cde 13.2e(AB) 6.2b(B) 17.9a(A) 100 0 91.7 8.3 64.7 35.3 1 -0.04 1 -1.24 1 -2.87
MS + NAA 4 ppm 48.2 abcd 24.8de(A) 6.2b(B) 17.9a(A) 86.7 13.3 100 0 88.2 11.8 1 -0.16 2 1.44 1 -3.77
MS + NAA 6 ppm 37.2 cde 38.1bcd(A) 6.2b(B) 9.3bc(B) 100 0 100 0 85.7 14.3 1 -0.68 1 -0.73 1 -3
MS + pikloram 2 ppm 56.6 ab 38.8bcd(A) 6.2b(B) 7.4c(B) 100 0 82.6 17.4 90.5 9.5 1 -0.04 1 0.02 1 -3.91
MS + pikloram 4 ppm 50.2 abcd 35.4cd(A) 7.2a(B) 16.8ab(B) 100 0 96.8 3.2 64.7 35.3 1 -0.21 2 2.46 1 -0.99
MS + pikloram 6 ppm 54.7 abc 41.9bcd(A) 6.0b(C) 21.2a(B) 100 0 100 0 92.3 7.7 1 0.2 1 -1.82 2 1.26
P-value 0.01 0.00 0.00 0.00 0.01 0.00 0.00 0.74 0.03 0.00
Keterangan: Angka-angka yang diikuti huruf kecil yang sama pada kolom yang sama dan angka-angka yang diikuti huruf besar yang sama pada baris yang sama tidak
berbeda nyata pada uji DMRT (α = 0.05). Tipe 1: Kalus kompak, warna agak putih keruh sampai agak kekuningan; Tipe 2: Kalus kompak, warna putih bersih seperti kapas; -: data tidak tersedia. Skor 1: < 25%; skor 2: 25-50%; skor 3: 50-75%; skor 4: 75-100%; skor 5: > 100%. Md: nilai median skor
28
Tipe kalus
Kalus yang tumbuh dari eksplan petal sejak awal tumbuhnya merupakan kalus tipe 1 dan kalus tipe 2. Analisis dengan Tabel Kontingensi dan Chi Kuadrat menunjukkan komposisi media berpengaruh nyata terhadap tipe kalus pada semua genotipe.
Berdasarkan keempat variabel yang diamati pada eksplan petal, komposisi media terbaik pada induksi kalus dari eksplan petal adalah media dasar B5 dengan tambahan pikloram 2 ppm. Media ini menghasilkan kalus dengan persentase tinggi, proporsi kalus tipe 1 sedang sampai tinggi, dan ukuran kalus yang besar (nilai median skor 2 dari rentang 1-2 pada varietas Matahari dan skor 5 dari rentang 1-5 pada varietas Simas) walaupun mempunyai nilai waktu muncul kalus yang cepat pada varietas Matahari, sedang pada aksesi Dramaga, dan lambat pada varietas Simas.
Dalam protokol embriogenesis somatik beberapa jenis tanaman berkayu, paling tidak ada 2 skenario untuk memperoleh kalus embriogenik. Skenario pertama adalah dari eksplan yang dikulturkan akan langsung didapatkan kalus yang sudah bersifat embriogenik. Contoh skenario ini adalah pada embriogenesis somatik nangka (Roy dan Debnath 2005). Skenario kedua melalui tahapan induksi kalus, kemudian kalus yang didapatkan (yang belum tentu embriogenik) disubkultur ke media dengan komposisi berbeda hingga didapatkan kalus yang embriogenik. Contoh skenario ini adalah pada kopi (Etienne 2005) dan kakao (Figuera dan Laurence 2005; Maximova et al. 2005). Embriogenesis somatik pada kakao melalui tahapan kultur pada media PCG, SCG, dan ED. Dua minggu setelah ditanam di media ED baru akan didapatkan 2 tipe kalus, yaitu kalus embriogenik dan non embriogenik. Induksi embrio somatik dengan skenario 2 mempunyai pola umum, yaitu pada tahap pertama eksplan dikulturkan dalam media yang mengandung auksin kuat dengan konsentrasi relatif tinggi, kemudian kalus yang diperoleh disubkultur ke media tanpa atau rendah auksin dengan atau tanpa pemberian sitokinin. Sitokinin yang paling sering dipakai adalah BA.