ISOLASI DAN KLONING PADA Escherichia coli GEN AaWRKY1
Artemisia annua L
ELMITA HAPSARI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Isolasi dan Kloning Gen AaWRKY1 Artemisia annua L adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2014
ELMITA HAPSARI
iv
ABSTRAK
ELMITA HAPSARI. Isolasi dan Kloning pada Escherichia coli Gen AaWRKY1 Artemisia annua L Dibimbing oleh I MADE ARTIKA dan SRI KOERNIATI.
Gen AaWRKY1 menyandi protein WRKY1 yang merupakan aktivator transkripsi Amorpha-4,11-diene synthase (ADS) yang berfungsi sebagai katalisator biosintesis artemisinin sehingga peningkatan ekspresi gen AaWRKY1
secara berlebih dapat meningkatkan kadar artemisinin. Studi ini bertujuan mengisolasi gen AaWRKY1 dari Artemisa annua L. Amplifikasi gen AaWRKY1
dilakukan dengan teknik PCR (Polymerase Chain Reaction) menggunakan pasangan primer spesifik dan cetakan cDNA. Fragmen gen AaWRKY1 produk PCR selanjutnya diklon pada vektor kloning pJET 1.2 dengan bantuan enzim
T4-ligase dan ditransformasikan ke sel kompeten bakteri Escherichia coli DH5α melalui metode kejut panas, serta ditumbuhkan pada media LB agar yang mengandung antibiotik ampisilin, kemudian koloni diseleksi dengan PCR Koloni. Hasil studi menunjukkan bahwa amplifikasi gen AaWRKY1 dengan primer spesifik menghasikan amplikon berukuran ± 1500 pb. Fragmen gen tersebut berhasil diklon ke vektor pJET 1.2 dan digunakan untuk mentransformasi sel E. coli DH5α. Konfirmasi klon rekombinan dilakukan dengan PCR Koloni untuk mendapatkan koloni rekombinan pembawa gen AaWRKY.
Kata kunci : Artemisia annua L, gen AaWRKY1, kloning, PCR Koloni, pJET 1.2.
ABSTRACT
ELMITA HAPSARI. Isolation and Cloning in Escherichia coli gene AaWRKY1 of
Artemisia annua L WRKY gene (AaWRKY1) from Artemisia annua L Supervised by I Made Artika and Sri Koerniati.
Artemisia annua WRKY1 (AaWRKY1) gene encodes a protein WRKY a transcriptional activator of Amorpha-4,11-diene synthase (ADS). The overexpression farnesil diphosphate AaWRKY1 genes can increase levels of artemisinin. This study was aimed to isolate an AaWRKY1 gene from Artemisia annua L. Amplification of AaWRKY1 gene was done by PCR (Polymerase Chain Reaction) technique using specific primer pairs and cDNA as a template. Subsequently, AaWRKY1 gene fragment was cloned into a cloning vector pJET 1.2 using T4-ligase and transformed into competent cell Escherichia coli DH5α through heat shock method, and grown on LB agar medium containing ampicillin. Result showed that amplification with specific primers of AaWRKY1 gene generated an amplicon fragment of ± 1500 bp. The gene fragment was succesfully cloned into pJET 1.2 and transformed into cells of E. coli DH5α. Confirmation of recombinant clone was carried out using colony PCR to obtain recombinant colonies.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biokimia
ISOLASI DAN KLONING PADA Escherichia coli GEN AaWRKY1
Artemisia annua L
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
BOGOR 2014
Judul Skripsi : Isolasi dan Kloning pada Escherichia coli Gen AaWRKY1 Artemisia annua L
Nama : Elmita Hapsari
NIM : G84100088
Disetujui oleh
Dr Ir I Made Artika, MAppSc Pembimbing I
Dr Ir Sri Koerniati, MSc Pembimbing II
Diketahui oleh
Dr Ir I Made Artika, MAppSc Ketua Departemen
viii
PRAKATA
Bismillahirrahmanirrahim
Puji syukur penulis panjatkan kehadirat Allah SWT atas segala limpahan rahmat, taufik, serta hidayah-Nya sehingga karya ilmiah ini berhasil diselesaikan. Shalawat dan salam semoga selalu tercurahkan kepada Nabi Muhammad SAW dan keluarga dan sahabatnya. Tema yang dipilih dalam penelitian yang dilaksanakan Februari sampai Juni 2014 ini ialah Isolasi dan Kloning pada
Eschericia coli Gen AaWRKY1Artemisia annua L.
Penulis mengucapkan terima kasih kepada semua pihak yang telah memberikan bantuan dalam pembuatan laporan ini. Ucapan terima kasih terutama ditujukan kepada Bapak I Made Artika selaku dosen pembimbing utama dan Ibu Sri Koerniati selaku pembimbing lapangan yang telah membimbing serta memberi saran dan kritik yang membangun. Ucapan terima kasih penulis juga sampaikan kepada para peneliti, teknisi, staf, serta sesama mahasiswa yang juga melakukan penelitian di Laboratorium Biologi Molekuler, Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumber Daya Genetik Pertanian, Jl. Tentara Pelajar No.3A, Cimanggu, Bogor. Penulis juga mengucapkan terima kasih kepada Bapak, Ibu, Mba Hesti, Mba Edna, Ario, serta teman-teman Sekar Arum (Maya,Karan,Ezik,Jihan,Vivi,Ita,Ka Risma), Lia, Safirah, Ukdiah, Zahra, Afiah, teman-teman ‘S’, teman-teman sepembimbingan dan teman-teman Biokimia 47 atas segala doa, dan dukungan yang selalu diberikan.
Penulis berharap karya ilmiah ini dapat bermanfaat bagi berbagai pihak dan Ilmu pengetahuan, khususnya ilmu Biokimia.
Bogor, September 2014
DAFTAR ISI
DAFTAR TABEL ... x
DAFTAR GAMBAR ... x
DAFTAR LAMPIRAN ... x
PENDAHULUAN ... 1
METODE ... 2
Waktu dan Tempat Penelitian ... 2
Bahan ... 2
Alat ... 2
Prosedur ... 3
HASIL ... 6
PEMBAHASAN ... 10
SIMPULAN DAN SARAN ... 15
Simpulan ... 15
Saran ... 15
DAFTAR PUSTAKA ... 15
LAMPIRAN ... 18
x
DAFTAR TABEL
1 Komposisi larutan mix ligasi vektor pJET 1.2 5
2 Komposisi larutan mix PCR Koloni 6
3 Hasil Kuantitas RNA total Artemisia Annua L 7
DAFTAR GAMBAR
1 Elektroforegram hasil kualitas RNA Artemisia Annua L 6
2 Elektroforegram amplikon gen AaWRKY1 7
3 Elektroforegram purifikasi amplikon gen AaWRKY1 8 4 Hasil transformasi gen AaWRKY1 pada palsmid pJET 1.2 melalui bakteri
E.coli DH5α 8
5 Elektroforegram PCR Koloni 9
6 Elektroforegram PCR Koloni 2 9
DAFTAR LAMPIRAN
1 Diagram alir penelitian 18
2 Peta plasmid pJET 1.2 19
3 Komposisi larutan sediaan 20
4 Ekstrasi dan Purifikasi DNA dengan QIAQuick Qiagen 21 5 Diagram Alir Pembuatan Sel Kompeten E.coli DH5α 22
PENDAHULUAN
Penyakit Malaria merupakan penyakit yang dapat menyebabkan kematian terutama pada bayi, anak balita, dan ibu hamil. Penyakit Malaria juga masih endemis di sebagian besar wilayah Indonesia.Wilayah Indonesia bagian Timur merupakan wilayah stratifikasi malaria tinggi berdasarkan indikator Annual Parasite Incidence (API) (Depkes RI 2009).
Pengobatan malaria umumnya mengacu pada rekomendasi WHO. Indonesia memiliki obat antimalaria standar (klorokuin, kina, primakuin dan sulfadoksin-primetamin). WHO (2010) menyatakan bahwa Plasmodium falciparum yang merupakan parasit protozoa penyebab malaria telah resisten terhadap pil kina yang digunakan sebagai obat antimalaria standar. Adanya resistensi Plasmodium falciparum terhadap pil Kina membuat WHO membuat rujukan baru untuk pengobatan penyakit malaria yaitu dengan Artemnisin Combination Therapy (ACT) yang sudah mulai diterapkan di Indonesia sejak tahun 2004. ACT menggunakan dua pigmen yaitu artesunate amodiaquine (AAQ) dan dihydroartemisinin pip eraquine phosphate (DHP) selain itu AAQ memiliki efek efikasi yang lebih kecil dan efek samping yang lebih berat dari DHP (Hasugian et al 2007).
Tanaman Artemisia annua L mengandung bahan aktif artemisinin dengan kadar rata-rata 0.1-0.8% dalam berat kering tanaman (Dongming et al 2009). Namun budidaya di Indonesia hanya bisa menghasilkan tanaman Artemisia
dengan kadar artemisinin antara 0.39% (Gusmaini & Hera 2007). Atas dasar hal tersebut, upaya peningkatan kadar artemisinin pada tanaman Artemisia annua L diperlukan. Peningkatan kadar artemisinin dapat dilakukan dengan rekaya genetika. Peningkatan produksi artemisinin diperlukan mengingat kasus malaria yang masih tinggi di Indonesia khususnya bagian timur.
Salah satu pendekatan rekayasa genetik yang dapat dilakukan untuk meningkatkan kadar artemisinin pada tanaman Artemisia annua L adalah dengan mengkontrol ekspresi gen yang berkaitan dengan sintesis artemisinin. Langkah utama dalam biosintesis artemisinin adalah siklus farnesil difosfat yang dikatalisis oleh amorpha-4,11-diene synthase (ADS) yang diregulasi oleh gen faktor transkripsi (Dongming et al 2009). Overekspresi gen faktor transkripsi merupakan pendekatan yang menjanjikan untuk mendorong jalur metabolik sekunder (Verpoorte dan Memelink 2002, Pertesen 2007). Teknologi DNA rekombinan yang dilakukan adalah kloning gen AaWRKY1 yang diperoleh dari daun Artemisia annua L.
Protein WRKY merupakan faktor transkripsi dapat menaikkan atau menurunkan ekspresi gen (Oh et al. 2008). Gen AaWRKY1 menyandi protein
WRKY1 yang merupakan aktivator transkripsi Amorpha-4,11-diene synthase
(ADS). Protein WRKY merupakan suatu grup utama dalam faktor transkripsi pada suatu tanaman spesifik. W-box memiliki elemen yang terdapat pada promoter ADS. Gen AaWRKY1 mengkode leusin zipper yang terdapat protein WRKY dan dapat berinteraksi dengan tiga kali elemen W-box (Dongming et al 2009).
2
Pada Penelitian ini dilakukan isolasi gen AaWRKY1 dari tanaman
Artemisia annua L, apabila gen AaWRKY1 tersebut berhasil diisolasi dan dikarakterisasi, maka pemulia tanaman dapat memanfaatkan gen tersebut sebagai sumber gen baru dalam memperbaiki produktivitas artemisinin, seperti melalui penyisipan gen tersebut ke dalam tanaman melalui teknologi rekayasa genetik. Molekul DNA yang mengandung gen AaWRKY1 diperbanyak melalui amplifikasi dan digunakan untuk mentransformasi sel Escherichia coli (Tsen et al.
2002). Penyisipan molekul DNA rekombinan ke dalam sel Escherichia coli
menggunakan vektor berupa plasmid pJET 1.2 sehingga akan menghasilkan sel transforman yang mengandung AaWRKY1 untuk diaplikasikan pada tanaman
Artemisia annua L sehingga diharapkan tanaman yang sudah disisipin gen
AaWRKY1 dapat menghasilkan kadar artemisinin yang tinggi dan stabil. Penelitian ini bertujuan melakukan isolasi gen AaWRKY1, dan mengklon gen ke dalam vektor kloning pJET 1.2 agar dapat menambah koleksi penyediaan gen yang memperbaiki produksi artemisinin. Penelitian ini diharapkan menjadi langkah awal dalam menghasilkan lini tanaman transgenik Artemisia annua L sehingga memiliki kadar artemisinin yang tinggi dan stabil.
METODE
Waktu dan Tempat Penelitian
Penelitian ini dilakukan pada bulan Februari sampai Juni 2014 bertempat di Laboratorium Biologi Molekuler, Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumber Daya Genetik Pertanian, Jl. Tentara Pelajar No.3A, Cimanggu,Bogor.
Bahan
Bahan yang digunakan dalam penelitian ini adalah daun muda 0.1 gram atau kurang lebih 2 helai daun muda tanaman Artemisia annua L, akuades, nitrogen cair, mini kit RNeasy Qiagen (buffer RLT (Qiagen), buffer RPE (Qiagen),
buffer RW1(Qiagen), diethylpyrocarbonate (DEPC) 0.1 %, supermix 5x enzim transcriptase i script, cDNA sintetase Roche, RNAs Free water,buffer PCR (5x HiFi Fidelity), primer gen WR1 (forward 5’- GTC GAC ATG GAA AGT GTT TGT GTT TAT GGA -3’, dan Reverse 5’- GAA TTC TTA AAA TTT GAA ATC AAG GTC TAA ATC -3’), enzim Taq DNA Polimerase Hot Start, agarosa, buffer
TAE 1x (asam borat 0.83 M, Tris HCl 1 M pH 8.3, etilendiamina tetra-asetat 10 mM), akuades, marker DNA 1 kb (Invtritrogen), marker DNA 100bp (Vivantis),
loading dye, gel red (BIOTIUM, Biorad),Plasmid pJET 1.2, T4 ligase (Thermo Scientific), bufer ligasi, 10x Taq buffer (Thermo Scientific), dNTP mix 2 mM, 25 mM MgCl2, pJET 1.2 Forward Sequencing Primer 10 µM, pJET 1.2 Reverse
Sequencing Primer 10 µM, Taq DNA Polymerase 5 U/µL (Thermo Scientific), kultur bakteri Escherichia coli, media LB (Luria bertani),dan antibiotik ampisilin.
Alat
neraca analitik, labu Erlenmeyer, pipet volumetrik, QIAshredder spin column, tabung RNeasy mini column, sentrifus, Nanodrop 2000/200c Spectrophotometer V1.0 User Manual with package Laptop [Thermo Scientific], mesin PCR DNA Peltier Thermal Cycler [Bio-Rad], stopwatch, perangkat alat elektroforesis,
komputer, UV Illuminator ChemiDocTM Gel System EQ [Bio-Rad] (Sistem XRS, Image Lab™ Software, dan kamera CCD), laminar, dan alat-alat gelas.
Prosedur
Isolasi Total RNA Artemisia Annua L
Bagian tanaman yang digunakan untuk isolasi RNA Artemisia Annua L
adalah daun muda berdasarkan metode Qiagen 2010. Semua peralatan yang digunakan terlebih dahulu direndam dengan diethylpyrocarbonate (DEPC) 0.1 % dan disterilasasi dengan autoklaf. Sebanyak 0.1 gram daun dimasukkan ke dalam mortar, dan ditambahkan nitrogen cair sampai semua daun terendam. Daun digerus hingga halus dan dimasukkan ke dalam tabung mikro 2 mL kemudian ditambahkan dengan 450 µL buffer RLT yang mengandung merkaptoetanol 5 µL dan divorteks selama 1 menit hingga homogen lalu diinkubasi pada suhu 56 ºC selama 3 menit. Kemudian suspensi dipindahkan ke dalam tabung QIAshredder spin column. Sampel disentrifus selama 2 menit dengan kecepatan 12000 rpm. Supernatan yang dihasilkan dipindahkan ke dalam tabung mikro 1.5 mL yang baru dan ditambahkan etanol absolut (96%) sebanyak setengah dari volume total. Selanjutnya sebanyak 650 µL supernatan dipindahkan ke dalam tabung RNeasy mini column, tabung kemudian disentrifus kembali selama 15 detik pada kecepatan 1200 g.
Supernatan yang dihasilkan pada tahap ini dibuang kemudian pelet yang terdapat pada membran ditambahkan dengan larutan RW1 yang mengandung etanol sebanyak 700 µL ke dalam kolom RNeasy. Suspensi kemudian disentrifus kembali dengan kecepatan 1200 g selama 15 detik. Supernatan yang dihasilkan dibuang, ditambahkan buffer RPE sebanyak 500 µL kedalam kolom Rneasy dan disentrifus selama 2 menit dengan kecepatan 1200 g. Kolom RNeasy dipindahkan ke dalam tabung mikro 1.5 mL yang baru kemudian ditambahkan 50 µL air bebas RNase pada bagian tengah, didiamkan selama 15 menit, kemudian disentrifus pada kecepatan 1200 g selama 1 menit sehingga diperoleh RNA total. Kemudian kolom RNeasy kembali dipindahkan ke dalam tabung mikro 1.5 mL yang baru lainnya dan ditambahkan 30 µL air bebas RNase, didiamkan selama 15 menit, kemudian disentrifus pada kecepatan 1200 g selama 1 menit sehingga diperoleh RNA total tabung kedua.
Uji Kuantitatif, Kualitatif dan Kemurnian RNA Artemisia annua L dengan Spektrofotometer
RNA yang telah diisolasi kemudian dianalisis secara kuantitatif, kualitatif dan kemurnian RNA yang dilakukan dengan metode Thermo Fisher Scientific
4
adalah larutan akuades. Larutan akuades dimasukkan ke dalam lubang optik sebanyak 2 µL dan kemudian dibersihkan dengan tisu. Selanjutnya sampel RNA sebanyak 2 µL dimasukkan ke dalam lubang optik. Hasil pengukuran berupa konsentrasi ng/µ L dan kemurnian RNA dapat dilihat langsung berdasarkan nilai rasio absorbansi pada panjang gelombang 230, 260, dan 280 nm.
Sintesis cDNA dengan Kit Transcriptor synthesis (RT-PCR)
Sintesis cDNA dengan iScript Reverse Transcription Supermix. Campuran reaksi terdiri dari iScript RT supermix 4 µL, RNA total 9 µL, Nuclease free water 7 µL sehingga total campuran reaksi 20 µL. Campuran reaksi tersebut diinkubasi 25°C selama 5 menit kemudian tahap reverse transcription dengan inkubasi pada suhu 42°C selama 30 menit dan dilanjutkan dengan tahap inaktivasi pada suhu 85°C selama 5 menit.
Sintesis cDNA dengan Transcriptor First Strand cDNA Synthesis Kit Roche. Tahap pertama yang dilakukan adalah denaturasi cetakan RNA dan primer. Campuran reaksi terdiri dari RNA total 9 µL , primer WR1 (Forward 5’- GTC GAC ATG GAA AGT GTT TGT GTT TAT GGA -3’, dan Reverse 5’- GAA TTC TTA AAA TTT GAA ATC AAG GTC TAA ATC -3’ masing-masing sebanyak 0.3µL dan PCR grade Water 3.4 µL sehingga total volume 13 µL. Campuran diinkubasikan pada suhu 65°C selama 5 menit selain itu campuran berisi RT-Mix disiapkan, campuran tersebut terdiri dari Transcriptor reverse
transcriptase reaction buffer 5x konsentrasi sebanyak 4 µL, protector RNase inhibitor 0.5 µL, deoxynucleotide mix 2 µL, dan transcriptor reverse transcriptase
0.5 µL sehingga total volume pada campuran RT-mix 7 µL. campuran RT-Mix dimasukkan kedalam tube berisi kan campuran RNA-primer yang telah diinkubasi sebelumnya sehingga volume akhir menjadi 20 µL. Tahap kedua yaitu tahap
reverse transcription dengan inkubasi campuran reaksi pada suhu 50°C selama 30 menit dan dilanjutkan dengan tahap inaktivasi pada suhu 85°C selama 5 menit. Isolasi Gen AaWRKY1
cDNA yang didapatkan dari sintesis menggunakan iScript maupun Roche dijadikan sebagai cetakan untuk reaksi PCR. Tabung mikro diisi dengan campuran reaksi PCR (total volum reaksi 25 µL ) yang terdiri atas 5 µL buffer PCR 5x Kappa HiFi Fidelity, 10 mM dNTPs mix 0.75 µL, 3 µL campuran primer WR1 (Forward 5’- GTC GAC ATG GAA AGT GTT TGT GTT TAT GGA -3’, sedangkan Reverse 5’- GAA TTC TTA AAA TTT GAA ATC AAG GTC TAA ATC -3’), 0.5 U/µL enzim Taq polymerase, 2.5 µL cDNA , dan 14.25 µL ddH2O. Reaksi amplifikasi dilakukan dengan tahap reaksi denaturasi pada suhu 96ºC selama 3 menit dilakukan satu kali, kemudian denaturasi kembali pada suhu 94°C selama 1 menit, penempelan primer pada suhu 53ºC selama 1 menit, dan pemanjangan pada suhu 72ºC selama 45 detik dan urutan reaksi ini diulang sebanyak 25 siklus dan diikuti proses pemanjangan akhir pada suhu 72ºC selama 5 menit. Selanjutnya produk PCR kemudian dicek keberadaan pita produk hasil PCR dengan elektroforesis gel agarosa 1% yang telah ditambahkan gel red dan divisualisasi menggunakan UV Illuminator ChemiDoc EQ (Bio-rad). Fragmen gen
ekstraksi gel menggunakan kit extraction and purification Kit Qiaquick (QIAGEN).
Ligasi Gen AaWRKY1 pada Vektor pJET1.2
Gen AaWRKY1 (1500 pb) yang didapatkan selanjutnya diligasikan pada vektor pJET1.2. Campuran mix ligasi diinkubasi pada suhu 22°C selama 10 menit. Campuran reaksi ligasi memiliki komposisi seperti pada Tabel 1. (Thermo Fisher Scientific 2012)
Tabel 1 Komposisi larutan mix ligasi vektor pJET 1.2
Larutan Volume
Transformasi Plasmid Rekombinan AaWRKY1 ke dalam Sel Escherichia coli (Sambrook & Rusell 2001).
Reaksi ligasi antara vektor pJET 1.2 dan gen AaWRKY1 sebanyak 10 L
dimasukkan ke dalam tube yang telah diisi dengan sel kompeten E. coli, kemudian diinkubasi di dalam es selama 30 menit. Selanjutnya campuran diinkubasi pada suhu 42ºC selama 90 detik, dan segera disimpan dalam es selama 2 menit. Media LB cair ditambahkan sebanyak 950 µL dan diinkubasi pada suhu 37 °C selama 1 jam. Setelah itu dilakukan sentrifugasi pada 5000 rpm 1 menit, Kemudian kultur dibuang dan disisakan sedikit. Kemudian sisa kultur hasil transformasi disebar pada media LB padat yang mengandung ampisilin (100 mg/L), dan diinkubasi pada suhu 37 °C selama 16 jam. Koloni yang tumbuh kemudian diperbanyak dalam 5 mL LB cair yang mengandung 5 µL ampisilin (100 mg/L) dan diinkubasi pada shaker incubator 37ºC selama 16 jam.
Analisis Koloni Rekombinan dengan PCR Koloni
6
Tabel 2 Komposisi larutan mix PCR Koloni
Larutan Volume
Kultur koloni 5.0 µL
10x Taq buffer 2.0 µL
dNTP mix 2 mM each 2.0 µL
25 mM MgCl2 1.2 µL
pJET 1.2 Forward Sequencing Primer 10 µM 0.4 µL
pJET 1.2 Reverse Sequencing Primer10 µM Water, Nuclease-free
0.4 µL 13.9 µL
Taq DNA Polymerase 5U/ µL 0.1 µL
Total Volume 25 µL
HASIL
Hasil kualitas, kuantitas, dan kemurnian RNA total Artemisia annua L
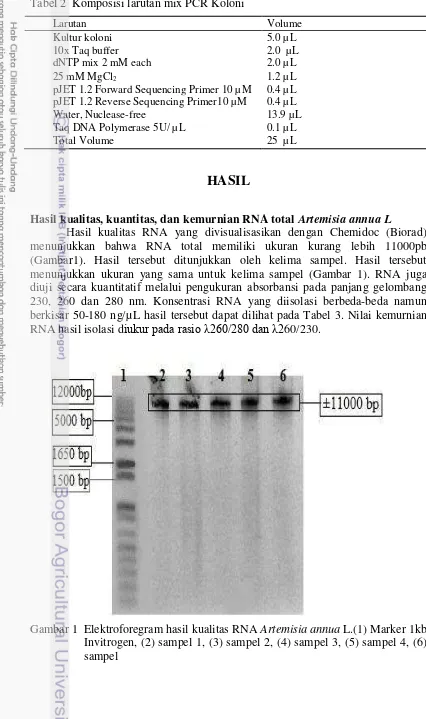
Hasil kualitas RNA yang divisualisasikan dengan Chemidoc (Biorad) menunjukkan bahwa RNA total memiliki ukuran kurang lebih 11000pb (Gambar1). Hasil tersebut ditunjukkan oleh kelima sampel. Hasil tersebut menunjukkan ukuran yang sama untuk kelima sampel (Gambar 1). RNA juga diuji secara kuantitatif melalui pengukuran absorbansi pada panjang gelombang 230, 260 dan 280 nm. Konsentrasi RNA yang diisolasi berbeda-beda namun berkisar 50-180 ng/µ L hasil tersebut dapat dilihat pada Tabel 3. Nilai kemurnian RNA hasil isolasi diukur pada rasio 260/280 dan 260/230.
Tabel 3 Hasil Kuantitas RNA total Artemisia annua L
Amplifikon Gen faktor transkripsi AaWRKY1
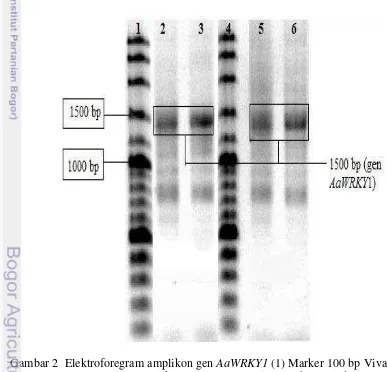
Elektroforegram gen faktor transkripsi AaWRKY1didapatkan melalui PCR cDNA yang disintesis dari RNA menggunakan dua jenis kit, Transcriptor First Strand cDNA Synthesis Kit (Roche) dan kit iScript (Biorad). Hasil elektroforegram yang didapat dari kedua jenis kit tidak ada perbedaan. Keduanya menghasilkan pita dengan pola yang sama. Primer yang digunakan kurang spesifik sehingga menghasilkan beberapa pita namun hanya pita yang berukuran 1500 pb yang dimurnikan (Gambar 2). Elektroforegram gen AaWRKY1yang dimurnikan berukuran 1500 pb dapat dilihat pada Gambar 3.
Gambar 2 Elektroforegram amplikon gen AaWRKY1 (1) Marker 100 bp Vivantis, (2) & (3) Amplikon gen AaWRKY1 yang berasal dari template cDNA iScript, (4) Marker 100 bp Vivantis, (5) & (6) Amplikon gen
AaWRKY1 yang berasal dari template cDNA Rosche
Sampel A260 [RNA] (ng/µL) A260/A280 A260/A230
1 4.68 187.3 2.01 2.04
2 1.44 100.3 1.87 1.58
3 2.50 57.6 2.02 1.88
4 1.74 69.8 1.92 1.02
8
Gambar 3 Elektroforegram purifikasi amplikon gen AaWRKY1.(1) Purifikasi gen
AaWRKY1, (2) Marker 100 bp Vivantis Transforman E.coli yang membawa Gen AaWRKY1
Fragmen gen AaWRKY 1 hasil amplifikasi yang sudah dimurnikan melalui gel purification diligasi dengan vektor cloning pJET 1.2 kemudian digunakan untuk mentransformasi sel E.coli DH5α. Transforman E.coli DH5α yang
membawa gen AaWRKY1 akan tumbuh didalam media seleksi antibiotik ampisilin yang ditunjukkan pada Gambar 4. Koloni tunggal bakteri yang tumbuh pada media LB agar yang mengandung ampicilin 100 mg/L. Sebanyak 28 koloni. Koloni-koloni yang tumbuh selanjutnya dikonfirmasi melalui PCR koloni.
Konfirmasi Plasmid Rekombinan AaWRKY 1
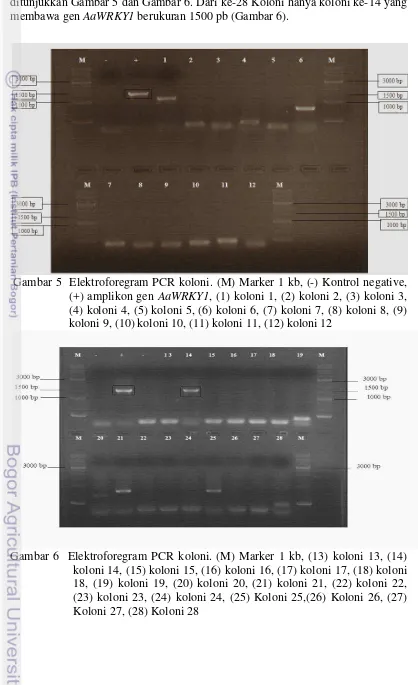
Bakteri E.coli DH5α yang telah bertransformasi membawa plasmid rekombinan gen AaWRKY 1 dikonfirmasi melalui PCR koloni . Hasil PCR koloni ditunjukkan Gambar 5 dan Gambar 6. Dari ke-28 Koloni hanya koloni ke-14 yang membawa gen AaWRKY1 berukuran 1500 pb (Gambar 6).
Gambar 5 Elektroforegram PCR koloni. (M) Marker 1 kb, (-) Kontrol negative, (+) amplikon gen AaWRKY1, (1) koloni 1, (2) koloni 2, (3) koloni 3, (4) koloni 4, (5) koloni 5, (6) koloni 6, (7) koloni 7, (8) koloni 8, (9) koloni 9, (10) koloni 10, (11) koloni 11, (12) koloni 12
10
PEMBAHASAN
Tanaman Artemisia annua L yang digunakan sebagai bahan penelitian diperoleh dari Kebun Percobaan Balitro di Manoko, Lembang. Artemisia annua L
termasuk ke dalam divisi Magnoliophyta, kelas Magnoliopsida pada ordo
Arterales dan famili Asteraceae, terdiri dari hampir 200 spesies. Artemisia annua,
Artemisia capilaris dan Artemisia vulgaris adalah tiga spesies dominan.Artemisia annua L merupakan tanaman subtropis yang berasal dari daerah di Cina yaitu Mongolia (Mc Vaugh 1984) dan tersebar ke Vietnam dan Malaysia namun saat ini tanaman Artemisia telah tersebar ke Argentina, Bulgaria, Francis, Hungaria, Rumania, Italia, Spanyol, USA, dan Yugoslavia (Klayman 1993). Artemisia annua L memiliki gen WRKY1. Protein WRKY merupakan suatu grup utama dalam faktor transkripsi pada suatu tanaman spesifik. WRKY full-length cDNA dalam Artemisia annua L disebut dengan AaWRKY1. Gen AaWRKY1 merupakan aktivator transkripsi Amorpha-4,11-diene synthase (ADS) yang berfungsi sebagai katalisator siklus farnesil difosfat sebagai langkah utama biosintesis artemisinin (OH et al 2008).
Bahan aktif artemisinin diperlukan untuk pengobatan malaria. Peningkatan kadar artemisnin dalam berat kering tanaman perlu dilakukan mengingat budidaya di Indonesia hanya bisa menghasilkan tanaman artemisia dengan kadar artemisinin antara 0.39% (Gusmaini & Hera 2007). Artemisinin diakumulasi dalam organ bagian atas daun dan bunga yang diebut glandular trichomes
(Ferreira, Simon & Janick 1995). Oleh sebab itu jaringan yang digunakan untuk mengisolasi RNA adalah daun. Isolasi RNA dilakukan sebagai tahap awal dari isolasi gen AaWRKY 1.
Kualitas, Kuantitas dan Kemurnian RNA Artemisa annua L
RNA Artemisia annua L diisolasi untuk mendapatkan RNA total. Penggunaan isolat RNA total sebagai materi awal mempunyai beberapa keuntungan dibandingkan menggunakan mRNA. Pertama ialah RNA total memiliki jumlah per-sel lebih banyak dibandingkan mRNA. Kedua ialah proporsi rRNA yang besar dalam RNA total dapat berperan sebagai target RNase sehingga memperlambat digesti nonspesifik dari mRNA (Qiagen 2010) selain itu RNA digunakan sebagai cetakan cDNA karena primer yang didesain berasal dari sekuens cDNA yang terdapat pada gen bank NCBI.
Kualitas RNA diperoleh dengan visualisasi menggunakan elektroforesis agarosa 1%. Gel Agarosa dapat memisahkan fragmen DNA dari beberapa ratus hingga 20.000 pb. Gel Agarosa 1% memiliki struktur serat yang baik, ukuran pori besar dan tahan terhadap gesekan (Bintang 2010). Hasil yang didapatkan besar RNA total adalah 11000 pb (Gambar 1). Pita RNA yang didapatkan sangat baik terang dan tebal. Ukuran RNA yang didapatkan ini cukup besar karena isolasi yang dilakukan merupakan isolasi total RNA.
konsentrasi tersebut dapat dipengaruhi oleh beberapa faktor yaitu, perbedaan jenis sampel, hasil gerusan sampel yang kurang halus, dan pengocokan yang kurang kuat saat melakukan ekstraksi sehingga seluruh isi sel tidak dapat terlisis dengan sempurna (Couch & Fritz 1990). Qiagen (2010) menyatakan bahwa kit komersial
RNeasy Plant Mini Kit dapat menghasilkan RNA total sampai dengan 35 µg dalam 0.1 gram daun. Isolasi RNA total Artemisia annua L juga pernah dilakukan Appalasamy et al (2012) dengan metode CTAB modifikasi dengan Konsentrasi RNA total terbesar yang didapat adalah 43.38 ng/µ L. Appalasamy et al (2012) juga melakukan isolasi total RNA dengan kit komersial yaitu IQeasyTM Plus Plant RNA Extraction Mini Kit (iNtRON Technologies) yang menghasilkan konsentrasi RNA terbesar 16.42 ng/µ L.
Kualitas kemurnian hasil isolasi RNA Artemisia annua L dapat diperoleh juga dengan menggunakan spektrofotometri nanodrop. Rasio absorbansi 260 nm dan 280 nm menunjukkan kemurnian RNA terhadap protein. Nanodrop Technologies (2007) menyatakan bahwa nilai A260/280 ~2 dapat diterima sebagai RNA yang murni. Hasil isolasi RNA didapatkan nilai A260/280 bervariasi yaitu 2.01, 1.87, 2.02, 1.92, dan 1.94. Nilai tersebut menunjukkan bahwa RNA yang telah diisolasi murni dari protein. Rasio A260/230 digunakan sebagai indikator tingkat kontaminasi oleh polisakarida dan polifenol (Loulakakis et al. 1996 dan Schultz et al. 1994). Nilai A260/230 untuk RNA yang dikatakan murni berkisar 2.0-2.2. Hasil isolasi RNA menunjukkan bahwa nilai A260/230 yang didapat adalah 2.04, 1.58,1.88, 1.02, dan 1.21. Nilai tersebut menunjukkan bahwa isolasi RNA yang masih dibawah angka 2.0 menunjukan bahwa RNA tersebut masih mengandung polisakarida/karbohidrat atau polifenol. RNA pada sampel 1 murni terhadap protein dan polifenol sehingga RNA pada sampel tersebut digunakan untuk membuat cDNA, dan isolasi gen AaWRKY1
Amplikon Gen AaWRKY 1 dari Artemisia annua L
Gen AaWRKY 1 diisolasi dengan cara amplifikasi cDNA menggunakan teknik PCR dan primer spesifik yang didisain berdasarkan sekuen gen AaWRKY 1
yang ada di genebank (NCBI FJ390842). Sintesis cDNA dilakukan dengan teknik RT-PCR dengan menggunakan RNA total sebagai cetakan (Watson et al 1987) dan enzim reverse transcriptase. Enzim Reverse transcriptase digunakan untuk membuat salinan cDNA dari mRNA dengan perluasan primer biasanya oligo dT yang memanfaatkan poli A dari mRNA (Turner et al 1995). Oligo dT dapat terikat dengan ekor poli (A) dan dapat digunakan untuk memperoleh kembali mRNA hal ini sudah berlangsung secara alami saat preparasi isolasi RNA total yaitu saat lisis sel dengan fenol-kloroform yang melewati kolom oligo (dT)-selulosa (Turner et al
1995). Gen yang diekpresikan pada jaringan tertentu dapat diisolasi dengan menggunakan cDNA sebagai cetakan (template). cDNA merupakan DNA yang komplemen dengan mRNA (Dale & Schantz 2002),mRNA adalah transkrip dari gen-gen yang terekspresi yang membawa pesan berupa informasi genetik dari DNA ke dalam bentuk protein (Darnell et al 1990). Isolasi gen dari cDNA sebagai cetakan lebih baik karena cDNA yang berasal dari eukariotik mRNA tidak memiliki sekuen intron sehingga yang hanya segmen penyandi protein (ekson) yang akan diekpresikan kedalam E.coli.
Amplifikasi gen AaWRKY1 menggunakan sepasang primer WR1 Forward
12
mengamplifikasi gen AaWRKY1 berukuran 1478 pb. Primer optimum menempel pada cetakan pada suhu 53ºC selama 1 menit dan memulai melakukan pemanjangan pada suhu 72ºC. Hasil amplifikasi gen divisualisasi dengan elektroforesis gel agarosa 1%. Hasil verifikasi dengan menggunakan marka 1kb (Invitrogen) memperlihatkan bahwa gen yang teramplifikasi kira-kira berukuran 1500 pb, mendekati 1478 pb. Sintesis cDNA menggunakan dua kit komersial yang berbeda merek namun hasil amplifikasi dari kedua jenis cetakan tidak berbeda menghasilkan pola yang sama dan pita berukuran kira-kira 1500 pb (Gambar 2). Perbedaan kedua kit komersial tersebut hanya pada jenisnya saja. Kit iScript Reverse Transcription Supermix menggunakan one step RT-PCR sedangakan Transcriptor First Strand cDNA Synthesis Kit Rosche merupakan teknik sintesis cDNA dengan two-step RT-PCR. one step RT-PCR mengkonversi RNA menjadi cDNA dilakukan dalam satu rangkaian reaksi dan dalam satu tabung reaksi yang sama sehingga tidak ada proses transfer sampel sehingga mengurangi kontaminasi. iScript Reverse Transcription Supermix mengandung oligo (dT) dan random primer sedangkan Transcriptor First Strand cDNA Synthesis Kit Rosche merupakan metode two-step RT PCR dengan reaksi transkripsi balik dan reaksi primer dengan RNA dilakukan terpisah melibatkan beberapa tabung reaksi. two-step RT PCR menggunakan primer spesifik sehingga diharapkan hasilnya lebih spesifik. Namun Gambar 2 menunjukkan hasil amplifikasi kedua jenis merek tidak ada perbedaan keduanya menghasilkan pita 1500 pb namun tidak spesifik.
Meskipun pita yang berukuran 1500 pb merupakan pita yang paling terang namun, terdapat fragmen lain yang terbentuk dari pita yang dihasilkan pada gel agarosa. Hal tersebut dapat disebabkan karena penggunaan suhu annealing yang belum optimal dan primer yang digunakan kurang spesifik. Suhu annealing
adalah suhu dimana primer akan menempel pada template DNA. Suhu annealing
dengan primer itu sendiri dan tidak memungkinkan untuk melakukan reaksi. lebih berbahaya jika molekul primer akan diperpanjang dengan DNA polimerase sehingga sekuen yang didapatkan berubah sehingga tidak dapat berikatan dengan situs target (Bing & Harry 2002). Hal lain yang juga harus dihindari adalah sekuen primer forward dan reverse yang saling berkomplemen sehingga menyebabkan primer-dimer. Penentuan urutan basa pasangan primer perlu dianalisis menggunakan program untuk mengetahui kemungkinan terjadinya primer-dimer akibat homologi sendiri (self-homology) atau homologi silang (cross-homology) sehingga tidak terbentuk produk-produk non spesifik yang muncul pada saat visualisasi produk PCR dengan elektroforesis gel agarosa. Hasil amplifikasi gen AaWRKY1 menghasilkan beberapa pita namun, pita yang berukuran 1500pb lah yang paling kuat dan terang. Pita tersebut diduga sebagai gen AaWRKY1. Amplikon gen AaWRKY1 yang berukuran 1500pb dimurnikan dengan kit komersial Extraction and Purification Kit (QIAquick Qiagen). Permurnian bertujuan untuk mendapatkan hanya gen AaWRKY1 yang berukuran 1500pb. Selain itu permurnian juga dilakukan agar amplikon gen
AaWRKY1 bebas dari pengotor-pengotor lain berupa nukleotida, sisa-sisa garam, dan enzim yang dapat mengganggu proses selanjutnya (Dobhal et al. 2010). Keberhasilan permurnian gen AaWRKY1 dapat dilihat pada Gambar 3 yaitu didapatkan pita tunggal yang berukuran 1500pb.
Plasmid Rekombinan AaWRKY1
Vektor yang digunakan dalam penelitian ini adalah pJET 1.2. Setelah gen
AaWRKY1 dimurnikan kemudian gen tersebut diligasikan ke vektor pJET1.2 agar dapat ditransformasikan ke dalam E.coli DH5α sebagai sel inang. Vektor
merupakan media pembawa DNA asing ke dalam sel inang (Pierce 2005). Vektor dapat berupa plasmid, bakteriofaga, fagemid, kosmid. Vektor plasmid bakteri merupakan vektor yang sering digunakan dalam konstruksi DNA rekombinan. Vektor pJET 1.2 merupakan vektor berupa plasmid. Terdapat dua jenis vektor yaitu vektor pengklonan dan vektor ekspresi. Vektor ekspresi adalah vektor yang dapat mengekpresikan protein dan memiliki daerah promoter sedangkan vektor pengklonan berfungsi untuk perbanyakan gen (Madigan et al 2009). Vektor pJET 1.2 merupakan vektor pengklonan dengan ukuran 2974 pb. pJET 1.2 merupakan vektor kloning linear yang dapat menerima insert berukuran 6pb sampai 10kb. Vektor kloning pJET 1.2 dipilih karena memiliki kelebihan yaitu pJET 1.2 telah mengandung grup fosfat pada ujung 5’ sehingga fosforilasi pada primer PCR tidak diperlukan. Selain itu pJET 1.2 hanya memerlukan waktu 5-10 menit dalam penyambungan DNA insert ke vektor sehingga lebih efisien waktu. Keuntungan lainnya adalah dapat langsung digunakan untuk mentrasnformasikan semua jenis strain E.coli dengan hasil ligasi. Ligasi dilakukan dengan menggunakan enzim T4 Ligase. Enzim tersebut mempercepat pembentukan ikatan fosfodiester antara ujung 5’P dengan 3’OH pada DNA (Pheiffer & Zimmerman 1λ83). Vektor pJET 1.2 juga lebih praktis digunakan karena hanya rekombinan plasmid yang mengandung DNA sisipan yang akan tumbuh dicawan kultur sehingga seleksi biru-putih tidak diperlukan (Thermo Fisher scientific 2012). Hasil Ligasi gen
AaWRKY1 ke vektor pJET 1.2 menghasilkan plasmid rekombinan gen AaWRKY1.
14
sehingga total plasmid berukuran 4474 pb. Peta plasmid gambaran hasil ligasi dapat dilihat pada Lampiran 2.
Koloni hasil transformasi pembawa gen AaWRKY1
Hasil Ligasi gen AaWRKY1 ke vektor pJET 1.2 kemudian ditransformasikan ke dalam sel bakteri Escherichia coli strain DH5α yang sudah dibuat kompeten dengan menggunakan larutan Innoe bufer yang dapat dilihat komposisinya pada Lampiran 3. Transformasi dilakukan dengan menggunakan metode heat shock. Transformasi metode ini dilakukan dengan cara memberikan kejut panas pada sel bakteri kompeten yaitu sel bakteri yang telah diberi CaCl2. Sel bakteri yang telah kompeten akan mudah dimasukkan DNA rekombinan setelah dibeti kejutan panas (Sambrook & Russell 2001). Kejut panas dilakukan pada suhu 42°C selama 90 detik dilanjutnya dengan inkubasi pada suhu dingin selama kurang lebih 15 menit untuk meningkatkan efisiensi dari transformasi (Kaur & Singh 2010). Dengan sistem kejutan panas, Kemungkinan masuknya DNA asing ke dalam sel akan menjadi lebih besar jika pada lingkungannya terdapat ion divalent Ca2+ dan Mg2+ yang diberikan dalam bentuk CaCl2 dan MgCl2.
Hasil transformasi E.coli dibiakan kedalam media Luria Bertani (LB) padat yang sudah mengandung antibiotik ampicilin 100 mg/L sebagai media seleksi sehingga koloni yang terbentuk pada cawan diduga merupakan E.coli yang membawa plasmid rekombinan gen AaWRKY1 (Gambar 4). Marka seleksi biasanya berupa gen yang membawa sifat resisten antibiotik tertentu dan vektor pJET 1.2 memiliki marka seleksi berupa gen resisten ampisilin NPTII dapat dilihat pada peta plasmid pJET 1.2 pada Lampiran 2. Terdapat kurang lebih 28 koloni tunggal, kemudian dilakukan konfirmasi plasmid pembawa gen tersebut melalui amplifikasi PCR.
Hasil PCR Koloni
Analisis koloni rekombinan dilakukan untuk konfirmasi keberhasilan konstruksi gen AaWRKY1. Analisis dilakukan untuk memastikan transforman membawa gen AaWRKY1 bukan plasmid kosong atau DNA lain yang tersisipi. Analisis dilakukan dengan PCR koloni, PCR koloni dipilih karena vektor kloning yang digunakan adalah pJET 1.2 dengan fragmen DNA sisipan berukuran kurang dari 3 (Thermo Fisher Scientific 2012). Selain itu, PCR koloni merupakan metode yang cepat untuk Screening plasmid insert secara langsung tanpa proses preparasi plasmid sebelumnya. Sebelum PCR koloni, koloni tunggal transforman dibiakkan kembali pada media LB cair yang sudang diberi antibiotik ampicilin kemudian setelah satu hari dibiakkan kultur diambil dan dipanaskan pada 100°C hal ini bertujuan agar DNA plasmid lepas dari E.coli sehingga dapat langsung diamplifikasi dengan PCR. PCR koloni menggunakan primer pJET 1.2 forward
dan pJET 1.2 primer reverse (Thermo Fisher scientific 2012). Primer pJET 1.2
forward dan pJET 1.2 primer reverse digunakan untuk PCR koloni karena gen yang diduga gen AaWRKY 1 telah diiligasi dalam vektor pJET 1.2 sehingga amplifikasi gen diharapkan merupakan gen yang disisipkan.
menunjukkan fragmen DNA yang lebih rendah ukurannya yaitu pada koloni 1, koloni 2, koloni 3, koloni 4, koloni 5, koloni 6 (Gambar 5), koloni 21 dan Koloni 25 (Gambar 6) hal ini dikarenakan hasil transformasi berhasil namun hasil ligasi bukan fragmen gen yang diduga gen AaWRKY1 yang terligasi atau plasmid kemasukan insert DNA lain, dan koloni sisanya menunjukan hasil dimer primer hal tersebut dikarenakan tidak ada DNA yang tersisipi dalam plasmid atau dapat dikatakan plasmid kosong. Koloni ke-14 yang positif sebelumnya telah dibiakkan kedalam media LB cari yang telah diberi ampicilin. Fragmen gen target yaitu gen
AaWRKY1 yang berukuran 1500pb diindentifikasi telah terdapat pada vektor kloning pJET 1.2. hal tersebut dibuktikan dengan terdapatnya satu pita DNA spesifik yang berukuran 1500pb pada hasil PCR Koloni.
SIMPULAN DAN SARAN
Simpulan
Gen yang diduga gen AaWRKY1 telah berhasil diisolasi dari daun tanaman
Artemisia annua L. Hasil amplifikasi gen yang diduga gen AaWRKY1 berukuran sekitar 1500pb. Gen yang diduga gen AaWRKY1 sudah berhasil dikloning ke dalam vektor kloning pJET 1.2. dan ditransfer ke E.coli Satu dari 28 koloni transforman membawa gen AaWRKY1 berukuran 1500pb.
Saran
Perlu dilakukan sequencing vektor rekombinan untuk mengkomfirmasi keberadaan dan kebenaran setiap komponen didalam vektor sebelum dilakukan transformasi plasmid vektor rekombinan ke tanaman.
DAFTAR PUSTAKA
Appalasamy S, Ning S P, Arvind B, Ahmad S O, Nad-Ali B J, Chan L K. 2012. Optimization of total RNA isolation method from the aromatic medical plant Artemisia annua L. International Jurnal of Plant Biology 3 (e7) : 34-37.
Bing Y C & Harry W. 2002. PCR cloning protocol. Second edition. USA : Library of Congress Cataloging in Publication Data.
Bintang M. 2010. Biokimia Teknik Penelitian. Jakarta (ID) : Erlangga.
Couch JA, Fritz PJ. 1990. Isolation of DNA from plants high in polyphenolics.
Plant Mol Biol Rep 8: 8-12 Dale JW. 1994. Molecular Genetic of Bacteria
England: John Wiley and Sons.
16
Darnell et al. 1990. Molecular CellBiology. New York (US):Scientific American Books.
Departemen Kesehatan RI. 2009. Rencana Strategis Kementerian Kesehatan Tahun 2010-2014. Jakarta.
Departemen Kesehatan. 2009. Profil Kesehatan Indonesia 2008. Jakarta. http://www.depkes. go.id [11 Februari 2014].
Dobhal S, P Dinesh, K Anil, A Sanjeev. 2010. Studies on plant regeneration and transformation efficiency of Agrobacterium mediated transformation using neomycin phospotransferase II (nptII) dan glucuronidase (GUS) as a reporter gene. Afr J Biotech 9(41):6853-6859.
Dongming Ma, Gaobin Pu, Caiyan Lei, Lanqing Ma, Huahong Wang, Yangwu Guo, Jianlin Chen , Zhigao Du , Hong Wang , Guofeng Li. 2009. Isolation and characterization of AaWRKY1, an Artemisia annua transcription factor that regulates the Amorpha-4,11-diene synthase gene, a key gene of Artemisinin biosynthesis. Plant Cell Physiol 50 (12): 2146-2161. doi:10.1093/pcp/pcp149.
Duke SO and RL. Paul. 1993. Development an fine structure of glandular trichomes of Artemisia annua L. J.Int.Plant Sci. 154 (1) : 107-118. doi: 10.1086/297096.
Faibanks D J & Andersen. 1999. Genetics : The continuity of life. Pasific Grove (US): Brooks/Cole Publishing Company.
Ferreira JFS, Simon JE, & Janick J. 1995. Developmen-tal studies of Artemisia annua: flowering and Artemisinin production under greenhouse and field conditions. Planta Medica.l. 61(2): 167-170. doi:10.1055/s-2006-958040. Grunewald H. 2003. Optimization of polymerase chain reactions. Dalam Bartlett
& Stirling (Eds), Method in Molecular Biology: PCR Protocols Second Edition. New York (US) : Humana press.
Gusmaini dan Hera N. 2007. Potensi pengembangan budidaya Artemisia annua L
di Indonesia .Presp. 6(2): 57-67.
Hasugian AR, Purba HLE, Wuwung RM, Ebsworth EP, Maristela R, Penttinen PMP, Laihad F, Anstey NM, Tjitra E, Price RN. 2007. Dihydroartemisinin-piperaquine versus Artesunate-amodiaquine: superior efficacy and posttreatment prophylaxis against multidrug-resistant
Plasmodium falciparum and Plasmodium vivax malaria. Clin Infect Dis.
44 (8): 1075-7.
Kaur R, Singh K. 2000. Orchid Transformation: protocol, problems and pracatical applications. Asian J Exp. Biol. Sci, 1 (4):711-718.
Klayman D L. 1993. Artemisia annua: from weed to respectable antimalarial plant. In: Kinghorn AD and Balandri MF (eds) Human Medicinal Agents from Plants.
Loulakakis KA. 1996. Isolation of functional RNA from grapevine tissues poor innucleic acid content. J EnolVitic 47:181-185.
Madigan M T, J M Martinko, P V Dunlap,& D P Clark. 2009. Brock Biology of microorganism. 12th Edition. San Francisco (US) : Pearson Education. McVaugh R. 1984. A descriptive account of the vascular plants of Western
Nanodrop Techologies, Inc. 2007. 260/280 and 260/230 Ratios nanodrop ND-1000 and ND-8000 8-sample spectrophotometers. Techinal Support Bul. Wilmington USA.
Oh SK, Baek KH, Park JM,Yi SY, Yu SH, Kamoun S Choi D. 2008. Capsicum annuum WRKY protein CaWRKY1 is a negative regulator of pathogen defense . New Phytol.177 : 977 – 989.
Petersen M. 2007. Current status of metabolic phytochemistry .Phytochemistry
68 : 2847 – 2860.
Pheiffer BH, Zimmerman SB. 1983. Polymer-stimulated ligation: enchanced blunt-or cohesive-end ligation of DNA or deoxyriboologonucleotides by T4 DNA ligase in polymer solutions. Nucleic Acid Res 11: 7853-7871. Pierce BA. 2005. Genetics : A conceptual approach. New York (US): WH
Freeman Publisher.
Qiagen. 2010. High-performance RNA for gene expression analysis. Qiagen Inc., United State of America (US) : 39 hlm.
Sambrook J, Russel DW. 2001. Molecular Cloning: A Laboratory manual. 3rd Edition. New York (US): Cold Spring Harbor Laboratory Pr, Cold Spring Harbor.
Sasmito B. 2010. Ekspresi gen Aminocyclopropane carboxylic synthase pada klon tanaman karet akibat pemberian etefon [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Thermo Fisher Scientific. 2009. Nanodrop 2000/200c Spectrophotometer V1.0 User Manual. Wilmington: Thermo Fisher Scientific.
Thermo Fisher Scientific. 2012. Thermo Scientific CloneJET PCR Cloning Kit Product Information. Wilmington: Thermo Fisher Scientific.
Turner P C et al 1995. Bios Instant Notes in Molecular Biology. New York (US) : Taylor & Francis Group.
Tsen SD, Eang SS, Chen MJ, Lee CC, & Tsen DH.2002. Natural plasmid transformation in Escherichia coli. Journal of Biomedical Science 9:246-252.
Verpoorte R. and Memelink J. 2002.Engineering secondary metabolite production in plants .Curr.Opin.Biotechnol.13 : 181 – 187.
Watson JD, Nancy HH, Jeffrey WR, Joan AS, & Alan MW. 1987. Molecular Biology of the Gene. USA: The BenjaminPublishing Company.
Weaver R F & P W Hedrick. 2005. Genetics. Third Edition. Dubuque (US) : WM C Brown Publishers
18
LAMPIRAN
Lampiran 1 Diagram alir penelitian
Persiapan bahan tanaman
Isolasi RNA
Sintesis cDNA
iScript Reverse Transcription Supermix
Transcriptor First Strand cDNA Synthesis Kit Rosche
Amplikasi gen AaWRKY1
Ligasi ke pJET 1.2
Transformasi sel E.coli
Lampiran 2 Peta plasmid pJET 1.2
Peta vektor pJET 1.2 (Thermo Fisher Scientific 2012)
20
Lampiran 3 Komposisi larutan sediaan Komposisi bufer TAE 50x
Pembuatan bufer TAE 1x (dari stok bufer TAE 50x) :
V1 x M1 = V2 x M2
V1 x 50 = 1 x 1000 mL
V1 = 20 mL (stok bufer TAE 50x ditera dengan akuades hingga 1000 mL)
Komposisi pembuatan Inoue bufer
Reagen Jumlah per 100 mL Konsentrasi akhir
MnCL2.4H2O 1.088 gram 55 mM
CaCl2.2H2O` 0.22 gram 15 mM
KCL 1.865 gram 250 mM
PIPES (0.5 M pH 6.7) 2 mL 10 mM
H2O s.d 100 mL
Komposisi LB Cair untuk 250 mL pH 7.0
Bahan Jumlah per 250 mL
Trypton 2.5 gram
NaCL 2.5 gram
Yeast 1.25 gram
Komposisi LB padat untuk 250 mL pH 7.0
Bahan Jumlah per 250 mL
Trypton 2.5 gram
NaCL 2.5 gram
Yeast 1.25 gram
Bacto agar 7.5 gram
Komposisi pembutan stock ampicilin 100 mg/mL
Bahan Jumlah per 50 mL
Ampicilin 5 gram
ddH20 steril 50 mL
Komposisi pembuatan Stock agarosa 1% 100 mL
Bahan Jumlah per 100 mL
Agarosa 1 gram
Lampiran 4 Ekstrasi dan Purifikasi DNA dengan QIAQuick Qiagen
Potong Gel column demgan pisau (Scapel)
Potongan gel dletakkan di tabung dan diberi 3
Volume buffer GC
Inkubasi 50ºC selama 2-3 menit sambil
digoyang-goyang
Cek warna jika kuning kemudian ditambahkan 1
volume Isopropanol
Kemudian dimasukkan ke dalam QIA quick spin coloumn dengan tabung 2
mL
Sentrifuse selama 1 menit, buang supernatant dan
22
Lampiran 5 Diagram Alir Pembuatan Sel Kompeten E.coliDH5α
Peremajaan E.coli DH5α
dalam 5 mL LB cair inkubasi 28ºC selama 16 jam 200 Rpm
4 mL kultur yang keruh dimasukkan ke dalam LB cair 50 mL inkubasi 28ºC selama 3 Jam 250 Rpm
Sel dipanen dengan sentrifus 4000 rpm selama
10 menit pada suhu 4oC, supernatant dibuang
Resuspensi kembali sel dengan 16 mL Innoue Buffer dalam keadaan dingin
Setrifugasi 4000 rpm selama 10 menit pada suhu 4oC keringkan
Resuspensi kembali dengan 4 mL Innoue Buffer yang telah disediakan dalam keadaan dingin
ditambah 300 µL DMSO,
Lampiran 6 Diagram Alir Pembuatan Media LB
Sterilisasi dengan autoklaf Aduk dengan Stiter, pH diukur sampai mencapai pH
7.0 (tambahkan NaOH jika kurang dari 7)
Larutan dibagi kedalam 2 tabung, untuk Lb cair dan Lb
padat
Untuk Lb padat ditambah bacto agar
Campuran Komposisi dimasukkan kecuali bacto
24
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 18 Agustus 1992 dari ayah Sutaryo Hadi Warsoko (Alm) dan ibu Haryati. Penulis adalah putri ke-3 dari tiga bersaudara. Pendidikan sekolah dasar di SD Negeri Joglo 10 pagi Jakarta Barat tamat pada tahun 2004. Penulis melanjutkan ke Sekolah Menengah Pertama Negeri 177 Jakarta tamat pada tahun 2007. Tahun 2010 penulis lulus dari SMA Negeri 90 Jakarta dan pada tahun yang sama penulis lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur SNMPTN IPB dan diterima di Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.
Penulis juga aktif dalam organisasi kampus sebagai staf Human Research Development di Himpunan profesi Departemen Biokimia Community Research and Education of Biochemistry Student (CREBs) IPB 2011-2012. dan Selain aktif berorganisasi, penulis juga tergabung pada beberapa kepanitian di Institut Pertanian Bogor, di antaranya Seminar Kesehatan Nasional (2012), International Scholarship Education Expo (ISEE )(2012), IPB Art Contest (2013).