KAJIAN AKTIVITAS KOMPONEN BIOAKTIF
DARI KEONG MATAH MERAH (
Cerithidea obtusa
)
RENI TRI CAHYANI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis yang berjudul Kajian Aktivitas Komponen Bioaktif dari Keong Matah Merah (Cerithidea obtusa) adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau kutipan dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Mei 2015
Reni Tri Cahyani
RINGKASAN
RENI TRI CAHYANI. Kajian Aktivitas Komponen Bioaktif dari Keong Matah Merah (Cerithidea obtusa). Dibimbing oleh SRI PURWANINGSIH dan AZRIFITRIA.
Keong matah merah (Cerithidea obtusa) merupakan salah satu spesies yang banyak dijumpai pada ekosistem mangrove di kawasan Asia-Pasifik. Hewan ini banyak digunakan untuk makanan dan dipercaya dapat digunakan sebagai obat. Penelitian ini bertujuan untuk menggali potensi aktivitas komponen bioaktif keong matah merah melalui karakterisasi keong matah merah; karakterisasi ekstrak keong matah merah dan pengujian aktivitas antioksidan, antidiabetes, antiinflamasi dan antibakteri secara in vitro. Karakterisasi keong matah merah meliputi identifikasi; pengamatan morfometrik; proporsi; dan analisis proksimat, sedangkan karakterisasi ekstrak keong matah merah meliputi rendemen; deskripsi ekstrak; toksisitas dengan metode BSLT; dan skrining komponen aktif secara kualitatif. Aktivitas bioaktif diukur secara in vitro meliputi antioksidan dengan metode DPPH, antidiabetes dengan metode inhibisi α-glukosidase, antiinflamasi dengan metode stabilitas membran sel darah merah, dan antibakteri dengan metode difusi agar.
Hasil identifikasi menunjukkan bahwa C. obtusa memiliki ciri khas bagian tumpul pada ujung cangkangnya. Rata-rata panjang cangkang, lebar cangkang, lebar kolumela, dan berat berturut-turut adalah 40,5 mm; 19,9 mm; 16,9 mm; dan 5,1 g. Proporsi cangkang, daging, dan jeroan berturut-turut 66,7%; 18,1%; dan 15,2%. Kadar air, protein, lemak, abu, dan karbohidrat berturut-turut 82,8%; 11,9%; 0,3%; 2,0%; dan 3,1%.
Rendemen tertinggi adalah ekstrak metanol (4,7%), diikuti oleh ekstrak etil asetat (0,5%) dan ekstrak n-heksan (0,2%). Semua ekstrak memiliki karakteristik bentuk pasta dan berbau amis. Warna ekstrak metanol, ekstrak etil asetat, dan ekstrak n-heksan berturut-turut adalah hijau pudar, hijau gelap, dan kuning kecoklatan. Uji toksisitas menunjukkan bahwa semua ekstrak bersifat toksik dengan nilai LC50 terendah adalah ekstrak n-heksan (176,3 μg/ml), diikuti
oleh ekstrak etil asetat (476,3 μg/ml) dan ekstrak metanol (715,4 μg/ml). Skrining komponen aktif menunjukkan bahwa ekstrak metanol mengandung alkaloid, flavonoid, triterpenoid, dan saponin; ekstrak etil asetat mengandung flavonoid, fenol hidrokuinon, triterpenoid, dan saponin; ekstrak n-heksan mengandung triterpenoid.
Ekstrak etil asetat memiliki aktivitas antioksidan (IC50 = 645,6 μg/ml),
sedangkan ekstrak metanol memiliki aktivitas antidiabetes (IC50 = 36,4 mg/ml).
Aktivitas antiinflamasi tidak ditemukan dari semua ekstrak, sedangkan aktivitas antibakteri ditemukan pada ekstrak n-heksan namun aktivitasnya sangat rendah (MIC = 46 mg/ml).
SUMMARY
RENI TRI CAHYANI. Study of Bioactive Components Activity of Cerithidea Obtusa. Supervised by SRI PURWANINGSIH and AZRIFITRIA.
Cerithidea obtusa is one of species that can be found in the mangrove ecosystem in the Asia-Pacific region. It has been widely used for food and reliable as medicine. This study was aimed to explore the potential of bioactive components activity through characterization of C. obtusa; characterization of C. obtusa extract; antioxidant, antidiabetic, antiinflammatory and antibacterial activity assay of C. obtusa extract in vitro. The characterization of C. obtiusa were included identification, morphometric observations, proportions and proximate analysis. Whereas, the characterization of C. obtusa extract were included yield, extract descriptions, toxicity with BSLT method, and screening of active component qualitatively. Bioactive activity was measured in vitro included antioxidant by DPPH method, antidiabetic by α-glucosidase inhibition method, antiinflammatory by red blood cell membrane stabilizing method, and antibacterial by disc diffusion method.
The identification results indicated that the C. obtusa had a blunt at the tip of the shell characterization. The average of shell length, shell width, columella width, and weight were 40.5 mm, 19.9 mm, 16.9 mm, and 5.1 g, respectively. The proportion of shells, meat, and offal were 66.7%, 18.1%, and 15.2%, respectively. Moisture content, protein, fat, ash, and carbohydrate were 82.8%, 11.9%, 0.3%, 2.0%, and 3.1%, respectively.
The highest yield was methanol extract (4.7%), followed by ethyl acetate extract (0.5%) and n-hexane extract (0.2%). All of extracts had characteristics of paste form and fishy smell. The colour of methanol extract, ethyl acetate extract, and n-hexane extract were faded green, dark green, and tawny, recpectively. Toxicity test showed that all of extracts were toxic with the lowest of LC50 value
was n-hexan extract (176.3 µg/ml), followed by ethyl acetate extract (476.3 µg/ml) and methanol extract (715.4 µg/ml). Screening of active
component adduced that methanol extract contained alkaloids, flavonoids, triterpenoids, and saponins; ethyl acetate extract contained flavonoids, phenolic hydroquinone, triterpenoids, and saponins; n-hexane extract contained triterpenoids.
Ethyl acetate extract had antioxidant activity (IC50 = 645,6 µg/ml) while
methanol extract had antidiabetic activity (IC50 = 36.4 mg/ml). antiinflammatory
activity was not found at all of extracts while antibacteria activity was discovered at n-hexane extract but the activity was very low (MIC = 46 mg/ml).
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
KAJIAN AKTIVITAS KOMPONEN BIOAKTIF
DARI KEONG MATAH MERAH (
Cerithidea obtusa
)
RENI TRI CAHYANI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Teknologi Hasil Perairan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah Yang Maha Kuasa atas segala rahmat dan karunia-Nya sehingga tesis dengan judul “Kajian Aktivitas Komponen Bioaktif dari Keong Matah Merah (Cerithidea obtusa)” ini dapat diselesaikan.
Terima kasih penulis ucapkan kepada Dr Ir Sri Purwaningsih, MSi selaku ketua komisi pembimbing dan Dr Azrifitria, MSi, Apt sebagai anggota komisi pembimbing atas kesediaan waktu untuk membimbing, memberikan arahan dan masukan selama penyusunan tesis. Terimakasih kepada Dr Ir Wini Trilaksani, MSc selaku ketua program studi S2 THP, Dr Eng Uju, SPi, MSi selaku perwakilan ketua program studi S2 THP dan Dr Desniar SPi, MSi selaku penguji luar komisi yang telah memberikan kritikan serta saran yang bersifat membangun untuk menyempurnakan tesis ini. Penulis juga mengucapkan terimakasih kepada staf administrasi, laboran, teman-teman S2 THP 2012, teman-teman S2 THP 2013 dan teman-teman dari program studi farmasi FKIK UIN Syarif Hidayatullah yang telah banyak membantu dan kerjasamanya yang baik selama penelitian dan penyusunan tesis, serta seluruh pihak yang telah membantu dan tidak dapat disebutkan satu per satu.
Terima kasih yang tak terhingga kepada kedua orangtua penulis Sri Purwaningsih dan Wagirun atas motivasi, doa, semangat dan dukungan baik
moril maupun material selama penulis menempuh studi. Penulis menyadari bahwa tesis ini masih banyak kekurangan. Semoga tesis ini membawa manfaat bagi seluruh civitas IPB khususnya dan masyarakat Indonesia umumnya.
Bogor, April 2015
DAFTAR ISI
DAFTAR TABEL xi
DAFTAR GAMBAR xii
DAFTAR LAMPIRAN xiii
1 PENDAHULUAN Latar Belakang 1
Perumusan Masalah 1
Tujuan Penelitian 2
Manfaat Penelitian 2
2 METODE PENELITIAN 4
Waktu dan Tempat 4
Alat dan Bahan 4
Prosedur Kerja 5
Rancangan Penelitian 12
3 HASIL DAN PEMBAHASAN 13
Karakteristik Keong Matah Merah 13
Identitas keong matah merah 13
Morfometrik keong matah merah 14
Proporsi keong matah merah 15
Komposisi kimia daging keong matah merah 15
Karakteristik Ekstrak Keong Matah Merah 17
Rendemen keong matah merah 17
Deskripsi keong matah merah 18
Toksisitas keong matah merah 18
Komponen aktif keong matah merah 20
Aktivitas Komponen Bioaktif Keong Matah Merah 22
Aktivitas antioksidan 22
Aktivitas antidiabetes 25
Aktivitas antiinflamasi 27
Aktivitas antibakteri 30
Aktivitas komponen bioaktif ekstrak keong matah merah 32
4 SIMPULAN DAN SARAN 34
DAFTAR PUSTAKA 35
LAMPIRAN 40
DAFTAR TABEL
1 Sistem reaksi inhibisi α-glukosidase 10
2 Morfometrik keong matah merah 15
3 Komposisi kimia daging keong matah merah 16
4 Rendemen ekstrak keong matah merah 17
5 Deskripsi ekstrak keong matah merah 18
6 Komponen aktif ekstrak keong matah merah 21
7 Aktivitas antibakteri ekstrak n-heksan keong matah merah 31
8 Aktivitas komponen bioaktif ekstrak keong matah merah 32
DAFTAR GAMBAR
1 Roadmap penelitian 3
2 Keong matah merah 13
3 Pengamatan morfometrik keong matah merah 14
4 Proporsi keong matah merah 15
5 Ekstrak keong matah merah 17
6 Hubungan antara kosentrasi ekstrak metanol keong matah merah dengan persentase mortalitas larva A. salina 19
7 Hubungan antara kosentrasi ekstrak etil asetat keong matah merah dengan persentase mortalitas larva A. salina 19
8 Hubungan antara kosentrasi ekstrak heksan keong matah merah dengan persentase mortalitas larva A. salina 20
9 Aktivitas antioksidan ekstrak keong matah merah 22
10 Aktivitas antioksidan ekstrak etil asetat keong matah merah 23
11 Hubungan antara konsentrasi ekstrak etil asetat keong matah merah dengan persentase inhibisi radikal bebas DPPH 23
12 Hubungan antara konsentrasi vitamin C dengan persentase inhibisi radikal bebas DPPH 24
13 Aktivitas antidiabetes ekstrak keong matah merah 25
14 Aktivitas antidiabetes ekstrak metanol keong matah merah 26
15 Hubungan antara konsentrasi ekstrak metanol keong matah merah dengan persentase inhibisi α-glukosidase 26
16 Hubungan antara konsentrasi glucobay dengan persentase inhibisi aktivitas α-glukosidase 27
17 Aktivitas antiinflamasi ekstrak keong matah merah 28
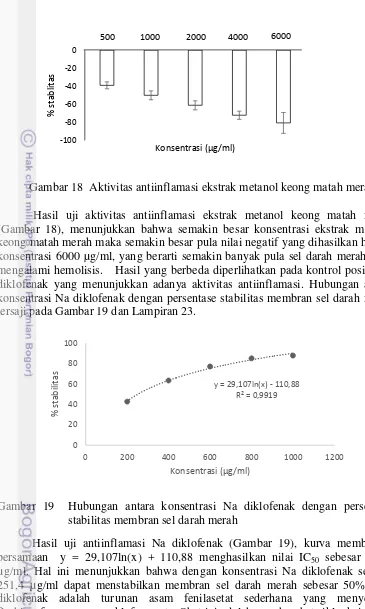
18 Aktivitas antiinflamasi ekstrak metanol keong matah merah 29
19 Hubungan antara konsentrasi Na diklofenak dengan persentase stabilitas membran sel darah merah 29
DAFTAR LAMPIRAN
1 Sertifikat identifikasi keong matah merah 41
2 Morfometrik keong matah merah 42
3 Komposisi kimia daging keong matah merah 43
4 Toksisitas ekstrak keong matah merah 44
5 Contoh perhitungan nilai LC50 45
6 Aktivitas antioksidan ekstrak keong matah merah 45 7 Aktivitas antioksidan ekstrak etil asetat keong matah merah 46 8 Normalitas aktivitas antioksidan ekstrak etil asetat keong matah
merah 46
9 Homogenitas aktivitas antioksidan ekstrak etil asetat keong matah
merah 46
10 Sidik ragam aktivitas antioksidan ekstrak etil asetat keong matah
merah 47
11 Uji lanjut Duncan aktivitas antioksidan ekstrak etil asetat keong
matah merah 47
12 Contoh perhitungan IC50 48
13 Aktivitas antioksidan vitamin C 48
14 Aktivitas antidiabetes ekstrak keong matah merah 49 15 Aktivitas antidiabetes ekstrak metanol keong matah merah 50 16 Normalitas aktivitas antidiabetes ekstrak metanol keong matah merah 51 17 Homogenitas aktivitas antidiabetes ekstrak metanol keong matah 51 18 Sidik ragam aktivitas antidiabetes ekstrak metanol keong matah 51 19 Uji lanjut duncan aktivitas antidiabetes ekstrak metanol keong matah
merah 51
20 Aktivitas antidiabetes glucobay 52
21 Aktivitas antiinflamasi ekstrak keong matah merah 53 22 Aktivitas antiinflamasi ekstrak metanol keong matah merah 54 23 Aktivitas antiinflamasi Na diklofenak 55 24 Aktivitas antibakteri ekstrak keong matah merah 56 25 Aktivitas antibakteri ekstrak n-heksan keong matah merah 57 26 Normalitas antibakteri ekstrak n-heksan keong matah merah 58 27 Homogenitas antibakteri ekstrak n-heksan keong matah merah 58 28 Sidik ragam aktivitas antibakteri ekstrak n-heksan keong matah 58 29 Hasil uji lanjut duncan aktivitas antibakteri ekstrak n-heksan
1
PENDAHULUAN
Latar Belakang
Kebutuhan obat-obatan bagi kesehatan manusia semakin meningkat dari tahun ke tahun. Menurut data dari Kementerian Kesehatan RI, Indonesia setidaknya membutuhkan 44 trilyun obat untuk memenuhi kebutuhan 240 juta penduduk Indonesia. Obat-obatan tersebut hampir 90% telah diproduksi dalam negeri, namun sayangnya 96% bahan obat yang digunakan masih impor (Kemenkes RI 2013). Indonesia dengan sebutan Marine Mega-Biodiversity terbesar di dunia seharusnya mampu memproduksi bahan obat sendiri tanpa tergantung dari pasokan bahan impor. Hal tersebut dapat dilakukan dengan cara memanfaatkan keanekaragaman sumber hayati laut yang dimiliki Indonesia. Organisme laut yang hidup secara terus-menerus di lingkungan laut akan mengalami berbagai tekanan, menyebabkan organisme tersebut menghasilkan berbagai senyawa bioaktif yang dapat dimanfaatkan sebagai bahan obat. Penelitian senyawa bioaktif kini mulai diarahkan pada hasil-hasil laut dan beberapa diantaranya telah menghasilkan beragam senyawa-senyawa baru yang sangat potensial untuk bahan obat.
Gastropoda atau sering disebut siput mewakili sekelompok hewan yang menggunakan perut sebagai alat gerak atau kakinya. Gastropoda sering disebut
univalves karena mereka hanya memiliki satu cangkang. Terdapat sekitar 62.000 spesies teridentifikasi dengan total 13.000 genus gastropoda telah ditemukan di seluruh dunia (Breazeale 2012). Menurut Sokolova dan Portner (2001), gastropoda laut mampu beradaptasi terhadap kondisi lingkungan yang sering tak terduga dan ekstrim seperti perubahan musim, perubahan suhu lingkungan dan pasang surut air laut. Organisme tersebut memiliki
α-amilase sebesar 72,23±0,44% pada konsentrasi 1 ml dan aktivitas antiinflamasi sebesar 72,58±1,66% pada konsentrasi 50 mg/ml sedangkan ekstrak metanol
N. didyma memiliki aktivitas antibakteri dengan zona hambat sebesar 19,30±0,39 mm. Sadhasivam et al. (2013), melaporkan bahwa ekstrak metanol
Aplysia sp. memiliki aktivitas inhibitor α-amilase sebesar 93% sedangkan ekstrak metanol K. ornata memiliki aktivitas antibakteri dengan zona hambat sebesar 23 mm. Ramasary et al. (2013), melaporkan bahwa ekstrak aseton C. ramusus
memiliki aktivitas antibakteri dengan zona hambat sebesar 26±1,53 mm pada konsentrasi 20 mg/ml.
obat. Kemampuannya sebagai bahan obat diduga karena di dalam daging keong matah merah mengandung suatu senyawa bioaktif. Beberapa penelitian sebelumnya telah dilakukan untuk mengetahui potensi senyawa bioaktif dari keong matah merah. Purwaningsih (2012), melaporkan bahwa ekstrak metanol keong matah merah memiliki aktivitas antioksidan kuat dengan nilai IC50 sebesar
58,19 µg/ml. Purwaningsih (2008), melaporkan bahwa ekstrak aseton keong matah merah juga memiliki aktivitas antikanker dimana mampu menghambat pertumbuhan kanker payudara pada mencit C3H dengan skor lesio kelompok
perlakuan 9,48-4,38 dibandingkan perlakuan kontrol dengan skor lesio 13,05. Purwaningsih et al. (2008), juga melaporkan bahwa ekstrak aseton keong matah merah mampu menghambat sel kanker serviks sebesar 90,62%, sel kanker paru sebesar 79,84% dan sel kanker leukimia sebesar 76,71%. Penelitian tentang keong matah merah hingga saat ini masih berfokus pada aktivitas antioksidan dan antikanker dan belum pernah dilaporkan untuk aktivitas bioaktif lainnya, sehingga perlu dilakukan kajian tentang aktivitas komponen bioaktif agar dapat menggali lebih dalam potensi keong matah merah sebagai bahan obat.
Perumusan Masalah
Indonesia memiliki keanekaragaman sumberdaya hayati laut yang belum banyak dieksplorasi potensinya sebagai bahan obat. Keong matah merah merupakan salah satu organisme laut yang hidup di perairan Indonesia. Spesies jenis ini telah lama dimanfaatkan oleh bangsa Cina sebagai bahan obat, namun belum banyak diketahui oleh masyarakat Indonesia tentang manfaat tersebut. Berdasarkan penelitian sebelumnya, keong matah merah memiliki aktivitas antioksidan dan antikanker baik secara in vitro maupun in vitro. Penelitian ini dilakukan untuk mencari aktivitas komponen bioaktif lain yang terkandung dalam keong matah merah. Adapun roadmap penelitian keong matah merah tersaji pada Gambar 1.
Tujuan Penelitian
Tujuan dari penelitian “Kajian Aktivitas Komponen Bioaktif dari Keong Matah merah (Cerithidea obtusa)” adalah menggali lebih dalam potensi aktivitas komponen bioktif dari keong matah merah sehingga dapat dimanfaatkan sebagai bahan obat. Pengujian aktivitas komponen bioaktif dari keong matah merah dilakukan secara in vitro meliputi aktivitas antioksidan, antidiabetes, antiinflamasi dan antibakteri.
Manfaat Penelitian
1) Memberikan informasi ilmiah mengenai potensi keong matah merah untuk bahan obat dalam upaya pengembangan sumber obat baru dalam bidang farmasi.
2) Memberikan informasi ilmiah dan dasar bagi penelitian lanjutan tentang aktivitas komponen bioaktif dari keong matah merah.
Gambar 1 Roadmap penelitian keong matah merah
2 METODE PENELITIAN
Waktu dan Tempat
Penelitian ini telah dilaksanakan pada bulan Juni – Desember 2014. Penelitian bertempat di Pusat Penelitian Oseanografi LIPI Ancol Jakarta; Laboratorium Karakteristik Bahan Baku Departemen Teknologi Hasil Perairan Fakultas Perikanan dan Ilmu Kelautan IPB; Pusat Penelitian Sumberdaya Hayati dan Bioteknologi IPB; Laboratorium Kimia Analitik, Kimia IPB; Pusat Studi Biofarmaka IPB; Laboratorium Pharmacy Sterile Technology dan Laboratorium Penelitian I, Program Studi Farmasi Fakultas Kedokteran dan Ilmu Kesehatan UIN Syarif Hidayatullah Jakarta.
Bahan dan Alat
Sampel yang digunakan dalam penelitian ini adalah keong matah merah yang diperoleh dari Pasar Muara Angke Jakarta. Berdasarkan informasi dari penjual, keong matah merah ini dipasok dari Desa Simpang Tiga Jaya, Kecamatan Tulung Selapan, Kabupaten Oki, Sumatra Selatan. Bahan yang digunakan untuk karakterisasi keong matah merah diantaranya alkohol 70%, selenium, H2SO4
pekat, NaOH 40%, H3BO3 2%, bromcresol green-methyl red, HCl 0,1 N dan
benzena. Bahan yang digunakan pada ekstraksi dan karakterisasi ekstrak keong matah merah diantaranya daging keong matah merah, metanol, etil asetat, n-heksan, larva udang A. salina, H2SO4 pekat, NaOH, pereaksi Meyer, Wagner dan
Dragendroff, pereaksi Liebermann-Burchard, kloroform dan HCl. Bahan yang digunakan pada pengujian aktivitas komponen bioaktif diantaranya Dimethyl Sufoxide (DMSO), Diphenylpicrylhydrazyl (DPPH), etanol pro analis dan vitamin C, bufer fosfat, p-Nitrophenyl α-D-glucopyranoside (p-NPG), enzim α -glukosidase, Na2CO3, akarbosa (Glucobay ® tablet), darah, dinatrium hidrogen
fosfat (Na2HPO4.2H2O), natrium dihidrogen fosfat (NaH2PO4.H2O), NaCl
fisiologis, Na diklofenak, Nutrient Agar (NA), Nutrient Broth (NB), Muller Hinton Agar (MHA), biakan E. coli, biakan S. aureus dan kloramfenikol.
Alat yang digunakan pada karakterisasi keong matah merah diantaranya
cool box, timbangan, jangka sorong, oven, desikator, destilator, seperangkat alat soklet. Alat yang digunakan pada ekstraksi dan karakterisasi ekstrak keong matah merah diantaranya Erlenmeyer, shaker, rotary evaporator (EYELA N1001T),
komponen bioaktif keong matah merah diantaranya spektrofotometer UV-Vis (Hitachi U-2910), elisa reader (Epoch), sentrifuge (Hettich EBA20), autoclave
(ALP KT40) dan pHmeter (Horiba F-52).
Prosedur Kerja
Identifikasi sampel
Identifikasi sampel dilakukan di Pusat Penelitian Oseanografi LIPI, Ancol, Jakarta. Sampel dibawa menuju laboratorium dalam keadaan hidup, dengan menggunakan cool box, kemudian dilakukan pengawetan dengan merendam sampel pada alkohol 70% pada wadah yang sudah diberi label. Identifikasi dilakukan dengan menggunakan kunci identifikasi Siput dan Kerang Indonesia (Dharma 1992) dan The Encyclopedia of Shells (Dance 1974).
Pengamatan morfometrik (Mujiono 2011)
Morfometrik merupakan peneraan pengukuran morfologi yang meliputi ukuran panjang dan berat, serta skala kondisi fisik berdasarkan standar morfologi tubuh. Pengamatan morfometrik cangkang keong matah merah dilakukan meliputi pengukuran panjang cangkang, lebar cangkang, lebar kolumela dan berat cangkang.
Perhitungan proporsi (Firdaus et al. 2013)
Proporsi merupakan perbandingan dari bagian-bagian terhadap keseluruhan. Perhitungan proporsi keong matah merah meliputi bagian cangkang, daging dan jeroan. Bagian daging selanjutnya digunakan untuk analisis proksimat.
Perhitungan proporsi:
Proporsi (%) = x 100%
Analisis proksimat
a. Kadar air (AOAC 2005)
Perhitungan kadar air :
Kadar air (%) = x 100%
Keterangan :
A = Berat cawan kosong (g)
B = Berat cawan yang diisi dengan sampel (g)
C = Berat cawan dengan sampel yang sudah dikeringkan (g)
b. Kadar abu (AOAC 2005)
Cawan pengabuan dikeringkan di dalam oven selama 1 jam pada suhu 105ºC, kemudian didinginkan selama 15 menit di dalam desikator dan ditimbang hingga didapatkan berat yang konstan. Sampel sebanyak 5 g dimasukkan ke dalam cawan pengabuan dan dipijarkan di atas nyala api bunsen hingga tidak berasap lagi. Cawan dimasukkan ke dalam tanur pengabuan dengan suhu 600ºC selama 6 jam, kemudian ditimbang hingga didapatkan berat yang konstan.
Perhitungan kadar abu:
Kadar abu (%) = x 100%
Keterangan :
A = Berat cawan porselen kosong (g) B = Berat cawan dengan sampel (g)
C = Berat cawan dengan sampel setelah dikeringkan (g)
c. Kadar protein (AOAC 2005)
Sampel sebanyak 0,25 g dimasukkan ke dalam labu Kjeldahl 100 ml, kemudian ditambahkan 0,25 g selenium dan 3 ml H2SO4 pekat. Sampel
didestruksi pada suhu 410oC selama kurang lebih 1 jam sampai larutan jernih lalu didinginkan. Aquadest sebanyak 50 ml dan 20 ml NaOH 40% ditambahkan ke dalam labu Kjeldahl, kemudian dilakukan proses destilasi dengan suhu destilator 100ºC. Destilat ditampung dalam labu Erlenmeyer 125 ml yang berisi campuran 10 ml asam borat (H3BO3) 2% dan 2 tetes indikator bromcresol green-methyl red
yang berwarna merah muda. Proses destilasi dihentikan setelah volume destilat mencapai 40 ml dan berwarna hijau kebiruan. Destilat kemudian dititrasi dengan HCl 0,1 N sampai terjadi perubahan warna merah muda. Volume titran dibaca dan dicatat. Larutan blanko dianalisis seperti contoh.
Perhitungan kadar protein:
N (%) = x 100%
Keterangan :
Faktor koreksi alat = 2,5 % Faktor konversi = 6,25
d. Kadar lemak (AOAC 2005)
Sampel sebanyak 5 g (A) dimasukkan ke dalam kertas saring dengan kedua ujungnya ditutup kapas bebas lemak. Sampel kemudian dimasukkan ke dalam selongsong lemak dan disambungkan dengan kondensor dan labu lemak yang sudah ditimbang berat tetapnya (B). Sampel kemudian disiram dengan pelarut lemak (benzena). Refluks dilakukan selama 6 jam. Pelarut lemak yang ada dalam labu lemak didestilasi hingga semua pelarut lemak menguap. Pelarut akan tertampung di ruang ekstraktor dan dikeluarkan sehingga tidak kembali ke dalam labu lemak, selanjutnya labu lemak dikeringkan dalam oven pada suhu 105ºC. Labu lemak kemudian didinginkan dalam desikator sampai beratnya konstan (C).
Perhitungan kadar lemak:
Kadar lemak (%) = x 100%
Keterangan :
A= Berat sampel (g)
B= Berat labu lemak kosong (g) C= Berat labu lemak dengan lemak (g)
e. Kadar karbohidrat (AOAC 2005)
Analisis karbohidrat dilakukan secara by difference, yaitu hasil pengurangan dari 100% dengan kadar air, kadar abu, kadar protein dan kadar lemak.
Perhitungan kadar karbohidrat:
Karbohidrat (%) = 100 % - ( kadar air + kadar abu + kadar protein + kadar lemak)
Ekstraksi (Purwaningsih et al. 2008)
Ekstraksi dilakukan dengan metode maserasi menggunakan pelarut tunggal yaitu metanol (polar), etil asetat (semi polar) dan n-heksan (non polar). Sampel daging keong matah merah dimaserasi dengan pelarut dengan perbandingan 1:3 (b/v) dan diaduk menggunakan shaker selama 24 jam. Larutan ekstrak yang diperoleh disaring dengan kertas saring untuk memisahkan filtrat dan residunya. Proses tersebut diulang 3 kali. Filtrat yang dihasilkan kemudian dievaporasi dengan rotary evaporator pada suhu 40ºC.
Perhitungan rendemen (Kridati et al. 2012)
Ekstrak keong matah merah yang diperoleh kemudian dihitung rendemennya. Rendemen merupakan perbandingan antara berat ekstrak yang dihasilkan dengan berat awal bahan yang dinyatakan dalam persen (%).
Perhitungan rendemen:
Uji deskripsi ekstrak (BPOM 2000)
Uji deskripsi ekstrak dilakukan dengan menggunakan panca indera langsung untuk mendeskripsikan bentuk, warna dan bau ekstrak. Uji deskripsi ekstrak keong matah merah bertujuan untuk mendapatkan karakteristik fisik ekstrak keong matah merah.
Uji toksisitas dengan metode BSLT (Juniarti et al. 2009)
Telur udang sebanyak 10 mg ditetaskan dalam 250 ml air laut di bawah lampu dan diaerasi dengan aerator selama 48 jam. Larutan induk sampel (2000 µg/ml) dibuat dengan cara melarutkan 20 mg sampel dalam 10 ml air laut dengan bantuan DMSO dan diencerkan pada konsentrasi 50, 100, 500, 1000 µg/ml. Sebanyak 100 µl air laut yang mengandung 10 ekor larva udang yang berumur 48 jam dipipet, kemudian dimasukkan ke dalam wadah uji dan ditambahkan larutan sampel yang akan diuji masing-masing sebanyak 100 µl. Larutan diaduk sampai homogen dan dibiarkan selama 24 jam. Jumlah larva yang mati dan masih hidup dihitung dari tiap lubang.
Perhitungan akumulasi mati tiap konsentrasi dilakukan dengan cara berikut: akumulasi mati untuk konsentrasi 50 µg/ml = angka mati pada konsentrasi 50 µg/ml + angka mati pada konsentrasi 100 µg/ml + angka mati pada konsentrasi 500 µg/ml + angka mati pada konsentrasi 1000 µg/ml.
Perhitungan akumulasi hidup tiap konsentrasi dilakukan dengan cara berikut: akumulasi hidup untuk konsentrasi 1000 µg/ml = angka hidup pada hidup pada konsentrasi 1000 µg/ml + angka hidup pada konsentrasi 500 µg/ml + angka hidup pada konsentrasi 100 µg/ml + angka hidup pada konsentrasi 50 µg/ml. Mortalitas dihitung dengan cara: akumulasi mati dibagi jumlah akumulasi hidup dan mati (total) dikali 100%. Grafik dibuat dengan konsentrasi sebagai sumbu x terhadap mortalitas sebagai sumbu y. Persamaan garis yang diperoleh dalam bentuk y = b(x) + a digunakan untuk mencari nilai LC50. Nilai
LC50 merupakan konsentrasi dimana zat menyebabkan kematian larva A. salina
sebesar 50%.
Uji komponen aktif (Harbone 1987)
jika adanya endapan putih kekuningan untuk pereaksi Meyer, endapan coklat untuk Wagner dan endapan merah jingga untuk pereaksi Dragendorff.
Uji Flavonoid : Sebanyak 0,1 g sampel diekstrak dengan 2 ml metanol panas. Filtrat yang dihasilkan diteteskan pada plat tetes dan ditambahkan H2SO4
pekat. Terbentuknya warna merah menunjukkan adanya senyawa flavonoid dalam bahan.
Uji Fenol Hidrokuinon : Sebanyak 0,1 g sampel diekstrak dengan 2 ml metanol panas. Filtrat yang dihasilkan diteteskan pada plat tetes dan ditambahkan NaOH 10%. Terbentuknya warna kuning-merah menunjukkan adanya senyawa fenol dalam bahan.
Uji Steroid dan Triterpenoid : Sebanyak 0,1 g sampel ditambah dengan 2 ml kloroform dalam tabung reaksi, kemudian diteteskan ke dalam plat tetes dan dibiarkan sampai kering. Pereaksi Liebermann-Burchard ditambahkan sebanyak 1 tetes. Terbentuknya warna merah menandakan adanya senyawa triterpenoid dan terbentuknya warna biru atau ungu menandakan adanya senyawa steroid.
Uji Saponin : Sebanyak 0,1 g sampel ditambah dengan 20 ml aquades, kemudian dipanaskan selama 5 menit. Larutan dituang ke dalam tabung reaksi dalam keadaan panas. Larutan diambil sebanyak 10 ml, kemudian dikocok kuat secara vertikal selama 10 detik. Adanya saponin ditandai dengan terbentuknya busa yang stabil setinggi 1-10 cm selama 10 menit dan tidak hilang pada saat ditambahkan dengan satu tetes HCl 2 N.
Uji aktivitas antioksidan (Salazar-Aranda et al. 2009)
a. Pembuatan larutan
Larutan induk sampel (10 mg/ml) dibuat dengan cara melarutkan sampel sebanyak 10 mg dalam 1 ml DMSO. Larutan induk sampel kemudian diencerkan dalam beberapa seri konsentrasi. Larutan DPPH 125 µM dibuat dengan cara melarutkan DPPH sebanyak 4,93 mg dengan etanol pro analis hingga 100 ml.
b. Pengujian
Larutan induk sampel (metanol, etil asetat, n-heksan) keong matah merah diencerkan pada konsentrasi 50 µg/ml. Sampel sebanyak 100 µl kemudian dipindahkan ke dalam microplate menggunakan pipet mikro dan ditambahkan 100 µl DPPH. Blanko berisi 100 µl etanol pro analis dan 100 µl DPPH. Campuran tersebut diinkubasi pada ruang gelap suhu ruang selama 30 menit, kemudian absorbansinya diukur menggunakan Elisa Reader pada panjang gelombang 517 nm. Uji aktivitas antioksidan kembali dari ekstrak terbaik pada konsentrasi 200, 400, 600, 800 dan 1000 µg/ml dan kontrol positif vitamin C pada konsentrasi 2,5; 5,0; 7,5; 10,0 dan 12,5 µg/ml. Persentase aktivitas inhibisi radikal bebas DPPH dihitung dengan persamaan: [(B – S)/B x 100], dimana B adalah absorbansi blanko dan S adalah absorbansi sampel, kemudian nilai konsentrasi dan inhibisi sampel diplot masing-masing pada sumbu x dan y pada persamaan regresi linier. Persamaan garis yang diperoleh dalam bentuk y = b(x) + a digunakan untuk mencari nilai IC50. Nilai IC50 menunjukkan konsentrasi
sampel yang diperlukan untuk menghambat radikal bebas sebesar 50%.
a. Pembuatan larutan
Larutan bufer fosfat pH 7 (100 mM) dibuat dengan cara melarutkan 1,3609 g KH2PO4 dan 1,4150 g K2HPO4 dengan akuabides hingga 100 ml. Larutan enzim α-glukosidase dibuat dengan cara melarutkan 1 mg enzim α-glukosidase
dengan bufer fosfat pH 7 yang mengandung 200 mg BSA hingga 100 ml dan diencerkan sebanyak 25 kali sebelum digunakan. Larutan p-NPG 10 mM dibuat dengan cara melarutkan 0,1507 g p-NPG dengan bufer fosfat pH 7 hingga 50 ml. Larutan Na2CO3 200 mM dibuat dengan cara melarutkan 1,0599 g Na2CO3
dengan bufer fosfat pH 7 hingga 50 ml. Larutan induk sampel (100 mg/ml) dibuat dengan cara melarutkan 100 mg sampel dalam 1 ml DMSO. Larutan induk
Larutan induk ekstrak (metanol, etil asetat, n-heksan) keong matah merah diencerkan pada konsentrasi 25 mg/ml. Larutan ekstrak sebanyak 10 µl ditambahkan ke dalam tabung reaksi yang berisi 25 µl p-NPG (10 mM) dan 50 µl bufer fosfat pH 7. Reaksi dimulai dengan penambahan 25 µl larutan enzim dan 25 µl bufer fosfat dilanjutkan dengan inkubasi selama 30 menit pada 37ºC. Reaksi dihentikan dengan penambahan 100 µl Na2CO3 (200 mM). Serapan
larutan diukur menggunakan elisa reader pada panjang gelombang 410 nm. Sistem reaksi inhibisi α-glukosidase tersaji pada Tabel 1.
Tabel 1 Sistem reaksi inhibisi α-glukosidase
Larutan B1 (µl) B0 (µl) S1(µl) S0 (µl)
Inkubasi pada suhu 370C selama 30 menit
Na2CO3 100 100 100 100
Keterangan :
B1 = Absorbansi blanko B0 = Absorbansi kontrol blanko S1 = Absorbansi sampel S0 = Absorbansi kontrol sampel
Uji aktivitas antidiabetes dilakukan kembali dari ekstrak terbaik pada konsentrasi 10, 20, 30, 40 dan 50 mg/ml dan kontrol positif Glucobay pada konsentrasi 0,1; 0,5; 1; 5 dan 10 mg/ml. Persentase inhibisi α-glukosidase
absorbansi sampel dan S0 adalah absorbansi kontrol sampel. Persamaan garis yang diperoleh dalam bentuk y = b(x) + a digunakan untuk mencari nilai IC50.
Nilai IC50 menunjukkan konsentrasi sampel yang diperlukan untuk menghambat
aktivitas α-glukosidase sebesar 50%.
Uji Aktivitas Antiinflamasi (Ravi et al. 2012)
a. Pembuatan larutan
Larutan Na2HPO4.2H2O (0,15 M) dibuat dengan cara melarutkan 2,671 g
Na2HPO4.2H2O dengan akuades hingga 100 ml. Larutan NaH2PO4.H2O (0,15 M)
dibuat dengan cara melarutkan 2,070 g NaH2PO4.H2O dengan akuades hingga
100 ml. Larutan dapaf fosfat pH 7,4 (0,15 M) dibuat dengan cara mencampurkan 81 ml larutan Na2HPO4.2H2O (0,15 M) dengan 19 ml larutan NaH2PO4.H2O
(0,15 M), kemudian disterilisasi dengan autoklaf pada suhu 115οC selama 30 menit. Larutan isosalin dibuat dengan cara melarutkan 0,85 g NaCl dengan dapar fosfat pH 7,4 (0,15 M) hingga 100 ml, kemudian disterilisasi dengan autoklaf pada suhu 115οC selama 30 menit. Larutan hiposalin dibuat dengan cara melarutkan 0,25 g NaCl dengan dapar fosfat pH 7,4 (0,15 M) hingga 100 ml, kemudian disterilisasi dengan autoklaf pada suhu 115οC selama 30 menit. Larutan induk sampel (10 mg/ml) dibuat dengan cara melarutkan 100 mg sampel dalam 10 ml larutan isosalin dengan bantuan DMSO.
b. Pembuatan suspensi sel darah merah
Darah dari Palang Merah Indonesia (PMI) sebanyak 10 ml disentrifugasi pada 3000 rpm selama 10 menit. Supernatan yang terbentuk dipisahkan menggunakan pipet steril. Endapan sel-sel darah yang tersisa kemudian dicuci dengan larutan isosalin (0,85%, pH 7,2) dan disentrifugasi kembali. Proses tersebut diulang 4 kali sampai isosalin jernih. Volume sel darah merah diukur dan diresuspensi dengan isosalin sehingga didapatkan suspensi sel darah merah dengan konsentrasi 10% v/v.
c. Pengujian
IC50 menunjukkan konsentrasi sampel yang diperlukan untuk menstabilkan
membran sel darah merah sebesar 50%.
Uji aktivitas antibakteri (Rasyid 2012)
a. Pembuatan media
Media NA dibuat dengan cara melarutkan 1,4 g nutrient agar dalam 50 ml akuades dan dihomogenkan dengan memanaskan di atas hotplate. Masing-masing sebanyak 5 ml NA dimasukkan dalam tabung reaksi, ditutup dengan kapas dan disterilkan dengan autoklaf 121οC selama 15 menit. Tabung reaksi berisi NA kemudian dimiringkan sampai NA membeku.
Media NB dibuat dengan cara melarutkan 1,3 g nutrient broth dalam 100 ml akuades dan dihomogenkan dengan memanaskan di atas hotplate. Masing-masing sebanyak 9 ml NB dimasukkan dalam tabung reaksi ditutup dengan kapas dan disterilkan dengan autoklaf 121οC selama 15 menit.
Media MHA dibuat dengan cara melarutkan 7,6 g muller hinton agar dalam 200 ml akuades dan dihomogenkan dengan memanaskan di atas hotplate. Masing-masing sebanyak 20 ml MHA dimasukkan dalam tabung reaksi ditutup dengan kapas dan disterilkan dengan autoklaf 121οC selama 15 menit.
b. Penyegaran dan pembuatan suspensi bakteri
Penyegaran bakteri dilakukan dengan memindahkan 1 ose bakteri dari stok ke tabung reaksi berisi media NA. Inkubasi dilakukan pada suhu 37οC selama 24 jam. Pembuatan suspensi bakteri dilakukan dengan memindahkan 1 ose bakteri dari media NA ke dalam media NB yang telah dingin secara aseptik, kemudian diinkubasi pada suhu 37οC selama 24 jam. Biakan bakteri yang telah diinkubasi kemudian diukur optical density (OD) pada panjang gelombang 600 nm dengan nilai antara 0,5 – 0,8.
c. Pembuatan larutan
Larutan induk ekstrak (100 mg/ml) dibuat dengan cara melarutkan 100 mg sampel dalam 1 ml DMSO, kemudian diencerkan pada beberapa seri konsentrasi. Larutan induk kloramfenikol (10 mg/ml) dibuat dengan cara melarutkan 10 mg kloramfenikol dalam 1 ml DMSO, kemudian diencerkan pada konsentrasi 1 mg/ml.
d. Pengujian
Media MHA yang dibuat sebelumnya dipanaskan kemudian ditambahkan 20 µl bakteri dan di vortek kemudian dituang dalam cawan petri steril, goyangkan membentuk angka 8 dan diamkan selama 15 menit sampai membeku. Masing-masing paper disk yang telah ditetesi ekstrak sebanyak 20 µl diletakkan dalam cawan petri menggunakan pinset steril. Bakteri kemudian diinkubasi selama 24 jam pada suhu 370C. Diameter zona hambat yang terbentuk diukur dengan jangka sorong. MIC (Minimum Inhibitory Concentration) menunjukkan konsentrasi sampel minimum yang dapat menghambat pertumbuhan bakteri uji.
Rancangan percobaan yang digunakan dalam penelitian ini adalah Rancangan Acak Lengkap (RAL) dengan tiga kali ulangan. Data yang diperoleh dari hasil penelitian dilakukan uji normalitas dan homogenitas, kemudian dilakukan analisis sidik ragam dan jika berpengaruh nyata maka diuji lanjut menggunakan uji Duncan (Steel dan Torrie 1993).
Hipotesis
H0 : Perbedaan konsentrasi ekstrak tidak berpengaruh terhadap aktivitas
antioksidan, antidiabetes, antiinflamasi dan antibakteri keong matah merah. H1 : Perbedaan konsentrasi ekstrak berpengaruh terhadap aktivitas antioksidan,
antidiabetes, antiinflamasi dan antibakteri keong matah merah.
Model observasi Rancangan Acak Lengkap (RAL) adalah sebagai berikut :
Yij = μ + αi + ɛ ij
Keterangan :
Yij : Respon pengaruh perlakuan pada taraf i ulangan ke-j
μ : Pengaruh rata-rata umum
αi : Pengaruh perlakuan pada taraf ke-i
ɛ ij : Pengaruh acak (galat percobaan) pada konsentrasi taraf i ulangan ke-j j : 1,2, dan 3
3
HASIL DAN PEMBAHASAN
Karakteristik Keong Matah Merah
Identitas keong matah merah
Hasil identifikasi keong matah merah menunjukkan bahwa sampel yang digunakan pada penelitian ini merupakan spesies Cerithidea obtusa. Sertifikat identifikasi sampel tersaji pada Lampiran 1. Adapun klasifikasi Cerithidea obtusa
adalah Filum Moluska, Kelas Gastropoda, Ordo Mesogastropoda, Famili Potamididae, Genus Cerithidea dan Spesies Obtusa. Menurut Houbrick (1984), mesogastropoda dari keluarga Potamididae merupakan siput intertidal yang umum dan banyak dijumpai di habitat berlumpur dan muara. Sebagian besar terbatas pada daerah tropis dan subtropis, mereka merupakan fauna yang mencolok pada hutan bakau dan rawa-rawa payau dimana makanannya berupa detritus dan mikroalga. Famili Potamididae terdiri dari berbagai genus dengan bentuk cangkang yang beragam. Famili Potamididae dibagi menjadi dua sub famili yaitu Potamidinae dan Batillariinae yang secara sederhana dibedakan oleh struktur radularnya. Genus Cerithidea adalah kelompok terbesar pada sub famili Potamidinae.
Keong matah merah merupakan salah satu spesies dari genus Cerithidea
cangkang, spire, whorl dan aperture. Keong matah merah memiliki cangkang berbentuk piramidial memanjang dengan warna coklat kemerahan dan putih dengan pola berulir, body whorl tidak tampak jelas sedangkan unit whorl dan
spire yang jelas, aperture berbentuk bulat tanpa saluran siphon yang membentuk celah pada sudut aperture, apex yang tererosi sehingga membentuk ujung cangkang yang tumpul. Struktur apex inilah yang menjadi ciri khas spesies
cerithidea obtusa untuk dibedakan dengan jenis cerithidea yang lain, sehingga penamaan obtusa digunakan (obtusus = tumpul). Keong matah merah yang digunakan pada penelitian ini tersaji pada Gambar 2.
Gambar 2 Keong matah merah (Karyanto et al., 2004)
Keong matah merah adalah spesies umum pada ekosistem mangrove di kawasan Asia-Pasifik. Ekosistem mangrove merupakan lingkungan yang
ekstrim karena dipengaruhi oleh pasang surut air laut, suhu dan salinitas yang berubah-ubah. Kondisi tersebut menyebabkan keong matah merah memiliki kemampuan beradaptasi untuk tetap dapat bertahan hidup. Menurut Ernanto et al.
(2010), adaptasi gastropoda mencakup daya tahan terhadap kehilangan air dan pemeliharaan keseimbangan panas tubuh. Gastropoda masuk ke dalam cangkang ketika pasang turun, kemudian menutup celah menggunakan operkulum sehingga kehilangan air dapat dikurangi. Gastropoda juga memiliki toleransi terhadap suhu panas dan dingin yang ekstrim dan memperlihatkan adaptasi tingkah laku dan struktur tubuh untuk menjaga keseimbangan panas internal. Hewan tersebut hanya aktif jika pasang naik dan tubuhnya terendam air.
Beberapa gastropoda secara komersial dimanfaatkan untuk makanan. Spesies tertentu dari genus Cerithidea dijual secara umum sebagai seafood di Vietnam dan negara-negara Asia lainnya (Thao 2008). Keong matah merah
disebut juga “Siput Belitung (Malaysia)”, “Red Chut Chut Snail (Singapura)”, Oc
Len (Vietnam) dan “Jup Jaeng (Thailand)” merupakan genus Cerithidae yang umum dijumpai sebagai makanan di Asia Tenggara. Keong ini dimasak dengan cara direbus dan dimakan dengan menggigit dan menghisap pada ujung cangkangnya, sementara itu bentuk dan warna cangkang yang indah telah banyak dimanfaatkan sebagai ornamen dan kerajinan.
Keong matah merah telah lama digunakan oleh bangsa cina untuk pengobatan penyakit kanker, namun di Indonesia pemanfaatannya masih terbatas pada konsumsi. Studi kasus pada penderita kanker yang menggunakan obat dengan bahan baku keong matah merah oleh Purwaningsih (2006), menunjukkan bahwa sebagian penderita mengalami perubahan ke arah sembuh. Penelitian
Body whorl
apex
tentang aktivitas antikanker secara in vitro dan in vivo juga telah dilakukan oleh Purwaningsih (2008) dan Purwaningsih et al. (2008) yang menunjukkan bahwa keong matah merah dapat menghambat pertumbuhan kanker payudara pada mencit C3H dan menghambat pertumbuhan sel lestari kanker serviks, paru dan
leukimia.
Morfometrik keong matah merah
Pengamatan morfometrik menggunakan sampel 30 ekor keong matah merah yang diambil secara acak untuk diukur panjang cangkang, lebar cangkang, lebar kolumela dan berat. Adapun cara dan hasil pengamatan morfometrik tersaji pada Gambar 3, Tabel 2 dan Lampiran 2.
Gambar 3 Pengamatan morfometrik keong matah merah Tabel 2 Morfometrik keong matah merah
No. Parameter Satuan Nilai*
1. Panjang cangkang mm 40,5±1,0
2. Lebar cangkang mm 19,9±0,8
3. Lebar kolumela mm 16,9±0,7
4. Berat g 5,2±0,6
Keterangan : *Hasil rata-rata 30 sampel ± standar deviasi
Hasil pengamatan morfometrik yang telah dilakukan (Tabel 2), diketahui terdapat variasi panjang cangkang, lebar cangkang, lebar kolumela dan berat keong matah merah. Hasil tersebut tidak jauh berbeda dengan hasil penelitian Insanabella (2012), yang menyatakan bahwa keong matah merah memiliki panjang cangkang rata-rata 38,0 mm, lebar cangkang rata-rata 16,6 mm, lebar kolumela rata-rata 14,9 mm, dan berat rata-rata 4,2 gram. Variasi ukuran keong matah merah dapat disebabkan adanya perbedaan pertumbuhan antara masing-masing dari keong.
Proporsi keong matah merah
Persentase proporsi keong matah merah diperoleh dengan membandingkan antara bagian daging, jeroan dan cangkang dengan berat total keong. Persentase hasil pengukuran proporsi tersaji pada Gambar 4.
41 mm 20 mm
17 mm
Gambar 4 Proporsi keong matah merah
Hasil pengukuran proporsi (Gambar 4), diketahui persentase terbesar adalah cangkang kemudian diikuti oleh daging dan jeroan. Hasil tersebut tidak jauh berbeda dengan penelitian Insanabella (2012), yang menyebutkan bahwa nilai proporsi daging keong matah merah sebesar 19,7%, jeroan sebesar 18,9% dan cangkang sebesar 61,4%. Kondisi yang sama juga dilaporkan Apriandi (2011), yang menyebutkan bahwa persentase terbesar dari gastropoda Fasciolaria salmo adalah cangkang sebesar 69,7% diikuti daging sebesar 22,1% dan jeroan sebesar 18,2%. Hal tersebut menunjukkan bahwa bagian cangkang memiliki presentase terbesar dari keseluruhan berat total keong.
Komposisi kimia daging keong matah merah
Setiap bahan pangan mempunyai komposisi kimia yang berbeda-beda. Komposisi kimia suatu bahan pangan dapat diketahui dengan analisis proksimat. Analisis proksimat meliputi kadar air, protein, lemak, abu dan karbohidrat tersaji pada Tabel 3 dan Lampiran 3.
Tabel 3 Komposisi kimia daging keong matah merah
No. Kandungan Nilai (%)
1. Kadar air 82,8±0,1
2. Protein 11,9±0,1
3. Lemak 0,3±0,1
4. Abu 2,0±0,2
5. Karbohidrat* 3,1±0,2
Keterangan : n = 3; *By difference
Kandungan air dari suatu bahan pangan perlu diketahui untuk menentukan persentase zat-zat gizi secara keseluruhan. Hasil analisis proksimat (Tabel 3), menunjukkan bahwa keong matah merah memiliki kandungan kadar air yang cukup tinggi. Hal tersebut sejalan dengan penelitian Insanabella (2012), yang menyebutkan bahwa kadar air keong matah merah sebesar 80,6% sedangkan menurut Purwaningsih (2012), kadar air keong matah merah sebesar 77,3%.
Kadar protein keong matah merah mempunyai persentase terbesar setelah kadar air (Tabel 3) dengan persentase nilai yang tidak jauh berbeda dengan penelitian Insanabella (2012) yaitu sebesar 14,3% dan penelitian Purwaningsih (2012) yaitu sebesar 13,8%. Kadar protein pada gastropoda jenis lain juga telah
dilaporkan. Anand et al. (2010), melaporkan bahwa kadar protein
18,1%
15,2% 66,7%
cangkang
pleuroploca trapezium sebesar 10,4% sedangkan Gifari (2011), melaporkan bahwa kadar protein Babylonia spirata sebesar 17,4%.
Kadar lemak keong matah merah tergolong rendah (Tabel 3). Sejalan dengan penelitian Insanabella (2012), yang melaporkan bahwa kadar lemak keong matah merah sebesar 0,2% sedangkan menurut Purwaningsih (2012), kadar lemak keong matah merah sebesar 2,8%. Kadar lemak pada gastropoda jenis lain juga telah dilaporkan. Anand et al. (2010), melaporkan bahwa kadar lemak
pleuroploca trapezium sebesar 1,7%. sedangkan Gifari (2011), melaporkan bahwa kadar lemak Babylonia spirata sebesar 0,3%.
Persentase kadar abu keong matah merah (Tabel 3) tidak jauh berbeda dengan penelitian Insanabella (2012), yaitu sebesar 1,7% sedangkan menurut penelitian Purwaningsih (2012), kadar abu keong matah merah sebesar 4,5%. Kadar abu pada gastropoda jenis lain juga telah dilaporkan. Apriandi (2011), melaporkan bahwa kadar abu Fasciolaria salmo sebesar 2,8% sedangkan Gifari (2011), melaporkan bahwa kadar abu Babylonia spirata sebesar 1,2%.
Persentase kadar karbohidrat keong matah merah (Tabel 3) tidak jauh berbeda dengan penelitian Insanabella (2012), yaitu sebesar 3,2% sedangkan menurut Purwaningsih (2012), kadar karbohidrat keong matah merah sebesar 1,6%. Kadar karbohidrat pada gastropoda jenis lain juga telah dilaporkan. Anand
et al. (2010), melaporkan bahwa kadar karbohidrat pleuroploca trapezium sebesar 4,3% sedangkan Apriandi (2011), melaporkan bahwa kadar karbohidrat
Fasciolaria salmo sebesar 5,2%.
Menurut Periyasamy et al. (2011), adanya perbedaan kandungan kadar air, protein, lemak, abu dan karbohidrat diduga disebabkan oleh kondisi lingkungan hidup keong yang berbeda terutama kandungan bahan organik sebagai makanan utama keong. Faktor yang mempengaruhi variabilitas dalam komponen kimia dari daging gastropoda yaitu jenis, ukuran, tingkat kematangan seksual, suhu, jenis makanan, musim dan lokasi pengambilan sampel.
Karakteristik Ekstrak Keong Matah Merah
Rendemen ekstrak keong matah merah
Ekstraksi dilakukan dengan cara terlebih dahulu mencuci keong matah merah sampai bersih kemudian cangkang dipecah menggunakan martil agar daging keong dapat diambil. Daging yang diperoleh kemudian dicacah menggunakan pisau tajam. Pencacahan ini bertujuan untuk memperluas kontak antara padatan dan pelarut pada proses ekstraksi sehingga pelarut dapat lebih baik dalam menarik zat aktif dalam bahan. Semakin luas permukaan padatan maka perpindahan massa ekstraksi akan berlangsung lebih cepat.
Gambar 5 Ekstrak keong matah merah
Proses penarikan bahan atau ekstraksi terjadi dengan mengalirnya pelarut ke dalam sel bahan yang menyebabkan protoplasma membengkak dan kandungan sel dalam bahan akan terlarut sesuai dengan kelarutannya. Hasil perhitungan rendemen ekstrak daging keong matah merah tersaji pada Tabel 4.
Tabel 4 Rendemen ekstrak keong matah merah Nama Berat Bahan Awal
(g)
Berat Ekstrak (g)
Rendemen (%)
Ekstrak metanol 75 3,5 4,7
Ekstrak etil asetat 75 0,4 0,5
Ekstrak n-heksan 75 0,2 0,2
Hasil pengukuran rendemen (Tabel 4), menunjukkan bahwa rendemen tertinggi dihasilkan oleh ekstrak metanol diikuti oleh ekstrak etil asetat dan ekstrak heksan. Prabowo (2009) melaporkan kondisi yang sama, yaitu rendemen tertinggi ekstrak keong matah merah adalah metanol sebesar 2,0% diikuti etil asetat sebesar 0,9% dan ekstrak n-heksan 0,2%. Hal ini menunjukkan bahwa keong matah merah mengandung lebih banyak senyawa polar.
Metanol merupakan pelarut dengan berat molekul yang rendah sehingga memudahkan pembentukan ikatan hidrogen pada jaringan sampel. Metanol banyak digunakan dalam proses isolasi senyawa organik bahan karena dapat melarutkan seluruh golongan metabolit sekunder (Hart et al. 2003).
Deskripsi ekstrak keong matah merah
Deskripsi ekstrak merupakan salah satu parameter spesifik yang ditentukan dengan menggunakan panca indera dan bertujuan untuk pengenalan awal ekstrak secara sederhana dan subjektif meliputi bentuk, warna dan bau (BPOM 2000). Hasil uji deskripsi ekstrak tersaji pada Tabel 5.
Tabel 5 Deskripsi ekstrak keong matah merah
Nama Bentuk Warna Bau
Ekstrak metanol Pasta Hijau pudar Amis
Ekstrak etil asetat Pasta Hijau gelap Amis
Hasil uji deskripsi ekstrak (Tabel 5), menunjukkan bahwa ekstrak yang diperoleh semua berbentuk pasta dan berbau khas sebagaimana karakter khas pada produk perikanan (amis), sedangkan warna ekstrak bervariasi yaitu hijau pudar pada ekstrak metanol, hijau gelap pada ekstrak etil asetat dan kuning kecoklatan pada ekstrak n-heksan. Perbedaan warna ekstrak diduga disebabkan oleh perbedaan zat warna dari senyawa yang tertarik oleh masing-masing pelarut yang digunakan. Warna hijau pada ekstrak metanol dan ekstrak etil asetat diduga karena adanya senyawa yang membentuk zat warna hijau, seperti klorofil. Warna kuning kecoklatan pada ekstrak heksan diduga terbentuk karena pelarut n-heksan menarik senyawa non polar atau senyawa hidrofobik seperti minyak atau essensial oil yang pada umumnya berwarna kuning kecoklatan. Menurut Manurung et al. (2004), molekul zat warna merupakan gabungan dari zat organik tidak jenuh dengan kromofor sebagai pembawa warna. Zat organik tidak jenuh yang dijumpai dalam pembentukan zat warna adalah senyawa aromatik antara lain senyawa hidrokarbon aromatik dan turunannya, fenol dan turunannya serta senyawa-senyawa hidrokarbon yang mengandung nitrogen.
Toksisitas ekstrak keong matah merah
Toksisitas ekstrak keong matah merah dapat diketahui dengan melakukan uji Brine Shrimp Lethality Test (BSLT). Metode BSLT didasarkan pada bahan senyawa aktif yang bersifat toksik dan mampu membunuh larva A. salina. Metode ini dipilih karena mudah dikerjakan, murah, cepat dan cukup akurat. Nilai LC50 (Letal Concentration) merupakan jumlah dosis atau konsentrasi
ekstrak uji yang dapat menyebabkan kematian larva udang sebesar 50% setelah masa inkubasi 24 jam. Hasil uji toksisitas ekstrak keong matah merahtersaji pada Gambar 6, 7, 8 dan Lampiran 4.
Gambar 6 Hubungan antara konsentrasi ekstrak metanol keong matah merah dengan persentase mortalitas larva A. salina
Hasil uji toksisitas (Gambar 6), kurva membentuk persamaan regresi y = 0,0732x – 2,3715 menghasilkan nilai LC50 sebesar 715,4 µg/ml. Hal tersebut
menunjukkan bahwa konsentrasi ekstrak metanol sebesar 715,4 µg/ml akan menyebabkan kematian larva A. salina sebesar 50%. Contoh perhitungan nilai
0 200 400 600 800 1000 1200
LC50 tersaji pada Lampiran 5. Nilai LC50 sebesar 715,4 µg/ml menunjukkan
bahwa ekstrak metanol keong matah merah dalam kategori toksik. Menurut Meyer et al. (1982), suatu ekstrak bersifat toksik jika ekstrak dapat menyebabkan kematian 50% hewan uji pada konsentrasi < 1000 µg/ml.
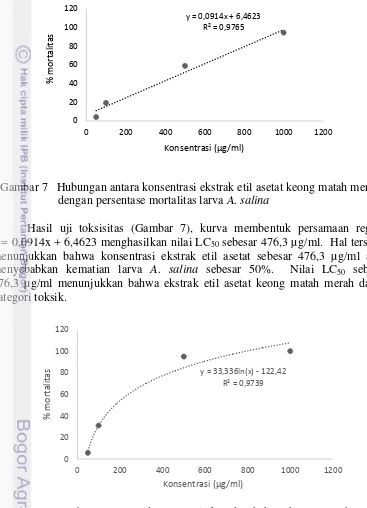
Gambar 7 Hubungan antara konsentrasi ekstrak etil asetat keong matah merah dengan persentase mortalitas larva A. salina
Hasil uji toksisitas (Gambar 7), kurva membentuk persamaan regresi y = 0,0914x + 6,4623 menghasilkan nilai LC50 sebesar 476,3 µg/ml. Hal tersebut
menunjukkan bahwa konsentrasi ekstrak etil asetat sebesar 476,3 µg/ml akan
menyebabkan kematian larva A. salina sebesar 50%. Nilai LC50 sebesar
476,3 µg/ml menunjukkan bahwa ekstrak etil asetat keong matah merah dalam kategori toksik.
Gambar 8 Hubungan antara konsentrasi ekstrak n-heksan keong matah merah dengan persentase mortalitas larva A. salina
Hasil uji toksisitas (Gambar 8), kurva membentuk persamaan regresi y = 33,336 ln(x) – 122,42 menghasilkan nilai LC50 sebesar 176,3 µg/ml. Hal
tersebut menunjukkan bahwa konsentrasi ekstrak n-heksan sebesar 176,3 µg/ml
y = 0,0914x + 6,4623
0 200 400 600 800 1000 1200
%
0 200 400 600 800 1000 1200
akan menyebabkan kematian larva A. salina sebesar 50%. Nilai LC50 sebesar
176,3 µg/ml menunjukkan bahwa ekstrak n-heksan keong matah merah dalam kategori toksik.
Larva A. salina merupakan pemakan bahan-bahan organik sehingga komponen-komponen dari ekstrak akan terus menerus terakumulasi dalam tubuh sehingga menyebabkan kematian larva A. salina. Menurut Cahyadi (2009), cara kerja senyawa dalam ekstrak adalah dengan bertindak sebagai stomach poisoning. Senyawa-senyawa ini masuk ke dalam tubuh larva sehingga alat pencernaannya akan terganggu. Senyawa ini juga menghambat reseptor perasa pada daerah mulut larva. Hal ini mengakibatkan larva gagal mendapatkan stimulus rasa sehingga tidak mampu mengenali makanannya dan akhirnya mengalami kematian.
Menurut Meyer et al. (1982), BSLT merupakan salah satu metode uji toksisitas yang banyak digunakan untuk pencarian senyawa antikanker baru. Metode BSLT telah terbukti memiliki korelasi dengan aktivitas antikanker dengan LC50 < 1000 µg/ml. Hal ini didukung pada penelitian Purwaningsih (2008) dan
Purwaningsih et al. (2008) yang menyatakan bahwa ekstrak keong matah merah dapat menghambat pertumbuhan sel kanker secara in vivo dan in vitro.
Komponen aktif ekstrak keong matah merah
Uji komponen aktif merupakan tahap pendahuluan dalam suatu penelitian yang bertujuan untuk memberikan gambaran mengenai golongan komponen aktif yang terkandung dalam bahan yang sedang diteliti secara kualitatif dengan melihat reaksi pengujian warna dengan menggunakan suatu pereaksi warna. Hasil uji komponen aktif ekstrak keong matah merahtersaji pada Tabel 6.
Tabel 6 Komponen aktif ekstrak keong matah merah
mencegah keracunan serta infeksi. Investigasi secara ekologi kimia mengungkapkan bahwa senyawa tersebut tidak hanya memainkan peran dalam metabolisme produsen tetapi juga dalam strategi mereka beradaptasi dalam lingkungan tertentu.
Beberapa senyawa aktif, khususnya struktur dan aktivitas biologisnya telah berhasil diisolasi dari hewan-hewan laut. Senyawa aktif tersebut mempunyai potensi sebagai obat. Senyawa bioaktif yang menarik diteliti umumnya diisolasi dari spons laut, ubur-ubur, terumbu karang, moluska, echinodermata, dan krustasea. Senyawa bioaktif yang telah diisolasi dari hewan laut yaitu steroid, terpenoid, isoprenoid, nonisoprenoid, quinon dan nitrogen heterosiklik (Bhakuni dan Rawat 2005)
Beberapa penelitian tentang aktivitas farmakologi komponen aktif telah dilaporkan. Divakaran et al. (2013), melaporkan bahwa flavonoid memiliki aktivitas penghambatan radikal bebas dan radioproteksi terhadap DNA secara in vitro dan ex vivo. Matsuda et al. (2002), melaporkan bahwa flavonoid juga memiliki aktivitas penghambatan agregasi platelet dan aldosa reduktase, yang dapat membantu mengurangi keparahan sindrom diabetes. Liu et al. (2014), menambahkan bahwa flavonoid dan triterpenoid memiliki aktivitas antioksidan dan bertanggung jawab terhadap efek klinis yang baik pada diabetes tipe II melalui pencegahan stres oksidatif dan hiperglikemia postprandial. Menurut Rumondang et al. (2013), triterpenoid memiliki aktivitas antibakteri dengan menghambat pertumbuhan bakteri E. coli dan S. aureus. Menurut Punitha et al.
(2006), alkaloid dapat menurunkan aktivitas transaminase dan produksi kreatinin pada mencit diabetes. Menurut Bnouham et al. (2006), saponin dilaporkan dapat menurunkan kadar gula darah pasca makan pada mencit diabetes.
Aktivitas Komponen Bioaktif Keong Matah Merah
Aktivitas antioksidan
Aktivitas antioksidan dapat diukur secara in vitro menggunakan metode DPPH. Metode ini dipilih karena memiliki banyak kelebihan diantaranya sederhana, mudah dikerjakan dan cepat. Peredaman warna ungu pada panjang gelombang maksimumnya (517±20 nm) dikaitkan dengan kemampuan sebagai
anti radikal bebas (free radical scavanger). Menurut Molyneux (2004), DPPH merupakan senyawa radikal bebas yang bersifat stabil karena hanya memiliki satu
Gambar 9 Aktivitas antioksidan ekstrak keong matah merah pada konsentrasi 50 µg/ml. Ekstrak metanol; Ekstrak etil asetat; Ekstrak n-heksan
Hasil uji aktivitas antioksidan (Gambar 9), menunjukkan bahwa pada konsentrasi 50 µg/ml, ekstrak etil asetat keong matah merah memiliki persentase inhibisi tertinggi disusul oleh ekstrak metanol dan ekstrak n-heksan. Hal ini sejalan dengan penelitian Merdekawati (2013), yang menyebutkan bahwa ekstrak kasar Turbo setosus mempunyai nilai aktivitas antioksidan tertinggi pada pelarut etil asetat, disusul oleh metanol dan n-heksan dengan nilai IC50
berturut-turut sebesar 1578,4 µg/ml, 2088,2 µg/ml dan 2542,6 µg/ml. Berdasarkan hasil tersebut maka ekstrak etil asetat merupakan ekstrak terbaik dan digunakan pada tahap selanjutnya. Ekstrak etil asetat keong matah merah diukur aktivitas antioksidannya dengan metode yang sama pada konsentrasi 200, 400, 600, 800 dan 1000 µg/ml. Hasil uji aktivitas antioksidan ekstrak etil asetat keong matah merah tersaji pada Gambar 10 dan Lampiran 7.
Gambar 10 Aktivitas antioksidan ekstrak etil asetat keong matah merah. Huruf superscript berbeda yang mengikuti angka menandakan perbedaan
nyata (α<0,05)
Hasil uji normalitas dengan Kolmogorov-Smirnov menunjukkan bahwa persentase inhibisi ekstrak etil asetat keong matah merah bersifat menyebar normal (Lampiran 8), sedangkan hasil uji homogenitas dengan Levene
menunjukkan bahwa persentase inhibisi ekstrak etil asetat keong matah merah bersifat homogen (Lampiran 9). Hasil sidik ragam (Lampiran 10), menunjukkan bahwa perbedaan konsentrasi ekstrak etil asetat keong matah merah
memberikan pengaruh yang nyata (α=0,05) terhadap aktivitas antioksidan. Hasil
uji lanjut Duncan terhadap aktivitas antioksidan ekstrak etil asetat keong matah merah (Lampiran 11) menunjukkan adanya perbedaan yang nyata antar konsentrasi ekstrak (200, 400, 600, 800, 1000 µg/ml). Hubungan antara konsentrasi sampel dengan persentase inhibisi radikal bebas DPPH tersaji pada Gambar 11 dan 12.
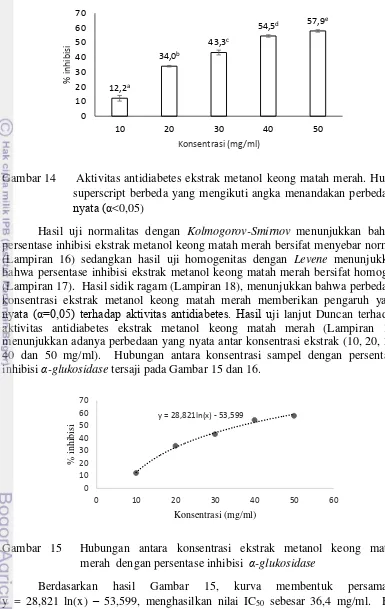
Gambar 11 Hubungan antara konsentrasi ekstrak etil asetat keong matah merah dengan persentase inhibisi radikal bebas DPPH
Berdasarkan Gambar 11, kurva membentuk persamaan regresi y = 25,267 ln(x) – 113,48, menghasilkan nilai IC50 sebesar 645,6 µg/ml. Nilai
tersebut dikatagorikan sebagai nilai antioksidan dengan aktivitas rendah yaitu >200 µg/ml. Contoh perhitungan nilai IC50 tersaji pada Lampiran 12. Menurut
Molyneux (2004), nilai IC50 merupakan salah satu parameter untuk
menginterpretasikan hasil dari pengujian DPPH. Nilai IC50 didefinisikan sebagai
konsentrasi substrat yang dapat menyebabkan berkurangnya 50% aktivitas DPPH. Semakin kecil nilai IC50 berarti aktivitas antioksidannya semakin tinggi. Menurut
Velayutham et al. (2014), antioksidan digambarkan sebagai substansi yang ketika hadir dalam konsentrasi rendah relatif secara signifikan menghambat oksidasi substrat. Antioksidan akan bereaksi dengan ROS untuk menghentikan proses oksidasi. Satu molekul antioksidan hanya dapat bereaksi dengan satu radikal bebas, oleh karena itu ada kebutuhan konstan untuk mengisi sumber antioksidan endogen atau melalui suplementasi.
0 200 400 600 800 1000 1200
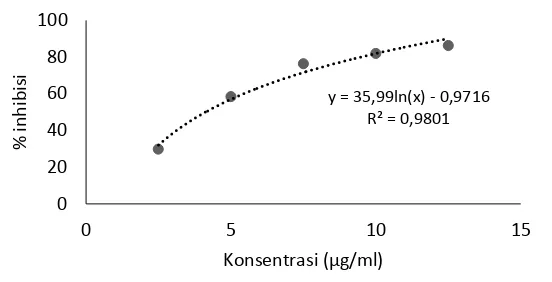
Gambar 12 Hubungan antara konsentrasi vitamin C dengan persentase inhibisi radikal bebas DPPH
Aktivitas antioksidan ekstrak etil asetat keong matah merah berbeda jauh dengan aktivitas antioksidan kontrol positif vitamin C (Gambar 12 dan Lampiran 13), dimana kurva membentuk persamaan regresi y = 35,99 ln(x) – 0,9716, menghasilkan nilai IC50 sebesar 4,1 µg/ml. Sejalan dengan penelitian
Purwaningsih (2012) yang menyebutkan bahwa nilai IC50 vitamin C sebesar 3,6
µg/ml. Hal tersebut menunjukkan bahwa Vitamin C memiliki aktivitas antioksidan sangat kuat karena <50 µg/ml. Vitamin C merupakan vitamin larut air yang sering dikonsumsi masyarakat sebagai antioksidan. Menurut Naidu (2003), vitamin C diperlukan manusia untuk pembentukan kolagen, kartinin, dan neurotransmitter. Hewan dan tumbuhan dapat mensintesis vitamin C dalam tubuhnya sendiri tetapi vitamin ini tidak dapat disintesis oleh manusia karena tidak memiliki enzim gulonolakton oksidase.
Beberapa penelitian tentang aktivitas antioksidan gastropoda laut telah dilaporkan. Merdekawati (2013), melaporkan bahwa nilai IC50 ekstrak etil asetat
Turbo setosus sebesar 1578,4 µg/ml sedangkan nilai IC50 ekstrak etil asetat
Melo sp. pada penelitian Tias (2010) sebesar 2760,0 µg/ml. Penelitian Apriandi (2011), menyebutkan bahwa nilai IC50 ekstrak etil asetat Fasciolaria salmo
sebesar 6825,0 µg/ml. Menurut Molyneux (2004), suatu senyawa dikatakan antioksidan sangat kuat apabila nilai IC50 kurang dari 50 µg/ml, kuat apabila nilai
IC50 antara 50-100 µg/ml, sedang apabila nilai IC50 berkisar antara 100-150 µg/ml
dan lemah apabila nilai IC50 berkisar antara 150-200 µg/ml.
Aktivita antidiabetes
Aktivitas antidiabetes dapat diukur secara in vitro menggunakan metode
penghambatan kerja enzim α-glukosidase. Enzim α-glukosidase (α-D-glukoside Glukohidrolase, EC 3.2.1.20) merupakan enzim yang mengkatalisasi pemecahan ikatan 1,4 α-glikosida pada ujung non pereduksi dari maltooligosakarida dengan melepas β-D-glukosa. Enzim ini juga dapat menghidrolisis secara lambat ikatan
1,6-α-D-glukosidik sehingga dapat melanjutkan kerja α-amilase, yaitu menghidrolisis lanjut α-limit dekstrin menjadi glukosa (Berdanier et al. 2006).
Penghambatan kerja enzim α-glukosidase dilakukan berdasarkan pada pemecahan substrat untuk menghasilkan produk berwarna, yang diukur absorbansinya selama periode waktu tertentu. Menurut Sugiwati et al. (2009), substrat p-NPG, setelah terhidrolisis akan menjadi α- D-glukosa dan p-nitrofenol
yang berwarna kuning. Warna kuning yang dihasilkan menjadi indikator kemampuan inhibitor untuk menghambat reaksi yang terjadi. Semakin besar kemampuan inhibitor menghambat kerja α-glukosidase, maka warna kuning larutan yang dihasilkan akan lebih pudar dibandingkan larutan tanpa inhibitor. Hasil uji aktivitas antidiabetes ekstrak keong matah merahtersaji pada Gambar 13 dan Lampiran 14.
Gambar 13 Aktivitas antidiabetes ekstrak keong matah merah pada konsentrasi 25 mg/ml. Ekstrak metanol; Ekstrak etil asetat; Ekstrak n-heksan
Hasil uji antidiabetes (Gambar 13), menunjukkan bahwa semua sampel memiliki kemampuan inhibisi α-glukosidase yang berbeda-beda pada konsentrasi 25 mg/ml. Ekstrak metanol keong matah merah memiliki persentase inhibisi tertinggi sedangkan ekstrak n-heksan dan etil asetat keong matah merah memiliki persentase inhibisi α-glukosidase sangat rendah. Hal ini sejalan dengan penelitian Sadhasivam et al. (2013) yang menyebutkan bahwa ekstrak metanol gastropoda
Aplysia sp. memiliki aktivitas inhibisi α-amilase sebesar 93,0%, B. leachii sebesar 70,6% dan K. ornata sebesar 49,0% sedangkan pada ekstrak aseton aktivitas inhibisi α-amilase menunjukkan persentase di bawah 10%. Hal ini menunjukkan bahwa aktivitas antidiabetes pada keong matah merah aktif pada senyawa polar. Berdasarkan hasil tersebut maka ekstrak metanol merupakan ekstrak terbaik dan digunakan pada tahap selanjutnya. Hasil uji aktivitas antidiabetes ekstrak metanol keong matah merah tersaji pada Gambar 14 dan Lampiran 15.