1
AKTIVITAS ANTIOKSIDAN DAN KOMPONEN BIOAKTIF DARI KEONG PEPAYA (Melo sp.)
Oleh :
FAUZIAH NARYUNING TIAS C34060032
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR 2010
2
RINGKASAN
FAUZIAH NARYUNING TIAS. C34060032. AKTIVITAS ANTIOKSIDAN DAN KOMPONEN BIOAKTIF DARI KEONG PEPAYA (Melo sp.). Dibimbing oleh RUDDY SUWANDY dan NURJANAH.
Radikal bebas merupakan suatu molekul yang sangat reaktif karena mempunyai satu atau lebih elektron yang tidak berpasangan. Radikal bebas sangat reaktif karena kehilangan satu atau lebih elektron yang bermuatan listrik, dan untuk mengembalikan keseimbangannya maka radikal bebas berusaha mendapatkan elektron dari molekul lain atau melepas elektron yang tidak berpasangan tersebut. Reaktivitas radikal bebas dapat dihambat oleh sistem antioksidan yang melengkapi sistem kekebalan tubuh. Antioksidan akan menyerahkan satu atau lebih elektronnya kepada radikal bebas sehingga dapat menghentikan kerusakan yang disebabkan oleh radikal bebas. Antioksidan sintetik yang berlebih dapat mengakibatkan keracunan. Antioksidan alami dinilai lebih aman oleh karena itu antioksidan alami harus dikembangkan. Salah satu komoditas hasil perairan yang diharapkan memiliki antioksidan alami adalah keong pepaya (Melo sp.).
Tujuan dari penelitian ini adalah menentukan karakteristik, rendemen ekstrak kasar, aktivitas antioksidan, dan komponen bioaktif dari keong pepaya dengan berbagai jenis pelarut.
Analisis proksimat dilakukan dengan mengacu pada AOAC (2005). Proses ekstraksi menggunakan ekstraksi bertingkat (Quinn 1988 diacu dalam Darusman et al. 1995). Uji aktivitas antioksidan menggunakan metode DPPH (Blois 1958
diacu dalam Hanani et al. 2005). Uji fitokimia dilakukan menurut Harborne
(1987).
Rendemen keong pepaya segar dibagi antara daging, jeroan serta cangkangnya yang memiliki nilai sebesar 55,18%; 11,06%; dan 30,58%. Daging dan jeroan keong pepaya diuji secara terpisah. Daging keong pepaya memiliki kadar air 28,54%, abu 7,40%, abu tidak larut asam 0,18%, lemak 1,08%, protein 61,58% dan karbohidrat 1,40%. Jeroan keong pepaya memiliki kadar air 24,85%, abu 9,20%, abu tidak larut asam 0,17%, lemak 9,71%, protein 52,84% dan karbohidrat 3,40%.
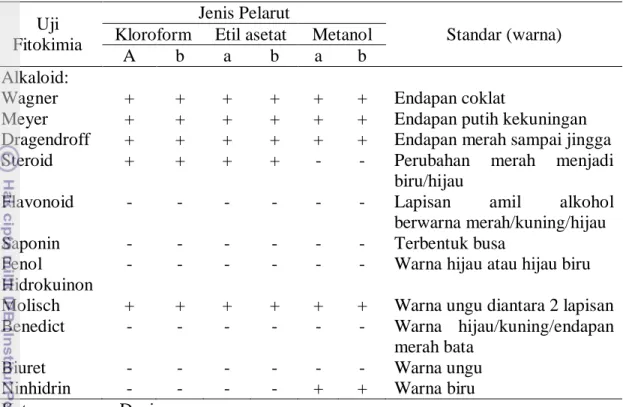
Hasil rendemen terbesar yaitu ekstraksi dengan menggunakan pelarut metanol (polar) sedangkan rendemen terkecil yaitu menggunakan pelarut etil asetat (semi polar). Hasil aktivitas antioksidan tertinggi terdapat pada jeroan
ekstrak kasar metanol dengan IC50 yaitu 1156 ppm, sedangkan aktivitas terendah
yaitu jeroan yang berasal dari ekstrak kasar kloroform dengan IC50 yaitu 2799
ppm. Keong pepaya memiliki aktivitas antiokisidan yang sangat rendah.
Keong pepaya mengandung komponen alkaloid, karbohidrat. Komponen bioaktif berupa steroid hanya terdapat pada ekstrak kloroform dan ekstrak etil asetat. Komponen bioaktif berupa asam amino hanya terdapat pada daging dan jeroan ekstrak kasar metanol.
3
AKTIVITAS ANTIOKSIDAN DAN KOMPONEN BIOAKTIF DARI KEONG PEPAYA (Melo sp.)
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada Fakultas Perikanan dan Ilmu Kelautan
Institut Pertanian Bogor
Oleh :
FAUZIAH NARYUNING TIAS C34060032
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR 2010
4 SKRIPSI
Judul Skripsi : Aktivitas Antioksidan dan Komponen Bioaktif dari
Keong Pepaya (Melo sp.)
Nama : FauziahNaryuningTias
Nrp : C34060032
Departemen : Teknologi Hasil Perairan
Menyetujui,
Pembimbing I Pembimbing II
Dr. Ir. Ruddy Suwandi, MS, MPhil Ir. Nurjanah, MS
NIP. 195805111985031002 NIP. 195910131986012002
Mengetahui,
Ketua Departemen Teknologi Hasil Perairan
Dr. Ir. Ruddy Suwandi, MS, MPhil NIP. 195805111985031002
5
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi dengan judul Aktivitas
Antioksidan dan Komponen Bioaktif dari Keong Pepaya (Melo sp.) adalah karya sendiri dan belum diajukan dalam bentuk apapun kepada Perguruan Tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang telah diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Agustus 2010
Fauziah Naryuning Tias C34060032
6
KATA PENGANTAR
Ucapan syukur penulis panjatkan ke hadirat Tuhan Yang Maha Esa, atas karunia-Nya yang berlimpah, yang membuat penulis sanggup menyelesaikan
skripsi yang berjudul Aktivitas Antioksidan dan Komponen Bioaktif dari
Keong Pepaya (Melo sp.). Penulis mengucapkan terima kasih kepada semua pihak yang telah membantu dalam penulisan ini, terutama kepada:
1. Bapak Dr. Ir. Ruddy Suwandi, MS, M.Phil dan Ibu Ir. Nurjanah MS selaku
dosen pembimbing yang telah memberikan pengarahan dan pencerahan dalam penyusunan skripsi ini.
2. Ibu Asadatun Abdullah S.Pi, M.Si, M.S.M selaku dosen penguji yang telah
memberikan pengarahan dan masukan sangat membangun bagi penulis.
3. Bapak Dr. Ir. Ruddy Suwandi, MS, M.Phil selaku Ketua Departemen
Teknologi Hasil Perairan yang telah membantu penulis dalam menyelesaikan skripsi ini.
4. Bapak Dr. Ir. Agoes M. Jacob, Dipl, Biol selaku ketua komisi pendidikan
Teknologi Hasil Perairan yang telah banyak memberikan pengarahan bagi penulis.
5. Kedua orang tua tercinta dan kakakku tersayang, untuk dukungan yang
diberikan baik dukungan moral maupun materiil yang telah diberikan pada penulis tanpa batas.
6. Om Herman, Tante Ani dan Aulia atas segala kebersamaan dan
kebersediaanya yang telah mengizinkan penulis melakukan preparasi bahan baku dirumah.
7. Bu Ema, Mba Lastri, Mba Vie dan Mas Ipul yang telah banyak membantu
penulis dan memberikan bantuannya kepada penulis.
8. Seluruh staf THP yang telah banyak membantu penulis dalam pembuatan
skripsi ini.
9. Tim Antioksidan yang telah melakukan penelitian bersama dan selalu saling
membantu, terima kasih kepada Pipit, Dyan, Aul, Abang, Uu, Sabrong, Azwin.
v
10. Kak Nazar yang sudah bersedia menunggu di laboratorium biotek 1 setiap
penulis melakukan maserasi, dan bersedia direpotkan dihari libur.
11. Dina, Nia, Dini dan Budi Irawan yang selalu mengingatkan dan memberikan
semangat kepada penulis agar cepat lulus.
12. Ginanjar Pratama yang telah banyak membatu dalam pengambilan sampel.
13. Uty, Cubay, Gae, Tika, Abang, Aul teman yang sangat menyenangkan dan
bersahabat.
14. Teman-teman yang sudah sangat membantu penulis dengan tawa dan
supportnya (Ica, Dede, Mba Anjie, Rida, Ratna, Mba Arince, Aciput, Cece, Era, Memey, Patcet, Wahyu, Uji, Ijal, Bang Io, Bang Hendra, Idek, Jiro, Jeng Idmar, Iben, Reja)
15. Teman-teman satu PA yang selalu saling support (Roma, Nanang, Anjar).
16. Idris, Joha, Buja yang dulu dianggap garis berbahaya dan memberikan
pertemanan yang sangat mengesankan.
17. Temen-temen THP 43 yang paling hebat atas segala dukungan, kerjasama,
kebersamaan dan semangat yang selalu diberikan kepada penulis.
18. THP 44 dan 45 (spesial untuk Hilma dan Boncel) atas keakraban dan
kebersamaanya.
19. Teman-teman penulis dan semua pihak yang tidak dapat disebutkan satu
persatu, yang telah memberikan bantuan dan dukungan moril dalam penyusunan skripsi ini.
Penulis menyadari bahwa penulisan skripsi ini masih terdapat kekurangan. Oleh karena itu, kritik dan saran yang bersifat membangun dari semua pihak sangat penulis harapkan demi perbaikan. Akhir kata, semoga penulisan skripsi ini dapat bermanfaat dan dapat memberikan informasi yang berguna bagi semua pihak yang memerlukan.
Bogor, Agustus 2010
vi
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 16 Juni 1988. Penulis merupakan anak kedua dari dua bersaudara dari pasangan Sunarto dan Lestari Ningsih.
Penulis memulai jenjang pendidikan formal di TK Asybiah (tahun 1993-1994), SD N tugu VIII Cimanggis (tahun 1994-1999), SD N 03 pagi Jagakarsa (tahun 1999-2000), selanjutnya penulis melanjutkan pendidikannya di SLTP N 166 Jakarta (tahun 2000-2003). Pendidikan menengah atas ditemph penulis di SMA N 38 Jakarta (2003-2006). Pada tahun 2006, penulis diterima di Institut Pertaian Bogor melalui USMI (Undangan Seleksi Masuk IPB) dan pada tahun 2007 penulis diterima di Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Selama masa perkuliahan, penulis aktif dalam berbagai organisasi kemahasiswaan seperti Himpunan Mahasiswa Teknologi Hasil Perikanan (Himasilkan) sebagai anggota Divisi Informasi dan Komunikasi periode
2007-2008, Fisheries Processing Club 2008-sekarang. Selain itu penulis juga aktif
dalam berbagai kepanitiaan di FPIK. Penulis juga pernah mengikuti pelatihan ISO 22000 yang diadakan di Institut Pertanian Bogor. Penulis juga pernah tercatat sebagai asisten mata kuliah Pengetahuan Bahan Baku Industri Hasil Perairan 2009-2010.
Sebagai salah satu syarat untuk meraih gelar sarjana, penulis melalukan
penelitian yang berjudul Aktivitas Antioksidan dan Komponen Bioaktif dari
Keong Pepaya (Melo sp.). Dibimbing oleh Bapak Dr. Ir. Ruddy Suwandi MS, M.Phil dan Ibu Ir. Nurjanah MS.
vii DAFTAR ISI DAFTAR TABEL ... ix DAFTAR GAMBAR ... x DAFTAR LAMPIRAN ... xi 1 PENDAHULUAN ... 1 1.1 Latar Belakang ... 1 1.2 Tujuan ... 2 2 TINJAUAN PUSTAKA ... 3
2.1 Deskripsi dan Klasifikasi Keong Pepaya (Melo sp.) ... 3
2.2 Radikal Bebas ... 5
2.3 Antioksidan ... 6
2.3.1 Sumber antioksidan ... 7
2.3.2 Mekanisme kerja antioksidan ... 8
2.3.3 Uji aktivitas antioksidan ... 9
2.4 Ekstraksi Senyawa Aktif ... 10
2.5 Senyawa Fitokimia ... 12 2.5.1 Alkaloid ... 12 2.5.2 Steroid/Triterpenoid ... 13 2.5.3 Flavonoid ... 13 2.5.4 Saponin ... 14 2.5.5 Fenol Hidroquinon ... 14 2.5.6 Karbohidrat ... 14 2.5.7 Gula pereduksi ... 15 2.5.8 Peptida ... 15 2.5.9 Asam amino ... 16 3 METODOLOGI ... 17
3.1 Waktu dan Tempat ... 17
3.2 Alat dan Bahan ... 17
3.3 Metode Penelitian ... 18
3.3.1 Pengambilan bahan baku dan preparasi bahan baku ... 18
3.3.2 Karakterisasi bahan baku ... 19
a. Rendemen ... 19
b. Uji proksimat ... 19
1). Kadar air (AOAC 2005) ... 19
2). Kadar abu (AOAC 2005) ... 19
3). Analisis kadar abu tidak larut asam (SNI 01-3836-2000) ... 20
viii
4). Kadar protein (AOAC 2005) ... 20
5). Kadar lemak (AOAC 2005) ... 21
3.3.3 Ekstraksi komponen antioksidan ... 22
a. Uji aktivitas antioksidan DPPH (Bois 1958 diacu dalam Hanani et al. 2005) ... 24
b. Uji fitokimia (Harborne 1987) ... 24
4 HASIL DAN PEMBAHASAN ... 27
4.1 Karakteristik Bahan Baku ... 27
4.1.1 Rendemen ... 27
4.1.2 Kandungan gizi bahan baku ... 29
4.2 Ekstraksi Komponen Antioksidan ... 32
4.3 Ekstrak Kasar ... 35
4.3.1 Aktivitas antioksidan ... 36
4.3.2 Senyawa fitokimia ... 43
5 KESIMPULAN DAN SARAN ... 47
5.1 Kesimpulan ... 47
5.2 Saran ... 47
DAFTAR PUSTAKA ... 48
LAMPIRAN ... 51
ix
DAFTAR TABEL
Nomor Teks Halaman
1 Sumber- sumber radikal bebas ... 6
2 Bahan pangan sumber antioksidan alami ... 7
3 Beberapa pelarut organik dan sifat fisiknya ... 11
4 Hasil uji proksimat daging dan jeroan keong pepaya kering ... 29
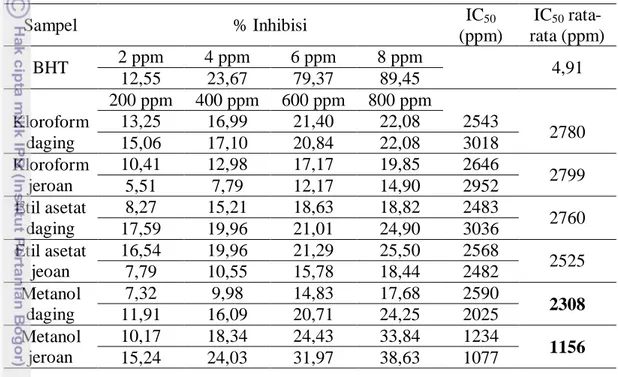
5 Hasil uji aktivitas antioksidan ekstak kasar daging dan jeroan keong pepaya ... 37
x
DAFTAR GAMBAR
Nomor Teks Halaman
1 Melo sp. ... 3
2 Cangkang keong pepaya dan anatomi gastropoda ... 4
3 Struktur DPPH dan DPPH tereduksi hasil reaksi dengan antioksidan ... 9
4 Tahapan proses ekstraksi daging dan jeroan keong pepaya ... 23
5 Diagram batang presentasi rendemen keong pepaya ... 28
6 Ekstrak kasar daging dan jeroan keong pepaya ... 34
7 Rendemen ekstrak kasar daging dan jeroan keong pepaya ... 34
8 Perubahan warna pada ekstrak kasar keong pepaya dan BHT .... 38
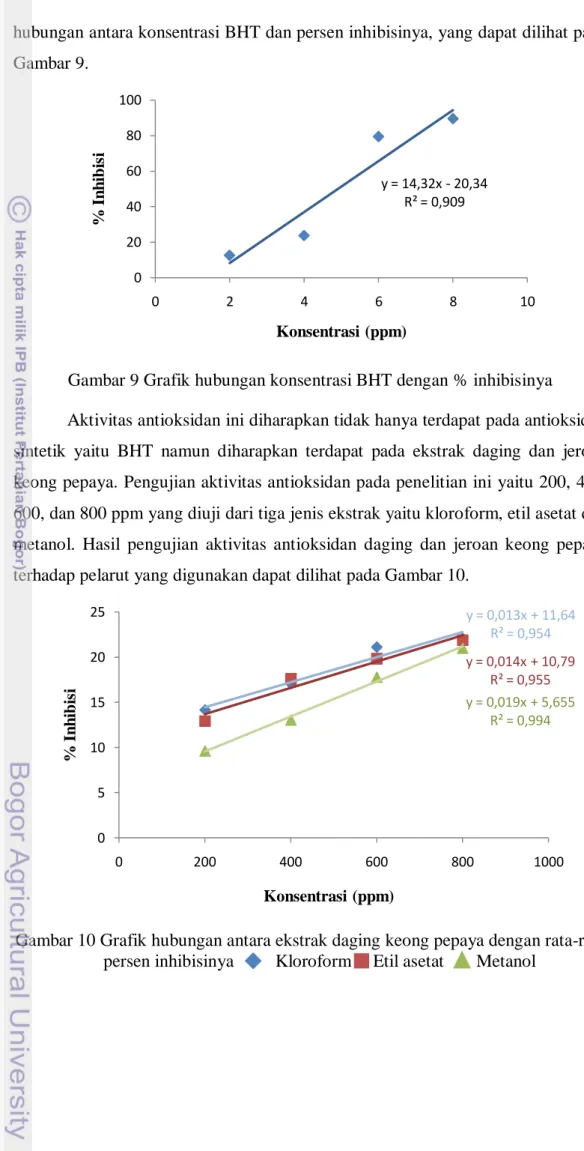
9 Grafik hubungan konsentrasi BHT dengan % inhibisinya ... 39
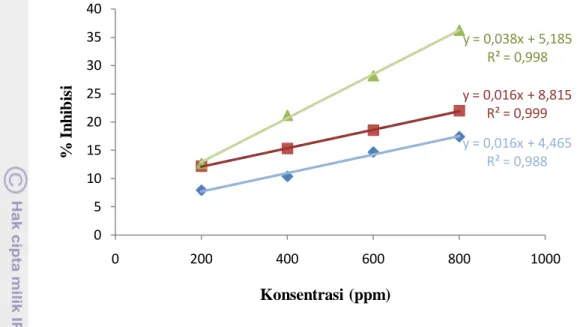
10 Grafik hubungan antara ekstrak daging keong pepaya dengan rata-rata persen inhibisinya ... 39
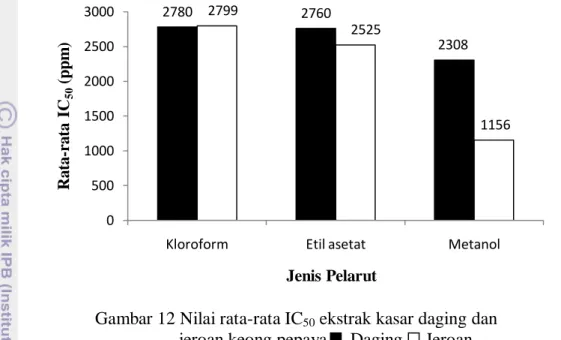
11 Grafik hubungan antara ekstrak jeroan keong pepaya dengan rata-rata persen inhibisinya ... 40
12 Nilai rata-rata IC50 ekstrak kasar daging dan jeroan keong pepaya ... 41
xi
DAFTAR LAMPIRAN
Nomor Halaman
1 Data uji proksimat ... 52
2 Contoh perhitungan uji proksimat ... 53
3 Data rendemen ekstrak kasar keong pepaya ... 54
4 Perhitungan pembuatan larutan stok ... 55
5 Hasil persen inhibisi dan IC50 BHT ... 56
6 Hasil uji aktivitas antioksidan ... 56
7 Contoh perhitungan persen inhibisi dan IC50 ... 58
1 PENDAHULUAN
1.1 Latar Belakang
Dewasa ini, dunia kedokteran dan kesehatan banyak membahas tentang radikal bebas dan antioksidan. Reaksi yang melibatkan senyawa radikal bebas diketahui merupakan sumber dari berbagai penyakit, antara lain penyakit kulit dan penyakit degeneratif (Supari 1996 diacu dalam Muchtadi 2001). Sebagian besar penyakit diawali oleh adanya reaksi oksidasi yang berlebihan di dalam tubuh (Winarsi 2007). Reaksi oksidasi terjadi karena adanya molekul oksigen. Molekul ini sangat dibutuhkan oleh organisme aerob karena dapat memberikan energi pada proses metabolisme dan respirasi, namun pada kondisi tertentu keberadaanya dapat berimplikasi pada berbagai penyakit dan kondisi degeneratif, seperti penuaan dini, kanker dan lain-lain (Winarsi 2007).
Reaksi oksidasi terjadi setiap saat termasuk pada saat proses pernafasan. Reaksi ini dapat menyebabkan terbentuknya radikal bebas yang sangat aktif, yang dapat merusak struktur serta fungsi sel (Winarsi 2007). Radikal bebas merupakan suatu molekul yang sangat reaktif karena mempunyai satu atau lebih elektron yang tidak berpasangan. Radikal bebas sangat reaktif karena kehilangan satu atau
lebih elektron yang bermuatan listrik, dan untuk mengembalikan
keseimbangannya maka radikal bebas berusaha mendapatkan elektron dari molekul lain atau melepas elektron yang tidak berpasangan tersebut. Radikal bebas selain dihasilkan dari proses pernafasan juga dapat disebabkan oleh produk sampingan dari proses metabolisme dalam tubuh (Praptiwi et al. 2006).
Reaktivitas radikal bebas dapat dihambat oleh sistem antioksidan yang melengkapi sistem kekebalan tubuh. Antioksidan merupakan senyawa yang dapat menghambat spesies oksigen reaktif/spesies nitrogen reaktif (ROS/RNS) dan juga
radikal bebas (Rohman dan Riyanto 2005). Antioksidan akan menyerahkan satu
atau lebih elektronnya pada radikal bebas sehingga dapat menghentikan kerusakan yang disebabkan oleh radikal bebas. Di dalam tubuh terdapat mekanisme antioksidan, namun bila jumlah radikal bebas dalam tubuh berlebih maka dibutuhkan antioksidan yang berasal dari sumber alami atau sintetik dari luar
Antioksidan sintetik merupakan antioksidan yang dibutuhkan dari luar tubuh atau eksogeneous seperti BHA (butil hidroksi anisol), BHT (butil hidroksi toluen), PG (propil galat), dan TBHQ (tert-butil Hidrokuinon). Antioksidan ini
dapat meningkatkan terjadinya penyakit karsinogenesis (Amarowicz et al. 2000
diacu dalam Rohman dan Riyanto 2005). Penggunaan antioksidan sintetik dalam
bahan pangan yang berlebihan dapat menyebabkan keracunan (Winarno 1997
diacu dalam Santoso et al. 2010). Hal inilah yang menyebabkan penggunaan
antioksidan alami mengalami peningkatan.
Salah satu jenis bahan baku alami yang mungkin memiliki aktivitas antioksidan yaitu keong pepaya (Melo sp). Gastropoda merupakan binatang yang melekat pada terumbu karang dan dasar laut yang berusaha mempertahankan diri dengan menghasilkan senyawa kimia dalam bentuk metabolit sekunder yang ditakuti dan dihindari predator, senyawa metabolit berkhasiat sebagai antikanker (cytotoxic) dan antibiotik (Proksch 2002 diacu dalam Purwaningsih 2007). Keong pepaya termasuk Kelas Gastropoda yang diharapkan memiliki aktivitas antioksidan.
Salah satu jenis dari Famili Volutidae yaitu keong pepaya ditemukan di perairan pantai Cirebon. Keong pepaya di perairan pantai Cirebon ini umumnya sudah dikonsumsi oleh masyarakat dan banyak yang menyukai hidangan yang berasal dari keong pepaya. Masyarakat umumnya belum mengetahui potensi yang dimiliki oleh keong pepaya. Hal tersebut mendasari penelitian ini untuk mengetahui potensi antioksidan yang terdapat pada keong pepaya. Hasil penelitian ini diharapkan dapat memperkaya informasi mengenai kandungan senyawa antioksidan keong pepaya yang dapat bermanfaat bagi bidang pangan, farmasi dan industri.
1.2 Tujuan
Tujuan dari penelitian ini adalah menentukan karakteristik, rendemen ekstrak kasar, aktivitas antioksidan, dan komponen bioaktif dari keong pepaya (Melo sp.) dengan berbagai jenis pelarut.
2 TINJAUAN PUSTAKA
2.1 Deskripsi dan Klasifikasi Keong Pepaya (Melo sp.)
Melo sp. termasuk Famili Volutidae yang kebanyakan tidak memiliki
operkulum dan memiliki 180 jenis di seluruh dunia (Grzimex 1974). Melo sp.
memiliki cangkang yang sangat besar. Puncaknya dapat tak terlihat dan terlihat. Apex halus, besar dan berbentuk seperti kubah. Puncak lingkarannya halus dan
seperti mahkota, terdapat sejumlah columella yang saling berlipat. Klasifikasi
keong papaya (Melo sp.) (Lineaus 1958) adalah sebagai berikut:
Kingdom : Animalia Phylum : Molusca Class : Gastropoda Subclass : Caenogastropoda Order : Hypsogastropoda Suborder : Neogastropoda Superfamiliy : Muricoidea Family : Volutidae Subfamily : Amoriinae Genus : Melo sp.
Famili volutidae merupakan salah satu keong yang disukai oleh para kolektor. Volutidae termasuk jenis karnivor yang memangsa hewan-hewan kecil, echinodermata dan moluska lainnya. Hidup di pasir yang bersih, dan berlindung di
bagian bawah (Beechey 2005). Keong pepaya tersebar di perairan Indo-Pacific
(Australia dan New Guinea) dan Indonesia (Grzimek 1974). Bentuk keong pepaya dapat dilihat pada Gambar 1.
Keong laut masuk dalam Kelas Gastropoda laut. Tubuhnya dilindungi oleh sebuah cangkang dan biasanya melingkar karena torsi, bentuk kepala jelas, mempunyai tentakel, mata dan radula. Kaki lebar dan datar, bernafas dengan
sebuah atau sepasang insang, dioecious, larva trocopor, dan veliger
(Purwaningsih 2007).
Tubuh keong terdiri atas empat bagian utama yaitu kepala, kaki, isi perut, dan mantel. Pada kepala terdapat sepasang mata, sepasang tentakel, sebuah mulut, dan sebuah siphon. Mantel merupakan arsitek pembentuk struktur cangkang dan pola luarnya. Di dalam kepala terdapat probosis yang di dalamnya terdapat radula. Kaki berukuran besar dan berbentuk pipih yang berfungsi untuk merayap dan melekat (Yulianda 1999). Cangkang dan anatomi gastropoda dapat dilihat pada Gambar 2.
Gambar 2 Cangkang keong pepaya dan anatomi gastropoda Sumber: Pretre (1850)
Cangkang gastropoda paling luar disebut periostrakum, merupakan lapisan
tipis yang terdiri atas bahan protein seperti zat tanduk disebut conchiolin atau
choncin. Pada lapisan ini terdapat beberapa pigmen beraneka warna yang menjadikan banyak cangkang keong laut sangat indah warnanya: kuning, hijau cemerlang, dengan bercak-bercak merah atau garis-garis. Cangkang pada gastropoda terdiri atas lapisan kalsium karbonat sebanyak tiga lapis atau lebih, yang terluar adalah prismatik atau palisade, lapisan tengah atau lamella, dan paling dalam adalah lapisan nakre atau hipostrakum (Suwignyo et al. 1997 diacu dalam Purwaningsih 2007). Struktur cangkang terbuat dari kalsium karbonat,
yaitu 89-99% dan sisanya 1-2% fosfat, bahan organik conchiolin dan air (Darma
2.2 Radikal Bebas
Radikal bebas merupakan suatu molekul yang sangat reaktif karena mempunyai satu atau lebih elektron yang tidak berpasangan. Radikal bebas sangat reaktif karena kehilangan satu atau lebih elektron yang bermuatan listrik, dan untuk mengembalikan keseimbangannya maka radikal bebas berusaha mendapatkan elektron dari molekul lain atau melepas elektron yang tidak berpasangan tersebut. Radikal bebas dalam jumlah berlebih di dalam tubuh sangat berbahaya karena menyebabkan kerusakan sel, asam nukleat, protein dan jaringan lemak (Dalimartha & Soedibyo 1998 diacu dalam Praptiwi et al. 2006).
Radikal bebas adalah atom, molekul atau sedikit kumpulan yang berisi satu atau lebih elektron yang tidak berpasangan. Radikal bebas bersifat tidak stabil, reaktif, dan memiliki kemampuan untuk merusak molekul biologi yaitu DNA, protein, lipid, dan karbohidrat (Surai 2002).
Radikal bebas memiliki reaktivitas yang tinggi. Hal ini ditunjukkan oleh sifatnya yang segera menarik atau menyerang elektron di sekelilingnya. Senyawa radikal bebas juga dapat mengubah suatu molekul menjadi suatu radikal. Dampak kerja radikal bebas akan terbentuk radikal bebas yang berasal dari atom atau molekul yang elektronnya diambil untuk berpasangan dengan radikal sebelumnya, namun bila dua senyawa radikal bertemu elektron yang tidak berpasangan dari kedua senyawa tersebut akan bergabung dan membentuk ikatan kovalen yang stabil. Sebaliknya bila senyawa bertemu dengan senyawa bukan radikal bebas, akan terjadi tiga kemungkinan yaitu: (1) radikal bebas akan memberikan elektron yang tidak berpasangan (reduktor) pada senyawa bukan radikal bebas; (2) radikal bebas menerima elektron (oksidator) dari senyawa bukan radikal bebas; (3) radikal bebas bergabung dengan senyawa bukan radikal bebas (Winarsi 2007).
Tahapan pembentukan reaksi radikal bebas terjadi melalui tiga tahap yang terdiri atas tahap inisiasi yaitu awal pembentukan radikal bebas. Tahap propagasi yaitu pemanjangan rantai radikal. Tahap terminasi yaitu bereaksinya senyawa radikal dengan radikal lain atau dengan penangkap radikal, sehingga potensi propagasinya rendah (Fessenden dan Fessenden 1986). Sumber radikal bebas internal dan eksternal dapat dilihat pada Tabel 1.
Tabel 1 Sumber-sumber radikal bebas
Sumber Internal Sumber Eksternal
Mitokondria Fagosit
Xanthin oksidase
Reaksi yang melibatkan logam transisi Jalur arakhidonat Peroksisom Olahraga Peradangan Iskemia/reperfusi Rokok Radiasi Sinar UV Polusi Obat-obatan kimia Bahan-bahan kimia Industrial solvents
Sumber: Furst (1996) diacu dalam Surai (2002)
Radikal bebas merupakan salah satu bentuk senyawa oksigen reaktif, yang secara umum diketahui sebagai senyawa yang memiliki elektron yang tidak berpasangan. Radikal bebas dapat terbentuk melalui dua cara, yaitu secara endogen (sebagai respon normal proses biokimia internal maupun eksternal) dan secara eksogen (berasal dari polusi, makanan, serta injeksi ataupun absorpsi melalu injeksi. Senyawa ini terbentuk di dalam tubuh, dipicu oleh bermacam-macam faktor (Muchtadi 2001).
Radikal bebas bisa terbentuk, misalnya ketika komponen makanan diubah menjadi bentuk energi melalui proses metabolisme. Pada proses metabolisme ini sering kali terjadi kebocoran elektron. Kondisi inilah yang menyebabkan mudahnya terbentuk radikal bebas, seperti anion superoksida, hidroksil, dan lain-lain. Radikal bebas juga dapat terbentuk dari senyawa lain yang sebenarnya bukan radikal bebas, tetapi mudah berubah menjadi radikal bebas, contohnya hidrogen
peroksida (H2O2), ozon. Kedua kelompok senyawa tersebut sering diistilahkan
sebagai senyawa oksigen reaktif (SOR) atau reactive oxygen species (ROS)
(Winarsi 2007).
2.2 Antioksidan
Antioksidan adalah suatu senyawa yang dapat memperlambat atau mencegah proses oksidasi. Antioksidan dapat menghambat laju oksidasi bila bereaksi dengan radikal bebas (Hudson 1990 diacu dalam Praptiwi et al. 2006).
Antioksidan merupakan senyawa pemberi elektron (elektron donor) atau reduktan. Senyawa ini memiliki berat molekul kecil dengan cara mencegah terbentuknya radikal. Antioksidan merupakan senyawa yang dapat menghambat
reaksi oksidasi dengan mengikat radikal bebas dan molekul yang sangat reaktif, akibatnya kerusakan sel dapat dihambat (Winarsi 2007).
Antioksidan berfungsi menetralisasi radikal bebas, sehingga atom dan elektron yang tidak berpasangan mendapatkan pasangan elektron dan menjadi stabil. Keberadaan antioksidan dapat melindungi tubuh dari berbagai macam penyakit degeneratif dan kanker. Antioksidan juga membantu menekan proses penuaan dini (Tapan 2005).
2.2.1 Sumber antioksidan
Antioksidan berdasarkan sumbernya dapat dibagi menjadi dua, yaitu antioksidan sintetik (antioksidan yang diperoleh dari hasil sintesis reaksi kimia)
dan antioksidan alami (antioksidan hasil ekstraksi bahan alami) (Adawiyah et al.
2001). Antioksidan alami di dalam makanan dapat berasal dari: (a) senyawa antioksidan yang sudah ada dari suatu atau dua komponen makanan; (b) senyawa antioksidan yang terbentuk dari reaksi-reaksi selama proses pengolahan; (c) senyawa antioksidan yang diisolasi dari sumber alami dan ditambahkan pada makanan sebagai bahan tambahan makanan (Pratt 1992 diacu dalam
Adawiyah et al. 2001). Bahan pangan sumber antioksidan alami dapat dilihat
pada Tabel 2.
Tabel 2 Bahan pangan sumber antioksidan alami
Antioksidan Bahan Pangan
Vitamin A dan Karotenoid
Mentega, margarin, buah-buahan berwarna kuning, sayuran hijau
Vitamin E Biji bunga matahari, biji-bijian yang mengandung kadar
minyak tinggi, kacang-kacangan, susu Vitamin C
(asam askorbat)
Buah-buahan (jeruk), sayur-sayuran (sebagian rusak dalam pemasakan), kentang
Vitamin B2 (riboflavin)
Susu, produk hasil olahan susu, daging, ikan, telur, serealia utuh, kacang-kacangan
Seng (Zn) Bahan pangan hewani: daging, udang, ikan, susu
Tembaga (Cu) Hati, udang, biji-bijian, serealia (kadar dalam makanan
tergantung pada konsentrasi Cu dalam tanah)
Selenium (Se) Serealia, daging, ikan (kadar dalam makanan tergantung
pada konsentrasi Cu dalam tanah)
Protein Ovalbumin dalam telur, gliadin dalam gandum
Sumber: Belleville-Nabet (1996) diacu dalam Muchtadi (2001)
Senyawa-senyawa yang umumnya terkandung dalam antioksidan alami adalah fenol, polifenol, dan yang paling umum adalah flavonoid (flavonol,
isoflavon, flavon, katekin, flavonon), turunan asam sinamat, tokoferol, dan asam organik polifungsi. Saat ini tokoferol sudah diproduksi secara sintetik untuk tujuan komersil (Pratt dan Hudson 1990).
2.2.2 Mekanisme kerja antioksidan
Antioksidan dalam menghambat oksidasi atau menghentikan reaksi berantai pada radikal bebas dari lemak yang teroksidasi. Hal ini dapat disebabkan oleh empat macam mekanisme reaksi, yaitu: 1) pelepasan hidrogen dari antioksidan; 2) pelepasan elektron dari antioksidan; 3) addisi lemak ke dalam cincin atomatik pada antioksidan; dan 4) pembentukan senyawa kompleks antara lemak dan cincin aromatik dari antioksidan (Ketaren 1986).
Antioksidan dapat digolongkan menjadi tiga kelompok berdasarkan mekanisme kerjanya, yaitu antioksidan primer, sekunder dan tersier. Antioksidan primer disebut juga antioksidan enzimatis. Suatu senyawa dikatakan sebagai antioksidan primer, apabila dapat memberikan atom hidrogen secara cepat pada senyawa radikal, kemudian radikal antioksidan yang terbentuk segera berubah menjadi senyawa yang lebih stabil (Winarsi 2007). Antioksidan primer bekerja dengan cara mencegah pembentukan senyawa radikal bebas yang telah terbentuk menjadi molekul yang kurang reaktif (Belleville-Nabet 1996 diacu dalam Winarsi 2007).
Antioksidan sekunder disebut juga antioksidan eksogeneus atau non-enzimatis. Antioksidan dalam kelompok ini disebut pertahanan preventif. Sistem pertahanan ini, pembentukan senyawa oksigen reaktif dihambat dengan cara pengkelatan metal, atau dirusak pembetukannya. Antioksidan sekunder bekerja dengan cara memotong reaksi oksidasi berantai dari radikal bebas atau dengan cara menangkapnya, akibatnya radikal bebas tidak akan bereaksi dengan komponen seluler. Antioksidan sekunder ini dapat berupa komponen non nutrisi, dan komponen nutrisi dari sayuran dan buah-buahan (Winarsi 2007). Antioksidan sekunder juga berfungsi memperlambat laju autooksidasi dengan berbagai mekanisme diluar mekanisme pemutusan rantai autoksidasi dengan pengubahan radikal lipida ke bentuk lebih stabil (Gordon 1990).
Kelompok antioksidan tersier meliputi sistem enzim DNA-repair dan metionin sulfoksida reduktase. Enzim-enzim ini berfungsi dalam perbaikan
biomolekuler yang rusak akibat reaktivitas radikal bebas. Kerusakan DNA yang
terinduksi senyawa radikal bebas dicirikan oleh rusaknya single dan double
strand, baik gugus non-basa maupun basa (Winarsi 2007). 2.2.3 Uji aktivitas antioksidan
Metode yang umum digunakan dalam pengujian aktivitas antioksidan adalah metode serapan radikal bebas DPPH (Diphenylpicrylhydrazyl) karena merupakan metode yang sederhana, mudah, dan menggunakan sampel dalam
jumlah sedikit dengan waktu yang singkat (Hanani et al. 2005). DPPH adalah
radikal bebas yang bersifat stabil dan beraktivitas dengan cara mendelokasi elektron bebas pada suatu molekul, sehingga molekul tersebut tidak reaktif sebagaimana radikal bebas yang lain. Proses ini dapat ditunjukkan dengan adanya warna ungu (violet) pekat yang dapat dikarakterisasi pada pita absorbansi (Molyneux 2004).
Senyawa antioksidan akan bereaksi dengan radikal DPPH melalui donasi atom hidrogen dan menyebabkan peluruhan warna DPPH dari ungu menjadi kuning yang diukur dengan panjang gelombang 517 nm. Senyawa dapat dikatakan memiliki aktivitas antioksidan apabila senyawa tersebut mampu mendonorkan atom hidrogennya untuk berikatan dengan DPPH membentuk DPPH tereduksi, ditandai dengan semakin hilangnya warna ungu menjadi kuning pucat. Pengukuran aktivitas antioksidan ini dengan metode DPPH menggunakan prinsip spektrofotometri (Molyneux 2004). Struktur DPPH dan DPPH tereduksi hasil reaksi dengan antioksidan dapat dilihat pada Gambar 3.
Diphenylpicrylhydrazyl (radikal bebas) Diphenylpicrylhydrazine (non radikal) Gambar 3 Struktur DPPH dan DPPH tereduksi hasil reaksi dengan antioksidan
Parameter untuk menginterpretasikan hasil pengujian dengan metode
yang dibutuhkan untuk menghambat 50% radikal bebas DPPH
(Andayani et al. 2003). Suatu senyawa dikatakan memiliki aktivitas antioksidan
sangat kuat jika nilai IC50 kurang dari 50 ppm, kuat IC50 antara 50-100 ppm,
sedang jika nilai IC50 101-150 ppm, dan lemah jika nilai IC50 antara 150-200 ppm
(Molyneux 2004).
2.3 Ekstraksi Senyawa Aktif
Ekstraksi merupakan suatu cara memisahkan campuran beberapa zat
menjadi komponen-komponen yang terpisah (Winarno et al. 1973). Ragam
ekstraksi tergantung pada tekstur dan kandungan air bahan yang diekstraksi dan pada jenis senyawa yang diisolasi (Harborne 1987).
Ekstraksi dapat dilakukan dalam dua cara yaitu aqueous phase dan
organik phase. Cara aqueous phase dilakukan dengan menggunakan pelarut air, misalnya untuk gula, NaCl dan sebagainya. Cara organik phase dilakukan dengan menggunakan pelarut organik seperti kloroform, eter dan sebagainya, misalnya untuk bahan-bahan berlemak, karoten dan sebagainya (Winarno et al. 1973).
Metode ekstraksi yang digunakan tergantung dari beberapa faktor, antara lain tujuan ekstraksi, skala ekstraksi, sifat-sifat komponen yang akan diekstraksi dan sifat pelarut yang digunakan. Metode umum ekstraksi yang dapat dilakukan terdiri atas ekstraksi dengan pelarut, destilasi, supercritical fluid extraction (SFE), pengepresan mekanik dan sublimasi. Metode yang banyak digunakan adalah destilasi dan ekstraksi menggunakan pelarut (Houghton dan Raman 1998).
Syarat pelarut dapat digunakan di dalam proses ekstraksi, yaitu pelarut tersebut merupakan pelarut terbaik untuk bahan yang akan diekstraksi dan pelarut tersebut harus terpisah dengan cepat setelah pengocokkan. Pelarut agar cepat terpisah harus menggunakan pelarut yang mempunyai berat jenis yang berbeda, yaitu yang mempunyai berat jenis lebih besar dari 1 atau kurang dari 1
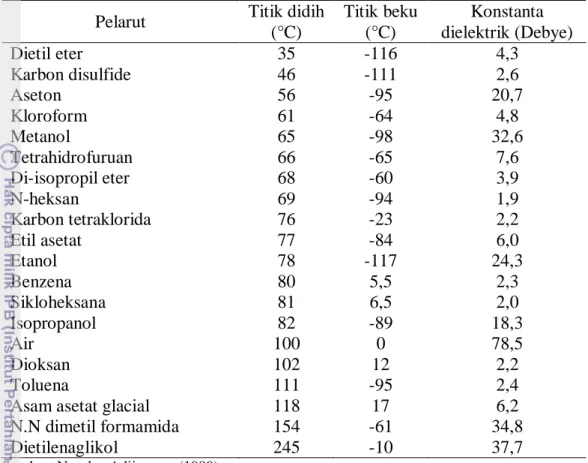
(Winarno et al. 1973). Beberapa pelarut organik dan sifat-sifat fisiknya dapat
Tabel 3 Beberapa pelarut organik dan sifat fisiknya
Pelarut Titik didih
(°C) Titik beku (°C) Konstanta dielektrik (Debye) Dietil eter Karbon disulfide Aseton Kloroform Metanol Tetrahidrofuruan Di-isopropil eter N-heksan Karbon tetraklorida Etil asetat Etanol Benzena Sikloheksana Isopropanol Air Dioksan Toluena
Asam asetat glacial N.N dimetil formamida Dietilenaglikol 35 46 56 61 65 66 68 69 76 77 78 80 81 82 100 102 111 118 154 245 -116 -111 -95 -64 -98 -65 -60 -94 -23 -84 -117 5,5 6,5 -89 0 12 -95 17 -61 -10 4,3 2,6 20,7 4,8 32,6 7,6 3,9 1,9 2,2 6,0 24,3 2,3 2,0 18,3 78,5 2,2 2,4 6,2 34,8 37,7 Sumber: Nur dan Adijuwana (1989)
Kelarutan zat di dalam pelarut-pelarut tergantung dari ikatannya yaitu polar atau non polar. Zat yang polar contohnya air, sedangkan non polar yaitu karbontetrakhlorida. Zat-zat yang polar hanya larut dalam pelarut polar, sedangkan zat-zat non polar hanya larut di dalam pelarut non polar
(Winarno et al. 1973). Pelarut yang bersifat polar mampu mengekstrak senyawa
alkaloid kuartener, komponen fenolik, karotenoid, tannin, gula, asam amino, dan glikosida. Pelarut non polar dapat mengekstrak senyawa kimia seperti lilin, lemak, dan minyak yang mudah menguap. Pelarut semi polar mampu mengekstrak senyawa fenol, terpenoid, alkaloid, aglikon, dan glikosida (Harborne 1987). Metanol merupakan senyawa polar yang disebut sebagai pelarut universal karena selain mampu mengekstrak komponen polar juga dapat mengekstrak komponen nonpolar seperti lilin dan lemak (Houhton dan Raman 1998).
Hasil ekstrak tergantung pada beberapa faktor antara lain kondisi alamiah senyawa tersebut, metode ekstraksi yang digunakan, ukuran partikel sampel, kondisi dan waktu penyimpanan, lama waktu ekstraksi, dan perbandingan jumlah
pelarut terhadap jumlah sampel (Darusman et al. 1995). Jenis dan mutu pelarut yang digunakan menentukan keberhasilan proses ekstraksi. Pelarut yang digunakan harus dapat melarutkan zat yang diinginkannya. Keberhasilan ekstraksi tergantung pada banyaknya ekstraksi yang dilakukan. Hasil yang diperoleh maksimal jika ekstraksi dilakukan berulang-ulang dengan jumlah pelarut yang sedikit-sedikit. Efisiensi ekstraksi dapat ditingkatkan dengan menggunakan luas kontak yang besar (Khopkaar 2003).
2.5 Senyawa Fitokimia
Fitokimia merupakan suatu bagian ilmu pengetahuan alam. Istilah fitokimia (dari kata “phyto” = tanaman) yang berarti kimia tanaman. Fitokimia menguraikan aspek kimia suatu tanaman (Sirait 2007). Fitokimia atau kimia tumbuhan berada diantara kimia organik bahan alam dan biokimia tumbuhan, serta berkaitan erat dengan keduanya. Fitokimia ini mencakup struktur kimianya, biosintesis, perubahan serta metabolismenya, penyebaran secara alamiah dan fungsi biologisnya. Senyawa fitokimia berpotensi mencegah berbagai penyakit degeneratif dan kardiovaskuler (Harborne 1987).
2.5.1 Alkaloid
Alkaloid adalah senyawa kimia tanaman hasil metabolit sekunder, yang terbentuk berdasarkan prinsip pembentukan campuran (Sirait 2007). Alkaloid merupakan golongan terbesar dari senyawa hasil metabolisme sekunder pada tumbuhan. Alkaloid banyak ditemukan dalam berbagai bagian tumbuhan seperti biji, daun, ranting, dan kulit kayu (Suradikusumah 1989).
Pada umumnya alkaloid merupakan senyawa yang bersifat basa yang mengandung satu atau lebih atom nitrogen, biasanya dalam gabungan, sebagai bagian dari sistem siklik (Harborne 1987). Alkaloid yang mengandung cincin heterosiklik biasanya disebut alkaloid sejati, sedangkan yang tidak mengandung cincin heterolistik disebut protoalkaloid. Keduanya diturunkan dari asam amino (Suradikusumah 1989).
Alkaloid sering kali beracun bagi manusia dan banyak yang mempunyai kegiatan fisiologi yang menonjol, jadi digunakan secara luas di bidang pengobatan. Alkaloid sering bersifat optis aktif, kebanyakan berbentuk kristal tetapi hanya sedikit yang berupa cairan. Fungsi alkaloid dalam tumbuhan tetap
belum begitu pasti walaupun beberapa senyawa dilaporkan berperan sebagai pengatur tumbuhan atau penolak dan pemikat serangga (Harborne 1987).
2.5.2 Steroid/Triterpenoid
Triterpenoid adalah senyawa yang kerangka karbonnya berasal dari enam
satuan isoprene dan secara biosintesis diturunkan dari hidrokarbon C30 asiklik,
yaitu skualena. Senyawa ini berstruktur siklik yang rumit, kebanyakan berupa alkohol, aldehida, atau asam karboksilat. Senyawa ini tidak berwarna, berbentuk kristal, seringkali bertitik leleh tinggi dan aktif optik. Triterpenoid ini dapat dibagi menjadi empat golongan senyawa yaitu triterpena sebenarnya, steroid, saponin, dan glikosida jantung. Kedua golongan yang terakhir sebenarnya triterpena atau steroid yang terutama terdapat sebagai glikosida (Harborne 1987).
Steroid atau sterol adalah triterpen yang bentuk dasar sistem cincin siklopentana perhidrofenantren. Sterol awalnya diduga hanya terdapat pada binatang. Sterol diketahui juga terdapat pada jaringan tumbuhan (fitosterol). Fitosterol secara struktural berbeda dengan sterol binatang. Perbedaannya dengan kolesterol terutama karena adanya substitusi gugus metal, etil atau etilidien (Suradikusumah 1989).
2.5.3 Flavonoid
Flavonoid adalah senyawa yang terdiri atas C6-C3-C6 (Sirait 2007).
Flavonoid merupakan senyawa fenol terbanyak yang ditemukan di alam. Flavonoid ditemukan dalam tumbuhan tingkat tinggi, tetapi tidak dalam mikroorganisme. Senyawa ini menjadi warna merah, ungu, biru, dan kuning dalam tumbuhan (Suradikusumah 1989).
Flavonoid terdapat dalam tumbuhan sebagai campuran, jarang sekali dijumpai hanya flavonoid tunggal dalam jaringan tumbuhan. Flavonoid umumnya terdapat pada tumbuhan sebagai glikosida. Flavonoid diklasifikasikan menjadi flavon, flavonol, flavanon, flavanonol, isoflavon, calkon, dihidrokalkon, auron, antosianidin, katekin, flavan-3,4-diol (Harborne 1987).
Flavonoid dapat berguna bagi kehidupan manusia. Flavon dalam dosis kecil bekerja sebagai stimulant pada jantung, hesperidin mempengaruhi pembuluh darah kapiler. Flavon yang terhidroksilasi bekerja sebagai diurematik dan sebagai antioksidan pada lemak (Sirait 2007).
2.5.4 Saponin
Saponin adalah glikosida dan sterol yang telah terdeteksi pada lebih dari 90 suku tumbuhan. Saponin juga merupakan senyawa aktif permukaan dan bersifat seperti sabun. Saponin dapat dideteksi berdasarkan kemampuannya membentuk busa dan menghemolisis sel darah. Pencarian saponin dalam tumbuhan telah dirangsang oleh kebutuhan terhadap sumber sapogenin yang mudah diperoleh dan dapat diubah dalam laboratorium menjadi sterol hewan yang berkhasiat penting (Harborne 1987).
Saponin sebagian besar bereaksi netral (larut dalam air), beberapa ada yang bereaksi dengan asam (sukar larut dalam air), sebagian besar ada yang bereaksi dengan basa. Saponin dapat membentuk senyawa kompleks dengan kolesterol. Saponin dapat bersifat toksik terhadap ikan dan binatang berdarah dingin lainnya. Saponin yang beracun disebut sapotoksin. Saponin dapat menyebabkan stimulasi pada jaringan tertentu misalnya pada epitel hidung, bronkus, ginjal, dan sebagainya. Stimulasi pada ginjal diperkirakan menimbulkan efek diuretika (Sirait 2007).
2.5.5 Fenol hidrokuinon
Fenol mencakup sejumlah senyawa yang umumnya mempunyai sebuah cincin aromatik dengan satu atau lebih gugus hidroksil. Senyawa fenol larut dalam air, karena paling sering bergabung dengan gula glukosida dan biasanya terdapat
dalam rongga sel. Flavonoid merupakan golongan fenol terbesar
(Suradikusumah 1989).
Kuinon adalah senyawa berwarna dan mempunyai kromofor dasar seperti kromofor pada benzokuinon. Kuinon terdiri atas dua gugus karbonil yang berkonyugasi dengan dua ikatan rangkap karbon-karbon. Kuinon dapat dibagi menjadi empat kelompok untuk tujuan identifikasi yaitu, benzokuinon, naftokuinon, antrakuinon, dan kuinon isoprenoid (Harborne 1987).
2.5.6 Karbohidrat
Karbohidrat biasa digolongkan menjadi tiga golongan berdasarkan
makromolekulnya menjadi monosakarida sederhana (glukosa, fruktosa)
turunannya; oligosakarida, yang terbentuk dengan kondensasi dua satuan monosakarida atau lebih (sukrosa), dan polisakarida, yang terdiri atas satuan
monosakarida berantai panjang, disambungkan dengan cara kepala ke ekor, berbentuk rantai lurus atau bercabang (Harborne 1987).
Karbohidrat merupakan konstituen yang paling banyak jumlahnya dibandingkan dengan kandungan kimia lainnya yang terdapat dalam tanaman ataupun hewan. Karbohidrat dibentuk melalui proses fotosintesis pada tanaman. Zat tersebut diubah menjadi senyawa kimia organik lain yang diperlukan tanaman.
Karbohidrat mempunyai peranan penting yaitu berguna sebagai storing energy
seperti pati, dapat pula berguna sebagai transport of energy seperti sukrosa, dan
sebagai penyusun dinding sel seperti selulosa (Sirait 2007). 2.5.7 Gula pereduksi
Sifat pereduksi dari suatu molekul gula ditentukan dengan ada tidaknya gugus hidroksil (OH) bebas yang reaktif. Gugus hidroksil yang reaktif pada glukosa (aldosa) biasanya terletak pada karbon nomor satu (anomerik), sedangkan pada fruktosa (ketosa) terletak pada karbon nomor dua. Sukrosa tidak mempunyai gugus OH bebas yang reaktif karena keduanya sudah saling terikat, sedangkan laktosa mempunyai OH bebas pada atom C nomor satu pada gugus glukosanya (Winarno 1997).
Gula adalah senyawa tanpa warna dan bila terdapat dalam jumlah mikro, harus dideteksi dengan cara reaksi menggunakan pereaksi kromogen yang cocok. Gula mereduksi seperti glukosa yang secara klasik dideteksi berdasarkan pembentukan endapan merah-kuning dengan larutan fehling, dapat mudah dideteksi pada kromatogram dengan menggunakan pereaksi fenol atau amina (Harborne 1987).
2.5.8 Peptida
Peptida merupakan hasil polikondensasi asam amino. Gugus karbonil dari satu asam amino berikatan dengan gugus asam amino lain membentuk ikatan amida atau ikatan peptida (Sastroamidjojo 1996). Pembentukan ikatan peptida memerlukan banyak energi, sedangkan untuk hidrolisis praktis tidak memerlukan energi. Reaksi keseimbangan ini lebih cenderung berjalan ke arah hidrolisis daripada sintesis (Winarno 2008).
Ikatan peptida ini terbentuk dengan menarik unsur H2O dari gugus
kondensasi yang kuat. Tiga asam amino dapat disatukan oleh dua ikatan peptida dengan cara sama untuk membentuk suatu tripeptida, tetrapeptida dan pentapeptida. Asam amino yang bergabung dengan cara demikian dalam jumlah banyak dihasilkan struktur yang dinamakan polipeptida. Peptida dengan panjang yang bermacam-macam dibentuk oleh hidrolisa sebagian dari rantai polipeptida yang panjang dari protein, yang dapat mengandung ratusan asam amino (Lehninger 1982).
2.5.9 Asam amino
Asam amino merupakan rantai panjang penyusun protein yang terikat satu sama lain dalam ikatan peptida. Asam amino terdiri atas unsur-unsur karbon, hidrogen, oksigen dan nitrogen. Unsur nitrogen adalah unsur utama protein, karena terdapat pada semua protein namun tidak terdapat pada karbohidrat dan lemak. Asam amino terdiri atas karbon yang terikat pada satu gugus karboksil
(-COOH), satu gugus amino (-NH2), satu atom hidrogen (-H) dan satu gugus
rantai cabang (-R). Asam amino dibedakan berdasarkan rantai cabang gugus R-nya (Almatsier 2006).
Sifat fisika asam amino ditentukan oleh struktur ion dwikutub. Kelompok asam amino lebih mudah larut dalam air daripada pelarut organik. Asam amino membentuk garam dengan asam atau basa karena bersifat amfoter (Robinson 1995). Derajat ionisasi dari asam amino sangat dipengaruhi oleh pH. Pada pH yang rendah misalnya pada pH 1,0 gugus karboksilnya tidak terdisosiasi, sedang gugus aminonya menjadi ion. Pada pH yang tinggi misalnya pada pH 11,0
karboksilnya terdisosiasi sedang gugusan aminonya tidak terdisosiasi
3 METODOLOGI
3.1 Waktu dan Tempat
Penelitian ini dilakukan dari Januari sampai April 2010. Keong pepaya dibeli dari nelayan di sekitar Perairan Cirebon. Analisis proksimat keong ini dilakukan di Laboratorium Konservasi Satwa Langka dan Harapan, Pusat Antar Universitas (PAU), Institut Pertanian Bogor. Analisis aktivitas antioksidan dan uji fitokimia dilakukan di Laboratorium Biokimia Hasil Perairan, Laboratorium Pengetahuan Bahan Baku Hasil Perairan, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
3.2 Alat dan Bahan
Alat-alat yang digunakan antara lain pisau, timbangan digital, timbangan analitik. Alat-alat yang digunakan dalam uji proksimat yaitu gegep, kompor listrik, cawan porselen, oven, desikator, tanur pengabuan, labu kjehdal, kondensor, buret, dan alat soxhlet. Alat-alat yang digunakan untuk uji aktivitas
antioksidan yaitu sudip, aluminium foil, gelas ukur, gelas piala, corong terpisah,
vortex, elenmeyer, kapas, shaker, kertas saring whatman 42, evaporator, vakum
evaporator, botol ekstrak, freezer, tabung reaksi, pipet tetes, pipet volumetrik,
pipet mikro, inkubator, spektrofotometer UV-VIS Hitachi U-2800.
Bahan-bahan yang digunakan dalam penelitian ini terdiri dari bahan utama dan bahan pembantu. Bahan utama dalam penelitian ini yaitu daging dan jeroan keong pepaya (Melo sp.) segar yang telah dikeringkan dengan panas matahari. Bahan-bahan yang dibutuhkan untuk analisis proksimat meliputi akuades, kristal K2SO4, kjeltab jenis HgO, larutan H2SO4 pekat, larutan H2O2, asam borat (H3BO3)
4% yang mengandung indikator bromcherosol green 0,1% dan methyl red 0,1%
(2:1), larutan NaOH-Na2S2O3, larutan HCl 0,2 N, pelarut lemak (n-heksana),
larutan HCl 10%, larutan AgNO3 0,1 N, dan akuades. Bahan-bahan yang
digunakan pada tahap ekstraksi yaitu kloroform, etil asetat, dan metanol. Bahan-bahan yang dibutuhkan untuk uji aktivitas antioksidan, yaitu ekstrak daging dan
jeroan keong pepaya, kristal Diphenylpicrylhydrazyl (DPPH), metanol,
antioksidan sintetik BHT (Butylated Hydroxytoluena) sebagai pembanding dan es. Bahan-bahan yang dibutuhkan untuk uji fitokimia meliputi pereaksi Wagner,
pereaksi Meyer, pereaksi Dragendroff (uji alkaloid), kloroform, anhidra asetat, asam sulfat pekat (uji steroid), serbuk magnesium, amil alkohol (uji flavonoid), air
panas, larutan HCl 2 N (uji saponin), etanol 70%, larutan FeCl3 5% (uji fenol
hidrokuinon), peraksi Molisch, asam sulfat pekat (uji Molisch), pereaksi Benedict (uji Benedict), pereaksi Biuret (uji Biuret), dan larutan Ninhidrin 0,1% (uji Ninhidrin).
3.3 Metode Penelitian
Penelitian ini dilakukan melalui 4 tahap, yaitu: (1) pengambilan bahan baku dan preparasi bahan baku; (2) karakterisasi bahan baku; (3) ekstraksi komponen antioksidan; dan (4) uji komponen fitokimia
3.3.1 Pengambilan bahan baku dan preparasi bahan baku
Bahan baku keong pepaya (Melo sp.) diambil dari perairan pantai Cirebon. Keong pepaya (Melo sp.) dibeli dari berbagai nelayan di tempat pelelangan ikan perairan Cirebon. Keong pepaya diambil dengan cara mengumpulkan keong selama beberapa hari. Keong pepaya tidak terlalu banyak diperjual belikan karena merupakan hasil tangkapan samping di wilayah perairan Cirebon, tetapi keong pepaya merupakan salah satu komoditi favorit di lingkungan masyarakat. Pengambilan keong pepaya dilakukan setiap 2 hari sekali setelah nelayan menurunkan hasil tangkapannya dari kapal. Ukuran panjang keong pepaya yang digunakan dalam penelitian ini berkisar antara 10-16 cm.
Cangkang keong pepaya dipecahkan terlebih dahulu. Daging dan jeroan keong pepaya dipisahkan. Daging dan jeroan tersebut dipotong kecil-kecil kemudian dijemur di bawah sinar matahari selama 1 minggu. Proses pengeringan berlangsung lama karena pada saat pengeringan merupakan musim penghujan sehingga sulit dalam tahapan pengeringan.
Jeroan keong pepaya yang sudah kering dihancurkan dengan mengunakan blender sehingga diperoleh serbuk. Daging tidak mengalami proses penghancuran dengan menggunakan blender karena agak keras, sehingga untuk mengatasinya, daging keong pepaya dipotong tipis-tipis saja. Serbuk jeroan keong pepaya dan irisan tipis daging keong pepaya akan digunakan dalam proses ekstraksi dengan pelarut non polar, semi polar dan polar, serta analisis proksimat.
3.3.2. Karakterisasi bahan baku
Karakterisasi keong pepaya dilakukan melalui perhitungan rendemen dan uji proksimat.
a. Rendemen
Perhitungan rendemen dilakukan untuk mengetahui persentase rendemen daging dan jeroan keong pepaya baik dalam keadaan kering maupun segar. Perhitungan rendemen secara matematik adalah sebagai berikut:
b. Uji Proksimat
Analisis proksimat yang dilakukan terhadap keong pepaya pada keong kering baik pada daging maupun jeroan. Daging dan jeroan keong pepaya tersebut dikeringkan dengan menggunakan sinar matahari, kemudian dihaluskan dengan dipotong-potong tipis untuk daging dan dihancurkan dengan blender untuk jeroan. Analisis proksimat yang dilakukan adalah:
1) Kadar air (AOAC 2005)
Tahap pertama yang dilakukan untuk menganalisis kadar air adalah cawan
porselen dikeringkan dalam oven pada suhu 102-105 oC selama 30 menit. Cawan
tersebut diletakkan dalam desikator (kurang lebih 40 menit) hingga dingin kemudian ditimbang hingga beratnya konstan, kemudian daging dan jeroan keong pepaya ditimbang sebanyak 1-2 gram yang dimasukkan ke dalam cawan. Cawan
tersebut dimasukkan ke dalam oven dengan suhu 150 oC selama 8 jam. Cawan
tersebut diletakkan dalam desikator dan kemudian ditimbang. Kadar air ditentukan dengan rumus:
2) Kadar abu (AOAC 2005)
Tahap pertama yang dilakukan untuk menganalisis kadar abu yaitu sebanyak 1 gram sampel daging dan jeroan keong pepaya (Melo sp.) ditempatkan dalam cawan abu. Cawan tersebut dibakar sampai berasap dan berhenti ketika sampel sudah tidak mengeluarkan asap. Setelah itu cawan abu porselen diletakkan
dalam tanur pada suhu 600 oC selama 2 jam. Cawan abu didinginkan selama 30 menit kemudian ditimbang beratnya. Kadar abu ditentukan dengan rumus:
3) Analisis kadar abu tidak larut asam menurut SNI 01-3836-2000 (BSN 2000)
Abu hasil penetapan kadar abu total dilarutkan dalam 25 ml HCl 10% dan dididihkan selama 5 menit. Larutan tersebut kemudian disaring dengan kertas saring Whatman bebas abu dan dicuci dengan air suling sampai bebas klorida
(dengan peraksi AgNO3). Kertas saring Whatman kemudian dikeringkan dalam
oven. Abu yang telah kering kemudian diabukan kembali dalam tanur dengan menggunakan wadah cawan porselen. Cawan porselen tersebut kemudian didinginkan dalam desikator dan ditimbang hingga beratnya tetap (BSN 2000). Kadar abu tidak larut asam ditentukan dengan rumus:
4) Kadar protein (AOAC 2005)
Tahap-tahap yang dilakukan dalam analisis protein terdiri dari tiga: yaitu destruksi, destilasi dan titrasi.
(1) Tahap destruksi
Daging dan jeroan keong pepaya ditimbang sebanyak 0,25 gram, kemudian dimasukkan ke dalam tabung kjelhdal. Selanjutnya ditambahkan
0,25 gram selenium dan 3 ml H2SO4 pekat ke dalam tabung tersebut.
Tabung yang berisi larutan tersebut dimasukkan ke dalam alat pemanas. Proses destruksi dilakukan sampai larutan berwarna bening.
(2) Tahap destilasi
Isi labu dituangkan ke dalam labu destilasi, lalu ditambahkan akuades 50 ml. Air bilasan juga dimasukkan ke dalam alat destilasi dan ditambahkan larutan NaOH 40% sebanyak 20 ml. Cairan dalam ujung tabung kondensor ditampung dalam erlenmeyer 10 ml berisi larutan
yang ada di bawah kondensor. Destilasi dilakukan sampai diperoleh 10 ml destilat dan berwarna hijau kebiruan.
(3) Tahap titrasi
Titrasi dilakukan dengan menggunakan HCl 0,1 N sampai warna larutan erlenmeyer berubah menjadi merah muda. Kadar protein ditentukan dengan rumus:
5) Kadar lemak (AOAC 2005)
Penentuan kadar lemak dilakukan dengan menggunakan metode ekstraksi soxhlet. Daging dan jeroan keong pepaya sebanyak 2 gram dimasukkan ke dalam kertas saring dan dimasukkan ke dalam selongsong lemak, kemudian dimasukkan ke dalam labu lemak yang sudah ditimbang berat tetapnya dan disambungkan dengan tabung soxhlet. Selongsong lemak dimasukkan ke dalam ruang ekstraktor tabung soxhlet dan disiram dengan pelarut lemak berupa heksan sebanyak 150 ml. Tabung ekstraksi dipasang pada alat destilasi soxhlet, lalu dipanaskan selama 6 jam. Pelarut lemak yang ada dalam labu lemak didestilasi hingga semua pelarut lemak menguap. Pada saat destilasi pelarut akan tertampung di ruang ekstraktor, pelarut dikeluarkan sehingga tidak kembali ke dalam labu lemak, selanjutnya labu
lemak dikeringkan dalam oven pada suhu 100 oC selama 1 jam, setelah itu labu
didinginkan dalam desikator sampai beratnya konstan. Kadar lemak ditentukan dengan rumus:
3.3.3 Ekstraksi komponen antioksidan
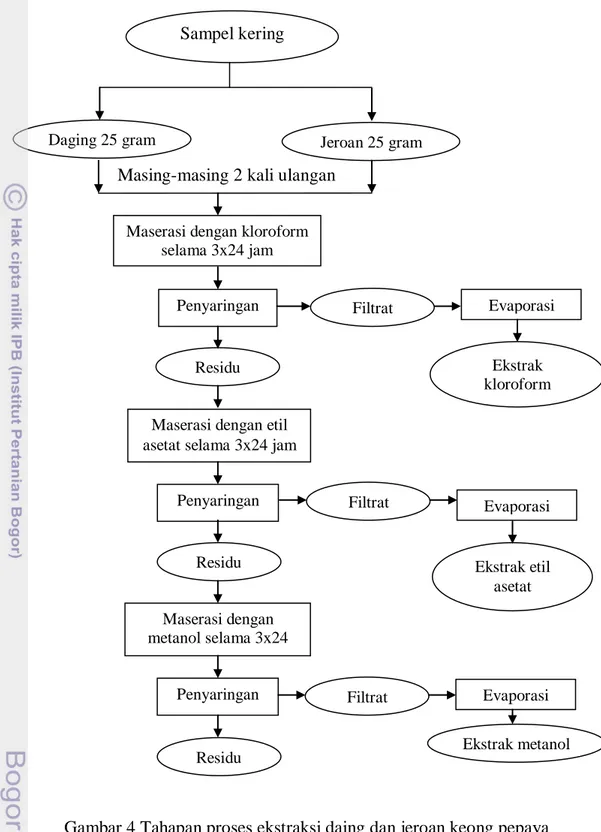
Ekstraksi komponen antioksidan dilakukan dengan menghasilkan ekstrak kasar terlebih dahulu. Komponen antioksidan diperoleh melalui ekstraksi bertingkat dengan menggunakan tiga jenis pelarut. Pelarut yang digunakan yaitu pelarut non polar (kloroform), semi polar (etil asetat), dan polar (metanol).
Sampel kering (daging dan jeroan) yang telah dihancurkan masing-masing sebanyak 25 gram, dimaserasi dengan menggunakan pelarut kloroform terlebih dahulu sebanyak 100 ml selama 3x24 jam. Hasil maserasi yang berupa larutan disaring dengan menggunakan kertas saring whatman 42 sehingga dihasilkan residu dan filtratnya. Residu yang dihasilkan akan dimaserasi selama 3x24 jam dengan menggunakan pelarut etil asetat sebanyak 100 ml, kemudian disaring kembali dengan menggunakan kertas saring whatman 42 yang dihasilkan residu dan filtratnya. Residu dari ekstrak etil asetat ini akan dimaserasi dengan pelarut metanol sebanyak 100 ml selama 3x24 jam. Hasil larutan maserasi tersebut akan disaring kembali dengan menggunakan kertas saring whatman 42 sehingga dihasilkan residu dan filtratnya.
Filtrat dari ekstraksi kloroform, etil asetat dan metanol akan dievaporasi sehingga pelarut terpisah dengan ekstraknya. Proses evaporasi menggunakan vakum evaporator pada suhu 40 °C sehingga dihasilkan ekstrak kasarnya. Ekstrak kasar ini kemudian akan dimasukkan ke dalam botol ekstrak yang akan digunakan untuk dilakukan uji aktivitas antioksidan dengan metode DPPH (Bois 1958 diacu
dalam Hanani et al. 2005) dan uji fitokimia secara kualitatif (Harborne 1987).
Masing-masing 2 kali ulangan
Gambar 4 Tahapan proses ekstraksi daing dan jeroan keong pepaya Sumber: Quinn (1988) diacu dalam Darusman et al. (1995)
yang dimodifikasi Sampel kering
Daging 25 gram
Maserasi dengan kloroform selama 3x24 jam
Penyaringan
Residu
Maserasi dengan etil asetat selama 3x24 jam
Penyaringan Evaporasi Ekstrak kloroform Maserasi dengan metanol selama 3x24 jam Residu Penyaringan Residu Filtrat Filtrat Evaporasi Ekstrak etil asetat Filtrat Evaporasi Ekstrak metanol Jeroan 25 gram
a. Uji aktivitas antioksidan (DPPH) (Blois 1958 diacu dalam Hanani et al. 2005)
Ekstrak kasar keong pepaya yang diperoleh dari ektraksi bertingkat dengan kloroform, etil asetat, metanol akan dilarutkan dengan pelarut metanol p.a dengan konsentrasi 200, 400, 600, 800 ppm. Antioksidan sintetik BHT digunakan sebagai pembanding dengan konsentrasi 2, 4, 6, 8 ppm. Larutan DPPH yang akan digunakan, dibuat dengan melarutkan kristal DPPH dalam pelarut metanol dengan konsentrasi 1 mM. Proses pembuatan larutan DPPH 1 mM dilakukan dalam kondisi suhu rendah dan terlindung dari cahaya matahari. Sebanyak 4,5 ml larutan uji atau pembanding direaksikan dengan 0,5 ml larutan DPPH 1 mM dalam tabung reaksi. Campuran tersebut diinkubasi pada suhu 37 °C selama 30 menit, kemudian diukur absorbansinya dengan menggunakan spektrofotometri UV-VIS Hitachi U-2800 pada panjang gelombang 517 nm, aktivitas antioksidan dari masing-masing sampel dan antioksidan pembanding BHT dinyatakan dengan persen inhibisi, yang dihitung dengan rumus sebagai berikut:
Nilai konsentrasi sampel (ekstrak ataupun antioksidan pembanding BHT) dan persen inhibisinya diplotkan masing-masing pada sumbu x dan y pada persamaan regresi linear. Persamaan regresi linear yang diperoleh dalam bentuk
persamaan y = a + bx, digunakan untuk mencari nilai IC50 (inhibitor
concentration 50%) dari masing-masing sampel dengan menyatakan nilai y
sebesar 50 dan nilai x yang akan diperoleh sebagai IC50. Nilai IC50 menyatakan
besarnya konsentrasi larutan sampel (ekstrak ataupun antioksidan pembanding BHT) yang dibutuhkan untuk mereduksi radikal bebas DPPH sebesar 50%.
b. Uji fitokimia (Harborne 1987)
Uji fitokimia dilakukan untuk menentukan komponen bioaktif yang terdapat pada ekstrak kasar keong keong pepaya masing-masing pelarut. Uji fitokimia yang dilakukan terdiri dari uji alkaloid, steroid/triterpenoid, flavonoid, saponin, fenol hidrokuinon, molisch, benedict, biuret, dan ninhidrin. Metode uji ini berdasarkan Harborne (1987).
a) Uji Alkaloid
Sejumlah sampel dilarutkan dalam beberapa tetes asam sulfat 2 N kemudian diuji dengan tiga pereaksi alkaloid yaitu, pereaksi Dragendorff, pereaksi Meyer, dan pereaksi Wagner. Hasil uji dinyatakan positif bila dengan pereaksi Meyer terbentuk endapan putih kekuningan, terbentuk endapan coklat dengan pereaksi Wagner dan terbentuk endapan merah hingga jingga dengan pereaksi Dragendorff.
b) Uji Steroid/triterpenoid
Sejumlah sampel dilarutkan dalam 2 ml kloroform dalam tabung reaksi. Anhrida asetat ditambahkan sebanyak 10 tetes kemudian ditambahkan asam sulfat pekat 3 tetes ke dalam campuran tersebut. Hasil uji positif mengandung steroid dan triterpenoid yaitu dengan terbentuknya larutan berwarna merah untuk pertama kali kemudian berubah menjadi biru dan hijau.
c) Uji Flavonoid
Sejumlah sampel ditambah serbuk magnesium 0,1 mg dan 0,4 ml amil alkohol (campuran asam klorida 37% dan etanol 95% dengan volume yang sama) dan 4 ml alkohol kemudian campuran dikocok. Hasil uji positif sampel mengandung flavonoid ditunjukkan dengan terbentuknya warna merah, kuning atau jingga pada lapisan amil alkohol.
d) Uji Saponin
Saponin dapat dideteksi dengan uji busa dalam air panas. Busa yang stabil selama 30 menit dan tidak hilang pada penambahan 1 tetes HCl 2 N menunjukkan adanya saponin.
e) Uji Fenol hidrokuinon (pereaksi FeCl3)
Sejumlah sampel diekstrak dengan 20 ml etanol 70%. Larutan yang
dihasilkan diambil sebanyak 1 ml kemudian ditambahkan 2 tetes larutan FeCl3
5%. Hasil uji positif sampel mengandung Fenol hidrokuinon ditunjukkan dengan terbentuknya warna hijau atau hijau biru.
f) Uji Molisch
Sebanyak 1 ml larutan sampel diberi 2 tetes pereaksi Molish dan 1 ml asam sulfat pekat melalui dinding tabung. Uji positif yang menunjukkan adanya
karbohidrat ditandai terbentuknya kompleks berwarna ungu diantara 2 lapisan cairan.
g) Uji Benedict
Larutan sampel sebanyak 8 tetes dimasukkan ke dalam 5 ml pereaksi Benedict. Campuran dikocok dan dididihkan selama 5 menit. Hasil uji positif sampel mengandung gula pereduksi ditunjukkan dengan terbentuknya larutan berwarna hijau, kuning atau endapan merah bata.
h) Uji Biuret
Sebanyak 1 ml larutan sampel ditambahkan 4 ml pereaksi Biuret. Campuran dikocok dengan seksama. Hasil uji positif sampel mengandung senyawa peptida dengan terbentuknya larutan berwarna ungu.
i) Uji Ninhidrin
Sebanyak 2 ml larutan sampel ditambah beberapa tetes larutan ninhidrin 0,1%. Campuran dipanaskan dalam penangas air selama 10 menit. Hasil uji positif sampel mengandung asam amino ditunjukkan warna biru.
4 HASIL DAN PEMBAHASAN
4.1 Karakteristik Bahan Baku
Bahan baku keong pepaya (Melo sp.) merupakan bahan baku yang diambil di Perairan Cirebon Jawa Barat. Bahan baku yang digunakan merupakan keong pepaya dalam bentuk kering. Proses pengeringan ini ditujukan untuk megurangi kadar air keong pepaya sehingga keong ini lebih awet. Proses pengeringan dilakukan di bawah sinar matahari. Keong pepaya dalam keadaan segar memiliki tekstur daging yang keras dan sedikit kenyal. Jeroannya memiliki tekstur yang kenyal dan tidak lembek. Cangkang keong pepaya sangat keras dan sangat sulit untuk dihancurkan.
Keong pepaya yang digunakan dalam penelitian ini terdiri dari daging dan jeroan yang dikeringkan. Daging keong pepaya memiliki tektsur yang sangat keras, berwarna cokelat kehitaman yang garis coklatnya masih sedikit terlihat. Jeroan yang dikeringkan memiliki tekstur yang tidak telalu keras dan berwarna cokelat kehitaman. Daging dan jeroan setelah kering dihancurkan, jeroan diblender sedangkan daging keong pepaya hanya dipotong kecil-kecil karena memiliki tekstur yang sangat keras. Bahan baku yang digunakan harus halus karena dapat mempermudah saat analisis proksimat serta saat proses ekstraksi dengan berbagai jenis pelarut, hal ini perlu dilakukan agar memperluas kontak antara bahan baku dan pelarut. Bahan baku daging dan jeroan keong pepaya ini disimpan dalam wadah tertutup yang diletakkan di dalam lemari pendingin.
Karakterisasi bahan baku dilakukan untuk mengetahui sifat dari bahan baku yang digunakan. Karakterisasi yang dilakukan pada penelitian ini yaitu pengukuran rendemen dan uji proksimat.
4.1.1 Rendemen
Rendemen merupakan presentasi bagian tubuh bahan baku yang dapat dimanfaatkan, semakin tinggi nilai rendemen suatu bahan baku maka semakin tinggi nilai ekonomis suatu bahan. Perhitungan rendemen didapatkan dengan membandingkan antara berat masing-masing bahan dengan berat total keong pepaya. Keong pepaya ditimbang berat utuhnya yaitu berat keong beserta cangkangnya. Bagian daging dan jeroannya dipisahkan, ditimbang berat daging,
jeroan serta cangkangnya. Persentasi rendemen keong pepaya dapat dilihat pada Gambar 5.
Gambar 5 Diagram batang persentasi rendemen keong pepaya
Hasil perhitungan rendemen dapat diketahui bahwa nilai rendemen tertinggi ada pada daging keong pepaya. Nilai rendemen daging keong pepaya melebihi setengah dari berat total keong pepaya yaitu 55,18%. Hasil ini dapat membuktikan bahwa keong pepaya merupakan salah satu bahan yang dapat dimanfaatkan dagingnya sebagai bahan baku yang diolah lebih lanjut. Daging keong pepaya juga dapat dimanfaatkan sebagai bahan baku yang kaya protein karena berdasarkan hasil pengukuran nilai kandungan gizi, daging keong pepaya memiliki nilai protein yang sangat tinggi. Bahan baku yang kaya protein memiliki fungsi yang baik bagi tubuh yaitu dapat membentuk jaringan baru dan mempertahankan jaringan yang telah ada (Winarno 1992).
Hasil perhitungan jeroan keong pepaya dapat dikatakan kecil karena hanya sebesar 11,06%. Pemanfaatan menggunakan bagian jeroan dari suatu bahan baku memang masih jarang pengembangannya. Pemanfaatan jeroan tetap dapat dikembangkan. Manusia umumnya tidak ingin mengkonsumsi jeroan, namun penggunaan jeroan tidak hanya dikonsumsi. Pemanfaatan jeroan dapat diambil ekstraknya sebagai komponen bioaktif.
Hasil perhitungan cangkang keong pepaya sebesar 30,58%. Hasil rendemen cangkang jauh lebih tinggi bila dibandingkan dengan hasil perhitungan rendemen jeroan. Cangkang keong diketahui banyak mengandung kalsium karbonat. Sebagian struktur cangkang terbuat dari kalsium karbonat, yaitu 89-99%
55,18 11,06 30,58 0 10 20 30 40 50 60
Daging Jeroan Cangkang
R en d em e n ( % ) Bagian Tubuh
dan sisanya 1-2% fosfat, bahan organik conchiolin dan air (Darma 1988 diacu dalam Purwaningsih 2007). Tingginya kandungan kalsium karbonat pada cangkang keong ini dapat dijadikan fortifikasi bahan pangan yang kaya akan kalsium.
4.1.2 Kandungan gizi bahan baku
Zat gizi berperan dalam penyediaan energi, untuk proses metabolisme dan proses pertumbuhan, sebagai zat pembangun dan zat pengatur, serta membentuk jaringan baru dan mempertahankan jaringan yang pernah ada (Winarno 1992).
Kandungan gizi bahan baku keong pepaya dilakukan dengan uji proksimat. Uji proksimat ini dilakukan untuk memperoleh data kasar komposisi kimia suatu bahan baku. Uji proksimat yang dilakukan yaitu dengan menguji bagian daging dan jeroannya untuk mengetahui komposisi kimia keong pepaya secara terpisah antara daging dan jeroan. Pengujian proksimat keong pepaya dilakukan dengan menggunakan sampel kering. Komposisi kimia hasil uji proksimat daging dan jeroan keong pepaya dapat dilihat pada Tabel 4.
Tabel 4 Hasil uji proksimat daging dan jeroan keong pepaya kering
Komponen Nilai
Daging Jeroan
Kadar air (%) Kadar abu (%)
Kadar abu tidak larut asam (%) Kadar Lemak (%) Kadar Protein (%) Kadar Karbohidrat (%) 28,54 7,40 0,19 1,08 61,58 1,40 24,85 9,20 0,59 9,71 52,84 3,40
Kadar air merupakan jumlah air yang terkandung dalam suatu bahan. Kadar air berpengaruh terhadap keawetan suatu bahan. Apabila kadar air tinggi maka bahan tersebut akan cepat mengalami penurunan mutu. Kandungan air dapat mempengaruhi penampakan, karakteristik maupun daya awet suatu bahan yang mengakibatkan mudahnya bakteri, kapang dan khamir untuk berkembang sehingga mempercepat kebusukan (Winarno 1992). Kadar air keong pepaya daging dan jeroan yaitu 28,54% dan 24,85%. Dari data ini dapat diketahui bahwa kadar air pada daging keong pepaya lebih tinggi dibandingkan dengan kadar air pada jeroan. Perbedaan kadar air pada daging dan jeroan tidak terlalu berpengaruh. Perbedaan ini dikarenakan pada saat proses pengeringan, kondisi