KERENTANAN Plutella xylostella DARI GARUT, JAWA
BARAT, TERHADAP LIMA JENIS INSEKTISIDA
KOMERSIAL DAN EKSTRAK Tephrosia vogelii
MASAIDAH CARDI
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Kerentanan Plutella xylostella dari Garut, Jawa Barat, terhadap Lima Jenis Insektisida Komersial dan Ekstrak Tephrosia vogelii adalah benar karya saya dengan arahan dari pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan di dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Mei 2014
Masaidah cardi
ABSTRAK
MASAIDAH CARDI. Kerentanan Plutella xylostella dari Garut, Jawa Barat, terhadap Lima Jenis Insektisida Komersial dan Ekstrak Tephrosia vogelii. Dibimbing oleh DJOKO PRIJONO.
Plutella xylostella merupakan hama penting pada kubis yang dapat menurunkan produksi secara nyata. Petani sering mengendalikan hama tersebut menggunakan insektisida sintetik secara intensif sehingga dapat menyebabkan resistensi hama terhadap insektisida. Penelitian ini bertujuan menentukan kerentanan larva P. xylostella asal Garut, Jawa Barat, terhadap 5 jenis insektisida komersial, yaitu deltametrin, emamektin benzoat, klorantraniliprol, profenofos, dan spinetoram serta ekstrak Tephrosia vogelii. Formulasi 5 jenis insektisia komersial tersebut dan ekstrak etil asetat daun T. vogelii diuji terhadap larva instar II P. xylostella menggunakan metode celup daun dengan pemberian daun kubis perlakuan selama 48 jam. Jumlah larva yang mati dihitung setiap hari sampai 96 jam setelah perlakuan (JSP), kemudian data mortalitas larva diolah dengan analisis probit. Berdasarkan LC95 pada 96 JSP, deltametrin dan profenofos
memiliki toksisitas yang rendah terhadap larva P. xylostella, sementara klorantraniliprol memiliki toksisitas sedang. LC95 tiga jenis insektisida tersebut
berturut-turut 3677.09, 10872.00, dan 362.36 mg b.a./l yang masing-masing 367.7, 14.5, dan 9.2 kali lipat lebih tinggi daripada konsentrasi anjuran masing-masing. Sementara itu, larva P. xylostella masih rentan terhadap emamektin benzoat, spinetoram, dan ekstrak T. vogelii. LC95 emamektin benzoat (9.28 mg
b.a./l), dan spinetoram (3.63 mg b.a./l) masing-masing 1.1 dan 3.3 kali lebih rendah daripada konsentrasi anjuran masing-masing. Selain itu, LC95 ekstrak T. vogelii (2907 mg/l) lebih rendah daripada LC95 deltametrin dan profenofos. Selain
mengakibatkan kematian, insektisida emamektin benzoat dan spinetoram dapat menghambat perkembangan pembentukan pupa, sedangkan deltametrin, emamektin benzoat, dan profenofos mengakibatkan penghambatan kemunculan imago.
ABSTRACT
MASAIDAH CARDI. Susceptibility of Plutella xylostella from Garut, West Java, to Five Commercial Insecticides and Tephrosia vogelii Extract. Supervised by DJOKO PRIJONO.
Plutella xylostella is a major pest of cabbage worldwide which can reduce cabbage yield significantly. Farmers often use insecticides to control the pest, but intensive insecticide use can lead to the development of pest resistance to insecticides. This study was conducted to determine the susceptibility of P. xylostella from Garut, West Java, to five commercial insecticides, i.e. chloranthraniliprole, deltamethrin, emamectin benzoat, profenofos, and spinetoram, as well as to Tephrosia vogelii extract. The commercial formulations of those five insecticides and ethyl acetate T. vogelii leaf extract were tested against second instar larvae P. xylostella with a leaf-dip feeding method in which the feeding treatment was given for 48 hours. The number of dead larvae was counted daily until 96 hours after treatment (HAP), then larval mortality data were analyzed by the probit method. Based on LC95 at 96 JSP, deltamethrin and
profenofos had low toxicity on P. xylostella larvae, while chloranthraniliprole was moderately toxic. LC95 of these insecticides were 3677.09, 10872.00, and 362.36
mg a.i./l, respectively, which were 367.7, 14.5, and 9.2-fold higher than their respective recommended field rates. On the other hand, P. xylostella larvae were still susceptible to emamectin benzoat, spinetoram, and T. vogelii extract. LC95 of
emamectin benzoate and spinetoram were 9.28 and 3.63 mg a.i./l, respectively, which were 1.1 and 3.3-fold lower that their respective recommended field rate. Meanwhile, LC95 of T. vogelii extract was 2907 mg/l which was lower than that of
deltamethrin and profenofos. In addition to lethal effect, emamectin benzoate and spinetoram could inhibit the formation of pupal development, whereas deltamethrin, emamectin benzoate, and profenofos caused in inhibition of adult emergence.
©Hak Cipta Milik IPB, tahun 2014 Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
KERENTANAN Plutella xylostella DARI GARUT, JAWA
BARAT, TERHADAP LIMA JENIS INSEKTISIDA
KOMERSIAL DAN EKSTRAK Tephrosia vogelii
MASAIDAH CARDI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian pada
Departemen Proteksi Tanaman
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
Judul Skripsi : Kerentanan Plutella xylostella dari Garut, Jawa Barat, terhadap Lima Jenis Insektisida Komersial dan Ekstrak
Tephrosia vogelii
Nama Mahasiswa : Masaidah Cardi NIM : A34100027
Disetujui oleh
Ir. Djoko Prijono, MAgrSc. Dosen Pembimbing
Diketahui oleh
Dr. Ir. Abdjad Asih Nawangsih, MSi. Ketua Departemen Proteksi Tanaman
PRAKATA
Puji dan syukur ke hadirat Allah SWT yang telah mernberikan rahmat dan hidayah-Nya sehingga penulis dapat menyelesaikan skripsi yang berjudul
“Kerentanan Plutella xylostella dari Garut, Jawa Barat, terhadap Lima Jenis Insektisida Komersial dan Ekstrak Tephrosia vogelii”. Penelitian dan penulisan skripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Pertanian di Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor (IPB). Penelitian dilaksanakan di laboratorium Departemen Proteksi Tanaman IPB dari Januari sampai Maret 2014 dengan dukungan dana sebagian dari Program Kreativitas Mahasiswa, Direktorat Jenderal Pendidikan Tinggi,
Ucapan terima kasih penulis sampaikan kepada
1. Ir. Djoko Prijono, MAgrSc. selaku dosen pembimbing akademik dan skripsi yang senantiasa memberikan bimbingan, pengetahuan, saran, masukan, dan arahan kepada penulis.
2. Dr. Ir. Gede Suastika, MSc. selaku dosen penguji tamu yang telah memberikan saran dan motivasi kepada penulis.
3. Bapak Didi Cardi, Ibu Lilis Mulyasaroh, Asep S, Sufi N, Nurarifin, nenek Hj. Enok, beserta keluarga lainnya yang selalu memberi semangat, doa, dan dukungan dalam belajar.
4. Rekan-rekan di Laboratorium Fisiologi dan Toksikologi Serangga, khususnya kepada Wirathazia Enbya L. Chenta, Aulia Rakhman, Muhammad Sigit Susanto SP., Trijanti A. Widinni, SP., dan Annisa Nurfajrina SP. yang telah memberikan saran dan semangat.
5. Teman-teman di Departemen Proteksi Tanaman angkatan 47 yang telah menjadi teman seperjuangan dan Nurohmat yang telah memberikan motivasi dan perhatian.
6. Direktorat Jenderal Pendidikan Tinggi, Kementerian Pendidikan dan Kebudayaan atas beasiswa Bidik Misi yang diberikan kepada penulis melalui IPB.
7. Sahabat pemondokan Jaika khususnya Cucu Cahyati, Elin Tasliah, Ari Sukma Kinanti, Sarah Soraya, Cholila Widya H, Ivanya Meisya, dan Avilia P yang telah memberikan semangat dalam pelaksanaan tugas akhir.
Semoga skripsi ini bermanfaat bagi pengembangan pengetahuan tentang pestisida dan bagi pembaca yang memerlukan.
Bogor, Mei 2014
DAFTAR ISI
DAFTAR TABEL viii
DAFTAR GAMBAR viii
DAFTAR LAMPIRAN ix
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 4
Manfaat Penelitian 4
BAHAN DAN METODE 5
Tempat dan Waktu Penelitian 5 Bahan Insektisida Komersial 5 Bahan Tumbuhan Sumber Ekstrak 5 Perbanyakan Tanaman Pakan 5 Pembiakan Serangga Uji 5
Ekstraksi T. vogelii 6
Uji Toksisitas di Laboratorium 6
Uji Pendahuluan 6
Uji Lanjutan 7
HASIL DAN PEMBAHASAN 8
Toksisitas Insektisida Uji terhadap Larva P. xylostella 8 Pengaruh Insektisida Uji terhadap Perkembangan P. xylostella 13
SIMPULAN DAN SARAN 15
DAFTAR PUSTAKA 16
LAMPIRAN 19
DAFTAR TABEL
1 Toksisitas lima jenis insektisida komersial dan ekstrak T. vogelii terhadap larva P. xylostella 11 2 Pengaruh perlakuan lima jenis insektisida komersial dan ekstrak T. vogelii
terhadap persentase pupa yang terbentuk dan imago P. xylostella yang
muncul 14
DAFTAR GAMBAR
1 Struktur kimia rotenolon, tefrosin, rotenon, dan deguelin 3 2 Perkembangan tingkat mortalitas larva P. xylostella pada perlakuan
DAFTAR LAMPIRAN
1 Peta lokasi pengambilan sampel daun T. vogelii di Kawasan Agropolitan, Kecamatan Pacet, Kabupaten Cianjur, Jawa Barat 20 2 Peta lokasi pengambilan sampel larva P. xylostella di Desa Sukahurip,
Kecamatan Cigedug, Kabupaten Garut, Jawa Barat 21 3 Mortalitas larva P. xylostella pada perlakuan uji pendahuluan deltametrin 22 4 Mortalitas larva P. xylostella pada perlakuan uji pendahuluan emamektin
benzoat 22
5 Mortalitas larva P. xylostella pada perlakuan uji pendahuluan
klorantraniliprol 22
6 Mortalitas larva P. xylostella pada perlakuan uji pendahuluan profenofos 22 7 Mortalitas larva P. xylostella pada perlakuan uji pendahuluan spinetoram 23 8 Mortalitas larva P. xylostella pada perlakuan uji pendahuluan ekstrak T.
vogelii 23
9 Mortalitas larva P. xylostella pada perlakuan uji lanjutan deltametrin 23 10 Mortalitas larva P. xylostella pada perlakuan uji lanjutan emamektin
benzoat 23
11 Mortalitas larva P. xylostella pada perlakuan uji lanjutan klorantraniliprol 24 12 Mortalitas larva P. xylostella pada perlakuan uji lanjutan profenofos 24 13 Mortalitas larva P. xylostella pada perlakuan uji lanjutan spinetoram 24 14 Mortalitas larva P. xylostella pada perlakuan uji lanjutan ekstrak
T. vogelii 24
15 Sidik ragam persentase pupa P. xylostella yang terbentuk pada perlakuan
.deltametrin 25
16 Sidik ragam persentase imago P. xylostella yang muncul pada perlakuan
.deltametrin 25
17 Sidik ragam persentase pupa P. xylostella yang terbentuk pada perlakuan
.emamektin .benzoat 25
18 Sidik ragam persentase imago P. xylostella yang muncul pada perlakuan
.emamektin benzoat 25
19 Sidik ragam persentase pupa P. xylostella yang terbentukpada perlakuan
klorantraniliprol 25
20 Sidik ragam persentase imago P. xylostella yang muncul pada perlakuan
klorantraniliprol 26
21 Sidik ragam persentase pupa P. xylostella yang terbentukpada perlakuan
.profenofos 26
22 Sidik ragam persentase imago P. xylostella yang muncul pada perlakuan
.profenofos 26
23 Sidik ragam persentase pupa P. xylostella yang terbentuk pada perlakuan
.spinetoram 26
24 Sidik ragam persentase imago P. xylostella yang muncul pada perlakuan
.spinetoram 26
25 Sidik ragam persentase pupa P. xylostella yang terbentuk pada perlakuan
.ekstrak T. vogelii 27
26 Sidik ragam persentase imago P. xylostella yang muncul pada perlakuan
PENDAHULUAN
Latar Belakang
Kubis (Brassica oleracea var. capitata) merupakan salah satu tanaman sayuran utama yang banyak dibudidayakan di daerah dataran tinggi. Budi daya kubis dihadapkan pada berbagai kendala, di antaranya serangan hama dan penyakit. Salah satu hama utama pada kubis yaitu Plutella xylostella (L.) (Lepidoptera: Yponomeutidae). Hama tersebut biasanya menyerang tanaman kubis yang belum membentuk krop, namun dapat menyerang krop jika populasi tinggi dan hama pesaingnya yaitu Crocidolomia pavonana (F.) (Lepidoptera: Crambidae) tidak ada (Sastrosiswojo dan Setiawati 1993).
Serangan hama P. xylostella dapat mengakibatkan kerusakaan ringan sampai berat. Kerusakan berat pada daun akan terjadi apabila populasi larva P. xylostella tinggi. Larva tersebut akan memakan seluruh daun dan hanya menyisakan tulang-tulang daun. Kerusakan ringan dapat mengakibatkan penurunan kualitas kubis, sedangkan kerusakan berat menyebabkan tanaman tidak dapat dipanen sama sekali (Sastrosiswojo dan Setiawati 1993).
Petani sering melakukan pengendalian hama P. xylostella dengan menggunakan insektisida sintetik. Hal ini karena petani menganggap bahwa aplikasi pestisida dapat memberikan hasil cepat dan nyata, serta tidak memerlukan banyak tenaga (Djojosumarto 2008). Namun demikian, penggunaan insektisida sintetik yang intensif dapat mengakibatkan penurunan kerentanan hama sasaran terhadap insektisida yang sering digunakan. Bila kepekaan hama sasaran terhadap insektisida berkurang, insektisida tersebut tidak akan efektif lagi dalam mengendalikan hama sasaran. Hama yang telah mengalami penurunan kerentanan terhadap insektisida hingga tingkat tertentu dikategorikan sudah resisten (Georghiou dan Mellon 1983).
Resistensi merupakan fenomena evolusi terjadinya seleksi gen resisten pada serangga oleh aplikasi insektisida (Denholm dan Horowitz 2001). Gen tersebut menyandikan berbagai mekanisme, terutama peningkatan detoksifikasi insektisida atau penurunan kepekaan bagian sasaran di dalam tubuh serangga. Penyemprotan yang dilakukan secara intensif dapat menyebabkan proses resistensi serangga berkembang dengan cepat sehingga mengakibatkan penurunan efikasi insektisida (Denholm dan Horowitz 2001). Akibatnya jumlah serangga yang mati sedikit atau tidak ada sama sekali, meskipun telah dilakukan penyemprotan dengan menggunakan dosis normal atau dosis yang lebih tinggi (Djojosumarto 2008; Yu 2008).
P. xylostella merupakan serangga hama yang cepat berkembang menjadi resisten terhadap insektisida komersial. Kasus resistensi hama P. xylostella
terhadap insektisida dilaporkan pertama kali oleh Ankersmith (1953), yaitu resistensi P. xylostella strain Lembang terhadap DDT dengan dosis penggunaan meningkat sebesar 9 kali dibandingkan dengan dosis normal. Hama tersebut juga telah dilaporkan resisten terhadap beberapa jenis insektisida lain. Moekasan et al.
(2004) melaporkan bahwa P. xylostella asal Lembang, Pangalengan, Kejajar/Dieng dan Batu sangat resisten terhadap deltametrin, profenofos, dan
2
Pangalengan masih cukup rentan terhadap insektisida tersebut. Udiarto dan Setiawati (2007) juga melaporkan bahwa P. xylostella dari daerah Lembang, Pangalengan, Garut, dan Buleleng telah resisten terhadap deltametrin dan profenofos tetapi masih cukup rentan terhadap spinosad. Lebih lanjut dilaporkan bahwa P. xylostella asal Lembang, Pangalengan, dan Garut telah resisten terhadap abamektin.
Resistensi P. xylostella terhadap insektisida komersial juga telah sering dilaporkan di negara lain. Sebagai contoh, di Korea P. xylostella dilaporkan resisten terhadap organofosfat dan karbamat dengan nisbah resistensi (NR) 2.5-4.3 (Kim et al. 1990), di Jepang resisten terhadap piretroid dengan NR 5.6 (Hama 1990), di Hawaii agak resisten terhadap spinosad dengan NR 0.9-3.2 (Sparks et al.
2011), di Brazil resisten terhadap abamektin dengan NR 61.7 (Santos et al. 2011), dan di Tiongkok, populasi larva P. xylostella dari 6 lokasi di Provinsi Guangddong dilaporkan resisten terhadap klorantraniliprol dengan NR 2.6–2000 (Troczka et al. 2012).
Dalam rangka mengembangkan strategi pengelolaan resistensi hama terhadap insektisida perlu dilakukan pemantauan kerentanan hama terhadap insektisida secara rutin (Brent 1986). Strategi pengelolaan resistensi yang dapat dilakukan antara lain menggunakan insektisida hanya jika benar-benar diperlukan sehingga dapat mencegah atau menunda terjadinya resistensi, tidak menggunakan insektisida yang golongan kimia atau cara kerjanya sama secara terus menerus atau melakukan pergiliran (rotasi) penggunaan insektisida, memerhatikan rekomendasi dosis penggunaan dengan saksama, dan menggunakan campuran insektisida yang tepat untuk menghindarkan atau menunda resistensi (Denholm et al. 1998; Djojosumarto 2008).
Lima jenis insektisida komersial yang akan diuji toksisitasnya terhadap larva P. xylostella dalam penelitian ini ialah deltametrin, emamektin benzoat, klorantraniliprol, profenofos, dan spinetoram. Deltametrin merupakan insektisida yang termasuk golongan piretroid yang bersifat racun kontak dan racun perut, serta memiliki efek knockdown yang kuat (Khambay dan Jewess 2010). Emamektin benzoat merupakan analog sintetik dari avermektin B1, yaitu senyawa makrolida yang dihasilkan dari fermentasi bakteri tanah Streptomyces avermitilis, bersifat racun kontak, racun perut dan translaminar (Pitterna 2007). Klorantraniliprol termasuk golongan senyawa antranilik diamida yang bersifat sebagai racun perut dan racun kontak (Cordova et al. 2006). Profenofos merupakan insektisida golongan organofosfat yang bersifat racun perut dan racun kontak berspektrum luas yang biasa digunakan sebagai insektisida dan akarisida nonsistemik (Yu 2008). Spinetoram merupakan turunan semisintetik dari spinosin J dan spinosin L, (golongan makrolida) yang bersifat racun kontak dan racun perut (Crouse et al. 2007).
3 Daun kacang babi Tephrosia vogelii (Leguminosae) merupakan salah satu bahan insektisida nabati yang potensial. Morallo-Rejesus (1986) melaporkan bahwa ekstrak T. vogelii yang diaplikasikan secara kontak dengan dosis 11 mg/g bobot tubuh larva menyebabkan kematian larva P. xylostella sebesar 50%. Wulan (2010) melaporkan bahwa ekstrak heksana daun T. vogelii memiliki aktivitas insektisida yang kuat terhadap larva C. pavonana dengan LC50 0.14%. Abizar dan
Prijono (2010) melaporkan bahwa ekstrak etil asetat daun T. vogelii juga memiliki aktivitas insektisida yang kuat terhadap larva C. pavonana dengan LC50 0.091%.
Hasil serupa dilaporkan oleh Nailufar (2011) yang menunjukkan bahwa LC50
ekstrak etil asetat daun T. vogelii terhadap serangga hama tersebutadalah 0.11%. Daun T. vogelii mengandung bahan aktif rotenon, deguelin, tefrosin, dan rotenolon (Gambar 1) (Delfel et al. 1970; Lambert et al. 1993; Caboni et al.
2005). Rotenon bersifat sebagai racun perut dengan efek racun kontak lebih terbatas, tidak sistemik, dan bersifat selektif (Matsumura 1985; Djojosumarto 2008). Insektisida nabati tersebut bekerja lambat dalam membunuh serangga dengan cara menghambat proses respirasi sel di dalam mitokondria, yaitu menghambat transfer elektron antara NADH dehidrogenase dan koenzim Q pada kompleks I dari rantai transpor elektron di dalam mitokondria sehingga menurunkan produksi ATP dan sel akan kekurangan energi. Hal tersebut lambat laun akan mengakibatkan terjadinya kelumpuhan berbagai sistem otot dan jaringan tubuh lainnya, yang akhirnya menyebabkan kematian (Hollingworth 2001).
4
Tujuan Penelitian
Penelitian ini bertujuan menentukan kerentanan larva P. xylostella yang berasal dari Garut Jawa Barat, terhadap lima jenis insektisida komersial, yaitu deltametrin, emamektin benzoat, klorantraniliprol, profenofos, dan spinetoram serta ekstrak daun T. vogelii. Sebagai data penunjang, larva P. xylostella yang bertahan hidup pada perlakuan 3 taraf konsentrasi terendah setiap insektisida uji tetap diperlihara untuk menentukan persentase pembentukan pupa dan kemunculan imago.
Manfaat Penelitian
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium Fisiologi dan Toksikologi Serangga, Departemen Proteksi Tanaman, Fakultas Pertanian Institut Pertanian Bogor (IPB), dari Januari sampai Maret 2014.
Bahan Insektisida Komersial
Insektisida komersial yang diuji ialah deltametrin (Decis 25 EC, bahan aktif [b.a.] 25 g/l), emamektin benzoat (Proclaim 19 EC, b.a. 19 g/l), klorantraniliprol (Prevathon 50 SC, b.a. 50 g/l), profenofos (Curacron 500 EC, b. a. 500 g/l), dan spinetoram (Endure 120 SC, b. a. 120 g/l), yang diperoleh dari salah satu kios pertanian di Bogor. Konsentrasi anjuran deltametrin, emamektin benzoat, klorantraniliprol, dan profenofos terhadap hama P. xylostella masing-masing setara dengan 10, 10, 40, dan 750 mg b.a./l cairan semprot. Konsentrasi anjuran emamektin benzoat didasarkan pada konsentrasi anjuran formulasi Proclaim 5 SG (b.a. emamektin benzoat 50 g/l). Endure 120 SC belum terdaftar untuk mengendalikan hama P. xylostella pada kubis di Indonesia sehingga sebagai acuan digunakan konsentrasi anjuran spinosad yang merupakan senyawa induk dari spinetoram, yaitu 12 mg b.a./l.
Bahan Tumbuhan Sumber Ekstrak
Bahan tumbuhan yang digunakan sebagai sumber ekstrak adalah daun T. vogelii yang berasal dari Kawasan Agropolitan, Kecamatan Pacet, Kabupaten Cianjur, Jawa Barat (Lampiran 1).
Perbanyakan Tanaman Pakan
Benih kubis ‘KK Cross’ disemai pada nampan semai 50-lubang yang berisi media tanah dan pupuk kandang. Pada saat penyemaian dilakukan pemupukan dengan pupuk majemuk ‘Dekastar’ (NPK 18-9-10+TE). Setelah berumur 4 minggu, bibit kubis dipindahkan ke dalam polybag berkapasitas 5 L yang berisi campuran tanah dan pupuk kandang dengan perbandingan 3:1 (v/v). Pada tiap
polybag ditanam 1 bibit kubis. Pemeliharaan yang dilakukan meliputi pemupukan, penyiraman, penyulaman, penyiangan gulma, dan pengendalian hama secara mekanis. Daun dari tanaman kubis yang berumur 2 bulan digunakan sebagai pakan larva P. xylostella dan untuk pengujian (Abizar dan Prijono 2010).
Pembiakan Serangga Uji
6
telur menetas, larva dipindahkan ke dalam wadah plastik (35 cm x 25 cm x 6 cm) yang dialasi kertas stensil dan bagian tutup wadah diberi jendela kasa. Larva diberi pakan daun kubis bebas pestisida dan alas kertas stensil diganti setiap hari. Setelah larva membentuk pupa, pupa dimasukkan ke dalam kurungan kasa sampai imago muncul. Pemeliharaan imago dan pengumpulan telur dilakukan dengan cara seperti yang dijelaskan sebelumnya. Larva instar II dari keturunan generasi II digunakan untuk pengujian.
Ekstraksi T. vogelii
Daun T. vogelii yang diambil dari Kawasan Agropolitan, Kecamatan Pacet, Kabupaten Cianjur, langsung dipotong kecil-kecil menggunakan gunting, kemudian dikeringkan di dalam kamar asap selama 7 hari. Potongan daun T. vogelii yang sudah kering digiling menggunakan blender hingga menjadi serbuk, kemudian diayak dengan menggunakan pengayak kawat kasa berjalinan 0.5 mm. Hasil pengayakan sebanyak 200 gram direndam dalam 1600 ml pelarut etil asetat menggunakan labu erlenmeyer 2000 ml. Perendaman dilakukan sekurang-kurangnya selama 24 jam dan diulang sebanyak 3 kali (Nailufar 2011). Cairan hasil rendaman disaring dengan menggunakan corong kaca bertingkat yang setiap corong dialasi dengan kertas saring Whatman No. 41 diameter 185 mm. Pelarut dalam cairan hasil penyaringan diuapkan dengan menggunakan rotary evaporator
pada suhu 50 ºC dan tekanan 240 mbar sehingga diperoleh ekstrak kasar daun T. vogelii. Sebelum digunakan untuk pengujian, ekstrak disimpan di dalam lemari es pada suhu ± 4 ºC.
Uji Toksisitas di Laboratorium
Pengujian toksisitas insektisida dilakukan melalui dua tahap, yaitu uji pendahuluan dan uji lanjutan. Larva instar II P. xylostella yang digunakan pada uji pendahuluan dan uji lanjutan merupakan keturunan dari larva yang diambil dari pertanaman kubis di Kampung Cirata, Desa Sukahurip, Kecamatan Cigedug, Kabupaten Garut, Jawa Barat masing-masing pada tanggal 7 Januari dan 1 Maret 2014.
Uji Pendahuluan
Formulasi insektisida komersial berbahan aktif deltametrin, emamektin benzoat, klorantraniliprol, profenofos, dan spinetoram masing-masing diuji pada konsentrasi formulasi 0.05%, 0.1% dan 0.2% (v/v). Konsentrasi tertinggi merupakan konsentrasi anjuran yang tertera pada label kemasan masing-masing insektisida. Kelima formulasi insektisida komersial tersebut diencerkan dengan akuades yang mengandung 0.2 ml/l bahan perekat Agristick (bahan aktif alkilaril poliglikol eter 400 g/L). Akuades yang mengandung Agristick 0.2 ml/l digunakan sebagai larutan kontrol. Uji pendahuluan lebih lanjut dilakukan pada konsentrasi yang lebih rendah (emamektin benzoat dan spinetoram) atau lebih tinggi (deltametrin, klorantraniliprol, dan profenofos) sesuai dengan hasil uji pendahuluan pertama (Lampiran 1 sampai 5). Semua pengujian dilakukan menggunakan metode pencelupan daun (dipping) dengan 3 ulangan.
7 dimasukkan ke dalam cawan petri yang dialasi tisu kemudian ke dalam setiap cawan dimasukkan 10 larva instar II P. xylostella. Pemberian daun perlakuan dilakukan selama 24 jam. Pada 24 jam berikutnya ditambahkan daun perlakuan atau daun kontrol secukupnya, kemudian ditambahkan daun tanpa perlakuan pada 48 jam berikutnya. Jumlah larva yang mati dicatat setiap hari dari 24 sampai 96 jam setelah perlakuan (JSP).
Uji pendahuluan ekstrak daun T. vogelii dilakukan pada konsentrasi 0.05%, 0.1%, dan 0.2% berdasarkan hasil penelitian sebelumnya (Nailufar 2011). Ekstrak tersebut dicampur dengan pelarut metanol dan pengemulsi Tween 80 dengan perbandingan 5:1 (v/v) (konsentrasi akhir 1.2%), kemudian ditambahkan akuades sehingga didapatkan suspensi dengan konsentrasi yang diinginkan. Daun kontrol dicelup dalam akuades yang mengandung metanol dan Tween 80 dengan perbandingan dan konsentrasi akhir yang sama seperti pada sediaan ekstrak uji. Suspensi ekstrak T. vogelii dikocok dengan menggunakan pengocok ultrasonik untuk mencampurkan secara merata ekstrak tersebut di dalam air (Abizar dan Prijono 2010). Tahapan pengujian selanjutnya sama seperti pada uji pendahuluan lima insektisida komersial di atas.
Uji Lanjutan
Hasil uji pendahuluan setiap insektisida uji digunakan untuk menentukan 5 taraf konsentrasi yang diharapkan dapat mengakibatkan kematian serangga uji antara 15% dan 95%. Konsentrasi deltametrin yang dijuji ialah 375, 525, 750, 115 dan 1500 mg b.a./l; konsentrasi uji emamektin benzoat 0.95, 1.52, 1.9, 3.8, 6.6 mg b.a/l; konsentrasi uji klorantraniliprol 20, 30, 50, 75 dan 120 mg b.a./l; konsentrasi uji profenofos 250, 450, 800, 1500 dan 2500 mg b.a./l; konsentrasi uji spinetoram 0.24, 0.36, 0.6, 1.08 dan 1.8 mg b.a./l, sedangkan konsentrasi ekstrak T. vogelii
yang diuji ialah 250, 400, 700, 1000, dan 2000 mg ekstrak/l.
Cara perlakuan dan pengamatan pada uji lanjutan sama seperti uji pendahuluan, tetapi pada uji lanjutan setiap perlakuan diulang 5 kali. Data mortalitas kumulatif pada 48, dan 96 JSP diolah dengan analisis probit menggunakan program POLO-PC (LeOra 1987). LC95 setiap insektisida
komersial yang diuji dibandingkan dengan konsentrasi anjuran yang tertera pada label produk insektisida untuk menentukan tingkat kerentanan relatif hama P. xylostella terhadap insektisida tersebut.
8
HASIL DAN PEMBAHASAN
Toksisitas Insektisida Uji terhadap Larva Plutella xylostella
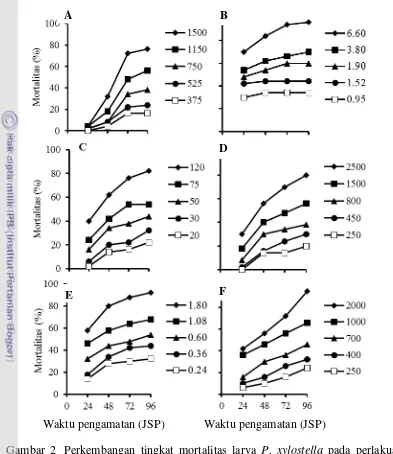
Perlakuan dengan lima jenis insektisida komersial, yaitu deltametrin, emamektin benzoat, klorantraniliprol, profenofos, dan spinetoram, mengakibatkan mortalitas larva P. xylostella yang secara umum meningkat seiring dengan bertambahnya waktu dan semakin besarnya konsentrasi insektisida (Gambar 1). Perkembangan mortalitas larva P. xylostella dari 24 sampai 96 JSP akibat perlakuan dengan 5 jenis insektisida tersebut pada kisaran konsentrasi yang diuji menunjukkan pola yang agak beragam.
Perlakuan dengan deltametrin 375–1500 mg b.a./l mengakibatkan kematian larva P. xylostella yang rendah pada 24 JSP kemudian meningkat nyata antara 24 dan 48 JSP serta meningkat lebih tajam antara 48 dan 72 JSP, dan selanjutnya peningkatan kematian larva melandai antara 72 dan 96 JSP (Gambar 1A). Deltametrin merupakan insektisida piretroid yang bekerja sebagai racun saraf, yaitu menunda penutupan saluran ion natrium pada akson saraf sehingga mengganggu transmisi impuls saraf dan mengakibatkan gejala hipereksitasi, gemetaran, kejang-kejang, kelumpuhan otot dan berbagai organ tubuh, dan akhirnya menyebabkan kematian (Yu 2008; Khambay dan Jewess 2010). Bagian sasaran pada sistem saraf larva P. xylostella tampaknya sudah tidak peka terhadap deltametrin sehingga kematian serangga uji yang seharusnya berlangsung cepat, pada penelitian ini tingkat kematian larva P. xylostella masih rendah pada 24 JSP.
Kematian larva P. xylostella akibat perlakuan dengan emamektin benzoat 0.95-6.6 mg b.a./l sudah cukup tinggi pada 24 JSP, kemudian masih meningkat dalam proporsi yang lebih rendah antara 24 dan 48 JSP sedangkan antara 48 dan 96 JSP peningkatan kematian larva melandai (Gambar 1B). Emamektin benzoat merupakan turunan semisintetik dari avermektin B1a dan B1b (makrolida) yang
berasal dari aktinomiset tanah Streptomyces avermitilis (Pitterna 2007). Avermektin merupakan racun saraf yang menyebabkan pembukaan saluran ion klorida pada membran pascasinapsis sel saraf yang menyebabkan terjadinya peningkatan pemasukan ion klorida ke dalam sel saraf sehingga mengakibatkan gejala kelumpuhan dan kematian serangga (Pitterna 2007; Casida dan Durkin 2013). Insektisida tersebut bekerja cepat dan bagian sasaran larva P. xylostella
tampaknya masih peka terhadap insektisida tersebut sehingga perlakuan dengan emamektin benzoat sudah mengakibatkan kematian serangga uji yang cukup tinggi pada 24 JSP dan setelah itu hanya terjadi peningkatan kematian serangga uji yang rendah.
9
Gambar 2 .Perkembangan tingkat mortalitas larva P. xylostella pada perlakuan deltametrin (A); emamektin benzoat (B); klorantraniliprol (C); profenofos (D); spinetoram (E); ekstrak T. vogelii (F). Satuan konsentrasi pada legenda adalah mg b.a./l untuk insektisida komersial dan mg ekstrak/l untuk ekstrak T. vogelii.
Klorantraniliprol termasuk dalam golongan diamida antranilat yang bekerja mengaktifkan reseptor rianodin sehingga membuka saluran ion kalsium di dalam retikulum sarkoplasma sel otot yang menyebabkan pelepasan ion kalsium secara berlebihan. Akibatnya ion kalsium di dalam sel otot berkurang dan pengaturan kontraksi otot terganggu, yang selanjutnya menyebabkan terjadinya kelumpuhan dan kematian serangga (Cordova et al. 2006). Klorantraniliprol bekerja lebih lambat dibandingkan dengan racun saraf yang bekerja cepat dan kepekaan bagian sasaran tampaknya sudah menurun sehingga kematian serangga uji pada 24 JSP lebih rendah dibandingkan dengan perlakuan emamektin benzoat, tetapi
A
Waktu pengamatan (JSP) Waktu pengamatan (JSP)
A
D
F B
10
meningkat cukup tajam antara 24 dan 48 JSP, yang selanjutnya antara 48 dan 96 JSP masih terjadi peningkatan kematian larva dengan proporsi yang lebih rendah.
Profenofos merupakan insektisida organofosfat yang menyebabkan kematian pada serangga akibat terjadinya penghambatan kerja enzim asetilkolinesterase pada celah sinapsis saraf (Casida dan Durkin 2013). Hal ini menyebabkan terjadinya penumpukan asetilkolin pada membran pascasinapsis sel saraf yang mengakibatkan gejala hipereksitasi, gemetaran, kejang-kejang, kelumpuhan, dan kematian (Yu 2008). Insektisida organofosfat merupakan racun saraf yang bekerja cepat tetapi kepekaan bagian sasaran tampaknya sudah menurun sehingga kematian larva P. xylostella pada 24 JSP lebih rendah dibandingkan dengan perlakuan klorantraniliprol.
Spinetoram merupakan campuran turunan semisintetik dari spinosin J dan L (makrolida) yang berasal dari aktinomiset tanah Saccharopolyspora spinosa
(Crouse et al. 2007). Spinosin bekerja sebagai agonis reseptor asetilkolin pada membran pascasinapsis saraf sehingga saluran ion Na+ terbuka dan menimbulkan rangsangan terus-menerus sehingga akan terjadi gejala hipereksitasi, kejang-kejang, kelumpuhan dan kematian (Salgado dan Sparks 2010). Spinetoram bekerja relatif cepat dan bagian sasaran tampaknya masih peka terhadap insektisida tersebut sehingga perlakuan dengan spinetoram sudah mengakibatkan kematian serangga uji yang cukup tinggi pada 24 JSP, kemudian antara 24 dan 48 JSP masih terjadi peningkatan kematian larva yang cukup tajam, dan antara 48 dan 96 JSP masih terjadi kematian larva dengan proporsi yang lebih rendah.
Perlakuan dengan ekstrak T. vogelii 250–2000 mg/l juga mengakibatkan kematian larva yang cukup tinggi pada 24 JSP kemudian kematian larva meningkat secara bertahap antara 24 dan 96 JSP, kecuali pada perlakuan dengan konsentrasi tertinggi yang meningkat cukup tajam antara 72 dan 96 JSP (Gambar 1F). Senyawa aktif dalam daun T. vogelii, yaitu rotenon dan beberapa senyawa rotenoid lain (Delfel et al. 1970), bukan racun saraf tetapi racun respirasi sel yang menghambat transfer elektron dalam kompleks I dari rantai transpor elektron di dalam mitokondria sehingga menurunkan produksi ATP yang lambat laun mengakibatkan kematian serangga (Hollingworth 2001). Insektisida nabati ini bekerja relatif lambat, yaitu peningkatan kematian serangga uji antara 24 dan 96 JSP lebih tinggi daripada tingkat kematian pada 24 JSP.
Pada pengamatan terakhir (96 JSP), perlakuan dengan deltametrin 375–1500 mg b.a./l, emamektin benzoat 0.95–6.6 mg b.a./l, klorantraniliprol 20–120 mg b.a./l, profenofos 250–2500 mg b.a./l, dan spinetoram 0.24–1.8 mg b.a./l mengakibatkan kematian larva P. xylostella berturut-turut 14%-76%, 34%-96%, 22%-82%, 20%-80%, dan 32%-92% (Gambar 1). LC50 dan LC95 semua
insektisida uji pada 96 JSP lebih kecil dibandingkan dengan LC50 dan LC95 pada
48 JSP (Tabel 1). Hal ini sesuai dengan pola peningkatan kematian serangga uji dari 48 JSP ke 96 JSP (Gambar 1).
Berdasarkan hasil analisis probit data kematian serangga uji pada 96 JSP, LC50 dan LC95 deltametrin masing-masing 928.40 dan 3677.09 mg b.a./l,
11
Tabel 1 Toksisitas lima jenis insektisida komersial dan ekstrak T. vogelii terhadap larva P. xylostella
a
JSP: jam setelah perlakuan.
ba:
intersep. b: kemiringan garis regresi. GB: galat baku, SK: selang kepercayaan.
c
: satuan ekstrak T. vogelii yaitu mg ekstrak/l. Insektisida Konsentrasi Profenofos 750 48 -4.279 ± 0.749 1.286 ± 0.251 2122.57 (1491.51-4007.89) 40312.00
12
Konsentrasi anjuran deltametrin, emamektin benzoat, klorantraniliprol, dan profenofos berturut-turut 10, 10, 40, dan 750 mg b.a./l, sedangkan konsentrasi anjuran spinetoram disamakan dengan konsentrasi anjuran spinosad (campuran spinosin A dan D) yaitu 12 mg b.a./l karena di Indonesia formulasi spinetoram belum terdaftar untuk mengendalikan P. xylostella. LC95 pada 96 JSP untuk
deltametrin, klorantraniliprol, dan profenofos berturut-turut 367.7, 9.1, dan 14.5 kali lebih tinggi daripada konsentrasi anjuran masing-masing, sedangkan LC95
pada 96 JSP untuk emamektin benzoat dan spinetoram masing-masing 1.1 dan 3.3 kali lebih rendah daripada konsentrasi anjuran insektisida tersebut. Dengan demikian, larva P. xylostella asal Garut, Jawa Barat, sudah tidak rentan terhadap deltametrin, klorantraniliprol, dan profenofos, tetapi masih rentan terhadap emamektin benzoat dan spinetoram.
Hasil analisis probit data kematian serangga uji pada perlakuan dengan ekstrak T. vogelii menunjukkan bahwa LC50 dan LC95 pada 96 JSP masing-masing
607.48 dan 2907 mg/l (Tabel 1). LC95 ekstrak tersebut lebih rendah daripada LC95
deltametrin dan profenofos sehingga ekstrak T. vogelii berpotensi untuk digunakan sebagai alternatif dalam pengendalian hama P. xylostella yang resisten terhadap insektisida sintetik, khususnya deltametrin dan profenofos.
Hasil penelitian ini sesuai dengan hasil penelitian Moekasan et al. (2004) yang melaporkan bahwa larva P. xylostella dari Lembang dan Pangalengan (Bandung, Jawa Barat) sudah resisten terhadap deltametrin dengan LC90
masing-masing sekitar 15 000 kali dan lebih dari 1800 kali dibandingkan dengan konsentrasi anjuran insektisida tersebut serta resisten terhadap profenofos dengan LC90 masing-masing lebih dari 172 000 kali dan sekitar 315 kali dibandingkan
dengan konsentrasi anjuran insektisida tersebut. Moekasan et al. (2004) juga melaporkan bahwa larva P. xylostella dari Kejajar-Dieng (Wonosobo, Jawa Tengah) dan Batu (Jawa Timur) sudah resisten terhadap abamektin dengan L90
masing-masing sekitar 15 dan 18 kali dibandingkan dengan konsentrasi anjuran insektisida tersebut.
Di luar negeri, resistensi hama P. xylostella terhadap insektisida piretroid dan organofosfat juga telah sering dilaporkan (Furlong et al. 2013). Berdasarkan mekanismenya, resistensi serangga hama terhadap insektisida piretroid dapat disebabkan oleh penurunan laju penetrasi insektisida melalui kutikula, penurunan kepekaan bagian sasaran (perubahan saluran ion natrium pada akson saraf), serta peningkatan detoksifikasi insektisida oleh enzim sitokrom P450 dan esterase (Khambay dan Jewess 2010). Sementara itu, resistensi serangga hama terhadap insektisida organofosfat dapat disebabkan oleh penurunan kepekaan bagian sasaran (perubahan enzim asetilkolinesterase) serta peningkatan detoksifikasi insektisida oleh enzim sitokrom P450, esterase, dan glutation-S-transferase (Yu 2008).
13 Emamektin benzoat dan spinetoram merupakan insektisida semisintetik yang masih relatif baru dan tampaknya masih jarang digunakan oleh petani di lokasi tempat pengambilan larva P. xylostella yang digunakan dalam penelitian ini. Di Brasil, P. xylostella telah dilaporkan resisten terhadap abamektin (campuran avermektin B1a dan B1b dengan NR 61.7 (Santos et al. 2011). Di
Amerika Serikat, seleksi resistensi larva P. xylostella terhadap spinetoram dapat dilakukan di laboratorium dengan NR 629 sampai 10 000 (Sparks et al. 2012).
Lima insektisida komersial yang diuji merupakan racun saraf, sedangkan ekstrak T. vogelii mengandung rotenon yang bekerja sebagai racun respirasi sel. Larva P. xylostella yang resisten terhadap insektisida racun saraf tampaknya tidak menunjukkan resistensi silang terhadap rotenon yang bekerja sebagai racun respirasi sel sehingga ekstrak T. vogelii efektif terhadap serangga hama tersebut.
Pengaruh Insektisida Uji terhadap Perkembangan P. xylostella
Faktor lain yang tidak kalah penting dalam penelitian ini yaitu pengamatan perkembangan larva P. xylostella yang bertahan hidup. Pengamatan tersebut dimaksudkan untuk mengetahui pengaruh insektisida yang digunakan dalam menghambat perkembangan larva P. xylostella. Pengamatan dilakukan pada semua perlakuan dan dilakukan hanya pada 3 taraf konsentrasi terendah dan kontrol. Jumlah pupa yang terbentuk dan imago yang muncul dicatat dan diolah dengan menggunakan analisis ragam menggunakan program SAS 9.1 (SAS Institute 2002).
Perlakuan dengan deltametrin 375-750 mg b.a./l, klorantraniliprol 20-50 mg b.a./l, profenofos 250-800 mg b.a./l, dan ekstrak T. vogelii 250-700 mg/l tidak berpengaruh nyata terhadap perkembangan larva P. xylostella yang bertahan hidup menjadi pupa (Tabel 2). Hal tersebut menunjukkan bahwa pengaruh insektisida tersebut tidak berlanjut setelah larva uji diberi daun tanpa perlakuan. Sementara itu, pada perlakuan dengan emamektin benzoat 1.90 mg b.a./l dan spinetoram 0.6 mg b.a./l, persentase pupa yang terbentuk lebih rendah secara nyata dibandingkan dengan kontrol. Tampaknya kerja emamektin benzoat dan spinetoram sebagai racun saraf dapat memengaruhi proses fisiologi yang mengatur perkembangan serangga.
Perlakuan dengan klorantraniliprol dan ekstrak T. vogelii juga tidak berpengaruh nyata terhadap persentase kemunculan imago P. xylostella. Pengaruh nyata terhadap persentase kemunculan imago terjadi pada perlakuan deltametrin 750 mg b.a./l, emamektin benzoat 1.9 mg b.a./l, dan profenofos 250-800 mg b.a./l. Sifat racun saraf yang kuat dari ketiga insektisida tersebut tampaknya dapat menyebabkan pengaruh jangka panjang terhadap perkembangan P. xylostella
14
Tabel 2 Pengaruh perlakuan lima jenis insektisida komersial dan ekstrak T. vogelii terhadap persentase pupa yang terbentuk dan imago P. xylostella
yang muncul
Angka dalam lajur yang sama yang diikuti oleh huruf yang sama tidak berbeda nyata berdasarkan uji Duncan pada taraf nyata 5%. Persentase pupa yang terbentuk dan imago yang muncul dihitung relatif terhadap jumlah larva yang bertahan hidup pada 96 JSP.
b
15
SIMPULAN DAN SARAN
Simpulan
Larva P. xylostella asal Garut, Jawa Barat, sudah tidak rentan terhadap deltametrin, klorantraniliprol, dan profenofos dengan LC95 berturut-turut 367.7,
9.1, dan 14.5 kali lebih tinggi daripada konsentrasi anjuran masing-masing, tetapi masih rentan terhadap emamektin benzoat dan spinetoram dengan LC95 1.1 dan
3.3 kali lebih rendah daripada konsentrasi anjuran masing-masing. LC95 ekstrak T. vogelii, yaitu 2907 mg ekstrak/l, lebih rendah daripada LC95 deltametrin (3677.1
mg b.a./l) dan profenofos (10872.0 mg b.a./l). Berdasarkan hasil penelitian ini dapat disimpulkan bahwa ekstrak T. vogelii layak digunakan sebagai insektisida alternatif untuk mengendalikan hama P. xylostella, termasuk yang sudah resisten terhadap deltametrin dan profenofos. Selain mengakibatkan kematian, insektisida emamektin benzoat dan spinetoram dapat menghambat perkembangan pembentukan pupa, sedangkan deltametrin, emamektin benzoat, dan profenofos mengakibatkan penghambatan kemunculan imago.
Saran
16
DAFTAR PUSTAKA
Abizar M, Prijono D. 2010. Aktivitas insektisida ekstrak daun dan biji Tephrosia vogelii J.D. Hooker (Leguminosae) dan ekstrak buah Piper cubeba L. (Piperaceae) terhadap larva Crocidolomia pavonana (F.) (Lepidoptera: Crambidae). JHPT Trop. 10(1):1-12.
Ankersmith Gw. 1953. DDT resistance in Plutella xylostella (Curt.) in Java. Bull Entomol Res. 44(3):421-425.
Brent KJ. 1986. Detection and monitoring of resistant forms: an overview. Di dalam: Committee on Strategies for the Management of Pesticide Resistant Pest Populations. Pesticide Resistance: Strategies and Tactics for Management. Washington DC (US): National Academic Press. hlm 298-312.
Casida JE, Durkin KA. 2013. Neuroactive insecticides: targets, selectivity, resistance, and secondary effects. Annu Rev Entomol. 58:99-117. doi: 10.1146/annurev-ento-120811-153645
Caboni P, Sarais G, Angioni A, Garau VL, Cabras P. 2005. Fast and versatile multi residue method for the analysis of botanical insecticides on fruits and vegetables by HPLC/DAD/MS. J Agric Food Chem. 53(22):8644-8649. Cordova D, Benner EA, Sacher MD, Rauh JJ, Sopa GP, et al. 2006. Anthranilic
diamides: A new class of insecticides with novel mode of action, ryanodine receptor activation. Pestic Biochem Physiol. 84(3):196-124.
Crouse GD, Dripps JE, Orr N, Sparks TC, Waldron C. 2007. DE-175 (spinetoram), a new semi-synthetic spinosyn in development. Di dalam: Krämer W, Schirmer U, editor. Modern Crop Protection Compounds. Weinheim (DE): Wiley-VCH. hlm 1013-1031.
Dadang, Prijono D. 2008. Insektisida Nabati: Prinsip, Pemanfaatan, dan Pengem-bangan. Bogor (ID): Departemen Proteksi Tanaman, Institut Pertanian Bogor.
Delfel NE, Tallent WH, Carlson DG, Wolff IA. 1970. Distribution of rotenone and deguelin in Tephrosia vogelii and separation of rotenoid-rich fractions.
J Agric Food Chem. 18(3):385−390.
Denholm I, Horowitz RA. 2001. Impact of insecticide resistance mechanisms on management strategies. Di dalam: Ishaaya I, editor. Biochemical Sites of Insecticide Action and Resistance. New York (US): Springer-Verlag. hlm 323-335.
Denholm I, Horowitz RA, Cahill M, Ishaaya I. 1998. Management of resistance to novel insecticides. Di dalam: Ishaaya I, Degheele D, editor. Insecticides with Novel Modes of Action. New York (US): Springer-Verlag. hlm 339-341.
Djojosumarto P. 2008. Pestisida dan Aplikasinya. Jakarta (ID): Agromedia Pustaka.
17 Georghiou GP, Mellon RB. 1983. Pesticide resistance in time and space. Di dalam: Georghiou GP, Saito T, editor. Pest Resistance to Pesticides. New York (US): Plenum Press. hlm 1-46.
Hollingworth RM. 2001. Inhibitors and uncouplers of mitochondrial oxidative phosphorylation. Di dalam: Krieger R, editor. Handbook of Pesticide Toxicology. Vol 2. San Diego (US): Academic Press. hlm 1169-1227. Hama H. 1990. Insecticide resistance characteristics of diamondback moth. Di
dalam: Talekar NS, editor. Diamondback Moth and Other Crucifer Pests. Proceedings of the Second International Workshop; 1992 Des 10-14; Tainan. Taipai (TW); AVRDC. hlm 455-463.
Kagaku S. 2012. Development of the Novel Insecticide Spinetoram. Tokyo (JP): Sumitomo Chemical.
Khambay BPS, Jewess PJ. 2010. Pyrethroid. Di dalam: Gilbert L, Gill S, editor.
Insect Control: Biological and Synthetic Agents. San Diego (US): Academic Press. hlm 1-29.
Kim GH, Seo YS, Lee JH, Cho KY. 1990. [Development of fenvalerate resistance in the diamondback moth Plutella xylostella Linn. (Lepidoptera: Yponomeutidae)] [dalam bahasa Korea]. Kor J Appl Entomol. 29(3):194-200.
Lambert N, Trouslot MF, Nef-Campa C, Crestin H. 1993. Production of rotenoids by heterotrophic and photomixotrophic cell cultures of Tephrosia vogelii. Phytochemistry.34(6):1515-1520.
LeOra Software. 1987. POLO-PC User’s Guide. Petaluma (US): LeOraSoftware. Matsumura F. 1985. Toxicology of Insecticides. Ed ke-2. New York (US): Plenum
Press.
Moekasan TK, Sastrosiswojo S, Rukmana T, Susanto, Purnamasari IS, Kurnia A. 2004. Status resistensi lima strain Plutella xylostella L. terhadap formulasi fipronil, deltametrin, profenofos, abamektin, dan Bacillus thuringiensis. J Hort. 14(2):84-90.
Morallo-Rejesus B. 1986. Botanical insecticides against the diamondback month. [Internet] [diunduh 2013 Nov 11]. Tersedia pada: http://www.avrd.orgpdf86dbm86DBM23pdf.
Nailufar N. 2011. Aktivitas insektisida ekstrak daun Tephrosia vogelii
(Leguminosae) dan buah Piper aduncum (Piperaceae) terhadap larva
Crocidolomia pavonana [skripsi]. Bogor (ID): Institut Pertanian Bogor. Pitterna T. 2007. Chloride channel activators/new natural products (avermectins
and milbemycins). Di dalam: Krämer W, Schirmer U, editor. Modern Crop Protection Compounds. Weinheim (DE): Wiley-VCH. hlm 1069-1088. SAS Institute. 2002. SAS 9.1 TS Level 1M3. Cary (US): SAS Institute.
Salgado VL, Sparks TC. 2010. The spinosyns: chemistry, biochemistry, mode of action, and resistance. Di dalam: Gilbert L, Gill S, editor. Insect Control: Biological and Synthetic Agents. San Diego (US): Academic Press. hlm 207-243.
18
Sastrosiswojo S, Setiawati W. 1993. Hama-hama tanaman kubis dan cara pengendaliannya. Di dalam: Permadi AH, Sastrosiswojo S, editor. Kubis. Bandung (ID): Badan Penelitian dan Pengembangan Pertanian dan Balai Penelitian Hortikultura. hlm 39-50.
Sparks TC, Dripps JE, Watson GB, Paroonagian D. 2011. Resistance and cross-resistance to the spinosyns – a review and analysis. Pestic Biochem and Physiol. 102(10):1-10.
Troczka B, Zimmer CT, Elias J, Schorn C, Bass C, Davies TGE, Field LM, Williamson MS, Slater R, Nauen R. 2012. Resistance to diamide insecticides in diamondback moth, Plutella xylostella (Lepidoptera: Plutellidae) is associated with a mutation in the membrane-spanning domain of the ryanodine receptor. Insect Biochem Molec Biol. 42(11):873-880. Udiarto B, Setiawati W. 2007. Suseptibilitas dan kuantifikasi resistensi empat
strain Plutella xylostella L. terhadap beberapa insektisida. J Hort. 17(3):277-284.
Wang X, Wu Y. 2012. High levels of resistance to chlorantraniliprole evolved in field populations of Plutella xylostella. J Econ Entomol. 105(3):23-1019. Wulan RDR. 2008. Aktivitas insektisida ekstrak daun Tephrosia vogelii Hook. f.
(Leguminosae) terhadap larva Crocidolomia pavonana (F.) (Lepidoptera: Pyralidae) [skripsi]. Bogor (ID): Institut Pertanian Bogor.
19
20
Lampiran 1 .Peta lokasi pengambilan sampel daun T. vogelii di Kawasan Agropolitan, Kecamatan Pacet, Kabupaten Cianjur, Jawa Barat
Cianjur
6049’18 LS dan 10708’42 BT
21
Lampiran 2 .Peta lokasi pengambilan sampel larva P. xylostella di Desa Sukahurip, Kecamatan Cigedug, Kabupaten Garut, Jawa Barat
Desa Sukahurip
22
Lampiran 3 Mortalitas larva P. xylostella pada perlakuan uji pendahuluan deltametrin Catatan kaki seperti pada Lampiran 1.
Lampiran 5 .Mortalitas larva P. xylostella pada perlakuan uji pendahuluan Catatan kaki seperti pada Lampiran 1.
23 Catatan kaki seperti pada Lampiran 1.
Lampiran 8 Mortalitas larva P. xylostella pada perlakuan uji pendahuluan ekstrak
T. vogelii Catatan kaki seperti pada Lampiran 1.
Lampiran 9 Mortalitas larva P. xylostella pada perlakuan uji lanjutan deltametrin Konsentrasi
JSP = jam setelah perlakuan.
Lampiran 10 Mortalitas larva P. xylostella pada perlakuan uji lanjutan emamektin benzoat
24
Catatan kaki seperti pada Lampiran 7.
Lampiran 12 Mortalitas larva P. xylostella pada perlakuan uji lanjutan profenofos Konsentrasi
Catatan kaki seperti pada Lampiran 7.
Lampiran 13 Mortalitas larva P. xylostella pada perlakuan uji lanjutan spinetoram Konsentrasi
Catatan kaki seperti pada Lampiran 7.
Lampiran 14 Mortalitas larva P. xylostella pada perlakuan uji lanjutan ekstrak T. vogelii
25
26
..perlakuan insektisida .profenofos Sumber
27 Lampiran 25 Sidik ragam persentase pupa P. xylostella yang terbentuk pada
perlakuan ekstrak T. ..vogelii
Sumber keragamaan
db JK KT Fhitung Pr>F
Perlakuan 3 55.382 18.461 0.34 0.799 Galat 16 878.520 54.907
Total 19 933.902
Lampiran 26 Sidik ragam persentase imago P. xylostella yang muncul pada
..perlakuan ekstrak T. vogelii
Sumber keragamaan
db JK KT Fhitung Pr>F
Perlakuan 3 176.665 58.888 1.08 0.384 Galat 16 869.860 54.366
28
RIWAYAT HIDUP
Penulis dilahirkan di Tasikmalaya pada tanggal 4 April 1992 dari pasangan Bapak H. Didi Cardi dan Hj. Ibu Lilis Mulyasaroh. Penulis adalah putri pertama dari empat bersaudara. Penulis menyelesaikan pendidikan sekolah menengah atas di SMA Negeri 6 Tasikmalaya pada tahun 2010 dan pada tahun yang sama penulis melanjutkan pendidikan di Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB (USMI). Penulis mengikuti perkuliahan dengan Mayor Proteksi Tanaman, Fakultas Pertanian. Selama masa perkuliahan, penulis menerima beasiswa Bidik Misi dari Direktorat Jenderal Pendidikan Tinggi, Kementerian Pendidikan dan Kebudayaan. Penulis menjadi asisten praktikum mata kuliah Dasar-Dasar Proteksi Tanaman (2012), Ilmu Hama Tumbuhan Dasar (2013), Hama dan Penyakit Tanaman Pangan dan Hortikultura (2013), serta Pemanfaatan dan Pengelolaan Pestisida (2014) di Departemen Proteksi Tanaman IPB. Penulis menjadi kandidat mahasiswa berprestasi Departemen Proteksi Tanaman tahun 2013.
Penulis aktif dalam organisasi Himpunan Mahasiswa Proteksi Tanaman 2013), Himpunan Mahasiswa Tasikmalaya, dan Gentra Kaheman (2012-2013). Penulis mendapatkan dana Program Kreativitas Mahasiswa-Kewirausahaan yang berjudul Arthropode T-shirt sebagai Kaos Edukasi Asli Indonesia (2012) dan Teakubi Steak Berbasis Ubi Jalar Sebagai Diversifikasi Pangan (2013) serta Program Kreativitas Mahasiswa-Penelitian dengan penelitian yang berjudul Keefektifan Ekstrak Tephrosia vogelii, Piper aduncum, dan Campurannya untuk Mengatasi Hama Plutella xylostella yang Resisten terhadap Insektisida Komersial (2014). Selain mengikuti kegiatan kampus, penulis juga aktif mengikuti kepanitiaan beberapa kegiatan kampus dan mengikuti beberapa seminar yang diadakan di IPB.
Wulan RDR. 2008. Aktivitas insektisida ekstrak daun Tephrosia vogelii Hook. f. (Leguminosae) terhadap larva Crocidolomia pavonana (F.)
(Lepidoptera: Pyralidae) []. Bogor (ID): Institut Pertanian Bogor.