ISOLASI SENYAWA FLAVONOIDA DARI DAUN TUMBUHAN SAMBANG DARAH (Excoecaria cochinchinensis Lour.)
SKRIPSI
SEPTIAN V ZEGA 090802028
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
ISOLASI SENYAWA FLAVONOIDA DARI DAUN TUMBUHAN SAMBANG DARAH (Excoecaria cochinchinensis Lour.)
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar sarjana sains
SEPTIAN V ZEGA 090802028
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : ISOLASI SENYAWA FLAVONOIDA DARI DAUN
TUMBUHAN SAMBANG DARAH (Excoecaria cochinchinensis Lour.)
Kategori : SKRIPSI
Nama Mahasiswa : SEPTIAN V ZEGA
Nomor Induk Mahasiswa : 090802028
Program Studi : SARJANA (S1) KIMIA
Departemen : KIMIA
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN
ALAM (FMIPA) UNIVERSITAS SUMATERA UTARA
Disetujui di
Medan, September 2013
Komisi Pembimbing :
Pembimbing 2 Pembimbing 1
Dra. Frida Simanjuntak Drs. Albert Pasaribu, M.Sc
NIP. 1958 0509 1986 012001 NIP. 1964 0810 1991 031002
Diketahui/ Disetujui oleh
Departemen Kimia FMIPA USU Ketua,
PERNYATAAN
ISOLASI SENYAWA FLAVONOIDA DARI DAUN TUMBUHAN SAMBANG DARAH (Excoecaria cochinchinensis Lour.)
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, September 2013
PENGHARGAAN
Puji dan syukur penulis ucapkan kepada Tuhan Yang Maha Pengasih dan Maha Penyayang atas segala penyertaan-Nya sehingga penulis dapat menyelesaikan penelitian dan penulisan tugas akhir ini.
Ucapan terima kasih saya sampaikan kepada Bapak Drs. Albert Pasaribu, M.Sc dan Ibu Dra. Frida Simanjuntak selaku dosen pembimbing yang telah banyak memberikan arahan, bimbingan, ilmu dan waktu selama penulis melakukan penelitian dan penulisan tugas akhir ini hingga selesai. Ucapan terima kasih yang sebesar-besarnya penulis sampaikan kepada kedua orang tua tercinta, Ayah tercinta Obadia Zega, S.Pd dan Ibu tercinta Vestina Hondrӧ, A.Md yang selalu memberikan kasih sayang dan dukungan dalam hal moral dan materi, serta telah berjuang tak kenal lelah dalam memberikan yang terbaik dalam kehidupan penulis, serta seluruh keluarga besar yang selalu memberikan motivasi dan semangat kepada penulis. Ucapan terima kasih juga penulis ucapkan kepada Ketua dan Sekretaris Departemen Kimia FMIPA USU, Ibu Dr. Rumondang Bulan Nst MS dan Bapak Drs. Albert Pasaribu, M.Sc serta Ibu Dra. Emma Zaidar M.Si selaku dosen wali yang telah bayak memberikan nasihat dan masukan selama penulis menjalani masa kuliah. Bapak dan Ibu dosen bidang Kimia Bahan Alam Hayati serta seluruh dosen Departemen Kimia FMIPA USU. Terima kasih juga penulis sampaikan kepada rekan-rekan asisten Kimia Bahan Alam Hayati FMIPA USU (Iwan, Melda, Putri, Junita, Berkat, Doni, Agnes, Siska dan Anita), teman-teman seperjuangan dalam penelitian dan teman-teman stambuk 2009 dan untuk sahabat-sahabat tercinta (Egi, Fantoso, Ari, Jo, Naomi, Atika) yang telah memberikan motivasi dan bantuan kepada penulis. Dan penulis juga mengucapkan terimakasih kepada seluruh teman, saudara, dan kerabat yang telah banyak membantu dalam penyelesaian tugas akhir ini, tetapi tidak bisa saya tuliskan satu per satu.
ABSTRAK
ISOLATION OF FLAVONOID FROM THE LEAVES OF SAMBANG DARAH PLANTS
(Excoecaria cochinchinensis Lour.)
ABSTRACT
DAFTAR ISI
Daftar Lampiran ix
Daftar Gambar x
Bab 3 Metodologi Penelitian 30
3.1 Alat-alat 30
3.2 Bahan-bahan 31
3.3.1 Penyediaan Sampel 31
3.3.2 Uji Skrining Fitokimia 31
3.3.3 Ekstraksi Daun Tumbuhan Sambang Darah 32 3.3.4 Pemutusan Gula dari Senyawa Flavonoida (Hidrolisa) 32 3.3.5 Analisis Kromatografi Lapis Tipis 33 3.3.6 Isolasi Senyawa Flavonoida dengan Kromatografi Kolom 33
3.3.7 Pemurnian 34
3.3.8 Uji Kemurnian Hasil Isolasi dengan Kromatografi Lapis Tipis 34 3.3.9 Identifikasi Senyawa Hasil Isolasi 35 3.3.9.1 Identifikasi dengan Spektrofotometer Ultraviolet-
Visible (UV-Vis)
35 3.3.9.2 Identifikasi dengan Spektrofotoneter
Inframerah (FT-IR)
35
3.3.9.3 Identifikasi dengan Spektrometer Resonansi Magnetik Inti Proton (1H-NMR)
35
3.4 Bagan Skrining Fitokimia 36
3.5 Bagan Penelitian 37
Bab 4 Hasil dan Pembahasan 39
4.1 Hasil Penelitian 39
4.2 Pembahasan 43
Bab 5 Kesimpulan dan Saran 46
5.1 Kesimpulan 46
5.2 Saran 46
DAFTAR LAMPIRAN
Halaman Lampiran A. Determinasi daun Tumbuhan Sambang Darah
(E. cochinchinensis Lour)
50 Lampiran B. Gambar Daun Tumbuhan Sambang Darah
(E. cochinchinensis Lour)
51
Lampiran C. Kromatogram Lapis Tipis Ekstrak Pekat Kloroform daun tumbuhan Sambang Darah (E. cochinchinensis Lour)
52 Lampiran D. Kromatogram Lapis Tipis Senyawa Hasil Isolasi 53 Lampiran E. Spektrum Ultraviolet-Visible Beberapa Senyawa Flavonoida 54 Lampiran F. Ekspansi Spektrum 1H-NMR Senyawa Hasil Isolasi pada
δ = 5,6 - 8,2 ppm
55
Lampiran H. Spektrum 1H-NMR Senyawa Flavonoida Pembanding untuk Senyawa Hasil Isolasi
DAFTAR GAMBAR
Halaman
Gambar 2.1 Kerangka Dasar Senyawa Flavonoida 10
Gambar 4.1 Spektrum UV-Visible Senyawa Hasil Isolasi 39
Gambar 4.2 Spektrum FT-IR Senyawa Hasil Isolasi 40
Gambar 4.3 Spektrum 1H-NMR Senyawa Hasil Isolasi 41
Gambar 4.4 Ekspansi Spektrum 1H-NMR Senyawa Hasil Isolasi pada 1,0 - 9,0 ppm
42
DAFTAR TABEL
Halaman
Tabel 2.1 Sifat Golongan Flavonoida 12
Tabel 2.2 Sistem Pelarut pada Kromatografi Lapis Tipis untuk Senyawa Flavonoid
ABSTRAK
ISOLATION OF FLAVONOID FROM THE LEAVES OF SAMBANG DARAH PLANTS
(Excoecaria cochinchinensis Lour.)
ABSTRACT
BAB I
PENDAHULUAN
1.1 Latar Belakang
Senyawa flavonoida diduga sangat bermanfaat dalam makanan karena, berupa senyawa fenolik, senyawa ini yang bersifat antioksidan kuat. Flavonoid memiliki kemampuan untuk menghilangkan dan secara efektif menghilangkan spesies pengoksidasi yang merusak. Oleh karena itu, makanan yang kaya flavonoid dianggap penting untuk mengobati penyakit-penyakit, seperti kanker dan penyakit jantung (Heinrich dkk, 2009).
Flavonoid diketahui memiliki kemampuan untuk menghancurkan radikal bebas, termasuk radikal superoksida dan radikal hidroksil. Selain itu, sifat redoks dari flavonoid memungkinkan untuk bertindak sebagai reduktor, dan pada beberapa kasus, dapat bertindak sebagai agen pengkelat untuk logam transisi. Sifat dari flavonoid yang dapat menghancurkan radikal bebas ini, dapat melindungi tubuh manusia dari penyakit dan dari studi epidemiologi menunjukkan bahwa dengan mengkonsumsi flavonoid dapat menurunkan resiko kanker dan peradangan (Nessa, 2003).
Genus Excoecaria adalah anggota dari family Euphorbiaceae yang terdiri dari hampir 40 spesies yang tersebar di seluruh wilayah tropis Afrika, Asia, dan barat laut Australia (A. S. R. Anjaneyulu, 2000).
Tumbuhan yang berasal dari Indocina ini tidak menyukai tanah yang tergenang air. Tumbuhan sambang darah rasanya pedas, sifatnya hangat, dan beracun. Tumbuhan ini berkhasiat membunuh parasit (parasitisid), menghilangkan rasa gatal (antipruritik), dan penghenti pendarahan (hemostatis) (Dalimartha, 2003).
Beberapa penelitian terdahulu yang pernah dilakukan terhadap tumbuhan sambang darah :
1. Dari ekstrak daun dan ranting tumbuhan sambang darah (Excoecaria cochinchinensis Lour.) telah diisolasi tiga senyawa diterpenoid
teroksigenasi (Jing-Hua Yang.et.al. 2005).
2. Uji aktivitas antimikroba tanaman Excoecaria cochinchinensis Lour terhadap bakteri Staphylococcus aureus dan Propionibacterium acnes, dimana ekstraknya dibandingkan aktivitasnya dengan beberapa senyawa kimia yang sering digunakan sebagai antibakteri, seperti Benzoil peroksida, asam azelat, dan clindamycin fosfat. Hasilnya adalah ekstraknya memiliki aktivitas yang sama dengan asam azelat dan benzoil peroksida, namun lebih rendah dari clindamycin (P. Leelapornpisid.et.al. 2005).
3. Dari daun tumbuhan sambang darah juga telah diisolasi 2 senyawa baru Megastigmane Glucosides dan beberapa senyawa yang lain, yaitu Asam Galat, Asam sikimat, Asam p-hidroksibenzoat dan senyawa-senyawa kaempferol (Phan Minh Giang.et.al. 2005).
Dari uji pendahuluan yang peneliti lakukan, yaitu dengan uji skrining fitokimia dengan pereaksi FeCl3 5%, NaOH 10%, Mg-HCl dan H2SO4(p) menunjukkan bahwa
ekstrak metanol daun tumbuhan sambang darah mengandung senyawa flavonoida.
khususnya mengenai senyawa flavonoida yang terkandung di dalam tumbuhan sambang darah.
1.2 Permasalahan
Permasalahan dalam penelitian ini adalah golongan flavonoida apa yang terdapat dalam daun tumbuhan sambang darah dan bagaimana cara mengisolasi senyawa
flavonoida yang terdapat dalam daun tumbuhan sambang darah (E. cochinchinensis Lour)
1.3 Tujuan Penelitian
Tujuan dari penelitian ini adalah untuk mengisolasi senyawa flavonoida dan menentukan golongan senyawa flavonoida dari daun tumbuhan sambang darah (E. cochinchinensis Lour)
1.4 Manfaat Penelitian
Dari hasil penelitian diharapkan dapat memberikan sumber informasi ilmiah pada bidang Kimia Bahan Alam Hayati khususnya tentang golongan senyawa flavonoida yang terkandung dalam daun tumbuhan sambang darah (E. cochinchinensis Lour)
1.5 Lokasi Penelitian
1. Tempat Pengambilan Sampel
2. Tempat Melakukan Penelitian
Penelitian dilakukan di Laboratorium Kimia Bahan Alam Hayati, Departemen Kimia FMIPA – USU, Medan
3. Lokasi Identifikasi Kristal Hasil Isolasi
Analisis Spektrofotometer Ultaviolet-Visibel (UV-Vis), Spektrofotometer Inframerah (FT-IR), dan Spektrometer Resonansi Magnetik Inti Proton (1H-NMR) dilakukan di Pusat Penelitian Kimia – LIPI, kawasan PUSPITEK Serpong, Tangerang.
1.6 Metodologi Penelitian
Dalam penelitian ini, isolasi senyawa flavonoida dilakukan terhadap daun tumbuhan sambang darah berupa serbuk yang halus dan kering sebanyak 1000 gram. Tahap awal dilakukan uji skrining fitokimia untuk senyawa flavonoida, yaitu dengan menggunakan pereaksi FeCl3 5%, NaOH 10%, Mg-HCl dan H2SO4(p).
Tahap Isolasi yang dilakukan : - Ektraksi Maserasi
- Ekstraksi Partisi
- Pemutusan Gula (Hidrolisa) - Analisis Kromatografi Lapis Tipis - Analisis Kromatografi Kolom - Analisis pasta hasil isolasi
Tahap analisis hasil isolasi yang dilakukan adalah : a. Analisis Kromatografi Lapis Tipis
BAB 2
TINJAUAN PUSTAKA
2.1 Tumbuhan Sambang Darah
2.1.1 Sistematika Tumbuhan Sambang Darah
Sistematika tumbuhan Sambang Darah adalah sebagai berikut :
Kingdom : Plantae
Divisi : Spermatophyta
Class : Dicotyledonae
Ordo : Euphorbiales
Famili : Euphorbiaceae
Genus : Excoecaria
Spesies : Excoecaria cochinchinensis Lour.
Nama Lokal : Sambang Darah
2.1.2 Morfologi Tumbuhan Sambang Darah
banyak daripada bunga betina. Buah tiga keping, bundar, dengan diameter sekitar 1 cm. Mudah diperbanyak dengan stek batang atau cangkokan.
Kandungan kimia dari tumbuhan sambang darah adalah Tanin, asam bahenat, triterpenoid eksokarol, silosterol. Getahnya mengandung resin dan senyawa yang sangat beracun (Dalimartha, 2003).
2.1.3 Khasiat Tumbuhan Sambang Darah
Tumbuhan sambang darah digunakan untuk mengatasi gangguan yang berhubungan dengan pendarahan seperti haid terlalu berlebihan, muntah darah, batuk darah. Penyakit lain amandel dan disentri. Sebagai obat luar untuk eksim, gatal-gatal, dan kulit bersisik (Anonim, 2010). Daunnya biasanya digunakan rakyat Vietnam untuk mengobati berbagai penyakit, seperti diare berkepanjangan dan disentri (Do T. L, 1991).
2.2 Klasifikasi Senyawa Kimia Bahan Alam
Dengan meningkatnya jenis dan tipe senyawa yang ditemukan di dalam berbagai bahan alam, berkembang juga system klasifikasi senyawa yang berasal dari bahan alam, tetapi biasanya ada 4 jenis klasifikasi yang digunakan, antara lain :
1. Klasifikasi Berdasarkan Struktur Kimia
Klasifikasi ini adalah klasifikasi formal berdasarkan kerangka struktur molekul, yaitu : a. Senyawa lemak rantai terbuka atau alifatik, seperti asam-asam lemak, gula, dan
hampir semua asam amino.
b. Senyawa sikloalifatik atau alisiklik, seperti terpenoid, steroid, dan beberapa alkaloid.
c. Senyawa benzoid atau aromatik, seperti fenol dan kuinon.
Karena klasifikasi ini hanya didasarkan pada kerangka molekul, banyak molekul bahan alam yang terkait akan masuk ke dalam lebih dari satu golongan. Misalnya geraniol, farnesol, dan skualena termasuk golongan a, dan timol termasuk golongan c, namun berdasarkan pertimbangan biogenetic, molekul-molekul tersebut diperlakukan seperti terpenoid dan steroid pada golongan b.
2. Klasifikasi Berdasarkan Aktivitas Fisiologi
Biasanya pengembangan bahan alam didahului dengan pengamatan dan pengalaman empiric khasiat bahan alam tersebut untuk menyembuhkan penyakit tertentu. Oleh karena itu, salah satu cara penyelidikan bahan obat dari tumbuhan atau bahan alam lainnya adalah melalui ekstraksi dan penetapan khasiat farmakologi ekstrak, diikuti dengan isolasi komponen murni.
Sebenarnya hampir separuh dari obat yang digunakan sekarang adalah bahan alam, seperti berbagai jenis alkaloid, antibiotik atau steroid. Oleh karena itu, suatu klasifikasi yang menggunakan landasan aktivitas fisiologi banyak digunakan, misalnya hormone, vitamin, antiobiotik, dan mikotoksin. Walaupun senyawa yang termasuk dalam golongan itu memiliki berbagai struktur dan asal-usul biosintetik, aspek dan aktivitas yang dimilikinya sama.
3. Klasifikasi Berdasarkan Taksonomi
Pengetahuan tentang kandungan komponen tumbuhan berkembang dengan sangat pesat karena berkembangnya metode ekstraksi, isolasi, dan karakterisasinya. Hal ini mendorong berkembangnya suatu bidang baru yang disebut kemotaksonomi (chemotaxonomy) atau sistematik kimia (chemosystematic) yang mengarah ke
pembagian kandungan tumbuhan berdasarkan taksa tumbuhan. Dengan kata lain, isi kandungan tumbuhan dianggap sebagai tanda bagi evolusi dan klasifikasi tumbuhan.
4. Klasifikasi Berdasarkan Biogenesis
Biogenesis dan biosintesis memiliki arti yang sama dan sering kali digunakan tanpa perbedaan. Namun, istilah biogenesis biasanya digunakan untuk reaksi pembentukan yang masih dalam taraf hipotesis, sedangkan jika reaksi tersebut telah dibuktikan secara eksperimen, digunakan istilah biosintesis. Sebagian besar, bahkan hampir semua senyawa kandungan kimia bahan alam adalah senyawa organik, dan sumber utama senyawa karbon atau senyawa organik ini adalah glukosa yang dibentuk melalui fotosintesis di dalam tumbuhan autotropik atau diperoleh dari organism heterotrof.
2.3 Senyawa Flavonoida
Istilah “flavonoid” dikenakan pada suatu golongan besar senyawa yang berasal dari kelompok senyawa yang paling umum, yaitu senyawa flavon, dimana terdapat suatu jembatan oksigen di antara cincin A dalam kedudukan orto, dan atom karbon benzil yang terletak di sebelah cincin B, membentuk cincin tipe 4-piron. Senyawa heterosiklis ini, pada tingkat oksidasi yang berbeda terdapat dalam kebanyakan tumbuhan. Senyawa-senyawa flavonoid biasanya terdapat dalam sel-sel jaringan dalam bunga. Banyaknya ragam warna yang ada dalam bunga, terutama disebabkan karena adanya senyawa-senyawa flavonoid, terutama antosianin yang merupakan pigmen tumbuhan yang penting setelah klorofil dan karotena (Manitto, 1992).
Senyawa flavonoid diturunkan dari unit C6-C3 (fenil propana) yang bersumber
dari asam sikimat (via fenilalanin) dan unit C6 yang diturunkan dari jalur poliketida.
Fragmen poliketida ini disusun dari tiga molekul malonil-KoA, yang bergabung dengan unit C6-C3 (sebagai KoA tioester) untuk membentuk unit awal triketida. Oleh
karena itu flavonoid yang berasal dari biosintesis gabungan terdiri atas unit-unit yang diturunkan dari asam sikimat dan jalur poliketida.
Selain flavonoid, golongan bahan alam lain yang memberikan rasa kesat dan pahit dan sering dijumpai bersamaan dalam tanaman adalah senyawa tannin. Golongan ini terdiri atas senyawa polifenol larut-air, yang memiliki bobot molekul yang tinggi. Secara garis besar, tannin terbagi menjadi dua golongan yaitu tannin dapat terhidrolisis, yang terbentuk dari esterifikasi gula (misalnya glukosa) dengan asam fenolat sederhana yang merupakan tannin turunan-sikimat (misalnya asam galat), dan tannin tidak dapat terhidrolisis, yang kadang disebut sebagai tannin terkondensasi, yang berasal dari reaksi polimerisasi (kondensasi) antar flavonoid. Sesuai dengan namanya, tannin dapat terhidrolisis dapat dihidrolisis oleh basa untuk membentuk asam sederhana dan gula. Sifat utama tanin ini adalah kemampuannya berikatan dengan protein. Senyawa ini digunakan untuk menyamak kulit, menjernihkan bir dan sebagai astringen dalam sediaan farmasi. Tanin tersebar luas di dunia tanaman dan dapat diproduksi oleh tanaman sebagai penghalang pakan, karena ikatannya dengan protein membuat tanaman ini tidak menarik untuk dimakan (Heinrich dkk, 2009).
2.3.1 Struktur Dasar Senyawa Flavonoida
Golongan flavonoid dapat digambarkan sebagai deretan senyawa C6-C3-C6. Artinya
kerangka karbonnya terdiri atas dua gugus C6 (cincin benzena tersubstitusi) yang
dihubungkan oleh rantai alifatik tiga karbon.
C C C
A B
Kelas-kelas yang berlainan dalam golongan ini dibedakan berdasarkan cincin heterosiklik-oksigen tambahan dan gugus hidroksil yang tersebar menurut pola yang berlainan. Flavonoid sering terdapat sebagai glikosida. Golongan terbesar flavonoid berciri mempunyai cincin piran yang menghubungkan rantai tiga karbon dengan salah satu dari cincin benzena. Sistem penomoran untuk turunan flavonoid adalah sebagai berikut :
(Robinson, 1995)
2.3.2 Klasifikasi Senyawa Flavonoida
Di alam flavonoida terdapat dalam berbagai bentuk. Hal ini disebabkan adanya modifikasi lebih lanjut seperti dimerisasi, glikosilasi gugus hidroksil atau inti flavonoid, pembentukan bisulfat, yang diuraikan sebagai berikut :
1. Flavonoida O-glikosida
Flavonoida biasanya terdapat sebagai flavonoida O-glikosida. Pada senyawa tersebut satu gugus hidroksil flavonoida atau lebih terikat pada satu gula atau lebih dengan ikatan hemiasetal yang tidak tahan asam. Pengaruh glikosilasi menyebabkan flavonoida menjadi kurang reaktif dan lebih mudah larut dalam air ataupun cairan. Glukosa merupakan gula yang paling umum terlibat walaupun galaktosa, ramnosa, xilosa dan arabinosa juga sering ditemukan.
2. Flavonoida C-glikosida
Gula dapat juga terikat pada atom karbon flavonoida dan dalam hal ini gula tersebut terikat langsung pada inti benzena dengan suatu ikatan karbon-karbon yang tahan asam. Glikosida yang demikian disebut C-glikosida. Jenis gula yang terlibat lebih sedikit dibandingkan dengan gula pada O-glikosida.
3. Flavonoida Sulfat
Flavonoida sulfat adalah golongan flavonoida lain yang mudah larut dalam air. Senyawa ini mengandung satu ion sulfat atau lebih yang terikat pada hidroksi fenol atau gula. Secara teknis senyawa ini sebenarnya bisulfat karena terdapat sebagai garam yaitu flavon-O-SO3K. Banyak yang berupa glikosida bisulfat,
bagian bisulfat terikat pada hidroksil fenol yang mana saja yang masih bebas atau pada suatu gula.
4. Biflavonoida
Biflavonoida merupakan flavonoida dimer. Flavonoida yang biasanya terlibat adalah flavon dan flavanon yang secara biosintesis mempunyai pola oksigenasi yang sederhana dan ikatan antar flavonoida berupa ikatan karbon-karbon atau ikatan eter. Monomer flavonoida yang digabungkan menjadi biflavonoida dapat berjenis sama atau berbeda, dan letak ikatannya berbeda-beda. Banyak sifat fisika dan kimia biflavonoida menyerupai sifat monoflavonoida pembentuknya dan akibatnya kadang-kadang biflavonoida sukar dikenali. Biflavonoida jarang ditemukan sebagai glikosida.
5. Aglikon flavonoida yang aktif-optik
Menurut Harborne (1987), dikenal sekitar sepuluh kelas flavonoida. Semua flavonoida menurut strukturnya merupakan turunan senyawa induk flavon dan memiliki sifat tertentu yaitu:
Tabel 2.1 Sifat Golongan Flavonoida
Golongan flavonoida
Penyebaran Ciri khas
Antosianin
Terutama tidak berwarna, dalam daun tumbuhan yang berkayu.
Terutama ko-pigmen tidak berwarna dalam bunga sianik dan asianik tersebar luas dalam daun.
Seperti flavonol
Seperti flavonol
Tidak berwarna dan hampir seluruhnya terbatas pada gimnospermae
Pigmen bunga kuning,
kadang-kadang terdapat juga dalam jaringan lain
Tidak berwarna, dalam daun dan buah (terutama dalam Citrus)
Tidak berwarna, sering kali dalam akar, hanya terdapat dalam suku Leguminosae
Larut dalam air, λ maks 515-545 nm, bergerak dengan BAA pada kertas.
Menghasilkan antosianidin bila jaringan dipanaskan dalam HCl 2M selama setengah jam.
Setelah hidrolisis, berupa bercak kuning murup pada kromatogram Forestal bila disinari sinar UV, maksimal spektrum pada 330 – 350 nm. Setelah hidrolisis, berupa bercak coklat redup pada kromatogram Forestal mak-simal spektrum pada 330-350 nm.
Mengandung gula yang terikat melalui ikatan C-C, bergerak dengan pengembang air, tidak seperti flavon biasa.
Pada kromatogram BAA
berupa bercak redup dengan RF tinggi .
Dengan amonia berwarna merah (perubahan warna dapat diamati in situ), maksimal spektrum 370-410 nm.
Berwarna merah kuat dengan Mg/HCl, kadang – kadang sangat pahit .
Menurut Robinson (1995), flavonoida dapat dikelompokkan berdasarkan keragaman pada rantai C3 yaitu:
1. Flavonol
Flavonol sering terdapat sebagai glikosida, biasanya 3-glikosida dan aglikon flavonol yang umum yaitu kamferol, kuarsetin dan miresetin yang berkhasiat sebagai antioksidan dan antiinflamasi.Flavonol lain yang terdapat di alam bebas kebanyakan merupakan variasi struktur sederhana dari flavonol. Larutan flavonol dalam suasana basa dioksidasi oleh udara tetapi tidak begitu cepat sehingga penggunaan basa pada pengerjaannya masih dapat dilakukan.
2. Flavon
Flavon berbeda dengan flavonol dimana pada flavon tidak terdapat gugusan 3-hidroksi. Hal ini mempunyai serapan UV-nya, gerakan kromatografi, serta reaksi warnanya. Flavon terdapat juga sebagai glikosidanya lebih sedikit daripada jenis glikosida pada flavonol. Flavon yang paling umum dijumpai adalah apigenin dan luteolin. Luteolin merupakan zat warna yang pertama kali dipakai di Eropa. Jenis yang paling umum adalah 7-glukosida dan terdapat juga flavon yang terikat pada gula melalui ikatan karbon-karbon. Contohnya luteolin 8-C-glikosida. Flavon dianggap sebagai induk dalam nomenklatur kelompok senyawa flavonoida.
O
O O
O
3. Isoflavon
Isoflavon merupakan isomer flavon, tetapi jumlahnya sangat sedikit dan sebagai fitoaleksin yaitu senyawa pelindung yang terbentuk dalam tumbuhan sebagai pertahanan terhadap serangan penyakit. Isoflavon sukar dicirikan karena reaksinya tidak khas dengan pereaksi warna manapun. Beberapa isoflavon (misalnya daidzein) memberikan warna biru muda cemerlang dengan sinar UV bila diuapi amonia, tetapi kebanyakan yang lain tampak sebagai bercak lembayung yang pudar dengan amonia berubah menjadi coklat.
4. Flavanon
Flavanon terdistribusi luas di alam. Flavanon terdapat di dalam kayu, daun dan bunga. Flavanon glikosida merupakan konstituen utama dari tanaman genus prenus dan buah jeruk, dua glikosida yang paling lazim adalah neringenin dan hesperitin, terdapat dalam buah anggur dan jeruk.
O
O
O
5. Flavanonol
Senyawa ini berkhasiat sebagai antioksidan dan hanya terdapat sedikit sekali jika dibandingkan dengan flavonoida lain. Sebagian besar senyawa ini diabaikan karena konsentrasinya rendah dan tidak berwarna.
6. Katekin
Katekin terdapat pada seluruh dunia tumbuhan, terutama pada tumbuhan berkayu. Senyawa ini mudah diperoleh dalam jumlah besar dari ekstrak kental uncaria gambir dan daun teh kering yang mengandung kira-kira 30% senyawa ini. Katekin berkhasiat sebagai antioksidan.
7. Leukoantosianidin
Leukoantosianidin merupakan senyawa tidak berwarna, terutama terdapat pada tumbuhan berkayu. Senyawa ini jarang terdapat sebagai glikosida, contohnya melaksidin, apiferol.
O
O
OH
O
OH
O
OH
8. Antosianidin
Antosianin merupakan pewarna yang paling penting dan paling tersebar luas dalam tumbuhan. Pigmen yang berwarna kuat dan larut dalam air ini adalah penyebab hampir semua warna merah jambu, merah marak, ungu dan biru dalam daun, bunga dan buah pada tumbuhan tinggi. Secara kimia semua antosianin merupakan struktur aromatik tunggal yaitu sianidin dan semuanya terbentuk dari pigmen sianidin ini dengan penambahan atau pengurangan gugus hidroksil atau dengan metilasi atau glikosilasi.
9. Khalkon
Khalkon adalah pigmen fenol kuning yang berwarna coklat tua dengan sinar UV bila dikromatografi kertas. Aglikon khalkon dapat dibedakan dari glikosidanya karena hanya pigmen dalam bentuk glikosida yang dapat bergerak pada kromatografi kertas dalam pengembang air.
O
O
10.Auron
Auron berupa pigmen kuning emas yang terdapat dalam bunga tertentu dan briofita. Dalam larutan basa senyawa ini berwarna ros dan tampak pada kromatografi kertas berupa bercak kuning, dengan sinar ultraviolet warna kuning kuat berubah menjadi merah jingga bila diberi uap amonia.
2.3.3. Sifat Kelarutan Flavonoida
Flavonoid yang berupa aglikon merupakan golongan polifenol yang memiliki sifat senyawa fenol yaitu bersifat agak asam, oleh karena itu dapat larut dalam basa. Namun apabila terlalu lama dibiarkan di dalam larutan basa dan terdapat cukup banyak oksigen, maka dapat terjadi penguraian pada senyawa tersebut. Senyawa flavonoid termasuk senyawa polar, karena mempunyai sejumlah gugus hidroksil ataupun suatu gugus gula. Hal ini memungkinkan flavonoid dapat larut dalam pelarut polar seperti etanol (EtOH), metanol (MeOH), butanol, aseton, dimetilsulfoksida (DMSO), dimetilformamida (DMF), air dan lain-lain. Keberadaan gugus gula yang terikat pada flavonoid (glikosida) cenderung menyebabkan flavonoid lebih mudah terlarut dalam air. Hal ini memberikan pilihan pelarut yang luas karena air dapat dicampurkan dengan pelarut-pelarut di atas. Namun hal sebaliknya tidak berlaku pada aglikon yang kurang polar seperti isoflavon, flavanon, dan flavon serta flavonol yang termetoksilasi cenderung lebih mudah larut dalam pelarut seperti eter dan kloroform (Markham, 1988).
O
O
2.4. Teknik Pemisahan 2.4.1. Ekstraksi
Beberapa metode ekstraksi dapat digunakan untuk mengekstrak suatu konstituen dalam suatu bahan tanaman, yang diantaranya adalah maserasi, perkolasi, ekstraksi sokletasi, ekstraksi pelarut bertekanan, ekstraksi dengan refluks, dan destilasi uap. Dalam ekstraksi padat-cair, bahan tanaman ditempatkan dalam sebuah wadah, dan dibiarkan terjadi kontak dengan pelarut. Proses yang terjadi dari seluruh proses dinamis tersebut dapat diuraikan menjadi beberapa tahap, yaitu tahap pertama pelarut akan berdifusi ke dalam sel, kemudian pelarut akan melarutkan metabolit, dan pada proses akhir pelarut akan berdifusi keluat dari sel bersama dengan metabolit (Sarker, 2007).
Terdapat sejumlah metode ekstraksi, namun yang paling sederhana adalah ekstraksi dingin. Dengan cara ini bahan kering diekstraksi pada suhu kamar secara berturut-turut dengan pelarut yang kepolarannya semakin tinggi, yaitu heksana, kloroform, etil asetat, aseton, metanol, dan air. Keuntungan utama dari cara ini merupakan metode ekstraksi yang mudah karena ekstraksi tidak dipanaskan sehingga sangat kecil kemungkinan bahan alam tidak terurai. Penggunaan pelarut dengan peningkatan kepolaran secara berurutan memungkinkan pemisahan bahan-bahan alam berdasarkan kelarutannnya dan polaritasnya dalam pelarut. Ekstraksi dingin memungkinkan banyak senyawa terekstraksi, walaupun beberapa senyawa memiliki kelarutan yang terbatas dalam pelarut pada suhu kamar (Heinrich dkk, 2009).
2.4.2. Kromatografi
terdistribusi diantara fase diam dan fase gerak. Kekuatan tarik fase diam terhadap solute menghasilkan suatu perlambatan pergerakan untuk melewati sistem (Braithwaite, 1999)
Pemisahan secara kromatografi dilakukan dengan cara mengotak-atik langsung beberapa sifat fisika umum dari molekul. Sifat utama yang terlibat adalah : (1) kecenderungan molekul untuk melarut dalam cairan (kelarutan), (2) kecenderungan molekul untuk melekat pada permukaan serbuk halus (adsorpsi, penjerapan), dan (3) kecenderungan molekul untuk menguap atau berubah ke keadaan uap (keatsirian). Dalam sistem kromatografi, campuran yang akan dipisahkan ditempatkan dalam keadaan sedemikian rupa sehingga komponen-komponennya harus menunjukkan dua dari ketiga sifat tersebut.
Fase padat yang bertindak sebagai fase diam dalam kromatografi cair-padat (KCP) ataupun gas-padat (KGP) disebut sebagai adsorben atau penjerap, sedangkan bahan tempat melekatnya fase diam disebut sebagai penyangga. Jika fase gerak digerakkan melalui fase diam untuk menghasilkan pemisahan kromatografi, proses ini dikenal sebagai pengembangan. Setelah senyawa-senyawa dipisahkan dengan pengembangan, hasilnya didekteksi atau divisualisasi. Jika senyawa-senyawa yang dipisahkan benar-benar dikeluarkan dari sistem, maka senyawa itu telah dielusi atau elusi telah terjadi. Senyawa yang dipisahkan biasanya disebut sebagai linarut, atau secara kelompok disebut cuplikan. Dan hasil keseluruhan dari kromatografi disebut sebagai kromatogram (Gritter, 1991).
2.4.2.1. Kromatografi Lapis Tipis
dihasilkan sangat rapat, sehingga memungkinkan untuk mendeteksi senyawa dalam konsentrasi rendah. Senyawa yang dipisahkan dapat didekteksi dengan semprotan korosif pada suhu tinggi, dimana hal ini tidak dapat dilakukan pada kromatografi kertas.
Hal yang harus diperhatikan adalah atmosfer ruang pemisahan harus jenuh dengan pelarut, karena menentukan besar kecilnya nilai Rf. Hal ini dapat dilakukan dengan menggunakan wadah yang sekecil mungkin, dan menghubungkan dinding dengan kertas yang terendam dalam pelarut. Pengembangan pelarut dalam lempeng biasanya menggunakan teknik ascending, yang berlangsung lebih lambat dibandingkan dengan teknik descending. Letak senyawa hasil pemisahan dapat diketahui dengan menyemprot lempeng tipis dengan pereaksi atau dengan scanning bila menggunakan senyawa radioaktif (Bintang, 2010).
Kromatografi lapis tipis menggunakan lempeng kaca atau aluminium yang telah dilapisi dengan penyerap (misalnya silica gel) dengan ketebalan tertentu tergantung pada jumlah bahan yang akan dimuat ke dalam lempeng. Pelapisan ke dalam lempeng analisis biasanya memiliki ketebalan 0,2 mm; lempeng preparatif memiliki ketebalan hingga 1-2 cm. Campuran senyawa diisikan 1-2 cm dari tepi dasar lempeng berupa bercak ataupun pita memanjang. Lempeng kemudian dimasukkan ke dalam bejana kromatografi berisi pelarut yang telah ditentukan sebelumnya yang akan meresap naik di dalam lempeng dan memisahkan campuran senyawa berdasarkan polaritas komponennya. Lempeng lapis-penyerap sering menggunakan indikator fluoresensi (F254) sehingga bahan alam yang mengabsorpsi sinar UV gelombang
pendek (254 nm) akan tampak sebagai bercak hitam pada latar hijau. Pada sinar UV gelombang-panjang, senyawa tertentu dapat menampakkan fluoresensi biru atau kuning terang. Baik sifat absorbans UV maupun fluoresensi dapat digunakan untuk memantau pemisahan senyawa pada lempeng KLT. Metode ini memiliki sejumlah keuntungan untuk anailsis dan isolasi bahan alam yang aktif secara biologis :
a. Biayanya murah dibandingkan metode instrumental dan hanya butuh sedikit pelatihan atau pengetahuan tentang kromatografi.
c. Fleksibilitas dalam pemilihan fase gerak dan fase diam
d. Pemisahan mudah dioptimalkan dengan menargetkan satu komponen dan metode dapat segera dikembangkan.
e. Secara praktis semua pemisahan dapat dicapai dengan fase gerak dan fase diam yang tepat.
f. Sejumlah besar sampel dapat dianalisis atau dipisahkan secara simultan (Heinrich dkk, 2009).
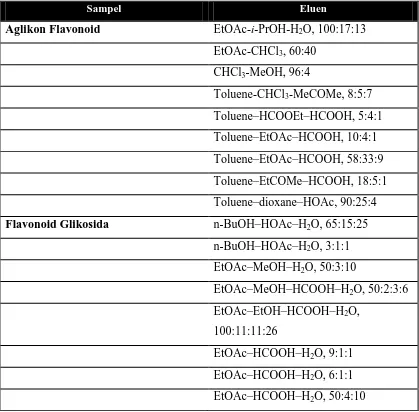
Banyak sistem pelarut yang berbeda telah digunakan untuk pemisahan flavonoid dengan menggunakan KLT, antara lain :
Tabel 2.2 Sistem Pelarut pada Kromatografi lapis tipis untuk senyawa flavonoid
Sampel Eluen
Aglikon Flavonoid EtOAc-i-PrOH-H2O, 100:17:13
EtOAc-CHCl3, 60:40
CHCl3-MeOH, 96:4
Toluene-CHCl3-MeCOMe, 8:5:7
Toluene–HCOOEt–HCOOH, 5:4:1 Toluene–EtOAc–HCOOH, 10:4:1 Toluene–EtOAc–HCOOH, 58:33:9 Toluene–EtCOMe–HCOOH, 18:5:1 Toluene–dioxane–HOAc, 90:25:4 Flavonoid Glikosida n-BuOH–HOAc–H2O, 65:15:25
n-BuOH–HOAc–H2O, 3:1:1
EtOAc–MeOH–H2O, 50:3:10
EtOAc–MeOH–HCOOH–H2O, 50:2:3:6
EtOAc–EtOH–HCOOH–H2O,
100:11:11:26
EtOAc–HCOOH–H2O, 9:1:1
EtOAc–HCOOH–H2O, 6:1:1
EtOAc–HCOOH–HOAc–H2O,
100:11:11:26
EtOAc–HCOOH–HOAc–H2O, 25:2:2:4
THF–toluene–HCOOH–H2O, 16:8:2:1
CHCl3–MeCOMe–HCOOH, 50:33:17
CHCl3–EtOAc–MeCOMe, 5:1:4
CHCl3–MeOH–H2O, 65:45:12
CHCl3–MeOH–H2O, 40:10:1
MeCOMe–butanone–HCOOH, 10:7:1 MeOH–butanone–H2O, 8:1:1
Flavonoid glukuronida EtOAc–Et2O–dioxane–HCOOH–H2O,
30:50:15:3:2
EtOAc–EtCOMe–HCOOH–H2O,
60:35:3:2
Aglikon Flavanone CH2Cl2–HOAc–H2O, 2:1:1
Flavanone glikosida CHCl3–HOAc, 100:4
CHCl3–MeOH–HOAc, 90:5:5
n-BuOH–HOAc–H2O, 4:1:5 (upper
layer)
Khalkon EtOAc–hexane, 1:1
Isoflavon CHCl3–MeOH, 92:8
CHCl3–MeOH, 3:1
Isoflavon glikosida n-BuOH–HOAc–H2O, 4:1:5 (upper
layer)
Dihidroflavonol CHCl3–MeOH–HOAc, 7:1:1
Biflavonoid CHCl3–MeCOMe–HCOOH, 75:16.5:8.5
Toluene–HCOOEt–HCOOH, 5:4:1 Antosianidin dan Antosianin EtOAc–HCOOH–2 M HCl, 85:6:9
n-BuOH–HOAc–H2O, 4:1:2
EtCOMe–HCOOEt–HCOOH–H2O,
EtOAc–butanone–HCOOH–H2O,
6:3:1:1
Proantosianidin EtOAc–MeOH–H2O, 79:11:10
EtOAc–HCOOH–HOAc–H2O,
30:1.2:0.8:8
(Andersen, 2006)
2.4.2.2. Kromatografi Kolom
Kromatografi cair yang dilakukan di dalam kolom besar merupakan metode kromatografi terbaik untuk pemisahan campuran dalam jumlah besar (lebih 1 g). Pada kromatografi kolom, campuran yang akan dipisahkan diletakkan berupa pita pada bagian atas kolom penjerap yang berada dalam tabung kaca. Pelarut (fase gerak) dibiarkan mengalir melalui kolom karena aliran yang disebabkan oleh gaya berat atau didorong dengan tekanan. Pita senyawa linarut bergerak melalui kolom dengan laju yang berbeda, memisah dan dikumpulkan berupa fraksi ketika keluar dari kolom. Untuk pemisahan normal, nisbah bobot 30 : 1 ternyata memadai jika pemisahan tidak terlalu sulit, yang biasanya ditunjukkan dengan bercak-bercak yang letaknya berjauhan pada KLT. Jika pemisahan lebih sulit, harus digunakan nisbah penjerap : linarut yang lebih tinggi yaitu 100 : 1 atau bahkan 300 : 1, dan lebih sering digunakan kolom kecil panjang.
Ukuran partikel penjerap untuk kolom biasanya lebih besar daripada untuk KLT. Kemasan kolom biasanya 63-250 µm untuk kolom yang dijalankan dengan gaya tarik bumi. Kolom yang dijalankan memakai tekanan udara atau pompa, biasanya mengandung partikel 40-63 µm atau lebih halus. Penjerap KLT biasanya dapat melewati ayakan 250 mesh dan mempunyai ukuran partikel lebih kecil dari 63 µm (Gritter, 1991).
kromatografi. Kolom kromatogafi biasanya terbuat dari gelas. Panjang kolom biasanya disesuaikan dengan jumlah komponen yang akan dianalisis dalam suatu senyawa, sedangkan lebar kolom disesuaikan dengan jumlah senyawa yang akan dianalisis. Bahan yang dapat dipakai untuk sediaan kromatografi sebagai pengisi kolom cukup banyak jenisnya. Selama proses kesetimbangan dengan pelarut, bahan pengisi kolom dibiarkan mengendap, dan partikel-partikel halus yang tertinggal dalam suspensi dibuang dengan cara dekantasi. Jika hal ini tidak dilakukan, maka laju alir pelarut yang menuruni kolom akan menurun karena tersumbat oleh partikel-partikel halus.
Kolom kromatografi harus benar-benar padat, bahan kolom kira-kira sepertiga pelarutnya. Suspensi akan tetap tinggal pada kolom, sedangkan kelebihan pelarut akan turun meninggalkan kolom. Lebih baik pada proses turunnya pelarut pada kolom dibantu dengan membuka kran agar larutan menetes, sehingga isi kolom lebih cepat turun. Saat meneteskan sampel dengan pada permukaan kolom, sebaiknya kran kolom dibuka, agar eluen menetes dan sampel masuk ke dalam kolom.
Metode pemisahan kromatografi didasarkan pada perbedaan distribusi molekul-molekul komponen di antara fase gerak dan fase diam berdasarkan perbedaan tingkat kepolaran. Komponen akan bergerak lebih cepat meninggalkan kolom bila molekul-molekul komponen tersebut berinteraksi secara lemah dengan fase diam. Daya interaksi komponen yang akan dipisahkan dengan fase diam sangat menentukan tingkat keberhasilan kromatografi (Bintang, 2010).
2.4.2.3. Harga Rf (Reterdation Factor)
Jarak perambatan bercak dari titik penotolan Rf =
Jarak perambatan pelarut dari titik penotolan (Sastrohamidjojo, 1996)
2.5 Teknik Spektroskopi
Spektroskopi adalah studi mengenai antaraksi antara energi cahaya dan materi. Warna-warna yang tampak dan fakta bahwa orang bisa melihat, adalah akibat-akibat absorpsi energi oleh senyawaan organik maupun anorganik. Yang merupakan perhatian utama dalam kimia organik adalah fakta bahwa panjang gelombang pada mana suatu senyawaan organik menyerap energi cahaya, bergantung pada struktur senyawaan itu. Oleh karena itu teknik-teknik spektroskopi dapat digunakan untuk menentukan struktur senyawaan yang tidak diketahui dan untuk mempelajari karakteristik ikatan dari senyawaan yang diketahui (Fessenden, 1982).
2.5.1. Spektrofotometri Ultra Violet
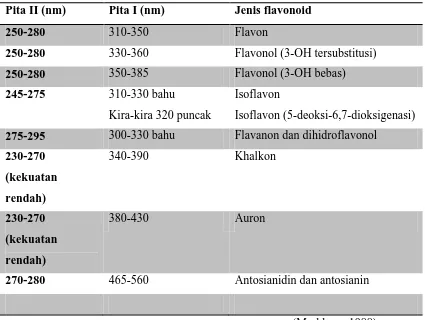
Tabel 2.3 Rentangan serapan spektrum UV-tampak flavonoid
Pita II (nm) Pita I (nm) Jenis flavonoid
250-280 310-350 Flavon
250-280 330-360 Flavonol (3-OH tersubstitusi)
250-280 350-385 Flavonol (3-OH bebas)
245-275 310-330 bahu
Kira-kira 320 puncak
Isoflavon
Isoflavon (5-deoksi-6,7-dioksigenasi) 275-295 300-330 bahu Flavanon dan dihidroflavonol
230-270
270-280 465-560 Antosianidin dan antosianin
(Markham, 1988)
2.5.2. Spektrofotometri Infra Merah (FT-IR)
Instrumen yang digunakan untuk mengukur resapan radiasi inframerah pada berbagai panjang gelombang disebut spektrofotometer inframerah. Pita-pita inframerah dalam sebuah spektrum dapat dikelompokkan menurut intensitasnya, yaitu: kuat (s, strong), medium (m), dan lemah (w, weak). Daerah antara 1400 – 4000 cm-1 (2,5 sampai kira-kira 7,1 µm) yang merupakan bagian kira spektrum inframerah, merupakan daerah yang khusus berguna untuk identifikasi gugus-gugus fungsional. Daerah ini menunjukkan absorpsi yang disebabkan modus uluran. Daerah dikanan 1400 cm-1 seringkali sangat rumit karena baik modus uluran maupun modus tekukan mengakibatkan absorpsi pada daerah tersebut. Dalam daerah ini biasanya korelasi antara suatu pita dan suatu gugus fungsional spesifik tidak dapat ditarik dengan cermat, namun tiap senyawaan organik mempunyai resapan yang khas disini. Oleh karena itu bagian spektrum ini disebut daerah sidik jari (fingerprint region). Meskipun bagian kiri suatu spektrum nampaknya sama untuk senyawaan-senyawaan yang mirip, daerah sidik jari harus sesuai antara dua spektra, agar dapat disimpulkan bahwa kedua senyawaan itu identik (Fessenden, 1982).
2.5.3. Spektrofotometri Resonansi Magnetik Inti Proton (1H-NMR)
Spektroskopi NMR didasarkan pada penyerapan gelombang radio oleh inti-inti tertentu dalam molekul organik, apabila molekul ini berada dalam medan magnet yang kuat. Inti-inti atom unsur-unsur dapat dikelompokkan sebagai inti yang mempunyai spin atau tidak mempunyai spin. Suatu inti berspin akan menimbulkan medan magnet kecil, yang diperikan oleh suatu momen magnetik nuklir, suatu vektor. Jika molekul yang mengandung atom-atom hidrogen diletakkan dalam medan magnetik luar, maka momen magnetik dari tiap inti hidrogen atau proton, akan mengambil salah satu dari dua orientasi dilihat dari medan magnet luar itu. Kedua orientasi yang diambil oleh momen magnetik nuklir itu adalah paralel atau antiparalel terhadap medan luar. Dalam keadaan paralel, arah momen magnetik proton sama dengan arah medan luar. Dalam keadaan antiparalel, momen magnetik proton berlawanan arah dengan medan luar (Fessenden, 1982).
Sesuai dengan persamaan dasar TMI, dengan nisbah magnetorik yang merupakan sifat hakiki inti, maka antaraksi energi kerapan-radio dengan medan magnet kuat pada suatu proton, hanya satu puncak tunggal. Luas puncak (yang diukur dengan perangkun) sebanding dengan jumlah proton yang terwakili (Silverstein, 1986). Spektrum Resonansi Mangetik Inti pada umunya digunakan untuk:
1. Menentukan jumlah proton yang memiliki lingkungan kimia yang sama pada suatu senyawa organik.
2. Mengetahui informasi mengenai struktur suatu senyawa organik.
Pada beberapa spektrum NMR akan terlihat sinyal TMS pada angka nol sehingga sinyal ini tidak perlu dianalisa. TMS dipilih sebagai standar karena:
1. TMS mempunyai 12 atom hidrogen yang keseluruhannya mempunyai lingkungan kimia yang sama, sehingga menghasilkan sinyal singlet yang kuat karena mengandung banyak atom hidrogen
BAB 3
7. Tabung reaksi Pyrex
8. Spatula 9. Pipa kapiler 10.Pipet tetes
11.Labu takar 250 ml Pyrex
12.Labu rotarievaporator 1000 ml
13.Labu didih 1000 ml Schoot / Duran
14.Rotarievaporator
15.Kolom kromatografi Pyrex
16.Botol vial
17.Neraca analitis Mettler AE 200
18.Lampu UV 19.Penangas Air 20.Statif dan klem 21.Alat destilasi 22.Bunsen 23.Bejana KLT
24.Spektrofotometer FT-IR Shimadzu
25.Spektrofotometer UV-Visible
3.2 Bahan-bahan
1. Daun sambang darah
2. Metanol Destilasi
3. N-heksana Teknis
4. Etil asetat Teknis
5. Aquadest
6. Kloroform Teknis
7. Silika gel 40 (70-230 mesh) ASTM E.Merck. KGaA 8. FeCl3 5%
9. NaOH 10% 10.Mg-HCl 11.H2SO4 (p)
12.HCl 2N
13.Plat KLT Merck/ Kieselgel 60 F254
14.Pereaksi Benedict
3.3 Prosedur Penelitian
3.3.1 Penyediaan Sampel
Sampel yang diteliti adalah daun tumbuhan sambang darah yang diperoleh dari areal sekitar kampus USU, Medan, Sumatera Utara. Daun tumbuhan sambang darah dikeringkan di dalam dan pada suhu ruangan, lalu dihaluskan sampai diperoleh serbuk daun sambang darah sebanyak 1000 gram.
3.3.2 Uji Skrining Fitokimia
- Dimasukkan ± 10 gram serbuk daun tumbuhan sambang darah yang telah dikeringkan dan dipotong kecil-kecil ke dalam Erlenmeyer
- Ditambahkan metanol ± 100 ml - Didiamkan
- Disaring
- Dibagi ekstrak metanol kedalam 4 tabung reaksi - Ditambahkan masing-masing pereaksi :
a. Tabung I : dengan FeCl3 5% menghasilkan larutan hitam
b. Tabung II : dengan NaOH 10% menghasilkan larutan biru violet c. Tabung III : dengan Mg-HCl menghasilkan larutan merah muda d. Tabung IV : dengan H2SO4(p) menghasilkan larutan merah
3.3.3 Ekstraksi Daun Tumbuhan Sambang Darah
Serbuk daun tumbuhan sambang darah ditimbang sebanyak 1000 gram, kemudian dimasukkan ke dalam ekstraktor dan diekstraksi maserasi dengan metanol sebanyak 7 liter hingga semua sampel terendam secara merata, dibiarkan selama ± 72 jam dan diulangi sebanyak 2 kali. Hasil ekstraksi ditampung dan dipekatkan dengan menggunakan alat rotarievaporator sehingga diperoleh ekstrak pekat metanol. Kemudian ekstrak pekat metanol diuapkan diatas penangas air sampai semua pelarut metanol menguap. Lalu dilakukan pemblokan tanin dengan cara melarutkan ekstrak pekat metanol dengan etil asetat dan disaring. Filtrat etilasetat dirotarievaporator dan diuapkan hingga semua pelarut etilasetat habis menguap. Fraksi pekat etil asetat dilarutkan kembali dengan metanol dan dilakukan ekstraksi partisi secara berulang-ulang dengan n-heksana, dimana partisi dihentikan ketika lapisan n-heksana menjadi bening. Kemudian lapisan metanol diuapkan hingga pekat sehingga diperoleh ekstrak pekat metanol sebanyak 16,33 gram.
3.3.4 Pemutusan Gula dari Senyawa Flavonoida (Hidrolisa)
diaduk di atas penangas air selama 1 jam, kemudian didinginkan dan disaring. Ekstrak metanol-asam hasil hidrolisa diekstraksi partisi dengan kloroform sebanyak 3 kali. Kemudian lapisan kloroform dirotarievaporator lalu diuapkan di atas penangas air hingga semua pelarut kloroform menguap sehingga diperoleh ekstrak pekat kloroform sebanyak 1,44 gram.
3.3.5 Analisis Kromatografi Lapis Tipis
Analisis kromatografi lapis tipis dilakukan terhadap ekstrak kloroform dengan menggunakan fase diam silika gel 60 F254 Merck. Analisis ini bertujuan untuk mencari
perbandingan pelarut yang sesuai untuk pemisahan senyawa didalam analisis kromatografi kolom. Pelarut yang sesuai didasarkan pada jumlah bercak atau noda yang terpisah dengan baik dalam kromatografi lapis tipis.
Pelarut yang digunakan adalah campuran antara n-heksana : etil asetat dengan perbandingan (90:10) v/v, (80:20) v/v, (70:30) v/v, (60:40) v/v. Prosedur yang dilakukan adalah dimasukkan 10 ml larutan fase gerak n-heksana : etil asetat (90:10) v/v ke dalam bejana kromatografi, kemudian dijenuhkan. Ditotolkan ekstrak pekat metanol pada batas bawah plat KLT yang telah diaktifkan. Dimasukkan plat ke dalam bejana yang berisi pelarut yang telah dijenuhkan dan ditutup. Setelah proses elusi selesai, plat dikeluarkan dari dalam bejana dan dikeringkan. Kemudian plat difiksasi dengan pereaksi FeCl3 5%. Diamati warna bercak yang timbul dan dihitung harga Rf
yang diperoleh. Dilakukan perlakuan yang sama untuk perbandingan pelarut n-heksana : etil asetat (80:20) v/v, (70:30) v/v, dan (60:40) v/v.
3.3.6 Isolasi Senyawa Flavonoida dengan Kromatografi Kolom
n-heksan : etil asetat dengan perbandingan (90:10) v/v, (80:20) v/v, (70:30) v/v, dan (60:40) v/v.
Dirangkai alat kolom kromatografi. Terlebih dahulu dibuburkan 65 gram silika gel dengan menggunakan n-heksana, diaduk hingga homogen lalu dimasukkan ke dalam kolom kromatografi. Kemudian dielusi dengan menggunakan n-heksana 100% hingga silika gel padat dan homogen. Dimasukkan 1,44 gram ekstrak pekat kloroform yang telah dibuburkan juga terlebih dahulu dengan silika gel ke dalam kolom kromatografi yang telah berisi silika gel yang telah padat. Lalu ditambahkan fasa gerak n-heksana : etil asetat (90:10) v/v secara perlahan-lahan dan diatur sehingga aliran fasa yang keluar dari kolom sama banyaknya dengan penambahan fasa gerak dari atas. Ditingkatkan kepolaran dengan menambahkan fasa gerak n-heksana : etil asetat dengan perbandingan (80:20) v/v, (70:30) v/v, dan (60:40) v/v. Hasil yang diperoleh ditampung dalam botol vial setiap 5 ml lalu di KLT dan digabung fraksi dengan harga Rf yang sama.
3.3.7 Pemurnian
Senyawa yang diperoleh dari hasil isolasi dimurnikan dengan melarutkan kembali pasta yang diperoleh dengan pelarut etil asetat, diaduk hingga semua pasta larut sempurna. Kemudian ditambahkan n-heksana secara perlahan-lahan melalui dinding beaker glass hingga terjadi pengendapan zat-zat pengotor di dasar wadah. Kemudian didekantasi larutan pada lapisan atas (n-heksana), lalu diuapkan sisa pelarut dari pasta hingga diperoleh pasta yang bebas dari pelarut.
3.3.8 Uji Kemurnian Hasil Isolasi dengan Kromatografi Lapis Tipis (KLT)
Uji kemurnian pasta dilakukan dengan kromatografi lapis tipis dengan menggunakan fasa diam silika gel 60 F254 dengan fasa gerak n-heksana : etil asetat (60:40) v/v,
yang sebelumnya telah dilarutkan dengan etil asetat pada plat KLT. Dimasukkan plat KLT tersebut ke dalam bejana kromatografi yang telah jenuh. Setelah pelarut fasa gerak merembes sampai batas atas, plat KLT dikeluarkan dari bejana, dikeringkan dan difiksasi dengan menggunakan pereaksi FeCl3 5%. Diamati warna noda yang dihasilkan dan dihitung harga Rf yang diperoleh.
3.3.9 Identifikasi Senyawa Hasil Isolasi
3.3.9.1 Identifikasi dengan Spektrofotometer UV-Visible
Analisis dengan alat spektrofotometer UV-Visible diperoleh dari Laboratorium Pusat Penelitian Kimia – LIPI, kawasan PUSPITEK Serpong Tangerang dengan menggunakan metanol sebagai pelarut.
3.3.9.2 Identifikasi dengan Spektrofotometer Inframerah (FT-IR)
Analisis dengan alat spektrofotometer FT-IR diperoleh dari Laboratorium Pusat Peneltian Kimia – LIPI, kawasan PUSPITEK Serpong Tangerang dengan menggunakan KBr sebagai pelarut.
3.3.9.3 Identifikasi dengan Spektrometer Resonansi Magnetik Inti Proton (1H-NMR)
3.4 Bagan Skrining Fitokimia
Serbuk daun tumbuhan sambang darah (E. cochinchinensis Lour)
diekstraksi maserasi dengan metanol disaring
dipekatkan
dibagi ke dalam 4 tabung reaksi
Tabung I Tabung II Tabung III Tabung IV
3.5 Bagan Penelitian
1000 g serbuk daun tumbuhan sambang darah (E. cochinchinensis Lour)
Diskrining fitokimia Dimaserasi dengan metanol sebanyak 7L
Didiamkan selama ± 72 jam Diulangi sebanyak 2 kali Disaring
Ekstak metanol Residu
Diskrining fitokimia
Dipekatkan dengan rotarievaporator
Diuapkan hingga semua pelarut metanol menguap
Ekstrak pekat metanol
Dilarutkan dengan etil asetat secara berulang-ulang sampai bening Disaring
Diekstraksi partisi dengan n-heksana hingga bening
Lapisan Metanol Lapisan n-heksana (tidak dilanjutkan) Diskrining fitokimia
Dipekatkan dengan rotarievaporator
Dilakukan uji kandungan gula dengan pereaksi benedict (+) Dihidrolisa dengan HCl 2N sambil dipanaskan selama 1 jam Didinginkan
Disaring
Ekstrak metanol asam Residu
Diekstraksi partisi dengan kloroform sebanyak 3 kali
Lanjutan
Lapisan kloroform
Dipekatkan
Ekstrak pekat kloroform
Diskrining fitokimia
Diuji KLT untuk mengetahui sistem eluen yang sesuai pada kromatografi kolom Dikolom kromatografi dengan fasa diam silika gel dan fasa gerak
yaitu campuran pelarut n-heksana:etil asetat dengan perbandingan (90:10; 80-20; 70:30; 60:40) v/v
Ditampung tiap fraksi sebanyak 5 ml dalam botol vial Diuji KLT untuk mengetahui harga Rf
Digabung fraksi dengan harga Rf yang sama
Fraksi 1 - 67
Hasil negatif Hasil negatif Hasil Positif Hasil Positif
BAB 4
HASIL DAN PEMBAHASAN
4.1 Hasil Penelitian
Hasil skrining fitokimia terhadap ekstrak metanol dari daun tumbuhan sambang darah (E. cochinchinensis Lour) menunjukkan bahwa sampel positif terhadap pereaksi-pereaksi flavonoida. Hasil isolasi senyawa flavonoida dari daun tumbuhan sambang darah yaitu berupa pasta, berwarna coklat kekuningan dengan massa = 37 mg, dan harga Rf = 0,44 dengan fase gerak n-heksana : etil asetat (60:40) v/v positif terhadap pereaksi flavonoida.
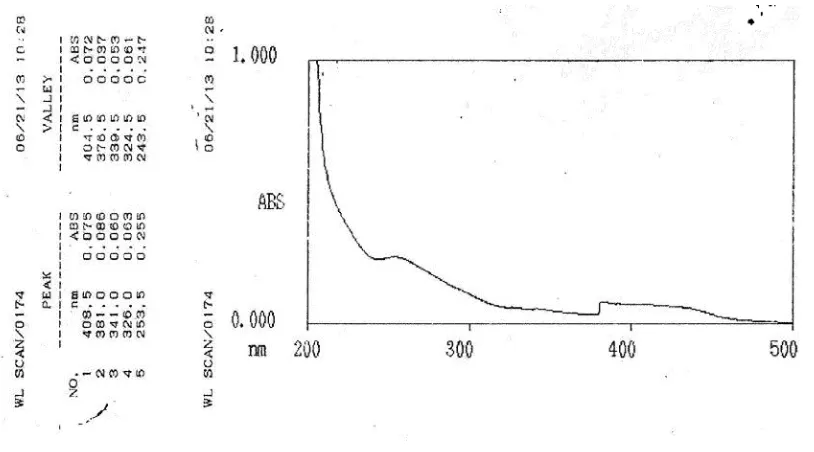
Spektrum UV-Visible senyawa hasil isolasi ditunjukkan pada gambar 4.1 di bawah ini :
Keterangan, x : Panjang gelombang (nm) y : Absorbansi (abs)
Hasil analisis Spektrofotometer Ultraviolet-Visible (UV-Vis) dengan pelarut metanol memberikan panjang gelombang maksimum (λ maks) sebagai berikut :
1. Pada pita I memberikan panjang gelombang 381 nm 2. Pada pita II memberikan panjang gelombang 253,5 nm
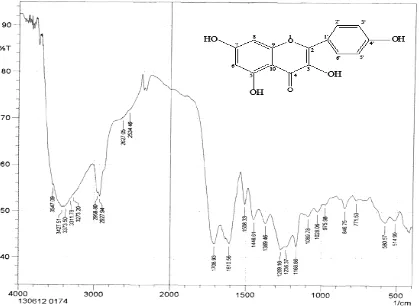
Spektrum FT-IR senyawa hasil isolasi dapat dilihat pada gambar 4.2 dibawah ini :
Keterangan, x : Bilangan gelombang (cm-1) y : Transmitasi (%T)
Gambar 4.2 Spektrum FT-IR Senyawa Hasil Isolasi
Dari hasil analisa Spektrofotometer Infra Merah (FT-IR) memberikan pita-pita serapan pada daerah bilangan gelombang (cm-1) sebagai berikut :
2. Pada bilangan gelombang 2958,80 – 2927,94 cm-1 puncak tajam menunjukkan adanya vibrasi ulur C-H.
3. Pada bilangan gelombang 1708,93 cm-1 puncak sedang menunjukkan adanya vibrasi ulur ikatan rangkap C=O dari keton.
4. Pada bilangan gelombang 1610,56 cm-1 puncak sedang menunjukkan adanya vibrasi ulur C=C dari sistem alkena.
5. Pada bilangan gelombang 1508,33 – 1446,61 cm-1 puncak tajam menunjukkan adanya vibrasi ulur C=C dari sistem aromatik.
6. Pada bilangan gelombang 1269,16 – 1236,37 cm-1 puncak sedang menunjukkan adanya vibrasi ulur C-O dari gugus alkohol.
7. Pada bilangan gelombang 1168,86 cm-1 puncak tajam menunjukkan adanya vibrasi ulur C-CO-C dari gugus keton.
8. Pada bilangan gelombang 1089,78 – 1028,06 cm-1 puncak sedang menunjukkan adanya vibrasi ulur dari C-O-C simetris.
9. Pada bilangan gelombang 975,98 cm-1 puncak sedang menunjukkan adanya vibrasi tekuk C-H aromatis (Silverstein, 1986).
Spektrum Resonansi Magnetik Inti Proton (1H-NMR) senyawa hasil isolasi dapat dilihat pada gambar 4.3 dibawah ini :
Gambar 4.3 Spektrum 1H-NMR Senyawa Hasil Isolasi
Gambar 4.4 Ekspansi Spektrum 1H-NMR Senyawa Hasil Isolasi pada 1,0 – 9,0 ppm
Dari hasil analisis Spektrometer Resonansi Magnetik Inti Proton (1H-NMR) senyawa hasil isolasi dengan menggunakan pelarut Aseton-d6 memberikan pergeseran kimia
pada daerah (ppm) sebagai berikut :
1. Pergeseran kimia pada daerah δ = 6,2600 – 6,2639 ppm dengan puncak doublet menunjukkan proton-proton H-6 pada cincin A struktur flavonoida.
2. Pergeseran kimia pada daerah δ = 6,5285 – 6,5324 ppm dengan puncak doublet menunjukkan proton-proton H-8 pada cincin A struktur flavonoida.
3. Pergeseran kimia pada daerah δ = 6,8969 – 6,9151 ppm dengan puncak doublet menunjukkan proton-proton H-3’ dan H-5’ pada cincin B struktur flavonoida. 4. Pergeseran kimia pada daerah δ = 7,8931 – 7,9112 ppm dengan puncak doublet
5. Pergeseran kimia pada daerah δ = 9,3069 ppm dengan puncak singlet menunjukkan proton dari OH pada C-5 dari cincin B struktur flavonoida.
4.2 Pembahasan
Dari hasil kromatografi lapis tipis, diperoleh bahwa perbandingan pelarut yang sesuai untuk mengisolasi senyawa flavonoida pada kromatografi kolom dari daun tumbuhan sambang darah adalah campuran pelarut n-heksana : etil asetat (60:40) v/v yang menunjukkan pemisahan yang lebih baik dari noda yang dihasilkan (Lampiran C). Proses pemisahan dilakukan dengan kolom kromatografi dan fraksi yang dihasilkan diuji KLT untuk mengetahui kemurnian dan harga Rf yang sama. Kemudian fraksi yang memiliki harga Rf yang sama digabungkan dan kemurniannya diuji dengan menggunakan eluen n-heksana : etil asetat (60:40) v/v, benzena : eter (80:20) v/v, dan kloroform : metanol (80:20) v/v yang menunjukkan hanya satu noda pada senyawa yang dihasilkan (Lampiran D).
Hasil intepretasi Spektrum Infra-Merah dan Spektrum Resonansi Magnetik Inti Proton (1H-NMR) senyawa hasil isolasi dengan menggunakan pelarut Aseton-d6
dalam standar TMS diperoleh :
1. Pergeseran kimia pada daerah δ = 9,3069 ppm dengan puncak singlet menunjukkan proton dari OH pada C-5 dari cincin B struktur flavonoida. Hal ini didukung oleh spektrum inframerah pada bilangan gelombang 3547,09 – 3311,78 cm-1 puncak melebar menunjukkan adanya vibrasi ulur –OH dan spektrum pada bilangan gelombang 1269,16 – 1236,37 cm-1 dengan puncak sedang menunjukkan adanya vibrasi ulur C-O dari gugus alkohol.
2. Pergeseran kimia pada daerah δ = 7,8931 – 7,9112 ppm dengan puncak doublet menunjukkan proton-proton H-2’ dan H-6’ pada cincin B struktur flavonoida (Lampiran F). Hal ini didukung oleh spektrum inframerah pada bilangan gelombang 2958,80 – 2927,94 cm-1 puncak tajam menunjukkan adanya vibrasi ulur C-H dan pada bilangan gelombang 1508,33 cm-1 dengan puncak tajam menunjukkan adanya vibrasi ulur C=C aromatis.
gelombang 2958,80 – 2927,94 cm-1 puncak tajam menunjukkan adanya vibrasi ulur C-H dan pada bilangan gelombang 1508,33 cm-1 dengan puncak tajam menunjukkan adanya vibrasi ulur C=C aromatis.
4. Pergeseran kimia pada daerah δ = 6,5285 – 6,5324 ppm dengan puncak doublet menunjukkan proton-proton H-8 pada cincin A struktur flavonoida (Lampiran F). Hal ini didukung oleh spektrum inframerah pada bilangan gelombang 2958,80 – 2927,94 cm-1 puncak tajam menunjukkan adanya vibrasi ulur C-H dan pada bilangan gelombang 1508,33 cm-1 dengan puncak tajam menunjukkan adanya vibrasi ulur C=C aromatis.
5. Pergeseran kimia pada daerah δ = 6,2600 – 6,2639 ppm dengan puncak doublet menunjukkan proton-proton H-6 pada cincin A struktur flavonoida (Lampiran F). Hal ini didukung oleh spektrum inframerah pada bilangan gelombang 2958,80 – 2927,94 cm-1 puncak tajam menunjukkan adanya vibrasi ulur C-H dan pada bilangan gelombang 1508,33 cm-1 dengan puncak tajam menunjukkan adanya vibrasi ulur C=C aromatis.
Dari hasil interpretasi spektrum UV-Vis memberikan serapan pada pita I dengan panjang gelombang 381 nm dan pita II dengan panjang gelombang 253,5 nm yang menunjukkan panjang gelombang senyawa hasil isolasi berada pada rentang panjang gelombang senyawa flavonoida golongan flavonol (dengan panjang gelombang pita I berkisar 350-385 nm dan pita II 250-280 nm) (Lampiran E). Namun bentuk peak serapan dari spektrum UV-Vis senyawa hasil isolasi tidak begitu jelas, disebabkan oleh pengaruh konsentrasi senyawa yang sangat rendah.
Selain itu, dari data Spektrum Inframerah senyawa hasil isolasi diperoleh pada bilangan gelombang 2958,80 – 2927,94 cm-1 puncak tajam menunjukkan vibrasi ulur C-H dan pada bilangan gelombang 1508,33 – 1446,61 cm-1 puncak tajam menunjukkan adanya vibrasi ulur C=C dari cincin benzena, serta pada bilangan gelombang 975,98 cm-1 puncak sedang menunjukkan adanya vibrasi tekuk dari C-H benzena.
Dari hasil pembahasan diatas, data spektrum UV-Vis, data inframerah dan
1
H-NMR dapat, dan berdasarkan skrining fitokimia dapat diduga bahwa senyawa yang diisolasi dari daun tumbuhan sambang darah (E. cochinchinensis Lour) merupakan senyawa flavonoida golongan flavonol dengan kerangka sebagai berikut :
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
1. Dari hasil uji skrining fitokimia dengan pereaksi flavonoida menunjukkan bahwa daun tumbuhan sambang darah (E. cochinchinensis Lour) mengandung senyawa flavonoida.
2. Hasil isolasi senyawa flavonoida dari daun tumbuhan sambang darah (E. cochinchinensis Lour) yaitu berupa pasta, berwarna coklat kekuningan dengan
massa = 37 mg, dan harga Rf = 0,44 dengan fase gerak n-heksana : etil asetat (60:40) v/v positif terhadap pereaksi flavonoida. Hasil uji kemurnian Kromatografi Lapis Tipis terhadap pasta hasil isolasi yang diperoleh dengan harga Rf = 0,16 dengan fase gerak benzena : eter (80:20) v/v dan harga Rf = 0,7 dengan fase gerak kloroform : metanol (80:20) v/v, positif terhadap pereaksi flavonoida.
3. Hasil analisis dengan spektrofotometer inframerah (FT-IR), spektrofotometer Ultraviolet-Visible (UV-Vis) dan spektrometer Resonansi Magnetik Inti Proton (1H-NMR) menunjukkan bahwa senyawa hasil isolasi dari daun tumbuhan sambang darah diduga adalah senyawa flavonoida golongan flavonol.
5.2 Saran
DAFTAR PUSTAKA
Andersen, M & Markham, K.R. 2006. Flavonoids. New York: Taylor & Francis Group
Anonim. 2010. Trubus Herbal Indonesia Berkhasiat. Vol 08. Depok: Redaksi Trubus
A. S. R. Anjaneyulu, V. L. Rao. 2000. Phytochemistry. 55, 891
Bintang, M. 2010. Biokimia Teknik Penelitian. Bogor: Erlangga
Braithwaite, A & Smith, F.J. 1996. Chromatographic Methods. Fifth Edition. Netherlands: Kluwer Academic Publishers
Heinrich, M, dkk. 2009. Farmakognosi dan Fitoterapi. Jakarta: Penerbit Buku Kedokteran
Dalimartha, S. 2003. Atlas Tumbuhan Obat Indonesia. Jilid 3. Cetakan Pertama. Jakarta: Pustaka Bunda
Do T. L. 1991. Vietnamese Medicinal Plants and Herbal Remedies. pp 555-556. Hanoi: Science and Technology
Fessenden, R. J & Fessenden, J.S. 1982. Kimia Organik. Jilid 1. Edisi Kedua. Terjemahan Aloysius Pudjaatmaka. Jakarta: Erlangga
Gritter, R. J. 1991. Pengantar Kromatografi. Terbitan kedua. Terjemahan Kosasih Padmawinata. Bandung: Penerbit ITB
Harbone, J. B. 1987. Metoda Fitokimia Penuntun Cara Modern Menganalisa Tumbuhan. Terbitan Kedua. Terjemahan Kosasih Padmawinata dan Iwang Soediro. Bandung: Penerbit ITB
Jing-Hua Yuang et al. 2005. Three New Highly Oxygenated Diterpenoids from Excoecaria cochinchinensis Lour. China: Yunnan University
Manitto, P. 1992. Biosintesis Produk Alami. Cetakan Pertama. Terjemahan Koensoemardiyah. Semarang: Penerbit IKIP Press
Nessa, F. 2003. Free Radical-Scavenging Activity of Organic Extract and Pure Flavonoids of Blumea balsamifera DC Leaves. Food Chemistry. 88 (2004) hal 243-252
Patrick, G. 2004. Organic Chemistry. Second Edition. New York: Taylor & Francis Group
P. Leelapornpisid et al. 2005. Antimicrobial Activity of Herbal Extracts on Staphylococcus aureus and Propionibacterium acnes. Chiang Mai. Thailand
Phan Minh Giang et al. 2005. New Megastigmane Glucosides from Excoecaria cochinchinensis Lour. Var cochinchinensis. Vol 53 No. 12. Vietnam: Vietnam National University
Robinson, T. 1995. Kandungan Organik Tumbuhan Tinggi. Terjemahan Padmawinata. Bandung: Penerbit ITB
Sarker, S et al 2006. Natural Products Isolation. Second Edition. Totowa, New Jersey: Humana Press Inc
Sastrohamidjojo, H. 1996. Sintesis Bahan Alam. Yogyakarta: Penerbit Gadjah Mada University Press
Silverstein, R. M. 1986. Penyelidikan Spektrometrik Senyawa Organik. Terjemahan A. J. Hatomo dan Anny Viktor Purba. Edisi Keempat. Jakarta: Penerbit Erlangga
Lampiran C. Kromatogram Lapis Tipis Ekstrak Pekat Kloroform daun tumbuhan Sambang Darah (E. cochinchinensis Lour) sebelum Kromatografi Kolom
E E E E
I
II
III
IV
Keterangan
Fasa diam : Kieselgel 60 F254
E : Ekstrak pekat kloroform daun sambang darah
No Fasa gerak Jumlah noda Rf
I n-heksana : etil asetat (90:10) v/v - -
II n-heksana : etil asetat (80:20) v/v 2 0,12
0,22
III n-heksana : etil asetat (70:30) v/v 5
0,10 0,22 0,36 0,44 0,54
IV n-heksana : etil asetat (60:40) v/v 6
Lampiran D. Kromatogram Lapis Tipis Senyawa Hasil Isolasi
E E E
I
II
III
Keterangan :
Fasa diam : Kieselgel 60 F254
E : Ekstrak Pekat Etil asetat daun sambang darah I : Fasa gerak n-heksana : etil asetat (60:40) v/v II : Fasa gerak kloroform : metanol (80:20) v/v III : Fasa gerak benzena : eter (80:20) v/v
No Fasa gerak Jumlah noda Rf
I n-heksana : etil asetat (60:40) v/v 1 0,44
II kloroform : metanol (80:20) v/v 1 0,7
Lampiran F. Ekspansi Spektrum 1H-NMR Senyawa Hasil Isolasi pada δ = 5,6 - 8,2 ppm
H-2' H-6'
H-3' H-5'