1
ISOLASI SENYAWA FLAVONOIDA DARI BUNGA TUMBUHAN MAWAR PUTIH (Rosa hybrida L.)
SKRIPSI
RUT SAMAYANA LUBIS 110802041
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
2
ISOLASI SENYAWA FLAVONOIDA DARI BUNGA
TUMBUHAN MAWAR PUTIH (Rosa hybrida L.)
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar sarjana sains
RUT SAMAYANA LUBIS 110802041
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
3
PERSETUJUAN
Judul : Isolasi Senyawa Flavonoida Dari Bunga Mawar
Putih (Rosa Hybrida L.)
Kategori : Skripsi
Nama Mahasiswa : Rut Samayana Lubis
Nomor Induk Mahasiswa : 110802041
Program Studi : Sarjana (S1) Kimia
Departemen : Kimia
Fakultas : Matematika dan Ilmu Pengetahuan Alam
(FMIPA) Universitas Sumatera Utara Disetujui di
Medan, Agustus 2015 Komisi Pembimbing :
Pembimbing 2 Pembimbing 1
Lamek Marpaung, M.Phil, Ph.D Dr. Sovia Lenny, M.Si NIP: 1952 0828 1982 031001 NIP: 1975 1018 2000 032001 Diketahui/ Disetujui oleh
Departemen Kimia FMIPA USU Ketua,
4
PERNYATAAN
ISOLASI SENYAWA FLAVONOIDA DARI BUNGA MAWAR PUTIH (Rosa hybrida L.)
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Agustus 2015
5
PENGHARGAAN
Segala Puji dan syukur penulis panjatkan kepada Tuhan Yesus Kristus karena atas berkat dan kasihNya yang senantiasa menyertai sehingga penulis dapat menyelesaikan penelitian dan penulisan skripsi.
Ucapan terima kasih yang tak terhingga penulis sampaikan kepada kedua orang tua yang sangat saya sayangi dan cintai Charlos Lubis dan Anni Luceria Sianipar yang selalu memberikan kasih sayang, doa, motivasi, dukungan dan materi. Serta kepada adik penulis Ribka, Daniel, Debora yang juga selalu memberi dukungan kepada penulis. Penulis juga menyadari bahwa skripsi ini tidak akan selesai tanpa adanya bantuan dari berbagai pihak, maka penulis mengucapkan terima kasih yang luar biasa kepada:
1. Ibu Dr.Sovia Lenny,M.Si dan Bapak Lamek Marpaung, M.Phill, Ph.D selaku dosen pembimbing yang telah banyak memberikan bimbingan, arahan, ilmu dan waktu kepada penulis selama penulis melakukan penelitian hingga penulisan skripsi ini selesai.
2. Ibu Dr. Rumondang Bulan Nst, MS selaku ketua Departemen Kimia, Bapak Drs. Albert Pasaribu, M.Sc. selaku sekretaris Departemen Kimia.
3. Seluruh Bapak dan Ibu Dosen Departemen Kimia yang
memberikan ilmu dan motivasi.
4. Kepala Laboratorium Bapak Lamek Marpaung, M.Phil, Ph.D yang juga sangat banyak memberikan bimbingan, ilmu, arahan, dan membantu saya khususnya pada saat mengerjakan penelitian serta kepercayaan kepada saya untuk menjadi assisten di lab KBA Hayati.
5. Sahabat penulis Siska Yuliani dan Benni P. Sianipar,S.Si yang selalu mendukung penulis dan membuat penulis kembali semangat. 6. Teman-teman stambuk 2011 dan Assisten KBA Hayati yakni
teman-teman seperjuangan.
6
ISOLASI SENYAWA FLAVONOIDA DARI BUNGA TUMBUHAN MAWAR PUTIH (Rosa hybrida L.)
ABSTRAK
Telah dilakukan isolasi senyawa flavonoida pada 900 gram bunga tumbuhan mawar putih (Rosa hybrida L.) secara ekstraksi maserasi dengan pelarut metanol. Lapisan metanol dipekatkan dan dihidrolisa dengan HCl 2 N. Filtratnya diekstraksi partisi dengan kloroform. Ekstrak pekat kloroform dianalisis dengan KLT. Pemisahan komponen dilakukan dengan menggunakan kromatografi kolom dengan fasa diam silika gel dan fasa gerak n-heksana:etil asetat dengan perbandingan (90:10) v/v, (80:20) v/v, (70:30) v/v dan (60:40) v/v. Hasil yang
diperoleh adalah kristal jarum, berwarna kuning sebanyak 10 mg, titik lebur 154-1560 C dan Rf = 0.58. Struktur dianalisa dengan menggunakan Spektroskopi UV-Visible, Inframerah (FT-IR) dan Resonansi Magnetik Inti Proton (1H-NMR). Dari hasil analisa spektroskopi diduga bahwa senyawa yang diperoleh adalah senyawa flavonoid golongan flavonol.
7
ISOLATION OF FLAVONOID COMPOUND FROM FLOWER OF WHITE ROSE (Rosa hybrida L.)
ABSTRACT
Has been done isolation of flavonoid compound 900 gram flower of white rose (Rosa hybrida L.) with extraction maceration by methanol solvent. Methanol layer was concentrated and then hydrolized with HCl 2 N, then the filtrate was extracted with chloroform. The concentrated choloroform extract was analysed with TLC. The separation compound was done with Column Chromatography with silica gel as the stationary phase and n-hexane:ethyl acetate (90:10) v/v,
(80:20) v/v,(70:30) v/v and(60:40) v/v as the mobile phase. The fractions from
n-hexane : aethy acetate (70:30) v/v were purified with TLC preparative and
recrystallized to get pure compound. The result is yellow crystal with weight 10 mg, melting point 154-1560 C dan Rf = 0.58. The structure was analyzed with using UV-Visible, Fourier Transform Infra Red (FT-IR) and Proton Nuclear Magnetic Resonancy (1H-NMR) Spectroscopy. From the analysis spectrocopy, was estimated that isolated compound of flavonoid is flavonol.
9 3.3.5.4. Uji Kemurnian Hasil Isolasi dengan Titik Lebur 28
10
DAFTAR TABEL
Nomor Judul Halaman
Tabel
Tabel 2.1. Eluen yang digunakan untuk Kromatografi 16
Tabel 2.2. Fase Diam yang digunakan untuk Kromatografi Lapis Tipis 18
Tabel 4.1. Interpretasi Soektrum FT-IR Senyawa Hasil Isolasi 36
Tabel 4.2. Pergeseran Kimia 1H-NMR Senyawa Hasil Isolasi 37
11
DAFTAR GAMBAR
Nomor Judul Halaman
Gambar
Gambar 2.1. Struktur Senyawa Flavonoida 7
Gambar 2.2. Ikatan Hidrogen Flavonoida dan Silika Gel 17 Gambar 4.1. Spektrum Ultraviolet-Visible (UV-Vis) Senyawa Hasil Isolasi 34 Gambar 4.2. Spektrum Infra Red (IR) Senyawa Hasil Isolasi 35 Gambar 4.3. Spektrum Ultraviolet Spektrum 1H-NMR Senyawa Hasil Isolasi 36
12
DAFTAR LAMPIRAN
Nomor Judul Halaman
Lampiran
Lampiran 1. Gambar Bunga Mawar Putih (Rosa hybrida L.) 45 Lampiran 2. Hasil Determinasi Tumbuhan Bunga Mawar Putih(R.hybrida L.) 46 Lampiran 3. Kromatogram Lapis Tipis Ekstrak Pekat Kloroform Tumbuhan 47 Bunga Mawar Putih (R.hybrida L.) Sebelum Kromatografi Kolom Lampiran 4. Kromatogram Lapisan Tipis Ekstrak Bunga Mawar 48
Putih (R.hybrida L.) Penggabungan Fraksi Lampiran 5. Kromatogram Lapisan Tipis Ekstrak Bunga mawar 49
Putih (R.hybrida L.) Sebelum KLT Preparatif. Lampiran 6. Kromatogram Lapisan Tipis Senyawa murni hasil isolasi 50 Lampiran 7. Spektrum Ultraviolet-Visible Beberapa Senyawa Flavonoida 51 Lampiran 8. Ekspansi Spektrum 1H-NMRSenyawa Hasil Isolasi 52
Pada δ=1,2-4,0 ppm Lampiran 9. Ekspansi Spektrum 1H-NMR Senyawa Hasil Isolasi 53
Pada δ=0-10,0 ppm
Lampiran 10.Ekspansi Spektrum 1H-NMR Senyawa Hasil Isolasi 54
Pada δ=6,0-7,9 ppm
6
ISOLASI SENYAWA FLAVONOIDA DARI BUNGA TUMBUHAN MAWAR PUTIH (Rosa hybrida L.)
ABSTRAK
Telah dilakukan isolasi senyawa flavonoida pada 900 gram bunga tumbuhan mawar putih (Rosa hybrida L.) secara ekstraksi maserasi dengan pelarut metanol. Lapisan metanol dipekatkan dan dihidrolisa dengan HCl 2 N. Filtratnya diekstraksi partisi dengan kloroform. Ekstrak pekat kloroform dianalisis dengan KLT. Pemisahan komponen dilakukan dengan menggunakan kromatografi kolom dengan fasa diam silika gel dan fasa gerak n-heksana:etil asetat dengan perbandingan (90:10) v/v, (80:20) v/v, (70:30) v/v dan (60:40) v/v. Hasil yang
diperoleh adalah kristal jarum, berwarna kuning sebanyak 10 mg, titik lebur 154-1560 C dan Rf = 0.58. Struktur dianalisa dengan menggunakan Spektroskopi UV-Visible, Inframerah (FT-IR) dan Resonansi Magnetik Inti Proton (1H-NMR). Dari hasil analisa spektroskopi diduga bahwa senyawa yang diperoleh adalah senyawa flavonoid golongan flavonol.
7
ISOLATION OF FLAVONOID COMPOUND FROM FLOWER OF WHITE ROSE (Rosa hybrida L.)
ABSTRACT
Has been done isolation of flavonoid compound 900 gram flower of white rose (Rosa hybrida L.) with extraction maceration by methanol solvent. Methanol layer was concentrated and then hydrolized with HCl 2 N, then the filtrate was extracted with chloroform. The concentrated choloroform extract was analysed with TLC. The separation compound was done with Column Chromatography with silica gel as the stationary phase and n-hexane:ethyl acetate (90:10) v/v,
(80:20) v/v,(70:30) v/v and(60:40) v/v as the mobile phase. The fractions from
n-hexane : aethy acetate (70:30) v/v were purified with TLC preparative and
recrystallized to get pure compound. The result is yellow crystal with weight 10 mg, melting point 154-1560 C dan Rf = 0.58. The structure was analyzed with using UV-Visible, Fourier Transform Infra Red (FT-IR) and Proton Nuclear Magnetic Resonancy (1H-NMR) Spectroscopy. From the analysis spectrocopy, was estimated that isolated compound of flavonoid is flavonol.
13
BAB 1
PENDAHULUAN
1.1Latar Belakang
Rosa hybrida L. merupakan salah satu genus yang besar dari famili rosaceae, yang terdiri dari sekitar 150 spesies tersebar luar di beberapa bagian wilayah Eropa, Asia, Timur tengah dan Amerika Utara. Umumnya tumbuhan mawar sangat berkembang dalam industri bunga potong dan sering dibuat menjadi tanaman kebun. Bunga mawar dapat juga digunakan dalam industri makanan, pewangi, dan kosmetik yang berkembang pesat beberapa tahun belakangan ini (Luqman, 1992).
Mawar merupakan salah satu jenis bunga yang dapat dimanfaatkan menjadi minyak atsiri. Manfaat minyak atsiri mawar dalam industri diantaranya sebagai bahan baku kosmetik, obat, dan parfum. Minyak atsiri dapat diperoleh dengan mengekstrak dari tumbuhan tersebuth. Sejak abad ke 17, industri minyak mawar sudah berkembang di negara-negara Persia, Turki, dan Bulgaria. Sedangkan di Indonesia, mawar dalam jumlah besar biasanya digunakan sebagai tanaman pot, taman, dan bunga potong. Bunga mawar masing-masing memiliki nama latin yang berbeda. Bunga mawar putih dengan nama latin Rosa hybrida L. Bunga mawar merah dengan nama latin Rosa canina L. dan bunga mawar merah muda dengan nama latin Rosa santana L. (Soekartiwi, 1996).
Flavonoid adalah kelompok terbesar dari senyawa fenolik yang terdapat di alam, yang dimana dalam bagian tumbuhan baik dalam keadaan bebas dan sebagai glikosida. Istilah flavonoid diambil dari bahasa latin “flavus” yang artinya kuning, sebagian besar dari senyawa flavonoid berwarna kuning. Flavonoid juga dikenal sebagai pigmen atau co-pigmen dalam tumbuhan. Adanya pigmen-pigmen menyebabkan adanya warna yang berbeda-beda dan kombinasi warna yang terdapat di kulit, daun, bunga, buah biji dari tumbuhan. Warna-warna ini dapat menarik serangga. Flavonoid juga ditemukan mempunyai aktiftas biologis yang meliputi: antimikroba, menghambat adhesi mitokondria, antikanker dan lain sebagainya (Bhat, 2005).
Flavonoid mempunyai banyak aktifitas biologis yang meliputi antimikroba, pemberantas serangga. Sebagai contoh, flavon dan isoflavon yang dibentuk de novo sebagai antifungi dalam beberapa daun tumbuhan (Harborne, 1999). Menurut literatur bahwa bunga mengandung flavonoid, salah satu bunga yang mengandung flavonoid adalah jenis bunga mawar putih (Rosa hybrida L.). Penelitian terdahulu terhadap beberapa jenis bunga mawar diantaranya adalah karakterisasi kandungan fitokimia Taif rose dan uji aktifitas sebagai antioksidan dan antikanker yang dilakukan oleh Dobreva, A pada tahun 2011.
Peneliti melaporkan bahwa adanya golongan flavonol, quercetin, kamferol, dan antosianin. Peneliti juga melaporkan adanya kandungan minyak atsiri pada Taif rose (Dobreva, 2011). Juga telah dilakukan penelitian Senyawa flavonoid dalam bunga mawar putih oil-bearing (Rosa alba L.) peneliti melaporkan senyawa kandungan flavonoid dalam R. alba L. adalah golongan flavonol glikosida dan senyawa tanin dari tumbuhan R. alba L. (Sayed, 2013).
dan H2SO4(p) menunjukkan bahwa ekstrak metanol dan etil asetat R. hybrida L.
mengandung senyawa flavonoida. Dari uraian diatas dan berdasarkan literatur mengenai kandungan kimia yang terdapat pada bunga mawar putih, maka peneliti tertarik melakukan penelitian terhadap R.hybrida L, khususnya mengenai senyawa flavonoida dan jenis golongan flavonoid yang terkandung di dalamnya.
1.2 Permasalahan
Permasalahan dalam penelitian ini adalah bagaimana cara mengisolasi senyawa flavonoida yang terdapat dalam bunga mawar putih (R.hybrida L.)
1.3 Tujuan Penelitian
Tujuan dari penelitian ini adalah untuk mengisolasi senyawa flavonoida dan mengetahui golongan senyawa flavonoida dari bunga mawar putih (R.hybrida L.)
1.4 Manfaat Penelitian
1.5 Lokasi Penelitian
1. Lokasi Pengambilan Sampel
Sampel yang digunakan diperoleh dari daerah kecamatan Medan johor, Medan.
2. Lokasi Penelitian
Penelitian dilakukan di laboratorium Kimia Bahan Alam Hayati FMIPA Universitas Sumatera Utara
3. Lokasi Identifikasi Senyawa Hasil Isolasi
Analisis Spektrofotometer Inframerah (FT-IR), dan Spektrometer Resonansi Magnetik Inti Proton (1H-NMR) dilakukan di Pusat Penelitian Kimia- LIPI, kawasan PUSPITEK Serpong, Tangerang. Analisis Spektrofotometer UV-Visible dilakukan di Laboratorium kimia Organik Fakultas MIPA UGM, Yogyakarta.
1.6. Metode Penelitian
fitokimia untuk senyawa flavonoida, yaitu dengan menggunakan pereaksi FeCl3
5%, NaOH 10%, Mg-HCl dan H2SO4(p).
Tahap isolasi yang dilakukan
1. Ekstraksi Maserasi 2. Pemisahan Tanin 3. Ekstraksi Partisi 4. Hidrolisa
5. Analisis Kromatografi Lapis Tipis 6. Kromatografi Kolom
7. Pemurnian dengan kromatografi preparatif 8. Rekristalisasi
9. Analisis Kristal Hasil Isolasi yang meliputi; a) Titik lebur
b) Analisis Kromatografi Lapis Tipis
BAB 2
TINJAUAN PUSTAKA
2.1. Tumbuhan Bunga Mawar Putih (Rosa hybrida L.)
Tumbuhan mawar tersebar menjadi 100 spesies lebih, yang kebanyakan tumbuh di bagian daerah yang berudara sejuk. Spesies mawar dimasukkan dalam kategori semak yang berduri atau tanaman yang memanjat yang tingginya mencapai 1 sampai 5 meter, dan daunnya yang panjangnya antara 5-15cm. Daun majemuk yang tiap tangkai daun terdiri dari paling sedikit 3 atau 5 hingga 9 atau 13 anak daun. Daunnya berbentuk lonjong, pertulangan menyirip, meruncing di ujung daun, tepi beringgit. Tanaman mawar dapat tumbuh dengan baik di dataran rendah hingga dataran tinggi tetapi untuk jenis Mawar tea atau teh hibrida hanya menyukai dataran tinggi sebab bunganya akan tumbuh dengan sempurna, baik bentuk, ukuran, warna, maupun baunya. Tanaman mawar tidak menyukai air yang menggenang. Mawar dapat tumbuh dengan baik pada tanah yang derajat keasaman pH-nya anara 6-8 (Soekartiwi,1996).
Berdasarkan hasil determinasi Bunga Mawar Putih dari Herbarium Medanese diperoleh sistematika sebagai berikut:
Kingdom : Plantae
Divisi : Spermatophyta
Ordo : Rosales
Famili : Rosaceae
Genus : Rosa
Spesies : Rosa hybrida L.
Nama Lokal : Mawar Putih
Bunga mawar memiliki berbagai macam spesies/varietas yang sangat banyak sekali dan tersebar di seluruh dunia, salah satunya adalah R. hybrida L. termasuk dalam Famili Rosaceae, sering dijuluki Prince of flower karena keindahan bentuk dan warnanya, serta baunya yang harum memikat. Mawar berwarna beragam, yaitu merah, merah jambu, kuning, ungu, putih, dan lain-lain. Mawar dapat dimanfaatkan sebagai bunga potong dan tanaman hias, serta sebagai bahan industri kosmetika atau pewangi makanan. Tim Direktorat Bina Produksi Holtikultura (1988) mencatat bahwa penggolongan mawar menjadi sembilan kelompok utama, yaitu:
1. Hybrid tea, jenis bunga mawar yang bertangkai panjang dengan bunga tunggal di ujungnya.
2. Floribunda, jenis bunga mawar yang bunganya cukup besar dan warnanya yang bervariasi dan memiliki tangkai tegak panjang.
3. Grandiflora, jenis bunga mawar yang berukuran raksasa dengan diameter dapat mencapai 7,5-12,5 cm
4. Climbing rose, jenis bunga mawar yang berkisar 5-15 cm dan tumbuh merunduk karena beratnya cabang serta tersusu dalam tandan yang jarang. Kelompok mawar ini baru dapat berbunga seelah umurnya lebih dari dua tahun
5. Polyantha, jenis bunga mawar yang memiliki bunga kecil dengan diameter 5cm dan di dekat pucuk cabang terdapat banyak ranting yang masing-masing memiliki sekuntum bunga
7. Mawar tea, jenis bunga mawar yang disebut nenek moyang mawar di Asia dengan ukuran bunga kecil
8. Mawar tua, yang disebut dengan mawar kuno dan memiliki aroma yang sangat wangi
9. Special purpose, jenis bunga mawar yang dibedakan atas tiga golongan, yaitu mawar pohon, mawar perdu, dan mawar mini yang mana masing masing memiliki nama-nama latin mawar yang berbeda (Luqman, 1992).
2.2. Senyawa Flavonoida
Flavonoida adalah golongan polifenol yang terdiri atas 15 atom karbon yang dihasilkan oleh seluruh tumbuhan. Lebih dari 4000 jenis flavonoid telah diidentifikasi, sejumlah besar yang telah diteliti memiliki aktifitas therapeutic. Sejumlah flavonoid yang tampak memiliki aktifitas anti viral yakni melawan virus (Walsh, 2003).
Berikut adalah struktur senyawa flavonoida dan penomorannya
O
angiospermae, tetapi pada bunga yang tidak berwarna juga banyak tersebar luas dan melimpah (Hill, et al., 1991).
Istilah flavonoida diberikan pada suatu golongan besar senyawa yang berasal dari kelompok yang paing umum, yaitu senyawa flavon, suatu jembatan oksigen terdapat diantara cincin A dalam kedudukan orto, dua atom karbon benzil yang terletak disebelah cincin B. Senyawa heterosiklik ini, pada tingkat oksidasi paling rendah dan dianggap sebagai struktur induk. Kerangka flavonoid dapat ditulis sebagai sistem C6-C3-C6 yang mana senyawa-senyawa flavonoid adalah
senyawa 1,3 diarilpropana, senyawa isoflavonoid adalah senyawa 1,2 biarilpropana, sedang senyawa-senyawa neoflavonoid adalah 1,1 diarilpropana yang merupakan turunan flavonoida (Manitto, 1981).
2.2.1. Klasifikasi Senyawa Flavonoida
Flavonoida mengandung sistem aromatik yang terkonjugasi sehingga menunjukkan pita serapan kuat pada daerah spektrum sinar ultraviolet dan spektrum sinar tampak, umumnya dalam tumbuhan terikat pada gula yang disebut dengan glikosida (Harborne, 1996).
1.Flavonoida O-Glikosida
Pada flavonoid O-glikosida, satu atau lebih gugus hidroksil terikat pada gula atau lebih. Flavonoid O-glikosida ini bersifat hemiasetal yang tidak tahan asam yang diakibatkan ikatan hidroksil dapat diputus oleh adanya asam.
O
O HO
HO OH
ROH2C
Pada flavonoida C-glikosida, gula dapat terikat pada atom karbon flavonoid dengan ikatan karbon-karbon yang tahan asam apabila dibandingkan dengan flavonoid o-glikosida. Tetapi hanya beberapa jenis gula saja yang dapat berikatan dengan flavonoid C-glikosida yakni galaktosa seperti; ramnosa, xilosa dan arabinosa. Dalam hal ini tidak semua jenis gula dapat terikat pada flavonoid C glikosida. Gula dapat terikat pada atom C yang ditemukan pada atom C nomor 6 dan 8 dalam cincin A. Tetapi flavonoida juga dapat mengalami O-glikosilasi menjadi flavonoida C-glikosida.
3.Flavonoid Sulfat
Pada flavonoid Sulfat, satu ion sulfat berikatan pada gugus hidroksi fenol flavonoid tersebuth. Contohnya Flavonoida O-SO3K yang berupa garam. Senyawa
flavonoida sulfat ini mudah larut dalam air. Flavonoida sulfat terikat pada hidroksi fenol yang bebas atau dapat menggantikan gula.
Pada biflavonoid merupakan dua golongan flavonoid baik berbeda atau sama yang bergabung contoh flavonol dan flavanon dan lain sebagainya. Biflavonoid jarang ditemukan sebagai glikosida.
O
O O
O
OH
(amentoflavon, suatu biflavonoid)
5.Aglikon flavonoid optis-aktif
Pada aglikon flavonoid yang aktif-optik yakni berkaitan dengan stereokimia-mutlak flavonoid. Dimana putaran 589,3 nm, garis D natrium. Yang termasuk dalam golongan aglikon optis aktif (yaitu memutar cahaya terpolarisasi-datar) adalah katekin, pterokarpan, rotenoid dan beberapa biflavonoid. Putaran aglikon flavonoid alam berkaitan dengan stereokimia mutlak flavonoid (Markham,1988).
Berikut juga penggolongan flavonoida menurut Robinson berdasarkan keragaman pada rantai C3 yakni :
1.Flavonol
O
O
Flavonol sangat tersebar luas di dalam tumbuhan, baik sebagai kopigmen antosianin dalam daun bunga maupun dalam daun tumbuhan tinggi. Dalam tumbuhan terdapat banyak sekali glikosida flavonol. Sampai saat ini yang paling umum adalah kuersetin 3-rutinosida yang dikenal sebagai rutin. Flavonol adalah derivatif 3-hidroksi dari flavon dan mempunyai panjang gelombang band I pada 352 nm dan pada band II pada 240-285nm (Bhat, 2005).
2.Flavanon
O
O
Flavanon mempunyai panjang gelombang band I pada 304 nm dan pada band II pada 240-285nm. Flavanon dibentuk secara biosintesis dari khalkon oleh adanya enzim khalkon isomerase. Cincin tertutup menghasilkan 2-phenylbenzopyran-4, yang mempunyai karbon asimetris pada C-2. (Harborne, 1999).
Penentuan struktur flavanon dilakukan dehidrogenasi ikatan -2,3, memberikan flavon. Bentuk aromatik tersubstitusi biasanya dapat dikenal dengan pergeseran kimia dan bentuk penggabungan o,m,p proton-priton cincin A dan B. Flavanon terdistribusi luas di alam. Flavanon terdapat dalam kayu, daun dan bunga. Flavanon glikosida merupakan konstituen utama dari tanaman genus prunus (famili Rosaceae) dan buah jeruk (Sastrohamidjojo, 1996).
O
O
OH
Dihidroflavanol adalah 3-hidroksi derivatif dari flavanon dan mempunyai panjang gelombang maksimum band I 300-320nm dan pada band II 270-295nm (Bhat, 2005). Dalam biosintesis flavonoid, dihidroflavanol dibentuk dengan penambahan oksidasi dari gugus hidroksil pada posisi C-3 dari flavanon. Mereka ditunjukkan sebagai 3-hidroksiflavanon atau flavanon-3-ol (Harborne, 1999).
4.Kalkon
O
Kalkon merupakan senyawa C6-C3-C6 yang merupakan prekursor pertama dalam
biosintesis flavonoid. Kalkon merupakan struktur flavonoida cincin C terbuka yang paling sederhana. (Harborne, 1999). Kalkon bertindak sebagai prekursor untuk pembentukan turunan flavonoid. Kalkon tidak mengandung cincin γ pyron dan mempunyai cincin terbuka yang mana terhubung dengan dua cincin aromatik
dan dihubungkan oleh tiga atom karbon α,β tak jenuh. Kalkon mempunyai
panjang gelombang maksimum pada band I 340-390nm dan pada band II 220-270nm (Bhat, 2005).
kalkon warnanya jauh lebih kuat daripada warna flavanon, terutama dalam larutan basa warnya merah jingga (Robinson,1995).
5.Isoflavon
O
O
Isoflavon adalah mengandung cincin benzo-γ−pyron. Isoflavon mempunyai substitusi phenil pada posisi 3 pada cincin pyron dan isoflavon mempunyai panjang gelombang maksimum pada band I 300-340nm dan pada band II 245-270nm (Bhat, 2005).
6.Antosianidin
O
+
Warna biru, ungu, violet dan merah yang tampak pada bunga, buah dan batang dari tumbuhan dikarenakan karena adanya pigmen antosianidin (Ikan, 1991). Antosianidin mempunyai panjang gelombang maksimum pada band I 465-550nm dan pada band II 270-280nm (Bhat, 2005).
O
O
O
OCH3
O
Istilah rotenoid pertama dikenal karena adanya rotenon dan rotenon dibentuk dari siklisasi cincin dari metoksi-isoflavon. Rotenoid sangat berpotensi sebagai insektisida dan pembunuh ikan (Dewick, 2002).
8.Auron
O
O CH
Auron memiliki kerangka 2-benzylidene-coumaranone atau 2-benzylindene-3-(2H)-benzofuranon. Auron hanya mempunyai panjang gelombang maksimum pada band I 340-430nm (Bhat, 2005).
2.3.Teknik Pemisahan
dihindari ketika melakukan pemisahan molekul dari bahan-bahan hidup, sebab hal ini akan berisiko menyebabkan hilangnya aktivitas biologi (Bintang ,2010).
2.3.1. Ekstraksi
Tumbuhan adalah material yang terdiri atas beberapa senyawa (kompleks) yang menghasilkan beberapa metabolit sekunder dengan kepolaran dan gugus fungsi yang berbeda dalam strukturnya. Pada umumnya senyawa bahan alam meliputi, zat lilin, asam lemak, polietilen, terpen, steroid, fenolik (fenol sederhana, feni propanoid, flavonoid, tanin, antosianin, quinon, kumarin, lignan), alkaloid, dan derivat – derivat glikosida(saponin, kardiak glikosida dan flavonoid glikosida). Beberapa pendekatan yang dilakukan untuk mengekstraksi material tumbuhan pada zaman dahulu air digunakan untuk mengekstrak. Tetapi sekarang sudah menggunakan pelarut organik dengan tingkat kepolaran yang berbeda untuk mengekstraksi kandungan tumbuhan misalkan dengan menggunaan sokletasi, reflux, destilasi uap, ekstraksi dengan menggunakan tekanan (Sarker, 2006).
Tiga metode dasar pada ekstraksi cair-cair adalah ekstraksi bertahap(batch), ekstraksi kontinyu, dan ekstraksi counter current. Ekstraksi bertahap adalah cara yang paling sederhana dimana caranya cukup dengan menambahkan pelarut pengekstraksi yang tidak bercampur dengan pelarut semula kemudian dilakukan pengocokan sehingga terjadi kesetimbangan konsentrasi zat yang akan diekstraksi pada kedua lapisan, didiamkan dan dipisahkan (Khopkar, 1990).
2.3.1.1.Perkolasi
merupakan tempat simplisia yang akan dialiri dengan pelarut. Sehingga perkolator akan mengekstrak simplisia dan hasil ekstrak turun melalui keran sehingga dalam hal ini pelarut dapat berganti-ganti setelah pelarut yang lain habis. Metode perkolasi adalah metode maserasi cara dingin yang terbarukan yakni metode ekstraksi cara dingin (Pavia, 1995).
2.3.1.2. Sokletasi
Metode Ekstraksi sokletasi merupakan ekstraksi cara panas yang dimana menggunakan tabung soklet. Simplisia yang akan diekstraksi diletakkan dalam sebuah sarung yang terbuat dari kertas saring dan sarung soklet tersebut dimasukkan ke dalm tabung soklet. Sebuah labu didih pelarut ditempatkan dibawah tabung soklet sehingga pelarut akan menguap naik ke kondensor dan membasahi tabung soklet. Ekstraksi sokletasi berlangsung secara kontinu (Pavia,1995).
2.3.1.3. Maserasi
Maserasi adalah salah satu teknik ekstraksi yang dimasukkan dalam metode ekstraksi dingin. Maserasi dilakukan tanpa adanya penggunaan suhu dalam menarik metabolit dari simplisia. Metode ekstraksi dingin ini lebih sederhana dan dapat digunakan untuk ekstraksi maserasi skala besar menggunakan pelarut yang sesuai.
Kromatografi adaah sebuah proses fisika dalam memisahkan yang diakibatkan oleh perbedaan afinitas dengan adanya dua fase yakni fase diam dan fase gerak berupa cair yakni dinamakan kromatografi cair dan apabila fase geraknya berupa gas maka dinamakan kromatografi gas. Kedua teknik ini sangat berkembang baik dalam analisis makanan dan metabolit sekunder (Egan, 1981).
Kromatografi merupakan teknik untuk pemisahan dan pemisahan dari campuran. Teknik ini dilihat berdasarkan pemisahan warna atau noda campuran antara dua fase, yakni fase diam dan fase gerak. Ada 4 tipe kromatografi yakni ;
1. Kolom kromatografi 2. Kromatografi Lapis Tipis 3. Gas kromatografi
4. Kromatografi kertas
Pada kolom kromatografi adsorben berupa bubuk (alumina atau silika gel) yang dibungkus dalam kolom. Sampel dalam skala kecil yang ingin dipisahkan dimasukkan dalam kolom. Pelarut seperti pentana, benzen, eter, dibiarkan turu mengalir di sepanjang kolom. Fraksi-fraksi dikumpul yang merupakan komponen yang sudah dipisahkan. Pada kromatografi lapis tipis memungkinkan untuk memisahkan sampel skala kecil. Plat terbuat dari kaca yang dilapisi dengan selulosa, alumina, silika. Ini dilakukan dengan menyebarkan atau mencelupkan plat ke sebuah chamber. Setelah lempeng/plat kering, plat akan naik sesuai dengan gaya kapilaritas. Pemisahan di campuran yang terjadi di kolom kromatografi. Pada kromatografi kertas proses yang terjadi di dalamnya sama dengan KLT dan dalam hal ini kertas sebagai adsorbent dan pada kromatografi gas digunakan untuk memisahkan dan analisa molekul organik.
Tabel 2.1. Eluen yang digunakan untuk Kromatografi
Petroleum eter
sangat mirip kemampuannya mempengaruhi resolusi zat terlarut dan menghasilkan kromatogram sedangkan proses partisi contohnya dapat terjadi di kromatografi lapis tipis dan kromatografi kertas (Khopkar, 1990).
2.3.2.1 Kromatografi Lapis Tipis
Pemisahan dengan kromatografi lapis tipis dilakukan dengan meletakkan ekstrak campuran sebagai noda atau garis tipis pada sebuah adsorben contohnya plat silika. Proses yang terjadi pada kromatografi lapis tipis yakni :
1.Proses Adsorpsi
Adsorben yang umum digunakan dalam adsorpsi kromatografi metabolit sekunder adalah silika dan alumina, karena noda(ekstrak) mudah untuk bergerak pada adsorben ini. Migrasi noda diakibatkan oleh perbedaan afinitas dan pemisahan yang terjadi karena adanya salah satu senyawa daam ekstrak yang akan lebih terikat atau tertahan kuat pada silika atau alumina yakni senyawa yang lebih polar akan bergerak lebih lama ketika dibandingkan dengan senyawa non polar. Silika mempunyai gugs silanol yang berikatan langsung dengan gugus hidroksil yang terbebas dengan ikatan hidrogen yang sangat kuat. Seperti gambar dibawah ini :
O
2.Proses Partisi
Tahap ini melibatkan pengaruh tingkat kelarutan senyawa antara fasa diam dan fasa gerak. Senyawa-senyawa yang mudah larut dalam fase gerak akan bermigrasi pada plat yakni senyawa polar dan non polar akan lebih lama bermigrasi (Sarker, 2006).
Tabel 2.2 Fase Diam yang digunakan untuk Kromatografi Lapis Tipis
Fase Diam Tingkat Kepolaran
Selulosa
Pati
Gula
Magnesium Silikat Tingkat kepolaran fase diam
Kalsiun Sulfat
Asam Silika
Silika Gel
Alumunium Oksida
(Bhal, 2007)
2.3.2.2 Kromatografi Kolom
Fraksi-fraksi yang dihasilkan akan dikumpulkan dan pada fraksi tersebuth telah terjadi pemisahan. Pemisahan pada kromatografi kolom ini untuk lebih mempermudah mengidentifikasi senyawa-senyawa yang belum diketahui (Sarker,2006).
Dengan menggunakan kromatografi kolom untuk isolasi flavonoid pada dasarnya dimana ekstrak total flavonoid dicampur dengan fase diam seperti selulosa, silika, poliamida. Kemudian dimasukkan fase gerak yang sesuai. Kolom berupa tabung kaca yang dilengkapi dengan keran di salah satu ujung. Fase diam pada kolom ini berupa silika dimana fase diam ini untuk memisahkan aglikon yang kurang polar misalnya, isoflavon, flavanon, metil flavon dan flavonol. Sementara apabila pada kromatografi kolom digunakan fase diam gel sphadex (deret G) maka pelarut harus air, digunakan utuk memisahkan poliglikosida yang berbeda bobot molekulnya. Fase diam digunakan berdasarkan sifat kepolaran senyawa dan pelarut yang sesuai. Dan poliamida sebenarnya juga dapat memisahkan semua flavonoid dan glikosida (Markham, 1988).
2.3.2.3Kromatografi Lapis Tipis Preparatif
Pemisahan bergantung pada banyaknya campuran yang terkandung dalam ekstrak, KLT preparatif adalah langkah pemurnian yang digunakan di akhir metode isolasi.
Berikut langkahnya :
Dengan berat sampel paling sedikit 10mg dan biasanya menggunakan fase diam silika gel dan fase gerak adalah heksana : Etila asetat (60:40)v/v dan apabila senyawa yang kepolarannya rendah atau senyawa non polar maka digunakan
2.4 Teknik Spektroskopi
Metode-metode ini teknik spektroskopi mempunyai 3 keunggulan utama dalam bidang kimia :
1. Metode spektroskopi adalah lebih mudah dan cepat dibanding uji secara kimia.
2. Metode spektroskopi menyediakan lebih banyak informasi tentang struktur molekul.
3. Metode spektroskopi tidak merusak dan tidak mendekstruksi sampel. Ada 4 metode spektroskopi yang mana sangat luas digunakan dalam kimia organik yakni ; ultraviolet-Vis, IR, NMR dan MS (Bhal, 2007)
2.4.1 Spektrofotometer Ultraviolet-Visibel (UV-Vis)
Pada spektoskopi UV, panjang gelombang untuk daerah ultraviolet adalah 200-270 nm dan daerah visibel adalah 400-750 nm. Radiasi dari panjang gelombang cukup untuk menaikkan elektron seperti elektron non bonding atau elektron terlibat dalam ikatan phi untuk ke tingkat lebih tinggi (Bhal, 2007).
dari molekul yang dihasilkan dari transisi dari elektron valensi di dalam molekul. Khas dari suatu pita serapan adalah letak dan intensitasnya yang berhubungan dengan panjang gelombang dari radiasi yang mempunyai energi yang sama yang dibutuhkan oleh transisi elektron. Kromofor adalah suatu gugus kovalentidak jenuh yang bertanggung jawabutuk serapan elektronik contoh C=C, C=O, NO2,
dan ausokrom adalah suatu gugus jenuh dengan elektron tidak terikat dimana bila menempel kepada suatu kromofor, mengubah baik panjang gelombang, intenitasnya serapan contoh OH, NH2, Cl. Geseran batokromik adalah geseran
dari serapan ke panjang gelombang yang lebih panjang karena substitusi gugus lain. Geseran Hipsokromik adalah geseran dari serapan ke panjang gelombang yang lebih pendek karena substitusi gugus lain (Silverstain, 1981).
2.4.2 Spektrofotometer Infra Merah (FT-IR)
Adsorpsi FT-IR dikarenakan ikatan kovalen diantara molekul dari vibrasi level energi rendah ke energi level tinggi dan ikatan yang lebih kuat membutuhkan energi lebih besar untuk menggetarkan (stretching and bending). Maka absorpsi radiasi IR dan panjang gelombang yang lebih pendek (Bhal, 2007).
pada lebih daripada satu panjang gelombang. Misalnya, suatu ikatan OH menyerap energi pada kira-kira 3330cm-1. Energi pada panjang gelombang ini menyebabkan kenaikan vibrasi ulur (streching vibration) pada ikatan OH itu. Suatu ikatan OH itu juga menyerap pada kira-kira 1250cm-1. Energi pada panjang gelombang ini menyebabkan kenaikan vibrasi tekuk (Bending vibrations). Misalnya, ikatan non polar mengadsorpsi radiasi infra merah sangat lemah karena tidak ada perubahan momen ikatan apabila atom-atom saling berosilasi. Ikatan non polar contohnya seperti ikatan seperti C-C dan C-H dan ikatan polar menyebabkan adsorpsi pada infra merah kuat seperti C=O menunjukkan adsorpsi kuat (Fessenden,1982).
2.4.3 Spektrofotometer H-NMR
Semua proton dalam molekul yang identik dalam lingkungan kimia akan memiliki pergerseran kimia yang sama. Dengan demikian, semua proton dari TMS atau semua proton dalam benzen, siklopentana, atau aseton memiliki nilai
resonansi yang berdekatan pada nilai δ.
Pada beberapa spektrum NMR akan terlihat sinyal TMS pada angka nol sehingga sinyal ini tidak perlu dianalisa. TMS dipilih sebagai standart karena:
1. TMS mempunyai 12 atom hidrogen yang keseluruhannya mempunyai
lingkungan kimia yang sama, sehingga menghasilkan sinyal singlet yang kuat karena mengandung banyak atom hidrogen.
2. Elektron-elektron pada ikatan C-H dalam senyawa ini berada dekat dengan hidrogen jika dibanding dengan senyawa lain. Ini berarti inti hidrogen sangat terlindungi dari medan magneteksternal sehingga dibutuhkan medan magnet yang besar untuk membawa atom hidrogen ke kondisi resonansi (Dachriyanus, 2004).
3. TMS merupakan cairan yang volatile, dapat ditambahkan dalam jumlah sedikit pada larutan sampel dapat diperoleh kembali dengan menguapkan pelarutnya.
4. TMS bersifat inert dan tidak larut dalam air (Supratman, 2010).
BAB 3
METODE PENELITIAN
3.1 Alat-alat
1. Spektrofotometer FT-IR Shimadzu 2. Spektrofotometer UV-Visible Shimadzu
3. Spektrometer 1H-NMR Jeol/Delta2NMR500MHz
4. Ekstraktor Schoot/ Duran
5. Pipa kapiler
6. Rotarievaporator Bűchi R-114
7. Labu rotarievaporator
8. Labu didih Schoot/ Duran
9. Kolom kromatografi Pyrex
10. Lampu UV UVGL 58
11. Alat destilasi
12. Bejana Kromatografi Lapis Tipis
3.2 Bahan-bahan
1. Bunga mawar putih segar
2. Metanol Destilasai
3. N-heksana Teknis
5. Kloroforom Teknis 6. Benzena Teknis 7. Aseton Teknis
8. Silika gel 60 G (0.063-0.200 mm) E.Merck. KGaA 9. FeCl3 5%
10.NaOH 10 % 11.Serbuk Mg 12.HCl(p)
13.H2SO4(P)
14.HCl 6%
15.Plat KLT Merck/ Kieselgel 60F254
16.Pereaksi Benedict
3.3 Prosedur Penelitian
3.3.1. Penyediaan Sampel
Pada penelitian, sampel yang diteliti adalah bunga mawar putih yang diperoleh dari Kecamatan Medan Johor, Medan, Sumatera Utara. Bunga mawar putih segar yang diteliti dalam penelitian ini sebanyak 900 gram.
3.3.2.Skrining Fitokimia
sebagai berikut; 10 gram serbuk bunga mawar putih yang telah dikeringkan ke dalam dua gelas Erlenmeyer lalu ditambahkan 100 mL metanol ke dalam gelas Erlenmeyer I, dan 100 mL etil asetat ke dalam gelas Erlenmeyer II. Didiamkan selama 1 malam. Didekantasi lalu dibagi masing-masing ekstrak sampel ke dalam 4 tabung reaksi
- Untuk ekstrak metanol dan etil asetat
a. Tabung I : dengan FeCl3 5% menghasilkan larutan berwarna hitam
b. Tabung II : dengan serbuk Mg, dan HCl(p) menghasilkan larutan merah jambu
c. Tabung III: dengan NaOH 10% menghasilkan larutan biru kehijauan
d. Tabung IV: dengan H2SO4(p) menghasilkan larutan orange kekuningan
Pada analisis kromatografi lapis tipis dimaksudkan untuk menguji hasil isolasi yang sudah murni. Apabila pada KLT terdapat satu noda/bercak maka isolat sudah murni.
3.3.3. Ekstraksi dan Fraksinasi
3.3.3.1. Pemisahan Tanin
Ekstrak pekat metanol yang sudah menarik semua senyawa polar dan non polar dari bunga mawar putih dilarutkan dengan pelarut etil asetat untuk memisahkan tanin. Tanin juga merupakan senyawa polifenol yang tidak larut dalam pelarut polar aprotik, misalnya; etil asetat. Kemudian lapisan etil asetat disaring dan dipekatkan dengan rotarievaporator.
3.3.3.2. Ekstraksi Partisi dengan N-Heksana
Ekstrak etil asetat dilarutkan dengan metanol kembali yang bertujuan untuk ekstraksi partisi dengan N-heksana. Pada Ekstraksi partisi pelarut harus tidak bercampur agar terbentuk 2 lapisan. Digunakan pelarut N-heksana bertujuan untuk menghilangkan senyawa non polar, misalnya; klorofil, lemak, zat lilin dll.
3.3.3.3. Hidrolisa
Ekstrak pekat metanol dihidrolisa HCl 6 % dengan bertujuan untuk memutuskan ikatan gula pada senyawa flavonoida dengan perbandingan sampel dan HCl 6% adalah 2:5 lalu dipanaskan diatas waterbath selama 30 menit lalu disaring untuk memperoleh filtrat yang bebas gula. (Mabry et all, 1970)
Filtrat yang sudah bebas gula diekstraksi partisi dengan kloroform. Digunakan kloroform karena metanol yang sudah bercampur dengan air yang berasal dari HCl 6% tidak bercampur dengan kloroform. Sehingga lapisan yang kita butuhkan adalah lapisan kloroform.
3.3.3.5. Pemisahan Komponen-Komponen dengan Kromatografi Kolom
Kromatografi kolom bertujuan untuk mempekat fraksi-fraksikan ekstrak pekat kloroform menjadi fraksi-fraksi yang lebih murni. Kromatografi kolom dilakukan dengan menggunakan fasa diam silika gel 60F254 Merck dan fasa gerak
n-heksana:etil asetat (90:10; 80:20; 70:30; 60:40; v/v). Pada alat kromatografi kolom diisi dengan silika gel yang telah dibuburkan dengan n-heksana. Ekstrak pekat kloroform(flavonoid total) dimasukkan kedalam kolom. Kemudian dielusi dengan menggunakan n-heksana:etil asetat (90:10; 80:20; 70:30; 60:40; v/v). Hasil yang diperoleh ditampung dalam botol vial setial 10 ml, lalu di KLT dan digabung fraksi dengan harga Rf yang sama lalu diuji dengan FeCl3 5%.
Kemudian diuapkan hingga terbentuk kristal. Kristal yang diperoleh diuji dengan KLT untuk melihat apakah sudah murni yakni adanya satu noda dan jika terdapat noda dua atau lebih maka dimurnikan dengan KLT Preparatif dan rekristalisasi.
3.3.4. Analisis Kromatografi Lapis Tipis
dimaksudkan untuk mengetahui sistem dan rasio pelarut yang sesuai untuk pemisahan yang baik pada kromatografi kolom.
Dimasukkan 10 ml larutan fase gerak n-heksana : etil asetat (90:10 v/v) ke
dalam chamber kemudian dijenuhkan. Ditotolkan ekstrak pekat kloroform pada plat KLT lalu dimasukkan pada chamber yang telah jenuh, ditutup, dan dielusi. Plat yang telah dielusi dikeluarkan dari bejana lalu dikeringkan. Kemudian, plat dilihat di bawah lampu UV, lalu diamati nodanya yang tampak. Dihitung harga Rf yang didapatkan. Perlakuan yang sama dilakukan juga pada perbandingan pelarut n-heksana : etil asetat (80:20; 70:30; 60:40; v/v).
3.3.5. Pemurnian dan Pemurnian Hasil Isolasi
3.3.5.1 Pemurnian Hasil Isolasi Dengan KLT Preparatif
3.3.5.2 Rekristalisasi
Kristal hasil isolasi dilarutkan dengan etil asetat dan n-heksana. Pada rekristalisasi digunakan dua pelarut yang saling bercampur. Dimana satu pelarut dapat melarutkan kristal sedangkan pelarut lain tidak dapat melarutkan kristal sehingga terjadi pengendapan senyawa yang tidak larut didasar wadah. Etil asetat dapat melarutkan senyawa isolat sedangkan n-heksana tidak dapat melarutkan senyawa hasil isolat. Larutan yang bagian atas dipipet sehingga kristal yang tidak larut tertinggal didasar wadah.
3.3.5.3. Uji Kemurnian Hasil Isolasi dengan Kromatografi Lapis Tipis
Uji kemurnian kristal yang dilakukan dengan KLT yakni dengan fasa diam silika gel 60 F254 dengan fasa gerak n-heksana : etil asetat (70:30 v/v).. Dimasukkan 10
ml fasa gerak dalam chamber lalu dijenuhkan. Ditotolkan kristal pada batas bawah, teknik penotolan kristal yang baik yakni harus bulat dan sekecil mungkin. Setelah fasa gerak merembes sampai batas atas, maka plat KLT dikeluarkan dari chamber, dikeringkan, lalu dilihat dibawah sinar UV.
Kristal hasil isolasi yang telah murni dimasukkan ke dalam alat melting point apparatus lalu diamati pada suhu berapa kristal melebur. Dalam prosedur penelitian ini dilakukan uji titik lebur dilakukan karena hasil yang diperoleh berupa kristal.
3.3.6. Identifikasi Senyawa Hasil Isolasi
3.3.6.1. Identifikasi dengan Spektrofotometer Ultraviolet-Visible (UV-Vis)
Analisis dengan alat Spektrofotometer Ultraviolet-Visible (UV-Vis) diperoleh dari Laboratorium Penelitian Kimia Organik, USU dengan menggunakan metanol sebagai pelarut.
3.3.6.2. Identifikasi dengan Spektrofotometer Infra Merah (FT-IR)
3.3.6.3. Identifikasi dengan Spektrometer Resonansi Magnetik Inti Proton (1H-NMR)
3.4. Bagan Skrining Fitokimia
3.4.1. Bagan Skrining Fitokimia dengan Metanol
di maserasi dengan metanol disaring
dibagi ke dalam 4 tabung reaksi
Tabung I Tabung II Tabung III Tabung
IV 10 gram Bunga mawar putih
3.4.1. Bagan Skrining Fitokimia dengan Etil Asetat
di maserasi dengan etil asetat disaring
dibagi ke dalam 4 tabung reaksi
Tabung I Tabung II Tabung III Tabung
IV 10 gram Bunga mawar putih
3.5 Bagan Penelitian
900 gram Bunga mawar putih segar
Dilarutkan dengan etil asetat berulang-ulang sampai bening sampai habis di atas waterbath
Endapan
Ekstrak pekat etil asetat
Lapisan Metanol
Dilarutkan dengan metanol
Diekstraksi partisi dengan n-heksana sampai bening
Lapisan n-heksana Dipekatkan dengan rotari evaporator
Diskrining fitokimia
Diuji KLT untuk mengetahui eluen yang sesuai pada kromatografi kolom
Dikolom kromatografi dengan fasa diam silika gel 60GF (0,063-0,2mm) dan fasa gerak ialah n-heksan : etil asetat dengan perbandingan 90:10;80:20;70:30;60:40v/v
Diuji KLT untuk mengetahui harga Rf Digabung Fraksi dengan harga Rf yang sama
Fraksi 1-31fraksi
DiKLT Preparatif dengan fase diam silika gel dan fase gerak
n-heksana: etil asetat (7:3)v/v Direkristalisasi
Dianalisis KLT Dihitung massanya Diuji titik leburnya
BAB 4
HASIL DAN PEMBAHASAN
4.1. Hasil Penelitian
Hasil skrining fitokimia terhadap ekstrak metanol dan etil asetat bunga mawar putih (R.hybrida L.) menunjukkan bahwa ekstrak metanol dan ekstrak etil asetat sampel positif terhadap pereaksi- pereaksi flavonoida.
Hasil elusi dari perbandingan pelarut n-heksana:etil asetat 70:30 (v/v) pada fraksi 59-72, di KLT preparatif dengan eluen benzena : aseton 70:30 (v/v) untuk mendapatkan senyawa murni. Sehingga diperoleh senyawa murni berupa kristal jarum berwarna kuning, seberat 9 mg, dan nilai Rf 0,56
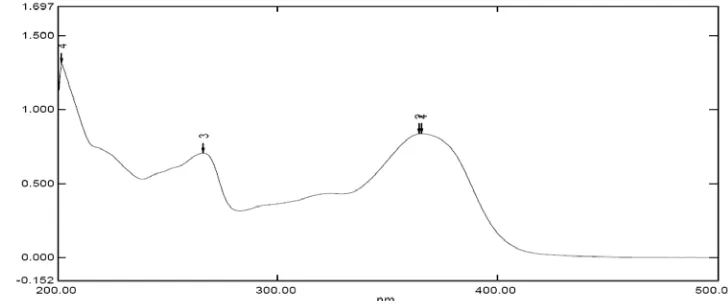
Gambar 4.1. Spektrum Ultraviolet-Visible (UV-Vis) senyawa hasil isolasi
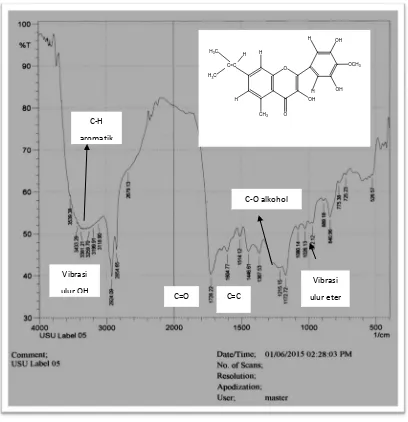
Gambar 4.2. Spektrum FT-IR senyawa hasil isolasi
C=O C=C
Vibrasi
ulur OH
Vibrasi
ulur eter
O
O OH H
H
CH3
H
OH OH
OCH3
H C=C
H3C
H3C H
C-H
aromatik
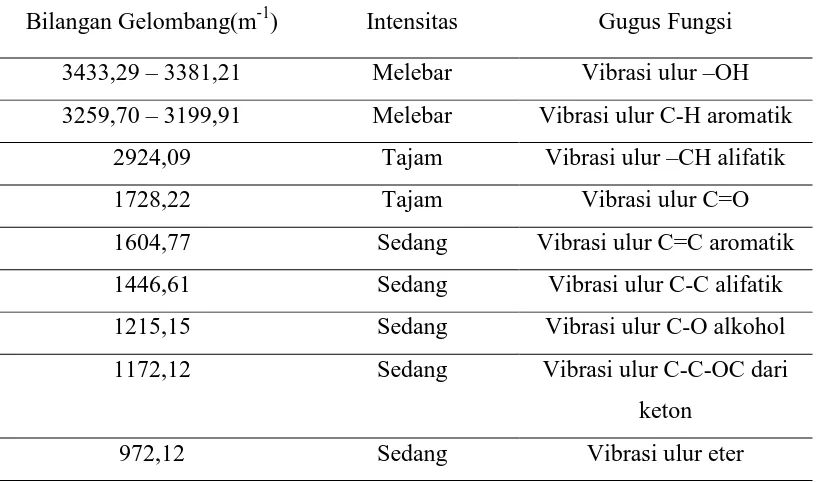
Dari hasil analisis Spektrofotometer Infra Merah (FT-IR) memberikan pita-pita serapan pada daerah bilangan gelombang (cm-1) sebagai berikut:
Tabel 4.1. Interpretasi Soektrum FT-IR Senyawa Hasil Isolasi
Bilangan Gelombang(m-1) Intensitas Gugus Fungsi
3433,29 – 3381,21 Melebar Vibrasi ulur –OH
3259,70 – 3199,91 Melebar Vibrasi ulur C-H aromatik
2924,09 Tajam Vibrasi ulur –CH alifatik
1728,22 Tajam Vibrasi ulur C=O
1604,77 Sedang Vibrasi ulur C=C aromatik
1446,61 Sedang Vibrasi ulur C-C alifatik
1215,15 Sedang Vibrasi ulur C-O alkohol
1172,12 Sedang Vibrasi ulur C-C-OC dari
keton
972,12 Sedang Vibrasi ulur eter
Berikut adalah hasil analisa Spektrometer Resonansi Magnetik Inti Proton (1H-NMR dengan menggunakan pelarut Aseton-d6 pada senyawa hasil
Gambar 4.3. Spektrum 1H-NMR senyawa hasil isolasi
Hasil analisis Spektrometer Resonansi Magnetik Inti Proton (1H-NMR) senyawa hasil isolasi dengan menggunakan pelarut Aseton-d6 memberikan
pergeseran kimia pada daerah (ppm) pada gambar 4.3. sebagai berikut :
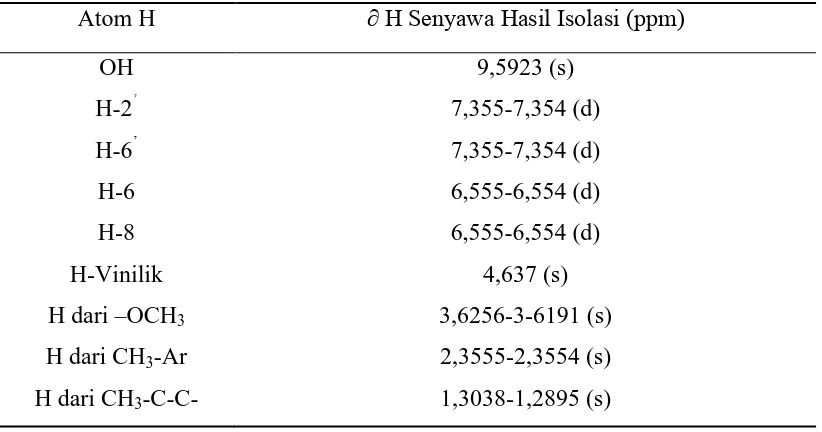
Tabel 4.2. Pergeseran Kimia 1H-NMR Senyawa Hasil Isolasi
Atom H ∂ H Senyawa Hasil Isolasi (ppm)
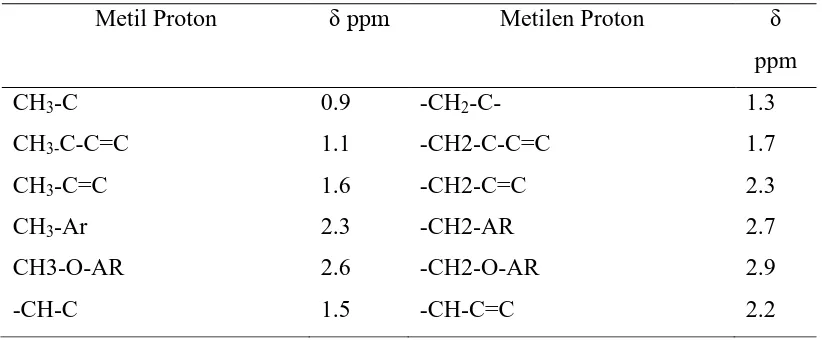
Tabel 4.3. Pergeseran Kimia 1H-NMR Senyawa Organik Pada Umumnya
Metil Proton δ ppm Metilen Proton δ
ppm
CH3-C 0.9 -CH2-C- 1.3
CH3-C-C=C 1.1 -CH2-C-C=C 1.7
CH3-C=C 1.6 -CH2-C=C 2.3
CH3-Ar 2.3 -CH2-AR 2.7
CH3-O-AR 2.6 -CH2-O-AR 2.9
-CH-C 1.5 -CH-C=C 2.2
(Pavia, et al. 1979)
4.2. Pembahasan
kemurniannya diuji dengan menggunakan eluen kloroform : etil asetat (70:30) v/v dan benzena : aseton (70:30) v/v, menunjukkan tiga noda pada senyawa yang dihasilkan (Lampiran 5). Selanjutnya di kromatografi lapis tipis preparatif dengan sistem pelarut yang cocok yakni benzena : aseton 70:30 (v/v) (Lampiran 6).
Dari hasil interpretasi spektrum UV-Vis memberikan serapan dengan panjang gelombang pita 1 364 nm dan pita 2 266 nm yang menunjukkan panjang gelombang senyawa hasil isolasi berada pada rentang panjang gelombang senyawa flavonoida golongan flavonol (dengan panjang gelombang pita I berkisar 300-400 nm dan pita II 250-270 nm) (Lampiran 7).
Dari hasil intepretasi Spektrum Infra-Merah dan Spektrum Resonansi Magnetik Inti Proton (1H-NMR) dan FT-IR senyawa hasil isolasi dengan menggunakan pelarut Aseton-d6 dalam standar TMS diperoleh yaitu:
Pergeseran kimia pada daerah δ=9,5923 ppm dengan puncak singlet menunjukkan proton dari OH pada cincin B dalam struktur flavonol senyawa hasil isolasi. Hal ini juga didukung oleh spektrum infra merah pada bilangan gelombang 3433,29-3381,21 cm-1 puncak melebar menunjukkan adanya vibrasi ulur –OH dan pada bilangan gelombang 1215,15 cm-1 dengan puncak sedang menunjukkan adanya vibrasi ulur C-O dari alkohol.
Pergeseran kimia pada daerah δ=6,555-6,554 ppm dengan puncak doublet menunjukkan proton dari H-6 dan H-8’ pada cincin A dalam struktur flavonol senyawa hasil isolasi. Hal ini juga didukung oleh spektrum infra merah pada bilangan gelombang 3259,70-3199,91 cm-1 dengan puncak melebar menunjukkan adanya vibrasi ulur C-H aromatik.
Pergeseran kimia pada daerah δ=4,6374 ppm dengan puncak singlet menunjukkan proton dari –C=C-H/ H-Vinilik pada cincin B dalam struktur flavonol senyawa hasil isolasi. Hal ini juga didukung oleh spektrum infra merah pada bilangan gelombang 1446,61 cm-1 dengan puncak sedang menunjukkan adanya Vibrasi ulur –CH alifatik.
Pergeseran kimia pada daerah δ=3,6256-3,6191 ppm dengan puncak singlet menunjukkan proton dari substituen OCH3 pada cincin A dalam struktur
flavonol senyawa hasil isolasi. Hal ini juga didukung oleh spektrum infra merah pada bilangan gelombang 972,12 cm-1 dengan puncak sedang menunjukkan adanya vibrasi ulur eter.
Pergeseran kimia pada daerah δ=2,3555-2,354 ppm dengan puncak singlet menunjukkan proton dari CH3 dekat aromatik pada cincin A dalam struktur
flavonol senyawa hasil isolasi. Adapun substituen CH3 dapat bertukar posisi tetapi
berdasarkan kestabilan posisi, diperkirakan posisi CH3 di cincin B.
Pergeseran kimia pada daerah δ=1,3038-1,2895 ppm dengan puncak singlet menunjukkan proton dari substituen CH3 dekat rantai lurus alifatis/C-C
alifatis pada cincin A dalam struktur flavonol senyawa hasil isolasi. Adapun substituen CH3 pada cincin A ini posisi nya tidak dapat ditentukan tetapi
Adapun letak dari peak metil yang melekat pada Vinilik di cincin A pada H-NMR lebih up field dibandingkan dengan H dari vinilik itu sendiri diakibatkan oleh H vinilik langsung berikatan pada C=C yang bersifat elektronegatif karena adanya ikatan rangkap sehingga sangat down field dibandingkan proton metil. Maka kesimpulannya proton vinilik jauh lebih down field dari proton metil yang melekt pada vinilik, lebih jelasnya tercantum pada tabel 4.3 (Bhal, 2007).
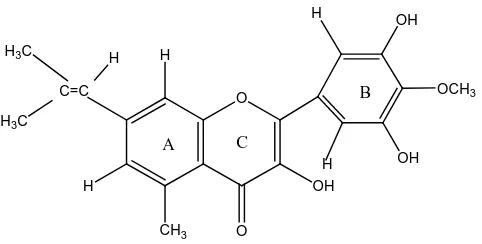
Dari data hasil spektrum UV-visible, Spektrum Inframerah (FT-IR), Spektrum 1H-NMR diduga senyawa hasil isolasi adalah senyawa flavonoida golongan flavonol. Meskipun demikian penulis mengakui kristal hasil isolasi dilihat dari data hasil Spektrum 1H-NMR kurang murni karena adanya campuran /mixing dari senyawa lain dan campuran ini dapat dilihat lebih lanjut dengan menggunakan HPLC. Berikut ini merupakan struktur flavonol yang diduga dari senyawa hasil isolasi:
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
1. Hasil isolasi yang diperoleh dari 900 g bunga Mawar putih (R. Hybrida L.) merupakan kristal kuning sebanyak 10 mg dengan harga Rf=0,58 (benzena:aseton (70:30) v/v) dan Rf=0,88 (kloroform:etil asetat (70:30) v/v) adalah positif terhadap pereaksi senyawa flavonoida
2. Hasil analisis dengan Spektrofotometri UV-Visible, Spektrofotometri Inframerah (FT-IR) dan Spektrometri Resonansi Magnetik Inti Proton (1 H-NMR) menunjukkan bahwa senyawa hasil isolasi dari bunga Mawar putih (R. Hybrida L.) diduga adalah senyawa flavonoida golongan flavonol.
5.2 Saran
DAFTAR PUSTAKA
Bhat, S., et al. 2005. Chemistry Of Natural Products. Narosa Publishing House. India.
Bintang, M. 2010. Biokimia Teknik Penelitian. Erlangga. Jakarta.
Dachriyanus. 2004. Analisis Struktur Senyawa Organik secara Spektroskopi. Andalas University Press. Padang.
Dewick, P. M., 2002. Medicinal Natural Products. John Wiley & Sons Ltd. England.
Dobreva, A. 2011. The Flavonoid Contet in The White oil-bearing Rose alba L. An International Journal Published by Faculty of Agriculture.
Fessenden, R.J.1982.Kimia Organik. Jilid I.Cetakan Kedua. Terjemahan. Aloysius Pudjaatmaka. Erlangga. Jakarta.
Harborne, J. B., et al. 1999. The Handbook of Natural Flavonoids. John Wiley & Sons. England.
Hill, R. A., et al.1991. Dictionary of Natural Products. Chapman & Hall. London.
Ikan, R. 1969. Natural Product A Laboratory Guide. Academic Press. San Diego.
Khopkar, S. M., 1990. Konsep Dasar Analitik. Penerbit Universitas Indonesia. Jakarta.
Luqman, T. 1992. Aneka Mawar dan Cara Perbanyakannya. Suara karya. Jakarta.
Manito, P. 1981. Biosintesis Produk Alami. Terjemahan Koensoemardiyah. IKIP Semarang Press. Semarang.
Markham, K. R. 1988. Cara Mengidentifikasi Flavonoida. Terjemahan Kosasi Padmawinata. ITB Press. Bandung.
Muldja, M.H. 1995. Analisis Instrumental. Cetakan Pertama. Universitas Airlangga Press. Surabaya.
Pavia, et al. 1979. Introduction to Organic Laboratory Techniques A microscale Approach. Second Edition. Saunders College. Philadelphia.
Robinson, T. 1995. Kandungan Organik Tumbuhan Tinggi. Edisi ke-4. Terjemahan Kosasih Padmawinata. ITB Press. Bandung.
Sastrohamidjojo, H. 1996. Sintesis Bahan Alam. Gadjah Mada University Press. Yogyakarta.
Sarker, S et al 2006. Natural Product Isolation. Second Edition. Humana Press Inc. New Jersey.
Sayed, E., et al,2013. Characterization of the Phytochemical Constituents of Taif Rose and Its Antioxidant and Anticancer Activities.
Silverstain, R.M. 1986. Penyidikan Spektrometrik Senyawa Organik. Terjemahan A. J. Hatomo dan Anny Viktor Purba. Edisi Ke-4. Jakarta: Penerbit Erlangga.
Soekartiwi. 1996. Manajemen Agribisnis Bunga Potong. Penerbit Universitas Indonesia. Jakarta.
Lampiran 3. Kromatogram Lapis Tipis Ekstrak Pekat Kloroform Tumbuhan Bunga Mawar Putih (R.hybrida L.) Sebelum Kromatografi Kolom
E E E E
9:1 8:2 7:3 6:4
Keterangan :
Fasa diam : Kieselgel 60 F254
E : Ekstrak Pekat Lapisan Kloroform Bunga Mawar Putih
(R.hybrida L.)
No Fasa gerak Jumlah noda Rf
I n-heksana:etil asetat 90:10 (v/v) -
-
II n-heksana:etil asetat 80:20 (v/v) 2 0,30
III n-heksana:etil asetat 70:30 (v/v) 4 0,54
0,61
0,66
0,75
IV n-heksana:etil asetat 60:40 (v/v) 3 0,68
0,74
0,82
Lampiran 4. Kromatogram Lapisan Tipis ekstrak bunga mawar putih (R.hybrida L.) penggabungan fraksi
Keterangan :
Fasa diam : Kieselgel 60 F254
E : Ekstrak Pekat Lapisan Kloroform Bunga Mawar Putih
(R.hybrida L.)
No Fraksi Jumlah Noda Rf
I 1-31 2 0,88
0,80
II 32-58 2 0,79
0,66
III 59-72 3 0,76
0,65
0.58
IV 73-115 3 0.42
0,32
0,29
Lampiran 5. Kromatogram Lapisan Tipis Ekstrak bunga mawar putih
III
Keterangan :
Fasa diam : Kieselgel 60 F254
E : Ekstrak Pekat Lapisan Kloroform Bunga Mawar Putih
(R.hybrida L.)
No. Fasa Gerak Jumlah Noda Rf
I. n-heksana:etil asetat 70:30 (v/v)
3 0,76
0,65
Lampiran 6. Kromatogram Lapisan Tipis Senyawa murni hasil isolasi
I II III
Keterangan :
Fasa diam : Kieselgel 60 F254
E : Ekstrak Pekat Lapisan Kloroform Bunga Mawar Putih
(R.hybrida L.)
No. Fasa Gerak Jumlah Noda Rf
1. n-heksana:etil asetat 70:30
(v/v)
1 0,56
2. kloroform:etil asetat 70:30(v/v) 1 0,88
Lampiran 8. Ekspansi Spektrum 1H-NMR Senyawa Hasil Isolasi pada δ=1,2-4,0 ppm
CH3
OCH3 CH3
O
O OH H
H
CH3
H
OH OH
OCH3
H C=C
H3C
Lampiran 9. Ekspansi Spektrum 1H-NMR Senyawa Hasil Isolasi pada δ=0-10,0 ppm
OCH3
H Vinilik H-6
H-2’
CH3
O
O OH H
H
CH3
H
OH OH
OCH3
H C=C
H3C
Lampiran 10. Ekspansi Spektrum 1H-NMR Senyawa Hasil Isolasi pada δ=6,0-7,9 ppm
r
H-6 H-2’
’
O
O
OH H
H
CH3
H
OH OH
OCH3
H C=C
H3C