Lampiran 3. Spektrum Ultraviolet-Visibel Beberapa Senyawa Flavonoida
Lampiran 4. Kromatogram Lapis Tipis Ekstrak Pekat Kloroform daun Tumbuhan Mawar Putih Sebelum Kromatografi Kolom
E
I II
E E
III
E E
IV V
Keterangan :
Fasa diam : Kieselgel 60 F254
E : Ekstrak Pekat Lapisan Kloroform Daun Tumbuhan Mawar Putih
No Fasa gerak Jumlah noda Rf
I n-heksana : etil asetat (90:10) v/v 1 0,11 II n-heksana : etil asetat (80:20) v/v 3
0,14 0,24 0,34
III n-heksana : etil asetat (70:30) v/v 5
Lampiran 5. Kromatogram Lapis Tipis ekstrak daun tumbuhan Mawar
E : Ekstrak daun tumbuhan Mawar Putih
Lampiran 6. Kromatogram Lapis Tipis fraksi III daun tumbuhan Mawar Putih sebelum KLT preparatif
Keterangan:
Fasa diam : Kieselgel 60 F254
E : Fraksi III daun Tumbuhan Mawar putih
No Fasa Gerak Jumlah Noda Rf
I Petroleum Benzena : Aseton 70 : 30 (v/v)
3 0,16
0,26 0,33 II Kloroform : Metanol 80 : 20 (v/v) 2 0,28 0,77 III Kloroform : Etil asetat 80 : 20 (v/v) 3 0,11 0,26 0,37 IV n-heksana : Etil asetat 60 : 40 (v/v) 1 0,55
I II III IV
Lampiran 7. Kromatogram Lapis Tipis senyawa murni hasil isolasi
Keterangan :
Fase diam : Kieselgel 60 F254 E : Pasta Hasil Isolasi
No Fasa Gerak Jumlah Noda Rf
1 Petroleum Benzena : Aseton 70 : 30 (v/v)
Lampiran 8. Spektrum 1H-NMR Senyawa Hasil Isolasi pada δH = 0 ppm - 13,5 ppm
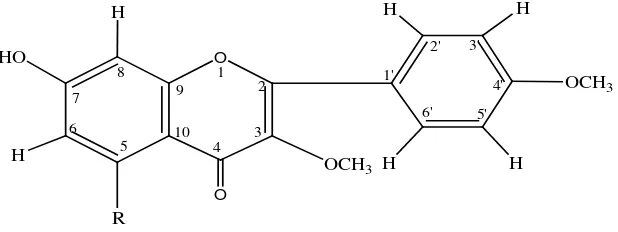
O O
HO
OCH3
OCH3
1 2
3 4 5
6 7
8 9
10
1'
2' 3'
4'
5' 6'
Lampiran 9. Spektrum Ekspansi 1H-NMR Senyawa Hasil Isolasi pada δH = 1,9 ppm – 4 ppm
O O
HO
OCH3
OCH3
1 2
3 4 5
6 7
8 9
10
1'
2' 3'
4'
5' 6'
4"
Lampiran 10. Spektrum Ekspansi 1H-NMR Senyawa Hasil Isolasi pada δH = 6,2 ppm – 7,9 ppm
O O
HO
OCH3
OCH3
1 2
3 4 5
6 7
8 9
10
1'
2' 3'
4'
5' 6'
Lampiran 11. Spektrum 1H-NMR Senyawa Pembanding
untuk Senyawa Hasil Isolasi (Chamberlain, 1970)
Lampiran 12. Spektrum 1H-NMR Senyawa Flavonoida Pembanding untuk
Lampiran 13. Spektrum 1H-NMR Senyawa Flavonoid Pembanding untuk Senyawa Hasil Isolasi (Mabry, 1970)
DAFTAR PUSTAKA
Andersen, M., Markham, K.R. 2006. Flavonoids. Taylor & Francis Group. New York.
Bhat, S., Nagasampagi, B., S., Sivakumar.,M. 2005. Chemistry of Natural
Product. Narosa publishing. New Delhi
Brown, D.W., Floyd, A.J.,Sainsbury, M. 1988. Organic Spectroscopy. Jhon Wiley & Sons Ltd. New York
Crozier, A. 2006. Plant Secondary Metabolites. Blackwell Publishing. United Kingdom
Chamberlain, N.F. 1974. The Practice of NMR Spectroscopy, with Spectra-Structure Correlations for Hydrogen-1. Plenum Press. New York
Dobreva, A. 2011. The Flavonoid Content in The White oil-bearing Rose alba L.
An international Journal Published by Faculty of Agriculture
Gritter, R. J., Bobbit,J.M., Schwarting, A.E. 1991. Pengantar Kromatografi. Edisi Kedua. Penerbit ITB. Bandung
Harbone, J. B. 1987. Metode Fitokimia. Terbitan Kedua. Penerbit ITB. Bandung Harborne, J.B., Mabry, T. J. 1982. The Flavonoids: Advance in Research.
Chapman and Hall Ltd. New York
Hariana, H. A. 2005. Tumbuhan obat dan khasiatnya. Penebar Swadaya. Jakarta Harmita. 2009. Analisis Fisikokimia. Volume 1 dan 2. Penerbit Buku Kedokteran
EGC. Jakarta
Hasim, I. 1995. Aneka Permasalahan Tanaman Hias dan Pemecahannya. Penebar Swadaya. Jakarta
Heinrich, M., Barnes, J., Gibbons, S., Williamson, E.M. 2010. Farmakognosi dan Fitoterapi. Penerbit Buku Kedokteran EGC. Jakarta
Lubis, R . S. 2015 . Isolasi Senyawa Flavonoida dari Bunga Tumbuhan Mawar Putih ( Rosa hybrida L.) . Universitas Sumatera Utara. Medan
Luqman, T. 1992. Aneka Mawar dan Cara Perbanyakannya. Suara Karya. Jakarta Mabry, T.J., Markham, K.R., Thomas, M.B. 1970. The Sistematic Identification
of Flavonoids. Springer Verlag. New York
Manito, P. 1981.Biosintesis Produk Alami. Terjemahan Koensoemardiyah. IKIP Semarang Press. Semarang
Markham, K. R. 1988. Cara Mengidentifikasi Flavonoida. Terjemahan Kosasi Padmawinata. ITB Press. Bandung
Nuraini, D. 2014. Aneka Manfaat Bunga untuk Kesehatan. Penerbit Dunia Sehat. Yogyakarta
Ogiso, A., Sato, A., Sato, S., Tamura, C.1972. Novel Macrocyclic Flavonoid Glycoside Toxic Components from Leucothoe Keiskei. An international Journal Published by Tetrahedron Letters Pergamon Press
Robinson, T. 1995. Kandungan Organik Tumbuhan Tinggi. Edisi Keenam. Penerbit ITB. Bandung
Rosanti, D. 2013. Morfologi Tumbuhan. Penerbit Erlangga. Jakarta
Supratman, U. 2010. Elusidasi Struktur Senyawa Organik. Penerbit Widya Padjajaran. Bandung
Suryowinoto, S. 1997. Flora Eksotika, Tanaman Hias Berbunga. Penerbit Kanisius. Yogyakarta
BAB 3
METODE PENELITIAN
3.1Alat-alat
- Spektrofotometer FT-IR Shimadzu
- Spektroskopi 1H-NMR
Jeol/Delta2NMR 500MHz - Spektrofotometer UV-Visible
- Kolom kromatografi
- Rotarievaporator Buchi R114
- Labu Rotarievaporator Schoot/Duran
- Lampu UV UVGL 58
- Neraca analitis Mettler AE
200 - Chamber - Maserator - Alat destilasi
- Corong pisah Pyrex
- Labu takar Pyrex
- Gelas Beaker Pyrex
- Erlenmeyer Pyrex
- Penangas air - Corong kaca
- Gelas ukur Pyrex
3.2Bahan-Bahan
- Petroleum Benzene ProAnalis
- Kertas saring biasa - Pereaksi Benedict
3.3Prosedur Penelitian
3.3.1. Penyediaan Sampel
Sampel yang diteliti adalah daun tumbuhan mawar putih yang diperoleh dari daerah Berastagi, Kabupaten Karo, Sumatera Utara. Daun Mawar putih dikeringkan diudara terbuka, lalu dihaluskan sampai diperoleh serbuk daun Mawar putih sebanyak 1080 g.
3.3.2. Uji Flavonoida
Didekantasi lalu dibagi masing-masing ekstrak sampel kedalam 2 tabung reaksi. Untuk ekstrak metanol dan etil asetat :
a. Tabung I ( ekstrak metanol ) : dengan FeCl3 5% menghasilkan larutan berwarna hitam
b. Tabung II ( ekstrak etil asetat ) : dengan FeCl3 5% menghasilkan larutan berwarna hitam
3.3.3 Ekstraksi
Ekstraksi dilakukan terhadap daun tumbuhan bunga mawar putih sebanyak 1080 g, dimana daun mawar putih yang telah dikering anginkan dan dihaluskan. Kemudian dimaserasi dengan menggunakan metanol sebanyak 15 Liter sampai semua sampel terendam dan dibiarkan selama ± 24 jam. Perendaman dilakukan secara berulang-ulang hingga ekstrak menunjukkan hasil negatif dengan menggunakan perekasi FeCl3 5%. Maserat ditampung dan dipekatkan dengan menggunakan alat rotarievaporator sehingga diperoleh ekstrak pekat metanol. Kemudian diuapkan pada penangas air hingga semua pelarut metanol menguap dan dihasilkan ekstrak pekat berwarna hitam.
3.3.3.1 Pemisahan Tanin
3.3.3.2 Ekstraksi Partisi dengan n-heksana
Ekstrak pekat etil asetat dilarutkan dengan metanol kembali yang bertujuan untuk ekstraksi partisi dengan menggunakan n-heksana. Pada ekstraksi partisi syaratnya yaitu pelarut harus tidak bercampur agar terbentuk 2 lapisan, sehingga digunakan metanol karena metanol tidak bercampur dengan n-heksana. Ekstrak kemudian dipartisi dengan pelarut n-heksana berkali-kali hingga diperoleh ekstrak metanol bebas nonpolar (flavonoida glikosida). Kemudian ekstrak metanol diuapkan kembali hingga seluruh pelarut menguap dan dihasilkan ekstrak pekat metanol bebas nonpolar berwarna hitam sebanyak 40,39 g.
3.3.3.3 Hidrolisa
Ekstrak pekat metanol bebas tannin dan bebas nonpolar (flavonoida glikosida) dihidrolisa yang bertujuan untuk memutuskan ikatan gula pada senyawa flavonoida dengan menggunakan HCl 6%. Ekstrak pekat metanol bebas tannin dan bebas nonpolar dilarutkan dengan HCl 6% dengan perbandingan sampel adalah 2:5 kemudian ditambahkan aquadest lalu dipanaskan diatas waterbath selama 60 menit, setelah air mendidih lalu disaring untuk memperoleh filtrat yang dimana merupakan aglikon flavonoida (Mabry et al, 1970).
3.3.3.4 Ekstraksi Partisi dengan Kloroform
3.3.3.5 Pemisahan Komponen-Komponen dengan Kromatografi Kolom
Pemisahan komponen-komponen secara kolom dilakukan terhadap ekstrak pekat kloroform yang telah diperoleh. Fasa diam yang digunakan adalah silika gel dan fasa gerak yaitu n-heksana 100 %, campuran pelarut n-heksana : etil asetat dengan perbandingan (90:10 v/v , 80:20 v/v, 70:30 v/v, 60:40 v/v) . Dirangkai alat kolom kromatografi terlebih dahulu dibuburkan silika gel 40 (70-230 mesh) ASTM dengan menggunakan n-heksana, diaduk-aduk hingga homogen lalu dimasukkan dalam kolom kromatografi .
Ekstrak pekat klorofom dilarutkan dengan etil asetat lalu dicampurkan dengan silika gel. Kemudian pelarut etil asetat diuapkan pada penangas air sampai etil asetat menguap, lalu dimasukkan kedalam kolom kromatografi. Kemudian dielusi dengan menggunakan n-heksana 100% hingga silika gel padat dan homogen, lalu ditambahkan fasa gerak n-heksana : etil asetat ( 90:10 )v/v secara perlahan-lahan dan diatur sehingga aliran fasa yang keluar dari kolom sama banyaknya dengan penambahan fasa gerak dari atas.
3.3.4. Uji Kemurnian Hasil Isolasi dengan Kromatografi Lapis Tipis (KLT)
Uji kemurnian senyawa hasil isolasi dilakukan dengan kromatografi lapis tipis dengan menggunakan fasa diam silika gel 60 F254 dengan fasa gerak n-heksana : etil asetat (7:3) v/v. Dalam hal ini prosedur yang dilakukan yaitu dimasukkan 10 ml eluen ke dalam chamber, lalu dijenuhkan. Ditotolkan fraksi positif FeCl3 5% (fraksi 18-122) yang sebelumnya sudah dilarutkan dengan etil asetat pada batas bawah plat KLT. Kemudian ditunggu hingga plat kering dan dimasukkan plat KLT tersebut kedalam chamber yang telah jenuh. Setelah eluen merembes sampai batas atas plat KLT , plat KLT kemudian dikeluarkan dari chamber, dikeringkan dan difiksasi dengan pereaksi FeCl3 5% dan menghasilkan bercak berwarna hitam yang menunjukkan adanya senyawa flavonoida. Kemudian ditentukan harga RF dari tiap noda dan digabungkan tiap fraksi dari botol vial yang memiliki harga Rf yang sama dan pola noda yang sama yaitu fraksi 18-23, fraksi 24-39, fraksi fraksi 40-54, fraksi 55-88, fraksi 89-102 dan fraksi 103-122. Kemudian gabungan fraksi 40-54 di KLT kembali dan terdapat 3 noda pada plat KLT dan menunjukkan senyawa belum murni kemudian dilakukan pemurnian dengan KLT preparatif.
3.3.5 Pemurnian Hasil Isolasi
3.3.5.1 Pemurnian Hasil Isolasi Dengan Kromatografi Lapis Tipis Preparatif
Dimasukkan plat KLT pada chamber yang berisi perbandingan pelarut yang sesuai untuk menaikkan noda yaitu digunakan petroleum benzena : aseton ( 70 : 30 ) v/v pada saat mencapai batas atas plat KLT diangkat dan didiamkan kemudian dimasukkan kembali sampai 2 kali pemasukkan plat kedalam chamber agar noda-noda benar-benar terpisah dengan baik, kemudian diangkat dan dikeringkan, plat disinari dengan lampu UV kemudian ditandai noda yang terpisah kemudian dikeruk dengan menggunakan alat pengeruk dan dimasukkan kedalam corong kaca kecil yang bawahnya telah dibuat kapas sebagai penyaringan kemudian diekstraksi pada bagian atas corong menggunakan pelarut metanol : etil asetat ( 1 : 1 ) dibiarkan sampai filtratnya habis turun, filtrat yang ditampung dimurnikan dengan penguapan kembali pelarut sampai terbentuk pasta, kemudian di KLT kembali untuk melihat apakah senyawa hasil isolasi sudah murni menghasilkan 1 noda, ada adsorpsi pada sinar UV dan positif dengan pereaksi FeCl3.
3.3.5.2 Pemurnian
3.3.6 Identifikasi Senyawa Hasil Isolasi
3.3.6.1 Identifikasi dengan Spektrofotometer Ultraviolet-Visibel (UV-Vis)
Analisis dengan alat spektrofotometer Ultraviolet-Visibel ( UV-Vis ) diperoleh dari Laboratorium Pusat Penelitian Kimia- LIPI, kawasan PUSPITEK Serpong, Tangerang dengan menggunakan pelarut metanol.
3.3.6.2 Identifikasi dengan Spektrofotometer Infra-Merah (FT-IR)
Analisis dengan alat spektrofotometer Inframerah (FT-IR) diperoleh dari Laboratorium Pusat Penelitian Kimia- LIPI, Kawasan PUSPITEK Serpong, Tangerang dengan menggunakan KBr.
3.3.6.3 Identifikasi dengan Spektroskopi Resonansi Magnetik Inti Proton
(1H-NMR)
3.4 Bagan Uji Polifenol dan Uji Flavonoida
3.4.1 Bagan Uji Polifenol dengan Metanol
Serbuk daun Mawar Putih
Tabung I
diamati warna larutan
ditambahkan pereaksi FeCl3 5%
diamati perubahan warna
Larutan Hitam
di ekstraksi dengan metanol disaring
dimasukkan kedalam tabung reaksi
3.4.2 Bagan Uji Flavonoida dengan etil asetat
Serbuk daun Mawar Putih
Tabung I
diamati warna larutan
ditambahkan pereaksi FeCl3 5%
diamati perubahan warna
Larutan Hitam
di ekstraksi dengan etil asetat disaring
dimasukkan kedalam tabung reaksi
3.5 Bagan Penelitian
1080 gram serbuk daun tumbuhan mawar putih (Rosa alba L.)
dimaserasi dengan metanol hingga terendam didiamkan selama ± 24 jam
diulangi sebanyak 5 kali disaring
ekstrak metanol ampas
ektrak pekat metanol
dilarutkan dengan etilasetat sampai larutan negatif bila diuji dengan FeCl3 5%
disaring
Ekstrak Etilasetat
diuji dengan FeCl3 5% (+)
dipekatkan dengan rotarievaporator
Ekstrak pekat etilasetat
diuapkan hingga seluruh etil asetat menguap dilarutkan dengan metanol
diekstraksi partisi dengan n-heksana hingga bening
lapisan n-heksana (tidak dilanjutkan) lapisan metanol
diuji dengan FeCl3 5% (+) di pekatkan dengan rotarievaporator
dilakukan uji kandungan gula dengan penambahan pereaksi Benedict (+)
di Hidrolisa dengan menggunakan HCl 6% sambil dipanaskan hingga 60 menit sambil diaduk didinginkan
disaring
ekstrak metanol asam Residu
dipartisi dengan klorofom hingga lapisan kloroform negatif bila diuji dengan FeCl3 5%
Lapisan metanol
diuapkan hingga seluruh pelarut metanol habis menguap
Ekstrak pekat kloroform
diuji FeCl3 5% (+)
diuji KLT untuk mengetahui eluen yang sesuai
dikolom kromatografi dengan fase diam silika gel dan fase gerak (eluen) n-heksana : etil asetat (90:10; 80:20; 70:30; 60:40) (v/v)
ditampung tiap fraksi sebanyak ± 10 mL dalam botol vial diuji Kromatografi Lapis Tipis
digabung fraksi dengan harga Rf yang sama
Fraksi 18-23
dipreparatif dengan eluen Petroleum Benzena : Aseton (70:30) dikeringkan
disinari dibawah lampu UV digerus dari plat
dilarutkan dengan campuran metanol : etil asetat 1:1 disaring IR), spektroskopi 1H-NMR,
BAB 4
HASIL DAN PEMBAHASAN
4.1Hasil Penelitian
Hasil uji flavonoida terhadap ekstrak metanol dan ekstrak etil asetat dari daun tumbuhan mawar putih menunjukkan bahwa sampel positif terhadap pereaksi FeCl3 5%.
Hasil elusi dari perbandingan pelarut n-heksana : etil asetat 70:30 (v/v) pada fraksi 40-54, dilakukan KLT preparatif dengan eluen Petroleum Benzena : Aseton 70:30 (v/v) untuk mendapatkan senyawa murni. Sehingga diperoleh senyawa murni berupa pasta berwarna coklat kemerahan, seberat 8,8 mg dan nilai Rf 0,33.
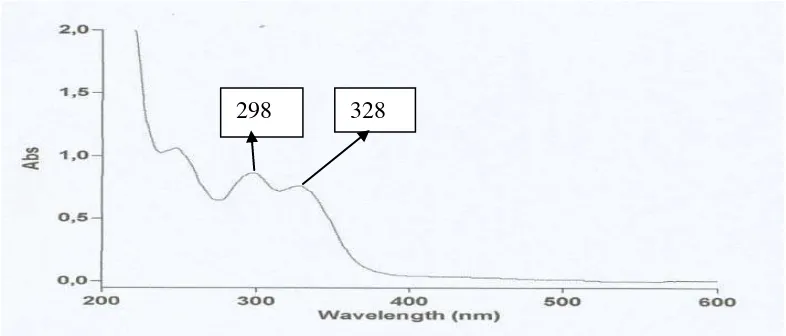
Spektrum UV-Visibel senyawa hasil isolasi dengan menggunakan pelarut metanol ditunjukkan pada gambar 4.1 dibawah ini
Gambar 4.1 Spektrum UV-Visibel Senyawa Hasil Isolasi
Panjang gelombang (nm) Abs
328 298
0,758 0,865 328
Dari hasil karakterisasi dan elusidasi menggunakan Spektrofotometer Ultraviolet-Visibel (UV-Vis) menunjukkan adanya dua serapan panjang gelombang maskimum (λ maks) yaitu pada pita I menunjukkan panjang gelombang 328 nm dan pada pita II menunjukkan panjang gelombang 298 nm.
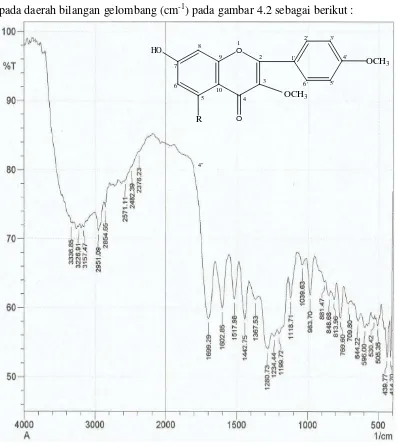
Spektrum FT-IR pasta hasil isolasi memberikan puncak-puncak serapan pada daerah bilangan gelombang (cm-1) pada gambar 4.2 sebagai berikut :
Gambar 4.2 Spektrum Inframerah Merah (FT-IR) Senyawa Hasil Isolasi
Hasil analisis Spektrofotometer FT-IR dari pasta hasil isolasi menghasilkan pita-serapan pada daerah bilangan gelombang pada tabel 4.2 sebagai berikut :
Tabel 4.2 Hasil Analisis Spektrum FT-IR Senyawa Hasil Isolasi
Gugus Fungsi intensitas Bilangan Gelombang (cm-1)
-OH Rendah 3226,91-3336,85
C-H alifatis Rendah 2854,65-2951,09
C-H aromatis Rendah 3157,47
C=O Tajam 1699,29
C=C aromatik Sedang 1442,75, 1517,98, 1602,85
-CH3 Rendah 1367,53
-C-O gugus Alkohol Sedang 1280,73
C-O-C Rendah 1039,63-1118,71
Berdasarkan data hasil analisis spektrofotometer inframerah diatas menunjukkan bahwa senyawa hasil isolasi memiliki gugus fungsi yang lazim ditemukan pada senyawa flavonoida.
z
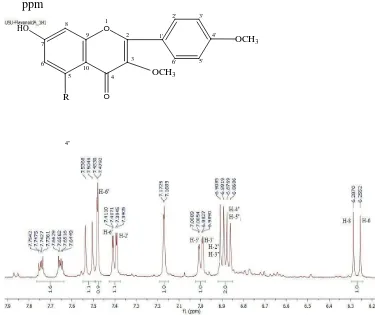
Gambar 4.3 Spektrum 1H-NMR Senyawa Hasil Isolasi pada δH = 0-13,5 ppm
Gambar 4.4 Spektrum 1H-NMR Senyawa Hasil Isolasi δH = 6,2 ppm-7,9 ppm
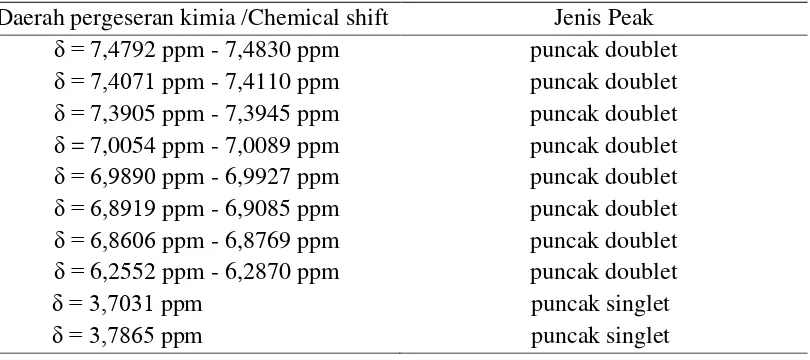
Berikut merupakan pergeseran kimia dan jenis peak 1H-NMR senyawa hasil isolasi pada tabel 4.3 :
Tabel 4.3 Pergeseran kimia dan jenis peak 1H-NMR senyawa hasil isolasi Daerah pergeseran kimia /Chemical shift Jenis Peak
δ = 7,4792 ppm - 7,4830 ppm
Ekstrak pekat metanol dihidrolisis dengan HCl 2 N yang bertujuan untuk memutuskan ikatan gula. Kemudian dipartisi dengan kloroform dan dipekatkan. Sebelum dimasukkan kedalam kolom ekstrak pekat dianalisis dengan kromatografi lapis tipis. Dari hasil kromatografi lapis tipis, diketahui bahwa perbandingan pelarut yang baik untuk memisahkan senyawa flavonoida dari daun tumbuhan daun mawar putih adalah 70:30 (v/v) yang menunjukkan pemisahan yang lebih baik dari noda yang dihasilkan (lampiran 4).
Setelah pemisahan dengan kromatografi kolom kemudian dilakukan analisis KLT untuk penggabungan fraksi dan diperoleh 6 penggabungan (lampiran 5). Fraksi yang dilanjutkan yaitu fraksi 40-54 sebanyak 75,5 mg karena pemisahan noda yang dihasilkan lebih baik dan noda berada ditengah plat dibandingkan dengan fraksi 55-88, fraksi 89-102, fraksi 103-108 yang nodanya bersifat sangat polar dan fraksi 18-23, fraksi 24-39 lebih nonpolar. Kemudian dianalisis KLT dengan sistem pelarut petroleum benzene : aseton 70:30 (v/v), kloroform : metanol 80:20 (v/v), kloroform : etil asetat 80:20 (v/v), n-heksana : etil asetat 60:40 (v/v) (lampiran 6). Kemudian dianalisis kromatografi Lapis Tipis Preparatif dengan sistem pelarut yang cocok adalah petroleum benzene : aseton 70:30 (v/v) diamati dengan lampu UV, lalu diambil noda, kemudian silika gel dikerok dan dielusi dengan perbandingan pelarut metanol : etil asetat 1:1 (v/v) di dalam corong kecil. Senyawa yang diperoleh kemudian kemurniannya diuji KLT dengan eluen petroleum benzene aseton 70:30 (v/v) (lampiran 7) yang menunjukkan hanya satu noda pada senyawa yang dihasilkan.
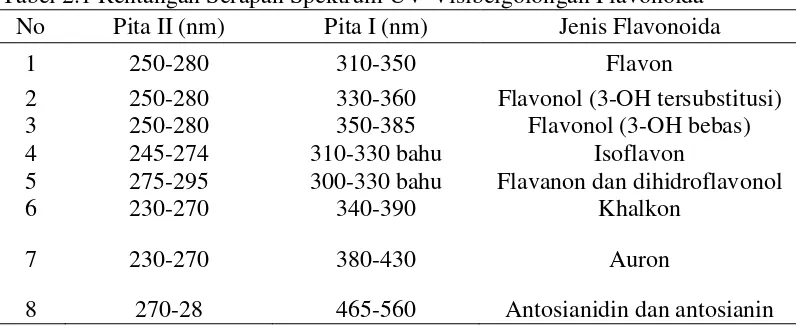
Dari hasil interpretasi spektrum UV-Visibel dengan pelarut metanol (Gambar 4.1) memberikan panjang gelombang (λ maks) 328 nm pada pita I dan 298 nm pada pita II ( Tabel 4.1). Hal ini menunjukkan bahwa senyawa hasil isolasi sesuai dengan spektrum UV-Visibel dari senyawa pembanding Flavonoid (lampiran 3) kemungkinan yaitu Flavon dan terjadi penyimpangan dari literatur yaitu terjadi pergeseran absorbsi maksimum ke daerah yang panjang gelombang yang lebih tinggi atau disebut batokromik ( batochromic shift ). Kemungkinan hal ini terjadi karena adanya pengaruh subtituen yang diikatnya.
Hasil interpretasi Spektrum Infra Merah (FT-IR), Spektrum Resonansi Magnetik inti proton 1H-NMR dengan menggunakan pelarut aseton-d6
menunjukkan
Pergeseran kimia pada daerah δH = 6,2552 ppm - 6,2870 ppm terdapat puncak doublet menunjukkan proton yang berjodohan antara proton H-6 dan H-8 pada cincin A dikarenakan adanya subtituen yaitu dapat berupa –OH dan –OCH3 pada C-7. Hal ini didukung oleh spektrum IR pada bilangan gelombang 1442,75 cm-1 , 1517,98 cm-1 dan 1602,85 cm-1 puncak sedang menunjukkan adanya vibrasi ikatan rangkap C=C dari sistem aromatik dan pada bilangan gelombang 3157,47 cm-1 menunjukkan vibrasi rendah –CH sistem aromatik.
Pergeseran kimia pada daerah δH = 7,3905 ppm - 7,3945 ppm terdapat puncak doublet dan δH = 7,4071 ppm - 7,4110 ppm terdapat puncak doublet yang menunjukkan proton yang berjodohan antara proton H-2' dan H-6' pada cincin B. Hal ini didukung oleh spektrum IR pada bilangan gelombang 1442,75 cm-1 , 1517,98 cm-1 dan 1602,85 cm-1 puncak sedang menunjukkan adanya vibrasi ikatan rangkap C=C dari sistem aromatik dan pada bilangan gelombang 3157,47 cm-1 menunjukkan vibrasi rendah –CH sistem aromatik.
Pergeseran kimia pada daerah δH = 7,4792 ppm - 7,4830 ppm terdapat puncak doublet yang menunjukkan proton H -6̎ yang bertetangga dengan proton dari H-5̎ pada cincin D (R= aromatis) . Hal ini didukung oleh IR pada bilangan gelombang 1442,75 cm-1 , 1517,98 cm-1 dan 1602,85 cm-1 puncak sedang menunjukkan adanya vibrasi ikatan rangkap C=C dari sistem aromatik dan pada bilangan gelombang 3157,47 cm-1 menunjukkan vibrasi rendah –CH sistem aromatik.
Pergeseran kimia pada daerah δH = 6,8919 ppm - 6,9085 ppm terdapat puncak doublet yang menunjukkan proton H -2̎ dan H -3̎ pada cincin D (R= aromatis). Hal ini didukung oleh IR pada bilangan gelombang 1442,75 cm-1 , 1517,98 cm-1 dan 1602,85 cm-1 puncak sedang menunjukkan adanya vibrasi ikatan rangkap C=C dari sistem aromatik dan pada bilangan gelombang 3157,47 cm-1 menunjukkan vibrasi rendah –CH sistem aromatik.
Pergeseran kimia pada daerah δ = 6,8606 ppm - 6,8769 ppm terdapat puncak doublet yang menunjukkan proton H -4̎ dan H -5̎ pada cincin D (R= aromatis). Hal ini didukung oleh IR pada bilangan gelombang 1442,75 cm-1 , 1517,98 cm-1 dan 1602,85 cm-1 puncak sedang menunjukkan adanya vibrasi ikatan rangkap C=C dari sistem aromatik dan pada bilangan gelombang 3157,47 cm-1 menunjukkan vibrasi rendah –CH sistem aromatik.
1039,63 cm-1 dan 1118,71 cm-1 puncak rendah menunjukkan adanya vibrasi ulur dari C-O-C.
Pergeseran kimia pada daerah δH = 3,7865 ppm terdapat puncak singlet menunjukkan adanya proton –OCH3. Hal ini didukung oleh data dari spektrum inframerah pada bilangan gelombang 2854,65-2951,09 cm-1 puncak rendah menunjukkan adanya vibrasi ulur –CH alifatis, vibrasi tekuk –CH3 puncak rendah pada bilangan gelombang 1367,53 cm-1, dan pada bilangan gelombang 1039,63 cm-1 dan 1118,71 cm-1puncak rendah menunjukkan adanya vibrasi ulur dari C-O-C.
Berdasarkan dengan spektrum 1H-NMR bahwa di C-5 tidak terdapat subtituen OH karena tidak ada peak muncul pada 12 ppm, kemungkinan yaitu dapat berupa subtituen R (aromatik) dan –OCH3 . Pada cincin B yaitu pada C-4’ diduga subtituen OH atau –OCH3 hal ini diperkuat oleh muculnya peak doublet-doublet. Demikian halnya pada cincin A, dimana subtituen pada C-7 dapat berupa OH atau –OCH3 .
Oleh karena analisa yang dilakukan hanya 1H-NMR maka belum bisa menentukan atau menginterpretasi peak doublet-doublet yang terletak pada 6,9 ppm. Dan diduga bahwa peak ini adalah peak dari senyawa aromatis (R), dan belum dapat juga menentukan posisi dari senyawa aromatis ini sama halnya dengan subtituen lainnya seperti –OCH3 dan OH.
Berdasarkan analisis data dan interpretasi yang dilakukan pada spektrum UV-Visible, spektrum Inframerah (FT-IR) dan spektrum 1H-NMR, pasta yang diisolasi dari daun tumbuhan Mawar Putih (Rosa alba L. ) adalah senyawa flavonoida golongan flavon dengan dugaan struktur senyawa sebagai berikut :
Ogiso et al 1972 menemukan sifat toksisitas dalam ekstrak metanol dari
Leucothoe keiskei miq. Dimana dari tumbuhan ini yang telah diuji aktivitasnya
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
1. Hasil uji Flavonoida menggunakan pereaksi FeCl3 5% menunjukkan bahwa daun mawar putih mengandung senyawa flavonoida.
2. Hasil isolasi yang diperoleh dari 1080 g daun tumbuhan mawar putih merupakan pasta berwarna coklat kemerahan diperoleh sebanyak 8,8 mg , Rf = 0,33 dengan eluen Petroleum Benzena : Aseton 70:30 (v/v)
3. Hasil analisis dengan Spektrofotometer Infra Merah (FT-IR), Spektrofotometer UV-Visible, Spektroskopi Resonansi Magnetik Inti Proton 1H-NMR menunjukkan bahwa senyawa hasil isolasi dari daun tumbuhan mawar putih merupakan flavonoida golongan flavon.
4. Kemungkinan Struktur kimia senyawa hasil isolasi
5.1 Saran
1. Karena spektrum senyawa hasil isolasi lebih kompleks dari spektrum 1 H-NMR flavonoid pada umumnya, maka disarankan untuk menganalisa hasil isolasi ini dengan spektroskopi NMR 1 dimensi 13C-NMR dan NMR 2 dimensi (1H-1H COSY, 1H-13C HMQC, dan 1H-13C HMBC) serta Spektrometer Massa
BAB 2
TINJAUAN PUSTAKA
2.1Tumbuhan Mawar Putih
2.1.1. Morfologi Tumbuhan Mawar
Bunga Mawar yang termasuk famili Rosaceae berbentuk semak kadang-kadang memanjat (Nuraini, 2014). Daunnya merupakan daun majemuk menyirip yang memiliki daun penumpu. Struktur daun mawar (Rosa sp.) ini terdiri dari anak daun (foliolum) yang terdiri dari lebih dari satu helai yang didukung oleh tangkai anak daun; tangkai anak daun (petiololus) yang merupakan tempat melekatnya anak daun ; ibu tangkai daun (petiolus communis) merupakan tempat melekatnya anak daun dan tangkainya ;serta daun penumpu.
Rosa alba L atau Rosa indica Lindl berbunga besar berwarna putih atau
putih pucat, memiliki perhiasan bunga ganda , berbau harum ( Suryowinoto, 1997).
2.1.2. Sistematika Tumbuhan Bunga Mawar Putih
Kingdom : Plantae
Divisi : Spermatophyta Kelas : Dycotyledoneae
Ordo : Rosidales
Famili : Rosaceae
Genus : Rosa
2.1.3. Jenis-Jenis Tumbuhan Bunga Mawar
Mawar beragam warna yaitu merah, merah jambu, kuning, ungu, putih, dan lain-lain. Jumlah varietas mawar saat ini diperkirakan mencapai 5000 macam, namun hanya sekitar 300-400 varietas saja yang dikenal secara umum dan sering
dibudidayakan. Luqman (1992), Tim Direktorat Bina Produksi Hortikultura (1988) mencatat bahwa diantara varietas tersebut penggolongan mawar menjadi Sembilan kelompok utama, yaitu:
a. Hybrid tea
Jenis bunga mawar yang bertangkai panjang dengan bunga tunggal diujungnya sehingga tampak megah dan cantik
b. Floribunda
Jenis bunga potong dan tanaman taman yang bunganya cukup besar dengan warna bervariasi dab tangkai tegak panjang
c. Grandiflora
Bunganya berukuran raksasa dengan diameter dapat mencapai 7,5-12,5 cm.
d. Climbing rose
Diameter bunga berkisar antara 5-15 cm dan tumbuh merunduk karena beratnya cabang serta tersusun dalam tandan yang jarang. Kelompok mawar ini pertumbuhannya sangat lamban dibandingkan kelompok lain dan rata-rata baru dapat berbunga setelah umurnya lebih dua tahun.
e. Polyantha
Jenis mawar taman dengan warna bunga yang sangat beraneka ragam, bunga kecil dengan garis tengah sekitar 5 cm dan didekat pucuk cabangnya terdapat banyak ranting yang masing-masing memiliki sekuntum bunga
Jenis mawar yang diameter bunganya sangat lebar (15 cm) dan juga merupakan kelompok mawar yang sudah sulit ditemukan dalam literature
g. Mawar tea
Merupakan nenek moyang mawar di Asia dengan ukuran bunga kecil
h. Mawar tua
disebut juga mawar kuno, dan aromanya sangat wangi
i. Special purpose
mawar yang dibedakan atas tiga golongan, yaitu mawar pohon, mawar perdu, mawar mini.
Luqman (1992), Rukmana (1992) dan Subiyanto (1991) menguraikan pengelompokkan bunga mawar berdasarkan bentuk bunga menjadi tiga kelompok, yaitu:
a. Mawar berbunga tunggal
Mawar yang mahkota bunganya tersusun dari satu lapis daun bunga sebanyak 5-7 helai
b. Mawar berbunga semidobel
daun bunganya berjumlah antara 10-20 helai yang tersusun dalam beberapa lapis, biasanya mahkota bunga semidobel ini agak terbuka bagian atasnya
c. Mawar berganda
O1
Flavonoid merupakan salah satu golongan fenol alam yang terbesar (Markham, 1988). Flavonoida umumnya terdapat dalam tumbuhan tingkat tinggi tetapi terdapat juga dalam alga. Golongan flavonoid dapat digambarkan sebagai deretan senyawa C6-C3-C6. Artinya, kerangka karbonnya terdiri atas dua gugus C6 (cincin benzene tersubtitusi) disambungkan oleh rantai alifatik tiga karbon. Golongan terbesar flavonoid berciri mempunyai cincin piran yang menghubungkan rantai tiga-karbon dengan salah satu dari cincin benzene. Adapun sistem penomoran untuk turunan flavonoid sebagai berikut pada gambar 2.1 (Robinson, 1995).
Gambar 2.1 flavonoid
2.2.1 Klasifikasi Senyawa Flavonoida 1 . Flavonoida O-glikosida
Flavonoida biasanya terdapat sebagai flavonoid O-Glikosida. Pada senyawa tersebut satu gugus hidroksil flavonoid atau lebih yang terikat pada satu gula atau lebih dengan ikatan hemiasetal yang tak tahan asam Pengaruh glikosilasi menyebabkan flavonoid menjadi kurang reaktif dan lebih mudah larut dalam air. Sifat terakhir ini memungkinkan penyimpanan flavonoid di vakuola sel. Salah satu contohnya yaiu Apigenin 7-O-β-D-glukopiranosida pada gambar 2.2 (Markham, 1988).
O
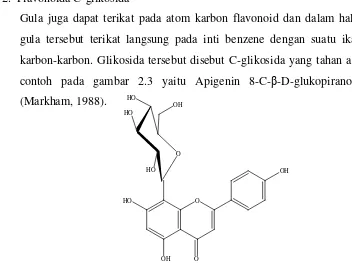
2. Flavonoida C-glikosida
Gula juga dapat terikat pada atom karbon flavonoid dan dalam hal ini gula tersebut terikat langsung pada inti benzene dengan suatu ikatan karbon-karbon. Glikosida tersebut disebut C-glikosida yang tahan asam contoh pada gambar 2.3 yaitu Apigenin 8-C-β-D-glukopiranosida (Markham, 1988).
3. Flavonoida Sulfat
Flavonoid flavonoid lain yang mudah larut dalam air yang mungkin ditemukan hanya flavonoida sulfat. Senyawa ini mengandung satu ion sulfat atau lebih yang terikat pada hidroksil fenol atau gula. Secara teknis senyawa ini sebenarnya bisulfat karena terdapat sebagai garam, yaitu flavon-O-SO3-K (Markham, 1988).
4. Biflavonoid
Biflavonoid adalah flavonoid dimer flavonoid yang biasa terlibat yaitu biasanya flavon dan flavanon secara biosintesis mempunyai pola oksigenasi yang sederhana dan ikatan antar flavonoid yaitu ikatan karbon-karbon atau ikatan eter contoh pada gambar 2.4 Amentoflavon ( Markham, 1988). Biflavonoid terdapat hampir khusus dalam gimnospermae tetapi kadang-kadang dapat juga ditemukan dalam
O
5. Aglikon Flavonoida
Anglikon flavonoid mempunyai atom karbon atom asimetrik dan dengan demikian menunjukkan sifat keaktifan optik (yaitu memutar bidang polarisasi-datar). Yang termasuk dalam golongan ini adalah flavanon, dihidroflavonol, katekin, pterokarpan, rotenoid, dan beberapa biflavonoid (Markham, 1988).
flavonoida dapat dikelompokkan berdasarkan keragaman pada rantai C3 yaitu
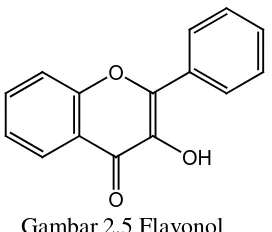
1. Flavonol
2. Flavon
Flavon (Gambar 2.6) memiliki struktur yang sangat mirip dengan flavonol (Crozier, 2006). Hanya ada 2 flavon umum yaitu apigenin dan luteolin. Flavon juga terdapat dalam bentuk glikosida tetapi jenis glikosidanya lebih sedikit daripada jenis gikosida pada flavonol (Harbone, 1987).
3. Isoflavon
Isoflavon yang telah dikenal lebih dari 200 senyawa, merupakan isomer flavon, tetapi jauh lebih langkah. Hampir semuanya terdapat dalam suku leguminosae (Harbone, 1988). Isoflavon berlainan dengan flavonoid, pada kedudukan dari cincin aromatik B pada rantai propana sentral, struktur isoflavon dapat dilihat pada gambar 2.7 (Manitto, 1980).
4. Flavanon
Flavanon dapat dikarakterisasi karena tidak adanya terdapat ikatan rangkap pada atom karbon no 2 dan 3 (gambar 2.8) dan dengan adanya pusat atom karbon kiral pada pada C2. Struktur flavanon memiliki kereaktifan yang tinggi. Flavanon dalam konsentrasi tinggi terdapat dalam buah jeruk (Citrus) (Crozier, 2006).
O O
Gambar 2.6 flavon
O O
5. Flavanonol
Flavanonol atau dihidroflavonol (gambar 2.9) merupakan flavonoid yang paling kurang dikenal dan tidak diketahui apakah senyawa ini terdapat dalam bentuk glikosida. Tidak seperti leukoantosianidin, senyawa ini stabil dalam asam klorida panas tetapi terurai oleh basa hangat menjadi kalkon (Robinson 1995).
6. Antosianin
Antosianin merupakan pewarna paling penting dan paling tersebar luas dalam tumbuhan (Harbone, 1988). Antosianin ialah pigmen daun bunga merah sampai biru yang biasa ( meskipun apigeninidin kuning), banyaknya sampai 30% bobot kering dalam beberapa bunga. Tidak seperti golongan flavonoid lainnya antosianin selalu terdapat sebagai glikosida. Salah satu contoh antosianin Malvidin-3-O-glikosida dapat dilihat pada gambar 2.10 (Robinson, 1995).
7. Antosianidin
Antosianidin ialah aglikon antosianin yang terbentuk bila antosianin dihidrolisis dengan asam (Harbone, 1988) dimana secara luas tersebar dalam kingdom plantae dan jelas terdapat dalam jaringan bunga dan buah. Antosianidin (gambar 2.11) ini bertanggung jawab dalam meberikan warna merah,biru, dan ungu. Antosianidin juga ditemukan dalam di daun, batang, biji dan jaringan akar dan memiliki peran penting dalam menarik serangga dalam penyerbukan. Adapun contoh antosianidin yang paling umum yaitu pelargonidin, cyaniding, delphinidin, peonodin, petunidin, dan malvidin ( Crozier, 2006 ).
8. Auron
Auron berupa pigmen kuning emas terdapat dalam bunga tertentu dan bryofita (gambar 2.12). Dikenal hanya lima aglikon , tetapi pola hidroksilasi senyawa ini umumnya serupa dengan pola pada flavonoid lain dalam larutan basa senyawa ini menjadi merah rose. Beberapa contoh auron yaitu leptosin, aureusidin, sulfuretin, dan sulfuretin ( Crozier, 2006 ).
O+
OH
OH HO
OH
Gambar 2.11 antosianidin
O
9. Kalkon
Kalkon merupakan zat warna kuning pada bunga, kadang terdapat pada jaringan lain. Sifat khas kalkon memberikan warna merah dengan ammonia (Sirait, 2000). Kalkon tidak terdapat cincin benzo γ-piron sehingga merupakan flavonoid cincin terbuka.Struktur dari kalkon dapat dilihat pada gambar 2.13 (Bhat, 2005).
2.2.2 Sifat Kelarutan Senyawa Flavonoida
Flavonoida dalam bentuk glikosida kelarutannya bertambah dalam air dan alkohol. Flavanon dan glikosida kalkon sulit larut dalam metanol, etanol, dan campuran alkohol-air. Flavan-3-ol ( katekin, proantosianidin, dan tanin terkondensasi) dapat diekstrak secara langsung menggunakan air sedangkan metanol merupakan pelarut yang baik untuk katekin dan aseton 70 % untuk prosianidin. Antoasianin dapat diekstrak menggunakan metanol asam. Metanol asam ini mengandung asam asetat 7% dan asam trifluoroasetat 3% (Andersen, 2006).
2.3Teknik Pemisahan
2.3.1 Ekstraksi
Ekstraksi adalah suatu metode pemisahan substansi atau zat dari campurannya dengan menggunakan pelarut yang sesuai. Ekstraksi dapat digolongkan berdasarkan bentuk campuran yang diekstraksi dan proses pelaksanaannya. Berdasarkan bentuk campurannya yaitu ekstraksi padat-cair ; zat yang diekstraksi terdapat di dalam campuran yang berbentuk padatan.
O
Ekstraksi jenis ini banyak dilakukan didalam usaha mengisolasi zat berkhasiat yang terkandung didalam bahan alam seperti steroid, hormon, antibiotika, dan lipida pada biji-bijian. Kemudian ekstraksi cair-cair ; zat yang diekstraksi terdapat didalam campuran yang berbentuk cair. Ekstraksi cair-cair sering juga disebut ekstraksi pelarut banyak dilakukan untuk memisahkan zat seperti iod, atau logam-logam tertentu dalam larutan air.
Berdasarkan proses pelaksanaanya yaitu ekstraksi Kontinyu (Continues Extraction) pada ekstraksi kontinyu, pelarut yang sama digunakan secara berulang-ulang sampai proses ekstraksi selesai. Tersedia berbagai alat dari jenis ekstraksi ini seperti alat soxhlet atau Craig Countercurent. Dan yang kedua Ekstraksi Bertahap (Batch) pada ekstraksi bertahap, setiap kali ekstraksi selalu digunakan pelarut yang baru sampai proses ekstraksi selesai. Alat yang digunakan adalah berupa corong pisah (Yazid, 2005).
Flavonoid biasanya (glikosida) dapat terdegradasi oleh aktivitas enzim saat tumbuhan dalam bentuk segar dan dalam bentuk tidak kering. Oleh karena itu disarankan sampel yang digunakan dalam bentuk kering, lipofilik, atau sampel beku. Ketika sampel atau material dalam bentuk kering digunakan pada umumnya diubah dalam bentuk serbuk halus. Untuk ekstraksi pelarut yang dipilih disesuaikan dengan sifat flavonoidnya. Polaritas merupakan dasar pertimbangan dalam hal pemilihan pelarut (Andersen, 2006). Aglikon flavonoid kepolaran rendah (flavon, dihidroflavonol, flavanon, isoflavon) dapat diekstraksi menggunakan kloroform, diklorometan, dietil eter atau etil asetat sedangkan aglikon flavonoid yang lebih polar seperti hidroksi flavon, flavonol, biflavon, auron, khalkon dapat diekstraksi dengan aseton, metanol, etanol dan air atau kombinasi dari pelarut tersebut. Metanol dan air dalam campuran yang bervariasi merupakan salah satu sistem pelarut yang sesuai untuk senyawa yang kepolarannya tinggi (Bhat, 2005).
2.3.2 Kromatografi
Kromatografi didefinisikan sebagai prosedur pemisahan zat terlarut oleh suatu proses migrasi diferensial dinamis dalam sistem yang terdiri atas dua fase atau lebih. Salah satu fase bergerak secara bersinambungan dalam arah tertentu dan didalamnya, zat-zat terlarut menunjukkan perbedaan mobilitas yang disebabkan oleh perbedaan adsorpsi, partisi, kelarutan, tekanan uap, ukuran molekul, atau kerapatan muatan ion (Harmita, 2014).
2.3.2.1Kromatografi Lapis Tipis
Kromatografi lapis tipis merupakan kromatografi adsorbsi dan adsorben bertindak sebagai fase stasioner. Kromatografi lapis tipis (thin layer chromatography atau TLC) dapat digunakan untuk memisahkan berbagai senyawa seperti ion-ion anorganik, kompleks senyawa-senyawa organik baik yang terdapat di alam dan senyawa-senyawa sintetik.Metode pemisahan ini merupakan metode fisikokimia yang didasarkan atas penyerapan, partisi (pembagian), atau gabungannya ( Harmita, 2009).
Ada empat jenis adsorben yang biasa digunakan yaitu silika gel, alumina, kieselguhr, dan selulosa. Dari keempat adsorben tersebut yang paling banyak dipakai adalah silika gel. Kelebihan penggunaan kromatografi lapis tipis dibandingkan dengan kromatografi kertas ialah karena dapat dihasilkannya pemisahan yang sempurna, kepekaan yang lebih tinggi, dan dapat dilaksanakan dengan lebih cepat ( Adnan, 2010 ).
2.3.2.2 Kromatografi Kolom
Kromatografi kolom merupakan peralatan yang sangat penting dalam pemisahan flavonoida. Adapun fase diam yang pada umumnya digunakan dalam kromatografi kolom yaitu silika gel, sephadex, polyamida dan selulosa dimana fase gerak yang biasa digunakan yaitu campuran antara pelarut organik polar dan pelarut organik nonpolar dengan menggunakan metode elusi gradient (Bhat, 2005).
Mekanisme pemisahan pada kromatografi kolom didasarkan pada adsorbsi komponen-komponen campuran yang memiliki afinitas yang berbeda-beda pada permukaan fase diam. Interaksi antara adsorben dan komponen-komponen campuran harus bersifat reversible. Aliran fase gerak akan membawa komponen-komponen campuran dengan kecepatan yang berbeda-beda sesuai dengan afinitas komponen tersebut terhadap adsorben. Komponen yang memiliki afinitas paling kecil akan bergerak lebih cepat.
Setelah pemasukkan sampel terjadi proses elusi atau pemisahan komponen-komponen sampel. Elusi diteruskan hingga komponen-komponen terpisah atau hingga tiap-tiap komponen keluar dari kolom. Untuk senyawa yang tidak berwarna, eluat dipisahkan dalam beberapa fraksi, yang masing-masing dengan volume kecil dan penetapan tiap tiap fraksi. Dan tahap yang terakhir yaitu deteksi atau penetapan kadar komponen. Dimana senyawa kemudian ditetapkan dan ditimbang setelah fraksi diuapkan dengan uji bercak, KKt atau KLT atau dengan spektrofotometri (Harmita, 2009).
2.3.2.3 Kromatografi Lapis tipis Preparatif
Pada KLT preparatif, sampel dilarutkan dalam sedikit pelarut sebelum ditotolkan pada plat pelarut yang baik yang digunakan yaitu pelarut non polar seperti n-heksana, diklorometana, etil asetat. Jika pelarut digunakan sedikit polar akan terjadi pelebaran pita (Hostettman, 1995).
Sampel yang akan dipisahkan ditotolkan berupa garis pada salah satu sisi plat lapisan dan dikembangkan secara tegak lurus pada garis sampel sehingga campuran akan terpisah menjadi beberapa pita. Penampakan pita dilakukan dengan cara yang tidak merusak senyawa yang tidak berwarna dan penjerap yang mengandunng pita dikerok dari plat kaca kemudian sampel dielusi dengan penjerap dengan pelarut polar (Gritter, 1991).
2.4Teknik Spektroskopi
2.4.1 Spektrofotometer Ultraviolet-Visibel (UV-Vis)
Spektrum UV-Visibel merupakan hasil interaksi antara radiasi elektromagnetik (REM) dan molekul. REM merupakan bentuk energi radiasi yang mempunyai sifat gelombang dan partikel (foton) (Harmita,2009).
Flavonoid dapat diidentifikasi dengan mudah dengan menggunakan metode spektroskopi salah satunya adalah spektrofotometer Ultraviolet (UV). Spektrofotometer Ultraviolet biasanya digunakan untuk mengkarakterisasi dan mengidentifikasi tipe-tipe flavonoid. Spektra UV-Vis dari tiap pigmen tumbuhan akan berbeda dikarenakan kromofor yang berbeda-beda.
cincin A sedangkan pita I merupakan hasil absorpsi dari sistem sinamoil cincin B (Bhat,2005). Berikut rentangan serapan spektrum UV-Visibel golongan flavonoida pada tabel 2.1 (Markham, 1988).
Tabel 2.1 Rentangan Serapan Spektrum UV-Visibelgolongan Flavonoida No Pita II (nm) Pita I (nm) Jenis Flavonoida
1 250-280 310-350 Flavon
2 250-280 330-360 Flavonol (3-OH tersubstitusi)
3 250-280 350-385 Flavonol (3-OH bebas)
4 245-274 310-330 bahu Isoflavon
5 275-295 300-330 bahu Flavanon dan dihidroflavonol
6 230-270 340-390 Khalkon
7 230-270 380-430 Auron
8 270-28 465-560 Antosianidin dan antosianin
2.4.2 Spektrofotometer Infra Merah (FT-IR)
ikatan dan bending (vibrasi lentur/tekuk) yaitu vibrasi yang disebabkan oleh sudut ikatan sehingga terjadi pembesaran atau pengecilan sudut ikatan. Gerakan vibrasi yang diamati dalam spektrum inframerah jika menghasilkan perubahan momen dipol sedangkan jika ( µ=0) akan teramati dalam spektrum raman.
Frekuensi molekular dapat dipengaruhi oleh beberapa faktor yaitu penggandengan vibrasi, ikatan hidrogen, efek induksi, efek resonansi (mesomeri), sudut ikatan dan efek medan.Dalam spektrum inframerah juga perlu diperhatikan letak (frekuensi), bentuk pita (melebar atau tajam), dan intensitas pita (kuat, sedang, lemah) karena merupakan petunjuk sangat berharga dalam mengidentifikasikan gugus fungsi yang terdapat dalam spektrum (Harmita, 2009).
2.4.3 Spektroskopi Resonansi Magnetik Inti Proton (1H-NMR)
Geseran kimia didefinisikan sebagai rasio antara kekuatan perisai inti
(nuclear shielding) dan medan terapan yang digunakan (applied field).Geseran
kimia merupakan fungsi dari inti dan lingkungannya, serta berkaitan dengan jumlah molekular. Geseran kimia biasanya diukur dengan membandingkan terhadap senyawa standar yang sesuai. Senyawa standar pembanding ditambahkan kedalam sampel yang akan diperiksa misalnya TMS (Harmita, 2009).
TMS (tetramethylsilan) merupakan senyawa standard yang biasa digunakan untuk sampel organik. Perbandingan antara letak resonansi suatu proton atau karbon tertentu dengan letak resonansi proton atau karbon standard dinamakan pergeseran kimia (chemical shift) dari proton atau karbon dan diberi simbol delta. Senyawa ini juga dapat digunakan untuk pembanding 13C-NMR. Tetra Metil Silan sangat cocok sebagai senyawa standard karena
a. TMS mempunyai dua belas proton sehingga memberikan satu puncak tunggal yang tajam ( singlet )
b. TMS merupakan cairan yang volatile, dapat ditambahkan dalam jumlah sedikit pada larutan sampel dalam pelarutnya (pelarut berdeuterium) sampel dapat diperoleh kembali dengan menguapkan pelarutnya
c. Proton dan karbon pada hampir semua senyawa organik mengalami resonansi pada medan yang lebih rendah daripada proton atau karbon TMS karena Si bersifat lebih elektropositif terhadap karbon
d. Larut dalam sebagian besar pelarut organik e. TMS bersifat inert
f. Tidak larut dalam air atau D2O (Supratman, 2010)
Tabel 2.2 Karakteristik Pergeseran kimia 1H-NMR dari flavonoid
Flavanon, dihidroflavonol 5.75-5.95 (d) 5.9-6.1 (d)
7-Glikosida 5.9-6.1 6.1-6.4 (d)
Subtituen 4’-oksigenasi H-2’; H-6’(δ) ppm H-3’;H-5’ (δ) ppm
Flavonol 7.9-8.1 (d) 6.5-7.1 (d)
Flavonon 7.1-7.3 (d) 6.5-7.1 (d)
Dihidroflavonol 7.2-7.4 (d) 6.5-7.1 (d)
Isoflavon 7.2-7.4 (d) 6.5-7.1 (d) Flavonol 3’,4’-O-glikosil 7.2-7.5 (d) 7.3-7.7 (d)
Subtituen H-2 (δ) ppm H-3 (δ) ppm
Flavanon 5.0-5.5 (q) 2.8 (q)
Dihidroflavonol 4.8-5.0 4.1-4.3 (d)
Dihidroflavonol 3-glikosil 5.0-5.6 (d) 4.3-4.6 (d)
Flavon 6.3 (s)
Isoflavon 7.6-7.8 ; 7.8-8.1 (CDCl3)
8.5-8.7 (DMSO-D6)
BAB 1
PENDAHULUAN
1.1Latar Belakang
Flavonoid adalah senyawa-senyawa polifenol yang mempunyai 15 atom karbon, terdiri dari dua cincin benzene yang dihubungkan menjadi satu oleh rantai linier yang terdiri dari tiga atom karbon. Kerangka ini dapat ditulis sebagai sistem C6 -C3-C6 ( Manitto, 1981) .
Flavonoid merupakan senyawa fenolik yang paling banyak yang ditemukan dalam kingdom plantae (Harbone, 1993). Flavonoid diturunkan dari bahasa latin yaitu flavus yang berarti kuning dan flavonoid diketahui sebagai pigmen tumbuhan dan memberikan warna pada kulit batang, daun-daun, bunga-bunga, dan biji dari tumbuhan (Bhat, 2005).
Flavonoid paling tinggi konsentrasinya terdapat didalam epidermis daun dan di dalam kulit buah-buahan dan memiliki kepentingan serta memiliki banyak peran sebagai metabolit sekunder. Senyawa flavonoid juga berperan memberikan banyak warna dialam bahkan flavonoid yang tidak berwarna mengabsorb cahaya pada spektrum UV (karena banyak gugus kromofor) dan warna ini menarik perhatian serangga dan berperan sebagai agen polinasi.
Flavonoid secara luas terdistribusi di alam dan pada umumnya pada tumbuhan tingkat tinggi termasuk famili Leguminoseae, Rutaceae, Primulaceae, Polygonaceae, Salicaceae, Pinaceae, Asteraceae, Lamiaceae, Bignoniaceae,
Moraceae, Betulaceae, Rubiaceae, Myrtaceae dan Rosaceae (Bhat, 2005) . Famili
Rosaceae terdiri sekitar 100 genus dan 2000 spesies dimana genus Rosa terdiri
dari 250 spesies dan bunga Mawar dikenal sebagai kembang ros (sunda), rose flower (inggris), yue ji hua (cina) (Hariana, 2005) merupakan family rosaceae (Nuraini, 2014) tidak hanya menyimpan keindahan warna warni tetapi juga menyimpan khasiat obat bagi kecantikan dan kesehatan tubuh (Khaerani, 2014).
Kelopak bunga mawar mengandung flavonoid sebagai antioksidan , zinc, tannin, astringent, Vitamin A, vitamin B, vitamin C, vitamin B dan vitamin D (Khaerani, 2014). Bunga Mawar dalam buku Tumbuhan Obat & Khasiatnya
bahan kimia yang terkandung dalamnya yaitu sitral, sitronerol, geraniol, linalool, nerol, eugenol, feniletil alkohol, farnesol.
Bunga dan akar dalam kondisi kering serta daun dalam kondisi segar dapat dimanfaatkan untuk mengobati beberapa penyakit seperti batuk darah dan campak (Hariana, 2005). Tanaman yang memerlukan banyak air ini (Hasim, 1995) juga dapat digunakan untuk anti kejang, mengatasi rambut rontok, rontok dan mengobati gigitan serangga. Sedangkan bunga Mawar Putih (Rosa alba) dapat digunakan sebagai antiradang, anti kejang, penyegar dan tonikum (Nuraini, 2014).
Lee, H.J., et al (2011) dalam jurnal Anthocyanin Compositions and
Biological Activities from the Red Petals of Korean Edible Rose (Rosa hybrida cv.
Noblered ) melaporkan dalam 50 µg/ mL ekstrak metanol asam mahkota mawar merah menunjukkan adanya aktivitas antosianin sebagai antioksidan, antikanker, dan antialergi.
Dobreva dalam jurnal The flavonoid content in the white oil–bearing rose
(Rosa alba L.) melaporkan bahwa dalam mahkota Rosa alba L terdapat flavonoid
sebanyak 13 mg/g bunga mawar ( Dobreva, 2011).
mahkota bunga tumbuhan Mawar Putih ( Rosa hybrida L.) melalui hasil identifikasi spektrofotometer UV-Visibel, Infra Merah (FT-IR), Spektrofotometer Resonansi Magnetik Inti Proton ( 1H-NMR).
Dari uji pendahuluan yang peneliti lakukan yaitu dengan uji Polifenol dan flavonoida dengan pereaksi FeCl3 % menunjukkan bahwa ekstrak metanol dan etil asetat daun tumbuhan ini positif mengandung senyawa flavonoida. Kemudian beberapa literatur diatas maka peneliti tertarik untuk melakukan penelitian terhadap daun tumbuhan Mawar Putih, untuk membandingkan golongan flavonoid yang terkandung didalam daun Mawar Putih dan mahkotanya serta membandingkan golongan flavonoid dari daun tumbuhan Mawar Putih terhadap Mawar Merah.
1.2Permasalahan
Permasalahan dalam penelitian ini adalah senyawa flavonoida golongan apakah yang terkandung dalam daun tumbuhan mawar putih.
1.3Tujuan Penelitian
Tujuan dari penelitian ini adalah untuk mengisolasi senyawa flavonoida dari daun tumbuhan Mawar Putih.
1.4Manfaat Penelitian
Dari hasil penelitian diharapkan dapatmemberikan sumber informasi ilmiah pada bidang Kimia Bahan Alam Hayati khususnya tentang senyawa flavonoida yang terkandung dalam daun tumbuhan Mawar Putih.
1.5Lokasi Penelitian
1.5.1 Tempat Pengambilan Sampel
Sampel yang digunakan diperoleh dari daerah Berastagi, kabupaten Tanah Karo, Sumatera Utara.
1.5.2 Tempat Melakukan Penelitian
Identifikasi senyawa hasil isolasi yang meliputi analisa spektrofotometer UV-Vis, spektrofotometer FT-IR, spektroskopi 1H-NMR dilakukan di LIPI, komplek PUSPITEK, Serpong, Tangerang..
1.6Metodologi Penelitian
ISOLASI SENYAWA FLAVONOIDA DARI DAUN TUMBUHAN MAWAR PUTIH (Rosa alba L.)
ABSTRAK
Isolasi senyawa flavonoida dari 1080 gram daun tumbuhan Mawar Putih (Rosa
alba L.) telah dilakukan melalui tahap awal ekstraksi maserasi dengan pelarut
metanol. Fraksi metanol diuapkan dan dilarutkan dengan pelarut etilasetat dan kemudian dipekatkan dan diuapkan. Fraksi etil asetat dilarutkan dengan metanol dan dipartisi dengan n-heksana. Ekstrak pekat metanol dihidrolisis dengan HCl 2 N kemudian dipartisi dengan kloroform. Ekstrak pekat kloroform dipisahkan dengan kromatografi kolom dengan fasa diam silika gel dan eluen n-heksana : etilasetat dengan perbandingan (90:10) v/v, (80:20) v/v,(70:30) v/v dan (60:40) v/v. Senyawa yang diperoleh dimurnikan dengan kromatografi lapis tipis preparatif, menghasilkan pasta berwarna coklat kemerahan sebanyak 8,8 mg dengan Rf 0,33. Selanjutnya struktur dianalisa dengan menggunakan spektrofotometer UV-Visibel, Inframerah (FT-IR) dan Spektroskopi Resonansi Magnetik Inti Proton (1H-NMR). Dari hasil analisa spektroskopi bahwa senyawa yang diperoleh adalah senyawa flavonoid golongan flavon.
ISOLATION OF FLAVONOID COMPOUNDS FROM WHITE ROSE LEAVES (Rosa alba L.)
ABSTRACT
The isolation of flavonoid compounds from White Rose Leaves (Rosa alba L.) has been done first by maceration technique with methanol solvent. Methanol fraction was evaporated, was dissolved with ethyl acetate solvent, was concentrated and was evaporated. Ethyl acetate fraction was dissolved with methanol and was partitioned with n-hexane solvent. The concentrated extract of methanol was acided by HCl 2N, then was partition extracted with chloroform. The concentrated extract of chloroform was separated with column chromatography with stationary phase silica gel and eluent n-hexane:ethyl acetate (90:10) v/v, (80:20) v/v,(70:30) v/vand (60:40) v/v. The compounds was purified with TLC preparative yielding paste with weight 8,8 mg with retardation factor =0,33. The compound further was identified analysis by using spectroscopy ultraviolet Visible (UV-Vis), Fourier Transform Infra Red Spectroscopy (FT-IR) and Proton Nuclear Magnetic Resonance Spectroscopy (1H-NMR) was estimated as flavonoid is flavon.
ISOLASI SENYAWA FLAVONOIDA DARI DAUN
TUMBUHAN MAWAR PUTIH (
Rosa alba
L.)
SKRIPSI
HAPOSANRIA Br TAMPUBOLON
120802065
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
ISOLASI SENYAWA FLAVONOIDA DARI DAUN TUMBUHAN
MAWAR PUTIH (Rosa alba L.)
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
HAPOSANRIA Br TAMPUBOLON 120802065
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : Isolasi Senyawa Flavonoida Dari Daun Tumbuhan Mawar Putih (Rosa alba L.)
Kategori : Skripsi
Nama Mahasiswa : Haposanria Br Tampubolon Nomor Induk Mahasiswa : 120802065
Program Studi : Sarjana (S1) Kimia Departemen : Kimia
Fakultas : Matematika Dan Ilmu Pengetahuan Alam (FMIPA) Universitas Sumatera Utara
Disetujui di
Medan, Juni 2016
Komisi Pembimbing:
Pembimbing 2 Pembimbing 1
Dr.Sovia Lenny, M.Si Lamek Marpaung, M.Phill, Ph.D NIP. 1975 1018 2000 032001 NIP. 1952 0828 1982 031001
Diketahui/Disetujui oleh
Departemen Kimia FMIPA USU Ketua
PERNYATAAN
ISOLASI SENYAWA FLAVONOIDA DARI DAUN TUMBUHAN MAWAR PUTIH (Rosa alba L.)
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya
Medan, Juni 2016
PENGHARGAAN
Segala Puji dan syukur yang tak henti-hentinya penulis panjatkan kepada Tuhan Yesus Kristus karena atas berkat, kasih, penyertaan, dan kekuatan yang hanya dari padaNya selama perjalanan 4 tahun ini kepada penulis dan hingga saat skripsi ini dapat diselesaikan dalam waktu yang ditetapkanNya.
Maka penulis mengucapkan terima kasih kepada Bapak Dr.Sutarman, M.Sc selaku dekan Fakultas Matematika dan Ilmu Pengetahuan Alam. Ucapan terima kasih juga penulis tujukan kepada Bapak Lamek Marpaung, M.Phill, Ph.D dan ibu Dr.Sovia Lenny,M.Si selaku dosen pembimbing yang telah banyak memberikan bimbingan, arahan, motivasi, ilmu dan waktu kepada penulis selama penulis melakukan penelitian hingga penulisan skripsi ini selesai. Terima kasih kepada Ibu Dr. Rumondang Bulan Nst, MS selaku ketua Departemen Kimia, Bapak Drs. Albert Pasaribu, M.Sc. selaku sekretaris Departemen Kimia. Terimakasih dengan tulus kepada Kepala Laboratorium Bapak Lamek Marpaung, M.Phil, Ph.D dan selaku dosen pembimbing satu yang juga sangat-sangat banyak memberikan bimbingan, ilmu, arahan, nasehat, motivasi, dukungan dan dengan sangat sabar mengajari saya saat mengerjakan penelitian bahkan dalam penyusunan skripsi ini. Terima kasih penulis ucapkan kepada Christabel Manuela (jeje dan k’melda) atas doa, kasih & dukungan yang tak henti-hentinya kepada saya. Terima kasih kepada sahabat sekaligus saudara yang ku kasihi yang senantiasa mendoakan, menyemangati, mendukung, dan selalu ada dalam dikondisi apapun yaitu edakku Crystina Simanjuntak, S.Si. Terima kasih juga kepada assisten KBA Hayati dan teman seperjuangan 2012 yang sangat banyak membantu dalam penelitian. Ucapan terima kasih yang paling terdalam penulis sampaikan kepada kedua orang tua yang sangat saya sayangi dan cintai V.P.Tampubolon dan C.D.Sitorus yang selalu memberikan kasih sayang, doa, motivasi, dukungan yang luar biasa dan materi kepada penulis. Serta kepada adik penulis tersayang Gerry Tampubolon, Dominggo Tampubolon, Marhara Tampubolon yang selalu menghibur dan membuat penulis kembali semangat. Juga kepada seluruh pihak yang turut mendukung tetapi namanya tidak dapat disebutkan satu persatu terima kasih banyak dan Tuhan yang membalas semuanya.
Akhir kata, penulis sangat berharap semoga skripsi ini dapat memberikan manfaat dan pengetahuan bagi semua pihak yang berkepentingan. Tuhan Yesus Memberkati
ISOLASI SENYAWA FLAVONOIDA DARI DAUN TUMBUHAN MAWAR PUTIH (Rosa alba L.)
ABSTRAK
Isolasi senyawa flavonoida dari 1080 gram daun tumbuhan Mawar Putih (Rosa
alba L.) telah dilakukan melalui tahap awal ekstraksi maserasi dengan pelarut
metanol. Fraksi metanol diuapkan dan dilarutkan dengan pelarut etilasetat dan kemudian dipekatkan dan diuapkan. Fraksi etil asetat dilarutkan dengan metanol dan dipartisi dengan n-heksana. Ekstrak pekat metanol dihidrolisis dengan HCl 2 N kemudian dipartisi dengan kloroform. Ekstrak pekat kloroform dipisahkan dengan kromatografi kolom dengan fasa diam silika gel dan eluen n-heksana : etilasetat dengan perbandingan (90:10) v/v, (80:20) v/v,(70:30) v/v dan (60:40) v/v. Senyawa yang diperoleh dimurnikan dengan kromatografi lapis tipis preparatif, menghasilkan pasta berwarna coklat kemerahan sebanyak 8,8 mg dengan Rf 0,33. Selanjutnya struktur dianalisa dengan menggunakan spektrofotometer UV-Visibel, Inframerah (FT-IR) dan Spektroskopi Resonansi Magnetik Inti Proton (1H-NMR). Dari hasil analisa spektroskopi bahwa senyawa yang diperoleh adalah senyawa flavonoid golongan flavon.
ISOLATION OF FLAVONOID COMPOUNDS FROM WHITE ROSE LEAVES (Rosa alba L.)
ABSTRACT
The isolation of flavonoid compounds from White Rose Leaves (Rosa alba L.) has been done first by maceration technique with methanol solvent. Methanol fraction was evaporated, was dissolved with ethyl acetate solvent, was concentrated and was evaporated. Ethyl acetate fraction was dissolved with methanol and was partitioned with n-hexane solvent. The concentrated extract of methanol was acided by HCl 2N, then was partition extracted with chloroform. The concentrated extract of chloroform was separated with column chromatography with stationary phase silica gel and eluent n-hexane:ethyl acetate (90:10) v/v, (80:20) v/v,(70:30) v/vand (60:40) v/v. The compounds was purified with TLC preparative yielding paste with weight 8,8 mg with retardation factor =0,33. The compound further was identified analysis by using spectroscopy ultraviolet Visible (UV-Vis), Fourier Transform Infra Red Spectroscopy (FT-IR) and Proton Nuclear Magnetic Resonance Spectroscopy (1H-NMR) was estimated as flavonoid is flavon.
DAFTAR ISI
2.4.1 Spektrofotometer Ultraviolet Visibel (UV-Vis) 19
2.4.2 Spektroskopi Infra-Merah (FT-IR) 20
Bab 3 METODE PENELITIAN 25
3.3.3.5 Pemisahan Komponen-Komponen dengan Kromatografi Kolom 29
3.3.4 Uji Kemurnian Hasil Isolasi dengan KLT 30
3.3.5 Pemurnian Hasil Isolasi 30
3.3.5.1 Pemurnian dan Pemurnian Hasil Isolasi dengan KLT preparatif 30
3.3.5.2 Pemurnian 31
3.3.6 Identifikasi Senyawa Hasil Isolasi 32
3.3.6.1 Identifikasi dengan Spektrofotometer Ultraviolet Visibel (UV-Vis) 32
3.3.6.2 Identifikasi dengan Spektrofotometer Inframerah (FT-IR) 32
3.3.6.3 Identifikasi dengan Spektrometer Resonansi Magnetik Inti Proton (1H-NMR) 32
3.4 Bagan Uji Flavonoida 33
3.4.1 Bagan Uji Flavonoida dengan metanol 33
3.4.2 Bagan Uji Flavonoida dengan etil asetat 34
3.5 Bagan Penelitian 35
Bab 4 HASIL DAN PEMBAHASAN 4.1 Hasil Penelitian 37
4.2 Pembahasan 41
Bab 5 KESIMPULAN DAN SARAN 5.1 Kesimpulan 47
5.2 Saran 48
DAFTAR TABEL
Nomor Judul Halaman Tabel
2.1 Rentangan Serapan Spektrum UV-Visibel golongan
Flavonoid 20
2.2 Karakteristik pergeseran kimia 1H-NMR dari Flavonoida 24 4.2 Hasil Analisis Spektrum FT-IR Senyawa Hasil Isolasi 39
4.3 Pergeseran kimia dan jenis peak 1H-NMR senyawa
hasil isolasi 41
DAFTAR GAMBAR
Nomor Judul Halaman
Gambar
2.1 Flavonoid 8
2.2 Apigenin 7-O-β-D-glukopiranosida 8
2.3 Apigenin 8-C-β-D-glukopiranosida 9
2.4 Amentoflavon 10
2.5 Flavonol 10
2.6 Flavon 11
2.7 Isoflavon 11
2.8 Flavanon 11
2.9 Flavononol 12
2.10 Malvidin-3-O-glikosida 12
2.11 Antosianidin 13
2.12 Auron 13
2.13 Kalkon 14
4.1 Spektrum UV-Visibel Senyawa Hasil Isolasi 37
4.2 Spektrum Inframerah (FT-IR) Senyawa Hasil Isolasi 38
4.3 Spektrum 1H-NMR Senyawa Hasil Isolasi pada δH = 0-13,5 ppm 40
4.4 Spektrum 1H-NMR Senyawa Hasil Isolasi pada δH = 6,2 -7,9 ppm 40
DAFTAR LAMPIRAN
Nomor Judul Halaman Lampiran
1. Gambar Tumbuhan Mawar Putih 52 2. Hasil Determinasi daun Tumbuhan
Mawar Putih 53
3. Spektrum Ultraviolet-Visibel Beberapa