DAYA TAHAN SPERMATOZOA TERHADAP PROSES
PEMBEKUAN PADA BERBAGAI JENIS
SAPI PEJANTAN UNGGUL
EROS SUKMAWATI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Daya Tahan Spermatozoa terhadap Proses Pembekuan pada Berbagai Jenis Sapi Pejantan Unggul adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juni 2014
Eros Sukmawati
RINGKASAN
EROS SUKMAWATI. Daya Tahan Spermatozoa terhadap Proses Pembekuan pada Berbagai Jenis Sapi Pejantan Unggul. Dibimbing oleh IIS ARIFIANTINI dan BAMBANG PURWANTARA
Rendahnya kualitas spermatozoa setelah pembekuan dan proses pencairan dapat terjadi karena perubahan suhu dan osmolaritas yang ekstrim. Salah satu kerusakan pada spermatozoa selama proses pembekuan dan proses pencairan kembali adalah peroksidasi lipid. Tujuan penelitian ini adalah untuk menguji daya tahan spermatozoa terhadap pembekuan pada berbagai jenis, umur dan individu pejantan serta mengevaluasi derajat kerusakan membran spermatozoa melalui pengukuran kadar malondialdehyde (MDA). Penelitian menggunakan semen dari tiga puluh pejantan sapi dengan tiga jenis yang berbeda (Simental, Limosin dan Friesian Holstein) dibagi dalam dua kelompok umur (4-6 dan 7-8 tahun). Semen dikoleksi menggunakan vagina buatan dan dievaluasi secara makroskopis dan mikroskopis. Semen diencerkan dengan susu skim kuning telur, dikemas dalam mini straw (0.25 ml), equilibrasi pada 5oC dan dibekukan di atas uap nitrogen cair. Data dianalisa dengan general linier model (GLM), uji Duncan’s serta uji korelasi Pearson disajikan dalam rata-rata ± SD.
Hasil analisa menunjukkan bahwa kualitas semen segar tidak dipengaruhi jenis pejantan, umur maupun individu. Kualitas semen beku dipengaruhi beberapa faktor seperti jenis pejantan mempengaruhi motilitas (P<0.0001), umur mempengaruhi viabilitas dan MPU (P<0.05) sedangkan kadar MDA dipengaruhi oleh jenis pejantan (P<0.0001) dan umur (P<0.005).
Sapi FH memiliki daya tahan terhadap pembekuan yang rendah dengan nilai
recovery rate (RR) 57.53±1.74% dan kadar MDA tinggi 0.81±0.31 nmol/108 spermatozoa, sedangkan sapi Limosin memiliki RR yang paling tinggi yaitu 59.70±3.23% dan kadar MDA yang rendah 0.52±0.25 nmol/108 spermatozoa. Pembekuan menurunkan motilitas, viabilitas dan MPU spermatozoa pada semua jenis sapi, dengan tingkat penurunan motilitas, viabilitas dan MPU masing-masing 28.32±1.45% dan 29.73±1.54%; 21.58±4.09% dan 22.55±5.60% serta 21.25 ±6.86% dan 23.51±6.05%.
Pejantan FH nomor 307104 memiliki nilai RR paling rendah (56.14± 1.50%), penurunan motilitas (31.25±1.22%), penurunan viabilitas (25.63± 7.91%), penurunan MPU (30.75±1.50%) dan kadar MDA (1.13±0.25 nmol/108 spermatozoa) paling tinggi dibanding pejantan lainnya. Pejantan Simental nomor 60656 memiliki nilai RR paling tinggi (61.70±1.46%), penurunan motilitas (26.81 ±1.43%), penurunan viabilitas (15.63±7.64%), penurunan MPU (11.00±7.42%) dan kadar MDA (0.26±0.1nmol/108 spermatozoa) paling rendah dari pejantan lainnya.
<0.0001) dan MPU semen beku (r=-0.29080, p-value 0.0013). Penelitian ini menyimpulkan bahwa jenis, umur dan individu pejantan mempengaruhi kualitas dan ketahanan spermatozoa terhadap pembekuan. Kerusakan membran pada pejantan umur 7-8 tahun lebih rendah dari pada usia 4-6 tahun.
SUMMARY
EROS SUKMAWATI. Freezing Capacity of Sperm on Various Type of Superior Bulls. Supervised by IIS ARIFIANTINI and BAMBANG PURWANTARA
Low quality of sperm after freezing and thawing process can be done due to changes of extreme temperature and osmolarity. The effect of freezing and thawing process, among other thing is lipid peroxidation. The objective of the study was to evaluate the sperm freezing capability and sperm membrane damage by measuring the levels of malondialdehyde (MDA). Semen samples were collected from 30 bulls of three breeds : Simmental, Limousine and Holstein Friesian, which were devided into two groups: five 4-6 years old bulls and five 7-8 years old bulls, respectively. Semen were collected using artificial vagina and evaluate macro-and microscopically. The semen than diluted with skim milk egg yolk, packing into mini straw (0.25 ml), equilibrate at 5oC and frozen above liquid nitrogen vapoar. Data were analyzed using general linier model (GLM), Duncan 's test and examined for correlation by Pearson and presented as average ± SD.
Results of the experiment showed that breed, age and individual were not influenced by semen quality. Factors influencing frozen semen quality were breed to influence motility (P<0.0001), age to influence viability and membrane integrity (P<0.05) and levels of MDA influenced by breeds (P<0.0001) and age (P<0.005).
The FH bulls had low recovery rates (RR) 57.53±1.74% if indicated high MDA levels (0.81±0.31 nmol/108 sperm). Limousine bulls had the highest RR (59.70±3.23%) and low MDA level (0.52±0.25 nmol/108 sperm). Freezing processes to decrease the sperm motility, viability and MI of all bulls. Sperm motility, viability and MI were decreased by 28.32±1,45% and 29.73±1.54%, 21.58±4.09% and 22.55±5.60% and 21.25±6.86% and 23.51±6.05% respectively. The FH bull number 307104 have the lowest value of RR (56.14±1.50%), decreased of motility (31.25±1.22%), decreased of viabilitas (25.63±7.91%), decreased of MPU (30.75±1.50%) and rate of MDA (1.13±0.25 nmol/108 sperma) highest than other bulls. Simmental bulls number 60656 have a highest value of RR (61.70±1.46%), decreased of motility (26.81±1.43%), decreased of viability (15.63±7.64%), decreased of membrane integrity/MI (11.00±7.42%) and MDA concentration (0.26 ± 0.1 nmol/108 sperma), the lowest than other breeds.
Bulls age of 7-8 years has indicated lower parameters than the bulls at age of 4-6 years on motility (28.99±2.16% vs 29.26±2.15%), viability (21.24±4.70% vs 22.36±4.12%), MI (20.75±7.93% vs 23.62±6.88%) and rate of MDA (0.53±0.13 nmol/108 sperms vs 0.69±0.22 nmol/108 sperms).There were negative correlation between rate of MDA and motility (r=-0.31948, P=0.0004), viability (r=-0.34998, p-value <0.0001) and MI (r=-0.29080, p-value 0.0013). In conclution that individual, breed and age influenced frozen semen quality and freezing capacity of bull semen and membrane damage at 7-8 years old bull less occured that 4-6 years old.
Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Biologi Reproduksi
DAYA TAHAN SPERMATOZOA TERHADAP PROSES
PEMBEKUAN PADA BERBAGAI JENIS
SAPI PEJANTAN UNGGUL
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
Judul Tesis : Daya Tahan Spermatozoa terhadap Proses Pembekuan pada Berbagai Jenis Sapi Pejantan Unggul
Nama : Eros Sukmawati
NIM : B 352120091
Disetujui oleh Komisi Pembimbing
Prof Dr Dra R Iis Arifiantini, MSi Ketua
Prof Dr Drh Bambang Purwantara, MSc Anggota
Diketahui oleh
Ketua Program Studi Biologi Reproduksi
Prof Dr Drh Mohamad Agus Setiadi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga tesis ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Juli 2013 ini ialah Daya Tahan Spermatozoa terhadap Proses Pembekuan pada Berbagai Jenis Sapi Pejantan Unggul
Terima kasih penulis ucapkan kepada Ibu Prof Dr Dra R Iis Arifiantini, MSi dan Bapak Prof Dr Drh Bambang Purwantara, MSc selaku pembimbing, Bapak Prof Dr Drh Mohamad Agus Setiadi serta Ibu Prof Dr Drh Tuty L. Yusuf, MS yang telah banyak memberi saran. Di samping itu, penghargaan penulis sampaikan kepada Bapak Drh Maydaswar, MSi, Bapak Drh Oloan Parlindungan Lubis, MP beserta kepala seksi dan staf produksi semen beku Balai Inseminasi Buatan Lembang serta Dr Drh Joko Pamungkas, MSc beserta staf laboratorium Biokimia Pusat Studi Satwa Primata IPB.
Ungkapan terima kasih juga disampaikan kepada bapak (alm), ibu, suami, anak-anak serta seluruh keluarga dan sahabat atas segala doa dan kasih sayangnya.
Semoga tesis ini bermanfaat bagi yang membacanya.
Bogor, Juni 2014
DAFTAR ISI
Breeding Soundness Evaluation (BSE) 3
Kriopreservasi Semen 4
Fisiologi dan Biokimia Semen 5
Radikal Bebas 10
Penyiapan Bahan Pengencer 12
Koleksi dan Evaluasi Semen 13
Pengenceran, pengemasan dan pembekuan
semen 13
Pengujian Keutuhan Membran Plasma (MPU) 14
Kadar Malondialdehyde (MDA) 29 Korelasi antara kadar MDA dengan parameter
spermatozoa 33
5 SIMPULAN DAN SARAN 35
Simpulan 35
Saran 36
DAFTAR PUSTAKA 36
DAFTAR TABEL
1 Karakteristik semen segar dari berbagai jenis sapi 15
2 Karakteristik semen beku pasca thawing 16
3 Penurunan motilitas spermatozoa pada berbagai jenis sapi 17 4 Pengaruh umur terhadap penurunan motilitas spermatozoa 20 5 Penurunan viabilitas spermatozoa pada berbagai jenis sapi 21 6 Pengaruh umur terhadap penurunan viabilitas spermatozoa 24 7 Penurunan MPU spermatozoa pada berbagai Jenis sapi 26 8 Pengaruh umur terhadap penurunan keutuhan membran spermatozoa 28 9 Korelasi kadar MDA dengan kualitas spermatozoa sesudah pembekuan 34
DAFTAR GAMBAR
1 Spermatozoa dan bagian-bagiannya 6
2 Struktur membran plasma spermatozoa 7
3 Peroksidasi lipid (a) dan hydroperoksidasi lipid (b) 10
4 Mekanisme proses peroksidasi 11
5 Struktur kimia malondialdehyde 12
6 Efek pembekuan pada jenis sapi Simental, Limosin dan FH 16 7 Penurunan motilitas dan recovery rate pejantan Simental 18 8 Penurunan motilitas dan recovery rate pejantan Limosin 19 9 Penurunan motilitas dan recovery rate pejantan FH 19 10 Viabilitas spermatozoa dengan pewarnaan eosin 2% 21
11 Penurunan viabilitas pejantan Simental 22
12 Penurunan viabilitas pejantan Limosin 23
13 Penurunan viabilitas pejantan FH 23
14 Reaksi spermatozoa terhadap larutan HOS 25
15 Penurunan MPU spermatozoa pejantan Simental 26
16 Penurunan MPU spermatozoa pejantan Limosin 27
17 Penurunan MPU spermatozoa pejantan FH 27
18 Reaksi malondialdehyde dengan asam tiobarbiturat (TBA) 30 19 Kadar malondialdehyde (MDA) spermatozoa pasca thawing
pada berbagai jenis sapi 30
20 Kadar MDA spermatozoa pasca thawing jenis Simental 31
21 Kadar MDA spermatozoa pasca thawing jenis Limosin 31 22 Kadar MDA spermatozoa pasca thawing jenis FH 32
23 Pengaruh umur terhadap kadar Malondialdehyde spermatozoa 33 24 Hubungan MDA dengan MPU spermatozoa pasca thawing
1
PENDAHULUAN
Latar Belakang
Kebutuhan daging dan susu sebagai pemenuh kebutuhan gizi semakin meningkat seiring dengan meningkatnya populasi, pendapatan, dan kesadaran masyarakat akan pentingnya pemenuhan gizi khususnya protein hewani. Sapi merupakan salah satu sumber protein hewani yang dagingnya banyak diminati oleh berbagai kalangan di Indonesia. Pengembangan sapi potong maupun perah telah banyak dilakukan dan pemerintah telah melakukan berbagai upaya demi terpenuhinya permintaan pasar seperti mengimpor daging dan sapi bakalan.
Seluruh sapi berpotensi dijadikan sebagai ternak bibit yang didasarkan pada berbagai faktor. Faktor yang menentukan efisiensi maksimum produksi susu sapi perah adalah berapa banyak liter susu yang diproduksi per hari sepanjang hidupnya, sedangkan untuk sapi tipe pedaging faktor yang menentukan adalah kecepatan tumbuh setiap hari. Jenis sapi Simental, Limosin dan FH banyak disukai peternak karena dapat beradaptasi dengan baik selain itu jenis sapi Simental dan Limosin juga memiliki pertumbuhan otot yang sangat baik, menghasilkan karkas yang tinggi dan sedikit lemak. Sapi FH merupakan sapi tipe perah dan termasuk intensif dalam produksi susu saat ini.
Peningkatan produktivitas sapi perlu didukung oleh teknologi reproduksi dan yang umum diterapkan yaitu inseminasi buatan (IB). Dengan menerapkan IB maka potensi sapi pejantan unggul dapat dioptimalkan. Inseminasi buatan di Indonesia telah menunjukkan perkembangan yang luar biasa, pelaksanaannya sebagian besar menggunakan semen beku yang diproduksi oleh dua balai inseminasi buatan nasional yaitu Balai Besar Inseminasi Buatan (BBIB) Singosari dan Balai Inseminasi Buatan (BIB) Lembang serta lima belas Balai Inseminasi Buatan Daerah (BIBD) yang tersebar di berbagai provinsi.
Salah satu cara pemilihan pejantan yang baik untuk bibit yaitu dengan mengevaluasi kualitas semen. Kualitas dan kuantitas semen yang diproduksi oleh tiap pejantan berbeda-beda. Kualitas semen beku saat ini hanya diuji motilitas dan gerakan individu saja padahal banyak indikator lain yang bisa menggambarkan kerusakan spermatozoa sesudah dibekukan. Sesuai dengan persyaratan mutu yang ditetapkan oleh Badan Standardisasi Nasional (BSN) dan tertuang dalam standar mutu produksi semen beku sapi SNI 4869.1: 2008 meliputi daya tahan terhadap pembekuan yang rutin dilakukan yakni motilitas pasca thawing lebih dari 40% dan gerakan individu 2-3.
2
Salah satu kerusakan pada spermatozoa selama proses pembekuan sampai pencairan kembali adalah peroksidasi lipid (Waluyo 2006). Stres oksidasi pada spermatozoa merupakan penyebab utama disfungsi spermatozoa dengan menghambat proses oksidasi fosforilasi sehingga terjadi peningkatan reactive oxygen species (ROS) spermatozoa. Kadar ROS yang tinggi dalam sel dapat mengoksidasi lipid, protein dan DNA (Sharma 1999).
Spermatozoa dalam mempertahankan hidupnya membutuhkan energi. Energi disintesis dalam mitokondria melalui proses enzimatik fosforilasi oksidatif
(oxidative phosphorylation/OXPHOS). Adanya gangguan transfer elektron pada proses OXPHOS akan menghasilkan ROS yang bersifat oksidator (Sudjarwo 2003). Dalam konsentrasi normal ROS diperlukan sebagai mediator penting terhadap fungsi spermatozoa dan terlibat dalam induksi hiperaktivasi, kapasitasi dan reaksi akrosom serta fusi spermatozoa dengan sel telur namun bila produksi ROS berlebih dapat menyebabkan kerusakan asam lemak khususnya asam lemak tak jenuh yang merupakan komponen penting dari fosfolipid penyusun membran spermatozoa (Sanocka et al. 2004).
Oksidase lipid pada membran spermatozoa menghasilkan senyawa
malondialdehyde (MDA) yang bersifat toksik pada sel. Senyawa ini mempunyai berat molekul rendah dan merupakan satu dari beberapa molekul hasil penguraian endoperoksida lipid yang terbentuk selama proses peroksidasi lipid. Peningkatan kadar MDA biasa digunakan sebagai salah satu indikator untuk peroksidasi lipid membran (Halliwell dan Gutteridge 1999).
Adanya perbedaan karakteristik secara biokimia dan fisiologis antar semen membutuhkan tes tambahan dalam penilaian kualitas semen beku selain motilitas dan gerakan individu, yaitu viabilitas dan membran plasma utuh serta pengukuran kadar MDA. Penelitian ini bertujuan untuk menguji daya tahan spermatozoa terhadap pembekuan (freezing capability) pada berbagai jenis, individu dan umur pejantan serta mengevaluasi kerusakan membran spermatozoa dalam pengencer skim-kuning telur melalui pengukuran kadar MDA.
Kerangka Pemikiran
Membran plasma spermatozoa memiliki fosfolipid yang mengandung asam lemak tak jenuh ganda sehingga sangat rentan terhadap serangan radikal bebas. Hal ini menunjukkan bahwa membran spermatozoa adalah target utama ROS dan lipid merupakan sasaran yang potensial. Peroksidasi lipid yang berkepanjangan akan merusak struktur matriks lipid dan menyebabkan membran sel tidak stabil, mengubah fungsi membran serta menurunkan fluiditas membran spermatozoa yang mengakibatkan hilangnya motilitas, viabilitas dan fertilitas spermatozoa.
Molekul reaktif seperti radikal hidroksil akan menarik atom hidrogen dari ikatan rangkap asam lemak tak jenuh dan membentuk radikal peroksil lipid. Radikal ini kemudian bereaksi dengan asam lemak tak jenuh lainnya membentuk hidroperoksida lipid dan radikal peroksil lipid yang baru. Selanjutnya akan meneruskan reaksi oksidasi terhadap lipid lainnya sehingga terjadi peroksidasi lipid. Oksidasi lipid pada membran spermatozoa menghasilkan senyawa
3 Tujuan Penelitian
Penelitian ini bertujuan untuk :
1. Menguji pengaruh jenis, umur serta individu pejantan terhadap kualitas semen yang dihasilkan.
2. Mengevaluasi derajat kerusakan membran melalui pengukuran kadar MDA menggunakan metode asam thyobarbituric.
3. Mengetahui hubungan kadar MDA dengan parameter kualitas spermatozoa pasca thawing (motilitas, viabilitas, MPU).
Manfaat Penelitian
Hasil penelitian diharapkan dapat memberikan manfaat sebagai berikut : 1. Tolak ukur tingkat serta derajat kerusakan semen yang diperkenankan. 2. Memberikan landasan bagi BIB untuk memiliki standar evaluasi kualitas
semen beku sesuai dengan yang dipersyaratkan oleh baku mutu yang ditetapkan SNI.
3. Faktor penentu bagi sistem seleksi dan pengafkiran pejantan unggul di balai-balai inseminasi buatan.
2
TINJAUAN PUSTAKA
Breeding Soundness Evaluation (BSE)
Pejantan yang digunakan sebagai sumber semen di Balai Inseminasi Buatan merupakan pejantan unggul yang terpilih. Diantara keunggulan yang dipersyaratkan adalah (1) berasal dari turunan yang telah diketahui kelebihannya (2) mempunyai riwayat produksi dan produktivitas semen yang memadai (3) sehat dan tidak memiliki cacat tubuh serta (4) mempunyai penampilan tubuh yang seimbang sesuai dengan jenisnya. Satu hal yang juga sangat penting adalah melewati seleksi individu menggunakan breeding soundness evaluation (BSE).
Evaluasi BSE adalah salah satu metode yang sangat penting dan strategis untuk memprediksi potensi pejantan yang akan digunakan untuk proses pengembangbiakan. Di berbagai negara maju aplikasikan BSE pada sapi telah dilakukan secara rutin. Hoflack et al. (2006) melaporkan aplikasi BSE di Belgia dan Belanda. Teknik BSE juga telah diterapkan dengan konsisten di Amerika Serikat dan Eropa (Godfrey dan Dodson 2005; LeaMaster dan DuPonte 2007; Barham dan Pennington 2009).
4
Kriopreservasi Semen
Salah satu kelebihan program IB adalah optimalisasi seekor pejantan dengan genetik unggul dan dimanfaatkan semaksimal mungkin. Namun IB juga memiliki kekurangan yaitu diperlukan pelaksana yang terlatih baik dan terampil untuk melaksanakan koleksi, penilaian, pengenceran, pembekuan semen dan inseminasi pada ternak betina. Inseminasi dapat dilakukan dengan menggunakan semen beku ataupun semen cair.
Aplikasi inseminasi menggunakan semen beku telah dilakukan di Indonesia sejak tahun 1972 menggunakan semen beku hasil impor. Produksi semen beku di Indonesia dimulai sejak tahun 1976 di BIB Lembang (Jawa Barat) dan dilanjutkan di Singosari (Jawa Timur) pada tahun 1982. Kriopreservasi (pengawetan beku) semen dilakukan dengan tujuan untuk menyediakan semen beku siap pakai sehingga dapat kapan saja digunakan untuk inseminasi.
Prinsip yang terpenting dari kriopreservasi sel spermatozoa ialah pengeluaran air dari dalam sel (dehidrasi) sebelum terjadi pembekuan intraseluler. Bila tidak terjadi dehidrasi akan terbentuk kristal es besar dalam sel yang dapat merusak sel itu sendiri dan bila terjadi dehidrasi yang sangat hebat maka sel akan mengalami kekeringan sehingga sel mati (Supriatna dan Pasaribu 1992).
Sel mengalami penyusutan selama proses pembekuan dan pembekuan yang terjadi di luar sel akan memengaruhi tekanan osmotik. Pembekuan yang terlalu cepat akan mengakibatkan terbentuknya kristal es intraseluler yang dapat menyebabkan kematian spermatozoa pada saat thawing. Thawing semen beku haruslah melewati proses yang cepat, proses yang lambat akan berpengaruh pada kerusakan membran sesuai prinsip biofisika. Proses thawing yang cepat secara langsung dapat mengembalikan kondisi normal komposisi ionik di dalam sel.
Thawing yang lambat memengaruhi stabilitas membran sel.
Pengolahan semen yang tepat diperlukan untuk menghasilkan semen beku berkualitas dengan daya fertilitas yang tinggi. Pengolahan semen yang dimaksud adalah penambahan bahan pengencer dan krioprotektan untuk mempertahankan kehidupan spermatozoa selama penyimpanan. Tujuan utama pengenceran semen adalah untuk memperbanyak volume semen sehingga menambah jumlah betina yang akan dikawinkan (Campbell et al. 2003) dan dilakukan untuk menjamin kebutuhan fisik dan kimiawi spermatozoa (Nuryadi 2001). Berdasarkan fungsinya larutan pengencer harus mengandung zat sumber energi, bahan anti cold shock, buffer, keseimbangan elektrolit dan antibiotik (Garner dan Hafez 2000).
Bahan pengencer yang digunakan dalam pembekuan semen bervariasi antara spesies hewan mamalia karena setiap semen memiliki daya toleransi yang berbeda-beda terhadap setiap jenis bahan pengencer. Kini telah banyak dikembangkan berbagai jenis pengencer dengan keunggulan masing-masing. Tris, sitrat dan kuning telur banyak digunakan sebagai pengencer. Selain itu susu skim (10%) dikombinasikan dengan gliserol (7%) dan antibiotik juga telah berhasil digunakan sebagai pengencer semen beku selama bertahun-tahun (Vishwanath dan Shannon 2000). Susu skim mempunyai kelebihan sebagai media isotonik dan anti coldshock karena banyak mengandung komponen yang menguntungkan untuk mempertahankan kelangsungan hidup spermatozoa.
5 pembekuan semen disebut dengan agen krioprotektan. Salah satu krioprotektan yang sering ditambahkan dalam pengencer semen adalah gliserol. Penambahannya ke dalam pengencer bergantung pada jenis pengencer, metode pembekuan dan spesies hewan yang digunakan. Penambahan gliserol dapat mencegah pembentukan kristal es besar yang dapat merusak organel sel secara mekanis. Dosis optimum gliserol dalam pengencer semen sapi sebesar 7% (Visnawanath dan Shannon 2000).
Fisiologi dan Biokimia Semen
Semen adalah sekresi kelamin jantan yang secara normal diejakulasikan ke dalam saluran kelamin betina saat kopulasi. Semen terdiri atas sel spermatozoa dan cairan (plasma) semen. Sel spermatozoa dibuat di dalam testis, produksi spermatozoa memerlukan temperatur 3 sampai 5oC di bawah temperatur tubuh.
Seminal plasma adalah suatu komponen essensial yang berfungsi pembawa dan pelindung spermatozoa dan merupakan suatu cairan yang dihasilkan oleh kelenjar prostat, vesicular dan kelenjar bulbouretralis yang disekresikan ke dalam uretra. Seminal plasma terdiri atas senyawa organik dan anorganik yakni ion metal, asam organik, glukosa, lipid dan asam amino, sedangkan senyawa dengan berat molekul tinggi ditemukan dalam bentuk protein (Susilawati 2011). Senyawa tersebut umumnya bersifat hormonal, enzimatis dan mengandung senyawa yang berpeluang dapat terintegrasi dengan permukaan membran spermatozoa.
Untuk mengetahui karakteristik fisiologis semen biasanya dilakukan evaluasi secara makroskopik (volume, pH, konsistensi, warna dan bau) dan mikroskopis (gerakan massa, motilitas, persentase hidup, konsentrasi dan morfologi spermatozoa). Volume ejakulat semen sapi berkisar antara 3-5 ml dengan pH 6.4-7.0 (Ax et al. 2000). Konsistensi dan warna semen bergantung dari konsentrasi spermatozoa. Semen dengan konsentrasi spermatozoa tinggi berwarna krem dengan konsistensi kental, sedangkan semen dengan konsentrasi rendah berwarna lebih terang (putih) dengan konsistensi encer. Semen sapi yang normal memiliki konsistensi dari sedang sampai kental (Feradis 2010).
Gerakan massa merupakan cerminan tingkat motilitas dan konsentrasi spermatozoa. Berdasarkan penilaian gerakan massa, kualitas semen dikelompokkan menjadi: (a) sangat baik (+3) bila terlihat banyak gelombang, gelap, tebal dan aktif bergerak; (b) baik (+2) bila terlihat gelombang kecil, tipis, jarang dan lambat; (c) cukup (+1) bila hanya terlihat gerakan individu; dan (d) buruk (0) bila sedikit atau tidak ada gerakan individu (Arifiantini 2012).
Persentase hidup spermatozoa dapat dievaluasi menggunakan pewarna diferensial eosin atau eosin-negrosin. Menurut Garner dan Hafez (2000) pejantan sudah dianggap bagus jika spermatozoa memiliki konsentrasi minimal 800 juta/ml, nilai motilitas antara 70-80% dan abnormalitas maksimal 20%. Campbell
et al. (2003) menyatakan bahwa konsentrasi spermatozoa pada sapi jantan dewasa berkisar antara 800-1200 juta/ml semen. Penilaian spermatozoa tiap ml semen sangat penting karena faktor ini dipakai sebagai kriteria penentu kualitas semen dan menentukan tingkat pengenceran semen tersebut.
6
Gambar 1 Spermatozoa dan bagian-bagiannya (Varner 2007)
Kepala spermatozoa umumnya berbentuk oval, datar dan inti mengandung kromatin yang kompak. Inti spermatozoa terdiri atas deoksiribonukleat acid (DNA) kompleks yang merupakan protein dasar disebut dengan protamin spermatozoa. Bagian ujung anterior inti spermatozoa dilindungi oleh kantong membran berlapis ganda dan tipis yang disebut akrosom. Akrosom mengandung enzim akrosin, hialuronidase dan enzim hidrolitik lainnya yang akan memengaruhi proses fertilisasi (Ax et al. 2000).
Bagian kepala spermatozoa membawa materi genetik dan enzim yang akan berfungsi pada saat spermatozoa menembus ovum dan lapisan-lapisan sel yang melindunginya. Ekor spermatozoa terdiri atas bagian leher, tengah, utama dan ujung. Ekor spermatozoa mengandung axonema yang ditutupi oleh membran plasma dimana axonema tersebut bertanggung jawab terhadap motilitas spermatozoa. Pada bagian tengah ekor terdapat mitokondria yang berfungsi untuk merombak adenosin triphosphate (ATP) menjadi adenosin diphosphate (ADP). Selanjutnya ADP akan dirombak menjadi adenosin monophosphate (AMP). Setiap energi yang dihasilkan digunakan untuk pergerakan spermatozoa (Garner dan Hafez 2000).
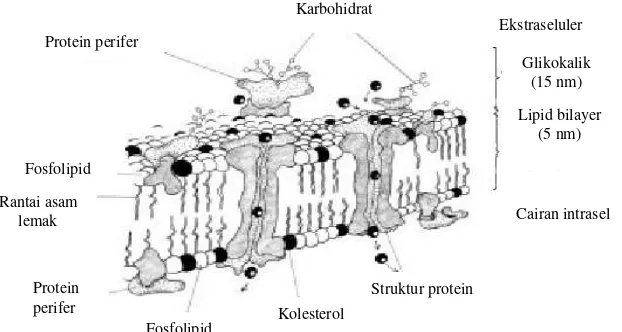
Seluruh permukaan spermatozoa dilapisi oleh membran plasma berupa dua lapis fosfolipid (fosfolipid bilayer) yang bersifat selektif semi permeable, struktur tersebut sangat kompleks dalam susunan mosaik yang teratur dan memiliki peran biologik spesifik pada permukaannya (Gambar 2).
Membran spermatozoa berfungsi untuk memelihara integritas membran dan membentuk permukaan yang dinamis antar sel serta sebagai perlindungan terhadap lingkungan. Membran bagian kepala memegang peranan pada saat kapasitasi, reaksi akrosom dan penetrasi sedangkan membran bagian ekor berfungsi mendapatkan substrat untuk energi yang digunakan untuk pergerakan.
Kerusakan membran pada bagian kepala akan menyebabkan enzim yang berfungsi untuk fertilisasi keluar dan spermatozoa kehilangan fertilitasnya, sebaliknya kerusakan spermatozoa pada bagian ekor terutama pada bagian
7
Gambar 2 Struktur membran plasma spermatozoa (Sumber Amann dan Graham 1993 dalam Morel 1999)
Campbell et al. (2002) menyatakan hampir semua membran mengandung enzim dan sistem transport yang membantu mempertahankan kesetimbangan intraseluler. Disamping itu membran juga mengandung gugus-gugus permukaan yang bermuatan listrik untuk mempertahankan perbedaan potensial listrik sepanjang struktur membran. Bagian luar membran banyak mengandung sisi pengenal spesifik untuk mengenali isyarat molekuler tertentu yang memungkinkan komunikasi antar sel.
Secara umum struktur membran spermatozoa tersusun dari 43% lipid, 48% protein, 9% karbohidrat dan zat-zat lain yang bergabung bersama secara non kovalen dan sangat sensitif terhadap faktor-faktor ekstrinsik suhu, kekuatan ionik dan polaritas larutan (Park dan Graham 1992).
Lipid merupakan komponen membran spermatozoa yang berperan penting dalam menjaga stabilitas dan kelangsungan hidup spermatozoa secara keseluruhan termasuk kemampuan spermatozoa dalam proses kapasitasi dan membuahi sel telur. Lipid membran spermatozoa tersusun dari fosfolipid, kolesterol, triasilgliserol dan asam lemak bebas. Fosfolipid merupakan komponen utama lipid membran spermatozoa yang membentuk membran lapis ganda (Sherwood 2011).
Campbell et al. (2002) menyatakan kepala fosfolipid hidrofilik membentuk permukaan membran bagian luar sedangkan kepala hidrofobik membentuk permukaan membran bagian dalam. Diantara lapisan kepala fosfolipid hidrofilik dan kepala fosfolipid hidrofobik terdapat protein globular dan fibrous dengan distribusi yang bervariasi. Protein-protein ini bersifat dinamis dan dapat bergerak bebas diantara kedua lapisan fosfolipid.
Protein-protein pada membran ada yang terletak secara vertikal sehingga sebagian masuk dan menembus ke dalam dua lapisan fosfolipid (lipid bilayer) serta berinteraksi dengan bagian hidrofilik dari lipid membran yang disebut protein integral sedangkan protein-protein yang terletak dipermukaan bagian luar membran sebagai pemegang dua lapisan fosfolipid disebut protein ferifer.
Protein-protein ini berfungsi sebagai reseptor terhadap rangsangan eksternal dan sinyal (misalnya cahaya, aroma, hormon, obat-obatan, faktor penumbuh dan transporter), sebagai enzim dan antigen yang terlibat dalam pengenalan kepala
8
spermatozoa (misalnya adesi zona pelusida-spermatozoa, induksi reaksi akrosom dan fusi spermatozoa sel telur).
Pada bagian luar dari kedua lapisan fosfolipid terdapat karbohidrat yang sebagian besar berbentuk glikokaliks, merupakan oligosakarida yang berikatan dengan protein dan membran lipid. Karbohidrat membran spermatozoa selain berfungsi sebagai sumber untuk pembentukan ATP juga berperan penting dalam membantu proses kapasitasi dan reaksi akrosom spermatozoa (Kelso et al. 1997).
Sanocka et al. (2004) melaporkan bahwa sebagian besar fosfolipid membran spermatozoa mamalia mengandung asam lemak poli tak jenuh (poly unsaturated fatty acide/PUFA) dalam konsentrasi yang sangat tinggi. Asam lemak poli tak jenuh ini penting untuk mempertahankan fluiditas (sifat kecairan) membran plasma yang dibutuhkan untuk memelihara fungsi-fungsi biokimia dan biologis penting termasuk pemeliharaan berbagai aktivitas enzim terikat membran dan penyempurnaan peristiwa fusi membran yang terkait dengan reaksi akrosom dan penyatuan spermatozoa dengan sel telur.
Meskipun demikian, asam lemak tak jenuh juga rentan terhadap serangan radikal bebas sehingga terjadi peroksidasi lipid. Beberapa penelitian menunjukkan bahwa vitamin E, sebagai antioksidan ekstraseluler memiliki kemampuan untuk membalikkan dampak negatif dari suplementasi asam lemak tak jenuh (Wathes et al. 2007). Pada tingkat sel, asam lemak memiliki efek langsung pada transkripsi gen yang menyandi protein penting bagi peristiwa reproduksi (Mattos et al. 2000). Asam lemak tak jenuh ganda seperti linoleat (C18 : 2n-6) , - linolenat (C18 : 3n-3) , eicosapentaenoic (C20 : 5n-3) dan docosahexaenoic (C22 : 6n-3) banyak di membran spermatozoa sapi dan memengaruhi fluiditas membran dan fertilitas. Docosahexanoic acide (DHA) merupakan asam lemak tak jenuh terpenting pada membran spermatozoa mewakili 30% total asam lemak dan sebagian besar pada fraksi fosfotidil etanolamin dan fraksi fosfatidilkolin (Kelso et al. 1997; Argaman
et al. 2013).
DHA penting dalam meregulasi fluiditas membran yang dibutuhkan untuk memelihara berbagai aktivitas enzim dan penyempurnaan peristiwa fusi membran dengan sel telur. Penambahan DHA pada pakan sapi FH dapat meningkatkan kualitas semen segar tetapi tidak terhadap semen beku pasca thawing (Gholani et al. 2010).
Kolesterol merupakan komponen lipid membran yang mempunyai satu gugus hidroksil dari satu ikatan rangkap pada cincin steroid dengan delapan rantai atom karbon. Kolesterol sangat vital bagi spermatozoa dalam mempertahankan fluiditas (sifat kecairan) membran, semakin banyak kandungan kolesterol pada membran akan membuat membran semakin bersifat cair sebaliknya semakin sedikit kandungan kolesterol pada membran akan menyebabkan spermatozoa semakin mudah mengalami kerusakan (Kelso et al.1997). Terbukti ada kolerasi yang kuat antara kandungan kolesterol membran dengan tingkat keutuhan membran spermatozoa (Flesch dan Gadella (2000).
9 dari spermatozoa kuda sekitar 0.36 (Parks dan Lynch 1992 dalam Loomis dan Graham 2008).
Kolesterol mencegah fase lateralis pemisahan fosfolipid. Kolesterol berperan penting dalam stabilisasi membran. Kandungan kolesterol yang rendah dalam plasma semen dan spermatozoa menyebabkan kerentanan spermatozoa terhadap cold shock. Makin tinggi rasio kolesterol dan fosfolipid pada semen maka makin tahan terhadap pendinginan dan pembekuan. Oleh karena itu, kolesterol merupakan faktor penting untuk mempertahankan sifat-sifat membran
Resistensi cold shock tinggi pada spesies yang mengandung kolesterol yang lebih besar untuk rasio fosfolipid dan saturasi yang lebih besar dengan ikatan gugus asil. Spermatozoa sapi memiliki kolesterol yang lebih tinggi dari pada kuda dan babi. Tingkat tinggi sterol menstabilkan sel spermatozoa yang mengakibatkan kriopreservasi yang lebih baik (Meyers 2005). Hal ini tercermin dalam keberhasilan kriopreservasi semen dari mamalia yang berbeda-beda.
Penelitian lain menunjukkan bahwa profil lipid dan komposisi asam lemak membran secara langsung memengaruhi sifat spermatozoa (integritas, fluiditas, stabilitas dan permeabilitas) yang pada gilirannya memengaruhi kapasitas fertilisasi (Retterstol 2001). Penambahan kolesterol semen dapat meningkatkan ketahanan spermatozoa terhadap pembekuan (Situmorang 2002; Farshad 2011).
Sapi mempunyai sensitivitas yang tinggi terhadap cold shock dibanding spesies lainnya seperti ayam dan manusia (Loomis dan Graham 2008). Oleh karena itu untuk mencapai tingkat ketahanan yang tinggi saat pembekuan, spermatozoa melewati periode adaptasi dahulu pada suhu 50C . Tujuannya adalah memberikan kesempatan gliserol untuk melakukan penetrasi di membran plasma sel spermatozoa. Semakin lama waktu ekuilibrasi, semakin maksimal gliserol berdifusi dan beradaptasi dengan spermatozoa. Akan tetapi spermatozoa sapi yang terlalu lama berada pada suhu ekuilibrasi cenderung kehabisan energi dan terjadi penumpukan asam laktat yang akan berdampak pada penurunan viabilitas spermatozoa (Situmorang 2002).
Integritas membran spermatozoa adalah keutuhan membran spermatozoa atau suatu keadaan yang menunjukkan mekanisme fungsi fisiologis membran tetap terjaga sebagai kontrol terhadap sistem transpor. Pengukuran membran plasma utuh (MPU) dengan metode hypoosmotic swelling test (HOST) digunakan untuk evaluasi fungsional dari integritas membran spermatozoa. Penurunan persentase integritas membran terjadi karena adanya kerusakan membran spermatozoa.
Lechniak et al. (2002) menyatakan ketidakstabilan membran dan konsentrasi ion intraseluler akan memengaruhi integritas membran. Kerusakan membran mengakibatkan terjadinya ketidakstabilan penyerapan cairan saat spermatozoa diletakkan pada medium dengan tekanan osmosis rendah. HOS Test yang memiliki tekanan osmosis rendah dengan mudah masuk ke dalam tubuh spermatozoa yang memiliki tekanan osmosis lebih tinggi. Bila kondisi membran spermatozoa baik cairan ke dalam sel tidak dapat keluar kembali sehingga ekor spermatozoa bengkak dan melingkar.
10
Radikal Bebas
Radikal bebas adalah suatu senyawa atau molekul yang mengandung satu atau lebih elektron tidak berpasangan pada orbital luarnya. Di dalam sel hidup, radikal bebas terbentuk pada membran plasma mitokondria, peroksisom, retikulum endoplasma dan sitosol melalui reaksi-reaksi enzimatis yang berlangsung dalam proses metabolisme. Tubuh memiliki mekanisme proteksi yang menetralkan radikal bebas yang terbentuk antara lain dengan adanya enzim-enzim dismutase (SOD), catalase dan glutathion (GPX).
Dalam kondisi tertentu radikal bebas dapat melebihi sistem pertahanan tubuh, kondisi ini disebut sebagai stress oksidatif. Pada kondisi ini, keseimbangan antara radikal bebas dengan kemampuan antioksidan alami tubuh akan terganggu yang akhirnya akan menyebabkan kerusakan jaringan. Radikal-radikal bebas antara lain superoksida (O2-), hidroksil (OH-) dan peroksil (ROO-). Radikal bebas bersifat sangat reaktif, dan bila bereaksi dengan asam lemak tak jenuh akan membentuk peroksidasi lipid (Agarwal et al. 2008).
Peroksidasi Lipid
Peroksidasi lipid terjadi pada proses pembekuan semen dan menyebabkan kerusakan sel spermatozoa. Peroksidasi lipid disebabkan oleh kandungan asam lemak tak jenuh dalam fosfolipid membran plasma yang sangat tinggi dan sangat rentan terhadap serangan radikal bebas sehingga akan merangsang terjadinya reaksi autokatalitik dan akan merusak ikatan ganda membran plasma tersebut (Sanocka et al. 2004).
Radikal bebas yang dihasilkan karena adanya ROS dapat menyebabkan kerusakan seluruh membran biologis dengan cara menyerang protein, lipid, asam nukleat, dan gliko-konjugat. Perusakan sel oleh radikal bebas didahului oleh kerusakan membran sel. Kerusakan membran sel tersebut terjadi dengan cara: (a) terjadi ikatan kovalen antara radikal bebas dengan komponen membran sehingga terjadi perubahan struktur dari fungsi reseptor, (b) oksidasi gugus thiol pada komponen membran oleh radikal bebas yang menyebabkan proses transport membran terganggu, (c) terjadi reaksi peroksidasi lipid membran yang mengandung asam lemak tidak jenuh (poly unsaturated fatty acid).
(a) (b)
Gambar 3 Peroksidasi lipid (a) dan hidroperoksidasi lipid (b)
11
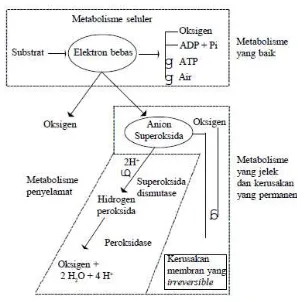
Gambar 4 Mekanisme proses peroksidasi (Hammerstedt 1993 dalam Gazali dan Tambing 2002)
Metabolisme seluler yang bersifat aerob dan menyebabkan terjadinya sintesa ATP bergantung pada pelepasan elektron bebas. Reaksi samping dari elektron ini dengan oksigen dapat menghasilkan anion superoksida yang akan menyebabkan kerusakan sel. Sel yang mengandung cukup superoksida dismutase dan peroksidase dapat mengeluarkan anion superoksida dan akan meminimumkan kerusakan peroksidatif.
Efek toksik yang ditimbulkan dari peroksidasi lipid terhadap sel mamalia mencakup penghambatan metabolisme oksidatif, penghambatan glikolisis, lisis pada eritrosit, oksidasi sulphidril dan penghambatan kerja enzim, modifikasi protein dan asam amino, kerusakan membran dan inaktifasi enzim pengikat membran serta denaturasi DNA (Gazali dan Tambing 2002).
Meskipun kriopreservasi menyajikan beberapa keuntungan akan tetapi protokol pembekuan menyebabkan kerusakan membran plasma spermatozoa. Proses pembekuan-thawing tidak hanya memengaruhi fase lipid (fase cair-gel), tetapi juga menyebabkan redistribusi lateral dan perubahan konformasi protein membran.
Malondialdehyde (MDA)
Oksidase lipid pada membran spermatozoa menghasilkan senyawa
12
proses peroksidasi lipid. Kadar MDA menjadi alat ukur yang paling banyak digunakan sebagai indikator peroksidasi lipid (Halliwell dan Gutteridge 1999).
Pengukuran kadar MDA merupakan cara pengukuran aktivitas radikal bebas secara tidak langsung sebab yang diukur adalah produk dari reaksi radikal bebas bukan pengukuran radikal bebas secara langsung. Kadar MDA yang tinggi menunjukkan terjadinya kerusakan membran spermatozoa. Keadaan ini diindikasikan dengan menurunnya persentase integritas normal membran spermatozoa.
Gambar 5 Struktur kimia Malondialdehyde
Kadar MDA dipengaruhi oleh bahan pengencer yang digunakan. Sebagai bahan perbandingan kadar MDA spermatozoa sapi dalam pengencer citrat-kuning telur 0.263 ± 0.07 nmol/108 spermatozoa sedangkan dalam pengencer Tris-kuning telur 0.562 ± 0.105 nmol/108 spermatozoa (Asadpour et al. 2011). Kadar MDA dalam pengencer Bioxcell® 0.70 ± 0.13 nmol/108 spermatozoa (Sariozkan et al. 2009).
3
MATERI DAN METODE
Lokasi dan Waktu
Penelitian dilakukan di Laboratorium Balai Inseminasi Buatan (BIB) Lembang Bandung dan Laboratorium Biokimia Pusat Studi Satwa Primata (PSSP) Institut Pertanian Bogor. Waktu penelitian dilaksanakan mulai bulan Juli sampai dengan bulan Desember tahun 2013.
Materi Penelitian
Materi penelitian menggunakan semen dari 30 ekor sapi pejantan unggul BIB Lembang yaitu sapi Simental, Limosin dan Fries Holstein (FH) pada kelompok kelompok umur 4-6 dan 7-8 tahun masing-masing sebanyak 5 ekor, dengan kisaran bobot badan sapi FH 800±45.37 kg, Limosin 850±40.38 kg dan Simental 900±50.85 kg. Pakan yang diberikan perhari seragam berupa Hay rumput afrika ±1 kg, konsentrat ±4 kg, feedmix 15g, Se 7g dan rumput gajah ±50 kg serta air minum yang disediakan terus menerus.
Metode
Penyiapan Bahan Pengencer
13 mg dalam larutan 10 ml aquadest). Perbandingan antibiotik dan larutan skim adalah 1 : 100. Untuk membuat 100 ml pengencer semen maka dibutuhkan 86 ml susu skim yang telah diberi antibiotik, 5 ml kuning telur, 8 ml gliserol dan 1 gr glukosa.
Koleksi dan Evaluasi Semen
Semen dikoleksi menggunakan vagina buatan sesuai standar operasional prosedur Balai Inseminasi Buatan Lembang. Frekuensi penampungan dua kali/ minggu/pejantan. Penelitian menggunakan empat ejakulat dari masing-masing pejantan yang digunakan sebagai ulangan. Segera setelah koleksi, semen dievaluasi secara makroskopis meliputi volume, warna, konsistensi dan pH serta secara mikroskopis meliputi persentase motilitas, viabilitas, morfologi (normalitas dan abnormalitas spermatozoa), keutuhan membran spermatozoa (MPU) dan konsentrasi spermatozoa perml (Arifiantini 2012). Hanya semen yang memiliki gerakan massa ≥++ dan motilitas ≥70%, abnormalitas <20% dan konsentrasi >1.000 x106 ml digunakan dalam penelitian ini.
Pengenceran, Pengemasan dan Pembekuan Semen
Semen yang memenuhi persyaratan diencerkan dengan konsentrasi 100 x106 per ml, kemudian diequilibrasi dalam cool top (4-5°C) selama 3 jam selanjutnya dikemas dalam ministraw 0.25 ml (Minitube Jerman) menggunakan mesin otomatis (Combo System Minitube Jerman). Setiap straw mengandung 25x106 spermatozoa motil. Semen dibekukan dalam uap N2 cair selama 7 menit (Digit cool 5300 ZB 250 IMV Prancis). Mesin diprogram dengan laju penurunan 3°C/menit dari suhu +4°C ke -10°C, 40°C/menit dari suhu -10°C ke -100°C dan 20°C/menit dari suhu -100°C ke -140°C. Proses terakhir adalah pencelupan spermatozoa ke dalam N2 cair suhu -196°C dan penyimpanan.
Thawing Semen Beku
Thawing (pencairan kembali) semen dilakukan 24 jam setelah penyimpanan, pada suhu 37°C selama 30 detik. Setelah itu dilakukan pemeriksaan kualitas semen meliputi persentase motilitas, viabilitas, MPU dan kadar MDA spermatozoa (nmol/108 spermatozoa).
Pengujian Motilitas
Sebanyak 5 µl semen diteteskan di atas gelas obyek kemudian ditutup dengan gelas penutup. Motilitas spermatozoa dinilai menggunakan mikroskop phase kontras (Olymphus BX 53), pembesaran 200X yang dilengkapi heating table (37°C) dan kamera video. Persentase motilitas spermatozoa dinilai dari 0 hingga 100% pada 5 lapang pandang sedangkan kecepatan sel bergerak antara 0-5 (Ax et al. 2000; Arifiantini 2012).
Nilai Recovery Rate
Menunjukkan kemampuan spermatozoa untuk pulih kembali setelah proses pembekuan (Garner dan Hafez 2000).
a
14
a : Persentase spermatozoa motil pasca thawing
b : Persentase spermatozoa motil pada semen segar
Pengujian Viabilitas
Satu tetes semen dengan dua tetes pewarna eosin dihomogenkan, dibuat preparat ulas pada gelas obyek dan difiksasi di atas heating table. Perhitungan dilakukan pada 10 lapang pandang dengan jumlah spermatozoa minimal 200 sel (Arifiantini 2012) menggunakan mikroskop (Olympus BX 51) pembesaran 400x. Spermatozoa yang mati menyerap warna sedangkan yang hidup tidak menyerap warna (transparan).
Pengujian Keutuhan Membran Plasma (MPU)
Keutuhan membran plasma dilakukan menggunakan osmotic resistance test
(ORT) atau hypoosmotic swelling (HOS) test (Fonseca et al. 2005). Sebanyak 50 µL semen dimasukkan dalam 1000 µl larutan HOS (1.351g fruktosadan 0.735g Na-sitrat dalam 100 ml aquadest dengan osmolaritas 150 mOsm), dihomogenkan kemudian diinkubasi pada suhu 37oC selama 30 menit. Satu tetes larutan yang telah diinkubasi diteteskan pada gelas obyek kemudian ditutup. Evaluasi dilakukan secara acak dari 10 lapang pandang min 200 spermatozoa. dihitung menggunakan mikroskop phase kontras pembesaran 400X. Spermatozoa yang memiliki membran plasma utuh ditandai oleh ekor melingkar atau menggembung sedangkan yang rusak ditandai oleh ekor yang lurus (Arifiantini 2012).
Pengujian Kadar Malondialdehyde
Pengujian kadar MDAmenggunakan metode asam thiobarbituric spermatozoa sesuai metode Rao (1989) dan Anghel et al. (2009). Sebanyak 1 ml semen yang sudah di thawing, disentrifus 1000 xg (10 menit). Supernatan dibuang dan pelet spermatozoa dicuci 2 kali dengan Tris HCl pH 7.1 kemudian tambah aquadest 1 ml dan reagen Thiobarbituric Acid 0.5 ml. (TBA; 0.67 g asam 2-thiobarbituric ad100 ml air suling dengan 0.5 g NaOH ad 100 ml asam asetat glacial). Sampel dipanaskan dalam penangas air (90oC) selama 1 jam, disentrifus 4000 xg (10 menit). Supernatan yang dihasilkan berwarna pink dan diukur absorbannya menggunakan spektrofotometer pada panjang gelombang 532 nm. Koefisien MDA : 1.56 x 105 M-1cm-1 hasil dinyatakan dalam nmoles MDA/108spermatozoa.
Analisis Data
15
4
HASIL DAN PEMBAHASAN
Karakteristik Semen Segar
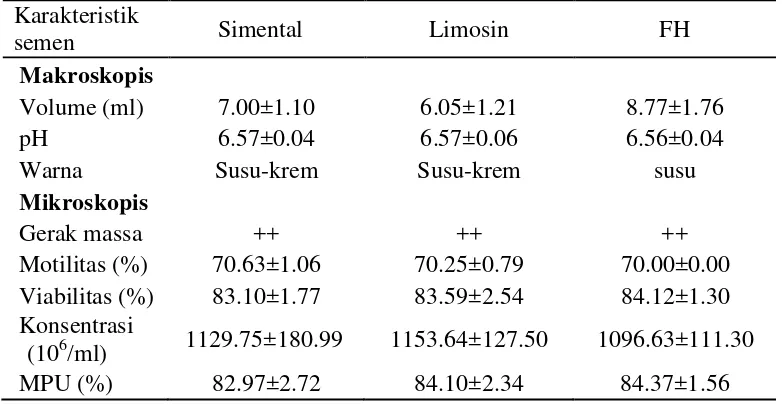
Sel spermatozoa adalah sel yang unik dengan dua bagian utama yaitu kepala dan ekor yang berperan dalam proses pembuahan. Ekor spermatozoa berfungsi untuk pergerakan spermatozoa sedangkan kepala berfungsi pada reaksi akrosom dan fusi membran. Secara makroskopis volume semen yang didapat antara 6.05-8.77 ml, pH 6.56-6.57, berwarna putih susu-krem, konsistensi sedang. Secara mikroskopis motilitas spermatozoa antara 70.00-70.63%, viabilitas antara 83.10- 84.12% dan MPU antara 82.97-84.37% dengan konsentrasi spermatozoa antara 1096.63 x 106-1153.64 x 106 perml (Tabel 1). Semua nilai tersebut dalam kisaran semen yang normal menurut Garner dan Hafez (2000).
Tabel 1 Karakteristik semen segar dari berbagai jenis sapi Karakteristik
semen Simental Limosin FH
Makroskopis
Volume (ml) 7.00±1.10 6.05±1.21 8.77±1.76
pH 6.57±0.04 6.57±0.06 6.56±0.04
Warna Susu-krem Susu-krem susu
Mikroskopis
Gerak massa ++ ++ ++
Motilitas (%) 70.63±1.06 70.25±0.79 70.00±0.00 Viabilitas (%) 83.10±1.77 83.59±2.54 84.12±1.30 Konsentrasi
(106/ml) 1129.75±180.99 1153.64±127.50 1096.63±111.30
MPU (%) 82.97±2.72 84.10±2.34 84.37±1.56
Semen segar yang diproduksi oleh tiap pejantan berbeda-beda kualitas dan kuantitasnya akan tetapi berdasarkan analisa dalam penelitian ini, faktor jenis dan umur pejantan tidak memengaruhi kualitas semen segar yang dihasilkan walaupun terdapat variasi nilai.
Karakteristik Semen Beku
16
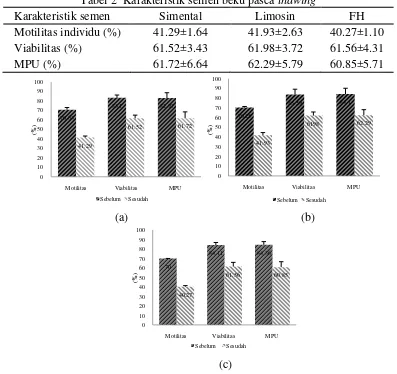
Tabel 2 Karakteristik semen beku pasca thawing
Karakteristik semen Simental Limosin FH
Motilitas individu (%) 41.29±1.64 41.93±2.63 40.27±1.10 Viabilitas (%) 61.52±3.43 61.98±3.72 61.56±4.31
MPU (%) 61.72±6.64 62.29±5.79 60.85±5.71
(a) (b)
(c)
Gambar 6 Efek pembekuan pada jenis sapi Simental (a), Limosin (b) dan FH (c) Pengaruh Pembekuan Terhadap Motilitas Spermatozoa
Motilitas dianggap sebagai salah satu parameter yang paling sering digunakan untuk mengevaluasi fertilitas spermatozoa. Motilitas spermatozoa bergantung pada fungsi mitokondria. Adenosine Tri Phosphate (ATP) dihasilkan oleh fosforilasi oksidatif di dalam membran mitokondria dan ditransfer ke mikrotubulus untuk motilitas. Oleh karena itu, menurunnya motilitas spermatozoa akibat pembekuan diyakini terkait dengan kerusakan mitokondria (Ruiz-Pesini et al. 2001; Januskauskas dan Zillinskas 2002; Dziekonska et al. 2009).
Susmiarsih (2010) menyatakan bahwa DNA mitokondria (mtDNA) berperan pada gangguan motilitas spermatozoa. Namun studi lainnya menyatakan tidak ada korelasi antara mtDNA dan motilitas spermatozoa. Penjelasan mengenai peran mtDNA terhadap motilitas spermatozoa sepertinya masih sedikit kontroversial. MtDNA bersama-sama dengan genom inti bertanggung jawab menyandi kompleks enzim respirasi yang sangat diperlukan untuk transfer elektron pada proses fosforilasi oksidasi dalam menghasilkan energi ATP.
Mutasi genetik mtDNA menyebabkan gangguan kompleks enzim yang berdampak menurunnya produksi ATP dan timbulnya radikal bebas yang bersifat
17 merusak membran plasma. Rusaknya membran plasma mitokondria spermatozoa mengakibatkan terganggunya metabolisme sel spermatozoa, sehingga menyebabkan penurunan motilitas spermatozoa (Spiropoulus et al. 2002; Tremellen 2008).
Faktor Jenis Pejantan
Pada penelitian ini, motilitas spermatozoa pasca thawing mengalami penurunan yang cukup signifikan pada semua jenis sapi yang diuji. Total penurunan motilitas pada Limosin 28.32±1.45% lebih rendah dibanding FH 29.73 ±1.54% dan Simental 29.34±1.36% (P<0.05). Motilitas pasca thawing jenis sapi FH 40.27±1.10% lebih rendah (P<0.05) dibandingkan dengan Limosin 41.93± 2.63% dan Simental 41.29±1.64% (Tabel 3).
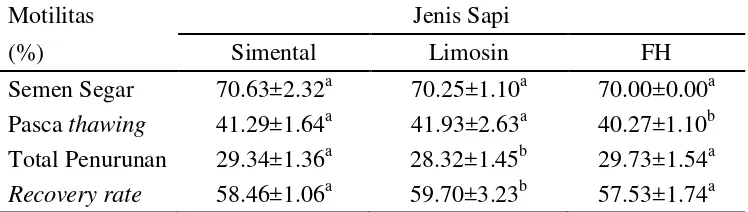
Tabel 3 Penurunan motilitas spermatozoa pada berbagai jenis sapi
Motilitas Jenis Sapi
(%) Simental Limosin FH
Semen Segar 70.63±2.32a 70.25±1.10a 70.00±0.00a Pasca thawing 41.29±1.64a 41.93±2.63a 40.27±1.10b Total Penurunan 29.34±1.36a 28.32±1.45b 29.73±1.54a
Recovery rate 58.46±1.06a 59.70±3.23b 57.53±1.74a
Superskrip huruf yang berbeda pada baris yang sama menunjukkan perbedaan yang nyata (P < 0.05)
Kualitas semen yang dihasilkan berbeda-beda sehingga berpengaruh terhadap kualitas semen beku yang dihasilkan. Hal ini terbukti dari perbedaan nilai recovery rate (RR) yaitu kemampuan spermatozoa untuk pulih kembali dari proses pembekuan dengan membandingkan presentase spermatozoa motil pada semen segar dengan setelah thawing (Garner dan Hafez 2000).
Hasil perhitungan nilai RR (%) untuk Limosin 59.70±3.23% lebih tinggi (P<0.05) dari Simental 58.46±1.06%. dan FH 57.53±1.74% sehingga Limosin dianggap memiliki ketahanan spermatozoa terhadap pembekuan yang lebih baik dibanding Simental dan FH (Gambar 7). Hasil analisa GLM diketahui bahwa motilitas semen beku dipengaruhi oleh jenis dan individu pejantan sebagai sumber semen (P<0.0001).
Faktor individu pejantan
Selain jenis pejantan, individu juga menjadi salah satu faktor yang memengaruhi nilai motilitas spermatozoa. Setiap individu memiliki nilai motilitas semen segar dan pasca thawing yang berbeda-beda sehingga menghasilkan persentase penurunan dan nilai RR yang berbeda-beda juga. Secara umum motilitas spermatozoa sebelum dibekukan tidak kurang dari 70% dan sesudah dibekukan (pasca thawing) tidak kurang dari 40% dengan persentase penurunan kurang dari 31.5%.
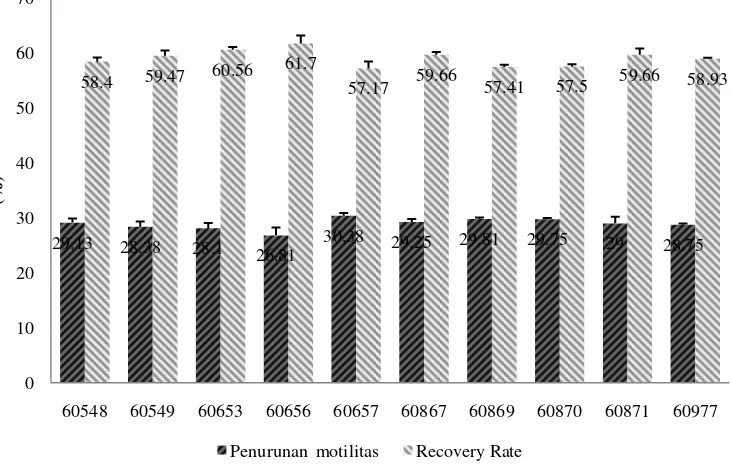
18
RR paling tinggi (61.70±1.46%) sehingga pejantan 60656 dianggap memiliki ketahanan spermatozoa yang paling baik diantara pejantan Simental lainnya (Gambar 7).
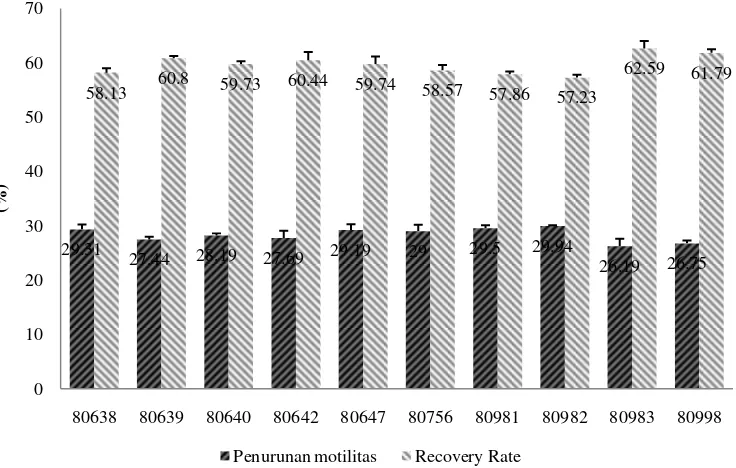
Pada sapi jenis Limosin, motilitas semen segar antara 70.00-72.50% dan semen beku pasca thawing antara 40.06-43.81% dengan penurunan berkisar antara 26.19-29.94%. Pejantan nomor 80982 mengalami penurunan motilitas paling tinggi (29.94±0.13%) dan nilai RR paling rendah (57.23±0.13%) sedangkan pejantan nomor 80983 mengalami penurunan motilitas paling rendah (26.19±1.40%) dengan nilai RR paling tinggi (62.59±1.38%) sehingga pejantan nomor 80983 dianggap memiliki ketahanan spermatozoa terhadap pembekuan yang lebih baik dibanding pejantan limousin lainnya (Gambar 8).
Pada sapi jenis FH, motilitas semen segar antara 70.00-71.25% dan semen beku pasca thawing antara 40.00-41.50% dengan penurunan berkisar antara 28.50-31.25%. Pejantan nomor 307104 mengalami penurunan motilitas paling tinggi (31.25±1.22%) dan nilai RR paling rendah (56.14±1.50%) sedangkan pejantan nomor 306102 mengalami penurunan motilitas paling rendah (28.50±0.58%) dengan nilai RR paling tinggi (59.29±0.56%) sehingga pejantan nomor 306102 dianggap memiliki ketahanan spermatozoa yang lebih baik terhadap pembekuan dibanding pejantan FH lainnya (Gambar 9).
Gambar 7 Penurunan motilitas dan recovery rate pejantan Simental
29.13 28.38 28.1
26.81
30.38 29.25 29.81 29.75 29 28.75
58.4 59.47 60.56
61.7
57.17 59.66 57.41 57.5 59.66 58.93
0 10 20 30 40 50 60 70
60548 60549 60653 60656 60657 60867 60869 60870 60871 60977
(%
)
19
Gambar 8 Penurunan motilitas dan recovery rate pejantan Limosin
Gambar 9 Penurunan motilitas dan recovery rate pejantan FH
Hasil penelitian menunjukkan adanya variasi ketahanan spermatozoa terhadap pembekuan antar pejantan sehingga diperlukan protokol prosessing dan pembekuan spermatozoa yang berbeda-beda. Hal ini disebabkan adanya variasi kualitas genetik dari masing-masing pejantan (Chandolia et al. 1999; Srianto et al. 2009). Sprott et al. (1998) menyatakan bahwa produksi spermatozoa berkorelasi positif dengan ukuran testis dipengaruhi oleh genetik, umur, bangsa ternak dan individu.
29.31
27.44 28.19 27.69 29.19 29 29.5 29.94 26.19 26.75
58.13 60.8 59.73 60.44 59.74 58.57 57.86 57.23
62.59 61.79
0 10 20 30 40 50 60 70
80638 80639 80640 80642 80647 80756 80981 80982 80983 80998
(%
)
Penurunan motilitas Recovery Rate
29.13 29.44 28.75 28.75 28.5 29.5 29.5 30 31.25 30.5
58.39 57.94 58.93 58.93 59.29 57.86 57.86 57.14
56.14 56.74
0 10 20 30 40 50 60 70
30686 30687 30697 30699 306102 307100 307101 308103 307104 308108
(%
)
20
Faktor umur pejantan
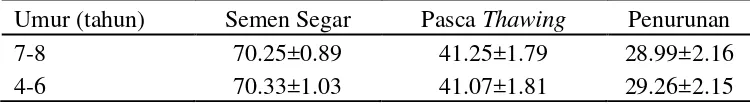
Faktor yang mempengaruhi kualitas semen salah satunya adalah umur pejantan, karena perkembangan testis dan spermatogenesis dipengaruhi oleh umur. Spermatogenesis adalah proses pembentukan spermatozoa yang terjadi dalam tubuli seminiferi. Proses spermatogenesis pada sapi berlangsung selama 55 hari dan berlangsung pertama kali ketika sapi umur 10-12 bulan dan produksi semen meningkat sampai umur 7 tahun (Nuryadi 2000).
Hasil penelitian sebelumnya melaporkan bahwa umur dewasa pada sapi jantan dikaitkan dengan penurunan motilitas spermatozoa (Brito et al. 2002). Berbeda dengan Hallap et al. (2006) yang melaporkan adanya peningkatan motilitas dan integritas membran pada sapi umur dewasa (lebih dari 7 tahun) terkait dengan kadar lemak yang rendah dalam semen dan berkurangnya asam lemak tak jenuh ganda dalam membran spermatozoa sapi dewasa terutama asam arakidonat dan asam docosahexaenoic (DHA). Pada penelitian ini, faktor umur tidak berpengaruh signifikan terhadap motilitas semen segar maupun pasca
thawing (Tabel 4).
Tabel 4 Pengaruh umur terhadap penurunan motilitas spermatozoa Umur (tahun) Semen Segar Pasca Thawing Penurunan
7-8 70.25±0.89 41.25±1.79 28.99±2.16
4-6 70.33±1.03 41.07±1.81 29.26±2.15
Motilitas semen segar, pasca thawing maupun penurunan motilitas antar kelompok umur tidak berbeda (P>0.05). Motilitas semen segar kelompok umur 7-8 tahun 70.25±0.7-89% sedangkan pada kelompok umur 4-6 tahun 70.33±1.03%. Motilitas pasca thawing pada kelompok umur 7-8 tahun 41.25±1.79% dan kelompok umur 4-6 tahun 41.07±1.81%. Penurunan motilitas pada kelompok umur 7-8 tahun 28.99±2.16% dan kelompok umur 4-6 tahun 29.26±2.15%.
Pengaruh Pembekuan Terhadap Viabilitas Spermatozoa
Pengujian viabilitas spermatozoa digunakan sebagai indikator integritas struktur membran spermatozoa. Sel yang mati akan menyerap warna karena permeabilitas dinding sel yang meningkat. Pada sel yang membran plasmanya masih utuh, warna eosin tidak bisa menyusup ke dalam spermatozoa. Perbedaan kemampuan menghisap zat warna antara sel mati dan sel hidup memberi kemungkinan untuk menaksirkan jumlah spermatozoa yang hidup lebih obyektif.
Hilangnya viabilitas spermatozoa tidak bisa dihindari karena selama pengolahan semen, spermatozoa mengalami perubahan kondisi lingkungan yang sangat ekstrim. Lemma (2011) menyatakan ada dua rentang suhu yang rentan terhadap kerusakan spermatozoa selama pembekuan yaitu periode pendinginan (0°C sampai -5°C) dan pembentukan kristal es (-6°C sampai -15°C).
21
Gambar 10 Viabilitas spermatozoa dengan pewarnaan eosin 2%; spermatozoa yang mati menyerap warna (kepala panah) yang hidup tidak menyerap warna (panah)
Kristal es mulai terbentuk di ruang ekstraseluler sedangkan sel itu sendiri tidak ikut membeku disebabkan karena membran plasma menahan perkembangan kristal es di dalam sitoplasma sel. Air yang terdapat di dalam sel kemudian berdifusi keluar karena meningkatnya konsentrasi cairan ekstraseluler yang disebabkan oleh membekunya sebagian besar air yang ada di ruang ekstraseluler. Faktor Jenis Pejantan
Viabilitas spermatozoa pasca thawing lebih sedikit bila dibandingkan dengan semen segar hal ini disebabkan suhu yang sangat rendah saat pembekuan mengakibatkan bocornya substansi vital dalam spermatozoa sehingga enzim intraseluler, lipoprotein, ATP, kalium intraseluler berkurang dan menyebabkan kerusakan membran plasma sehingga nilai viabilitas menurun (Carreira et al. 2013).
Pada penelitian ini, total penurunan viabilitas spermatozoa antara jenis sapi Simental, Limosin dan FH sama (P>0.05) berkisar antara 21.58±4.09% dan 22.55 ±5.60% (Tabel 5). Penurunan viabilitas terjadi karena terbentuknya kristal es menyebabkan kerusakan struktur membran secara fisik dan adanya radikal bebas yang terbentuk dapat memicu terjadinya peroksidasi lipid sehingga akan menurunkan
motilitas dan daya hidup spermatozoa (Sikka 2004; Carreira et al. 2013).
Tabel 5 Penurunan viabilitas spermatozoa pada berbagai jenis sapi
Viabilitas Jenis Sapi
(%) Simental Limosin FH
Semen Segar 83.10±3.02 83.59±5.52 84.11±2.69
22
Faktor Individu
Setiap individu memiliki persentase viabilitas spermatozoa yang berbeda-beda. Pada penelitian ini, persentase viabilitas semen segar sebelum dibekukan antara 79-88% dan viabilitas semen beku pasca thawing antara 55-65% dengan penurunan berkisar antara 16-26%. Penurunan persentase viabilitas dapat disebabkan terikatnya kolesterol pada membran plasma sehingga mempengaruhi fluiditas dari membran dan terganggunya transfortasi molekul-molekul dan makanan yang dibutuhkan untuk metabolisme (Situmorang 2002).
Pada sapi jenis Simental, viabilitas semen segar antara 80.38-85.63% dan semen beku pasca thawing antara 58.75-65.25% dengan penurunan berkisar antara 15.63-25.37%. Penurunan viabilitas paling tinggi pada pejantan nomor 60657 sebesar 25.37±5.36% dan paling rendah pada pejantan nomor 60656 sebesar 15.63 ±7.64% (Gambar 11).
Gambar 11 Penurunan viabilitas pejantan Simental
Pada sapi jenis Limosin, viabilitas semen segar antara 79.25-87.75% dan viabilitas semen beku pasca thawing antara 56.25-65.25% dengan penurunan berkisar antara 16.13-25.63%. Penurunan viabilitas paling tinggi pada pejantan nomor 80982 sebesar 25.63±6.17% dan paling rendah pada pejantan nomor 80647 sebesar 16.13±6.00% (Gambar 12).
Pada sapi jenis FH, viabilitas semen segar antara 82.50-86.38% dan viabilitas semen beku pasca thawing antara 58.25-64.00% dengan penurunan berkisar antara 20.38-25.63%. Penurunan viabilitas paling tinggi pada pejantan nomor 307104 sebesar 25.63±7.91% dan paling rendah nomor 306102 sebesar
60548 60549 60653 60656 60657 60867 60869 60870 60871 60977
23
Gambar 12 Penurunan viabilitas pejantan Limosin
Gambar 13 Penurunan viabilitas pejantan FH
Nilai-nilai tersebut termasuk kisaran normal karena menurut Ax et al. (2000) persentase hidup semen segar sebesar 60-80%. Lessard et al. (2000) menyatakan penurunan kualitas spermatozoa sesudah pembekuan sangat tinggi sekitar 50% spermatozoa mati selama pembekuan dan spermatozoa yang bertahan hidup umumnya mempunyai fertilitas yang rendah, sedangkan Nebel (2007) melaporkan kematian spermatozoa sesudah pembekuan sekitar 30%.
Killian et al. (1999) menyatakan protein seperti osteopontin dan lipocalin-jenis prostaglandin D-synthase yaitu beberapa protein spesifik yang dimiliki oleh membran spermatozoa, bervariasi antar pejantan dan memengaruhi viabilitas spermatozoa. Selain protein di membran, komposisi plasma semen tidak
24.75
80638 80639 80640 80642 80647 80756 80981 80982 80983 80998
P
21.88 21.5 21.63 21.75 20.38 22.25 22.88 24.25
25.63
30686 30687 30697 30699 306102 307100 307101 308103 307104 308108
24
homeostatis dan bervariasi tidak hanya antar spesies tetapi juga di antara individu dan antar ejakulasi dari hewan yang sama (Garner dan Hafez 2000).
Adanya perbedaan karakteristik plasma semen antar individu dan antar semen dari koleksi hewan yang sama tentu saja memengaruhi kualitas semen yang dihasilkan. Spermatozoa sapi juga menghasilkan asam laktat dalam jumlah yang tinggi dari metabolisme fruktosa plasma semen dan ini bisa memengaruhi daya tahan spermatozoa (Haugan et al. 2007).
Kerusakan lanjut semen beku terjadi saat pencairan kembali dengan terbentuknya rekristalisasi membentuk kristal es yang lebih besar. Konsentrasi elektrolit yang berlebihan dapat melarutkan selubung lipoprotein membran sel spermatozoa pada waktu thawing, permeabilitas membran sel akan berubah dan menyebabkan kematian sel (Watson 2000).
Faktor umur Pejantan
Kualitas semen dipengaruhi oleh beberapa faktor internal diantaranya jenis pejantan, variasi individu dan umur (Beran et al. 2011). Brito et al. (2002) menyatakan temperatur dan karakteristik morfologi skrotum, testis dan testicular vascular cone terkait dengan produksi sperma dan kualitas semen oleh karena itu dapat digunakan ketika melakukan seleksi pejantan menggunakan breeding soundness evaluation (BSE). Hasil analisa GLM menunjukan umur berpengaruh terhadap daya hidup spermatozoa pasca thawing (P<0.05) tetapi tidak pada semen segar (Tabel 6).
Tabel 6 Pengaruh umur terhadap penurunan viabilitas spermatozoa umur (tahun) Semen Segar Pasca Thawing Penurunan
7-8 83.68±3.99 62.44±4.04a 21.24±4.70
4-6 83.52±3.39 60.93±4.04b 22.58±4.12
Superskrip huruf yang berbeda pada kolom yang sama menunjukkan perbedaan yang nyata (P < 0.05)
Persentase viabilitas semen segar pada kedua kelompok umur hampir sama yaitu 83.68±3.99% dan 83.52±3.39% (P>0.05). Akan tetapi persentase viabilitas pasca thawing pada kelompok umur 7-8 tahun 62.44±4.04% lebih tinggi dibanding kelompok umur 4-6 tahun 60.93±4.04% (P<0.05). Persentase penurunan viabilitas pada sapi kelompok umur 7-8 tahun 21.24±4.70% lebih sedikit dari pada kelompok umur 4-6 tahun 22.36±4.12% (P>0.05).
Pengaruh Pembekuan Terhadap Keutuhan Membran Plasma
Salah satu karakteristik paling mencolok dari spermatozoa dalam hal biokimia adalah proporsi yang sangat tinggi dari rantai panjang asam lemak tak jenuh ganda sebagai komponen fosfolipid membran plasma. Tingginya asam lemak tak jenuh dapat memberikan tingkat fleksibilitas yang tinggi pada membran plasma spermatozoa serta menyediakan sumber energi potensial dalam rangka memfasilitasi flagel untuk gerak. Lipid spermatozoa juga memainkan peran penting dalam fusi membran dan sinyal transduksi pada saat reaksi akrosom dan fertilisasi (Sanocka et al. 2004)
25 berakibat pada penurunan viabilitas spermatozoa dan kerusakan membran. Selama kriopreservasi terjadi perubahan temperatur dan osmolalitas yang ekstrem. Aksi tersebut berefek pada perubahan struktur organisasi dan komposisi lipid membran plasma di tiap bagian penting spermatozoa (Moće dan Graham 2008). Konsekuensinya adalah terjadi kerusakan fungsional spermatozoa yang berefek pada penurunan motilitas, pergerakan abnormal (circullar movement) dan kematian dini spermatozoa (Loomis dan Graham 2008).
Pembekuan juga menyebabkan beberapa perubahan termasuk masuknya kalsium kedalam sel. Membran plasma adalah struktur yang sangat dinamis yang mengatur tidak hanya pertukaran ekstraseluler, tetapi juga proses pembuahan (Bailey et al. 2000). Perbedaan komposisi lipid dari membran plasma spermatozoa sebagai faktor kunci dalam freezability spermatozoa (Kelso et al. 1997)
Masing-masing spesies hewan mengandung komposisi membran yang berbeda menyebabkan efek pendinginan yang berbeda sehingga ketahanan terhadap pembekuan yang berbeda pula di berbagai spesies. Karakteristik membran yang memengaruhi sensitivitas diantaranya rasio kolesterol/fosfolipid dan rasio protein/fosfolipid. Flesch dan Gadella (2000) menyatakan terdapat korelasi yang kuat antara kandungan kolesterol membran dengan tingkat keutuhan membran spermatozoa.
Gambar 14 Reaksi spermatozoa terhadap larutan HOS; spermatozoa yang memiliki membran plasma utuh (kepala panah) spermatozoa dengan membran plasma rusak (panah)
Faktor Jenis Pejantan
Pendinginan merupakan pemicu stres spermatozoa karena akan merubah konfigurasi dari fosfolipid membran plasma dan mengganggu fungsi serta permeabilitas membran sel (Watson 2000; Cooter et al 2005; Wongtawan et al.