OPTIMASI SINTESIS Li4Ti5O12 DENGAN PENAMBAHAN LiOH.H2O UNTUK ANODA BATERAI ION LITHIUM
Skripsi
Diajukan untuk Memenuhi Persyaratan Memperoleh
Gelar Sarjana Sains (S.Si)
Oleh
RARAS DEWI PRIMA EKASARI NIM : 1111097000004
PROGRAM STUDI FISIKA FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH JAKARTA JAKARTA
iv
LEMBAR PERNYATAAN
Dengan ini saya menyatakan bahwa :
1. Skripsi ini merupakan hasil karya asli saya yang diajukan untuk memenuhi
salah satu persyaratan memperoleh gelar strata 1 di UIN Syarif Hidayatullah Jakarta.
2. Semua sumber yang saya gunakan dalam penulisan ini telah saya cantumkan sesuai dengan ketentuan yang berlaku di UIN Syarif Hidayatullah Jakarta.
3. Jika dikemudian hari terbukti bahwa karya ini bukan hasil karya asli saya atau merupakan hasil jiplakan dari karya orang lain, maka saya bersedia
menerima sanksi yang berlaku di UIN Syarif Hidayatullah Jakarta.
Jakarta, Juli 2015
v ABSTRAK
Telah dilakukan penelitian sintesa Li4Ti5O12 untuk aplikasi komponen anoda pada baterai lithium ion. Sintesa dilakukan dengan metoda SSR (solid state reaction)
dari bahan serbuk LiOH.H2O (teknis) dan TiO2 (teknis). Percobaan dilakukan untuk meningkatkan presentase fasa Li4Ti5O12 yaitu dengan melakukan penambahan bahan baku LiOH.H2O dengan variasi 0%; 2,5%; 5% dan 7,5%. Proses diawali dengan melakukan pencampuran menggunakan ball-milling
selama 15 jam. Kemudian dilakukan proses kalsinasi pada suhu 700oC selama 2 jam dan dilanjutkan dengan proses sintering pada suhu 850oC selama 4 jam. Karakterisasi material aktif dilakukan dengan mengetahui fasa yang terbentuk menggunakan uji XRD, gugus fungsi dengan FTIR, ukuran partikel dengan PSA,
morfologi dengan SEM, surface area dengan BET serta kapasitas baterai dengan
Charge-Discharging. Komposisi terbaik didapatkan pada variasi penambahan
LiOH.H2O sebanyak 5%.
vi ABSTRACT
Li4Ti5O12 as anode material for lithium on battery has been synthesized. Synthesized has been done by solid state reaction (SSR) method with the powder of LiOH.H2O (thenical) and TiO2 (technical) as starting materials. Experiments were carried out to increase the procentage of phase of Li4Ti5O12 is excess a raw material LiOH.H2O with variations 0%; 2,5%; 5%; 7,5%. The process begins by mixing using a ball-milling for 15 hours. Then do the calcination process at 700oC to 2 hours and followed by sintering at 850oC for 4 hours. Characterization of the active material is done by knowing the phase with XRD, functional group with
FTIR, particle size with PSA, morphology with SEM, surface area with BET and capacity battery with charge-discharging. The best composition is obtained in addition LiOH.H2O variations as much as 5 %
vii
KATA PENGANTAR
Alhamdulillah, Alhamdulillahirobbil’aalamin, puji syukur kepada Allah
SWT atas segala kemudahan yang telah diberi sehingga penulis dapat menyelesaikan penelitian di Pusat Penelitian Fisika Lembaga Ilmu Pengetahuan
Indonesia (LIPI) Kawasan Puspiptek Serpong. Sholawat serta salam tak lupa selalu tercurahkan untuk baginda Rosululloh SAW yang telah membimbing manusia ke jalan kebenaran.
Dalam proses penyusunan skripsi ini penulis mengucapkan banyak terima kasih kepada:
1. Keluarga tercinta. Papa, Mama, Yonas dan Prabu, terima kasih atas semua dukungan dan doa kalian yang tak lupa selalu dipanjatkan kepada Allah SWT.
2. Ibu Dr. Sitti Ahmiatri Saptari, M.Si selaku dosen pembimbing yang selalu memberikan kritik dan saran yang membangun.
3. Bapak Slamet Priyono, MT selaku pembimbing lapangan selama penelitian berlangsung.
4. Bapak Dr. Agus Salim, M.Si selaku Dekan Fakultas Sains dan
Teknologi Universitas Islam Negeri Syarif Hidayatullah Jakarta. 5. Bapak Ambran Hartono. M.Si dan Dr. Agus Budiono selaku dosen
penguji.
viii
Arif, Pak Edi, Pak Salim, Pak Daerobi, Pak Wahyudi dan Pak Pri, terima kasih atas ilmu yang telah diberikan.
7. Sahabat Seperjuangan di fisika UIN Jakarta angkatan 2011. Special untuk sahabat seperjuangan di Fisika Material UIN Jakarta angkatan 2011. Betty, Tirta, Risma, Yuli, Fada, Nabila, Ryan, Lutfi, Reno,
Achmad, Dayu, Rizki, Darwin, Satrio, Ali, Azam dan Special Vinggo. Terima kasih atas segala kebersamaannya, kalian sahabat terbaik.
8. Seluruh mahasiswa PKL/TA di P2F LIPI, Arin, Suci, Juni, Tiara, Okta, Heri, dll. Terima kasih atas segala bantuannya.
9. Seluruh staff P2F LIPI, terima kasih atas bantuan untuk mengarakterisasi sampel.
10.Sahabat-sahabatku tercinta, Ibun, Vio, Nanda, Uni, Raise, Ria, Andra,
Nuni, Raise, Uni, Ria, Reza, Ale, dll. Terima kasih atas segala dukungan dan doanya.
11.Seluruh pihak yang terkait dengan penelitian ini yang belum disebutkan.
Penulis Menyadari bahwa skripsi ini merupakan buah karya yang
penyusunannya didasari atas keterbatasan penulis dalam memahami segala hal yang pernah dilalui selama penelitian berlangsung. Sekiranya ada saran dan kritikan selalu penulis harapkan untuk pengembangan di masa depan.
Jakarta, 24 Juni 2015
ix DAFTAR ISI
Halaman Judul ... i
Lembar Persetujuan Pembimbing ... ii
Lembar Pengesahan Ujian ... iii
Lembar Pernyataan ... iv
Abstrak ... v
Abstract ... vi
Kata Pengantar ... vii
Daftar Isi ... ix
Daftar Gambar ... xi
Daftar Tabel ... xii
BAB I PENDAHULUAN 1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Tujuan Penelitian ... 4
1.4 Sasaran Penelitian ... 4
1.5 Sistematika Penulisan ... 4
BAB II TINJAUAN PUSTAKA 2.1 Baterai Ion Lithium ... 6
2.2 Anoda Li4Ti5O12 ... 9
2.2.1 Tinjauan Pustaka Terkait Dengan Penelitian ... 11
2.3 Solid State Reaction ... 14
2.3.1 Kalsinasi ... 19
2.3.2 Sintering ... 20
2.4 Bahan Pembentuk Keramik Li4Ti5O12 ... 22
2.4.1 LiOH.H2O (Lithium Hidroksida) ... 22
2.4.2 TiO2 (Titanium Oksida = Titania) ... 25
2.5 Kinetika Sintesis Li4Ti5O12 Melalui Solid State Reaction ... 26
BAB III METODE PENELITIAN 3.1 Tempat Dan Waktu Penelitian ... 28
3.2 Alat Dan Bahan Baku ... 28
3.2.1 Bahan Baku ... 28
3.2.2 Alat ... 29
3.3 Diagram Alir Metode Penelitian ... 30
3.4 Formulasi Bahan Aktif Li4Ti5O12 ... 32
3.5 Proses Pembuatan Sampel Uji Dan Pengujian ... 32
3.5.1 Analisis Struktur Kristal Dengan X-ray Diffraction (XRD) ... 32
3.5.2 Scanning Morfologi Dengan SEM ... 34
x
3.5.4 Pengukuran Ukuran Bahan Aktif Dengan PSA ... 37
3.5.5 Pengujian Gugus Fungsi Dengan FTIR ... 39
3.5.6 Pengujian Kapasitas Baterai Dengan Uji Charge-Discharging 40
BAB IV HASIL DAN PEMBAHASAN 4.1 Analisa Komposisi Fasa Dengan X-ray Diffraction ... 43
4.2 Analisa Gugus Fungsi Dengan FTIR ... 46
4.3 Analisa Morfologi Partikel Dengan SEM ... 49
4.4 Analisa Ukuran Partikel Dengan PSA ... 52
4.5 Analisa Surface Area Dengan BET ... 53
4.6 Analisa Capacity Battery Dengan Uji Charge-Discharging ... 55
BAB V KESIMPULAN DAN SARAN 5.1 Kesimpulan ... 58
5.2 Saran ... 58
DAFTAR PUSTAKA ... 60
xi
[image:11.595.108.525.152.596.2]DAFTAR GAMBAR
Gambar 2.1 : Driving Range Untuk Hipotesis Kendaraan Listrik Yang
Di Dukung Oleh Berbagai Sistem Baterai Dan
Pembakaran Mesin ... 6
Gambar 2.2 : Skema Representasi Dari Baterai Ion Lithium ... 7
Gambar 2.3 : Kedudukan Atom Dari Struktur Spinel Li4Ti5O12 ... 9
Gambar 2.4 : Hasil Analisa XRD Li4Ti5O12 Dengan Perbedaan Suhu Sintering ... 12
Gambar 2.5 : Hasil Analisa XRD Li4Ti5O12 Setelah Diberi Perlakuan Panas 800oC ... 14
Gambar 2.6 : Diagram Solid State Reaction ... 16
Gambar 2.7 : Skema Mekanisme Pembentukan Li4Ti5O12 ... 18
Gambar 2.8 : Tahap Proses Sintering ... 20
Gambar 2.9 : Struktur Kristal ... 26
Gambar 3.1 : Bahan Baku Li4Ti5O12 ... 28
Gambar 3.2 : Alat Penelitian ... 29
Gambar 3.3 : Diagram Alir Penelitian ... 30
Gambar 3.4 : Alat Uji XRD ... 33
Gambar 3.5 : Alat Uji SEM ... 34
Gambar 3.6 : Alat Uji BET ... 36
Gambar 3.7 : Kurva Distribusi Ukuran Partikel ... 37
Gambar 3.8 : Alat Uji PSA ... 37
Gambar 3.9 : Skema Alat Spektroskopi FTIR ... 38
Gambar 3.10 : Alat Uji FTIR ... 39
Gambar 3.11 : Alat Uji Charge-Discharging ... 41
Gambar 4.1 : Pola Difraksi Sinar-X Li4Ti5O12 ... 43
Gambar 4.2 : Hasil Analisa Gugus Fungsi Dengan Li4Ti5O12 ... 46
Gambar 4.3 : Penampang Hasil SEM Serbuk Li4Ti5O12 ... 49
Gambar 4.4 : Hasil Pengukuran Ukuran Partikel Pada Hasil Analisa Gambar SEM ... 50
Gambar 4.5 : Kurva Hysterisis Hasil Analisa BET ... 53
xii
[image:12.595.106.524.149.552.2]DAFTAR TABEL
Tabel 2.1 : Karakteristik LiOH.H2O ... 23
Tabel 3.1 : Berat Masing-Masing Bahan ... 31
Tabel 4.1 : Komposisi Fasa dari Li4Ti5O12 ... 43
Tabel 4.2 : Konstanta Kisi dari Li4Ti5O12 ... 44
Tabel 4.3 : Tabulasi Nilai Wavenumber Bahan Aktif Li4Ti5O12 ... 47
Tabel 4.4 : Hasil Pengukuran Ukuran Partikel Dari Analisa SEM ... 51
Tabel 4.5 : Ukuran Partikel Serbuk Li4Ti5O12 ... 51
Tabel 4.6 : Besar Surface Area, Pori-Pori dan Total Volume ... 53
1 BAB I
PENDAHULUAN
1.1Latar Belakang
Perhatian di seluruh dunia sedang tertuju pada ketersediaan bahan bakar fosil
yang terus menurun. Hal ini terjadi akibat semakin meningkatnya kebutuhan manusia akan bensin, solar, biomassa dan sebagainya. Peningkatan permintaan akan bahan bakar fosil ini juga diakibatkan karena terus bertambahnya jumlah populasi manusia.
Dimana tingkat ketergantungan manusia terhadap bahan bakar fosil sangat tinggi. Tetapi hal tersebut berbanding terbalik dengan lamanya pembaharuan kembali bahan
bakar fosil seperti minyak bumi [1].
Tidak hanya pada persediaan bahan bakar fosil yang semakin terbatas, masalah yang meluas juga terjadi pada pencemaran udara yang di tandai dengan rusaknya
keseimbangan alam seperti pemanasan global.
Dengan kenyataan yang ada, penyimpanan energi menjadi hal terpenting saat ini. Berbagai upaya dilakukan, seperti menggunakan energi listrik, etanol, fuel cell,
hibrid, sel surya maupun Baterai Lithium-Ion [2].
Baterai Lithium-ion merupakan salah satu media yang ringkas dan efektif untuk
2
satu contoh pemanfaatan baterai lithium adalah pada kendaraan listrik (electric
vehicle) yang dapat mengurangi emisi karbon dioksida [3]. Kendaraan berbasis energi
listrik telah berkembang lebih pesat dibandingkan energi alternative, karena aplikasi
teknologi yang lebih mudah dan aman. Saat ini, teknologi berbasis Lithium
digunakan pada baterai primer (not-rechargeable) dan baterai sekunder
(rechargeable).
Berbagai penelitian mengenai material baterai ion lithium seperti elektrolit,
katoda (elektroda positif), anoda (elektroda negatif), binder serta teknik produksi baterai terus dilakukan secara intensif. Termasuk salah satu komponen yang ada di
dalam baterai lithium yaitu elektroda negatif, atau biasa disebut dengan anoda.
Anoda baterai lithium ion konvensional yang berbahan karbon (graphite, hard
carbon, soft carbon) dianggap tidak lagi sesuai karena safety yang tidak begitu baik.
Titanate (Li4Ti5O12) dianggap sebagai kandidat yang cocok sabagai pengganti karbon karena memiliki safety yang lebih tinggi, tingkat toksisitas yang rendah, cycling rate
yang lebih besar dan biaya produksi yang lebih murah. Salah satu material anoda
yang tengah banyak menjadi perhatian adalah material Li4Ti5O12(Lithium Titanat) atau LTO. Li4Ti5O12 memiliki potensi sebagai pengganti grafit untuk anoda. Hal ini di karenakan Li4Ti5O12 memiliki tegangan operasi yang stabil, yaitu sebesar 1,55 V vs. Li+/Li, yang tidak menyebabkan adanya dendrit ion lithium pada anoda selama proses interkalasi [4]. Memiliki kapasitas yang tinggi (175 mAh/g), laju
3
karena memiliki struktur spinel yang kuat, hal ini mengakibatkan struktur atau volume kisi dari material Li4Ti5O12 sulit untuk berubah pada saat proses interkalasi atau proses insersi atau ekstraksi lithium selama siklus baterai [5][6].
Pada penelitian sebelumnya [7], telah dilakukan sintesis Li4Ti5O12 dengan menggunakan bahan baku LiOH.H2O dan TiO2. Dengan menggunakan pengujian XRD, di dapat bahwa fasa Li4Ti5O12 dan fasa TiO2 rutille. Hasil ini masih belum maksimal, dimana seharusnya fasa TiO2 tidak terbentuk. Oleh karena itu, pada penelitian kali ini akan dilakukan sintesis Li4Ti5O12 dengan variasi penambahan bahan baku LiOH.H2O untuk mengoptimalkan fasa Li4Ti5O12 yang terbentuk.
1.2PerumusanMasalah
4 1.3TujuanPenelitian
Penelitian kali ini secara khusus bertujuan untuk :
1. Meningkatkan fasa Li4Ti5O12 yang di sintesis dari bahan teknis dengan menambahkan bahan baku LiOH.H2O.
2. Mengetahui karakteristik material aktif Li4Ti5O12 yang disintesis dengan penambahan bahan baku LiOH.H20
3. Mengetahui performa elektrokimia setengah sel baterai lithium dengan uji
charge-discharging
1.4SasaranPenelitian
Terkait dengan tujuan penelitian yang berupaya untuk meningkatkan fasa Li4Ti5O12 maka sasaran dari penelitian ini tertuju pada penambahan bahan baku LiOH.H2O dan mendapatkan komposisi yang tepat untuk sintesis Li4Ti5O12 serta mengetahui karakteristik material aktif pengaruhnya terhadap kapasitas sel baterai.
1.5Sistematika Penelitian
Skripsi ini terdiri dari lima bab, yaitu :
●Bab 1 Pendahuluan
Bab ini berisi latar belakang penelitian, perumusan permasalahan, tujuan penelitian, sasaran penelitian dan sistematika penulisan.
5
● Bab 2 Tinjauan Pustaka
Bab ini berisi studi literatur dasar teori, yang berkaitan dengan baterai ion lithium, anoda Li4Ti5O12, tinjauan pusataka terkait dengan penelitian, solid
state reaction, bahan pembentuk keramik Li4Ti5O12 serta kinetika sintesis Li4Ti5O12 guna penyelesaian permasalahan.
● Bab 3 Metode Penelitian
Bab ini berisi tempat dan waktu penelitian, diagram alir penelitian, variabel
penelitian, formulasi penelitian, komposisi material, peralatan preparasi sampel pengujian, peralatan karakterisasi sampel dan prosedur penelitian
secara detail.
●Bab 4 Hasil dan Pembahasan
Bab ini berisi data-data hasil penelitian dari hasil analisa komposisi fasa menggunakan alat uji XRD, analisa gugus fungsi menggunakan alat uji FTIR,
analisa morfologi menggunakan alat uji SEM, analisa ukuran partikel menggunakan alat uji PSA, analisa surface area menggunakan alat uji BET,
analisa capacity battery dengan menggunakan alat uji charge-discharging
beserta pembahasannya.
● Bab 5 Penutup
Bab ini berisi kesimpulan akhir berdasarkan pembahasan serta saran terhadap
6 BAB II
TINJAUAN PUSTAKA 2.1 Baterai Ion Lithium
Baterai ion lithium terus berkembang secara pesat sebagai secondary
battereies yang paling banyak diaplikasikan dalam mobil listrik HEV (hybrid
electric vehicle). Ada dua jenis klasifikasi dari baterai ion lithium, yaitu baterai
primer (habis dalam satu kali pakai) dan baterai sekunder (dapat diisi ulang).
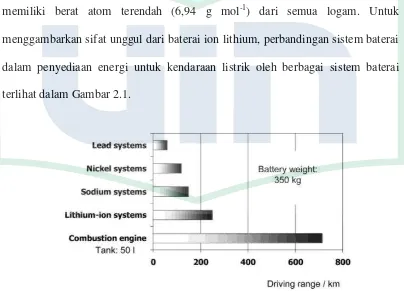
Baterai ion lithium menawarkan potensi terbesar untuk pengembangan EV / HEVs dibandingkan dengan sistem baterai yang lain [8]. Hal ini karena lithium memiliki berat atom terendah (6,94 g mol-1) dari semua logam. Untuk menggambarkan sifat unggul dari baterai ion lithium, perbandingan sistem baterai dalam penyediaan energi untuk kendaraan listrik oleh berbagai sistem baterai
terlihat dalam Gambar 2.1.
[image:18.595.111.515.385.676.2]7
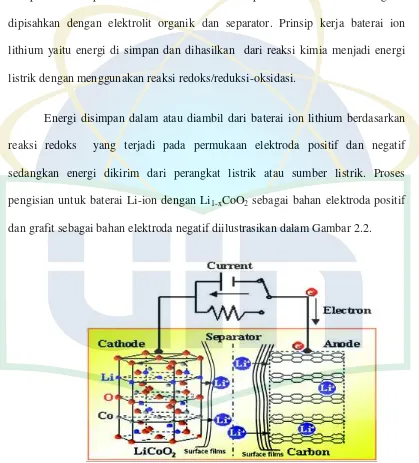
Baterai ion lithium adalah baterai yang di rekayasa, perangkat penyimpanan berupa energi elektrokimia yang terdiri dari berbagai bahan dan
komponen. Komponen dasar adalah elektroda positiv dan elektroda negativ dipisahkan dengan elektrolit organik dan separator. Prinsip kerja baterai ion lithium yaitu energi di simpan dan dihasilkan dari reaksi kimia menjadi energi
listrik dengan menggunakan reaksi redoks/reduksi-oksidasi.
Energi disimpan dalam atau diambil dari baterai ion lithium berdasarkan
reaksi redoks yang terjadi pada permukaan elektroda positif dan negatif sedangkan energi dikirim dari perangkat listrik atau sumber listrik. Proses
[image:19.595.105.524.180.643.2]pengisian untuk baterai Li-ion dengan Li1-xCoO2 sebagai bahan elektroda positif dan grafit sebagai bahan elektroda negatif diilustrasikan dalam Gambar 2.2.
Gambar 2.2 Skema representasi dari baterai ion lithium selama charging. Sisi kiri menunjukkan struktur berlapis dari Li1-xCoO2 dan sisi kanan lembar grafit. Selama proses
8
Proses pengisian baterai ion lithium direpresentasikan dalam Gambar 2.2 yang dapat dijelaskan oleh persamaan redoks:
6C + xLi + xe- LixC6 ( Elektroda negatif)
Li1-xCoO2 + xLi+ + xe- LiCoO2 ( Elektroda positif)
Untuk oksidasi Li1-xCoO2 dalam setengah-sel reaksi, x adalah terbatas pada 0,5 karena alasan keamanan, sesuai dengan 4,2 V vs Li/Li+ [11]. Selain itu, kobalt relatif beracun [12], dan selama daya tinggi charging/discharging dapat
mulai bereaksi exothermically sehingga akan melelehkan separator dan terjadi
hubungan pendek. Cobalt juga mahal, sehingga menjadi tantangan utama yang
dihadapi baterai ion lithium berkekuatan tinggi saat ini untuk penggunaan skala besar ada di EV / HEVs.
Kemampuan kapasitas energi yang tersimpan dalam baterai lithium
tergantung pada berapa banyak ion lithium yang dapat disimpan dalam struktur bahan elektrodanya dan berapa banyak yang dapat digerakan dalam proses
charging dan discharging, karena jumlah arus elektron yang tersimpan dan
tersalurkan sebanding dengan jumlah ion lithium yang bergerak [13]. Pada proses charging, material katoda akan terionisasi, menghasilkan ion lithium bermuatan
positif dan bermigrasi ke dalam electrolyte menuju komponen anoda, sementara
elektron yang diberikan akan dilepaskan bergerak melalui rangkaian luar menuju
9 2.2 Anoda Li4Ti5O12
Li4Ti5O12 atau LTO merupakan material anoda yang dapat digunakan sebagai pengganti grafit dalam baterai ion lithium sekunder [14]. LTO merupakan salah satu dari pengembangan material baru yang memiliki beda tegangan yang cukup tinggi terhadap Li/Li+. Hal ini dilakukan sebagai pengganti grafit yang memiliki keunggulan kapasitas tinggi juga memiliki keterbatasan nyata, yaitu ketidakmampuan dalam kondisi high rates discharge dikarenakan host yang
dimiliki grafit adalah interkalasi satu dimensi. Kondisi high rate akan
menimbulkan efek litiasi yang akan menumbuhkan dendritik pada lapisan anoda
sehingga rentan terhadap terjadinya hubungan pendek dalam baterai yang berakibat eksplosif dari segi faktor keamanan [15].
[image:21.595.111.523.144.700.2]Li4Ti5O12 merupakan keramik lithium-titanimum oxide yang merupakan keramik lithium titanate, lebih dikenal dengan lithium titanate. Memiliki struktur spinel face-centered cubic. Gambar 2.3. memperlihatkan struktur spinel Li4Ti5O12 sebagai berikut:
10
Struktur spinel ini memiliki dua kisi yang berfungsi sebagai tempat tinggal ion-ion penyusunnya, yaitu kisi tetrahedral (A) dan kisi oktahedral (B). Kisi-kisi
tersebut dibedakan oleh bilangan koordinasi oksigennya, dimana kisi A mempunyai tetangga 4 anion oksigen lainnya, sedangkan kisi B mempunyai 6 anion tetangga oksigen. Pola susunan ion-ion LTO spinel adalah kubus pusat
muka (FCC). Satu unit sel mengandung 32 anion oksigen dan kation-kation logamnya tersebar dalam dua kisi yang berbeda, yaitu 64 kisi tetrahedral dan 32
kisi oktahedral. Tetapi perlu diketahui bahwa dari 96 kisi ini hanya 24 kisi saja yang diisi oleh ion-ion logam, yaitu 8 kisi tetrahedral dan 16 kisi oktahedral. Kisi
tetrahedral ditempati oleh kation bervalensi 1 (Li+)dan kisi oktahedral ditempati oleh kation bervalensi 4 (Ti4+) maka jumlah total muatan positif adalah 8x(+1)= +8 ditambah 16x(+4)=+64, atau jumlah total muatan adalah 72. Untuk
kesetimbangan diperlukan 36x(-2)= (-72) muatan negatif O2-, maka dalam satu unit cell terdapat 3 molekul Li4Ti5O12 [15].
Karena melibatkan 3 molekul, maka akan ada 3 Li+ persatuan unit molekul, sementara itu per gram Li4Ti5O12 mengandung 1/459.16 mol sehingga kapasitas teoritik muatan per gram keramik Li4Ti5O12 = 3 x 96.500 (Coulomb) x 0.0021786 / 3600 = 172.5 mAh/g [11,12].
Keramik ini dikenal dengan sebutan material zero-strain insertion, karena
jika diukur dengan menggunakan synchrotron XRD yaitu mengukur perubahan
kisi kristal yang sangat kecil, 0.002 Å pada saat awal discharge dan 0.006 Å
11
keramik ini adalah kemampuan strukturnya untuk tidak mengalami perubahan bentuk selama terjadi insersi ion Li+.
2.2.1 Tinjauan Pustaka Terkait dengan penelitian
Pengujian mengenai adanya TiO2 rutile (perbandingan molar Li dan Ti) pada sintesis Li4Ti5O12 sudah banyak dilakukan terbukti dengan adanya beberapa jurnal yang membahas mengenai hal tersebut. Jurnal yang berjudul ―Pengaruh Kondisi Persiapan terhadap Sifat Fabrikasi Lithium Titanat dengan Metode Solid-State‖ yang ditulis oleh Guo-Qing Zhang, dkk (2012) [18] meneliti persiapan awal
dari sintesis Li4Ti5O12 yang menggunakan bahan baku Li2CO3 dan TiO2 dengan metode solid state dengan menggunakan air dan etanol sebagai pelarut. Percobaan
dilakukan dengan beberapa varian dengan perbandingan Li dan Ti yaitu 4:5, 6:5, 8:5. Bahan baku dicampur dengan menggunakan mixer magnetik dengan air dan
etanol (perbandingan air dan etanol adalah 7:3) sebagai pelarut. Bahan yang telah bercampur lalu di keringkan pada suhu 80oC selama 5 jam. Sintesis Li4Ti5O12 dilakukan dengan melakukan proses sintering dengan variasi suhu 750oC, 850OC dan 950OC. Karakterisasi bahan dilakukan dengan menggunakan XRD untuk mengetahui adanya fasa TiO2 yang terbentuk, SEM untuk mengetahui
morphology bahan aktif serta uji charging-discharging untuk mengetahui
12
(A) (B)
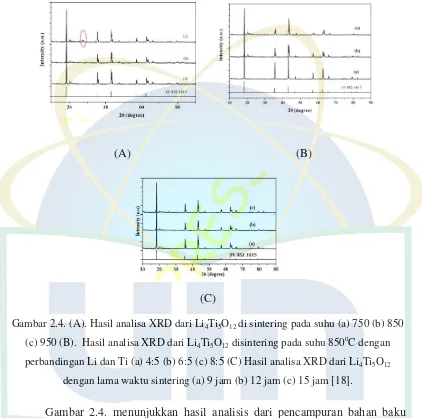
[image:24.595.104.526.128.546.2](C)
Gambar 2.4. (A). Hasil analisa XRD dari Li4Ti5O12 di sintering pada suhu (a) 750 (b) 850
(c) 950 (B). Hasil analisa XRD dari Li4Ti5O12 disintering pada suhu 850oC dengan
perbandingan Li dan Ti (a) 4:5 (b) 6:5 (c) 8:5 (C) Hasil analisa XRD dari Li4Ti5O12
dengan lama waktu sintering (a) 9 jam (b) 12 jam (c) 15 jam [18].
Gambar 2.4. menunjukkan hasil analisis dari pencampuran bahan baku
Li2CO3 dan TiO2 dengan air dan etanol sebagai pelarut. Dari penelitian yang ada, dapat disimpulkan bahwa hal yang terpenting dalam melakukan sintesis Li4Ti5O12 adalah menentukan perbandingan komposisi, suhu kalsinasi dan suhu sintering. Menurut analisa SEM, mendapatkan hasil partikel yang seragam dan memiliki ukuran yang sama adalah faktor untuk menentukan kinerja elektrokimia. Kondisi
13
Pengujian lain mengenai adanya fasa TiO2 rutile (perbandingan molar Li dan Ti) pada sintesis Li4Ti5O12 juga dilakukan oleh Qian, dkk (2014) [19] dalam jurnalnya yang berjudul ―Parameter Ketergantungan Sintesis dari Kinerja
Elektrokimia Solvotermal pada sintesis Li4Ti5O12‖. Penelitian tersebut menggunakan bahan baku Litium Asetat (LiAc) dan Tetrabutil Titanat
Ti(O(CH2)3CH3)4 atau dilambangkan Ti(OR)4 dengan metode solvotermal. Perbandingan Li dan Ti adalah 0,8-1,4. Percobaan dimulai dengan mencampur
LiAc dan Ti(OR)2 menggunakan magnetik stirring menggunakan etanol sebagai pelarut. Setelah homogen, bahan di diamkan pada suhu 180oC selama 4 jam sampai mencapai suhu ruang. Setelah itu dilakukan proses kalsinasi pada suhu 800oC selama 2 jam dengan kenaikan suhu 5oC/menit. Efek dari pemanasan tersebut adalah morpologi partikel dan sifat elektrokimia yang dapat diselidiki.
Selanjutnya dilakukan kalsinasi pada suhu 400oC, 600oC dan 800oC untuk mendapatkan hasil yang optimal dari perbandingan Li dan Ti. Karakterisasi
dilakukan dengan menganalisa fasa yang terbentuk menggunakan XRD,
morphology partikel menggunakan SEM serta kapasitas baterai menggunakan uji charging-discharging.
14
bahwa sampel dengan perbandingan Li dan Ti 1,4 hanya memiliki satu fasa yaitu Li4Ti5O12. Hasil analisa SEM, terlihat bahwa partikel beraglomerasi, partikel kecil berkumpul bersama membentuk satu partikel besar. Uji charging-discharging
menunjukkan bahwa kapasitas baterai meningkat seiiring dengan meningkatnya perbandingan Li dan Ti. Jadi dapat disimpulkan bahwa menurut jurnal yang
[image:26.595.101.524.179.537.2]ditulis oleh Qian, dkk (2014) perbandingan molar Li dan Ti mempunyai dampak yang kuat pada kinerja elektrokimia bahan aktif Li4Ti5O12 untuk anoda baterai lithium.
Gambar 2.5. Hasil XRD dari sampel Li4Ti5O12 setelah diberi perlakuan panas
800oC [19].
2.3 Solid State Reaction
Sintesis Solid-state biasanya dilakukan dengan mencampur bahan padat
dan kemudian campuran tersebut di kuatkan pada suhu tinggi. Metode ini banyak
15
yang dapat dipakai pada kalsinasi suhu tinggi (yaitu 1000oC). Bahan padat di hancurkan dalam mortar sebelum di kalsinasi dalam tungku. Bubuk Li4Ti5O12 yang disintesis dengan reaksi solid-state dari garam lithium dan titanium pada
suhu 700- 1000oC. Umumnya, TiO2 (anatase atau rutil) digunakan sebagai sumber titanium dan Li2CO3 atau LiOH sebagai garam litium [20]. Kadang-kadang, pelarut (etanol) digunakan sebagai dispersant untuk menyediakan lingkungan yang lebih baik pada bahan awal campuran homogen. Sebagai contoh,
sejumlah stoikiometri dari TiO2 dan LiOH.H2O pertama kali tersebar di n-heksana untuk menjamin homogenitas. Kemudian, setelah menghilangkan pelarut, bahan
dipanaskan pada 800oC selama 24 jam dalam oksigen [21]. Li2CO3 dan TiO2 sebagai bahan awal, yang dipanaskan di udara pada 973 K selama 12 jam dan kemudian di kuatkan pada 1123 K selama 24 jam [22].
Kinerja elektrokimia dipengaruhi oleh parameter sintetis yang berbeda, seperti bahan awal (misalnya, titanium atau garam litium), suhu kalsinasi (yaitu
700, 1000oC), aktivasi mechanochemical, waktu kalsinasi [23]. Pengaruh bahan
awal (anatase atau rutile TiO2), suhu penguat (700, 800, 900OC), dan aktivasi
mechanochemical (bola milling atau energi tinggi pada proses milling). Li2CO3 dan TiO2 (baik anatase atau rutil) dicampur dengan air deionisasi setelah menambahkan 2% garam amonium dari asam polikarboksilat sebagai dispersan.
Serbuk campuran di milling pada energi yang tinggi selama 3 jam pada kecepatan
16
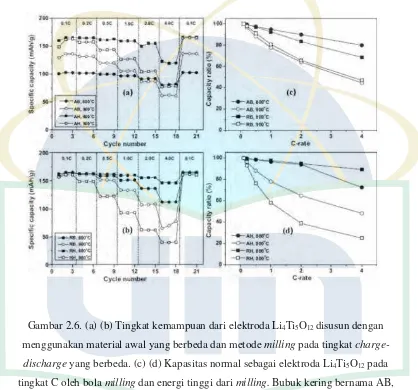
[image:28.595.106.524.174.564.2]suhu 700, 800, 900oC selama 3 jam di udara. Kinerja dan kapasitas dari Li4Ti5O12 disiapkan pada kondisi yang berbeda, ditunjukkan pada Gambar 2.6.
Gambar 2.6. (a) (b) Tingkat kemampuan dari elektroda Li4Ti5O12 disusun dengan
menggunakan material awal yang berbeda dan metode milling pada tingkat
charge-discharge yang berbeda. (c) (d) Kapasitas normal sebagai elektroda Li4Ti5O12 pada
tingkat C oleh bola milling dan energi tinggi dari milling. Bubuk kering bernama AB, AH, RB dan RH yang dalam jenis Li4Ti5O12 dan metode milling, dimana A dan B berdiri
untuk anatase dan rutile Li4Ti5O12 serta B dan H untuk bola milling dan tinggi energi
milling [24].
Rutile TiO2 lebih diinginkan dalam memperoleh Li4Ti5O12 daripada
anatase karena anatase merupakan transformasi fasa dari rutile, karna anatase
memiliki karakteristik yang lebih kaku dalam reaksi solid-state. Proses Miling
17
heterocoagulation dengan stabilitas dispersi tinggi dan distribusi seragam.
Aktivasi mechanochemical oleh energi tinggi dalam proses milling dari bahan
dasar lebih efektif dalam menurunkan suhu reaksi dan ukuran partikel serta meningkatkan content dari Li4Ti5O12 pada hasil akhir proses milling daripada hasil
milling yang di komersialkan. Kapasitas spesifik Li4Ti5O12 yang dibuat dari anatase TiO2 tergantung pada metode milling dan perlakuan suhu panas,
sedangkan rutile TiO2 menunjukkan kapasitas seragam yaitu sebesar 160,6-165,1
mAh/g, terlepas dari perbedaan yang besar dengan parameter kandungan utama Li4Ti5O12. Secara keseluruhan, bubuk Li4Ti5O12 dengan kapasitas spesifik 165 mAh/g dapat disintesis dengan mengoptimalkan metode milling dan bahan awal
[24].
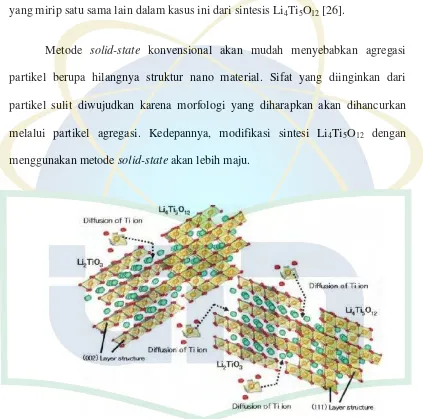
Li2TiO3 selalu ada berdampingan sebagai bahan tidak murni bersama dengan Li4Ti5O12 melalui proses solid-state [25]. Hal ini terlihat bahwa fase dari kedua bahan Li2TiO3 dan Li4Ti5O12 adalah struktur lapisan yang sempurna, dimana lapisan-lapisan Li2TiO3 (002) and Li4Ti5O12 (111), memiliki jarak yang sangat dekat satu sama lain, masing-masing adalah 4,80 dan 4,84 Å. Kedua zat ini kemungkinan besar dapat saling mengunci satu sama lain, pada tahap mereka
koeksistensi. Di sisi lain, titania juga dapat stabil karena kekurangan oksigen dan secara parsial disubtitusi dengan nitrogen (N2 bawah atmosfer). Ini dapat memungkinkan difusi jarak pendek dari ion Ti dari lapisan yang dihentikan untuk memperkaya konsentrasi Ti antara lapisan Li2TiO3 (002) terhadap Li4Ti5O12 (111), seperti yang digambarkan pada Gambar 2.7. Jika tidak langsung, yaitu
18
kedua fase berlapis dapat saling bertautan. Arti penting dari aktivasi mekanik dari intermediet, maka, jelas sebagai struktur lapisan intermediet dan produk akhir
yang mirip satu sama lain dalam kasus ini dari sintesis Li4Ti5O12 [26].
Metode solid-state konvensional akan mudah menyebabkan agregasi
partikel berupa hilangnya struktur nano material. Sifat yang diinginkan dari
[image:30.595.104.527.165.584.2]partikel sulit diwujudkan karena morfologi yang diharapkan akan dihancurkan melalui partikel agregasi. Kedepannya, modifikasi sintesi Li4Ti5O12 dengan menggunakan metode solid-state akan lebih maju.
Gambar 2.7. Skema mekanisme pembentukan Li4Ti5O12 dari Campuran Li2TiO3 + TiO2
[26].
Li et al. [27] menunjukkan sistem reaksi gelombang mikro yang akan
19
Karena Li2CO3 dan TiO2 hanya bisa menyerap sejumlah kecil gelombang mikro pada suhu relatif rendah, maka sistem crucible ganda diaplikasikan untuk
mencapai suhu tinggi yang dibutuuhkan pada saat reaksi solid-stateketika karbon
yang digunakan sebagai media pemanas antara dua cawan lebur porselen. Sistem reaksi gelombang mikro di tempatkan di tengah perputaran plat dari modifikasi
gelombang mikro dengan iradiasi pada 500-700 W selama 10-15 menit.
Sebuah metode lelehan-garam adalah modifikasi dari metode solid-state
dengan memperkenalkan berbagai macam garam, seperti LiCl, NaCl atau KCl kedalam sistem metode solid-state konvensional [28]. Untuk fluks halida, kualitas
tinggi dan kristal kecil dapat tumbuh pada fluks halida sebagai intermedia. Rasio molar dari bahan awal LiOH · H2O: TiO2: LiCl-KCl adalah tetap untuk 4:5:10. Bubuk campuran yang dikalsinasi pada 800OC selama 8 jam di udara, dan bubuk akhir yang di hasilkan dicuci dengan air bersih dan n-butanol untuk mengahpus sisa garam. Adapun garam cair tunggal, misalnya LiCl atau KCl, titik leleh
masing-masing sekitar 612oC atau 789oC. Sedangkan komposit LiCl-KCl secara dramatis dapat mengurangi titik leleh, sehingga daerah reaksi mencair dapat dengan mudah diperoleh, yang dapat mempercepat difusi bahan baku, dan
memperlihatkan pembentukan kristal [29].
2.3.1 Kalsinasi
Kalsinasi adalah proses pemanasan tanpa fusi, untuk mengubah konstitusi
20
konstitusi. Tujuan kedua adalah untuk menghilangkan CO2, SO2 dan zat volatile lainnya. Tujuan ketiga adalah oksidasi zat sepenuhnya atau sebagian. Kalsinasi
juga dilakukan dalam proses pembakaran dan pemanggangan. Secara kimiawi, kalsinasi dapat didefinisikan sebagai proses dekomposisi termal yang diterapkan pada zat dan bijih untuk membawa transisi fase, menghilangkan fraksi yang
mudah menguap dan dekomposisi termal [30]. Proses kalsinasi dilakukan pada suhu 750oC selama 2 jam dengan proses kenaikan suhu secara bertahap. Slamet Priyono [31] melaporkan bahwa hasil analisa DTA/TG dari prekusor Li4Ti5O12 (campuran Li2CO3 dan TiO2) menunjukkan bahwa pada suhu 750oC tidak terjadi reaksi kimia dan tidak mengalami penurunan berat.
2.3.2 Sintering
Sintering merupakan salah satu proses perlakuan panas yang dilakukan
pada material yang dikompakkan (pellet atau bulk) maupun material serbuk
dengan maksud untuk menyempurnakan sifat-sifatnya. Temperatur sintering dibawah titik leleh material atau dua per tiga dari titik leleh [32]. Terjadi
perubahan struktur mikro selama proses sintering, seperti penurunan jumlah pori dan ukuran pori, peningkatan densitas, penyusutan volume, dan pertumbuhan
butir (grain growth) [33]. Perubahan struktur mikro menyebabkan terjadinya
21
Gambar 2.8. Tahap proses sintering (a) partikel bebas (b) tahapan awal (c) tahapan kedua (d) tahapan akhir [32]
Material keramik masih berupa partikel bebas sebelum dipanaskan (Gambar 2.8a). Pada tahap awal sintering terbentuk batas butir (grain-boundary),
dan pada saat yang bersamaan terbentuk pori (Gambar 2.8b). Selanjutnya terjadi pengerutan pori dan ukuran pori mengecil serta batas butir juga membesar, ini terjadi pada tahap pertengahan (Gambar 2.8c). Membesarnya batas butir dan
mengerutnya pori secara cepat, menyebabkan keramik (dalam bentuk pelet) mengalami penyusutan, namun densitasnya membesar. Pada tahap ini juga terjadi
pertumbuhan butir (grain growth). Proses ini terjadi selama kenaikan suhu 300oC
sampai suhu sintering. Tahap akhir proses sintering (Gambar 2.8d), hanya terdapat perubahan bentuk serta pengecilan pori secara lambat, dan sampai
membentuk ukuran pori terkecil [35].
Pada proses sintering terjadi difusi atau transfer materi antar partikel yang
menyebabkan adanya ikatan antar butiran-butiran partikel [33][36]. Bila difusi terjadi pada kondisi padat, disebut solid-state sintering. Bila ditambah sedikit
material dalam fase cair, maka proses disebut sintering fase cair (liquid phase).
22
dengan kenaikan suhu secara bertahap. Bambang,dkk [38] melaporkan bahwa TiO2 anatase yang terbentuk padas suhu sintering 850oC sangat kecil dibandingkan dengan suhu sintering 800oC dan 900oC sehingga dapat dikatakan bahwa pada suhu sintering 850oC hanya ada satu fasa kristal yang terbentuk yaitu Li4Ti5O12.
2.4 Bahan Pembentuk Keramik Li4Ti5O12
2.4.1 LiOH.H2O (Lithium Hidroksida)
Litium hidroksida adalah senyawa anorganik dengan rumus LiOH. Bahan ini berwarna putih dengan bentuk kristal. LiOH ini juga memiliki sifat larut dalam air dan sedikit larut dalam etanol , serta merupakan basis paling lemah di
antara logam alkali hidroksida. Hal ini terlihat dalam benruk anhidrat dan monohdrat (LiOH.H2O), keduanya merupakan basa yang kuat.
Litium hidroksida merupakan hasil dari reaksi metatesis antara lithium karbonat dan kalsium hidroksida [39]:
Li2CO3 + Ca(OH)2→ 2 LiOH + CaCO3
Awalnya hidrat diproduksi dengan proses dehidrasi oleh pemanasan di bawah vakum hingga 180 ° C. Di laboratorium, litium hidroksida timbul oleh aksi
23
2 Li + 2 H2O → 2 LiOH + H2
Li2O + H2O → 2 LiOH
Namun pada umumnya, reaksi tersebut di hindari. Meskipun lithium karbonat lebih banyak digunakan, hidroksida merupakan prekursor yang efektif untuk garam lithium, misalnya:
[image:35.595.105.520.206.724.2]LiOH + HF → LiF + H2O
Tabel 2.1 Karakteristik LiOH.H2O [40]
Spesifikasi Keterangan
Wujud Kristal Putih
Applikasi Ukuran partikel lebih kecil dari lithium
hidroksida yang ditawarkan oleh FMC,
menyediakan reaktivitas yang lebih besar yang
dapat bermanfaat dalam beberapa aplikasi kimia
Spesifikasi Produk LiOH, wt% (56,6 min)
Co2, wt% (0,50 max)
Cl, wt% (0,003 max)
24
CaO, wt% (0,1 max)
Fe2O3, wt% (0,003 max)
NaOH, wt% (0,05 max)
Acid Insolubles, wt% (0,005 max)
Data Lain Kerapatan
Bebas 0,9 /cm3
Tap 1,0 g/cm3
Sifat Fisik Berat Molekul
Kerapatan @20oC
Pembentukan Panas
Standar
Pembentukan Panas Fusi
Panas Spesifik @25oC
Kehilangan air akibat
hidrasi
41,96
1,51 g/cm3
-188,9 kcal/mole
0,867 kcal/mole
0,453 cal/g/oC
100-110oC
Daya Larut Air Temperatur (oC) Persen berat LiOH
25
0
20
100
10,7
10,9
14,8
*Fase padat dalam kesetimbangan dengan larutan
jenuh adalah monohidrat, LiOH.H2O
Toksisitas / Data
Keselamatan
Korosif, berbau, Kristal Putih, Korosif terhadap
mata (dapat menyebabkan kebutaan), Kulit,
hidung dan tenggorokan, menghirupterus
menerus dapat menyebabkan kerusakan
paru-paru.
Penanganan / Kuat /
Pembuangan
Jangan sampai terkena mata, kulit atau
pakaian.Hindari menghirup debu. Cuci sampai
bersih setelah menggunakan bahan. Simpan
dalam wadah tertutup. Simpan jauh dari bahan
asam dan air. Membuang limbah sesuai dengan
hukum dan peraturan lokal dan federal.
Wadah Pengiriman 375 lbs (170 Kg) serat Polyethylene berlapis
26
2.200 lbs (182-1000 Kg)
Pengiriman Terbatas Pengiriman lithium hidroksida digambarkan
sebagai "Lithium hidroksida, UN 2680". Semua
kiriman Hazard kelas 8 dan memerlukanlabel
"Korosif".
2.4.2 TiO2(Titanium Oksida = Titania)
TiO2 juga merupakan bahan pembentuk komposit keramik Li4Ti5O12. Titania (TiO2) bersifat polimorfi dengan struktur kristal yaitu: 2 fasa yang stabil pada suhu rendah antara antara lain anatase dan brookit, sedangkan 1 fasa yang lain
yaitu rutil stabil pada suhu tinggi. TiO2 memiliki struktur dasar quasi hexagonal
closed packed. (HCP) dari oksigen, sedangkan kationnya mengisi separuh sisipan
27
Gambar 2.9. Struktur kristal oktahedral dalam tetrahedral (a). TiO2 anatase, (b).TiO2 rutile [41].
Karakteristik dari TiO2 diantaranya serbuk berwarna putih, memiliki titik lebur 1843oC, densitas 4230 kg.m-3, tidak mudah terbakar dan tidak mengandung racun [42]. Berdasarkan bentuk struktur kristal TiO2 dapat menyebabkan difusi anisotropik dari kation Ti4+ ke arah sumbu c lebih besar dari pada ke arah sumbu a. Memiliki konduktifitas listrik yang rendah dan konstanta dielektrik yang tinggi.
Pembuatan LTO dilakukan secara proses metalurgi serbuk dengan mencampur serbuk Lithium karbonat dan Titanium oksida.
2.5 Kinetika Sintesis Li4Ti5O12 Melalui Solid State Reaction
Reaksi padatan yang digunakan dalam sintesis bahan elektrokimia memiliki banyak keuntungan, seperti proses yang sederhana, tanpa menggunakan
pelarut, ramah lingkungan dan mudah untuk mendapatkan bahan berkualitas baik seperti bahan ukuran nano. Baru-baru ini, pembuatan bahan elektrokimia lebih
banyak menarik perhatian karena kebutuhannya yang semakin meningkat.Oleh karena itu ketertarikan untuk mempelajari sintesis bahan elektrokimia dengan menggunakan metode reaksi padatan mendapatkan perhatian yang lebih di
bandingakan dengan bukan metode lainnya [42]. Hal ini juga diketahui bahwa spinel Li4Ti5012 sebagai bahan elektrokimia yang memiliki banyak manfaat misalnya, memiliki reversibilitas elektrokimia sangat baik, koefisien difusi kimia yang lebih tinggi daripada karbon.Oleh karena itu bahan ini telah dipilih sebagai bahan anoda dan digunakan dalam perangkat penyimpanan energi. Dahulu, bahan
di sintesis dengan menggunakan metode sol-gel atau beberapa metode lainnya
28
serangkaian keuntungan yang dimiliki oleh metode ini. Banyak penelitianyang telah berhasil melakukan sisintesis melalui reaksi solid state dengan sifat
28 BAB III
METODE PENELITIAN 3.1 Tempat dan Waktu Penelitian
Tugas akhir ini dilaksanakan di Pusat Penelitian Fisika (P2F) Lembaga Ilmu Pengetahuan Indonesia (LIPI) kawasan Puspiptek serpong, Tangerang.
Penelitian dilakukan dari tanggal 13 Oktober 2014 sampai dengan 26 Mei 2015.
3.2 Bahan Baku dan Alat 3.2.1 Bahan Baku
Penelitian ini dilakukan dengan menggunakan bahan baku pro-analysis
yang terdiri dari serbuk Lithium Hydroxide Monohydrate (LiOH.H2O) dan Titanium Oksida (TiO2). Pada penelitian ini dilakukan variasi penambahan LiOH.H2O sebanyak 0%, 2,5%, 5%, 7,5% untuk mengoptimalkan komposisi persentase phasa Li4Ti5O12. Sintesis bahan aktif Li4Ti5O12 dengan penambahan LiOH.H2O dilakukan dengan menggunakan metode reaksi solid-state.
29 3.2.2 Alat
Pada penelitian ini menggunakan beberapa alat seperti berikut:
A. Beaker Glass B. Spatula
C. Timbangan Digital D. Mortar dan pesstle
E. Ayakan 400 mesh
F. Oven G. Hot Plate
H. Press Hidrolik I. Magnetic Stirrer
A B C D E
[image:42.595.104.533.175.595.2]F G H I
Gambar 3.2. Alat Penelitian A. Beaker Glass B. Spatula C. Timbangan Digital D. Mortar dan pesstle E. Ayakan 400 mesh F. Oven G. Hot Plate H. Press Hidrolik I. Magnetik
30 3.3 Diagram Alir Metodologi Penelitian
[image:43.595.62.522.196.736.2]Penelitian mengenai pengaruh penambahan bahan baku LiOH.H2O pada sintesis bahan aktif Li4Ti5O12 terhadap performa elektrokimia sel baterai, mengikuti alur metode penelitian seperti terlihat pada Gambar 3.3.
Gambar 3.3. Diagram Alir Metodologi Penelitian Kalsinasi 750oC selama 2 Jam
Mixing dan Milling
Kesimpulan
Gerus 400 Mesh Pencampuran
Slurry
Vacum drying and Pressing
Struktur Kristal, Gugus Fungsi, Surface Area,
Morfologi, Ukuran Partikel Analisa Charge Discharging Pembuatan
Anoda
Karakterisasi
Material Karakterisasi
Sel Material Aktif
Anoda
Sintering 850oC selama 4 Jam Menimbang bahan
31 3.4 Formulasi Bahan Aktif Li4Ti5O12
Pada optimasi material aktif Li4Ti5O12 dengan bahan teknis TiO2 dan LiOH.H2O, perhitungan berat dari masing-masing bahan mengacu pada persamaan di bawahh ini:
4LiOH.H2O + 5TiO2 Li4Ti5O12 + H2O
Dengan diketahui bahwa berat molekul dari masing-masing bahan yaitu :
Mr LiOH.H2O = 41,965 gr/mol
Mr TiO2 = 79,87 gr/mol Mr Li4Ti5O12 = 459,114 gr/mol
Dimana berat total setiap formulasi adalah sebesar 15 gram, maka di dapat
[image:44.595.105.523.163.580.2]berat dari masing-masing bahan adalah sebagai berikut :
Tabel 3.1. Berat masing-masing bahan
Penambahan LiOH.H2O
LiOH.H2O (gr) TiO2 (gr)
0 % 5,4843 13,0474
2,5 % 5,6214 13,0474
5,0 % 5,7586 13,0474
7,5 % 5,8956 13,0474
3.5 Proses Pembuatan Sampel Uji dan Pengujian
3.5.1 Analisis Struktur Kristal dengan X-ray Diffraction (XRD)
Difraksi sinar-X (XRD) secara luas digunakan untuk identifikasi bulk struktur
32
tembaga (8,05 keV, 0,154 nm) [45]. Radiasi ini menembus permukaan dan berinteraksi dengan struktur internal padatan. Gangguan konstruktif terjadi ketika insiden balok berinteraksi dengan bidang kristal di sudut Θ. Detektor menerima
satu set sinyal interferensipada sudut yang berbeda, Θ, yang sesuai dengan jarak
kisi berdasarkan hukum Bragg:
n λ = 2 d sin Θ; n = 1, 2, …
dimana d adalah jarak antara dua bidangt atom (jarak kisi), n adalah bilangan
bulat disebut orde reflektansi, λ adalah panjang gelombang elektromagnetik radiasi, dan Θ adalah sudut antara insiden balok dan pencerminan pesawat kristal.
Kisi jarak, d, adalah karakteristik dan karena itu dapat digunakan untuk
mengidentifikasi struktur kristal dan komposisi atom. Untuk kristal memiliki ukuran yang lebih kecil dari sekitar 1 µm, interferensi destruktif pada arah
hamburan terjadi karena kurangnya jarak dalam struktur kristal. Ukuran kristal dapat dihitung dengan persamaan Scherrer [46][47]. Untuk sub-mikrometer partikel atau kristal:
dXRD= K λ (β cos Θ)-1
di mana dXRD adalah ukuran kristal rata-rata, K faktor bentuk, λ panjang gelombang, dan β perluasan garis pada setengah dari intensitas maksimum.
33
Gambar 3.4. Alat uji XRD
3.5.2 Scanning morfologi dengan Scanning Electron Moicroscopy (SEM) SEM digunakan untuk memperoleh informasi kualitatif dan kuantitatif tentang morfologi atau komposisi sampel dengan bertujuan untuk mengoptimalkan hubungan mikroskopis dengan data kromatografi. Teknik
memberikan karakterisasi direproduksi dari semua fitur gambar seperti ukuran partikel, masukan dan struktur pori-pori internal yang padat. Pada prinsipnya,
analisis SEM harus mengekstrak jumlah maksimum informasi yang diperoleh per fitur dan meminimalkan baik kompleksitas dan waktu yang dibutuhkan untuk analisis [48].
Dalam SEM, berkas elektron dilewatkan melalui ruang dan dievakuasi kemudian difokuskan oleh lensa elektromagnetik ke permukaan sample. Balok
34
elektron sekunder secara inelastic dipancarkan dari sampel dan dikumpulkan oleh
sintilator. Sinyal yang dihasilkan digunakan untuk memodulasi kecerahan tabung
sinar katoda untuk membentuk tampilan layar CRT. Perbedaan dalam hasil emisi sekunder dari perubahanan pada permukaan topografi. Elektron kembali tersebar (elastis) dan dikumpulkan untuk membentuk citra dan hasil kontras berikutnya
dari perbedaan komposisi. Saat ini, pencitraan SEM diperbesar dengan manipulasi yang dikendalikan sepenuhnya secara terkomputerisasi dari berkas elektron yang
[image:47.595.102.519.165.594.2]rastering pada permukaan sampel. Kamera berevolusi tinggi digunakan untuk merekam gambar pada layar tampilan dan mencetak gambar mikrograf [49].
Gambar 3.5. Alat Uji SEM
3.5.3 Analisis Surface Area (BET)
Luas permukaan spesifik (SSA) untuk bubuk kering dapat ditentukan oleh Brunauer-Emmett-Teller (BET) analisis. Brunauer, Emmett, dan Teller berasal
35
Teknik pengukuran ini didasarkan pada adsorpsi fisik nitrogen atau helium pada suhu rendah, suhu konstan. Disini, nitrogen cair digunakan, yang memiliki suhu
didih 73 K. Teknik ini mengukur penyerapan gas (adsorpsi) untuk meningkatkan tekanan parsial pada sampel serbuk kering dan pelepasan gas (desorpsi) pada penurunan parsial tekanan. Pengukuran yang dihasilkan menghasilkan adsorpsi
isoterm yang berhubungan dengan jumlah adsorpsi pada tekanan relatif, dimana SSA diperoleh dari bubuk. Dengan asumsi bahwa partikel berbentuk bola, tidak
berpori, halus, dan monodisperse, rata-rata ukuran partikel primer dapat dihitung
[51]:
dBET= 6 (ρSSA)-1
di mana ρ adalah densitas bulk bubuk dan SSA luas permukaan spesifik massa.
dBET menjelaskan diameter volume permukaan dan dapat digambarkan sebagai rata-rata diameter partikel primer, tapi dBET tidak memberikan informasi mengenai distribusi ukuran partikel bubuk.
Preparasi sampel untuk analisa luas permukaan cukup sederhana. Sampel yang digunakan berupa serbuk. Namun juga tergantung dari seri alat, pada seri lama mengharuskan bahan dipeletkan terlebih dahulu agar tidak menghasilkan
debu yang dapat merusak alat. Berat serbuk sampel yang digunakan sebesar 0,01-0,1 gram.
Dilakukan dua tahap pada uji BET. Alat ini terdiri dari dua bagian yaitu
Degasser dan Analyzer. Tahap pertama adalah menghilangkan gas – gas yang
36
pada suhu 2000C selama 3 jam, proses ini dilakukan pada bagian Degasser. Kemudian tahap selanjutnya dilakukan pada bagian Analyzer. Proses ini memakai
[image:49.595.103.526.164.538.2]nitrogen cair sebagai absobernya.
Gambar 3.6. Alat Uji BET
3.5.4 Pengukuran Ukuran Bahan Aktif dengan Particle Size Analyzer (PSA) Analisis ukuran partikel (PSA) adalah distribusi pengukuran ukuran partikel dalam sampel. Fitur utama dari PSA adalah penghancuran atau dispersi menjadi
unit diskrit dengan cara kimia, mekanik, atau cara ultrasonik dan pemisahan partikel menurut batas ukuran dengan cara seperti penyaringan dan sedimentasi serta metode lainnya (difraksi) [52].
37
diberikan diplot terhadap logaritma dari diameter partikel efektif. Kurva distribusi ukuran partikel, ketika dibedakan grafis, menghasilkan kurva distribusi frekuensi
[image:50.595.106.525.191.651.2]untuk berbagai ukuran partikel. Kurva frekuensi biasanya menunjukkan puncak atau puncak mewakili ukuran partikel yang paling umum.
Gambar 3.7. Kurva distribusi ukuran partikel [53]
38 3.5.5 Pengujian Gugus Fungsi dengan FTIR
Spektroskopi FTIR (Fourier Transform Insfrared) merupakan
spektroskopi inframerah yang dilengkap dengan transformasi Fourier untuk deteksi dan analisis hasil spektrumnya. Inti spektroskopi FTIR adalah
interferometer Michelson yaitu alat untuk menganalisis frekuensi dalam sinyal gabungan [54].
Spektrum inframerah tersebut dihasilkan dari pentrasmisian cahaya yang
melewati sampel, pengukuran intensitas cahaya dengan detektor dan dibandingkan dengan intensitas tanpa sampel sebagai fungsi panjang gelombang. Spektrum inframerah yang diperoleh kemudian diplot sebagai intesitas fungsi
energi, panjang gelombang (µm) atau bilangan gelombang (cm-1) [55].
Skema alat spektroskopi FTIR secara sederhana ditunjukan pada Gambar
[image:51.595.106.521.289.679.2]3.5.
39
Analisis gugus fungsi suatu sampel dilakukan dengan membandingkan pita absorbsi yang terbentuk pada spektrum inframerah menggunakan tabel
[image:52.595.106.524.167.537.2]korelasi dan menggunakan spektrum senyawa pembanding (yang sudah diketahui).
Gambar 3.10. Alat Uji FTIR
3.5.6 Pengujian Kapasitas Baterai dengan Uji Charge-Discharging
Charge-discharging adalah teknik elektrokimia yang paling umum
digunakan untuk karakterisasi perangkat penyimpanan energi. Dalam pengujian ini sebuah cell diisi dan di kosongkan dengan menggunakan arus konstan di antara
tegangan atas dan tegangan bawah. Batas tegangan atas dan bawah ditentukan
40
lebih tinggi dari 0 V vs Li / Li + karena pada potensi rendah lithium cenderung untuk deposit (penyetor) pada permukaan elektroda, yang akhirnya menyebabkan
pertumbuhan dendrit lithium, hal ini menyebabkan masalah keamanan.
Arus yang diterapkan secara langsung berkaitan dengan output daya
elektroda. Biasanya "laju C" digunakan untuk menentukan tingkat cycle LIBs,
dimana xC didefinisikan sebagai 1/x jam per charge atau discharging. Dapat
dikatakan C/10 atau C/5 sebagai cycle yang lambat, meskipun tidak dalam
keadaan setimbang.
Ada tiga cara untuk menunjukan hasil pengujian charge-discharging yaitu
potensial-kapasitas profil, diferensial potensial-kapasitas profil dan kinerja
cycling. Dari pengujian charge-discharging, kita dapat memperoleh informasi
tentang transformasi fasa dalam elektroda dengan kecepatan yang berbeda, kinerja
laju, struktur yang berbeda (kristal atau amorf), berbagai potensi untuk
penggunaaan yang praktis dan cycle life dari LIBs [56].
Untuk melakukan uji charge-discharging mula-mula serbuk Li4Ti5O12 dijadikan lembaran dengan membuat slurry dengan komposisi serbuk Li4Ti5O12, PVDF dan AB (Acetilyn Black) adalah 90:7:3. Kemudian slurry dicoatingkan
pada Cu foil dengan tembal 150 µm dan dikeringkan pada suhu 85oC selama 0,5
jam. Lembaran anoda yang telah mengering kemudian di potong dengan panjang
41
43 BAB IV
HASIL DAN PEMBAHASAN
4.1 Analisa Komposisi Fasa Serbuk Li4Ti5O12 dengan X-ray Diffraction
Studi pengaruh penambahan LiOH.H2O pada bahan aktif Li4Ti5O12 terhadap fasa yang terbentuk pada bahan aktif anoda setelah melalui proses
kalsinasi dan sintering dilakukan dengan cara menganalisis pola difraksi sinar-x. Proses identifikasi pola difraksi sinar-x bahan aktif dilakukan dengan
menggunakan alat uji XRD dengan merek Rigaku tipe SmartLab di Pusat
Penelitian Fisika-LIPI, dimana menggunakan CuK- sebagai sumber cahaya dengan mengaplikasikan scanning speed 2o/menit dengan rentang sudut 10o sampai 80o.
44
penambahan sebesar 2,5% adalah 94,70%, penambahan sebesar 5% adalah 95,90% serta penambahan sebesar 7,5% adalah 95,50%. Sementara itu fasa TiO2 rutile yanga terbentuk pada penambahan LiOH.H2O sebesar 0% adalah 5,50%, penambahan sebesar 2,5% adalah 5,30%, penambahan sebesar 5% adalah 4,10% serta penambahan 7,5% adalah 4,50%. Puncak difraksi (2θ) Li4Ti5O12 terjadi pada 18o, 37o, 43o, 47o, 58o, 63o, 66o, 75o, 76o dan 79o. Meskipun fasa utama telah diperoleh, namun adanya puncak TiO2 rutile di sudut difraksi 27o menyababkan serbuk yang diperoleh bukan fasa tunggal namun merupakan campuran Li4Ti5O12 dan TiO2 rutile.
Gambar 4.1. Pola Difraksi Sinar-X dari material Li4Ti5O12 dengan penambahan
[image:56.595.104.524.159.619.2]LiOH.H2O sebesar 0%, 2,5%, 5% dan 7,5%
Tabel 4.1. Komposisi Fasa dari Li4Ti5O12 dengan Penambahan LiOH.H2O Hasil Analisa
Software HIGHSCORE
Sampel Li4Ti5O12 (%) TiO2 (%)
0% 94,50 5,50
45
5% 95,90 4,10
7,5% 95,50 4,50
Penambahan LiOH.H2O pada pembuatan bahan aktif Li4Ti5O12 berhasil menyebabkan fasa TiO2 rutile yang terbentuk cenderung menurun sampai pada penambahan sebanyak LiOH.H2O sebanyak 5% dan kembali meningkat pada penambahan LiOH.H2O sebanyak 7,5%. Hal ini menunjukkan bahwa penambahan LiOH.H2O pada sintesis menyebabkan campuran awal semakin merata. Setiap butir material awal TiO2 bercampur dengan LiOH.H2O sehingga fasa Li4Ti5O12 yang diharapkan semakin meningkat.
Hasil analisa software HIGHSCORE pada pengaruh penambahan
LiOH.H2O terhadap konstanta kisi, volume kisi, dan densitas teoritis diperlihatkan pada Tabel 4.2. Pengaruh penambahan LiOH.H2O pada Konstanta Kisi (a) menyebabkan konstanta kisi menjadi membesar pada penambahan LiOH.H2O 2,5% dan 7,5%. Sedangkan pada Li4Ti5O12 tanpa penambahan LiOH.H2O lebih kecil daripada Li4Ti5O12 dengan penambahan LiOH.H2O 5%. Nilai konstanta kisi yang terbentuk memiliki perbedaan yang sangat kecil, sehingga dapat dikatakan bahwa konstanta kisi yang terbentuk pada setiap sampel sama besar. Sedangkan
[image:57.595.107.517.652.723.2]volume kisi hanya pangkat tiga dari konstanta kisi karena kisi berbentuk kubik. Tabel 4.2 Konstanta kisi Li4Ti5O12 dengan penambahan LiOH.H2O hasil analisa software
HIGHSCORE
Sampel a (A) V (A3) Calc. Density (g/cm3)
0% 8,3553 583,27 3,56
2,5% 8,3568 583,61 3,55
5% 8,3558 583,34 3,56
46
4.2 Analisa Gugus Fungsi dengan Fourier Transform Infra Red (FTIR)
Proses identifikasi gugus fungsi bahan aktif dilakukan dengan menggunakan alat uji FTIR dengan merek Thermo Scientific tipe Nicolet iS10 di
Pusat Penelitian Fisika-LIPI. Alat ini membantu untuk mengetahui kemungkinan fasa yang terbentuk (mengkonfirmasi hasil XRD) dan mengetahui adanya gugus
fungsi.
Pengambilan data dibagi menjadi dua yaitu metode ATR dengan
wavenumber rendah dan metode transmisi dengan wavenumber tinggi. Wavenumber rendah dinilai dari skala 400 cm-1 sampai 1000 cm-1 yang
menunjukkan gugus khas. Sedangkan wavenumber tinggi di nilai dari skala 1000
cm-1 sampai dengan 4000 cm-1 yang menunjukkan gugus fungsi. Getaran spinel berada pada wavenumber rendah dengan kisaran antara 400 cm-1 sampai dengan
47 A
B
C
[image:59.595.104.525.105.597.2]D
Gambar 4.2. Menunjukkan hasil analisa gugus fungsi dengan FTIR pada
wavenumber tinggi (kiri) dengan menggunakan metode transmisi dan wavenumber rendah (kanan) dengan menggunakan metode ATR pada masing-masing sampel serbuk
48
Dari uji Spektroskopi FTIR didapatkan spektrum inframerah seperti yang tampak pada Gambar 4.2. Dapat dilihat bahwa pada setiap sampel getaran spinel
telah terbentuk pada wavenumber rendah dengan kisaran 500 cm-1 sampai dengan
700 cm-1.
Pengambilan data wavenumber tinggi dilakukan dengan cara membuat
sampel dalam bentuk pellet. Data yang tertera merupakan data yang menunjukkan
adanya serapan terhadap atsmosfer (lingkungan sekitar). Pada masing-masing
sampel memperlihatkan tidak terlalu tingginya nilai serapan yang di miliki. Sampel yang memiliki nilai serapan tertinggi adalah sampel C dengan
[image:60.595.103.523.116.727.2]penambahan LiOH.H2O sebesar 5%.
Tabel 4.3. Tabulasi nilai wavenumber bahan aktif Li4Ti5O12 berdasarkan literature dengan penambahan LiOH.H2O sebesar A. 0% B. 2,5% C. 5% D. 7,5%
No Designated Wavenumber (cm)-1
A B C D
1 Ti-O stretching TiO6 [59] 547,18 544,39 538,35 553,07 2 Ti-O pada TiO2 rutile [59] 603,11 597,37 - 597,22 3 Symmetric stretching
vibration TiO6 octahedral [59]
635,49 641,52 647,26 641,37
4 C-O stretching [59] 1044,64 1053,58 1053,48 1053,48
5 AntiSymmetricstretching
vibration of CO32- anions [58] 1495,01 1439,08 1433,20 1495,01 1439,08 1495,01 1439,08 1483,24
6 Strong aSymmetric
stretching band COO- [58]
1636,30 1636,30 1636,30 1648,08
7 Adsorbed CO2 on surface of material [58]
- 1983,65 - 1986,70
8 C-N [59] 2498,77 2492,89 2498,77 2498,77
9 Broad stretching band of
OH- [58]
49
Pada wavenumber berkisar 590 sampai 605 cm-1 menandakan terdapat fasa
TiO2 rutile. Dapat dilihat pada Tabel 4.3 bahwa pada sampel A pick yang menandakan adanya fasa TiO2 rutile terlihat pada wavenumber berkisar 603,11, sampel B pick yang menandakan adanya fasa TiO2 rutile terlihat pada
wavenumber berkisar 597,37, sampel C pick yang menandakan adanya fasa TiO2 rutile tidak terbaca oleh alat FTIR, hal ini mengkonfirmasi hasil XRD bahwa sampel C (sintesis Li4Ti5O12 dengan penambahan LiOH.H2O sebesar 5%) memiliki fasa TiO2 rutile yang paling kecil. Dan sampel D pick yang menandakan adanya fasa TiO2 rutile terlihat pada wavenumber berkisar 597,22.
4.3 Analisa Morfologi Partikel dengan SEM
Proses identifikasi permukaan partikel bahan aktif dilakukan dengan menggunakan alat uji SEM dengan merek Hitachi tipe SU3500 di Pusat Penelitian
Fisika-LIPI. Alat ini membantu untuk mengetahui penampang dari partikel. Gambar 4.4. menunjukkan hasil foto SEM dari serbuk Li4Ti5O12 dengan variasi presentase penambahan LiOH.H2O. Pada semua foto sampel menunjukkan aglomerasi partikel yang jelas, beberapa partikel kecil yang berukuran rata-rata 1
mikrometer tetap bersama untuk membentuk satu partikel yang besar (material
50
(a) (b)
[image:62.595.105.526.109.556.2](c) (d)
Gambar 4.3. Penampang hasil SEM serbuk Li4Ti5O12 dengan perbesaran 10k SE dengan
penambahan LiOH.H2O sebesar (a) 0% (b) 2,5% (c) 5% (d) 7,5%
51
(a) (b)
[image:63.595.107.525.112.506.2](c) (d)
Gambar 4.4. Hasil Pengukuran Ukuran Partikel pada Hasil Gambar SEM dengan perbesaran 200X SE menggunakan Software Image-J Serbuk Li4Ti5O12 dengan
penambahan LiOH.H2O (a) 0% (b) 2,5% (c) 5 % , dan (d) 7,5%
Pengukuran ukuran partikel dari gambar SEM dengan perbesaran 200X
menggunakan bantuan software Image-J ditunjukkan pada Gambar 4.5. Perhitungan ukuran partikel dilakukan dengan mengambil 30 data sample dengan
variasi partikel besar, sedang dan kecil. Hasil pengukuran partikel dari analisis gambar SEM dengan menggunakan softwae Image-J ditunjukkan oleh Tabel 4.4. Perhitungan menunjukkan bahwa variasi penambahan LiOH.H2O tidak mempengaruhi ukuran partikel dengan rata-rata ukuran partikel 15 µm dan hasil perhitungan standar deviasi memiliki nilai yang cukup besar, ini menandakan
52
Tabel 4.4. Hasil pengukuran ukuran partikel dari analisa SEM dengan menggunakan
software Image-J dari Serbuk Li4Ti5O12 dengan penambahan LiOH.H2O (A) 0% (B) 2,5%
(C) 5% dan (D) 7,5%
A (µm) B (µm) C (µm) D (µm)
Nilai Maksimum
36,07285 63,43809 52,18982 67,167
Nilai Minimum
3,241022 1,261566 2,985411 0,56419
Nilai Rata-Rata
16,12726 16,94057 15,89155 15,7068
Standar Deviasi
8,423989 12,89895 11,31562 14,40913
4.4 Analisis Ukuran Partikel dengan PSA
[image:64.595.104.526.149.561.2]Analisa PSA pada masing-masing sampel serbuk Li4Ti5O12 diperlukan untuk mengetahui ukuran partikel dari tiap-tiap sampel serbuk.
Tabel 4.5. Ukuran Partikel Serbuk Li4Ti5O12 yang disintesis dengan melebihkan bahan
LiOH.H2O
Penambahan LiOH.H2O
Ukuran Partikel (µm)
0 % 26,46
2,5 % 32,93
5,0 % 25,29
7,5 % 33,13
Tabel 4.5. menunjukkan besar ukuran partikel yang diukur dengan
Particle Size Analyzer Merek Cilas (1190). Semakin banyak penambahan
LiOH.H2O maka ukuran partikel memiliki kecenderungan semakin besar, walaupun peningkatan ukuran partikel tersebut tidak terlalu signifikan. Ukuran partikel yang cenderung menjadi semakin besar ini disebabkan oleh meningkatnya
53
miling yang sama yaitu berkisar 15 jam. Tetapi semakin besar presentase penambahan LiOH.H2O, maka semakin besar jumlah massa total dari bahan baku yang di milling bersama. Mengacu bahwa proses ball-milling adalah merubah ukuran partikel menjadi berukuran berkisar mikrometer. Dengan demikian, semakin besar massa total dari bahan baku yang dimilling, maka semakin sedikit
bahan baku yang di hancurkan secara sempurna, sehingga ukuran partikel yang dihasilkan lebih besar.
Penambahan LiOH.H2O meningkatkan ukuran partikel namun tidak terlalu signifikan dan ukuran partikel cenderung homogen. Hal ini dapat dilihat dari
besarnya standar deviasi yang di dapat dari besar ukuran partikel pada tabel adalah 4,1593 dengan batas atas adalah 33,6118 serta batas bawah adalah 25,2932 maka dapat dinyatakan bahwa distribusi ukuran partikel dari tabel 4.5 bersifat
seragam karena masih dalam range batas atas dan batas bawah.
Bila dibandingkan dengan hasil perhitungan ukuran partikel dari analisa
gambar SEM, terlihat bahwa hasil perhitungan ukuran partikel dengan menggunakan alat uji PSA memiliki nilai yang lebih besar. Hal ini disebabkan karena partikel kecil larut dalam media pendispersan ketika melakukan proses
analisa PSA. Namun hasil yang diperoleh masih dalam batasan toleransi dari pengukuran dengan software Image-J seperti pada Tabel 4.4.
4.5 Analisa Surface Area dengan BET
Proses identifikasi ukuran surface area bahan aktif dilakukan dengan
54
Pusat Penelitian Fisika-LIPI. Alat ini membantu untuk mengetahui ukuran surface
[image:66.595.106.526.209.730.2]area dan besar pori-pori pada bahan aktif Li4Ti5O12.
Tabel 4.6. Besar surface area, pori-pori dan total volume pori partikel serbuk Li4Ti5O12
yang di sintesis dengan melebihkan bahan baku LiOH.H2O
Penambahan LiOH.H2O
Surface Area (m2/g) Pori-pori (nm) Total Volume pori (cc/g)
0% 11,081 1,79341 9,936 x 10-3
2,5% 2,129 4.32686 4,606 x 10-3
5% 21,783 1,57196 17,12 x 10-3
7,5% 3,919 3,90455 7,652 x 10-3
Besar surface area dipengaruhi oleh total volume pori. Semakin besar
total volume pori maka semakin besar pula ukuran surface areanya, dan
sebaliknya. Sampel dengan penambahan LiOH.H2O sebanyak 0% dan 5% memiliki type mikroporos sedangkan sample dengan penambahan LiOH.H2O 2,5% dan 7,5% memiliki type mesoporous [60].
(a) (b)
55
Gambar 4.5. Kurva Hysterisis hasil analisa surface area dengan alat uji BET dari Serbuk Li4Ti5O12 dengan penambahan LiOH.H2O (a) 0% (b) 2,5% (c) 5% dan (d) 7,5%
Bentuk pori dapat di ketahui dengan menganalisa kurva histerisis seperti pada Gambar 4.6. Garis merah pada kurva menunjukkan besar nilai adsorbsi dan
garis biru menunjukkan besar nilai desorbsi. Bila dilihat dalam gambar serbuk Li4Ti5O12 dengan penambahanan LiOH.H2O sebanyak 0% dan 5% memiliki bentuk kurva yang hampir sama. Sedangkan Li4Ti5O12 dengan penambahan LiOH.H20 sebanyak 2,5% dan 7,5% juga memiliki bentuk yang saling menyerupai. Bentuk kurva yang dimiliki oleh sampel (a) dan (c) menandakan
bahwa pori yang terbentuk pada serbuk Li4Ti5O12 adalah kerucut (conical) sedangkan pada sampel (b) dan (d) menandakan bahwa pori yang terbentuk pada serbuk Li4Ti5O12 adalah celah (slits


![Gambar 2.5. Hasil XRD dari sampel Li4Ti5O12 setelah diberi perlakuan panas 800oC [19]](https://thumb-ap.123doks.com/thumbv2/123dok/1135415.763273/26.595.101.524.179.537/gambar-hasil-xrd-sampel-li-diberi-perlakuan-panas.webp)