MEMBRAN,
imp
X, YANG TERLIBAT DALAM
PATOGENISITAS PADA
Xanthomonas axonopodis
pv.
glycines
ANY FITRIANI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Saya menyatakan dengan sebenar-benarnya bahwa segala pernyataan dalam disertasi
saya yang berjudul
ANALISIS GEN PENYANDI PROTEIN TERIKAT MEMBRAN , impX, YANG TERLIBAT DALAM PATOGENISITAS PADA Xanthomonas axonopodis pv. glycines
Merupakan hasil karya saya sendiri dengan arahan Komisi Pembimbing, dan bukan
hasil jiplakan atau tiruan dari tulisan siapapun. Disertasi ini belum pernah diajukan untuk
memperoleh gelar pada program sejenis di perguruan tinggi manapun
Semua data dan informasi yang digunakan telah dinyatakan secara jelas dan dapat
diperiksa kebenarannya.
Bogor, Februari 2007
Any Fitriani
patogenisitas pada Xanthomonas axonopodis pv. glycines. Dibimbing oleh Antonius Suwanto, Budi Tjahjono dan Aris Tri Wahyudi.
Xanthomonas axonopodis pv glycines (Xag) adalah bakteri penyebab penyakit pustul pada tanaman kedelai. Mutan non patogenik (Xag M715) telah dikonstruksi melalui mutagenesis transposon untuk mengetahui gen yang terlibat patogenisitas. Tujuan dari penelitian ini adalah untuk 1) mengisolasi gen/gen-gen yang terlibat patogenisitas pada Xag YR32, (2) mengkarakterisasi gen/gen-gen yang terlibat patogenisitas pada Xag YR32, (3) mempelajari struktur dan fungsi gen yang terlibat patogenisitas pada Xag YR32, (4) menentukan posisi penyisipan transposon pada Xag
M715.
DNA sekitar penyisipan Tn5 dari Xag YR32 diisolasi melalui inverse Polymerase Chain Reaction (IPCR). Analisis BLASTN dari urutan DNA memperlihatkan similaritas pada nukleotida yang terlibat patogenisitas pada Xanthomonas axonopodis pv citri
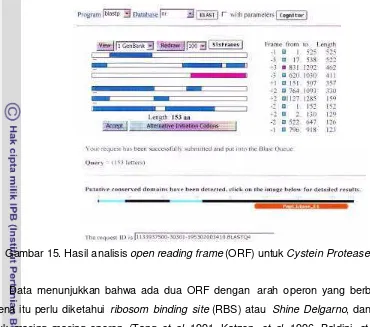
(GenBank accession No. NC003919) dengan identity 99%. BLASTX menunjukkan bahwa urutan nukleotida menyandikan inner membrane protein (imp) dan cystein protease (cp) (identity 90% dan 99%). Analisis Open Reading Frame (ORF) finder
menunjukkan dua arah transkripsi yang berlawanan dari gen impX dan cp. Putative
promoter, ribosom binding site (RBS), kodon awal dan akhir ditemukan pada gen impX.
Putative promoter, RBS, kodon awal dan akhir ditemukan pada gen cp. Analisis ini menunjukkan bahwa transposon menyisip pada C-terminal impX. Analisis fungsi protein menunjukkan sebagai putative ABC-ATPase, suatu protein transmembran, famili ABC transporter, termasuk kelompok ABC-A1 yang mengekspor molekul. Analisis menunjukkan bahwa transposon menyisip pada ATP-ase dari ABC-ATPase. Analisis transkrip pada Xag YR32 menunjukkan bahwa gen ditranskrip tetapi hanya terdeteksi sangat tipis pada Xag M715. Analisis hibridisasi Northern memperlihatkan bahwa gen
impX bersifat monosistronik dengan ukuran sekitar 546 bp. Introduksi impX ke dalam
Xag M715 dapat mengembalikan sifat patogen pada bioesai kotiledon kedelai. Xag
M715 menjadi patogen kembali. Sepuluh hari setelah infeksi, kotiledon yang terinfeksi oleh Xag YR32 menjadi coklat, sedangkan Xag M715 (pRP06) mencoklat pada 14 hari setelah infeksi. Analisis statistik menunjukkan bahwa fenotip Xag M715 berbeda dengan
Xag M715 (pRP06) dan fenotip Xag YR32 sama dengan Xag M715 (pRP06). Analisis awal ekspresi protein menunjukkan bahwa gen impX diekspresikan pada E. coli
BL21(DE3)pLysS. Fenotip non-patogenik dari Xag M715 disebabkan oleh penyisipan transposon pada ATP-ase dari ABC-ATPase transporter.
ABSTRACT
Any Fitriani. Analysis of a gene encoding transmembrane protein, impX, involved in pathogenicity in Xanthomonas axonopodis pv. glycines. Under supervision of Antonius Suwanto, Budi Tjahjono, and Aris Tri Wahyudi.
Xanthomonas axonopodis pv glycines (Xag) is the cause of bacterial pustule disease in soybean. A non pathogenic mutant (Xag M715) has been constructed by transposon mutagenesis to identify gene involved in pathogenicity. The objective of this study are (1) to isolate gene/genes involved pathogenicity in Xag YR32, (2) to characterize gene/genes involved pathogenicity in Xag YR32, (3) to study structure and function of gene involved pathogenicity in Xag YR32, (4) to determine position of transposon insertion in Xag M715.
DNA from Xag YR32 surrounding the Tn5 insertion (1,3 kb) was isolated employing inverse Polymerase Chain Reaction (IPCR). BLASTN analysis of the DNA sequence showed similarity to a region involved in pathogenicity of Xanthomonas axonopodis pv
citri (GenBank accession No. NC 003919) 99% identity. BLASTX showed the sequence encodes inner membrane protein (imp) and cystein protease (cp) (identity 90% and 99%, respectively). Open Reading Frame (ORF) finder analysis showed two opposite transcription direction of impX and cp genes. Putative promoter, ribosome binding site (RBS), start and stop codon, and stop transcription were found in impX. However, promoter, RBS, start and stop codon were found in cp. This analysis showed that the transposon was inserted in C-terminal portion of ImpX. Analysis of protein function indicated as putative ABC-ATPase. It is a transmembrane protein ABC transporter family, include in ABC-A1 type cluster that exported molecule. This analysis revealed that transposon was inserted in ATPase of ABC-ATPase. Transcript analysis in Xag
YR32 revealed that the gene was transcribed but could only be detected as a very thin in
Xag M715. Northern hybridization analysis showed that the gene is monocistronic of about 546 bp. Introduction of impX into Xag M715 could restore pathogenicity in soybean cotyledon assay, Xag M715 recovered to pathogenic. Ten days after infection, cotyledon infected by Xag YR32 were browning, meanwhile Xag M715(pRP06) were browning in 14-days after infection. Statistical analysis revealed that phenotype of Xag
M715 was different from Xag M715(pRP06) and phenotype of Xag YR32 was the same as Xag M715(pRP06). Preliminary protein expression of impX in E. coli showed that gene of impX was expressed in E. coli BL21(DE3)pLysS. Non pathogenic phenotype of
Xag M715 was caused by transposon insertion in ATPase of ABC-ATPase transporter.
MEMBRAN,
imp
X, YANG TERLIBAT DALAM
PATOGENISITAS PADA
Xanthomonas axonopodis
pv.
glycines
ANY FITRIANI
Disertasi sebagai salah satu syarat untuk memperoleh gelar Doktor
Pada Program Studi : Biologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Patogenisitas pada
Xanthomonas axonopodis pv glycines
Nama : Any Fitriani
NRP : G361020021
Program Studi : Biologi
Menyetujui,
Komisi Pembimbing
Ketua
Prof. Dr. Ir. Antonius Suwanto, M.Sc.
Anggota Anggota
Dr. Ir. Budi Tjahjono, M.Agr. Dr. Drs. Aris Tri Wahyudi, M.Si.
Mengetahui,
Ketua Program Studi Biologi Dekan Sekolah Pascasarjana
Dr. Ir. Dedy Duryadi Solihin, DEA Prof. Dr. Ir. Khairil. A. Notodiputro, MS.
Puji syukur penulis panjatkan kehadirat Allah SWT, atas rahmat dan hidayah Nya, penulis dapat menyelesaikan disertasi yang berjudul “Analisis Gen Penyandi Protein
Terikat Membran, impX, yang Terlibat dalam Patogenisitas pada Xanthomonas
axonopodis pv glycines”.
Pada kesempatan ini penulis mengucapkan terima kasih dan penghargaan yang
setinggi-tingginya kepada Prof. Dr. Ir. Antonius Suwanto, M.Sc. atas segala bimbingan
dan dedikasinya selama penulis melakukan penelitian di Laboratorium Research Center
Microbial Diversity (RCMD) dan penulisan disertasi. Atas kebaikan dan perhatian Beliau
yang tulus, penulis dapat melakukan sebagian penelitian di Laboratorium Research and
Development Charoen Phokpand Indonesia. Diskusi-diskusi yang menarik dan sarat
dengan ilmu, selalu Beliau tumpahkan dan tidak mengenal waktu. Banyak hal dari
Beliau yang dapat dijadikan teladan sebagai ilmuwan dan pendidik yang baik. Selama
menjadi bimbingan Beliau, penulis berkesempatan menjadi asisten praktikum
matakuliah Rekayasa Genetika Tahun 2004/2005, Tahun 2005/2006, dan Tahun
2006/2007 PS Bioteknologi, SPs IPB, pengajar pada Pokok Bahasan Bioteknologi
Mikroba pada matakuliah Prinsip-prinsip Bioteknologi (BIO-400) pada Tahun 2005/2006,
Departemen Biologi, IPB, Reviewer pada Majalah Biosains Hayati, November 2006.
Selain itu, penulis diminta untuk memberi Kuliah khusus pada matakuliah Kapita Selekta
Bioteknologi Program Studi Biologi, Program Pascasarjana ITB pada 6 November 2006.
Penulis sampaikan terima kasih dan penghargaan yang sebesar-besarnya untuk Dr.
Aris Tri Wahyudi, M.Si. atas pengarahan pada metode Inverse Polymerase Chain
Reaction (IPCR) dan segala masukan dalam diskusi selama penelitian dan penulisan
disertasi ini. Beliau juga selalu memberikan dukungan semangat selama penelitian.
Terima kasih kepada Dr. Ir. Budi Tjahjono, M.Agr. atas dukungan dan doa selama
proses penelitian berlangsung. Penulis tak lupa sampaikan rasa terima kasih pada
Bapak Dr. Muhammad Machmud, M.Sc., APU dari Balai Besar Penelitian dan
Pengembangan Bioteknologi dan Sumber Daya Genetik Pertanian, Departemen
Pertanian atas masukan dan penyempurnaan disertasi ini. Juga kepada Bapak Dr. Ir.
Giyanto, M.Si dari Departemen Proteksi Tanaman, Fakultas Pertanian IPB atas
masukan dan wawasan tentang ilmu yang dipelajari pada disertasi ini.
Ucapan terima kasih penulis sampaikan pada pengelola Beasiswa Program
Pendidikan Indonesia, atas ijin yang diberikan kepada penulis untuk mengikuti
pendidikan di program studi Biologi Sekolah Pascasarjana IPB. Ucapan terima kasih
juga penulis sampaikan kepada Dekan Sekolah Pascasarjana IPB, Ketua PS Biologi
SPs IPB atas perkenaan penulis melanjutkan pendidikan S3 di IPB.
Ucapan terima kasih penulis sampaikan kepada sahabat-sahabat, Dr. Yaya
Rukayadi, atas dorongan semangat yang tak henti-henti dan bantuan literatur yang sulit
diperoleh. Dr. Irawan Tan, atas dukungan dan persahabatan yang tulus. Juga kepada
teman-teman alumni RCMD, Dr. Andi Khaeruni R., Ir. Cecilia A. Semahu, M.Si., Dra.
Nurhasanah, M.Si, Ir. Dede Abdulrakhman, dan teman satu bimbingan di RCMD, Ir. Tati
Barus , M.P. dan Artini Pangastuti, SSi, M.Si. atas persahabatan yang tulus.
Kepada Mamah dan Bapak, penulis mengucapkan banyak terima kasih atas
dorongan moril dan doa selama menempuh pendidikan ini. Terima kasih yang tak
terhingga kepada suami tercinta, Taufik Mahpudin atas doa, kasih sayang, dukungan
moril dan materil, pengertian dan pengorbanannya selama penulis mengikuti program
S3 di IPB.
Kepada semua pihak yang telah membantu dan tak tersebutkan namanya, penulis
ucapkan terima kasih atas segala bantuannya. Semoga budi baik yang diberikan
diterima Allah SWT sebagai amal shaleh. Semoga disertasi ini menjadi sumbangan ilmu
yang bermanfaat. Amien.
Bogor, April 2007
Any Fitriani
RIWAYAT HIDUP
Penulis dilahirkan di Bandung, pada tanggal 2 Februari 1965 sebagai anak sulung
dari lima bersaudara dari pasangan Bapak Achmad Sumantri dan Ibu Emi Rustemi.
Penulis menyelesaikan pendidikan Sekolah Dasar hingga Sekolah Menengah Atas di
Bandung.
Pada tahun 1983 penulis diterima sebagai mahasiswa Biologi Institut Teknologi
Bandung (ITB) melalui jalur Proyek Perintis II. Pada tahun 1987 sampai dengan 1989,
penulis menjadi staf peneliti di Laboratorium Kultur Jaringan Tumbuhan dan Fitokimia,
Pusat Antar Universitas Ilmu Hayati, ITB. Pada tahun 1989 penulis lulus sebagai
Sarjana Biologi. Pada tahun 1989 sampai dengan 1991, penulis menjadi Kepala Bagian
Research and Development Plant Tissue Culture pada PT Purwasari Nusantara,
Yayasan Bunga Nusantara. Pada tahun 1995 penulis mendapat beasiswa Tim
Manajemen Program Doktor (TMPD) dari Departemen Pedidikan dan Kebudayaan RI,
diterima pada Program Studi Biologi, Program Pascasarjana ITB dan menamatkannya
pada tahun 1998. Pada tahun 2002 penulis mendapat beasiswa Pendidikan
Pascasarjana (BPPS) dari Departemen Pendidikan Nasional RI untuk melanjutkan
Program Doktor pada Program Studi Biologi, Sekolah Pascasarjana, Institut Pertanian
Bogor (IPB). Penulis bekerja sebagai staf pengajar Departemen Pendidikan Biologi,
Fakultas Pendidikan Matematika dan Ilmu Pengetahuan Alam, Universitas Pendidikan
Indonesia sejak tahun 1991.
Selama mengikuti Program Doktor, penulis berkesempatan menyajikan karya ilmiah
berjudul “Analysis of A Gene Involved in Pathogenicity of Xanthomonas axonopodis pv.
glycines” pada Pertemuan Ilmiah Tahunan Perhimpunan Mikrobiologi Indonesia (PIT
PERMI) 2006 di Solo, 26-27 Agustus 2006. Sebagian dari Disertasi ini akan
dipublikasikan pada Journal Microbiology Indonesia dengan judul “Evidence for a Link
Between Pathogenicity and the Role of Imp Bacterial Transport Effector Proteins in
Soybean Infection by Xanthomonas axonopodis pv glycines” (telah diterima untuk
xi
DAFTAR TABEL... xiii
DAFTAR GAMBAR... xiv
I. PENDAHULUAN 1.1 Latar Belakang ... 1
1.2 Tujuan dan Manfaat Penelitian... 3
II. TINJAUAN PUSTAKA 2.1 Mikroorganisme Penyebab Pustul Bakteri ... 4
2.2 Gejala dan Epidemiologi Pustul Bakteri ... 5
2.3 Patogenisitas pada Bakteri... 7
2.4 Mekanisme Patogenisitas pada Bakteri ... 8
2.5 Protein Membran Dalam (Inner Membrane Proteins)... 12
2.6 ATP Binding Cassette Transporter (ABC transporter)... 16
2.7 ATPase... 18
III. BAHAN DAN METODE 3.1 Waktu dan Tempat Penelitian ... 19
3.2 Bahan dan Alat 3.2.1 Galur-galur Bakteri dan Plasmid... 19
3.2.2 Media Tumbuh ... 20
3.3 Metodologi 3.3.1 Isolasi DNA Genom Total ... 20
3.3.2 Inverse Polymerase Chain Reaction (IPCR)... 21
3.3.3 Isolasi dan Pemurnian Hasil PCR dan Fragmen DNA dari Gel Agarosa... 21
3.3.4 Kloning Gen Patogenisitas ... 22
3.3.5 Isolasi DNA Plasmid ... 23
3.3.6 Sekuensing dan Analisis Sekuen DNA ... 23
3.3.7 Analisis Urutan Asam Amino ... 23
3.3.8 Isolasi RNA dan RT-PCR ... 24
3.3.9 Analisis Hibridisasi Northern ... 24
3.3.10 Uji Komplementasi... 26
3.3.11 Konjugasi Tiga Tetua ... 26
3.3.12 Bioesai Patogenisitas pada Kotiledon Kedelai ... 27
3.3.13 Kloning dan Ekspresi Gen impX... 27
3.3.14 Isolasi Protein... 28
3.3.15 Elektroforesis Protein dengan SDS-PAGE... 28
IV. HASIL DAN PEMBAHASAN 4.1 Inverse PCR... 29
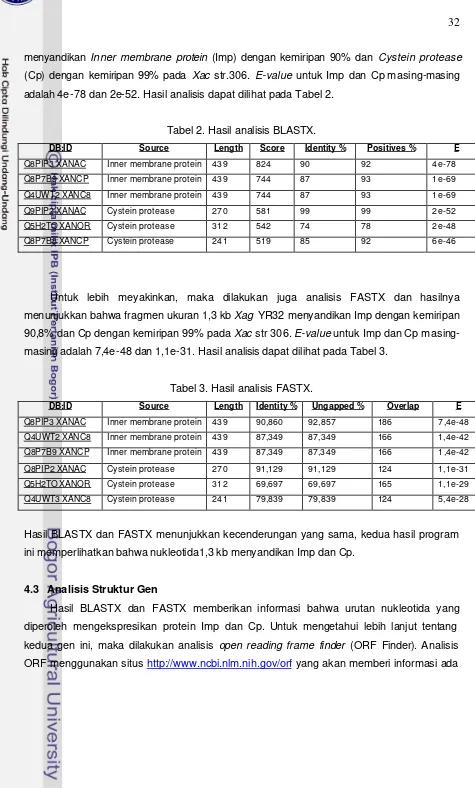
4.2 Analisis urutan DNA ... 30
4.3 Analisis Struktur Gen ... 32
4.4 Analisis Fungsi ImpX ... 39
4.5 Analisis RNA... 43
4.6 Uji Komplementasi ... 46
4.7 Bioesai Kotiledon ... 48
xii
4.9 Implikasi Hasil Penelitian dengan Penelitian Sebelumnya ... 59 4.10 Hipotesis Mekanisme Patogenisitas pada Xag... 60
V. KESIMPULAN
5.1 Kesimpulan ... 62 5.2 Saran... 62
Nomor Halaman
1 Galur-galur bakteri dan plasmid yang digunakan dalam
Penelitian ……… 19
2 Hasil analisis BLASTX ………. 32
3 Hasil analisis FASTX ……….. 32
4 Hasil pengujian patogenisitas dengan bioesai kotiledon ……… 48
5 Persentase gejala nekrosis pada kotiledon kedelai ……… 49
xiv
Nomor Halaman
1 Pustul bakteri pada kedelai ... 7
2 Skema prediksi lokasi subselular faktor virulen pada bakteri
Gram negatif dan Gram positif ... 10
3 Skematik lima jalur utama sistem sekresi... 11
4 Hipotesis model mekanisme molekuler aktivitas virulen dan
avirulen dari AvrBs3 dari Xanthomonas campestris pv vesicatoria 13
5 Beberapa tipe protein terikat membran lipid bilayer ... 15
6 Jalur target dan insersi protein membran pada E. coli …………. 16
7 Struktur skematik beberapa ABC transporter ... 18
8 Hidrolisis ATP ... 19
9 Elektroforesis gel agarosa DNA produk dari hasil inverse PCR .... 29
10 Elektroforesis gel agarosa DNA hasil verifikasi pFT3551 ... 30
11 Plasmid rekombinan pFT3551 ... 30
12 Hasil analisis BLASTN... 31
13 Hasil penyejajaran urutan nukleotida ukuran 1,3 kb
dengan database... 31
14 Hasil analisis ORF untuk Imp ... 33
15 Hasil analisis ORF untuk Cp ... 34
16 Struktur gen pada fragmen 1,3 kb dari
Xanthomonas axonopodis pv. glycines YR32... 35
17 Posisi situs restriksi pada fragmen 1,3 kb Xag YR32 ... 36
18 Hasil analisis ORF sekuen imps yang telah digabungkan ... 36
19 Urutan DNA dari struktur gen impX dan asam aminonya serta
xv
Nomor Halaman
20 Peta fisik gen imp, cp dan tonB-dependent receptor... 39
21 Karakter-karakter putative ABC-ATPase transporter ImpX
pada Xag YR32 ………. 41
22 Peta fisik putative ABC-ATPase transporter ImpX pada
Xag YR32 ... 42
23 Hasil elektroforesis sampel RNA total dari berbagai
Xanthomonas... 43
24 Elektroforesis gel agarosa DNA hasil RT-PCR
dari RNA total sampel... 44
25 Elektroforesis gel agarosa terdenaturasi RNA dan analisis
hibridisasi RNA Xag YR32 dan Xag M715... 46
26 Konstruksi plasmid pRP06 ... 47
27 Hasil verifikasi pRP06... 48
28 Diagram persentase gejala nekrosis pada kotiledon kedelai setelah diinfeksi beberapa galur bakteri ... 49
29 Hasil uji komplementasi... 50
30 Konstruksi plasmid pEG01 untuk ekspresi protein heterologous .. 57
31 Verifikasi hasil PCR impX dan verifikasi plasmid pEG01
dengan NdeI dan BamHI... 58
32 Hasil SDS-PAGE protein total ... 58
33 Uji patogenisitas Xag YR32 dan Xag M715 in planta ... 59
34 Hipotesis mekanisme patogenisitas pada Xag YR32 dan
I. PENDAHULUAN
1.1
Latar Belakang
Kedelai (Glycine max L. Merr.) merupakan salah satu bahan pangan yang
termasuk kategori kacang-kacangan dan menduduki lima besar sebagai pangan
dunia. Kedelai bagi industri pengolahan pangan di Indonesia banyak digunakan
sebagai bahan baku pembuatan tahu, tempe dan kecap. Jenis industri yang
tergolong skala kecil-menengah ini berada dalam jumlah yang sangat banyak
menyebabkan tingginya tingkat kebutuhan konsumsi kedelai yang mencapai lebih
dari 2.24 juta ton setiap tahunnya.
Produksi kedelai dunia tahun 2006 didominasi oleh Amerika Serikat (82,8 juta
ton/thn), Brazil (50,2 juta ton/thn), Argentina (38,3 juta ton/thn), China (16,9 juta
ton/thn), India (6,0 juta ton/thn), Paraguay (3,5 juta ton/thn), Canada (3,0 juta ton/thn)
dan Bolivia (1,7 juta ton/thn). Produksi Indonesia pada tahun 2006 hanya 0,749 juta
ton, sementara itu keperluan Nasional adalah 2,119 juta ton. Hal ini berarti
ketergantungan akan suplai kedelai impor sekitar 1,37 juta ton. Lonjakan impor
kedelai disebabkan peningkatan konsumsi produk industri dan impor kedelai
Indonesia menghabiskan devisa sebanyak 200-300 juta dollar Amerika Serikat
pertahun (Departemen Pertanian 2006).
Kandungan gizi kedelai sangat baik untuk nutrisi manusia. Komposis i kimia biji
kedelai terdiri atas 40% protein, 20% lemak atau minyak, 35% karbohidrat, dan 5
persen serat. Kandungan protein dalam biji kedelai sebagian besar terdiri atas asam
amino leusin. Kandungan lemak didominasi oleh lemak tak jenuh seperti asam
linolenat, asam linoleat dan asam oleat. Karbohidrat terdiri atas disakarida sukrosa
(2,5-8,2%), trisakarida raffinosa (0,1-1,0%), dan tetrasakarida stachyosa (1,4-4,1%).
Kedelai juga mengandung fitoestrogen berupa isoflavon yang dapat mencegah
terjadinya osteoporosis. Serat pada kedelai merupakan polisakarida seperti selulosa,
hemiselulosa, dan pektin. Begitu besarnya kontribusi kedelai dalam hal penyediaan
bahan pangan bergizi, kedelai dijuluki sebagai Gold from The Soil. Selain itu, karena
kandungan protein yang sangat baik sebagai bahan nutrisi manusia, juga kandungan
asam amino yang beragam, maka kedelai dijuluki sebagai World’s Miracle
(Soybean-Wikipedia, the free encyclopedia.htm).
Sampai saat ini, Indonesia adalah pengimpor potensial kedelai. Hal ini
kontradiktif dengan luasnya lahan potensial untuk pertanaman kedelai, karena
Indonesia merupakan negara ketiga terbesar dari sudut luas areal tanaman kedelai,
produksi kedelai selama 10 tahun terakhir lebih banyak sebagai kontribusi perluasan
areal tanam (73%) dan sisanya 27% berasal dari peningkatan produktivitas.
Meskipun setiap tahunnya terjadi peningkatan produksi kedelai nasional, tetapi tidak
dapat menyusul laju permintaan kedelai dalam negeri. Rendahnya produktivitas
tanaman kedelai disebabkan oleh beberapa faktor, diantaranya pengendalian hama
dan penyakit yang belum baik. Ada lima jenis penyakit utama kedelai yaitu, busuk
akar dan batang (Rhizoctonia solani), karat (Phakopsora pachyrhizi), kerdil kedelai
(Soybean Stunt Virus), bakteri hawar daun (Pseudomonas syringae pv. glycines),
dan pustul bakteri (Xanthomonas axonopodis pv. glycines) (Departemen Pertanian
2005).
Penyakit pustul bakteri termasuk salah satu penyebab rendahnya produktivitas
kedelai yang paling menentukan. Awal mula terjadinya infeksi, Xanthomonas
axonopodis pv glycines (Xag) masuk ke dalam ruang antar sel daun melalui angin
dan air. Xag melakukan kolonisasi dan mulai menunjukkan gejala pada 20-30 hari
setelah tanam. Gejala awal ditandai dengan adanya bercak hijau pada permukaan
atas dan bawah daun. Kemudian terbentuk penonjolan di bagian tengah bercak
permukaan bawah daun. Tonjolan ini akan membesar dan jaringan sekitarnya akan
mati. Pada saat terkena angin, jaringan yang mati akan terbawa dan akhirnya
berlubang (Hartman et al. 1999).
Penanganan penyakit pustul bakteri dapat dilakukan dengan beberapa cara,
diantaranya dengan rotasi tanaman atau tanaman dengan genotip resisten terhadap
penyakit ini. Selain itu, pengendalian penyakit ini dapat dilakukan dengan biokontrol.
Di Laboratorium kami, telah dilakukan penelitian tentang biokontrol penyakit pustul
bakteri yaitu Pseudomonas fluorescens B29 yang mampu berkompetisi dengan Xag.
Mekanisme kompetisi kedua jenis bakteri ini adalah karena kedua jenis bakteri
tersebut hidup menempati relung ekologi yang sama pada filosfer (Suwanto 1994a).
Selain itu, pengendalian penyakit dapat didekati dengan pemahaman
mekanisme patogenisitas. Penelitian yang mengarah ke mekanisme patogenisitas
pada Xag telah dilakukan, diantaranya oleh Rukayadi (1998), Akhdiya (2000), dan
Pratiwi (2004). Rukayadi (1998) telah mengkonstruksi peta genetik parsial dan
mengkarakterisasi sintasan epifitik mutan Xag M715 yang bersifat non patogenik.
Mutan Xag M715 dikonstruksi dari Xag YR32 tipe liar melalui mutagenesis dengan
transposon menggunakan pYR103. Pada pYR103 terdapat transposon komposit
miniTn5-KmR yang merupakan turunan dari Tn5 dengan penambahan gen resisten
trimetrophim (TpR). Hasil hibridisasi Southern menggunakan pelacak pYR103
berukuran 2,8 kb-EcoRI menunjukkan bahwa transposon menyisip pada potongan
melakukan pengujian in planta pada tanaman kedelai dan tomat dari isolat-isolat Xag
yaitu YR32 (tipe liar) dan M715 (mutan nonpatogenik). Hasilnya menunjukkan bahwa
YR32 bersifat patogen pada tanaman kedelai dan reaksi hipersensitif pada tomat
sedangkan M715 tidak menunjukkan sifat patogenisitas pada tanaman kedelai dan
reaksi hipersensitif pada tomat.
Akhdiya (2000) telah mengamplifikasi fragmen DNA pengapit transposon
berukuran 0,7 kb yang telah disisipkan pada pGEM-T Easy (pAA01) dengan
menggunakan primer Km-Tn903 dan M13F. Pratiwi (2004) telah mengidentifikasi
posisi penyisipan transposon pada mutan Xag M715 dengan menggunakan pAA01
sebagai pelacak. Fragmen DNA kemudian diurut nukleotidanya dan diperoleh urutan
DNA berukuran 1,8 kb. Berdasarkan analisis bioinformatikanya, terdapat tiga
kerangka, yaitu : (1) kerangka I ialah 68 nukelotida yang mirip dengan ujung
karboksil gen xcsN penyandi protein sistem sekresi tipe II pada Xanthomonas
axonopodis pv. citri str. 306, (2) kerangka II mirip dengan akhir sekuen AEO11699
atau gen penyandi protein sistem sekresi tipe II pada Xanthomonas axonopodis pv
citri str. 306., (3) kerangka III mirip dengan gen iroN penyandi TonB
dependent-receptor pada Xanthomonas axonopodis pv. citri str. 306.
Berdasarkan penelitian terakhir, belum ditemukan dengan jelas gen yang terlibat
dalam patogenisitas pada Xanthomonas axonopodis pv. glycines YR32, demikian
juga dengan posisi penyisipan transposon pada genom Xag M715. Oleh karena itu,
perlu dilakukan penelitian lebih lanjut mengenai mekanisme patogenisitas pada Xag.
1.2 Tujuan dan Manfaat Penelitian
Penelitian ini bertujuan untuk (1) mengisolasi gen/gen-gen yang terlibat
patogenisitas pada Xag YR32, (2) mengkarakterisasi gen/gen-gen yang terlibat
patogenisitas pada Xag YR32, (3) mempelajari struktur dan fungsi gen yang terlibat
patogenisitas pada Xag YR32, (4) menentukan posisi penyisipan transposon pada
Xag M715. Untuk mencapai tujuan-tujuan tersebut dilakukan serangkaian
eksperimen lain, yaitu : (1) mempelajari transkrip gen yang terlibat patogenisitas
pada Xag YR32 dan M715, (2) membuktikan gen yang terlibat patogenisitas melalui
uji komplementasi dan bioasai kotiledon, (3) mempelajari ekspresi heterologous gen
tersebut pada E.coli. Hasil penelitian ini diharapkan dapat memberi sumbangan
ilmiah tentang mekanisme patogenisitas pada Xag khususnya dan bakteri lain
II. TINJAUAN PUSTAKA
2.1 Mikroorganisme Penyebab Pustul Bakteri
Xanthomonas campestris pv. glycines merupakan bakteri penyebab penyakit
pustul pada tanaman kedelai (Moffet dan Croft 1983). Sinonimnya adalah Xanthomonas
campestris pv. phaseoli (Semangun 1991). Berdasarkan homologi DNA-DNA,
Xanthomonas campestris pv. glycines diusulkan namanya menjadi Xanthomonas
axonopodis pv. glycines (Vauterin 2000).
Morfologi sel Xag berbentuk batang, berukuran 0,5-0,9 x 1,4-2,4 µm, mempunyai
satu flagela polar dan bersifat Gram negatif. Pada medium Beef Infusion Agar koloninya
berwarna kuning pucat dan semakin lama akan menjadi kuning tua, berukuran kecil, dan
sirkuler dengan tepian yang halus. Bakteri ini sangat cepat menghidrolisis pati,
menghasilkan auksin, bakteriosin, dan eksopolisakarida (Sinclair dan Beckman 1989).
Sebagai anggota dari genus Xanthomonas, bakteri ini bersifat oksidatif, dan aerobik
obligat (Briyant et al. 1979). Sedangkan menurut Lelliot dan Stead (1987),
patovar-patovar X. campestris mempunyai sifat Gram negatif, katalase positif, pertumbuhan
terhambat oleh 0,02-0,1% TZC (triphenyl tetrazolium chloride), koloni berwarna kuning
madu pada medium kentang agar dekstrosa, dan melakukan respirasi aerobik.
Temperatur optimum pertumbuhan bakteri ini adalah berkisar 30-33oC, temperatur
maksimum 38oC dan temperatur minimum 10oC. Bakteri ini sangat sesuai untuk
berkembang dengan baik di daerah beriklim hangat (Kennedy dan Tachibana 1973).
Genom Xag terdiri atas kromosom dan dilaporkan beberapa spesies Xanthomonas
mengandung plasmid-plasmid kriptik (Kado 1992). Widjaya (1996) melaporkan bahwa
Xag YR32 mempunyai satu kromosom sirkuler dengan ukuran sekitar 5020 kilo pasang
basa (kb). Berdasarkan pada hasil analisis menggunakan pulse fieldgel electrophoresis
(PFGE), diketahui bahwa strain Xag YR32 memiliki plasmid indigenous yang berukuran
lebih dari 10,5 kb (Suwanto 1994b). Pada strain lain, Rosana et al. (1995) melaporkan
bahwa strain Xag 8ra mempunyai satu kromosom sirkuler dan diduga memiliki plasmid
endogenous. Sementara itu, pada strain Xag 333 dari Brazil diperoleh adanya dua
plasmid indigenous multikopi yang masing-masing berukuran sekitar 25 kb dan 1,7 kb
(Baldini 1999). Selanjutnya Sharma et al. (1994) melaporkan bahwa strain Xag yang
diisolasi dari tanaman kedelai dari Maharashtra, India, memiliki dua jenis plasmid kriptik
yang masing-masing ukuran 1,5 kb dan 25 kb. Genom X. campestris mengandung %
2.2 Gejala dan Epidemiologi Penyakit Pustul Bakteri
Penyakit pustul bakteri banyak terdapat di daerah yang beriklim lembab, hangat,
dan sering hujan, termasuk Indonesia. Di Indonesia, pustul bakteri termasuk salah satu
penyakit yang sangat merugikan petani kedelai. Serangan bakteri pustul mengakibatkan
perontokan daun lebih cepat (premature defoliation) dan penurunan ukuran dan jumlah
biji. Gejala awal penyakit ini ditandai munculnya bintik hijau pucat pada permukaan
daun, terutama permukaan bawah daun. Titik kuning akan terbentuk pada bagian
tengah bintik (Gambar 1). Pelukaan daun sering terjadi di daerah anak tulang daun
(vena) dan bintik akan bergabung dan membentuk luka den gan bentuk yang tidak
beraturan.
Berdasarkan epidemiologinya, pustul bakteri dibawa oleh angin atau hujan atau
tetesan air pantulan dari tanah. Penyakit dapat menyebar selama penanaman melalui
daun yang basah. Bakteri dapat masuk pada tanaman melalui bagian tanaman yang
terbuka seperti stomata atau luka. Iklim hangat dan seringnya hujan akan mempercepat
perkembangan penyakit.
Infeksi terjadi dan masuk ke ruang antar sel. Di dalam ruang antar sel, bakteri
memperbanyak diri dengan suplai nutrien berasal dari inang. Gejala penyakit timbul
setelah 20-30 hari setelah infeksi, hal ini ditandai dengan penonjolan kearah abaksial
dan adaksial daun. Gejala penyakit diikuti dengan penguningan daerah sekitar yang
terinfeksi. Gejala ini menunjukkan terjadinya kematian di sekitar sel daun yang terinfeksi.
Nekrosis akan semakin besar dan akhirnya terbentuk lubang.
Bakteri pustul dapat bertahan hidup selama 2,5 tahun dalam benih. Apabila benih
yang mengandung patogen tersebut ditanam, patogen akan aktif kembali, oleh karena
itu biji yang terinfeksi merupakan sumber inokulum atau sumber penularan yang sangat
penting bagi terjadinya epidemi penyakit pustul bakteri di lapangan. Satu biji terinfeksi
dalam seribu biji sehat, apabila ditanam dalam kondisi yang sesuai, sudah cukup
sebagai sumber terjadinya epidemi untuk patogen ini di lapangan (Agarwal dan Sinclair
1987).
Gambar 1. Pustul bakteri pada kedelai (Rukayadi 1998)
Keterangan : Gejala kuning pada permukaan bawah daun. Titik kuning terbentuk pada tengah bintik
Umumnya penyakit pustul bakteri sangat merugikan para petani kedelai di
Indonesia. Demikian juga di dunia, 40% hasil panen kedelai berkurang setiap tahunnya.
Pengendalian penyakit pustul bakteri dapat dilakukan dengan berbagai cara antara lain,
rotasi tanaman, termasuk metode yang efektif untuk menghindari inokulum yang berasal
dari tanaman kedelai sebelumnya. Di laboratorium kami, penelitian yang mengarah pada
pengendalian penyakit pustul bakteri dilakukan oleh Khaeruni (1998) yang melaporkan
bahwa aplikasi suspensi biokontrol yang disuplementasi dengan bakteri kitinolitik WS7b
dan fotosintetik anoksigenik MB7 sangat signifikan terhadap kesintasan P. fluorescent
B29, selain itu dapat menghambat populasi Xag endogen dan Xag YR32, menekan
populasi jamur filosfer, menghambat kecepatan penyakit, meningkatkan berat basah
2.3 Patogenisitas pada Bakteri
Patogenisitas merupakan kemampuan patogen untuk menimbulkan suatu penyakit
dengan melumpuhkan pertahanan inang, sedangkan virulensi adalah derajat
patogenisitas. Bakteri yang dapat menyebabkan penyakit mempunyai faktor-faktor
khusus sebagai faktor virulen. Faktor-faktor virulen berperan dalam mempertahankan
kesintasan bakteri pada lingkungan yang sangat ekstrim bagi mikrob tersebut, terutama
lingkungan endogen inang. Beberapa sinyal dapat mengontrol ekspresi faktor virulen,
misalnya kadar oksigen, temperatur, konsentrasi ion, dan pH (Pettersson et al. 1996).
Bakteri patogen melakukan beberapa strategi untuk dapat melumpuhkan inang,
diantaranya harus dapat masuk ke dalam inang, menembus pertahanan inang, dan
merusak sel inang. Bakteri patogen dapat masuk ke dalam inang melalui beberapa
portals of entry. Pada tanaman, bakteri patogen dapat masuk melalui stomata, hidatoda, atau luka. Bakteri patogen dapat menembus pertahanan inang melalui beberapa cara,
diantaranya dengan membentuk kapsul untuk mencegah fagositosis. Komponen dinding
sel berupa protein dinding sel sebagai fasilitas pencegahan fagositosis. Enzim -enzim
yang disekresikan oleh mikrob dapat membantu melumpuhkan pertahanan inang.
Bakteri patogen dapat merusak sel inang secara langsung dan tidak langsung. Sel inang
dirusak secara langsung oleh hasil metabolisme dan multiplikasi bakteri di dalam sel
inang. Selain itu, sel inang dirusak secara tidak langsung oleh toksin yang dihasilkan
bakteri, yaitu eksotoksin dan endotoksin (Wilson et al. 2002).
Toksin analogi dengan senjata biologi yang berupa molekul protein atau
nonprotein yang dihasilkan oleh bakteri untuk menghancurkan atau merusak sel inang.
Toksin nonprotein adalah lipopolisakarida (LPS) yang merupakan endotoksin pada
bakteri Gram negatif dan asam teikoat pada bakteri Gram positif. Toksin protein
umumnya adalah eksotoksin. Toksin ini adalah enzim yang dikirimkan ke sel eukariotik
dengan dua metode yang berbeda, yaitu : (1) sekresi ke dalam lingkungan sekitar atau
(2) langsung diinjeksikan ke sitoplasma sel inang melalui sistem sekresi tipe III atau
mekanisme lainnya. Eksotoksin bakteri dapat dikategorikan ke dalam tiga tipe
berdasarkan komposisi dan fungsi asam aminonya, yaitu : (1) toksin A-B, (2) toksin
proteolitik, dan (3) toksin pembentuk pori (pore forming toxin) (Wilson et al. 2002).
Beberapa spesies bakteri yang memproduksi toksin A-B diantaranya adalah
Pseudomonasaeruginosa, Escherichia coli, Vibrio cholerae. Toksin A-B mempunyai dua
bertanggung jawab atas pengikatan dan pengiriman toksin ke dalam sel inang. Toksin
proteolitik berperan dalam pemecahan protein inang menjadi gejala penyakit, contohnya
botulinum dari Clostridium botulinum. Target botulinum adalah synaptobrevin yang
mencegah pengeluaran neurotransmitter yang dapat menyebabkan paralysis. Botulinum
dapat mencerna synaptobrevin dan menyebabkan paralysis susunan saraf periferi.
Membrane-disrupting toxins ditemukan pada beberapa spesies bakteri dan membentuk
pori pada membran sel inang yang akhirnya sel menjadi lisis (Wilson et al. 2002). Toksin
pembentuk pori merupakan toksin yang mampu membentuk pori pada sel target yang
memfasilitasi masuknya toksin yang disekresikan, sebagai contoh Colicin pada E. coli
(Parker dan Feil 2004).
2.4 Mekanisme Patogenisitas pada Bakteri
Pada dasarnya gejala penyakit pada tanaman disebabkan oleh masuknya protein
tertentu atau toksin yang dihasilkan oleh patogen ke dalam sel inang. Masuknya protein
ini ke dalam sel tanaman menyebabkan dua fenomena. Pada tanaman yang rentan,
infeksi menyebabkan gejala dan dapat diikuti dengan kematian jaringan dan akhirnya
kematian tanaman (compatible interaction). Pada tanaman yang resisten atau tanaman
bukan inang akan terjadi reaksi hipersensitif yang ditandai dengan adanya nekrosis
pada area yang terinfeksi (incompatible interaction) (Wiggerich et al. 2000).
Selama kurun waktu dua dekade ini, penelitian yang mengarah ke mekanisme
patogenisitas pada bakteri terhadap tanaman ataupun hewan dan manusia sudah
banyak dilakukan. Penelitian-penelitian ini menghasilkan hipotesis-hipotesis tentang
mekanisme patogenisitas pada bakteri. Ada beberapa hipotesis yang menunjukkan jalur
sekresi protein pada bakteri Gram negatif. Hueck et al. (1998) menyatakan ada empat
tipe jalur sekresi, yaitu Type I sec -independent pathway (T1SS), Type III
sec-independent pathway (T3SS), serta Type II dan Type IV sec-dependent secretion
pathway (T2SS dan T4SS).
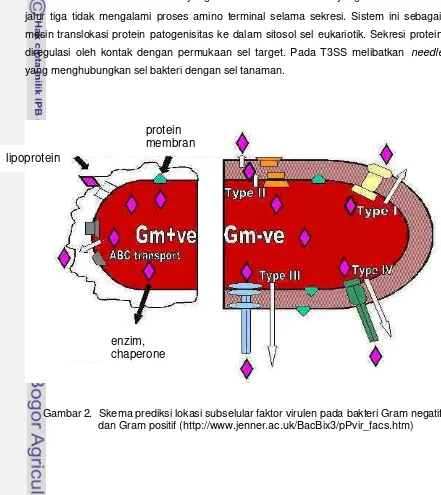
Gambar 2 menunjukkan bagan skematik sistem sekresi protein. Hueck et al.
(1998), Buttner & Bonas (2002) dan Noel et al. (2002) menyatakan bahwa sistem
sekresi tipe I (T1SS) serupa dengan tipe III (T3SS), yaitu tidak tergantung pada sistem
sekresi dan tidak melibatkan proses amino terminal dari protein yang disekresikan.
Beberapa T1SS ditunjukkan pada sistem sekresi alpha-hemolisin E. coli, adenilat siklase
oleh B. pertusis, leukotoksin oleh Pasteurella haemolytica, dan protease oleh P.
pada membran dalam suatu ATP-binding cassette protein (ABC protein), yang
menyediakan energi untuk sekresi protein. Protein membran luar yang mengeluarkan
protein melalui jalur sekresi. Membran fusi protein yang membantu protein
meninggalkan membran dalam dan menjangkau ruang periplasmik.
Paling sedikit piranti T3SS tersusun atas 20 protein, sebagian ada di membran
dalam dan memerlukan ATP-ase yang terikat membran. Protein yang disekresi melalui
jalur tiga tidak mengalami proses amino terminal selama sekresi. Sistem ini sebagai
mesin translokasi protein patogenisitas ke dalam sitosol sel eukariotik. Sekresi protein
diregulasi oleh kontak dengan permukaan sel target. Pada T3SS melibatkan needle
yang menghubungkan sel bakteri dengan sel tanaman.
Gambar 2. Skema prediksi lokasi subselular faktor virulen pada bakteri Gram negatif dan Gram positif (http://www.jenner.ac.uk/BacBix3/pPvir_facs.htm)
protein membran lipoprotein
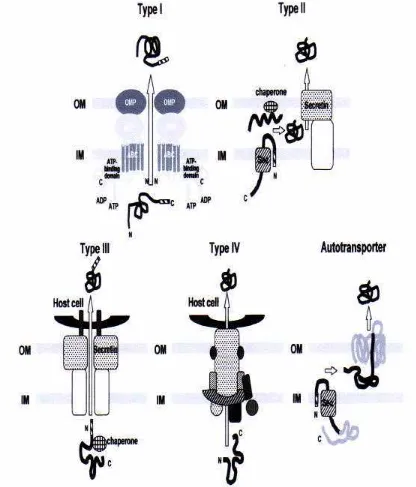
Gambar 3. Skematik lima jalur utama sistem sekresi.
Keterangan : ABC eksporter E. coli Hly (T1SS), jalur Xcp P. aeruginosa (T2SS), sistem Ysc untuk sekresi protein Yop pada Yersinia (T3SS), sistem VirB dan Cag A. tumefaciens dan H. pylori (T4SS), dan sekresi IgA1-protease pada
N.gonorrhoeae (autotransport er atau T5SS). IM, membran dalam; OM, Membrane luar; N, amino terminal; C, karboksil terminal (Omori dan Idei 2003)
Jalur T2SS dan T4SS melibatkan tahap yang terpisah dari transpor melalui
membran dalam ke membran luar. Protein yang dikeluarkan pada jalur ini ditandai
adanya 30 asam amino, terutama berupa signal sekuen amino terminal yang hidrofobik.
Signal sekuen membantu protein ke luar dan dipotong oleh signal peptidase yang ada di
periplasmik ketika protein mencapai periplasmik.
Jalur T4SS termasuk kelompok autotransporter, diantaranya immunoglobulin
gonococcal dan protease lain dari Helicobacter pylori. Pada jalur T4SS, protein
dikeluarkan dari sitoplasma melalui jalur sekresi dan terjadi pemotongan signal peptida
amino terminal.
Pada bakteri Gram positif, eksotoksin dikeluarkan melalui ABC transporter.
Desvaux et al. (2006) menyatakan bahwa T3SS terdapat juga pada bakteri Gram positif.
Hasil penelitian tersebut menunjukkan bahwa faktor virulen pada bakteri Gram positif
dikeluarkan melalui ABC transporter dan melalui T3SS.
Omori dan Idei (2003) mengemukakan bahwa sistem transport eksoprotein pada
bakteri Gram negatif melibatkan lima tipe. Autotransporter mempunyai kelompok
tersendiri, yaitu T5SS, seperti terlihat pada Gambar 3.
Eksotoksin di dalam sel tanaman dapat menyebabkan gejala penyakit atau hanya
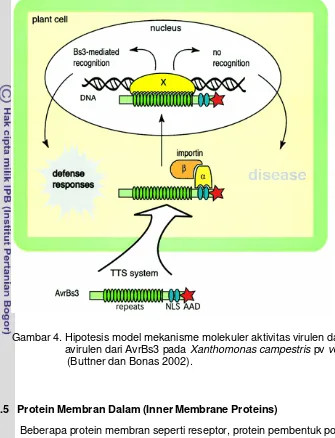
reaksi hipersensitif. Hal ini sangat tergantung dari genotip tanaman. Butner dan Bonas
(2002) mengemukakan hipotesis mekanisme terjadinya penyakit atau pertahanan pada
tanaman setelah diinfeksi oleh patogen seperti terlihat pada Gambar 4. Pada Gambar 4
dapat dijelaskan bahwa protein AvrBs3 mempunyai karakteristik 34 asam amino
berulang, dua karboksil terminal fungsional sebagai sinyal lokalisasi di inti (NLSs) dan
suatu acidic activation domain (AAD). AvrBs3 masuk ke dalam sel inang melalui T3SS. Di dalam sel tanaman, NLSs berikatan dengan importin α dan bersama-sama dengan
importin β menuju inti sel. Secara langsung maupun tidak langsung (melalui protein X)
interaksi antara AvrBs3 dengan DNA tanaman memulai untuk modulasi transkriptom
inang dan muncul gejala penyakit pada tanaman yang rentan. Pada tanaman yang
resisten respons pertahanan diinduksi pengenalan AvrBs3 protein R Bs3 (Butner dan
Gambar 4. Hipotesis model mekanisme molekuler aktivitas virulen dan avirulen dari AvrBs3 pada Xanthomonas campestris pv vesicatoria
(Buttner dan Bonas 2002).
2.5 Protein Membran Dalam (Inner Membrane Proteins)
Beberapa protein membran seperti reseptor, protein pembentuk pori, pompa ion,
pengangkut nutrien dan metabolit, protein fotosintetik dan protein transport determinan
virulen, dan toksin sangat penting untuk komunikasi sel dengan lingkungannya.
Protein-protein tersebut termasuk Protein-protein membran dalam atau inner membranproteins (IMPs).
Pada dasarnya IMPs merupakan protein transmembran atau protein integral yang
tertanam pada membran dalam bakteri Gram negatif atau Gram positif. Fungsi IMPs
pada bakteri Gram negatif sangat erat kaitannya dengan transportasi molekul dari dalam
sel (sitosol) menuju ke luar sel (lingkungan) vice versa. Selain itu, IMPs juga mempunyai
fungsi yang sama pada Gram positif, yaitu sebagai sarana transportasi molekul, tetapi
Karakteristik IMPs sangat unik untuk setiap jenis atau famili, sangat tergantung
pada fungsi dari protein itu pada sel. Alberts et al. (2002) menyatakan bahwa beberapa
membran protein melalui lipid bilayer, protein transmembran ini bersifat ampifatik,
mempunyai daerah hidrofobik dan daerah hidrofilik. Daerah hidrofobik melalui membran
dan berinteraksi dengan ekor hidrofobik di dalam molekul lipid di bagian dalam bilayer.
Bagian hidrofilik terdedah air pada satu atau sisi lain dari membran. Beberapa jenis
protein transmembran berdasarkan jenis dan bentuknya dapat dilihat pada Gambar 5.
Menurut Alberts et al. (2002), protein transmembran selalu mempunyai orientasi yang
unik pada membran yang menunjukkan model asimetris yang sangat tergantung pada
mekanisme sintesis dan menyisipnya protein tersebut pada lipid bilayer membran dan
perbedaan fungsi pada domain sitoplasmik atau nonsitoplasmik. Kedua domain ini
dipisahkan oleh rentang ikatan polipeptida yang berhubungan dengan daerah hidrofobik
lipid bilayer dan sebagian besar tersusun atas residu asam amino nonpolar.
Pemahaman tentang fungsi dan struktur IMPs perlu disertai dengan pemahaman
biogenesisnya. Sebagai bakteri model, penelitian biogenesis IMPs lebih fokus pada
Escherichia coli (E. coli),. Sementara itu, penelitian-penelitian serupa pada bakteri lain
belum pernah diteliti. Pada dasarnya IMPs berfungsi sebagai alat transportasi metabolit,
ion, gula, dan protein dari sel ke lingkungannya vice versa, dan protein yang ditranspor
berupa toksin atau protein virulen determinan yang terlibat dalam petogenisitas. Pada E.
coli, integrasi protein dapat terjadi melalui mekanisme Sec-dependent atau
Sec-independent. Mayoritas IMPs dibawa ke membran oleh signal recognition particle (SRP)
dan dibantu reseptor Fts Y yang menjadi media pembawa pada Sec-translocon. SRP E.
coli mempunyai homologi dengan SRP eukariot, tetapi komposisinya lebih sederhana.
Inti Sec-translocon terdiri atas komponen membran integral SecY, SecE, dan SecG,
yang membentuk suatu heterotrimer dan SecA suatu subunit perifer. Translocon,
sebagai suatu porus translokasi untuk protein sekretori dan IMPs. SecA adalah ATPase
yang berfungsi sebagai motor molekuler dan mengendalikan translokasi protein
Gambar 5. Beberapa tipe protein terikat membran lipid bilayer.
Keterangan : Sebagian besar protein transmembran terikat melintasi lipid sebagai (1) single α heliks, (2) multipel α heliks atau (3) β-sheet (β barrel). Beberapa protein single-pass dan multipass terikat secara kovalen pada ikatan asam lemak pada lipid-monolayer sitosol (1). Membran protein lain terdedah hanya pada satu sisi membrane. (4) beberapa terikat pada permukaan sitosol suatu α helix ampifatik ke dalam monolayer lipid bilayer sitosol melalui permukaan hidrofobik heliks. (5) Lainnya, terikat pada bilayer oleh ikatan kovalen dalam monolayer sitosol atau (6) melalui suatu ikatan oligosakarida pada fosfatidilinositol dalam monolayer nonsitosolik. (7,8) beberapa protein terikat pada membran hanya oleh interaksi nonkovalen dengan protein membran lain (Alberts et al. 2002).
Untuk memahami biogenesis IMPs pada E. coli, diperlukan beberapa
pengetahuan translokasi protein. Sebagian besar komponen melibatkan protein
translokasi membran dalam (IM) E. coli, yang disebut sekresi. Protein sekretori
dipelihara dalam suatu translocation-competent state oleh chaperon SecB. Preprotein
dikirimkan pada Sec translocon dan Sec translocon menjadi perantara translokasi
protein sekretori melewati IM. Inti dari Sec translocon terdiri atas protein membran
integral SecY, SecE, dan SecG, dan subunit perifer SecA. SecA terdiri atas dimer,
bersama-sama dengan SecYEG membentuk mesin proton motive force dan ATP-driven
sekresi protein lain yaitu jalur TAT. Preprotein yang ditransport oleh jalur TAT biasanya
mengikat kofaktor dan melipat sebelum translokasi melewati IM, sedangkan Sec hanya
dapat mengakomodasi ikatan peptida yang tidak melipat (Gambar 6) (de Gier dan
Luirink 2001).
Akhir-akhir ini telah dibuktikan bahwa IMPs YidC terlibat dalam penyusunan IMPs
Sec-translocase-dependent pada membran. Bukti menunjukkan bahwa YidC merupakan
bagian dari Sec -translocase dan terlibat dalam pelepasan sebagian IMPs transmembran
dari Sec-translocase ke dalam lapisan lipid bilayer. Selain itu, YidC terlibat juga dalam
penyusunan IMPs Sec-translocase-dependent dan Sec-translocase-independent
(Froderberg et al. 2003).
Gambar 6. Jalur target dan insersi protein membran pada E. coli.
2.6 ATP Binding Cassette Transporter (ABC Transporter)
Gen ABC transporter merupakan superfamili gen yang menyandikan protein ABC
transporter dan satu dari sebagian besar famili yang ada pada prokariot sampai dengan
manusia. ABC transporter adalah protein transmembran yang berfungsi untuk
transportasi berbagai substrat termasuk produk metabolit, lemak dan sterol, antibiotik,
protein seperti toksin, virulen determinan, gula, dan ion melintasi membran dalam dan
luar. Protein diklasifikasikan sebagai ABC transporter berdasarkan ATP-binding domain,
juga diketahui sebagai nucleotide-binding folds (NBFs) (Nikaido 2002).
Gen ABC transporter pertama kali diidentifikasi 30 tahun lalu pada prokariot.
Protein ini menggunakan energi hidrolisis ATP untuk transportasi beberapa substrat
melintasi membran sel. Pada eukariot, ABC transporter terutama mentranspor molekul
ke luar membran plasma atau ke dalam pada mitokondria, dan retikulum endoplasma.
Idealnya struktur suatu ABC transporter terdiri atas dua transmembran domain (TMs), masing-masing terdiri atas α-heliks yang melintasi fosfolipid bilayer beberapa
kali. Heliks ini membentuk multipas tiga sampai lima kali, antara TMs terdapat ligand
binding domain yang menghadap sisi ekstraseluler protein sebagai importer dan pada
sisi sitoplasmik sebagai eksporter. Protein ABC juga terdiri atas satu atau dua
ATP-binding domain(s), suatu nucleotide-binding folds (NBFs) dan terdapat pada membran
sisi sitoplasmik. ATP-binding domain terbagi menjadi dua motif, yaitu Walker A dan
Walker B yang dipisahkan oleh sekitar 90-120 asam amino. Motif lainnya adalah motif C
atau motif signature (LSGGQ) yang terdapat diantara Walker Motif A dan Walker Motif
B. Motif signature terdiri atas asam amino pendek dan sangat conserved (Nikaido 2002).
Pearson et al. (2004) menyatakan bahwa suatu ABC transporter mempunyai beberapa
kriteria, yaitu N-terminal tersusun atas asam amino hidrofobik, mempunyai tiga sampai
lima putative transmembran region, mempunyai signal peptida, C-terminal mempunyai
ABC ATP-ase Walker motif, Walker motif A (GXXGKT), Walker motif B (KXHD ), X
merupakan residu asam amino nonconserved, motif signature (LSGGQ), dan motif EAA
pada sistem impor ABC.
Menurut Saurin et al. (1998), berdasarkan fungsinya, protein ABC dikelompokan
menjadi dua kelompok besar yaitu ABC-A dan ABC-B. ABC-A berfungsi sebagai protein
ABC yang mengekspor molekul dari dalam sel ke luar sel, sedangkan ABC-B berfungsi
sebagai protein ABC yang mengimpor molekul dari luar sel ke dalam sel. ABC-A terbagi
menjadi ABC-A1 dan ABC-A2. ABC-A1 diantaranya mengekspor molekul protein,
terdapat pada prokariot dan eukariot. ABC-B juga terbagi menjadi ABC-B1 dan ABC-B2.
ABC-B1 diantaranya mengimpor ion besi siderophore dan metal, ion oligosakarida,
molybdenum, asam amino polar, glycine-betaine, nitrat, dan oligopeptida. ABC-B2
mengimpor antibiotik resisten, monosakarida-C, monosakarida-N. ABC-B hanya
dijumpai pada prokariot (Saurin et al. 1998).
ABC transporter dapat diklasifikasi menjadi half transporter atau full transporter.
Fulltransporter terdiri atas dua TMs dan NBFs. Half transporter hanya terdiri atas satu
TMs dan NBFs dan harus berkombinasi dengan half transporter lain agar dapat
berfungsi. Half transporter dapat membentuk homodimer jika dua ABC transporter
identik bersatu dan heterodimer jika dua ABC transporter tidak identik bersatu
(http://en.wikipedia.org/wiki). Ilustrasi dapat dilihat pada Gambar 7.
A B C
Gambar 7. Struktur skematik beberapa ABC transporter.
Keterangan : (A) Pada bakteri, beberapa transporter tersusun atas dua subunit transmembran (persegi) dan dua subunit ATPase (bulat). Jika suatu importer, diperlukan suatu subunit ke lima, suatu periplasmik-binding protein. (B) Pada beberapa transporter bakteria, dua domain ATPase berfusi menjadi protein tunggal. (C) Sebagian besar transporter pada jamur dan hewan, semua domain berfusi menjadi polipeptida tunggal (Nikaido 2002).
2.7 ATPase
ATPase merupakan salah satu kelas enzim yang mengkatalisasi penguraian
adenosine trifosfat (ATP) menjadi adenosine difosfat (ADP) dan ion fosfat bebas. Reaksi
defosforilasi akan melepaskan energi dan energi tersebut digunakan untuk
mengendalikan reaksi kimia lainnya. Secara luas, proses ini digunakan dalam semua
bentuk kehidupan (Gambar 8).
Transmembran ATPase mengimpor beberapa metabolit penting yang terlibat
metabolisme sel dan mengekspor toksin, sampah dan ion-ion yang dapat mengganggu
proses seluler. Suatu contoh penting adalah pertukaran ion Na+ dan K+ (atau Na+/K+
ATPase), yang menjadikan keseimbangan konsentrasi ionik dan memelihara potensial
sel. Contoh lain adalah hidrogen K+ ATPase (H+/K+ ATPase atau pompa proton
lambung) yang memelihara keasaman lambung.
Transmembran ATPase membentuk energi potensial kimia ATP karena terjadi
perpindahan metabolit yang melawan gradien konsentrasi. Pada model transpor ini
terjadi perpindahan metabolit dari konsentrasi rendah menuju konsentrasi tinggi. Proses
ini dikenal dengan transpor aktif (Alberts et al. 2000).
Gambar 8. Hidrolisis ATP.
III. BAHAN DAN METODE
3.1 Waktu dan Tempat Penelitian
Penelitian ini dilakukan sejak bulan Mei 2005 sampai dengan November 2006 di
Laboratorium Pusat Studi Keragaman Mikrob Fakultas Matematika dan Ilmu
Pengetahuan Alam, Baranangsiang Bogor, dan Research and Development Charoen
Phokphand Indonesia, Jakarta.
3.2 Bahan dan Alat
3.2.1 Galur-galur Bakteri dan Plasmid
Bakteri dan plasmid yang digunakan pada penelitian ini tercantum pada Tabel 1.
Tabel 1. Galur-galur bakteri dan plasmid yang digunakan dalam penelitian
Galur dan plasmid
Karakteristik Referensi
X.a.pv.glycines
(Xag) YR32
Tipe liar, Rif-R asal Muara-Bogor Rukayadi (1995)
Xag M715 KanR,Rif-Rpat- Rukayadi (1998)
X.c.pv campestris Tipe liar, Bogor Khaeruni (2005)
Escherichia coli
DH5 α
supE44rlacU169
(φ80lacZrM15)hsdR17recA1endA1gyrA96
thi -1relA1
Sambrook dan Russel (2001)
Escherichia coli
BL21(DE3)pLysS
F-ompThsdS(r
1-m1-)gal dcm(DE3)pLysS
(camR)
Novagen (2006)
Plasmid
pFT3551 ApR, amplikon hasil IPCR berukuran 1.3 kb (gen imps,cp) dari Xag YR32 diligasi dengan vektor pGEM-T Easy
Penelitian ini
pGOE12 ApR, amplikon hasil PCR gen imps berukuran 0,519 kb dari Xag YR32 diligasi dengan vektor pGEM-T Easy
Penelitian ini
pEG01 ApR, gen imps 0,519 kb diligasi pada situs
NdeI dan BamHI pada vektor pET15b
Penelitian ini
pRP06 TcR, gen imps,cps 1,3 kb diligasi pada situs
EcoRI pada vektor pRK415
Penelitian ini
pET15b ApR T7 cassette lacI rop Novagen (2006) pGEM-T Easy ApR, lacZ Promega (2005)
pRK415 TcR, kisaran inang luas Ditta et al. (1980) pRK2013 KmR, colE1 replikon, tra+ pada RK2, lacZ Ditta et al. (1980)
Pada penelitian ini digunakan isolat X.axonopodis pv.glycines YR32 sebagai
acuan untuk mempelajari mekanisme patogenisitas pada X. axonopodis pv glycines
YR32. Enzim yang digunakan untuk teknik molekuler antara lain EcoRV, EcoRI, NdeI,
BamHI, T4 DNA ligase (New England Biolabs (NEB) Inc., USA., Invitrogen USA), Taq
polimerase (New England Biolabs (NEB) USA, dan Finnzymes OY, Finland). Purifikasi
DNA (Wizard®SV Gel and PCR Clean-Up System, Promega, USA). Proteinase-K,
RNase dan lisozim dari Sigma Chemical Co, Australia.
Alat utama yang digunakan dalam penelitian ini adalah seperangkat piranti
elektroforesis mini gel (Bio-Rad Mini-Sub Cell GT, CA, USA), kamera Polaroid Hoefer’s
Photoman DS32 (Kodak), UV Transilluminator (Hoefer Scientific Instruments, San
Fransisco, USA), Microcentrifuge (SORVALL® Pico, USA), Automated DNA Sequencer
2720 Thermal Cycler (Applied Biosystems, USA), GeneAmp PCR system 2400 (Applied
Biosystems, USA), Gel Documentation (Herolab UVT, USA), seperangkat piranti
elektroforesis protein Miniprotean® (Bio-Rad Mini-Sub Cell GT, CA, USA),
Spektrofotometer U-2010 (Hitachi, Japan).
3.2.2 Media Tumbuh
Bakteri X. axonopodis pv glycines YR32 tipe liar maupun mutannya M715,
ditumbuhkan pada media Yeast Dextrose CaCO3 (YDC). Setiap liter medium YDC
mengandung ekstrak khamir 10 g, dekstrosa 5 gram, CaCO3 20 gram, agar-agar 15
gram dan air suling 1000 ml. Bakteri Xanthomonas diinkubasi pada suhu 28-30 oC
selama 24-48 jam, sedangkan Escherichia coli ditumbuhkan pada media Luria Bertani
(LB) (ekstrak khamir lima gram, triptone 10 gram, dan NaCl 10 gram, air suling 1000 ml)
pada suhu 37 oC selama 12-16 jam. Antibiotika yang ditambahkan pada media adalah
rifampisin (Rif) 100 µg/ml, ampisilin (Ap) 100 µg/ml, tetrasiklin (Tc) 15 µg/ml, kanamisin
(50 µg/ml), atau kloramfenikol (34 µg/ml).
3.3 Metodologi
3.3.1 Isolasi DNA Genom Total
Isolasi total DNA genom mengikuti metode Lazo et al. (1987). Sel Xag ditumbuhkan
selama semalam di dalam lima mililiter medium LB cair yang diinkubasi pada suhu 28oC,
dan dipanen dengan disentrifugasi pada kecepatan 12000 rpm selama empat menit.
Sentrifugasi dilakukan menggunakan Microcentrifuge (SORVALL® Pico, USA). Pelet
dicuci dengan satu mililiter buffer STE (100mM NaCl, 10mM Tris-HCl, satu mM EDTA
pH 8.0) kemudian diresuspensikan dan disentrifugasi pada kecepatan yang sama
disentrifugasi selama 12000 rpm selama empat menit. Setelah pelet diresuspensi
dengan 200 µl buffer STE dan ditambahkan 40 µl larutan SDS 10%, suspensi diinkubasi
pada suhu 65oC selama 30 menit kemudian didinginkan pada suhu ruang. Lisis sel
dilakukan dengan menambahkan empat µl 10 mg/ml Proteinase-K, lalu diinkubasi pada
suhu 37oC selama tiga jam. Setelah ditambah 200 µl buffer STE, suspensi diekstraksi
dengan larutan fenol dan kloroform sebanyak 250 µl, lalu dibolak balik secara perlahan
sampai terbentuk emulsi kemudian disentrifugasi 12000 rpm selama 10 menit. Tahap ini
dilakukan sebanyak lima kali. Supernatan ditambah kloroform sebanyak 200 µl dan
disentrifugasi 12000 rpm selama 10 menit. Tahap ini dilakukan dua kali. Supernatan
yang mengandung DNA dipindahkan ke tabung mikro steril dan dipresipitasi dengan
satu mililiter etanol 95% dingin. Benang-benang DNA dililit menggunakan ujung tip mikro
ukuran 200 µl, lalu dikeringudarakan. DNA disuspensikan dalam ddH20 yang
mengandung 10 µg/ml RNase. Setelah diinkubasi selama 10 menit pada suhu 65oC,
DNA disimpan pada suhu –20oC.
3.3.2 Inverse Polymerase Chain Reaction (IPCR)
Inverse PCR dilakukan sesuai dengan metode seperti yang diterangkan Wahyudi
et al. (2001). Primer didisain dari sekuen Pratiwi (2004) dengan urutan nukleotida P1 :
5’-ATCCTTGCCGCCATTGACCTG-3’ dan P2: 5’-CCACCGAACTTGAACTGGTC-3’.
PCR dilakukan dengan LA Taq polimerase (TaKaRa Bio Inc. Japan) dengan kondisi
prePCR pada suhu 94oC selama satu menit, denaturasi pada suhu 95oC selama dua
menit, penempelan primer pada suhu 62oC selama satu menit, sintesis pada suhu 72oC
selama satu menit, postPCR pada suhu 72oC selama 10 menit. PCR dilakukan
sebanyak 30 siklus.
3.3.3 Isolasi dan Pemurnian Hasil PCR dan Fragmen DNA dari Gel Agarosa
Fragmen DNA dengan ukuran yang sesuai diisolasi dari gel dengan metode
pemurnian DNA melalui sentrifugasi (Wizard SV Gel and PCR Clean-UP System,
Promega, USA). Gel sisipan dipotong-potong berbentuk kubus satu mm3, lalu
dimasukkan ke dalam tabung mikro steril. Kemudian pada tabung mikro tersebut
ditambahkan 10 µl Membrane Binding Solution per 10 mg gel, divortex dan diinkubasi
pada suhu 65oC sampai gel larut. SV Minicolumn dimasukkan ke dalam Collection Tube.
Campuran gel terlarut dipindahkan pada Minicolumn kemudian diinkubasi pada suhu
ruang selama satu menit. Campuran disentrifugasi pada 12000 rpm selama satu menit.
Cairan dibuang dan Minicolumn dimasukkan kembali ke Collection Tube. Untuk mencuci
disentrifugasi 12000 rpm selama satu menit. Cairan dibuang, dan Minicolumn
dimasukkan kembali ke dalam Collection Tube. Pencucian diulang kembali dengan
menambahkan 500 µl Membrane Wash Solution, lalu disentrifugasi 12000 rpm selama
lima menit. Minicolumn dipindahkan ke tabung mikro steril, kemudian ditambahkan 50 µl
ddH2O, diinkubasi pada suhu ruang selama satu menit. Hasil elusi disentrifugasi pada
12000 rpm selama satu menit, lalu disimpan pada –20 oC. Pemurnian hasil PCR
dilakukan sama dengan isolasi DNA dari gel, hanya Membrane Binding Solution
ditambahkan dengan volume yang sama dengan volume PCR.
3.3.4 Kloning Gen Patogenisitas
Hasil purifikasi DNA dari Inverse PCR diklon pada vektor pGEM-T Easy.
Campuran diligasi dan diinkubasi pada suhu 16oC selama semalam. Transformasi
dilakukan dengan terlebih dahulu menyiapkan sel kompeten. Sel E. coli DH5α
ditumbuhkan pada media LB pada suhu 37oC semalam. Lalu disubkultur dengan
memindahkan satu persen kultur E. coli pada medium LB dan diinkubasi selama tiga jam
pada 37oC. Sebanyak 1.5 mililiter kultur dimasukkan ke dalam tabung mikro steril,
kemudian disentrifugasi dengan kecepatan 6000 rpm selama dua menit. Pada pelet
ditambahkan satu mililiter NaCl dingin, kemudian diresuspensi dan diinkubasi selama 20
menit di atas es. Suspensi disentrifugasi dengan kecepatan 6000 rpm selama dua menit.
Dua ratus µl CaCl2-Tris dingin ditambahkan pada pelet dan diresuspensi, lalu diinkubasi
selama 30 menit di atas es. Setelah itu sel kompeten siap digunakan untuk transformasi.
Transformasi dilakukan dengan mencampurkan hasil ligasi ke dalam 200 µl sel
kompeten. Campuran tersebut kemudian diinkubasi di atas es selama 30 menit,
kemudian diinkubasi pada suhu 42oC selama 60 detik untuk proses heat –shock. Untuk
memulihkan kondisi fisiologi sel, campuran ditambahkan 250 µl medium LB cair dan
digoyang horisontal pada suhu 37oC selama satu jam. Seluruh campuran disentrifugasi
dengan kecepatan 6000 rpm selama dua menit. Pada pelet ditambahkan 200 µl medium
LB cair dan disuspensikan. Suspensi disebar pada medium selektif LA+(X-Gal 40 µg/ml)
dan antibiotika yang sesuai.
Koloni transforman yang tumbuh dan berwarna putih diambil untuk dilakukan
verifikasi plasmid. Untuk mengetahui ukuran DNA sisipan pada plasmid transforman,
3.3.5 Isolasi DNA Plasmid
Isolasi plasmid dilakukan dengan metode lisis alkalin (Sambrook dan Russel
2001). Lima mililiter kultur sel ditumbuhkan semalam, kemudian dipanen dengan
disentrifugasi pada kecepatan 6000 selama dua menit. Pelet disuspensi dengan 200 µl
1XTE yang mengandung 50 mM glukosa, kemudian diinkubasi di suhu ruang selama
lima menit. Kemudian ditambahkan 200 µl larutan 1%SDS dalam 0.2 M NaOH, dan
suspensi dibolak balik secara perlahan sampai terjadi lisis yang ditandai dengan
berubahnya larutan menjadi bening dan kental. Sebanyak 200 µl larutan Na-asetat (pH
4,8) ditambahkan dan di vortex, lalu diinkubasi selama 10 menit. Tabung mikro
disentrifugasi pada kecepatan 10000 rpm selama 10 menit. Supernatan diekstraksi
menggunakan fenol+kloroform+isoamilalkohol (25:24:1). Fase cair dipindahkan ke
tabung mikro steril lalu diendapkan dengan 2x volum etanol absolut dingin pada –20oC
selama 30 menit. Setelah disentrifugasi pada 10000 rpm selama 10 menit, DNA dicuci
dengan 70% (V/V) etanol dingin dan dikeringudarakan. DNA disuspensi dalam ddH2O
dan mengandung 10 µg/ml RNAse (Sigma Chemical Co., Australia). Setelah diinkubasi
pada suhu 37oC selama 30 menit, DNA disimpan pada suhu –20oC.
3.3.6 Sekuensing dan Analisis Sekuen DNA
Sekuensing DNA dilakukan dengan piranti DNA sequencer ABI PRISM
3100-AVANT Genetic Analyzer. DNA sisipan disekuen menggunakan primer universal
M13-Reverse dan M13-Forward . Sekuen DNA yang diperoleh dibandingkan dengan sekuen
DNA/protein yang ada di database European Bioinformatics Institute (EBI) BLASTX 2.0
pada situs http://www.ebi.ac.uk. Untuk mengetahui fungsi protein yang disandikan oleh gen tersebut dilakukan pelacakan dengan BLAST pada situs
http://www.ncbi.nlm.nih.gov. Analisis ORF juga dilakukan dengan akses
http://www.ncbi.nlm.nih.gov. Analisis promotor dilakukan dengan piranti lunak dari
www.softberry.com. Struktur gen diketahui dengan perunutan sekuen setelah diketahui kodon awal dan kodon akhir.
3.3.7 Analisis Urutan Asam Amino
Urutan asam amino ImpX dibandingkan dengan database European
Bioinformatics Institute (EBI) SWISS-MODEL REPOSITORY. Urutan asam amino
3.3.8 Isolasi RNA dan Reverse Transcriptase Polymerase Chain Reaction (RT-PCR)
RNA total diisolasi dari kultur cair Xag YR32 dan M715 setelah diinkubasi selama
28 jam (OD600= 0,7). RNA total diisolasi menggunakan Reagent TRIZOL ®
(Invitrogen,
USA). Kualitas RNA yang terisolasi diverifikasi dengan melarikannya pada gel
elektroforesis gel agarosa 1,5% terdenaturasi. Hasil elektroforesis diwarnai dengan 0,5
µM ethidium bromida. RNA dikuantifikasi dengan spektrofotometri pada 260 nm dan 280 nm. Sampel RNA total (5µg) dilakukan transkriptase terbalik oleh enzim reverse
transcriptase M-MuLV (ProtoScript First Strand cDNA Synthesis Kit, New England
Biolabs, Beverly, USA) dengan primer gen spesifik Reverse menggunakan metode
standard dalam volume reaksi 20 µl. cDNA diamplifikasi dengan PCR menggunakan
primer (imp-forward dan imp-reverse). Perancangan primer menggunakan Netprimer
Analysis Software dari PRIMER Biosoft International. PCR dilakukan pada kondisi
praPCR pada suhu 95oC selama tiga menit, denaturasi pada suhu 95oC selama satu
menit, penempelan primer pada suhu 62oC selama satu menit, sintesis pada suhu 72oC
selama satu menit dan postPCR pada suhu 72oC selama tujuh menit. PCR dilakukan
sebanyak 30 siklus. Amplikon dilarikan pada elektroforesis gel agarosa menggunakan
buffer TAE. 16S rDNA diamplifikasi dengan PCR menggunakan universal primer spesifik
prokaryot (63F dan 1387R). Amplifikasi 16S rDNA dilakukan pada kondisi prePCR pada
suhu 94oC selama lima menit, denaturasi pada suhu 94oC selama 30 detik, penempelan
pada suhu 55oC selama 30 detik, sintesis pada suhu 72oC selama satu menit, postPCR
pada suhu 72oC selama lima menit. PCR dilakukan sebanyak 30 siklus.
3.3.9 Analisis Hibridisasi Northern
Transfer RNA pada Membran Nilon. Gel yang berisikan RNA total dari Xag
YR32 dan Xag M715 (5 µg) dilarikan menggunakan elektroforesis pada gel agarosa 1%
terdenaturasi selama dua jam pada 65V. Gel kemudian diwarnai dengan µM ethidium
bromida 0,5 selama 15 menit dan divisualisasi menggunakan UV transilluminator. Gel
dicuci dengan DEPC-treated water, lalu direndam dalam 200 ml 0,05 N NaOH selama
10 menit. Gel dipindahkan ke dalam 200 ml 20xSSC (3,0 M NaCl ; 0,3 M Na-asetat) pH
7,0 selama 40 menit. Gel segera ditransfer pada membran nilon (Amersham
Life-Science, USA) semalam pada suhu ruang menggunakan larutan 20xSSC pH7,0 dengan
metode kapiler (Sambrook dan Russel 2001). Membran dicuci dalam 6xSSC pada suhu
ruang dengan agitasi selama 15 menit, lalu dikeringkan di atas kertas blotting
(Amersham Life-Science, USA), dilanjutkan dengan fiksasi nukleotida pada membran
Pelabelan Pelacak dan Deteksi Hibridisasi. DNA pelacak dilabel dengan menggunakan NEBlotTM PhototopeTM Kit (New England Biolab, Beverly, USA). Sebanyak
5 ng – 1 µg DNA hasil RT-PCR (375 bp) dalam 34 µl akuabides di dalam tabung mikro,
didenaturasi dalam air dengan pemanasan 100oC selama lima menit. Untuk menjaga
DNA tetap terdenaturasi, tabung mikro segera disimpan di atas es selama lima menit.
Tabung mikro disentrifugasi pada 5000 rpm selama 30 detik. Selanjutnya secara
berturut-turut ke dalam tabung ditambahkan 10 µl 5x mix labelling, lima µl mix dNTP,
dan satu µl fragmen Klenow. Tabung reaksi kemudian diinkubasi pada suhu 37oC
selama semalam. Reaksi dihentikan dengan menambahkan lima µl 0,2 M EDTA pH 8,0.
DNA dipurifikasi dengan NucTrap Probe Purification Column (Stratagen, USA). Pada
tabung mikro ditambahkan lima µl satu persen Tween 20 dan 15 µl 1 kali bufer STET
(0,1 M NaCl; 10 mMTris pH 8,0; satu mM EDTA pH 8,0; 5% Triton X-100). Kolom
dibasahi dengan 1x bufer STET sampai jenuh dan dikeluarkan dari kolom dengan
syringe. Sampel dimasukkan ke dalam kolom, lalu dikeluarkan dengan syringe. Untuk
mengeluarkan sisa-sisa DNA yang ada di dalam kolom, kolom dicuci dengan 1 kali
buffer STET dengan syringe. DNA yang diperoleh digunakan sebagai pelacak. DNA
pelacak disimpan pada suhu -20oC sebelum digunakan.
Membran diletakkan di dalam tabung hibridisasi, kemudian dimasukkan 10 ml
larutan hibridisasi yang berisi formamide lima mililiter, 50xDenhar