HIDROLISIS PATI GADUNG (Dioscorea hispida Dennst)
SECARA ENZIMATIS PADA PEMBUATAN SIRUP GLUKOSA
TESIS
Oleh
MEIYANNI ADAWIYAH SIREGAR 127051009/IPN
PROGRAM STUDI MAGISTER ILMU PANGAN
FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA
MEDAN
HIDROLISIS PATI GADUNG (Dioscorea hispida Dennst)
SECARA ENZIMATIS PADA PEMBUATAN SIRUP GLUKOSA
TESIS
Diajukan sebagai salah satu syarat untuk memperoleh
Gelar Magister Sains pada Program Studi Magister Ilmu Pangan di Fakultas Pertanian Universitas Sumatera Utara
Oleh
MEIYANNI ADAWIYAH SIREGAR 127051009/IPN
PROGRAM STUDI MAGISTER ILMU PANGAN
FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA
MEDAN
Judul Tesis : Hidrolisis Pati Gadung (Dioscorea hispida Dennst) Secara Enzimatis pada Pembuatan Sirup Glukosa Nama : Meiyanni Adawiyah Siregar
NIM : 127051009
Program Studi : Magister Ilmu Pangan
Menyetujui Komisi Pembimbing,
(Prof. Dr. Ir. Zulkifli Lubis, M.App.Sc) (Dr.Ir. Herla Rusmarilin, MP)
Ketua Anggota
Mengetahui :
Ketua Program Studi Dekan
(Dr. Ir. Elisa Julianti, M.Si) (Prof. Dr. Ir. Darma Bakti, MS)
PERNYATAAN
Dengan ini penulis menyatakan bahwa tesis dengan judul “Hidrolisis Pati
Gadung (Dioscorea hispida Dennts) Secara Enzimatis Pada Pembuatan Sirup
Glukosa” adalah benar merupakan gagasan dan hasil penelitian saya sendiri,
dibawah arahan komisi pembimbing. Semua data dan sumber informasi yang
digunakan dalam tesis ini telah dinyatakan secara jelas dan dicantumkan dalam
daftar pustaka dibagian akhir tesis serta dapat diperiksa kebenarannya.
Tesis ini juga belum pernah diajukan untuk memperoleh gelar pada
Program Studi sejenis di Perguruan Tinggi lain. Apabila di emudian hari
ditemukan seluruh atau sebagian tesis ini bukan hasil karya penulis sendiri atau
adanya plagiat dalam bagian-bagian tertentu, penulis bersedia menerima sanksi
pencabutan gelar akademik yang penulis sandang dan sanksi-sanksi lainnya sesuai
dengan peraturan perundangan yang berlaku.
Medan, April 2015
HIDROLISIS PATI GADUNG (Dioscorea hispida Dennst)
SECARA ENZIMATIS PADA PEMBUATAN SIRUP GLUKOSA
ABSTRAK
Beberapa jenis Dioscorea yang tumbuh di Indonesia belum dimanfaatkan secara maksimal, salah satunya umbi gadung. Gadung (Dioscorea hispida Dennst) adalah jenis umbi yang tumbuh liar di hutan dan tidak sulit mendapatkannya dan berpotensi dimanfaatkan sebagai sirup glukosa. Hidrolisis pati menjadi sirup glukosa dapat dilakukan dengan bantuan asam atau enzim. Pada proses hidrolisis untuk pembuatan sirup glukosa terdiri dari dua tahap, yaitu dengan likuifikasi dan sakarifikasi. Sirup glukosa adalah pemanis makanan dan minuman yang berbentuk cairan, tidak berbau dan tidak berwarna tetapi memiliki rasa manis. Penelitian ini bertujuan untuk mengetahui pengaruh pH dan waktu sakarifikasi terhadap sirup glukosa hasil hidrolisis enzimatis pati umbi gadung.
Penelitian ini dilaksanakan secara eksperimen dengan menggunakan rancangan acak lengkap (2 faktor 3 ulangan). Hasil penelitian menunjukkan bahwa pH 4, 5, 6 dan 7, waktu sakarifikasi 24, 36, 48, dan 60 jam dan interaksi pH dan sakarifikasi berpengaruh dengan rendemen, gula reduksi, dekstrosa equivalen, total padatan terlarut, dan viskositas sirup glukosa. pH yang paling optimal adalah 5, waktu sakarifikasi yang paling optimal adalah 48 jam dan interaksi terbaik adalah pH 5 dan waktu sakarifikasi 60 jam.
HYDROLYSIS OF STARCH GADUNG (Dioscorea hispida
Dennts) ENZYMATICALLY IN THE MANUFACTURE OF
GLUCOSE SYRUP
ABSTRACT
Some type of Dioscorea that grown in Indonesia have not been fully utilized, one tuber gadung. Gadung ( Dioscorea hispida Dennts) is a kind of tuber that grows wild int the woods and not difficult to get and potentially be used as glucose syrup. Hydrolysis of starch into glucose syrup can be done with acid or enzymes. In the hydrolysis process to make glucose syrup in composed of two phase, liquefaction and saccarification. Glucose syrup is sweetened foods and beverages in the form of a liquid, odorless, and colorless but has a sweet taste. This is study aim to determine the effect of pH and saccaharification time against enzymatic hydrolysis of glucose syrup yam tuber starch.
This study was conducated experimentally by using completely randomized design (2 factor 3 replications). The result showed that pH 4, 5, 6 and 7 and saccarification time 24, 36, 48 and 60 hours and interaction effect of pH and saccarification time to yield, reducing sugar, dextrose equivalent, total dissolved solids, and the viscosity of glucose syrup. The most optimal pH is 5, the most optimal saccarification time 48 hours and the best interaction is pH 5 and 60 hour saccarification time.
RIWAYAT HIDUP
Meiyanni Adawiyah Siregar dilahirkan di Padangsidempuan pada tanggal 18 Mei 1989. Anak sulung dari Ayahanda Husni Siregar, SH dan ibunda
Ummi Sutan Nasution.
Pada tahun 1995, penulis memasuki Sekolah Dasar Negeri 12
Padangsidempuan dan lulus pada tahun 2001. Kemudian, penulis memasuki
jenjang pendidikan SLTP yaitu di SMP Negeri 1 Padangsidempuan dan lulus pada
tahun 2004. Kemudian, penulis memasuki jenjang pendidikan SLTA yaitu di
SMA Negeri 2 Plus Sipirok dan lulus pada tahun 2007. Kemudian, penulis
melanjutkan ke jenjang Strata-1 dengan progam studi Teknologi Hasil Pertanian
di Universitas Riau dan lulus tahun 2012.
Setelah menyelesaikan Strata-1, penulis melanjutkan pendidikan ke
program Magister Ilmu Pangan Universitas Sumatera Utara Medan pada tahun
KATA PENGANTAR
Puji dan syukur penulis ucapkan kepada Tuhan Yang Maha Esa yang telah
memberikan berkat dan rahmat-Nya sehingga penulis dapat menyelesaikan tesis
yang berjudul “Hidrolisis Pati Gadung (Dioscorea Hispida Dennst) Secara
Enzimatis pada Pembuatan Sirup Glukosa”
Pada kesempatan ini penulis mengucapkan terima kasih kepada :
1. Bapak Prof. Dr. Ir. Zulkifli Lubis, M.App.Sc., sebagai ketua komisi
pembimbing dan Ibu Dr.Ir. Herla Rusmarilin, MP., sebagai anggota komisi
pembimbing yang telah memberi arahan dan bimbingan kepada penulis
terutama dalam penyelesaian tesis ini.
2. Ibu Dr. Ir. Elisa Julianti, M.Si., selaku ketua Jurusan Magister Ilmu Pangan
dan Ibu Era Yusraini, STP, M.Si., selaku sekretaris Jurusan Magister Ilmu
Pangan beserta seluruh staf pengajar dan pegawai di Jurusan Magister Ilmu
Pangan Universitas Sumatera Utara, atas bantuannya selama ini.
3. Kedua orang tua tercinta, nenek dan adik-adik yang telah memberikan
dukungan moril dan spiritual kepada penulis.
4. Teman, kakak dan adik di Jurusan Magister Ilmu Pangan, serta rekan-rekan
semua yang telah banyak membantu penulis dalam penyelesaian tesis ini.
Akhirnya, semoga tesis ini dapat bermanfaat bagi kita semua.
Medan, Februari 2015
DAFTAR ISI
Hal
JUDUL ... i
LEMBAR PERSETUJUAN TESIS ... ii
SURAT PERNYATAAN ... iii
Tanaman Umbi Gadung (Dioscorea hispida Dennst) ... 7
Komposisi Kimia Umbi Gadung ... 8
Faktor-Faktor yang Mempengaruhi Hidrolisa Pati Menjadi Glukosa .. 18
Mekanisme Kerja Enzim ... 19
Faktor-Faktor yang Mempengaruhi Aktivitas Enzim ... 20
Pembuatan Sirup Glukosa ... 22
Likuifikasi... 23
Sirup Gula ... 24
Pelaksanaan Penelitian ... 31
Pembuatan Pati dari Umbi Gadung (Dioscorea hispida Dennst) 31 Pembuatan Sirup Glukosa Secara Enzimatis ... 31
Pengamatan ... 32
Hasil Analisis Proksimat Pati Gadung (Dioscorea hispida Dennts) .... 41
Hasil Analisis Sirup Glukosa ... 42
Pengaruh pH dengan Parameter yang Diamati ... 43
Pengaruh Waktu Sakarifikasi dengan Parameter yang Diamati ... 44
DAFTAR TABEL
No. Judul Halaman
1. Produksi, Impor dan Konsumsi Gula ... 3
2. Komposisi Zat Gizi Umbi Gadung ... 9
3. Enzim-Enzim yang Banyak Digunakan di dalam Industri Pengolahan Pati (Hidrolisa) ... 15
4. Standar Mutu Sirup Glukosa ... 25
5. Syarat Mutu Sirup Glukosa ... 26
6. Nilai Kemanisan Relatif Sirup Glukosa dan Beberapa Pemanis Lainnya ... 26
7. Komposisi Kimia Pati Gadung ... 41
8. Pengaruh pH dengan Parameter yang Diamati ... 43
9. Pengaruh Waktu Sakarifikasi dengan Parameter yang Diamati ... 44
10.Uji LSR Pengaruh Intereaksi pH dan Sakarifikasi dengan Rendemen .. 48
11.Uji LSR Pengaruh Intereaksi pH dan Sakarifikasi dengan Gula Reduksi ... 53
12.Uji LSR Pengaruh Intereaksi pH dan Sakarifikasi dengan Dekstrosa Equivalen ... 60
13.Uji LSR Pengaruh Intereaksi pH dan Sakarifikasi dengan Total Padatan Terlarut ... 66
DAFTAR GAMBAR
No. Judul Halaman
1. Gadung ... 7
2. Reaksi Pembuatan Glukosa dari Hidrolisa Pati ... 20
3. Proses Pembuatan Pati Gadung (Dioscorea hispida Dennst) ... 39
4. Proses Pembuatan Sirup Glukosa ... 40
5. Pati Gadung ... 41
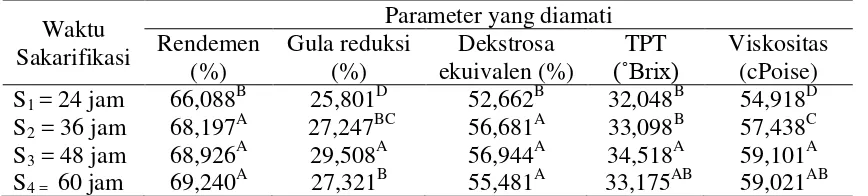
6. Grafik Hubungan pH (Derajat Keasaman) dengan Rendemen ... 45
7. Grafik Hubungan Waktu Sakarifikasi dengan Rendemen ... 47
8. Grafik Interaksi pH dan Waktu Sakarifikasi dengan Rendemen ... 49
9. Grafik Hubungan pH (Derajat Keasaman) dengan Gula Reduksi ... 50
10.Grafik Hubungan Waktu Sakarifikasi dengan Gula Reduksi ... 52
11.Grafik Interaksi pH dan Waktu Sakarifikasi dengan Gula Reduksi ... 54
12.Grafik Hubungan pH (Derajat Keasaman) dengan Dekstrosa Equivalen ... 56
13.Grafik Hubungan Waktu Sakarifikasi dengan Dekstrosa Equivalen ... 58
14.Grafik Interaksi pH dan Waktu Sakarifikasi dengan Dekstrosa Equivalen ... 60
15.Grafik Hubungan pH (Derajat Keasaman) dengan Total Padatan Terlarut ... 62
16.Grafik Hubungan Waktu Sakarifikasi dengan Total Padatan Terlarut .. 64
17.Grafik Interaksi pH dan Waktu Sakarifikasi dengan Total Padatan Terlarut ... 66
18.Grafik Hubungan pH (Derajat Keasaman) dengan Viskositas ... 68
DAFTAR LAMPIRAN
No. Judul Halaman
1. Daftar Sidik Ragam Rendemen ... 81
2. Uji LSR pH dan Waktu Sakarifikasi dengan Rendemen ... 82
3. Daftar Sidik Ragam Gula Reduksi ... 83
4. Uji LSR pH dan Waktu Sakarifikasi dengan Gula Reduksi ... 84
5. Daftar Sidik Ragam Dekstrosa Equivalen... 85
6. Uji LSR pH dan Waktu Sakarifikasi dengan Dekstrosa Equivalen ... 86
7. Daftar Sidik Ragam Total Padatan Terlarut ... 87
8. Uji LSR pH dan Waktu Sakarifikasi dengan Total Padatan Terlarut .... 88
9. Daftar Sidik Ragam Viskositas ... 89
10.Uji LSR pH dan Waktu Sakarifikasi dengan Viskositas ... 90
HIDROLISIS PATI GADUNG (Dioscorea hispida Dennst)
SECARA ENZIMATIS PADA PEMBUATAN SIRUP GLUKOSA
ABSTRAK
Beberapa jenis Dioscorea yang tumbuh di Indonesia belum dimanfaatkan secara maksimal, salah satunya umbi gadung. Gadung (Dioscorea hispida Dennst) adalah jenis umbi yang tumbuh liar di hutan dan tidak sulit mendapatkannya dan berpotensi dimanfaatkan sebagai sirup glukosa. Hidrolisis pati menjadi sirup glukosa dapat dilakukan dengan bantuan asam atau enzim. Pada proses hidrolisis untuk pembuatan sirup glukosa terdiri dari dua tahap, yaitu dengan likuifikasi dan sakarifikasi. Sirup glukosa adalah pemanis makanan dan minuman yang berbentuk cairan, tidak berbau dan tidak berwarna tetapi memiliki rasa manis. Penelitian ini bertujuan untuk mengetahui pengaruh pH dan waktu sakarifikasi terhadap sirup glukosa hasil hidrolisis enzimatis pati umbi gadung.
Penelitian ini dilaksanakan secara eksperimen dengan menggunakan rancangan acak lengkap (2 faktor 3 ulangan). Hasil penelitian menunjukkan bahwa pH 4, 5, 6 dan 7, waktu sakarifikasi 24, 36, 48, dan 60 jam dan interaksi pH dan sakarifikasi berpengaruh dengan rendemen, gula reduksi, dekstrosa equivalen, total padatan terlarut, dan viskositas sirup glukosa. pH yang paling optimal adalah 5, waktu sakarifikasi yang paling optimal adalah 48 jam dan interaksi terbaik adalah pH 5 dan waktu sakarifikasi 60 jam.
HYDROLYSIS OF STARCH GADUNG (Dioscorea hispida
Dennts) ENZYMATICALLY IN THE MANUFACTURE OF
GLUCOSE SYRUP
ABSTRACT
Some type of Dioscorea that grown in Indonesia have not been fully utilized, one tuber gadung. Gadung ( Dioscorea hispida Dennts) is a kind of tuber that grows wild int the woods and not difficult to get and potentially be used as glucose syrup. Hydrolysis of starch into glucose syrup can be done with acid or enzymes. In the hydrolysis process to make glucose syrup in composed of two phase, liquefaction and saccarification. Glucose syrup is sweetened foods and beverages in the form of a liquid, odorless, and colorless but has a sweet taste. This is study aim to determine the effect of pH and saccaharification time against enzymatic hydrolysis of glucose syrup yam tuber starch.
This study was conducated experimentally by using completely randomized design (2 factor 3 replications). The result showed that pH 4, 5, 6 and 7 and saccarification time 24, 36, 48 and 60 hours and interaction effect of pH and saccarification time to yield, reducing sugar, dextrose equivalent, total dissolved solids, and the viscosity of glucose syrup. The most optimal pH is 5, the most optimal saccarification time 48 hours and the best interaction is pH 5 and 60 hour saccarification time.
I. PENDAHULUAN
Latar Belakang
Gadung (Dioscorea hispida Dennst) adalah jenis umbi yang tumbuh liar
dihutan dan tidak begitu sulit mendapatkannya. Masa pertumbuhan tidak
membutuhkan perawatan dan penanganan khusus. Produktivitas umbi gadung
persatuan luas menurut Pambayun (2008) dapat mencapai lebih dari 40
ton/hektar/tahun jika dibudidaya secara intensif. Umbi gadung dikonsumsi
masyarakat Indonesia terutama di wilayah Maluku, Nusa Tenggara dan Sulawesi
dalam bentuk gaplek sebagai makanan pokok penganti beras atau sagu pada saat
paceklik (Surhaini dkk., 2009).
Beberapa jenis Dioscorea yang tumbuh di Indonesia belum dimanfaatkan
secara maksimal. Tingginya kadar karbohidrat ini menunjukkan potensi
Dioscorea sebagai bahan pangan alternatif. Menuurut Chung dkk., (2008) umbi
gadung memiliki kandungan karbohidrat sekitar 18% (bb), pati (75-84 bk),
protein, lipid, sebagian besar vitamin, dan kaya dengan mineral. Melihat
komposisi kimianya, gadung layak untuk dimanfaatkan menjadi berbagai produk
olahan sebagaimana jenis umbi lainnya. Akan tetapi, keterbatasan pemanfaatan
gadung adalah kandungan racun yang berupa sianida. Umbi gadung mengandung
asam sianida (HCN) yang sangat tinggi, yaitu 36,49 mg/100kg berat umbi,
sehingga diperlukan beberapa tahapan proses untuk menghilangkan racunnya
(Ekowati, 2007).
Untuk meningkatkan nilai tambah dari hasil pertanian perlu dilakukan
gadung, selama ini hanya dimanfaatkan untuk produk keripik dan tepung gadung.
Untuk mendapatkan nilai ekonomi yang lebih tinggi gadung berpotensi diolah
lebih lanjut menjadi sirup glukosa (Anamia dkk., 2004).
Salah satu kebutuhan pokok masyarakat dunia adalah gula. Gula
merupakan komoditi penting bagi masyarakat Indonesia. Kebutuhan akan gula
dari setiap Negara tidak hanya untuk memenuhi kebutuhan pokok, tetapi juga
karena gula merupakan bahan pemanis utama yang digunakan sebagai bahan baku
pada industri makanan dan minuman. Semakin meningkatnya kebutuhan dan
ketergantungan akan gula, produsen membuat berbagai jenis. Ada beberapa jenis
pemanis buatan yang sering digunakan seperti, sakarin, siklamat dan aspartam.
Bahan pemanis sintetis seperti sakarin dan natrium siklamat, tidak dapat
menggantikan gula secara keseluruhan, karena kualitas kemanisannya yang
cenderung menghasilkan rasa yang kurang enak (off-flavours) pada pemakaian
konsentrasi tinggi (Tjokroadikoesoemo, 1986). Penggunaan pemanis buatan
secara berlebihan juga dapat menyebabkan efek buruk pada kesehatan manusia
(Syakira, 2012).
Total konsumsi gula Indonesia mengalami kenaikan setiap tahunnya,
sehingga harus dipenuhi dengan impor. Ada banyak faktor yang menyebabkan
Indonesia menjadi Negara pengimpor gula. Salah satu faktor utamanya adalah
ketidakmampuan industri gula dalam negeri untuk memenuhi kebutuhan dan
permintaan gula masyarakat yang terus meningkat. Untuk mengatasi import gula
yang semakin meningkat dan penggunaan pemanis buatan dibutuhkan cara
alternatif untuk mengatasinya. Produksi, konsumsi dan import gula tahun
Tabel 1. Produksi, Impor dan Konsumsi Gula
Tahun Produksi (ton) Impor (ton) Konsumsi (ton)
2005 2.241.742 1.980.487 3.057.536
2006 2.307.027 1.405.942 3.760.000
2007 2.448.143 2.972.788 3.750.067
2008 2.668.429 983.944 3.508.000
2009 2.299.503 1.373.546 4.850.109
2010 2.214.489 2.300.089 4.289.000
2011 2.228.259 2.060.000 4.670.770
2012 2.591.687 2.350.000 5.200.000
2013 2.762.477 2.260.000 5.516.470
Sumber : Dewan Gula Indonesia, 2013
Pada tahun 2010-2013 total produksi gula Indonesia mengalami kenaikan
yang diikuti dengan naiknya tingkat konsumsi gula masyarakat. Kebutuhan gula
nasional yang terus meningkat tersebut telah menyebabkan terjadinya defisit
produksi setiap tahunnya, sehingga harus dipenuhi oleh impor. Indonesia yang
beriklim tropis memiliki banyak sumber daya alam nabati yang berpotensi untuk
diolah menjadi gula. Produksi gula tidak hanya dari tebu, tetapi dapat berasal dari
umbi-umbian. Alternatif yang dapat membantu penyediaan gula di Indonesia
adalah membuat sirup glukosa (gula cair) dari pati umbi-umbian. Salah satu
potensi umbi yang dapat dijadikan sirup glukosa adalah umbi gadung (Dioscorea
hispida Dennst).
Sirup glukosa adalah pemanis makanan dan minuman yang berbentuk
cairan, tidak berbau dan tidak berwarna tetapi memiliki rasa manis yang tinggi
(Hidayat, 2006). Hidrolisis pati menjadi sirup glukosa dapat dilakukan dengan
bantuan asam atau enzim pada waktu, suhu dan pH tertentu (Chalpin dan Bucke,
1990). Pada proses hidrolisis untuk pembuatan sirup glukosa terdiri dari dua
tahap, yaitu dengan likuifikasi dan sakarifikasi (Judoamidjojo, 1990).
Likuifikasi merupakan proses hidrolisis pati menjadi molekul-molekul
sedangkan sakarifikasi merupakan proses hidrolisis lanjut, dimana maltodekstrin
sebagai hasil dari tahap likuifikasi dihidrolisis lebih lanjut menjadi glukosa oleh
enzim tunggal maupun enzim campuran. Proses likuifikasi berlangsung pada pH
5,5, suhu 85˚C waktu 40 menit, perbandingan pati dan enzim amilase 1: 0,002
(Othmer, 1976). Proses sakarifikasi berlangsung pada pH 4,5, suhu 60˚C, waktu
reaksi 48-96 jam, dan penambahan enzim glukoamilase 0,5–1,1% (Coney, 1979).
Kedua tahapan ini dipengaruhi oleh beberapa faktor diantaranya adalah
konsentrasi enzim, lamanya proses tahapan, pH, suhu dan konsentrasi pati
(Rochmawatin, 2010).
Enzim bekerja secara spesifik, maka dapat diharapkan bahwa kandungan
bahan penyusun sirup yang dihasilkan dapat di atur perbandingannya sesuai
dengan spesifikasi yang telah ditetapkan. Sejak ditemukan cara hidrolisis pati
menjadi bahan yang lebih manis oleh Kirchoff, banyak usaha yang telah
dilakukan orang untuk lebih meningkatkan rasa manis dari produk hidrolisis
tersebut (Sukardati dan Wahyu, 2001). Amilase (α, β dan glukoamilase)
merupakan enzim yang penting dalam bidang pangan dan bioteknologi. Oleh
karena itu, hidrolisis pati dari umbi gadung untuk menjadi sirup glukosa pada
penelitian ini akan menggunakan enzim amilase dan glukoamilase. Faktor-faktor
yang mempengaruhi hidrolisis secara enzimatis diantaranya adalah konsentrasi
enzim, lama hidrolisis, suhu, pH, dan inhibitor (Poedjiadi, 1994).
Industri makanan dan minuman memiliki kecenderungan untuk
menggunakan sirup glukosa. Hal ini didasari oleh beberapa kelebihan sirup
glukosa dibandingkan sukrosa, diantaranya sirup glukosa tidak mengkristal seperti
digunakan dalam industri permen, selai dan pengalengan buah-buahan (Hidayat
dan Ikarisztiana, 2004).
Berdasarkan kandungan pati umbi gadung (Dioscorea hispida Dennst)
yang tinggi maka pati umbi gadung berpotensi dimanfaatkan sebagai sirup
glukosa. Oleh karena itu, penelitian ini dimaksud untuk menggali dan
mengembangkan potensi umbi gadung sebagai sirup glukosa yang di produksi
secara enzimatis.
Tujuan Penelitian
Tujuan penelitian ini adalah untuk mengetahui pengaruh pH dan waktu
sakarifikasi terhadap sirup glukosa hasil hidrolisis enzimatis pati umbi gadung
(Dioscorea hispida Dennst) serta mengetahui karakteristik mutu sirup glukosa
hasil hidrolisis enzimatis pati gadung (Dioscorea hispida Dennst) sesuai Standar
Nasional Indonesia (SNI).
HipotesisPenelitian
Hipotesis dari penelitian ini adalah sebagai berikut:
1. pH sakarifikasi pati umbi gadung (Dioscorea hispida Dennst) secara
enzimatis memberi pengaruh terhadap karakteristik mutu sirup glukosa
yang dihasilkan.
2. Waktu sakarifikasi pati umbi gadung (Dioscorea hispida Dennst) secara
enzimatis memberi pengaruh terhadap karakteristik mutu sirup glukosa
3. Interaksi pH dan waktu sakarifikasi pati umbi gadung (Dioscorea hispida
Dennst) secara enzimatis memberi pengaruh terhadap karakteristik mutu
sirup glukosa yang dihasilkan.
Manfaat Penelitian
Manfaat penelitian ini adalah sebagai berikut:
1. Dapat memberikan informasi akan penggunaan umbi gadung (Dioscorea
hispida Dennst) menjadi sirup glukosa melalui proses hidrolisis enzimatis.
2. Dapat memberikan informasi tentang karakteristik mutu sirup glukosa dari
pati umbi gadung (Dioscorea hispida Dennst) secara enzimatis dengan
perlakuan pH dan waktu sakarifikasi.
3. Bagi masyarakat, rancangan penelitian ini diharapkan menambah
pengetahuan tentang pembuatan sirup glukosa dari pati umbi-umbian
sehingga dapat memberikan tambahan pengetahuan tentang bahan alami
TINJAUAN PUSTAKA
Tanaman Gadung (Dioscorea hispida Dennst)
Tanaman berumbi adalah salah satu kekayaan nabati di alam kita,
diantaranya adalah gadung. Gadung merupakan salah satu jenis umbi-umbian
yang tergolong dalam famili Dioscoreaceae. Tanaman gadung berasal dari India
bagian barat, kemudian menyebar luas ke Asia Tenggara (Ndaru, 2011).
Taksonomi umbi gadung sebagai berikut (Anonim, 2014).
Kingdom : Plantae
Divisi : Magnoliophyta
Kelas : Liliopsida
Ordo : Dioscoreales
Famili : Dioscoreaceae
Genus : Dioscorea
Spesies : Dioscore hispida Dennts
Jenis umbi ini di Indonesia dikenal dengan beberapa nama daerah yaitu
gadung, sekapa, ubi hutan, bitule, bati, kasimun, janeng dan lain-lainnya.
Tanaman Gadung merupakan perdu yang tumbuh menjalar, tingginya dapat
mencapai 5-10 m. Batangnya bulat, berbentuk galah, berbulu, dan berduri yang
tersebar sepanjang batang dan tangkai daun. Umbinya bulat diliputi rambut akar
yang besar dan kaku. Kulit umbi berwarna gading atau coklat muda, daging
umbinya berwarna putih atau kuning. Umbinya muncul dekat permukaan tanah.
Dapat dibedakan dari jenis-jenis Dioscorea lainnya karena daunnya merupakan
daun majemuk (Kasno dkk., 2002).
Berdasarkan warna daging umbinya, gadung dapat dikelompokkan
menjadi 2, yaitu gadung putih dan kuning. Gadung kuning umumnya lebih besar
dan padat umbinya bila dibandingkan gadung putih. Umbi gadung merupakan
salah satu jenis tanamanan umbi-umbian yang tumbuh liar dihutan, pekarangan
maupun perkebunan. Pada umumnya umbi gadung dapat dimanfaatkan sebagai
bahan pangan, namun karena tanaman ini mengandung racun seperti dioscorin dan
HCN maka gadung masih belum banyak dimanfaatkan oleh masyarakat (Rosmeri
dan Monica, 2013).
Gadung adalah umbi jenis yang dapat tumbuh baik pada disemua tempat
yang mempunyai suhu tropis. Berat umbi antara 5-10 kg/umbi, dapat mencapai 60
kg. Gadung dipanen usia 6-12 bulan, ditandai pertumbuhan daun berkurang,
warna daun mulai menguning, dan banyak daun rontok (Kasno dkk., 2002).
Komposisi Kimia Umbi Gadung
Indonesia merupakan daerah tropis, sehingga banyak tumbuh tanaman
digunakan sebagai alternatif sumber karbohidrat dan merupakan komoditi yang
mempunyai prospek yang sangat baik, salah satunya umbi jenis Dioscorea
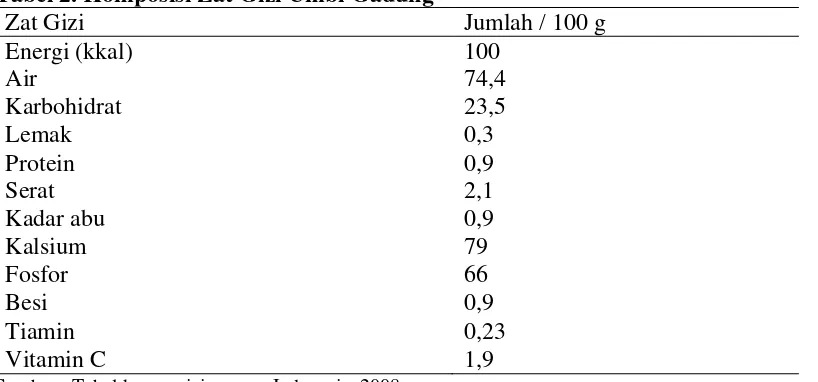
(Oesman dkk., 2009). Komposisi zat gizi umbi gadungdapat dilihat pada Tabel 2.
Tabel 2. Komposisi Zat Gizi Umbi Gadung
Zat Gizi Jumlah / 100 g
Sumber : Tabel komposisi pangan Indonesia, 2008
Dari tabel dapat diketahui bahwa karbohidrat memiliki kandungan 23,5 g,
lemak 0,3 g, protein 0,9 g, serat 2,1 g dan beberapa kandungan lainnya.
Sedangkan menuurut Chung dkkl., (2008) umbi gadung memiliki kandungan
karbohidrat sekitar 18% (bb), pati (75-84 bk), protein, lipid, sebagian besar
vitamin, dan kaya dengan mineral. Melihat komposisi kimianya, gadung layak
untuk dimanfaatkan menjadi berbagai produk olahan sebagaimana jenis umbi
lainnya. Akan tetapi, keterbatasan pemanfaatan gadung adalah kandungan racun
yang berupa sianida. Umbi gadung mengandung asam sianida (HCN) yang sangat
tinggi, yaitu 36,49 mg/kg berat umbi, sehingga diperlukan beberapa proses untuk
menghilangkan racunnya (Ekowati, 2007).
Salah satu alternatif pengolahan umbi gadung adalah mengolahnya
menjadi tepung atau pati sehingga kadar sianida aman dikonsumsi. Hal ini karena
2012). Racun ini bila terkonsumsi dalam kadar rendah dapat menyebabkan pusing
(Rukmana, 2001). Tubuh manusia dapat menerima HCN jika mengkonsumsi
dalam batas yang dianjurkan. FAO dalam Harijono dkk., (2009) menyatakan
untuk umbi-umbian dengan kadar maksimal 50mg/kg. Tepung umbi gadung
memiliki beberapa kelebihan dibandingkan dengan tepung dari umbi-umbi
lainnya, yaitu memiliki kandungan amilosa yang tinggi dan teksturnya yang
lembut (Guranatne dan Hoover, 2002).
Prinsip dasar metode detoksifikasi sianida pada umbi gadung adalah
menghambat terjadinya reaksi antara subtrat linamarin dan metillinamarin dengan
enzim linamarase. Perendaman irisan umbi dalam larutan 8 persen selama tiga
hari mampu mengurangi racun sianida dengan residu yang terbentuk relatif rendah
yaitu 7,32 ppm. Pemanasan irisan umbi gadung setebal 2 mm dalam air mendidih
selama 30 menit ternyata lebih efektif menurunkan kadar sianida bila
dibandingkan dengan metode perendaman dalam garam, yakni 4,12 ppm.
Penurunan kadar sianida dalam umbi gadung itu terjadi karena pemanasan dalam
air mendidih selama 30 menit bisa mengakibatkan enzim linamarase dan
glukosidase tidak aktif dan pembentukan asam sianida pun menjadi terputus
(Pambayun dkk., 2000).
Gadung digunakan sebagai obat nyeri haid dan obat rematik. Gadung
mengandung alkaloid, saponin, flavonoid dan tannin (Riset dan Teknologi
Indonesia, 2002). Menurut Sautour dkk (2007) sebagian besar spesies yam
mengandung saponin steroidal (± 2%) dan sapogenin seperti diosgenin yang
merupakan bahan industri untuk sintesis berbagai jenis steroid. Steroid digunakan
yam juga bersifat sitotoksik. Famili dioscorea juga mengandung senyawa bioaktif
dioscorin yang merupakan protein yang berfungsi sebagai antioksidan (Shewry,
2003) dan antihipertensi (Myoda dkk., 2006).
Pati
Pati merupakan gabungan dari ratusan bahkan ribuan molekul glukosa
yang terangkai menjadi satu membentuk suatu rantai panjang yang bercabang
maupun tidak bercabang. Manusia memanfaatkan pati dengan cara
menghidrolisinya menjadi polisakarida dan maltosa yang kemudian dapat
digunakan sebagai sumber energi (Richana dan Suarni, 2011). Sumber karbohidrat
yang diperlukan oleh tubuh banyak terdapat dari berbagai makanan pokok yang
dikonsumsi sehari-hari. Pati dari sumber yang berbeda mempunyai karakteristik
fisik dan kimia yang berbeda yang akan menentukan kesesuaian penggunaannya
bila diolah menjadi produk (Chaplin, 2004).
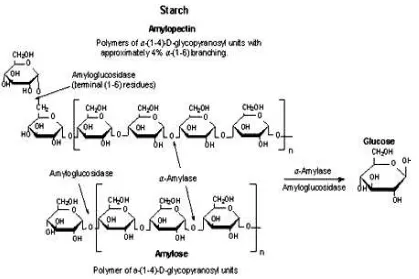
Pati tersusun dari dua makromolekul polisakarida, yaitu amilosa dan
amilopektin, yang keduanya tersimpan dalam bentuk butiran yang disebut granula
pati. Amilosa tersusun dari molekul-molekul glukosa yang terikat glikosidik α-1,4
yang membentuk struktur linier, dimana ujung rantai yang satu bersifat pereduksi
dan ujung yang lain bersifat non pereduksi. Amilopektin disamping disusun oleh
struktur utama linier juga memiliki struktur bercabang, dimana percabangannya
diikat dengan ikatan glikosisik α-1,6. Amilopektin memiliki struktur molekul
yang lebih besar dibanding amilosa dan umumnya kandungannya di dalam
granula pati lebih banyak dibandingkan amilosa (Benion, 1989).
Kandungannya amilosa dan amilopektin dan struktur granula pati
pati seperti kemampuan membentuk gel dan kekentalannya (Whistler dkk, 1984).
Perbedaan amilosa dengan amilopektin yaitu amilosa memberikan sifat keras,
sedangkan amilopektin menyebabkan sifat lengket. Amilosa memberikan warna
ungu pekat amilopektin tidak bereaksi (Hawab, 2004).
Amilosa dan amilopektin dapat dipisahkan dengan cara melarutkannya ke
dalam air panas dibawah suhu gelatinisasi pati. Fraksi terlarut air panas adalah
amilosa dan fraksi yang tidak terlarut adalah amilopektin (Muchtadi dkk., 1992).
Rasio antara amilosa dan amilopektin berbeda antar pati, tetapi untuk pati yang
normal terdiri dari 25% amilosa dan 75% amilopektin. Semakin banyak
kandungan amilopektin maka pati tersebut akan mudah larut dalam air. Dengan
demikian akan mudah untuk memutus polisakarida tersebut menjadi glukosa
(Bailey, 1986).
Kandungan pati di dalam bahan cukup penting, sehingga semakin tinggi
kandungan pati semakin dikehendaki konsumen. Kandungan pati didalam bahan
bakunya akan dipengaruhi oleh umur tanaman dan lama penyimpanan setelah
panen. Oleh karena itu pada pembuatan tepung umbi dikehendaki kandungan
patinya maksimum, maka umbi hasil panen sebaiknya segera diolah dan tidak
dilakukan penyimpanan (Antarlina dan Utomo, 1999). Dalam keadaan murni
granula pati berwarna putih, mengkilat, dan tidak berbau (Brautlecht, 1953).
Pati memegang peranan penting dalam industri pengolahan pangan non
pangan, seperti pada industri kertas, lem, tekstil, permen, glukosa, dekstrosa, sirup
fruktosa, dan lain-lain. Pada industri makanan, pati digunakan sebagai binding dan
thickening agent. Oleh karena itu, karakteristik pati seperti swelling power,
untuk menghasilkan produk makanan berbasis pati yang berkualitas (Koswara,
2006).
Hidrolisis Pati
Reaksi hidrolisis berlangsung lambat, untuk mempercepatnya dapat
digunakan katalisator. Katalisator adalah zat yang dapat mempercepat reaksi
tetapi tidak ikut bereaksi pada prosesnya secara keseluruhan. Pada hidrolisa pati,
katalisator yang dapat dipakai adalah HCl, H2SO4 dan enzim (Sadikin, 2002).
Hidrolisis pati merupakan proses pemecahan molekul amilum menjadi
bagian-bagian penyusunnya yang lebih sederhana seperti dekstrin, isomaltosa,
maltosa dan glukosa. Proses hidrolisis dipengaruhi oleh beberapa faktor, yaitu:
enzim, ukuran partikel, temperatur, pH, waktu hidrolisis, perbandingan cairan
terhadap bahan baku (volume substrat), dan pengadukan (Purba, 2009). Menurut
Junk dan Pancoast (1973), hidrolisa pati dapat dilakukan dengan 3 cara, yaitu :
Hidrolisa Asam
Hidrolisa asam juga dapat dikenal hidrolisa secara non enzimatik.
Hidrolisa ini menggunakan asam sebagai katalisnya, biasanya yang di pakai
adalah asam kuat, misalnya HCl. Pada hidrolisa pati dengan asam, diperlukan
suhu tinggi yaitu 140°C - 160°C. Pada pembuatan glukosa, hidrolisa asam
menghasilkan konversi yang cukup rendah jika dibandingkan dengan hidrolisa
enzim. Hidrolisa secara asam lebih mudah dilakukan, lebih murah biayanya
namun memiliki kekurangan dibanding reaksi enzimatis. Di samping itu metode
ini juga mempunyai beberapa kelemahan, antara lain diperlukan
peralatan-peralatan yang tahan korosi, menghasilkan sakarida dengan spektra-spektra
asam juga dapat menyebabkan terjadinya degradasi karbohidrat yang dapat
mempengaruhi warna, rasa, bahkan menimbulkan masalah teknis (Said, 1987).
Hidrolisa Asam dan Enzim
Menurut Junk dan Pancoast (1973), kombinasi asam dan enzim dalam
hidrolisa terdiri dari dua tahap yaitu : tahap hidrolisa dengan asam mineral dan
tahap hidrolisa dengan enzim. Enzim yang biasa digunakan adalah α-amilase, β
-amilase, dan glukoamilase.
Hidrolisa Enzim
Sejak lama peneliti berusaha mengantikan hidrolisa system asam dengan
system enzim. Karena hidrolisis secara enzimatis memiliki perbedaan mendasar
dibandingkan hidrolisis secara asam dalam hal spesifitas pemutusan rantai polimer
pati. Hidrolisis secara kimiawi dan fisik akan memutuskan rantai secara acak
sedangkan hidrolisis enzimatis akan memutuskan rantai polimer pati secara
spesifik pada percabangan tertentu (Norman, 1981).
Hidrolisa enzim dilakukan menggunakan bantuan enzim α-amilase dan
enzim glukoamilase (amiloglukosidase). Enzim α-amilase digunakan pada proses
likuifikasi, sedangkan glukoamilase digunakan pada proses sakarifikasi. Hidrolisa
enzim lebih banyak memberikan keuntungan dibandingkan dengan hidrolisa
asam. Hidrolisa enzim menghasilkan konversi yang lebih besar jika dibandingkan
dengan hidrolisa asam. Hidrolisa enzim juga dapat mencegah adanya reaksi efek
samping karena sifat katalis enzim sangat spesifik, sehingga dapat
mempertahankan flavor dan aroma bahan dasar (Winarno, 1986). Pada Tabel 3,
dapat dilihat enzim-enzim yang banyak digunakan di dalam industri pengolahan
Tabel 3. Enzim-Enzim yang Banyak Digunakan di dalam Industri Pengolahan Pati (Hidrolisis)
Jenis Enim Diisolasi dari Mikroba
Isoamilase α-1,6 menghasilkan sirup
maltosa
Menurut Winarno dan Fardiaz (1984), dengan adanya katalisator enzim
suatu reaksi dapat dipercepat kira-kira 1012 sampai 1020 kali jika dibandingkan
dengan reaksi tanpa katalisator. Sebagaian besar reaksi kimia dalam sel-sel hidup
akan terjadi dengan sangat lambat jika tidak katalis oleh enzim (Martin dkk.,
1983). Kelebihan enzim dibandingkan katalis biasa adalah (1) dapat
meningkatkan produk beribu kali lebih tinggi; (2) bekerja pada pH yang relative
netral dan suhu yang relatif rendah; dan (3) bersifat spesifik dan selektif terhadap
subtrat tertentu. Enzim telah banyak digunakan dalam bidang industri pangan,
farmasi dan industri kimia lainnya. Dalam bidang pangan misalnya amilase,
contohnya amilase, lipase, dan protease. Enzim dapat diisolasi dari hewan,
tumbuhan dan mikroorganisme (Azmi, 2006).
Berdasarkan reaksi yang dikatalisisnya, enzim diklasifikasikan menjadi
enam kelas utama yaitu oksidoreduktase, transferase, hidrolase, liase, isomerase
dan ligase. Amilase merupakan kelompok enzim hidrolase yaitu enzim yang
mengkatalisis reaksi hidrolisis suatu substrat dengan bantuan molekul air
(Montgomery dkk., 1993).
Amilase (α, β dan glukoamilase) merupakan enzim yang dapat mengubah
pati menjadi gula. Amilase dapat dikelompokkan menjadi tiga golongan enzim.
Pertama adalah α-amilase yang memecah ikatan dibagian dalam substrat sehingga
disebut juga endoamilase yang biasa digunakan dalam tahap likuifikasi untuk
memproduksi larutan dekstrin. Kedua, β-amilase yang menghidrolisis unit paling
ujung dari substrat dan biasa digunakan untuk produksi high maltose syrup.
Ketiga, glukoamilase yang menghidrolis dekstrin lebih lanjut menjadi glukosa
pada tahap sakarifikasi (Wong, 1995 dalam Sulistyo 2006).
Penggunaan α-amilase yang diperoleh dari mikroba umumnya stabil pada
pH 5,5-8,0 dan suhu optimumnya bervariasi bergantung pada sumber enzim
tersebut. Penggunaan α-amilase dalam proses hidrolisa pati sering disebut
likuifikasi, karena adanya penurunan viskositas dengan cepat, dan kecepatannya
dapat bervariasi untuk berbagai substrat (Risnoyatiningsih, 2011).
Enzim β-amilase (β-1,4 glukan maltohidrolase) dapat diisolasi dari
kecambah barley, dan kacang kedelai. Enzim β-amilase memecah ikatan
glukosida β-1,4 pada pati dan glikogen dengan membalikkan konfigurasi karbon
Cara hidrolisis ikatan α-1,4 oleh β-amilase terjadi dengan memotong 2 unit
glukosa dan secara bertahap pemotongan dari ujung rantai gula yang bukan
pereduksi, disebut eksiamilase. Enzim β-amilase aktif pada pH 5-6
(Tjokrodiakusoemo, 1986).
Enzim glukoamilase diproduksi dari Aspergillus dan Rhizopus.
Tergantung pada organism asalnya, enzim-enzim tersebut memiliki sifat-sifat
kimia enzim yang berbeda-beda, namun pada kondisi yang tepat semua enzim
tersebut dapat menghidrolisis pati secara sempurna menjadi glukosa. Enzim
glukoamilase bersifat eksoamilase, yaitu dapat memutus rantai pati menjadi
molekul-molekul glukosa pada bagian tidak mereduksi dari molekul tersebut,
memecah ikatan α-1,4 dan α-1,6. Enzim glukoamilase memecah pati dari luar
dengan mengeluarkan unit-unit glukosa dari ujung bukan pereduksi polimer pati.
Hasil reaksinya hanya glukosa, sehingga dapat dibedakan dengan α-amilase dan
β-amilase. Enzim tersebut dapat menghidrolisi pati sampai mencapai DE 95-98
(dextrosa ekuivalen yaitu kenaikan derajat konversi) dan dengan dextrosa 93-95%
(Tjokroadikoesomo, 1986). Pengaruh enzim glukoamilase posisi glukosa α dapat
diubah menjadi β dengan pH optimalnya 4-5 dan suhu optimalnya 50-60°C
(Winarno,1995).
Faktor-Faktor yang Mempengaruhi Hidrolisa Pati menjadi Glukosa
Faktor-faktor yang mempengaruhi hidrolisa pati menjadi glukosa adalah
suhu, waktu, pH, kadar suspensi, dan jumlah penambahan enzim. Pada umumnya
semakin tinggi suhu, semakin naik laju reaksi kimi. Tetapi perlu di ingat bahwa
semakin tinggi suhu reaksi, inaktivasi enzim juga semakin meningkat. Suhu
menurunkan stabilitasnya. Sebaliknya suhu yang makin rendah dapat
meningkatkan stabilitas, namun produktifitasnya dan aktivitas enzim menurun.
Hidrolisa dengan enzim glukoimailase hanya dapat dilakukan pada suhu 60˚C
(Tjokrodiakusoemo, 1986).
Semakin lama waktu reaksi, maka kadar glukosa yang dihasilkan semakin
besar. Lamanya waktu reaksi juga dipengaruhi atau tergantung oleh banyaknya
substrat yang di hidrolisa dan jumlah enzim yang ditambahkan (Soesanto, 1983).
Sebagian besar aktivitas enzim dipengaruhi derajat keasaman media
tempat enzim tersebut melakukan kegiatan katalitiknya. Derajat keasaman optimal
yang ditunjukan oleh enzim tertentu tidak selalu konstan. Masih ada berbagai
faktor lain yang memberikan pengaruh atas aktivitas enzim tersebut
(Risnoyatiningsih, 2011).
Pada kadar suspensi tinggi mengakibatkan kekentalan campuran semakin
meningkat, sehingga jumlah kandungan partikel pati tidak larut semakin
meningkat. Hal ini mengakibatkan proses hidrolisa tidak dapat berjalan dengan
baik atau sempurna. Semakin banyak kadar suspensi pati yang dihidrolisa, maka
waktu proses yang diperlukan untuk menghidrolisa pati tersebut akan semakin
lama. Jumlah enzim yang dibutuhkan juga semakin banyak. Peningkatan
kecepatan reaksi ini akan semakin kecil hingga tercapai suatu titik batas yang
pada akhirnya penambahan konsentrasi subtrat hanya akan sedikit meningkatkan
kecepatan reaksi (Lehninger, 1997). Hal ini disebabkan semua molekul enzim
telah membentuk ikatan kompleks dengan substrat yang selanjutnya dengan
kenaikan konsentrasi substrat tidak berpengaruh terhadap kecepatan reaksinya
Semakin banyak jumlah enzim yang ditambahkan pada pati, akan
menghasilkan kadar glukosa yang semakin banyak pula. Keadaan ini juga
semakin mempercepat reaksi hidrolisa, untuk enzim α- amilase digunakan
perbandingan 2 kg enzim untuk setiap ton pati, sedangkan untuk enzim
glukomaliase digunakan sebanyak 0,5-1,1 L untuk setiap ton pati
(Risnoyatiningsih, 2011).
Mekanisme Kerja Enzim
Hidrolisis secara enzimatis memiliki perbedaan mendasar dengan
hidrolisis secara asam. Hidrolisis secara asam memutus rantai pati secara acak,
sedangkan hidrolisis secara enzimatis memutus rantai pati secara spesifik pada
percabangan tertentu. Hidrolisis secara enzimatis lebih menguntungkan
dibandingkan hidrolisis asam, karena prosesnya lebih spesifik, kondisi prosesnya
dapat dikontrol, biaya pemurnian lebih murah, dan kerusakan warna dapat
diminimalkan (Virlandia, 2008).
Enzim yang dapat digunakan adalah α-amilase, β-amilase,
amiloglukosidase, glukosa isomerase, pullulanase, dan isoamilase. Enzim yang
biasa digunakan untuk proses pembuatan sirup glukosa secara sinergis adalah
enzim α-amilase dan enzim glukoamilase. Enzim α-amilase akan memotong
ikatan amilosa dengan cepat pada pati kental yang telah mengalami gelatinisasi.
Kemudian enzim glukoamilase akan menguraikan pati secara sempurna menjadi
glukosa pada tahap sakarifikasi. Reaksi pembuatan glukosa dengan hidrolisa pati
Gambar 2. Reaksi Pembuatan Glukosa dari Hidrolisis Pati (Anonim, 2013)
Faktor – Faktor yang Mempengaruhi Aktivitas Enzim
Faktor – faktor yang mempengaruhi aktivitas enzim adalah suhu, pH,
konsentrasi enzim, konsentrasi substrat, dan aktivator atau inhibitor. Enzim
mempercepat terjadinya reaksi kimia pada suatu sel hidup. Dalam batas-batas
suhu tertentu, kecepatan reaksi yang dikatalisis enzim akan naik bila suhunya
naik. Reaksi yang paling cepat terjadi pada suhu optimum (Rodwell,1987). Oleh
karena itu, penentuan suhu optimum aktivitas enzim sangat perlu karena apabila
suhu terlalu rendah maka kestabilan enzim tinggi tetapi aktivitasnya rendah,
sedangkan pada suhu tinggi aktivitas enzim tinggi tetapi kestabilannya rendah
(Muchtadi dkk., 1992). Namun, kecepatannya akan menurun drastis pada suhu
perubahan konformasi panas (denaturasi) enzim. Kebanyakan enzim tidak aktif
pada suhu sekitar 55-60˚C (Rabyt dan White, 1987).
Sebagian besar aktivitas enzim dipengaruhi derajat keasaman media
tempat enzim tersebut melakukan kegiatan katalitiknya. Menurut Tranggono dan
Sutardi (1990), Enzim mempunyai aktivitas maksimum pada kisaran pH yang
disebut pH optimum. Suasana yang terlalu asam atau alkali akan mengakibatkan
denaturasi protein dan hilangnya secara total aktivitas enzim. pH optimum untuk
beberapa enzim pada umumnya terletak diantara netral atau asam lemah yaitu
4,5-8. pH optimum sangat penting untuk penentuan karakteristik enzim. Pada subtrat
yang berbeda, enzim memiliki pH optimum yang berbeda. Menurut Winarno
(1986), enzim yang sama seringkali mempunyai pH optimum yang berbeda,
tergantung pada asal enzim tersebut. Pengaturan pH harus bertujuan untuk
mendapatkan keaktifan enzim yang maksimal. pH optimum pada tahapan
gelatinisasi dan liquifikasi menggunakan enzim α-amilase adalah 5,3-6,5
(Chalpin, 2004).
Kecepatan reaksi dalam reaksi enzimatis sebanding dengan konsentrasi
enzim (Martin dkk., 1983). Semakin tinggi konsentrasi enzim maka kecepatan
reaksi akan semakin meningkat hingga pada batas konsentrasi tertentu dimana
hasil hidrolisis akan konstan dengan naiknya konsentrasi enzim yang disebabkan
penambahan enzim sudah tidak efektif lagi (Reed, 1991).
Kecepatan reaksi enzimatis pada umumnya tergantung pada konsentrasi
substrat. Kecepatan reaksi akan meningkat apabila konsentrasi substrat
meningkat. Peningkatan kecepatan reaksi ini akan semakin kecil hingga tercapai
sedikit meningkatkan kecepatan reaksi (Lehninger, 1997). Hal ini disebabkan
semua molekul enzim telah membentuk ikatan kompleks dengan substrat yang
selanjutnya dengan kenaikan konsentrasi substrat tidak berpengaruh terhadap
kecepatan reaksinya (Tranggono dan Sutardi, 1990).
Enzim memerlukan aktivator dalam reaksi katalisnya. Aktivator adalah
senyawa atau ion yang dapat meningkatkan kecepatan reaksi enzimatis.
Komponen kimia yang membentuk enzim disebut juga kofaktor. Kofaktor dapat
berupa ion-ion anorganik seperti Zn, Fe, Ca, Mn, Cu, atau Mg atau dapat pula
sebagai molekul organik kompleks yang disebut koenzim (Martoharsono, 1984).
Selain dipengaruhi oleh adanya aktivator. Aktivator enzim juga dipengaruhi oleh
adanya inhibitor. Inhibitor adalah senyawa atau ion yangdapat menghambat aktivitas
enzim (Lehninger, 1997).
Pembuatan Sirup Glukosa
Tahap hidrolisis pati terbagi dalam dua tahap, yaitu: tahapan pemecahan
molekul-molekul pati menjadi dekstrin, disebut dekstrinisasi atau gelatinisasi.
Dalam tahap ini yang berperan adalah enzim α-amilase. Enzim α-amilase ini
hanya mampu memecah amilosa dan amilopektin pada ikatan α (1-4) sehingga
hasil akhir yang diperoleh adalah dekstrin. Tahap pemecahan lebih lanjut dari
dekstrin menjadi glukosa, disebut sakarifikasi. Dalam tahap ini yang berperan
adalah enzim amiglukoamilase, dimana enzim ini mampu memutuskan ikatan α
(1-6) sehingga diperoleh hasil akhir glukosa (Melliawati, 2006).
Likuifikasi
Proses liquifikasi adalah proses pencairan gel pati dengan menggunakan
pH 5,5, suhu 85°C, waktu proses 40 menit, dan perbandingan pati dan enzim
1:0,002. Jika proses ini dilakukan pada pH dan suhu tidak optimal maka aktivitas
enzim akan berkurang dan enzim akan rusak dan mati (Othmer, 1976). Enzim α
-amilase adalah endoenzim yang bekerjanya memutus ikatan α-1,4 dibagian dalam
molekul baik pada amilosa maupun amilopektin. Enzim α-amilase relatif tahan
panas, tetapi tidak tahan terhadap pH yang rendah. Enzim α- amilase mempunyai
suhu optimum 80˚C-110˚C dan pH optimum 5,0-7,0 (Risnoyatiningsih, 2011).
Dalam tahap likuifikasi, proses hidrolisa pati dilakukan sampai derajat
konversi sekitar 10-20% DE (Fleming, 1968), sedangkan menurut Inglett (1970)
sampai mencapai 15-20% DE atau sampai cairan berwarna coklat kemerahan bila
direaksikan dengan larutan iod. Beberapa faktor yang mempengaruhi proses
likuifikasi yaitu konsentrasi substrat, konsentasi enzim, pengaturan suhu, pengaturan
pH, dan lama likuifikasi(Jariyah dan Yunianta, 2001).
Sakarifikasi
Proses sakarifikasi adalah proses hidrolisis dextrin menjadi glukosa
dengan bantuan enzim amiloglukosidase. Proses ini berlangsung pada pH 4,5,
suhu 60°C, waktu reaksi 48-96 jam, dengan penambahan enzim 0,5-1,1%. Proses
ini dilakukan pada suhu dan pH yang optimal sesuai dengan kereaktifan enzim
glukoamilase, untuk waktu dan penambahan enzim juga harus sesuai dengan
substrat yang di tambahkan sehingga didapatkan kadar glukosa yang maksimal
(Coney, 1979). Enzim glukoamilase bersifat eksoamilase, yaitu dapat memotong
ikatan α-1,4 pada pati. Disamping itu amiloglukosidase (glukoamilase) juga dapat
memotong ikatan α-1,6, sehingga molekul-molekul pati dapat dikonversikan
mempunyai suhu optimum 50˚C-60˚C dan pH optimum 4,0-5,0 (Winarno, 1995).
Pengaturan kondisi pada proses hidrolisis enzim sangat penting karena
berpengaruh pada aktivitas enzim untuk merubah substrat menjadi produk yang
diinginkan, yaitu glukosa.
Hidrolisis dengan enzim dapat menghasilkan beberapa produk hidrolisis
pati dengan sifat-sifat tertentu yang didasarkan nilai DE (Dekstrosa Ekuivalen).
Nilai DE 100 adalah dekstrosa murni sedangkan nilai DE 0 adalah pati alami.
Hidrolisis dengan nilai DE 50 adalah maltosa, nilai DE di bawah 20 adalah
maltodekstrin, dan hidrolisis dengan DE 20-100 adalah sirup glukosa (Februadi,
2011).
Sirup Glukosa
Sirup glukosa adalah salah satu produk bahan pemanis makanan dan
minuman yang berbentuk cairan, tidak berbau dan tidak berwarna tetapi memiliki
rasa manis yang tinggi. Perbedaannya dengan gula pasir yaitu, gula pasir
merupakan disakarida, sedangkan sirup glukosa adalah monosakarida, terdiri atas
satu monomer yaitu glukosa. Sirup glukosa dapat dibuat dengan cara hidrolisis
menggunakan asam atau enzim (Hidayat, 2006). Pemotongan rantai pati oleh
asam lebih tidak teratur dibandingkan dengan hasil pemotongan rantai pati oleh
enzim, sehingga hasilnya adalah campuran dekstrin, maltosa dan glukosa. Hasil
hidrolisis enzim lebih dapat dikendalikan, sehingga dapat diatur kadar maltose
atau glukosanya (Tjokroadikoesoemo, 1986).
Pembuatan sirup glukosa secara enzimatis dapat menghasilkan rendemen
dan mutu sirup glukosa yang lebih tinggi dibandingkan dengan cara hidrolisis
minimal 70%, DE minimal 20 dan kandungan sulfur dioksida minimal 40g/kg.
Standar mutu sirup glukosa secara umum disajikan pada Tabel 4.
Tabel 4. Standar Mutu Sirup Glukosa
Komponen Kandungan
Kadar air Max. 20%
Abu Max. 1%
Kadar gula reduksi D-glukosa Min. 30%
Kadar pati Tidak ada
Logam berat (Pb, As, Zn) Negatif
Warna Tidak berwarna-Kekuningan
Sulfur dioksida Untuk kembang gula max. 400ppm,
yang lain 40ppm
Sumber : Dhoni, 2002 dalam Mahartantri, 2005
Tingkat mutu sirup glukosa yang dihasilkan ditentukan oleh tingkat
konversi pati menjadi komponen-komponen glukosa yang dikenal sebagai
Dextrose Equivalen (DE) (Mc Pherson dan Secb, 1997). Menurut de Man (1997),
Sirup glukosa adalah larutan gula yang dipekatkan yang diperoleh dari pati dan
mempunyai Dextrose Equivalent (DE) 20 atau lebih. Jika DE-nya kurang dari 20,
produknya disebut maltodextrin, sedangkan dekstrosa monohidrat dan dekstrosa
anhidrat adalah D-glukosa yang dimurnikan dan dikristalkan yang diperoleh dari
pati. Menurut Martin dkk., (1983), tingkat mutu sirup glukosa ditentukan oleh
kadar bahan kering sirup, kadar abu dan beberapa logam berat yang terkandung
didalamnya. Tabel mutu sirup glukosa menurut SNI (1994), disajikan pada Tabel
Tabel 5. Syarat Mutu Sirup Glukosa
No. Kriteria Uji Satuan Persyaratan
1.
Nilai kemanisan relatif sirup glukosa lebih rendah dibandingkan sukrosa
dan tergantung derajat konversinya. Makin tinggi derajat konversi makin tinggi
pula kemanisannya. Nilai kemanisan relatif sirup glukosa dan beberapa pemanis
lainnya dapat dilihat pada Tabel 6.
Tabel 6. Nilai Kemanisan Relatif Sirup Glukosa dan Beberapa Pemanis Lainnya
Bahan Nilai kemanisan (sukrosa= 100)
Sukrosa 100
Menurut Jacob (1994), nilai kemanisan sirup glukosa dapat digolongkan
jika nilai dekstrosa ekuivalennya 40-45% dan disebut “sweetose” bila nilai
dekstrosa ekuivalennya 56-64%.
Kegunaan Sirup Glukosa
Sirup glukosa adalah cairan gula kental yang diperoleh dari pati. Sirup
glukosa digunakan dalam industri permen, selai, pengalengan buah-buahan,
biskuit, es krim, bumbu masak, sirup, kecap dan sebagainya. Fungsi sirup glukosa
dalam pembuatan permen agar dapat meningkatkan viskositas dari permen
sehingga tidak lengket. Penggunaan sirup glukosa ternyata dapat mencegah
kerusakan pada permen (Hidayat dan Ikarisztiana, 2004). Sirup glukosa berfungsi
memperlunak hasil atau hasilnya halus sehingga kembang gula yang dihasilkan
tidak terlalu keras, selain itu juga berfungsi mencegah pengkristalan sukrosa atau
gula. Penambahan sirup glukosa dalam kadar tinggi akan menyerap dan mengikat
air sehingga mikroba tidak bebas mengunakan air untuk tumbuh pada produk
yang ditumbuhui (Minarni, 1996).
Industri makanan dan minuman memiliki kecenderungan untuk
menggunakan sirup glukosa. Hal ini didasari oleh beberapa kelebihan sirup
glukosa dibandingkan sukrosa, diantaranya sirup glukosa tidak mengkristal seperti
halnya sukrosa jika dilakukan pemanasan pada suhu tinggi seperti pada produk
roti dan kue-kue. Glukosa juga digunakan sebagai substituen, karena produk ini
mengandung karbohidrat atau gula pereduksi, misalnya dalam industri fermentasi
(alkohol). Dalam industri farmasi, glukosa juga sangat dibutuhkan, khususnya
dalam pembuatan larutan infus. Selain itu hidrogenasi dekstrosa di bawah
formulasi makanan penderita kencing manis dan digunakan juga sebagai bahan
METODE PENELITIAN
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Oktober - Desember 2014 di
Laboratorium Laboratorium Ilmu dan Teknologi Pangan Fakultas Pertanian dan
Laboratorium Biokimia Fakultas FMIPA Universitas Sumatera Utara, Medan.
Bahan dan Alat Penelitian
Sampel yang digunakan dalam penelitian ini adalah umbi gadung
(Dioscorea hispida Dennst) ukuran sedang jenis gadung kuning yang diperoleh
dari Louksemawe, Aceh. NaOH 1%, enzim α-amylase, enzim glukoamilase,
Na2HPO4 10 %, KI 30 %, H2SO4 25 %, Na2S2O3 0,1 N, aquades, NaOH 30%, HCl
30%, karbon aktif, amilum 1%, larutan Luff Schrool
Pisau, kain saring, stoples bening, blender (Cosmos), labu takar (Pyrex),
pipet tetes, magnetic stirrer, gelas ukur (Pyrex), kertas saring, autoclave
(Wisconsin), shaker incubator (Vision), termometer, tabung reaksi, corong, beker
glass (pyrex), dan alat titrasi, neraca analitik (Mettler Toledo), erlenmeyer
(Pyrex), pH meter, oven (Gallencamp), hot plate (PMC), desikator, mafel, alat
tulis dan alat dokumentasi.
Metoda Penelitian
Penelitian ini dilakukan secara eksprimen dan menggunakan Rancangan
Acak Lengkap (RAL) dengan dua faktor, yang terdiri dari 16 (enam belas)
perlakuan dan 3 (tiga) kali ulangan sehingga diperoleh 48 unit. Perlakuan tersebut
Faktor I : pH pada proses sakarifikasi (P) yang terdiri dari 4 taraf:
P1 = 4
P2 = 5
P3 = 6
P4 = 7
Faktor II: Lama proses sakarifikasi (S) yang terdiri dari 4 taraf:
S1 = 24 jam
S2 = 36 jam
S3 = 48 jam
S4 = 60 jam
Model Rancangan (Bangun, 1991)
Rancangan yang digunakan adalah Rancangan Acak Lengkap (RAL) dua
faktor dengan model sebagai berikut:
Yijk = μ + αi + βj + (αβ)ij + εijk
dimana :
Yijk = Hasil pengamatan faktor P pada taraf i, dan faktor S pada taraf
ke-j dengan ulangan ke-k
μ = Efek nilai tengah atau rataan
αi = Pengaruh dari faktor P pada taraf ke-i
βj = Pengaruh dari faktor S pada taraf ke-j
(αβ)ij = Komponen interaksi dari faktor P dan faktor S
Apabila diperoleh hasil berbeda nyata dan sangat nyata maka uji
dilanjutkan dengan uji beda rataan dengan menggunakan uji LSR (Least
Significant Range).
Pelaksanaan Penelitian
Pembuatan Pati dari Umbi Gadung (Dioscorea hispida Dennst)
Proses pembuatan pati umbi gadung dimulai dengan proses pengupasan
dan membersihkan umbi, kemudian diiris tipis-tipis. Irisan umbi gadung direndam
di air mengalir selama 3 hari lalu dikeringkan dengan sinar matahari. Kemudian
irisan umbi gadung dihaluskan dan ditambah air dengan rasio 1:1. Bubur umbi
gadung disaring dengan kain saring untuk memisahkan ampasnya lalu
diendapkan.
Endapan pati gadung dipisahkan dari supernatan dan dicuci dengan
penambahan air 1:2 (b/v), diaduk, dan diendapkan kembali. Pencucian diulangi
±10 kali. Setelah itu dilanjutkan dengan pengeringan dengan oven pada suhu 55˚C
selama 6 jam (Risnoyatiningsih, 2011), kadar air sekitar 12% (Prawiyanti., dkk,
2011).
Pembuatan Sirup Glukosa Secara Enzimatis
Pati umbi gadung ditimbang sebanyak 30 g dengan menggunakan
timbangan, kemudian ditambahkan air sebanyak 100 ml. Suspensi pati kemudian
diatur pHnya menjadi 5 dengan cara menambahkan NaOH 1%. Suspensi
kemudian dilikuifikasi yaitu memanaskan suspensi hingga suhu 85°C, lalu
Hasil likuifikasi didingankan dan diatur pH-nya 4, 5, 6 dan 7 dengan
menggunakan HCl. Selanjutnya ditambahkan enzim glukoamilase 0,05 g.
Kemudian dilakukan proses sakarifikasi dengan cara menjaga suhunya tetap 60°C
selama 24, 36, 48, 60 jam yang dilakukan dengan menggunakan shaker incubator.
Larutan sirup glukosa yang dihasilkan pada proses sakarifikasi selanjutnya
ditambahkan karbon aktif sebanyak 0,2 g untuk dilakukan proses purifikasi yaitu
dengan cara memanaskan larutan sirup ini pada suhu 80°C selama 10 menit.
Setelah dilakukan pemurnian menggunakan karbon aktif, larutan sirup glukosa
disaring, kemudian dilakukan uji kadar gula pereduksi dengan metode
Luff-Schrool (Risnoyatiningsih, 2011).
Pengamatan
Parameter pengamatan yang dilakukan adalah: Analisa kadar asam sianida
(Sudarmadji dkk., 1997), kadar air (Sudarmadji, dkk., 1989), kadar abu
(Sudarmadji, dkk., 1989), kadar pati (Sudarmadji, dkk., 1989), kadar amilosa dan
amilopektin (Apriyantono dkk., 1998), gula pereduksi metode Luff Schrool (SNI
01- 2891-1992 titrasi iodometri), total padatan terlarut (Norman, 1998), Dexstrose
Equivalen (Shi, 2000), viskositas (Sukardjo, 2002), dan rendemen.
Analisa Kadar Asam Sianida (Sudarmadji dkk., 1997)
Sebanyak 20 g pati umbi gadung yang telah dihaluskan kemudian
ditambahkan 100 ml aquades dalam erlenmeyer dan didiamkan selama 2 jam.
Tambahkan lagi 100 ml aquades dan didestilasi dengan uap. Destilat ditampung
dalam erlenmeyer yang telah diisi dengan 20 ml NaOH 2,5%. Setelah didestilasi
dihentikan. Destilasi kemudian ditambahkan 5 ml KI 5% dan 8 ml NH4OH.
Campuran destilat tersebut dititrasi dengan larutan AgNO3 0,02 N sampai terjadi
kekeruhan. Kemudian dihitung kadar asam sianida dengan rumus :
HCN =
Kadar Air (Sudarmadji dkk., 1989)
Timbang sampel sebanyak 2 g dalam cawan porselin yang tetah diketahui
beratnya. Dikeringkan dalam oven pada suhu 1050C selama 4 jam. Kemudian
didinginkan dalam desikator selama 15 menit dan ditimbang. Dipanaskan lagi
dalam oven selama 30 menit, didinginkan lagi dalam desikator dan ditimbang.
Perlakuan ini diulangi sehingga didapat berat yang konstan. Dihitung
pengurangan berat yang merupakan banyaknya air dalam bahan dengan :
Kadar air (%) =
Kadar Abu (Sudarmadji dkk., 1989)
Timbang 2 g sampel dalam krus porselin yang kering dan telah diketahui
beratnya. Kemudian pijarkan dalam muffle sampai diperoleh abu berwarna
keputih-putihan. Masukkan krus dan abu ke dalam desikator dan ditimbang berat
abu setelah dingin.
Kadar abu (%) =
Kadar Pati (Sudarmadji dkk., 1989)
Sampel ditimbang sebanyak 5 g kemudian dimasukkan ke dalam
dengan pendingin balik. Setelah dingin dinetralkan dengan dengan NaOH 10%
dan dimasukkan dalam labu ukur 50 ml dan ditambah dengan aquades sampai
tanda batas, kemudian sampel dipipet 5 ml dan dimasukkan kedalam erlenmeyer
250 ml dan ditambah 25 ml larutan Luff-Schoorl dan dihubungkan dengan
pendingin balik atau pendingin udara dan dipanaskan di atas nyala api hingga
larutan mendidih selama 2 menit. Larutan dibiarkan mendidih selama 10 menit
dan setelah selesai didinginkan dengan cepat dengan air mengalir. Setelah dingin,
larutan di pindah kedalam erlenmeyer tertutup, sisa dicuci dan dimasukkan
kedalam erlenmeyer tertutup tersebut kemudian ditambah asam sulfat 6 N sampai
tidak berbuih, kemudian ditambah kalium iodida. Selanjutnya larutan dititrasi
dengan natrium tiosulfat 0,1 N dan menggunakan indikator kanji 0,5% sampai
warna biru hilang.
Kadar Pati =
Dimana :
G = mg glukosa (Vol Na2S2O3 Blanko - Vol Na2S2O3 contoh)
Fp = Faktor pengenceran
W = Bobot contoh (mg)
Kadar Amilosa dan Amilopektin (Apriyantono dkk., 1998)
Sebanyak 100 mg sampel ditimbang dan dimasukkan dalam labu ukur 100
ml, kemudian 1 ml etanol 95% dan 9 ml NaOH 1 N ditambahkan ke dalam
sampel. Larutan dipanaskan dalam waterbath (air mendidih) selama 10 menit
(sampai pati tergelatinisasi). Setelah itu, labu ukur yang berisi sampel didinginkan
selama 1 jam dan ditambahkan akuades sampai tanda tera, kemudian dikocok.
Sebanyak 5 ml larutan sampel dipipet dan dimasukkan ke dalam labu ukur 100 ml G x Fp x 0,9
yang telah diisi 40 ml akuades. Sebanyak 1 ml asam asetat 1 N dan 2 ml larutan,
kemudian ditambahkan air sampai tanda tera. Larutan sampel dikocok dan
dibiarkan selama 20 menit. Larutan sampel diambil untuk dianalisa
spektrofotometer. Selain itu, dibuat juga larutan blanko dengan cara
mencampurkan semua bahan kecuali sampel. Kadar amilosa diukur dengan cara
sebagai berikut:
Kadar amilosa (%) =
Dimana:
A = konsentrasi amilosa dari kurva standar (mg/ml)
fP = faktor pengenceran
V = volume awal (ml)
W = bobot awal (mg)
Kadar amilopektin diperoleh dari selisih antara kadar pati dengan kadar
amilosa sampel.
Penentuan % kadar gula pereduksi metode Luff Schrool (SNI 01- 2891-1992 titrasi iodometri)
Sampel diambil sebanyak 5 g ditimbang dengan neraca analitik dan
dimasukkan ke dalam labu takar 250 ml serta ditambah air aquades hingga tanda
batas. Kemudian disaring dan dipipet 10 ml, filtratnya dimasukkan ke dalam labu
takar 250 ml. Ditambahkan 10 ml Pb asetat 5% kemudian dikocok. Larutan yang
didapat dites dengan tetesan larutan Na2HPO4 10 %, bila timbul endapan putih
berarti sudah cukup. Selanjutnya ditambahkan air hingga tanda batas, dikocok dan
dibiarkan sekitar 30 menit dan kemudian disaring. Sebelum terjadi inversi filtrat
sebanyak 10 ml dipipet ke dalam labu erlenmeyer 500 ml. A x fP x V
Kemudian ditambahkan 15 ml air, dan 25 ml larutan Luff Schoorll
dipanaskan selama 2 menit sampai mendidih dan dididihkan terus selama 10
menit dengan nyala kecil diangkat dan didinginkan cepat. Setelah dingin
ditambahkan 5 ml KI 20 % dan 5 ml H2SO4 25 % dengan pelan-pelan.
Selanjutnya dititrasi dengan larutan Natrium thiosulfat 0,1 N dan larutan pati 1 %
sebagai indikator titrasi sampai warna biru tua hilang. Dari selisih kedua penitaran
dapat dihitung jumlah glukosa fruktosa atau gula invert dengan menggunakan
daftar tabel Lehman.
Kadar gula reduksi =
Dimana :
mg kesetaraan = volume blanko – volume sampel
fp = faktor pengenceran
fN = faktor normalitas Na2S2O3 (0,1 N )
total sampel ml = volume sampel sebelum dianalisis
Ket : dari 100 ml larutan sampel diambil 10 ml untuk setiap kali titrasi, jadi faktor fP adalah 10.
Total Padatan Terlarut (Norman, 1998)
Uji total padatan terlarut ini dilakukan untuk mengetahui kadar gula pada
sirup. Tujuan analisis ini untuk mengetahui kadar gula pada sirup yang sesuai
dengan SNI. Pengukuran dilakukan dengan cara meneteskan produk pada kaca
sensor yang ada pada hand refraktometer dan angka brix dapat segera dibaca.
Dexstrose Equivalen (Shi, 2000)
Nilai Dextrose Equivalen diawali dengan mencari nilai Fehling factor
dengan cara 2,5 g glukosa dilarutkan dengan aquades sampain 1000 ml lalu mg kesetaraan x fP x fN
total sampel ml