SINTESIS ZEOLIT BERBASIS SILIKA SEKAM PADI DENGAN METODE ELEKTROKIMIA SEBAGAI ADSORBEN RHODAMIN B
(Skripsi)
Oleh
Hanif Amrulloh ZA
JURUSAN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
SYNTHESIS OF ZEOLITE-BASED RICE HUSK SILICA WITH ELECTROCHEMICAL METHOD AS ADSORBENT RHODAMIN B
By
Hanif Amrulloh ZA
This study was carried out to prepare synthetic zeolite from rice husk silica and aluminum metal using electrochemical method, and to assess the potential of the zeolites produced as adsorbent for Rhodamin B from water after the zeolites were subjected to calcination treatment at 300 oC. To produce zeolites with different compositions, preparation was undertaken at varied pHs of 4, 5, 6, 8, 10 and electrolysis times of 15, 30, 45, 50 minutes. Four zeolites with the highest adsorption capacities were then characterised using SEM-EDS, and the best sample was characterized using BET. The results obtained indicate that selected zeolites are those pepraed at pH 8 and electrolysis time of 30 minutes, pH 4 and electrolysisi time of 15 minutes, pH 10 and electrolysis times of 15 and 30 minutes. The highest adsorption capacity was exhibited by the sample preparaed at pH 8 and time of 30 minutes, with the adsorption capacity of 0.1206 mg/g. This particular sample was found to have the surface area of 79.479 m2/g and pore diameter of 18.387 nm. The adsorption capacity of the zeolite was found to significantly lower than that of rice husk silica, which is 1.0585 mg/g. The main reason for this result is most likely the larger surface area of the silica, which is 380,272 m²/g and pore diameter of 9.934 nm. The results of SEM-EDS analyses cearly indicate that electrochemical variables employed result in different composition of the zeolites as expected.
ABSTRAK
SINTESIS ZEOLIT BERBASIS SILIKA SEKAM PADI DENGAN METODE ELEKTROKIMIA SEBAGAI ADSORBEN RHODAMIN B
Oleh
Hanif Amrulloh ZA
Dalam penelitian ini telah dilakukan pembuatan zeolit sintetik dari silika sekam padi dan logam aluminium dengan metode elektrokimia, selanjutnya diuji aktivitasnya sebagai adsorben Rhodamin B setelah dikalsinasikan pada suhu 300
oC. Untuk membuat zeolit dengan komposisi yang berbeda, digunakan variasi pH
4, 5, 6, 8, 10 dan waktu elektrolisis 15, 30, 45, 60 menit. Empat zeolit dengan kapasitas adsorpsi tertinggi selanjutnya dikarakterisasi dengan SEM-EDS, dan sampel dengan kapasitas adsorpsi terbaik dikarakterisasi dengan BET. Hasil yang didapatkan, menunjukkan bahwa zeolit yang digunakan dihasilkan pada pH 8 dan waktu elektrolisis 30 menit, pH 4 dan waktu elektrolisis 15 menit, pH 10 dan waktu elektrolisis 15 dan 30 menit. Kapasitas adsorpsi tertinggi didapatkan dari sampel yang dihasilkan pada pH 8 dan waktu 30 menit, sebesar 0,1206 mg/g. Zeolit yang dihasilkan memiliki luas permukaan 79,479 m2/g dan diameter pori 18,387 nm. Kapasitas adsorpsi zeolit diketahui lebih kecil dibandingkan silika sekam padi, yaitu 1,0585 mg/g. Alasan utamanya adalah karena luas permukaan silika yang lebih besar, yaitu 380,272 m²/g dan diameter pori 9.934 nm. Hasil analisis SEM-EDS menunjukkan bahwa variabel elektrokimia yang dipelajari mempengaruhi komposisi zeolit yang dihasilkan.
RIWAYAT HIDUP
Penulis dilahirkan di Bumi Nabung, 21 tahun silam tanggal 30 April 1993 sebagai anak pertama dari tiga bersaudara, dari Bapak M. S. Zamroni Aly dan Ibu Endah Wahyuni.
Penulis menyelesaikan pendidikan dasar di SDN 4 Metro Barat Kota Metro dan menyelesaikannya tahun 2004, pendidikan tingkat menengah hingga tahun 2007 di SMP Negeri 3 Kota Metro. Kemudian penulis melanjutkan pendidikan di SMA Negeri 3 Kota Metro dan menyelesaikannya tahun 2010. Pada tahun yang sama, penulis diterima sebagai mahasiswa Jurusan Kimia FMIPA Universitas Lampung melalui jalur Seleksi Nasional Masuk Perguruan Tinggi Negeri (SNMPTN).
“Berangkatlah kamu baik dalam keadaan
merasa ringan maupun berat, dan berjihadlah kamu
dengan harta dan dirimu dijalan Allah, yang
demikian itu adalah lebih baikbagimu,
jika kamu mengetahui.”
(Q.S, At Taubah; 41)
“Maka apabila telah selesai (dari sesuatu urusan), kerjakanlah dengan sungguh-sungguh (urusan) yang lain.”
SANWACANA
Segala Puji bagi Allah, Rabb semesta alam atas nikmat-Nya yang tak terhingga, kasih sayang-Nya yang tak terbilang, serta nikmat persaudaraan yang senantiasa terjaga hingga hari ini sehingga penulis dapat menyelesaikan skripsi yang berjudul SINTESIS ZEOLIT BERBASIS SILIKA SEKAM PADI DENGAN
METODE ELEKTROKIMIA SEBAGAI ADSORBEN RHODAMIN B. Shalawat teriring salam semoga tersampaikan kepada Rasulullah SAW beserta keluarga dan sahabat serta umatnya di akhir zaman, Aamiin.
Teriring doa nan tulus jazaakumullah khaiiran katsir, penulis mengucapkan terima kasih kepada:
1. Bapak Wasinton Simanjuntak, Ph. D. selaku Pembimbing I penulis atas seluruh dedikasi yang beliau berikan selama menempuh pendidikan di kampus, atas semua kesabaran, keikhlasan, bimbingan dan nasihat yang diberikan hingga penelitian dan skripsi ini dapat terselesaikan. Semoga Allah membalas kebaikan beliau dengan baraakah yang tidak ternilai.
3. Ibu Kamisah D Pandiangan, M. Si. selaku Pembahas dalam penelitian penulis atas semua bimbingan, nasihat, dan kesabaran beliau sehingga skripsi ini dapat terselesaikan. Semoga Allah membalasnya dengan kebaikan. 4. Ibu Dian Septiani P, M. Si. selaku pembimbing akademik atas nasehat,
bimbingan serta motivasi yang diberikan kepada penulis.
5. Bapak Dr. Eng. Suripto Dwi Yuwono, M. T. selaku Ketua Jurusan Kimia FMIPA Unila.
6. Bapak dan Ibu Dosen Jurusan Kimia FMIPA Universitas Lampung atas seluruh dedikasi dan ilmu yang diberikan selama penulius menempuh perkuliahan. Semoga Allah melimpahkan baraakah kepada Bapak dan Ibu. 7. Bapak Prof. Suharso, Ph.D selaku dekan Fakultas Matematika dan Ilmu
Pengetahuan Alam Universitas Lampung.
8. Teriring syukur ananda, matur sembah nuwun kagem Bapak Zamroni Aly lan Ibu Endah Wahyuni, atas seluruh cinta, kasih sayang, kesabaran, keikhlasan, doa serta semua dedikasi dalam mendidik ananda, semoga Allah membalas cintanya dengan jannah-Nya, aamiin Allahuma aamiin.
9. Adinda Azis Fajar Setiawan dan M. Danang M’aruf serta keluarga besar, atas semua doa dan kasih sayangnya sehingga penulis dapat menyelesaikan skripsi ini.
11. Jazaakumullah ahsanul jazaa teruntuk Adinda Vina Ulwiyatul Khajar atas semua doa, dukungan, dan nasihat yang diberikan kepada penulis. Semoga Allah membalasnya dengan kebaikan.
12. Rekan kerja penelitian Faradilla Syani, Leni Astuti, Funda Elisya, Mbak Ruth Meta M, S. Si., Mbak Juwita Ratna Sari, S. Si., Mbak Luh Gede Rai P., S. Si., Mbak Nurjanah, S. Si., Bu Laila, S.Si., Bu Rina, S.Pd., serta adik-adik satu bimbingan terima kasih untuk semua kerjasama dan bantuannya.
13. Rekan-rekan Kimia Angkatan 2010 terima kasih untuk persaudaraan, cerita dan kenangan yang dibina selama menempuh pendidikan di kampus.
14. Rekan-rekan SPIK Himaki FMIPA Unila 2012-2013 Fafai, Shifa, Kristi, Ely, Jeje, Ridho, Gegek, Yudha, Yunia dan semua pengurus Himaki FMIPA Unila 2012-2013 terima kasih untuk semua cinta, kekeluargaan, keceriaan dan kerjasama kita.
15. Rekan-rekan DPM FMIPA Unila 2013-2014 Muhammad Chairuddin, Rido Septadinata, Mujiono dan Siti Fadilah terima kasih untuk persaudaraan, keceriaan, kerjasama, dan kebersamaan kita.
16. Rekan-rekan Olimpiade Sains Unila Hapin Afriyani, S. Si., Wesly dan Arinta terima kasih untuk kerjasama dan pengalaman hidup yang tak akan penulis lupakan.
17. Uni Kidas, Mb Liza, Mb Nora, Mas Nomo dan Pak Gani terima kasih atas seluruh bantuan yang diberikan kepada penulis.
Penulis menyadari bahwa dalam penulisan skripsi ini masih terdapat kekurangan dan kesalahan, untuk itu penulis mengharapkan kritik dan saran yang membangun demi perbaikan penulisan di masa datang. Semoga bermanfaat.
Bandar Lampung, Juli 2014 Penulis
DAFTAR ISI
b. Faktor-Faktor yang Mempengaruhi Adsorpsi ... 23
c. Isoterm Adsorpsi ... 23
1. Isoterm Adsorpsi Freundlich ... 23
2. Isoterm Adsorpsi Langmuir ... 24
D.Elektrolisis …… ... 26
1. Faktor-Faktor yang Mempengaruhi Elektrolisis ... 27
2. Reaksi pada Elektroda ... 27
3. Hukum Faraday ... 28
F. Karakterisasi Zeolit ... 29
1. Difraksi Sinar-X (XRD) ... 30
2. Brunauer-Emmett-Teller (BET) ... 32
3. Scanning Electron Microscope-Energy Dispersive Spectrometer (SEM/EDS)……… 36
2. Ekstraksi Silika dengan Metode Presipitasi … ... 41
3. Pembuatan Sol Silika Sekam Padi …… ... 42
4. Pembuatan Zeolit dengan Metode Elektrolisis ... 42
5. Karakterisasi Adsorben ... 43
a. Karakterisasi dengan Difraksi Sinar-X (XRD) ... 43
b. Karakterisasi dengan SEM/EDS ... 44
c. Karakterisasi dengan BET ... 45
E. Pembuatan Zeolit dengan Metode Elektrokimia ... 56
F. Penentuan Panjang Gelombang Maksimum Rhodamin B ... 59
1. Penentuan Adsorben Optimum ... 61
2. Penentuan Waktu Setimbang ... 63
3. Pengaruh Konsentrasi Awal ... 64
4. Penentuan pH Optimum ... 65
5. Kinetika Adsorpsi ... 66
6. Isoterm Adsorpsi ... 67
H. Karakterisasi Adsorben ... 69
1. X-Ray Diffractometer (XRD) ... 69
2. Scanning Electron Microscope-Energy Dispersive Spectrometer (SEM/EDS) ... 70
3. Brunauer-Emmett-Teller (BET) ... 75
V. SIMPULAN DAN SARAN ... 80
A. Simpulan ... 80
B. Saran ... 81
DAFTAR TABEL
Tabel Halaman
1. Contoh zeolit alam yang umum ditemukan... 7
2. Rumus oksida beberapa jenis zeolit sintetik... 9
3. Komposisi sekam padi... ... 12
4. Karakteristik silika sekam padi yang dihasilkan dengan dengan metode IPSIT... 17
5. Perbedaan antara adsorpsi fisika dengan adsorpsi kimia ... 22
6. Hasil sintesis zeolit... 58
7. Hasil uji adsorpsi Rhodamin B dengan silika dan zeolit sintetik... 62
8. Ringkasan perhitungan kinetika orde dua semu adsorpsi Rhodamin B dengan silika sekam padi... 66
9. Nilai parameter isoterm adsorpsi Rhodamin B dengan silika sekam padi... 68
DAFTAR GAMBAR
Gambar Halaman
1. Struktur kimia zeolit ... 6
2. Struktur molekul Rhodamin B ... 18
3. Kurva isotermal Langmuir ... 25
4. Skema alat difraksi sinar-X ... 30
5. Difraksi dari bidang kristal... 32
6. Tipe adsorpsi dan desorpsi isotermis pada padatan atau bahan mesopori dan mikropori ... 35
7. Skema alat Scanning Electron Microscope... 36
8. Mikrostruktur zeolit NaP1... 37
9. Hasil analisis EDS kaolin ... 38
10. Sekam padi ... 53
11. Sol natrium silikat ... 54
12. Gel silika sebelum dicuci ... 54
13. Gel silika setelah dicuci ... 55
14. Reaktor sintesis zeolit ... 56
15. Proses sintesis ... 57
16. Mekanisme sintesis zeolit ... 57
17. Panjang gelombang maksimum Rhodamin B ... 59
19. Proses adsorpsi Rhodamin B ... 61
20. Kurva waktu setimbang adsorpsi Rhodamin B dengan silika sekam padi ... 63
21. Kurva pengaruh konsentrasi awal adsorpsi Rhodamin B dengan silika sekam padi ... 64
22. Kurva pH optimum adsorpsi Rhodamin B dengan silika sekam padi .... 65
23. Kurva model orde dua semu adsorpsi Rhodamin B dengan silika sekam padi ... 66
24. Kurva isoterm adsorpsi Rhodamin B dengan silika sekam padi ... 67
25. Pola difraksi sinar-x silika ... 69
26. Mikrogram perbesaran 10.000x ... 71
27. Mikrogram perbesaran 50.000x ... 72
28. EDS silika ... 73
29. EDS zeolit sintetik ... 74
30. Kurva dan hasil Multi-Point BET plot silika ... 76
31. Kurva dan hasil Multi-Point BET plot zeolit sintetik ... 77
32. Kurva dan hasil adsorpsi BJH silika ... 78
I. PENDAHULUAN
A. Latar Belakang
Salah satu industri yang terus berkembang pesat di Indonesia adalah industri tekstil, yang telah berperan penting untuk memenuhi kebutuhan dalam negeri maupun sebagai sumber devisa. Permasalahan utama dengan industri ini adalah limbah cair yang jumlahnya sangat besar dan mengandung zat warna tekstil, sehingga memerlukan penanganan yang cermat sebelum limbah dilepas ke
lingkungan bebas, karena zat warna tekstil merupakan senyawa kimia yang sangat stabil dan berbahaya bagi makhluk perairan. Salah satu contoh zat warna yang sering digunakan dalam industri tekstil adalah Rhodamin B.
Karena masalah zat warna tekstil, berbagai metode penanganan telah
lumpur (Zaman dan Huboyo, 2011) dan zeolit alam (Anshari, 2011; Ambarwati, 2005).
Zeolit alam telah dikenal sejak lama sebagai adsorben yang efektif untuk berbagai peruntukan termasuk untuk pengolahan limbah (Anshari, 2011). Namun
demikian, bahan ini memiliki sejumlah kelemahan antara lain mengandung banyak pengotor, komposisi yang beragam serta kristalinitasnya kurang baik. Karena kelemahan tersebut, dewasa ini yang banyak diaplikasikan adalah zeolit sintetik. Zeolit sintetik menjadi perhatian, karena memiliki berbagai keunggulan dibanding zeolit alam, antara lain komposisinya dapat diatur sehingga sifatnya memenuhi persyaratan sesuai dengan penggunaannya, dan memiliki kemurnian yang tinggi karena dapat dihasilkan dari bahan baku yang murni.
Zeolit sintetik dapat dibuat dari berbagai bahan baku, karena komponen utama zeolit adalah silika dan alumina dengan komponen minor berupa kation, terutama alkali misalnya Na dan K (Donahoe and Liou, 1984), dan alkali tanah misalnya Mg dan Ca (Pradhan et al., 2004). Berdasarkan komposisi ini, sifat zeolit sintetik pada dasarnya ditentukan oleh nisbah Si/Al, sehingga nisbah ini dapat digunakan sebagai dasar untuk membuat zeolit dengan sifat-sifat yang berbeda.
pemanasan dengan microwave dari campuran natrium aluminat dan natrium silikat (Azizi et al., 2012).
Dalam pengembangan zeolit sintetik, silika sekam padi merupakan bahan baku yang sangat potensial karena didukung oleh berbagai faktor. Sekam padi merupakan residu pertanian yang jumlahnya melimpah di Indonesia, termasuk Provinsi Lampung. Sebagai gambaran, data Biro Pusat Statistik (BPS) Provinsi Lampung menunjukkan bahwa pada tahun 2012 produksi padi mencapai 3 juta ton. Hasil penelitian (Widowati, 2001) menunjukkan, sekitar 20% dari gabah kering adalah sekam, dengan demikian potensi sekam yang ada di Provinsi Lampung ada sekitar 600.000 ton. Hasil penelitian Sharma et al.(1984) juga menunjukkan, bahwa sekam padi mengandung silika sekitar 22%. Dengan demikian, potensi silika sekam padi yang dimiliki Provinsi Lampung mencapai 136.000 ton. Silika sekam padi diketahui larut dalam larutan alkali, sehingga dapat diperoleh dengan mudah menggunakan metode ekstraksi alkalis misalnya dengan NaOH dan KOH (Kalaphathy et al., 2000; Daifullah et al., 2003; Pandiangan dkk., 2009; Pandiangan dkk., 2008; Suka dkk., 2008).
Prinsip dasar gagasan ini adalah, elektrolisis logam aluminium yang ditempatkan dalam sol silika sekam padi. Dalam proses ini, logam aluminium akan teroksidasi menjadi kation Al3+, yang akan terlarut secara merata dalam sol silika. Dengan demikian, diharapkan akan diperoleh produk yang sangat homogen. Di samping itu, secara umum telah diketahui bahwa proses elektrokimia dapat dikendalikan dengan mengatur variabel elektrokimia yang diterapkan, dua yang paling utama adalah pH larutan dan waktu elektrolisis. Hal ini berarti, jumlah kation Al3+ yang terbentuk dalam proses elektrolisis dapat diatur dengan mengatur kedua variabel di atas, yang berarti juga bahwa nisbah Si/Al dapat diatur dengan mengatur variabel elektrokimia tersebut.
Sesuai dengan latar belakang yang dipaparkan di atas, masalah utama yang dipelajari dalam penelitian ini adalah bagaimana pengaruh pH larutan dan waktu elektrolisis terhadap nisbah Si/Al zeolit sintetik yang dihasilkan dan bagaimana hubungan komposisi Si/Al dengan unjuk kerja zeolit sebagai adsorben zat warna tekstil Rhodamin B.
B. Tujuan Penelitian
1. Mendapatkan zeolit sintetik dengan nisbah Si/Al yang berbeda. 2. Mendapatkan informasi tentang pengaruh pH dan waktu elektrolisis
terhadap nisbah Al/Si zeolit sintetik yang dihasilkan.
C.Manfaat Penelitian
1. Membuka peluang untuk mendapatkan nilai tambah dari sekam padi 2. Membuka peluang untuk penanganan zat warna tekstil yang lebih murah
II. TINJAUAN PUSTAKA
A.Zeolit
1. Pengertian Zeolit
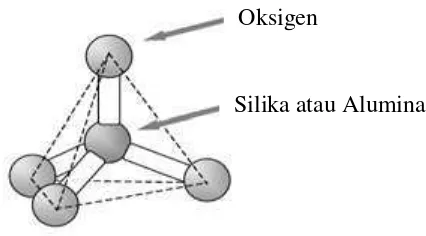
Zeolit adalah mineral kristal alumina silikat berpori terhidrat yang mempunyai struktur kerangka tiga dimensi terbentuk dari tetrahedral [SiO4]4- dan [AlO4]5-.
Kedua tetrahedral di atas dihubungkan oleh atom-atom oksigen, menghasilkan struktur tiga dimensi terbuka dan berongga yang didalamnya diisi oleh atom-atom logam biasanya logam-logam alkali atau alkali tanah dan molekul air yang dapat bergerak bebas (Breck, 1974; Chetam, 1992; Scot et al., 2003).
Umumnya, struktur zeolit adalah suatu polimer anorganik berbentuk tetrahedral unit TO4, dimana T adalah ion Si4+ atau Al3+ dengan atom O berada diantara dua
atom T, seperti ditunjukkan dalam Gambar 1.
Gambar 1. Struktur kimia zeolit (Haag, 1984) Oksigen
Struktur zeolit memiliki rumus umum Mx/n [(AlO2)x(SiO2)y].wH2O, dimana M
adalah kation alkali atau alkali tanah, n adalah jumlah valensi kation, w adalah banyaknya molekul air per satuan unit sel, x dan y adalah angka total tetrahedral per satuan unit sel, dan nisbah y/x biasanya bernilai 1 sampai 5, meskipun ditemukan juga zeolit dengan nisbah y/x antara 10 sampai 100 (Bekkum et al., 1991). Dewasa ini dikenal dua jenis zeolit, yakni zeolit alam dan zeolit sintetis, namun sekarang zeolit yang paling banyak digunakan adalah zeolit sintesis.
2. Zeolit Alam
Zeolit alam ditemukan dalam bentuk mineral dengan komposisi yang berbeda, terutama dalam nisbah Si/Al dan jenis logam yang menjadi komponen minor, seperti diperlihatkan dalam Tabel 1.
Tabel 1. Contoh zeolit alam yang umum ditemukan (Subagjo, 1993)
No. Zeolit Alam Komposisi
1 Analsim Na16(Al16Si32O96).16H2O
metamorfosa yang selanjutnya mengalami proses pelapukan karena pengaruh panas dan dingin (Lestari, 2010). Sebagai produk alam, zeolit alam diketahui memiliki komposisi yang sangat bervariasi, namun komponen utamanya adalah silika dan alumina. Di samping komponen utama ini, zeolit juga mengandung berbagai unsur minor, antara lain Na, K, Ca (Bogdanov et al., 2009), Mg, dan Fe (Akimkhan, 2012).
Terlepas dari aplikasinya yang luas, zeolit alam memiliki beberapa kelemahan, diantaranya mengandung banyak pengotor seperti Na, K, Ca, Mg dan Fe serta kristalinitasnya kurang baik. Keberadaan pengotor-pengotor tersebut dapat mengurangi aktivitas dari zeolit. Untuk memperbaiki karakter zeolit alam sehingga dapat digunakan sebagai katalis, adsorben, atau aplikasi lainnya, biasanya dilakukan aktivasi dan modifikasi terlebih dahulu (Mockovciakova et al., 2007).
3. Zeolit sintetik
Dengan perkembangan penelitian, dewasa ini telah dikenal beragam zeolit sintetik, dan beberapa diantaranya disajikan dalam Tabel 2.
Tabel 2. Rumus oksida beberapa jenis zeolit sintetik (Georgiev et al., 2009)
Zeolit Rumus Oksida
Dewasa ini zeolit sintetik terus dikembangkan, dengan dua fokus utama yaitu bahan baku dan metode. Dari segi bahan baku utama, digunakan 2 jenis bahan baku yakni bahan baku sintetik dan bahan baku limbah. Wongkasemjit et al. (2002) mensintesis zeolit Analcium (ANA) dan Na-P1 (GIS) dari bahan baku sintetik alumatran dan silatran dengan proses sol-gel dan teknik microwave. Alumatran dan silatran digunakan sebagai prekursor untuk menghasilkan aluminosilikat melalui proses sol-gel. NaCl dan NaOH digunakan sebagai agen hidrolisis. Konsentrasi NaOH mempengaruhi bentuk kristalnya, kristal yang sangat baik terbentuk pada konsentrasi NaOH yang tinggi. Proses pembentukan gel adalah reaksi endotermik. Proses pertumbuhan kristal maksimum diketahui
menggunakan differential scanning calorimetry (DSC) terjadi pada suhu 106 oC.
Dengan NaOH/ H2O sebagai agen hidrolisis dan rasio SiO2, Al2O3, Na2O dan H2O
suhu 110 oC, sedangkan ANA terbentuk pada suhu 130 oC selama 8 jam. Ukuran
partikel yang terbentuk, GIS 4,55 µm dan ANA berukuran 9,96 µm.
Sunardi dan Abdullah (2007) melaporkan telah mensintesis zeolit dengan bahan baku abu layang batu bara dengan metode peleburan menggunakan NaOH serta aplikasinya sebagai adsorben logam merkuri (II). Abu layang dan NaOH dicampur dan dihomogenkan lalu dilebur pada temperatur 550 oC selama 60 menit. Hasil peleburan ditambahkan akuades, diaduk selama 12 jam dan dihidrotermalkan pada temperatur 90 oC selama 24 jam. Hasil karakterisasi menggunakan Fourrier Transform Infra Red (FTIR) dan X-Ray Diffraction (XRD) menunjukkan bahwa telah terbentuk zeolit tipe faujasit. Dengan bahan baku yang sama, Laosiripojana et al. (2010) berhasil mensintesis zeolit dengan metode fusi. Abu layang dicampur dengan NaOH kondisi udara pada suhu 450 oC di dalam furnace. Produk yang dihasilkan dilarutkan dengan akuades kemudian diaduk dengan mesin pengaduk selama 12 jam. Kristal yang dihasilkan dicuci dengan akuades dan dikeringkan semalaman dengan suhu 105 oC. Karakterisasi zeolit menggunakan X-Ray Diffraction (XRD) diketahui bahwa zeolit hasil sintesis memiliki rumus oksida 1.08Na2O.Al2O3.1.68SiO2.1.8H2O. Luas
permukaan zeolit hasil sintesis diketahui menggunakan X-ray flouresensi (XRF) dan Brunauer-Emmett-Teller (BET) adalah 49-69 m2/g.
Bahan baku lain yang digunakan dalam sintesis zeolit adalah silika sekam padi. Kamarudin et al. (2004) melaporkan telah mensintesis zeolit dari silika sekam padi, mula-mula sekam padi dibakar dalam furnace pada suhu 450, 600 dan 800
NaOH pada suhu 80 oC selama 2 jam, kemudian dicampurkan dengan gel
(natrium aluminat dan natrium hidoksida) dan dipanaskan pada suhu 100 oC selama 14 jam. Zeolit yang terbentuk dikarakterisasi dengan X-Ray Diffraction (XRD), diketahui zeolit yang terbentuk bertipe zeolit Y dan P. Luas permukaan zeolit yang terbentuk dengan analisis adsorbsi nitrogen diketahui 39-211 m2/g, volume pori 0,014-0,075 cm3/g dan rata-rata diameter pori 2,95-6 nm.
Wittayakun et al. (2008) melaporkan telah mensintesis zeolit NaP dan NaY dari silika sekam padi dengan metode hidrotermal. Dalam pelaksanaannya, proses dilakukan secara hidrotermal pada suhu 100 oC dengan rasio optimum dari SiO2,
Al2O3 dan Na2O adalah 10:1:4,6. Parameter yang dipelajari adalah waktu aging
dan waktu kristalisasi. Dari hasil yang diberikan, waktu aging tidak memberikan efek yang besar, akan tetapi perubahan waktu kristalisasi memberikan hasil transformasi yang signifikan. Untuk melihat perubahan transformasi
menggunakan alat X-Ray Diffraction (XRD) dan Scanning Electron Micrograph (SEM) digunakan untuk melihat distribusi ukuran partikel, pada kondisi optimum ukuran partikelnya 7-14 µm.
(400-900 oC) dalam keadaan udara dan argon, dikarakterisasi menggunakan FTIR,
XRD dan SEM-EDX didapatkan komposit zeolit-karbon membentuk ZSM-5 dan kembali ke fasa kristobalit pada suhu kalsinasi 800 oC.
B.Silika Sekam Padi
Sekam padi merupakan hasil samping penggilingan padi tertinggi sekitar 20% (Widowati, 2001). Hasil penelitian Sharma et al. (1984) menunjukkan bahwa dalam sekam padi terkandung silika dengan kadar sekitar 22%, di samping komponen lain seperti ditunjukkan dalam Tabel 3.
Tabel 3. Komposisi sekam padi (Sharma et al., 1984)
Komposisi Kandungan (% Berat) Senyawa-senyawa organik 73,87
Al2O3 1,23
Fe2O3 1,28
CaO 1,24
MgO 0,21
SiO2 22,12
MnO2 0,074
Pemanfaatan silika yang demikian luas juga didukung kemudahan untuk memperoleh silika dari sekam padi, yakni dengan cara ekstraksi atau dengan pengabuan.
Suka dkk. (2008) berhasil mengkarakterisasi sekam padi Provinsi Lampung dengan metode ekstraksi. Mula-mula sekam padi dipreparasi, sekam padi direndam dalam air panas selama 2 jam dan dicuci berulang-ulang dengan air panas untuk menghilangkan pengotor organiknya. Kemudian, sekam padi yang telah bersih direndam ke dalam KOH 5% selama 60 menit. Filtrat yang diperoleh diasamkan dengan HCl hingga pH mencapai 7,0. Produk yang dihasilkan
dikarakterisasi dengan FTIR, muncul puncak Si-OH dan Si-O-Si yang
menunjukkan adanya gugus fungsi siloksan, yang mengindikasikan bahwa silika sekam padi merupakan silika reaktif. Sifat reaktif silika ini juga didukung hasil karakterisasi menggunakan XRD, yang menunjukkan bahwa silika adalah amorf dengan fase kristobalit. Karakterisasi dengan EDS menunjukkan unsur unsur yang terkandung, meliputi O, Na, Mg, Al, Si, K, dan Ca. Hasil yang didapatkan, sekam padi yang diekstraksi memiliki kadar silika 40,8% dengan kemurnian sekitar 95,53%.
Endapan kemudian disaring dan dioven. Dari hasil yang didapatkan, ekstraksi silika dari abu sekam padi dengan larutan KOH menunjukkan semakin besar waktu dan konsentrasi KOH akan semakin banyak rendemen silika yang
diperoleh. Rendemen pengambilan terbesar yaitu 50,97% pada konsentrasi KOH 10% dengan waktu ekstraksi 90 menit.
Menurut Mittal (1997) reaksi yang terjadi antara SiO2 yang terkandung dalam abu
sekam padi dengan larutan alkali, larutan KOH adalah sebagai berikut:
SiO2 + 2KOH K2SiO3 + H2O
Kemudian, dalam larutan tersebut ditambahkan asam, larutan HCl yang
digunakan untuk mengikat kalium sehingga dihasilkan SiO2. Reaksi yang terjadi
sebagai berikut:
K2SiO3 + 2HCl SiO2 + 2KCl + H2O
Selain ekstraksi menggunakan alkali, Zulhajri dkk. (2000) mengekstrak silika dari sekam padi dengan cara perendaman di dalam larutan asam klorida dengan
konsentrasi 0%, 1%, 3%, 5%, dan 10% selama 24 jam dilanjutkan dengan
pengabuan pada suhu pemanasan 900 oC selama 2 jam dan pengekstrakan dengan asam nitrat encer. Residu kemudian dipanaskan pada suhu 900 oC selama 2 jam. Asam klorida digunakan, karena cenderung bereaksi dengan oksida logam
Selain itu, Javed et al. (2010) mempelajari bagaimana pengaruh kalium
permanganat terhadap sekam padi dan kualitas silika amorf yang dihasilkan dari pembakaran sekam padi. Sekam padi direndam dalam larutan KMnO4 (0,001 N)
pada suhu ruang selama 30 menit dan digunakan sekam padi tanpa larutan
KMnO4 sebagai pembanding. Sekam padi dengan perlakuan dan tanpa perlakuan
kemudian dianalisis dengan SEM dan Thermogravimetric Analyses (TGA). Dari hasil analisis SEM, menunjukkan bahwa selulosa dan zat-zat organik dapat larut ke dalam larutan KMnO4. Analisis TGA dari sekam padi menunjukkan bahwa
degradasi termal dari sekam padi dengan perlakuan relatif lebih cepat dibandingkan dengan sekam padi tanpa perlakuan, yang disebabkan karena adanya pembentukan oksigen dari dekomposisi KMnO4.
Abu sekam padi yang dihasilkan dari pembakaran dengan furnace pada suhu 750 oC selama 1 jam, dikarakterisasi dengan XRD dan FTIR untuk mengetahui kualitas silika yang dihasilkan. Hasil analisis FTIR menunjukkan bahwa ikatan O-Si-O dalam abu sekam padi yang dihasilkan menjadi lemah akibat penambahan kalium permanganat. Dengan analisis XRD menunjukkan bahwa penambahan larutan kalium permanganat ke sekam padi menghasilkan silika amorf kualitas baik.
Karena teknologi dalam pembuatan silika dari sekam padi mengalami
2007), dimana metode ini dapat diaplikasikan dalam skala industri. Secara garis besar, teknologi ini melibatkan tiga proses, seperti disajikan di bawah ini.
Digesti
Abu + NaOH (l) Na2O.xSiO2 (l) + Abu tak larut
Presipitasi
Na2O.xSiO2 (l) + CO2 (g) xSiO2(s) + Na2CO3(l)
Regenerasi
Na2CO3(l) + Ca(OH)2(s) CaCO3(s) + 2NaOH (l)
Dengan metode ini tahap pertama adalah digesti, mula mula abu sekam padi dilarutkan ke dalam larutan NaOH agar terbentuk natrium silikat kemudian disaring dan filtrat yang bersih siap untuk diendapkan. Langkah selanjutnya adalah presipitasi, pada langkah ini bertujuan untuk mengendapkan silika dari larutan natrium silikat. Gas karbon dioksida dengan laju alir tertentu dilewatkan ke larutan silikat. Diaduk terus menerus dan endapan silika disaring dan dicuci dengan air untuk menghilangkan garam anorganik. Filtrat yang dihasilkan digunakan untuk tahap regenerasi.
Regenerasi adalah tahap dimana penambahan kalsium akan bereaksi dengan natrium karbonat membentuk kalsium karbonat dan natrium hidroksida. Filtrat hasil proses pengendapan ditambahkan kalsium dan akan membentuk kalsium karbonat dan natrium hidroksida, kemudian disaring untuk menghilangkan
kembali. Penerapan metode ini menghasilkan silika dengan sifat-sifat seperti disajikan dalam Tabel 4.
Tabel 4. Karakteristik silika sekam padi yang dihasilkan dengan dengan metode IPSIT
Sifat Bubuk Amorf
Penampilan Bubuk Putih
Kemurnian >98%
Luas Permukaan Area 50-300 m2/gm Berat jenis kotor 120-400 g / liter Pengurangan pengapian 3,0-6,0% pH dari 5% bubur 6.4 ± 0.5 Kehilangan panas 4.0-7.0%
C.Pengolahan Limbah Zat Warna Tekstil
Limbah tekstil mengandung bahan-bahan yang berbahaya bila dibuang ke lingkungan, terutama di daerah perairan. Sebagian besar bahan yang terdapat dalam limbah tekstil adalah zat warna, terutama zat warna sintetik. Zat warna sintetik merupakan molekul dengan sistem elektron terdelokalisasi dan
mengandung dua gugus fungsi yaitu kromofor dan auksokrom. Kromofor berfungsi sebagai penerima elektron, sedangkan auksokrom sebagai pemberi elektron yang mengatur kelarutan dan warna. Gugus kromofor yang penting yaitu gugus azo (-N=N-), gugus karbonil (-C=O), gugus etilen (-C=C-), dan gugus nitro (-NO2). Sedangkan beberapa gugus auksokrom yang penting adalah –NH2,
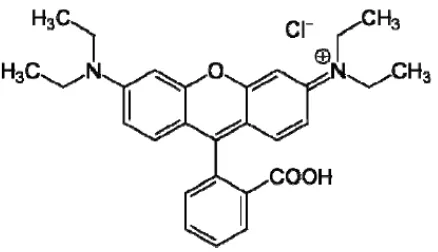
Salah satu zat warna yang umum digunakan adalah Rhodamin B, yang memiliki struktur kimia seperti ditunjukkan dalam Gambar 2.
Gambar 2. Struktur molekul Rhodamin B (Ismadji dkk., 2005)
Rhodamin B adalah zat warna berbahaya yang sering digunakan dalam dunia industri. Walaupun Rhodamin B tidak diklasifikasikan berdasarkan
karsinogenitasnya terhadap manusia (IARC, 1987), tetapi beberapa penelitian menunjukkan bahwa Rhodamin B dapat menyebabkan iritasi pada manusia dan menyebabkan kanker terhadap beberapa hewan percobaan (HSDB, 2002). Lebih lagi, dalam konsentrasi tinggi efek kronis Rhodamin B dapat menyebabkan kerusakan pada hati (Cahyadi, 2006).
Dalam upaya pengolahan limbah zat warna, beberapa metode telah
dikembangkan, dan secara umum dapat dibedakan menjadi metode biologi, kimia, dan fisika.
1. Pengolahan Limbah Secara Biologi
sp., Pseudomonas sp., dan Flavobacterium sp. Sebaliknya, ada beberapa bakteri yang dilaporkan mampu mendegradasi zat warna azo pada kondisi aerob
diantaranya adalah Plesimonas sp., dan Vibrio sp. (Sastrawidana, 2009).
Pada kondisi anaerob, degradasi zat warna tekstil menggunakan bakteri lebih cepat dibandingkan dengan kondisi aerob, namun kelemahannya yaitu
menghasilkan amina aromatik yang bersifat lebih toksik dibandingkan dengan zat warna azo itu sendiri (Van der Zee, 2002). Hasil uji toksisitas menunjukkan degradasi limbah tekstil pada kondisi anaerob lebih toksik dibandingkan dengan limbah awal (Sastrawidana, 2009).
Jamur yang dilaporkan mampu untuk mendegradasi zat warna khususnya zat warna azo merupakan jenis jamur pendegradasi kayu diantaranya adalah
Phanerocheate chrysosporium (Shingh et al., 2009), Irpex lacteus (Tavcar et al.,
2006), dan Polyporus Rubidus (Dayaram and Dasgupta, 2008). Degradasi menggunakan jamur juga menghasilkan produk toksik meskipun toksisitasnya lebih rendah daripada produk yang dihasilkan dari proses biodegradasi
menggunakan bakteri (Hakala, 2007).
2. Koagulasi
Koagulasi merupakan salah satu metode pengolahan limbah zat warna secara kimia. Prinsip koagulasi adalah proses pengendapan partikel yang tersuspensi dalam air atau limbah cair dengan cara penetralan muatan partikel oleh muatan koagulan yang berlawanan (Viesman and Hammer, 1998). Akibat penetralan muatan ini, partikel polutan dalam air akan menggumpal karena berkurangnya gaya kohesi antar partikel (Gregor et al., 1997). Dalam aplikasinya, koagulasi dapat dibedakan atas koagulasi konvensional dan koagulasi secara elektrokimia atau elektrokoagulasi.
Koagulasi konvensional pada umumnya dilakukan dengan menebar koagulan ke dalam air limbah yang akan diolah untuk menurunkan kekeruhan, warna, senyawa patogen dan kontaminan (Viesman and Hammer, 1998; Eikebrokk, 1999). Proses koagulasi konvensional secara umum berlangsung dengan melibatkan empat mekanisme utama, yakni netralisasi muatan, penjebakan, absorpsi dan interaksi kimia (Thomas et al., 1999). Bahan-bahan kimia yang digunakan sebagai koagulan antara lain adalah alumunium sulfat, Al2(SO4)3 (Gregor et al., 1997);
ferrosulfat hidrat, FeSO4.7H2O; ferri klorida, FeCl3 (Ritter et al.,1999); ferri
sulfat, Fe(SO4)3; dan polialumunium klorida, [Al2(OH)nCl6-n]m (Tumbas et al.,
1999).
menggunakan elektroda sebagai koagulan dan melibatkan berbagai mekanisme untuk menghilangkan polutan yang ada dalam air. Umumnya elektroda yang sering digunakan adalah logam Al (Holt et al., 2002), Fe (Jiang et al., 2002), dan Pt/ I (Buso et al., 1997).
Kelemahan dari metode koagulasi adalah karena prosesnya adalah pengendapan sehingga akan menghasilkan endapan, sehingga semakin banyak limbah yang diproses maka semakin banyak endapan yang dihasilkan dan membutuhkan penanganan lebih lanjut. Dalam proses elektrokoagulasi menggunakan logam, sehingga semakin lama logam yang digunakan akan semakin habis terkikis dan juga membutuhkan energi listrik yang banyak
3. Adsorpsi
Adsorpsi merupakan peristiwa penyerapan pada permukaan suatu adsorben, misalnya adsorpsi zat padat terhadap gas atau zat cair oleh suatu zat padat. Zat yang teradsorpsi disebut sebagai adsorbat dan zat pengadsorpsi disebut adsorben (Kasmadi, 2002).
a. Jenis – Jenis Adsorpsi
Adsorpsi oleh zat padat dibedakan menjadi dua, yaitu adsorpsi fisika dan adsorpsi kimia (Adamson, 1990). Adsorpsi fisika umumnya terjadi karena adanya gaya Van der Walls dan berlangsung bolak-balik. Ketika gaya tarik-menarik molekul
antara zat terlarut dengan adsorben lebih besar dari gaya tarik-menarik zat terlarut dengan pelarut, maka zat terlarut akan teradsorpsi di permukaan adsorben.
mengakibatkan kemampuan adsorpsi berkurang. Beberapa perbedaan penting antara adsorpsi fisik dan adsorpsi kimia disajikan pada Tabel 5.
Tabel 5. Perbedaan antara adsorpsi fisika dengan adsorpsi kimia (Bernasconi et al., 1995)
No. Parameter Adsorpsi fisika Adsorpsi kimia
1 Adsorbat Semua gas Kecuali gas mulia
2 Jenis ikatan Fisika Kimia
3 Panas adsorpsi 5 – 10 kkal/gr-mol gas 10-100 kkal/gr-mol gas
4 Temperatur operasi Di bawah suhu kritis Di atas suhu kritis 5 Energi aktivasi Kurang dari 1
kkal/gr-mol
10-60 kkal/gr-mol
6 Reversibilitas Reversible Tidak selamanya
reversible
7 Tebal lapisan Banyak (multilayer) Satu (monolayer)
8 Kecepatan adsorpsi Besar Kecil
9 Jumlah zat
10 Adsorben Semua jenis Terbatas
Pada adsorpsi kimia, molekul yang teradsorpsi pada permukaan bereaksi secara kimia, sehingga terjadi pemutusan dan pembentukan ikatan (Adamson, 1990). Ikatan antara adsorben dan adsorbat dapat cukup kuat sehingga spesies aslinya tidak dapat ditemukan kembali. Adsorpsi ini bersifat irreversibel dan diperlukan energi yang besar untuk melepas adsorbat kembali dalam proses adsorpsi. Pada adsorpsi kimia, umumnya kapasitas adsorpsi akan bertambah dengan
b. Faktor – Faktor yang Mempengaruhi Adsorpsi
Adsorpsi dapat dipengaruhi oleh beberapa faktor, yakni luas permukaan adsorben, ukuran partikel, waktu kontak, dan distribusi ukuran pori. Semakin luas
permukaan suatu adsorben maka semakin banyak adsorbat yang dapat diserap, sehingga proses adsorpsi dapat semakin efektif. Semakin kecil ukuran diameter partikel suatu adsorben maka semakin luas permukaan adsorben sehingga adsorpsi semakin efektif. Waktu kontak yang lebih lama memungkinkan proses difusi dan penempelan molekul adsorbat berlangsung lebih baik sehingga proses adsorpsi akan semakin efektif. Faktor lainnya yakni distribusi pori, distribusi pori akan mempengaruhi distribusi ukuran molekul adsorbat yang masuk kedalam partikel adsorben (Danang, 2008).
c. Isoterm Adsorpsi
Adsorpsi sering dirangkaikan dengan istilah isoterm yang menunjukkan hubungan antara aktivitas (konsentrasi) fase cair dari adsorbat dan jumlah adsorbat pada suhu konstan. Isoterm adsorpsi menunjukkan hubungan kesetimbangan antara konsentrasi adsorbat dalam fluida dan dalam permukaan adsorben pada suhu tetap. Kesetimbangan terjadi pada saat laju pengikatan adsorben terhadap
adsorbat sama dengan laju pelepasannya. Persamaan yang dapat digunakan untuk menjelaskan data percobaan isoterm dikaji oleh Freundlich dan Langmuir.
1. Isoterm Adsorpsi Freundlich
lebih besar dari gaya tarik antar molekul atau gaya tarik menarik yang relatif lemah antara adsorbat dengan permukaan adsorben. Gaya ini disebut gaya van der Waals sehingga adsorbat dapat bergerak dari satu bagian permukaan ke
bagian permukaan lain dari adsorben. Menurut Atkins (1999) pada proses adsorpsi zat terlarut oleh permukaan padatan diterapkan isoterm Freundlich yang diturunkan secara empiris dengan persamaan sebagai berikut:
x/m = k C1/n (1)
Apabila dilogaritmakan, persamaan akan menjadi:
log x/m = log k + 1/n log C (2) Keterangan:
x/m = jumlah adsorbat terjerap per satuan bobot adsorben ( g/g adsorben) C = konsentrasi kesetimbangan adsorbat dalam larutan setelah adsorpsi
(ppm)
k, n = konstanta empiris
Isoterm Freundlich menganggap bahwa pada semua sisi permukaan adsorben akan terjadi proses adsorpsi di bawah kondisi yang diberikan. Isoterm Freundlich tidak mampu memperkirakan adanya sisi-sisi pada permukaan yang mampu mencegah adsorpsi pada saat kesetimbangan tercapai, dan hanya ada beberapa sisi aktif saja yang mampu mengadsorpsi molekul terlarut (Jason, 2004).
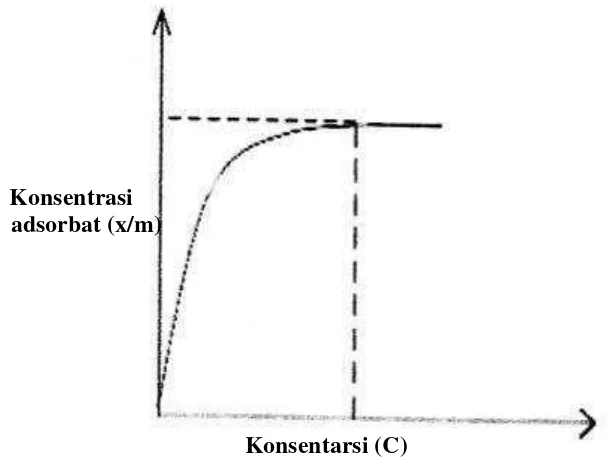
2. Isoterm Adsorpsi Langmuir
Kurva isoterm adsorpsi Langmuir disajikan dalam Gambar 3.
Konsentrasi adsorbat (x/m)
Konsentarsi (C)
Gambar 3. Kurva isotermal Langmuir.
Persamaan isoterm adsorpsi Langmuir dapat diturunkan secara teoritis dengan menganggap terjadinya kesetimbangan antara molekul-molekul zat yang diadsorpsi pada permukaan adsorben dengan molekul-molekul zat yang tidak teradsorpsi.
Adapun persamaan isoterm Langmuir adalah sebagai berikut :
C merupakan konsentrasi adsorbat dalam larutan, q merupakan konsentrasi adsorbat yang terjerap per gram adsorben, k merupakan konstanta yang berhubungan dengan afinitas adsorpsi dan q
max merupakan kapasitas adsorpsi
maksimum dari adsorben (Jason, 2004).
D.Elektrolisis
Elektrolisis adalah proses penggunaan energi listrik menjadi energi kimia. Dalam proses elektrolisis, larutan yang dihasilkan tidak hanya menghantarkan arus listrik, melainkan juga mengalami perubahan kimia. Perubahan kimia yang terjadi selama proses elektrolisis mudah dilihat di sekitar elektroda, walaupun perubahan ini hanya berupa penguraian sederhana (Svehla, 1985).
Aliran listrik melalui suatu konduktor (penghantar) melibatkan perpindahan elektron dari potensial negatif tinggi ke potensial lainnya yang lebih rendah. Mekanisme dari transfer ini tidak sama untuk berbagai konduktor. Dalam penghantar elektronik, seperti padatan dan lelehan logam, penghantaran berlangsung melalui perpindahan elektron langsung melalui penghantar dari potensial yang diterapkan. Dalam hal ini, atom-atom penyusun penghantar listrik tidak terlibat dalam proses tersebut. Akan tetapi penghantar elektrolistrik yang mencangkup larutan elektrolit dan lelehan garam-garam. Penghantaran
1. Faktor-Faktor yang Mempengaruhi Elektrolisis
Faktor-faktor yang mempengaruhi proses elektrolisis yaitu kerapatan listrik, waktu, tegangan, kadar keasaman (pH), ketebalan plat, dan jarak antar elektroda (Putero dkk., 2008).
Pemilihan elektroda juga berpengaruh dalam proses elektrolisis. Faktor-faktor yang dipertimbangkan ketika memilih bahan elektroda adalah stabilitas fisik dan kimiawi yang meliputi ketahanan terhadap korosi, pembentukan oksida dan hidrida tertentu, laju dan selektivitas produk yang akan terbentuk, konduktivitas listrik, factor ketahanan dan harga, serta kesesuaian dengan desain sel atau system (Artadi, 2007).
2. Reaksi Pada Elektroda
Apabila listrik dialirkan melalui lelehan senyawa ion maka senyawa ion itu akan diuraikan. Kation direduksi di katoda, sedangkan anion dioksidasi di anoda. Reaksi elektrolisis dalam larutan elektrolit berlangsung lebih kompleks. Spesi yang bereaksi belum tentu kation atau anionnya, tetapi mungkin saja air atau elektrodanya. Hal itu bergantung pada potensial spesi-spesi yang terdapat dalam larutan (Keenan et al., 1984).
3. Hukum Faraday
Akibat aliran arus listrik searah ke dalam larutan elektrolit akan terjadi perubahan kimia dalam larutan tersebut. Menurut Michael Faraday (1834) lewatnya arus 1 F mengakibatkan oksidasi 1 massa ekivalen suatu zat pada suatu elektroda (anoda) dan reduksi 1 massa ekivalen suatu zat pada elektroda yang lain (katoda) (Mollah et al., 2004).
Hukum Faraday I : Massa zat yang timbul pada elektroda karena elektrolisis berbanding lurus dengan jumlah listrik yang mengalir melalui larutan.
Keterangan:
W = massa zat yang diendapkan (g) Ar = Massa atom relatif (g/mol) n = valensi ion
t = waktu (detik)
F = bilangan faraday = 96500 C
E.Spektrometer UV-Vis
Prinsip dari spektrometer UV-Vis adalah interaksi elektromagnetik yang dipancarkan oleh sumber energi dengan materi, dimana hasil interaksi radiasi UV-Vis terhadap materi mengakibatkan materi tersebut mengalami transisi elektronik (Fessenden dan Fessenden, 1999). Transisi elektronik yang diserap atau absorbansi tersebut sebanding dengan jumlah senyawa organik yang ada dalam sampel. Senyawa-senyawa yang dianalisis dengan spektrofotometer UV-Vis mampu mengabsorbsi sinar pada panjang gelombang UV 200-380 nm dan UV-Vis pada 380-780 nm (Supriyanto, 1999).
Spektrofotometer UV-Vis untuk penentuan konsentrasi didasarkan pada hukum Lambert-Beer. Lambert menyelidiki mengenai hubungan antara adsorpsi radiasi dengan panjang gelombang melalui medium yang dapat menyerap cahaya. Bila suatu sinar radiasi monokromatik melewati suatu medium dengan ketebalan tertentu, diketahui bahwa tiap lapisan menyerap radiasi yang dipancarkan dengan jumlah bagian yang sama. Dari hukum Lambert dan Beer dapat dilihat adanya hubungan antara absorbansi dengan konsentrasi, atau dikenal dengan hukum Lambert-Beer, dimana secara matematis persamaannya dapat ditulis sebagai berikut:
A = ɛ . b . c (5) Keterangan:
A = Absorbansi larutan
ɛ = koefisien ekstingsi molar (serapan molar) (cm-1M-1) b = tebal medium (larutan) (cm)
c = konsentrasi larutan (M)
Berdasarkan hal yang telah dijelaskan di atas, maka spektrofotometer UV-Vis digunakan untuk memantau proses adsorpsi zeolit sintetik dalam penelitian ini, karena alat ini dapat memantau perubahan konsentrasi zat warna Rhodamin B setelah proses adsorpsi yang ditunjukkan pada hubungan absorbansi dengan konsentrasi.
F. Karakterisasi Zeolit
1. Difraksi Sinar –X (XRD)
Sinar –X merupakan suatu bentuk radiasi elektromagnetik yang berbeda dengan sinar ( = 400-800 nm) yaitu mempunyai panjang gelombang lebih pendek ( ≈ 0,1 nm). Hamburan sinar ini dihasilkan jika suatu elektroda logam ditembak dengan elektron-elektron kecepatan tinggi dalam tabung vakum (Smallman,1991).
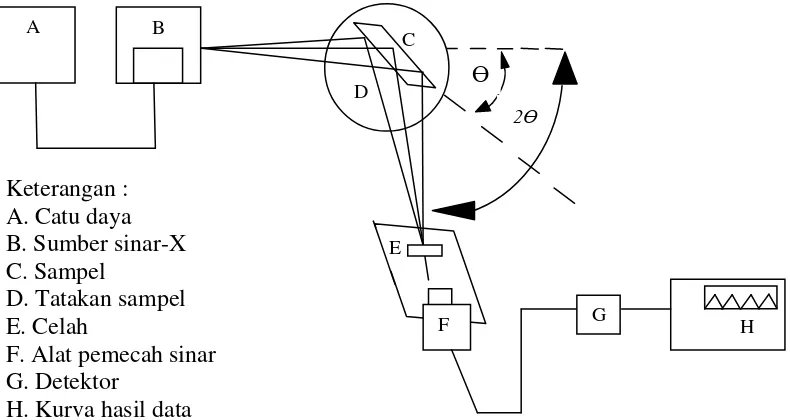
Elektron tersebut mengalami perlambatan saat masuk ke dalam logam dan menghasilkan radiasi dengan jarak panjang gelombang kontinu yang disebut Bremsstrahlung. Skema alat difraksi sinar –X disajikan pada Gambar 4.
Gambar 4. Skema alat difraksi sinar-X (Callister, 2009)
Secara umum prinsip kerja XRD adalah sebagai berikut :
1. Generator tegangan tinggi (A) berfungsi sebagai catu daya sumber sinar-X (B).
3. Berkas sinar-X didifraksikan oleh sampel dan difokuskan melewati celah (E), kemudian masuk ke alat pencacah (F).
4. Intensitas difraksi sinar-X direkam (G) dan ditampilkan dalam bentuk kurva (H) terhadap jarak antar bidang d.
Analisis menggunakan alat difraktometer sinar-X didasarkan pada pola difraksi dari paduan atau senyawa yang dihasilkan oleh proses difraksi, ukuran panjang gelombang sinar-X harus tidak berbeda jauh dengan jarak antar atom di dalam kristal, sehingga pola berulang dari kisi kristal akan berfungsi seolah-olah seperti kisi difraksi untuk panjang gelombang sinar-X.
Sinar-X yang didifraksikan oleh setiap kristal mineral bersifat spesifik, dan bergantung bagaimana atom menyusun kisi kristal mineral tersebut serta bagaimana atom sejenis tersusun. Ketika sinar-X menumbuk sampel dan
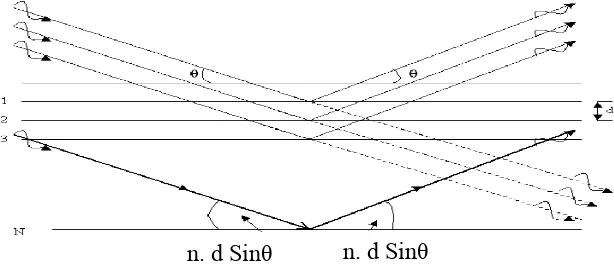
terdifraksi, maka jarak antar atom pada lapisan permukaan kristal dapat ditentukan berdasarkan hukum Bragg, yaitu :
n = 2d Sin θ (6)
n yakni bilangan bulat dan merupakan tingkat difraksi sinar-X, yakni panjang gelombang yang dihasilkan oleh katoda yang digunakan, seperti Cu Kα = 1,5414 Å, sedangkan d merupakan jarak antara batas lapisan permukaan, dan
n. d Sinθ n. d Sinθ
Untuk mengetahui keadaan sinar datang dan sinar refleksi dari difraksi suatu bidang kristal dapat dilihat pada Gambar 5.
Gambar 5. Difraksi dari bidang kristal (Callister Jr, 2009)
Selanjutnya, suatu kristal mineral dapat ditentukan strukturnya dengan cara membandingkan pola difraksi yang dihasilkan dengan pola difraksi mineral acuan atau baku.
2. Brunauer-Emmett-Teller (BET)
Luas permukaan katalis pada penelitian ini ditentukan melalui pengukuran menggunakan Surface Area Analyzer Quantachrome NOVA-1000 versi 2.2 yang didasarkan pada metode BET yaitu adsorpsi dan desorpsi isotermis dari gas yang diserap (nitrogen). Kuantitas gas yang diserap dapat dihitung dengan persamaan sebagai berikut :
Keterangan:
W = Berat gas yang diserap (adsorbed) pada tekanan relatif P/Po (g) Wm = Berat gas nitrogen (adsorbed) pada lapis tunggal (g)
P = Tekanan kesetimbangan adsorpsi (atm) Po = Tekanan uap jenuh adsorpsi (atm) P/ Po = Tekanan relatif adsorpsi
C = Konstanta energi
Persamaan BET di atas akan merupakan garis lurus apabila dibuat grafik 1/ [W (P/Po – 1)] versus P/Po (Lowell and Shields,1984). Selanjutnya untuk
pengukuran luas permukaan dengan metode BET berdasarkan pada persamaan berikut:
(8) Keterangan:
St = luas permukaan total (m2) Wm = berat gas nitrogen (g)
M = berat molekul dari gas nitrogen (g/mol)
N = bilangan Avogadro (6,023 x 1023 molekul/mol)
Acs = luas molekul cross sectional gas nitrogen (16,2 Å)
Pengukuran luas permukaan spesifik ditentukan dengan menggunakan persamaan berikut:
(9)
Keterangan:
S = luas permukaan spesifik (m2/g) St = luas permukaan total (m2) bc = berat cuplikan (g)
Volume total pori adalah volume gas yang teradsorpsi pada tekanan jenuh, untuk menghitung volume total pori digunakan persamaan berikut:
(10)
Keterangan:
Vρ = volume total pori (cc)
Wa = berat nitrogen yang teradsorpsi pada P/Po = 0,99 (g) = densitas nitrogen pada 77oK (g/cc)
Perhitungan ukuran pori dilakukan dengan asumsi bahwa geometri pori berbentuk silindris sehingga rata-rata jari-jari pori dihitung dari perbandingan volume total pori dan luas permukaan spesifik, dengan menggunakan persamaan berikut:
(11) Keterangan:
Terdapat enam tipe adsorpsi isotermis pada metode BET bila volume total gas adsorpsi (Va) diplotkan sebagai fungsi P/Po, hasil adsorpsi isotermis tersebut disajikan pada Gambar 6.
Gambar 6. Tipe adsorpsi dan desorpsi isotermis pada padatan atau bahan mesopori dan mikropori
Tipe I merupakan karakteristik padatan mikropori seperti zeolit, yang
menunjukkan kapasitas adsorpsi yang tinggi dan cepat. Tipe II menunjukkan adsorpsi isotermis pada material atau bahan yang tak berpori, sedangkan pada tipe III untuk bahan yang makropori. Ciri utama isotermis pada tipe IV adalah adanya hysteresis loop dan kenaikan grafik yang tinggi pada P/Po. Isotermis tipe ini
umumnya terdapat pada bahan mesopori seperti silika gel. Pada tipe V
menujukkan adsorpsi nitrogen yang rendah pada tekanan relatif rendah, kenyataan ini mengindikasikan bahwa interaksi rendah antara adsorbat dengan adsorben.
Isotermis tipe VI sangat jarang ditemukan, tipe ini dapat dihasilkan pada nitrogen yang diadsorpsi pada karbon spesial (Sing et al., 1985).
3. Scanning Electron Microscope-Energy Dispersive Spectrometer (SEM/EDS)
Untuk melakukan karakterisasi material yang heterogen pada permukaan bahan pada skala mikrometer atau bahkan submikrometer serta menentukan komposisi unsur sampel secara kualitatif maupun kuantitatif dapat dilakukan dengan menggunakan satu perangkat alat SEM (Scanning Electron Microscope) yang dirangkaikan dengan EDS (Energy Dispersive Spectrometer). Pada SEM
(Scanning Electron Microscope) dapat diamati karakteristik bentuk, struktur, serta distribusi pori pada permukaan bahan, sedangkan komposisi serta kadar unsur yang terkandung dalam sampel dapat dianalisis dengan menggunakan EDS (Energy Dispersive Spectrometer) (Goldstein et al., 1981).
Alat ini dilengkapi sumber cahaya yang berupa suatu filamen dan biasanya suatu kawat tungsten seperti ditunjukkan pada Gambar 7.
Karakterisasi menggunakan SEM-EDS dilakukan melalui adsorpsi isotermis gas oleh padatan sampel. Jumlah molekul gas yang diadsorpsi pada permukaan luar padatan sampel sangat sedikit dibandingkan dengan yang diadsoprsi oleh porinya. prinsip kerja Scanning Electron Microscope, dengan cara mengalirkan arus pada kawat filamen tersebut dan perlakuan pemanasan, sehingga dihasilkan elektron. Elektron tersebut dikumpulkan dengan tegangan tinggi dan berkas elektron difokuskan dengan sederetan lensa elektromagnetik. Ketika berkas elektron mengenai target, informasi dikumpulkan melalui tabung sinar katoda (CRT) yang mengatur intensitasnya.
Setiap jumlah sinar yang dihasilkan dari CRT dihubungkan dengan jumlah target, jika terkena berkas elektron berenergi tinggi dan menembus permukaaan target, karena terjadi ionisasi atom dari cuplikan padatan. Elektron bebas ini tersebar keluar dari aliran sinar utama, sehingga tercipta lebih banyak elektron bebas, dengan demikian energinya habis lalu melepaskan diri dari target. Elektron ini kemudian dialirkan ke unit demagnifikasi dan dideteksi oleh detektor dan selanjutnya dicatat sebagai suatu foto (Wagiyo dan Handayani, 1997). Contoh foto hasil analisis SEM ditunjukkan pada Gambar 8.
Pada EDS analisis kualitatif dilakukan dengan cara menentukan energi dari puncak yang ada dalam spektrum dan membandingkan dengan tabel energi emisi sinar-x dari unsur-unsur yang sudah diketahui. Analisis kuantitatif tidak hanya menjawab unsur apa yang ada dalam sampel tetapi juga konsentrasi unsur tersebut.
Untuk melakukan analisa kuantitatif maka perlu dilakukan beberapa proses antara lain meniadakan background, dekonvolusi peak yang bertumpang tindih dan menghitung konsentrasi unsur (Larry and Hanke, 2001). Contoh Hasil EDS ditunjukkan pada Gambar 9.
III. METODOLOGI PENELITIAN
A.Tempat dan Waktu Penelitian
Penelitian ini dilakukan selama 4 bulan yaitu pada bulan Februari hingga Mei 2014, bertempat di Laboratorium Biomassa Jurusan Kimia Fakultas MIPA Universitas Lampung. Karakterisasi adsorben menggunakan XRD dilakukan di Batan, SEM-EDS dan BET (Brunauer-Emmett-Teller) dilakukan di Institut Teknologi Bandung, Bandung. Analisis uji adsorpsi menggunakan
Spektrofotometer UV-VIS di Universitas Lampung, Lampung.
B.Alat dan Bahan
1. Alat-alat yang digunakan
Alat-alat yang digunakan dalam penelitian ini antara lain, Scanning Electron Microscope-Energy Dispersive X-Ray Spectroscopy (SEM-EDS)
2. Bahan-bahan yang digunakan
Bahan-bahan yang digunakan dalam penelitian ini antara lain : sekam padi,
elektroda aluminium, larutan NaOH 1,5%, larutan HNO3 10%, akuades, zat warna
Rhodamin B.
C. Prosedur penelitian
1. Preparasi Sekam Padi
Langkah awal dalam penelitian ini adalah preparasi sampel sekam padi. Sebanyak 100 gram sekam padi direndam dalam air panas selama 2 jam untuk mengekstrak bahan organik larut air yang merupakan bahan pengotor dalam proses ekstraksi silika. Sekam padi kemudian disaring dan dicuci lagi secara berulang dengan cara disiram dengan air panas untuk menghilangkan pengotor bahan organik larut air yang masih diperkirakan menempel pada permukaan sekam padi. Kemudian, sekam padi yang telah bebas dari pengotor
dikeringanginkan dan selanjutnya sekam padi siap digunakan untuk ekstraksi silika.
2. Ekstraksi Silika dengan Metode Presipitasi
kemudian dipanaskan sampai mendidih selama 30 menit. Selanjutnya, sampel disaring dan filtrat yang mengandung silika terlarut ditampung. Untuk
mengendapkan silika, filtrat kemudian ditambahkan larutan asam HNO3 10%
secara bertahap hingga terbentuk endapan silika dalam bentuk gel dan pH pengendapan silika mencapai 7,0. Gel silika kemudian didiamkan (dituakan) selama 24 jam pada suhu kamar. Selanjutnya gel silika disaring dan dicuci dengan akuades panas di dalam pompa vakum hingga air cucian bersifat netral. Silika yang diperoleh kemudian dikeringkan dalam oven pada suhu 110 °C selama 24 jam dan dihaluskan.
3. Pembuatan Sol Silika Sekam Padi
Sebanyak 20 gram silika sekam padi hasil ekstraksi dimasukkan ke dalam 600 mL larutan NaOH 1,5 % kemudian dipanaskan sambil diaduk menggunakan hotplate stirer hingga larut.
4. Pembuatan Zeolit dengan Metode Elektrolisis
110 oC selama 24 jam untuk menghilangkan air. Zeolit yang diperoleh selanjutnya digerus hingga menjadi bubuk dan dikalsinasi pada suhu 300 oC.
5. Karakterisasi Adsorben
a. Karakterisasi dengan Difraksi Sinar-X (XRD)
Pada penelitian ini karakterisasi dengan XRD dilakukan untuk menganalisis struktur kristalografi sampel Zeolit, apakah sampel bersifat amorf atau kristalin. Sumber sinar radiasi menggunakan Kα dari Cu. Langkah-langkah yang dilakukan dalam analisis menggunakan XRD adalah sebagai berikut:
1. Sampel yang akan dianalisis disiapkan dan direkatkan pada kaca, kemudian dipasang pada tempatnya yang berupa lempeng tipis berbentuk persegi panjang (sampel holder) dengan bantuan malam (lilin perekat).
2. Sampel yang disimpan dipasang pada sampel holder kemudian dilekatkan pada sampel stand dibagian goniometer.
3. Parameter pengukuran dimasukkan pada softwere pengukuran melalui komputer pengontrol, yaitu meliputi penentuan scan mode, penentuan rentang sudut, kecepatan scan cuplikan, memberi nama cuplikan dan memberi nomor urut file data.
4. Alat difraktometer dioperasikan dengan perintah “Start” pada menu
5. Hasil difraksi dapat dilihat pada komputer dan intensitas difraksi pada sudut 2 tertentu dapat dicetak oleh mesin printer.
6. Sampel dari sampel holder diambil setelah pengukuran cuplikan selesai.
b. Karakterisasi dengan SEM/EDS
Analisis menggunakan SEM dilakukan untuk mengetahui morfologi permukaan sampel dan ukuran partikel. Analisis menggunakan SEM ini dilakukan pada semua sampel Zeolit yang dihasilkan. Adapun langkah-langkah dalam uji SEM ini adalah sebagai berikut:
1. Sampel yang akan dianalisis disiapkan dan direkatkan pada spesimen holder (Dolite, double sticy tape).
2. Sampel yang telah dipasang pada holder kemudian dibersihkan dengan Hand Blower.
3. Sampel dimasukkan dalam mesin couting untuk diberi lapisan tipis yang berupa gold-poladium selama 4 menit sehingga menghasilkan lapisan dengan ketebalan 200-400 Å.
4. Sampel dimasukkan ke dalam Specimen Chamber.
5. Pengamatan dan pengambilan gambar pada layer SEM dengan mengatur pembesaran yang diinginkan.
c. Karakterisasi dengan BET
Analisis BET dilakukan untuk mengetahui luas permukaan spesifik, volume total pori, dan rata-rata jari-jari pori sampel adsorben yang digunakan. Karakterisasi ini dilakukan dengan langkah kerja sebagai berikut:
1. Tombol pemilih adsorbat dipastikan pada arah tank.
2. Gas nitrogen dari tabung dialirkan dengan memutar (berlawanan arah jarum jam) kran tabung gas.
3. Listrik dihidupkan dengan menghidupkan stabilizer.
4. Pompa vakum dihidupkan dengan menekan tombol merah pada magnetik kontaktor.
5. Power alat dihidupkan, kemudian ditunggu sampai muncul menu utama pada layar LCD.
6. Pengukuran yang diinginkan dilakukan dengan mengikuti menu program pada layar LCD.
6. Uji Aktivitas Adsorpsi Zeolit Terhadap Zat Warna Rhodamin B
Uji aktivitas adsorbsi zeolit terhadap zat warna Rhodamin B menggunakan metode batch seperti yang dilakukan Sari dan Widiastuti (2010). Meliputi :
a. Pembuatan Larutan Standar Rhodamin B
larutan ini selanjutnya dibuat larutan standar dengan konsentrasi 10, 20, 30, 40, dan 50 ppm dengan metode pengenceran. Selanjutnya absorbansi larutan pada panjang gelombang 552 nm dan diplot terhadap konsentrasi untuk mendapatkan kurva standar.
b. Studi Adsorpsi
Rhodamin B dengan konsentrasi 50 ppm diambil sebanyak 50 mL dimasukkan ke dalam gelas kimia 100 mL. Kemudian, zeolit sintetik yang dihasilkan dan silika masing-masing sebanyak 2 gram dimasukkan ke dalam larutan tersebut dan diaduk dengan kecepatan 400 rpm selama 1 jam. Campuran di sentrifus dan disaring. Hasil filtrat kemudian dianalisis dengan UV-VIS pada panjang gelombang 552 nm.
Dari semua sampel yang digunakan ditentukan adsorben yang memiliki aktivitas adsorbsi terbaik untuk dilakukan studi adsorbsi selanjutnya, meliputi (i) penentuan waktu setimbang, (ii) mempelajari variabel yang mempengaruhi kinerja adsorpsi yaitu konsentrasi awal adsorbat, (iii) penentuan kinetika adsorpsi dan (iv)
penentuan isoterm adsorpsi.
1. Penentuan Waktu Setimbang
dengan kecepatan 400 rpm pada waktu yang berbeda yakni 15, 30, 45, 60, 75, 90, dan 120 menit. Selanjutnya, absorbansi filtrat pada panjang gelombang 552 nm dan diplotkan terhadap waktu untuk mendapatkan kurva adsorpsi. Dari percobaan ini akan diperoleh waktu adsorpsi yang optimum.
2. Pengaruh Konsentrasi Awal Rhodamin B
Untuk mempelajari apakah konsentrasi awal Rhodamin B mempengaruhi kapasitas adsorpsi, dalam penelitian ini akan dilakukan percobaan adsorpsi dengan waktu optimum yang didapatkan percobaan sebelumnya. Konsentrasi awal akan divariasi yakni 10, 20, 30, 40, dan 50 ppm, selanjutnya dilakukan seperti percobaan sebelumnya. Dari percobaan ini akan didapatkan konsentrasi awal Rhodamin B yang menghasilkan jumlah Rhodamin B yang mampu
diadsorpsi secara maksimal.
3. Pengaruh pH
4. Isoterm Adsorpsi
Percobaan ini dilakukan untuk mengetahui tipe isoterm adsorpsi dari sampel adsorben yang digunakan. Untuk maksud ini dilakukan variasi berat adsorben yakni sebanyak 0,4; 0,6; 0,8; 1; 1,5; dan 2 gram. Masing-masing sampel diadsorpi pada keadaan optimum yang didapatkan sebelumnya.
7. Pengolahan Data
a. Penentuan Kapasitas Adsorpsi
Kapasitas adsorpsi zeolit dihitung dengan menggunakan persamaan berikut
Dalam persamaan di atas, C0 adalah konsentrasi awal Rhodamin B (mg/L), Ce
konsentrasi kesetimbangan Rhodamin B (mg/L), V adalah volume sampel (L), dan m adalah massa zeolit (g).
Dari penentuan ini, dihitung efisiensi penyisihan dengan menggunakan persamaan berikut
(12)
b. Kinetika Adsorpsi
Secara umum kinetika adsorpsi dapat dijelaskan dengan lima model yakni orde 1 semu, orde dua semu, Bangham, model difusi intra-partikel dan Elovich, namun adsorpsi zat warna sintetik diketahui umumnya mengikuti model orde dua semu. Model ini, dapat dijelaskan sebagai berikut :
dimana ks adalah konstanta laju model orde dua semu (dalam g/(mg min)). Setelah integrasi dan penggunaan kondisi-kondisi batas qt=0 pada t =0 dan qt=qt pada t=t, persamaan linier dapat diperoleh sebagai berikut
Laju penyerapan awal, h (mg/g min) sedangkan t t-> 0 dapat didefinisikan sebagai berikut
Laju adsorpsi awal (h), kapasitas adsorpsi kesetimbangan (qe) dan konstanta orde dua semu ks dapat ditentukan secara eksperimen dari slope dan intersep plot dari t/qt versus t.
(14)
(15)
c. Penentuan Isoterm Adsorpsi
Isoterm adsorpsi terkarakterisasi oleh nilai konstanta tertentu yang
menggambarkan karakteristik permukaan, afinitas dari adsorben dan kapasitas adsorpsi dari adsorben. Untuk menggambarkan kesetimbangan adsorpsi,
persamaan isoterm yang bermacam-macam telah digunakan seperti Langmuir dan Freundlich.
Model isoterm adsorpsi Langmuir mengasumsikan bahwa penyerapan mengambil pada tempat spesifik yang homogen dalam adsorben dan distribusi yang seragam dari tempat adsorpsi energetik. Akibatnya, sekali molekul adsorbat menempati tempat, tidak ada lagi penyerapan yang dapat terjadi pada tempat tersebut. Oleh karena itu, model Langmuir digunakan untuk adsorpsi monolayer pada
permukaan dengan jumlah terbatas pada tempat yang sama.
qmax (mg/L) dan K (L/mg) berturut-turut adalah kapasitas monolayer yang dicapai
pada konsentrasi tinggi dan konstanta kesetimbangan. Ce adalah konsentrasi kesetimbangan dalam larutan (mg/L) dan q menunjukkan jumlah yang diserap pada kesetimbangan (mg/g).
Model Freundlich menganggap permukaan heterogen dengan distribusi panas adsorpsi yang tidak seragam pada permukaan. Parameter Freundlich ditentukan dengan rumus
Kf dan 1/n berturut-turut menunjukkan faktor kapasitas Freundlich dan parameter intensitas Freundlich. Ce adalah konsentrasi kesetimbangan dalam larutan (mg/L) dan q menunjukkan jumlah yang diserap pada kesetimbangan (mg/g).
V. SIMPULAN DAN SARAN
A. Simpulan
Berdasarkan hasil penelitian yang telah dilakukan, dapat diperoleh kesimpulan bahwa:
1. Berdasarkan uji adsorpsi terhadap Rhodamin B didapatkan bahwa silika sekam padi memiliki kapasitas adsorpi yang lebih besar dibanding zeolit sintetik. Hasil ini diyakini terkait dengan luas permukaan silika sekam padi (380,272 m2/g) yang jauh lebih besar dibanding luas permukaan zeolit sintetik (79,479 m2/g).
2. Uji adsorpsi Rhodamin B dengan zeolit yang dihasilkan memiliki nilai
kapasitas adsorpsi tertinggi 0,1206 mg/g, hasil sintesis pada potensial 8 V, pH 8, dan waktu 30 menit.
3. Studi adsorpsi Rhodamin B dengan silika sekam padi menunjukkan bahwa kondisi optimum adalah waktu adsorpsi 60 menit, konsentrasi awal 50 ppm, dan pH larutan 5. Pada kondisi optimum ini, dicapai efisiensi penghilangan Rhodamin B 84,682% dengan kapasitas adsorpsi 1,0585 mg/g adsorben.
5. Isoterm adsorpsi Rhodamin B dengan silika sekam padi mengikuti isoterm Langmuir dan Freundlich. Nilai qmax dan K Langmuir berturut-turut 3,646
mg/L dan 0,057 L/mg, Kdan n Freundlich 1,889 L/g dan 0,390.
B. Saran
Beberapa hal yang disarankan pada penelitian selanjutnya adalah sebagai berikut :
1. Umumnya zeolit banyak digunakan sebagai adsorben, oleh karena itu disarankan untuk menggunakan zeolit sintetik sebagai adsorben untuk adsorbat lain seperti logam berat atau zat warna lain.
DAFTAR PUSTAKA
Abramian, L and H. El-Rassy. 2009. Adsorption kinetics and thermodynamics of azo-dye Orange II onto highly porous titania aerogel. Chemical Engineering J 150. pp. 403–410.
Adam, F., S. Balakrishnan, and P. Wong. 2006. Rice Husk Ash Silica as a Support Material for Ruthenium Based Heterogenous Catalyst. J. of Physical Science. 17(2), pp. 1–13.
Adamson, W. A. 1990. Physical Chemistry of Surfaces. Third Edition. John. Willey And Sons Inc. New York.
Adnan, O., O. Cigdem., E. Yunus, and O. A. Sara. 2007. Modification of bentonite with a cationic surfactant: An adsorption study of textile dye Reactive Blue 19. J. of Hazardous Materials 140(1-2). pp. 173-179.
Agung, M. G. F., M. R. Hanafie Sy., dan P. Mardina. 2013. Ekstraksi Silika dari Abu Sekam Padi dengan Pelarut KOH. Konversi. 2 (1).
Ahamed, J. A., V. Balakrishnan., and S. Arivoli. 2011. Kinetic and Equilibrium Studies of Rhodamine B Adsorption by Low Cost Activated Carbon. Scholar Research Library. Arch. Appl. Sci. Res. 3 (3). pp. 154-166.
Akbar, F., I. Zahrina., dan A. Yelmida. 2011. Sintesis ZSM-5 dari Natrium Silikat yang Berasal dari Abu Sawit. Jurnal Sains dan Teknologi 10 (1). Akimkhan, A. M. 2012. Structural and Ion-Exchange Properties of Natural
Zeolite. Lisence in tech.
Aldrich. 1992. Aldrich Chemical Catalogue. Milwaukee. USA. Aldrich Chemical Company.
Ali, P. dan S.K. Muhammad. 2008. Biodecolorization of Acid Violet 19 by Alternaria solani. African J of Biotechnology, 7. pp. 831-833.
Anshari, R. 2011. Penentuan Kapasitas Penyerapan Zat Warna Tekstil Remazol Briliant (RB) Red F3B oleh Zeolit. (Skripsi). Department Chemistry. Institut Tekhnologi Bandung. Bandung.
Artadi, A. 2007. Penggunaan Grafit Batu Baterai Sebagai Alternatif Elektroda Spektrografi Emisi. J.FN. 1, 2.
Atkins P. W. 1999. Kimia Fisika jilid II. Diterjemahkan oleh Kartohadiprodjo. Oxford University Press. Terjemahan dari: Physical Chemistry.
Azizi, S.N., A. R. Samadi-Maybodi., and M. Yarmohammadi. 2012. Synthesis of NaA zeolite using PTMAOH (phenyltrimethylammoniumhydroxide): hydrothermal and microwave heating methods and comparison of their XRD patterns. J. of Inorganic Chemistry. 2. pp. 1-5.
Bekkum, V. H., E.M. Flanigen., P. A., Jacobs., and J. C. Jansen. 1991. Introduction to Zeolite Science and Practice. 2nd. Revised Edn. Elsevier. Amsterdam.
Bernasconi, G., H. H. Grester., H. Hauser., and E. Scheneiter. 1995. Teknologi Kimia Bagian 2. Terjemahan Lienda Handojo. Pradnya Paramita. Jakarta.
Biro Pusat Statistik. 2012. Lampung Dalam Angka.
Bogdanov, B., D. Georgiev., K. Angelova,. and Y. Hristov. 2009. Synthetic Zeolites and Their Industrial and Environmental Applications Review. International Science conference. Volume IV Natural & Mathematical science.
Breck, D. W. 1974. Zeolite Molecular Sieves: Structure, Chemistry and Use. London: John Wiley and Sons. pp. 4.
Buso, A., M. Giomo., L. Boaretta., G. Sandona., and A. Paratella. 1997. New electrochemical reactor for wastewater treatment : electrochemical characterization. Chemical Engineering and Processing. 36. pp. 255-260. Cahyadi, W. 2006. Analisis dan Aspek Kesehatan Bahan Tambahan Pangan.
Penerbit PT Bumi Aksara, Jakarta.
Callister, W.D. 2009. Materials Science and Engineering An Introduction 8Th. John Wiley & Sons Inc.
Cheetam, D. A. 1992. Solid State Compound. Oxford university press. pp. 234-237.