SITI ASTUTI. Characteristic of Sheep Spermatozoa during Freezing process with which Medium Diluents added Glutathione. Under direction NI WAYAN KURNIANI KARJA
The aim of the study was to the characteristics of sheep spermatozoa during the freezing process by using the added glutathione (GSH). Semen sheep divided into 3 group: semen control group; semen was diluted edded by 1 mM GSH; semen was diluted by NSF 3 mM. Characteristics of sheep before freezing, after equilibration, and after freezing evaluated. Motility of spermatozoa in 3 mM 6 hours after thawing, higher than the control and 1 mM (p<0.05). Plasma membrane integrity of spermatozoa immediately after semen dilution and after diequilbration did not differ among treatments (p>0.05). Plasma membrane integrity immediately after thawing in the 1 mM GSH group higher than 3 mM GSH group (p<0.05). Three hours after thawing, plasma membrane integrity of spermatozoa in the 3 mM GSH group was higher than control group and 1 mM GSH groups (p<0.05), but 6 hours after thawing the integrity did not differ among treatment groups (p>0.05). Olthough there are differences in sperm viability among treatment groups immediately after semen dilution (p<0.05), but there were no significant differences in the viability of spermatozoa between the treatment groups after the equilibration and after thawing (p>0.05). No significant difference was found in the morphology of spermatozoa among the group (p>0.05). The addition of 3 mM glutathione to the freezing extender affected the motility of spermatozoa after 6 hours post-thawing and the plasma membrane integrity intact after 3 hours post-thawing.
dengan Medium Pengencer yang Ditambahkan Glutation. Dibimbing oleh NI WAYAN KURNIANI KARJA.
Penelitian ini bertujuan untuk mengetahui karakteristik spermatozoa domba selama proses pembekuan dengan menggunkan medium pengencer yang ditambahkan glutation (GSH). Semen domba dibagi menjadi 3 kelompok yaitu kelompok kontrol dimana semen diencerkan dengan NSF 1 tanpa penambahan GSH, kelompok GSH 1 mM adalah kelompok semen yang diencerkan dengan NSF 1 ditambahkan 1 mM GSH, dan kelompok GSH 3 mM adalah kelomopk semen yang diencerkan dengan NSF1 yang ditambahkan 3 mM GSH. Evaluasi karakteristik semen domba dilakukan sebelum pembekuan, setelah ekuilibrasi, dan setelah pembekuan. Hanya motilitas spermatozoa pada kelompok 3 mM 6 jam setelah thawing lebih tinggi dari kontrol dan kelompok GSH 1 mM (p<0.05). Integritas membran plasma spermatozoa segera setelah semen diencerkan dan setelah diekuilbrasi tidak berbeda diantara perlakuan (p>0.05). Intergritas membran plasma segera setelah thawing pada kelompok GSH 1 mM lebih tinggi dari kelompok GSH 3 mM (p<0.05). Tiga jam setelah thawing, integritas membran plasma spermatozoa pada kelompok GSH 3 mM lebih tinggi dari kontrol dan GSH 1 mM (p<0.05), tetapi 6 jam setelah thawing integritas membran plasma spermatozoa tidak berbeda diantara kelompok perlakuan (p>0.05). Walaupun ada perbedaan viabilitas spermatozoa diantara kelompok perlakukan segera setelah semen diencerkan (p<0.05), tetapi tidak ditemukan adanya perbedaan yang nyata pada viabilitas antara spermatozoa diantara kelompok perlakuan setelah waktu ekuilibrasi dan setelah thawing (p>0.05). Tidak ditemukan adanya perbedaan abnormalitas spermatozoa diantara kelompok perlakuan selama proses pembekuan dan setelah thawing (p>0.05). Penambahan glutation dengan dosis 3 mM dalam medium pengencer semen domba memberikan pengaruh yang baik terhadap motilitas spermatozoa setelah 6 jam post-thawing dan terhadap integritas membran plasma utuh setelah 3 jam post- thawing, namun tidak berpengaruh pada viabilitas dan abnormal spermatozoa.
KARAKTERISTIK SPERMATOZOA DOMBA SELAMA
PROSES PEMBEKUAN DENGAN MEDIUM PENGENCER
YANG DITAMBAHKAN GLUTATION
SITI ASTUTI
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa skripsi yang berjudul: Karakteristik Spermatozoa Domba Selama Proses Pembekuan dengan Medium Pengencer yang Ditambahkan Glutation adalah benar-benar hasil karya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Semua sumber data dan informasi yang berasal atau dikutip dari karya-karya yang diterbitkan maupun yang tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan tercantum dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, September 2012
SITI ASTUTI. Characteristic of Sheep Spermatozoa during Freezing process with which Medium Diluents added Glutathione. Under direction NI WAYAN KURNIANI KARJA
The aim of the study was to the characteristics of sheep spermatozoa during the freezing process by using the added glutathione (GSH). Semen sheep divided into 3 group: semen control group; semen was diluted edded by 1 mM GSH; semen was diluted by NSF 3 mM. Characteristics of sheep before freezing, after equilibration, and after freezing evaluated. Motility of spermatozoa in 3 mM 6 hours after thawing, higher than the control and 1 mM (p<0.05). Plasma membrane integrity of spermatozoa immediately after semen dilution and after diequilbration did not differ among treatments (p>0.05). Plasma membrane integrity immediately after thawing in the 1 mM GSH group higher than 3 mM GSH group (p<0.05). Three hours after thawing, plasma membrane integrity of spermatozoa in the 3 mM GSH group was higher than control group and 1 mM GSH groups (p<0.05), but 6 hours after thawing the integrity did not differ among treatment groups (p>0.05). Olthough there are differences in sperm viability among treatment groups immediately after semen dilution (p<0.05), but there were no significant differences in the viability of spermatozoa between the treatment groups after the equilibration and after thawing (p>0.05). No significant difference was found in the morphology of spermatozoa among the group (p>0.05). The addition of 3 mM glutathione to the freezing extender affected the motility of spermatozoa after 6 hours post-thawing and the plasma membrane integrity intact after 3 hours post-thawing.
dengan Medium Pengencer yang Ditambahkan Glutation. Dibimbing oleh NI WAYAN KURNIANI KARJA.
Penelitian ini bertujuan untuk mengetahui karakteristik spermatozoa domba selama proses pembekuan dengan menggunkan medium pengencer yang ditambahkan glutation (GSH). Semen domba dibagi menjadi 3 kelompok yaitu kelompok kontrol dimana semen diencerkan dengan NSF 1 tanpa penambahan GSH, kelompok GSH 1 mM adalah kelompok semen yang diencerkan dengan NSF 1 ditambahkan 1 mM GSH, dan kelompok GSH 3 mM adalah kelomopk semen yang diencerkan dengan NSF1 yang ditambahkan 3 mM GSH. Evaluasi karakteristik semen domba dilakukan sebelum pembekuan, setelah ekuilibrasi, dan setelah pembekuan. Hanya motilitas spermatozoa pada kelompok 3 mM 6 jam setelah thawing lebih tinggi dari kontrol dan kelompok GSH 1 mM (p<0.05). Integritas membran plasma spermatozoa segera setelah semen diencerkan dan setelah diekuilbrasi tidak berbeda diantara perlakuan (p>0.05). Intergritas membran plasma segera setelah thawing pada kelompok GSH 1 mM lebih tinggi dari kelompok GSH 3 mM (p<0.05). Tiga jam setelah thawing, integritas membran plasma spermatozoa pada kelompok GSH 3 mM lebih tinggi dari kontrol dan GSH 1 mM (p<0.05), tetapi 6 jam setelah thawing integritas membran plasma spermatozoa tidak berbeda diantara kelompok perlakuan (p>0.05). Walaupun ada perbedaan viabilitas spermatozoa diantara kelompok perlakukan segera setelah semen diencerkan (p<0.05), tetapi tidak ditemukan adanya perbedaan yang nyata pada viabilitas antara spermatozoa diantara kelompok perlakuan setelah waktu ekuilibrasi dan setelah thawing (p>0.05). Tidak ditemukan adanya perbedaan abnormalitas spermatozoa diantara kelompok perlakuan selama proses pembekuan dan setelah thawing (p>0.05). Penambahan glutation dengan dosis 3 mM dalam medium pengencer semen domba memberikan pengaruh yang baik terhadap motilitas spermatozoa setelah 6 jam post-thawing dan terhadap integritas membran plasma utuh setelah 3 jam post- thawing, namun tidak berpengaruh pada viabilitas dan abnormal spermatozoa.
Penulis dilahirkan pada tanggal 11 Agustus 1989 di Jayapura-Papua. Penulis merupakan anak kedua dari enam bersaudara dari pasangan Bapak Patong dan Ibu Supenti.
Penulis menempuh pendidikan yang dimulai dari pendidikan dasar (SD) dan lulus pada tahun 2001 di SDN 01 Arsopura, Distrik Skanto Kabupaten Keerom. Pendidikan lanjutan menengah pertama (SMP) diselesaikan Penulis pada tahun 2004 di SMPN 02 Arso Distrik Skanto Kabupaten Keerom. Pendidikan lanjutan menengah atas (SMA) diselesaikan pada tahun 2007 di SMAN 02 Distrik Skanto, Kabupaten Keerom. Penulis diterima menjadi mahasiswa di Institut Pertanian Bogor pada tahun 2008 melalui jalur Beasiswa Undangan Daerah (BUD) dan pada tahun berikutnya. Penulis diterima sebagai mahasiswa kedokteran hewan, Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga penulisan skripsi yang berjudul Karakteristik Spermatozoa Domba Selama Proses Pembekuan dengan Medium Pengencer yang Ditambahkan Glutation dapat diselesaikan.
Penulis mengucapkan terima kasih yang sebesar-besarnya kepada;
1. Drh. Ni Wayan Kurniani Karja, MP,Ph.D sebagai dosen pembimbing yang telah memberikan bimbingan, saran, dan motivasi.
2. Hibah bersaing Institut Pertanian Bogor No. 15/13.24.4/SPP/PHB/2011 yang membiayai penelitian ini.
3. Seluruh dosen pengajar Fakultas Kedokteran Hewan atas semua ilmu yang telah bapak dan ibu berikan kepada Penulis
4. Laboratorium Fertilisasi In Vitro dan Unit Rehabilitas Reproduksi (URR) Fakultas Kedokteran Hewan, IPB berserta segenep staf.
5. Pemerintah Daerah Kabupaten Keerom atas dukungan financial selama Penulis menempuh studi di IPB.
6. Bapak, Ibu, kakak dan adik-adik (Eva, Ali, Midah, Nanda, Gilang), serta sahabat dekat (Saenal) terima kasih atas doa dan semangat yang diberikan. 7. Teman sepenelitian Dhia, serta kakak S2 (Ari dan Fitrah) terima kasih atas
bantuan dan semangat yang diberikan.
8. Sahabat-sahabatku (Burki, Hastin, Nisa, Gita, Sri, Ana, Ruri, dan Afifah) terima kasih atas doa dan semangat yang diberikan.
9. Rekan- rekan Avenzoar 45 yang tidak bisa disebutkan satu-persatu.
10.Teman-teman Matoa House (Dika, Dian, Neni, Wiwi, Resa, Clara) terima kasih atas doa dan dukunganya.
11.Teman-teman BUD Keerom (Zack, Iwan, Irma, Abia) terima kasih atas doa dan dukungannya.
Penulis menyadari bahwa skripsi ini jauh dari sempurna, untuk itu penulis mengharapkan kritik dan saran dari semua pihak. Penulis berharap agar skripsi ini bermanfaat bagi pihak-pihak yang membutuhkan dan dapat menambah ilmu pengetahuan.
Bogor, September 2012
© Hak Cipta milik IPB, tahun 2012
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah, dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
KARAKTERISTIK SPERMATOZOA DOMBA SELAMA
PROSES PEMBEKUAN DENGAN MEDIUM PENGENCER
YANG DITAMBAHKAN GLUTATION
SITI ASTUTI
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
Ditambahkan Glutation
Nama : Siti Astuti
NRP : B04080201
Disetujui,
drh. Ni Wayan Kurniani Karja, MP, Ph.D Pembimbing
Diketahui,
drh. H. Agus Setiyono, MS, Ph.D, APVet Wakil Dekan Fakultas Kedokteran Hewan
DAFTAR TABEL………... xii
DAFTAR GAMBAR……….. xiii
DAFTAR LAMPIRAN ……….. xiv
PENDAHULUAN
Reactive Oxygen Species (ROS)……… 7
Glutation………. 8
BAHAN DAN METODE Waktu Penelitian ……….... 10
Alat dan Bahan………... 10
Metode Penelitian Persiapan Bahan Pengencer……….. 10
Koleksi Spermatozoa……… 10
Kriopreservasi Spermatozoa………. 11
Evaluasi Karakteristik Spermatozoa Domba……….. 11
Penilaian Motilitas Spermatozoa……….... 12
Penilaian Integritas Membran Plasma Spermatozoa………... 12
Penilaian Viabilitas dan Morfologi Abnormalitas Spermatozoa………… 12
Analisis Data………... 13
HASIL DAN PEMBAHASAN Karakteristik Semen Domba Segera Setelah Koleksi………... 14
Persentase Motilitas Spermatozoa………... 15
Persentase Integritas Membran Plasma Spermatozoa……… 16
Persentase Viabilitas Spermatozoa………. 18
Persentase Morfologi Abnormal Spermatozoa………... 20
SIMPULAN DAN SARAN……… 22
xii
1 Karakteristik semen segera setelah koleksi……… 14 2 Persentase motilitas spermatozoa domba selama proses pembekuan…… 15 3 Persentase integritas membran plasma spermatozoa selama proses
pembekuan……….. 17
xiii
xiv
Halaman
1 Hasil uji data motilitas………... 28
2 Hasil uji data integritas membran plasma………... 29
3 Hasil uji data viabilitas………... 30
PENDAHULUAN
Latar Belakang
Salah satu faktor penyebab kegagalan dalam program inseminasi buatan (IB) ialah kualitas semen yang digunakan untuk IB. Beberapa faktor yang dapat mempengaruhi kualitas semen setelah dibekukan adalah pengelolahan semen,
pemilihan jenis pengencer, dan pemilihan jenis krioprotektan (Herdis et al. 2003).
Dalam pengolahan semen harus dilakukan seoptimal mungkin sehingga kualitasnya dapat dipertahankan. Kontak antara spermatozoa dan udara yang mengandung oksigen selama koleksi dan pengolahan semen dapat mengakibatkan peningkatan aktivitas metabolisme oksidatif di dalam sel, sebagai akibatnya konsentrasi radikal bebas sebagai salah satu produk metabolismenya juga akan meningkat (Holt 2000).
Selama proses pembuatan semen beku yang meliputi proses pendinginan,
pembekuan dan thawing juga dapat mengakibatkan kerusakan fisik dan kimia
pada membran sel spermatozoa yang dapat mempengaruhi kelangsungan hidup sperma dan motilitasnya. Selama proses pembekuan, selain akan terjadi
perubahan suhu dan tekanan osmotik (Baumber et al. 2003), juga terjadi
peroksidasi lipida dan setelah proses pembekuan aktivitas peroksida lipida
meningkat pada bagian tengah membran (midpiece) (Gadea et al. 2007).
Meningkatnya peroksida lipida diawali dengan terbentuknya reactive oxygen
Antioksidan merupakan senyawa yang bersifat nukloephilik yang dapat memutuskan atau menekan reaksi radikal bebas dan mampu untuk mengakhiri siklus reaksi (Hammersdet 1993). Glutation (GSH) merupakan salah satu senyawa antioksidan berupa komponen sulfihidril non-protein di dalam sel yang dapat menetralisirkan radikal bebas hidroksil yang sangat reaktif yang menyebabkan terjadinya peroksidasi lipid pada membran sel (Holt 2000). Fungsi dasar GSH dalam sperma mamalia sebagai mekanisme pencegahan ROS dan membantu melawan efek stres dari oksidatif dalam sperma (Luberda 2005).
Tujuan
Penelitian ini bertujuan untuk mengetahui karakteristik spermatozoa domba selama proses pembekuan dengan medium pengencer yang ditambahkan GSH.
Hipotesa Penelitian
TINJAUAN PUSTAKA
Karakteristik Semen
Semen merupakan cairan yang mengandung spermatozoa dan plasma semen
yang dihasilkan dari sekresi oleh kelanjar-kelanjar kelamin jantan (Herdis et al.
2003). Adapun perbedaan warna, konsistensi, dan konsentrasi dari semen mempunyai hubungan yang erat satu sama lain. Warna semen domba yang normal berwarna krem, derajat kekeruhan tergantung atas konsentrasi spermatozoa yang dikandung. Semen domba normal mempunyai konsistensi yang kental. Konsistensi atau derajat kekentalan dapat dilihat dengan cara menggoyangkan tabung penampung berisi semen segar secara perlahan. Semen dengan konsistensi kental akan terlihat pada saat memiringkan tabung gelas penampung dan selanjutnya kembali pada posisi normal, maka proses kembalinya larutan semen tersebut ke posisi tegak akan lama, dibandingkan dengan semen dengan konsistensi encer (Rasad 2011). Selain itu, derajat keasaman (pH) juga sangat menentukan status kehidupan spermatozoa di dalam semen. Derajat keasaman pada domba berkisar 5.7- 7.3. Semakin rendah atau semakin tinggi pH semen dari
pH normal akan membuat spermatozoa lebih cepat mati (Suyadi et al. 2004).
Secara mikroskopis, semen yang berkualitas baik adalah mempunyai gerakan masa dan motilitas dengan daya gerak maju yang progresif. Semakin aktif dan semakin banyak spermatozoa yang bergerak ke depan, maka gerakan massa akan
semakin baik (Sujoko et al. 2009).
Spermatozoa
pengurangan setengah jumlah kromosom, dan pengurangan jumlah deoxyribo nucleid acid (DNA) per sel sehingga menghasilkan spermatid dan 2) spermiogenesis, dimana spermatid akan berubah menjadi spermatozoa (Schatten & Constantinescu 2007).
Secara normal spermatozoa terdiri dari kepala dan ekor yang diselaputi oleh membran sel, yang mempunyai struktur sangat kompleks dalam susunan mozaik
yang teratur dan memiliki peran biologik spesifik pada permukaannya (Jones et al
1993). Membran sel berfungsi untuk mempertahankan integritas sel dan membentuk interfase dinamis antara sel dengan lingkungan sekitarnya (Schatten & Constantinescu 2007). Secara umum membran spermatozoa tersusun dari lipid, protein dan karbohidrat serta zat lain yang bergabung bersama secara non kovalen dan sangat sensitif terhadap faktor-faktor ekstrinsik seperti suhu, kekuatan ionik
dan polaritas pelarut (Kelso et al. 1997). Lipid merupakan komponen utama
penyusun struktur membran spermatozoa, yang berperan penting dalam menjaga stabilitas dan kelangsungan hidup spermatozoa secara keseluruhan, termasuk kemampuan spermatozoa untuk mengkapasitasi serta membuahi sel telur (Darnell
et al. 1990). Membran akrosom pada kepala sperma berfungsi untuk kapasitasi, reaksi akrosom dan penembusan ovum pada proses fertilisasi. Membran bagian
belakang akrosom (post acrosomal region) berfungsi untuk mengadakan kontak
pertama dan menjadi satu dengan oolema ovum pada proses fertilisasi, sedangkan
membran pada bagian tengah (midpiece) ekor berfungsi untuk mendapatkan
substrat untuk energi spermatozoa dan menghantarkan gelombang gerak, serta
membran bagian utama (principle piece) berfungsi untuk pergerakan spermatozoa.
Pada bagian luar membran plasma sel terdapat karbohidrat yang berikatan dengan lipid (glikolipid) atau dengan protein (glikoprotein) yang disebut selubung sel (Schatten & Constantinescu 2007).
Pembekuan Semen
dilihat dari kualitas semen setelah thawing tetapi juga dari jumlah spermatozoa
yang berhasil pulih dari proses pembekuan yang di sebut recovery rate
(Arifiantini et al. 2007). Dalam proses pembekuan semen adanya hambatan yang
disebabkan oleh kejutan dingin (cold shock) dan perubahan interaseluler akibat
pengeluaran air dari sel dan terbentuknya kristal-kristal es (Herdis et al. 2003)
akan menyebabkan kerusakan sel. Kejutan dingin terjadi karena adanya penurunan suhu yang cepat sampai di bawah 0 ºC sehingga menurunkan viabilitas sel. Pengaruh utama dari kejutan dingin terhadap sel spermatozoa ialah penurunan motilitas dan daya hidup, sedangkan pembentukan kristal es dalam proses kriopreservasi menyebabkan menumpuknya elekrolit di dalam sel. Penumpukan elektrolit akan merusak dinding sel spermatozoa saat pencairan kembali sehingga permeabilitas membran plasma menurun dan menyebabkan kematian sel (Watson 2000).
Pengenceran Semen
Pengencer semen merupakan larutan yang bersifat isotonis yang memiliki
tekanan osmotik sama dengan plasma darah. Dalam pengencer semen terkandung bahan-bahan yang bersifat buffer, mengandung bahan nutrisi untuk kelangsungan
hidup bagi spermatozoa, dan mampu melindungi dari cold shock (Herdis et al.
2003). Adapun menurut Bearden & Fuquay (1997) pengencer semen memiliki beberapa syarat yang telah ditetapkan yaitu 1) bersifat isotonis terhadap semen, 2) memiliki kemampuan sebagai penyangga sehingga dapat mempertahankan sperma terhadap perubahan pH, 3) dapat melindungi sperma dari cekaman dingin selama proses ekuilibrasi, pendinginan, dan pembekuan, 4) mengandung nurtisi untuk proses metabolisme sperma, 5) mengandung antibiotik untuk mencegah kontaminasi bakteri.
Laktosa
Laktosa adalah salah satu karbohidrat golongan disakarida yang terdiri atas dua unit monosakarida, yakni satu unit glukosa dan satu unit galaktosa yang keduanya dapat dimetabolisme oleh spermatozoa melalui glikolisis dan siklus
2009). Adenosin trifosfat dimanfaatkan oleh spermatozoa sebagai sumber energi dalam proses pergerakan sehingga dapat tetap motil dan sekaligus untuk mempertahankan daya hidupnya. Menurut Lehninger (1994) laktosa merupakan salah satu senyawa pereduksi dan memiliki struktur yang stabil. Sebagai senyawa pereduksi, laktosa memiliki fungsi untuk meredam senyawa-senyawa pengoksidasi, sehingga berperan dalam meminimumkan terjadinya reaksi oksidasi. Laktosa juga dapat berfungsi sebagai krioprotektan ekstraseluler yang
berperan dalam melindungi spermatozoa selama pembekuan (Rizal et al. 2003),
laktosa dapat melindungi membran plasma sel spermatozoa dari kerusakan secara
mekanik selama proses pengolahan semen, terutama saat pendinginan, freezing
dan thawing (Molinia et al. 1994). Menurut Maxwell & Salamon (2000) laktosa lebih efektif dalam menurunkan suhu kristalisasi selama pembekuan dibandingkan dengan golongan monosakarida lainnya, sehingga pembentukan kristal es dapat diminimalkan.
Kuning Telur
Kuning telur berfungsi sebagai sumber energi dan agen protektif (Souhoka
et al. 2009). Kuning telur mengandung glukosa sebagai sumber energi bagi spermatozoa disamping protein dan vitamin-vitamin yang larut dalam air atau
minyak (Gazali & Tambing 2002). Kandungan lechitin dalam kuning telur,
lechitin dapat melindungi membaran plasma sel spermatozoa dari kejutan dingin (cold shock) saat semen disimpan pada suhu dingin (Sudaryani 2003). Selain itu, kuning telur juga mampu mempertahankan dan melindungi integritas selubung
lipoprotein sel spermatozoa (Paulenza et al. 2002).
Gliserol
Krioprotektan ialah zat kimia nonelektrolit yang berperan dalam mengurangi pengaruh mematikan selama pembekuan baik berupa pengaruh larutan maupun adanya pembentukan kristal es sehingga viabilitas sel dapat dipertahankan. Dalam proses preservasi semen terjadi kejutan dingin yang dapat merusak membran sel spermatozoa dan bisa menyebabkan kematian spermatozoa.
semen adalah gliserol karena mampu mengikat air yang cukup kuat dengan tiga gugus hidroksil yang dimilikinya. Gliserol dapat berdifusi ke dalam sel lebih cepat, mampu mengubah kristal es yang berukuran besar dan tajam, dan melenturkan membran sel sehingga tidak mudah rapuh, serta gliserol dapat mengurangi daya merusaknya terhadap spermatozoa dengan jalan memodifikasi kristal es yang terbentuk (Supriatna & Pasaribu 1992).
Walaupun gliserol dapat memberikan perlindungan terhadap sel spermatozoa, namun dapat juga merusak struktur spermatozoa selama proses pembekuan semen, menyebabkan kejutan osmotik, dan menurunkan nilai antibiotika dalam pengencer semen, serta menurunkan volume sel sperma sebanyak setengah dari volume larutan isotonik sesudah pencairan kembali. Oleh karena itu, kandungan gliserol di dalam pengencer semen bergantung pada metode pendinginan atau pembekuan, komposisi pengencer, dan cara penambahan (Gazali & Tambing 2002).
Antibiotik
Perlunya penambahan antibiotik dalam pengencer semen domba. Biasanya antibiotik yang sering digunakan dalam penambahan bahan pengencer semen beku antara lain gentamycin, lincomycin, spectinomycin, streptomycin, dan penisilin. Penambahan antibiotik dalam pengencer dimaksudkan untuk mencegah pertumbuhan mikroorganisme (Hafez 2000).
Reactive Oxygen Species (ROS)
dikarenakan merusak bagian dari membran plasma sel dan dapat mengakibatkan kematian spermatozoa (Holt 2000). Selain itu, peroksidasi lipid yang terjadi secara terus-menerus dapat menyebabkan ketidak stabilan membran, mengubah
viskositas membran, dan merangsang aktivitas fosfolipase A2 (Gazali & Tambing
2002).
Pada sel mamalia efek toksik yang disebabkan oleh perokidasi lipid ialah menghambat metabolisme oksidatif, menghambat proses glikolisis, menghambat kerja enzim sulfhidril, dan menyebabkan denaturasi DNA. Ciri kerusakan sel spermatozoa akibat peroksida lipid ialah rendahnya motilitas spermatozoa, kerusakan enzim intraseluler, dan kerusakan membran plasma terutama bagian akrosom (White 1993).
Glutation
Glutation mempunyai kandungan senyawa molekul tiol tripeptida terdiri dari tiga asam amino yaitu, L-glutamin, L-cystien, dan L-glysin (Luberda 2005). Glutation merupakan antioksidan yang mempunyai potensi melindungi sistem biologi akibat adanya suatu proses atau reaksi yang merugikan dengan jalan mereduksi dan menekan reaksi radikal bebas (Hammersdet 1993). Glutation merupakan antioksidan primer yang berfungsi untuk mencegah pembentukan radikal bebas baru, glutation berkerja dengan mengubah radikal bebas baru menjadi molekul yang kurang berdampak negatif sebelum radikal bebas tersebut mempunyai kesempatan untuk bereaksi (Wijaya 1996). Menurut Sugiyanta (2007) Glutation digunakan sebagai kofaktor oleh enzim peroksidase untuk mendetoksikasi peroksida dari serangan radikal bebas molekuler dan
transhydrogenase untuk mengurangi oksidasi pada DNA, protein, dan biomolekuler lainya. Glutation peroksidase dapat membentuk pertahanan terhadap oksidan atau radikal bebas di dalam tubuh dan mencegah kerusakan sel dengan cara mengkatalisa peroksida menjadi air dan oksigen. Glutation yang didistribusikan ke dalam sel, mempunyai peranan penting dalam mekanisme pertahanan interseluler terhadap stres oksidatif yang disebabkan oleh produksi
ROS berlebih selama proses pembekuan dan thawing spermatozoa (Ansari et al.
kedalam semen kerbau dapat meningkatkan kualitas spermatozoa setelah post-thawing (motilitas, viabilitas, dan intergritas sperma). Sedangkan Bilodeau et al.
(2001) dan Gadea et al. (2007) melaporkan bahwa penambahan GSH dalam
BAHAN DAN METODE
Waktu Penelitian
Penelitian ini dilakukan pada bulan Juli sampai dengan bulan September
2011. Kegiatan ini dilakukan di Laboratorium Fertilitas In Vitro, Unit Rehabilitas
Reproduksi (URR), Departemen Klinik, Reproduksi, dan Patologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Alat dan Bahan
Alat yang digunakan dalam penelitian ini adalah tabung reaksi, gelas ukur, Erlenmeyer, kertas saring, timbangan mikro, pipet tetes, pipet mikro, vagina buatan dan perlengkapannya, pH meter, bunsen, kontainer nitrogen cair,
waterbath, lemari es, styrofoam, gelas objek, cover glas, mikroskop cahaya,
straw, dan syringe. Bahan yang digunakan dalam penelitian yaitu, semen domba,
Pengencer Niwa dan Sasaki Freezing (NSF), medium fertilisasi in vitro dan N2
cair.
Metode Penelitian Persiapan Bahan Pengencer
Komposisi bahan pengencer yang digunakan dalam penelitian ini adalah medium NSF yang terdiri dari NSF I dan NSF II. NSF I mengandung 20% (v/v)
kuning telur, 8.8% (w/v) laktosa dan 200 μg/ml ampicilin, glutation 1 mM atau 3
mM, sedangkan NSF II terdiri dari 92.42% (v/v) medium NSF I tanpa glutation, 1.48% (v/v) Orvus Es Paste (OEP), 6% (v/v) gliserol, glutation 1 mM atau 3 mM.
Koleksi Spermatozoa
Semen diperoleh dari dua domba jantan yang sudah dewasa kelamin. Penampungan semen dilakukan dengan menggunakan vagina buatan yang terbuat
dari karet khusus yang dilengkapi dengan inner liner pada bagian dalamnya untuk
ke laboratorium untuk di proses. Sebelum proses pembekuan semen dilakukan, terlebih dahulu dilakukan evaluasi terhadap karakteristik semen yang meliputi pemeriksaan makroskopis dan mikroskopis. Pemeriksaan makroskopis terdiri dari pemeriksaan terhadap volume semen, pH, warna, dan konsistensi, sedangkan pemeriksaan mikrososkopis meliputi pemeriksaan terhadap motilitas, viabilitas, membran plasma utuh (MPU), dan morfologi abnormal spermatozoa.
Kriopreservasi Spermatozoa
Kriopreservasi merupakan suatu teknik penyimpanan spermatozoa dalam keadaan beku (suhu -196 ºC). Semen dibagi menjadi 3 kelompok yaitu; kelompok K adalah kelompok kontrol dimana semen diencerkan dengan NSF I tanpa penambahan GSH; kelompok GSH 1 mM adalah kelompok semen yang diencerkan dengan NSF I ditambah 1 mM GSH; dan kelompok GSH 3 mM adalah kelompok semen yang diencerkan dengan NSF I yang ditambah 3 mM GSH. Semen dari setiap kelompok semen diekuilibrasi pada suhu 4 ºC selama 2 jam. Pada akhir dari waktu ekuilibrasi, setiap kelompok semen kemudian ditambahkan NSF II, dan selanjutnya diekulibrasi kembali pada suhu yang sama selama 5 menit. Perbandingan penambahan medium NSF I dengan NSF II sebesar 1:1 dengan konsentrasi akhir setelah penambahan medium NSF II adalah 100 x
106 spermatozoa/ml. Spermatozoa segera dimasukkan ke dalam straw berukuran
0.25 ml (IMV, France), kemudian diletakkan pada sebuah styrofoam plate dalam
uap nitrogen selama 20 menit sebelum dimasukkan ke dalam nitrogen cair.
Thawing dilakukan dengan cara meletakkan straw di udara pada suhu kamar selama 30 detik, kemudian mencelupkannya ke dalam bak berisi air pada temperatur 37 ºC selama 30 detik, kemudian spermatozoa dimasukkan ke dalam
medium pengencer IVF diinkubator 5% C02 temperatur 38.5 ºC. Dilakukan
evaluasi terhadap karakteristik spermatozoa setelah thawing (post-thawing).
Pemeriksa post-thawing dilakukan pada waktu 0 jam, 3 jam, dan 6 jam.
Evaluasi Karakteristik Spermatozoa Domba
motilitas progresif spermatozoa, integritas fungsional dari membran spermatozoa
dengan hypoosmotic swelling test (HOS-Test), serta viabilitas dan morfologi
abnormal spermatozoa yang dideterminasi dengan pewarnaan eosin-negrosin.
Penilaian Motilitas Spermatozoa
Penilaian persentase motilitas spermatozoa ditentukan dengan cara menempatkan satu tetes spermatozoa yang telah diencerkan dengan larutan 0.9% NaCl pada gelas objek yang ditutup dengan gelas penutup. Pengamatan terhadap spermatozoa yang bergerak progresif dilakukan secara subjektif pada enam lapang pandang yang berbeda di bawah mikroskop dengan pembesaran 400 X. Penilaian berdasarkan persentase mulai dari nol sampai seratus persen.
Penilaian Integritas Membran Plasma Spermatozoa
Penilaian persentase integritas membran plasma spermatozoa diperiksa menggunakan HOS-Test dengan komposisi larutan HOS untuk 10 ml air mili-Q
ditambahkan dengan 0.135 g fruktosa dan 0.0735 g trisodium citat 2H2O. Sampel
semen sebanyak 20 μl diencerkan dengan 80 μl larutan HOS dan dibiarkan selama
10 menit pada suhu kamar. Sepuluh μl sampel semen diletakkan pada gelas objek
yang ditutup dengan gelas penutup dan evaluasi dilakukan di bawah mikroskop dengan perbesaran 400 X. Perhitungan dilakukan pada lima kotak teracak terhadap spermatozoa yang mempunyai ekor melingkar (membran plasma utuh) maupun yang mempunyai ekor lurus (membran plasma tidak utuh).
Penilaian Viabilitas dan Morfologi Abnormalitas Spermatozoa
Penilaian viabilitas dan abnormal spermatozoa dengan menggunakan
metode pewarnaan eosin-negrosin. Sebanyak 10 μl sampel semen dan 40 μl
sehingga terlihat transparan, dan spermatozoa yang mempunyai morfologi abnormal bisa dilihat bagian kepala lebih besar dibandingkan dengan spermatozoa yang lain serta bagian kepala dan ekor bercabang.
Analisis Data
HASIL DAN PEMBAHASAN
Karakteristik Semen Domba Segera Setelah Koleksi
Pemeriksaan karakteristik semen domba segera setelah koleksi yang dilakukan dalam penelitian ini meliputi pemeriksaan secara makroskopis dan mikroskopis. Hasil pemeriksaan karakteristik semen domba segera disajikan pada Tabel 1.
Tabel 1 Karakteristik semen segar setelah koleksi
Karakteristik Rata-rataan
Hasil pemeriksaan makroskopis menunjukan warna semen domba berwarna
putih susu-krem, hal ini sesuai dengan penelitian Qomariyah et al. (2001) yang
menyatakan warna semen domba berwarna putih susu atau krem. Konsistensi dari semen domba yang diperoleh dari penelitian ini mempunyai konsistensi yang
kental sama halnya dengan penelitian Hastono et al. (2001). Menurut Garner &
Hafez (2000) volume semen domba perejakulasi berkisar 0.8- 1.2 ml, sehingga dilihat dari hasil yang diperoleh volume semen dalam penelitian ini lebih rendah. Adanya perbedaan volume semen bisa dikarenakan oleh perbedaan umur, ukuran badan, tingkat makanan, frekuensi penampungan, dan cara penampungan (Murtidjo 1993). Derajat keasaman (pH) dalam penelitian ini masih dalam kisaran normal nilai semen domba yaitu 5.9-7.3 (Garner & Hafez 2000).
nuhi syarat motilitas progresif lebih dari 65% dan abnormalitas kurang dari 20%.
m
nilai persentase dari nol sampai seratus persen (0-100%) (Bearden et al. 2004).
domba selama proses pembekuan dalam enelitian ini disajikan dalam Tabel 2.
ersentase motilitas sperma s pembekuan
Kelompok Persentase motilitas±
yang diperoleh dari penelitian ini adalah 1.2 ± 1.07. Menurut Garner & Hafez (2000) bahwa kisaran abnormal spermatozoa domba antara 5-20%, sehingga dilihat dari hasil penelitian ini maka nilai abnormal spermatozoa yang didapatkan masih di bawah kisaran normal. Hasil rata-rataan persentase MPU pada penelitian ini 88.8 ± 4.26. Dari hasil evaluasi tersebut di atas, semen domba yang dikoleksi layak untuk dibekukan karena meme
Persentase Motilitas Spermatozoa
Motilitas spermatozoa berperan dalam penentuan kualitas semen karena berkaitan erat dengan kemampuan spermatozoa untuk fertilisasi. Pengukuran persentase motilitas dilakukan secara subjektif yang dilihat di bawah mikroskop dengan perbesaran 400 X dengan cara membandingkan spermatozoa yang bergerak progresif dengan semua spermatozoa yang teramati dinyatakan dala
Persentase motilitas spermatozoa p
Tabel 2 P tozoa domba selama prose
SD
K 75±0 67.5±2.9 38.8±2.5 30±0 21.3±6.3a
GSH 1 mM 75±0 71.1±2.5 42.5±2.9
G
33.8±2.5 22.5±2.9a
SH 3 mM 75±0 71.1±2.5 40±4.1 33.8±2.5 28.8±4.8b
Ket:
penambahan glutation dengan konsentrasi 3 mM. Superskrip berbeda pada kolom yang sama menunjukan perbedaan nyata (p< 0.05).
(K) Kontrol, (GSH 1 mM) penambahan glutation dengan konsentrasi 1 mM, (GSH 3 mM)
k terhadap motilitas spermatozoa 6 jam s
membran plasma permatozoa sehingga meningkatkan motilitas spermatozoa.
a menembus membran sel telur selama
proses fertilisasi (Ansari et al. 2010).
jam dan 3 jam tidak berbeda diantara kelompok perlakukan (p>0.05), akan tetapi
6 jam setelah thawing, motilitas spermatozoa pada kelompok GSH 3 mM lebih
tinggi dari kontrol dan kelompok GSH 1 mM (p<0.05). Hasil penelitian ini menunjukan penambahan GSH dalam pengencer semen domba selama proses pembekuan memberikan pengaruh yang bai
etelah thawing pada konsentrasi 3 mM.
Glutation merupakan antioksidan yang mampu menetralisirkan reaksi radikal bebas hidroksil yang bersifat sangat reaktif. Radikal hidroksil dapat merusak 3 jenis komponen penting yang diperlukan untuk mempertahankan integritas membran sel yakni 1) asam lemak tak jenuh yang merupakan komponen
penting fosfolipid plasma dalam penyusun membran plasma sel; 2) deoxyribo
nucleid acid (DNA) yang merupakan perangkat genetik sel; 3) protein yang mempunyai peran penting sebagai enzim, pembentuk matriks, dan sitoskeleton (Suryohudoyo 2000). Penambahan glutation dapat meminimalkan kerusakan membran plasma spermatozoa akibat reaksi rantai peroksidasi lipid serta dapat mempertahankan persentase motilitas spermatozoa selama proses pembekuan
(Holt 2000; Triwulanningsih et al. 2003). El-kon II & Darwish (2011) juga
melaporkan bahwa penambahan GSH dalam semen cair kerbau dapat membantu menjaga integritas normal akrosom dan menstabilkan
s
Persentase Integritas Membran Plasma Spermatozoa
Integritas membran plasma atau keutuhan membran plasma spermatozoa merupakan faktor yang penting untuk kelangsungan hidup spermatozoa karena kerusakan membran plasma akan berpengaruh terhadap proses metabolisme spermatozoa yang berhubungan dengan daya hidup spermatozoa yang dihasilkan (Rizal 2005). Metabolisme dapat berlangsung dengan baik apabila membran plasma berada dalam keadaan utuh, sehingga dapat mengatur lalu lintas masuk
dan keluar semua elektrolit yang dibutuhkan dalam proses metabolisme (Herdis et
al. 2003). Selain itu, integritas membran plasma mempunyai fungsi untuk
Persentase integritas membran plasma spermatozoa selama proses pembekuan dalam penelitian ini disajikan dalam Tabel 3.
Tabel 3 Persentase integritas membran plasma spermatozoa selama proses pembekuan
Kelompok Persentase integritas membran plasma ± SD
Segera
K 85.1±5.9 79.3±4.6 74.7±8.8a 57.4±3.2a 50.1±6.8
GSH 1 mM 89.1±1.6 85.6±6.9 79.8±12.9b 59.1±8.8a 57.1±9.1
GSH 3 mM 86.1±7.9 85.1±4.6 73.1±11.8a 62.7±6.2b 54.5±11.0
Ket: (K) Kontrol, (GSH 1 mM) penambahan glutation dengan konsentrasi 1 mM, (GSH 3 mM) penambahan glutation dengan konsentrasi 3 mM. Superskrip berbeda pada kolom yang sama menunjukan perbedaan nyata (p< 0.05).
Data pada Tabel 3 menunjukan bahwa integritas membran plasma spermatozoa segera setelah semen diencerkan dan setelah diekuilibrasi tidak beda
diantara perlakuan (p>0.05). Integritas membran plasma segera setelah thawing
pada kelompok GSH 1 mM lebih tinggi dari kelompok kontrol dan kelompok
GSH 3 mM (p<0.05). Tiga jam setelah thawing, integritas membran plasma
spermatozoa pada kelompok GSH 3 mM lebih tinggi dari kontrol dan GSH 1 mM
(p<0.05), tetapi 6 jam setelah thawing integritas membran plasama spermatozoa
tidak berbeda diantara kelompok perlakuan (p>0.05). Hasil penelitian ini menunjukkan bahwa penambahan GSH ke dalam pengencer selama proses
pembekuan dapat melindungi keutuhan membran plasma spermatozoa. Ansari et
al. (2010) melaporkan bahwa pemberian GSH sebanyak 2 mM pada pengencer
semen kerbau dapat melindungi membran plasma dari stres oksidatif akibat produksi ROS berlebihan sehingga menyebabkan peroksidasi lipid, sedangkan
penelitian Triwulanningsih et al. (2003) menemukan bahwa penambahan GSH
Larutan hypoosmotic swelling test (HOS-Test) dalam penelitian ini digunakan untuk melihat integritas membran plasma utuh. Spermatozoa dengan membran plasma yang masih utuh akan ditandai dengan ekor spermatozoa
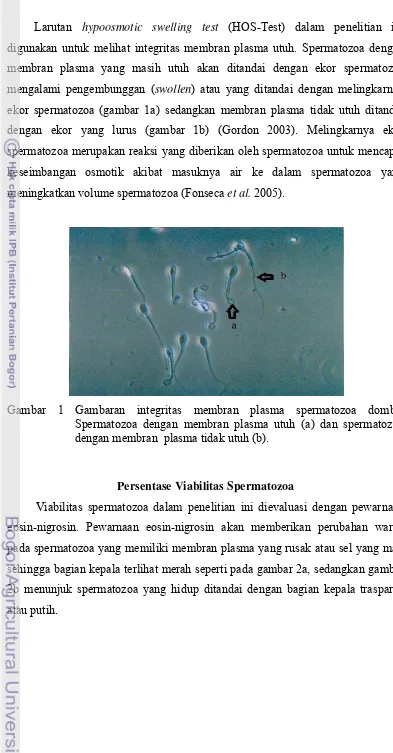
mengalami pengembunggan (swollen) atau yang ditandai dengan melingkarnya
ekor spermatozoa (gambar 1a) sedangkan membran plasma tidak utuh ditandai dengan ekor yang lurus (gambar 1b) (Gordon 2003). Melingkarnya ekor spermatozoa merupakan reaksi yang diberikan oleh spermatozoa untuk mencapai keseimbangan osmotik akibat masuknya air ke dalam spermatozoa yang
meningkatkan volume spermatozoa (Fonseca et al. 2005).
Gambar 1 Gambaran integritas membran plasma spermatozoa domba. Spermatozoa dengan membran plasma utuh (a) dan spermatozoa dengan membran plasma tidak utuh (b).
Persentase Viabilitas Spermatozoa
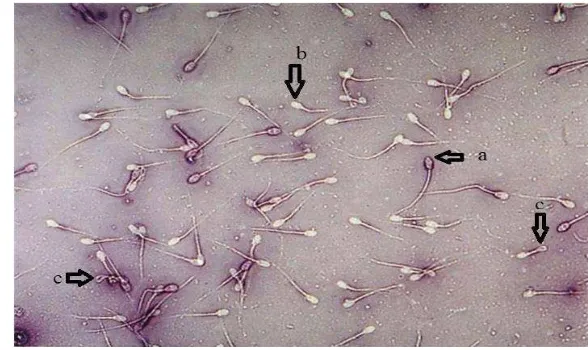
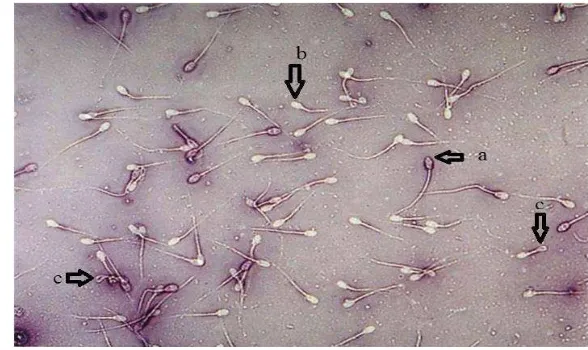
Gambar 2 Contoh gambaran spermatozoa domba setelah diwarnai dengan eosin- nigrosin. Spermatozoa mati (a). Spermatozoa hidup (b). Spermatozoa
ekor melingkar atau membengkok (c).
Viabilitas spermatozoa domba selama proses pembekuan dalam penelitian ini disajikan dalam Tabel 4.
Tabel 4 Persentase viabilitas spermatozoa selama proses pembekuan
Kelompok Persentase viabilitas±SD
Segera
GSH 1mM 80.4±4.5b 77.6±4.5 57.8±12.0 34.7±4.3 25.9±9.9
GSH 3mM 81.3±3.6b 80.0±8.9 51.5±14.9 38.7±4.9 30.8±5.3
Ket: (K) Kontrol, (GSH 1 mM) penambahan glutation dengan konsentrasi 1 mM, (GSH 3 mM) penambahan glutation dengan konsentrasi 3 mM. Superskrip pada kolom yang sama menunjukan perbedaan nyata (p< 0.05).
Data dalam Tabel 4 menunjukan bahwa terjadi penurunan viabilitas spermatozoa setelah semen dibekukan. Walaupun terjadi perbedaan viabilitas spermatozoa diantara kelompok perlakuan segera setelah semen diencerkan (p<0.05), tetapi tidak ditemukan adanya perbedaan yang nyata pada viabilitas antara spermatozoa diantara kelompok perlakuan setelah waktu ekuilibrasi, segera
setelah thawing (0 jam), 3 jam setelah thawing, dan 6 jam setelah thawing
Terdapat dua faktor yang dapat menurunkan viabiltas spermatozoa yaitu,
adanya kejutan dingin (cold-shock) dan perubahan intraseluler akibat pengeluaran
air yang berkaitan dengan pembekuan kristal es (Gazali & Tambing 2002). Faktor pertama adanya kejutan dingin terjadi karena adanya penurunan suhu yang terjadi secara mendadak yang bisa mencapai di bawah 0°C yang dapat menurunkan viabilitas sel, hal ini dapat disebabkan dalam tahap transisi dari membran lipid yang mana menyebabkan terjadinya tahap pemisahan dan penurunan sifat permeabilitas dari membran biologi sel hidup (Watson 1995). Faktor kedua yang menyebabkan penurunan viabilitas sel yaitu terjadinya pembekuan kristal es selama proses kriopreservasi adalah adanya penumpukan elektrolit di dalam sel. Penumpukan elektrolit ini akan merusak dari dinding membran sel sehingga pada waktu pencairan kembali permeabilitas membran plasma akan menurun dan sel akan mati (Gazali & Tambing 2002). Pemberian GSH adalah melindungi viabilitas spermatozoa dari reaksi lipid peroksidasi yang dapat merusak membran
plasma sel (Ansari et al. 2010).
Persentase Morfologi Abnormal Spermatozoa
Persentase abnormal spermatozoa domba selama proses pembekuan dalam penelitian ini disajikan dalam Tabel 5.
Tabel 5 Persentase abnormal spermatozoa domba selama proses pembekuan
Kelompok Persentase abnormal spermatozoa ±SD
Segera
K 0.6±0.8 1.2±0.9 1.6±1.1 1.3±1.1 2.1±1.9
GSH 1 mM 0.8±1.2 1.9±1.7 1.7±0.9 2.2±0.5 2.5±0.5
GSH 3 mM 1.9±1.1 0.9±1.4 0.9±1.2 2.5±1.6 1.6±1.2
Ket: (K) Kontrol, (GSH 1 mM) penambahan glutation dengan konsentrasi 1 mM, (GSH 3 mM) penambahan glutation dengan konsentrasi 3 mM
Data dalam Tabel 5 menunjukan tidak ditemuakan adanya perbedaan abnormalitas spermatozoa diantara kelompok perlakuan baik sebelum dan setelah
dibekukan, setelah waktu ekuilibrasi, segera setelah thawing (0 jam), 3 jam
dalam penelitian ini dapat dinyatakan penambahan GSH tidak mempengaruhi hasil persentase abnormalitas spermatozoa. Menurut Garner & Hafez (2000) bahwa kisaran abnormal spermatozoa domba antara 5-20%, sehingga dilihat dari hasil penelitian ini maka nilai abnormal spermatozoa yang didapatkan masih di bawah batas normal.
Menurut Barth & Oko (1989) bentuk-bentuk abnormalitas spermatozoa diklasifikasikan menjadi dua yaitu abnormalitas primer dan sekunder. Abnormalitas primer terjadi karena adanya kegagalan dalam proses spermatogenesis ditubuli seminiferi. Abnormalitas primer dapat dikarenakan faktor keturunan dan pengaruh lingkungan yang buruk. Bentuk dari abnormalitas
primer meliputi kepala besar (macrocephalus) atau kepala kecil (microchepalus),
SIMPULAN DAN SARAN
Simpulan
1. Penambahan glutation dengan dosis 3 mM dalam medium pengencer semendomba memberikan pengaruh yang baik terhadap motilitas spermatozoa
setelah 6 jam post-thawing dan persentase membran plasma utuh setelah 3 jam
post-thawing.
2. Penambahan glutation dalam medium pengencer semen domba tidak mempengaruhi viabilitas dan morfologi abnormalitas spermatozoa dalam penelitian ini.
Saran
DAFTAR PUSTAKA
Ansari MS, Rahka BA, Ullah N, Andrabi SMH, Iqbal S et al. 2010. Effect of
exogenous glutathione in extender on the freezability of Nila-Ravi buffalo (Bubalus bubalis) bull spermatozoa. Anim Sci Papers and Reports 28 (3): 235-244.
Arifiantini RI, Supriatna I, Aminah. 2007. Kualitas semen beku kuda dalam pengenceran susu skim dan dimitropoulos dengan dimetilformamida
sebagai krioprotektan. Media Perternakan 30 (2): 100-105.
Barth AD, Oko RJ.1989. Abnormal Morphology of Bovine Spermatozoa: Lowa:
Lowa States University Pr.
Baumber J, Ball BA, Linfor JJ, Meyers SA. 2003. Reactive oxygen species and cryopreservation promote DNA fragmentation in equine spermatozoa.
Androl 24: 621-628.
Bearden HJ, Fuquay JW.1997. Applied Animal Reproduction. Ed ke-4. New
Jersey: Prentice Hall, Upper Saddle.pp 133-177.
Bearden HJ, Fuquy JW, Willard ST. 2004. Applied Animal Reproduction. Ed ke-
6. New Jersey: Pearson Prentice Hall.
Bilodeau JF, Blanchettes, Gagnon C, Sirad MA. 2001. Thiols prevent H2O2
mediated loss of sperm motility in cryopreserved bull semen
Theriogenology 56: 275-286.
Darnell J, Lodish H, Baltimore D. 1990. Moleculer Cell Biology. Ed ke-2 e. Anim
Sci Books. Pp. 491 – 527.
El-kon II, Darwish SA. 2011. Effect of glutathione (GSH) on microscopic
parameters and DNA integrity in egyptian buffalo semen during liquid and
frozen storage. J Repro and Infert 2 (3): 32-40.
Fonseca JF, Torres CAA, Maffilli VV, Borges AM, Santos ADF et al. 2005.
Hypoosmotic swelling test in fresh goat spermatozoa. Anim Reprod 2 (2):
139-144.
Gadella BM. 2008. Sperm membrane physiology and relevance for
fertilization. Anim Reprod Sci. 107: 229-236.
Gadea J, Gumbao D, Novas SC, Zquez FAZ, Grullo LA et al. 2007.
Supplementation of the dilution medium after thawing with reduced glutathione improves function and the in vitro fertilizing ability of
Garner DL, Hafez ESE. 2000. Spermatozoa and seminal plasma. Di dalam : Hafez
B, Hafez ESE, edior. Reproduction in Farm Animals. Ed ke-7.
Philadelphia: Lippincot William and Wilkins. Chapter 7. Hlm: 96-109.
Gazali M, Tambing SN. 2002. Kriopreservasi sel spermatozoa. Hayati 9 (1):
27-32.
Gordon I. 2003. Laboratory Production of Cattle Embryos. Ed ke-2. CABI Publishing.
Hafez ESE. 2000. Reproduction In Animals.Ed ke-7. Philadelphia: Lea and
Fibiger.
Hammerstedt RH. 1993. Maintenance of bioenergic balance in sperm and
prevention of lipid peroxydation. J Reprod Fertil 5 : 675-690.
Hastono I, Inounu, dan Hidayati N. 2001. Karakteristik semen dan tingkat libido
domba persilangan. Prosiding Seminar Teknologi Peternakan dan
Veteriner. Bogor: Balai Penelitian Ternak. pp. 106-112.
Herdis, Toelihere MR, Supriatna I, Purwaritara B, dan Adikara RTS. 2003. Integritas dan daya hidup spermatozoa pada pembekuan semen domba
garut (ovis arios) dengan pengenceran dasar tris dan susu skim kuning
telur. J Sains dan Teknologi Indonesia 2 (3): 62-68.
Holt WV. 2000. Basic aspects of frozen storage of semen. Anim Repro Sci 62:36.
Jones RT, Mann, Sherins RJ. 1993. Demage to ram spermatozoa by peroxidation
of endogenous phospholipids. J Reprod Fertil 50 : 261 – 268.
Kelso, Redpath KAA, Noble RC, Speake BK. 1997. Lipid and antioxidant changes in spermatozoa and seminal plasma throughout the reproductive
period of bull.J Repro Fert.109 : 1 – 9.
Lehninger. 1994. Dasar-dasar Biokimia. Jilid 2. Ahli bahasa: Thenawijaya M.
Jakarta: Erlangga.
Luberda Z. 2005. The role of gluthation in mammalian gamets. Repro Boilogy 5
(1): 5-17.
Maxwell WMC, Salamon S. 2000. Storage of ram semen. Anim Reprod Sci.
62:77-111.
Molinia FC, Evans G, Guintana-Casares PI, Maxwell WMC. 1994. Effect of monosaccharides and disaccharides in Tris-based diluentson motility,
acrosome integrity and fertility of pellet frozen ram spermatozoa. Anim
Murtidjo AB. 1993. Memelihara Domba. Yogyakarta: Kaninus. Hlm 104-107. Paulenz H, Soderquist L, Perez-Pe R, Berg KA. 2002. Effect of different
extenders and storage temperatures on sperm viability of liquid ram
semen. Theriogenology 57 (2): 823-836.
Qomariyah S, Mihardja, Idi R. 2001. Pengaruh kombinasi telur dengan air kelapa terhadap daya tahan dan abnormalitas spermatozoa domba Priangan pada
penyimpanan 50°C. Prosiding Seminar Nasional Teknologi Peternakan
dan Veteriner.Bogor: Puslitbang Bioteknologi LIPI. pp. 172-177.
Rasad SD. 2011. Teknologi reproduksi ternak. Universitas Padjadjaran Bandung: Lab Reproduksi Ternak 1-37.
Rizal M, Toelihere MR, Yusuf TL, Purwantara B, Situmorang P. 2003. Kriopreservasi semen domba garut dalam pengencer tris dengan
konsentrasi laktosa yang berbeda. Media Kedokteran Hewan. 19 (2):
83.
Rizal M. 2005. Fertilitas spermatozoa ejakulasi dan epididimis domba garut hasil kriopreservasi menggunakan modifikasi pengencer tris dengan berbagi krioprotektan dan antioksidan [disertasi]. Bogor: Sekolah Pascasarjana,
Institut Pertanian Bogor.
Schatten H, Constantinescu GM. 2007. Comparative Reproductive Biology. USA:
Blackwell Pub.
Souhoka DF, Matatula MJ, Mesang-Nalley MM, Rizal M. 2009.Laktosa mempertahankan daya hidup spermatozoa kambing peranakan Etawah
yang dipreservasi dengan plasma semen domba priangan. J Vet 10 (3):
135-142.
Sudaryani T. 2003. Kualitas Telur. Jakartat. Penebar Swadaya.
Sugiyanta. 2007. Peran glutathione sebagai master antioksidan. Biomedis 1 (1):
48-53.
Sujoko H, Setiadi MA, Boediono A. 2009. Seleksi spermatozoa domba garut dengan metode sentrifugasi gradien densitas percoll. Bogor: Institut Pertanian Bogor .
Supriatna I, Pasaribu FH. 1992. In vitro fertilisasi, Transfer Embrio dan
Suryohudoyo P. 2000. Oksidan, antioksidan, dan radikal bebas. Suryohudoyono
P dalam: Kapita Selekta Ilmu Kedokteran Molekuler. Jakarta: CV Sagung
Seto. Hlm 31-47.
Suyadi T. Susilawati, Isnaini N. 2004. Uji pembekuan semen kambing Boer.
Laporan Penelitian Kerjasama Dotjen Pertenakan. Malang: Fakultas Peternakan, Universitas Brawijaya.
Triwulanningsih E, Situmorang P, Sugiarti T, Sianturi RG, dan Kusumaningrum DA. 2003. Pengaruh penambahan glutathione pada medium pengencer
sperma terhadap kualitas semen cair (chilled semen). JITV 8 (2) : 91-97.
Watson PF. 1995. Recent developments and concepts in the cryopreservationof
spermatozoa and assesment of their post-thawing function. Reprod Fertil
Dev 7:871-891
.
Watson PF. 2002. The causes of reduced fertilitiy with cryoperserved semen.
Anim Reprod Sci 60-61:481-492.
White IG. 1993. Lipids and calcium uptake of sperm in relation to cold shock and
preservation. A review. Reprod Fertil Dev 5:639-658.
Wijaya A. 1996. Radikal bebas dan parameter status antioksidan. Forum
Lampiran 1 Hasil Uji Motilitas
Duncan
N
Subset for alpha = 0.05
1 2 3 4 5 6
kontrol post thawing 6 jam 4 21.2500
GSH 1 mM post thawing 6 jam 4 22.5000
GSH 3 mM post thawing 6 jam 4 28.7500
kontrol post thawing 3 jam 4 30.0000 30.0000
GSH 1 mM post thawing 3 jam 4 33.7500
GSH 3 mM post thawing 3 jam 4 33.7500
kontrol post thawing 0 jam 4 38.7500
GSH 3 mM post thawing 0 jam 4 41.2500
GSH 1 mM post thawing 0 jam 4 42.5000
kontrol ekuilibrasi 4 67.5000
GSH 1 mM Ekuilibrasi 4 71.2500 71.2500
GSH 3 mM ekulibrasi 4 71.2500 71.2500
kontrol segera 4 75.0000
GSH 1 mM segera 4 75.0000
GSH 3 mM segera 4 75.0000
Lampiran 2 Hasil Uji Integritas Membran Plasma
Duncan
N
Subset for alpha = 0.05
1 2 3 4
kontrol post thawing 6 jam 4 50.1250
GSH 3 mM post thawing 6 jam 4 54.4500
GSH 1 mM post thawing 6 jam 4 57.0500
kontrol post thawing 3 jam 4 57.4250
GSH 1 mM post thawing 3 jam 4 59.0750
GSH 3 mM post thawing 3 jam 4 62.7000 62.7000
GSH 3 mM post thawing 0 jam 4 73.0750 73.0750
kontrol post thawing 0 jam 4 74.6500
kontrol ekuilibrasi 4 79.2500 79.2500
GSH 1 mM post thawing 0 jam 4 79.8250 79.8250
GSH 3 mM ekulibrasi 4 85.0500 85.0500
kontrol segera 4 85.0500 85.0500
GSH 1 mM Ekuilibrasi 4 85.6000 85.6000
GSH 3 mM segera 4 86.0500 86.0500
GSH 1 mM segera 4 89.1000
Lampiran 3 Hasil Uji Viabilitas
Duncan
N
Subset for alpha = 0.05
1 2 3 4
GSH 1 mM post thawing 6 jam 4 25.6250
kontrol post thawing 6 jam 4 26.3500 26.3500
GSH 3 mM post thawing 6 jam 4 30.3750 30.3750
kontrol post thawing 3 jam 4 32.1250 32.1250
GSH 1 mM post thawing 3 jam 4 34.7250 34.7250
GSH 3 mM post thawing 3 jam 4 38.6750
GSH 3 mM post thawing 0 jam 4 51.5375
kontrol post thawing 0 jam 4 51.7500
GSH 1 mM post thawing 0 jam 4 57.8250
kontrol segera 4 76.4750
kontrol ekuilibrasi 4 77.3500
GSH 1 mM segera 4 80.3750
GSH 3 mM segera 4 81.3000
GSH 3 mM ekulibrasi 4 83.9000
GSH 1 mM Ekuilibrasi 4 89.1000
Lampiran 4 Hasil Uji Abnormalitas
Duncan
N
Subset for alpha = 0.05
1
kontrol segera 4 .5500
GSH 1 mM segera 4 .8250
GSH 3 mM post thawing 0 jam 4 .8750
GSH 3 mM ekulibrasi 4 .9500
kontrol ekuilibrasi 4 1.1750
kontrol post thawing 3 jam 4 1.3250
kontrol post thawing 0 jam 4 1.5500
GSH 3 mM post thawing 6 jam 4 1.6000
GSH 1 mM post thawing 0 jam 4 1.6500
GSH 3 mM segera 4 1.7500
GSH 1 mM Ekuilibrasi 4 1.9250
kontrol post thawing 6 jam 4 2.1000
GSH 1 mM post thawing 3 jam 4 2.1500
GSH 1 mM post thawing 6 jam 4 2.5000
GSH 3 mM post thawing 3 jam 4 2.5000
PENDAHULUAN
Latar Belakang
Salah satu faktor penyebab kegagalan dalam program inseminasi buatan (IB) ialah kualitas semen yang digunakan untuk IB. Beberapa faktor yang dapat mempengaruhi kualitas semen setelah dibekukan adalah pengelolahan semen,
pemilihan jenis pengencer, dan pemilihan jenis krioprotektan (Herdis et al. 2003).
Dalam pengolahan semen harus dilakukan seoptimal mungkin sehingga kualitasnya dapat dipertahankan. Kontak antara spermatozoa dan udara yang mengandung oksigen selama koleksi dan pengolahan semen dapat mengakibatkan peningkatan aktivitas metabolisme oksidatif di dalam sel, sebagai akibatnya konsentrasi radikal bebas sebagai salah satu produk metabolismenya juga akan meningkat (Holt 2000).
Selama proses pembuatan semen beku yang meliputi proses pendinginan,
pembekuan dan thawing juga dapat mengakibatkan kerusakan fisik dan kimia
pada membran sel spermatozoa yang dapat mempengaruhi kelangsungan hidup sperma dan motilitasnya. Selama proses pembekuan, selain akan terjadi
perubahan suhu dan tekanan osmotik (Baumber et al. 2003), juga terjadi
peroksidasi lipida dan setelah proses pembekuan aktivitas peroksida lipida
meningkat pada bagian tengah membran (midpiece) (Gadea et al. 2007).
Meningkatnya peroksida lipida diawali dengan terbentuknya reactive oxygen
Antioksidan merupakan senyawa yang bersifat nukloephilik yang dapat memutuskan atau menekan reaksi radikal bebas dan mampu untuk mengakhiri siklus reaksi (Hammersdet 1993). Glutation (GSH) merupakan salah satu senyawa antioksidan berupa komponen sulfihidril non-protein di dalam sel yang dapat menetralisirkan radikal bebas hidroksil yang sangat reaktif yang menyebabkan terjadinya peroksidasi lipid pada membran sel (Holt 2000). Fungsi dasar GSH dalam sperma mamalia sebagai mekanisme pencegahan ROS dan membantu melawan efek stres dari oksidatif dalam sperma (Luberda 2005).
Tujuan
Penelitian ini bertujuan untuk mengetahui karakteristik spermatozoa domba selama proses pembekuan dengan medium pengencer yang ditambahkan GSH.
Hipotesa Penelitian
TINJAUAN PUSTAKA
Karakteristik Semen
Semen merupakan cairan yang mengandung spermatozoa dan plasma semen
yang dihasilkan dari sekresi oleh kelanjar-kelanjar kelamin jantan (Herdis et al.
2003). Adapun perbedaan warna, konsistensi, dan konsentrasi dari semen mempunyai hubungan yang erat satu sama lain. Warna semen domba yang normal berwarna krem, derajat kekeruhan tergantung atas konsentrasi spermatozoa yang dikandung. Semen domba normal mempunyai konsistensi yang kental. Konsistensi atau derajat kekentalan dapat dilihat dengan cara menggoyangkan tabung penampung berisi semen segar secara perlahan. Semen dengan konsistensi kental akan terlihat pada saat memiringkan tabung gelas penampung dan selanjutnya kembali pada posisi normal, maka proses kembalinya larutan semen tersebut ke posisi tegak akan lama, dibandingkan dengan semen dengan konsistensi encer (Rasad 2011). Selain itu, derajat keasaman (pH) juga sangat menentukan status kehidupan spermatozoa di dalam semen. Derajat keasaman pada domba berkisar 5.7- 7.3. Semakin rendah atau semakin tinggi pH semen dari
pH normal akan membuat spermatozoa lebih cepat mati (Suyadi et al. 2004).
Secara mikroskopis, semen yang berkualitas baik adalah mempunyai gerakan masa dan motilitas dengan daya gerak maju yang progresif. Semakin aktif dan semakin banyak spermatozoa yang bergerak ke depan, maka gerakan massa akan
semakin baik (Sujoko et al. 2009).
Spermatozoa
pengurangan setengah jumlah kromosom, dan pengurangan jumlah deoxyribo nucleid acid (DNA) per sel sehingga menghasilkan spermatid dan 2) spermiogenesis, dimana spermatid akan berubah menjadi spermatozoa (Schatten & Constantinescu 2007).
Secara normal spermatozoa terdiri dari kepala dan ekor yang diselaputi oleh membran sel, yang mempunyai struktur sangat kompleks dalam susunan mozaik
yang teratur dan memiliki peran biologik spesifik pada permukaannya (Jones et al
1993). Membran sel berfungsi untuk mempertahankan integritas sel dan membentuk interfase dinamis antara sel dengan lingkungan sekitarnya (Schatten & Constantinescu 2007). Secara umum membran spermatozoa tersusun dari lipid, protein dan karbohidrat serta zat lain yang bergabung bersama secara non kovalen dan sangat sensitif terhadap faktor-faktor ekstrinsik seperti suhu, kekuatan ionik
dan polaritas pelarut (Kelso et al. 1997). Lipid merupakan komponen utama
penyusun struktur membran spermatozoa, yang berperan penting dalam menjaga stabilitas dan kelangsungan hidup spermatozoa secara keseluruhan, termasuk kemampuan spermatozoa untuk mengkapasitasi serta membuahi sel telur (Darnell
et al. 1990). Membran akrosom pada kepala sperma berfungsi untuk kapasitasi, reaksi akrosom dan penembusan ovum pada proses fertilisasi. Membran bagian
belakang akrosom (post acrosomal region) berfungsi untuk mengadakan kontak
pertama dan menjadi satu dengan oolema ovum pada proses fertilisasi, sedangkan
membran pada bagian tengah (midpiece) ekor berfungsi untuk mendapatkan
substrat untuk energi spermatozoa dan menghantarkan gelombang gerak, serta
membran bagian utama (principle piece) berfungsi untuk pergerakan spermatozoa.
Pada bagian luar membran plasma sel terdapat karbohidrat yang berikatan dengan lipid (glikolipid) atau dengan protein (glikoprotein) yang disebut selubung sel (Schatten & Constantinescu 2007).
Pembekuan Semen
dilihat dari kualitas semen setelah thawing tetapi juga dari jumlah spermatozoa
yang berhasil pulih dari proses pembekuan yang di sebut recovery rate
(Arifiantini et al. 2007). Dalam proses pembekuan semen adanya hambatan yang
disebabkan oleh kejutan dingin (cold shock) dan perubahan interaseluler akibat
pengeluaran air dari sel dan terbentuknya kristal-kristal es (Herdis et al. 2003)
akan menyebabkan kerusakan sel. Kejutan dingin terjadi karena adanya penurunan suhu yang cepat sampai di bawah 0 ºC sehingga menurunkan viabilitas sel. Pengaruh utama dari kejutan dingin terhadap sel spermatozoa ialah penurunan motilitas dan daya hidup, sedangkan pembentukan kristal es dalam proses kriopreservasi menyebabkan menumpuknya elekrolit di dalam sel. Penumpukan elektrolit akan merusak dinding sel spermatozoa saat pencairan kembali sehingga permeabilitas membran plasma menurun dan menyebabkan kematian sel (Watson 2000).
Pengenceran Semen
Pengencer semen merupakan larutan yang bersifat isotonis yang memiliki
tekanan osmotik sama dengan plasma darah. Dalam pengencer semen terkandung bahan-bahan yang bersifat buffer, mengandung bahan nutrisi untuk kelangsungan
hidup bagi spermatozoa, dan mampu melindungi dari cold shock (Herdis et al.
2003). Adapun menurut Bearden & Fuquay (1997) pengencer semen memiliki beberapa syarat yang telah ditetapkan yaitu 1) bersifat isotonis terhadap semen, 2) memiliki kemampuan sebagai penyangga sehingga dapat mempertahankan sperma terhadap perubahan pH, 3) dapat melindungi sperma dari cekaman dingin selama proses ekuilibrasi, pendinginan, dan pembekuan, 4) mengandung nurtisi untuk proses metabolisme sperma, 5) mengandung antibiotik untuk mencegah kontaminasi bakteri.
Laktosa
Laktosa adalah salah satu karbohidrat golongan disakarida yang terdiri atas dua unit monosakarida, yakni satu unit glukosa dan satu unit galaktosa yang keduanya dapat dimetabolisme oleh spermatozoa melalui glikolisis dan siklus
2009). Adenosin trifosfat dimanfaatkan oleh spermatozoa sebagai sumber energi dalam proses pergerakan sehingga dapat tetap motil dan sekaligus untuk mempertahankan daya hidupnya. Menurut Lehninger (1994) laktosa merupakan salah satu senyawa pereduksi dan memiliki struktur yang stabil. Sebagai senyawa pereduksi, laktosa memiliki fungsi untuk meredam senyawa-senyawa pengoksidasi, sehingga berperan dalam meminimumkan terjadinya reaksi oksidasi. Laktosa juga dapat berfungsi sebagai krioprotektan ekstraseluler yang
berperan dalam melindungi spermatozoa selama pembekuan (Rizal et al. 2003),
laktosa dapat melindungi membran plasma sel spermatozoa dari kerusakan secara
mekanik selama proses pengolahan semen, terutama saat pendinginan, freezing
dan thawing (Molinia et al. 1994). Menurut Maxwell & Salamon (2000) laktosa lebih efektif dalam menurunkan suhu kristalisasi selama pembekuan dibandingkan dengan golongan monosakarida lainnya, sehingga pembentukan kristal es dapat diminimalkan.
Kuning Telur
Kuning telur berfungsi sebagai sumber energi dan agen protektif (Souhoka
et al. 2009). Kuning telur mengandung glukosa sebagai sumber energi bagi spermatozoa disamping protein dan vitamin-vitamin yang larut dalam air atau
minyak (Gazali & Tambing 2002). Kandungan lechitin dalam kuning telur,
lechitin dapat melindungi membaran plasma sel spermatozoa dari kejutan dingin (cold shock) saat semen disimpan pada suhu dingin (Sudaryani 2003). Selain itu, kuning telur juga mampu mempertahankan dan melindungi integritas selubung
lipoprotein sel spermatozoa (Paulenza et al. 2002).
Gliserol
Krioprotektan ialah zat kimia nonelektrolit yang berperan dalam mengurangi pengaruh mematikan selama pembekuan baik berupa pengaruh larutan maupun adanya pembentukan kristal es sehingga viabilitas sel dapat dipertahankan. Dalam proses preservasi semen terjadi kejutan dingin yang dapat merusak membran sel spermatozoa dan bisa menyebabkan kematian spermatozoa.
semen adalah gliserol karena mampu mengikat air yang cukup kuat dengan tiga gugus hidroksil yang dimilikinya. Gliserol dapat berdifusi ke dalam sel lebih cepat, mampu mengubah kristal es yang berukuran besar dan tajam, dan melenturkan membran sel sehingga tidak mudah rapuh, serta gliserol dapat mengurangi daya merusaknya terhadap spermatozoa dengan jalan memodifikasi kristal es yang terbentuk (Supriatna & Pasaribu 1992).
Walaupun gliserol dapat memberikan perlindungan terhadap sel spermatozoa, namun dapat juga merusak struktur spermatozoa selama proses pembekuan semen, menyebabkan kejutan osmotik, dan menurunkan nilai antibiotika dalam pengencer semen, serta menurunkan volume sel sperma sebanyak setengah dari volume larutan isotonik sesudah pencairan kembali. Oleh karena itu, kandungan gliserol di dalam pengencer semen bergantung pada metode pendinginan atau pembekuan, komposisi pengencer, dan cara penambahan (Gazali & Tambing 2002).
Antibiotik
Perlunya penambahan antibiotik dalam pengencer semen domba. Biasanya antibiotik yang sering digunakan dalam penambahan bahan pengencer semen beku antara lain gentamycin, lincomycin, spectinomycin, streptomycin, dan penisilin. Penambahan antibiotik dalam pengencer dimaksudkan untuk mencegah pertumbuhan mikroorganisme (Hafez 2000).
Reactive Oxygen Species (ROS)
dikarenakan merusak bagian dari membran plasma sel dan dapat mengakibatkan kematian spermatozoa (Holt 2000). Selain itu, peroksidasi lipid yang terjadi secara terus-menerus dapat menyebabkan ketidak stabilan membran, mengubah
viskositas membran, dan merangsang aktivitas fosfolipase A2 (Gazali & Tambing
2002).
Pada sel mamalia efek toksik yang disebabkan oleh perokidasi lipid ialah menghambat metabolisme oksidatif, menghambat proses glikolisis, menghambat kerja enzim sulfhidril, dan menyebabkan denaturasi DNA. Ciri kerusakan sel spermatozoa akibat peroksida lipid ialah rendahnya motilitas spermatozoa, kerusakan enzim intraseluler, dan kerusakan membran plasma terutama bagian akrosom (White 1993).
Glutation
Glutation mempunyai kandungan senyawa molekul tiol tripeptida terdiri dari tiga asam amino yaitu, L-glutamin, L-cystien, dan L-glysin (Luberda 2005). Glutation merupakan antioksidan yang mempunyai potensi melindungi sistem biologi akibat adanya suatu proses atau reaksi yang merugikan dengan jalan mereduksi dan menekan reaksi radikal bebas (Hammersdet 1993). Glutation merupakan antioksidan primer yang berfungsi untuk mencegah pembentukan radikal bebas baru, glutation berkerja dengan mengubah radikal bebas baru menjadi molekul yang kurang berdampak negatif sebelum radikal bebas tersebut mempunyai kesempatan untuk bereaksi (Wijaya 1996). Menurut Sugiyanta (2007) Glutation digunakan sebagai kofaktor oleh enzim peroksidase untuk mendetoksikasi peroksida dari serangan radikal bebas molekuler dan
transhydrogenase untuk mengurangi oksidasi pada DNA, protein, dan biomolekuler lainya. Glutation peroksidase dapat membentuk pertahanan terhadap oksidan atau radikal bebas di dalam tubuh dan mencegah kerusakan sel dengan cara mengkatalisa peroksida menjadi air dan oksigen. Glutation yang didistribusikan ke dalam sel, mempunyai peranan penting dalam mekanisme pertahanan interseluler terhadap stres oksidatif yang disebabkan oleh produksi
ROS berlebih selama proses pembekuan dan thawing spermatozoa (Ansari et al.
kedalam semen kerbau dapat meningkatkan kualitas spermatozoa setelah post-thawing (motilitas, viabilitas, dan intergritas sperma). Sedangkan Bilodeau et al.
(2001) dan Gadea et al. (2007) melaporkan bahwa penambahan GSH dalam
BAHAN DAN METODE
Waktu Penelitian
Penelitian ini dilakukan pada bulan Juli sampai dengan bulan September
2011. Kegiatan ini dilakukan di Laboratorium Fertilitas In Vitro, Unit Rehabilitas
Reproduksi (URR), Departemen Klinik, Reproduksi, dan Patologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Alat dan Bahan
Alat yang digunakan dalam penelitian ini adalah tabung reaksi, gelas ukur, Erlenmeyer, kertas saring, timbangan mikro, pipet tetes, pipet mikro, vagina buatan dan perlengkapannya, pH meter, bunsen, kontainer nitrogen cair,
waterbath, lemari es, styrofoam, gelas objek, cover glas, mikroskop cahaya,
straw, dan syringe. Bahan yang digunakan dalam penelitian yaitu, semen domba,
Pengencer Niwa dan Sasaki Freezing (NSF), medium fertilisasi in vitro dan N2
cair.
Metode Penelitian Persiapan Bahan Pengencer
Komposisi bahan pengencer yang digunakan dalam penelitian ini adalah medium NSF yang terdiri dari NSF I dan NSF II. NSF I mengandung 20% (v/v)
kuning telur, 8.8% (w/v) laktosa dan 200 μg/ml ampicilin, glutation 1 mM atau 3
mM, sedangkan NSF II terdiri dari 92.42% (v/v) medium NSF I tanpa glutation, 1.48% (v/v) Orvus Es Paste (OEP), 6% (v/v) gliserol, glutation 1 mM atau 3 mM.
Koleksi Spermatozoa
Semen diperoleh dari dua domba jantan yang sudah dewasa kelamin. Penampungan semen dilakukan dengan menggunakan vagina buatan yang terbuat
dari karet khusus yang dilengkapi dengan inner liner pada bagian dalamnya untuk