KULTUR DAUN DAN PANGKAL BATANG
IN VITRO ANGGREK BULAN RAKSASA
(Phalaenopsis gigantea J.J.Smith)
PADA BEBERAPA MEDIA KULTUR JARINGAN
RAMDAN
A24062710
DEPARTEMEN AGRONOMI DAN HORTIKULTURA
FAKULTAS PERTANIAN
RAMDAN. Kultur Daun Dan Pangkal Batang In Vitro Anggrek Bulan Raksasa (Phalaenopsis gigantea J.J.Smith) pada Beberapa Media Kultur Jaringan. (Dibimbing oleh DEWI SUKMA dan YUPI ISNAINI)
Penelitian ini bertujuan untuk mendapatkan kombinasi zat pengatur
tumbuh yang tepat untuk induksi organogenesis P. gigantea dan mengetahui
media yang cocok untuk pertumbuhan pangkal batang anggrek P. gigantea.
Penelitian ini dilaksanakan pada bulan Maret 2010 sampai Maret 2011 di
Laboratorium Kultur Jaringan Anggrek, Kebun Raya Bogor.
Bahan yang digunakan dalam penelitian ini adalah tunas in vitro anggrek
Phalaenopsis gigantea berumur 5 tahun dengan 4-5 daun dari Laboratorium
Kultur Jaringan Tanaman, Kebun Raya Bogor. Eksplan yang digunakan adalah
eksplan daun dan pangkal batang.
Penelitian ini terdiri dari empat percobaan yaitu percobaan kultur daun dan
pangkal batang P. gigantea masing-masing dua tahap. Rancangan yang digunakan
pada penelitian ini adalah Rancangan Acak Lengkap (RAL). Percobaan kultur
daun P. gigantea (Tahap I) terdiri atas sembilan taraf perlakuan media dengan
kombinasi zat pengatur tumbuh NAA dan BAP. Percobaan kultur pangkal batang
P. gigantea (Tahap I) terdiri atas empat taraf perlakuan kombinasi media dengan
bahan organik.
Percobaan kultur daun P. gigantea (Tahap II) terdiri atas tujuh taraf
perlakuan media ditambah zat pengatur tumbuh BAP dan TDZ. Percobaan kultur
pangkal batang P. gigantea (Tahap II) terdiri atas lima taraf perlakuan media
ditambah kitosan. Media yang digunakan pada percobaan kultur daun (Tahap I
dan II) dan kultur pangkal batang (Tahap II) yaitu media Murashige dan Skoog
yang berkonsentrasi 50% (½ MS), sedangkan percobaan kultur pangkal batang
P. gigantea (Tahap I) menggunakan media Knudson C (KC).
Hasil percobaan kultur daun (Tahap I) menunjukan bahwa perlakuan
belum berhasil menginduksi organogenesis dan kalus P. gigantea. Percobaan
kultur daun (Tahap II) berhasil menginduksi PLBs pada media A4 (½ MS +
iii
Bahan organik pada kultur pangkal batang (Tahap I) berpengaruh positif
bagi pertumbuhan eksplan. Media G10 (KC + air kelapa + ekstrak taoge)
merupakan media terbaik pada peubah pengamatan persentase hidup eksplan
(100%), waktu muncul daun (7,5 MSI), jumlah daun (8,2 daun/eksplan), waktu
muncul tunas (9,2 MSI), jumlah tunas (3,8 tunas/eksplan), dan jumlah akar (1,7
akar/eksplan). Waktu muncul akar (8 MSI) dan panjang akar (4 mm) terbaik pada
perlakuan media G12 (KC + air kelapa + ekstrak taoge + ekstrak pisang).
Percobaan kultur pangkal batang P. gigantea (Tahap II) cukup optimal.
Perlakuan media A10 (½ MS) dan A13 (½ MS + 15 ppm kitosan) merupakan
media terbaik pada peubah pengamatan persentase hidup eksplan yaitu 71%.
Perlakuan A10 (½ MS) dan A12 (½ MS + 10 ppm kitosan) merupakan media
terbaik pada peubah pengamatan waktu muncul daun yaitu 5 MSI. Jumlah daun
(1,9 daun/eksplan), waktu muncul tunas (5 MSI), dan jumlah tunas (0,9
tunas/eksplan) terbaik pada perlakuan media A14 (½ MS + 20 ppm kitosan).
(Phalaenopsis gigantea J.J.Smith)
PADA BEBERAPA MEDIA KULTUR JARINGAN
Skripsi sebagai salah satu syarat
untuk memperoleh gelar Sarjana Pertanian
pada Fakultas Pertanian Institut Pertanian Bogor
RAMDAN
A24062710
DEPARTEMEN AGRONOMI DAN HORTIKULTURA
FAKULTAS PERTANIAN
Judul
:KULTUR DAUN DAN PANGKAL BATANG
IN VITRO
ANGGREK BULAN RAKSASA (Phalaenopsis gigantea
J.J.Smith)
PADA
BEBERAPA
MEDIA
KULTUR
JARINGAN
Nama
:RAMDAN
NRP
:A24062710
Menyetujui,
Dosen Pembimbing 1 Dosen Pembimbing 2
Dr. Dewi Sukma, S.P, M.Si. Yupi Isnaini, S.Si, M.Si.
NIP. 19700404 199702 2001 NIP. 19711227 200604 2002
Mengetahui,
Ketua Departemen Agronomi dan Hortikultura
Fakultas Pertanian IPB
Dr. Ir. Agus Purwito, M.Sc. Agr NIP. 19611101 198703 1 003
Penulis merupakan anak kedua dari Bapak Anwar Nahdi dan Ibu Ati
Suhati. Penulis dilahirkan di Karawang, Provinsi Jawa Barat pada tanggal 30
Desember 1988.
Penulis menyelesaikan pendidikan dasar di SDN Nagasari IX Karawang
pada tahun 2000. Tahun 2003 penulis menyelesaikan pendidikan di SLTPN 1
Karawang dan lulus dari SMAN 1 Karawang pada tahun 2006. Tahun 2006
penulis diterima di Institut Pertanian Bogor melalui jalur USMI (Undangan
Seleksi Masuk IPB) dan pada tahun 2007 diterima sebagai mahasiswa
Departemen Agronomi dan Hortikultura, Fakultas Pertanian IPB.
Tahun 2007 penulis aktif di HIMAGRON (Himpunan Mahasiswa
Agronomi) sebagai staf Divisi Klub Pecinta Tanaman Hias dan Bunga. Penulis
KATA PENGANTAR
Puji syukur penulis panjatkan kepada Allah SWT yang telah memberikan
kekuatan, rahmat dan karunia-Nya, sehingga penulis dapat menyelesaikan skripsi
yang berjudul “Kultur Daun Dan Pangkal Batang In Vitro Anggrek Bulan Raksasa (Phalaenopsis gigantea J.J.Smith) pada Beberapa Media Kultur Jaringan”.
Pada kesempatan kali ini penulis mengucapkan terima kasih dan
penghargaan terhadap semua pihak yang membantu menyusun skripsi ini,
terutama:
1. Ibu, Bapak (alm) dan kakak saya tercinta yang telah memberikan doa,
semangat, dan dorongan secara lahir dan batin.
2. Dr. Dewi Sukma, S.P, M.Si. selaku pembimbing skripsi yang telah
memberikan masukan dan saran untuk penyusunan skripsi ini.
3. Yupi Isnaini, S.Si, M.Si. selaku pembimbing skripsi yang telah
memberikan masukan dan saran untuk penyusunan skripsi ini.
4. Dr. Ir. Winarso P. Widodo, M.Sc. selaku pembimbing akademik yang
telah membimbing penulis selama menjalani studi.
5. Staf pengajar dan staf komisi pendidikan Departemen Agronomi dan
Hortikultura, Fakultas Pertanian, IPB.
6. Peneliti dan staf Laboratorium Kultur Jaringan Anggrek, Kebun Raya
Bogor yang telah memberikan bantuan selama pelaksanaan penelitian.
7. Teman-teman AGH 43 yang telah memberikan motivasi dan masukan.
8. Semua pihak yang telah membantu dalam penyelesaian skripsi ini.
Semoga skripsi ini bermanfaat bagi dunia pendidikan khususnya
perkembangan ilmu pengetahuan dan teknologi (IPTEK) dan bagi yang
memerlukanya.
Bogor, Agustus 2011
KATA PENGANTAR ... vii
Morfologi Phalaenopsis gigantea ... 5
Akar ... 5
Habitat Tumbuh Phalaenopsis gigantea ... 8
Kultur Jaringan ... 8
Tempat dan Waktu Penelitian ... 15
Bahan dan Alat ... 15
Metode Penelitian ... 15
Kultur Daun Phalaenopsis gigantea (Tahap I) ... 16
Kultur Pangkal Batang Phalaenopsis gigantea (Tahap 1) ... 17
Kultur Daun Phalaenopsis gigantea (Tahap II) ... 17
Kultur Pangkal Batang Phalaenopsis gigantea (Tahap II) ... 18
Pelaksanaan Penelitian ... 18
Sterilisasi Botol dan Alat Tanam ... 18
ix
Kultur Daun (Tahap I) ... 23
Kultur Pangkal Batang (Tahap I)... 23
Kultur Daun (Tahap II) ... 27
Kultur Pangkal Batang (Tahap II) ... 27
Pembahasan ... 31
Kultur Daun ... 31
Kultur Pangkal Batang ... 33
KESIMPULAN DAN SARAN ... 38
Kesimpulan ... 38
Saran ... 38
Nomor Halaman
1. Pengaruh Kombinasi NAA dan BAP Terhadap Induksi Organogenesis daun Phalaenopsis gigantea ... 24
2. Rekapitulasi Sidik Ragam Pengaruh Bahan Organik Terhadap
Pertumbuhan Pangkal Batang Phalaenopsis gigantea ... 25
3. Pengaruh Bahan Organik Terhadap Pertumbuhan Pangkal Batang
Phalaenopsis gigantea ... 25
4. Pengaruh BAP dan TDZ Terhadap Induksi Organogenesis daun
Phalaenopsis gigantea... 28
5. Rekapitulasi Sidik Ragam Pengaruh Kitosan Terhadap Pertumbuhan Pangkal Batang Phalaenopsis gigantea ... 29
6. Pengaruh Kitosan Terhadap Peubah Pertumbuhan Pangkal Batang
DAFTAR GAMBAR
Nomor Halaman
1. Anggrek Phalaenopsis gigantea ... 5
2. Bunga Phalaenopsis gigantea. ... 7
3. Alur Percobaaan ... 16
4. Kultur Daun (Tahap I) Phalaenopsis gigantea. ... 24
5. Morofologi Kultur Pangkal Batang Phalaenopsis gigantea (Tahap I) .... 26
6. Eksplan dengan Jumlah Daun dan Tunas Terbanyak pada Perlakuan Bahan Organik ... 26
7. Eksplan Membentuk Akar pada Perlakuan Bahan Organik ... 27
8. Kultur Daun Phalaenopsis gigantea (Tahap II) . ... 28
9. Morfologi Eksplan Phalaenopsis gigantea pada Perlakuan Kitosan ... 30
Nomor Halaman
1. Komposisi Setengah Konsentrasi Media Murashige dan Skoog
(½ MS) dan New Dogashima Medium (NDM) ... 44
2. Komposisi Media Knudson C. ... 45
3. Planlet Awal Phalaenopsis gigantea. ... 45
4. Kematian Eksplan Daun Phalaenopsis gigantea akibat Toksin ... 46
5. Tunas Multipel Phalaenopsis gigantea ... 46
PENDAHULUAN
Latar Belakang
Phalaenopsis gigantea merupakan salah satu jenis anggrek dari genus
Phalaenopsis (golongan anggrek bulan) dan penyebarannya terbatas hanya di
Kalimantan dan Sabah (Puspitaningtyas dan Mursidawati, 1999). Phalaenopsis
gigantea merupakan salah satu spesies prioritas untuk konservasi tumbuhan
Indonesia pada tahun 2010 (Risna et al., 2010). Perdagangan P. gigantea sudah
diatur dan dibatasi oleh kuota karena sudah termasuk dalam Appendix II CITES
(CITES, 2011) dan diatur dalam Peraturan Pemerintah No 7/1999, serta Peraturan
Menteri Kehutanan No P.57/Menhut II/ 2008 (Risna et al., 2010). Namun status
kelangkaan spesies ini belum dieavaluasi dalam IUCN red list (WCMC, 2011).
Pusat Konservasi Tumbuhan Kebun Raya Bogor telah melakukan upaya
konservasi spesies ini, salah satunya dengan cara perbanyakan secara kultur
jaringan atau in vitro.
Perbanyakan P. gigantea secara vegetatif sulit dilakukan karena
Phalaenopsis merupakan anggrek monopodial. Pertumbuhan P. gigantea sangat
lambat di alam maupun pada media kultur jaringan. Pada media kultur jaringan P.
gigantea memerlukan waktu hingga 5 tahun untuk siap aklimatisasi. Informasi
mengenai perbanyakan P. gigantea masih sangat terbatas.
Penelitian mengenai kultur in vitro P. gigantea sudah pernah dilakukan
oleh [Kartiman (2004); Murdad et al., (2010) ; dan Latip et al., (2010)], namun
ketiganya menggunakan Protocorm Like Bodies (PLBs) sebagai sumber eksplan.
Protocorm Like Bodies didapatkan dari perbanyakan melalui biji secara in vitro,
namun sekarang ini sangat sulit untuk mendapatkan buah dan biji P. gigantea.
Oleh karena itu, perlu mencari alternatif eksplan lainnya untuk pembentukan
PLBs, salah satunya adalah melalui kultur daun. Publikasi hasil penelitian
mengenai kultur daun P. gigantea sampai saat ini belum ditemukan.
Hasil Penelitian Kartiman (2004) menunjukan bahwa kombinasi IBA
0,5 mg/l dengan BAP 1 mg/l pada media ½ MS dapat meningkatkan jumlah PLBs
terbanyak pada kultur PLBs P. gigantea. Hasil penelitian Handini dan Isnaini
anggrek P. sumatrana dijumpai pada media ½ MS dengan penambahan kombinasi
2 mg/l BAP dengan 0,01 mg/l NAA. Latip et al., (2010) menambahkan bahwa
penambahan 0,5 – 2 mg/l BAP dan 0,1 – 0,3 mg/l Thidiazuron (TDZ) dapat meningkatkan jumlah PLBs yang terbentuk pada kultur PLBs P. gigantea.
Mengacu pada penelitian diatas, maka kultur daun P. gigantea dilakukan dengan
kombinasi media yang hampir sama.
Pada kultur daun P. gigantea perlu diperhatikan pula sisa pangkal batang
setelah pemotongan daun. Oleh karena itu, penyelamatan pangkal batang
dilakukan dengan mengkulturkannya kembali secara in vitro.
Kultur in vitro anggrek P. gigantea pada media Hyponex sudah pernah
dilakukan di Laboratorium Kultur Jaringan Kebun Raya Bogor, namun
pertumbuhannya masih kurang optimal (Widyastuti, 2003). Hasil penelitian
Widyastuti (2003) menunjukan bahwa hasil terbaik dalam pertumbuhan kecambah
P. gigantea dijumpai pada media KC dengan penambahan ekstrak pisang atau ubi.
Menurut Gunawan (2002), ekstrak pisang merupakan komponen tambahan yang
sangat popular pada media anggrek. Akan tetapi, kultur in vitro spesies
Phalaenopsis lain pada media Knudson C (KC) ditambah bahan organik air
kelapa dan ekstrak taoge menunjukan hasil yang cukup optimal. Air kelapa telah
diketahui sebagai sumber zat pengatur tumbuh yang dapat digunakan untuk
perkembangan embrio, diantaranya adalah sitokinin endogen (Wattimena, et al.,
2003).
Hasil penelitian Pornpeanpakdee et al., (2006) menunjukan bahwa
pertumbuhan PLBs Dendrobium Sonia Jo ‘Eiskul’ meningkat secara signifikan
pada media dengan penambahan 10-20 mg/l kitosan. Kitosan merupakan
polisakarida alami yang dibentuk oleh polimer N-asetil-D-glukosamin dan
D-glukosamin. Pada bidang pertanian, kitosan biasa digunakan untuk pupuk,
proteksi tanaman dan stimulasi pertumbuhan (Sukwattanasinitt et al.,2001). Oleh
karena itu, perlu dilakukan penelitian lebih lanjut mengenai kultur daun dan
3
Tujuan
Penelitian ini bertujuan untuk :
1. Mendapatkan kombinasi zat pengatur tumbuh yang tepat untuk induksi
organogenesis P. gigantea.
2. Mengetahui media yang cocok untuk pertumbuhan pangkal batang
anggrek P. gigantea.
Hipotesis
1. Terdapat komposisi media kultur yang optimum untuk kultur daun dan
pangkal batang anggrek P. gigantea.
2. Senyawa organik kompleks dapat meningkatkan pertumbuhan pangkal
batang anggrek P. gigantea.
3. Kitosan dapat meningkatkan pertumbuhan pangkal batang anggrek
Botani Anggrek
Tanaman anggrek merupakan famili yang memiliki jumlah
keanekaragaman sangat besar yaitu terdiri dari 700 genus dan 35 000 spesies yang
tersebar di seluruh dunia (Puspitaningtyas dan Mursidawati, 1999). Contoh dari
genus anggrek yaitu Dendrobium, Phalaenopsis, Renanthera, Vanda, Cattleya,
Bulbophylum, dan masih banyak genus lain. Anggrek umumnya hidup secara
epifit di batang-batang pohon di hutan tropis namun ada pula yang hidup secara
terestrial di atas permukaan tanah, saprofit atau lithofit (dipermukaan batu). Genus
Phalaenopsis merupakan anggrek yang hidup secara epifit.
Tipe perkembangan anggrek dibedakan menjadi dua yaitu monopodial dan
simpodial. Monopodial merupakan tipe pertumbuhan yang terus tumbuh ke atas
dan tidak akan berhenti. Tipe ini hanya memiliki satu titik tumbuh (tidak
bercabang), ia akan bercabang apabila titik tumbuhnya dihilangkan atau dirusak.
Tipe simpodial merupakan pertumbuhan yang dapat berhenti apabila bulb (batang
semu) telah mencapai ukuran maksimal dan kembali membentuk bulb.
Phalaenopsis dan Renanthera termasuk anggrek dengan tipe perkembangan
monopodial. (Iswanto, 2005)
Anggrek memiliki permukaan daun yang dilapisi kutikula (lapisan lilin)
yang dapat melindungi tanaman dari serangan hama dan penyakit. Kedudukan
daun tersusun secara berjajar berseling. Batang anggrek yang menebal merupakan
batang semu yang dikenal dengan istilah pseudobulb (pseudo-semu, bulb-batang
yang menggembung), berfungsi sebagai penyimpan air dan makanan untuk
bertahan dalam keadaan kering (Sastrapradja, 1980). Batang dan daun anggrek
mengandung klorofil, hal ini sangat membantunya memaksimalkan penyerapan
sinar matahari untuk fotosintesis dalam habitatnya di hutan yang minim cahaya.
Klorofil pada batang anggrek tidak mudah hilang atau terdegradasi walaupun
daun-daunnya telah gugur, oleh sebab itu anggrek juga memiliki julukan
evergreen.
Akar tanaman anggrek berdasarkan fungsinya dibedakan menjadi akar
5
tubuh tanaman pada media, sedangkan akar udara berfungsi untuk mengambil air
dan unsur hara dari media tempat tumbuhnya. Contoh akar lekat dapat di jumpai
pada anggrek jenis simpodial seperti Dendrobium, Bulbophyllum, maupun
Cattleya, sedangkan akar udara dimiliki oleh anggrek monopodial seperti
Phalaenopsis dan Renanthera (Puspitaningtyas dan Mursidawati, 1999).
Morfologi Phalaenopsis gigantea
Setiap jenis anggrek memiliki karakter morfologi yang berbeda. Hal
tersebut dapat dilihat dari bentuk daun, letak daun, batang, akar, bunga, dan buah.
Phalaenopsis gigantea memiliki keunggulan bentuk daunnya lebar dan jumlah
bunganya yang banyak (Gambar 1). Berdasarkan karakter morfologi tersebut
maka Phalaenopsis gigantea mempunyai ciri-ciri sebagai berikut:
Gambar 1. Anggrek Phalaenopsis gigantea.
Akar
Akar anggrek Phalaenopsis memiliki ciri khas yaitu adanya
perkembangan akar udara atau akar aerial. Akar aerial merupakan akar yang
hijau keputihan atau kuning kecoklatan, licin dan mengkilat. Akar aerial ini
mempunyai lapisan sel atau jaringan yang disebut velamen yang bersifat spongy
(berongga). Jaringan tersebut berfungsi untuk memudahkan akar menyerap air
hujan yang jatuh pada kulit pohon inang dan membasahi akar udara.
Batang
Batang anggrek Phalaenopsis gigantea berbentuk tunggal dengan ujung
batang tumbuh lurus tidak terbatas dan terdiri dari satu batang utama yang
ukurannya pendek, hanya 3-5 cm, bahkan nyaris tidak tampak karena tertutup oleh
pelepah daun (Iswanto, 2005). Apabila daun-daun tua pada batang sebelah bawah
telah gugur, maka batang tampak seperti mati, pola pertumbuhan ini disebut
monopodial.
Daun
Daun anggrek Phalaenopsis gigantea berjumlah 5-6 helai, dengan panjang
daun mencapai 50-68,5 cm dan lebar 20-25,5 cm (O’Byrne, 2001). Daun tebal, tegar, membengkok membentuk busur dan menggantung ke bawah (menjuntai)
sebagai tempat penyimpanan air karena anggrek Phalaenopsis bersifat
monopodial dan tidak mempunyai pseudobulb (Iswanto, 2005).
Bunga
Bunga anggrek bulan raksasa (Phalaenopsis gigantea) tersusun dalam
tandan yang tumbuh dari ketiak daun paling bawah dengan tangkai menjuntai
sepanjang 40 cm. Jumlah bunga tiap tandan sekitar 20-30 kuntum dan masing
masing bunga bergaris tengah 5 cm (O’Byrne, 2001). Menurut Iswanto (2005),
bunga tersebut tersusun menurut pola baku, yaitu terdiri atas tiga buah kelopak
bunga (sepal) dan tiga buah mahkota bunga (petal) (Gambar 2). Satu buah
kelopak bunga terletak di punggung dinamakan kelopak punggung (sepalum
dorsalum), sedangkan dua lainnya dinamakan daun kelopak samping (sepalum
lateraria). Mahkota bunga ada tiga buah, posisinya berseling dengan kelopak
7
Gambar 2. Bunga Phalaenopsis gigantea.
Pada pusat bunga terdapat alat kelamin jantan dan betina yang menjadi
satu disebut gynostemium, yang berasal dari kata gynaecium atau putik dan
stemona yang berarti benang sari. Ukuran kelopak bunga rata-rata lebih kecil atau
sama dengan tajuk bunganya. Bibir bunga memiliki tiga penutup tengah yang
terkadang berbulu halus. Bagian dalamnya berwarna ungu atau putih berbintik
coklat kehitaman dengan tepung sari yang berbentuk dua bulatan kecil berwarna
kuning dan bersayap, sedangkan bunganya berwarna hijau keputihan dengan
bintik-bintik dan garis-garis kecil coklat kehitaman, yang mekar dalam periode
7-30 hari.
Buah
Phalaenopsis gigantea memiliki buah yang berbentuk jorong bergaris
garis dengan panjang 10 cm atau lebih (O’Byrne, 2001). Apabila buah tua dibelah,
akan terlihat lapisan menyerupai kapas yang dipenuhi beribu-ribu biji anggrek.
Biji
Biji Phalaenopsis gigantea menyerupai tepung dan berwarna kekuning
kuningan atau kecoklat-coklatan. Bentuk mikroskopik biji Phalaenopsis
Habitat Tumbuh Phalaenopsis gigantea
Phalaenopsis gigantea umumnya tumbuh di dataran rendah hingga tinggi,
yaitu berkisar 1 - 1 000 meter di atas permukaan laut (Puspitaningtyas dan
Mursidawati, 1999). Suhu optimum yang dibutuhkan anggrek Phalaenopsis untuk
fotosintesis dan respirasi ialah 21-26oC. Anggrek Phalaenopsis menyukai suhu
minimum 16-18oC pada malam hari dengan suhu siang 24oC (Setiawan dan
Setiawan, 2008).Phalaenopsis gigantea menyukai kelembaban pada siang hari
yaitu 50-70%., namun menyukai kelembaban yang lebih besar dari 70% di sekitar
perakarannya sepanjang waktu (Puspitaningtyas dan Mursidawati, 1999).
Intensitas cahaya ideal untuk Phalaenopsis adalah 1 000-1 500 foot candles atau
semi teduh (ternaungi) dengan intensitas cahaya matahari 20-50% (Gunawan,
1992).
Kultur Jaringan
Kultur jaringan secara luas dapat didefinisikan sebagai usaha mengisolasi,
menumbuhkan, memperbanyak, dan meregenerasikan protoplas, sel utuh atau
bagian tanaman seperti; meristem, tunas, daun muda, ujung akar, kepala sari, dan
bakal buah dalam suatu lingkungan aseptik terkendali (Gunawan, 1992). Kultur
jaringan ini berawal dari suatu konsep yang disebut konsep totipotensi sel yaitu
tiap bagian dari tumbuhan tingkat tinggi dipisahkan dan dari setiap bagian-bagian
yang dipisahkan itu dapat tumbuh menjadi tanaman lengkap (Arditti dan Ernst,
1993).
Kultur jaringan mempunyai beberapa keunggulan bila dibandingkan
dengan metode perbanyakan tanaman lainnya, diantaranya adalah dapat
menghasilkan bibit yang seragam dalam waktu singkat dan dengan produksi
tinggi, sifat tanaman yang sama seperti induknya, kecepatan tumbuh bibit yang
lebih cepat dibandingkan bibit hasil perbanyakan konvensional, serta tanaman
yang relatif lebih sehat
Armini et al., (1992) menyatakan bahwa keberhasilan perbanyakan
tanaman kultur jaringan dipengaruhi oleh sifat genetik tanaman, karakteristik
9
lingkungan dalam kultur in vitro sangat mempengaruhi keberhasilan kultur
tanaman tertentu.
Kultur Jaringan Anggrek
Kultur jaringan anggrek pertama kali dicoba oleh Haberlandt pada tahun
1902, karena adanya sifat tanaman yang disebut totipotensi. Kemudian disusul
oleh penelitian Morel tahun 1960 yang dipublikasikan mengenai perbanyakan
tanaman anggrek secara kultur jaringan. Penemuan ini didukung oleh Wimber
tahun 1963 yang berhasil mengadakan perbanyakan klon-klon anggrek
Cymbidium secara kultur jaringan.
Kultur jaringan anggrek yang sering digunakan adalah kultur tunas
dibandingkan dengan kultur biji. Perbanyakan melalui biji jarang dilakukan
karena dikhawatirkan adanya perbedaan genetik, sehingga planlet yang dihasilkan
tidak seragam. Kultur tunas yaitu menumbuhkan meristem tunas, tunas apikal
yang mengandung meristem apikal beserta dua atau lebih primodia daun dan juga
dari kuncup lateral. Pertumbuhan kultur tunas anggrek dibutuhkan suhu antara
21-24o dan pemberian cahaya terus-menerus dengan intensitas 500-700 lumen.
(Gunawan, 1992)
Media yang sering digunakan pada kultur jaringan anggrek adalah media
Vacin and Went dan KC. Namun media ini tidak mempunyai komposisi yang
lengkap, sehingga dibutuhkan media yang komponennya lengkap untuk
pertumbuhan yang optimal. Di era tahun 2000, protokol regenerasi tanaman
Phalaenopsis direalisasikan menggunakan medium ½ konsentrasi nutrisi
Murashige dan Skoog (½ MS) yang ditambahkan thidiazuron 0-1 mg/l dan 2,4-
dichloropenoxyacetic acid (2,4-D) 0-10 mg/l, sedangkan PLBs dapat dibentuk dari
kalus tersebut pada medium ½ MS yang ditambah thidiazuron saja sebanyak 0,1-1
mg/l (Ying-Chun et al., 2000).
Bahan Organik
Keberhasilan metode kultur jaringan sangat bergantung pada media yang
digunakan. Media kultur jaringan harus menyediakan unsur makro dan mikro
tanaman selain karbohidrat yang biasa diberikan berupa gula. Gula berfungsi
sebagai pengganti karbon yang biasa diperoleh dari atmosfer melalui fotosintesis.
Hasil yang lebih baik akan diperoleh apabila ke dalam media kultur jaringan
ditambahkan vitamin, asam amino dan zat pengatur tumbuh. Walaupun
penggunaan senyawa organik kompleks seperti juice, yeast extract, dan casein
hydrolysate disarankan untuk dihindari, tapi terkadang hasil yang lebih tinggi
diperoleh dengan adanya penambahan bahan-bahan tersebut. Ekstrak pisang
merupakan komponen tambahan yang sangat populer pada media anggrek
(Gunawan,1992).
Jenis pisang yang umumnya digunakan sebagai bahan untuk media kultur
jaringan yaitu jenis pisang ambon. Bubur pisang yang biasa digunakan berkisar
150-200 g/l. Kandungan pada buah pisang adalah vitamin A, tiamin (vitamin B1),
riboflavin (vitamin B2), piridoksin (vitamin B6) dan asam askorbat (vitamin C),
sedangkan gula dalam pisang terdiri atas senyawa 4,6% dextrosa, 3,6% levulosa,
dan 2% sukrosa (PKBT, 2007).
Penggunaan ekstrak ubi sering digunakan pada kultur jaringan
Phalaenopsis. Media dengan penambahan ekstrak ubi dapat memacu
pertumbuhan eksplan Phalaenopsis fuscata (Rahayu et al., 2010). Kandungan gizi
pada 100 g ubi jalar yaitu karbohidrat, lemak, protein, mineral, kalsium, vitamin
A, dan vitamin C. (Soeprapto, 1992)
Ekstrak taoge sering digunakan dalam kultur jaringan anggrek. Komposisi
dan nilai gizi pada 100 gram taoge yaitu kalori, protein, lemak, hidrat arang,
kalsium, fosfor, zat besi, vitamin A, vitamin B, vitamin C, dan air. Asam amino
esensial yang terkandung dalam protein kacang hijau antara lain triptofan 1,35 %,
treonin 4,50 %, fenilalanin 7,07 %, metionin 0,84 %, lisin 7,94 %, leusin 12,90 %,
isoleusin 6,95 % dan valin 6,25 % (Soeprapto, 1992).
Air kelapa dapat digunakan sebagai pelengkap dalam media kultur
jaringan. Air kelapa telah diketahui sebagi sumber yang dapat digunakan untuk
11
2003). Sitokinin merupakan zat pengatur tumbuh (ZPT) yang terdapat dalam air
kelapa disamping senyawa lainnya. Zat pengatur tumbuh umumnya mendorong
terjadinya pertumbuhan dan perkembangan sehingga terjadi perubahan dan
penampilan tanaman (Prihatmanti, 2002). Sitokinin penting peranannya dalam
pembelahan dan diferensiasi sel. Air kelapa mengandung gula dan gula alkohol
yang selalu diberikan karena dapat memperbaiki pertumbuhan in vitro (Wattimena,
1991). Di dalam air kelapa juga terkandung sitokinin karena di dalamnya terdapat
1.3-difenilurea, zeatin, zeatin glukosida dan zeatin ribosida (Armini et. al., 1992).
Zat Pengatur Tumbuh
Zat pengatur tumbuh adalah senyawa organik yang dalam konsentrasi
rendah mampu mendorong, menghambat atau secara kualitatif mengubah
pertumbuhan dan perkembangan tanaman. Gunawan (1988) mengatakan bahwa
dalam kultur jaringan, dua golongan zat pengatur tumbuh yang sangat penting
adalah sitokinin dan auksin. Fungsi sitokinin dalam kultur jaringan adalah
mendorong pembelahan sel-sel.
Perbandingan konsentrasi sitokinin yang lebih tinggi daripada auksin akan
merangsang pertumbuhan dan pembentukan tunas, akan tetapi jika auksin lebih
tinggi daripada sitokinin akan merangsang pertumbuhan dan pembentukan akar.
Bila sitokinin dan auksin memiliki konsentrasi yang sama, maka akan merangsang
pertumbuhan dan pembentukan kalus.
Sitokinin
Sitokinin merupakan zat pengatur tumbuh yang mempengaruhi dan
mendorong pembelahan sel dan memperlambat proses penghancuran butir-buitr
klorofil pada daun yang terlepas dari tanaman. Sitokinin juga berperan sebagai
perkembangan dominasi apikal, perkembangan tunas adventif dan diferensial
tunas . Sitokinin merupakan turunan adenine yang terdiri dari sitokinin alami yaitu
zeatin dan 2-iP, dan sitokinin sitentik yang terdiri dari kinetin, Benzyl Amino
Purine (BAP), PBA, 2Ci-4PU, dan 2,6Ci-4PU. Benzyl Amino Purine (BAP)
merupakan satu kelompok sitokinin selain dari kinetin yang berfungsi untuk
Auksin
Auksin merupakan salah satu golongan fitohormon baik alamiah maupun
sinetik, yang dapat menginduksi pemanjangan sel dan juga dalam kasus
pembelahan sel. Auksin mempunyai peran fisiologis yang dapat mempengaruhi
tanaman yaitu, mendorong perpanjangan sel dan organ, mendorong pembentukan
akar, mendorong gerakan trofisme, mendorong dominasi apikal, mencegah
imbibisi, mendorong pembentukan kalus dan mendorong pembungaan
(Gunawan, 1992). Auksin sintetik antara lain Napthalene Acetic Acid (NAA),
IAA, IBA dan 2,4 D.
Napthalene Acetic Acid (NAA) termasuk dalam auksin eksogen sehingga
dapat menggantikan hormon IAA (auksin endogen). NAA berfungsi untuk
meningkatkan pertumbuhan perakaran dan mendorong pertumbuhan stek dari
tanaman berkayu dan tanaman berbatang lunak. Penambahan auksin pada
konsentrasi yang rendah pada media akan mendorong pembentukan akar adventif,
sedangkan pada konsentrasi tinggi cenderung membentuk kalus.
Kitosan
Kitosan adalah salah satu polimer alam yang dapat diperoleh dari berbagai
jenis mahluk hidup. Kitosan ditemukan pada kulit ari dari serangga serta dalam
dinding sel jamur dan ganggang (Sanford, 2002). Kitosan adalah polisakarida
yang terdiri dari d-glukosamin dan N-asetil-d-glukosamin.
Kitosan memiliki muatan positif yang kuat dan menarik molekul
bermuatan negatif. Fisiologis yang unik dan sifat biologi kitosan telah
menyebabkan penggunaannya dalam variabel industri untuk menghilangkan ion
logam dari air limbah, penghapusan pewarna, penambahan untuk pakan ternak
dan pencegahan kontaminan dalam industri makanan, kontrol kolesterol darah,
dan sebagai aditif untuk kosmetik produk seperti pelembab, lotion mandi, dan
krim wajah, tangan dan tubuh (Shahidi et al., 2001). Kitosan telah digunakan pula
sebagai bahan pelapis untuk buah-buahan, biji-bijian dan sayuran (Photchanachai
13
Chandrkrachang (2002) melaporkan bahwa kitosan semprot (10 mg/l)
meningkatkan pertumbuhan tanaman anggrek muda. Limpanavech et al. (2003)
mempelajari pengaruh konsentrasi, derajat deasetilasi dan polimerisasi kitosan,
terhadap pertumbuhan dan perkembangan Dendrobium Sonia Jo 'Eiskul'.
Oligomer dan polimer kitosan dengan 70, 80, dan 90% deasetilasi (% DD) pada
konsentrasi 1, 10, 50 dan 100 mg/l tidak berpengaruh terhadap pertumbuhan
vegetatif, tetapi kitosan menginduksi pembungaan awal pada Dendrobium Sonia
Jo 'Eiskul'.
Chandrkrachang (2002) melaporkan bahwa penyemprotan kitosan dengan
konsentrasi 2,5-40 mg/l dapat meningkatkan panjang daun anggrek
Paphiopedilum. Kliangkeaw et al. (2003) menambahkan bahwa kitosan dapat
meningkatkan pertumbuhan Paph. bellatulum x Paph. angthong dalam kultur
jaringan.
Regenerasi Tanaman
Metode kultur daun spesies Phalaenopsis sudah banyak dipublikasikan,
namun masih terdapat kendala dalam proses regenerasi eksplan. Regenerasi
tanaman anggrek pada kultur in vitro dapat membentuk embriogenesis dan
organogenesis. Embriogenesis somatik atau embriogenesis aseksual adalah proses
dimana sel-sel somatik berkembang menjadi embrio melalui tahap-tahap
morfologi yang khas tanpa melalui fusi gamet. Organogenesis merupakan proses
pembetukan organ-organ tanaman seperti tunas dan akar.
Ciri utama dari proses embriogenesis somatik adalah pembentukan
struktur bipolar dari eksplan somatik yang akhirnya membentuk kecambah dengan
titik tumbuh akar dan daun pada masing-masing ujungnya secara serempak.
Sedangkan proses organogenesis ditandai dengan pembentukan struktur unipolar
yaitu hanya pembentukan titik tumbuh daun atau akar secara terpisah. Karena
prosesnya mirip dengan perkembangan pada biji, tanaman klonal yang dihasilkan
dengan teknik embriogenesis somatik secara morfologi sangat mirip dengan
tanaman asal dari biji, sedangkan tanaman dari proses organogenesis bentuk
Embrio somatik dapat terbentuk melalui dua jalur, yaitu secara langsung
maupun tidak langsung (melewati fase kalus). Keberhasilan akan tercapai apabila
kalus atau sel yang digunakan bersifat embriogenik yang dicirikan oleh sel yang
berukuran kecil, sitoplasma padat, inti besar, vakuola kecil-kecil dan mengandung
butir pati. Embrio somatik dapat dihasilkan dalam jumlah besar dari kultur kalus,
namun untuk tujuan perbanyakan dalam skala besar, jumlahnya kadang-kadang
dapat lebih ditingkatkan melalui inisisasi sel embrionik dari kultur suspensi yang
berasal dari kalus primer. (Wiendi et al., 1991)
Zat pengatur tumbuh berperan penting dalam menentukan arah
pertumbuhan suatu kultur. Zat pengatur tumbuh 2,4-D merupakan auksin yang
paling umum digunakan untuk menginduksi embriogenesis somatik. Selain
auksin, zat pengatur tumbuh sitokinin juga berpengaruh terhadap diferensiasi sel
dalam proses embriogenesis somatik. Setiap genotip atau jaringan mempunyai
respon yang berbeda dalam penyerapan zat pengatur tumbuh dalam medium dan
memiliki kandungan zat pengatur tumbuh endogen yang berbeda. Oleh karena itu
dalam embriogenesis somatik kadang-kadang hanya dibutuhkan auksin, sitokinin
secara sendiri-sendiri atau campuran auksin dan sitokinin. (Wattimena, 1991)
METODE PENELITIAN
Tempat dan Waktu Penelitian
Penelitian dilakukan di Laboratorium Kultur Jaringan Anggrek, Kebun
Raya Bogor. Penelitian dilaksanakan pada bulan Maret 2010 hingga Juni 2011.
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini adalah tunas in vitro anggrek
Phalaenopsis gigantea berumur 5 tahun dengan 4-5 daun dari Laboratorium
Kultur Jaringan Tanaman, Kebun Raya Bogor. Eksplan yang digunakan adalah
eksplan daun dan pangkal batang. Eksplan daun P. gigantea (Tahap 1) ditanam
dalam media dasar Murashige and Skoog dengan konsentrasi 50% (½ MS)
ditambah gula (20 g/l), pepton (2 g/l), gelrite (2 g/l), dan kombinasi BAP dan
NAA sebagai perlakuan. Eksplan daun P. gigantea (Tahap 2) ditanam dalam
media dasar Murashige and Skoog dengan konsentrasi 50% (½ MS) ditambah
gula (20 g/l), gelrite (2 g/l), dan BAP atau Thidiazuron (TDZ) sebagai perlakuan.
Eksplan pangkal batang P. gigantea (Tahap 1) ditanam dalam media
Knudson C (KC) ditambah gula (20 g/l), gelrite (2 g/l), arang aktif (2 g/l) dan
bahan organik yaitu air kelapa (150 ml/l), taoge (30 g/l), ubi (30 g/l), dan pisang
(30 g/l). Eksplan pangkal batang P. gigantea (Tahap 2) ditanam dalam media
Murashige and Skoog dengan konsentrasi 50% (½ MS) ditambah gula (20 g/l),
pepton (2 g/l), gelrite (2 g/l) dan kitosan. Bahan-bahan lain yang digunakan air
destilata, betadine, alkohol 70% dan alkohol 95%.
Alat yang digunakan adalah autoklaf, kompor gas, timbangan analitik,
Laminar Air Flow Cabinet (LAF), botol kultur, petridish, pinset, pisau scapel,
kertas tissue, lampu spirtus, labu ukur, gelas ukur, Erlenmeyer, dan label.
Metode Penelitian
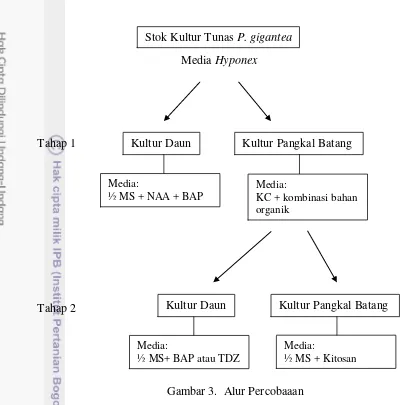
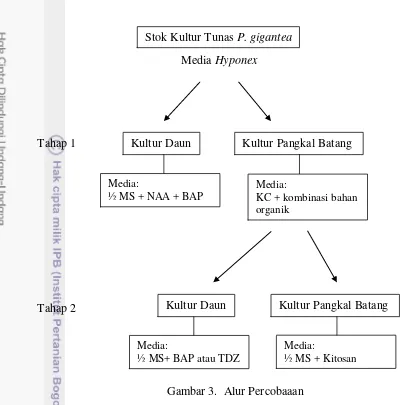
Penelitian ini terdiri dari empat percobaan, yaitu percobaan kultur daun
dan pangkal batang P. gigantea masing-masing dua tahap. Alur percobaan dapat
Media Hyponex
Tahap 1
Tahap 2
Gambar 3. Alur Percobaaan
Kultur Daun Phalaenopsis gigantea (Tahap I)
Percobaan kultur daun P. gigantea menggunakan sembilan taraf perlakuan
yaitu media ditambah kombinasi zat pengatur tumbuh NAA dengan BAP. Eksplan
yang digunakan adalah daun P. gigantea. Setiap perlakuan terdiri dari tiga
ulangan, dengan tiap ulangan terdiri dari 10 botol kultur dan setiap botol ditanami
satu eksplan. Adapun kombinasi media yang digunakan dalam percobaan kultur
daun adalah:
G1 = ½ MS
G2 = ½ MS + 0,01 mg/l NAA
G3 = ½ MS + 0,02 mg/l NAA
G4 = ½ MS + 1 mg/l BAP
Stok Kultur Tunas P. gigantea
Kultur Daun Kultur Pangkal Batang
Kultur Daun Kultur Pangkal Batang
Media:
½ MS + NAA + BAP
Media:
KC + kombinasi bahan organik
Media:
½ MS + Kitosan Media:
17
Kultur Pangkal Batang Phalaenopsis gigantea (Tahap 1)
Percobaan ini terdiri atas empat taraf perlakuan yaitu kombinasi media
dengan ditambah bahan organik. Eksplan yang digunakan pangkal batang
P. gigantea. Setiap perlakukan terdiri dari tiga ulangan, dengan setiap ulangan
terdiri dari 10 botol kultur dan setiap botol ditanami satu eksplan. Adapun
kombinasi media yang digunakan dalam percobaan kultur pangkal batang adalah:
G10 = Knudson C + Air Kelapa + Ekstrak Taoge
G11 = Knudson C + Air Kelapa + Ekstrak Taoge dan Ubi
G12 = Knudson C + Air Kelapa + Ekstrak Taoge dan Pisang
G13 = Knudson C + Air Kelapa + Ekstrak Taoge, Ubi, dan Pisang.
Kultur Daun Phalaenopsis gigantea (Tahap II)
Percobaan kultur daun P. gigantea menggunakan tujuh taraf perlakuan
yaitu media ditambah zat pengatur tumbuh BAP atau Thydiazuron (TDZ).
Eksplan yang digunakan adalah daun P. gigantea. Setiap perlakuan terdiri dari
tiga ulangan, dengan tiap ulangan terdiri dari lima botol kultur dan setiap botol
ditanami satu eksplan. Adapun kombinasi media yang digunakan dalam
Kultur Pangkal Batang Phalaenopsis gigantea (Tahap II)
Percobaan ini terdiri atas lima taraf perlakuan yaitu kombinasi media
dengan ditambah kitosan. Eksplan yang digunakan tunas P. gigantea. Setiap
perlakuan terdiri dari tujuh ulangan, dengan setiap ulangan terdiri dari satu botol
kultur dan setiap botol ditanami satu eksplan. Adapun kombinasi media yang
digunakan dalam percobaan kultur pangkal batang adalah:
A10 = ½ MS
A11 = ½ MS + 5 ppm kitosan
A12 = ½ MS + 10 ppm kitosan
A13 = ½ MS + 15 ppm kitosan
A14 = ½ MS + 20 ppm kitosan
Pelaksanaan Penelitian
Sterilisasi Botol dan Alat Tanam
Alat-alat yang digunakan dalam penanaman harus dalam keadaan steril.
Alat-alat logam dan gelas dapat disterilisasikan dengan menggunakan autoklaf.
Alat-alat dan kertas saring dibungkus rapi dengan kertas tebal sebelum dimasukan
ke dalam autoklaf. Temperatur yang digunakan untuk sterilisasi adalah 121oC
pada tekanan 17,5 psi selama satu jam. Alat tanam seperti pinset dan gunting
dapat disterilkan dengan dicelupkan dalam alkohol 95% dan dibakar. Media dan
aquades juga disterilkan dalam autoklaf.
Sterilisasi Lingkungan Kerja
Lampu ultraviolet pada LAF cabinet dinyalakan selama 30-60 menit, agar
kontaminan pada laminar dapat hilang. Sebelum memulai kerja, permukaan LAF
cabinet dilap dengan menggunakan tisu yang telah disemprotkan alkohol 70%.
Setelah melakukan kerja, permukaan LAF cabinet dibersihkan kembali dengan
19
Pembuatan Media
Media yang digunakan dalam percobaan kultur daun P. gigantea (Tahap I)
adalah media dasar ½ MS (Lampiran 1). Pembuatan media dilakukan dengan
pemipetan stok media MS lengkap masing-masing 25 ml, kecuali vitamin 50 ml.
Kemudian ditambah gula 20 g/l, pepton 2 g/l, gelrite 2 g/l, aquades, dan ditambah
kombinasi NAA dan BAP untuk perlakuan kultur daun P. gigantea.
Percobaan kultur pangkal batang P. gigantea (Tahap I) menggunakan
media Knudson C. Pembuatan media dilakuan dengan pemipetan stok lengkap
masing-masing. Media ditambah gula (20 g/l), arang aktif (2 g/l), dan bahan
organik air kelapa (150 ml/l), ekstrak taoge (30 ml/l), ubi (30 g/l), dan pisang (30
g/l) sebagai perlakuan.
Ekstrak taoge didapatkan dengan merebus taoge (30 g) yang sudah
ditambah air 250 ml, kemudian air rebusan ditambahkan pada media. Ekstak ubi
dan pisang didapatkan dengan menambahkan pisang (30 g) atau ubi (30 g) dengan
air, kemudian dilakukan penghalusan dengan blender. Setelah pisang dan ubi
menjadi halus, kemudian dilakukan penyaringan ekstrak dengan menggunakan
kain saring.
Percobaan kultur daun P. gigantea (Tahap II) menggunakan media ½ MS.
Pembuatan media dilakukan dengan pemipetan stok lengkap masing masing
25 ml, kecuali vitamin 50 ml, kemudian ditambah gula 20 g/l, aquades, dan
ditambah BAP atau TDZ sebagai perlakuan.
Percobaan kultur pangkal batang P. gigantea (Tahap II) menggunakan
media ½ MS. Pembuatan dilakuan dengan pemipetan stok lengkap masing
masing. Media ditambah gula (20 g/l), arang aktif (2 g/l), dan bahan organik air
kelapa (150 ml/l), taoge (30 g/l), ubi (30 g/l), dan pisang (30 g/l) sebagai
perlakuan.
Setiap perlakuan ditambahkan aquades hingga volume larutan 500 ml,
kemudian pH larutan dihitung hingga pH 5,6. Larutan tersebut kemudian
ditambahkan gelrite (2 g/l) dan dipanaskan di kompor gas hingga mendidih.
Larutan media yang sudah dipanaskan dimasukan ke dalam botol kultur steril dan
dengan autoklaf selama kurang lebih 15 menit dengan suhu 121oC dan tekanan
17,5 psi. Setelah sterilisasi, media disimpan di ruang penyimpanan.
Persiapan Eksplan
Eksplan yang digunakan dalam penelitian ini adalah eksplan steril.
Sebelum penanaman dilakukan, eksplan dipilah menjadi beberapa golongan, yaitu
tunas muda, sedang dan tua. Ketiga golongan tunas dibagi sama rata, sehingga
tunas pada setiap perlakuan lebih seragam. Pada percobaan kultur daun
P. gigantea (Tahap I), bagian daun pada masing-masing tunas dipotong dan sisa
batangnya dipisahkan. Potongan daun tersebut kemudian dimasukan ke dalam
larutan betadine, agak kontaminan yang ada pada eksplan dapat hilang.
Sedangkan pangkal batangnya ditanam langsung pada media Knudson C.
Percobaan kultur daun P. gigantea (Tahap II) menggunakan eksplan steril.
Kultur daun menggunakan potongan daun yang berasal dari tunas muda
P. gigantea hasil tahap pertama, sedangkan sisa batang ditanam dalam media
½ MS tanpa atau dengan penambahan kitosan (kultur pangkal batang tahap II).
Penanaman
Penanaman dilakukan di Laminar Air Flow cabinet. Eksplan steril
diletakan di atas petridish steril, selanjutnya dipotong menggunakan pisau skapel
dan pinset sebanyak satu daun atau pangkal batang pada setiap botol media.
Setelah penanaman selesai, botol media ditutup dengan menggunakan plastik dan
diikat dengan karet gelang. Botol tanam kemudian disimpan di ruang
penyimpanan.
Pengamatan
Variabel yang diamati pada percobaan kultur daun P. gigantea adalah
sebagai berikut:
1. Persen Kontaminasi
Jumlah eksplan yang terkontaminasi oleh bakteri atau cendawan dihitung
21
2. Waktu Tumbuh PLBs
Waktu munculnya PLBs yang dihitung sejak eksplan ditanam.
3. Jumlah PLBs
Jumlah PLBs yang terbentuk yang dihitung setiap minggu setelah muncul.
4. Jumlah PLBs yang Berkecambah
Jumlah PLBs yang berkecambah yang dihitung pada akhir pengamatan.
5. Waktu Muncul Kalus
Waktu munculnya kalus yang dihitung sejak eksplan ditanam.
6. Jumlah Eksplan Berkalus
Jumlah eksplan yang berkalus pada akhir pengamatan.
Variabel yang diamati pada percobaan kultur pangkal batang P. gigantea
adalah sebagai berikut:
1. Persentase Hidup Eksplan
Jumlah eksplan yang hidup pada akhir pengamatan.
2. Jumlah Daun Baru
Jumlah daun yang terbentuk dihitung setiap minggu.
3. Waktu Muncul Daun baru
Waktu daun yang muncul sejak pangkal batang ditanam.
4. Jumlah Tunas Baru
Jumlah tunas baru yang terbentuk pada saat pengamatan.
5. Waktu Muncul Tunas Baru
Waktu muncul tunas pertama sejak pangkal batang ditanam.
6. Jumlah Akar
Jumlah akar yang terbentuk pada saat pengamatan.
7. Waktu Muncul Akar
Waktu akar yang muncul sejak pangkal batang ditanam.
8. Panjang akar
Analisis Data
Percobaan-percobaan dalam penelitian ini menggunakan Rancangan Acak
Lengkap (RAL) dengan satu faktor perlakuan komposisi media.
Model aditif yang digunakan adalah:
Yij= µ + τi+ εij Keterangan:
i = 1,2,…..,t dan j= 1,2,…..,r
Yij = Respon pertumbuhan terhadap komposisi media ke-i dan ulangan ke-j.
µ = Rataan umum respon pertumbuhan.
τi = Pengaruh komposisi media ke-i.
εij = Pengaruh galat dari komposi media ke-i dan ulangan ke-j.
Analisis data pengamatan kuantitatif menggunakan uji F untuk melihat
perbedaaan antara percobaan perlakuan terhadap pengamatan kuantitatif yang
diamati. Uji lanjut dengan menggunakan uji perbandingan berganda Duncan
(DMRT, Duncan Multiple Range Test) untuk menganalisis perlakuan mana yang
berbeda nyata. Analisis data dengan menggunakan software Statistical Analysis
HASIL DAN PEMBAHASAN
Hasil
Kultur Daun (Tahap I)
Tingkat kontaminasi pada percobaan kultur daun adalah 0%. Hasil
pengamatan pada masing-masing perlakuan terhadap peubah yang diamati
menunjukan bahwa kultur daun P. gigantea tidak berhasil menginduksi PLBs dan
kalus setelah 24 MSI (Tabel 1). Kalus muncul pada 12 MSI di media G6 (½ MS+
1 mg/l BAP + 0,02 mg/l NAA), namun kalus mati pada 20 MSI. Selain itu, PLBs
muncul pada 12 MSI pada media G8 (½ MS + 2 mg/l BAP + 0,01 mg/l NAA),
namun PLBs kemudian mati pada 15 MSI.
Respon daun anggrek P. gigantea terhadap kombinasi BAP dan NAA
seletah 24 MSI tidak terjadi. Morfologi daun P. gigantea setelah 24 MSI
menunjukan bahwa sebagian eksplan masih berwarna hijau, sedangkan yang lain
mengalami kematian (Gambar 4)
Kultur Pangkal Batang (Tahap I)
Kombinasi media ditambah dengan bahan organik memberikan pengaruh
yang berbeda terhadap peubah yang diamati. Hasil analisis sidik ragam
menunjukan bahwa perlakuan bahan organik berpengaruh nyata terhadap
persentase hidup eksplan, dan berpengaruh sangat nyata terhadap waktu muncul
akar dan panjang akar (Tabel 2).
Hasil pengamatan pada masing-masing perlakuan terhadap peubah yang
diamati menunjukan bahwa perlakuan G10 (KC + air kelapa + ekstrak taoge)
merupakan perlakuan terbaik pada sebagian besar peubah pengamatan (Tabel 3).
Respon pertumbuhan anggrek P. gigantea terhadap kombinasi media dengan
bahan organik dapat dilihat dari morfologi eksplannya. Morfologi eksplan pada 24
MSI menunjukan bahwa eksplan pangkal batang tumbuh dengan baik (Gambar
Tabel 1. Pengaruh NAA dan BAP Terhadap Induksi Organogenesis Daun
Phalaenopsis gigantea pada 12 dan 24 MSI.
Kode kelapa + ekstrak taoge dan pisang, G13 = KC + air kelapa + ekstrak taoge, ubi, dan pisang.
G1 G2 G3
G4 G6
G7 G8 G9
25
Tabel 2. Rekapitulasi Sidik Ragam Pengaruh Bahan Organik Terhadap Beberapa Peubah Pertumbuhan Pangkal Batang Phalaenopsis gigantea pada 24 MSI.
Keterangan: tn= tidak berbeda nyata pada taraf uji F 5% * = berbeda nyata pada taraf uji F 5%
Phalaenopsis gigantea pada 24 MSI.
Peubah Perlakuan berdasarkan uji DMRT pada tingkat kepercayaan.
G10= KC + air kelapa + ekstrak taoge, G11= KC + air kelapa + ekstrak taoge dan ubi, G12= KC + air kelapa + ekstrak taoge dan pisang, G13= KC + air kelapa + ekstrak taoge, ubi, dan pisang.
Pertumbuhan pangkal batang anggrek P. gigantea dapat dilihat
berdasarkan jumlah daun dan tunasnya. Eksplan yang memiliki jumlah daun dan
tunas terbanyak adalah perlakuan G13 (KC + air kelapa + ekstrak taoge + ekstrak
ubi + ekstrak pisang) yaitu 30 daun dan 22 tunas (Gambar 6). Pertumbuhan akar
diawali dengan benjolan kecil pada batang bagian atas, dan kemudian memanjang
membentuk akar (Gambar 7).
Peubah Pr> F KK Uji F
Persentase hidup eksplan 0,0244 20,14 *
Gambar 5. Morfologi kultur pangkal batang anggrek Phalaenopsis gigantea
pada beberapa perlakuan bahan organik setelah 24 MSI. G10= KC + air kelapa + ekstrak taoge, G11= KC + air kelapa + ekstrak taoge dan ubi, G12= KC + air kelapa + ekstrak taoge dan pisang, G13= KC + air kelapa + ekstrak taoge, ubi, dan pisang.
Gambar 6. Kultur Phalaenopsis gigantea dengan jumlah daun dan tunas terbanyak pada beberapa perlakuan bahan organik setelah 24 MSI. G10= KC + air kelapa + ekstrak taoge, G11= KC + air kelapa + ekstrak taoge dan ubi, G12= KC + air kelapa + ekstrak taoge dan pisang, G13= KC + air kelapa + ekstrak taoge, ubi, dan pisang
G11 G12
G12 G13
G10
G13
27
Gambar 7. Eksplan Anggrek P. gigantea yang Membentuk Akar pada beberapa
perlakuan bahan organik setelah 24 MSI. G10= KC + air kelapa + ekstrak taoge, G11= KC + air kelapa + ekstrak taoge dan ubi, G12= KC + air kelapa + ekstrak taoge dan pisang, G13= KC + air kelapa + ekstrak taoge, ubi, dan pisang.
Kultur Daun (Tahap II)
Tingkat kontaminasi pada percobaan ini adalah 0%. Hasil pengamatan
pada masing-masing perlakuan terhadap peubah yang diamati menunjukan bahwa
PLBs berhasil diinduksi pada media A4 (½ MS+ 2 mg/l BAP) setelah 14 MSI
(Tabel 4). Morfologi kondisi daun setelah 16 MSI menunjukan jaringan pada
ujung daun yang dipotong mengalami kematian pada setiap perlakuan
(Gambar 8).
Kultur Pangkal Batang (Tahap II)
Kombinasi media ditambah dengan bahan kitosan memberikan pengaruh
yang berbeda terhadap peubah yang diamati. Hasil analisis sidik ragam
menunjukan bahwa perlakuan kitosan berpengaruh sangat nyata terhadap waktu
muncul tunas (Tabel 5). Hasil pengamatan pada masing-masing perlakuan
terhadap peubah yang diamati menunjukan bahwa perlakuan A14 (½ MS + 20
ppm kitosan) memberikan hasil terbaik untuk pertumbuhan tunas dan daun (Tabel
6).
Morfologi eksplan pada 8 MSI menunjukan bahwa respon pertumbuhan
eksplan sudah baik, namun daun pada beberapa perlakuan terlihat menguning
(Gambar 9). Pertumbuhan pangkal batang anggrek P. gigantea dapat dilihat
berdasarkan jumlah daun dan tunasnya. Eksplan yang memiliki jumlah daun dan
tunas terbanyak adalah perlakuan A14 (½ MS + 20 ppm kitosan) dengan 5 daun
dan 6 tunas (Gambar 10).
G12 G11
Tabel 4. Pengaruh BAP dan TDZ Terhadap Induksi Organogenesis Daun
Phalaenopsis gigantea pada 8 MSI.
Kode Media
29
Tabel 5. Rekapitulasi Sidik Ragam Pengaruh Kitosan Terhadap Beberapa Peubah Pertumbuhan Pangkal Batang Phalaenopsis gigantea pada 8 MSI.
Peubah Pr>F KK Perlakuan
Persentase hidup eksplan 0,8246 25,92x) tn
Waktu muncul daun 0,5284 23,27 tn
Keterangan: tn= tidak berbeda nyata pada taraf uji F 5% * = berbeda nyata pada taraf uji F 5%
Tabel 6. Pengaruh Kitosan Terhadap Beberapa Peubah Pertumbuhan Pangkal Batang Phalaenopsis gigantea pada 8 MSI.
Peubah Perlakuan berdasarkan uji DMRT pada tingkat kepercayaan 5%.
Gambar 9. Morfologi eksplan Phalaenopsis gigantea pada beberapa perlakuan kitosan setelah 8 MSI. A10 = ½ MS, A11= ½ MS + 5 ppm kitosan, A12 = ½ MS + 10 ppm kitosan, A13 = ½ MS + 15 ppm kitosan, A14 = ½ MS + 20 ppm kitosan.
Gambar 10. Eksplan Phalaenopsis gigantea dengan Jumlah Daun dan Tunas Terbanyak pada beberapa perlakuan kitosan setelah 8 MSI. A10 = ½ MS, A11= ½ MS + 5 ppm kitosan, A12 = ½ MS + 10 ppm kitosan, A13 = ½ MS + 15 ppm kitosan, A14 = ½ MS + 20 ppm kitosan.
A14 A13
A12 A11
A10
A10 A11 A12
31
Pembahasan
Kultur Daun
Kultur daun P. gigantea (Tahap I) tidak berhasil membentuk kalus atau
PLBs sampai 24 MSI. Kalus dan PLBs sempat terbentuk, namun kemudian mati.
Media yang kurang cocok dan browning atau pencoklatan diduga sebagai faktor
penyebab kematian eksplan. Proses pencoklatan eksplan dimulai dari bagian daun
yang dilukai, yang kemudian diduga mengeluarkan fenol. Fenol tersebut
menyebar pada media dan menyebabkan kematian eksplan. Kematian eksplan
akibat browning dan fenol sulit dikendalikan.
Kalus terbentuk pada media G6 (½ MS+ 1 mg/l BAP + 0,02 mg/l NAA),
namun kalus kemudian menghitam dan mati. Hal tersebut juga dilaporkan pada
hasil penelitian Rianawati et al., (2009) tentang kultur daun pada tiga hybrid
Phalaenopsis, dimana eksplan daun berubah warna menjadi kuning kecoklatan
dan kemudian menghitam pada hampir seluruh media perlakuan. Kematian
jaringan diduga dikarenakan eksplan gagal beregenerasi dan umur daun yang
sudah tua.
Hasil kultur daun menunjukan bahwa PLBs dapat terbentuk pada media
G8 ( ½ MS + 2 mg/l BAP + 0,01 mg/l NAA), walaupun PLBs kemudian mati.
Hasil penelitian ini tidak optimal bila dibandingkan dengan hasil penelitian
Handini dan Isnaini (2009) pada kultur daun P. sumatrana, meskipun media yang
digunakan untuk menginduksi PLBs terbanyak merupakan media yang sama
dengan penelitian ini. Isnaini (2011, komunikasi pribadi) menyatakan bahwa
jumlah PLBs terbanyak dijumpai pada media ½ MS dengan penambahan 2 mg/l
BAP dan 0,1 mg/l NAA pada kultur daun P. cornucervi.
Percobaan kultur daun P. gigantea (Tahap II) berhasil menginduksi PLBs
setelah 14 MSI. Sebagian besar daun masih berwarna hijau pada 8 MSI, kemudian
beberapa daun mati setelah 10 MS . Kematian daun pada beberapa eksplan diduga
karena adanya luka akibat pemotongan yang mengeluarkan senyawa fenol,
sehingga menganggu penyerapan unsur hara.
Hasil penelitian Latip et al., (2010) menunjukan bahwa penambahan
tertinggi (66%) pada kultur PLBs P. gigantea setelah 80 hari inkubasi (± 11 MSI).
Hasil penelitian tersebut berbeda dengan penelitian ini, walaupun perlakuan yang
digunakan sama. Perbedaan hasil tersebut diduga dikarenakan perbedaan spesies
dan umur eksplan.
Hasil penelitian ini berbeda dengan yang dilaporkan oleh Tokuhara dan
Mii (1993), dimana penambahan 0,1 mg/l NAA dan 1 mg/l BAP pada media New
Dogashima Medium (NDM) memiliki persentase eksplan yang membentuk PLBs
terbanyak (71,4%) pada hibrid Phalaenopsis (P. gigantea x Doritaenopsis
odoriko). Tokuhara dan Mii (2001) menambahkan bahwa persentase eksplan
membentuk PLBs terbanyak (44%) dijumpai pada media NDM dengan
penambahan 0.1 mg/l NAA dan 1 mg/l BAP pada kultur tunas anggrek
Phalaenopsis hybrid. Media NDM memiliki unsur makro yang lebih rendah bila
dibandingkan dengan media ½ MS (Lampiran 1), sehingga media NDM lebih
baik untuk pertumbuhan P. gigantea yang biasa hidup ditempat yang kurang
unsur hara.
Hasil Penelitian Kartiman (2004) menunjukan bahwa kombinasi 0,5 mg/l
IBA dengan 1 mg/l BAP pada media ½ MS dapat meningkatkan jumlah PLBs
terbanyak (10 PLBs/eksplan) pada kultur PLBs P. gigantea. Selanjutnya, hasil
penelitian Latip et al., (2010) menunjukan bahwa penambahan 0,5 mg/l BAP pada
media NDM menghasilkan jumlah PLBs (3-46 PLBs/eksplan) dan PLBs
berkecambah (37,85%) terbanyak pada kultur PLBs P. gigantea. Penelitian
Kartiman (2004) dan Latip et al., (2010) menggunakan eksplan PLBs, sedangkan
penelitian ini menggunakan daun. Kultur daun masih lebih sulit bila dibandingkan
kultur PLBs dalam menginduksi PLBs P. gigantea. Hal tersebut dikarenakan
PLBs memiliki jaringan yang lebih muda bila dibandingan daun, sehingga respon
yang dihasilkan menjadi lebih baik.
Di lain pihak, Lee dan Lee (2003) melaporkan bahwa penambahan 0,1 - 1
mg/l TDZ pada media ½ MS, tidak dapat menginduksi kalus pada kultur PLBs
anggrek Cypripedium formosanum setelah 8 MSI. Selanjutnya, Peneliti tersebut
melaporkan bahwa kombinasi TDZ dengan 2,4 D berhasil menginduksi kalus
33
sebaliknya, perlakuan TDZ tunggal lebih baik daripada perlakuan kombinasi TDZ
dengan 1 mg/l NAA untuk membentuk kalus pada kultur kalus Kigela piñata.
Hasil penelitian Chen dan Chang (2004) menunjukan bahwa penambahan
3 mg/l TDZ pada media ½ MS memacu jumlah PLBs terbanyak (59,5
PLBs/petridish) pada kultur biji P. amabilis var Formosa Shimadzo. Selanjutnya
Chen dan Chang (2006) melaporkan bahwa penambahan 3 mg/l TDZ pada media
MS memiliki persentase eksplan embriogenesis (93,8%) dan jumlah embrio
terbanyak (19,4 embrio/eksplan) pada kultur daun P. amabilis. Gow et al., (2008)
melaporkan bahwa jumlah embrio terbanyak (7,8 embrio/eksplan) dapat terbentuk
pada media ½ MS ditambah 3 mg/l TDZ pada kultur daun P. amabilis.
Hasil penelitian Chen et al., (2000) menunjukan bahwa penambahan 0,1
mg/l TDZ memacu persentase eksplan membetuk PLBs (10,68%) dengan jumlah
PLBs (74 PLBs/eksplan) dan PLBs berkecambah (13 kecambah/eksplan) pada
kultur kalus Phalaenopsis hibrid. Perbedaan hasil penelitian ini diduga
dikarenakan oleh perbedaan media dasar, konsentrasi ZPT dan eksplan yang
digunakan. Selain itu, perbedaan spesies dapat menghasilkan respon yang berbeda
pula.
Kultur Pangkal Batang
Hasil pengamatan pada percobaan kultur pangkal batang (Tahap I)
menunjukan bahwa pertumbuhan eksplan memiliki respon yang beragam terhadap
media perlakuan. Pada umumnya eksplan masih berwarna hijau pada 10 MSI,
namun setelah 12 MSI banyak eksplan yang mengalami kematian. Kematian
eksplan paling banyak disebabkan oleh stress akibat pemotongan daun dan akar,
sehingga eksplan menjadi coklat dan kering. Selain itu, air kelapa, ekstrak ubi,
dan pisang merupakan bahan organik yang mengandung gula, sehingga
penambahan bahan bahan organik tersebut ke dalam media dapat menyebabkan
tekanan osmosis pada media semakin besar. Tekanan osmosis yang besar dapat
menyebabkan cairan pada eksplan keluar, sehingga eksplan akan mengering dan
mati.
Pengamatan pada keempat media menunjukan bahwa kematian eksplan
pisang). Hasil penelitian ini berbeda dengan hasil penelitian Rahayu et al., (2010)
tentang pembesaran kecambah anggrek P. fuscata. Hasil penelitian tersebut
menunjukan bahwa persentase hidup eksplan tertinggi (100%) dijumpai pada
media KC ditambah air kelapa dan ekstrak pisang. Perbedaan tersebut diduga
disebabkan oleh berbedanya eksplan dan media yang digunakan. Eksplan
kecambah memiliki tingkat regenerasi lebih baik bila dibandingkan pangkal
batang, sehingga adaptasi eksplan terhadap media menjadi lebih baik.
Perlakuan G10 (KC + air kelapa + ekstrak taoge) merupakan perlakuan
terbaik untuk pembentukan daun, tunas, dan akar. Hasil penelitian ini berbeda
dengan hasil penelitian Widyastuti (2003) pada pembesaran kecambah
P. gigantea. Hasil penelitian tersebut menunjukan bahwa pertumbuhan daun (5,1
daun/eksplan) dan tunas (2,3 tunas/eksplan) terbaik dijumpai pada media KC
dengan penambahan ekstrak ubi.
Jumlah daun P. gigantea setelah 24 MSI tidak dipengaruhi oleh
kandungan bahan organik pada media. Hasil uji sidik ragam menunjukan bahwa
jumlah daun pada keempat perlakuan tidak nyata. Perlakuan G10 (KC + air kelapa
+ ekstrak taoge) memiliki jumlah daun tertinggi, namun ketika dikombinasikan
dengan ekstrak bahan organik lainnya menghasilkan jumlah daun yang lebih
rendah. Seperti halnya dengan penelitian Rahayu et al., (2010) menunjukan bahwa
penambahan air kelapa dan ekstrak taoge pada media KC memiliki rataan jumlah
daun tertinggi (4,38 daun/eksplan) pada kultur kecambah P. fuscata, namun ketika
dikombinasikan dengan ubi atau pisang menghasilkan jumlah daun yang lebih
rendah. Spesies Phalaenopsis diduga tidak tumbuh dengan baik pada media
dengan bahan organik yang komplek.
Perlakuan media G12 (KC + air kelapa + ekstrak taoge + ekstrak pisang)
kurang optimal dalam pertumbuhan daun. Untari dan Puspitaningtyas (2006)
melaporkan bahwa penambahan ekstrak pisang pada media kultur anggrek hitam
(Coelogyne pandurata Lindl.), tidak lebih baik pertumbuhannya bila
dibandingkan pada media kultur tanpa bahan organik. Hasil penelitian ini
berbanding terbalik dengan hasil penelitian Widiastoety dan Purbadi (2003) yang
35
dengan penambahan pisang. Spesies anggrek diduga memiliki respon yang
berbeda-beda terhadap bahan organik yang sama.
Penambahan ekstrak pisang pada penelitian ini tidak berpengaruh terhadap
pertumbuhan tunas P. gigantea. Hasil penelitian ini berbeda dengan penelitian
Untari dan Puspitaningtyas (2006) pada kultur kecambah anggrek hitam
(Coelogyne pandurata Lindl.), dimana penambahan ekstrak pisang memberikan
hasil terbaik dalam jumlah tunas (4,1 tunas/eksplan). Demikian pula hasil
penelitian Rahayu et al., (2010) yang menunjukan bahwa penambahan ekstrak
pisang pada kultur in vitro P. fuscata memiliki pertumbuhan eksplan yang lebih
baik. Akan tetapi, kombinasi ekstrak ubi dan pisang pada P. fuscata memiliki
pertumbuhan yang kurang baik. Bahan organik kompleks seperti air kelapa,
ekstrak nanas dan kentang dilaporkan kaya akan energi dan mengandung vitamin
dan hormon tanaman (Arditti dan Abdul Karim, 2000). Pemberian bahan organik
yang berlebihan diduga dapat mengakibatkan toksis bagi eksplan.
Penurunan hasil akibat bahan organik yang terlalu kompleks dilaporkan
pula oleh Murdad et al., (2010) pada kultur PLBs anggrek P. gigantea, dimana
penambahan ekstrak kentang atau sukrosa saja pada media XER menghasilkan
indeks pertumbuhan terbaik (537). Akan tetapi pada media dengan penambahan
kentang dan gula menyebabkan pertumbuhan menjadi lebih lambat. Hal ini
menunjukan bahwa P. gigantea memiliki kebutuhan nutrisi yang sedikit untuk
memacu pertumbuhannya.
Hasil penelitian ini menunjukan bahwa penambahan air kelapa, ekstrak
taoge dan pisang (G12) memberikan hasil yang cukup baik untuk pertumbuhan
akar P. gigantea. Widyastuti (2003) melaporkan bahwa penambahan ekstrak
pisang pada media Vacin and Went (VW) dan ½ MS memberikan hasil terbaik
bagi pertumbuhan akar anggrek P. gigantea yaitu 3,1 akar/eksplan. Selanjutnya,
Rahayu et al., (2010) melaporkan bahwa penambahan ekstrak pisang pada media
KC memberikan hasil terbaik bagi pertumbuhan akar P. fuscata yaitu 4,15
akar/eksplan. Hasil penelitian Untari dan Puspitaningtyas (2006) justru
sebaliknya, dimana penambahan ekstrak pisang tidak optimal bagi pertumbuhan