PENGARUH PERLAKUAN KOLKISIN PADA BUNGA PASCA
PENYERBUKAN DAN PLANLET IN VITRO UNTUK INDUKSI
POLIPLOID PADA ANGGREK BULAN (Phalaenopsis amabilis)
FAHMUR RAZAQ
DEPARTEMEN AGRONOMI DAN HORTIKULTURA
FAKULTAS PERTANIAN
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Pengaruh Perlakuan Kolkisin pada Bunga Pasca Penyerbuka dan Planlet In Vitro untuk Induksi Poliploid pada Anggrek Bulan (Phalaenopsis amabilis) adalah karya saya dan dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau kutipan dari karya yang diterbitkan mau pun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya limpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Februari 2016
Fahmur Razaq
NIM A24110126
ABSTRAK
FAHMUR RAZAQ. Pengaruh Perlakuan Kolkisin pada Bunga Pasca Penyerbukan dan Planlet In Vitro untuk Induksi Poliploid pada Anggrek Bulan (Phalaenopsis amabilis). Dibimbing oleh DEWI SUKMA dan SANDRA ARIFIN AZIZ.
Induksi poliploidi merupakan salah satu metode alternatif untuk meningkatkan ukuran dan kualitas tanaman hias. Penelitian dilakukan untuk menginduksi poliploidi pada embrio atau planlet Phalaenopsis amabilis dengan perlakuan kolkisin. Penelitian ini terdiri dari 2 percobaan, percobaan 1 adalah perlakuan kolkisin pada bunga setelah polinasi dan pada percobaan 2, perlakuan kolkisin diberikan pada planlet in vitro. Pada percobaan 1, bunga setelah polinasi dibalut dengan kapas dan dioleskan dengan 500 mg L-1 kolkisin pada 3 dan 10 hari setelah polinasi lalu kapas dilepas pada 5 hari setelah perlakuan. Buah yang dihasilkan setelah masak dipanen dikecambahkan dalam media Murashige & Skoog setengah konsentrasi (1/2MS). Pada percobaan 2, planlet direndam dalam larutan kolkisin konsentrasi 25 mg L-1 selama 0, 5, 10 dan 15 hari lalu dipindahkan ke media 1/2MS. Hasil percobaan menunjukkan bahwa perlakuan kolkisin pada bunga setelah polinasi menekan ukuran buah dan jumlah protocorm. Pada Percobaan 2, secara umum perlakuan kolkisin tidak mempengaruhi pertumbuhan planlet. Berdasarkan pengamatan jumlah kromosom, planlet tetraploid ditemukan pada planlet yang berasal dari perlakuan perendaman dalam kolkisin selama 10 hari.
ABSTRACT
FAHMUR RAZAQ. The Effect of Colchicine on Pollinated Flower and In Vitro Plantlet for Polyploidi Induction of Moth Orchid (Phalaenopsis amabilis). Supervised by DEWI SUKMA and SANDRA ARIFIN AZIZ.
Polyploidy induction is an alternative method to increase plant size and quality of ornamental plants. The research was carried out to induce polyploidy on embryo or plantlets Phalaenopsis amabilis using colchicine. The research consisted of 2 experiments, the first one was colchicine treatment on pollinated flower and the second one was on in vitro planlets. In the first experiment, pollinated flowers were covered with cotton then 500 mg L-1 colchicines was smeared on it at 3 or 10 days after pollination then the cotton removed after 5 days of treatment. Matured fruits (pods) were harvested and the seed were germinated in a half strength of Murashige and Skoog (1/2MS) medium. In the second experiment, plantlets were immersed in 25 mg L-1colchicines for 0, 5, 10, and 15 days then transferred to 1/2MS medium. The result of the first experiment showed that colchicine decreased pod size, weight and number of protocorm per pod after germination. In the second experiment, plantlets growth were not affected by colchicines application. Tetraploid plantlet was found on plantlet with 10 days of colchicine treatment.
PENGARUH PERLAKUAN KOLKISIN PADA BUNGA PASCA
PENYERBUKAN DAN PLANLET IN VITRO UNTUK INDUKSI
POLIPLOID PADA ANGGREK BULAN (Phalaenopsis amabilis)
FAHMUR RAZAQ
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian
pada
Departemen Agronomi dan Hortikultura
DEPARTEMEN AGRONOMI DAN HORTIKULTURA
FAKULTAS PERTANIAN
PRAKATA
Puji syukur kepada Allah SWT yang telah memberikan karunia-Nya sehingga saya dapat menyelesaikan karya ilmiah ini sebagai salah satu syarat dalam menyelesaikan studi program sarjana di Fakultas Pertanian Bogor. Topik yang saya pilih adalah kultur jaringan anggrek dengan judul penelitian Pengaruh Perlakuan Kolkisin pada Bunga Pasca Penyerbukan dan Planlet In Vitro untuk Induksi Poliploid pada Anggrek Bulan (Phalaenopsis amabilis)
Ucapan terima kasih saya sampaikan kepada dosen pembimbing saya, Ibu Dr Dewi Sukma, SP MSi dan Prof Dr Ir Sandra A Aziz, MS yang telah memberikan masukan-masukan yang bermanfaat dalam pembuatan karya ilmiah ini. Terima kasih juga saya ucapkan kepada kedua orang tua serta keluarga saya atas dukungan serta doanya.
Bogor, Februari 2016
i
DAFTAR ISI
DAFTAR TABEL iii
DAFTAR GAMBAR iii
DAFTAR LAMPIRAN iv
PENDAHULUAN 1
Latar Belakang 1
Tujuan 2
Hipotesis 2
TINJAUAN PUSTAKA 3
Anggrek 3
Genus Phalaenopsis 3
Perbanyakan Anggrek 4
Kultur Jaringan 5
Media Kultur Jaringan Anggrek 6
Poliploidi 7
Kolkisin 8
METODE PENELITIAN 10
Tempat dan Waktu Penelitian 10
Bahan 10
Alat 10
Metode Percobaan 10
Metode Pelaksanaan 12
HASIL DAN PEMBAHASAN 16
SIMPULAN DAN SARAN 27
DAFTAR PUSTAKA 28
iii
DAFTAR TABEL
1. Rata-rata panjang dan lebar bunga, sepal dan petal beberapa aksesi
anggrek Phalaenopsis spesies (Fauziah 2013) 5
2. Jumlah bunga, jumlah buah, dan persen jumlah buah Phal. amabilis
yang dihasilkan pada perlakuan waktu pemberian kolkisin saat 18
MSSf 16
3. Rata-rata panjang tangkai sampai ujung buah Phal. amabilis pada
perlakuan waktu pemberian kolkisin 17
4. Rata-rata panjang buah Phal. amabilis pada perlakuan waktu pemberian
kolkisin 17
5. Rata-rata diameter buah Phal. amabilis pada perlakuan waktu
pemberian kolkisin 17
6. Jumlah buah, jumlah buah yang menghasilkan protocorm, dan kisaran jumlah protocorm perbuah Phal. amabilis pada perlakuan waktu
pemberian kolkisin 20
7. Rata-rata pertambahan jumlah PLBs per planlet pada perlakuan lama perendaman planlet Phal. amabilis pada kolkisin 23 8. Rata-rata pertambahan jumlah daun per planlet pada perlakuan lama
perendaman planlet Phal. amabilis pada kolkisin 23 9. Rata–rata pertambahan jumlah akar per planlet pada perlakuan lama
perendaman planlet Phal. amabilis pada kolkisin 25 10.Hasil pengamatan jumlah kromosom pada planlet Phal. amabilis hasil
perlakuan lama perendaman kolkisin ulangan 1 pada 12 MSSk 25
DAFTAR GAMBAR
1. (P1) Panjang pangkal sampai ujung buah, (P2) Panjang buah 13 2. (A) Bunga Phal. amabilis setelah selfing, (B) Bunga Phal. amabilis 3
hari setelah selfing, (C) Bunga Phal. amabilis 10 hari setelah selfing, (D) Buah Phal. amabilis setelah dipanen pada 18 MSSf 18 3. Pengaruh perlakuan waktu pemberian kolkisin terhadap rata-rata bobot
buah Phal. amabilis pada 18 MSSf. Angka-angka yang disertai huruf yang sama tidak berbeda nyata berdasarkan uji Tukey padaα<5% 19 4. (A) Protocorm Phal. amabilis kontrol, (B) Protocorm Phal. amabilis
perlakuan pengolesan kolkisin 3 hari setelah selfing, (C) Protocorm Phal. amabilis perlakuan pengolesan kolkisin 10 hari setelah selfing
pada 7 MSS 21
5. (A) Kontaminasi bakteri dan (B) Kontaminasi cendawan pada 2 MSSk 21 6. (A) PLBs yang muncul pada basal organ of the protocorm (BOP) dan
(B) PLBs yang muncul pada daun saat 8 MSSk 22
iv
8. Sel diploid (A) dan (B) pada planlet diploid perlakuan kolkisin 5 hari, Sel tetraploid (C) dan diploid (D) pada planlet mixoploid perlakuan kolkisin 10 hari, Sel tetraploid (E) dan (F) pada planlet tetraploid perlakuan kolkisin 10 hari yang diamati dengan mikroskop cahaya
perbesaran 1000x. 26
DAFTAR LAMPIRAN
1. Pengamatan kromosom sel akar planlet Phal. amabilis ulangan I perlakuan lama perendaman planlet Phal. amabilis pada kolkisin yang
PENDAHULUAN
Latar Belakang
Anggrek merupakan salah satu tanaman hias yang banyak diminati karena bentuk dan warna bunganya beraneka ragam serta dapat digunakan sebagai bunga potong, tanaman pot, atau elemen tanaman. Anggrek tergolong jenis tanaman hias yang memiliki bunga cantik dan beraneka warna. Kecantikan bunganya dihiasi dengan corak yang bervariasi, dari titik-titik abstrak hingga berpola. Bentuk bunganya pun beragam, dari yang berukuran kecil-kecil menjuntai, berpilin, hingga yang menyerupai rangkaian bunga (Hew dan Yong 1997).
Anggrek memiliki nilai ekonomi yang cukup tinggi. Anggrek tidak hanya dijual di pasar dalam negeri namun anggrek juga sudah menjadi komoditas ekspor karena penggemar di manca negara cukup banyak (Prasetio 2010). Produksi anggrek Indonesia pada tahun 2013 sebanyak 20 277 672 tangkai (BPS 2014). Nilai komoditi anggrek untuk ekspor pada bulan Januari 2014 sebanyak US$ 29 246.00 dengan Jepang sebagai negara tujuan ekspor utama (DEPTAN 2014).
Phalaenopsis merupakan salah satu genus yang populer di kalangan pencinta anggrek (Handini et al. 2012). Penampilan dan warna genus
Phalaenopsis yang anggun sangat banyak diminati. Phalaenopsis mengalami peningkatan permintaan pasar yang luar biasa. Floris umumnya menggunakan anggrek genus Phalaenopsis sebagai rangkaian bunga. Pangsa pasar genus anggrek ini kurang lebih sebesar 20% dari total pasar anggrek (Setiawan 2002).
Genus Phalaenopsis terdiri dari 66 spesies dan 22 spesies diantaranya secara alami terdapat di Indonesia (Tsai 2001). Jenis Anggrek Indonesia genus
Phalaenopsis yang sangat terkenal adalah Anggrek Bulan (Phalaenopsis amabilis) yang diangkat sebagai bunga nasional oleh Almarhumah Ibu Tien Suharto pada tahun 1983 dan dijuluki puspa pesona. Saat berbunga, Phal. amabilis menghasilkan bunga dengan jumlah yang banyak dan serentak (Widiarsih dan Dwimahyani 2008). Jumlah bunga Phal. amabilis tiap tangkainya mencapai 25 bunga, lebih banyak dibandingkan dengan Phal. sumatrana yang memiliki 3-9 bunga per tangkai, Phal. viridis dan Phal. pulcerima dengan jumlah bunga mencapai 16 bunga per tangkai (Sastrapradja et al 1976; Iswanto 2005; Wardana 2012).
Phal. amabilis memiliki bunga yang tahan lama dengan bentuk proposional. Bunga Phal. amabilis memiliki diameter 6-12 cm (Sastrapradja et al
1976). Fauziah (2013) membuktikan panjang, lebar, sepal dan petal bunga Phal. amabilis lebih unggul dibandingkan dengan genus Phalaenopsis asli Indonesia lainnya, namun tidak lebih unggul dibandingkan dengan Phalaenopsis hibrid (Pangestu 2014). Tangkai Phal. amabilis dapat mencapai 100 cm, paling panjang dibandingkan dengan genus Phalaenopsis lainnya (Sastrapradja et al 1976).
2
oryzalin dan trifuralin (Dhooghe 2009). Induksi poliploidi pada Phal. amabilis
dapat dilakukan dengan memberikan kolkisin baik secara in vivo maupun in vitro. Induksi poliploid in vivo pada bunga Phal. amabilis pasca penyerbukan menggunakan kolkisin berhasil menginduksi zigot ataupun embrio dan menghasilkan planlet mutan poliploid. Azmi (2015) melakukan perlakuan kolkisin dengan taraf konsentrasi kolkisin antara 0–2000 mg L-1 serta lama perlakuan 3 dan 5 hari. Hasil penelitian induksi poliploid in vivo ini membuktikan bahwa konsentrasi dan lama perlakuan kolkisin yang optimal untuk induksi poliploid planlet Phal. amabilis adalah 500 mg L-1 dan 5 hari dengan kisaran 250-50 protocorm yang dihasilkan perbuah. Semua perlakuan kolkisin dilakukan pada 3 hari setelah penyerbukan sendiri buatan (selfing) bunga Phal. amabilis.
Rahayu (2014) melakukan induksi poliploid Phal. amabilis menggunakan kolkisin secara in vitro. Perlakuan kolkisin dilakukan dengan metode perendaman
protocorm Phal. amabilis dalam kondisi in vitro. Konsentrasi kolkisin yang efektif untuk induksi ploiploid protocorm Phal. amabilis adalah 50 mg L-1 (33.3%) dengan persentase hidup protocorm 93.4%. Semua perlakuan perendaman protocorm Phal. amabilis pada kolkisin dilakukan selama 10 hari.
Waktu perlakuan kolkisin pada bunga Phal. amabilis setelah selfing yang optimal dan lama perlakuan perendaman kolkisin yang optimal pada planlet Phal. amabilis untuk mendapatkan tanaman poliploidi Phal. amabilis belum diketahui, maka penelitian pengaruh perlakuan kolkisin pada bunga pasca penyerbukan dan planlet in vitro untuk induksi poliploid pada Phal. amabilis perlu dilakukan.
Tujuan
1. Mempelajari pengaruh waktu perlakuan kolkisin setelah selfing terhadap buah
Phal. amabilis
2. Mempelajari pengaruh lama perendaman planlet Phal. amabilis pada kolkisin untuk menginduksi poliploid Phal. amabilis secara in vitro.
Hipotesis
1. Terdapat waktu perlakuan kolkisin setelah selfing yang berpengaruh terhadap pertumbuhan buah dan jumlah protocormPhal. amabilis
TINJAUAN PUSTAKA
Anggrek
Anggrek termasuk ke dalam famili Orchidaceae, satu famili yang sangat besar dan bervariasi (Winata 2002). Penyebaran famili Orchidaceae meliputi, Asia hingga Amerika Selatan dan Amerika Tengah. Beberapa spesiesnya ditemukan di daerah Kutub Utara, selatan Patagonia, dataran Pulau Macquarie, hingga Antartika. Beberapa jenisnya juga ditemukan di kaki Gunung Himalaya (Hew dan Yong 1997). Famili Orchidaceae memiliki sekitar 43 000 spesises dari 750 genera yang berbeda. Kurang lebih 5 000 spesies diantaranya terdapat di Indonesia (Darmono 2003).
Potensi pasar untuk bunga potong anggrek dan anggrek dalam pot sangat besar. Potensi pasarnya sangat jelas tergambar dari permintaan pasar dunia terhadap tanaman anggrek baik dalam bentuk bunga potong ataupun anggrek di dalam pot (Hew dan Yong 1997). Potensi plasma nutfah anggrek di Indonesia sangat tinggi, yaitu sekitar 5 000 jenis namun yang dibudidayakan secara komersial tidak lebih dari 10% (Santoso 2006). Hal tersebut menunjukkan bahwa peluang bisnis anggrek masih sangat terbuka.
Genus Phalaenopsis
Phalaenopsis merupakan salah satu genus anggrek yang cukup populer di kalangan pencinta anggrek (Handini et al. 2012). Phalaenopsis berasal dari bahasa Yunani, phalaina artinya kupu–kupu, dan opsis artinya menyerupai, dengan demikian Phalaenopsis berarti menyerupai kupu–kupu (Setiawan 2002).
Susunan tubuh genus Phalaenopsis terdiri atas akar, batang, daun, bunga, buah, dan biji. Genus Phalaenopsis bersifat epifit (Sastrapradja et al 1976). Anggrek epifit adalah anggrek yang dihabitat alaminya tumbuh menumpang pada tanaman lain, tetapi tidak merugikan tanaman yang ditumpangi (Yusnita 2012). Tanaman epifit ditandai dengan karakter pertumbuhannya yang melekat pada permukaan kulit pohon, dengan seluruh bagian tumbuhan (akar, batang, daun) berada diudara.
Akar genus Phalaenopsis terdiri atas dua macam, yaitu akar lekat dan akar udara. Akar lekat berfungsi untuk melekat dan menahan keseluruhan tanaman agar tetap berada pada posisinya. Akar udara berperan dalam proses pertumbuhan dan perkembangan tanaman, karena akar udara memiliki kemampuan untuk menyerap unsur hara.
Batang genus Phalaenopsis berukuran sangat pendek, bahkan kadang-kadang tidak terlihat karena tertutup pelepah daun. Daun berbentuk lanset atau bundar panjang sampai jorong, dengan panjang antara 20-30 cm dan lebar 3-12 cm, berdaging tebal, berwarna hijau kelam, hijau muda, hijau keungu-unguan, sampai hijau kemerah-merahan (Sastrapradja et al 1976; Hew dan Yong 1997; Yusnita 2012).
4
pleurente yang berarti karangan bunganya (anthotaxisinflorescentia) tumbuh dari pangkal atau samping batang. Bunganya tersusun dalam rangkaian berbentuk tandan dan bercabang. Daun mahkota berbentuk bundar melebar, dengan pangkal yang kecil dan ujung tumpul. Daun kelopak berbentuk jorong dengan ujung runcing. Bibir bunga bertaju tiga, berbentuk segitiga, berwarna kuning pucat hingga kuning tua dan bergaris-garis kemerahan di sebelah dalam. Bunga anggrek mekar bertahan hingga 1 bulan. Penyerbukan bunga selain terjadi secara alami dengan bantuan serangga lebah atau kupu-kupu penyerbuk, juga dapat dilakukan secara buatan oleh manusia (Sastrapradja et al 1976; Rukmana 2000).
Genus Phalaenopsis terdiri dari 66 spesies dan 22 spesies diantaranya secara alami terdapat di Indonesia (Tsai 2001). Salah satu spesies anggrek yang terkenal pada genus Phalaenopsis di Indonesia adalah anggrek bulan (Phalaenopsis amabilis) yang merupakan salah satu anggrek kebanggaan nasional. Tanggal 5 Juni 1990, anggrek bulan resmi dinobatkan sebagai bunga nasional, dengan sebutan “Puspa Pesona”.
Kedudukan tanaman anggrek bulan dalam sistematika (taksonomi) tumbuhan diklasifikasikan sebagai berikut menurut Rukmana (2000):
Kingdom : Plantae
Spesies : Phalaenopsis amabilis (L.) Blume
Jumlah bunga Phal. amabilis tiap tangkainya mencapai 25 bunga, lebih banyak dibandingkan dengan Phal. sumatrana yang memiliki 3-9 bunga per tangkai, Phal. viridis dan Phal. pulcherima dengan jumlah bunga mencapai 16 bunga per tangkai (Sastrapradja et al 1976; Iswanto 2005 ; Wardana 2012).
Phal. amabilis memiliki bunga yang tahan lama dengan bentuk proposional. Bunga Phal. amabilis memiliki diameter 6-12 cm (Sastrapradja et al
1976). Fauziah (2013) membuktikan panjang, lebar, sepal dan petal bunga Phal. amabilis lebih unggul dibandingkan dengan genus Phalaenopsis asli Indonesia lainnya (Tabel 1), namun tidak lebih unggul dibandingkan dengan Phalaenopsis
hibrid (Pangestu 2014). Tangkai Phal. amabilis dapat mencapai 100 cm, paling panjang dibandingkan dengan genus Phalaenopsis lainnya (Sastrapradja et al
1976).
Perbanyakan Anggrek
5
dalam kondisi aseptik, pelestarian plasma nutfah, produksi sepanjang tahun dan dapat memperbanyak tanaman yang sulit diperbanyak secara konvesional seperti anggrek (Zulkarnain 2009). Perbanyakan secara in vitro telah banyak diusahakan secara komersial di negara-negara maju seperti Amerika, Jepang dan Eropa terutama untuk pengadaan bibit. Hasil percobaan pada anggrek Cymbidium dari bahan tanaman yang terbatas dapat dihasilkan bibit dalam jumlah banyak dengan waktu yang singkat (Widiastoety dan Bahar 1995).
Tabel 1 Rata-rata panjang dan lebar bunga, sepal dan petal beberapa aksesi anggrek Phalaenopsis spesies (Fauziah 2013)
Aksesi Bunga Sepal dorsal Sepal lateral Petal
Panjang Lebar Panjang Lebar Panjang Lebar Panjang Lebar
modesta, PC: Phal. Cornucervi, PT: Phal. tetraspis, PAC: Phal. amabilis Cidaun.
Kultur Jaringan
Kultur jaringan adalah suatu teknik membudidayakan jaringan tanaman menjadi tanaman baru yang lengkap dan mempunyai sifat seperti induknya (Sandra 2013). Kultur jaringan merupakan teknik perbanyakan tanaman dengan memperbanyak jaringan mikro tanaman yang ditumbuhkan secara in vitro
menjadi tanaman yang sempurna dalam jumlah yang tidak terbatas (Yuliarti 2010). Kultur jaringan tanaman adalah metode untuk memisahkan bagian dari tanaman seperti sel, jaringan atau organ (daun, petal, batang, akar, mata tunas, meristerm) serta menumbuhkannya dalam lingkungan tertentu dalam keadaan aseptik, sehingga bagian–bagian tersebut dapat memperbanyak diri dan beregenerasi membentuk tanaman.
6
Haberlandt membuktikan hipotesisnya dengan menanam jaringan palisade daun Lamium purpureum dan Eichornia crassipes, kemudian jaringan epidermis
Ornithogalum dengan menggunakan media mineral dan sukrosa. Hasil dari percobaan Haberlandt adalah sel membesar dan tetap hidup selama satu bulan tetapi tidak mengalami pembelahan sehingga jumlahnya tetap (Santoso dan Nursandi 2001). Keberhasilan aplikasi teknik kultur jaringan sebagai sarana perbanyakan tanaman secara vegetatif pertama kali dilaporkan oleh White pada tahun 1934, yakni melalui kultur akar tanaman tomat. Pada tahun 1939, Gautheret, Nobécourt dan White berhasil menumbuhkan kalus tembakau dan wortel secara in vitro. Ditemukannya prosedur perbanyakan secara in vitro pada tanaman anggrek Cymbidium pada tahun 1960 oleh Morel, serta diformulasikannya komposisi medium dengan konsentrasi garam mineral yang tinggi oleh Murashige dan Skoog pada tahun 1962, semakin merangsang perkembangan aplikasi teknik kultur jaringan pada berbagai spesies tanaman (Zulkarnain 2009).
Tahun 1980 kultur jaringan mulai berkembang di Indonesia. Kultur jaringan diaplikasikan untuk penyimpanan plasma nutfah dan perbaikan tanaman. Aplikasi kultur jaringan saat ini sudah menjadi kegiatan rutin untuk perbanyakan tanaman hortikultura, disamping untuk perbanyakan beberapa tanaman kehutanan dan perkebunan (Lestari 2008).
Aktifitas teknik kultur jaringan pada mulanya berorientasi hanya pada pembuktian dan pengembangan teori totipotensi, kemudian berkembang lebih jauh meliputi kajian biokimia, fisiologis, genetika, embriologi dan pemuliaan tanaman. Sekarang teknik kultur jaringan mampu menjadi teknologi andalan bidang agroindustri (Santoso dan Nursadi 2001). Pierik (1987) menjelaskan keuntungan dari perbanyakan kultur jaringan antara lain: dapat dihasilkan bibit dalam jumlah banyak dalam waktu yang relatif singkat, hemat ruangan, tidak tergantung musim, dan menyelesaikan persoalan perbanyakan tanaman berkayu secara konvensional yang selama ini sulit diatasi.
Sandra (2013) menjabarkan bahwa teknik kultur jaringan memiliki beberapa kelemahan. Kelemahannya antara lain dibutuhkan biaya investasi awal yang relatif lebih besar untuk pengadaan laboratorium, dibutuhkan keahlian khusus untuk mengerjakannya, tanaman yang dihasilkan berukuran kecil dengan kondisi aseptik, terbiasa di lingkungan dengan kelembapan tinggi, relatif memerlukan perlakuan khusus setelah aklimatisasi, serta perlu penyesuaian kembali ke lingkungan luar.
Media Kultur Jaringan Anggrek
Pengetahuan tentang senyawa yang dibutuhkan oleh sel dan jaringan dalam pembiakan secara mikro sangat penting karena dapat mempengaruhi keberhasilan in vitro. Ada dua faktor yang menentukan keberhasilan dalam kultur
7
(Santoso dan Nursandi 2001). Komposisi media biasanya berbeda sesuai dengan tumbuhan, jenis sel atau jaringan, serta umur jaringan yang akan dikulturkan (Pierik 1987).
Media kultur jaringan yang umum digunakan untuk kultur jaringan anggrek adalah media Murashige and Skoog (MS) dengan setengah konsentrasi (Andini 2013; Renalta 2013; Putri 2015). Media kultur yang juga sering digunakan untuk kultur jaringan anggrek adalah Knudson C (Azmi 2015). Penggantian media kultur jaringan dengan pupuk majemuk sebagai pengganti hara makro pada media kultur anggrek telah mulai dilakukan. Pupuk majemuk yang biasa digunakan adalah pupuk lengkap dengan merk dagang Hyponex (20-20-20) (Rachmatullah 2009; Andini 2013; Renalta 2013; Putri 2015). Putri (2015) melakukan penelitian media kultur jaringan pada Phalaenopsis hibrida. Media MS ½ lebih baik dalam pertambahan diameter clump Protocorm Like Bodies (PLBs) Phalaenopsis hibrida dari media pupuk lengkap (20-20-20), tetapi media pupuk lengkap (20-20-20) lebih baik dalam pertambahan jumlah planlet Phalaenopsis
hibrida dari media MS ½.
Media kultur jaringan anggrek biasanya ditambahkan dengan senyawa organik dan arang aktif. Penggunaan senyawa organik untuk merangsang pembelahan sel dan mendorong proses diferensiasi. Senyawa organik juga merupakan sumber hara dan sebagai suatu zat yang dapat menstimulir pertumbuhan. Senyawa organik kompleks yang umum digunakan adalah air kelapa, tomat, pisang, ekstrak ragi, dan fish emulsion. Arang aktif (charcoal)
berfungsi menyerap senyawa–senyawa fenol yang keluar dari luka bekas potong (Darmono 2003).
Poliploid
Poliploid merupakan kondisi susunan kromosom menjadi lebih dari dua set kromosom. Sel-sel tanaman poliploid menjadi lebih besar sehingga ukuran tanaman poliploid lebih besar dari tanaman normal (Griffith 2000). Poliploid menurut asal set kromosom dapat diklasifikasikan sebagai autopoliploid dan alopoliploid. Autopoliploid adalah set-set kromosom berasal dari spesies yang sama atau berasal dari penggandaan kromosom sendiri. Alopoliploid terjadi karena persilangan antara dua individu berbeda genom, tetapi masih berhubungan dekat, seperti persilangan antar spesies (Dhooghe et al. 2011).
Tanaman poliploid mempunyai jumlah kromosom lebih banyak daripada tanaman diploid oleh karena itu tanaman poliploid tampak lebih kekar, bagian-bagian tanaman menjadi lebih besar (akar, batang, daun, bunga, dan buah), sel-selnya (tampak jelas pada sel-sel epidermis) lebih besar, inti sel juga lebih besar, buluh-buluh pengangkutan mempunyai diameter lebih besar, dan stomata lebih besar (Suryo 1995). Hal ini dapat meningkatkan nilai produktivitas tanaman poliploid dibandingkan dengan tanaman dengan jumlah kromosom normal. Tanaman poliploid juga lebih subur dan memiliki pertumbuhan yang cepat (Griffith 2000).
8
lingkungan (Suryo 1995). Mengingat fertilisasi tanaman poliploidi menjadi berkurang, maka akan lebih menguntungkan apabila induksi poliploid dilakukan terhadap tanaman yang bijinya memiliki daya berkecambah rendah atau bijinya tidak diharapkan seperti anggrek, cabe, semangka, anggur, apel dan sebagainya.
Induksi poliploidi dapat dilakukan dengan memberikan zat antimitosis. Zat antimitosis mempengaruhi siklus pembelahan sel tumbuhan dengan cara menghambat migrasi kromosom dan menghasilkan sel poliploid. Kolkisin merupakan salah satu zat anti mitosis yang menghasilkan tanaman poliploid lebih banyak dibandingkan oryzalin dan trifuralin (Dhooghe 2009).
Kolkisin
Kolkisin (C22H25O6N) merupakan suatu alkaloid yang berasal dari umbi dan biji tanaman Autumn crocus (Cholcicum autumnale Linn.) yang termasuk dalam Famili Liliaceae. Kolkisin bersifat sebagai racun, pada tumbuhan memperlihatkan pengaruhnya pada nukleus yang sedang membelah. Larutan kolkisin dengan konsentrasi yang kritis mencegah terbentuknya benang-benang plasma dari gelendong inti (spindel) sehingga pemisahan kromosom pada anafase dari mitosis tidak berlangsung dan menyebabkan penggandaan kromosom tanpa pembentukan dinding sel (Suryo 1995).
Tidak ada ukuran tertentu mengenai besarnya konsentrasi kolkisin yang harus digunakan, juga mengenai lamanya waktu perlakuan. Keduanya tergantung dari bahan dan jenis tanaman yang akan digunakan dalam percobaan. Penggunaan konsentrasi larutan kolkisin dan waktu perlakuan yang kurang tepat, maka poliploidi belum dapat diperoleh. Penggunaan konsentrasi kolkisin yang terlalu tinggi atau waktu perlakuan terlalu lama mengakibatkan kolkisin akan memperlihatkan pengaruh negatif, yaitu penampilan tanaman menjadi lebih jelek, sel-sel banyak yang rusak atau bahkan menyebabkan kematian pada tanaman (Suryo 1995).
Induksi poliploid in vivo dengan kolkisin pada bunga Phal. amabilis pasca penyerbukan berhasil menginduksi zigot ataupun embrio dan menghasilkan planlet mutan poliploid. Azmi (2015) melakukan perlakuan kolkisin pada bunga
Phal. amabilis pasca penyerbukan dengan taraf konsentrasi kolkisin antara 0– 2000 mg L-1 serta lama perlakuan 3 dan 5 hari. Hasil penelitian Azmi membuktikan bahwa konsentrasi dan lama perlakuan kolkisin yang optimal untuk induksi poliploid planlet Phal. amabilis adalah 500 mg L-1 dan 5 hari dengan kisaran 250-50 protocorm yang dihasilkan perbuah. Semua perlakuan kolkisin dilakukan pada 3 hari setelah penyerbukan sendiri buatan (selfing) bunga Phal. amabilis. Waktu perlakuan kolkisin pada bunga Phal. amabilis pasca penyerbukan untuk mengoptimalkan induksi poliploid dan jumlah protocorm belum diketahui.
9
METODE PENELITIAN
Tempat dan Waktu Penelitian
Penelitian ini dilakukan di Greenhouse Anggrek Leuwikopo, Laboratorium Kultur Jaringan Tanaman 1, dan Laboratorium Mikro Teknik Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor pada bulan Januari sampai November 2015.
Bahan
Bahan tanaman yang digunakan adalah Phal. amabilis yang sedang berbunga asal Jawa Barat dan planlet Phal. amabilis yang berasal dari Kebun Raya Bogor. Komposisi media kultur in vitro yang digunakan adalah media cair pupuk lengkap dengan merek dagang Hyponex (20-20-20) 2 g L-1 + air kelapa 15% dan media padat MS ½ + air kelapa 15%. Bahan lain yang digunakan adalah kolkisin.
Alat
Alat yang digunakan antara lain Laminar Air Flow Cabinet (LAFC),
autoclave, gelas ukur, timbangan analitik, blender, botol kultur, erlenmeyer, shaker, gunting, pinset, skapel, cawan petri, sarung tangan, mikroskop, alat tulis, alat kultur lainnya dan kamera.
Metode Percobaan
Penelitian ini menggunakan dua macam eksplan anggrek Phal. amabilis
yaitu Phal. amabilis yang sedang berbunga dan planlet Phal. amabilis . Percobaan yang dilakukan sebagai berikut:
Percobaan 1: pengaruh perlakuan kolkisin pada bunga Phal. amabilis pasca penyerbukan untuk induksi poliploid.
Rancangan percobaan yang digunakan adalah Rancangan Acak Lengkap (RAL) dengan satu faktor yaitu waktu perlakuan kolkisin pada bunga anggrek
Phal. amabilis setelah persilangan sendiri buatan (selfing). Perlakuan waktu pemberian kolkisin yang diujikan adalah 3 hari setelah selfing, 10 hari setelah
selfing, dan kontrol tanpa pemberian kolkisin. Konsentrasi kolkisin yang digunakan pada perlakuan adalah 500 mg L-1 dengan lama perlakuan 5 hari. Setiap perlakuan menggunakan 14 ulangan, setiap ulangan terdiri dari satu bunga
Phal. amabilis sehingga terdapat 42 bunga Phal. amabilis sebagai satuan amatan. Variabel pertumbuhan buah seperti panjang tangkai sampai ujung, panjang, dan diameter buah mulai diamati pada 4 Minggu Setelah Selfing (MSSf). Jumlah buah yang dihasilkan dan bobot buah diamati pada 18 MSSf. Kisaran jumlah
11
bobot buah dianalisis menggunakan SAS 9.1.3 portable. Model aditif linear yang digunakan adalah : amabilis setelah persilangan sendiri buatan ke-i ulangan ke-j
µ : Nilai tengah umum
αi : Pengaruh perlakuan waktu perlakuan kolkisin pada bunga Phal. amabilis
setelah persilangan sendiri buatan ke-i
εij : Galat percobaan perlakuan waktu perlakuan kolkisin pada bunga Phal. amabilis setelah persilangan sendiri buatan ke-i, ulangan ke-j
Data dianalisis dengan sidik ragam berdasarkan uji-F pada taraf 5%, pada hasil uji-F nyata maka uji lanjut yang digunakan terhadap hasil dari rancangan kelompok lengkap teracak adalah uji Tukey pada α < 5%.
Percobaan 2: pengaruh lama perendaman Phal. amabilis pada kolkisin untuk induksi poliploid secara in vitro.
Rancangan percobaan yang digunakan adalah Rancangan Kelompok Lengkap Teracak (RKLT) dengan satu faktor yaitu lama perendaman planlet
Phal. amabilis pada kolkisin. Perlakuan lama perendaman yang diujikan adalah 5, 10, 15 hari perendaman tanpa kolkisin dan 5, 10, 15 hari perlakuan perendaman pada kolkisin. Konsentrasi kolkisin yang digunakan pada perlakuan dengan kolkisin adalah 25 mg L-1. Kolkisin dimasukan kedalam media Hyponex cair + air kelapa 15% dengan volume total 20 ml pada botol kultur untuk perlakuan lama perendaman kolkisin dan media Hyponex cair + air kelapa 15% dengan volume 20 ml tanpa penambahan kolkisin pada botol kultur untuk perendaman tanpa kolkisin. Botol kultur yang berisi planlet Phal. amabilis diletakkan pada shaker dengan kecepatan rotasi 100 rpm dengan lama sesuai perlakuan. Setelah perendaman, planlet dibilas tiga kali menggunakan akuades steril lalu disubkultur pada media pemulihan MS ½ + air kelapa 15%.
Perlakuan lama perendaman kolkisin disusun secara RKLT faktor tunggal dengan 5 ulangan dan 6 taraf, setiap ulangan terdiri dari satu botol kultur sehingga total satuan percobaan 30 botol kultur. Lima planlet ditanam pada setiap botol kultur sehingga terdapat 150 planlet sebagai satuan amatan. Variabel pertumbuhan seperti rata-rata pertambahan jumlah daun, akar, dan pembentukan Protocorm Like Body (PLBs) mulai diamati pada 2 Minggu Setelah Subkultur (MSSk) dan dianalisis menggunakan SAS 9.1.3 portable. Pengamatan jumlah kromosom pada ulangan I mulai diamati pada 12 MSSk. Sampel pada pengamatan jumlah kromosom adalah akar planlet. Model aditif linear yang digunakan adalah:
Yij = µ + αi + γj+ εij Keterangan :
12
Yij : Respon terhadap perlakuan lama perendaman planlet Phal. amabilis
dengan kolkisin ke-i ulangan ke-j µ : Nilai tengah umum
αi : Pengaruh perlakuan lama perendaman planlet Phal. amabilis dengan kolkisin ke-i
γj : Pengaruh ulangan ke-j
εij : Galat percobaan perlakuan lama perendaman planlet Phal. amabilis
dengan kolkisin ke-i, ulangan ke-j
Data dianalisis dengan sidik ragam berdasarkan uji-F pada taraf 5%, pada hasil uji-F nyata maka uji lanjut yang digunakan terhadap hasil dari rancangan kelompok lengkap teracak adalah uji Duncan’s Multiple Range Test (DMRT) pada
Probability(α<5%).
Metode Pelaksanaan
Percobaan 1: pengaruh perlakuan kolkisin pada bunga Phal. amabilis setelah penyerbukan untuk induksi poliploid.
Perlakuan kolkisin pada bunga Phal. amabilis
Bunga anggrek Phal. amabilis yang sedang mekar dilakukan penyerbukan sendiri buatan (selfing). Bunga dikastrasi, dibungkus dengan kapas, diolesi kolkisin dengan konsentrasi 500 mg L-1 pada waktu sesuai perlakuan, dan ditutup dengan aluminium foil selama 5 hari. Metode perlakuan dan konsentrasi kolkisin pada bunga Phal. amabilis sesuai dengan metode penelitian Azmi (2015) yang terbukti dapat menghasilkan planlet Phal. amabilis poliploid. Waktu perlakuan kolkisin disesuaikan dengan perlakuan. Buah anggrek hasil perlakuan dan kontrol dipanen pada 18 MSSf dan disemai secara in vitro pada media MS ½ + air kelapa 15%.
Pengamatan penelitian
1. Panjang pangkal sampai ujung buah
Pengukuran menggunakan benang yang nantinya diukur kembali menggunakan penggaris. Pengukuran dilakukan dari pangkal buah yang menempel pada peduncle sampai ujung buah (Gambar 1). Pengukuran panjang pangkal sampai ujung buah dilakukan 2 minggu sekali.
2. Panjang buah
Panjang buah merupakan panjang pangkal buah yang mulai membengkak sampai ujung buah. Pengukuran menggunakan benang yang nantinya diukur kembali menggunakan penggaris. Pengukuran dilakukan dari pangkal buah yang mulai membengkak sampai ke ujung buah (Gambar 1). Pengukuran panjang buah dilakukan 2 minggu sekali.
3. Diameter buah
14
Media padat MS ½ dibuat dengan memipet larutan makro dan mikro sesuai dengan volume takaran, ditambahkan 30 g L-1 gula, 5 ml L-1 Myo-inositol, 5 ml L-1 Vitamin, 5 ml L-1 FeDTA, air kelapa 15%. Pengaturan pH media menjadi 5.8 menggunakan HCl atau KOH dilakukan setelah penambahan gula, Myo, Vitamin, dan FeDTA. Media ditambahkan agar 7 g L-1 kemudian dimasak hingga mendidih. Media yang telah dimasak dimasukkan ke dalam botol kultur dan ditutup dengan plastik yang diikat menggunakan karet. Pembuatan satu liter media dapat digunakan untuk 40 botol kultur.
Botol kultur yang berisikan media disterilisasi kembali menggunakan
autoclave selama 20 menit pada suhu 121oC pada tekanan 17.5 psi sebelum dimasukkan ke ruang kultur. Media disimpan selama satu minggu sebelum digunakan untuk mengetahui bahwa media yang dibuat telah benar–benar bebas dari kontaminan.
Pembuatan larutan stok kolkisin
Kolkisin ditimbang sebanyak 100 mg, kemudian dilarutkan dalam 100 ml aquadest dalam keadaan steril. Larutan stok kolkisin dengan konsentrasi 1000 mg L-1 dilarutkan dengan cara diaduk menggunakan sudip agar homogen. 0.5 ml larutan stok kolkisin ditambahkan kedalam media cair pupuk lengkap sehingga volume total media cair menjadi 20 ml dalam keadaan steril untuk perlakuan lama perendaman kolkisin. Larutan stok kolkisin disimpan di lemari pendingin.
Perlakuan dan subkultur
Perlakuan dilakukan dalam keadaan steril di dalam Laminar. Planlet Phal. amabilis direndam pada media cair pupuk lengkap + air kelapa 15% untuk perendaman tanpa kolkisin dan pupuk lengkap 2 g L-1 + air kelapa 15% + kolkisin 25 mg L-1 untuk perlakuan lama perendaman kolkisin. Lama perendaman terdiri dari 6 taraf yaitu 5, 10, 15 hari perendaman tanpa kolkisin dan dengan kolkisin. Botol kultur yang berisi planlet Phal. amabilis diletakkan pada shaker dengan kecepatan rotasi 100 rpm dengan lama sesuai perlakuan. Planlet Phal. amabilis
yang telah direndam sesuai dengan lama perendaman dibersihkan dengan akuades sebanyak tiga kali dan disubkultur pada media padat MS ½ + air kelapa 15%. Jumlah planlet yang disubkultur yaitu 5 planlet per botol.
Pengamatan penelitian
Pengamatan dibagi menjadi dua bagian yaitu pengamatan selama 10 MSSk dan setelah 10 MSSk. Berikut adalah parameter yang diamati selama pengamatan.
Pengamatan selama 10 MSSk
1. Rata-rata jumlah pertambahan daun
Daun yang diamati hanya daun yang terbuka sempurna. Pengamatan jumlah daun dilakukan 2 minggu sekali.
2. Rata-rata jumlah pertambahan akar
Diamati dengan menghitung jumlah akar yang tumbuh. Pengamatan jumlah akar dilakukan 2 minggu sekali.
15
Diamati dengan menghitung PLBs yang tumbuh. Pengamatan jumlah
PLBs dikalakukan 2 minggu sekali. Pengamatan setelah 10 MSSk
Jumlah Kromosom
HASIL DAN PEMBAHASAN
Percobaan 1: Pengaruh perlakuan kolkisin pada bunga Phal. amabilis pasca penyerbukan untuk induksi poliploid
Perubahan karakteristik bunga Phal. amabilis pada tiga hari setelah selfing
terlihat pada stigma bunga yang mulai menutup dan kelopak yang mulai layu. Bunga Phal. amabilis perlakuan kolkisin dan tanpa perlakuan kolkisin mampu berkembang menjadi buah. Namun, ada beberapa buah perlakuan kolkisin dan tanpa perlakuan kolkisin yang tidak berkembang menjadi buah atau rontok sebelum dapat dipanen. Jumlah buah yang terbentuk disajikan pada Tabel 2. Buah yang mengalami kerontokan diduga disebabkan berbagai faktor, diantaranya kekeringan dan terserang hama kutu gajah.
Tabel 2 Jumlah bunga, jumlah buah, dan persen jumlah buah Phal. amabilis yang dihasilkan pada perlakuan waktu pemberian kolkisin saat 18 MSSf
Waktu perlakuan kolkisin Jumlah bunga Jumlah buah Persen jumlah buah
Kontrol 14 7 50
3 hari setelah selfing 14 7 50
10 hari setelah selfing 14 11 78.58
Perlakuan waktu pemberian menurunkan (P<0.05) rata-rata panjang tangkai sampai ujung buah Phal. amabilis pada 6 sampai 10 MSSf (Tabel 3). Rata-rata panjang tangkai sampai ujung buah perlakuan 3 dan 10 hari setelah
selfing tidak berbeda nyata, tetapi berbeda nyata dengan kontrol pada 6 sampai 10 MSSf. Perlakuan 3 dan 10 hari setelah selfing menurunkan 23.02 dan 25.92% rata-rata panjang tangkai sampai ujung buah Phal. amabilis saat 10 MSSf.
Penurunan panjang tangkai sampai ujung buah terbesar dan terkecil terjadi pada perlakuan 10 hari setelah selfing saat 6 MSSf (28.18%) dan 3 hari setelah selfing
saat 4 MSSf (16.94%). Rata-rata panjang tangkai sampai ujung buah pada perlakuan 10 hari setelah selfing konsisten paling kecil dari perlakuan lainnya pada 4 sampai 10 MSSf. Rata-rata panjang tangkai sampai ujung buah pada kontrol konsisten paling besar diantara perlakuan lainnya pada 4 sampai 10 MSSf. Perlakuan waktu pemberian kolkisin menurunkan (P<0.05) rata-rata panjang buah Phal. amabilis pada 4 sampai 10 MSSf (Tabel 4). Rata-rata panjang buah perlakuan 3 dan 10 hari setelah selfing tidak berbeda nyata, tetapi berbeda nyata dengan kontrol pada 4 sampai 10 MSSf. Perlakuan 3 dan 10 hari setelah
selfing menurunkan 37.69 dan 38.58% rata-rata panjang buah Phal. amabilis saat 10 MSSf. Penurunan panjang buah terbesar dan terkecil terjadi pada perlakuan 3 hari setelah selfing saat 4 MSSf (45.92%) dan 10 MSSf (37.69%). Kontrol konsisten memiliki rata-rata panjang buah tertinggi dari perlakuan lainnya pada 4 sampai 10 MSSf.
17
(33.07%). Terdapat kenaikan diameter buah pada perlakuan 10 hari setelah selfing
terhadap kontrol pada 4 MSSf (1.66%). Pemberian 3 hari setelah selfing konsisten memiliki rata-rata diameter buah terkecil diantara perlakuan lainnya pada 4 sampai 10 MSSf.
tn = tidak berbeda nyata pada taraf 5%, (**) = berbeda sangat nyata pada taraf 5%, KK =
Koefisien Keragaman, MSSf = Minggu Setelah Selfing. Angka-angka yang disertai huruf
yang sama pada kolom yang sama tidak berbeda nyata berdasarkan uji Tukey pada α<5%
Tabel 4 Rata-rata panjang buah Phal. amabilis pada perlakuan waktu pemberian kolkisin
(**) = berbeda sangat nyata pada taraf 5%, KK = Koefisien Keragaman, MSSf = Minggu
Setelah Selfing. Angka-angka yang disertai huruf yang sama pada kolom yang sama tidak
berbeda nyata berdasarkan uji Tukey pada α<5%
Tabel 5 Rata-rata diameter buah Phal. amabilis pada perlakuan waktu pemberian kolkisin
(**) = berbeda sangat nyata pada taraf 5%, KK = Koefisien Keragaman, MSSf = Minggu
Setelah Selfing. Angka-angka yang disertai huruf yang sama pada kolom yang sama tidak
berbeda nyata berdasarkan uji Tukey pada α<5%
19
tidak terbentuknya biji didalam buah dan atau terbentuk biji didalam buah tetapi tidak viabel (Azmi 2015).
Gambar 3 Pengaruh perlakuan waktu pemberian kolkisin terhadap rata-rata bobot buah Phal. amabilis pada 18 MSSf. Angka-angka yang disertai huruf yang sama tidak berbeda nyata berdasarkan uji Tukey padaα<5% Jumlah buah yang terbentuk dari bunga pada kontrol, perlakuan 3,dan 10 hari setelah selfing secara berurutan adalah 7, 7, dan 11 buah. Jumlah buah yang terbentuk pada kontrol berkurang karena tanaman kontrol terserang hama kutu gajah. Jumlah buah yang menghasilkan protocorm pada kontrol, perlakuan 3, dan 10 hari setelah selfing secara berurutan adalah 6, 3, dan 9 buah. Penelitian Azmi (2015) menghasilkan 85.71% jumlah buah terbentuk, 33.33% buah menghasilkan
protocorm, dan kisaran jumlah protocorm perbuah sedang (250>protocorm>50) pada perlakuan pemberian kolkisin pada bunga Phal. amabilis 3 hari setelah
selfing.
Diameter buah, jumlah buah yang terbentuk, jumlah buah yang menghasilkan protocorm, dan kisaran jumlah protocorm yang dihasilkan perlakuan 10 hari setelah selfing lebih banyak dari perlakuan 3 hari setelah selfing
diduga disebabkan oleh perlakuan waktu pemberian kolkisin pada bunga pasca penyerbukan. Bunga Phal. amabilis 3 hari setelah selfing diduga lebih peka terhadap efek toxic dari kolkisin dari pada bunga Phal. amabilis 10 hari setelah
selfing. Hai ini mempengaruhi kemampuan bunga Phal. amabilis untuk menghasilkan buah, menghasilkan biji viable, dan berkecambah menjadi
protocorm secara in vitro.
Penelitian Lee et al. (2008) membuktikan bahwa embio pada Phal. amabilis var. formosa mulai terbentuk pada 60 hari setelah penyerbukan. Azmi (2015) menduga bahwa apabila fertilisasi Phal. amabilis baru terjadi sekitar 2 bulan setelah penyerbukan, perlakuan kolkisin pada buah Phal. amabilis saat
20
kurang dari 2 bulan setelah penyerbukan akan menghasilkan planlet triploid. Planlet triploid dihasilkan dari penggabungan gamet betina diploid dan gamet jantan haploid. Perlakuan kolkisin 3 dan 10 hari setelah penyerbukan bunga Phal. amabilisi akan menginduksi sel somatik pada proses diferensiasi ovarium sehingga menghasilkan sel gamet betina diploid. Sel gamet jantan yang sedang meninduksi pembentukan gamet betina tidak mengalami pembelahan sehingga tidak terjadi penggandaan kromosom karena pengaruh kolkisin, sehingga sel gamet jantan tetap haploid.
Tabel 6 Jumlah buah, jumlah buah yang menghasilkan protocorm, dan kisaran jumlah protocorm perbuah Phal. amabilis pada perlakuan waktu pemberian kolkisin
Pengamatan pembentukan protocorm dilakukan pada 7 Minggu Setelah Semai (MSS), (a)
= angka didalam kurung menunjukkan data persen (%) terhadap jumlah buah
Penelitian perlakuan waktu pemberian kolkisin pada bunga Phal. amabilis
23
0.17 daun, tetapi tidak berbeda nyata dengan perlakuan lama perendaman kolkisin 5 dan 10 hari serta perendaman tanpa kolksin 5 hari.
Tabel 7 Rata-rata pertambahan jumlah PLBs per planlet pada perlakuan lama perendaman planlet Phal. amabilis pada kolkisin
Perlakuan Lama Perendaman (hari)
Rata–rata pertambahan jumlah PLBs
per planlet perendaman planlet Phal. amabilis pada kolkisin
Perlakuan
Rata–rata pertambahan daun per planlet Rata-rata daun
Perbedaan pertambahan jumlah daun diduga akibat perlakuan perendaman dan lama perendaman pada kolkisin menghambat pertambahan jumlah daun planlet Phal. amabilis pada 2 MSSk. Perlakuan lama perendaman kolkisin 15 hari secara konsisten menunjukkan rata-rata pertambahan jumlah daun paling rendah dari perlakuan lainnya pada 2 sampai 8 MSSk. Kondisi daun planlet
25
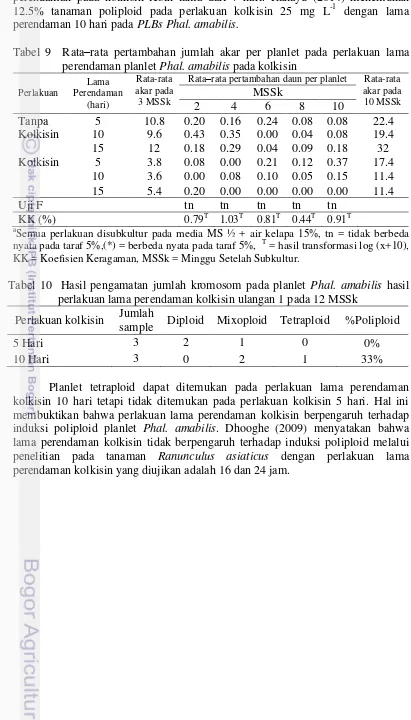
perendaman pada kolkisin lebih lama dari 7 hari. Rahayu (2014) menemukan 12.5% tanaman poliploid pada perlakuan kolkisin 25 mg L-1 dengan lama perendaman 10 hari pada PLBs Phal. amabilis.
Tabel 9 Rata–rata pertambahan jumlah akar per planlet pada perlakuan lama perendaman planlet Phal. amabilis pada kolkisin
Perlakuan
Rata–rata pertambahan daun per planlet Rata-rata akar pada
nyata pada taraf 5%,(*) = berbeda nyata pada taraf 5%, T = hasil transformasi log (x+10),
KK = Koefisien Keragaman, MSSk = Minggu Setelah Subkultur.
Tabel 10 Hasil pengamatan jumlah kromosom pada planlet Phal. amabilis hasil perlakuan lama perendaman kolkisin ulangan 1 pada 12 MSSk
Perlakuan kolkisin Jumlah
sample Diploid Mixoploid Tetraploid %Poliploid
5 Hari 3 2 1 0 0%
10 Hari 3 0 2 1 33%
SIMPULAN DAN SARAN
Simpulan
Perlakuan waktu pemberian kolkisin pada bunga Phal. amabilis pasca penyerbukan menekan pertumbuhan buah. Terdapat keragaman hasil jumlah procorm dari buah-buah yang ditanam. Perlakuan yang terbaik berdasarkan kisaran jumlah protocorm yang dihasilkan adalah perlakuan kolkisin 10 hari setelah selfing.
Perlakuan lama perendaman pada kolkisin secara umum tidak berpengaruh terhadap pertumbuhan planlet Phal. amabilis, tetapi berpengaruh terhadap induksi poliploid planlet Phal. amabilis. Perlakuan lama perendaman kolkisin 10 hari dapat menghasilkan planlet Phal. amabilis poliploid.
Saran
Penelitian lanjutan perlu dilakukan untuk mengamati pertumbuhan dan sitologi planlet Phal. amabilis hasil perlakuan waktu pemberian kolkisin 500 mg L-1 selama 5 hari pada bunga pasca penyerbukan. Perlu dilakukan penelitian lanjutan untuk mengamati pengaruh lama perendaman kolkisin 25 mg L-1 planlet
DAFTAR PUSTAKA
Andini N. 2013. Pertumbuhan PLBs dua populasi hasil persilangan anggrek
Phalaenopsis padabeberapa komposisi media [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Azmi TKK. 2015. Induksi poliploid anggrek bulan (Phalaenopsis sp.)
menggunakan kolkisin pada organ generatif dan protocorm [tesis]. Bogor (ID): Institut Pertanian Bogor.
[DEPTAN]. Departemen Pertanian. 2014. Basisdata Ekspor-Impor Komoditi Pertanian Hortikultura Tahun 2012 sampai dengan Saat Ini. [Internet].
[diunduh 2014 Des 02]. Tersedia pada:
www.database.deptan.go.id/eksim2012/.
Dhooghe E, Denis S, Eeckhaut T, Reheul D, Labeke MCV. 2009. In vitro introduction of tetraploids in ornamental Ranunculus. Euphytica. 168:33-40.doi: 10.1007/s10681-008-9876-1.
Dhooghe E, van Laere K, Eeckhaut T, Leus L, van Huylenbroeck J. 2011. Mitotic cromosome doubling of plant tissue in vitro. Plant Cell Tiss Organ Cult.
104: 359-373.
Dwiarum AC. 2007. Pengaruh komposisi media kultur in vitro dengan bahan organik terhadap pertumbuhan PLBs anggrek Phalaenopsis serpentilingua
[Skripsi]. Bogor (ID): Institut Pertanian Bogor.
Eigsti OJ, Dustin P. 1957. Colchicinein Agriculture, Medicine, Biology, and Chemistry. Iowa(US): Iowa State College Pr.
Fauziah N. 2013. Karakterisasi morfologi anggrek Phalaenopsis spp. spesies asli Indonesia [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Handini E, Isnaini Y, Wati RK, Cahyaningsih R, Wawangningrum H. 2012.
Mengenal Anggrek Tanduk Rusa (Phalaenopsis Cornu-cervi (Breda) Blume & Rchb. F.) dan Teknik Budidayanya. Bogor (ID): Pusat Konservasi Tumbuhan Kebun Raya Bogor.
Hew CS, Yong JWH. 1997. The Physiology of Tropical Orchid in Relation to the Industry. Singapore: World Scientific Publishing Co. Pte. Ltd.
29
Lestari EG. 2008. Kultur Jaringan. Bogor (ID): AkaDemiA.
Ling A. C. K., Yap C. P., Shaib J. M., and Vilasini P. 2007. Induction and morphogenesis of Phalaenopsis callus. J. Trop. Agric. And Fd. Sc. 35(1): 147-152.
Nilanthi D, Chen XL, Zhao FC, yang YS, Wu H. 2009. Induction of tetrapliods from petiole explants through colchicine treatments in Echinacea purpurela L. J Biomed Biotech. 1-7.doi:10.1155/2009/343485.
Pangestu F. 2014. Karakterisasi Morfologi Anggrek Phalaenopsis Hibrid [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Pierik RLM. 1987. In Vitro Culture of Higher Plant. London (EN): Martinus Nijhoff Publisher.
Prasetio B. 2010. 23 Peluang Usaha Top Bidang Agribisnis. Yogyakarta (ID): Andi Publisher.
Putri HA. 2015. Pengaruh komposisi media dasar dan kitosan terhadap pertumbuhan Protocorm Like Bodies (PLBs) dan planlet anggrek
phalaenopsis hibrida [skripsi]. Bogor (ID): Institut Pertanian Bogor. Rachmatullah. 2009. Penggunaan Hyponex dan bubur pepaya dalam pembesaran
planlet Anggrek Dendrobium “kanayao” secara in vitro dan perlakuan media aklimatisasi [skripsi] . Bogor (ID): Institut Pertanian Bogor.
Rahayu EMD. 2014. Induksi poliploidi Phalaenopsis amabilis (L.) Blume dan
Phalaenopsis amboinensis J.J. Smith menggunakan kolkisin secara in vitro dan in vivo [tesis]. Bogor (ID): Institut Pertanian Bogor.
Raynalta E. 2013. Pengaruh komposisi media dalam pertumbuhan protocorm like bodies, planlet, dan aklimatisasi Phalaenopsis amabilis [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Rukmana HR. 2000. Anggrek Bulan. Yogyakarta (ID): Kanisius.
Sandra E. 2013. Cara Mudah Memahami dan Menguasai Kultur Jaringan Skala Rumah Tangga. Bogor (ID): IPB Press.
Santoso HB. 2006. 8 Tanaman Hias Paling Populer. Jakarta (ID): AgroMedia Pustaka.
Santoso U, Nursandi F. 2001. Kultur Jaringan Tanaman. Malang (ID): UMM-Press.
Sastrapradja S, Nasution RE, Irawati, Soerojo L, Imelda M, Idris S, Soerohaldoko S, Roedjito W. 1976. Anggrek Indonesia. Jakarta (ID): Balai Pustaka. Setiawan H. 2002. Usaha Pembesaran Anggrek. Depok: Penebar Swadaya.
Surachman D. 2011. Teknik pemanfaatan air kelapa untuk perbanyakan nilam secara in vitro. Bul Teknik Pertanian. 16(1):31-33.
Suryo H. 1995. Sitogenetika. Yogyakarta (ID): Gajah Mada University Press. Tsai CC. 2001. Molecular Phylogeny and Biogeography of Phalaenopsis Species.
Di dalam: Chen WH, Chen HH, editor. Orchid Biotechnology II.
Singapore: World Scientific Publishing Co. Pte. Ltd. hlm 1-22.
Wardana H. 2012. Kenali Lebih Dekat Phalaenopsis amabilis, Bunga Nasional Indonesia. [Internet]. [diunduh 2016 Mar 07]. Tersedia pada: http://www.kompasiana.com/wardhanahendra/kenali-lebih-dekat-phalaeno psis-amabilis-bunga-nasional-indonesia_55107cec813311ca35bc6712. Widiastoety D, Bahar FA 1995. Pengaruh intensitas cahaya terhadap pertumbuhan
30
Widiarsih S, Dwimahyani I. 2008. Pengaruh Dosis Iridasi Sinar Gamma Terhadap Laju Pertumbuhan Anggrek Bulan (Phalaenopsis amabilis (L.)Bl.) Pada Fase Aklimatissasi dan Vegetatif Awal. Prosiding Simposium dan Pameran Teknologi Aplikasi Isotop dan Radiasi. Mugianto et al, editor. Jakarta (ID): Pusat Aplikasi Teknologi Isotop dan Radiasi – BATAN.
Wu H, Zheng S, He Y, Yan G, Bi Y, Zhu Y. 2007. Diploid female gametes induced by Colchicines in Oriental lilies. Sci Hort. 114: 50-53.
Yuliarti N. 2010. Kultur Jaringan Tanaman Skala Rumah Tangga. Yogyakarta (ID): Lily Publisher.
Yusnita. 2012. Pemulyaan Tanaman untuk Menghasilkan Anggrek Hibrida Unggul. Lampung (ID): Lembaga Penelitian Universitas Lampung.
LAMPIRAN
Lampiran 1 Pengamatan kromosom sel akar planlet Phal. amabilis ulangan I perlakuan lama perendaman planlet Phal. amabilis pada kolkisin yang diamati dengan mikroskop cahaya perbesaran 1000x
34