PENGGUNAAN HYPONEX DAN BUBUR PEPAYA
DALAM PEMBESARAN PLANLET ANGGREK
DENDROBIUM “Kanayao” SECARA
IN VITRO
DAN
PERLAKUAN MEDIA AKLIMATISASI
Oleh:
RACHMATULLAH A34302039
PROGRAM STUDI HORTIKULTURA
FAKULTAS PERTANIAN
RINGKASAN
RACHMATULLAH. Penggunaan Hyponex dan Bubur Pepaya dalam Pembesaran Planlet Anggrek Dendrobium ”Kanayao” secara In Vitro dan Perlakuan Media Aklimatisasi. (Dibimbing oleh AGUS PURWITO).
Penelitian ini dilaksanakan untuk mempelajari kombinasi Hyponex dan bubur pepaya yang terbaik dalam pembesaran planlet anggrek Dendrobium ‘Kanayao” secara in vitro sebagai alternatif pengganti media MS dan mempelajari media tanam terbaik dalam aklimatisasi bibit anggrek Dendrobium.
Penelitian terdiri dari dua percobaan terpisah yaitu pembesaran anggrek Dendrobium secara in vitro dan perlakuan media aklimatisasi. Rancangan yang digunakan pada kedua percobaan tersebut yaitu Rancangan Acak Lengkap (RAL) dengan faktor tunggal. Perlakuan pada percobaan pembesaran terdiri dari MS0 + vitamin (M1), Hyponex 1 g + vitamin (M2), Hyponex 2 g + vitamin (M3), Hyponex 1 g + pepaya 50 g (M4), Hyponex 1 g + pepaya 100 g (M5), Hyponex 1 g + pepaya 150 g (M6), Hyponex 2 g + pepaya 50 g (M7), Hyponex 2 g + pepaya 100 g (M8), Hyponex 2 g + pepaya 150 g (M9). Masing-masing perlakuan terdiri dari dua ulangan dengan10 botol tiap ulangan dan 2 tanaman dalam satu botol. Perlakuan pada percobaan media aklimatisasi yaitu Arang sekam (A1), Sphagnum moss (A2), Serbuk pakis (A3), dan Cocopeat (A4). Masing-masing perlakuan terdiri dari 5 ulangan dengan 10 tanaman tiap ulangan.
Eksplan percobaan pembesaran planlet berasal dari planlet plb (protocorm like bodies) Dendrobium “Kanayao“ steril. Planlet dipilih dengan tinggi lebih-kurang 3mm dan ditanam secara tunggal. Sedangkan bahan tanam percobaan media aklimatisasi menggunakan bibit Dendrobium “Mahlini ‘Kamiya’ x Kahleen Wee” hasil perbanyakan generatif yang siap aklimatisasi.
Hasil percobaan pembesaran planlet Dendrobium menunjukkan perkembangan secara umum yang baik, akan tetapi penambahan bubur pepaya mengakibatkan pertumbuhan lebih rendah. Perlakuan media pada peubah jumlah daun menunjukkan sangat berpengaruh nyata. Sedangkan pada peubah jumlah akar dan jumlah planlet menunjukkan tidak berpengaruh nyata hingga akhir pengamatan pada minggu ke-20. Peubah tinggi planlet di akhir pengamatan pada minggu ke-20 menunjukkan pengaruh nyata. Demikian pula peubah panjang daun, lebar daun dan panjang akar menunjukkan pengaruh sangat nyata.
Hasil percobaan aklimatisasi menunjukkan pertumbuhan planlet secara umum kurang baik. Faktor utama penyebabnya dimungkinkan karena serangan cendawan. Hal ini dapat dilihat dari bercak berwarna putih tepung dan hitam pada media dan pangkal planlet.
PENGGUNAAN HYPONEX DAN BUBUR PEPAYA
DALAM PEMBESARAN PLANLET ANGGREK
DENDROBIUM “Kanayao” SECARA
IN VITRO
DAN
PERLAKUAN MEDIA AKLIMATISASI
Skripsi sebagai salah satu syarat
untuk memperoleh gelar Sarjana Pertanian pada Fakultas Pertanian Institut Pertanian Bogor
0leh:
RACHMATULLAH A34302039
PROGRAM STUDI HORTIKULTURA
FAKULTAS PERTANIAN
LEMBAR PENGESAHAN
Judul : PENGGUNAAN HYPONEX DAN BUBUR PEPAYA DALAM PEMBESARAN ANGGREK DENDROBIUM “Kanayao” SECARA IN VITRO DAN PERLAKUAN MEDIA AKLIMATISASI
Nama : Rachmatullah NRP : A34302039
Menyetujui, Dosen Pembimbing
Dr Ir Agus Purwito, MSc. NIP.131 681 405
Mengetahui, Dekan Fakultas Pertanian
Prof. Dr Ir Didy Sopandie, M. Agr. NIP. 131 124 019
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 17 Mei 1983. Penulis adalah putra pertama dari lima bersaudara keluarga Munidin dan Wijiyanti.
Penulis memulai pendidikannya di taman kanak-kanak Ilham Jakarta Utara pada tahun 1988. Tahun 1989 penulis melanjutkan ke pendidikan dasar di SDN Kemala Bhayangkari 1 Jakarta Utara selama enam tahun. Kemudian tahun 1995 penulis melanjutkan pendidikan di SLTPN 1 Wonopringgo Kabupaten Pekalongan dan selesai pada tahun 1998. Pada tahun 1999 penulis melanjutkan pendidikan di SMUN 1 Kedungwuni Kabupaten Pekalongan. Tahun 2002 penulis diterima di Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB (USMI) sebagai mahasiswa Program Studi Hortikultura, Departemen Agronomi dan Hortikultura, Fakultas Pertanian.
KATA PENGANTAR
Puji syukur kita ucapkan kepada Allah SWT karena rahmat dan hidayah-Nya penulis dapat menyelesaikan penelitian ini.
Penelitian yang berjudul “Penggunaan Hyponex dan Bubur Pepaya dalam Pembesaran Planlet Anggrek Dendrobium “Kanayao” secara in Vitro dan Perlakuan Media Aklimatisasi” dilaksanakan sebagai tugas akhir dalam menyelesaikan pendidikan penulis di Program Studi Hortikultura, Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor.
Penulis menyampaikan terima kasih kepada Dr Ir Agus Purwito, MSc. sebagai pembimbing penelitian yang telah memberikan arahan dan bimbingan kepada penulis, Dr Dewi Sukma, Sp. Msi. sebagai dosen penguji dan pembimbing akademik yang dengan sabar menyemangati penulis dalam menyelesaikan pendidikan S1, Dr Ir Darda Effendi MSc. sebagai dosen penguji, Dr Ir Elis Nina Herliana MSc. dan keluarga sebagai pembimbing spiritual, motivator, teman berkeluh kesah dan seperti keluarga bagi penulis. Bapak, Ibu serta adik-adik yang saya cintai sebagai keluarga yang utuh dan tidak tergantikan, Dik Rima yang saya sayangi, dan rekan-rekan Hortikultura yang senantiasa memberikan do’a dan semangat kepada penulis.
Semoga penelitian ini dapat bermanfaat bagi penulis dan semua pihak yang berkepentingan.
Bogor,
DAFTAR ISI Keluarga Anggrek (Orchidaceae)... 4
Botani Anggrek Dendrobium... 7
Syarat Tumbuh Anggrek Dendrobium... 8
Perbanyakan Anggrek Dendrobium... 8
Kultur Jaringan Anggrek... 9
Pupuk Lengkap sebagai Pengganti Media MS... 10
Bahan Organik... 11
Rancangan Penelitian... 14
Pelaksanaan Penelitian... 16
Pengamatan... 18
HASIL DAN PEMBAHASAN Percobaan Pembesaran Planlet In Vitro... 20
Percobaan Media Aklimatisasi... 28
KESIMPULAN DAN SARAN Kesimpulan... 35
Saran... 35
DAFTAR PUSTAKA... 36
DAFTAR TABEL
Nomor Halaman
Teks
1. Rekapitulasi Sidik Ragam Jumlah Daun, Jumlah Akar, Tinggi Tunas, Panjang Daun, Lebar Daun, dan Panjang
Akar Anggrek Dendrobium……….. 21 2. Pengaruh Komposisi Media Pembesaran terhadap Rataan
Jumlah Daun AnggrekDendrobium selama 20 MST……..……. 23 3. Pengaruh Komposisi Media Pembesaran terhadap Rataan
Jumlah Akar AnggrekDendrobium selama 20 MST…………... 25 4. Pengaruh Komposisi Media Pembesaran terhadap Rataan
Tinggi Tunas, Panjang Daun, Lebar Daun, dan Panjang Akar
AnggrekDendrobium pada 20 MST……….. 26 5. Rekapitulasi Sidik Ragam Jumlah Daun, Tinggi Tunas,
Panjang Daun, dan Lebar Daun Anggrek Dendrobium selama
Aklimatisasi………..…...…... 30 6. Pengaruh Komposisi Media Aklimatisasi terhadap Rataan
Jumlah Daun Anggrek Dendrobium selama 12 MST……..……. 32 7. Pengaruh Komposisi Media Aklimatisasi terhadap Rataan
Tinggi Tunas, Panjang Daun, dan Lebar Daun Anggrek
Dendrobium pada 12 MST………..……….. 33
Lampiran
1. Komposisi Media Murashige dan Skoog (1962)... 40 2. Komposisi Hyponex 20-20-20... 41 3. Daftar Komposisi Bahan Organik yang Sering Digunakan
dalam Kultur In Vitro... 42 4. Sidik Ragam Jumlah Daun Anggrek Dendrobium pada
Perlakuan In Vitro... 43 5. Sidik Ragam Jumlah Akar Anggrek Dendrobium pada
Perlakuan In Vitro... 44 6. Sidik Ragam Tinggi, Panjang Daun, Lebar Daun dan Panjang
Akar Anggrek Dendrobium pada 20 MST Perlakuan In Vitro... 45 7. Sidik Ragam Persentase Hidup Anggrek Dendrobium pada
Perlakuan Aklimatisasi... 46 8. Sidik Ragam Jumlah Daun Anggrek Dendrobium pada
9. Sidik Ragam Tinggi Tunas, Panjang dan Lebar Daun Anggrek
PENGGUNAAN HYPONEX DAN BUBUR PEPAYA
DALAM PEMBESARAN PLANLET ANGGREK
DENDROBIUM “Kanayao” SECARA
IN VITRO
DAN
PERLAKUAN MEDIA AKLIMATISASI
Oleh:
RACHMATULLAH A34302039
PROGRAM STUDI HORTIKULTURA
FAKULTAS PERTANIAN
RINGKASAN
RACHMATULLAH. Penggunaan Hyponex dan Bubur Pepaya dalam Pembesaran Planlet Anggrek Dendrobium ”Kanayao” secara In Vitro dan Perlakuan Media Aklimatisasi. (Dibimbing oleh AGUS PURWITO).
Penelitian ini dilaksanakan untuk mempelajari kombinasi Hyponex dan bubur pepaya yang terbaik dalam pembesaran planlet anggrek Dendrobium ‘Kanayao” secara in vitro sebagai alternatif pengganti media MS dan mempelajari media tanam terbaik dalam aklimatisasi bibit anggrek Dendrobium.
Penelitian terdiri dari dua percobaan terpisah yaitu pembesaran anggrek Dendrobium secara in vitro dan perlakuan media aklimatisasi. Rancangan yang digunakan pada kedua percobaan tersebut yaitu Rancangan Acak Lengkap (RAL) dengan faktor tunggal. Perlakuan pada percobaan pembesaran terdiri dari MS0 + vitamin (M1), Hyponex 1 g + vitamin (M2), Hyponex 2 g + vitamin (M3), Hyponex 1 g + pepaya 50 g (M4), Hyponex 1 g + pepaya 100 g (M5), Hyponex 1 g + pepaya 150 g (M6), Hyponex 2 g + pepaya 50 g (M7), Hyponex 2 g + pepaya 100 g (M8), Hyponex 2 g + pepaya 150 g (M9). Masing-masing perlakuan terdiri dari dua ulangan dengan10 botol tiap ulangan dan 2 tanaman dalam satu botol. Perlakuan pada percobaan media aklimatisasi yaitu Arang sekam (A1), Sphagnum moss (A2), Serbuk pakis (A3), dan Cocopeat (A4). Masing-masing perlakuan terdiri dari 5 ulangan dengan 10 tanaman tiap ulangan.
Eksplan percobaan pembesaran planlet berasal dari planlet plb (protocorm like bodies) Dendrobium “Kanayao“ steril. Planlet dipilih dengan tinggi lebih-kurang 3mm dan ditanam secara tunggal. Sedangkan bahan tanam percobaan media aklimatisasi menggunakan bibit Dendrobium “Mahlini ‘Kamiya’ x Kahleen Wee” hasil perbanyakan generatif yang siap aklimatisasi.
Hasil percobaan pembesaran planlet Dendrobium menunjukkan perkembangan secara umum yang baik, akan tetapi penambahan bubur pepaya mengakibatkan pertumbuhan lebih rendah. Perlakuan media pada peubah jumlah daun menunjukkan sangat berpengaruh nyata. Sedangkan pada peubah jumlah akar dan jumlah planlet menunjukkan tidak berpengaruh nyata hingga akhir pengamatan pada minggu ke-20. Peubah tinggi planlet di akhir pengamatan pada minggu ke-20 menunjukkan pengaruh nyata. Demikian pula peubah panjang daun, lebar daun dan panjang akar menunjukkan pengaruh sangat nyata.
Hasil percobaan aklimatisasi menunjukkan pertumbuhan planlet secara umum kurang baik. Faktor utama penyebabnya dimungkinkan karena serangan cendawan. Hal ini dapat dilihat dari bercak berwarna putih tepung dan hitam pada media dan pangkal planlet.
PENGGUNAAN HYPONEX DAN BUBUR PEPAYA
DALAM PEMBESARAN PLANLET ANGGREK
DENDROBIUM “Kanayao” SECARA
IN VITRO
DAN
PERLAKUAN MEDIA AKLIMATISASI
Skripsi sebagai salah satu syarat
untuk memperoleh gelar Sarjana Pertanian pada Fakultas Pertanian Institut Pertanian Bogor
0leh:
RACHMATULLAH A34302039
PROGRAM STUDI HORTIKULTURA
FAKULTAS PERTANIAN
LEMBAR PENGESAHAN
Judul : PENGGUNAAN HYPONEX DAN BUBUR PEPAYA DALAM PEMBESARAN ANGGREK DENDROBIUM “Kanayao” SECARA IN VITRO DAN PERLAKUAN MEDIA AKLIMATISASI
Nama : Rachmatullah NRP : A34302039
Menyetujui, Dosen Pembimbing
Dr Ir Agus Purwito, MSc. NIP.131 681 405
Mengetahui, Dekan Fakultas Pertanian
Prof. Dr Ir Didy Sopandie, M. Agr. NIP. 131 124 019
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 17 Mei 1983. Penulis adalah putra pertama dari lima bersaudara keluarga Munidin dan Wijiyanti.
Penulis memulai pendidikannya di taman kanak-kanak Ilham Jakarta Utara pada tahun 1988. Tahun 1989 penulis melanjutkan ke pendidikan dasar di SDN Kemala Bhayangkari 1 Jakarta Utara selama enam tahun. Kemudian tahun 1995 penulis melanjutkan pendidikan di SLTPN 1 Wonopringgo Kabupaten Pekalongan dan selesai pada tahun 1998. Pada tahun 1999 penulis melanjutkan pendidikan di SMUN 1 Kedungwuni Kabupaten Pekalongan. Tahun 2002 penulis diterima di Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB (USMI) sebagai mahasiswa Program Studi Hortikultura, Departemen Agronomi dan Hortikultura, Fakultas Pertanian.
KATA PENGANTAR
Puji syukur kita ucapkan kepada Allah SWT karena rahmat dan hidayah-Nya penulis dapat menyelesaikan penelitian ini.
Penelitian yang berjudul “Penggunaan Hyponex dan Bubur Pepaya dalam Pembesaran Planlet Anggrek Dendrobium “Kanayao” secara in Vitro dan Perlakuan Media Aklimatisasi” dilaksanakan sebagai tugas akhir dalam menyelesaikan pendidikan penulis di Program Studi Hortikultura, Departemen Agronomi dan Hortikultura, Fakultas Pertanian, Institut Pertanian Bogor.
Penulis menyampaikan terima kasih kepada Dr Ir Agus Purwito, MSc. sebagai pembimbing penelitian yang telah memberikan arahan dan bimbingan kepada penulis, Dr Dewi Sukma, Sp. Msi. sebagai dosen penguji dan pembimbing akademik yang dengan sabar menyemangati penulis dalam menyelesaikan pendidikan S1, Dr Ir Darda Effendi MSc. sebagai dosen penguji, Dr Ir Elis Nina Herliana MSc. dan keluarga sebagai pembimbing spiritual, motivator, teman berkeluh kesah dan seperti keluarga bagi penulis. Bapak, Ibu serta adik-adik yang saya cintai sebagai keluarga yang utuh dan tidak tergantikan, Dik Rima yang saya sayangi, dan rekan-rekan Hortikultura yang senantiasa memberikan do’a dan semangat kepada penulis.
Semoga penelitian ini dapat bermanfaat bagi penulis dan semua pihak yang berkepentingan.
Bogor,
DAFTAR ISI Keluarga Anggrek (Orchidaceae)... 4
Botani Anggrek Dendrobium... 7
Syarat Tumbuh Anggrek Dendrobium... 8
Perbanyakan Anggrek Dendrobium... 8
Kultur Jaringan Anggrek... 9
Pupuk Lengkap sebagai Pengganti Media MS... 10
Bahan Organik... 11
Rancangan Penelitian... 14
Pelaksanaan Penelitian... 16
Pengamatan... 18
HASIL DAN PEMBAHASAN Percobaan Pembesaran Planlet In Vitro... 20
Percobaan Media Aklimatisasi... 28
KESIMPULAN DAN SARAN Kesimpulan... 35
Saran... 35
DAFTAR PUSTAKA... 36
DAFTAR TABEL
Nomor Halaman
Teks
1. Rekapitulasi Sidik Ragam Jumlah Daun, Jumlah Akar, Tinggi Tunas, Panjang Daun, Lebar Daun, dan Panjang
Akar Anggrek Dendrobium……….. 21 2. Pengaruh Komposisi Media Pembesaran terhadap Rataan
Jumlah Daun AnggrekDendrobium selama 20 MST……..……. 23 3. Pengaruh Komposisi Media Pembesaran terhadap Rataan
Jumlah Akar AnggrekDendrobium selama 20 MST…………... 25 4. Pengaruh Komposisi Media Pembesaran terhadap Rataan
Tinggi Tunas, Panjang Daun, Lebar Daun, dan Panjang Akar
AnggrekDendrobium pada 20 MST……….. 26 5. Rekapitulasi Sidik Ragam Jumlah Daun, Tinggi Tunas,
Panjang Daun, dan Lebar Daun Anggrek Dendrobium selama
Aklimatisasi………..…...…... 30 6. Pengaruh Komposisi Media Aklimatisasi terhadap Rataan
Jumlah Daun Anggrek Dendrobium selama 12 MST……..……. 32 7. Pengaruh Komposisi Media Aklimatisasi terhadap Rataan
Tinggi Tunas, Panjang Daun, dan Lebar Daun Anggrek
Dendrobium pada 12 MST………..……….. 33
Lampiran
1. Komposisi Media Murashige dan Skoog (1962)... 40 2. Komposisi Hyponex 20-20-20... 41 3. Daftar Komposisi Bahan Organik yang Sering Digunakan
dalam Kultur In Vitro... 42 4. Sidik Ragam Jumlah Daun Anggrek Dendrobium pada
Perlakuan In Vitro... 43 5. Sidik Ragam Jumlah Akar Anggrek Dendrobium pada
Perlakuan In Vitro... 44 6. Sidik Ragam Tinggi, Panjang Daun, Lebar Daun dan Panjang
Akar Anggrek Dendrobium pada 20 MST Perlakuan In Vitro... 45 7. Sidik Ragam Persentase Hidup Anggrek Dendrobium pada
Perlakuan Aklimatisasi... 46 8. Sidik Ragam Jumlah Daun Anggrek Dendrobium pada
9. Sidik Ragam Tinggi Tunas, Panjang dan Lebar Daun Anggrek
DAFTAR GAMBAR
Nomor Halaman
1. Bagian-bagian Bunga Anggrek………...………... 5
2. Buah Anggrek Utuh (a) dan Biji Anggrek (b)……...……. 6
3. Struktur Biji Anggrek………..……. 6
4. Keiki Tumbuh pada Batang………..…… 9
5. Metode Pengukuran Tinggi Planlet. Pangkal Planlet (a) dan Ujung Planlet (b)... 18
6. Plantlet Dendrobium Steril sebagai Bahan Perlakuan (a), Fenomena Browning Ditandai Warna Coklat di Sekitar Planlet (b)... 21
7. Keragaan Tunas Dendrobium pada Akhir Pengamatan in Vitro.. 27
8. Keragaan Akhir Pengamatan Media Aklimatisasi pada Minggu ke-12: Arang sekam (a), Sphagnum moss (b), Serbuk pakis (c), Cocopeat (d)... 34
PENDAHULUAN
Latar Belakang
Indonesia memiliki kekayaan sumberdaya genetik anggrek yang beraneka ragam dan sangat banyak jumlahnya seperti Dendrobium, Cattleya, Vanda, Phalaenopsis dan Renanthera. Anggrek-anggrek spesies tersebut tersebar di hutan-hutan Indonesia seperti hutan-hutan Kalimantan dan Irian Jaya. Potensi yang besar tersebut sangat berharga untuk pengembangan anggrek di Indonesia terutama dalam menghasilkan anggrek-anggrek silangan (Soeryowinoto, 2002). Dendrobium merupakan salah satu marga Orchidaceae yang jumlahnya besar dan beraneka ragam (Widiastoety et. al., 2000). Jenis ini paling populer di kalangan
hobiis maupun pengusaha anggrek karena bunganya memiliki beragam bentuk, ukuran dan warna. Selain itu, anggrek ini memiliki pangsa pasar 50% dari total pasar anggrek untuk tanaman dalam pot (Setiawan, 2002).
Melihat peluang ekonomi anggrek Dendrobium yang begitu besar, diperlukan teknik perbanyakan yang cepat dan efisien seperti teknik in vitro. Teknik ini memiliki kelebihan dibandingkan cara konvensional seperti pemisahan anakan (split) dan penggunaan benih. Kelebihan itu diantaranya dapat menghasilkan individu lebih banyak, seragam seperti tanaman induknya (true to type), bebas patogen dan dihasilkan dalam waktu singkat (Sandra, 2003).
2
kentang, Purwito (1986) menunjukkan bahwa Hyponex 20-20-20 menghasilkan umbi kentang mikro 30-40%. Selain itu, Hyponex juga telah digunakan pada perbanyakan anggrek Dendrobium oleh Muawanah (2005) dan hasilnya menunjukkan bahwa penggunaan Hyponex 1 g/l dan bubur tomat 50 g/l menghasilkan tunas anggrek terbanyak sebanyak 74,0 tunas.
Modifikasi media lainnya dapat pula dengan menggunakan bahan-bahan organik sebagai pengganti vitamin dan zat pengatur pertumbuhan sehingga diharapkan lebih murah, contohnya penggunaan air kelapa yang dikenal sebagai salah satu sumber sitokinin (Letham, 1974). Bahan organik yang digunakan dalam kultur jaringan berfungsi sebagai suplemen untuk memperkaya media dasar yang digunakan sehingga memberikan pertumbuhan planlet yang lebih baik (Hartmann dan Kester, 1983). Bubur tanaman yang ditambahkan dalam media berfungsi sebagai sumber asam amino, peptida, vitamin dan zat pengatur tumbuh. Asam amino dari tanaman lebih mudah diserap daripada asam amino anorganik (George dan Sherrington, 1984). Asam amino dapat membantu differensiasi jaringan dan digunakan dalam sintesis protein, sedangkan vitamin berguna untuk pertumbuhan tanaman khususnya pada jaringan aktif. Beberapa vitamin juga berperan sebagai co-faktor enzim agar enzim dapat aktif bekerja. (Macdonald, 2000). Pada penelitian ini digunakan bahan organik berupa bubur pepaya yang diharapkan dapat meningkatkan pertumbuhan planlet. Hasil penelitian Rahman et al. (2004) menunjukkan penambahan bubur pepaya sebanyak 50 – 100 ml/l mampu meningkatkan pertumbuhan planlet Doritaenopsis dalam media NP (New Phalaenopsis).
3
Masa aklimatisasi memerlukan media beraerasi dan draenasi baik serta kelembaban yang cukup, bebas organisme pengganggu dan bahan berbahaya, cukup hara mineral dan memiliki bobot yang ringan (Hartmann dan Kester, 1983). Media yang cocok pada aklimatisasi akan mengurangi cekaman berat pada bibit saat dipindahkan ke lapang (Dessler, 1981).
Tujuan Penelitian
Penelitian pembesaran planlet bertujuan untuk menghasilkan kombinasi Hyponex dan bubur pepaya yang terbaik dalam pembesaran planlet anggrek Dendrobium “Kanayao” secara in vitro sebagai alternatif pengganti media MS. Penelitian aklimatisasi bertujuan untuk mengetahui media tanam terbaik dalam aklimatisasi bibit anggrek Dendrobium.
Hipotesis
TINJAUAN PUSTAKA
Keluarga Anggrek (Orchidaceae)
Tanaman anggrek merupakan famili yang memiliki jumlah keanekaragaman sangat besar yaitu terdiri dari 700 genus dan 35.000 spesies yang tersebar di seluruh dunia (Oliveira dan Faria, 2005). Contoh dari genus anggrek yaitu Dendrobium, Phalaenopsis, Renanthera, Vanda, Cattleya, Bulbophylum dan masih banyak genus yang lain. Anggrek umumnya hidup secara epifit di batang-batang pohon di hutan tropis namun ada pula yang hidup secara terestrial di atas permukaan tanah, saprofit atau lithofit (di permukaan batu) (Rudhy, 2006).
Tipe perkembangan anggrek dibedakan menjadi dua yaitu monopodial dan simpodial. Monopodial merupakan tipe pertumbuhan yang terus tumbuh ke atas dan tidak akan berhenti. Tipe ini hanya memiliki satu titik tumbuh (tidak bercabang), ia akan bercabang apabila titik tumbuh tersebut dihilangkan atau rusak. Tipe simpodial merupakan pertumbuhan yang dapat berhenti apabila bulb
(batang semu) telah mencapai ukuran maksimal dan kembali membentuk bulb
baru di pangkal batang sehingga membentuk rumpun bulb (Rudhy, 2006).
Helaian daun anggrek berdaging berwarna hijau tua. Permukaan daun dilapisi kutikula (lapisan lilin) yang dapat melindungi dari serangan hama dan penyakit. Kedudukan daun tersusun secara berjajar berselingan. Batang anggrek yang menebal merupakan batang semu yang dikenal dengan istilah pseudobulb
(pseudo=semu, bulb=batang yang menggembung), berfungsi sebagai penyimpan air dan makanan untuk bertahan saat keadaan kering (Bose dan Battcharjee, 1980). Batang dan daun anggrek mengandung klorofil, hal ini sangat membantunya memaksimalkan penyerapan sinar matahari untuk fotosintesis dalam habitatnya di hutan yang minim cahaya. Klorofil pada batang anggrek tidak mudah hilang atau terdegradasi walaupun daun-daunnya telah gugur, oleh sebab itu anggrek juga memiliki julukan evergreen.
5
dapat kita jumpai pada anggrek jenis simpodial seperti Dendrobium, Bulbophyllum, maupun Cattleya. Sedangkan akar udara dimiliki oleh anggrek monopodial seperti Phalaenopsis, Vanda dan Renanthera (Rudhy, 2006).
Keindahan tanaman anggrek terletak pada bunganya yang unik dan beraneka warna. Gambar 1 menunjukkan bahwa bunga anggrek tersusun dari tiga buah sepal (kelopak bunga) dan tiga buah petal (mahkota bunga). Satu dari petal terjadi modifikasi membentuk labellum (bibir bunga). Labellum ini merupakan sebuah daya tarik tersendiri yang merupakan ciri keunikan dari suatu jenis karena memiliki bentuk dan warna yang beragam. Selain itu labellum berfungsi sebagai daya tarik bagi lebah untuk menghisap madu. Kedatangan lebah ini dapat membantu terjadinya penyerbukan. Bunga anggrek juga memiliki collum yaitu tempat kedudukan kelamin jantan dan betina (Rudhy, 2006).
Gambar 1. Bagian-bagian Bunga Anggrek (Rudhy, 2006)
6
(a) (b)
Gambar 2. Buah anggrek utuh (a) dan biji anggrek (b) (Nebel et al., 2008)
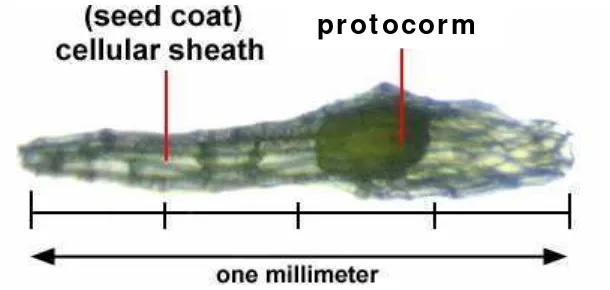
Berbeda dengan biji-biji pada umumnya, pada Gambar 3 dapat dilihat bahwa biji anggrek hanya memiliki embrio dan tidak memiliki endosperm (cadangan makanan) karena penyerbukan ganda yang tidak sempurna (Arditti, 1992). Oleh karena itu pada keadaan alami di alam biji anggrek akan berkecambah apabila di tempat jatuhnya terdapat cendawan mycoryza. Hasil dari metabolisme mycoryza berupa senyawa-senyawa organik sederhana yang dimanfaatkan biji anggrek untuk berkecambah dan tumbuh sebelum mampu memproduksi makanan sendiri. Embrio yang berkecambah membentuk protocorm
yaitu struktur seperti corm (batang berlapis) berukuran sangat kecil, berwarna hijau dan dapat melakukan fotosintesis. Setelah senyawa organik yang terbentuk mencukupi dalam protocorm, barulah tunas dan akar akan terbentuk (Wattimena
et al., 1992).
pr ot ocor m
7
Dendrobium berasal dari kata “dendron” yang berarti pohon dan “bios” yang berarti hidup (Williams, 1984). Dendrobium memiliki marga yang sangat besar yaitu terbesar kedua pada famili Orchidaceae, memiliki keanekaragaman ukuran, habitat, batang, daun, maupun warna bunga yang sangat besar. Jenis Dendrobium sangat banyak mencapai 1600 jenis yang tersebar di Indonesia, India, Burma, Malaysia, Australia, Selandia Baru, Cina dan Jepang.
Tipe pertumbuhan anggrek ini adalah simpodial atau melebar yang ditandai dengan tumbuhnya bulb silih berganti apabila bulb yang lama telah tua. Bunga Dendrobium yang telah mekar dapat bertahan lebih dari 30 hari dan setiap tangkainya memiliki lebih dari 20 kuntum bunga yang tersusun rapi (Setiawan, 2005). Tangkai bunga tumbuh pada ujung bulb dan samping-sampingnya sehingga memungkinkan memiliki tangkai bunga lebih dari satu. Masa matang buah berkisar antara 3 hingga 6 bulan. Daun anggrek biasanya oval memanjang dan menebal berfungsi sebagai penyimpan air (Wikimedia Foundation, 2008).
Klasifikasi taksonomi Dendrobium adalah sebagai berikut: Kingdom : Plantae
Divisio : Magnoliophyta Class : Liliopsida Ordo : Asparagales Famili : Orchidaceae Sub Famili : Epidendroidea Tribe : Dendrobieae Sub Tribe : Dendrobiinae Genus : Dendrobium
8
Syarat Tumbuh Anggrek Dendrobium
Persyaratan tumbuh setiap jenis anggrek berbeda-beda, tetapi semua jenis memerlukan aliran udara yang selalu bergerak. Manfaat aliran udara ini untuk mencegah timbulnya penyakit akibat lingkungan yang terlalu basah, menurunkan suhu udara pada siang hari yang panas, dan membawa unsur-unsur yang dibutuhkan tanaman seperti CO2, N2, dan air (Setiawan, 2005).
Anggrek Dendrobium merupakan tanaman yang berasal dari daerah tropis yang membutuhkan sinar matahari dan temperatur yang cukup panas, tidak seperti anggrek tertentu yang hanya cocok di daerah dingin seperti Paphiopedillum. Dendrobium membutuhkan cahaya 50-60% dan suhu 28-30oC dengan suhu minimal 15oC (Anggrek.org., 2005). Sedangkan lingkungan yang dikehendaki anggrek ini tidak terlalu basah tetapi membutuhkan kelembaban yang tinggi yaitu 65%-70%. Apabila keadaan media terlalu basah dapat menyebabkan tunas atau daun menjadi busuk (Soeryowinoto, 2002). Kebutuhan lingkungan tumbuh tersebut dapat diatasi dengan pemberian naungan dan pengabutan dengan sprayer.
Pertumbuhan anggrek Dendrobium optimal pada ketinggian kurang dari 400 mdpl walaupun pada ketinggian yang lebih tinggi masih dapat tumbuh dan berbunga (Setiawan, 2005). Lingkungan tumbuh Dendrobium tersebut merupakan daerah yang cukup panas. Umumnya Dendrobium hanya disiram pada saat hari cerah, saat mendung, hujan atau berkabut tidak perlu dilakukan penyiraman. Penyiraman pada saat media anggrek telah kering merupakan waktu yang tepat (Gunadi, 1979).
Perbanyakan Anggrek Dendrobium
9
Gambar 4. Keiki Tumbuh pada Batang (Nebel et al., 2008)
Perbanyakan konvensional yang dapat dilakukan yaitu dengan pemotongan batang (stek). Cara ini biasa dilakukan pada anggrek tipe pertumbuhan monopodial. Stek pada tipe simpodial seperti Dendrobium akan membentuk keiki. Anggrek juga dapat dilakukan pemisahan bulb dari rumpun (split), teknik ini dapat dilakukan pada anggrek tipe pertumbuhan simpodial. Rumpun bulb
dipisahkan dengan mengikutkan pada masing-masing bagian minimal 3 bulb, hal ini dimaksudkan agar individu baru nantinya dapat bertahan hingga kembali sehat dan membentuk bulb baru.
Cara perbanyakan lainnya yang telah banyak dilakukan di industri florikultur yaitu kultur jaringan. Cara ini disebut juga cara non konvensional karena membutuhkan teknologi dan biaya yang tidak sedikit untuk memulai dan melakukannya, juga dibutuhkan pengetahuan yang lebih rumit. Perbanyakan ini menggunakan bagian kecil dari tanaman (dapat berupa daun, akar, ujung batang, atau bunga) yang ditanam dalam kondisi aseptik dan lingkungan yang terkendali (Wattimena et al., 1992)
Kultur Jaringan Anggrek
10
Selain itu kultur jaringan memerlukan investasi yang besar untuk membangun laboratorium yang mungkin hanya cocok untuk perusahaan.
Kultur jaringan adalah teknik perbanyakan tanaman dengan cara mengisolasi bagian tanaman dalam kondisi aseptik sehingga dapat memperbanyak diri dan beregenerasi menjadi individu baru yang utuh (Gunawan, 1992). Teknik kultur jaringan didasari oleh konsep totipotensi sel yang artinya total genetic potential atau setiap sel dari tubuh multisel memiliki potensi memperbanyak diri dan berdiferensiasi menjadi tanaman lengkap (George dan Sherrington, 1984).
Media yang digunakan dalam kultur jaringan anggrek tidak jauh berbeda dengan media lainnya. Beberapa media yang digunakan untuk perbanyakan anggrek adalah Knudson 'C' (Knudson, 1946), Wimber (Wimber, 1963) atau Fonnesbech (Fonnesbech, 1972) atau media MS (Murashige and Skoog, 1962). Media yang digunakan umumnya media padat, kecuali Cattleya yang dikulturkan dalam media cair. Media ini dipadatkan dengan Bacto agar (8 - 10 %). Sebagai sumber karbon, sukrose ditambahkan dalam media (20 gr/L), atau kombinasi glukose (10%) dan sukrose (10%). Hormon pertumbuhan ditambahkan dalam media ini dalam konsentrasi rendah. Auksin yang digunakan antara lain IAA, IBA, NAA atau 2,4-D pada konsentrsi 1 mg/L karena diduga auksin dapat merangsang pertumbuhan akar. Sitokinin yang digunakan umumnya adalah Kinetin dan BAP pada konsentrsi 0.5 mg/L untuk merangsang pertumbuhan tunas (Mulyaningsih dan Nikmatullah, 2006).
Pupuk Lengkap sebagai Pengganti Media MS
Tanaman anggrek mutlak membutuhkan unsur-unsur makro yang dibutuhkan dalam jumlah besar dan unsur mikro yang dibutuhkan dalam jumlah sedikit. C, H, O, N, P, K, S, Ca, dan Mg merupakan unsur makro dan Fe, Cu, Zn, Mo, Mn, Se, B, Si merupakan unsur mikro (Soeryowinoto, 2002). Seluruh unsur tersebut terdapat dalam pupuk lengkap atau yang biasa disebut pupuk majemuk.
11
mencapai 99.9%. Oleh karena itu, pemakaian pupuk lengkap harus dengan konsentrasi yang tepat agar jumlah pengotornya (bahan kimia yang terikut di dalamnya) tidak mengganggu pertumbuhan planlet anggrek (Sandra, 2003).
Secara umum pupuk lengkap memiliki kesamaan kandungan dengan media dasar untuk kultur jaringan yaitu media MS. Dengan demikian, penggunaan pupuk ini diharapkan dapat menjadi alternatif menggantikan media dasar tersebut terutama pada perbanyakan anggrek dengan kultur jaringan. Pada penelitian ini menggunakan Hyponex 20-20-20. Pupuk daun Hyponex hijau mengandung 4% nitrat, 4% amonium, 12 % nitrogen terlarut, 20% K2O5, dan 20% K2O serta unsur-unsur lain seperti Magmesium, Kalsium, Mangan, Besi, Boron, Molibdenum, Sulfur, Seng, tembaga dan Cobalt (Tabel Lampiran 2). Pada penelitian sebelumnya, Purwito (1986) menunjukkan bahwa Hyponex 20-20-20 menghasilkan umbi kentang mikro 30-40%. Hasil penelitian Muawanah (2005) menunjukkan bahwa penggunaan Hyponex 1 g/l dan bubur tomat 50 g/l menghasilkan tunas terbanyak sebanyak 74.0 tunas.
Bahan Organik
Bahan organik alami yang digunakan dalam kultur jaringan sebagai suatu suplemen dimaksudkan untuk memantapkan pertumbuhan dan perkembangan kultur sehingga memberikan pertumbuhan yang ekstra bagi pertumbuhannya (Hartmann dan Kester, 1983). Sedangkan syarat bahan organik yang dibutuhkan yaitu mengandung zat organik, vitamin, gula, protein dan antioksidan (Sjabana dan Bahalwan, 2002). Antioksidan dari bahan organik berfungsi sebagai senyawa anti pencoklatan (browning). Contoh senyawa antioksidan tersebut yaitu asam askorbat, asam sitrat dan asam malat (Hartmann dan Kester, 1983). Salisbury dan Ross (1992) menyatakan bahwa untuk tumbuh dengan baik, tanaman memerlukan beberapa vitamin sebagai koenzim. Macdonald (2000), menambahkan bahwa koenzim berperan agar enzim pertumbuhan dapat bekerja.
12
fisiologi tanaman dalam kultur berupa arah pertumbuhan dan perkembangannya (Gamborg dan Shyluk, 1981).
Bubur Pepaya
Penggunaan bubur pepaya dalam kultur jaringan diharapkan dapat menambah zat-zat yang dibutuhkan oleh eksplan agar tumbuh lebih baik. Hardinsyah dan Briawan (1994), menyatakan bahwa kandungan pepaya dalam 100 g bahan terdiri dari 46 kal energi, 0.5 g protein, 0 g lemak, 12.2 g karbohidrat, 23 mg kalsium, 12 mg fosfor, 1.7 mg besi (Fe), 56 RE vitamin A, 78 mg vitamin C, 0.04 mg vitamin B dan 86.7 g air. Ashari (1995), menambahkan bahwa buah pepaya memiliki kandungan gula 4-10% dan sangat berair.
Penelitian Rahman et al. (2004), menunjukkan bahwa penambahan bubur pepaya 50-100 ml/l perupakan konsentrasi optimum bagi pertumbuhan planlet anggrek Doritaenopsis pada media NP (New Phalaenopsis). Bahan organik komplek terdiri dari karbohidrat, protein, lemak, beberapa vitamin, zat fenol, sedikit asam amino dan asam organik. Zat-zat tersebut atau zat yang belum diketahui, sendiri atau dalam kombinasi dimungkinkan menjadi faktor dalam meningkatkan regenerasi planlet.
Aklimatisasi
Tanaman in vitro yang akan dipindahkan ke lapang perlu proses pengadaptasian untuk mendukung daya tahan bibit yang disebut aklimatisasi. Perubahan lingkungan heterotrof (in vitro) menjadi autotrof (lapang) menyebabkan bibit harus mendapatkan karbohidrat melalui fotosintesis (Pierik, 1987). Planlet tersebut membutuhkan kondisi lingkungan yang hampir sama dengan lingkungan tumbuh sebelumnya yang telah tersedia hara lengkap dan berkelembaban udara optimal (Brainerd dan Fuchigami,1981).
13
Cocopeat merupakan serabut kelapa yang sudah disterilisasi. Cocopeat
bersifat menyimpan air. Penggunaan cocopeat dapat menghemat air karena penyiraman dapat dilakukan lebih jarang. Penyiraman dilakukan setelah media kering. Sphagnum moss merupakan media yang berbahan lumut. Sphagnum moss
BAHAN DAN METODE
Bahan dan Alat
Bahan utama yang digunakan pada penelitian ini yaitu planlet Dendrobium
“Kanayao” steril hasil perbanyakan dengan media MS + 0.1 ppm IAA + 0.5 ppm
BAP, pupuk daun Hyponex (20-20-20), buah pepaya masak dengan varietas
California dan agar. Bahan-bahan tambahan yang dibutuhkan yaitu alkohol 70%,
aquades, spiritus, plastik, karet gelang, dan tisu.
Alat-alat yang digunakan yaitu otoklaf, laminar air flow cabinet, neraca
analitik, blender, botol kultur, bunsen, hand sprayer, pinset, cawan petri, labu
erlenmayer, gelas piala, gelas ukur, pisau, corong, scapel, pengaduk kaca, pipet,
labu takar, pH meter, dan kain pembersih.
Sedangkan bahan yang digunakan pada penelitian aklimatisasi yaitu bibit
anggrek Dendrobium “Mahlini ‘Kamiya’ x Kahleen Wee”, arang sekam,
sphagnum moss, serbuk pakis, cocopeat, dan fungisida. Sedangkan alat yang
digunakan yaitu toples plastik, pinset, baskom dan hand sprayer.
Tempat dan Waktu
Penelitian ini dilaksanakan di Laboratorium Kultur Jaringan Tanaman
Departemen Agronomi dan Hortikultura, Fakultas Pertanian, IPB, Bogor.
Penelitian dilaksanakan selama 5 bulan mulai dari bulan Januari hingga Juni 2007.
Rancangan Penelitian
Penelitian ini terdiri dari pembesaran planlet anggrek Dendrobium secara
in vitro dan aklimatisasi yang disusun dalam Rancangan Lingkungan Acak
Lengkap (RAL) dengan faktor tunggal. Penelitian pembesaran planlet anggrek
Dendrobium terdiri dari 9 perlakuan, yaitu:
M1: MS0 + vitamin
M2: Hyponex 1 g/l + vitamin
M3: Hyponex 2 g/l + vitamin
M4: Hyponex 1 g/l + bubur pepaya 50 g/l
15
M6: Hyponex 1 g/l + bubur pepaya 150 g/l
M7: Hyponex 2 g/l + bubur pepaya 50 g/l
M8: Hyponex 2 g/l + bubur pepaya 100 g/l
M9: Hyponex 2 g/l + bubur pepaya 150 g/l
Setiap perlakuan terdiri dari 2 ulangan sehingga terdapat 18 satuan
percobaan. Satu satuan percobaan tersebut terdiri dari 10 botol kultur dengan 2
tunas setiap botol sehingga jumlah tunas yang diperlukan 360 tunas. Pada media
perlakuan tanpa penambahan bubur pepaya ditambahkan vitamin yaitu Thiamin,
Niacin, Pyridoxine, dan Glycin (Tabel Lampiran 1).
Penelitian aklimatisasi bibit anggrek Dendrobium terdiri dari 4 perlakuan
media yaitu:
A1: Arang sekam
A2: Sphagnum moss
A3: Serbuk pakis
A4: Cocopeat
Setiap perlakuan terdiri dari 5 ulangan sehingga terdapat 20 satuan
percobaan. Satu satuan percobaan tersebut terdiri dari 1 pot dengan 10 bibit setiap
pot sehingga jumlah tunas yang diperlukan 200 tunas.
Model matematika yang digunakan yaitu:
Yij = µ + αi + εij
Keterangan:
Yij : Respon perlakuan kombinasi media ke-i pada ulangan ke-j
µ : Nilai tengah populasi
αi : Pengaruh perlakuan kombinasi media pada taraf ke-i (i = 1, 2, 3, 4, 5, 6, 7, 8, 9)
εij : Pengaruh galat percobaan perlakuan kombinasi media ke-i pada ulangan ke-j
Setelah diuji F, perlakuan yang berpengaruh nyata diuji dengan uji lanjut DMRT
16
Pelaksanaan Penelitian
a. Pembesaran planlet secara in vitro
1. Sterilisasi alat
Sterilisasi alat dilakukan dengan mencuci alat-alat yang akan digunakan
dengan detergen hingga bersih. Setelah itu disterilisasi menggunakan otoklaf
pada suhu 121oC dan tekanan 17.5 psi (pounds per square inch) selama 60
menit. Alat yang telah disterilisasi disimpan di dalam oven penyimpanan
sehingga terjaga dari kontaminasi.
2. Pembuatan media kultur dan persiapan botol kultur
Bahan utama pembuatan media penelitian ini yaitu buah pepaya segar
yang dipilih setengah matang agar memudahkan pembuatan media. Buah
pepaya sebelum dihancurkan dicuci terlebih dahulu hingga bersih kemudian
diiris membujur. Biji dibuang dan daging buah dipisahkan dari kulit. Daging
buah tersebut ditimbang dan ditambahkan air dengan berat yang sama,
kemudian dihancurkan menggunakan blender hingga halus.
Pembuatan media berdasarkan konsentrasi dari taraf perlakuan. Semua
bahan media dicampur dalam labu takar dan ditera hingga 1 liter
menggunakan aquades. Setelah itu, dilakukan pengukuran pH hingga 5.8-6.0.
Pengaturan pH dilakukan dengan penambahan HCl 1N atau KOH 1N.
Formula tersebut kemudian ditambahkan agar-agar sebagai pemadat media
sebanyak 7 g/l, didihkan lalu dimasukkan ke dalam botol kultur steril.
Selanjutnya botol media ditutup dengan plastik hingga rapat dan disterilisasi
pada tekanan 17.5 psi dan suhu 121oC selama 10 menit.
3. Persiapan eksplan
Planlet Dendrobium yang digunakan berasal dari organogenesis kalus
in vitro. Planlet dikeluarkan dari botol dan diletakkan pada cawan petri steril.
setiap planlet dipisahkan satu persatu dari rumpun menggunakan scapel.
4. Penanaman
Penanaman planlet pada seluruh media dilakukan di dalam laminar air
flow cabinet. Alat-alat, bahan atau tangan harus disterilisasi terlebih dahulu
17
Penanaman eksplan dilakukan dengan menancapkan ke dalam media 2
eksplan setiap botol. Setiap botol dari seluruh perlakuan kemudian diletakkan
secara acak dalam rak kultur yang memanjang .
5. Pemeliharaan
Pemeliharaan dilakukan dengan menjaga keadaan lingkungan ruangan
kultur yaitu memberikan penyinaran lampu flourescent berintensitas cahaya
1000 lux pada rak kultur tempat botol-botol diletakkan dan suhu ruangan
diatur 20-25oC. Kondisi ini terus berlangsung selama 24 jam setiap hari.
B. Aklimatisasi bibit
1. Persiapan bibit dan media
Media tanam yang akan digunakan dicuci hingga bersih terlebih
dahulu kemudian direndam dalam fungisida 1 g/l selama 5 menit kemudian
ditiriskan. Setelah itu masing-masing media dimasukkan ke dalam toples
plastik transparan setinggi 20 cm dan berdiameter 15 cm berdasarkan
perlakuan dan siap untuk ditanami.
Bibit yang akan digunakan dikeluarkan dari botol dengan cara media
agar dilepaskan dengan hati-hati menggunakan kawat bengkok lalu bibit
dikait keluar. Bibit anggrek tersebut dibersihkan dari sisa-sisa media hingga
bersih lalu direndam dalam larutan fungisida 1 g/l selama 5 menit. Kemudian
ditiriskan dan siap ditanam.
2. Penanaman
Penanaman dilakukan dengan cara membuat alur tanam pada media
kemudian meletakkan 10 bibit dalam alur. Akar anggrek kemudian ditutup
hingga sempurna tetapi tidak menutupi batang bibit. Selesai penanaman,
toples ditutup (disungkup).
3. Pemeliharaan
Pemeliharaan dilakukan dengan penyiraman 2 kali sehari, pemupukan
menggunakan pupuk daun Vitabloom (30-10-10) 2 g/l satu kali seminggu
dengan cara disemprotkan ke daun dan pencegahan cendawan menggunakan
18
Pengamatan
a. Pembesaran planlet secara in vitro
Pada penelitian pembesaran planlet, peubah yang diamati yaitu:
1. Jumlah daun, dihitung saat daun telah membuka sempurna.
2. Jumlah akar, dihitung saat akar mencapai 2 mm.
3. Tinggi tunas, diukur saat akhir pengamatan dari pangkal tunas (a) hingga
titik pertemuan antara dua daun paling atas (b).
a b
Gambar 5. Metode Pengukuran Tinggi Planlet. Pangkal (a) dan Ujung Planlet (b)
4. Panjang daun, diukur saat akhir pengamatan pada daun terpanjang dari
pangkal hingga ujung daun.
5. Lebar daun, diukur saat akhir pengamatan pada daun terlebar di bagian
tengah daun.
6. Panjang akar, diukur saat akhir pengamatan pada akar terpanjang dari
pangkal hingga ujung akar.
Peubah-peubah tersebut di atas diamati satu minggu sekali selama 20
minggu setelah tanam pada setiap satuan percobaan.
b. Aklimatisasi bibit
Pada penelitian aklimatisasi, peubah yang diamati yaitu:
1. Persentase hidup, dengan membandingkan bibit hidup dengan bibit awal
dikalikan 100%.
19
3. Tinggi tanaman, diukur saat akhir pengamatan dari pangkal hingga titik
tumbuh tunas.
4. Panjang daun, diukur saat akhir pengamatan pada daun terpanjang dari
pangkal hingga ujung daun.
5. Lebar daun, diukur saat akhir pengamatan pada daun terlebar di bagian
tengah daun.
Peubah-peubah tersebut di atas diamati satu minggu sekali selama 14
HASIL DAN PEMBAHASAN
I. Percobaan Pembesaran Planlet In Vitro
Keadaan Umum
Eksplan yang ditanam berasal dari rumpun planlet (Gambar 5a) dengan
tinggi lebih-kurang 0.3 cm dengan jumlah daun rata-rata 2 helai dan jumlah akar
sebanyak 0 hingga 1 buah. Tunas yang ditanam mengalami pertumbuhan setelah 1
MST ditandai oleh jumlah akar yang bertambah. Semua media perlakuan dapat
menyediakan kebutuhan hara bagi tanaman sehingga tidak terjadi kematian.
Pertumbuhan tunas pada media pembesaran secara umum menunjukkan
perkembangan yang baik akan tetapi penambahan bubur pepaya mengakibatkan
pertumbuhan planlet lebih rendah dibandingkan media tanpa bubur pepaya. Hal
ini dimungkinkan karena kandungan unsur Fe (besi) pada buah pepaya yang
tinggi mencapai 1.7 mg/100 g bahan (Tabel lampiran 3). Fe merupakan unsur
mikro yang memiliki peran penting seperti pernyataan Bennett (1993), bahwa Fe
berperan dalam síntesis klorofil, fiksasi nitrogen, fotosíntesis dan transfer
elektrón. Tetapi jumlah Fe yang tinggi dapat menyebabkan gejala keracunan yaitu
menyebabkan ketidakseimbangan nutrisi dan menghasilkan pertumbuhan secara
umum menjadi tidak baik, menunda kedewasaan, tumbuh kerdil atau tinggi kurus.
Kemungkinan lain karena kandungan zat tertentu dalam buah pepaya (pada
getah) yang dapat menghambat pertumbuhan tunas. Fajar (2008), menyatakan
bahwa lebih dari 50 asam amino terkandung dalam getah pepaya, antara lain asam
aspartat, treonin, serin, asam glutamat, prolin, glisin, alanin, valine, isoleusin,
leusin, tirosin, fenilalalin, histidin, lysin, arginin, tritophan, dan sistein. Getah
pepaya juga mengandung enzim-enzim protease (pengurai protein) yaitu papain
dan kimopapain. Kadar papain dan kimopapain dalam buah pepaya muda
berturut-turut 10% dan 45%. Papain merupakan satu dari enzim paling kuat yang
dihasilkan oleh seluruh bagian tanaman pepaya. Enzim tersebut dapat memecah
21
(a) (b)
Gambar 6. Plantlet Dendrobium Steril sebagai Bahan Perlakuan (a), Fenomena Browning
Ditandai Warna Coklat di Sekitar Planlet (b).
Tunas pada media dengan penambahan bubur pepaya ditemukan mengalami
browning atau pencoklatan (Gambar 5b) sebanyak 1.7% yang disebabkan oleh
senyawa fenolik. Browning ditandai dengan warna coklat pada pangkal tunas
yang kemungkinan terluka akibat potongan saat pemisahan tunas dari rumpun
bahan yang ditanam. Pierik (1987), menyatakan bahwa pencoklatan disebabkan
aktifitas enzim pengoksidasi seperti polifenol oksidase dari jaringan yang dilukai.
Tunas browning mengalami pertumbuhan yang lambat tetapi masih dapat diamati
hingga akhir pengamatan. Zat fenol yang menyebar ke media diduga berasal dari
tunas bukan berasal dari media sehingga pertumbuhan tunas browning sangat
lambat dibandingkan tunas lain dalam perlakuan yang sama.
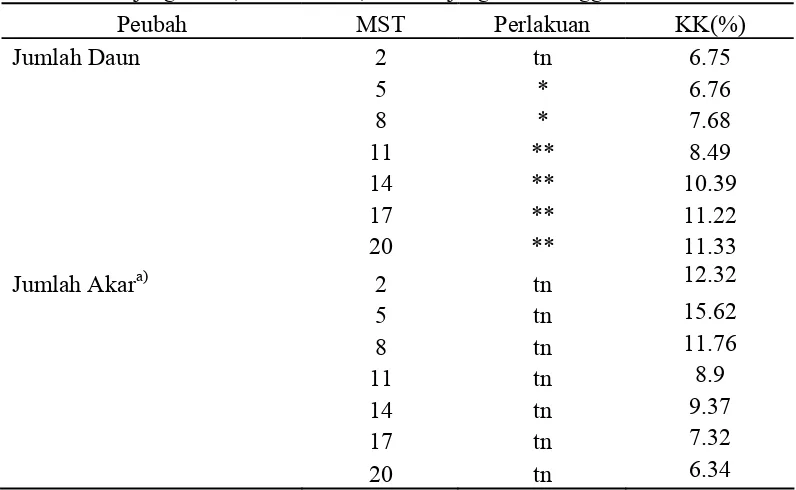
Tabel 1. Rekapitulasi Sidik Ragam Jumlah Daun, Jumlah Akar, Tinggi Tunas, Panjang Daun, Lebar Daun, dan Panjang Akar Anggrek Dendrobium.
22
Ket: tn = tidak berbeda nyata pada taraf 5% (P>0.05) * = berbeda nyata pada taraf 5% (P<0.05)
** = sangat berbeda nyata pada taraf 1% ((P<0.01)
a)
Data hasil transformasi (x+1)1/2
Berdasarkan hasil rekapitulasi sidik ragam terhadap peubah yang diamati
(Tabel 1), media pembesaran anggrek Dendrobium menunjukkan berpengaruh
sangat nyata pada 5 MST hingga akhir pengamatan (20 MST). Sedangkan
pengaruh media terhadap peubah jumlah akar dan jumlah tunas tidak berpengaruh
nyata pada awal hingga akhir pengamatan.
Media pembesaran planlet anggrek Dendrobium terhadap peubah tinggi
tunas yang diamati di akhir pengamatan menunjukkan berpengaruh nyata,
demikian pula pengaruh media pembesaran terhadap peubah panjang daun, lebar
daun dan panjang akar menunjukkan berpengaruh sangat nyata.
Jumlah Daun
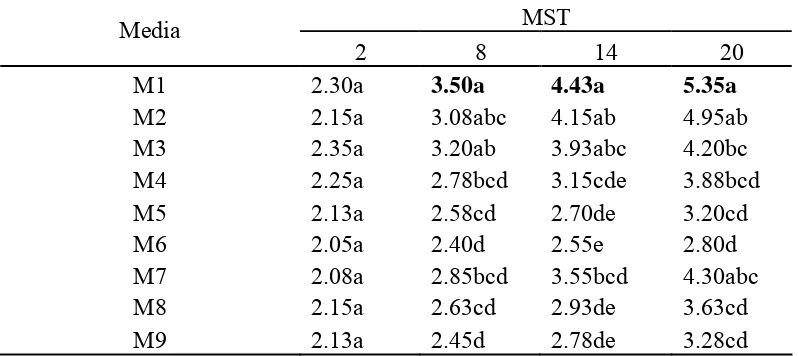
Hasil percobaan pada tabel 2 menunjukkan bahwa perlakuan mempengaruhi
secara nyata jumlah daun yang dihasilkan, dimulai pada 3 MST hingga akhir
pengamatan. Pada akhir pengamatan diperoleh data bahwa M1 (MS0 + vitamin)
dengan jumlah daun 5.35 helai menunjukkan tidak berbeda nyata terhadap M2
(Hyponex 1 g/l + vitamin) dengan jumlah daun 4.95 helai dan M7 (Hyponex 2 g/l
+ pepaya 50 g/l) dengan jumlah daun 4.30 helai. Berdasarkan hasil tersebut, M2
dan M7 diduga memiliki kandungan hara dan vitamin yang dapat menggantikan
M1.
Tabel 2 menunjukkan bahwa penambahan bubur pepaya (M5 dan M6)
berbeda nyata dengan M2 (tanpa penambahan bubur pepaya) terhadap peubah
jumlah daun. Hal ini menunjukkan bahwa penambahan bubur pepaya pada media
pembesaran tunas anggrek Dendrobium bersifat menghambat perkembangan
daun. Kemungkinan penambahan bubur pepaya dapat mengurangi keseimbangan
23
diketahui (Rahman et al. 2004). Zat-zat ini diperkirakan berasal dari getah pepaya.
Fajar (2008) menyatakan bahwa lebih dari 50 asam amino terkandung dalam
getah pepaya, antara lain asam aspartat, treonin, serin, asam glutamat, prolin,
glisin, alanin, valine, isoleusin, leusin, tirosin, fenilalalin, histidin, lysin, arginin,
tritophan, dan sistein. Getah pepaya sudah lama dikenal sebagai bahan proteolitik
dengan memanfaatkan papain untuk memecah ikatan protein sehingga daging
menjadi lebih lunak. Kemungkinan hal ini dapat pula terjadi pada tanaman
anggrek yang ditanam dalam media dengan penambahan bubur pepaya.
Kemungkinan lain kerena kandungan Fe pada buah pepaya yang tinggi
sehingga meracuni planlet dan mengakibatkan pertumbuhan yang tidak baik.
Gejala keracunan akibat Fe yang berlebih seperti pertumbuhan secara umum tidak
baik, menunda kedewasaan, dan tumbuh kerdil atau tinggi kurus (Bennett, 1993).
Tabel 2. Pengaruh Komposisi Media Pembesaran Terhadap Rataan Jumlah Daun AnggrekDendrobium selama 20 MST.
MST
Ket: Rataan yang diikuti dengan huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata menurut uji Duncan pada taraf kepercayaan α=0.05.
MST: Minggu Setelah Tanam
MS0 + vitamin (M1), Hyponex 1 g + vitamin (M2), Hyponex 2 g + vitamin (M3), Hyponex 1 g + pepaya 50 g (M4), Hyponex 1 g + pepaya 100 g (M5), Hyponex 1 g + pepaya 150 g (M6), Hyponex 2 g + pepaya 50 g (M7), Hyponex 2 g + pepaya 100 g (M8), Hyponex 2 g + pepaya 150 g (M9)
Semakin tinggi konsentrasi bubur pepaya yang diberikan mengakibatkan
pertumbuhan semakin kurang baik. Penggunaan bubur pepaya pada M4, M5 dan
M6 mengakibatkan jumlah daun yang dihasilkan lebih sedikit dibanding M2
24
pepaya 2 g/l, M7 memiliki rataan jumlah daun lebih tinggi dibandingkan M3
walaupun tidak berbeda nyata. Pada konsentrasi bubur pepaya yang lebih tinggi
diperoleh rataan jumlah daun yang semakin menurun. Hal ini diperkirakan
penambahan bubur pepaya 50 g/l merupakan konsentrasi optimum. Kemungkinan
pada konsentrasi 50 ml/l bubur pepaya memiliki kandungan asam organik,
vitamin atau zat lain yang tidak diketahui optimum berpengaruh untuk
meningkatkan pertumbuhan (Rahman et al. 2004).
Jumlah Akar
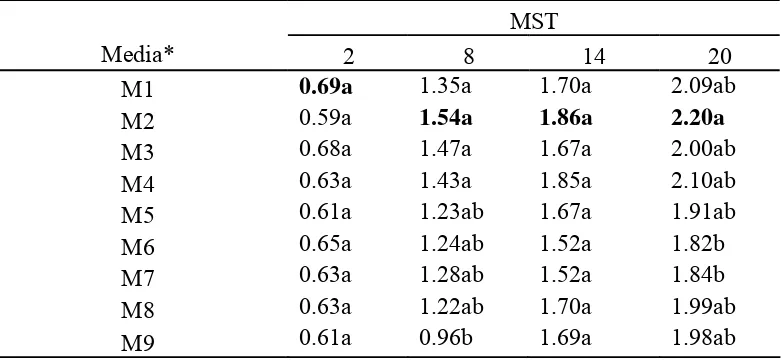
Hasil percobaan pada tabel 3 menunjukkan bahwa jumlah akar terbanyak
didapat dari M2 dengan rataan 2.20 buah. Pengaruh media tersebut tidak berbeda
nyata dengan seluruh perlakuan kecuali dengan M6 dan M7. Penambahan bubur
pepaya pada M4 meningkatkan jumlah akar dibandingkan M0 tetapi hasilnya
tidak signifikan. Hasil tersebut mengindikasikan bahwa media tanpa penambahan
bubur pepaya merupakan kondisi optimum bagi pertumbuhan akar.
Zat yang belum diketahui pada bubur pepaya diperkirakan menjadi
penyebab pertumbuhan akar yang tidak maksimal. Zat-zat dari bahan organik
sangat kompleks seperti diungkapkan Rahman et al. (2004) bahwa kandungan
bubur organik komplek terdiri dari karbohidrat, protein, lemak, bebarapa vitamin,
senyawa fenolik dan jumlah yang rendah dari asam amino dan asam organik.
Senyawa fenolik dimungkinkan terdapat dalam getah pepaya dan menyebabkan
25
Tabel 3. Pengaruh Komposisi Media Pembesaran terhadap Rataan Jumlah Akar AnggrekDendrobium selama 20 MST
MST
Ket: Rataan yang diikuti dengan huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata menurut uji Duncan pada taraf kepercayaan α=0.05.
MST: Minggu Setelah Tanam * = Data hasil transformasi (x+1)1/2
MS0 + vitamin (M1), Hyponex 1 g + vitamin (M2), Hyponex 2 g + vitamin (M3), Hyponex 1 g + pepaya 50 g (M4), Hyponex 1 g + pepaya 100 g (M5), Hyponex 1 g + pepaya 150 g (M6), Hyponex 2 g + pepaya 50 g (M7), Hyponex 2 g + pepaya 100 g (M8), Hyponex 2 g + pepaya 150 g (M9)
Penambahan bubur pepaya pada media pembesaran tunas anggrek
Dendrobium bersifat menghambat inisiasi akar sehingga jumlah akar lebih sedikit
jika dibandingkan dengan media tanpa penambahan bubur pepaya. Namun,
penambahan 50 g/l bubur pepaya pada 1 g/l Hyponex menghasilkan rataan jumlah
akar yang lebih jika dibandingkan dengan media 2 g/l tanpa penambahan
Hyponex. Hardinsyah dan Briawan (1994) (Tabel Lampiran 3) menyatakan bahwa
pepaya memiliki kandungan fosfor 12 mg/100 g bahan. Fosfor menurut Sutedjo
(2008) merupakan unsur yang dapat merangsang pertumbuhan akar, khususnya
akar benih/tanaman muda.
Tinggi Tunas, Panjang Daun, Lebar Daun, dan Panjang Akar
Hasil analisis sidik ragam menunjukkan bahwa pengaruh perlakuan
masing-masing media pada akhir pengamatan (20 MST) berpengaruh nyata terhadap
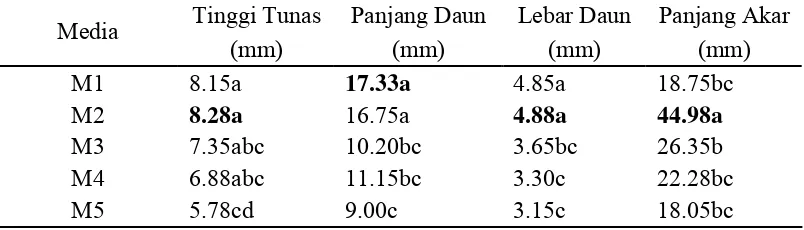
tinggi tunas. Hasil percobaan pada tabel 4 menunjukkan bahwa tinggi tunas
tertinggi dihasilkan pada media M2 (Hyponex 1 g/l + vitamin) dengan rataan
tinggi 8.28 mm, tetapi tidak berbeda nyata dengan M1 (MS0 + vitamin), M3
26
2 g/l + pepaya 50 g/l). Data tersebut menunjukkan bahwa unsur hara yang terdapat
pada M2 merupakan kondisi optimum bagi tanaman untuk tumbuh sedangkan
pada media dengan penambahan bubur pepaya terutama dengan konsentrasi yang
lebih tinggi mengakibatkan pertumbuhan eksplan terhambat. Senyawa fenol
dimungkinkan terdapat dalam bubur pepaya sehingga pada media yang diberi
bubur pepaya mengalami pertumbuhan yang lebih lambat. Menurut Hendariono
(2000), fenol dapat menjadi racun bagi tanaman karena pengikatan hidrogen pada
protein-protein.
Tinggi tunas menentukan keberhasilan aklimatisasi, tunas yang tinggi dan
vigor menandakan tunas tersebut sehat dan cadangan makanan yang terdapat pada
batang lebih banyak dibanding yang tidak tinggi. Cadangan makanan dapat
digunakan untuk metabolisme sementara hingga tunas dapat memperoleh hara dan
air dari lingkungan tumbuh yang baru.
Berdasarkan sidik ragam, perlakuan masing-masing media pada akhir
pengamatan (20 MST) berpengaruh sangat nyata terhadap panjang daun, lebar
daun, dan panjang akar. Hasil percobaan pada tabel 4 menunjukkan panjang daun
terpanjang didapat dari M1 (MS0 + vitamin) sebanyak 17.33 mm tetapi tidak
berbeda nyata dengan M2 (Hyponex 1 g/l + vitamin). Lebar daun terlebar didapat
dari M2 (Hyponex 1 g/l + vitamin) sebanyak 4.88 mm tetapi tidak berbeda nyata
dengan M1 (MS0 + vitamin). M2 dimungkinkan memiliki kandungan hara dan
vitamin yang dapat menggantikan M1. Panjang akar terpanjang didapat dari M2
(Hyponex 1 g/l + vitamin) dengan rataan panjang 44.98 mm.
Tabel 4. Pengaruh Komposisi Media Pembesaran Terhadap Rataan Tinggi Tunas, Panjang Daun, Lebar Daun, dan Panjang Akar Anggrek Dendrobium pada 20 MST
27
Tabel 4. (Lanjutan)
M6 5.18d 7.90c 3.05c 14.10c
M7 7.48ab 12.43b 4.25ab 16.58c
M8 6.55bcd 9.00c 3.33c 16.43c
M9 6.05bcd 8.80c 3.35c 13.55c
Ket: Rataan yang diikuti dengan huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata menurut uji Duncan pada taraf kepercayaan α=0.05.
MST: Minggu Setelah Tanam
MS0 + vitamin (M1), Hyponex 1 g + vitamin (M2), Hyponex 2 g + vitamin (M3), Hyponex 1 g + pepaya 50 g (M4), Hyponex 1 g + pepaya 100 g (M5), Hyponex 1 g + pepaya 150 g (M6), Hyponex 2 g + pepaya 50 g (M7), Hyponex 2 g + pepaya 100 g (M8), Hyponex 2 g + pepaya 150 g (M9).
Gambar 7. Keragaan Tunas Dendrobium pada Akhir Pengamatan in Vitro pada Berbagai media Pembesaran.
MS0 + vitamin (M1), Hyponex 1 g + vitamin (M2), Hyponex 2 g + vitamin (M3), Hyponex 1 g + pepaya 50 g (M4), Hyponex 1 g + pepaya 100 g (M5), Hyponex 1 g + pepaya 150 g (M6), Hyponex 2 g + pepaya 50 g (M7), Hyponex 2 g + pepaya 100 g (M8), Hyponex 2 g + pepaya 150 g (M9)
Gambar 8 menunjukkan keragaan eksplan pada akhir pengamatan (20
MST). Eksplan MST0 pada gambar merupakan eksplan awal saat penanaman
dengan tinggi lebih-kurang 0.3 cm, jumlah daun 2 helai dan rataan akar 0 buah
yang ditanam pada setiap perlakuan. Setelah 20 MST pertumbuhan menjadi
beragam. Secara visual eksplan tampak tidak berbeda jauh ukurannya, tetapi
media M1, M2 dan M3 menghasilkan eksplan yang lebih baik walaupun tanpa
II. Percobaan Media Aklimatisasi
Kondisi Umum
Media tanam yang akan digunakan disterilisasi terlebih dahulu untuk
menghilangkan patogen yang terbawa media sehingga kondisi media seragam
steril. Malaupun demikian, pertumbuhan tunas saat aklimatisasi secara umum
menunjukkan perkembangan yang kurang baik. Kemungkinan faktor utama yang
menyebabkan yaitu suhu tinggi di tempat percobaan. Keadaan panas
menyebabkan media tanam kering dengan cepat. Penyiraman yang dilakukan dua
kali sehari tidak dapat mempertahankan semua tanaman. Hal ini kemungkinan
akibat dari berbedanya kemampuan mengikat air.
Keberhasilan tanaman beradaptasi juga dipengaruhi oleh ketersediaan hara
yang dapat diambil oleh tanaman. Pemberian pupuk pada anggrek dengan cara
disemprot lebih efektif daripada disiramkan ke media atau akar. Hal ini diutarakan
oleh Tisdale (1985) bahwa pemberian pupuk melalui daun memberikan pengaruh
lebih cepat pada tanaman. Walaupun demikian, fungsi akar anggrek lebih
digunakan sebagai penopang, juga dapat berperan dalam penyerapan hara di
media walaupun kurang efektif.
Keunggulan pemakaian pupuk daun dibandingkan pupuk akar yaitu:
mensuplai hara sesuai kebutuhan tanaman, penyerapan hara oleh tanaman lebih
cepat, pemberiannya dapat merata, konsentrasi mudah diatur, mengandung hara
mikro dan struktur tanah (media) tetap baik (Lingga dan Marsono, 2001).
Tingkat keberhasilan hidup tunas selama 12 minggu pengamatan mencapai
85% dari seluruh satuan percobaan yang ditanam (400 tunas). Kondisi tanaman
berdaun hijau kekuningan, sebagian kering kemudian gugur. Pertumbuhan yang
kurang baik disebabkan oleh serangan cendawan. Dugaan ini diketahui dari tanda
yang dapat dilihat yaitu berwarna putih tepung dan hitam pada media dan pangkal
tunas. Berdasarkan literatur, tanda ini kemungkinan bagian dari organ Fusarium
spp. Fusarium menginfeksi melalui akar-akar dan berkembang dalam pembuluh
kayu. Fusarium oxysporum mempunyai banyak forma speciales (f. Sp.)
menyebabkan penyakit layu fusarium pada bermacam tanaman pertanian.
29
(Semangun, 2004). Tanaman yang terdapat tanda tersebut perkembangannya
menjadi turun seperti kurang vigor dan senesen dengan cepat. Fusarium
oxysporum tumbuh optimum in vitro pada suhu 25-30ºC. Pada suhu yang tinggi
umumnya tanaman mengalami cekaman dan lebih rentan terhadap F. oxysporum
(Wiyono, 2007). Fusarium menyerang akar dengan cepat dan menimbulkan
infeksi bermacam-macam (Cook and Baker, 1974). Anggrek.org. (2005),
menambahkan bahwa patogen menginfeksi tanaman melalui akar atau masuk
melalui luka pada akar rimpang yang baru saja dipotong, menyebabkan batang
dan daun berkerut. Bagian atas media tampak merana seperti kekurangan air,
menguning, dengan daun-daun yang keriput, umbi semu menjadi kurus,
kadang-kadang agak terpilin. Perakaran busuk, pembusukan pada akar dapat meluas ke
atas, sampai ke pangkal batang.
Perkembangan cendawan yang cepat kemungkinan disebabkan karena suhu
dan kelembapan yang optimum bagi perkembangan cendawan. Selain itu, kondisi
tanaman yang tidak sehat dipengaruhi pula oleh cuaca / iklim lingkungan
sehingga mudah terserang penyakit seperti pernyataan Wiyono (2007), bahwa
perkembangan penyakit sangat dipengaruhi oleh faktor dinamika iklim. Sehingga
pada musim hujan dunia pertanian banyak disibukkan oleh masalah penyakit
tanaman seperti penyakit kresek dan blas pada padi, antraknosa cabai dan
sebagainya. Faktor-faktor iklim berpengaruh terhadap ketahanan tanaman inang.
Tanaman vanili yang mengalami cekaman karena terlalu banyak cahaya akan
rentan terhadap penyakit busuk batang yang disebabkan oleh Fusarium.
Penyemprotan fungisida Dithane M-45 3 g/l yang dilakukan dua minggu
sekali tidak dapat menghambat perkembangan penyakit ini karena fusarium hidup
dalam jaringan tanaman (sistemik). Menurut Ploetz (1998), bahwa fusarium tidak
dapat dikendalikan dengan fungisida, sekalisaja tanah terinfeksi maka beberapa
tahun tidak dapat dinetralkan dengan fumigasi dan eradikasi.
Berdasarkan hasil rekapitulasi sidik ragam terhadap peubah yang diamati
(Tabel 5), perlakuan media aklimatisasi menunjukkan bahwa jumlah daun dan
tinggi tunas menunjukkan pengaruh sangat nyata pada akhir pengamatan. Namun,
perlakuan media aklimatisasi menunjukkan tidak berpengaruh nyata terhadap
30
Tabel 5. Rekapitulasi Sidik Ragam Jumlah Daun, Tinggi Tunas, Panjang Daun, dan Lebar Daun Anggrek Dendrobium selama Aklimatisasi
Peubah MST Perlakuan KK(%)
Ket: tn = tidak berbeda nyata pada taraf 5% (P>0,05) * = berbeda nyata pada taraf 5% (P<0,05) ** = sangat berbeda nyata pada taraf 1% (P<0,01)
a) Data hasil transformasi (x+0.5)1/2
Persentase Hidup
Persentase tunas yang dapat bertahan hidup terbanyak pada 10 MST
dihasilkan dari A3 (serbuk pakis) dengan nilai 100% kemudian menurun pada
akhir pengamatan (12 MST) hingga 98%. Persentase hidup yang baik selanjutnya
didapat dari M4 (cocopeat) dengan nilai 96%. Sedangkan pada M2 (Sphagnum
moss) dan M1 (Arang sekam) masing-masing memiliki nilai 80% dan 66%.
Media M3 dan M4 dapat mempertahankan persentse hidup lebih baik
daripada A1 dan A2. Persentase hidup tunas kemungkinan dipengaruhi oleh
kemampuan media memegang air. Evaporasi arang sekam kemungkinan lebih
besar dari media lain diketahui dari pengeringan yang lebih cepat. Sedangkan
kemampuan pegang air pada Sphagnum moss sangat besar, dengan demikian
evaporsi menjadi lebih rendah dan mengakibatkan media lebih lembab. Keadaan
ini kemungkinan mengakibatkan kerusakan karena persediaan oksigen di dalam
media yang sedikit. Media yang terlalu kuat memegang air dapat mengurangi
udara dalam media dan persediaan O2 menjadi minim sehingga menimbulkan
busuk akar (Sutiyoso, 1997). Selain itu, kerusakan akar mengakibatkan akar tidak
dapat menopang tunas dengan baik sehingga tunas menjadi rebah. Cocopeat
dimungkinkan memiliki kemampuan penguapan yang lebih baik dibandingkan
Sphagnum moss walaupun kemampuan menyerap airnya juga tinggi,
31
sphagnum moss yang masih basah. Yanti (2007), menyatakan bahwa penggunaan
media yang menyimpan banyak air pada daerah dengan kelembapan udara tinggi
tidak dianjurkan. Sifatnya yang selalu basah mengundang penyakit busuk akar
dan busuk tunas anakan.
Akar tanaman anggrek berdasarkan fungsinya dibedakan menjadi akar lekat
dan akar udara. Akar lekat berfungsi untuk melekatkan/menguatkan tubuh
tanaman pada media, sedangkan akar udara berfungsi untuk mengambil air dan
unsur hara dari lingkungan tempat tumbuhnya (Gunadi, 1977). Kerusakan akar
dapat mengganggu fungsi akar dalam menyerap unsur hara dan air, terutama pada
pembibitan yang biasa menggunakan media remah seperti serbuk pakis dan
cacahan kaliandra. Penetrasi akar ke dalam media remah ketika pembibitan
menjadi tidak baik seperti pernyataan Lakitan (2004), bahwa wilayah eksplorasi
akar memungkinkan kontak dengan air dan unsur hara. Eksplorasi akar
memegang peranan penting karena pot yang digunakan ketika pembibitan
berukuran kecil, sehingga media yang tertampung sedikit pula. Akar akan
menembus ke dalam media untuk mencari air. Sedangkan penyerapan air dan
unsur hara dilakukan oleh bulu-bulu akar.
Serbuk pakis menunjukkan persentase hidup tunas paling tinggi. Hal ini
dimungkinkan karena daya pegang air yang lebih baik dibandingkan arang sekam
dan evaporasi yang lebih tinggi dibanding sphagnum moss. Keadaan ini
menyerupai cocopeat yaitu permukaan atas media yang lebih kering daripada
bagian bawah sehingga tidak menyebabkan kerusakan akar yang terlalu parah
seperti sphagnum moss. Berdasarkan pengamatan visual, serbuk pakis paling
sedikit ditumbuhi cendawan dibanding media lain.
Jumlah Daun
Hasil percobaan pada tabel 6 menunjukkan bahwa perlakuan sangat nyata
mempengaruhi jumlah daun dimulai pada 4 MST hingga akhir pengamatan.
Rataan jumlah daun terbanyak diperoleh dari perlakuan serbuk pakis (2,3 helai)
hingga akhir pengamatan walaupun tidak berbeda nyata dengan cocopeat.
Kerusakan akar kemungkinan mempengaruhi jumlah daun pada media
perlakuan sphagnum moss sehingga lebih rendah dibandingkan serbuk pakis dan
32
hara seperti pernyataan Gunadi (1977) bahwa salah satu fungsi akar anggrek yaitu
menyerap unsur hara dan air. Selain itu, kerusakan akar juga menyebabkan
tanaman menjadi rebah sehingga daun menyentuh media. Keadaan ini
mengakibatkan daun mudah terserang penyakit kemudian menjadi busuk dan
mati. Tanaman yang terinfeksi Fusarium berakibat akar rusak dan pangkal batang
busuk sehingga mudah rebah (Semangun, 2004).
Jumlah daun pada arang sekam menjadi semakin sedikit karena sifat media
yang cepat kering. Hal ini dimungkinkan karena fungsi akar sebagai alat penyerap
hara dan air, seperti pernyataan Gunadi (1977), untuk mensuplai kebutuhan tidak
berfungsi maksimal. Media yang kering karena penguapan akibat suhu tinggi
dapat mengakibatkan pembentukan daun menjadi terhambat. Lakitan (1996),
mengungkapkan kadar air kurang dari 90% menyebabkan pembesaran sel daun
terhambat dan akan berhenti apabila kadar air mencapai 70-75%.
Tabel 6. Pengaruh Komposisi Media Aklimatisasi Terhadap Rataan Jumlah Daun Anggrek Dendrobium selama 12 MST
MST
Ket: Rataan yang diikuti dengan huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata menurut uji Duncan pada taraf kepercayaan α=0,05.
MST: Minggu Setelah Tanam * = Data hasil transformasi (x+0,5)1/2
Arang sekam (A1), Sphagnum moss (A2), Serbuk pakis (A3), Cocopeat (A4)
Tinggi Tunas, Panjang Daun, dan Lebar Daun
Hasil percobaan pada tabel 7 menunjukkan bahwa tinggi tunas tertinggi
didapat dari serbuk pakis (M3) dengan rataan 13,14 mm tetapi perlakuan ini tidak
berbeda nyata dengan cocopeat (M4) dengan rataan 12.50 mm. Sedangkan media
yang menghasilkan tanaman dengan tinggi terendah dihasilkan dari arang sekam
(M1) dengan rataan 10.18 mm dan tidak berbeda nyata dengan Sphagnum moss
(M2) dengan rataan 10.75 mm. Pertumbuhan tinggi tanaman dimungkinkan
33
faktor serangan penyakit juga mempengaruhi yaitu mengakibatkan metabolisme
menjadi terganggu. Wiyono (2007), menyatakan bahwa penyakit tanaman
menimbulkan gangguan fisiologis pada tanaman. Penyakit ini disebabkan oleh
cendawan, bakteri, fitoplasma, virus, viroid, nematoda dan tumbuhan tingkat
tinggi.
Perlakuan masing-masing media pada akhir pengamatan (12 MST)
berpengaruh tidak nyata terhadap panjang dan lebar daun dengan rataan tertinggi
41,95 mm diperoleh dari Sphagnum moss dan 10,74 mm dari serbuk pakis.
Tabel 7. Pengaruh Komposisi Media Aklimatisasi Terhadap Rataan Tinggi Tunas, Panjang Daun, dan Lebar Daun Anggrek Dendrobium pada 12 MST
Media Tinggi Tunas
(mm)
Ket: Rataan yang diikuti dengan huruf yang sama pada kolom yang sama menunjukkan tidak berbeda nyata menurut uji Duncan pada taraf kepercayaan α=0,05.
MST: Minggu Setelah Tanam
Arang sekam (A1), Sphagnum moss (A2), Serbuk pakis (A3), Cocopeat (A4)
(a) (b)
(c) (d)
Gambar 8. Keragaan Akhir Pengamatan Media Aklimatisasi pada Minggu ke-12: Arang sekam (a), Sphagnum moss (b), Serbuk pakis (c), Cocopeat (d).
Gambar 9 memperlihatkan keragaan tanaman hasil aklimatisasi pada akhir
34
kurang vigor dan banyak bibit yang gugur daun. Sedangkan pada serbuk pakis dan
sphagnum moss pertumbuhan bibit terlihat baik ditandai dengan tanaman yang
vigor dan daun berwarna hijau.
Gambar 9. Keragaan Tunas Anggrek Dendrobium Akhir Aklimatisasi pada 12 MST pada Berbagai Media Aklimatisasi.
Gambar 10 menunjukkan keragaan bibit pada akhir pengamatan
aklimatisasi (12 MST) yang diambil secara acak. Bibit yang ditanam pada media
arang sekam terlihat kurang baik pertumbuhannya dibandingkan bibit pada media
lain. Jumlah daun tidak banyak dikarenakan gugur daun, kurang vigor dan
akarnya tidak sehat karena penyakit. Bibit yang baik diperoleh dari media tanam
serbuk pakis, dan hasil bibit yang mendekati bibit pada serbuk pakis yaitu