i
MELALUI ORAL PADA DOSIS BERBEDA
MUHAMMAD SAFIR
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
iii Dengan ini saya menyatakan bahwa tesis “Respons benih ikan gurame (Osphronemus goramy) yang diberi hormon pertumbuhan rekombinan melalui oral pada dosis berbeda” adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukkan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Oktober 2012
v MUHAMMAD SAFIR. Response of Giant Gourami (Osphronemus goramy) Juvenile on Oral Administration in Different Dose of Recombinant Growth Hormone. Supervised by ALIMUDDIN and NUR BAMBANG PRIYO UTOMO.
This study was aimed to evaluate the response of giant gourami juvenile on oral administration of recombinant giant grouper growth hormone (rElGH). A total of 45 juvenile were fed with rElGH coated by hydropropylmethyl cellulose phthalate (HP55) and mix with commercial diet (35% protein content). Feeding fish with diet containing four different doses of rElGH (0 mg/kg feed, 0.3 mg/kg feed, 3.0 mg/kg feed, and 30.0 mg/kg feed) was performed in twice a week for 2 month. Fish were then maintained for 1 month without rElGH treatment. The results showed that biomass harvest in treatment 3.0 mg/kg (1,376.0±38.3 g) and 30.0 mg/kg (1,362.2±78.5 g) was similar, and the two treatments were 46.76% and 44.28% higher compared to control (977.6±96.7 g), respectively. In addition, rElGH treatment increased appetite, while artificial feed conversion ratio (1.18) was lower (P<0.05) by 23.72% compared to that of control (1.46). Oral administration of rElGH also increased hepatosomatic index (16.12%) and protein content (17%), while lipid content (21%) decreased compared to control. Similar in fish survival at end of experiment, insulin-like growth factor-1 and growth hormone receptor-1 gene expression levels in brain at 24 hours after feeding in rElGH treatment and control were obtained. Thus, orally rElGH administration was effective to be applied to enhance the growth of giant gourami juvenile. Keywords: Recombinant growth hormone, oral administration, dose, giant
vii MUHAMMAD SAFIR. Respons benih ikan gurame (Osphronemus goramy) yang diberi hormon pertumbuhan rekombinan melalui oral pada dosis berbeda. Dibimbing oleh ALIMUDDIN dan NUR BAMBANG PRIYO UTOMO.
Permasalahan utama dalam budidaya ikan gurame adalah pertumbuhannya yang relatif lambat, sehingga waktu yang diperlukan untuk mencapai ukuran konsumsi adalah relatif lama. Upaya untuk meningkatkan laju pertumbuhan dapat dilakukan dengan berbagai cara, seperti seleksi ikan, transfer gen, dan penggunaan protein rekombinan. Namun demikian, kedua metode awal tersebut kurang aplikatif diterapkan pada ikan gurame karena terkendala oleh pertumbuhan yang mengakibatkan pematangan gonad yang lama serta metode pemijahan buatan pada ikan gurame belum dikuasai dengan baik. Selanjutnya penggunaan protein rekombinan dalam hal ini hormon pertumbuhan rekombinan (recombinant growth hormone/rGH) merupakan metode tepat yang dapat dijadikan solusi alternatif untuk mengatasi permasalahan pada ikan gurame. Hal ini dapat dilihat dari beberapa hasil yang signifikan pada beberapa spesies ikan budidaya yang menunjukkan bahwa rGH mampu mempercepat pertumbuhan dan perkembangan, membantu proses metabolisme, osmoregulasi, reproduksi, dan fungsi kekebalan tubuh.
Aplikasi rGH dapat dilakukan menggunakan metode injeksi, perendaman, dan melalui pakan. Pemberian rGH melalui injeksi kurang aplikatif digunakan karena memerlukan waktu yang relatif lama, dan sumberdaya yang banyak serta dibatasi oleh ukuran ikan. Selanjutnya metode imersi hanya efektif dilakukan pada fase larva/benih ikan, sehingga pada penelitian ini aplikasi rGH diarahkan secara oral melalui pakan. Selain itu, rGH yang digunakan pada penelitian ini adalah dari ikan kerapu kertang (rElGH). Penelitian ini bertujuan untuk mendapatkan dosis rElGH dalam pakan yang memberikan pertumbuhan tertinggi dalam pendederan ikan gurame. Selain itu, penelitian ini juga dilakukan untuk mengevaluasi ekspresi gen insulin-like growth factor-1 (IGF-1) dan growth hormone receptor-1 (GHR-1) yang terkait dengan mekanisme kerja hormon pertumbuhan secara tidak langsung, serta menganalisis respons benih ikan gurame dalam memakan pakan, histologi hati dan hepatosomatic index (HSI). Hasil penelitian ini diharapkan dapat bermanfaat sebagai salah satu solusi untuk meningkatkan laju pertumbuhan ikan gurame dalam upaya peningkatan produksi perikanan budidaya Indonesia.
Produksi rElGH dilakukan menggunakan bakteri Escherichia coli BL21 yang mengandung plasmid pCold-rElGH. Bakteri dikultur pada media 2xYT pada suhu inkubasi 15°C selama 24 jam dan diinduksi dengan isopropyl-b-D-thiogalac-topyranoside dengan dosis 0,5 mM. Bakteri dilisis dengan menggunakan lisozim, kemudian rGH diendapkan menggunakan sentrifugasi. Analisis SDS-PAGE digunakan untuk memastikan adanya rElGH dalam protein total dari bakteri.
viii
rElGH dengan frekuensi 2 kali dalam seminggu, dan 4 minggu berikutnya hanya diberikan pakan normal.
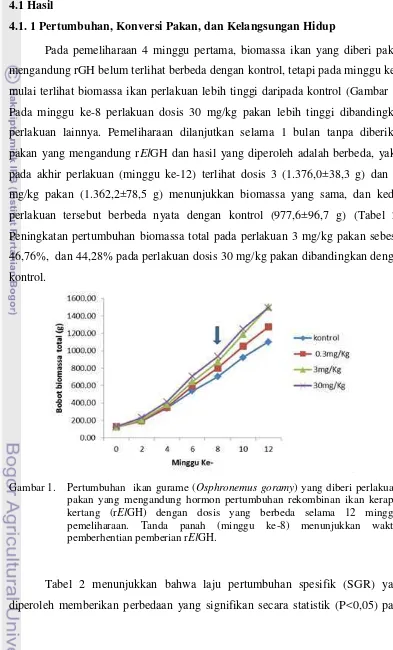
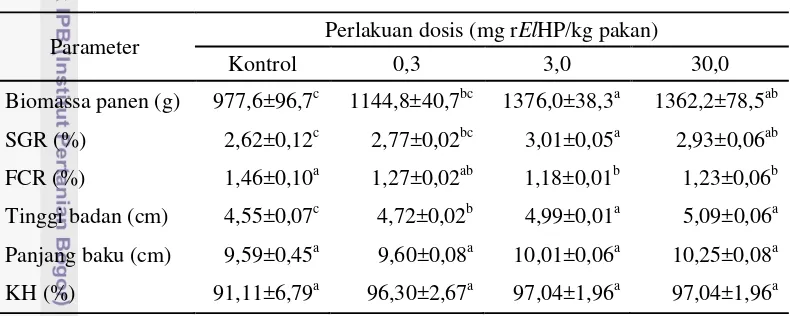
Hasil penelitian menunjukkan bahwa perlakuan rElGH dengan dosis 3 mg/kg pakan memberikan biomassa yang tertinggi (1.376,0±38,3 g), diikuti dosis 30 mg/kg pakan (1.362,2±78,5 g), 0,3 mg/kg pakan (1.144,8±40,7 g) dan terendah adalah kontrol (977,6±96,7 g). Biomassa ikan perlakuan dosis 3 mg/kg pakan berbeda nyata (P<0,05) dibandingkan kontrol. Peningkatan pertumbuhan biomassa total pada perlakuan 3 mg/kg pakan sebesar 46,76%, dan 44,28% pada perlakuan dosis 30 mg/kg pakan dibandingkan dengan kontrol. Selain itu, laju pertumbuhan spesifik (SGR) ikan perlakuan 3 dan 30 mg/kg pakan berbeda nyata (P<0,05) terhadap kontrol. SGR yang tertinggi terjadi pada perlakuan dosis 3 mg/kg pakan, yakni sebesar 14,89% dibandingkan dengan kontrol. Selain itu, konversi pakan (FCR) dan tinggi badan ikan perlakuan 3 mg/kg pakan masing-masing meningkat sebesar 23,72%, dan 9,67% dibandingkan dengan kontrol. Sementara itu, panjang baku dan kelangsungan hidup (KH) ikan tidak menunjukkan perbedaan yang signifikan (P>0,05). Berdasarkan nilai rerata, KH perlakuan rElGH (96,30-97,04%) relatif lebih tinggi daripada kontrol (91,11%). Variasi KH yang relatif rendah pada ikan perlakuan rElGH merupakan hal baik bagi akuakultur, karena variasi produktivitas (biomassa panen) budidaya akan menjadi kecil. Dengan kata lain bahwa kepastian pencapaian target produksi budidaya ikan dengan perlakuan rElGH lebih tinggi daripada tanpa perlakuan rElHP (kontrol).
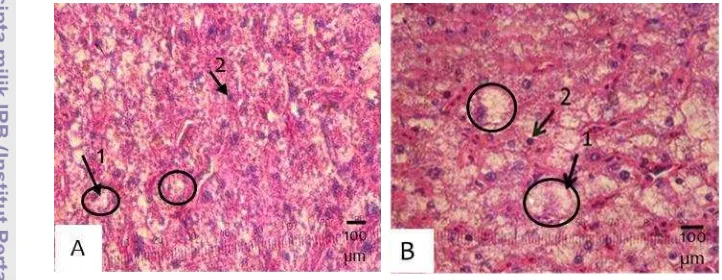
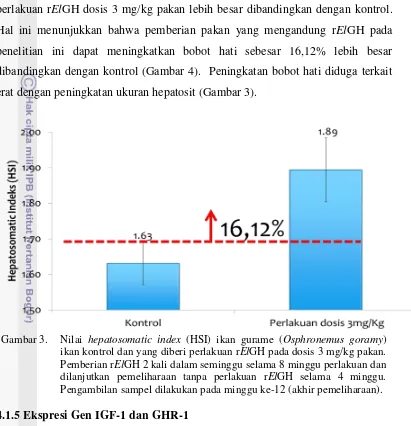
Gambaran histologi hati ikan perlakuan rElGH dosis 3 mg/kg pakan dan kontrol relatif sama. Hal ini menunjukkan bahwa pemberian pakan yang mengandung rElGH pada ikan gurame tidak memberikan efek negatif atau kerusakan pada hati. Perbedaan gambaran hati terdapat pada ukuran hepatosit yang lebih besar pada ikan perlakuan rElGH, yang diduga disebabkan oleh akumulasi nutrien lebih banyak dibandingkan dengan kontrol. Hal ini diperkuat dengan meningkatnya HSI ikan perlakuan rElGH sebesar 16,12% dibandingkan dengan kontrol. Selanjutnya, perlakuan rElGH 3 mg/kg pakan meningkatkan sintesis protein (kandungan protein yang meningkat) dan menstimulasi lipolisis (ditandai dengan penurunan kadar lemak).
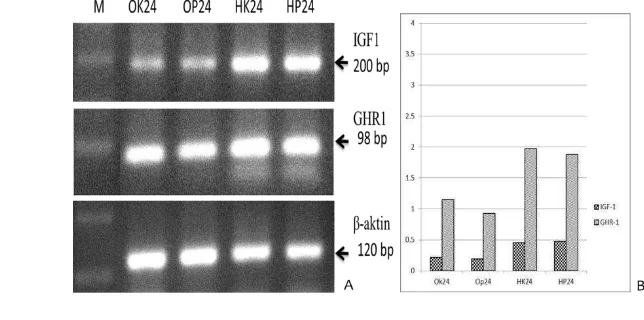
Analisis semi-kuantitatif RT-PCR menunjukkan bahwa ekspresi gen IGF-1 dan GHR-IGF-1 di otak dan hati saat 24 jam pasca perlakuan rElGH adalah relatif sama dengan kontrol. Dengan demikian mekanisme kerja rElGH melalui pakan diduga memanfaatkan mekanisme kerja secara langsung; tidak melibatkan jalur IGF-1 di hati.
Sebagai kesimpulan, pemberian rElGH melalui pakan dapat meningkatkan pertumbuhan ikan gurame secara signifikan. Dosis yang terbaik adalah 3 mg/kg pakan. Pemberian rElGH mampu menghemat penggunaan pakan dengan menurunkan FCR secara signifikan, dan meningkatkan HSI. Kadar lemak ikan perlakuan rElGH menurun. Pemberian rElGH melalui pakan tidak mempengaruhi ekspresi gen IGF-1 dan GHR-1 pada jam ke-24 setelah pemberian pakan.
ix
©
Hak Cipta milik IPB, tahun 2012
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjaun suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
xi
MELALUI ORAL PADA DOSIS BERBEDA
MUHAMMAD SAFIR
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Akuakultur
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
xii
Dosen Penguji Luar Komisi pada Ujian Tesis:
xiii Nama : Muhammad Safir
NIM : C151 10 0091
Disetujui Komisi Pembimbing
Dr. Alimuddin, S.Pi, M.Sc Dr. Ir. Nur Bambang P.U, M.Si Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Ilmu Akuakultur
Prof.Dr.Ir. Enang Harris, M.S Dr.Ir. Dahrul Syah, M.Sc. Agr
xv Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah TESIS ini berhasil diselesaikan. Penelitian dilaksanakan sejak bulan Maret sampai Juli 2012 dengan tema tentang rekayasa pada budidaya ikan gurame. Judul penelitian ini adalah “Respons benih ikan gurame (Osphronemus goramy) yang diberi hormon pertumbuhan rekombinan melalui oral pada dosis berbeda”.
Keberhasilan penulis dalam menyelesaikan penelitian ini tidak semata didapatkan sendiri, melainkan dengan bantuan orang-orang sekitar. Untuk itu penulis mengucapkan terima kasih kepada Dr. Alimuddin, S.Pi, M.Sc. selaku Pembimbing 1, Dr. Ir. Nur Bambang Priyo Utomo, M.Si. selaku Pembimbing II dan Dr. Dinamella Wahjuningrum, S.Si, M.Si, selaku penguji luar komisi pada ujian tesis. Irmawati S.Pi, M.Si, Aras Sazili, S.Pi, M.Si, Anna Octavera, S.Pi, M.Si, Eny Heriyati S.Pi, M.Si, Boyun Handoyo, S.Pi, M.Si, La Ode Muh. Arsal S.Pi, La Ode Aslin S.Pi, rekan-rekan di Laboratorium Reproduksi dan Genetika Organisme Akuatik, mahasiswa Akuakultur IPB 2010, serta Mahasiswa Pascasarjana Asal Sulawesi Selatan. Ucapan terima kasih juga penulis sampaikan kepada kedua orang tua dan saudara-saudara penulis atas segala dukungan, doa dan kasih sayangnya,
Penulis telah berusaha semaksimum mungkin dalam penyelesaian karya ilmiah ini. Dengan harapan, karya ilmiah ini dapat bermanfaat bagi penulis dan para pembaca pada umumnya.
Bogor, Oktober 2012
xix Halaman
DAFTAR TABEL... xiii
DAFTAR GAMBAR... xiv
DAFTAR LAMPIRAN... xv
I. PENDAHULUAN... 1
1.1. Latar Belakang... 1
1.2. Rumusan Masalah... 3
1.3. Tujuan dan Manfaat... 3
II. TINJAUAN PUSTAKA... 5
2.1. Ikan Gurame (Osphronemusgoramy)... 5
2.2. PertumbuhanIkanGurame……….…... 5
2.3. Hormon Pertumbuhan…... 6
2.4. HormonInsulin-like Growth Factor-1 (IGF-1) danGrowth Hormon Receptor-1………... 7
2.5. EfekrGHpadaPertumbuhanIkan... 8
2.6. PakanIkanGurame... 8
2.7. Penyalutan (Coating) ... 9
III. BAHAN DAN METODE... 11
3.1. IkanUji... 11
3.2. ProduksirGH………... 11
3.3. PembuatanPakanMengandungrGH... 12
3.4. Pemberian rElGH-HP55 denganDosisBerbedaMelaluiPakan 12 3.5. Analisis Hepatosomatic Index (HSI)... 13
3.6. AnalisisProksimatPakandanKomposisiTubuh (AOAC 1984)... 13
3.7. AnalisisEkspresi gen IGF-I dan GHR-1... 14
3.8. AnalisisStatistik... 16
IV. HASIL DAN PEMBAHASAN... 17
xx
4.1.4. Hepatosomatic index………... 20
4.1.5. Ekspresi Gen IGF-1 dan GHR-1... 20
4.2. Pembahasan... 21
V. SIMPULAN DAN SARAN... 25
5.1. Simpulan... 25
5.2. Saran... 25
DAFTAR PUSTAKA... 27
LAMPIRAN... 35
xxi Halaman
1. Komposisi proksimat pakan yang digunakan (% bobot kering)... 12 2 Biomassa panen, laju pertumbuhan spesifik (SGR), kelangsungan hidup
(KH), tingkat konversi pakan (FCR), tinggi badan dan panjang baku benih ikan gurame yang diberi perlakuan hormon pertumbuhan rekombinan ikan kerapu kertang (rElGH) dan control……….. 18 3. Proksimat (% berat kering) tubuh benih ikan gurame pada awal dan
xxiii Halaman
1. Pertumbuhan ikan gurame (Osphronemusgoramy) yang diberi perlakuan pakan yang mengandung hormon pertumbuhan rekombinan ikan kerapu kertang (rElGH) dengan dosis yang berbeda selama 12 minggu pemeliharaan. Tanda panah (minggu ke-8) menunjukkan waktu pemberhentian pemberian rElGH...
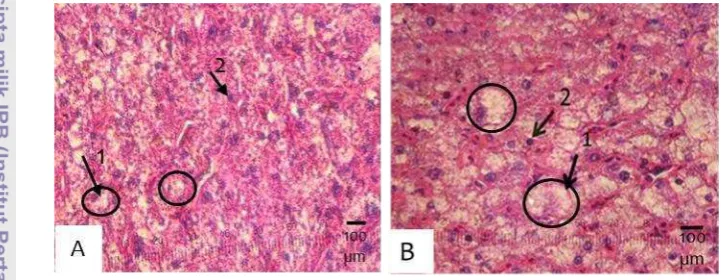
17 2. Histologi hati benih ikan gurame kontrol (A) dan perlakuan rElGH 3
mg/kg pakan (B) menggunakan pewarna H-E. 1=hepatosit; 2= sinusoid. Sampel diambil pada akhir pemeliharaan (minggu ke-12)... 19 3. Nilai hepatosomatic index (HSI) ikan gurame (Osphronemusgoramy)
ikan kontrol dan yang diberi perlakuan rElGH pada dosis 3 mg/kg pakan. Pemberian rElGH 2 kali dalam seminggu selama 8 minggu perlakuan dan dilanjutkan pemeliharaan tanpa perlakuan rElGH selama 4 minggu. Pengambilan sampel dilakukan pada minggu ke-12 (akhir pemeliharaan)... 20 4. Ekspresi gen insulin-like growth factor-1 (IGF-1), growth hormone
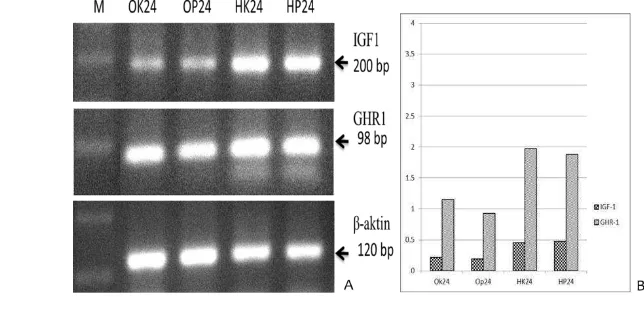
receptor -1 (GHR-1), dan β-aktin pada hati dan otak ikan gurame kontrol dan perlakuan pakan mengandung hormon pertumbuhan rekombinan ikan kerapu kertang (rElHP) pada jam ke-24 setelah pemberian pakan. A= Hasil elektroforesis DNA; B= Level ekspresi gen IGF-1/β-aktin dan GHR-1/β-aktin. OK24 (otak ikan kontrol jam ke-24), OP24 (otak ikan perlakuan jam ke-24), HK24 (hati ikan kontrol ikan jam 24) dan HP24 (hati ikan perlakuan ikan jam
xxv Halaman
1. Biomassa total setiap sampling hingga akhir pemeliharaan... 35 2. Laju pertumbuhan spesifik (SGR,%) ikan gurame selama pemeliharaan
pada minggu ke-8 dan 12……….. 35 3. Hasil analisis statistik biomassa panen pada benih ikan gurame... 35 4. Hasil analisis statistik laju pertumbuhan spesifik (SGR) pada benih
ikan gurame... 37 5. Hasil analisis statistik tingkat konversi pakan (FCR) pada benih ikan
gurame………. 38
6. Hasil analisis statistik tinggi badan benih ikan gurame……… 39 7. Hasil analisis statistik panjang baku benih ikan gurame……….. 41 8. Hasil analisis statistik kelangsungan hidup (KH) benih ikan gurame... 42 9 Analisis sederhana biaya penggunaan pakan pada benih ikan gurame
I. PENDAHULUAN
1.1 Latar Belakang
Ikan gurame (Osphronemus goramy) merupakan salah satu spesies ikan budidaya air tawar yang produksinya ditargetkan mencapai 48.900 ton pada tahun 2014 atau meningkat 127% dibandingkan dengan tahun 2009 yang hanya sebesar 46.452 ton (KKP 2010). Salah satu kendala untuk mencapai target tersebut adalah laju pertumbuhan ikan gurame lambat. Untuk mencapai ukuran konsumsi sebesar 500 g/ekor dibutuhkan waktu sekitar 1,5 tahun (SNI 2006).
Upaya untuk meningkatkan laju pertumbuhan dapat dilakukan dengan berbagai cara, seperti seleksi ikan, transfer gen, dan penggunaan protein rekombinan. Metode seleksi merupakan salah satu metode yang terbukti dapat meningkatkan pertumbuhan untuk beberapa ikan budidaya (Winarlin et al. 2007). Akan tetapi, metode ini kurang aplikatif untuk diterapkan ke ikan gurame. Ikan gurame membutuhkan waktu sekitar 3 tahun untuk setiap generasi sehingga diperlukan waktu yang relatif lama untuk perbaikan laju pertumbuhan yang signifikan. Rekayasa molekuler seperti transfer gen juga dapat dilakukan untuk memperbaiki laju pertumbuhan. Teknologi ini berhasil meningkatkan pertumbuhan sebesar 100 – 3.000x pada generasi ketiga (Beardmore & Porter 2003). Akan tetapi lambatnya ikan gurame mencapai ukuran induk, dan metode pemijahan buatan yang belum dikuasai dengan baik menjadi kendala untuk mengaplikasikan teknologi ini.
rGH ikan nila pada benih ikan mas koki dapat meningkatkan bobot tubuh hingga 3,5 kali dibandingkan kontrol (Acosta et al. 2009).
Hormon pertumbuhan merupakan polipeptida esensial yang dibutuhkan oleh vertebrata untuk pertumbuhan dan perkembangan organisme secara normal (Anathy et al. 2001), metabolisme (Rousseau & Dufour 2007), osmoregulasi (Sakamoto et al. 1997), kekebalan tubuh (Sakai et al. 1997; Yada et al. 1999) serta peningkatan reproduksi (McLean et al. 1993). Mekanisme kerja GH pada ikan dapat bersifat secara langsung dan tidak langsung. Mekanisme secara langsung adalah langsung mempengaruhi pertumbuhan organ tanpa perantara insulin–like growth factor-1 (IGF-1) dalam hati atau langsung ke organ target,
sedangkan secara tidak langsung adalah pertumbuhan dimediasi atau melibatkan IGF-1 dalam hati. Pada mekanisme tersebut terdapat beberapa faktor yang berperan di antaranya growth hormone receptor (GHR-1), yang memiliki fungsi dalam menangkap sinyal GH yang disekresikan oleh pituitari (Bjornsson et al. 2004; Debnanth 2010). Oleh karena itu pada penelitian ini dilakukan analisis ekspresi IGF-1 dan GHR-1 untuk melihat mekanisme kerja GH secara tidak langsung.
Aplikasi rGH dapat dilakukan menggunakan metode injeksi, perendaman, dan melalui pakan. Aplikasi rGH dengan cara injeksi meningkatkan pertumbuhan ikan rainbow trout (Agellon et al. 1988), ikan mujair (Tsai et al. 1994), ikan mas (Promdonkoy et al. 2004), ikan salmon coho (Oncorhynchus kisutch) (Shimizu et al. 2007), ikan nila (Lesmana 2010) dan ikan gurame (Irmawati, belum
dipublikasikan). Cara perendaman/imersi telah dilakukan pada ikan salmon (Oncorhynchus kisutch dan O. keta) (Moriyama & Kawauchi 1990), ikan nila (Acosta et al. 2009), ikan lele Afrika (Clarias gariepinus) (Yilmaz et al. 2009), ikan gurame (Putra 2010; Syazili et al. 2011), dan melalui pakan seperti pada ikan giant catfish (Pangasionodon gigas) (Piyaviriyakul et al. 2002), ikan mas
(Promdonkoy et al. 2004), ikan red seabrem (Xu et al. 2001), benih ikan nila (Hardiantho et al. 2011) serta pada benih ikan sidat (Handoyo 2012).
larva/benih ikan. Oleh karena itu, pada penelitian ini aplikasi rGH diarahkan secara oral melalui pakan. Beberapa rGH ikan seperti rGH ikan mas (rCcGH), ikan gurame (rOgGH), dan ikan kerapu kertang (rElGH) telah diproduksi, dan diuji bioaktivitasnya dalam memacu laju pertumbuhan ikan (Alimuddin et al. 2010). Berdasarkan analisis SDS-PAGE, rGH ikan kerapu kertang terekspresi pada level lebih tinggi dibandingkan kedua jenis rGH lainnya (Irmawati, belum dipublikasikan). Selain itu, aplikasi rElGH pada ikan sidat dengan dosis pemberian 30 mg/kg pakan dengan frekuensi pemberian 2 kali dalam seminggu telah dilakukan dan memberikan pertumbuhan yang signifikan lebih tinggi dibandingkan dengan kontrol (Handoyo 2012). Oleh karena itu pada penelitian ini digunakan rElGH untuk memacu pertumbuhan benih ikan gurame.
1.2 Rumusan Masalah
Ikan gurame merupakan ikan yang memiliki pertumbuhan yang lambat untuk mencapai ukuran konsumsi (~500 g) dibutuhkan waktu sekitar 1,5 tahun dari ukuran 2-3 cm. Aplikasi rGH melalui injeksi, dan imersi telah dilakukan dan hasilnya efektif untuk meningkatkan pertumbuhan, tetapi kurang efisien dari segi waktu, dan kurang praktis. Sementara itu, beberapa penelitian mengenai pemberian rGH melalui pakan di antaranya yang telah dilakukan oleh Tsai et al. (1997) pada juvenil ikan black seabream (Acantlmpagrus schlegeli), ikan giant catfish (Piyaviriyakul et al. 2002), ikan mas (Promdonkoy et al. 2004) dan ikan
sidat (Handoyo 2012), dan berhasil meningkatkan pertumbuhan secara signifikan. Oleh sebab itu, aplikasi rGH melalui pakan diharapkan dapat meningkatkan pertumbuhan ikan gurame, dengan mencari dosis yang optimum. Selain itu, untuk mengetahui mekanisme tidak langsung dari aplikasi rGH tersebut dilakukan analisis ekspresi IGF-1 dan GHR-1 yang terjadi di hati dan otak ikan perlakuan terbaik, dan kontrol.
1.3 Tujuan dan Manfaat
kerja hormon pertumbuhan secara tidak langsung, serta menganalisis respons benih ikan gurame dalam memakan pakan, histologi hati dan hepatosomatic index. Hasil penelitian ini diharapkan dapat bermanfaat sebagai salah satu solusi
II. TINJAUAN PUSTAKA
2.1 Ikan Gurame (Osphronemus goramy)
Ikan gurame merupakan salah satu jenis ikan air tawar yang termasuk dalam keluarga Anabantidae, keturunan Helostoma dari bangsa Labyrinthici. Ikan ini merupakan asli ikan Indonesia dan menyebar ke Malaysia, Thailands, Ceylon dan Australia. Karena ukurannya dapat mencapai 5 kg/ekor sehingga orang
Inggris menyebutnya “giant goramy”, sedangkan di Indonesia ikan ini dikenal dengan beberapa nama sesuai daerahnya. Orang Jawa menyebutnya ikan gurame/gurameh, Sumatera menyebutnya ikan kalau, kala, dan kalui, sedangkan di Kalimantan disebut ikan kalui. Ikan ini merupakan jenis ikan konsumsi, memiliki morfologi dengan bentuk tubuh pipih lebar, bagian punggung berwarna merah sawo dan bagian perut berwarna kekuning-kuningan atau keperak-perakan. Ikan ini memiliki pertumbuhan yang relatif lebih lambat dibandingkan pada kebanyakan ikan air tawar lainnya. Untuk mencapai ukuran konsumsi (~500 g) dibutuhkan waktu sekitar 1,5 tahun (SNI 2006).
2.2 Pertumbuhan Ikan Gurame
Pertumbuhan didefenisikan sebagai perubahan ukuran baik panjang maupun dimensi fisik lainnya, termasuk volume massa atau bobot, baik pada keseluruhan tubuh organisme maupun pada berbagai jaringan. Selain itu, perubahan tersebut dapat berkaitan dengan kandungan protein, lemak atau komponen kimia lainnya dari ke seluruhan tubuh, perubahan kandungan energi atau komponen jaringan dari seluruh tubuh (Weatherley & Gill 1987).
pada nilai biologis yang digambarkan dari jumlah dan kualitas asam amino yang dikandungnya (Watanabe 1988).
2.3 Hormon Pertumbuhan
Hormon pertumbuhan (growth hormone, GH) merupakan satu rantai polipeptida yang berukuran sekitar 22 kDa, disekresikan oleh bagian anterior dari kelenjar pituitari yang berperan dalam memacu pertumbuhan tubuh, khususnya dengan merangsang pelepasan somatomedin, dan mempengaruhi metabolisme protein, karbohidrat, dan lipid. GH bekerja dengan merangsang sintesis protein dan pemecahan lemak (untuk energi). Hormon ini merupakan peptida yang besar yang terdiri dari 191 asam amino. Sekresi hormon pertumbuhan dikendalikan oleh hipotalamus. Somatotropin menggambarkan hormon pertumbuhan yang biasa diproduksi di pituitari, sedangkan somatropin menggambarkan hormon pertumbuhan yang diproduksi menggunakan teknologi DNA rekombinan pada bioreaktor/fermentasi (Lindholm 2006).
Sekresi GH dirangsang oleh growth hormone releasing hormone (GHRH), ghrelin, protein pakan, kandungan gula darah yang rendah, peningkatan sekresi androgen, dan arginin, sedangkan yang menghambat antara lain somatostatin, konsentrasi hormon pertumbuhan dan insulin-like growth factor-1 (IGF-1) yang bersirkulasi, kandungan gula darah yang tinggi, glukokortikoid, dan estradiol ataupun estrogen lainnya. Fungsi GH yang sangat penting adalah memperbaiki dan memacu pertumbuhan somatik (Moriyama & Kawauchi 1990). Pada ikan, GH memiliki beberapa fungsi antara lain merangsang pertumbuhan gonad (Wong et al. 2006), otot dan tulang (Debnanth 2010). Selain itu, GH pada ikan juga
berperan dalam proses osmoregulasi (Sakamoto et al. 1997), meningkatkan nafsu makan/metabolisme (Rousseau & Dufour 2007), proses metamorfosis dan perkembangan (Anathy et al. 2009), merangsang hati untuk mengeluarkan IGF-1 (Moriyama et al. 2000), efisiensi pemberian pakan, menjaga keseimbangan/homeostasis energi, tingkah laku ketika bermigrasi, proses gametogenesis puberitas, perkembangan embrio (Debnanth 2010), serta meningkatkan sistem imunitas tubuh (Sakai et al. 1997; Yada et al. 1999).
secara langsung mempengaruhi pertumbuhan organ tanpa perantara IGF-1 dalam hati. Mekanisme secara tidak langsung, yakni GH mempengaruhi pertumbuhan dimediasi oleh IGF-1 dalam hati. Mekanisme ini berlangsung dengan adanya beberapa faktor yang berperan, yaitu: reseptor GH berperan dalam menangkap sinyal GH yang di sekresikan oleh kelenjar pituitari, GH binding protein (GHBPs) berperan dalam pengangkutan dan melindungi GH di dalam darah, dan IGF binding proteins (IGFBPs) berperan dalam melindungi dan mengangkut IGF-1 di
dalam darah menuju ke organ target, serta reseptor IGF berperan dalam menangkap sinyal IGF-1 dalam organ-organ yang menjadi target (Debnanth 2010).
2.4 Insulin-like Growth Factor-1 danGrowth Hormone Receptor-1
Insulin-like growth factor (IGF-1) merupakan polipeptida rantai tunggal
dengan berat molekul sekitar 7 kDa dan dikenal dengan nama lain somatomedin C, esensial bagi pertumbuhan embrio dan postnatal vertebrata. Sintesis dan pelepasan IGF-I dimulai dari masuknya rangsangan dari luar yang diintegrasikan oleh otak menjadi suatu perintah ke kelenjar pituitari untuk mensintesa dan mensekresikan GH. GH masuk ke dalam jaringan pembuluh darah, kemudian berikatan dengan reseptor yang sesuai/growth hormone receptor (GHR) di beberapa organ target terutama hati untuk menstimulasi sintesis dan pelepasan IGF-I. Selain itu, hati juga dapat distimulasi oleh GH endogen dan eksogen untuk memproduksi IGF-I. Sciara et al. (2008) menemukan korelasi dose dependent response antara GHR dengan IGF-1 pada ikan pejerrey Odontesthes bonariensis,
di mana IGF-I di dalam hati meningkat secara dramatis segera setelah dilakukan penyuntikan rpjGH pada ikan tersebut. Selanjutnya, GHR tidak mengalami peningkatan karena pituitari tidak memberikan sinyal untuk memproduksi GH. Namun demikian, kandungan GH dan IGF-I dapat memberikan umpan balik secara negatif terhadap kelenjar untuk tidak mensekresikan GH (Moriyama & Kawauchi 2001).
plasma IGF-I pada ikan yang hidup di air hangat lebih tinggi daripada di air dingin (Moriyama & Kawauchi 2001).
2.5 Efek rGH Pada Pertumbuhan Ikan
rGHtelah banyak digunakan untuk memacu pertumbuhan ikan. Pemberian rGH ikan mas yang diproduksi dalam Pichia pastoris sebanyak 0,1 μg/g bobot tubuh benih ikan nila dapat meningkatkan bobot tubuh sebesar 53,1% dibandingkan dengan kontrol (Li et al. 2003). Pemberian rGH tersebut dapat dilakukan melalui injeksi (Sekine et al. 1985; Tsai et al. 1995; Li et al. 2003; Funkenstein et al. 2005; Lesmana 2010), melalui perendaman (Acosta et al. 2007; Putra 2010; Syazili et al. 2011) serta melalui pakan (Tsai et al. 1997; Handoyo 2012).
Pemberian 0,5% rGH per kg pakan yang diberikan selama 12 minggu pada juvenil ikan sea bream hitam menunjukkan perbedaan bobot sebesar 60% dari perlakuan kontrol setelah pemeliharaan selama 16 minggu (Tsai et al. 1997). Menurut Sekine et al. (1985), pemberian rGH pada ikan rainbow trout dapat meningkatkan pertumbuhan sebesar 50% dibandingkan dengan ikan rainbow trout yang tidak diberi perlakuan rGH, sedangkan pada benih ikan beronang pemberian
rGH sebesar 0,5 μg/g bobot tubuh sebanyak 1 kali per minggu selama 4 minggu
dapat meningkatkan bobot tubuh sebesar 20% dari kontrol (Funkenstein et al. 2005). Selanjutnya, pemberian rGH pada benih ikan nila dengan dosis 30 mg/kg pakan dengan frekuensi pemberian 2 kali seminggu selama 3 minggu terbukti meningkatkan bobot tubuh sebesar 214,7% dari kontrol (Hardiantho 2011).
2.6 Pakan Ikan Gurame
pakan sebesar 43,29% dengan rasio E/P 8,0 kkal DE/g protein. Kebutuhan protein ikan gurame yang berukuran 25 dan 30 g sebesar 32,14% dengan rasio E/P 8 kkal DE/g. Kebutuhan karbohidrat pakan pada ikan gurame dengan bobot tubuh antara 29 dan 32 g adalah 20,8% dan dengan bobot berkisar antara 79 dan 80 dapat menggunakan karbohidrat pakan sampai kadar 47,5% (Mokoginta et al. 2004). 2.7 Penyalutan (Coating)
Penyalutan merupakan suatu cara untuk melindungi bahan-bahan yang diberikan bersama dengan pakan dari degradasi yang disebabkan oleh asam lambung ketika berada dalam lambung dan akan terserap dengan baik ketika berada di dalam usus. Bahan yang digunakan untuk penyalutan seperti kitosan, alginat, kuning/putih telur, HPMCP (hydroxypropyl methylcellulose phthalate) dan lainnya. Bahan penyalut seperti HPMCP telah diperkenalkan di pasaran sejak tahun 1971. Sebagai turunan dari selulosa untuk penyalutan, bahan tersebut telah di ujicobakan dan efektif dalam beberapa penelitian, baik di bidang farmasi maupun perikanan. Berdasarkan kelarutannya HPMCP terbagi dua, yaitu HP-50 dan HP-55. HP-50 larut dalam kondisi pH ≥ 5,0, sedangkan HP-55 larut dalam
III. BAHAN DAN METODE
3.1 Ikan Uji
Larva ikan gurame diperoleh dari pembenihan di Desa Ciherang Kec. Darmaga, Kab. Bogor. Larva dipelihara dalam akuarium berukuran 1,0x0,5x0,5 m3 dengan kepadatan sekitar 20 ekor/liter. Setelah ikan mencapai ukuran 0,75 -1,00 cm dilakukan pengurangan kepadatan menjadi 2-3 ekor/liter. Pakan awal yang diberikan berupa naupli Artemia sp. selama 10 hari, dilanjutkan dengan cacing sutera hingga ikan mencapai ukuran 4 - 5 cm dengan bobot 2,5 – 3,0 gram. Adaptasi terhadap pakan buatan dilakukan sebelum pemberian pakan mengandung rElGH.
3.2 Produksi rGH
Produksi rElGH dilakukan menggunakan bakteri Escherichia coli BL21 yang mengandung konstruksi pCold-1/rElGH (Alimuddin et al. 2010). Klon bakteri E. coli dikultur dalam 4 mL media 2xYT cair yang mengandung ampisilin, dan diinkubasi menggunakan shaker pada suhu 37°C selama 16-18 jam. Setelah itu, dilakukan subkultur dengan mengambil sebanyak 1 mL dari kultur awal, dan dimasukkan ke dalam 100 mL media 2xYT cair baru, dan diinkubasi pada suhu 37°C selama 2 jam. Kemudian kultur diberi kejutan suhu 15°C selama 30 menit, ditambahkan IPTG 1 mM sebanyak 1 mL, dan diinkubasi menggunakan shaker pada suhu 15°C selama 24 jam. Bakteri hasil kultur dikumpulkan dengan sentrifugasi pada 12.000 rpm selama 2-10 menit.
Lisis dinding sel bakteri dilakukan secara kimiawi menggunakan lisozim. Pelet bakteri hasil sentrifugasi dicuci menggunakan 1 mL bufer tris-EDTA (TE) per 200 mg bakteri, diinkubasi pada suhu 37°C selama 20 menit, dan selanjutnya disentrifugasi pada 12.000 rpm selama 1 menit. Supernatan dalam tabung microtube dibuang, diganti dengan larutan lisozim (10 mg dalam 1 mL buffer TE)
suhu -80°C hingga akan digunakan. Keberadaan rGH dalam badan inklusi dianalisis menggunakan metode SDS-PAGE (Blackshear (1984) dalam Bollag et al. (1996)).
3.3 Pembuatan Pakan Mengandung rGH
Pembuatan pakan mengandung rGH dilakukan dengan cara mencampurkan rElGH yang sudah dilakukan penyalutan (coating) ke dalam pakan komersial (protein sekitar 30%). Penyalutan pakan dilakukan berdasarkan metode Promdonkoy et al. (2004) menggunakan HP55 (Shin-Etsu, Japan) sehingga terbentuk matriks rElGH-HP55. Pelet rElGH dilarutkan dalam amonium asetat yang mengandung HP55 dalam etanol 72,8%. Setelah penyalutan, rElGH-HP55 dikering-bekukan menggunakan freeze drier. Selanjutnya matriks rElGH-HP55 diresuspensi dalam asam asetat yang mengandung 10 mM NaCl, dan 0,013% (w/v) deoxyholic acid hingga proteinnya mencapai konsentrasi 0,5 mg/mL. Pencampuran rElGH-HP55 dengan pakan uji dilakukan dengan cara disemprotkan, kemudian dikering-anginkan. Selanjutnya pada masing-masing pakan (kontrol, harian, dan perlakuan) diambil sebagian untuk analisis proksimat sebagai data awal tentang komposisi nutriasi pakan yang diberikan (Tabel 1). Tabel 1. Komposisi proksimat pakan yang digunakan (% bobot kering)
Parameter uji Pakan
DE (kkal/kg pakan) 2.881,71 2.920,56 2.924,19 2.949,96 2.971,45 C/P(kkal/g protein) 8,11 7,57 7,52 7,40 7,21 Keterangan: Pakan harian; Pakan tanpa dicampur HP-55, Pakan kontrol; Pakan dicampur HP-55. Pakan perlakuan diberikan 2 kali per minggu, BETN; bahan ekstrak tanpa nitrogen, DE: digestible energy yang diperhitungkan dari: 1 g protein= 3,5 kkal; 1 g lemak= 8,1 kkal; 1 g karbohidrat= 2,5 kkal.
3.4 Pemberian rElGH-HP55 dengan Dosis Berbeda Melalui Pakan
pakan yang telah diberi protein rElGH-HP55 dengan dosis berbeda (0; 0,3; 3,0; dan 30 mg/kg pakan). Setiap perlakuan diberi 3 kali ulangan. Pemberian pakan dilakukan 3 kali dalam sehari. Pakan mengandung rElGH-HP55 diberikan 2 kali dalam seminggu dengan tingkat pemberian pakan 5% dari bobot tubuh. Pemberian pakan mengandung rElGH diberikan satu kali pada pagi hari. Bobot ikan diukur setiap 2 minggu. Penghitungan kelangsungan hidup (KH) dilakukan pada akhir pemeliharaan. Panjang baku dan tinggi badan diukur pada semua ikan tiap perlakuan pada akhir pemeliharaan. Proksimat daging ikan awal, ikan dari perlakuan dosis terbaik, dan kontrol dianalisis pada akhir penelitian. Organ hati diambil masing-masing secara acak dari satu ekor ikan untuk perlakuan terbaik dan kontrol pada akhir penelitian untuk analisis histologis. Begitu juga untuk sampel analisis ekspresi gen IGF-1, dan GHR-1. Selanjutnya, pengukuran hepatosomatic index juga dilakukan dengan mengukur bobot tubuh dan hati
masing-masing 15 ekor ikan tiap perlakuan terbaik dan kontrol. Selain itu, sebagai data penunjang dilakukan pengukuran kualitas air kolam (suhu, pH, amoniak, nitrit dan oksigen terlarut) selama pemeliharaan.
3.5 Analisis Hepatosomatic Index (HSI)
HSI diukur dengan menimbang bobot hati dibandingkan dengan bobot tubuh ikan gurame hasil perlakuan terbaik dan kontrol. Pada akhir pemeliharaan sampel ikan perlakuan terbaik dan kontrol diambil masing-masing sebanyak 15 ekor, kemudian dimatikan, dan ditimbang bobot tubuh dan hati dari masing-masing ikan. Selanjutnya dilakukan perhitungan HSI pada kedua perlakuan tersebut. Data yang diperoleh selanjutnya dianalisis secara deskriptif.
3.6 Analisis Proksimat Pakan dan Komposisi Tubuh (AOAC 1984)
dalam oven bersuhu 105-110°C, sedangkan untuk proksimat dari daging ikan mengikuti metode Folch (Takeuchi 1988).
3.7 Analisis Ekspresi Gen IGF-I dan GHR-1
Analisis ekspresi gen IGF-I dan GHR-1 dilakukan untuk mendapatkan informasi tentang ekspresi gen IGF-I dan GHR-1 akibat introduksi dari rGH eksogen dengan cara mengambil sampel otak dan hati ikan gurame dari masing-masing perlakuan dosis rGH terbaik dan kontrol. Pengambilan sampel dilakukan pada akhir perlakuan, yakni setelah pemberian pakan rElGH diberhentikan selama 4 minggu, selanjutnya ikan dipindahkan ke dalam akuarium. Pemberian pakan yang mengandung rElGH, dan pakan kontrol dilakukan setelah ikan dipuasakan selama sehari (untuk mengosongkan isi lambung). Jaringan hati dan otak diambil pada jam ke-24 setelah perlakuan.
RNA total diekstraksi menggunakan isogen (Nippon Gen, Japan) sesuai prosedur dalam manual. Jaringan tersebut dimasukkan ke dalam masing-masing microtube yang berisi larutan isogen 200 µL, kemudian dihancurkan dengan
menggunakan penggerus yang telah disterilkan dengan dietylpyrocarbonate (DEPC) 0,1%. Ke dalam microtube ditambahkan larutan isogen hingga mencapai volume akhir 800 µL dan diinkubasi selama 5 menit pada suhu ruang sampai semua jaringan terlisis sempurna. Setelah itu, kloroform ditambahkan sebanyak 200 µL, kemudian disentrifugasi selama 5 menit dengan kecepatan 12.000 rpm pada suhu ruang. Supernatan yang terbentuk dipindahkan ke dalam microtube baru yang telah berisi 400 µL larutan isopropanol, kemudian disentrifugasi selama 15 menit dengan kecepatan 12.000 rpm pada suhu 4°C. Supernatan pada microtube dibuang, dan pelet RNA pada dasar microtube dilarutkan dengan cara
menambahkan 1 mL etanol 70% dingin, kemudian disentrifugasi selama 15 menit dengan kecepatan 12.000 rpm. RNA dikeringkan dengan cara membuang larutan yang terdapat pada microtube. Setelah kering sempurna, RNA dilarutkan dengan 30 µL DEPC 0,1%. Konsentrasi hasil isolasi RNA total diukur menggunakan alat pengukur konsentrasi RNA/DNA (GeneQuant). Absorbansi diukur dengan panjang gelombang 260, dan 280 nm.
dibuat 3 µg dalam 30 µL DEPC, kemudian diinkubasi pada suhu 65°C selama 10 menit dan diletakkan dalam kondisi on ice. Sampel RNA dipindahkan ke dalam microtube FSRMB dan ditambahkan 3 µL primer „dT3‟RACE-VECT‟ (5‟-GTA ATA CGA CTC ACT ATA GGG CAC GCG TGG TCG ACG GCC CGG GCT GGT TTT TTT TTT TTT TTT TTT -3‟) dengan konsentrasi 1 µg/3 µL. Larutan dihomogenkan dan diinkubasi pada suhu 37°C selama 1 jam. cDNA yang terbentuk ditambahkan 30 µL SDW steril dan disimpan dalam refrigerator hingga digunakan.
Ekspresi gen IGF-1 dan GHR-1 dideteksi menggunakan metode semi-kuantitatif PCR dengan primer IGF1-F: 5‟
-TTCAAGAGTGTCATGTGCTGTA-3‟ dan IGF1-R 5‟-CATAGCCTGTTGGTTTACTGAA-3‟ untuk amplifikasi gen IGF-1, GHR1-F: 5‟-ACCGGCCACAACATGAATATAAGG-3‟ dan GHR1-R:
5‟-GTCTTGATCAGGCAGGTCTGG-3‟ untuk amplifikasi gen GHR-1 (Irmawati, belum dipublikasikan). Kondisi PCR untuk IGF-1 adalah predenaturasi pada 94°C selama 3 menit, 35 siklus pada denaturasi 94°C selama 30 detik, annealing 57°C selama 30 detik, ekstensi 72°C selama 30 detik, dan ekstensi
akhir pada 72°C selama 3 menit. Kondisi PCR untuk GHR-1 adalah predenaturasi pada 94°C selama 3 menit, 35 siklus pada denaturasi 94°C selama 30 detik, annealing 60°C selama 30 detik, ekstensi 72°C selama 30 detik, dan ekstensi
akhir pada 72°C selama 3 menit.
Ekspresi gen β-aktin dianalisis sebagai kontrol internal loading RNA saat
sintesis cDNA. Primer yang digunakan untuk gen β-aktin adalah primer F (5‟ -AAC CAT GGA TGA TGA AAT CGC CGCA-3‟) dan R (5‟-TGA TGC CTG GGG CGA CCG ACG ATGG -3‟) (Irmawati, belum dipublikasikan) dengan kondisi PCR adalah predenaturasi pada 94°C selama 3 menit, 28 siklus pada denaturasi 94°C selama 30 detik, annealing 59°C selama 30 detik, ekstensi 72°C selama 30 detik, dan ekstensi akhir pada 72°C selama 3 menit. Pengecekan hasil amplifikasi PCR dilakukan dengan elektroforesis menggunakan gel agarosa 1,5%. Pengukuran level IGF-1 dan GHR-1 dilakukan dengan mengukur ketebalan pita DNA hasil elektroforesis menggunakan software UN-SCAN-IT gel 6.1, kemudian
3.8 Analisis Statistik
IV. HASIL DAN PEMBAHASAN
4.1 Hasil
4.1. 1 Pertumbuhan, Konversi Pakan, dan Kelangsungan Hidup
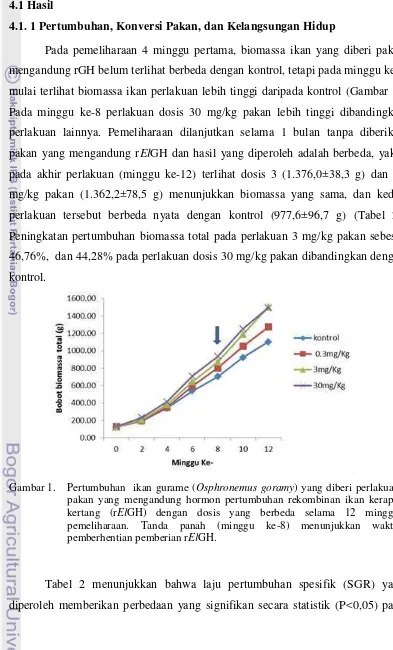
Pada pemeliharaan 4 minggu pertama, biomassa ikan yang diberi pakan mengandung rGH belum terlihat berbeda dengan kontrol, tetapi pada minggu ke-6 mulai terlihat biomassa ikan perlakuan lebih tinggi daripada kontrol (Gambar 1). Pada minggu ke-8 perlakuan dosis 30 mg/kg pakan lebih tinggi dibandingkan perlakuan lainnya. Pemeliharaan dilanjutkan selama 1 bulan tanpa diberikan pakan yang mengandung rElGH dan hasil yang diperoleh adalah berbeda, yakni pada akhir perlakuan (minggu ke-12) terlihat dosis 3 (1.376,0±38,3 g) dan 30 mg/kg pakan (1.362,2±78,5 g) menunjukkan biomassa yang sama, dan kedua perlakuan tersebut berbeda nyata dengan kontrol (977,6±96,7 g) (Tabel 2). Peningkatan pertumbuhan biomassa total pada perlakuan 3 mg/kg pakan sebesar 46,76%, dan 44,28% pada perlakuan dosis 30 mg/kg pakan dibandingkan dengan kontrol.
Gambar 1. Pertumbuhan ikan gurame (Osphronemus goramy) yang diberi perlakuan pakan yang mengandung hormon pertumbuhan rekombinan ikan kerapu kertang (rElGH) dengan dosis yang berbeda selama 12 minggu pemeliharaan. Tanda panah (minggu ke-8) menunjukkan waktu pemberhentian pemberian rElGH.
perlakuan 3 dan 30 mg/kg pakan dibandingkan dengan kontrol. SGR perlakuan 3 mg/kg pakan sebesar 14,89% lebih tinggi dibandingkan dengan kontrol. Selain itu, pemberian pakan perlakuan dosis 3 mg/kg pakan pada penelitian ini dapat menurunkan nilai konversi pakan (FCR) sebesar 23,72%, dan peningkatan tinggi badan ikan sebesar 9,67% dibandingkan dengan kontrol. Sementara itu, panjang baku dan kelangsungan hidup (KH) ikan tidak menunjukkan perbedaan yang signifikan (P>0,05) (Tabel 2).
Tabel 2 Biomassa panen, laju pertumbuhan spesifik (SGR), kelangsungan hidup (KH), tingkat konversi pakan (FCR), tinggi badan dan panjang baku benih ikan gurame yang diberi perlakuan hormon pertumbuhan rekombinan ikan kerapu kertang (rElGH) dan kontrol.
Parameter Perlakuan dosis (mg rElHP/kg pakan)
Kontrol 0,3 3,0 30,0
Biomassa panen (g) 977,6±96,7c 1144,8±40,7bc 1376,0±38,3a 1362,2±78,5ab SGR (%) 2,62±0,12c 2,77±0,02bc 3,01±0,05a 2,93±0,06ab FCR (%) 1,46±0,10a 1,27±0,02ab 1,18±0,01b 1,23±0,06b Tinggi badan (cm) 4,55±0,07c 4,72±0,02b 4,99±0,01a 5,09±0,06a Panjang baku (cm) 9,59±0,45a 9,60±0,08a 10,01±0,06a 10,25±0,08a KH (%) 91,11±6,79a 96,30±2,67a 97,04±1,96a 97,04±1,96a Keterangan: nilai ditampilkan dalam bentuk rerata ± simpangan eror. Huruf superskrip yang berbeda pada baris yang sama adalah berbeda nyata secara statistik (P<0,05). Benih ikan gurame diberi pakan mengandung rElGH 2 kali seminggu selama 8 minggu perlakuan, dan 4 minggu selanjutnya tanpa pemberian pakan perlakuan.
4.1.2 Histologi Hati
Pemberian pakan yang mengandung rElGH pada ikan gurame diduga memberikan efek pada hati. Berdasarkan hasil dari penelitian ini, secara histologis hati ikan perlakuan rElGH terbaik (dosis 3 mg/kg pakan) dan kontrol relatif sama (tidak terjadi kerusakan), namun perbedaan yang terjadi adalah ukuran hepatosit pada hati ikan perlakuan lebih besar dari kontrol (Gambar 3). Hal ini diduga karena akumulasi nutrien yang lebih besar pada hati ikan perlakuan.
4.1.3 Proksimat Tubuh Ikan
Komposisi kimiawi dari ikan kontrol dan ikan perlakuan setelah 12 minggu pemeliharaan dapat dilihat pada Tabel 3. Kandungan protein ikan perlakuan rElGH lebih tinggi dibandingkan dengan kontrol. Sebaliknya, kandungan lemak ikan kontrol lebih tinggi dibandingkan ikan perlakuan.
Tabel 3 Proksimat (% berat kering) tubuh benih ikan gurame pada awal dan akhir percobaan.
Kode sampel Kadar
Abu Protein Lemak
Karbohidrat Serat
Kasar BETN Ikan awal 12,03 60,29 25,81 0,82 1,06 Ikan kontrol 9,21 51,86 36,85 0,38 1,69 Ikan perlakuan
(3 mg/kg pakan) 6,42 60,61 30,38 0,95 1,63 Keterangan: Ikan awal; Ikan sebelum diberi pakan perlakuan, ikan kontrol; ikan yang diberi pakan (pakan +HP55), ikan perlakuan; ikan yang diberi pakan perlakuan dosis 3 mg/kg pakan(Pakan+rElGH-HP55)
4.1.4 Hepatosomatic index
Nilai hepatosomatic index (HSI) yang diperoleh dari ikan gurame hasil perlakuan rElGH dosis 3 mg/kg pakan lebih besar dibandingkan dengan kontrol. Hal ini menunjukkan bahwa pemberian pakan yang mengandung rElGH pada penelitian ini dapat meningkatkan bobot hati sebesar 16,12% lebih besar dibandingkan dengan kontrol (Gambar 4). Peningkatan bobot hati diduga terkait erat dengan peningkatan ukuran hepatosit (Gambar 3).
Gambar 3. Nilai hepatosomatic index (HSI) ikan gurame (Osphronemus goramy) ikan kontrol dan yang diberi perlakuan rElGH pada dosis 3 mg/kg pakan. Pemberian rElGH 2 kali dalam seminggu selama 8 minggu perlakuan dan dilanjutkan pemeliharaan tanpa perlakuan rElGH selama 4 minggu. Pengambilan sampel dilakukan pada minggu ke-12 (akhir pemeliharaan).
4.1.5 Ekspresi Gen IGF-1 dan GHR-1
Gambar 4. Ekspresi gen insulin-like growth factor-1 (IGF-1), growth hormone
receptor -1 (GHR-1), dan β-aktin pada hati dan otak ikan gurame kontrol
dan perlakuan pakan mengandung hormon pertumbuhan rekombinan ikan kerapu kertang (rElHP) pada jam ke-24 setelah pemberian pakan. A= Hasil elektroforesis DNA; B= Level ekspresi gen IGF-1/β-aktin dan GHR-1/β-aktin. OK24 (otak ikan kontrol jam ke-24), OP24 (otak ikan perlakuan jam ke-24), HK24 (hati ikan kontrol ikan jam ke-24) dan HP24 (hati ikan perlakuan ikan jam ke-24).
4.2 Pembahasan
Pertumbuhan ikan perlakuan rElGH pada akhir penelitian tetap lebih tinggi meskipun pemberian rGH telah dihentikan pada minggu ke-8 (Gambar 1). Hasil yang serupa juga dilaporkan oleh Promdonkoy et al. (2004) pada ikan koki (Carassius auratus) yakni peningkatan pertumbuhan bobot tetap diperoleh meskipun perlakuan rGH telah dihentikan selama 4 minggu.
dilaporkan pada ikan salmon (Cook et al. 2000; Devlin et al. 2004) ikan nila (Hardiantho et al. 2011) dan ikan sidat (Handoyo 2012). Penurunan FCR dapat menghemat biaya pakan sebesar 17,5% (Lampiran 9) dibandingkan dengan kontrol. Dalam hal ini, untuk mendapatkan produksi sebesar 1 kg daging hanya dibutuhkan biaya pakan sebesar Rp. 14.280,00, sedangkan pada kontrol dibutuhkan biaya pakan sebesar Rp. 17.330,00 (Lampiran 9). Hal ini membuktikan bahwa dengan pengaplikasian pakan yang mengandung rGH dapat menghemat biaya dalam produksi ikan gurame.
Berdasarkan analisis secara statistik pemberian rGH melalui pakan pada penelitian ini tidak berbeda nyata (P>0,05) untuk panjang baku dan kelangsungan hidup (Tabel 2). Secara rerata, KH perlakuan rElGH (96,30-97,04%) terlihat relatif lebih tinggi daripada kontrol (91,11%). Hal ini diduga terkait dengan peningkatan daya tahan tubuh terhadap stres akibat kondisisi lingkungan khususnya pH (5-6) relatif rendah. Rerata KH yang relatif lebih tinggi pada ikan yang diberi perlakuan rGH juga telah dilaporkan oleh peneliti sebelumnya, seperti Handoyo (2012) melaporkan peningkatkan KH benih ikan sidat (Anguilla sp.) yang diberi pakan mengandung rElGH. Peningkatan KH pada ikan yang diberi rGH disebabkan oleh peningkatan daya tahan ikan terhadap stres dan infeksi penyakit (Acosta et al. 2009). Selain itu juga telah dilaporkan oleh Sakai et al. (1997) bahwa pemberian rGH pada ikan rainbow trout juga efektif meningkatkan resistensi terhadap Vibrio anguillarum.
peranan yang sangat penting dalam sintesis protein, asimilasi nutrisi, produksi empedu, detoksifikasi, pemeliharaan metabolisme tubuh mencakup pengolahan karbohidarat, protein, lemak, dan vitamin. Dengan demikian, pertumbuhan yang tinggi dan peningkatan HSI ini menunjukkan semua proses dalam fungsi hati berjalan dengan baik.
Kandungan protein ikan perlakuan lebih tinggi dibandingkan dengan kontrol (Tabel 3). Sebaliknya, kandungan lemak ikan kontrol lebih tinggi dibandingkan ikan perlakuan. Tingginya kandungan protein pada ikan perlakuan karena meningkatnya nafsu makan dan efisiensi penggunaan energi, sehingga protein lebih banyak diretensi. Selain itu, pemberian rElGH melalui pakan pada penelitian ini diduga terjadinya peningkatan sintesis protein. Seperti yang dilaporkan oleh beberapa peneliti bahwa dengan pemberian rGH dapat meningkatkan sintesis protein dan menurunkan sintesis lemak pada mamalia (Pell et al. 1990; Johnsson et al. 1987) dan menstimulasi anabolisme dalam
meningkatkan penggantian dan sintesis protein pada ikan, yang terjadi pada hati dan otot dengan menstimulasi efisiensi dari translasi ribosom melalui peningkatan konsentrasi mRNA dan ribosom (Foster et al. 1991; Herbert et al. 2001). Mekanisme tersebut diduga melalui optimasi pemanfaatan protein sebagai sumber energi untuk pertumbuhan. Selanjutnya, penurunan kadar lemak tubuh pada ikan perlakuan diduga berkaitan dengan aktivitas enzim lipase, sesuai yang dikemukakan oleh Irmawati et al. (2012) bahwa aktivitas enzim lipase ikan gurame yang diberi rGH lebih tinggi dibandingkan dengan ikan kontrol. Ditambahkan oleh O‟Connor et al. (1993) bahwa rGH dapat menstimulasi lipolisis pada beberapa jenis spesies ikan seperti ikan rainbow trout. Kandungan protein yang lebih rendah pada kontrol diduga meningkatnya proses anabolisme dalam tubuh untuk memperbaiki sel-sel yang rusak untuk kelangsungan hidup. Hal tersebut terlihat dari kelangsungan hidup dan pertumbuhan yang lebih rendah pada ikan kontrol.
Hasil elektroforesis semi-kuantitatif RT-PCR ekspresi gen IGF-1 dan GHR-1 saat 24 jam setelah pemberian pakan yang mengandung rElGH dari hati dan otak ikan gurame dapat dilihat pada Gambar 4. Sebagai kontrol internal
GHR-1 pada hati dan otak ikan perlakuan dan kontrol adalah sama (Gambar 4). Hal ini menunjukkan bahwa mekanisme kerja rElGH dalam menginduksi pertumbuhan diduga terjadi secara langsung dan tidak melibatkan jalur IGF-1 di hati. Hal ini sesuai maksud pernyataan Debnanth (2010) bahwa mekanisme kerja GH dapat bersifat secara langsung dan tidak langsung. Mekanisme secara langsung adalah langsung mempengaruhi pertumbuhan organ tanpa perantara insulin–like growth factor (IGF-1) dalam hati atau langsung ke organ target, sedangkan secara tidak
V. SIMPULAN DAN SARAN
5.1 Simpulan
Pemberian rElGH melalui pakan dapat meningkatkan pertumbuhan ikan gurame secara signifikan. Dosis yang terbaik adalah dosis 3 mg/kg pakan. Pemberian rElGH mampu menghemat penggunaan pakan dengan menurunkan konversi pakan secara signifikan, dan meningkatkan hepatosomatic Index. Kadar lemak ikan perlakuan rElGH menurun. Pemberian rElGH melalui pakan tidak mempengaruhi ekspresi gen IGF-1 dan GHR-1 pada jam ke-24 setelah pemberian pakan. Induksi pertumbuhan akibat perlakuan rGH melalui pakan melibatkan mekanisme langsung.
5. 2 Saran
DAFTAR PUSTAKA
Acosta J, Morales R, Morales A, Alonso M, Estrada MP. 2007. Pichia pastoris expressing recombinant tilapia growth hormone accelerates the growth of tilapia. Biotechnology Lett. 29, 1671-1676. recombinant fish growth hormone. Can. J. Fish. Aquat. Sci. 45, 146-151. Alimuddin, Lesmana I, Sudrajat AO, Carman O, Faisal I. 2010. Production and
bioactivity potential of three recombinant growth hormones of farmed fish. Indonesian Aquaculture Journal 5, 11-16.
Anathy V, Venugopal T, Koteeswaran R, Pandian TJ, Mathavan S. 2001. Cloning, sequencing and expression of cDNA encoding growth hormone from Indian catfish (Heteropneustes fossilis). Journal of Bioscience 26(3), 315-324.
AOAC. 1984. Official Methods of Analysis of The Association of Official Agricultur Chemist. AOAC, Inc., Washington.
Beardmore JA, Porter JS. 2003. Genetically modified organisms and aquaculture. FAO Fisheries CircuLar, Roma.
Bjornsson BT, Johansson V. 2004. Growth hormone andocrinology of salmonid: regulatory mechanism and mode of action. Fish Physiology and Biochemistry 27, 227-242.
Cook JT, McNiven MA, Richardson GF, Sutterlin AM. 2000. Growth rate, body composition and feed digestibility/conversion of growth enhanced Atlantic salmon (Salmo salar). Aquaculture 188, 15-32
Debnanth S. 2010. A review on the physiology of insulin-like growth factor-1 (IGF-1) peptide in bony fisher and its phylogenetic correlation in 30 different taxa of 1 families of teleosts. Advances in Environmental Biology 5, 31-52.
Demain AL, Vaishnav P. 2009. Production of recombinant proteins by microbes and higher organisms. Biotechnol. Adv. 27, 297-306.
Foster AR, Houlhan DF, Gray C, Medalem F, Fauconneau B, Kaushik SJ, LeBail PY. 1991. The effect of ovine growth hormone on protein turnover in rainbow trout. Gen. Comp. Endocrinol. 82, 111-120.
Funkenstein B, Dyman A, Lapidot Z, de Jesus-Ayson EG, Gertler A, Ayson FG. 2005. Expression and purification of a biologically active recombinant rabbitfish (Siganus guttatus) growth hormone. Aquaculture 250, 504-515. Gahr SA, Vallejo RL, Weber GM, Shepherd BS, Silverstein JT, Caird ER. 2008.
Effects of short-term growth hormone treatment on liver and muscle transcriptomes in rainbow trout (Oncorhynchus mykiss). Physiology Genomics 32, 380-392.
Genten F, Terwinghe, Danguy. 2009. Atlas of Fish Histology. Department of Histology and Biopathology of Fish Fauna Laboratory of Functionnal Morphology Université Libre de Bruxelles (U.L.B) Brussels Belgium: Science Publishers.
.
Handoyo B. 2012. Metode pemberian dan respons benih ikan sidat terhadap hormone pertumbuhan rekombinan ikan kerapu kertang. [Tesis]. Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Hardiantho D, Alimuddin, Praseto AE, Yanti DH, Sumantadinata K. 2011. Aplikasi rekombinan growth hormone (rHP) ikan mas pada ikan nila melalui pakan buatan. Makalah disampaikan dalam pertemuan Broodstock Center nila dan temu koordinasi perekayasa Kementerian Kelautan dan Perikanan, di BBPBAT Sukabumi.
Herbert NA, Armstrong JD, Björnsson BT. 2001. Evidence that growth hormone-induced elevation in routine metabolism of juvenile Atlantic salmon is a result of increased spontaneous activity. J. Fish Biol. 59, 754–757.
Irmawati, Alimuddin, Zairin M, Supraudi MA, Wahyudi AT. 2012. Peningkatan laju pertumbuhan benih ikan gurame (Osphronemus goramy Lac.) yang direndam dalam media yang mengandung hormon pertumbuhan ikan mas. Jurnal Iktiologi Indonesia (in press).
Johnsson ID, Hathom DJ, Wilde RM, Teacher TT, Butler-Hogg BW. 1987. The effect of dose and method of administration of biosynthetic bovine somatotropin on live-weight gain, carcasss composition and wool growth in young lambs. Anim. Prod. 44, 405-414.
[KKP] Kementrian Kelautan dan Perikanan. 2010. Indonesian Fisheries Statistics 2009. Kementerian Kelautan dan Perikanan. Jakarta.
Lesmana I. 2010. Produksi dan bioaktivitas protein rekombinan hormon pertumbuhan dari tiga jenis ikan budidaya. [Tesis]. Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Li Y, Bai J, Jian Q, Ye X, Lao H, Li X, Luo J, Liang X. 2003. Expression of
common carp growth hormone in the yeast Pichia pastoris and growth stimulation of juvenile tilapia (Oreochromis niloticus). Aquaculture 216, 329-341.
Lindholm J. 2006. Growth hormone: historical notes. Pituitary 9, 5-10.
McLean E, Donaldson EM, Teskeredzic E, Souza LM. 1993. Growth enhancement following dietary delivery of recombinant porcine somatotropin to diploid and triploid of coho salmon (Oncorhynchus kisutch). Fish Physiol. Biochem. 11, 363–369.
Mokoginta I, Supriadi MA, Setiawati. 1995. Kebutuhan nutrisi ikan Gurame (Osphronemus gouramy) untuk pertumbuhan dan reproduksi. Laporan Penelitian Hiba Bersaing II/2 Perguruang Tinggi Tahun Anggaran 1994/1995. Direktorat Pembinaan Penelitian dan Pengabdian Pada Masyarakat. Direktorat Jenderal Pendidikan Tinggi, Depdikbud. FakuLtas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Mokoginta I, Takeuchi T, Hadadi A, Jusadi D. 2004. Different capabilities in utilizing dietary carbohydrate by fingerling and subadult giant gouramy (Osphronemus gouramy). Fisheries Science 70(6), 996–1002.
Moriyama S, Felix GA, Hiroshi K. 2000. Growth regulation by insuLin-like growth factor-1 in fish: review. Biosci. Biotechnol. Biochem. 64, 1553-1562.
Moriyama S, Kawauchi H. 1990. Growth stimulation of juvenile salmonids by immersion in recombinant salmon growth hormone. Nippon Suisan Gakkaishi 56 (1), 31-34.
Moriyama S, Kawauchi H. 2001. Growth regulation by growth hormone and insulin-like growth factor-I in teleosts. Outsuchi Mar. Sci. 26, 23-27. O'Connor PK, Reich B, Sheridan MA. 1993. Growth hormone stimulates hepatic
lipid mobilization in rainbow trout, Oncorhynchus mykiss. Journal Comp. Physiol. 163, 427–431.
Pell JM, Elock C, Harding RL, Morrell DJ, Simmonds AD, Wallis M. 1990. Growth, body composition, hormonal and metabolic status in lambs treated long-term with growth hormone. Br. Journal Nutr. 63, 431-445. Piyaviriyakul P, Panyim S, Eurwilaichitr L. 2002. High intracellular expression of
Promdonkoy B, Warit S, Panyim S. 2004. Production of a biologically active growth hormone from giant catfish (Pangasianodon gigas) in Escherichia coli. Biotechnology Lett. 26, 649-653.
Putra HGP. 2010. Pertumbuahan dan kelangsungan hidup benih ikan gurame yang diberi protein rekombinan HP melalui perendaman dengan dosis berbeda. [Skripsi]. Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Rousseau K, Dufour S. 2007. Comparative aspects of HP and metabolic regulation in lower vertebrates. Neuroendocrinol. 86(3), 165-174.
Sakai M, Kajita Y, Kobayashi M, Kawauchi H. 1997. Immunostimulating effect of growth hormone: in-vivo administration of growth hormone in rainbow trout enhances resistence to Vibrio anguillarum infection. Veterinary Immunology and Immunopathology 57, 17-152.
Sakamoto T, Shepherd BS, Madsen SS, Nishioka RS, Siharath K, Richman NH, Bern HA, Grau EG. 1997. Osmoregulatory actions of growth hormone and prolactin in an advanced teleost. Gen. Comp. Endocrinol. 106, 95-101. Sciara AA, Somoza GM, Arranz SE. 2008. Insulin–like growth factor-1 of
pejerrey, Odontesthes bonariensis: cDNA characterization, tissue distribution and expression frofiles after growth hormone administration. Journal Exp. Zoology 309A, 407-418.
Sekine S, Mizukami T, Nishi T, Kuwana Y, Saito A, Sato M, Itoh S, and Kawauchi H. 1985. Cloning and expression of cDNA for salmon growth hormone in Escherichia coli. Proc. Natl. Acad. Sci. USA 82, 4306-4310. Shimizu M, Fukada H, Hara A, Dickhoff WW. 2007. Response of the salmon
somatotropic axis to growth hormone administration under two different salinities. Aquaculture 273, 320-328.
Shin-Etsu. 2002. USPHypromellose Phthalate HPMCP. Tokyo: Japan.
Syazili A, Irmawati, Alimuddin, Sumantadinata K. 2011. Kinerja pertumbuhan dan kelangsungan hidup juvenile ikan gurame diremdam hormone pertumbuhan rekombinan dengan frekuensi berbeda. Jurnal Akuakultur Indonesia, 10 (in press).
SNI 01-7241-2006. Ikan gurame (Osphronrmus goramy Lac.). Bagian 5: Produksi kelas pembesaran di kolam.
Takeuchi T. 1988. Laboratory work chemical evaluation of dietary nutrient, p.79-229. In Watanabe, T. (Ed). Fish nutrient and mariculture. JICA. Tokyo. Kanagawa International Fisheries Training Centre, JICA.
Tsai HJ, Lin KL, Kuo JC, Chen SW. 1995. Highly efficient expression of fish growth hormone by Escherichia coli cells. Appl. Environ. Microbiol. 61, 4116-4119.
Tsai HJ, Hsih MH, Kuo JC. 1997. Escherichia coli produced fish growth hormone as a feed additive to enhance the growth of juvenile black seabream (Acanthopagrus schlegeli). Journal Appl. Ichthyol. 13, 78-82.
Watanabe T. 1988. Fish Nutrition and maricuLture, JICA text book. Japan: the general aquaculture course. pp.44 -77.
Weatherley AH, Gill HS.1987. The biology of fish growth. Academic press. Toronto.
Winarlin, Gustiano R, Kristanto AH. 2007. Uji banding pertumbuhan biomassa ikan nila (Oreochromis niloticus) seleksi dan nonseleksi di kolam dan danau. Balai Riset Perikanan Budidaya Air Tawar. Bogor.
Wong AOL, Hong Z, Yonghua J, Wendy K, Ko W. 2006. Feedback regulation of growth hormone and secretion in fish and the emerging concept of intrapituitary feedbeck loop: review. Comparative Biochemistry and Physiology 1, 284-305.
Xu B, Mai K, Xu Y, Miao H, Liu Z, Dong Y, Lan S, Wang R, Zhang P. 2001. Growth promotion of red sea bream, Pagrosomus major, by oral administration of recombinant eel and salmon growth hormone. Chin. J. Oceanol. Limnol. 19, 141-146.
Yada T, Nagae M, Moriyama S, Azuma T. 1999. Effects of prolactin and growth hormone on plasma immunoglobulin M levels of hypophysectomized rainbow trout, Oncorhynchus mykiss. Gen. Comp. Endocrinol. 115, 46-52. Yilmaz E, Cek S, Mazlum Y. 2009. The Effects of combined phytoestrogen
Lampiran 1, Biomassa total setiap sampling hingga akhir pemeliharaan
Wo W1 W2 W3 W4 W5 W6
1 118,197 208,665 377,840 597,990 809,080 1.069,376 1.249,203 1.131,006 2 134,667 204,879 357,440 579,730 752,470 984,800 1.137,500 1.002,833 3 120,672 161,394 287,440 433,520 543,000 710,420 919,690 799,018
124,512 191,646 340,907 537,080 701,517 921,532 1.102,131 977,619
1 131,697 200,943 366,320 606,480 819,630 1.058,320 1.299,580 1.167,883 2 121,635 158,526 275,070 471,980 639,700 936,060 1.187,260 1.065,625 3 129,636 232,272 413,140 707,260 942,840 1.157,340 1.330,450 1.200,814
127,656 197,247 351,510 595,240 800,723 1.050,573 1.272,430 1.144,774
1 122,229 175,770 329,730 600,320 809,780 1.130,930 1.465,740 1.343,511 2 129,213 230,751 408,860 638,250 856,910 1.164,040 1.461,400 1.332,187 3 120,357 213,642 409,000 690,540 948,090 1.268,570 1.572,560 1.452,203
123,933 206,721 382,530 643,037 871,593 1.187,847 1.499,900 1.375,967
1 131,616 244,566 449,190 743,750 998,270 1.318,922 1.505,172 1.373,556 2 132,525 229,212 426,350 728,110 994,620 1.318,610 1.624,710 1.492,185 3 129,924 227,367 364,830 654,800 810,860 1.117,030 1.350,780 1.220,856
131,355 233,715 413,457 708,887 934,583 1.251,521 1.493,554 1.362,199
30 mg/kg pemeliharaan pada minggu ke-8 dan 12
Perlakuan Ulangan SGR (%) minggu ke-
8 12
Lampiran 3, Hasil analisis statistik biomassa panen pada benih ikan gurame One-way ANOVA: Kontrol, Dosis 0,3mg/Kg, Dosis 3mg/Kg, Dosis 30mg/Kg
Source DF SS MS F P Factor 3 326578 108859 7,79 0,009 Error 8 111786 13973
Total 11 438364
Individual 95% CIs For Mean Based on
Means that do not share a letter are significantly different,
Fisher 95% Individual Confidence Intervals
Lampiran 4, Hasil analisis statistik laju pertumbuhan spesifik (SGR) pada benih ikan gurame
One-way ANOVA: Kontrol, Dosis 0,3mg/Kg, Dosis 3mg/Kg, Dosis 30mg/Kg
Source DF SS MS F P
Means that do not share a letter are significantly different,
Dosis 3mg/Kg subtracted from:
Descriptive Statistics: Kontrol, Dosis 0,3mg/Kg, Dosis 3mg/Kg, Dosis 30mg/Kg
Lampiran 5, Hasil analisis statistik tingkat konversi pakan (FCR) pada benih ikan gurame
One-way ANOVA: Kontrol, Dosis 0,3mg/Kg, Dosis 3mg/Kg, Dosis 30mg/Kg
Source DF SS MS F P
Fisher 95% Individual Confidence Intervals
Descriptive Statistics: Kontrol, Dosis 0,3mg/Kg, Dosis 3mg/Kg, Dosis 30mg/Kg
Lampiran 6, Hasil analisis statistik tinggi badan benih ikan gurame
One-way ANOVA: Kontrol, Dosis 0,3mg/Kg, Dosis 3mg/Kg, Dosis 30mg/Kg
Source DF SS MS F P Factor 3 0,55311 0,18437 26,64 0,000 Error 8 0,05537 0,00692
S = 0,08319 R-Sq = 90,90% R-Sq(adj) = 87,49%
Means that do not share a letter are significantly different,
Fisher 95% Individual Confidence Intervals All Pairwise Comparisons
Simultaneous confidence level = 82,43%
Kontrol subtracted from:
Lower Center Upper Dosis 0,3mg/Kg 0,01368 0,17032 0,32696 Dosis 3mg/Kg 0,28779 0,44443 0,60107 Dosis 30mg/Kg 0,21225 0,36889 0,52553
---+---+---+---+---- Dosis 30mg/Kg -0,06185 0,09479 0,25143
---+---+---+---+---- Dosis 30mg/Kg (----*---)
Descriptive Statistics: Kontrol, Dosis 0,3mg/Kg, Dosis 3mg/Kg, Dosis
Lampiran 7, Hasil analisis statistik panjang baku benih ikan gurame
One-way ANOVA: Kontrol, Dosis 0,3mg/Kg, Dosis 3mg/Kg, Dosis 30mg/Kg
Source DF SS MS F P
Means that do not share a letter are significantly different,
Dosis 0,3mg/Kg subtracted from:
Descriptive Statistics: Kontrol, Dosis 0,3mg/Kg, Dosis 3mg/Kg, Dosis 30mg/Kg
Lampiran 8, Hasil analisis statistik kelangsungan hidup (KH) benih ikan gurame One-way ANOVA: Kontrol, Dosis 0,3mg/Kg, Dosis 3mg/Kg, Dosis 30mg/Kg
Means that do not share a letter are significantly different,
Lampiran 9, Analisis sederhana biaya penggunaan pakan pada benih ikan gurame selama penelitian untuk semua perlakuan
Produksi/ gram daging
Kontrol 3.788,03 421,94 49.244,37 1.579,49 1,46 2.932,86 50.823,87 17,33
Dosis 0,3 mg/kg pakan
3.915,93 454,30 50.907,15 1.723,49 1,27 3.434,32 52.630,64 15,32
Dosis 3 mg/kg pakan
4.368,28 517,70 56.787,59 2.166,33 1,18 4.127,90 58.953,92 14,28
Dosis 30 mg/kg pakan
4.464,61 530,22 58.039,94 4.268,56 1,23 4.086,60 62.308,51 15,25 Biaya (Rp)
Harian Perlakuan Harian Perlakuan Total
Perlakuan
Total Pakan Total harga (Rp) pakan