EFEKTIVITAS PEMBERIAN HORMON PERTUMBUHAN
REKOMBINAN MELALUI PAKAN DENGAN BAHAN
PENYALUT BERBEDA DAN
PELLETING
PADA IKAN NILA
DULLAH IRWAN LATAR
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul “Efektivitas Pemberian Hormon Pertumbuhan Rekombinan Melalui Pakan dengan Bahan Penyalut Berbeda dan Pelleting pada Ikan Nila” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2013
RINGKASAN
DULLAH IRWAN LATAR. Efektivitas Pemberian Hormon Pertumbuhan Rekombinan Melalui Pakan dengan Bahan Penyalut Berbeda dan Pelleting pada Ikan Nila. Dibimbing oleh ALIMUDDIN, dan M. AGUS SUPRAYUDI.
Aplikasi pemberian hormon pertumbuhan rekombinan (recombinant growth hormone, rGH) untuk memacu pertumbuhan ikan dapat dilakukan melalui injeksi, perendaman, dan oral melalui pakan. Akan tetapi, metode penyuntikan dan perendaman relatif sulit diaplikasikan pada skala massal. Metode penyuntikan memerlukan waktu relatif lama dan tenaga banyak. Selanjutnya metode perendaman hanya efektif pada fase larva atau ikan berukuran kecil, pada dosis dan frekuensi perendaman tertentu. Selain itu, aplikasi metode perendaman skala massal dengan frekuensi lebih dari 1 kali perendaman, berpotensi tinggi menyebabkan ikan stres. Pemberian rGH melalui pakan adalah praktis dan hemat waktu. Akan tetapi, pada metode ini rGH perlu disalut (coating) untuk menghindari degradasi oleh enzim pencernaan, dan kerusakan akibat pH rendah di lambung.
Hydroxypropyl methylcellulose phthalate (HP55) merupakan bahan yang sering digunakan untuk menyalut rGH, tetapi harganya relatif mahal sehingga tidak efisien jika diaplikasikan dalam jumlah yang besar. Selulosa lainnya seperti polymethyl carbamide (PMC) juga dapat digunakan sebagai bahan penyalut. Harga PMC relatif murah, dan telah dilaporkan memiliki kemampuan melindungi bahan yang disalut dalam waktu relatif lama; penyimpanan pada suhu 20oC bertahan sekitar 1 tahun, 25 sampai 30oC sekitar 6 bulan, dan 35 sampai 38oC sekitar 3 bulan. Kuning telur ayam juga telah banyak digunakan sebagai pengikat (binder) obat dan suplemen pada pakan ikan. Harganya relatif murah dan mudah diperoleh. Penelitian ini dilakukan untuk menguji efektivitas pemberian rGH ikan kerapu kertang (rElGH) pada ikan nila melalui pakan dengan menggunakan berbagai bahan penyalut yang berbeda dan pelleting terhadap produksi, konversi pakan, kadar glukosa darah, kadar glikogen, dan kandungan proksimat ikan.
Produksi rElGH dilakukan menggunakan bakteri Escherichia coli BL21 yang mengandung vektor ekspresi protein pCold-ElGH. Bakteri dikultur pada media 2xYT pada suhu inkubasi 15°C selama 24 jam dan sintesis protein diinduksi dengan isopropyl-b-D-thiogalac-topyranoside dosis 0,5 mM. Dinding sel bakteri dilisis dengan menggunakan lisozim, kemudian protein total mengandung rElGH dalam bentuk badan badan inklusi diendapkan menggunakan sentrifugasi. Analisis SDS-PAGE digunakan untuk memastikan keberadaan rElGH dalam protein total bakteri.
Hasil penelitian menunjukkan bahwa perlakuan rElGH dengan menggunakan bahan penyalut kuning telur ayam meningkatkan biomassa (P<0,05) dibandingkan dengan kontrol (1.262,2±96,4 g). Biomassa ikan antar perlakuan penyalutan adalah sama (P>0,05). Peningkatan biomassa total pada perlakuan penyalutan menggunakan kuning telur ayam sebesar 46,85%, dengan HP55 32,50%, dengan PMC 27,99% dan pada metode pelleting sebesar 26,64% dibandingkan dengan kontrol. Selain itu, laju pertumbuhan spesifik (LPS) ikan perlakuan rGH yang disalut dengan HP55, kuning telur dan PMC adalah lebih tinggi (P<0,05) daripada kontrol. LPS ikan perlakuan penyalutan rGH dengan kuning telur ayam adalah sebesar 34,3% lebih tinggi daripada kontrol. Selain itu, tingkat konversi pakan ikan perlakuan penyalutan dan kontrol adalah sama. Sementara itu, kelangsungan hidup (KH) ikan perlakuan rElGH adalah lebih tinggi daripada kontrol (P<0,05). Rerata KH ikan perlakuan rElGH sebesar 96,80-97,33%, sedangkan kontrol adalah 93,07%.
Retensi protein pada ikan perlakuan penyalutan rElGH tidak berbeda dengan kontrol (P>0,05), sedangkan retensi lemak pada perlakuan penyalutan menggunakan PMC berbeda nyata (P<0,05) dengan perlakuan lainnya dan kontrol. Kadar glukosa darah terendah terdapat pada ikan perlakuan peleting, sementara perlakuan lainnya dan kontrol adalah sama (P>0,05). Kadar glikogen hati pada perlakuan kuning telur lebih tinggi daripada perlakuan lainnya dan kontrol, sementara kadar glikogen otot adalah sama antar perlakuan dan kontrol (P>0,05).
Sebagai kesimpulan, pemberian rElGH melalui pakan dapat meningkatkan pertumbuhan ikan nila secara signifikan. Bahan penyalut berupa PMC, dan kuning telur ayam dapat digunakan sebagai pengganti HP55. Retensi protein tidak dipengaruhi oleh penyalutan rElGH, sedangkan retensi lemak dipengaruhi oleh bahan penyalut yang digunakan.
SUMMARY
DULLAH IRWAN LATAR. Effectiveness administration of recombinant growth hormone through the feed with different coating materials and pelleting in Nile tilapia. Supervised by ALIMUDDIN and M. AGUS SUPRAYUDI.
Application of recombinant growth hormone (rGH) to improve the growth of fish can be performed by injection, immersion and oral delivery method through feed. However, injection and immersion methods are relatively difficult to be applied to mass scale. Injection delivery method is time consuming and labor intensive. Furthermore, immersion method is only effective on the larval stage or small fish size, at a certain immersion dose and frequency. In addition, applications mass-scale immersion method with frequency of more than 1 time, high-potential causing fish stress.
Oral delivery method is practical and time efficient. However, by this method rGH need to be coated to avoid degradation by digestive enzymes, and damage due to the low pH in the stomach.
Hydroxypropyl methylcellulose phthalate (HP55) is a material often used for coating the rGH, but it is relatively expensive and inefficient when applied in large amounts. Another cellulose such as polymethyl carbamide (PMC) can also be used as a coating agent. PMC is a relatively cheap price, and has been reported to protect the coated material in a relatively long time; storage at a temperature of 20oC for about 1 year, 25 to 30oC about 6 months, and 35 to 38 °C about 3 months. Chicken egg yolk has also been widely used as a binder of medicines and feed supplements in fish. Its price is relatively cheap and easy to obtain. This study was performed to examine the effectiveness supplementation of recombinant giant grouper GH (rElGH) in tilapia feed using a variety of coating materials and pelleting on production, feed conversion, blood glucose, glycogen levels and proximate content of fish.
Production of rElGH was performed using Escherichia coli BL21 containing pCold-ElGH protein expression vector. Bacteria were cultured in 2xYT media at incubation temperature of 15°C for 24 hours and protein synthesis was induced with isopropyl-bD-thiogalac-topyranoside in a dose of 0.5 mM. Lysis of bacterial cell walls was conducted using lysozyme, then total protein in inclusion body of rElGH were collected by centrifugation. SDS-PAGE analysis was used to ensure the presence of rElGH in the total bacterial protein.
This study consisted of 5 treatments including the control, and each treatment was given 3 replications. The size fish used fish was 5 to 6 cm in body length. Fish were maintained at hapa installed in a concrete pond (measuring 3x2x1 m) with a stocking density of 125 fish in each hapa. Fish maintenance was carried out for 2 months. During the first 2 weeks fish were fed diet without rElGH (feed adaptation) with a frequency of 3 times a day, and then fed on rGH-supplemented diet in 3 times at intervals of 3 days.
(SGR) of fish treated by HP55, chicken egg yolk, and PMC coated rGH were significantly higher (P<0.05) compated to control. SGR of chicken egg yolk coating treatment was about 34.3% higher compared to the control. In addition, fish feed conversion rate among treatments and control were similar. Meanwhile, survival of rElGH treatments were higher than control (P<0.05). Survival of rElGH treated fish was 96.80 to 97.33%, while the control was 93.07%.
Protein retention in fish treated by rElGH with different coating materials was similat to that of control (P>0.05), while lipid retention in PMC coating treatment was significantly lower (P0<0.05) than that of other treatments and control. Lower blood glucose level was obatined in pelleting treatment, while other treatments and control was (P>0.05). Liver glycogen content in chicken egg yolk coating treatment was higher than other treatments and control, while muscle glycogen content was similar among coanting treatments and control (P>0.05).
In conclusion, administration of rElGH through feed could significantly improve the growth of Nile tilapia. PMC and chicken egg yolk can be used as a substitute for HP55. Coating of rElGH did not affect protein retention, while lipid retention was affected by coating materials used.
© Hak Cipta Milik IPB, Tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
EFEKTIVITAS PEMBERIAN HORMON PERTUMBUHAN
REKOMBINAN MELALUI PAKAN DENGAN BAHAN
PENYALUT BERBEDA DAN
PELLETING
PADA IKAN NILA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2013
Dosen Penguji Luar Komisi pada Ujian Tesis:
Judul Tesis : Efektivitas Pemberian Hormon Pertumbuhan Rekombinan Melalui Pakan dengan Bahan Penyalut Berbeda dan Pelleting pada Ikan
Nama : Dullah Irwan Latar NIM : C151100261 Program Studi : Ilmu Akuakultur
Disetujui oleh Komisi Pembimbing
Dr. Alimuddin, S.Pi, M.Sc Ketua
Dr. Ir. M. Agus Suprayudi, M.Si Anggota
Diketahui oleh
Ketua Departemen Budidaya Perairan
Dr. Ir. Sukenda, M.Sc
Dekan Sekolah Pascasarjana
Dr. Ir. Dahrul Syah, M.Sc. Agr
Tanggal Ujian: 02 Mei 2013
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Penelitian yang dilaksanakan sejak bulan Juli 2012 sampai November 2012 dengan tema rekayasa pada budidaya ikan nila, dengan judul “Efektivitas Pemberian Hormon Pertumbuhan Rekombinan Melalui Pakan dengan Bahan Penyalut Berbeda dan Pelleting pada Ikan Nila”. Penelitian dilakukan di Laboratorium Reproduksi dan Genetika Organisme Akuatik, dan Kolam Percobaan Departemen Budidaya Perairan (BDP), Fakultas Perikanan dan Ilmu Kelautan (FPIK), IPB. Analisis proksimat, kandungan glikogen hati dan otot, dan glukosa darah dilakukan di Lab. Nutrisi Ikan, BDP-FPIK, IPB.
Keberhasilan penulis dalam menyelesaikan penelitian ini tidak semata didapatkan sendiri, melainkan dengan bantuan orang-orang sekitar. Untuk itu penulis mengucapkan terima kasih kepada:
1. Dr. Alimuddin, S.Pi, M.Sc. selaku Pembimbing I yang telah membimbing dan mengarahkan penulis selama melakukan penelitian sampai dengan penyusunan karya ilmiah ini dan atas dukungan materil dan spiritual selama perkuliahan dan penelitian.
2. Dr. Ir. M. Agus Suprayudi, M.Si. selaku Pembimbing II yang telah membimbing dan mengarahkan penulis selama melakukan penelitian sampai dengan penyusunan karya ilmiah ini.
3. Prof. Dr. Ir. Muhammad Zairin Junior, M.Sc. selaku penguji luar komisi atas saran dan pengarahannya dalam memperbaiki penulisan tesis.
4. Istriku Dewi Yuliantini, ST yang telah memberikan kasih sayang, perhatian, doa dan segala dukungan yang sangat berarti. Anak-anakku Ibnu Azzam Nawfal Latar (Alm) dan Hazrina Alyssa Azahra Latar yang menjadi penyemangat hidup dan penyimpan harapan penulis.
5. Ayahku Andi T. Latar, Ibunda Muharni Latar serta adikku Afandi Latar, SH, Rini Latar, S.Sos, Mimin B. Latar, dan Suryani Sufat Latar yang telah memberi nasehat, kasih sayang, doa restu, dukungan moril dan materil. 6. Ayah mertua Mamay Kamaludin (Alm), Ibu mertua Etty Mamay serta adik
iparku Tri Yanuar dan Catur May Andrian yang juga telah memberikan dukungan dan doanya.
7. Bapak Wandan G. Latar dan Mama Hj. Maryam Latar yang telah banyak membantu selama proses study.
8. Abangku Amir Rumra, S.Pi (Anggota DPRD Kab. Maluku Tenggara) dan Istrinya Ukhti Shani Rumra, atas bantuan dan dukungan yang diberikan selama ini.
9. Abangku Abd. Malik Serang, S.Pi, M.Si (Wakil Direktur IV Politeknik Perikanan Negeri Tual) atas bantuan dan dukungan yang diberikan selama ini.
10.Bapak Dr. rer.nat. Ir. E. A. Renjaan, M.Sc (Direktur Politeknik Perikanan Negeri Tual) atas kesempatan ijin belajar yang diberikan.
12.Sahabat-sahabatku yang tercinta (Anna Octavera, S.Pi, M.Si; Muhammad Safir, S.Pi, M.Si; Boyun Handoyo, S.Pi, M.Si; dan La Ode Muh. Arsal, S.Pi).
13.Teman-teman S1, S2 (Darmawan dan Fajar), dan S3 di Laboratorium Reproduksi dan Genetika Organisme Akuatik, dan teman-teman Ilmu Akuakultur 2010.
14.Teman-teman S2 Ilmu Akuakultur (Angkatan 2010) dan S2, S3 dari Politeknink Perikanan Negeri Tual yang sedang study pada SPs. Institut Pertanian Bogor.
15.Semua pihak yang telah memberikan dukungan baik secara langsung maupun tidak langsung.
Penulis telah berusaha semaksimal mungkin dalam penyelesaian karya ilmiah ini. Dengan harapan, karya ilmiah ini dapat bermanfaat bagi penulis dan para pembaca pada umumnya.
DAFTAR ISI
Halaman
DAFTAR TABEL xiv
DAFTAR GAMBAR xv
DAFTAR LAMPIRAN xvi
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 3
Manfaat Penelitian 3
TINJAUAN PUSTAKA 3
Ikan Nila (Oreochromis niloticus) 3
Hormon Pertumbuhan (Growth Hormone, GH)) 4
Pakan 6
HP55 (hydroxypropyl methylcellulose phthalate) 7
PMC (polymethylol carbamide) 7
Kuning telur ayam 7
BAHAN DAN METODE 8
Rancangan Percobaan 8
Produksi Protein rGH 8
Lisis Dinding Sel Bakteri 8
Prosedur Penyalutan 9
Pembuatan Pakan Mengandung rElGH-HP55 9
Pembuatan Pakan Mengandung rElGH-PMC 9
Pembuatan Pakan Mengandung rElGH-Kuning Telur 9
Pembuatan Pakan Pelleting Mengandung rElGH 9
Analisis Proksimat Pakan dan Tubuh Ikan 10
Analisis Kadar Glikogen Hati dan Otot 11
Analisis Kadar Glukosa Darah 11
Pemeliharaan dan Pemberian Pakan 11
Analisis Statistika 12
HASIL DAN PEMBAHASAN 12
Hasil 12
Pemberian Protein rElGH melalui Pakan dengan Berbagai Metode Penyalutan dan Metode Pelleting
12 Konversi Pakan, Retensi Protein, Retensi Lemak, dan Komposisi
Tubuh 14
Kadar Glukosa Darah 15
Kadar Glikogen Otot dan Hati 15
Pembahasan 16
Pertumbuhan dan Kelangsungan Hidup (KH) 16
Konversi Pakan, Retensi Protein, Retensi Lemak 17
Glukosa Darah 18
Kadar Glikogen Otot dan Hati 19
KESIMPULAN DAN SARAN 20
Kesimpulan 20
Saran 21
DAFTAR PUSTAKA 21
LAMPIRAN 28
DAFTAR TABEL
Halaman 1. Proksimat pakan yang digunakan dalam penelitian (% bobot kering) 10 2 Biomassa panen, laju pertumbuhan spesifik (LPS), kelangsungan hidup
(KH), ikan nila yang diberi perlakuan hormon pertumbuhan rekombinan ikan kerapu kertang (rElGH) yang dipelihara selama 2 bulan
13
3. Tingkat konversi pakan (TKP), retensi protein dan retensi lemak, ikan nila yang diberi perlakuan hormon pertumbuhan rekombinan ikan kerapu kertang (rElGH) yang dipelihara selama 2 bulan
14
4. Proksimat (% bobot basah) tubuh benih ikan nila pada awal dan akhir percobaan
15 5. Kadar glukosa darah, ikan nila yang diberi perlakuan hormon
pertumbuhan rekombinan ikan kerapu kertang (rElGH) yang dipelihara selama 2 bulan
15
6. Kadar glikogen hati dan otot ikan nila yang diberi perlakuan hormon pertumbuhan rekombinan ikan kerapu kertang (rElGH) yang dipelihara selama 2 bulan
16
DAFTAR GAMBAR
Halaman 1. Perkembangan pendapat tentang mediasi hormon pertumbuhan (growth
hormone; GH)
4 2. Mekanisme hormon pertumbuhan (growth hormone; GH) dalam
mempengaruhi pertumbuhan dan beberapa fungsi lain
5 3. Pertumbuhan ikan nila (Oreochromis niloticus) yang diberi perlakuan
pakan mengandung rElGH yang disalut menggunakan berbagai bahan serta metode pelleting dengan dosis yang sama, dan frekuensi
metode penyalutan dan peleting pada ikan nila 28 2. Hasil analisis statistik laju pertumbuhan spesifik (LPS) pada ikan
3. Hasil analisis statistik kelangsungan hidup (KH) pada ikan perlakuan rGH dengan metode penyalutan dan pelleting pada ikan nila 32 4. Hasil analisis statistik tingkat konversi pakan (TKP) pada ikan
perlakuan rGH dengan metode penyalutan dan pelleting pada ikan nila 34 5. Hasil analisis statistik retensi protein pada ikan perlakuan rGH dengan
metode penyalutan dan pelleting pada ikan nila 36 6. Hasil analisis statistik retensi lemak pada ikan perlakuan rGH dengan
metode penyalutan dan pelleting pada ikan nila 38 7. Hasil analisis statistik glukosa darah pada ikan perlakuan rGH dengan
metode penyalutan dan pelleting pada ikan nila 40 8. Hasil analisis statistik glikogen hati pada ikan perlakuan rGH dengan
metode penyalutan dan pelleting pada ikan nila 42 9 Hasil analisis statistik glikogen otot pada ikan perlakuan rGH dengan
metode penyalutan dan pelleting pada ikan nila
1 I PENDAHULUAN
Latar Belakang
Hormon pertumbuhan (growth hormone; GH) merupakan salah satu hormon yang disekresikan oleh somatotrof dari kelenjar pituitari bagian anterior (Ryynanen & Primmer, 2006) dengan berat molekul berkisar 20 sampai 25 kDa. Hormon ini telah banyak diteliti dan digunakan sebagai model untuk ilmu fisiologi, pengaturan ekspresi gen, hubungan struktur, fungsi, dan evolusi gen (Perez-Sanches 2000; Pozios et al. 2001; Zairin. 2003; Yada et al. 2005; Ryynanen & Primmer 2006). GH berperan penting dalam pengaturan pertumbuhan dan perkembangan dengan cara mendukung proses pembelahan, diferensiasi, dan pembesaran ukuran sel (Copeland & Nasir 1994). Selanjutnya GH juga berperan dalam proses osmoregulasi (Sakamato et al. 1997) dan reproduksi (van Der Kraak et al. 1990; Le Gac et al. 1993).
Sejak tahun 1980-an, peneliti telah berhasil mengisolasi gen GH dan memproduksi hormon pertumbuhan rekombinan (rGH) dari beberapa jenis ikan di antaranya adalah pada ikan salmon (Sekine et al. 1985), ikan flounder (Jeh et al. 1998), orange-spotted grouper (Li et al. 2005), dan ikan patin siam (Poen 2009). Selanjutnya, Cheng (1995) telah mengkaji rute atau teknik pemberian rGH serta efeknya terhadap pertumbuhan dan perkembangan ikan. Di Indonesia beberapa rGH ikan telah diproduksi dan diuji bioaktivitasnya dalam memacu laju pertumbuhan ikan, seperti rGH ikan mas (rCcGH), ikan gurame (rOgGH), dan ikan kerapu kertang (rElGH) (Alimuddin et al. 2010). Berdasarkan analisis SDS-PAGE, level ekspresi rElGH lebih tinggi dibandingkan rCcGH dan rOgGH (Irmawati 2013), sehingga rElGH potensial digunakan untuk memacu pertumbuhan berbagai spesies budidaya.
Aplikasi pemberian rGH untuk memacu pertumbuhan ikan dapat dilakukan melalui injeksi, perendaman, dan pakan. Pemberian rGH melalui penyuntikan telah berhasil dilakukan pada ikan mujair (Oreochromis mossambicus) (Tsai et al. 1994; Leedom et al. 2002), ikan rainbow trout (Onchorhynchus mykiss) (McLean et al. 1997), channel catfish (Ictalurus punctatus) (Silverstein et al. 2000), giant catfish (Pangasianodon hypophthalmus), ikan mas (Cyprinus carpio) (Promdonkoy et al. 2004; Utomo 2010), dan ikan salmon (Salmonella sp.) (Shimizu et al. 2007). Metode perendaman rGH juga telah dilakukan pada berbagai ikan dan memberikan hasil yang baik terhadap pertumbuhan (Moriyama & Kawauchi 1990; Acosta et al. 2007; Putra 2011; Syazili et al. 2011; Handoyo 2012; Irmawati et al. 2012). Akan tetapi, metode penyuntikan dan perendaman relatif sulit diaplikasikan untuk skala massal. Metode penyuntikan memerlukan waktu relatif lama dan tenaga banyak karena injeksi dilakukan per individu. Selanjutnya metode perendaman hanya efektif pada fase larva atau ikan berukuran kecil, dengan dosis dan frekuensi perendaman tertentu (Acosta et al. 2009). Aplikasi metode perendaman skala massal dengan frekuensi perendaman lebih dari 1 kali, berpotensi tinggi menyebabkan ikan stres.
2
pada juvenil ikan flounder, Ben-Atia et al. (1999) dan Hardiantho et al. (2011) pada ikan nila, Handoyo (2012) pada benih ikan sidat, dan Safir (2012) pada benih ikan gurame. Jeh et al. (1998) menambahkan bahwa pemberian rGH melalui pakan buatan merupakan metode yang praktis, karena tidak perlu menangani ikan satu per satu. Akan tetapi, pada metode ini rGH perlu disalut (coating) untuk menghindari degradasi akibat enzim pencernaan, dan pH rendah di lambung.
Bahan yang sering digunakan untuk menyalut rGH selama ini adalah hydroxypropyl methylcellulose phthalate (HP55), yang telah terbukti memberikan efek yang maksimal terhadap perumbuhan ikan, tetapi harganya relatif mahal sehingga tidak efektif jika diaplikasikan dalam jumlah yang besar. Selain bahan penyalutan di atas, bahan selulosa lainnya seperti polymethyl carbamide (PMC) juga dapat digunakan sebagai penyalut. Fungsi utama polymethyl carbamide adalah mengikat air dan berguna untuk mendapatkan kekentalan yang tepat (Wong et al. 1988). Selain itu, PMC juga berperan dalam pemberian udara terhadap adonan selama proses pembekuan, meningkatkan kekuatan pada permukaan produk (Arbuckle dan Marshall 1996). Harga PMC relatif murah, dan memiliki daya pelindung yang lama terhadap bahan yang disalut; pada suhu 20oC dapat bertahan selama 1 tahun, 25 sampai 30oC sekitar 6 bulan, dan 35 sampai 38oC sekitar 3 bulan (Wong et al. 1988). Alternatif penyalut rGH yang relatif murah dan mudah diperoleh adalah kuning telur ayam. Kuning telur ayam telah banyak digunakan sebagai pengikat (binder) obat dan suplemen pada pakan ikan. Pencampuran rGH langsung ke bahan penyusun pakan sebelum dibuat pelet (pelleting) juga praktis, tetapi proses pemanasan dapat merusak rGH. Selanjutnya, penyalutan rGH dengan bahan berbeda dan pelleting tersebut dapat mempengaruhi konversi pakan dan metabolisme ikan nila. Oleh karena itu, penelitian ini dilakukan untuk menguji efektivitas rGH ikan kerapu kertang (rElGH) pada ikan nila melalui pakan dengan menggunakan penyalut HP55, PMC dan kuning telur, serta pelleting terhadap pertumbuhan, kelangsungan hidup, produksi (biomassa), konversi pakan, kadar glukosa darah, kadar glikogen, dan kandungan proksimat ikan.
Perumusan Masalah
Pemberian rGH melalui injeksi dan imersi telah dilakukan untuk meningkatkan pertumbuhan, tetapi relatif kurang efisien dari segi waktu. Sementara itu, penelitian aplikasi rGH melalui pakan yang telah dilakukan oleh Acosta et al. (2007) menunjukkan pemberian rGH pada ikan nila mampu meningkatkan pertumbuhan sekitar 50%. Pemberian rGH melalui pakan umumnya disalut (coating) untuk menghindari degradasi akibat enzim pencernaan dan kerusakan akibat pH rendah pada lambung (Jeh et al. 1998), atau tercerna sebelum masuk ke dalam pembuluh darah.
3 sehingga secara ekonomis dapat terjangkau, dapat digunakan dengan relatif mudah dan bisa diterapkan dalam skala yang lebih besar. Selain dengan metode penyalutan, pengujian rElGH juga dapat dilakukan dengan cara dicampurkan langsung dengan bahan baku pakan, kemudian dilakukan proses pembuatan pelet, dan dalam proses tersebut digunakan PMC sebagai binder atau pengikat. Kedua bahan tersebut kemudian dibandingkan dengan HP55 untuk mengevaluasi efektivitasnya dalam melindungi atau menyelimuti rGH yang diberikan pada pakan ikan nila.
Tujuan Penelitian
Secara umum penelitian ini bertujuan untuk menguji efektivitas rGH ikan kerapu kertang (rElGH) pada ikan nila melalui pakan dengan menggunakan berbagai bahan penyalut berbeda dan pelleting terhadap pertumbuhan, kelangsungan hidup, produksi, konversi pakan, kadar glukosa darah dan glikogen, dan kandungan proksimat ikan.
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat menjadi salah satu pedoman dalam aplikasi rGH yang dapat digunakan dalam budidaya untuk memacu pertumbuhan ikan dalam rangka menunjang upaya peningkatan produksi perikanan Indonesia.
II TINJAUAN PUSTAKA
Ikan Nila
4
Hormon Pertumbuhan (Growth Hormone, GH)
Hormon pertumbuhan merupakan polipeptida yang disekresikan oleh bagian anterior dari kelenjar pituitari yang memiliki fungsi utama memacu pertumbuhan tubuh. Hormon ini merupakan peptida dengan berat berkisar 20-25 kDa dan relatif bersifat spesifik untuk masing-masing spesies. Sekresi hormon pertumbuhan dikendalikan oleh hipotalamus.
Secara umum, GH berperan dalam memacu pertumbuhan tubuh, khususnya dengan merangsang pelepasan somatomedin, dan mempengaruhi metabolisme protein, karbohidrat, dan lipid. Pada ikan GH memiliki beberapa fungsi yang telah diketahui, di antaranya merangsang pertumbuhan tulang, otot dan gonad. Hormon ini juga berperan pada proses metamorfosis dan perkembangan ikan, pada proses osmoregulasi, merangsang hati mengeluarkan IGF-1, tingkah laku ikan ketika bermigrasi, pada proses gametogenesis pubertas dan perkembangan embrio, menjaga keseimbangan/homeostasi energi, merangsang nafsu makan, mempengaruhi komposisi daging, efisiensi pemberian pakan, gambaran darah, dan meningkatkan sistem imunitas tubuh (Sakai et al. 1997; Wong et al. 2006; Liu et al. 2007; Debnanth 2010).
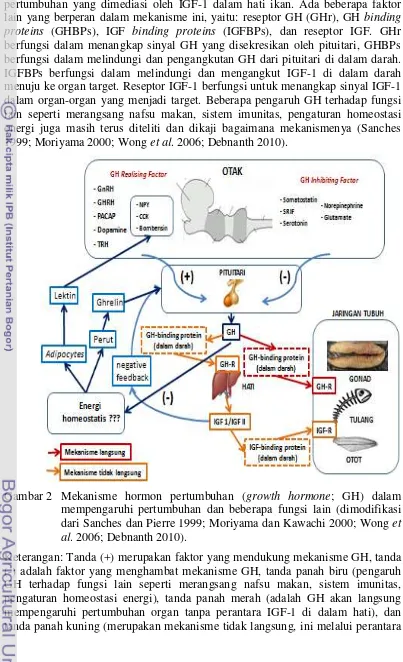
Mekanisme GH dalam mempengaruhi pertumbuhan ada beberapa pendapat yang terus berkembang (Gambar 1). Penelitian tentang bagaimana GH dimediasi dalam mempengaruhi pertumbuhan sudah dimulai sejak tahun 1950-an. Paradigma berkembang pada mamalia bahwa GH mempengaruhi pertumbuhan dimediasi oleh IGF-1 yang berada dalam hati. Pada tahun 1980-an berkembang paradigma bahwa ada mekanisme langsung pada GH dalam mempengaruhi pertumbuhan, dan kemudian diketahui bahwa dalam organ dapat memproduksi IGF-1 sendiri. Pada tahun 2000-an diketahui mediasi yang terjadi tidak hanya dalam hati, tetapi juga terjadi di luar hati dan ada peran IGF binding proteins (IGFBPs) dan acid-labile subunit (ALS) (Ohlsson et al. 2009).
Gambar 1 Perkembangan pendapat tentang mediasi hormon pertumbuhan (growth hormone; GH) dalam mempengaruhi pertumbuhan (Ohlsson et al. 2009). IGF-1 (insulin like growth factor 1), IGFBP3 (binding proteins 3), ALS (acid-labile subunit).
5 hati. Mekanisme tidak langsung adalah mekanisme GH dalam mempengaruhi pertumbuhan yang dimediasi oleh IGF-1 dalam hati ikan. Ada beberapa faktor lain yang berperan dalam mekanisme ini, yaitu: reseptor GH (GHr), GH binding proteins (GHBPs), IGF binding proteins (IGFBPs), dan reseptor IGF. GHr berfungsi dalam menangkap sinyal GH yang disekresikan oleh pituitari, GHBPs berfungsi dalam melindungi dan pengangkutan GH dari pituitari di dalam darah. IGFBPs berfungsi dalam melindungi dan mengangkut IGF-1 di dalam darah menuju ke organ target. Reseptor IGF-1 berfungsi untuk menangkap sinyal IGF-1 dalam organ-organ yang menjadi target. Beberapa pengaruh GH terhadap fungsi lain seperti merangsang nafsu makan, sistem imunitas, pengaturan homeostasi energi juga masih terus diteliti dan dikaji bagaimana mekanismenya (Sanches 1999; Moriyama 2000; Wong et al. 2006; Debnanth 2010).
Gambar 2 Mekanisme hormon pertumbuhan (growth hormone; GH) dalam mempengaruhi pertumbuhan dan beberapa fungsi lain (dimodifikasi dari Sanches dan Pierre 1999; Moriyama dan Kawachi 2000; Wong et al. 2006; Debnanth 2010).
6
1). GH-R (growth hormone receptors), IGF (insulin like growth factor), IGF-R (insulin like growth factor receptors).
Sekresi GH dirangsang oleh sinyal dari otak berupa neuropeptide, di antaranya growth hormone releasing hormone (GHRH), pituitary adenilate cyclase-activating polypeptide (PACAP), gonadothropin releasing hormone (GnRH), thyroid releasing hormone (TRH), neuropeptide-Y (NPY), bombensin, dan CCK. Sinyal dari otak yang berupa neurotransmitter yang telah diketahui adalah dopamin. Selain itu sekresi GH juga dirangsang oleh insulin like growth factor 1 (IGF-1) dan aktivin (sinyal dari pituitari), ghrelin, protein pakan, kandungan gula darah yang rendah, peningkatan sekresi androgen, arginin, T3/T4, dan CVP/CNP. Faktor yang dapat menghambat GH di antaranya somatostatin, SRIF, serotonin, glutamate, norepinephrine, konsentrasi hormon pertumbuhan dan insulin like growth factor 1 (IGF-1) yang bersirkulasi, kandungan gula darah yang tinggi, glukokortikoid, dan estradiol. Kandungan GH dalam tubuh ikan berkisar antara 0,2-111,2 ng/ml plasma darah (Björnsson et al. 2000; Arnesen et al. 2003; Drennon et al. 2003; Wong et al. 2006; Nordgarden et al. 2005).
Pakan
Protein merupakan komponen pakan yang sangat dibutuhkan sebagai pembentuk jaringan tubuh dalam proses pertumbuhan, tetapi jika kebutuhan energi dari sumber lemak dan karbohidrat tidak mencukupi, maka sebagian besar protein juga akan digunakan sebagai sumber energi. Sumber protein yang sering digunakan dalam pembuatan pakan ikan meliputi: tepung ikan, tepung udang, tepung kedelai, tepung kepala udang dan kedelai (Suprayudi 2010). Jumlah protein yang diperlukan dalam pakan secara langsung dipengaruhi oleh komposisi asam amino pakan. Ikan nila seperti hewan lain tidak memiliki kebutuhan protein yang mutlak, tetapi memerlukan suatu campuran yang seimbang antara asam amino esensial dan non esensial. Selanjutnya NRC (1983) mengemukakan pula bahwa kekurangan asam amino esensial mengakibatkan penurunan pertumbuhan. Sumber protein terbesar dalam pakan buatan adalah tepung ikan dan tepung kacang kedelai. Tepung kacang kedelai kekurangan asam amino metionin dan kekurangan ini dicukupi dari tepung ikan yang kaya akan asam amino lisin dan metionin.
7 HP55 (hydroxypropyl methylcellulose phthalate)
Penyalutan menggunakan HP55 merupakan suatu cara untuk melindungi bahan-bahan yang diberikan bersama dengan pakan dari degradasi yang disebabkan oleh asam lambung ketika berada dalam lambung dan akan terserap dengan baik ketika berada di dalam usus. Bahan yang dapat digunakan untuk penyalutan seperti kitosan, alginat, kuning/putih telur, dan HPMCP (hydroxypropyl methylcellulose phthalate). Bahan penyalut seperti HPMCP telah diperkenalkan di pasaran sejak tahun 1971. Sebagai turunan dari selulosa untuk penyalutan, bahan tersebut telah diuji dan efektif dalam beberapa penelitian, baik di bidang farmasi maupun perikanan. Berdasarkan kelarutannya, HPMCP terbagi
dua, yaitu HP50 dan HP55. HP50 larut dalam kondisi pH ≥ 5,0, sedangkan HP55 larut dalam kondisi pH≥ 5,5 (Shin-Etsu 2002).
Penggunaan HP55 sebagai bahan penyalut telah terbukti melindungi komponen aktif pada pakan ikan, sebagaimana dilaporkan oleh (Promdonkoy et al. (2004). Metode penggunaan HP55 sebagai penyalut juga telah dilakukan pada berbagai ikan dan memberikan hasil yang baik terhadap pertumbuhan (Handoyo 2012; Safir 2012).
PMC (Polymethylol Carbamide)
Polymethylol carbamide (PMC) digunakan sebagai binder pada pakan. PMC dapat mengikat setiap bahan gizi (aktif) secara bersama-sama. Penggunaan PMC sebagai binder dapat mengurangi kehilangan bahan gizi pakan yang larut
Persentase kuning telur sekitar 30% sampai 32% dari bobot telur. Kuning telur terdiri atas membran kuning telur (vitellin) dan kuning telur sendiri. Kuning telur merupakan makanan dan sumber lemak bagi perkembangan embrio. Komposisi kuning telur ayam adalah air 50%, lemak 32-36%, protein 16% dan glukosa 1-2% (Bell & William 2002). Asam lemak yang banyak terdapat pada kuning telur adalah linoleat, oleat dan stearat. Telur konsumsi diproduksi oleh ayam betina tanpa adanya ayam jantan (Bell & William 2002).Warna kuning telur dipengaruhi oleh pakan. Apabila pakan mengandung lebih banyak santofil, maka warna kuning telur semakin berwarna jingga kemerahan.
8
menghindari atau dapat meminimalisir terjadinya tingkat stres yang berlebihan pada ikan perlakuan serta dapat mengefektifkan waktu.
III BAHAN DAN METODE
Rancangan Percobaan
Rancangan percobaan yang digunakan adalah rancangan acak lengkap dengan 5 perlakuan (termasuk kontrol) dan 3 kali ulangan. Benih ikan nila diperoleh dari pembenihan di kolam percobaan BDP-FPIK IPB yang ukuran panjang tubuh sekitar 5 cm dengan kepadatan 125 ekor/m2, diberi pakan mengandung rGH sebanyak 3 kali dengan selang waktu 3 hari. Sebagai kontrol ikan diberi pakan tanpa rGH (pakan kontrol) secara 10%. Ikan dipelihara selama 2 bulan dalam hapa berukuran 3x2x1 meter. Perlakuan tersebut adalah perlakuan A: kontrol (pakan tanpa rGH); perlakuan B: penyalutan rGH dengan HP55; perlakuan C: penyalutan dengan PMC; perlakuan D: penyalutan dengan kuning telur (yolk); dan perlakuan E: penyalutan dengan PMC dan dicampur dengan bahan pakan sebelum dibuat menjadi pelet (pelleting). Bobot tubuh ikan pada semua perlakuan serta semua ulangan diukur biomassa totalnya setiap 2 minggu. Kelangsungan hidup ikan (KH) dihitung pada masa akhir pemeliharaan.
Produksi Protein rElGH
Produksi rElGH dilakukan menggunakan bakteri Escherichia coli BL21 yang mengandung konstruksi pCold-1/ElGH (Alimuddin et al. 2010). Klon bakteri E. coli dikultur dalam 4 mL media 2xYT cair yang mengandung ampisilin, dan diinkubasi menggunakan shaker pada suhu 37°C selama 16 sampai 18 jam. Setelah itu, dilakukan subkultur dengan mengambil sebanyak 1 mL dari kultur awal dan dimasukkan ke dalam 100 mL media 2xYT cair baru dan diinkubasi pada suhu 37°C selama 2 jam. Kemudian kultur diberi kejutan suhu 15°C selama 30 menit, ditambahkan IPTG 1 mM sebanyak 1 mL, dan diinkubasi menggunakan shaker pada suhu 15°C selama 24 jam. Bakteri hasil kultur dikumpulkan dengan sentrifugasi pada 12.000 rpm selama 2 sampai 10 menit.
Lisis Dinding Sel Bakteri
9 Prosedur Penyalutan
Prosedur penyalutan mengacu pada beberapa penelitian sebelumnya yang menggunakan bahan penyalut yang sama di antaranya adalah pakan uji dibuat dengan cara mencampurkan rEIGH yang sudah dilakukan penyalutan (coating) menggunakan HP55 (Shinetsu, Japan). Sementara coating menggunakan PMC mengikuti prosedur di Laboratorium Nutrisi Ikan, BDP-FPIK IPB dan kuning telur mengikuti metode yang sebelumnya sudah dilakukan sebagai berikut:
Pembuatan pakan mengandung rElGH-HP55
Pakan yang digunakan adalah pakan komersial dengan kandungan protein sekitar 30%. Penyalutan pakan mengandung rElGH dilakukan berdasarkan metode Promdonkoy et al. (2004) menggunakan HP55 sehingga terbentuk matriks rElGH-HP55. Pelet rElGH dilarutkan dalam amonium asetat yang mengandung HP55 dalam etanol 72,8%. Setelah penyalutan, rElGH-HP55 dikering-beku menggunakan freeze drier. Selanjutnya matrik rElGH-HP55 diresuspensi dalam asam asetat yang mengandung 10 mM NaCl, dan 0,013% (w/v) deoxyholic acid hingga konsentrasi rElGH menjadi 0,5 mg/mL. Pencampuran rElGH-HP55 dengan pakan uji dilakukan dengan cara disemprotkan dan kemudian dikering-anginkan.
Pembuatan pakan mengandung rElGH-PMC
Penyalutan 3 mg rElGH dengan PMC dilakukan sesuai dengan prosedur di Laboratorium Nutrisi Ikan, BDP-FPIK IPB. rElGH dilarutkan dalam 200 mL akuades. Pencampuran rElGH-PMC dengan pakan uji dilakukan dengan cara disemprotkan, dan kemudian dikering-anginkan. Pakan disimpan di lemari pendingin -20oC hingga akan diberikan ke ikan.
Pembuatan pakan mengandung rElGH-kuning telur
Sebanyak 3 mg rElGH (bobot basah) dilarutkan dalam 15 mL PBS dan selanjutnya dicampur dengan 20 mg kuning telur ayam yang berfungsi sebagai bahan pengikat (binder). Setelah dihomogenasi menggunakan vorteks, campuran kuning telur dengan rElGH disemprotkan secara merata pada 1 kg pakan komersial (protein sekitar 30%). Selanjutnya pakan dikering-udarakan sebelum diberikan ke ikan nila. Penyalutan pakan mengandung rElGH-kuning telur dilakukan berdasarkan metode Hardiantho et al. (2011). Pembuatan pakan yang mengandung rElGH-kuning telur sebanyak 1 kg dilakukan sekaligus dalam sekali pencampuran, kemudian pakan tersebut disimpan dalam lemari pendingin -20oC sampai akan dilakukan pemberian pakan pada ikan model.
Pembuatan pakan peleting mengandung rElGH
10
berdasarkan metode standar manual Laboratorium Nutrisi dan Kesehatan Ikan, BDP-FPIK IPB. Protein rElGH dilarutkan dalam 200 mL aquades yang dicampur dengan 20 mg kuning telur ayam yang berfungsi sebagai bahan pengikat (binder) pada pakan buatan. Pencampuran rElGH-PMC dengan pakan uji dilakukan dengan cara dicampurkan dengan 1 kg bahan baku pakan kemudian dilakukan proses peleting dan dikering-bekukan dengan menggunakan oven pada suhu 60oC. Perbedaan yang mendasar pada metode penyalutan menggunakan PMC dan metode pelleting dengan menggunakan PMC adalah pada penggunaan suhu, di mana suhu pada proses pelleting lebih tinggi yang memungkinkan rGH rusak, sementara dibandingkan dengan suhu pada proses penyalutan lebih rendah sehingga proses ini relatif aman. Kedua metode ini menggunakan bahan PMC, tetapi prosesnya berbeda, yaitu pada proses peleting; PMC dicampurkan langsung pada bahan baku pakan dan berfungsi sebagai pengikat (binder), sementara pada penyalutan PMC hanya dilakukan penyemprotan pada pakan.
Setelah dilakukan pencampuran matrik rElGH dan rElGH ke dalam pakan, selanjutnya dilakukan analisis proksimat untuk mengklarifikasi kandungan nutrisi pakan setelah dicampurkan. Komposisi nutrisi pakan yang akan diberikan (Tabel 1).
Tabel 1 Proksimat pakan yang digunakan dalam penelitian(% bobot kering)
Parameter Uji
DE (kkal/kg pakan) 2543.06 2458.00 2601.19 2523.19 2687.00
C/P (kkal/g protein) 8.93 7.90 8.01 7.96 8.64
Keterangan: DE (digestible energy) dikalkulasi menggunakan kandungan energi dalam protein sebesar 1 g protein= 3,5 kkal; 1 g lemak= 8,1 kkal; 1 kg karbohidrat= 2,5 kkal.
Analisis Proksimat Pakan dan Tubuh Ikan
11 Analisis Kadar Glikogen Hati dan Otot
Analisis kadar glikogen hati dan otot ikan nila mengacuh pada metode Wedemeyer dan Yasutake (1977). Jaringan otot atau hati sekitar 100 mg dididihkan dalam 3 mL 30% KOH sampai melarut selama 20 sampai 30 menit, kemudian ditambahkan 0,5 ml Na2SO4 jenuh dan 3,5 ml 95% etanol, selanjutnya dipanaskan sampai mendidih. Setelah dingin, larutan disentrifugasi dan supernatannya dibuang. Glikogen dilarutkan dalam 2 mL air dan diendapkan kembali dengan 2,5 mL etanol 95%. Supernatan dibuang dan glikogen yang mengendap dihidrolisis dengan 2 mL HCL 5M selama 30 menit dalam waterbath mendidih. Sampel didinginkan dan dinetralkan menggunakan 0,5 M NaOH (digunakan 1 tetes fenolred sebagai indikator). Sampel diencerkan sampai volume yang diketahui (50 sampai 100 mL), bergantung pada glikogen yang diharapkan dan analisis dilanjutkan dengan prosedur pengukuran glukosa.
Analisis kadar Glukosa Darah
Sampel darah sebanyak 0,05 mL, standar glukosa dan air (blanko) dimasukkan ke dalam tabung reaksi yang telah berisi 3,5 mL reagent (asam asetat 94 mL : o-toluidine 6 mL). Tabung reaksi berisi sampel tersebut dipanaskan di dalam waterbath mendidih selam 10 menit, kemudian diangkat dan didinginkan sampai temperatur ruang (warna stabil dalam 1 jam). Absorbansi sampel, dan
Benih ikan nila diperoleh dari pembenihan di kolam percobaan BDP-FPIK IPB. Benih ikan berukuran 5 sampai 6 cm dipelihara dalam hapa berukuran 3x3x2 m3 dengan kepadatan 125 ekor per hapa. Pakan awal yang diberikan (diadaptasikan) merupakan pakan buatan tanpa mengandung rEGH.
Pakan mengandung rElGH menggunakan dosis yang sama (3 mg/kg pakan). Setiap perlakuan diberi 3 kali ulangan. Pemberian pakan dilakukan 3 kali dalam sehari dengan interval waktu antar pemberian 3 hari sekali, dan tingkat pemberian pakan 10% dari bobot tubuh. Bobot total ikan diukur setiap 2 minggu. Kelangsungan hidup dan proksimat daging ikan dianalisis pada akhir penelitian. Penggunaan dosis rGH tersebut berdasarkan hasil penelitian Safir (2012) yang diuji pada benih ikan gurame. Hasil yang terbaik diperoleh menggunakan dosis 3 mg/kg pakan, dengan protokol pemberian dengan interval waktu 3 hari.
12
1. Laju pertumbuhan spesifik (Busacker et al. 1990)
LPS (%) =
Wt : bobot rerata ikan pada akhir percobaan (g) Wo : bobot rerata ikan pada awal percobaan (g) t : lama waktu pemeliharaan (hari)
LPS : Laju pertumbuhan spesifik (%) 2. Tingkat kelangsungan hidup (Effendie 1987)
KH : tingkat kelangsungan hidup ikan (%)
Nt : Jumlah ikan yang hidup pada akhir percobaan (ekor) No : Jumlah ikan yang hidup pada awal percobaan (ekor)
Analisis Statistika
Efektivitas perlakuan penyalutan rElGH dan pencampuran langsung ke dalam bahan pakan sebelum dibuat menjadi pelet ditentukan berdasarkan parameter pertumbuhan (bobot, panjang, dan biomassa), jumlah konsumsi dan konversi pakan (TKP), retensi protein dan lemak, kelangsungan hidup (KH); kandungan glikogen hati dan otot, serta glukosa darah. Semua parameter tersebut dianalisis menggunakan metode sidik ragam (ANOVA) dan uji lanjut Tukey dengan bantuan piranti lunak MINITAB 16, dengan faktor pembeda yaitu perlakuan metode penyalutan rElGH berbeda, dan metode pelleting. Kelangsungan hidup dianalisis secara deskriptif.
IV HASIL DAN PEMBAHASAN
Hasil
Pertumbuhan dan kelangsungan hidup
13
Gambar 3 Pertumbuhan ikan nila (Oreochromis niloticus) yang diberi perlakuan pakan mengandung rElGH yang disalut menggunakan berbagai bahan serta metode pelleting dengan dosis yang sama, dan frekuensi pemberian 3 kali dengan interval waktu 3 hari.
Pada Tabel 2 terlihat bahwa laju pertumbuhan spesifik (LPS) yang diperoleh dari semua perlakuan yang menggunakan metode penyalutan memberikan perbedaan yang signifikan secara statistik (P<0,05) dibandingkan dengan kontrol. Perlakuan rElGH yang disalut menggunakan kuning telur memiliki nilai tertinggi sebesar (46,85%), dan kemudian berturut-turut perlakuan yang disalut dengan HP55 (32,50%), PMC (27,99%), dan pelleting (26,64%). Sementara itu LPS perlakuan yang menggunakan metode pelleting tidak berbeda nyata dengan kontrol (P>0,05). Selanjutnya untuk kelangsungan hidup (KH) pada semua perlakuan baik perlakuan yang menggunakan metode penyalutan maupun dengan menggunakan metode pelleting menunjukkan perbedaan yang signifikan dengan kontrol (P<0,05). Sementara itu TKP pada semua perlakuan secara statistik tidak menunjukkan perbedaan yang signifikan dengan kontrol (P>0,05). Tabel 2 Biomassa panen, laju pertumbuhan spesifik (LPS), kelangsungan hidup
(KH), ikan nila yang diberi perlakuan hormon pertumbuhan rekombinan ikan kerapu kertang (rElGH) yang dipelihara selama 2 bulan
Perlakuan KH (%) Biomassa (g) LPS
14
Biomassa ikan perlakuan yang disalut menggunakan kuning telur menunjukkan perbedaan yang signifikan (P<0,05) dengan kontrol, tetapi biomassa ikan perlakuan yang disalut menggunakan kuning telur tidak berbeda dengan perlakuan penyalutan lainnya (P>0,05). Kelangsungan hidup (KH) ikan nila yang diberi perlakuan rElGH dengan penyalut berbeda dan pelleting lebih tinggi (P<0,05) daripada kontrol (Tabel 2).
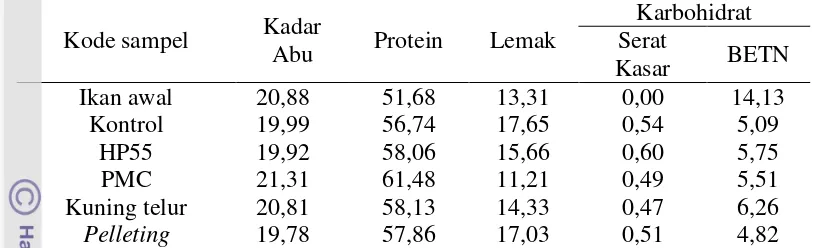
Konversi pakan, retensi protein, retensi lemak, dan komposisi tubuh
Perlakuan rGH meningkatkan konversi pakan, retensi protein dan retensi lemak, hal ini tercermin pada hasil analisis statistik (Tabel 3), di mana semua perlakuan yang menggunakan metode penyalutan dan metode pelleting memberikan efek yang signifikan (P<0,05). Perlakuan rGH yang disalut menggunakan kuning telur memiliki nilai tertinggi (21,53±0,46). Sementara itu nilai retensi lemak menunjukkan hasil yang berbeda pula, pada perlakuan rGH yang disalut menggunakan PMC menurun dan berbeda nyata (P<0,05) dengan perlakuan yang lain (Tabel 3). Terlihat juga bahwa nilai retensi lemak metode penyalutan satu dengan yang lainnya tidak berbeda dengan kontrol (P>0,05). Tabel 3 Tingkat konversi pakan (TKP), retensi protein dan retensi lemak, ikan nila
yang diberi perlakuan hormon pertumbuhan rekombinan ikan kerapu kertang (rElGH) yang dipelihara selama 2 bulan
Parameter uji
Perlakuan
Kontrol HP55 PMC Kuning Telur Pelleting
TKP 3,01 ± 0,19a 2,70 ± 0,07a 2,86 ± 0,29a 2,46 ± 0,11a 2,59 ± 0,14a
Retensi Protein (%)
18,62±1,06a 19,71±2,38a 20,39±2,20a 21,53±0,46a 21,66±2,86a
Retensi
Lemak (%) 25,79±1,78
a
26,55±1,84a 11,52±2,7b 22,58±1,34a 24,78±0,74a
Keterangan: TKP (tingkat konversi pakan). Nilai yang ditampilkan dalam bentuk rerata ± simpangan eror dari 3 ulangan. Huruf superskrip yang berbeda pada baris yang sama adalah berbeda nyata secara statistik (P<0,05).
15 Keterangan: Ikan awal; Ikan sebelum diberi pakan perlakuan, ikan perlakuan; ikan yang diberi pakan perlakuan dosis 3 mg/kg pakan (Pakan+rElGH+bahan penyalutan serta metode pelleting).
Kadar glukosa darah
Kadar glukosa darah pada ikan nila yang dipelihara selama 2 bulan dapat dilihat pada Tabel 5. Kadar glukosa ikan nila yang diberi perlakuan rGH yang disalut dengan menggunakan bahan berbeda (kuning telur ayam, HP55 dan PMC) serta metode pelleting adalah sama dengan kontrol (P>0,05).
Tabel 5 Kadar glukosa darah, ikan nila yang diberi perlakuan hormon pertumbuhan rekombinan ikan kerapu kertang (rElGH) yang dipelihara selama 2 bulan
Parameter uji
Perlakuan
Kontrol HP55 PMC Kuning Telur Pelleting
Glukosa
darah 17,63 ± 2,04
ab
20,81 ± 1,64a 18,21±1.23ab 17,34 ±2,45ab 11,85 ± 2,05b
Keterangan: nilai yang ditampilkan dalam bentuk rerata ± simpangan eror dari 3 ulangan. Huruf superskrip yang sama pada baris yang sama adalah tidak berbeda nyata secara statistik (P>0,05).
Kadar glikogen otot dan hati
16
Tabel 6 Kadar glikogen hati dan otot, ikan nila yang diberi perlakuan hormon pertumbuhan rekombinan ikan kerapu kertang (rElGH) yang dipelihara selama 2 bulan
Parameter uji
Perlakuan
Kontrol HP55 PMC Kuning Telur Pelleting
Glikogen
1,121± 0,255b 2,629±0,353a 1,755±0,169ab 0,806± 0,270b
Keterangan: nilai yang ditampilkan dalam bentuk rerata ± simpangan eror dari 3 ulangan. Huruf superskrip yang berbeda pada baris yang sama adalah berbeda nyata secara statistik (P<0,05).
Pembahasan
Pertumbuhan dan kelangsungan hidup (KH)
Kecepatan tumbuh ikan dipengaruhi oleh empat faktor utama yaitu, lingkungan, nutrisi, faktor endogen (fisiologis), dan faktor genetik. Faktor-faktor ini bekerja secara simultan dan saling berinteraksi dalam mengontrol kecepatan tumbuh (Sumpter, 1992). Faktor yang cukup besar pengaruhnya terhadap pertumbuhan adalah faktor fisiologis (regulasi hormon), hal ini terutama terkait dengan hormon pertumbuhan (GH). Hormon ini dapat meningkatkan enzim ornithine decarboxylase (ODC), yang berfungsi sebagai katalisator pada biosintesis polyamine yang penting untuk pembentukan makromolekul seperti DNA, RNA, dan protein (Sumpter, 1992). Peningkatan pertumbuhan ikan nila melalui pemberian rGH pada pakan juga sudah pernah dilaporkan sebelumnya oleh (Hardiantho et al. 2011; Handoyo 2012; Safir 2012). Pada penelitian ini, pemberian rGH melalui pakan dengan metode penyalutan secara signifikan dapat meningkatkan laju pertumbuhan sebesar 46,85% dibandingkan dengan kontrol. Selain itu, pemberian rElGH juga meningkatkan biomassa total dibandingkan dengan kontrol (Tabel 2).
Penelitian mengenai peran GH dalam mempengaruhi pertumbuhan sudah banyak dilakukan. Hal ini kemudian memunculkan kontroversi bahwa peran GH dalam pertumbuhan diketahui adanya mekanisme secara langsung dan tidak langsung yang berimplikasi terhadap pertumbuhan ikan. Dengan menggunakan western blot, Habibi et al. (2003) melaporkan keberadaan hGH pada jaringan lambung serta dalam serum setelah 30 menit dari intubasi pada ikan rainbow trout tidak ada jejak dari hGH yang bisa terdeteksi setelah setelah 90 menit pemberian, ini menunjukkan penyerapan hGH yang cepat pada ikan rainbow trout. Selain itu tidak ada imunoreaksi hGH yang terdeteksi pada jaringan lain termasuk usus tengah, otot, dan hati setelah diuji. Dengan demikian, diduga rGH diserap di lambung karena lambung merupakan sentral atau pusat pencernaan.
17 dan metode yang tepat untuk mendapatkan efek pertumbuhan yang optimum. Merujuk pada hasil analisis statistik bahwa pemberian rGH melalui pakan pada penelitian ini memperlihatkan taraf signifikan (P<0,05) untuk kelangsungan hidup pada perlakuan penyalutan dibandingkan dengan kontrol (Tabel 2). Secara rerata, KH perlakuan rElGH yang disalut menggunakan HP55 (97,33%), kuning telur (97,07%), PMC (96,27%), dan pelleting (96,80%) dari hasil terlihat semua perlakuan lebih tinggi dibandingkan dengan kontrol (93,07%).
Peningkatan kelangsungan hidup pada ikan yang diberi perlakuan rGH membuktikan bahwa rGH mampu meningkatkan kekebalan tubuh/imunitas pada ikan dari stres akibat kondisi lingkungan yang tidak sesuai. Rerata KH yang relatif lebih tinggi pada ikan yang diberi perlakuan rGH juga telah dilaporkan oleh peneliti sebelumnya, seperti Hardianto et al. (2011) melaporkan terjadi peningkatkan KH pada benih ikan nila, Handoyo (2012) melaporkan terjadi peningkatan KH pada benih ikan sidat (Anguilla sp.), dan Safir (2012) melaporkan terjadi peningkatan KH pada ikan gurame yang diberi pakan mengandung rElGH. Dengan demikian, metode penyalutan dengan menggunakan berbagai bahan serta metode pelleting tidak berpengaruh negatif terhadap kelangsungan hidup ikan. Kelangsungan hidup yang tinggi pada ikan perlakuan rElGH ini merupakan hal yang baik bagi dunia akuakultur, karena hal tersebut akan berdampak pada peningkatan produktivitas. Pada penelitian ini biomassa tertinggi diperoleh pada perlakuan rElGH yang disalut dengan kuning telur ayam.
Beberapa penelitian menunjukkan bahwa GH secara langsung mampu meningkatkan sel-sel yang berkompeten dalam sistem kekebalan tubuh/imunitas seperti limfosit, natural killer cell (NK cell), dan makrophages (Kelley 1989; Gala 1991). Meningkatkan resistensi terhadap infeksi bakteri Vibrio anguillarum melalui peningkatan aktivitas fagositosis (Sakai et al. 1997). GH juga mampu meningkatkan produksi superoxide anion dalam leukosit dan mitogenesis leukosit (Sakai et al. 1996). Pada ikan gilthead sea bream (Sparus aurata) dan silver sea bream (Sparus sarba) GH mampu menstimulasi lymphopoiesis dan fagositosis (Harris & Bird 2000). Pada ikan gilthead sea bream (Sparus aurata) juga terdeteksi adanya reseptor GH pada limfosit dan monosit yang menunjukkan bahwa GH secara langsung berhubungan dengan sistem imunitas (Calduch-Giner et al. 1995).
Konversi pakan, retensi protein dan lemak
18
meningkat akibat stimulasi hormon pertumbuhan (Volkaff et al. 2005; Debnanth 2010).
Kadar protein dan energi setiap perlakuan pada pakan yang digunakan adalah sama. Tingkat retensi protein juga sama antar perlakuan dan kontrol. Kadar energi pakan perlakuan dan kontrol relatif sama. Pakan kontrol memiliki energi 2543.06 kkal DE/kg pakan, sedangkan pakan yang disalut atau pakan perlakuan berturut-turut: HP55 2458.00, PMC 2601.19, kuning telur 2523.19, dan pelleting 2687.00 kkal DE/kg pakan (Tabel 1). Dengan demikian perbedaan konversi pakan secara signifikan dan kecenderungan peningkatan retensi protein berperan besar dalam meningkatkan pertumbuhan ikan yang diberi rElGH dibandingkan dengan kontrol. Pengaruh pertumbuhan pada ikan yang diberikan rGH dapat diduga karena rGH mampu bekerja sebagaimana fungsinya yaitu berperan penting pada metabolisme protein, lipid, dan karbohidrat (Bowen 2006). hal yang serupa juga disampaikan oleh Guyton (1994) bahwa GH berperan dalam meningkatkan protein tubuh, menggunakan lemak dari tempat penyimpanannya dan menghemat karbohidrat. Naiknya kecepatan pertumbuhan itu mungkin terutama disebabkan oleh naiknya kecepatan sintesis protein. Selanjutnya Guyton (1994) menyatakan bahwa penyebab utama kenaikan penyimpanan protein yang disebabkan hormon pertumbuhan tidak diketahui, namun ada serangkaian efek yang berbeda telah diketahui, yang semuanya dapat menjadi penyebab naiknya jumlah protein. Efeknya adalah bertambahnya pangangkutan asam amino melewati membran sel, bertambahnya sintesis protein oleh ribosom, peningkatan transkripsi DNA untuk membentuk RNA, dan penurunan katabolisme protein dan asam amino.
Hal yang serupa juga telah dilaporkan oleh peneliti sebelumnya bahwa pemberian rGH dari luar juga dapat mempengaruhi lipolisis dan glukoneogenesis (O'Connor et al. 1993). GH juga berpengaruh dalam sintesa protein dan omset lipid (Oommen & Johnson, 1998; Fauconneau et al. 1996). Akibatnya, ikan yang diberi perlakuan GH dari luar (eksogen) memiliki kemampuan lebih besar untuk mencerna makanan, menyerap nutrisi, dan mengkonversi lebih besar proporsi makanan untuk membentuk komposisi tubuh ikan, sehingga dapat berpengaruh terhadap peningkatan efisiensi pemberian pakan. Selain itu (Pell et al. 1990; Johnsson et al. 1987) juga melaporkan bahwa pemberian rGH dapat meningkatkan sintesis protein dan menurunkan sintesis lemak pada mamalia dan menstimulasi anabolisme dalam meningkatkan penggantian dan sintesis protein pada ikan, yang terjadi pada hati dan otot dengan menstimulasi efisiensi dari translasi ribosom melalui peningkatan konsentrasi mRNA dan ribosom (Foster et al. 1991; Herbert et al. 2001).
19 jaringan, hormon pertumbuhan meningkatkan perubahan asam lemak menjadi asetil-KoA dan kemudian digunakan untuk energi. Guyton (1994) melaporkan bahwa pengaruh pemberian hormon pertumbuhan pada tikus, maka tikus perlakuan lebih disukai memakai lemak sebagai energi daripada karbohidrat dan protein.
Ditambahkan oleh O’Connor et al. (1993) bahwa rGH dapat menstimulasi lipolisis pada beberapa jenis spesies ikan seperti ikan rainbow trout. Kandungan protein yang lebih rendah pada kontrol diduga meningkatnya proses anabolisme dalam tubuh untuk memperbaiki sel-sel yang rusak untuk kelangsungan hidup. Hal tersebut terlihat dari kelangsungan hidup dan pertumbuhan yang lebih rendah pada ikan kontrol. Hal tersebut juga menunjukkan bahwa efek langsung yang dihasilkan oleh hormon pertumbuhan rekombinan (rGH) adalah berfungsi pada organ sasarannya atau berkaitan langsung dengan reseptor di sel target, dan berpengaruh terhadap hampir seluruh dari jaringan tubuh (Guyton 1994).
Glukosa darah
Hormon pertumbuhan memiliki 3 pengaruh utama terhadap metabolisme glukosa di dalam sel yaitu mengurangi pemakaian glukosa untuk mendapatkan energi, meningkatkan pengendapan glikogen di dalam sel, dan mengurangi penyerapan glukosa oleh sel (Guyton 1994). sedangkan (Ganong 2002) menyatakan bahwa pemberian hormon pertumbuhan menurunkan responsivitas terhadap insulin. Kemampuan ikan dalam memanfaatkan karbohidrat dalam pakan sangat bergantung pada kompleksitas karbohidrat, sifat fisik, dan kadar karbohidrat dalam pakan. Kemampuan ini dapat dilihat dari sistem pencernaan dan sistem metaboliknya. Kemampuan sistem metabolik menggambarkan kemampuan ikan dalam memanfaatkan karbohidrat terabsorbsi (terutama dalam bentuk glukosa), hal ini diduga kuat kaitannya dengan rGH yang diberikan pada ikan. Untuk masuk ke dalam sel, glukosa perlu dibantu oleh insulin. Efek tidak langsungnya GH yaitu melalui perantara insulin like growth factor-1 (IGF-1), yang merupakan suatu hormon yang disekresi oleh hati dan jaringan lain yang berespon terhadap pemacuan pertumbuhan, sehingga keberhasilan GH sebenarnya tergantung pada aksi IGF-1 di sel target (Bowen 2006).
Matthews et al. (2003) mengemukakan bahwa peningkatan kadar glukosa darah yang berlangsung cepat dapat memicu bioaktivitas insulin pada tingkat tertinggi, sehingga pemasukan glukosa darah ke dalam sel berlangsung dengan cepat dan kadar glukosa dalam darah segera menurun. Ketersediaan glukosa dalam sel, digunakan untuk memenuhi kebutuhan fisiologis tubuh dan kebutuhan energi, setelah terpenuhi pemasukan glukosa yang tinggi akan merangsang terjadinya proses glikogenesis dan lipogenesis (Stryer, 2000). Rendahnya kadar glukosa darah pada pakan ikan yang megandung rGH menunjukkan turnover rate glukosa lebih cepat.
20
glukoneogenesis merupakan proses utama untuk memenuhi kebutuhan glukosa tubuh dan proses ini tetap aktif pada glukosa tinggi (Fu & Xie 2004).
Glikogen hati dan otot
Kadar glikogen hati tertinggi diperoleh pada perlakuan penyalutan dengan kuning telur. Glikogen berfungsi sebagai cadangan energi, dan hal ini diduga terkait kuat dengan tingginya laju pertumbuhan pada ikan nila yang diberi perlakuan rGH yang menggunakan bahan penyalut kuning telur. Menurut Turner dan Bagnara (1976) bahwa hal ini terjadi akibat dari pemberian GH pada pakan sehingga hewan mampu untuk meningkatkan mobilitas glikogen didalam tubuhnya. Glikogen merupakan salah satu bentuk simpanan energi di dalam tubuh yang dapat dihasilkan melalui konsumsi karbohidrat yang terdapat didalam pakan dan merupakan salah satu sumber energi utama yang digunakan oleh tubuh pada saat terjadinya fitnes. Glikogen merupakan bentuk simpanan karbohidrat di dalam hati dan otot. Hal ini menegaskan bahwa penambahan rEIGH pada pakan ikan akan memperlambat proses glikolisis dan lipogenesis serta menekan degradasi asam amino dan glukoneogenesis pada hati. Pada ikan karnivora, proses glukoneogenesis merupakan proses utama untuk memenuhi kebutuhan glukosa tubuh dan proses ini tetap aktif pada glukosa tinggi (Fu & Xie 2004).
Glikogen yang terdapat di dalam otot hanya dapat digunakan untuk keperluan energi di dalam otot tersebut dan tidak dapat dikembalikan ke dalam aliran darah dalam bentuk glukosa apabila terdapat bagian tubuh lain yang membutuhkannya, hal ini mengindikasi bahwa kontribusi glikogen terhadap pengeluaran energi total sangat kecil, hanya terlibat langsung pada aktivitas otot sehingga mobilisasi glikogen hanya berhubungan dengan peningkatan otot (Navarro & Gutieerrez 1995). Berbeda dengan glikogen hati dapat dikeluarkan apabila terdapat bagian tubuh lain yang membutuhkan. Glikogen yang terdapat di dalam hati dapat dikonversi melalui proses glycogenolysis menjadi glukosa dan kemudian dapat dibawa oleh aliran darah menuju bagian tubuh yang membutuhkan seperti otak, sistem saraf, jantung, otot dan organ tubuh lainnya.
V KESIMPULAN DAN SARAN
Kesimpulan
21 Saran
Dalam proses penyalutan rGH pada pakan untuk ikan, kuning telur dan PMC dapat digunakan sebagai bahan alternatif pengganti HP55. Pada metode pelleting, PMC dapat digunakan sebagai binder tetapi pada proses pengeringan pakan rGH di dalam oven direkomendasikan menggunakan suhu 60oC.
DAFTAR PUSTAKA
Acosta JR, Morales R, Morales M, Alonso M, Estrada MP. 2007. Pichia pastoris expressing recombinant tilapia growth hormon accelerates the growth of tilapia. Biotechnol Lett. 29: 1671-1676.
Acosta JR, Estrada MP, Carpio Y, Ruiz O, Morales R, Martinez E, Valdes J, Borroto C, Besada V, Sanchez A, Herrera F. 2009. Tilapia Somatotropin polypeptides: potent enhancers of fish growth and innate immunity. Biotecnología Aplicada. 26: 267-272.
Alimuddin, Lesmana I, Sudrajat AO, Carman O, Faisal I. 2010. Production and bioactivity potential of three recombinant growth hormones of farmed fish. Indonesian Aquaculture Journal. 5: 11-16.
Arbuckle WS, Marshall RT. 1996. Ice Cream. 5th Edit. Chapman and Hall Publishing, New York.
Arnesen AM, Toften H, Agustsson T, Stefansson SO, Handeland SO, Björnsson BT. 2003. Osmoregulation, feed intake, growth and growth hormone levels in Atlantic salmon (Salmo salar L.) transferred to seawater at different stages of smolt development. Aquaculture. 222:167-187.
Bell DD, William DW. 2002. Commerical chicken meat & egg production. CRC Press. 186 hal.
Ben-Atia I, Fine M, Tandler A, Funkenstein B, Maurice S,Cavari E and Gertler A 1999. Preparation of recombinant gilthead seabream (Sparus aurata) growth hormone and its use for stimulation of larvae growth by oral administration. Gen Comp Endocrinol. 113: 155–164.
Biswas AK, T. Morita, G. Yoshizaki, T. Takeuchi, 2005. Control of reproduction in Nile tilapia (Oreochronis nilocitus L.) by photoperiod manipulation. Aquaculture. 243: 229-239.
Björnsson BT, Hemre GI, Bjørnevik M, Hansen T. 2000. Photoperiod regulation of plasma growth hormone levels during induced smoltification of under yearling Atlantic salmon. Gen Comp Endocrinol. 119:17–25.
Borgeson TL. 2006. Effect of replacing fish meal with simple or complex mixtures of vegetable ingredients in diets fed to Nile tilapia (Oreochromis niloticus) [Thesis]. Department of Animal and Poultry Science University of Saskatchewan. Saskatoon, Saskatchewan.
Bowen R. 2006. Growth Hormone (Somatotropin).
http://www.vivo.colostate.edu/hbooks/pathphys/endocrine/hypopit/ gh.html.[15 Februari 2007]
Busacker GP, Adelman IR, Goolish EM. 1990. Growth. In: Schreck CB, Moyle PB. (eds.). Methods for Fish Biology. American Fisheries Society.
22
the gilthead sea bream (Sparus aurata). Journal Endocrinology. 146:459– 467.
Cheng CM. 1995. A Study on a Recombinant Teleostean Growth Hormone [Dissertation]. Maryland: University of Maryland, Baltimore County. Copeland KC. KS Nasir. 1994. Acute growth hormone effects on amino acid and
lipid metabolism. Journal Clin Endocrinol Metabol. 78: 1,040-1,047. Debnanth S. 2010. A review on the physiology of insulin like growth factor-I
(IGF-I) peptide in bony fishes and its phylogenetic correlation in 30 different taxa of 14 families of teleosts. Advances in Environmental Biology. 5:31-52.
Devlin RH, Biagi CA, Yesaki TY, 2004. Growth, viability and genetic characteristics of GH transgenic coho salmon strains. Aquaculture. 236: 607–632.
Drennon K, Moriyama K, Kawauchi H, Small B, Silverstein J, Parhar I, Shepherd B. 2003. Development of an enzyme-linked immuno sorbent assay for the measurement of plasma growth hormone (GH) levels in channel catfish (Ictalurus punctatus): assessment of environmental salinity and GH secretogogues on plasma GH levels. Gen Comp Endocrinol. 133:314-322.
Effendie, M. 1. 1987. Biologi Perikanan. Bag. I. Study of natural history. Fakultas Perikanan, Institut Pertanian Bogor, Bogor, 150 hal.
El-Saidy DMS, Gaber MMA. 2005. Effect of dietary protein levels and feeding rates on growth performance, production traits and body composition of Nile tilapia (Oreochromis niloticus L.) cultured in concrete tanks. Aquaculture. 36: 149-168.
El-Sayed AFM. 1999. Alternative dietary protein sources for farmed tilapia (Oreochromis spp). Aquaculture. 179: 149-168.
Fauconneau, B., Mady, M.P., Le Bail, P.Y., 1996. Effect of growth hormone on muscle protein synthesis in rainbow trout (Oncorhynchus mykiss) and Atlantic salmon (Salmo salar). Fish Physiology Biochemistry. 15:49–56.
Fasaklin EA, Serwata RD, Davies SJ. 2005. Comparative utilization of rendered animal derived products with or without composite mixture of soybean meal in hybrid tilapia (Oreochromis niloticus × Oreochromis mossambicus) diets. Aquaculture. 249: 329-338.
Foster AR, Houlhan DF, Gray C, Medalem F, Fauconneau B, Kaushik SJ, LeBail PY. 1991. The effect of ovine growth hormone on protein turnover in rainbow trout. Gen Comp Endocrinol. 82: 111-120.
Fu SJ, Xie XJ. 2004. Nutritional homeostasis in carnivorous southern catfish (Silirus meridionalis): is there a mechanism for increased energy expenditure during carbohydrate overfeeding? Comp Biochemical Physiolgy Part A. 130: 359-363.
Gala RR. 1991. Prolactin and growth hormone in the regulation of the immune system. Proc Sot Exp Biol Med. 198:513-527.
Ganong WF. 2002. Buku Ajar Fisiologi Kedokteran. Edisi 20. Brahm U. Pendit, Alih Bahasa. H. M. Djauhari Widjajakusumah, Editor. Jakarta: EGC Press