i
RESPONS BENIH IKAN GURAME (
Osphronemus goramy
)
YANG DIBERI HORMON PERTUMBUHAN REKOMBINAN
MELALUI ORAL PADA DOSIS BERBEDA
MUHAMMAD SAFIR
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
iii
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis “Respons benih ikan gurame
(Osphronemus goramy) yang diberi hormon pertumbuhan rekombinan melalui
oral pada dosis berbeda” adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukkan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Oktober 2012
v ABSTRACT
MUHAMMAD SAFIR. Response of Giant Gourami (Osphronemus goramy) Juvenile on Oral Administration in Different Dose of Recombinant Growth Hormone. Supervised by ALIMUDDIN and NUR BAMBANG PRIYO UTOMO.
This study was aimed to evaluate the response of giant gourami juvenile on oral administration of recombinant giant grouper growth hormone (rElGH). A total of 45 juvenile were fed with rElGH coated by hydropropylmethyl cellulose phthalate (HP55) and mix with commercial diet (35% protein content). Feeding fish with diet containing four different doses of rElGH (0 mg/kg feed, 0.3 mg/kg feed, 3.0 mg/kg feed, and 30.0 mg/kg feed) was performed in twice a week for 2 month. Fish were then maintained for 1 month without rElGH treatment. The results showed that biomass harvest in treatment 3.0 mg/kg (1,376.0±38.3 g) and 30.0 mg/kg (1,362.2±78.5 g) was similar, and the two treatments were 46.76% and 44.28% higher compared to control (977.6±96.7 g), respectively. In addition, rElGH treatment increased appetite, while artificial feed conversion ratio (1.18) was lower (P<0.05) by 23.72% compared to that of control (1.46). Oral administration of rElGH also increased hepatosomatic index (16.12%) and protein content (17%), while lipid content (21%) decreased compared to control. Similar in fish survival at end of experiment, insulin-like growth factor-1 and growth hormone receptor-1 gene expression levels in brain at 24 hours after feeding in rElGH treatment and control were obtained. Thus, orally rElGH administration was effective to be applied to enhance the growth of giant gourami juvenile.
vii RINGKASAN
MUHAMMAD SAFIR. Respons benih ikan gurame (Osphronemus goramy) yang diberi hormon pertumbuhan rekombinan melalui oral pada dosis berbeda. Dibimbing oleh ALIMUDDIN dan NUR BAMBANG PRIYO UTOMO.
Permasalahan utama dalam budidaya ikan gurame adalah pertumbuhannya yang relatif lambat, sehingga waktu yang diperlukan untuk mencapai ukuran konsumsi adalah relatif lama. Upaya untuk meningkatkan laju pertumbuhan dapat dilakukan dengan berbagai cara, seperti seleksi ikan, transfer gen, dan penggunaan protein rekombinan. Namun demikian, kedua metode awal tersebut kurang aplikatif diterapkan pada ikan gurame karena terkendala oleh pertumbuhan yang mengakibatkan pematangan gonad yang lama serta metode pemijahan buatan pada ikan gurame belum dikuasai dengan baik. Selanjutnya penggunaan protein rekombinan dalam hal ini hormon pertumbuhan rekombinan (recombinant
growth hormone/rGH) merupakan metode tepat yang dapat dijadikan solusi
alternatif untuk mengatasi permasalahan pada ikan gurame. Hal ini dapat dilihat dari beberapa hasil yang signifikan pada beberapa spesies ikan budidaya yang menunjukkan bahwa rGH mampu mempercepat pertumbuhan dan perkembangan, membantu proses metabolisme, osmoregulasi, reproduksi, dan fungsi kekebalan tubuh.
Aplikasi rGH dapat dilakukan menggunakan metode injeksi, perendaman, dan melalui pakan. Pemberian rGH melalui injeksi kurang aplikatif digunakan karena memerlukan waktu yang relatif lama, dan sumberdaya yang banyak serta dibatasi oleh ukuran ikan. Selanjutnya metode imersi hanya efektif dilakukan pada fase larva/benih ikan, sehingga pada penelitian ini aplikasi rGH diarahkan secara oral melalui pakan. Selain itu, rGH yang digunakan pada penelitian ini adalah dari ikan kerapu kertang (rElGH). Penelitian ini bertujuan untuk mendapatkan dosis rElGH dalam pakan yang memberikan pertumbuhan tertinggi dalam pendederan ikan gurame. Selain itu, penelitian ini juga dilakukan untuk mengevaluasi ekspresi gen insulin-like growth factor-1 (IGF-1) dan growth
hormone receptor-1 (GHR-1) yang terkait dengan mekanisme kerja hormon
pertumbuhan secara tidak langsung, serta menganalisis respons benih ikan gurame dalam memakan pakan, histologi hati dan hepatosomatic index (HSI). Hasil penelitian ini diharapkan dapat bermanfaat sebagai salah satu solusi untuk meningkatkan laju pertumbuhan ikan gurame dalam upaya peningkatan produksi perikanan budidaya Indonesia.
Produksi rElGH dilakukan menggunakan bakteri Escherichia coli BL21 yang mengandung plasmid pCold-rElGH. Bakteri dikultur pada media 2xYT pada suhu inkubasi 15°C selama 24 jam dan diinduksi dengan
isopropyl-b-D-thiogalac-topyranoside dengan dosis 0,5 mM. Bakteri dilisis dengan menggunakan lisozim,
kemudian rGH diendapkan menggunakan sentrifugasi. Analisis SDS-PAGE digunakan untuk memastikan adanya rElGH dalam protein total dari bakteri.
viii
dipindahkan ke hapa berukuran 2x1x1 m3 dalam kolam beton hingga akhir pemeliharaan. Selama 8 minggu pertama ikan diberi pakan yang mengandung rElGH dengan frekuensi 2 kali dalam seminggu, dan 4 minggu berikutnya hanya diberikan pakan normal.
Hasil penelitian menunjukkan bahwa perlakuan rElGH dengan dosis 3 mg/kg pakan memberikan biomassa yang tertinggi (1.376,0±38,3 g), diikuti dosis 30 mg/kg pakan (1.362,2±78,5 g), 0,3 mg/kg pakan (1.144,8±40,7 g) dan terendah adalah kontrol (977,6±96,7 g). Biomassa ikan perlakuan dosis 3 mg/kg pakan berbeda nyata (P<0,05) dibandingkan kontrol. Peningkatan pertumbuhan biomassa total pada perlakuan 3 mg/kg pakan sebesar 46,76%, dan 44,28% pada perlakuan dosis 30 mg/kg pakan dibandingkan dengan kontrol. Selain itu, laju pertumbuhan spesifik (SGR) ikan perlakuan 3 dan 30 mg/kg pakan berbeda nyata (P<0,05) terhadap kontrol. SGR yang tertinggi terjadi pada perlakuan dosis 3 mg/kg pakan, yakni sebesar 14,89% dibandingkan dengan kontrol. Selain itu, konversi pakan (FCR) dan tinggi badan ikan perlakuan 3 mg/kg pakan masing-masing meningkat sebesar 23,72%, dan 9,67% dibandingkan dengan kontrol. Sementara itu, panjang baku dan kelangsungan hidup (KH) ikan tidak menunjukkan perbedaan yang signifikan (P>0,05). Berdasarkan nilai rerata, KH perlakuan rElGH (96,30-97,04%) relatif lebih tinggi daripada kontrol (91,11%). Variasi KH yang relatif rendah pada ikan perlakuan rElGH merupakan hal baik bagi akuakultur, karena variasi produktivitas (biomassa panen) budidaya akan menjadi kecil. Dengan kata lain bahwa kepastian pencapaian target produksi budidaya ikan dengan perlakuan rElGH lebih tinggi daripada tanpa perlakuan rElHP (kontrol).
Gambaran histologi hati ikan perlakuan rElGH dosis 3 mg/kg pakan dan kontrol relatif sama. Hal ini menunjukkan bahwa pemberian pakan yang mengandung rElGH pada ikan gurame tidak memberikan efek negatif atau kerusakan pada hati. Perbedaan gambaran hati terdapat pada ukuran hepatosit yang lebih besar pada ikan perlakuan rElGH, yang diduga disebabkan oleh akumulasi nutrien lebih banyak dibandingkan dengan kontrol. Hal ini diperkuat dengan meningkatnya HSI ikan perlakuan rElGH sebesar 16,12% dibandingkan dengan kontrol. Selanjutnya, perlakuan rElGH 3 mg/kg pakan meningkatkan sintesis protein (kandungan protein yang meningkat) dan menstimulasi lipolisis (ditandai dengan penurunan kadar lemak).
Analisis semi-kuantitatif RT-PCR menunjukkan bahwa ekspresi gen IGF-1 dan GHR-IGF-1 di otak dan hati saat 24 jam pasca perlakuan rElGH adalah relatif sama dengan kontrol. Dengan demikian mekanisme kerja rElGH melalui pakan diduga memanfaatkan mekanisme kerja secara langsung; tidak melibatkan jalur IGF-1 di hati.
Sebagai kesimpulan, pemberian rElGH melalui pakan dapat meningkatkan pertumbuhan ikan gurame secara signifikan. Dosis yang terbaik adalah 3 mg/kg pakan. Pemberian rElGH mampu menghemat penggunaan pakan dengan menurunkan FCR secara signifikan, dan meningkatkan HSI. Kadar lemak ikan perlakuan rElGH menurun. Pemberian rElGH melalui pakan tidak mempengaruhi ekspresi gen IGF-1 dan GHR-1 pada jam ke-24 setelah pemberian pakan.
ix
©
Hak Cipta milik IPB, tahun 2012
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjaun suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
xi
RESPONS BENIH IKAN GURAME (
Osphronemus goramy
)
YANG DIBERI HORMON PERTUMBUHAN REKOMBINAN
MELALUI ORAL PADA DOSIS BERBEDA
MUHAMMAD SAFIR
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Akuakultur
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
xii
Dosen Penguji Luar Komisi pada Ujian Tesis:
xiii Judul Tesis : Respons benih ikan gurame (Osphronemus goramy) yang diberi hormon pertumbuhan rekombinan melalui oral pada dosis berbeda
Nama : Muhammad Safir NIM : C151 10 0091
Disetujui
Komisi Pembimbing
Dr. Alimuddin, S.Pi, M.Sc Dr. Ir. Nur Bambang P.U, M.Si Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Ilmu Akuakultur
Prof.Dr.Ir. Enang Harris, M.S Dr.Ir. Dahrul Syah, M.Sc. Agr
xv
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala
karunia-Nya sehingga karya ilmiah TESIS ini berhasil diselesaikan. Penelitian
dilaksanakan sejak bulan Maret sampai Juli 2012 dengan tema tentang rekayasa
pada budidaya ikan gurame. Judul penelitian ini adalah “Respons benih ikan
gurame (Osphronemus goramy) yang diberi hormon pertumbuhan rekombinan
melalui oral pada dosis berbeda”.
Keberhasilan penulis dalam menyelesaikan penelitian ini tidak semata
didapatkan sendiri, melainkan dengan bantuan orang-orang sekitar. Untuk itu
penulis mengucapkan terima kasih kepada Dr. Alimuddin, S.Pi, M.Sc. selaku
Pembimbing 1, Dr. Ir. Nur Bambang Priyo Utomo, M.Si. selaku Pembimbing II
dan Dr. Dinamella Wahjuningrum, S.Si, M.Si, selaku penguji luar komisi pada
ujian tesis. Irmawati S.Pi, M.Si, Aras Sazili, S.Pi, M.Si, Anna Octavera, S.Pi,
M.Si, Eny Heriyati S.Pi, M.Si, Boyun Handoyo, S.Pi, M.Si, La Ode Muh. Arsal
S.Pi, La Ode Aslin S.Pi, rekan-rekan di Laboratorium Reproduksi dan Genetika
Organisme Akuatik, mahasiswa Akuakultur IPB 2010, serta Mahasiswa
Pascasarjana Asal Sulawesi Selatan. Ucapan terima kasih juga penulis sampaikan
kepada kedua orang tua dan saudara-saudara penulis atas segala dukungan, doa
dan kasih sayangnya,
Penulis telah berusaha semaksimum mungkin dalam penyelesaian karya
ilmiah ini. Dengan harapan, karya ilmiah ini dapat bermanfaat bagi penulis dan
para pembaca pada umumnya.
Bogor, Oktober 2012
xvii RIWAYAT HIDUP
Penulis dilahirkan di Malili, Kabupaten Luwu Timur, Sulawesi Selatan
pada tanggal 22 Juli 1985 dari Ayah Abdullah dan Ibu Titi. Penulis merupakan
anak kedua dari sebelas bersaudara. Tahun 1998 penulis menyelesaikan
pendidikan dasar di SD 211 Angkona, Kec. Angkona, Tahun 2001 penulis
menyelesaikan pendidikan di SLTP Negeri 2 Malili, Kec. Malili, dan 2004 penulis
menyelesaikan pendidikan di SMUN 1 Malili, Kabupaten Luwu Timur. Pada
tahun yang sama (2004) penulis melanjutkan pendidikan tinggi di Universitas
Hasanuddin pada program studi Budidaya Perairan, melalui jalur SNMPTN dan
lulus pada tahun 2008. Selama menjadi mahasiswa penulis aktif dalam berbagai
kelembagaan di kampus. Pada tahun 2008 penulis bergabung sebagai tenaga
pendamping perikanan di Kab. Luwu-Timur. Tahun 2009 penulis bekerja di Pusat
Kegiatan Penelitian (PKP) UNHAS sebagai tenaga teknis lapangan. Pada tahun
yang sama penulis diterima sebagai tenaga kerja kontrak selama dua tahun
(2009-2011) di Bank Rakyat Indonesia (BRI) sebagai costumer service (CS). Karena
penulis memiliki keinginan yang tinggi untuk kuliah, penulis mendaftarkan diri
sebagai calon mahasiswa pascasarjana IPB dengan status pembiayaan mandiri.
Alhamdulillah tahun 2010 penulis diterima dan resmi menjadi mahasiswa
pascasarjana di IPB, pada program studi Ilmu Akuakultur (AKU). Pada tahun
kedua (semester III-IV) penulis mendapatkan beasiswa dari BAKRIE CENTER
FOUNDATION (BCF). Untuk menyelesaikan studi di sekolah pascasarjana
tersebut, penulis melakukan penelitian dengan judul tesis “Respons benih ikan
gurame (Osphronemus goramy) yang diberi hormon pertumbuhan rekombinan
melalui oral pada dosis berbeda”, dibimbing oleh Dr. Alimuddin, S.Pi, M.Sc, dan
xix
2.1. Ikan Gurame (Osphronemusgoramy)... 5
2.2. PertumbuhanIkanGurame……….…... 5
3.4. Pemberian rElGH-HP55 denganDosisBerbedaMelaluiPakan 12 3.5. Analisis Hepatosomatic Index (HSI)... 13
3.6. AnalisisProksimatPakandanKomposisiTubuh (AOAC 1984)... 13
3.7. AnalisisEkspresi gen IGF-I dan GHR-1... 14
3.8. AnalisisStatistik... 16
IV. HASIL DAN PEMBAHASAN... 17
4.1. Hasil... 17
xx
4.1.2. Histologi Hati... 19
4.1.3. Proksimat Tubuh Ikan... 19
4.1.4. Hepatosomatic index………... 20
4.1.5. Ekspresi Gen IGF-1 dan GHR-1... 20
4.2. Pembahasan... 21
V. SIMPULAN DAN SARAN... 25
5.1. Simpulan... 25
5.2. Saran... 25
DAFTAR PUSTAKA... 27
LAMPIRAN... 35
xxi DAFTAR TABEL
Halaman
1. Komposisi proksimat pakan yang digunakan (% bobot kering)... 12
2 Biomassa panen, laju pertumbuhan spesifik (SGR), kelangsungan hidup (KH), tingkat konversi pakan (FCR), tinggi badan dan panjang baku benih ikan gurame yang diberi perlakuan hormon pertumbuhan rekombinan ikan kerapu kertang (rElGH) dan control……….. 18
3. Proksimat (% berat kering) tubuh benih ikan gurame pada awal dan akhir percobaan...
xxiii DAFTAR GAMBAR
Halaman
1. Pertumbuhan ikan gurame (Osphronemusgoramy) yang diberi perlakuan pakan yang mengandung hormon pertumbuhan rekombinan ikan kerapu kertang (rElGH) dengan dosis yang berbeda selama 12 minggu pemeliharaan. Tanda panah (minggu ke-8) menunjukkan waktu pemberhentian pemberian rElGH...
17
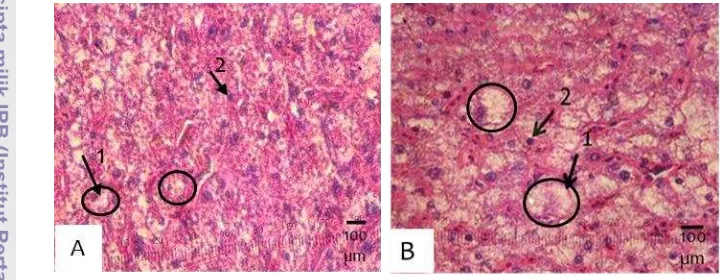
2. Histologi hati benih ikan gurame kontrol (A) dan perlakuan rElGH 3 mg/kg pakan (B) menggunakan pewarna H-E. 1=hepatosit; 2= sinusoid. Sampel diambil pada akhir pemeliharaan (minggu ke-12)... 19
3. Nilai hepatosomatic index (HSI) ikan gurame (Osphronemusgoramy) ikan kontrol dan yang diberi perlakuan rElGH pada dosis 3 mg/kg pakan. Pemberian rElGH 2 kali dalam seminggu selama 8 minggu perlakuan dan dilanjutkan pemeliharaan tanpa perlakuan rElGH selama 4 minggu. Pengambilan sampel dilakukan pada minggu ke-12 (akhir pemeliharaan)... 20
xxv DAFTAR LAMPIRAN
Halaman
1. Biomassa total setiap sampling hingga akhir pemeliharaan... 35
2. Laju pertumbuhan spesifik (SGR,%) ikan gurame selama pemeliharaan pada minggu ke-8 dan 12……….. 35
3. Hasil analisis statistik biomassa panen pada benih ikan gurame... 35
4. Hasil analisis statistik laju pertumbuhan spesifik (SGR) pada benih ikan gurame... 37
5. Hasil analisis statistik tingkat konversi pakan (FCR) pada benih ikan
gurame………. 38
6. Hasil analisis statistik tinggi badan benih ikan gurame……… 39
7. Hasil analisis statistik panjang baku benih ikan gurame……….. 41
8. Hasil analisis statistik kelangsungan hidup (KH) benih ikan gurame... 42
9 Analisis sederhana biaya penggunaan pakan pada benih ikan gurame selama penelitian untuk semua perlakuan...
1
I. PENDAHULUAN
1.1 Latar Belakang
Ikan gurame (Osphronemus goramy) merupakan salah satu spesies ikan
budidaya air tawar yang produksinya ditargetkan mencapai 48.900 ton pada tahun
2014 atau meningkat 127% dibandingkan dengan tahun 2009 yang hanya sebesar
46.452 ton (KKP 2010). Salah satu kendala untuk mencapai target tersebut adalah
laju pertumbuhan ikan gurame lambat. Untuk mencapai ukuran konsumsi sebesar
500 g/ekor dibutuhkan waktu sekitar 1,5 tahun (SNI 2006).
Upaya untuk meningkatkan laju pertumbuhan dapat dilakukan dengan
berbagai cara, seperti seleksi ikan, transfer gen, dan penggunaan protein
rekombinan. Metode seleksi merupakan salah satu metode yang terbukti dapat
meningkatkan pertumbuhan untuk beberapa ikan budidaya (Winarlin et al. 2007).
Akan tetapi, metode ini kurang aplikatif untuk diterapkan ke ikan gurame. Ikan
gurame membutuhkan waktu sekitar 3 tahun untuk setiap generasi sehingga
diperlukan waktu yang relatif lama untuk perbaikan laju pertumbuhan yang
signifikan. Rekayasa molekuler seperti transfer gen juga dapat dilakukan untuk
memperbaiki laju pertumbuhan. Teknologi ini berhasil meningkatkan
pertumbuhan sebesar 100 – 3.000x pada generasi ketiga (Beardmore & Porter
2003). Akan tetapi lambatnya ikan gurame mencapai ukuran induk, dan metode
pemijahan buatan yang belum dikuasai dengan baik menjadi kendala untuk
mengaplikasikan teknologi ini.
Teknologi protein rekombinan dimanfaatkan untuk menghasilkan protein
yang bermanfaat bagi ikan secara massal dengan menggunakan bakteri, ragi,
maupun sel sebagai media perbanyakan (Sekine et al. 1985; Demain & Vaishnav
2009). Aplikasi teknologi protein rekombinan dalam memperbaiki laju
pertumbuhan ikan dengan menggunakan hormon pertumbuhan rekombinan
(recombinant growth hormone, rGH) sudah dilaporkan oleh beberapa peneliti
pada berbagai spesies ikan dengan tingkat perbaikan pertumbuhan bervariasi.
Pemberian rGH pada ikan rainbow trout dapat meningkatkan pertumbuhan hingga
2
rGH ikan nila pada benih ikan mas koki dapat meningkatkan bobot tubuh hingga
3,5 kali dibandingkan kontrol (Acosta et al. 2009).
Hormon pertumbuhan merupakan polipeptida esensial yang dibutuhkan
oleh vertebrata untuk pertumbuhan dan perkembangan organisme secara normal
(Anathy et al. 2001), metabolisme (Rousseau & Dufour 2007), osmoregulasi
(Sakamoto et al. 1997), kekebalan tubuh (Sakai et al. 1997; Yada et al. 1999)
serta peningkatan reproduksi (McLean et al. 1993). Mekanisme kerja GH pada
ikan dapat bersifat secara langsung dan tidak langsung. Mekanisme secara
langsung adalah langsung mempengaruhi pertumbuhan organ tanpa perantara
insulin–like growth factor-1 (IGF-1) dalam hati atau langsung ke organ target,
sedangkan secara tidak langsung adalah pertumbuhan dimediasi atau melibatkan
IGF-1 dalam hati. Pada mekanisme tersebut terdapat beberapa faktor yang
berperan di antaranya growth hormone receptor (GHR-1), yang memiliki fungsi
dalam menangkap sinyal GH yang disekresikan oleh pituitari (Bjornsson et al.
2004; Debnanth 2010). Oleh karena itu pada penelitian ini dilakukan analisis
ekspresi IGF-1 dan GHR-1 untuk melihat mekanisme kerja GH secara tidak
langsung.
Aplikasi rGH dapat dilakukan menggunakan metode injeksi, perendaman,
dan melalui pakan. Aplikasi rGH dengan cara injeksi meningkatkan pertumbuhan
ikan rainbow trout (Agellon et al. 1988), ikan mujair (Tsai et al. 1994), ikan mas
(Promdonkoy et al. 2004), ikan salmon coho (Oncorhynchus kisutch) (Shimizu et
al. 2007), ikan nila (Lesmana 2010) dan ikan gurame (Irmawati, belum
dipublikasikan). Cara perendaman/imersi telah dilakukan pada ikan salmon
(Oncorhynchus kisutch dan O. keta) (Moriyama & Kawauchi 1990), ikan nila
(Acosta et al. 2009), ikan lele Afrika (Clarias gariepinus) (Yilmaz et al. 2009),
ikan gurame (Putra 2010; Syazili et al. 2011), dan melalui pakan seperti pada ikan
giant catfish (Pangasionodon gigas) (Piyaviriyakul et al. 2002), ikan mas
(Promdonkoy et al. 2004), ikan red seabrem (Xu et al. 2001), benih ikan nila
(Hardiantho et al. 2011) serta pada benih ikan sidat (Handoyo 2012).
Pemberian rGH melalui injeksi kurang aplikatif digunakan karena
memerlukan waktu yang relatif lama, dan sumberdaya yang banyak serta dibatasi
3
larva/benih ikan. Oleh karena itu, pada penelitian ini aplikasi rGH diarahkan
secara oral melalui pakan. Beberapa rGH ikan seperti rGH ikan mas (rCcGH),
ikan gurame (rOgGH), dan ikan kerapu kertang (rElGH) telah diproduksi, dan
diuji bioaktivitasnya dalam memacu laju pertumbuhan ikan (Alimuddin et al.
2010). Berdasarkan analisis SDS-PAGE, rGH ikan kerapu kertang terekspresi
pada level lebih tinggi dibandingkan kedua jenis rGH lainnya (Irmawati, belum
dipublikasikan). Selain itu, aplikasi rElGH pada ikan sidat dengan dosis
pemberian 30 mg/kg pakan dengan frekuensi pemberian 2 kali dalam seminggu
telah dilakukan dan memberikan pertumbuhan yang signifikan lebih tinggi
dibandingkan dengan kontrol (Handoyo 2012). Oleh karena itu pada penelitian ini
digunakan rElGH untuk memacu pertumbuhan benih ikan gurame.
1.2 Rumusan Masalah
Ikan gurame merupakan ikan yang memiliki pertumbuhan yang lambat
untuk mencapai ukuran konsumsi (~500 g) dibutuhkan waktu sekitar 1,5 tahun
dari ukuran 2-3 cm. Aplikasi rGH melalui injeksi, dan imersi telah dilakukan dan
hasilnya efektif untuk meningkatkan pertumbuhan, tetapi kurang efisien dari segi
waktu, dan kurang praktis. Sementara itu, beberapa penelitian mengenai
pemberian rGH melalui pakan di antaranya yang telah dilakukan oleh Tsai et al.
(1997) pada juvenil ikan black seabream (Acantlmpagrus schlegeli), ikan giant
catfish (Piyaviriyakul et al. 2002), ikan mas (Promdonkoy et al. 2004) dan ikan
sidat (Handoyo 2012), dan berhasil meningkatkan pertumbuhan secara signifikan.
Oleh sebab itu, aplikasi rGH melalui pakan diharapkan dapat meningkatkan
pertumbuhan ikan gurame, dengan mencari dosis yang optimum. Selain itu, untuk
mengetahui mekanisme tidak langsung dari aplikasi rGH tersebut dilakukan
analisis ekspresi IGF-1 dan GHR-1 yang terjadi di hati dan otak ikan perlakuan
terbaik, dan kontrol.
1.3Tujuan dan Manfaat
Tujuan dari penelitian ini adalah untuk mendapatkan dosis pemberian
pakan yang diperkaya rGH yang memberikan pertumbuhan tertinggi dalam
pendederan ikan gurame. Selain itu, penelitian ini juga dilakukan untuk
4
kerja hormon pertumbuhan secara tidak langsung, serta menganalisis respons
benih ikan gurame dalam memakan pakan, histologi hati dan hepatosomatic
index. Hasil penelitian ini diharapkan dapat bermanfaat sebagai salah satu solusi
untuk meningkatkan laju pertumbuhan ikan gurame dalam upaya peningkatan
5
II. TINJAUAN PUSTAKA
2.1 Ikan Gurame (Osphronemus goramy)
Ikan gurame merupakan salah satu jenis ikan air tawar yang termasuk
dalam keluarga Anabantidae, keturunan Helostoma dari bangsa Labyrinthici. Ikan
ini merupakan asli ikan Indonesia dan menyebar ke Malaysia, Thailands, Ceylon
dan Australia. Karena ukurannya dapat mencapai 5 kg/ekor sehingga orang Inggris menyebutnya “giant goramy”, sedangkan di Indonesia ikan ini dikenal
dengan beberapa nama sesuai daerahnya. Orang Jawa menyebutnya ikan
gurame/gurameh, Sumatera menyebutnya ikan kalau, kala, dan kalui, sedangkan
di Kalimantan disebut ikan kalui. Ikan ini merupakan jenis ikan konsumsi,
memiliki morfologi dengan bentuk tubuh pipih lebar, bagian punggung berwarna
merah sawo dan bagian perut berwarna kekuning-kuningan atau keperak-perakan.
Ikan ini memiliki pertumbuhan yang relatif lebih lambat dibandingkan pada
kebanyakan ikan air tawar lainnya. Untuk mencapai ukuran konsumsi (~500 g)
dibutuhkan waktu sekitar 1,5 tahun (SNI 2006).
2.2 Pertumbuhan Ikan Gurame
Pertumbuhan didefenisikan sebagai perubahan ukuran baik panjang
maupun dimensi fisik lainnya, termasuk volume massa atau bobot, baik pada
keseluruhan tubuh organisme maupun pada berbagai jaringan. Selain itu,
perubahan tersebut dapat berkaitan dengan kandungan protein, lemak atau
komponen kimia lainnya dari ke seluruhan tubuh, perubahan kandungan energi
atau komponen jaringan dari seluruh tubuh (Weatherley & Gill 1987).
Pertumbuhan ikan sangat berkaitan dengan asupan pakan yang
mengandung komponen berupa protein, lemak, dan karbohidrat. Komponen
tersebut yang sangat dibutuhkan adalah protein karena merupakan nutrien yang
digunakan untuk perbaikan jaringan tubuh yang rusak, pemeliharaan protein
tubuh, sebagai cadangan untuk pertumbuhan dan sumber energi. Kebutuhan
energi pada ikan dipengaruhi oleh beberapa faktor di antaranya ukuran dan
6
pada nilai biologis yang digambarkan dari jumlah dan kualitas asam amino yang
dikandungnya (Watanabe 1988).
2.3 Hormon Pertumbuhan
Hormon pertumbuhan (growth hormone, GH) merupakan satu rantai
polipeptida yang berukuran sekitar 22 kDa, disekresikan oleh bagian anterior dari
kelenjar pituitari yang berperan dalam memacu pertumbuhan tubuh, khususnya
dengan merangsang pelepasan somatomedin, dan mempengaruhi metabolisme
protein, karbohidrat, dan lipid. GH bekerja dengan merangsang sintesis protein
dan pemecahan lemak (untuk energi). Hormon ini merupakan peptida yang besar
yang terdiri dari 191 asam amino. Sekresi hormon pertumbuhan dikendalikan oleh
hipotalamus. Somatotropin menggambarkan hormon pertumbuhan yang biasa
diproduksi di pituitari, sedangkan somatropin menggambarkan hormon
pertumbuhan yang diproduksi menggunakan teknologi DNA rekombinan pada
bioreaktor/fermentasi (Lindholm 2006).
Sekresi GH dirangsang oleh growth hormone releasing hormone (GHRH),
ghrelin, protein pakan, kandungan gula darah yang rendah, peningkatan sekresi
androgen, dan arginin, sedangkan yang menghambat antara lain somatostatin,
konsentrasi hormon pertumbuhan dan insulin-like growth factor-1 (IGF-1) yang
bersirkulasi, kandungan gula darah yang tinggi, glukokortikoid, dan estradiol
ataupun estrogen lainnya. Fungsi GH yang sangat penting adalah memperbaiki
dan memacu pertumbuhan somatik (Moriyama & Kawauchi 1990). Pada ikan, GH
memiliki beberapa fungsi antara lain merangsang pertumbuhan gonad (Wong et
al. 2006), otot dan tulang (Debnanth 2010). Selain itu, GH pada ikan juga
berperan dalam proses osmoregulasi (Sakamoto et al. 1997), meningkatkan nafsu
makan/metabolisme (Rousseau & Dufour 2007), proses metamorfosis dan
perkembangan (Anathy et al. 2009), merangsang hati untuk mengeluarkan IGF-1
(Moriyama et al. 2000), efisiensi pemberian pakan, menjaga
keseimbangan/homeostasis energi, tingkah laku ketika bermigrasi, proses
gametogenesis puberitas, perkembangan embrio (Debnanth 2010), serta
meningkatkan sistem imunitas tubuh (Sakai et al. 1997; Yada et al. 1999).
Mekanisme GH dalam mempengaruhi pertumbuhan pada ikan yakni
7
secara langsung mempengaruhi pertumbuhan organ tanpa perantara IGF-1 dalam
hati. Mekanisme secara tidak langsung, yakni GH mempengaruhi pertumbuhan
dimediasi oleh IGF-1 dalam hati. Mekanisme ini berlangsung dengan adanya
beberapa faktor yang berperan, yaitu: reseptor GH berperan dalam menangkap
sinyal GH yang di sekresikan oleh kelenjar pituitari, GH binding protein (GHBPs)
berperan dalam pengangkutan dan melindungi GH di dalam darah, dan IGF
binding proteins (IGFBPs) berperan dalam melindungi dan mengangkut IGF-1 di
dalam darah menuju ke organ target, serta reseptor IGF berperan dalam
menangkap sinyal IGF-1 dalam organ-organ yang menjadi target (Debnanth
2010).
2.4 Insulin-like Growth Factor-1 danGrowth Hormone Receptor-1
Insulin-like growth factor (IGF-1) merupakan polipeptida rantai tunggal
dengan berat molekul sekitar 7 kDa dan dikenal dengan nama lain somatomedin
C, esensial bagi pertumbuhan embrio dan postnatal vertebrata. Sintesis dan
pelepasan IGF-I dimulai dari masuknya rangsangan dari luar yang diintegrasikan
oleh otak menjadi suatu perintah ke kelenjar pituitari untuk mensintesa dan
mensekresikan GH. GH masuk ke dalam jaringan pembuluh darah, kemudian
berikatan dengan reseptor yang sesuai/growth hormone receptor (GHR) di
beberapa organ target terutama hati untuk menstimulasi sintesis dan pelepasan
IGF-I. Selain itu, hati juga dapat distimulasi oleh GH endogen dan eksogen untuk
memproduksi IGF-I. Sciara et al. (2008) menemukan korelasi dose dependent
response antara GHR dengan IGF-1 pada ikan pejerrey Odontesthes bonariensis,
di mana IGF-I di dalam hati meningkat secara dramatis segera setelah dilakukan
penyuntikan rpjGH pada ikan tersebut. Selanjutnya, GHR tidak mengalami
peningkatan karena pituitari tidak memberikan sinyal untuk memproduksi GH.
Namun demikian, kandungan GH dan IGF-I dapat memberikan umpan balik
secara negatif terhadap kelenjar untuk tidak mensekresikan GH (Moriyama &
Kawauchi 2001).
Beberapa penelitian telah dilakukan pada berbagai spesies teleostei, dan
membuktikan bahwa GH merupakan pengatur utama produksi IGF-I. Kandungan
plasma IGF-I lebih tinggi pada ikan yang memiliki pertumbuhan yang cepat di
8
plasma IGF-I pada ikan yang hidup di air hangat lebih tinggi daripada di air
dingin (Moriyama & Kawauchi 2001).
2.5 Efek rGH Pada Pertumbuhan Ikan
rGHtelah banyak digunakan untuk memacu pertumbuhan ikan. Pemberian
rGH ikan mas yang diproduksi dalam Pichia pastoris sebanyak 0,1 μg/g bobot
tubuh benih ikan nila dapat meningkatkan bobot tubuh sebesar 53,1%
dibandingkan dengan kontrol (Li et al. 2003). Pemberian rGH tersebut dapat
dilakukan melalui injeksi (Sekine et al. 1985; Tsai et al. 1995; Li et al. 2003;
Funkenstein et al. 2005; Lesmana 2010), melalui perendaman (Acosta et al. 2007;
Putra 2010; Syazili et al. 2011) serta melalui pakan (Tsai et al. 1997; Handoyo
2012).
Pemberian 0,5% rGH per kg pakan yang diberikan selama 12 minggu
pada juvenil ikan sea bream hitam menunjukkan perbedaan bobot sebesar 60%
dari perlakuan kontrol setelah pemeliharaan selama 16 minggu (Tsai et al. 1997).
Menurut Sekine et al. (1985), pemberian rGH pada ikan rainbow trout dapat
meningkatkan pertumbuhan sebesar 50% dibandingkan dengan ikan rainbow trout
yang tidak diberi perlakuan rGH, sedangkan pada benih ikan beronang pemberian
rGH sebesar 0,5 μg/g bobot tubuh sebanyak 1 kali per minggu selama 4 minggu
dapat meningkatkan bobot tubuh sebesar 20% dari kontrol (Funkenstein et al.
2005). Selanjutnya, pemberian rGH pada benih ikan nila dengan dosis 30 mg/kg
pakan dengan frekuensi pemberian 2 kali seminggu selama 3 minggu terbukti
meningkatkan bobot tubuh sebesar 214,7% dari kontrol (Hardiantho 2011).
2.6 Pakan Ikan Gurame
Ikan memenuhi sebagian besar kebutuhan energinya dari protein yang
terkandung dalam pakan. Oleh karena itu, rasio energi/protein (rasio E/P) sangat
berpengaruh terhadap efisiensi pemanfaatan protein dan energi. Pakan yang
memiliki kandungan energi yang kurang, akan menyebabkan penggunaan
sebagian energi yang berasal dari protein untuk mengganti kekurangan tersebut,
sehingga energi yang berasal dari protein untuk pertumbuhan menjadi berkurang.
Hasil penelitian Mokoginta et al. (1995) menunjukkan kebutuhan protein terhadap
9
pakan sebesar 43,29% dengan rasio E/P 8,0 kkal DE/g protein. Kebutuhan protein
ikan gurame yang berukuran 25 dan 30 g sebesar 32,14% dengan rasio E/P 8 kkal
DE/g. Kebutuhan karbohidrat pakan pada ikan gurame dengan bobot tubuh antara
29 dan 32 g adalah 20,8% dan dengan bobot berkisar antara 79 dan 80 dapat
menggunakan karbohidrat pakan sampai kadar 47,5% (Mokoginta et al. 2004).
2.7Penyalutan (Coating)
Penyalutan merupakan suatu cara untuk melindungi bahan-bahan yang
diberikan bersama dengan pakan dari degradasi yang disebabkan oleh asam
lambung ketika berada dalam lambung dan akan terserap dengan baik ketika
berada di dalam usus. Bahan yang digunakan untuk penyalutan seperti kitosan,
alginat, kuning/putih telur, HPMCP (hydroxypropyl methylcellulose phthalate)
dan lainnya. Bahan penyalut seperti HPMCP telah diperkenalkan di pasaran sejak
tahun 1971. Sebagai turunan dari selulosa untuk penyalutan, bahan tersebut telah
di ujicobakan dan efektif dalam beberapa penelitian, baik di bidang farmasi
maupun perikanan. Berdasarkan kelarutannya HPMCP terbagi dua, yaitu HP-50
11
III. BAHAN DAN METODE
3.1 Ikan Uji
Larva ikan gurame diperoleh dari pembenihan di Desa Ciherang Kec.
Darmaga, Kab. Bogor. Larva dipelihara dalam akuarium berukuran 1,0x0,5x0,5
m3 dengan kepadatan sekitar 20 ekor/liter. Setelah ikan mencapai ukuran 0,75 -1,00 cm dilakukan pengurangan kepadatan menjadi 2-3 ekor/liter. Pakan awal
yang diberikan berupa naupli Artemia sp. selama 10 hari, dilanjutkan dengan
cacing sutera hingga ikan mencapai ukuran 4 - 5 cm dengan bobot 2,5 – 3,0 gram.
Adaptasi terhadap pakan buatan dilakukan sebelum pemberian pakan
mengandung rElGH.
3.2 Produksi rGH
Produksi rElGH dilakukan menggunakan bakteri Escherichia coli BL21
yang mengandung konstruksi pCold-1/rElGH (Alimuddin et al. 2010). Klon
bakteri E. coli dikultur dalam 4 mL media 2xYT cair yang mengandung ampisilin,
dan diinkubasi menggunakan shaker pada suhu 37°C selama 16-18 jam. Setelah
itu, dilakukan subkultur dengan mengambil sebanyak 1 mL dari kultur awal, dan
dimasukkan ke dalam 100 mL media 2xYT cair baru, dan diinkubasi pada suhu
37°C selama 2 jam. Kemudian kultur diberi kejutan suhu 15°C selama 30 menit,
ditambahkan IPTG 1 mM sebanyak 1 mL, dan diinkubasi menggunakan shaker
pada suhu 15°C selama 24 jam. Bakteri hasil kultur dikumpulkan dengan
sentrifugasi pada 12.000 rpm selama 2-10 menit.
Lisis dinding sel bakteri dilakukan secara kimiawi menggunakan lisozim.
Pelet bakteri hasil sentrifugasi dicuci menggunakan 1 mL bufer tris-EDTA (TE)
per 200 mg bakteri, diinkubasi pada suhu 37°C selama 20 menit, dan selanjutnya
disentrifugasi pada 12.000 rpm selama 1 menit. Supernatan dalam tabung
microtube dibuang, diganti dengan larutan lisozim (10 mg dalam 1 mL buffer TE)
sebanyak 500 µL, diinkubasi pada suhu 37°C selama 20 menit, lalu disentrifugasi
pada 12.000 rpm selama 1 menit. Supernatan dibuang, dan pelet yang terbentuk
merupakan protein rHP dalam bentuk badan inklusi (inclusion body). Pelet rGH
12
suhu -80°C hingga akan digunakan. Keberadaan rGH dalam badan inklusi
dianalisis menggunakan metode SDS-PAGE (Blackshear (1984) dalam Bollag et
al. (1996)).
3.3 Pembuatan Pakan Mengandung rGH
Pembuatan pakan mengandung rGH dilakukan dengan cara
mencampurkan rElGH yang sudah dilakukan penyalutan (coating) ke dalam
pakan komersial (protein sekitar 30%). Penyalutan pakan dilakukan berdasarkan
metode Promdonkoy et al. (2004) menggunakan HP55 (Shin-Etsu, Japan)
sehingga terbentuk matriks rElGH-HP55. Pelet rElGH dilarutkan dalam amonium
asetat yang mengandung HP55 dalam etanol 72,8%. Setelah penyalutan, rEl
GH-HP55 dikering-bekukan menggunakan freeze drier. Selanjutnya matriks rEl
GH-HP55 diresuspensi dalam asam asetat yang mengandung 10 mM NaCl, dan
0,013% (w/v) deoxyholic acid hingga proteinnya mencapai konsentrasi 0,5
mg/mL. Pencampuran rElGH-HP55 dengan pakan uji dilakukan dengan cara
disemprotkan, kemudian dikering-anginkan. Selanjutnya pada masing-masing
pakan (kontrol, harian, dan perlakuan) diambil sebagian untuk analisis proksimat
sebagai data awal tentang komposisi nutriasi pakan yang diberikan (Tabel 1).
Tabel 1. Komposisi proksimat pakan yang digunakan (% bobot kering)
Parameter uji Pakan
DE (kkal/kg pakan) 2.881,71 2.920,56 2.924,19 2.949,96 2.971,45 C/P(kkal/g protein) 8,11 7,57 7,52 7,40 7,21 Keterangan: Pakan harian; Pakan tanpa dicampur HP-55, Pakan kontrol; Pakan dicampur HP-55. Pakan perlakuan diberikan 2 kali per minggu, BETN; bahan ekstrak tanpa nitrogen, DE: digestible energy yang diperhitungkan dari: 1 g protein= 3,5 kkal; 1 g lemak= 8,1 kkal; 1 g karbohidrat= 2,5 kkal.
3.4 Pemberian rElGH-HP55 dengan Dosis Berbeda Melalui Pakan
Benih ikan gurame dipelihara dalam akuarium yang berukuran
13
pakan yang telah diberi protein rElGH-HP55 dengan dosis berbeda (0; 0,3; 3,0;
dan 30 mg/kg pakan). Setiap perlakuan diberi 3 kali ulangan. Pemberian pakan
dilakukan 3 kali dalam sehari. Pakan mengandung rElGH-HP55 diberikan 2 kali
dalam seminggu dengan tingkat pemberian pakan 5% dari bobot tubuh.
Pemberian pakan mengandung rElGH diberikan satu kali pada pagi hari. Bobot
ikan diukur setiap 2 minggu. Penghitungan kelangsungan hidup (KH) dilakukan
pada akhir pemeliharaan. Panjang baku dan tinggi badan diukur pada semua ikan
tiap perlakuan pada akhir pemeliharaan. Proksimat daging ikan awal, ikan dari
perlakuan dosis terbaik, dan kontrol dianalisis pada akhir penelitian. Organ hati
diambil masing-masing secara acak dari satu ekor ikan untuk perlakuan terbaik
dan kontrol pada akhir penelitian untuk analisis histologis. Begitu juga untuk
sampel analisis ekspresi gen IGF-1, dan GHR-1. Selanjutnya, pengukuran
hepatosomatic index juga dilakukan dengan mengukur bobot tubuh dan hati
masing-masing 15 ekor ikan tiap perlakuan terbaik dan kontrol. Selain itu, sebagai
data penunjang dilakukan pengukuran kualitas air kolam (suhu, pH, amoniak,
nitrit dan oksigen terlarut) selama pemeliharaan.
3.5 Analisis Hepatosomatic Index (HSI)
HSI diukur dengan menimbang bobot hati dibandingkan dengan bobot
tubuh ikan gurame hasil perlakuan terbaik dan kontrol. Pada akhir pemeliharaan
sampel ikan perlakuan terbaik dan kontrol diambil masing-masing sebanyak 15
ekor, kemudian dimatikan, dan ditimbang bobot tubuh dan hati dari
masing-masing ikan. Selanjutnya dilakukan perhitungan HSI pada kedua perlakuan
tersebut. Data yang diperoleh selanjutnya dianalisis secara deskriptif.
3.6 Analisis Proksimat Pakan dan Komposisi Tubuh (AOAC 1984)
Analisis proksimat terhadap pakan yang digunakan dan ikan perlakuan
terbaik dan kontrol dilakukan pada Laboratorium Nutrisi Ikan, Departemen
Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, IPB. Analisis tersebut
berupa kadar protein kasar yang dilakukan dengan menggunakan metode Kjeldahl,
kadar lemak dengan metode sochlet, kadar abu dengan pemanasan sampel dalam
tanur bersuhu 600 °C, karbohidrat menggunakan metode pelarutan sampel dengan
14
dalam oven bersuhu 105-110°C, sedangkan untuk proksimat dari daging ikan
mengikuti metode Folch (Takeuchi 1988).
3.7 Analisis Ekspresi Gen IGF-I dan GHR-1
Analisis ekspresi gen IGF-I dan GHR-1 dilakukan untuk mendapatkan
informasi tentang ekspresi gen IGF-I dan GHR-1 akibat introduksi dari rGH
eksogen dengan cara mengambil sampel otak dan hati ikan gurame dari
masing-masing perlakuan dosis rGH terbaik dan kontrol. Pengambilan sampel dilakukan
pada akhir perlakuan, yakni setelah pemberian pakan rElGH diberhentikan selama
4 minggu, selanjutnya ikan dipindahkan ke dalam akuarium. Pemberian pakan
yang mengandung rElGH, dan pakan kontrol dilakukan setelah ikan dipuasakan
selama sehari (untuk mengosongkan isi lambung). Jaringan hati dan otak diambil
pada jam ke-24 setelah perlakuan.
RNA total diekstraksi menggunakan isogen (Nippon Gen, Japan) sesuai
prosedur dalam manual. Jaringan tersebut dimasukkan ke dalam masing-masing
microtube yang berisi larutan isogen 200 µL, kemudian dihancurkan dengan
menggunakan penggerus yang telah disterilkan dengan dietylpyrocarbonate
(DEPC) 0,1%. Ke dalam microtube ditambahkan larutan isogen hingga mencapai
volume akhir 800 µL dan diinkubasi selama 5 menit pada suhu ruang sampai
semua jaringan terlisis sempurna. Setelah itu, kloroform ditambahkan sebanyak
200 µL, kemudian disentrifugasi selama 5 menit dengan kecepatan 12.000 rpm
pada suhu ruang. Supernatan yang terbentuk dipindahkan ke dalam microtube
baru yang telah berisi 400 µL larutan isopropanol, kemudian disentrifugasi selama
15 menit dengan kecepatan 12.000 rpm pada suhu 4°C. Supernatan pada
microtube dibuang, dan pelet RNA pada dasar microtube dilarutkan dengan cara
menambahkan 1 mL etanol 70% dingin, kemudian disentrifugasi selama 15 menit
dengan kecepatan 12.000 rpm. RNA dikeringkan dengan cara membuang larutan
yang terdapat pada microtube. Setelah kering sempurna, RNA dilarutkan dengan
30 µL DEPC 0,1%. Konsentrasi hasil isolasi RNA total diukur menggunakan alat
pengukur konsentrasi RNA/DNA (GeneQuant). Absorbansi diukur dengan
panjang gelombang 260, dan 280 nm.
Sintesis cDNA IGF-1 dan GHR-1 dilakukan menggunakan kit
15
dibuat 3 µg dalam 30 µL DEPC, kemudian diinkubasi pada suhu 65°C selama 10
menit dan diletakkan dalam kondisi on ice. Sampel RNA dipindahkan ke dalam
microtube FSRMB dan ditambahkan 3 µL primer „dT3‟RACE-VECT‟ (5‟-GTA
ATA CGA CTC ACT ATA GGG CAC GCG TGG TCG ACG GCC CGG GCT
GGT TTT TTT TTT TTT TTT TTT -3‟) dengan konsentrasi 1 µg/3 µL. Larutan
dihomogenkan dan diinkubasi pada suhu 37°C selama 1 jam. cDNA yang
terbentuk ditambahkan 30 µL SDW steril dan disimpan dalam refrigerator hingga
digunakan.
Ekspresi gen IGF-1 dan GHR-1 dideteksi menggunakan metode
semi-kuantitatif PCR dengan primer IGF1-F: 5‟ -TTCAAGAGTGTCATGTGCTGTA-3‟ dan IGF1-R 5‟-CATAGCCTGTTGGTTTACTGAA-3‟ untuk amplifikasi gen IGF-1, GHR1-F: 5‟-ACCGGCCACAACATGAATATAAGG-3‟ dan GHR1-R: 5‟-GTCTTGATCAGGCAGGTCTGG-3‟ untuk amplifikasi gen GHR-1 (Irmawati, belum dipublikasikan). Kondisi PCR untuk IGF-1 adalah predenaturasi
pada 94°C selama 3 menit, 35 siklus pada denaturasi 94°C selama 30 detik,
annealing 57°C selama 30 detik, ekstensi 72°C selama 30 detik, dan ekstensi
akhir pada 72°C selama 3 menit. Kondisi PCR untuk GHR-1 adalah predenaturasi
pada 94°C selama 3 menit, 35 siklus pada denaturasi 94°C selama 30 detik,
annealing 60°C selama 30 detik, ekstensi 72°C selama 30 detik, dan ekstensi
akhir pada 72°C selama 3 menit.
Ekspresi gen β-aktin dianalisis sebagai kontrol internal loading RNA saat sintesis cDNA. Primer yang digunakan untuk gen β-aktin adalah primer F (5‟ -AAC CAT GGA TGA TGA AAT CGC CGCA-3‟) dan R (5‟-TGA TGC CTG
GGG CGA CCG ACG ATGG -3‟) (Irmawati, belum dipublikasikan) dengan
kondisi PCR adalah predenaturasi pada 94°C selama 3 menit, 28 siklus pada
denaturasi 94°C selama 30 detik, annealing 59°C selama 30 detik, ekstensi 72°C
selama 30 detik, dan ekstensi akhir pada 72°C selama 3 menit. Pengecekan hasil
amplifikasi PCR dilakukan dengan elektroforesis menggunakan gel agarosa 1,5%.
Pengukuran level IGF-1 dan GHR-1 dilakukan dengan mengukur ketebalan pita
16
3.8 Analisis Statistik
Pertumbuhan bobot, laju pertumbuhan spesifik, konversi pakan,
kelangsungan hidup, tinggi badan dan panjang baku ikan gurame dianalisis
dengan metode sidik ragam (ANOVA), dan uji lanjut Fisher‟s menggunakan
program Minitab 16. Proksimat, ekspresi gen IGF-1 dan GHR-1, serta histologis
17
IV. HASIL DAN PEMBAHASAN
4.1 Hasil
4.1. 1 Pertumbuhan, Konversi Pakan, dan Kelangsungan Hidup
Pada pemeliharaan 4 minggu pertama, biomassa ikan yang diberi pakan
mengandung rGH belum terlihat berbeda dengan kontrol, tetapi pada minggu ke-6
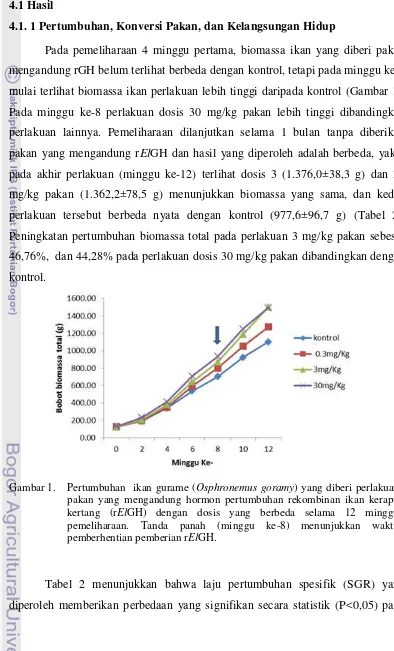
mulai terlihat biomassa ikan perlakuan lebih tinggi daripada kontrol (Gambar 1).
Pada minggu ke-8 perlakuan dosis 30 mg/kg pakan lebih tinggi dibandingkan
perlakuan lainnya. Pemeliharaan dilanjutkan selama 1 bulan tanpa diberikan
pakan yang mengandung rElGH dan hasil yang diperoleh adalah berbeda, yakni
pada akhir perlakuan (minggu ke-12) terlihat dosis 3 (1.376,0±38,3 g) dan 30
mg/kg pakan (1.362,2±78,5 g) menunjukkan biomassa yang sama, dan kedua
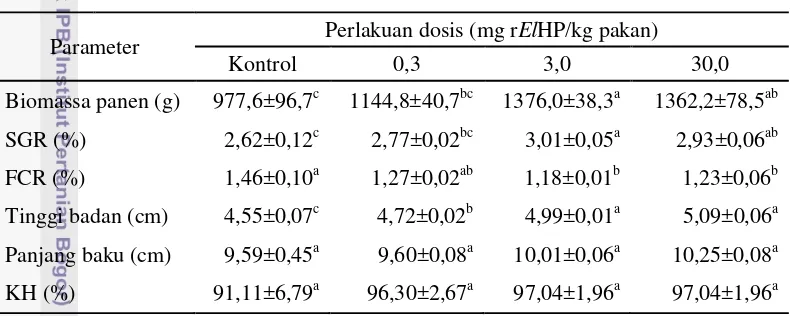
perlakuan tersebut berbeda nyata dengan kontrol (977,6±96,7 g) (Tabel 2).
Peningkatan pertumbuhan biomassa total pada perlakuan 3 mg/kg pakan sebesar
46,76%, dan 44,28% pada perlakuan dosis 30 mg/kg pakan dibandingkan dengan
kontrol.
Gambar 1. Pertumbuhan ikan gurame (Osphronemus goramy) yang diberi perlakuan pakan yang mengandung hormon pertumbuhan rekombinan ikan kerapu kertang (rElGH) dengan dosis yang berbeda selama 12 minggu pemeliharaan. Tanda panah (minggu ke-8) menunjukkan waktu pemberhentian pemberian rElGH.
Tabel 2 menunjukkan bahwa laju pertumbuhan spesifik (SGR) yang
18
perlakuan 3 dan 30 mg/kg pakan dibandingkan dengan kontrol. SGR perlakuan 3
mg/kg pakan sebesar 14,89% lebih tinggi dibandingkan dengan kontrol. Selain
itu, pemberian pakan perlakuan dosis 3 mg/kg pakan pada penelitian ini dapat
menurunkan nilai konversi pakan (FCR) sebesar 23,72%, dan peningkatan tinggi
badan ikan sebesar 9,67% dibandingkan dengan kontrol. Sementara itu, panjang
baku dan kelangsungan hidup (KH) ikan tidak menunjukkan perbedaan yang
signifikan (P>0,05) (Tabel 2).
Tabel 2 Biomassa panen, laju pertumbuhan spesifik (SGR), kelangsungan hidup (KH), tingkat konversi pakan (FCR), tinggi badan dan panjang baku benih ikan gurame yang diberi perlakuan hormon pertumbuhan rekombinan ikan kerapu kertang (rElGH) dan kontrol.
Parameter Perlakuan dosis (mg rElHP/kg pakan)
Kontrol 0,3 3,0 30,0
Biomassa panen (g) 977,6±96,7c 1144,8±40,7bc 1376,0±38,3a 1362,2±78,5ab SGR (%) 2,62±0,12c 2,77±0,02bc 3,01±0,05a 2,93±0,06ab FCR (%) 1,46±0,10a 1,27±0,02ab 1,18±0,01b 1,23±0,06b Tinggi badan (cm) 4,55±0,07c 4,72±0,02b 4,99±0,01a 5,09±0,06a Panjang baku (cm) 9,59±0,45a 9,60±0,08a 10,01±0,06a 10,25±0,08a KH (%) 91,11±6,79a 96,30±2,67a 97,04±1,96a 97,04±1,96a Keterangan: nilai ditampilkan dalam bentuk rerata ± simpangan eror. Huruf superskrip yang berbeda pada baris yang sama adalah berbeda nyata secara statistik (P<0,05). Benih ikan gurame diberi pakan mengandung rElGH 2 kali seminggu selama 8 minggu perlakuan, dan 4 minggu selanjutnya tanpa pemberian pakan perlakuan.
KH ikan semua perlakuan dan kontrol tidak menunjukkan perbedaan yang
signifikan (P>0,05). Seperti diperlihatkan pada Tabel 2, hal tersebut dikarenakan
nilai simpangan eror yang relatif lebih besar pada kontrol (6,79) dibandingkan
dengan perlakuan rElGH (1,96-2,67). Berdasarkan nilai rerata, KH perlakuan
rElGH (96,30-97,04%) relatif lebih tinggi daripada kontrol (91,11%). Variasi KH
yang relatif rendah pada ikan perlakuan rElGH merupakan hal baik bagi
akuakultur, karena variasi produktivitas (biomassa panen) budidaya akan menjadi
kecil. Dengan kata lain bahwa kepastian pencapaian target produksi budidaya ikan
19
4.1.2 Histologi Hati
Pemberian pakan yang mengandung rElGH pada ikan gurame diduga
memberikan efek pada hati. Berdasarkan hasil dari penelitian ini, secara histologis
hati ikan perlakuan rElGH terbaik (dosis 3 mg/kg pakan) dan kontrol relatif sama
(tidak terjadi kerusakan), namun perbedaan yang terjadi adalah ukuran hepatosit
pada hati ikan perlakuan lebih besar dari kontrol (Gambar 3). Hal ini diduga
karena akumulasi nutrien yang lebih besar pada hati ikan perlakuan.
4.1.3 Proksimat Tubuh Ikan
Komposisi kimiawi dari ikan kontrol dan ikan perlakuan setelah 12
minggu pemeliharaan dapat dilihat pada Tabel 3. Kandungan protein ikan
perlakuan rElGH lebih tinggi dibandingkan dengan kontrol. Sebaliknya,
kandungan lemak ikan kontrol lebih tinggi dibandingkan ikan perlakuan.
Tabel 3 Proksimat (% berat kering) tubuh benih ikan gurame pada awal dan
20
4.1.4 Hepatosomatic index
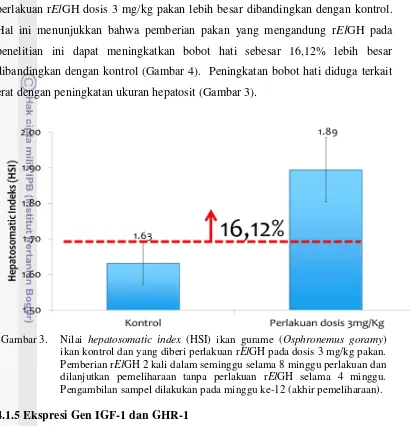
Nilai hepatosomatic index (HSI) yang diperoleh dari ikan gurame hasil
perlakuan rElGH dosis 3 mg/kg pakan lebih besar dibandingkan dengan kontrol.
Hal ini menunjukkan bahwa pemberian pakan yang mengandung rElGH pada
penelitian ini dapat meningkatkan bobot hati sebesar 16,12% lebih besar
dibandingkan dengan kontrol (Gambar 4). Peningkatan bobot hati diduga terkait
erat dengan peningkatan ukuran hepatosit (Gambar 3).
Gambar 3. Nilai hepatosomatic index (HSI) ikan gurame (Osphronemus goramy) ikan kontrol dan yang diberi perlakuan rElGH pada dosis 3 mg/kg pakan. Pemberian rElGH 2 kali dalam seminggu selama 8 minggu perlakuan dan dilanjutkan pemeliharaan tanpa perlakuan rElGH selama 4 minggu. Pengambilan sampel dilakukan pada minggu ke-12 (akhir pemeliharaan). 4.1.5 Ekspresi Gen IGF-1 dan GHR-1
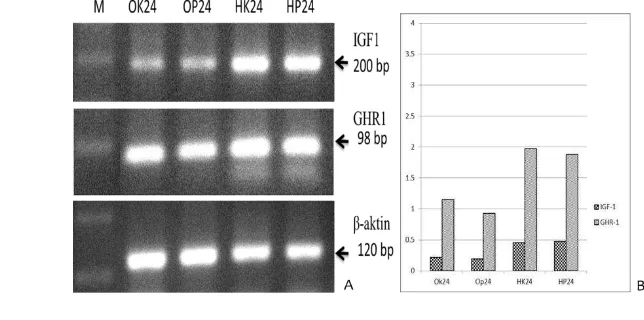
Tingkat ekspresi gen IGF-1 di organ hati dan otak pada jam ke-24 setelah
pemberian pakan mengandung rElGH adalah sama antara kontrol dan perlakuan
rElGH (Gambar 4). Demikian juga tingkat ekspresi gen GHR-1 pada kedua organ
21
Gambar 4. Ekspresi gen insulin-like growth factor-1 (IGF-1), growth hormone receptor -1 (GHR-1), dan β-aktin pada hati dan otak ikan gurame kontrol dan perlakuan pakan mengandung hormon pertumbuhan rekombinan ikan kerapu kertang (rElHP) pada jam ke-24 setelah pemberian pakan. A= Hasil elektroforesis DNA; B= Level ekspresi gen IGF-1/β-aktin dan GHR-1/β-aktin. OK24 (otak ikan kontrol jam ke-24), OP24 (otak ikan perlakuan jam ke-24), HK24 (hati ikan kontrol ikan jam ke-24) dan HP24 (hati ikan perlakuan ikan jam ke-24).
4.2 Pembahasan
Pertumbuhan ikan perlakuan rElGH pada akhir penelitian tetap lebih
tinggi meskipun pemberian rGH telah dihentikan pada minggu ke-8 (Gambar 1).
Hasil yang serupa juga dilaporkan oleh Promdonkoy et al. (2004) pada ikan koki
(Carassius auratus) yakni peningkatan pertumbuhan bobot tetap diperoleh
meskipun perlakuan rGH telah dihentikan selama 4 minggu.
Selain menunjukkan peningkatan biomassa total pada perlakuan dosis 3
mg/kg pakan, juga menunjukkan peningkatkan SGR dan tinggi badan serta
menurunkan tingkat konversi pakan secara signifikan (P<0,05) dibandingkan
dengan kontrol (Tabel 2). Peningkatan tersebut disebabkan karena hormon rGH
yang diberikan melalui pakan ini diduga dapat diterima oleh reseptor dalam tubuh
sehingga memberikan pengaruh yang terjadi melalui mekanisme secara langsung
(Gambar 4). Selanjutnya, penurunan FCR pada ikan perlakuan disebabkan
meningkatnya nafsu makan pada ikan. Kecepatan dalam mengkonsumsi pakan
akan menghindari kerusakan pakan akibat pencucian (leaching) saat pemberian.
Selanjutnya cepatnya pakan diterima dan masuk ke dalam saluran pencernaan
mengakibatkan proses penyerapan lebih cepat dan lebih baik sehingga
menyebabkan pemberian pakan lebih efisien. Hal ini terbukti dari peningkatan
22
dilaporkan pada ikan salmon (Cook et al. 2000; Devlin et al. 2004) ikan nila
(Hardiantho et al. 2011) dan ikan sidat (Handoyo 2012). Penurunan FCR dapat
menghemat biaya pakan sebesar 17,5% (Lampiran 9) dibandingkan dengan
kontrol. Dalam hal ini, untuk mendapatkan produksi sebesar 1 kg daging hanya
dibutuhkan biaya pakan sebesar Rp. 14.280,00, sedangkan pada kontrol
dibutuhkan biaya pakan sebesar Rp. 17.330,00 (Lampiran 9). Hal ini
membuktikan bahwa dengan pengaplikasian pakan yang mengandung rGH dapat
menghemat biaya dalam produksi ikan gurame.
Berdasarkan analisis secara statistik pemberian rGH melalui pakan pada
penelitian ini tidak berbeda nyata (P>0,05) untuk panjang baku dan kelangsungan
hidup (Tabel 2). Secara rerata, KH perlakuan rElGH (96,30-97,04%) terlihat
relatif lebih tinggi daripada kontrol (91,11%). Hal ini diduga terkait dengan
peningkatan daya tahan tubuh terhadap stres akibat kondisisi lingkungan
khususnya pH (5-6) relatif rendah. Rerata KH yang relatif lebih tinggi pada ikan
yang diberi perlakuan rGH juga telah dilaporkan oleh peneliti sebelumnya, seperti
Handoyo (2012) melaporkan peningkatkan KH benih ikan sidat (Anguilla sp.)
yang diberi pakan mengandung rElGH. Peningkatan KH pada ikan yang diberi
rGH disebabkan oleh peningkatan daya tahan ikan terhadap stres dan infeksi
penyakit (Acosta et al. 2009). Selain itu juga telah dilaporkan oleh Sakai et al.
(1997) bahwa pemberian rGH pada ikan rainbow trout juga efektif meningkatkan
resistensi terhadap Vibrio anguillarum.
Berdasarkan hasil analisis histologis hati ikan yang diberikan pakan yang
mengandung rElGH tidak memperlihatkan adanya efek negatif atau kerusakan.
Gambaran histologi hati ikan perlakuan dan kontrol relatif sama (Gambar 2).
Namun demikian, hati ikan perlakuan memiliki ukuran hepatosit yang berukuran
lebih besar yang diduga disebabkan oleh akumulasi nutrien dalam hati lebih
banyak dibandingkan dengan kontrol. Hal ini didukung dengan meningkatnya HSI
pada ikan perlakuan (Gambar 3), di mana hati ikan perlakuan lebih besar 16,12%
dibandingkan dengan kontrol. Peningkatan HSI erat kaitannya dengan
peningkatan ukuran hepatosit. Hal ini sejalan dengan Kwalska et al. (2011) yang
mengemukakan bahwa meningkatnya HSI karena meningkatnya ukuran hepatosit
23
peranan yang sangat penting dalam sintesis protein, asimilasi nutrisi, produksi
empedu, detoksifikasi, pemeliharaan metabolisme tubuh mencakup pengolahan
karbohidarat, protein, lemak, dan vitamin. Dengan demikian, pertumbuhan yang
tinggi dan peningkatan HSI ini menunjukkan semua proses dalam fungsi hati
berjalan dengan baik.
Kandungan protein ikan perlakuan lebih tinggi dibandingkan dengan
kontrol (Tabel 3). Sebaliknya, kandungan lemak ikan kontrol lebih tinggi
dibandingkan ikan perlakuan. Tingginya kandungan protein pada ikan perlakuan
karena meningkatnya nafsu makan dan efisiensi penggunaan energi, sehingga
protein lebih banyak diretensi. Selain itu, pemberian rElGH melalui pakan pada
penelitian ini diduga terjadinya peningkatan sintesis protein. Seperti yang
dilaporkan oleh beberapa peneliti bahwa dengan pemberian rGH dapat
meningkatkan sintesis protein dan menurunkan sintesis lemak pada mamalia (Pell
et al. 1990; Johnsson et al. 1987) dan menstimulasi anabolisme dalam
meningkatkan penggantian dan sintesis protein pada ikan, yang terjadi pada hati
dan otot dengan menstimulasi efisiensi dari translasi ribosom melalui peningkatan
konsentrasi mRNA dan ribosom (Foster et al. 1991; Herbert et al. 2001).
Mekanisme tersebut diduga melalui optimasi pemanfaatan protein sebagai sumber
energi untuk pertumbuhan. Selanjutnya, penurunan kadar lemak tubuh pada ikan
perlakuan diduga berkaitan dengan aktivitas enzim lipase, sesuai yang
dikemukakan oleh Irmawati et al. (2012) bahwa aktivitas enzim lipase ikan
gurame yang diberi rGH lebih tinggi dibandingkan dengan ikan kontrol.
Ditambahkan oleh O‟Connor et al. (1993) bahwa rGH dapat menstimulasi
lipolisis pada beberapa jenis spesies ikan seperti ikan rainbow trout. Kandungan
protein yang lebih rendah pada kontrol diduga meningkatnya proses anabolisme
dalam tubuh untuk memperbaiki sel-sel yang rusak untuk kelangsungan hidup.
Hal tersebut terlihat dari kelangsungan hidup dan pertumbuhan yang lebih rendah
pada ikan kontrol.
Hasil elektroforesis semi-kuantitatif RT-PCR ekspresi gen IGF-1 dan
GHR-1 saat 24 jam setelah pemberian pakan yang mengandung rElGH dari hati
GHR-24
1 pada hati dan otak ikan perlakuan dan kontrol adalah sama (Gambar 4). Hal ini
menunjukkan bahwa mekanisme kerja rElGH dalam menginduksi pertumbuhan
diduga terjadi secara langsung dan tidak melibatkan jalur IGF-1 di hati. Hal ini
sesuai maksud pernyataan Debnanth (2010) bahwa mekanisme kerja GH dapat
bersifat secara langsung dan tidak langsung. Mekanisme secara langsung adalah
langsung mempengaruhi pertumbuhan organ tanpa perantara insulin–like growth
factor (IGF-1) dalam hati atau langsung ke organ target, sedangkan secara tidak
langsung adalah pertumbuhan dimediasi atau melibatkan IGF-1 dalam hati.
Selanjutnya bahwa pemberian rGH akan meningkatkan GHR-1 pada hati ikan
(Gahr et al. 2008). Hal ini berbeda yang dilaporkan pada beberapa peneliti di
antaranya pada ikan sidat dengan metode yang sama (Handoyo 2012) dan benih
ikan gurame menggunakan metode imersi (Syazili et al. 2011) yang menghasilkan
level ekspresi gen IGF-1 di hati pada jam ke-24 lebih tinggi dari kontrol setelah
perlakuan yang mengindikasikan bahwa mekanisme rGH dalam menginduksi
25
V. SIMPULAN DAN SARAN
5.1 Simpulan
Pemberian rElGH melalui pakan dapat meningkatkan pertumbuhan ikan
gurame secara signifikan. Dosis yang terbaik adalah dosis 3 mg/kg pakan.
Pemberian rElGH mampu menghemat penggunaan pakan dengan menurunkan
konversi pakan secara signifikan, dan meningkatkan hepatosomatic Index. Kadar
lemak ikan perlakuan rElGH menurun. Pemberian rElGH melalui pakan tidak
mempengaruhi ekspresi gen IGF-1 dan GHR-1 pada jam ke-24 setelah pemberian
pakan. Induksi pertumbuhan akibat perlakuan rGH melalui pakan melibatkan
mekanisme langsung.
5. 2 Saran
Aplikasi pakan menggunakan rGH dapat diterapkan pada dosis 3 mg/kg
27
DAFTAR PUSTAKA
Acosta J, Morales R, Morales A, Alonso M, Estrada MP. 2007. Pichia pastoris
expressing recombinant tilapia growth hormone accelerates the growth of tilapia. Biotechnology Lett. 29, 1671-1676.
Acosta JR, Estrada MP, Carpio Y, Ruiz O, Morales R, Martinez E, Valdes J, recombinant fish growth hormone. Can. J. Fish. Aquat. Sci. 45, 146-151.
Alimuddin, Lesmana I, Sudrajat AO, Carman O, Faisal I. 2010. Production and bioactivity potential of three recombinant growth hormones of farmed fish.
Indonesian Aquaculture Journal 5, 11-16.
Anathy V, Venugopal T, Koteeswaran R, Pandian TJ, Mathavan S. 2001. Cloning, sequencing and expression of cDNA encoding growth hormone from Indian catfish (Heteropneustes fossilis). Journal of Bioscience 26(3), 315-324.
AOAC. 1984. Official Methods of Analysis of The Association of Official Agricultur Chemist. AOAC, Inc., Washington.
Beardmore JA, Porter JS. 2003. Genetically modified organisms and aquaculture. FAO Fisheries CircuLar, Roma.
Bjornsson BT, Johansson V. 2004. Growth hormone andocrinology of salmonid: regulatory mechanism and mode of action. Fish Physiology and Biochemistry 27, 227-242.
Cook JT, McNiven MA, Richardson GF, Sutterlin AM. 2000. Growth rate, body composition and feed digestibility/conversion of growth enhanced Atlantic salmon (Salmo salar). Aquaculture 188, 15-32
Debnanth S. 2010. A review on the physiology of insulin-like growth factor-1 (IGF-1) peptide in bony fisher and its phylogenetic correlation in 30 different taxa of 1 families of teleosts. Advances in Environmental Biology
5, 31-52.
Demain AL, Vaishnav P. 2009. Production of recombinant proteins by microbes and higher organisms. Biotechnol. Adv. 27, 297-306.
28
Foster AR, Houlhan DF, Gray C, Medalem F, Fauconneau B, Kaushik SJ, LeBail PY. 1991. The effect of ovine growth hormone on protein turnover in rainbow trout. Gen. Comp. Endocrinol. 82, 111-120.
Funkenstein B, Dyman A, Lapidot Z, de Jesus-Ayson EG, Gertler A, Ayson FG. 2005. Expression and purification of a biologically active recombinant rabbitfish (Siganus guttatus) growth hormone. Aquaculture 250, 504-515.
Gahr SA, Vallejo RL, Weber GM, Shepherd BS, Silverstein JT, Caird ER. 2008. Effects of short-term growth hormone treatment on liver and muscle transcriptomes in rainbow trout (Oncorhynchus mykiss). Physiology
Genomics 32, 380-392.
Genten F, Terwinghe, Danguy. 2009. Atlas of Fish Histology. Department of Histology and Biopathology of Fish Fauna Laboratory of Functionnal Morphology Université Libre de Bruxelles (U.L.B) Brussels Belgium: Science Publishers.
.
Handoyo B. 2012. Metode pemberian dan respons benih ikan sidat terhadap hormone pertumbuhan rekombinan ikan kerapu kertang. [Tesis]. Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Hardiantho D, Alimuddin, Praseto AE, Yanti DH, Sumantadinata K. 2011. Aplikasi rekombinan growth hormone (rHP) ikan mas pada ikan nila melalui pakan buatan. Makalah disampaikan dalam pertemuan Broodstock Center nila dan temu koordinasi perekayasa Kementerian Kelautan dan Perikanan, di BBPBAT Sukabumi.
Herbert NA, Armstrong JD, Björnsson BT. 2001. Evidence that growth hormone-induced elevation in routine metabolism of juvenile Atlantic salmon is a result of increased spontaneous activity. J. Fish Biol. 59, 754–757.
Irmawati, Alimuddin, Zairin M, Supraudi MA, Wahyudi AT. 2012. Peningkatan laju pertumbuhan benih ikan gurame (Osphronemus goramy Lac.) yang direndam dalam media yang mengandung hormon pertumbuhan ikan mas.
Jurnal Iktiologi Indonesia (in press).
Johnsson ID, Hathom DJ, Wilde RM, Teacher TT, Butler-Hogg BW. 1987. The effect of dose and method of administration of biosynthetic bovine somatotropin on live-weight gain, carcasss composition and wool growth in young lambs. Anim. Prod. 44, 405-414.
[KKP] Kementrian Kelautan dan Perikanan. 2010. Indonesian Fisheries Statistics 2009. Kementerian Kelautan dan Perikanan. Jakarta.