RESPONS BENIH IKAN SIDAT TERHADAP HORMON
PERTUMBUHAN REKOMBINAN IKAN KERAPU KERTANG
MELALUI PERENDAMAN DAN ORAL
BOYUN HANDOYO
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER
INFORMASI
Dengan in saya menyatakan bahwa tesis “Respons benih ikan sidat terhadap hormon pertumbuhan rekombinan ikan kerapu kertang melalui perendaman dan oral” adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukkan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Juni 2012
ABSTRACT
BOYUN HANDOYO. Response of Eel fingerling on Recombinant Giant Grouper Growth Hormone by immersion and oral administration. Supervised by ALIMUDDIN and NUR BAMBANG PRIYO UTOMO.
This study was aimed to determine an appropriate administration method and observe the response of eel fingerling on recombinant giant grouper growth hormone (rElGH). First study aimed to determine the immersion dose of rElGH to increase growth of eel juvenile (glass eel). After shock salinity treatment (NaCl 3% for 2 min), glass eel were immersed in water containing 0.9% NaCl, 0.01% bovine serum albumin, and different of dose of rElGH (0, 0.12, 1.2, 12 and 120 mg/L). The results showed that higher in growth body weight was obtained in treatment 12 mg/L (101.2±0.8), by increment of about 37.4% higher compared to that of control (72.93±1.8). Second study was aimed to determine the dose of rElGH mixed in artificial diet to increase growth of eel elver. HP55-coated rElGH was mixed to diet at different doses (0, 0.3, 3, and 30 mg/kg). Elver was fed on diet containing rElGH twice daily, 6% fish biomass. The result showed that higher in growth body weight was obtained in treatment 30 mg/kg (60.18±1.38), by increment of about 65.7% compared to control (36.32±0.97). Third study was aimed to compared of three administration method, namely immersion, oral, and combination of immersion and oral. The dosage of rElGH by immersion (12 mg/L) and oral administration (30 mg/kg feed) was obtained in previous study. Fish were maintained in 23-L glass aquaria for 120 days, at density of 45 fish per aquarium. The results showed that higher (P<0.05) biomass of harvest (73.68±2.07 g) was obtained in immersion and oral combination treatment, by increment of about 102.9% compared to control (36.32±0.97 g). Administration of rElGH also improved protein and lipid retentions by 142.5%, and 720% compared to that of control, respectively (P<0.05). In addition, rElGH treatment increased appetite, while artificial feed conversion ratio (4.75) was lower (P<0.05) by 55.15% compared to that of control (7.37). Combination of rElGH immersion and oral administrations also increased hepatosomatic index, reduced ammonia excretion and increased insuline-like growth factor-1/IGF-1 gene expression. Thus, rElGH administration via immersion and oral was a proper method to improve performance of eel fingerling, and application of rElGH can be useful to increase aquaculture production.
RINGKASAN
BOYUN HANDOYO. Respons benih ikan sidat terhadap hormon pertumbuhan rekombinan ikan kerapu kertang melalui perendaman dan oral. Dibimbing oleh ALIMUDDIN dan NUR BAMBANG PRIYO UTOMO.
Permasalahan utama dalam budidaya ikan sidat adalah pertumbuhannya yang lambat, konversi pakan yang tinggi dan rentan terserang penyakit pada pendederan benih (glass eel dan elver). Teknologi pemberian protein rekombinan hormon pertumbuhan (rGH) dapat dijadikan alternatif solusi untuk mengatasinya. Beberapa hasil yang signifikan pada beberapa spesies ikan budidaya menunjukkan bahwa rGH mampu mempercepat pertumbuhan, membantu proses metabolisme, osmoregulasi, fungsi kekebalan tubuh. Berdasarkan hal tersebut maka teknologi ini bisa dijadikan solusi untuk mengatasi permasalahan yang ada pada budidaya ikan sidat. Penelitian ini secara umum bertujuan untuk menguji penggunaan rGH ikan kerapu kertang (rElGH) pada ikan sidat dengan metode perendaman (pada fase glass eel) dan melalui pakan (pada fase elver) dalam meningkatkan pertumbuhan benih ikan sidat. Tujuan umum tersebut diwujudkan melalui beberapa penelitian, yaitu : 1) Penentuan dosis pemberian rElGH yang tepat (melalui perendaman) untuk mempercepat pertumbuhan ikan sidat; 2) Penentuan dosis pemberian rElGH yang tepat secara oral (melalui pakan) untuk mempercepat pertumbuhan ikan sidat; 3) Penentuan metode terbaik atara pemberian rElGH melalui perendaman, secara oral dan kombinasi keduanya untuk mempercepat pertumbuhan ikan sidat. Pada masing-masing tahap penelitian dilakukan identifikasi dan analisis respons perlakuan pemberian rElGH terhadap ikan yang diberi perlakuan.
konversi cacing sutera dan pakan buatan masing-masing sekitar 33,7% dan 25,6% lebih rendah daripada kontrol yang tidak diberi perlakuan rElGH. Dengan demikian pemberian rElGH dosis 12 mg/L pakan memberikan performa tertinggi.
Pada penelitian kedua yaitu penentuan dosis rElGH yang tepat dengan pemberian secara oral pada benih ikan sidat (elver) yang sudah mampu mengkonsumsi pakan buatan. Pada penelitian ini rElGH yang telah disalut (coating) dengan HP55, dicampur dengan pakan pada dosis berbeda (0; 0,3; 3; dan 30 mg rElGH/kg pakan). Hasil penelitian menunjukkan bahwa pertumbuhan bobot tertinggi (P>0,05) diperoleh pada perlakuan 30 mg/kg (60,18±1,38), dengan peningkatan sekitar 65,7% lebih tinggi dibandingkan dengan kontrol (36,32±0,97). Selain itu, pemberian rElGH meningkatkan nafsu makan, sedangkan tingkat konversi pakan/FCR ikan yang diberi dosis 30 mg/kg pakan (5,54) menurun sekitar 33% lebih rendah daripada FCR kontrol yang tidak diberi rElGH (7,37). Dengan demikian didapatkan dosis pemberian rElGH secara oral yang terbaik pada ikan sidat, yaitu 30 mg rElGH/kg
index/HSI (102,6%), dan meningkatkan ekspresi gen insuline-like growth factor-1/IGF-1 sebesar 21,91% dibandingkan dengan kontrol.
©
Hak Cipta milik IPB, tahun 2012
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjaun suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
RESPONS BENIH IKAN SIDAT TERHADAP HORMON
PERTUMBUHAN REKOMBINAN IKAN KERAPU KERTANG
MELALUI PERENDAMAN DAN ORAL
BOYUN HANDOYO
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Akuakultur
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Respons benih ikan sidat terhadap hormon pertumbuhan rekombinan ikan kerapu kertang melalui perendaman dan oral
Nama : Boyun Handoyo, S.Pi NIM : C151100081
Disetujui Komisi Pembimbing
Dr. Alimuddin, S.Pi, M.Sc Dr. Ir. Nur Bambang P.U, M.Si Ketua Anggota
Mengetahui
Ketua Program Studi A.n. Dekan Sekolah Pascasarjana Ilmu Akuakultur Sekretaris Program Magister
Prof.Dr. Enang Haris, M.S Dr.Ir. Dahrul Syah, M.Sc. Agr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah TESIS ini berhasil diselesaikan. Penelitian dilaksanakan sejak bulan November 2011 sampai Mei 2012 dengan tema tentang rekayasa pada budidaya ikan sidat. Judul penelitian ini adalah “Respons benih ikan sidat terhadap hormon pertumbuhan rekombinan ikan kerapu kertang melalui perendaman dan oral”.
Keberhasilan penulis dalam menyelesaikan penelitian ini tidak semata didapatkan sendiri, melainkan dengan bantuan orang-orang sekitar. Untuk itu penulis mengucapkan terima kasih kepada:
1. Dr. Alimuddin, S.Pi, M.Sc. selaku Pembimbing I yang telah membimbing dan mengarahkan penulis selama melakukan penelitian sampai dengan penyusunan karya ilmiah ini dan atas dukungan materil dan spiritual selama perkuliahan dan penelitian.
2. Dr. Ir. Nur Bambang Priyo Utomo, M.Si. selaku Pembimbing II yang telah membimbing dan mengarahkan penulis selama melakukan penelitian sampai dengan penyusunan karya ilmiah ini.
3. Dr. Dinamella Wahjuningrum, S.Si., M.Si. selaku penguji luar komisi atas saran dan pengarahannya dalam memperbaiki penulisan tesis.
4. Bapak Supriyadi M.Si. selaku Kepala BBAT Jambi ketika penulis memulai studi S2 yang telah memberikan nasehat, motivasi, dan dukungan dalam penyelesaian studi S2 yang penulis lakukan.
5. Bapak Dr. Elang Ilik Martawijaya selaku Direktur IPB Press yang berperan dalam kerjasama pembiayaan studi S2 yang penulis lakukan melalui pemberian beasiswa bagi penulis.
6. Istriku Eka Rachmayanti, telah memberikan kasih sayang, perhatian, doa dan segala dukungan yang sangat berarti. Anak-anakku (Tsamarah Kinasih Handoyo dan Husna Maharani Handoyo) yang menjadi penyemangat hidup dan penyimpan harapan penulis.
8. Ayah mertua Kasiran, Ibu mertua Lastariyah serta adik iparku Rahma dan Wawan yang juga telah memberikan dukungan dan doanya.
9. Ibu Lina Mulyani dan Bapak Dedi Supriyadi yang telah banyak membantu selama penelitian.
10.Bapak Agus Somamihardja (PT. SURI TANI PEMUKA) atas bantuan pakan yang diberikan dalam penelitian ini.
11.Bapak Suci Antoro yang telah memberikan beberapa bahan penelitian (terutama HP 55) dan nasehat selama penelitian.
12.Ibu Irmawati dan Siti Subaidah yang banyak memberikan ilmu rGH-nya sehingga memperlancar penyelesaian tesis ini.
13.Teman-teman S1 (Angkatan 45), S2, dan S3 di Laboratorium Reproduksi dan Genetika Organisme Akuatik, teman-teman Ilmu Akuakultur 2010. 14.Teman-teman dan seluruh staff BBAT Jambi yang telah memberikan
dukungan dalam penyelesaian studi S2 penulis.
15.Semua pihak yang telah memberikan dukungan baik secara langsung maupun tidak langsung.
Penulis telah berusaha semaksimal mungkin dalam penyelesaian karya ilmiah ini. Dengan harapan, karya ilmiah ini dapat bermanfaat bagi penulis dan para pembaca pada umumnya.
Bogor, Juli 2012
RIWAYAT HIDUP
Penulis dilahirkan di Banjarnegara, Jawa Tengah pada tanggal 26 Februari 1980 dari Ayah Mashudi dan Ibu Sri Nursiati. Penulis merupakan pertama dari dua bersaudara.
Pendidikan formal yang dilalui penulis adalah SDN 1 Kebanaran pada tahun 1986-1992 dilanjutkan di SMPN 2 Mandiraja pada tahun 1992-1995, kemudian SMUN 1 Banjarnegara pada tahun 1995 dan lulus tahun 1998. Penulis melanjutkan pendidikan tinggi di IPB melalui jalur Undangan Seleksi Masuk Institut Pertanian Bogor pada tahun yang sama dan memilih program studi Budidaya Perairan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan. Pada tahun 2002 penulis menyelesaikan studi sarjana di IPB dan pada tahun 2002 mulai bekerja menjadi staff Lembaga Manajemen Agrobisnis
Agroindustri (LMAA) sebagai Staff Penyusun Proyek “Industri Review”
kerjasama dengan Bank Rakyat Indonesia. Tahun 2003 penulis mulai bekerja di Balai Budidaya Air Tawar Jambi/BBAT Jambi (Dirjen Budidaya, Kementrian Kelautan dan Perikanan), dan menjabat sebagai Perekayasa Muda di Instansinya ini. Selain itu penulis juga aktif dalam penulisan buku, beberapa judul buku yang telah ditulis oleh penulis adalah : Industri Review Budidaya Kodok Lembu (BRI, 2001), Manual Produksi Induk Ikan Mas (BBAT Jambi–JICA, 2007), Manual Produksi Induk Ikan Nila (BBAT Jambi-JICA, 2007), dan Protokol Pemuliaan Ikan Patin Siam (PUSTINA, 2009), Cara Mudah dan Peluang Bisnis Budidaya Ikan Baung dan Jelawat (IPB Press 2010).
Pada tahun 2010 penulis melanjutkan studinya di Sekolah Pascasarjana IPB (S2) mengambil program studi Ilmu Akuakultur di Institut Pertanian Bogor dengan pembiayaan dari Beasiswa Penulis PT IPB Press. Untuk menyelesaikan studi di sekolah pascasarjana tersebut, penulis melakukan penelitian dengan judul
DAFTAR ISI
Halaman
DAFTAR TABEL... xiv
DAFTAR GAMBAR... xv
DAFTAR LAMPIRAN... xvii
I. PENDAHULUAN... 1
1.1. Latar Belakang... 1
1.2. Rumusan Masalah... 3
1.3. Tujuan dan Manfaat... 3
II. TINJAUAN PUSTAKA... 5
2.1. Ikan Sidat... 5
2.2. Hormon Pertumbuhan/Growth Hormone (GH)…... 10
2.3. Protein GH Rekombinan... 13
2.4. Pengujian Aktivitas GH Rekombinan pada Ikan... 14
III. BAHAN DAN METODE... 16
3.1. Ikan Uji... 16
3.2. Produksi Protein GH Rekombinan... 16
3.3. Analisis SDS PAGE... 17
3.4. Pembuatan Pakan Uji... 18
3.5. Penelitian 1: Penentuan Dosis Protein rElGH Terbaik dengan Pemberian Melalui Perendaman... 20
3.6. Penelitian 2 : Penentuan Dosis Pemberian Protein rElGH yang Terbaik dengan Pemberian Secara Oral... 21
3.7. Penelitian 3 : Penentuan Metode Terbaik antara Pemberian rElGH Melalui Perendaman, Pakan dan Kombinasinya... 22
3.8. Analisis Hepatosimatic Index (HSI)... 23
3.8. Analisis Ekskresi Amoniak (TAN)... 23
3.9. Analisis Proksimat Pakan dan Komposisi Tubuh... 23
3.10. Analisis Tingkat Ekspresi IGF-I... 24
IV HASIL DAN PEMBAHASAN... 25
4.1. Hasil... 25
4.1.1. Pemberian Protein rElGH melalui Perendaman... 25
4.1.2. Pemberian Protein rElGH Secara Oral... 26
4.1.3. Pemberian rElGH Melalui Perendaman dan Oral... 28
4.2. Pembahasan... 32
4.2.1. Pertumbuhan (Biomassa Panen dan SGR)... 32
4.2.2. Sintasan/SR... 34
4.2.3. Konversi Pakan, Retensi Protein dan Lemak, Komposisi Tubuh... 34
4.2.4. Ekskresi Amoniak (TAN)... 37
. 4.2.5. Nilai Hepatosomatic Index (HSI)... 37
4.2.6. Tingkat Ekspresi IGF-I... 38
4.2.7. Perbandingan antar Metode Pemberian rElGH Melalui Perendaman, Pakan dan Kombinasinya... 39
V KESIMPULAN DAN SARAN... 41
5.1. Kesimpulan... 41
5.2. Saran... 41
DAFTAR PUSTAKA... 42
DAFTAR TABEL
Halaman 1. Kandungan vitamin A (IU/100 gram), eicosapentaenoic acid/EPA dan
docosahexaenoic acid/DHA (mg/100 gram) pada beberapa bahan makanan (Suitha 2008)... 5 2 Komposisi pakan ikan sidat pada berbagai stadia berdasarkan ukuran
ikan (Tomiyama & Hibiya, 1977) ... 9 3. Tingkat pemberian pakan/feeding rate (FR), prosentase air dan lemak
pada pembuatan pakan pasta pada pendederan ikan sidat (Tomiyama & Hibiya, 1977)... 10 4. Beberapa pengujian aktivitas hormon pertumbuhan rekombinan yang
telah dilakukan pada ikan... 15 5. Proksimat dan kandungan energi pakan yang digunakan dalam
penelitian... 19 6. Desain percobaan penentuan dosis perendaman hormon pertumbuhan
rekombinan ikan kerapu kertang (rElGH) pada ikan sidat... 21 7. Desain percobaan penentuan dosis rElGH dalam pakan pada ikan
sidat... 22 8. Metode pemberian rElGH berbeda pada perlakuan yang digunakan
dalam penelitian... 22 9. Biomassa, laju pertumbuhan (SGR), sintasan (SR) dan tingkat konversi
pakan (FCR) ikan sidat (glass eel) yang diberi perendaman rElGH dan kontrol selama 2 bulan pemeliharaan... 26 10. Biomassa, laju pertumbuhan (SGR), sintasan (SR) dan tingkat konversi
pakan (FCR) ikan sidat (elver) yang diberi pakan rElGH dan kontrol selama 2 bulan pemeliharaan... 27 11. Respons pemberian rElGH dengan metode pemberian berbeda pada
DAFTAR GAMBAR
Halaman 1. Penyebaran benih ikan sidat di perairan Indonesia (dimodifikasi dari
Tesch 1911& Aoyama 2009)... 6 2. Siklus produksi ikan sidat di alam dan budidaya (dimodifikasi dari FAO
2012)... 7 3. Perkembangan pendapat tentang mediasi GH dalam mempengaruhi
pertumbuhan (dimodifikasi dari Ohlsson et al. 2009)... 11 4. Mekanisme hormon pertumbuhan (GH) dalam mempengaruhi
pertumbuhan dan beberapa fungsi lain (dimodifikasi dari Sanches 1999; Moriyama 2000; Wong et al. 2006; Debnanth 2010)... 12 5 Benih ikan sidat ukuran glass eel (A) dan elver (B) yang digunakan
dalam penelitian... 16 5. Proses penyalutan (coating) hormon pertumbuhan rekombinan ikan
kerapu kertang (rElGH) dengan menggunakan HP 55 (hypromellose phthalate) ... 18 6. Proses pembuatan pakan pasta yang mengandung hormon pertumbuhan
rekombinan ikan kerapu kertang (rElGH)... 19 7. Proses perendaman ikan uji dalam hormon pertumbuhan rekombinan
ikan kerapu kertang (rElGH) yang dilakukan dalam penelitian ini... 20 8. Pertumbuhan ikan sidat (Anguilla sp.) yang diberi perlakuan
perendaman rElGH dengan dosis berbeda pada awal pemeliharaan (hari pertama)... 25 9. Pertumbuhan ikan sidat (Anguilla sp.) yang diberi perlakuan rElGH
secara oral dengan dosis berbeda, dan frekuensi pemberian 2 hari/minggu selama 2 bulan pemeliharaan... 27 10. Ikan sidat hasil percobaan perlakuan pemberian rElGH dengan metode
11. Pertumbuhan ikan sidat yang diberi perlakuan rElGH melalui perendaman, pakan, dan kombinasi perendaman dan pakan... 29 12. Nilai hepatosomatic indeks (HSI) ikan sidat (Anguilla sp.) ikan kontrol
dan yang diberi perlakuan rElGH melalui peendaman dan pakan. Ikan dipelihara selama 4 bulan... 31 13. Level ekspresi IGF/β-aktin ikan sidat pada jam ke-0 (sebelum diberi
DAFTAR LAMPIRAN
Halaman 1. Hasil analisis SDS-PAGE protein rekombinan hormon pertumbuhan
ikan gurami (rOgGH), ikan mas (rCcGH) dan ikan kerapu kertang (rElGH)... 49 2. Hasil analisis IGF-I pada hati ikan sidat yang diberi perlakuan rElGH
dengan pertumbuhan terbaik dan kontrol... 50 3. Abstrak Sebagian dari tesis yang telah diseminarkan dalam
INDOAQUA & FITA 2012 pada tanggal 8-11 Juni 2012di Makassar... 51 4. Profil bahan penyalut (coating) rGH HP55 yang digunakan dalam
I. PENDAHULUAN
1.1. Latar Belakang
Ikan sidat merupakan jenis ikan yang sangat dicari di pasar internasional. Sebagai komoditas ekspor, pemanfaatan sumberdaya ikan sidat di Indonesia belum dilakukan dengan optimum, tidak seperti di negara lain (Jepang, China Taiwan dan negara-negara Eropa). Hal ini terlihat dari belum berkembangnya industri budidaya ikan sidat, padahal jumlah ikan sidat baik dalam ukuran benih maupun ukuran konsumsi sangat melimpah di muara sungai-sungai di Indonesia yang menghadap ke Samudera Pasifik dan Hindia sebagai tempat memijahnya ikan ini (Affandi 2005). Indonesia memiliki 6 spesies dari 17 spesies ikan sidat yang ada di dunia (Tomiyama & Hibiya 1977). Kondisi ini sangat menguntungkan karena sumber benih ikan sidat di dunia masih sangat tergantung hasil tangkapan dari alam (Tanaka 2006). Demikian pula pemanfaatan ikan untuk tujuan ekspor masih sangat rendah, terbatas hanya dalam ukuran benih (hasil tangkapan di alam, sehingga tidak memberikan nilai tambah). Budidaya ikan ini sudah dilakukan, akan tetapi belum berkembang seperti ikan lain karena teknologinya pembesarannya belum dikuasai sepenuhnya oleh pembudidaya. Spesies ikan sidat yang sudah mulai dibudidayakan di Indonesia di antaranya Anguilla bicolor dan A. marmorata. Kedua spesies ikan sidat tersebut dibudidayakan karena keberadaanya yang lebih melimpah dibandingkan jenis lain di Indonesia (Affandi 2005).
Selain ketersediaan benih yang terbatas, permasalahan utama dalam budidaya ikan sidat adalah pertumbuhannya yang lambat, ukuran benih yang tidak seragam, konversi pakan yang tinggi dan rentan terserang penyakit pada pendederan benih (glass eel dan elver). Berbagai penelitian telah dilakukan untuk meningkatkan pertumbuhan ikan sidat melaui pedekatan faktor eksternal, diantaranya penelitian pakan, rekayasa wadah/sistem teknologi pembesaran, dan manipulasi lingkungan pemeliharaan. Solusi melalui faktor internal misalnya melalui rekayasa genetika masih sulit dilakukan karena teknologi pematangan gonad, pemijahan, dan pemeliharaan larva belum diketahui dengan baik seperti pada ikan sidat (Tanaka 2006).
diujicobakan adalah penggunaan protein rekombinan hormon pertumbuhan (rGH) dalam sistem produksi benih ikan sidat (Lesmana 2010; Utomo 2010). Hormon pertumbuhan merupakan hormon polipeptida dengan panjang sekitar 22 kDa yang diproduksi dari somatotropin di dalam kelenjar pituitari bagian anterior. Hormon ini merupakan komponen yang penting dalam mengatur banyak aspek fisiologi seperti pertumbuhan, metabolisme, osmoregulasi, fungsi kekebalan tubuh, reproduksi, dan merangsang hati untuk menghasilkan insulin-like growth factor-1/ IGF-I (Moriyama et al. 1993, 2000; Li et al. 2003; Promdonkoy et al. 2004; Reinecke et al. 2005; Wong et al. 2006; Acosta. et al. 2007, 2009; Debnanth 2010). Penggunaan rGH juga merupakan prosedur yang relatif aman, karena yang dimodifikasi adalah bakteri yang memproduksi rGH saja, sehingga ikan yang diberikan rGH tidak dikategorikan sebagai organisme genetically modified organism/GMO (Khoo 2000; Acosta et al. 2007). Hal tersebut karena rGH tidak ditransmisikan ke keturunan ikan selanjutnya.
Penggunaan teknologi protein rGH untuk mempercepat pertumbuhan ikan sudah banyak dilakukan di daerah sub tropis pada beberapa spesies ikan yang berbeda. Pemberian rGH pada ikan rainbow trout dapat meningkatkan pertumbuhan sebesar 50% dibandingkan dengan ikan kontrol (Sekine et al. 1985). Pada ikan baronang pemberian rGH selama empat minggu dapat meningkatkan bobot tubuh sebesar 20% dibandingkan kontrol (Funkenstein et al. 2005). Pemberian rGH ikan mas sebesar 0,1 µg/g bobot tubuh pada benih ikan nila dapat meningkatkan bobot tubuh sebesar 53,1% dibandingkan dengan kontrol (Li et al. 2003). Pemberian rGH yang berbeda pada ikan nila melalui teknik penyuntikan atau injeksi berhasil meningkatkan bobot sebesar 20,94% (rGH ikan kerapu kertang); 18,09% (rGH ikan mas); 16,99% (rGH ikan gurame) (Lesmana 2010).
1.2. Rumusan Masalah
Dari hasil analisis permasalahan pada ikan sidat yaitu pertumbuhan yang lambat, konversi pakan yang tinggi, dan rentan terhadap serangan penyakit (Sakai
et al. 1997), maka penggunaan teknologi pemberian rGH dapat dijadikan alternatif solusi untuk mengatasinya. Beberapa hasil yang signifikan pada beberapa spesies ikan budidaya dapat dijadikan dasar untuk melakukan aplikasi penggunaan rGH dalam mempercepat pertumbuhan ikan sidat terutama pada fase pendederan. Teknologi ini diharapkan dapat meningkatkan pertumbuhan, meningkatkan sintasan dan menurunkan konversi pakan pada budidaya ikan sidat (fase pendederan). Efektivitas pemberian rGH dipengaruhi oleh dosis, metode pemberian, dan respons ikan terhadap pemberian. Dengan demikian berbagai tingkat pemberian dosis dan metode pemberian perlu diuji. Selanjutnya juga perlu dilihat respons benih ikan sidat terhadap pertumbuhan biomassa, sintasan, konversi pakan dan retensi pakan juga perlu dilakukan karena berkaitan erat dengan produksi. Komposisi tubuh (uji proksimat) dan tingkat ekskresi amonia (uji TAN) juga perlu dilakukan untuk melihat efek rGH terhadap keamanan pangan dan lingkungan. Pengujian level ekspresi IGF-1 juga perlu dilakukan untuk melihat respon hormonal akibat pemberian rGH sekaligus sebagai penanda/marka masuknya rGH yang kita berikan kedalam tubuh ikan. Teknologi ini diharapkan ikut berperan dalam peningkatan produksi dan efisiensi produksi ikan sidat.
1.3. Tujuan dan Manfaat
Secara umum penelitian ini bertujuan untuk menguji penggunaan rGH ikan kerapu kertang (rElGH) pada ikan sidat dengan metode perendaman (pada fase glass eel) dan melalui pakan (pada fase elver) dalam meningkatkan pertumbuhan benih ikan sidat. Tujuan umum tersebut diwujudkan melalui beberapa penelitian, yaitu:
1) Penentuan dosis pemberian rElGH yang tepat (melalui perendaman) untuk mempercepat pertumbuhan ikan sidat ukuran glass eel.
3) Penentuan metode terbaik antara pemberian rElGH melalui perendaman, secara oral dan kombinasi keduanya untuk mempercepat pertumbuhan ikan sidat.
4) Mengidentifikasi dan menganalisis respons benih ikan sidat terhadap pemberian rElGH.
II. TINJAUAN PUSTAKA
2.1. Ikan Sidat
Ikan sidat, Anguilla spp. merupakan jenis ikan yang sangat laku di pasar internasional (Jepang, China, Taiwan, Hongkong, Jerman, Italia dan beberapa negara lain). Dengan demikian ikan ini memiliki potensi yang menjanjikan sebagai komoditas ekspor. Tidak seperti halnya di negeri lain (Jepang, dan negara-negara Eropa), di Indonesia sumberdaya ikan sidat belum banyak dimanfaatkan. Hal ini terlihat dari tingkat pemanfaatan ikan sidat secara lokal (dalam negeri) masih sangat rendah, padahal jumlah ikan ini baik dalam ukuran benih maupun ukuran konsumsi cukup melimpah. Salah satu penyebabnya adalah ikan ini belum banyak dikenal, sehingga kebanyakan penduduk Indonesia belum familiar untuk mengkonsumsi ikan sidat. Demikian pula pemanfaatan ikan untuk tujuan ekspor masih sangat terbatas. Ekspor ikan sidat kebanyakan dalam ukuran
glass eel hasil tangkapan dari alam (Affandi 2005).
Selain rasanya yang enak, masyarakat Jepang menyadari banyaknya manfaat yang terkandung di dalam ikan sidat, sehingga dapat digunakan sebagai bahan makanan yang baik untuk menjaga dan meningkatkan kesehatan ( nutri-theurapic). Kandungan energi ikan sidat lebih besar dari telur ayam yang mencapai 270 kkal/100 g. Nutrisi lain seperti vitamin A, dan asam lemak esensial EPA (eicosapentaenoic acid) dan DHA (docosahexaenoic acid) yang dibutuhkan oleh tubuh yang lebih tinggi dibandingkan bahan makanan yang lain.
Tabel 1 Kandungan vitamin A (IU/100 gram), eicosapentaenoic acid/EPA dan
docosahexaenoic acid/DHA (mg/100 gram) pada beberapa bahan makanan (Suitha 2008)
Ikan sidat memiliki sifat yang unik dalam siklus hidupnya karena merupakan salah satu ikan yang melakukan migrasi/ruaya (katadromus). Indonesia yang diapit oleh 2 samudera tentunya memiliki sumberdaya benih sidat yang melimpah. Terbukti enam dari 17 spesies terdapat di Indonesia yakni: A. marmorata, A. celebensis, A. ancentralis, A. borneensis, A. bicolor bicolor dan A.
bicolor pacifica (Tomiyama & Hibiya, 1977). Jenis ikan tersebut menyebar di muara sungai yang berbatasan dengan laut dalam yakni di pantai selatan Pulau Jawa, pantai barat P. Sumatera, pantai timur P. Kalimantan, seluruh pantai P. Sulawesi, Kepulauan Maluku, Bali, Nusa Tenggara Barat dan Nusa Tenggara Timur hingga pantai utara dan selatan Papua (Gambar 1). Ikan sidat hidup di perairan estuaria (laguna) dan perairan tawar (sungai, rawa dan danau serta persawahan) dari dataran rendah hingga dataran tinggi.
(Tab
Gambar 1 Penyebaran benih ikan sidat di perairan Indonesia (dimodifikasi dari Tesch 1911& Aoyama 2009).
Dalam membudidayakan ikan sidat, benih yang sering disebut dengan
glass eel (yang berukuran kecil dan warna tubuh masih transparan) dan elver
(sudah berwarna gelap) sangat tergantung hasil tangkapan dari alam karena belum dapat dikembangbiakan secara komersial. Benih ikan sidat biasanya ditangkap di muara-muara sungai yang menghadap ke laut dalam. Keberadaan benih ikan sidat
di Indonesia sangat melimpah, sehingga merupakan potensi yang belum digali secara maksimum.
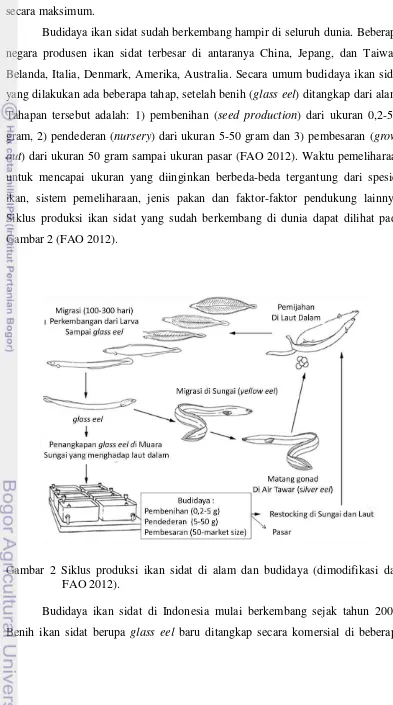
Budidaya ikan sidat sudah berkembang hampir di seluruh dunia. Beberapa negara produsen ikan sidat terbesar di antaranya China, Jepang, dan Taiwan, Belanda, Italia, Denmark, Amerika, Australia. Secara umum budidaya ikan sidat yang dilakukan ada beberapa tahap, setelah benih (glass eel) ditangkap dari alam. Tahapan tersebut adalah: 1) pembenihan (seed production) dari ukuran 0,2-5,0 gram, 2) pendederan (nursery) dari ukuran 5-50 gram dan 3) pembesaran ( grow-out) dari ukuran 50 gram sampai ukuran pasar (FAO 2012). Waktu pemeliharaan untuk mencapai ukuran yang diinginkan berbeda-beda tergantung dari spesies ikan, sistem pemeliharaan, jenis pakan dan faktor-faktor pendukung lainnya. Siklus produksi ikan sidat yang sudah berkembang di dunia dapat dilihat pada Gambar 2 (FAO 2012).
Gambar 2 Siklus produksi ikan sidat di alam dan budidaya (dimodifikasi dari FAO 2012).
daerah di Sulawesi dan Pantai selatan Pulau Jawa. Penangkapan glass eel secara kontinyu di Sulawesi dilakukan di daerah Kabupaten Poso, mayoritas benih yang tertangkap adalah jenis A. marmorata. Sedangkan di pantai selatan pulau Jawa, di antaranya adalah di Pelabuhan Ratu, Cilacap, Purworejo, dan Jember, mayoritas benih yang tertangkap adalah A. bicolor. Daerah lain yang memulai melakukan penangkapan terhadap glass eel adalah di pantai barat Pulau Sumatera, yaitu di Provinsi Bengkulu (A. bicolor).
Segmentasi budidaya ikan sidat di Indonesia dibagi menjadi beberapa tahap, yaitu: Pendederan 1, Pendederan 2, dan Pembesaran. Pendederan 1 dilakukan dari glass eel (0,2 gram) sampai elver yang berukuran 2-5 gram. Pendederan 2 dilakukan untuk ikan ukuran 2-5 gram dipelihara sampai 4 bulan sampai ikan berukuran 10-80 gram. Grading dilakukan setiap bulan, sampai didapatkan ukuran akhir 60-80 gram untuk dibesarkan pada tahap pembesaran sampai ukuran konsumsi (Suitha 2008). Budidaya ikan sidat semakin menarik ketika adanya larangan ekspor ikan sidat untuk ukuran glass eel. Berdasarkan SK Menteri Pertanian Nomor: 214/Kpts/UM/5/1973 tentang Larangan Pengeluaran Beberapa Jenis Ikan Hasil Perikanan dari Wilayah Negara RI serta Peraturan Menteri Perdagangan RI Nomor: 07/M-DAG/PER/4/2005 tanggal 19 April 2005 tentang Perubahan atas Lampiran Keputusan Menteri Perindustrian dan Perdagangan Nomor: 558/MPP/KEP12/1998 tentang Ketentuan Umum di Bidang Ekspor sebagaimana telah beberapa kali diubah terakhir dengan Keputusan Menteri Perindustrian dan Perdagangan Nomor: 385/MPP/Kep/6/2004
menyatakan bahwa “barang yang dilarang ekspornya adalah benih sidat (Anguilla spp) berukuran diameter tubuh kurang dari 5 mm”.
kekurangan nutrisi dengan mencampur pakan tersebut dengan bahan lain, misalnya tepung ikan, telur ayam, minyak ikan/minyak cumi, tepung roti, ragi, vitamin mix dan mineral mix. Sebagai acuan ada beberapa komposisi pakan pada berbagai stadia pemeliharaan ikan sidat (Tabel 2).
Tabel 2 Komposisi pakan ikan sidat pada berbagai stadia berdasarkan ukuran
- Kebutuhan vitamin: Vitamin A (oil), cholecalciferol, tocopherol acetate, thiamine nitrate, pyridoxine hydrochloride, nicotinamide, pantothenic acid calcium, folic acid cyanocobalamin, Vitamin K3, ribovlavin, d biotin, inositol chloride, ascorbic acid calcium.
- Kebutuhan mineral: Calcium carbonate, fumaric acid iron, potassium chloride, magnesium sulfate, phosphate of calcium, manganese sulfate, sulfate of copper, sulfate of zinc, calcium iodate, cobal chloride.
Hal lain yang perlu diperhatikan dalam manajemen pemberian pakan pada ikan sidat adalah tingkat pemberian pakan pada setiap ukuran (feeding rate), dan perbandingan antara air, minyak dan pakan pada pembuatan pakan pasta (Tabel 3). Pada fase pendederan dibutuhkan pakan pasta dengan prosentase air sebesar 140-160%, tanpa diberikan lemak tambahan. Tingkat pemberian pakan (feeding rate) pada pendederan ikan sidat berkisar antara 4-10% dari bobot biomassa tubuh ikan sidat.
Ada beberapa penyakit yang sering menyerang ikan sidat, di antaranya:
Aeromonas hydrophila (penyakit sirip merah/red fin disease), Pseudomonas anguilliseptica (penyakit bintik merah/red dot disease), dan saprolegnia (sering
disebut sebagai penyakit “jamuran”) oleh pembudidaya ikan sidat, Edwarsiella tarda, Flexibacter columnaris, Ichthyopthirus multifilis (penyakit bintik putih/white spot), Trichodina, Vibrio furnissii (rongga perut menggembung/
Tabel 3 Tingkat pemberian pakan(FR), prosentase air dan lemak pada pembuatan pakan pasta untuk pendederan ikan sidat ukuran glass eel dansidat muda (Tomiyama & Hibiya 1977).
Keterangan glass eel 1 glass eel 2 sidat muda
Feeding Rate (%) 10 4-6 3-5
Persentase air 140-160 140-160 130-140
Persentase lemak 0 0 3-5
2.2. Hormon Pertumbuhan/Growth Hormone (GH)
Hormon pertumbuhan merupakan polipeptida yang disekresikan oleh bagian anterior dari kelenjar pituitari yang memiliki fungsi utama memacu pertumbuhan tubuh. Hormon ini merupakan peptida yang besar yang terdiri dari 191 asam amino dengan berat berkisar 20-25 kDa dan relatif bersifat spesifik untuk masing-masing spesies. Menurut Biotechnology Industry Organization pada tahun 2007, GH manusia pertama kali ditemukan pada tahun 1920 oleh Evans dan Long. Kemudian, pada tahun 1979 hormon tersebut disintesis untuk pertama kali. Sekresi hormon pertumbuhan dikendalikan oleh hipotalamus. Somatotropin menggambarkan hormon pertumbuhan yang biasa diproduksi di hewan, sedangkan somatropin menggambarkan hormon pertumbuhan yang diproduksi oleh teknologi DNA rekombinan (Lindholm 2006; Utomo 2010).
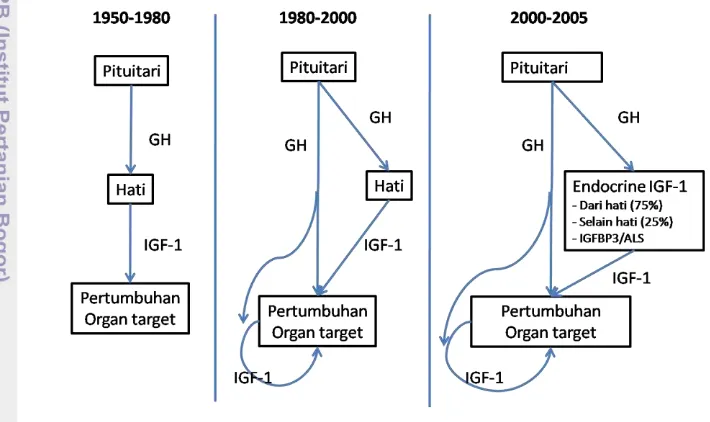
Mekanisme GH dalam mempengaruhi pertumbuhan ada beberapa pendapat yang terus berkembang (Gambar 3). Penelitian tentang bagaimana GH dimediasi dalam mempengaruhi pertumbuhan sudah dimulai sejak tahun 1950-an. Paradigma berkembang pada mamalia bahwa GH mempengaruhi pertumbuhan dimediasi oleh IGF-1 yang berada dalam hati. Pada tahun 1980-an paradigma berkembang bahwa ada mekanisme langsung pada GH dalam mempengaruhi pertumbuhan, dan kemudian diketahui bahwa dalam organ dapat memproduksi IGF-1 sendiri. Pada tahun 2000-an diketahui mediasi yang terjadi tidak hanya dalam hati, tetapi juga terjadi di luar hati dan ada peran IGF binding proteins (IGFBPs) dan acid-labile subunit (ALS) (Ohlsson et al. 2009).
Gambar 3 Perkembangan pendapat tentang mediasi GH dalam mempengaruhi pertumbuhan (dimodifikasi dari Ohlsson et al. 2009).
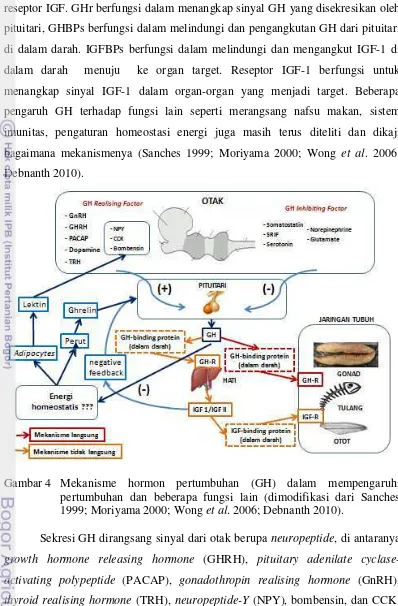
reseptor IGF. GHr berfungsi dalam menangkap sinyal GH yang disekresikan oleh pituitari, GHBPs berfungsi dalam melindungi dan pengangkutan GH dari pituitari di dalam darah. IGFBPs berfungsi dalam melindungi dan mengangkut IGF-1 di dalam darah menuju ke organ target. Reseptor IGF-1 berfungsi untuk menangkap sinyal IGF-1 dalam organ-organ yang menjadi target. Beberapa pengaruh GH terhadap fungsi lain seperti merangsang nafsu makan, sistem imunitas, pengaturan homeostasi energi juga masih terus diteliti dan dikaji bagaimana mekanismenya (Sanches 1999; Moriyama 2000; Wong et al. 2006; Debnanth 2010).
Gambar 4 Mekanisme hormon pertumbuhan (GH) dalam mempengaruhi pertumbuhan dan beberapa fungsi lain (dimodifikasi dari Sanches 1999; Moriyama 2000; Wong et al. 2006; Debnanth 2010).
Sekresi GH dirangsang sinyal dari otak berupa neuropeptide, di antaranya
growth hormone releasing hormone (GHRH), pituitary adenilate cyclase-activating polypeptide (PACAP), gonadothropin realising hormone (GnRH),
darah yang rendah, peningkatan sekresi androgen, arginin, T3/T4, dan CVP/CNP. Faktor yang dapat menghambat GH diantaranya somatostatin, SRIF, serotonin,
glutamate, norepinephrine konsentrasi hormon pertumbuhan dan insulin like growth factor 1 (IGF-1) yang bersirkulasi, kandungan gula darah yang tinggi, glukokortikoid, estradiol. Kandungan GH dalam tubuh ikan berkisar antara 0,2-111,2 ng/ml plasma darah (Björnsson et al. 2000; Arnesen et al. 2003; Drennon et al. 2003; Wong et al. 2006; Nordgarden et al. 2005; Utomo 2010).
2.3. Protein GH Rekombinan
Metode pembuatan protein hormon pertumbuhan rekombinan (rGH) mengacu kepada metode teknologi DNA rekombinan atau kloning gen, tahapan kloning gen yang dilakukan yaitu: isolasi gen, dalam hal ini DNA yang mengkode hormon pertumbuhan (GH), penyisipan gen ke dalam sistem vektor untuk membentuk vektor rekombinan, dan selanjutnya vektor rekombinan yang membawa sisipan gen GH tersebut diintroduksikan ke dalam sel inang (bakteri). Dan kemudian di dalam sel inang GH rekombinan tersebut akan diekspresikan dan diperbanyak dengan cepat sesuai dengan kecepatan sel inang membelah diri. Beberapa penelitian telah berhasil mengisolasi dan memproduksi rGH dari beberapa jenis ikan di antaranya adalah pada ikan salmon (Sekine et al. 1985); ikan flounder (Jeh et al. 1998); orange-spotted grouper (Li et al. 2005); ikan patin siam (Poen 2009); ikan mas (Utomo 2010); ikan kerapu kertang (Lesmana 2010).
2.4. Pengujian Aktivitas GH Rekombinan pada Ikan
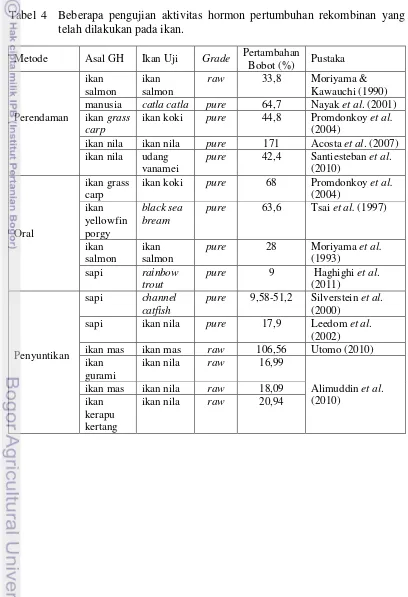
Teknik pengujian aktivitas rGH dapat dilakukan dengan memberikan protein rGH yang telah diproduksi kepada ikan budidaya, metode yang digunakan untuk memberikan protein rGH untuk memacu pertumbuhan atau meningkatkan kinerja banyak aspek fisiologi tubuh dapat dilakukan dengan cara injeksi (penyuntikan), imersi (perendaman), dan secara oral (pakan). Pemberian hormon pertumbuhan juga bisa diberikan dari ikan yang sama (Moriyama & Kawauchi 1990; Acosta et al. 2007; Moriyama et al. 1993; Utomo 2010), ikan berbeda (Tsai et al. 1997; Promdonkoy et al. 2004; Alimuddin et al. 2010), bahkan organisme berbeda, misalnya: pada ikan ke udang (Santiesteban et al. 2010), sapi ke ikan (Haghighi et al. 2011; Silverstein et al. 2000; Leedom et al. 2002), dan manusia ke ikan (Nayak et al. 2001). Masing-masing kasus memberikan efek yang berbeda terhadap pertambahan bobot ikan. Hormon yang diberikan juga berbeda tingkat kemurniannya (murni/pure dan kasar/raw). Beberapa aplikasi pemberian rGH dengan metode dan jenis ikan yang berbeda yang pernah diuji dapat dilihat pada Tabel 4.
Metode pemberian protein rGH melalui pakan buatan telah dilakukan di antaranya pada ikan flounder dengan frekuensi 1 kali seminggu selama 4 minggu (Jeh et al. 1998). Pemberian rGH melalui pakan buatan merupakan metode yang praktis, karena tidak perlu menangani ikan satu per satu (Jeh et al. 1998). Namun demikian, penggunaan pakan buatan terbatas pada benih ikan yang sudah memiliki sistem dan enzim pencernaan yang lengkap.
Metode pemberian protein rGH melalui perendaman juga bisa dilakukan dengan merendam ikan pada larutan rGH dengan dosis 30 mg/l selama 60 menit dengan interval 7 hari sekali, kemudian diukur pertumbuhannya, seperti yang dilakukan oleh Moriyama dan Kawauchi 2004. Metode ini cocok digunakan pada larva atau benih ikan yang masih memiliki permukaan tubuh yang bersifat semipermeabel. Metode ini juga aplikatif untuk produksi yang dilakukan pada skala masal.
giant catfish ke benih ikan mas dengan dosis 0,1 dan 1 µg per 10 µl PBS per g bobot tubuh. Dengan metode injeksi dapat dipastikan bahwa protein rGH masuk ke tubuh melalui peredaran darah. Meskipun demikian, metode ini memiliki kekurangan karena sulit untuk diaplikasikan pada ikan yang berukuran kecil dan untuk skala yang masal karena perlu penanganan satu per satu.
III. BAHAN DAN METODE
3.1. Ikan Uji
Seluruh ikan uji yang digunakan adalah ikan sidat (Anguilla sp.) yang berasal dari muara Sungai Cimandiri, Pelabuhan Ratu, Sukabumi, Jawa Barat.
Glass eel ditangkap pada satu minggu yang sama dan dikumpulkan oleh pengumpul glass eel di daerah tersebut. Glas eel yang digunakan berukuran panjang 5,52±0,22 cm, dan bobot 0,13±0,21 gram. Elver yang digunakan hasil pemeliharaan dari ukuran glass eel dengan ukuran panjang 7,45±0,75 cm, dan bobot 0,54±0,21 gram pada tahap persiapan selama 2 bulan dalam akuarium. Ikan sidat ukuran glass eel dan elver yang digunakan dapat dilihat pada Gambar 5.
Gambar 5 Benih ikan sidat ukuran glass eel (A) dan elver (B) yang digunakan dalam penelitian.
3.2. Produksi Protein GH Rekombinan
Pada penelitian ini digunakan bakteri Escherichia coli BL21 (DE3) yang mengandung konstruksi pCold/rElGH (Alimuddin et al. 2010). Dengan menggunakan analisis SDS-PAGE telah diketahui bahwa produksi rGH ikan kerapu kertang pada E. coli lebih tinggi daripada rGH ikan mas dan ikan gurami (Lampiran 1). Klon bakteri E.coli BL21 (DE3) mengandung pCold-I/rElGH yang disimpan dalam stok gliserol dilakukan kultur awal dengan digoreskan ke dalam media padat 2xYT yang mengandung ampisilin. Hasil goresan bakteri diinkubasi
dalam suhu 37oC selama 24 jam. Selanjutnya hasil kultur media padat tersebut diambil koloni tunggalnya untuk dilakukan subkultur pertama dalam 5 mL media 2xYT cair yang mengandung ampisilin (tabung L), dan diinkubasi menggunakan
shaker pada suhu 37oC selama 18 jam. Setelah itu, dilakukan subkultur kedua dengan mengambil sebanyak 1% dari kultur awal dan dimasukkan ke dalam 60 ml media 2xYT cair baru dan diinkubasi lagi pada suhu 37oC selama 2 jam. Induksi produksi rGH dilakukan dengan memberikan kejutan suhu 15oC selama 30 menit, ditambahkan IPTG sebanyak 750 µ L dan diinkubasi menggunakan
shaker pada suhu 15oC selama 24 jam. Bakteri hasil kultur dikumpulkan dengan sentrifugasi pada kecepatan 12.000 rpm selama 2 menit untuk mengendapkan sel. Pelet bakteri dicuci dengan phosphate buffer saline (PBS) sebanyak 1 kali dan selanjutnya disimpan pada suhu -80oC hingga akan digunakan
Pelet bakteri dicuci menggunakan 1 mL bufer tris-EDTA (TE) per 200 mg bakteri dan diinkubasi pada suhu 37oC selama 20 menit. Setelah bakteri diendapkan dengan sentrifugasi pada 12.000 rpm selama 1 menit, bakteri dilisis terlebih menggunakan lisozim sebanyak 500 µL (10 mg dalam 1 ml buffer TE), dan diinkubasi pada suhu 37oC selama 20 menit, lalu disentrifugasi pada 12.000 rpm selama 1 menit. Protein rElGH dalam bentuk badan inklusi/tidak larut diendapkan dengan cara sentrifugasi pada 12.000 rpm selama 1 menit. Pelet rElGH dicuci dengan PBS sebanyak 1 kali dan disimpan pada suhu -80oCsampai akan digunakan.
3.3. Analisis SDS-PAGE
mengandung 1,5M Tris-HCl (pH 6,8), 2M DDT, SDS 10%, bromophenol blue, gliserol 87%, dan ddH2O. Selanjutnya dimasukkan sebanyak 20 µl ke setiap sumur gel dan elektroforensis pada tegangan 150 Volt dan kuat arus listrik 60 mA. Setelah itu gel dimasukkan kedalam staining solution (metanol, air, coomassie brilliant blue R-250, dan asam asetat glasial) selama 3 jam. Lalu gel dimasukkan ke dalam de-staining solution (Ethanol, ddH2O, asam asetat glasial) selama sekitar 24 jam.
3.4. Pembuatan Pakan Uji
Pakan uji dibuat dengan cara mencampurkan rElGH yang sudah dilakukan penyalutan (coating) sebelumnya ke dalam pakan. Penyalutan pakan dilakukan dengan metode seperti yang dilakukan oleh Promdonkoy et al. (2004), menggunakan HP 55 (Shinetsu, Japan) sehingga terbentuk matriks rElGH-HP55 (Gambar 6). HP 55 tersebut memiliki nama dagang Hypromellose Pthalate (Hydroxypropylmethylcellulose Pthalate). Profil HP 55 yang digunakan dapat dilihat pada Lampiran 3.
Gambar 6 Proses penyalutan (coating) hormon pertumbuhan rekombinan ikan kerapu kertang (rElGH) dengan menggunakan HP 55 (hypromellose phthalate).
pakan komersial dibuat pasta ditimbang dan dibentuk
diberikan ke ikan uji
dilakukan pengeringan beku dalam freeze drying. Kemudian rElGH-HP55 disimpan pada suhu ruang hingga akan digunakan.
Setelah dilakukan pencampuran matrik rElGH-rElGH ke dalam pakan, dilakukan analisis proksimat untuk mengklarifikasi kandungan nutrisi pakan setelah dicampurkan. Komposisi nutrisi pakan yang akan diberikan (Tabel 5).
Tabel 5 Proksimat dan kandungan energi pakan yang digunakan dalam penelitian
Hasil uji (%) Pakan
GE (Gross Energy) dikalkulasi dengan menggunakan koefisien kandungan energi dalam protein sebesar 5,5 kkal/g, lemak 9,5 kkal/g, dan karbohidrat 4,5 kkal/g. Pakan perlakuan diberikan 2 hari/minggu.
Pencampuran rGH-HP55 dengan pakan uji dilakukan dengan cara disemprotkan secara merata. Kemudian pakan uji dikering-anginkan. Pakan uji yang digunakan berupa pakan komersial yang dihancurkan dalam bentuk tepung untuk dibuat pakan pasta (Gambar 7). Pembuatan pakan pasta dilakukan dengan cara mencampurkan pakan dalam bentuk tepung (yang telah diberi rElGH-HP55 sesuai dosisnya) dengan komposisi air sebanyak 140-160% dari bobot pakan tepung (Tomiyama & Hibiya 1977).
3.5. Penelitian 1: Penentuan Dosis Protein rElGH Terbaik dengan Pemberian Melalui Perendaman
Bioaktivitas protein rElGH ditentukan dengan menganalisis biomassa panen, specific growth rate (SGR), konversi pakan/feed convertion rate (FCR) dan survival rate (SR) ikan sidat yang telah direndam dengan rElGH dibandingkan dengan ikan sidat yang tanpa diberi perlakuan rElGH. Glass eel
diberikan perlakuan kejut salinitas (salinity shock) dalam NaCl 3,0% selama 2 menit kemudian direndam selama 2 jam (hasil penelitian pendahuluan) dalam air mengandung larutan rElGH dengan dosis berbeda (Tabel 5) + NaCl 0,9% + BSA 0,01% (Gambar 8). Setiap perlakuan dosis diulang tiga kali (Tabel 8).
Pemeliharaan ikan dilakukan dalam akuarium dengan padar tebar 5 ekor/liter, dimana setiap unit percobaan/akuarium ditebar glass eel sebanyak 150 ekor. Pemberian pakan cacing rambut dilakukan selama 1 bulan, dilanjutkan dengan pakan pasta selama 1 bulan pemeliharaan. Air akuarium diganti sebanyak 50-80% setiap hari. Sampling biomassa ikan diukur setiap 15 hari sekali. Kelangsungan hidup dihitung pada akhir percobaan.
Perlakuan perendaman rElGH yang diberikan menggunakan dosis 0; 0,12; 1,2; 12; dan 120 mg/L. Penentuan dosis berdasarkan hasil penelitian sebelumnya, pada ikan gurami (Syazilii et al. 2011)yaitu didapatkan dosis perendaman terbaik 120 mg/L, dengan sekali perendaman. Berdasarkan hasil SDS-PAGE rOgGH (gurami) memiliki tingkat produksi protein yang lebih kecil dibandingkan rElGH (kerapu kertang), maka dalam penelitian penentuan dosis ini dilakukan penurunan dosis (Tabel 6).
Tabel 6 Desain percobaan penentuan dosis perendaman hormon pertumbuhan rekombinan ikan kerapu kertang (rElGH) pada ikan sidat
Dosis perendaman (mg/L)
A = kontrol tanpa perlakuan rGH dan tanpa perlakuan salinitas. B = kontrol, perlakuan salinitas, BSA 0,01%.
C-F = perlakuan rGH dosis 0,12; 1,2; 12; dan 120 mg/L.
3.6. Penelitian 2: Penentuan Dosis Pemberian Protein rElGH yang Terbaik dengan Pemberian Secara Oral
Parameter yang diamati untuk menentukan bioaktivitas protein rElGH melalui pakan pada penelitian 2 ini juga dilakukan perbandingan biomassa panen, SGR, FCR dan SR. Elver ikan sidat hasil pendederan disiapkan dalam wadah pemeliharaan berupa akuarium berukuran 60x45x50 cm dengan padat tebar 3 ekor/liter, dimana setiap unit percobaan/akuarium ditebar sebanyak 45 ekor. Pakan yang digunakan adalah pakan pasta yang telah diberi protein rElGH dengan dosis berbeda dan pakan tanpa diberi rElGH. Air akuarium diganti sebanyak 50-80% setiap hari. Panjang dan bobot ikan dilakukan sampling pada awal dan akhir pemeliharaan. Bobot diukur setiap 15 hari sekali. Sintasan dihitung pada akhir percobaan.
Dosis rElGH tertinggi ditentukan berdasarkan hasil penelitian Hardiantho
frekuensi dua kali per-minggu dengan feeding rate/FR 6% dari bobot biomassa (Tabel 7). Dosis diturunkan karena tingkat produksi rElGH lebih tinggi dibandingkan dengan rOgGH. Pemberian pakan dilakukan sehari 2 kali dengan pembagian 3% pada pagi hari, dan 3% pada sore hari.
Tabel 7 Desain percobaan penentuan dosis rElGH dalam pakan pada ikan sidat Dosis rElGH dalam pakan (mg/100 gram pakan)
A (0) B (0,03) C (0,3) D (3) perendaman) dan penelitian 2 (melalui pakan), dengan memilih hasil dosis terbaik pada penelitian 1 dan 2 (Tabel 8).
Tabel 8 Metode pemberian rElGH pada perlakuan yang digunakan dalam penelitian
Perlakuan Metode Pemberian rElGH
Bulan pertama Bulan ketiga dan keempat Via pakan dengan dosis 0 mg rElGH/kg pakan sebanyak 6% biomassa ikan, diberikan 2 kali setiap minggu Via pakan Kejut salinitas 30 ppt,
rendam dalam 0 mg/L rElGH + BSA + 9 ppt selama 2 jam ( 1 kali pemberian)
Pemberian rElGH+HP55 melalui pakan dengan dosis 30 mg rElGH/kg pakan sebanyak 6% biomassa ikan, pakan dengan dosis 30 mg rElGH/kg pakan sebanyak 6% biomassa ikan, diberikan 2 kali setiap minggu Kontrol Kejut salinitas 30 ppt,
rendam dalam 0 mg/L rElGH + BSA + 9 ppt selama 2 jam ( 1 kali pemberian)
Pemberian rElGH+HP55 melalui pakan dengan dosis 0 mg rElGH/kg pakan sebanyak 6% biomassa ikan, diberikan 2 kali setiap minggu
Efektivitas pemberian rElGH pada penelitian 3 ini membandingkan antara perlakuan perendaman saja, pakan saja, dan mengkombinasikan pemberian melalui perendaman pada fase glass eel yang dilanjutkan pemberian melalui pakan setelah ikan bisa makan pakan buatan (ukuran elver). Parameter yang diamati meliputi biomassa panen, FCR, SR, retensi protein, retensi lemak,
hepatosomatic index (HSI), ekskresi amoniak, dan ekspresi IGF-1. Ikan dipelihara dalam akuarium berukuran 60x45x50 cm, dimana setiap unit percobaan/akuarium ditebar benih ikan sidat dengan padat tebar yang sama. Pemeliharaan dilakukan selama 2 bulan dengan padat tebar 2 ekor/liter (sebanyak 45 ekor/akuarium).
3.8. Analisis Hepatosimatic Index (HSI)
HSI diukur dengan menimbang bobot hati dibandingkan bobot tubuh pada ikan sidat hasil perlakuan terbaik dan kontrol pada penelitian ketiga. Pada akhir penelitian ketiga ikan sampel diambil sebanyak 10 ekor, kemudian dibius dengan minyak cengkeh dan ditimbang bobot tubuhnya. Kemudian ikan dibedah, diambil dan ditimbang bobot hatinya untuk dibandingkan dengan bobot tubuh (penghitungan HSI). Setelah itu dilakukan analisis secara deskriptif.
3.9. Analisis Ekskresi Amoniak (TAN)
Analisis ekskresi amoniak dilakukan dengan mengukur total amonium nitrogen (TAN) pada media pemeliharaan ikan pada penelitian 3.5.c. Pengukuran awal dilakukan setelah ikan dipuasakan selama 1 hari dan media pemeliharaan diisi dengan air baru. Pengukuran akhir dilakukan 24 jam setelah ikan dilakukan pemberian pakan sebanyak 6% dari biomassa ikan. Jumlah amoniak total dihitung untuk setiap satuan biomassa ikan yang dipelihara selama 24 jam. Pengukuran TAN dilakukan menggunakan test kit NH3/NH4+ (Tetra GmbH, Germany).
3.10. Analisis Proksimat Pakan dan Komposisi Tubuh (AOAC 1984)
pemanasan dan kadar air dengan metode pemanasan dalam oven bersuhu 105-110°C (Takeuchi 1988).
3.11. Analisis Tingkat Ekspresi IGF-I
Sampel diambil pada akhir penelitian pada hasil perlakuan terbaik, dan kontrol. Setelah pemberian rElHP melalui pakan dihentikan selama seminggu, sampel diambil pada jam ke-0 (sebelum perlakuan). Setelah sampel jam ke-0 diambil, ikan diberi pakan yang mengandung rElGH (30 mg/kg pakan) sebanyak 6% bobot biomassa. Sampel setelah perlakuan diambil 24 jam setelah pemberian pakan.
RNA total diekstraksi menggunakan isogen (Nippon Gen, Japan). Sintesis DNA komplementer (cDNA) dilakukan menggunakan kit Ready-To-Go-You-Prime First-Strand Beads (GE Healthcare) dengan prosedur sesuai manual. Tingkat ekspresi dianalisis menggunakan metode PCR semi-kuantiatif dengan primer F-eel IGF-I: 5’-GTKGACWCGCTGCARTTYGTGTG-3’, dan R-eel
IGF-I: 5’-CCTTCGRCTSGWGT TCTTCTGATG-3’ yang didesain oleh Laboratorium Reproduksi dan Genetika Organisme Akuatik. Proses polimerisasi dijalankan pada mesin PCR dengan program: proses denaturasi pada suhu 94oC selama 3 menit sebanyak 1 siklus; proses predenaturasi (94oC selama 30 detik) sebanyak 35 siklus, annealing (64oC selama 30 detik) sebanyak 35 siklus, ekstensi (72oC selama 30 detik) sebanyak 35 siklus, dan final ekstensi (72oC selama 3 menit) sebanyak 1 siklus. Hasil PCR dielektroforesis menggunakan agarosa 0,7% untuk melihat ekspresi gen IGF-1. Tingkat ekspresi IGF-1 dianalisis secara semi-kuantitatif, yaitu dengan melakukan perhitungan berdasarkan ketebalan pita IGF-1 dibandingkan dengan pita β-aktin menggunakan program komputer (UN-SCAN-IT gel 6.1.).
3.12. Analisis Statistik
IV. HASIL DAN PEMBAHASAN
4.1. Hasil
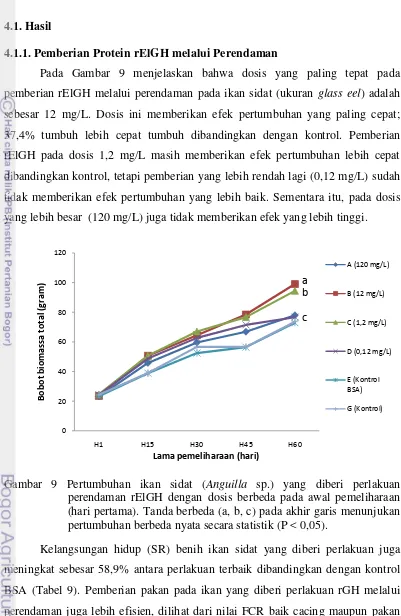
4.1.1. Pemberian Protein rElGH melalui Perendaman
Pada Gambar 9 menjelaskan bahwa dosis yang paling tepat pada pemberian rElGH melalui perendaman pada ikan sidat (ukuran glass eel) adalah sebesar 12 mg/L. Dosis ini memberikan efek pertumbuhan yang paling cepat; 37,4% tumbuh lebih cepat tumbuh dibandingkan dengan kontrol. Pemberian rElGH pada dosis 1,2 mg/L masih memberikan efek pertumbuhan lebih cepat dibandingkan kontrol, tetapi pemberian yang lebih rendah lagi (0,12 mg/L) sudah tidak memberikan efek pertumbuhan yang lebih baik. Sementara itu, pada dosis yang lebih besar (120 mg/L) juga tidak memberikan efek yang lebih tinggi.
Gambar 9 Pertumbuhan ikan sidat (Anguilla sp.) yang diberi perlakuan perendaman rElGH dengan dosis berbeda pada awal pemeliharaan (hari pertama). Tanda berbeda (a, b, c) pada akhir garis menunjukan pertumbuhan berbeda nyata secara statistik (P < 0,05).
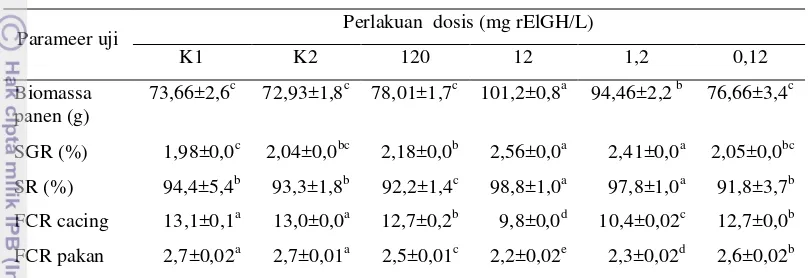
Kelangsungan hidup (SR) benih ikan sidat yang diberi perlakuan juga meningkat sebesar 58,9% antara perlakuan terbaik dibandingkan dengan kontrol BSA (Tabel 9). Pemberian pakan pada ikan yang diberi perlakuan rGH melalui perendaman juga lebih efisien, dilihat dari nilai FCR baik cacing maupun pakan buatan yang lebih rendah (32,6% dan 22,7%) dibandingkan dengan ikan kontrol.
Hal tersebut menunjukkan bahwa pemberian rGH secara langsung dapat meningkatkan produktivitas pada ikan sidat (dilihat dari pertumbuhan dan SR) dan menurunkan biaya produksi (dilihat dari nilai FCR).
Tabel 9 Biomassa, laju pertumbuhan (SGR), sintasan (SR) dan tingkat konversi pakan (FCR) ikan sidat (glass eel) yang diberi perendaman rElGH dan kontrol selama 2 bulan pemeliharaan.
Parameer uji Perlakuan dosis (mg rElGH/L)
K1 K2 120 12 1,2 0,12
Biomassa panen (g)
73,66±2,6c 72,93±1,8c 78,01±1,7c 101,2±0,8a 94,46±2,2 b 76,66±3,4c
SGR (%) 1,98±0,0c 2,04±0,0bc 2,18±0,0b 2,56±0,0a 2,41±0,0a 2,05±0,0bc
SR (%) 94,4±5,4b 93,3±1,8b 92,2±1,4c 98,8±1,0a 97,8±1,0a 91,8±3,7b
FCR cacing 13,1±0,1a 13,0±0,0a 12,7±0,2b 9,8±0,0d 10,4±0,02c 12,7±0,0b
FCR pakan 2,7±0,02a 2,7±0,01a 2,5±0,01c 2,2±0,02e 2,3±0,02d 2,6±0,02b
Keterangan: SGR= Specific Growth Rate; SR= Survival Rate; FCR= Feed Convertion Rate; K1= dosis 0; K2= dosis 0 + Shock salinitas + BSA. Huruf superskrip berbeda pada baris yang sama menunjukan berbeda nyata secara statistik (P < 0,05).
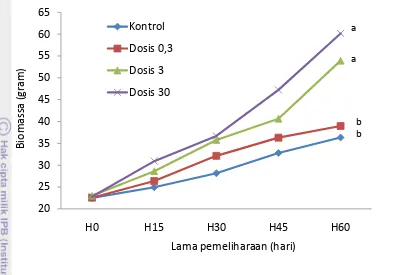
4.1.2.Pemberian Protein rElGH Secara Oral
Gambar 10 Pertumbuhan ikan sidat (Anguilla sp.) yang diberi perlakuan rElGH secara oral dengan dosis berbeda, dan frekuensi pemberian 2 hari/minggu selama 2 bulan pemeliharaan. Dosis pemberian rElGH dalam mg/kg pakan. Tanda a dan b menunjukkan berbeda nyata secara statistik (P< 0,05).
Pemberian pakan pada ikan yang diberi perlakuan rGH melalui perendaman juga lebih efisien, dilihat dari nilai konversi pakan/FCR pakan yang lebih rendah 58,1% jika dibandingkan ikan kontrol (Tabel 10).
Tabel 10 Biomassa, laju pertumbuhan (SGR), sintasan (SR) dan tingkat konversi pakan (FCR) ikan sidat (elver) yang diberi pakan rElGH dan kontrol selama 2 bulan pemeliharaan.
Parameter yang diamati
Perlakuan dosis (mg rElGH/kg pakan)
K (0) 0,3 3 30
Biomassa panen (g) 36,32±0,97b 38,97±2,9b 53,94±4,17a 60,18±1,38a SGR (%) 0,800±0,07b 0,911±0,13b 1,421±0,04a 1,620±0,06a SR (%) 73,33±2,22a 75,56±4,44a 74,81±10,5a 80,00±6,67a FCR pakan 6,12±0,00a 5,57±0,01a 4,22±0,02b 3,87±0,08c
4.1.3. Pemberian rElGH Melalui Perendaman dan Oral
Semua perlakuan baik pemberian melalui perendaman pada glass eel, secara oral melalui pakan (elver), dan kombinasi antara perendaman dan pakan menghasilkan respons pertumbuhan secara signifikan lebih tinggi dibandingkan dengan kontrol (Gambar 11).
Gambar 11 Ikan sidat hasil percobaan perlakuan pemberian rElGH dengan metode pemberian yang berbeda: A) perendaman + pakan; B) pakan saja; C) perendaman saja; D) kontrol.
Respons pertumbuhan tertinggi didapatkan pada perlakuan kombinasi pemberian antara perendaman dan pakan jika dilihat dari biomassa panen (Gambar 12). Perlakuan tersebut menghasilkan biomassa panen 102,9% lebih tinggi jika dibandingkan dengan kontrol (P<0,05). Hal ini juga menunjukkan bahwa pemberian rElGH lebih efektif jika diberikan secara berulang dan dalam dosis yang tepat.
A
B
Gambar 12 Pertumbuhan ikan sidat yang diberi perlakuan rElGH melalui perendaman, pakan, dan kombinasi perendaman dan pakan. Huruf berbeda pada akhir garis menunjukkan berbeda nyata secara statistik (P<0,05).
Pada Tabel 11 memperlihatkan bahwa respons ikan hasil perlakuan rGH yang diberikan melalui perendaman+pakan secara signifikan meningkatkan SGR sebesar 41,6% jika dibandingkan kontrol dan SR sebesar 20,87% jika dibandingkan dengan kontrol. Respons ikan hasil perlakuan rGH via rendam+pakan secara signifikan SGR (41,6%), biomassa panen (102,9%), SR (20,87%), retensi protein (129,7%), dan retensi lemak (720,9%) pada ikan perlakuan lebih tinggi jika dibandingkan kontrol. Sedangkan pada konversi pakan, ikan perlakuan secara signifikan memiliki FCR lebih rendah (lebih hemat) dibandingkan dengan kontrol. FCR ikan perlakuan via rendam+pakan lebih rendah 15,06 % pada pakan cacing dan 55,15% pada pakan buatan dibandingkan dengan kontrol. Pada pemeriksaan ekskresi amoniak (dalam hal ini diukur nilai TAN), ikan perlakuan (via perendaman) secara signifikan lebih rendah (25,11%) jika dibandingkan kontrol (P<0,05). Pada perlakuan lain nilainya tidak berbeda nyata jika dibandingkan dengan kontrol (P>0,05).
H0 H15 H30 H45 H60 H75 H90 H105 H120
Tabel 11 Respons pemberian rElGH dengan metode pemberian berbeda pada benih ikan sidat terhadap laju pertumbuhan (SGR), biomassa panen, sintasan (SR), tingkat konversi pakan (FCR), retensi pakan, dan total amonia nitrogen (TAN)
Parameter yang diamati
Perlakuan dosis (mg rElGH/kg pakan)
Kontrol Via rendam Via pakan Via pakan+ rendam Biomassa panen (g) 36,32±0,97d 51,57±2,09c 60,18±1,38b 73,68±2,07a SGR (%) 1,37±0,01d 1,67±0,01c 1,78±0,01b 1,94±0,01a SR (%) 68,46±3,19b 82,05±2,09a 74,65±6,05ab 82,80±4,16a FCR cacing 12,91±0,09b 11,19±0,36a 12,59±0,63b 11,22±0,38a FCR pakan 7,35±0,19d 6,25±0,11c 5,54±0,03b 4,74±0,04 a Retensi protein (%) 7,78±0,01d 12,13±0,01c 15,49±0,01b 17,87±0,01a Retensi lemak (%) 7,41±0,15d 26,11±0,01c 34,47±0,01b 60,91±0,07a TAN (mg/BW ikan/hari) 2,79±0,07b 2,23±0,25a 2,58±0,19ab 2,38±0,13ab
Keterangan : Huruf superskrip berbeda pada baris sama menunjukkan berbeda nyata (P< 0,05).
Pada pengukuran komposisi tubuh ikan hasil perlakuan (berat kering) secara deskriptif terlihat terjadinya peningkatan kadar lemak dan BETN. Pada kadar abu, protein, dan serat kasar terjadi penurunan jika dibandingkan dengan kontrol.
Tabel 12 Kandungan proksimat ikan sidat ukuran glass eel (awal pemeliharaan), ikan kontrol dan ikan yang telah diberi perlakuan rElGH dengan Pada penelitian ini juga dilakukan penghitungan hepatosomatic index
Gambar 13 Nilai hepatosomatic indeks (HSI) ikan sidat (Anguilla sp.) ikan kontrol dan yang diberi perlakuan rElGH melalui peendaman dan pakan. Ikan dipelihara selama 4 bulan.
Dalam penelitian ini juga diukur level ekspresi IGF-I. Deteksi level ekspresi IGF-I dapat dijadikan penanda untuk melihat efektivitas pemberian rElGH terhadap ikan yang diberikan. Hasil penelitian menunjukkan bahwa level ekspresi IGF-I pada ikan sidat perlakuan meningkat sebesar 21,91% lebih tinggi daripada kontrol pada 24 jam setelah diberi pakan yang mengandung rElGH (Gambar 14).
Gambar 14 Level ekspresi IGF/β-aktin ikan sidat pada jam ke-0 (sebelum diberi rELHP secara oral), dan 24 jam setelah diberi rElGH secara oral.
1,59
Kontrol (0 jam) Perlakuan (0 jam) Kontrol (24 jam) Perlakuan (24 jam)
Tingginya tingkat ekspresi IGF-1 akibat hormon pertumbuhan rekombinan (rElGH) yang diberikan menunjukkan bahwa aktivitas rElGH melibatkan IGF-1. Hasil analisis elektroforesis IGF-1 dapat dilihat pada Lampiran 2.
4.2. Pembahasan
4.2.1. Pertumbuhan (Biomassa Panen dan SGR)
Pemberian pertumbuhan hormon pada ikan sebaiknya diberikan pada dosis yang tepat. Pemberian pada dosis yang rendah tidak akan memberikan efek positif terhadap pertumbuhan, sedangkan pemberian yang terlalu tinggi juga dalam regulasinya akan memberikan efek negatif/negative feedback secara hormonal terhadap ikan (Debnanth 2010). Peningkatan pertumbuhan melalui pemberian rGH pada ikan melalui perendaman juga sudah pernah dilaporkan sebelumnya (Moriyama&Kawauchi 1990; Acosta et al. 2009; Santiesteban 2010). Pada penelitian ini, perendaman rGH dengan dosis yang tepat juga secara signifikan dapat meningkatkan laju pertumbuhan SGR sebesar 29,2% jika dibandingkan kontrol.
Peningkatan pertumbuhan melalui pemberian rGH pada ikan melalui perendaman juga sudah pernah dilaporkan sebelumnya (Moriyama & Kawauchi 1990; Acosta et al. 2009; Santiesteban 2010). Demikian juga pemberian rGH pada ikan secara oral untuk meningkatkan pertumbuhan telah dilaporkan pada beberapa penelitian sebelumnya (Bin et al. 2001; Promdonkoy et al. 2004; Haghighi et al. 2011). Pada penelitian ini rGH diberikan melalui perendaman dan pakan. Hasil penelitian menunjukkan bahwa kombinasi keduanya lebih baik daripada hanya melalui perendaman dan pakan saja.
kDA) (Moriyama&Kawauchi 1990; Carpio et al. 2007). Dengan demikian, diduga bahwa rGH diserap oleh tubuh ikan melalui insang dan lapisan epidermis. Selanjutnya, mekanisme penyerapan rGH pada pemberian secara oral, terjadi pada usus (Habibi et al. 2003).
Penelitian mengenai peran GH dalam mempengaruhi pertumbuhan sudah banyak dilakukan. Perkembangan terakhir diketahui adanya mekanisme secara langsung dan tidak langsung GH dalam memacu pertumbuhan.Mekanisme secara langsung adalah GH akan langsung mempengaruhi pertumbuhan organ (tanpa perantara IGF-1 di dalam hati). Sedangkan mekanisme tidak langsung adalah mekanisme GH dalam mempengaruhi pertumbuhan yang dimediasi oleh IGF-1 dalam hati ikan. Ada beberapa faktor lain yang berperan dalam mekanisme ini, yaitu: reseptor GH (GHr), GH binding proteins (GHBPs), IGF binding proteins
(IGFBPs), dan reseptor IGF. GHr berfungsi dalam menangkap sinyal GH yang disekresikan oleh pituitari, GHBPs berfungsi dalam melindungi dan pengangkutan GH dari pituitari di dalam darah. IGFBPs berfungsi dalam melindungi dan mengangkut IGF-1 di dalam darah menuju ke organ target. Reseptor IGF-1 berfungsi untuk menangkap sinyal IGF-1 dalam organ-organ yang menjadi target (Sanches 1999; Moriyama 2000; Wong et al. 2006; Debnanth 2010). Beberapa organ target yang sudah diteliti memiliki reseptor GH dan IGF, di antaranya pada hati dan otot (Fauconneau et al. 1996 ; Gahr et al. 2008) dan pada tulang (Ohlsson
et al. 2009).
4.2.2. Kelangsungan Hidup
Secara umum kelangsungan hidup benih ikan sidat yang diberi rElGH melalui perendaman, secara oral dan melalui pakan relatif lebih tinggi jika dibandingkan kontrol (P>0,05). Peningkatan kelangsungan hidup/sintasan pada ikan yang diberi perlakuan rGH membuktikan bahwa rGH mampu meningkatkan kekebalan tubuh/imunitas pada ikan dari stres akibat kondisi lingkungan yang tidak sesuai. Beberapa penelitian menunjukkan bahwa GH secara langsung mampu meningkatkan sel-sel yang berkompeten dalam sistem kekebalan tubuh/imunitas seperti limfosit, natural killer cell (NK cell), dan makrophages
(Kelley 1989; Gala 1991). Pada ikan rainbow trout, GH mampu meningkatkan resistensi terhadap infeksi bakteri Vibrio anguillarum melalui peningkatan aktivitas fagositosis (Sakai et al. 1997). GH juga mampu meningkatkan produksi
superoxide anion dalam leukosit dan mitogenesis leukosit (Sakai et al. 1996). Pada ikan gilthead sea bream (Sparus aurata) dan silver sea bream (Sparus sarba) GH mampu menstimulasi lymphopoiesis dan fagositosis (Harris & Bird 2000). Pada ikan gilthead sea bream (Sparus aurata) juga terdeteksi adanya reseptor GH pada limfosit dan monosit yang menunjukkan bahwa GH secara langsung berhubungan dengan sistem imunitas (Calduch-Giner et al. 1995). 4.2.3. Konversi Pakan, Retensi Protein dan Lemak, Komposisi Tubuh
Berdasarkan percobaan pendahuluan, pakan pasta yang digunakan sangat cepat terjadi pencucian yaitu 50-60% per-jam dari berat total yang diberikan (dalam berat kering) jika dimasukan ke dalam air dalam akuarium (kondisi sama dengan percobaan) tanpa pengaruh ikan. Akibat cepatnya pakan masuk ke dalam saluran pencernaan ikan menyebabkan pemberian pakan lebih efisien, karena lebih sedikit pakan yang hilang akibat terjadi pencucian. Hal ini juga terbukti dari peningkatan tingkat konversi pakan, retensi protein dan lemak. Peran hormon pertumbuhan/GH dalam meningkatkan efisiensi pemberian pakan/menurunkan FCR juga dilaporkan pada ikan striped bass, ikan mas (Fu et al. 1998), ikan nila (Rahman et al. 1998), (Farmanfarmaian & Sun 1999), ikan salmon (Cook et al. 2000; Devlin et al. 2004) ikan mud loach (Nam et al. 2004) dan ikan nila (Kobayashi et al. 2007).