1.1 Latar Belakang
Kehidupan manusia di dunia tanpa disadari tidak pernah luput dari keberadaan mikroorganisme yang tidak kasat mata. Mikroorganisme tersebut ada yang bersifat patogen yang memiliki implikasi pada kesehatan. Adanya aktivitas antioksidan dapat mempengaruhi proses tersebut. Jenis antioksidan maupun
antimikroba yang biasa digunakan berasal dari senyawa sintetik. Penggunaan obat sintetik dalam pengobatan kadang menjadi bumerang karena bersifat karsinogenik. Beberapa hasil penelitian telah membuktikan bahwa antioksidan sintetik berpotensi sebagai karsinogen terhadap efek reproduksi dan metabolisme (Hernani dan Raharjo 2005). Zheng et al. (2011) menyatakan saat ini terjadi peningkatan minat yang besar terhadap penemuan antioksidan alami untuk digunakan dalam makanan ataupun material pengobatan subtitusi antioksidan sintetik yang mungkin dapat bersifat karsinogen.
Menurut Harlis (2011), pemilihan bahan-bahan alami untuk pengobatan didasarkan karena setiap tumbuhan mengandung reseptor, struktur kimia dan hormon yang sama dengan manusia. Tumbuhan yang digunakan sebagai obat didominasi tumbuhan darat, sedangkan tumbuhan yang berasal dari laut seperti rumput laut belum banyak mendapat perhatian. Beberapa jenis rumput laut di Indonesia dapat digunakan sebagai obat, akan tetapi saat ini mengalami kendala karena penelitian mengenai pengolahannya belum berkembang, maka pemanfaatannya sampai saat ini sangat terbatas. Salah satu tumbuhan yang dapat
digunakan sebagai tumbuhan obat adalah rumput laut cokelat jenis Sargassum polycystum.
Berdasarkan data dari Food and Agriculture Organization (FAO) (2008), produksi rumput laut dunia pada tahun 2007 sudah mencapai 14,8 juta ton.
dari tahun 2002-2006 yaitu sekitar 62,01% per tahun (dari 223.080 ton meningkat menjadi 1.341.141 ton pada tahun 2006).
Selama ini Indonesia masih merupakan penghasil bahan baku berupa rumput laut kering yang diekspor ke berbagai negara. Oleh karena itu Indonesia memiliki potensi yang dapat dikembangkan dengan meningkatkan pemanfaatan rumput laut salah satunya adalah sebagai penghasil antioksidan dan antimikroba terhadap pertumbuhan mikroba patogen.
S. polycystum merupakan salah satu jenis rumput laut cokelat yang banyak terdapat di perairan Indonesia, khususnya di Taman Nasional Kepulauan Seribu. Rumput laut S. polycystum digunakan secara komersil di Indonesia sebagai sumber penghasil alginat, pemanis agar, bahan obat penyakit kantung kemih, bahan obat penyakit gondok, sayuran, dan kosmetik (Anggadiredja 2006).
Sekarang ini, hanya sedikit yang mempelajari secara detail aktivitas antimikroba dari rumput laut cokelat. Hasil studi Kim dan Lee (2008) dalam
Wei et al. (2011) menunjukkan Sargassum berpotensi memiliki aktivitas
antibakteri. Komponen fenolik yang berperan penting dalam aktivitas antibakteri dan antifungi yang terdapat pada rumput laut cokelat jauh lebih tinggi dibandingkan dengan rumput laut merah dan hijau. Rumput laut ini juga mengandung protein, vitamin C, fenol dan memproduksi beberapa jenis senyawa sekunder seperti florotanin, steroid dan sterol. Penelitian yang dilakukan oleh Thangaraju et al. (2012) menunjukkan aktivitas antibakteri, antikanker dan nano partikel perak yang dapat membunuh mikroba dari ekstrak kasar S. polycystum.
Berdasarkan uraian di atas maka dilakukan penelitian mengenai analisis aktivitas antioksidan dan antimikroba dari rumput laut S. polycystum dengan menggunakan bakteri Escherichia coli, Staphylococcus aureus, Bacillus subtilis karena bakteri ini merupakan bakteri yang paling sering mengkontaminasi makanan (Frazier dan Westhoff 1978) dan masing-masing mewakili bakteri
Gram-negatif dan Gram-positif. Pada penelitian ini dilakukan uji pada khamir
Candida maltosa. Penelitian ini mencakup ekstraksi senyawa S. polycystum
1.2 Tujuan
Tujuan penelitian ini adalah untuk menentukan pengaruh beberapa pelarut terhadap rendemen ekstrak kasar, kandungan fitokimia, total fenol, dan menguji
2 TINJAUAN PUSTAKA
2.1 Deskripsi dan Klasifikasi Sargassum polycystum
Sargassum adalah jenis alga cokelat yang mempunyai talus bercabang
seperti jari dan merupakan tanaman perairan yang berwarna cokelat, berukuran relatif besar, tumbuh dan berkembang pada substrat dasar yang kuat. Bagian atas tanaman menyerupai semak yang berbentuk simetris bilateral atau radial serta
dilengkapi dengan bagian-bagian untuk pertumbuhan (Atmadja et al. 1996). Klasifikasi rumput laut S. polycystum menurut Anggadiredja et al. (2006) adalah sebagai berikut:
Divisi : Phaeophyta Kelas : Phaeophyceae
Ordo : Fucales
Famili : Sargassaceae Genus : Sargassum
Spesies : Sargassum polycystum
Morfologi S. polycystum tidak jauh berbeda dengan ciri-ciri umum Phaeophyta. Talus silindris berduri-duri kecil merapat, holdfast membentuk cakram kecil dan di atasnya terdapat perakaran/stolon yang rimbun berekspansi ke segala arah. Memiliki batang pendek dengan percabangan utama tumbuh rimbun. Mempunyai gelembung udara (bladder) yang umumnya soliter, panjangnya mencapai 7 meter, warna talus umumnya cokelat (Aslan 1991). Bentuk morfologi rumput laut S. polycystum dapat dilihat pada Gambar 1.
Komposisi kimia dan pigmen yang terdapat pada rumput laut cokelat merupakan hasil dari fotosintesis yang jumlahnya sangat bervariasi, tergantung pada jenis, masa perkembangan dan kondisi tempat tumbuh. Senyawa kimia terbanyak yang terdapat pada rumput laut cokelat adalah alginat, dalam jumlah sedikit terdapat pula laminaran, fukoidon, selulosa, manitol, dan senyawa bioaktif lainnya (Yunizal 2004).
Pemanfaatan Sargassum selama ini adalah sebagai sumber alginat. Pada jaringan talus, asam alginat mengisi ruangan antar sel sehingga memperkokoh saluran jaringan tersebut. Alginat dapat diekstrak dari alga cokelat dengan larutan alkali (Glicksman 1983). S. polycystum mengandung alginat, vitamin C, vitamin E (α-tokoferol), mineral, karotenoid, klorofil, florotanin, polisakarida sulfat, asam lemak, dan asam amino. Tumbuhan ini memiliki potensi dalam penyembuhan penyakit kantung kemih, gondok, kolesterol, digunakan sebagai kosmetik, sumber alginat, dan antioksidan (Matanjun 2008).
2.2 Ekstraksi Senyawa Aktif
Ekstraksi merupakan metode pemisahan komponen-komponen tertentu antara dua atau lebih fase cairan (Keulemans dan Walraven 1965). Ekstraksi didefinisikan sebagai proses penarikan komponen yang diinginkan dari suatu bahan dengan cara pemisahan satu atau lebih komponen dari bahan tersebut. Faktor-faktor yang berpengaruh terhadap proses ekstraksi adalah lama ekstraksi, suhu, dan jenis pelarut yang digunakan harus memperhatikan daya melarutkan, titik didih, sifat toksik, mudah tidaknya terbakar, dan sifat korosif terhadap peralatan ekstraksi (Khopkar 2003).
ektraksi ada dua yaitu ekstraksi sederhana dan ekstraksi khusus (Harborne 1987). Ekstraksi sederhana terdiri atas:
a) Maserasi, yaitu metode ekstraksi dengan cara merendam sampel dalam pelarut dengan atau tanpa pengadukan;
b) Perkolasi, yaitu metode ekstraksi secara berkesinambungan;
c) Reperkolasi, yaitu perkolasi dimana hasil perkolasi digunakan untuk melarutkan sampel di dalam perkulator sampai senyawa kimianya terlarut;
d) Diskolasi, yaitu perkolasi dengan penambahan tekanan udara. Ekstraksi khusus terdiri atas:
a) Sokletasi, yaitu metode ekstraksi secara berkesinambungan untuk melarutkan sampel kering dengan menggunakan pelarut bervariasi;
b) Arus balik, yaitu metode ekstraksi secara berkesinambungan dimana sampel dan pelarut saling bertemu melalui gerakan aliran yang berlawanan;
c) Ultrasonik, yaitu metode ekstraksi dengan menggunakan alat yang menghasilkan frekuensi bunyi atau getaran antara 25-100 KHz.
Sifat penting yang harus diperhatikan dalam ekstraksi adalah kepolaran senyawa dilihat dari gugus polarnya. Suatu senyawa menunjukkan kelarutan yang berbeda-beda pada pelarut yang berbeda. Bahan dan senyawa kimia akan mudah larut pada pelarut yang relatif sama kepolarannya. Semakin besar konstanta dielektrik, maka pelarut tersebut semakin polar. Beberapa pelarut organik dan sifat fisiknya dapat dilihat pada Tabel 1.
Tabel 1 Pelarut organik dan sifat fisiknya
2.3 Fitokimia
Istilah fitokimia (dari kata “phyto” = tanaman dan “chemical” = zat kimia) berarti kimia tanaman. Fitokimia menguraikan aspek kimia suatu tanaman. Kajian fitokimia meliputi uraian tentang isolasi dan konstitusi senyawa kimia dalam tanaman, perbandingan struktur senyawa kimia tanaman dan perbandingan komposisi senyawa kimia dari bermacam-macam jenis tanaman atau penelitian untuk pengembangan senyawa kimia dalam tanaman (Sirait 2007).
2.3.1Alkaloid dari rumput laut
Alkaloid adalah senyawa kimia tanaman hasil metabolit sekunder yang terbentuk berdasarkan prinsip pembentukan campuran (Sirait 2007). Alkaloid merupakan golongan zat tumbuhan sekunder yang terbesar. Umumnya, alkaloid mencakup senyawa bersifat basa yang mengandung satu atau lebih atom nitrogen, biasanya dalam gabungan, sebagai bagian dari sistem siklik. Alkaloid biasanya tidak berwarna, kebanyakan berbentuk kristal tetapi hanya sedikit yang berupa cairan (misalnya nikotin) pada suhu kamar (Harborne 1987).
Beberapa contoh senyawa alkaloid yang telah umum dikenal dalam bidang farmakologi, diantaranya adalah nikotin (stimulan pada syaraf otonom), morfin (analgesik), kodein (analgesik dan obat batuk), atropin (obat tetes mata), skopolamin (sedatif/obat penenang menjelang operasi), kokain (analgesik), piperin (antifeedant), quinin (obat malaria), vinkristin (obat kanker), ergotamin (analgesik untuk migrain), reserpin (pengobatan simptomatis disfungsi ereksi), mitraginin (analgesik dan antitusif), serta vinblastin (antineoplastik dan obat kanker) (Sudarmadji et al. 2007). Kaewsritong et al. (2007) dalam Kantachumpoo dan Chirapart (2010) melaporkan ekstrak dari Padina australis, S. polycystum dan Turbinaria conoides yang menggunakan pelarut metanol, etanol, diklorometana dan eter mengandung terpenoid, flavonoid dan alkaloid.
2.3.2 Triterpenoid/steroid dari rumput laut
Triterpenoid adalah senyawa senyawa alam yang terbentuk dengan proses biosintesis dan terdistribusi secara luas dalam dunia tumbuhan dan hewan. Struktur terpenoid dibangun oleh molekul isoprene dengan kerangka terpenoid
bumi, eter atau kloroform dan dapat dipisahkan secara kromatografi pada silika gel atau alumina memakai pelarut tersebut. Terpenoid terdiri atas beberapa macam senyawa yaitu komponen minyak atsiri, diterpenoid, giberalin, triterpenoidem sterid dan karotenoid (Lenny 2006)
Sterol adalah triterpena yang kerangka dasarnya sistem cincin siklopentana perhidrofenantrena. Tiga senyawa yang biasa disebut fitosterol mungkin terdapat pada setiap tumbuhan tingkat tinggi yaitu sitosterol, stigmasterol dan kampesterol.
Sterol tertentu hanya terdapat dalam tumbuhan tingkat rendah, contohnya ergosterol yang terdapat dalam khamir dan sejumlah fungi. Sterol lain terutama terdapat dalam tumbuhan tingkat rendah tetapi kadang-kadang terdapat dalam tumbuhan tingkat tinggi, misalnya fukosterol, yaitu steroid utama pada alga cokelat dan juga terdeteksi pada kelapa (Harborne 1987).
Hasil penelitian Swantara et al. (2009) menyatakan bahwa senyawa streroid dan ester ditemukan pada ekstrak Sargassum ringgoldianum. Senyawa steroid seperti 3β-bromo-kolest-5-ena kemungkinan bersifat antiradikal bebas karena senyawa tersebut mengandung gugus bromo dan ikatan rangkap.
2.3.3 Flavonoid dari rumput laut
Flavonoid umumnya terdapat pada tumbuhan sebagai glikosida. Gugusan gula bersenyawa pada satu atau lebih grup hidroksil fenolik. Flavonoid terdapat pada seluruh bagian tanaman, termasuk pada buah, tepung sari dan akar. Flavonoid diklasifikasikan menjadi flavon, flavonol, flavanon, flavanonol, isoflavon, calkon, dihidrokalkon, auron, antosianidin, katekin dan flavan-3,4-diol (Sirait 2007).
Flavonoid terutama berupa senyawa yang larut dalam air. Flavonoid dapat diekstraksi dengan etanol 70%. Flavonoid berupa senyawa fenol, karena itu warnanya berubah bila ditambah basa atau amonia sehingga mudah dideteksi pada kromatogram atau dalam larutan. Flavonoid mengandung sistem aromatik yang
terkonjugasi dan karena itu menunjukkan pita serapan kuat pada daerah spektrum Ultra Violet (UV) dan spektrum tampak. Terbentuknya warna merah, kuning atau jingga di lapisan amil alkohol pada uji fitokimia menunjukkan adanya flavonoid (Harborne 1987). Hasil uji Prajitno (2006) menunjukkan bahwa rumput laut
epigallocathecin, cathecol, hesperidia, miricetin dan morin. Epigallocathecin merupakan komponen penting yang digunakan sebagai aktivitas antioksidan.
2.3.4 Saponin dari rumput laut
Saponin merupakan glikosida yang apabila dihidrolisis secara sempurna akan menghasilkan gula dan satu fraksi non-gula yang disebut sapogenin atau genin. Gula-gula yang terdapat dalam saponin jumlah dan jenisnya bervariasi, diantaranya glukosa, galaktosa, arabinosa, ramnosa, serta asam galakturonat dan
glukoronat. Sapogenin sendiri dapat dibedakan menjadi dua jenis, yaitu sapogenin triterpenik dan steroidik (Muchtadi 1989).
Saponin merupakan senyawa aktif permukaan dan bersifat seperti sabun. Saponin dapat dideteksi berdasarkan kemampuannya membentuk busa dan menghemolisis sel darah. Dari segi ekonomi, saponin penting karena kadang-kadang menimbulkan keracunan pada ternak (misalnya saponin alfalfa, Medicago sativa) atau karena rasanya yang manis (misalnya glisirizin dari akar manis, Glycyrrhiza glabra) (Harborne 1987). Sebagian besar saponin bereaksi netral (larut dalam air), beberapa ada yang bereaksi asam (sukar larut dalam air). Saponin dapat membentuk senyawa kompleks dengan kolesterol. Saponin bersifat toksik terhadap ikan dan binatang berdarah dingin lainnya. Hal inilah yang menyebabkan saponin banyak dimanfaatkan sebagai racun ikan. Saponin yang beracun disebut sapotoksin (Sirait 2007).
Saponin menyebabkan stimulasi pada jaringan tertentu misalnya, pada epitel hidung, bronkus, ginjal dan sebagainya. Stimulasi pada ginjal diperkirakan menimbulkan efek diuretika. Saponin dapat mempertinggi resorpsi berbagai zat oleh aktivitas permukaan. Saponin juga dapat meregangkan partikel tak larut dan
menjadikan partikel tersebut tersebar dan terbagi halus dalam larutan (Sirait 2007). Hasil penelitian Sahayaraj dan Kalidas (2011) menunjukkan bahwa
analisis fitokimia yang dilakukan pada rumput laut Padina pavonica (Phaeophyta)
dengan ekstrak kloroform dan benzena ditemukan senyawa steroid, saponin dan komponen fenol.
2.3.5Fenol hidrokuinon dari rumput laut
atau glikosil. Komponen fenolat bersifat larut air selama komponen tersebut berikatan dengan gula membentuk glikosida, dan biasanya terdapat dalam vakuola sel. Flavonoid merupakan kelompok yang terbesar di antara komponen fenolat alami yang strukturnya telah diketahui, tetapi fenol monosiklik sederhana, fenilpropanoid dan fenolat kuinon terdapat dalam jumlah sedikit. Kuinon dapat dibagi menjadi empat kelompok, yaitu benzokuinon, naftakuinon, antrakuinon, dan isoprenoid kuinon. Tiga kelompok pertama umumnya terhidrolisis dan
memiliki sifat fenol, sedangkan isoprenoid kuinon terdapat pada respirasi seluler (ubikuinon) dan fotosintesis (plastokuinon) (Harborne 1987).
Menurut Lincoln et al. (1991) dalam Smit (2004), banyak ditemukan respon kimia berupa aktivitas antioksidan dari makroalga. Beberapa zat yang penting pada reaksi ini adalah komponen halogen seperti alkali dan alkena, alkohol, aldehida, hidrokuinon, dan keton.
2.3.6Tanin dari rumput laut
Tanin adalah polifenol alami yang banyak digunakan sebagai bahan perekat tipe eksterior, yang terutama terdapat pada bagian kulit kayu. Tanin dapat dijumpai pada hampir semua jenis tumbuhan hijau di seluruh dunia baik tumbuhan tingkat tinggi maupun tingkat rendah dengan kadar dan kualitas yang berbeda-beda. Senyawa ini memiliki sifat antara lain dapat larut dalam air atau alkohol karena tanin banyak mengandung fenol yang memiliki gugus OH, dapat mengikat logam berat, serta adanya zat yang bersifat antirayap dan jamur. Tanin yang terdapat pada kulit kayu dan kayu dapat berfungsi sebagai penghambat kerusakan akibat serangan serangga dan jamur, karena memiliki sifat antiseptik (Carter et al. 1978 dalam Shut 2002). Menurut Cox (2010), florotanin merupakan komponen tanin yang hanya dapat ditemukan pada alga laut. Florotanin diekstrak dari alga cokelat yang memiliki aktivitas antioksidan tinggi yang mungkin berhubungan dengan molekul skeletonnya.
2.4 Senyawa Antioksidan
yang diproduksi oleh tubuh sendiri disebut sebagai antioksidan primer, secara alami tubuh mampu menghasilkan antioksidan sendiri, tetapi kemampuan inipun ada batasnya. Selain bertambahnya usia, kemampuan tubuh untuk memproduksi antioksidan alami pun akan semakin berkurang. Hal inilah yang menyebabkan stres oksidatif, yaitu suatu keadaan dimana jumlah radikal bebas melebihi kapasitas kemampuan netralisasi antioksidan (Rosalina 2009).
Antioksidan eksternal tidak dihasilkan oleh tubuh tetapi berasal dari
makanan seperti vitamin A, beta karoten, vitamin C, vitamin E, selenium, flavonoid, dan lain-lain. Antioksidan yang berasal dari makanan atau dari luar tubuh disebut juga antioksidan sekunder. Antioksidan internal bekerja dengan cara menangkal terbentuknya radikal bebas, sedangkan antioksidan eksternal bekerja dengan cara meredam atau menetralisir antioksidan yang sudah terbentuk (Rosalina 2009).
Tamat et al. (2007) menjelaskan antioksidan dapat berbentuk gizi seperti vitamin E dan C, non gizi (pigmen karoten, likopen, flavonoid dan klorofil), dan enzim (glutation peroksidase, koenzim Q10 atau ubiquinon). Antioksidan dapat dibagi menjadi tiga golongan, yaitu antioksidan preventif (enzim superoksidadismutase, katalase dan glutation peroksidase), antioksidan primer (vitamin A, fenolat, favonoid, katekin, kuersetin) dan antioksidan komplementer (vitamin C, β-karoten dan retinoid).
Nugroho et al. (2006) menyatakan rumput laut mengandung komponen unik yang kuat berupa fukoidan, alginat dan polifenol. Antioksidan klorofil pada ganggang laut hijau dapat berfungsi sebagai antioksidan. Zat ini membantu membersihkan tubuh dari reaksi radikal bebas yang sangat berbahaya bagi tubuh.
Hasil penelitian Swantara et al. (2009) menunjukkan adanya aktivitas antioksidan yang ditemukan pada ekstrak dua spesies rumput laut yaitu Exophylum wentii dan Gracillaria coronopifolia. Penelitian Kuda et al. (2005) menunjukkan ekstrak tiga alga cokelat yaitu Scytosiphon lomentoria,
Papenfussilla kumoro dan Nemacystus decipiens serta satu spesies ganggang
2.5 Uji Aktivitas Antioksidan dengan Metode DPPH
Metode uji 1,1-diphenyl-2-picrylhydrazil (DPPH) merupakan salah satu metode yang paling banyak digunakan untuk memperkirakan efisiensi kinerja dari substansi yang berperan sebagai antioksidan. Metode ini merupakan salah satu metode yang sederhana dengan menggunakan DPPH sebagai senyawa pendeteksi. Struktur kimia DPPH dalam bentuk radikal bebas (1) dan bentuk kompleks non radikal (2) dapat dilihat pada Gambar 2.
Gambar 2. Struktur kimia radikal bebas (1) dan bentuk non radikal (2) DPPH (Sumber: Molyneux 2004)
Molyneux (2004) menyatakan bahwa senyawa DPPH merupakan senyawa radikal bebas yang bersifat stabil sehingga dapat bereaksi dengan atom hidrogen yang berasal dari suatu antioksidan membentuk DPPH tereduksi. Ada tiga tahap reaksi antara DPPH dengan zat antioksidan, yang dapat dicontohkan dengan reaksi antara DPPH dengan senyawa monofenolat (antioksidan). Tahap pertama meliputi delokalisasi satu elektron pada gugus yang tersubstitusi dari senyawa tersebut, kemudian memberikan atom hidrogen untuk mereduksi DPPH. Tahap berikutnya meliputi dimerisasi antara dua radikal fenoksil, yang akan mentransfer radikal hidrogen dan akan bereaksi kembali dengan radikal DPPH. Tahap terakhir adalah pembentukan kompleks antara radikal hidroksil dengan radikal DPPH. Pembentukan dimer maupun kompleks antara zat antioksidan dengan DPPH tergantung pada kestabilan dan potensial reaksi dari struktur molekulnya. Ketika DPPH menerima elektron atau radikal hidrogen, maka akan terbentuk molekul diamagnetik yang stabil. Interaksi antioksidan dengan DPPH baik secara transfer
2.6 Senyawa Antimikroba
Antimikroba adalah senyawa kimia yang dapat membunuh atau menghambat pertumbuhan mikroorganisme. Antimikroba sebagai substansi dapat berupa senyawa kimia sintetik atau produk alami (Brock dan Madigan 2003). Senyawa antibakteri didefinisikan sebagai senyawa biologis atau kimia yang dapat membunuh atau menghambat pertumbuhan dan aktivitas bakteri. Berdasarkan aktivitasnya, senyawa antibakteri dapat dibedakan atas senyawa yang
bersifat bakterisidal (membunuh bakteri) seperti pinisilin, basitrasin, neomisin dan senyawa yang bersifat bakteristatik (menghambat pertumbuhan bakteri) seperti tetrasiklin dan kloramfenikol (Pelezar dan Chan 1986). Senyawa antibakteri dalam menghambat pertumbuhan bakteri dipengaruhi oleh berbagai faktor, antara lain: konsentrasi zat antibakteri, waktu penyimpanan, suhu lingkungan, sifat-sifat mikroba seperti jenis, umur, konsentrasi, dan keadaan mikroba (Frazier dan Westhoff 1978).
Senyawa antibakteri yang terkandung dalam berbagai ekstrak tanaman diketahui dapat menghambat bakteri patogen maupun perusak pangan (Frazier dan Westhoff 1978). Senyawa antibakteri yang berasal dari tanaman, sebagian besar merupakan metabolit sekunder tanaman, terutama golongan fenolik dan terpen dalam minyak atsiri dan alkaloid. Beberapa senyawa antibakteri alami yang berasal dari tanaman diantaranya adalah fitoaleksin, asam organik, minyak
esensial (atsiri), fenolik, dan beberapa kelompok pigmen atau senyawa sejenis (Herbert 1995).
Mekanisme senyawa antimikroba dalam menghambat pertumbuhan mikroba dibagi menjadi beberapa cara, yaitu (1) mengubah permeabilitas membran sehingga dengan rusaknya membran akan menyebabkan terhambatnya pertumbuhan sel atau matinya sel, (2) menyebabkan terjadinya denaturasi protein, (3) menghambat kerja enzim di dalam sel sehingga mengakibatkan terganggunya
metabolisme/matinya sel (Davidson dan Branen 1993 dalam Madigan et al. 2004), (4) merusak dinding sel mikroorganisme sehingga menyebabkan terjadinya lisis (Madigan et al. 2004).
Antimikroba alami umumnya berasal dari tanaman, hewan, maupun
Zat yang digunakan sebagai antibakteri harus mempunyai beberapa kriteria antara lain tidak bersifat racun, ekonomis, tidak merubah rasa, dan aroma makanan jika digunakan dalam bahan pangan, tidak mengalami penurunan aktivitas selama proses dan penyimpanan, tidak menyebabkan galur resisten dan sebaiknya membunuh dibandingkan menghambat pertumbuhan bakteri (Frazier dan Westhoff 1988).
Choudhury et al. (2005) dalam Yunus et al. (2009) menyatakan bahwa alga laut memiliki potensi sebagai sumber antibakteri. Salah satunya yang dilaporkan yaitu ekstrak metanol dari 56 rumput laut yang berasal dari kelas
Chlorophyta (alga hijau), Phaeophyta (alga cokelat) dan Rhodophyta (alga merah). Dari ketiga kelas rumput laut tersebut, rumput laut cokelat memiliki
aktivitas antibakteri tertinggi.
2.7 Mikroorganisme Patogen 2.7.1 Escherichia coli
Organisme ini tersebar luas di alam biasanya lazim terdapat dalam pencernaan manusia dan hewan. Spesies E. coli tidak dapat mengurangi asam sitrat dan garam asam sitrat sebagai sumber karbon tunggal dan tidak menghasilkan pigmen, tetapi kadang-kadang menghasilkan pigmen berwarna kuning. E. coli ditularkan bersama air atau makanan yang terkontaminasi oleh feses. E. coli berbentuk batang, tebal 0,5 µ m, panjang antara 1,0-3,0 µm, bervariasi dari bentuk koloid sampai berbentuk seperti filamen yang panjang, tidak berbentuk spora, motil dan filamen perithin beberapa galur tidak memiliki flagella, bersifat Gram-negatif (Merchant dan Parker 1961 dalam Wasitaningrum 2009).
Sebagian besar E. coli menyebabkan infeksi saluran kencing dan keracunan darah (Fardiaz 1989).
2.7.2 Staphylococcus aureus
Staphylococcus merupakan bakteri Gram-positif berbentuk bulat, biasanya tersusun dalam bentuk bergerombol yang tidak teratur seperti anggur. Staphylococcus bertambah dengan cepat pada beberapa tipe media dengan aktif
melakukan metabolisme, fermentasi karbohidrat dan menghasilkan
bermacam-macam pigmen dari warna putih higga kuning gelap. Staphylococcus
cepat menjadi resisten terhadap beberapa antimikroba (Jawetz et al. 1996). S. aureus umumnya sensitif terhadap antibiotik β-laktam, tetrasiklin, dan
kloramfenikol, tetapi resisten terhadap polimiksin (Pelczar dan Chan 1986).
S. aureus menghasilkan koagulase, dijumpai pada selaput hidung, kulit, kantung rambut, dapat menyebabkan keracunan makanan, serta komplikasi pada influenza. Keracunan makanan yang umum terjadi karena termakannya toksin yang dihasilkan oleh galur-galur toksigenik S. aureus yang tumbuh pada makanan tercemar. Pada umumnya gejala-gejala mual, pusing, muntah, dan diare muncul 2 sampai 6 jam setelah makan makanan tercemar itu. Tumbuh dengan cepat pada temperatur 20-35 o
2.7.3 Bacillus subtilis
C dengan berbagai media bakteriologi di bawah suasana aerobik dan mikrofilik. Koloni pada media padat berbentuk bulat, lambat dan mengkilat (Jawetz et al. 1996).
B. subtilis mempunyai ciri-ciri antara lain berbentuk batang, panjang 4-5 µm, lebar 1-1.25 µ m, bersifat aerob dan memiliki flagel, termasuk golongan
bakteri Gram-positif dan memiliki endospora. Genus Bacillus merupakan bakteri basil Gram-positif pembentuk spora, bersifat aerob dan merupakan
mikroorganisme saprofit yang lazim berada dalam tanah, air, udara dan tumbuh-tumbuhan seperti B. cereus dan B. subtilis yang menghasilkan
enterotoksin yang menyebabkan keracunan makanan (Greenwood et al. 1992).
B. subtilis memproduksi enzim dan antibiotik dalam respon untuk
hidup untuk mencari sumber energi makromolekuler saat nutrisi mulai berkurang. Sebagian besar enzim digunakan secara luas dalam pembuatan makanan, masakan, dan industri detergen biologis. Enzim yang memiliki manfaat bagi manusia seperti “thermostability”, mengaktifkan jangkauan pH, aktivitas pada detergen dan mengoksidasi lingkungan, dapat diidentifikasi oleh B. subtilis. Peranan B. subtilis pada industri enzim adalah dapat merefraktor analisis genetik dan itulah alasan B. subtilis dipilih untuk dipelajari mekanisme produksi enzimnya. Selain itu, kode genetik yang heterogen dengan materi yang dapat diklon-kan ke dalam B. subtilis yang dapat menghasilkan manipulasi untuk gandum berkualitas tinggi (Greenwood et al. 1992).
2.7.4 Candida maltosa
Candida telah dikenal dan dipelajari sejak abad ke 18 dan penyakit yang disebabkannya dihubungkan dengan higiene yang tidak baik. Di dalam perkembangannya genus Candida telah dikenal lebih dari 32 spesies, tetapi hanya 7 diantaranya yang terdapat pada manusia. Spesies Candida dapat dibedakan berdasarkan kemampuan fermentasi dan asimilasi terhadap larutan glukosa, maltosa, sukrosa, galaktosa, dan laktosa. Candida dapat meragikan glukosa dan maltosa, menghasilkan asam dan gas, asam dari sukrosa. Kadang peragian karbohidrat ini bersama dengan sifat koloni dan morfologi (Dumilah 1982).
Candida merupakan suatu ragi lonjong, bertunas yang menghasilkan
pseudomiselium baik dalam biakan maupun dalam jaringan eksudat.
Candida dapat menyebabkan penyakit sistemik progresif pada penderita yang
sistem imunnya tertekan. Selain itu Candida juga dapat menimbulkan invasi dalam aliran darah, tromboflebitis, endokarditis, infeksi mata, dan organ lain bila masuk ke dalam tubuh secara intravena (Jawetz et al. 1992). Candida secara mikroskopik berbentuk bulat, lonjong atau bulat lonjong, Gram-positif, dengan ukuran 2-5 µ x 5-28.5 µ koloni pada medium padat sedikit menimbul dari
permukaan media, dengan permukaan halus, licin atau berlipat-lipat, berwarna putih kekuning-kuningan dan berbau ragi (Dumilah 1982).
pseudohifa yang sebenarnya adalah rangkaian Blastospora yang dapat bercabang-cabang. Berdasarkan bentuk tersebut maka dikatakan bahwa Candida
menyerupai ragi atau yeast like, untuk membedakan dengan jamur yang hanya membentuk Blastospora (Jawetz et al 1992).
2.8 Uji Aktivitas Antimikroba
Uji antimikroba adalah uji kepekaan mikroba terhadap obat atau bahan. Aktivitas antimikroba ditentukan dengan mengukur diameter hambatannya, yaitu daerah bening yang terbentuk di sekitar kertas cakram. Ketentuan kekuatan
senyawa antibakteri adalah sebagai berikut: bila memiliki daerah hambatan 20 mm atau lebih berarti memiliki kekuatan antibakteri sangat kuat; bila daerah
hambatan yang dimilikinya berkisar 10-20 mm berarti kuat; bila daerah hambatan 5-10 mm berarti sedang; bila daerah hambatannya 5 mm atau kurang dari 5 mm maka di katakan lemah (Davis dan Stout 1971). Terdapat tiga macam metode uji
yang dapat digunakan untuk menguji aktivitas antibakteri menurut Zubaidan (2005) dan Istri (1999) dalam Maretania (2006) yaitu:
1. Metode penyebaran
• Metode kertas cakram yaitu meletakkan cakram kertas yang telah
direndam larutan uji di atas media padat yang telah diinokulasi dengan bakteri kemudian diinkubasi. Pertumbuhan bakteri diamati dengan melihat ada tidaknya zona hambat di sekeliling cakram.
• Metode silinder yaitu meletakkan beberapa silinder yang terbuat dari gelas
atau besi tahan karat di atas media agar yang telah diinokulasi dengan bakteri. Tiap silinder diisi dengan larutan yang akan diuji dan diinkubasi. Pertumbuhan diamati dengan melihat ada tidaknya zona hambat di sekeliling silinder.
• Metode sumur yaitu membuat sumur pada agar padat yang telah
diinokulasi pada bakteri dan diisi dengan larutan uji. Pertumbuhan bakteri diamati dengan terbentuknya zona hambat di sekeliling sumur.
2. Metode pengenceran
• Metode pengenceran tabung yaitu pengenceran zat mikroba dimasukkan
dilakukan pemindahan dari tabung reaksi ke dalam tabung-tabung berisi media steril yang kemudian diinkubasi dan diamati penghambatan pertumbuhan.
• Metode pengenceran agar yaitu pengenceran zat mikroba dan dimasukkan
ke dalam agar dengan konsentrasi bahan uji yang berbeda yang kemudian diinkubasi dan diamati penghambatan pertumbuhannya.
3. Metode bioautografi
• Metode bioautografi yaitu metode untuk mengetahui senyawa baru atau
senyawa yang belum diketahui aktivitas mikrobanya dengan menggunakan prinsip kerja difusi senyawa yang terpisah dengan Kromatografi Lapis Tipis (KLT) dan atau Kromatografi Kertas (KK).
• Metode bioautografi langsung yaitu zona hambatan diamati langsung pada
lempeng kromatografi yang sebelumnya disemprot dengan suatu suspensi mikroba dalam media agar cair dan diinkubasi pada temperatur dan waktu yang sesuai.
• Metode bioautografi kontak yaitu mencelupkan
Middelbeek dan Drijver de Haas (1992) dalam Setyaningsih et al. (2005) menjelaskan bahwa efektivitas senyawa antimikroba dapat dilihat pada pengujian antimikroba dengan menentukan konsentrasi terkecil agar pertumbuhan organisme uji dapat terhambat. Pengujian antimikroba dengan menentukan konsentrasi terkecil dilakukan dengan metode Minimum Inhibitory Concentration
(MIC). Metode MIC terdiri dari dua teknik, yaitu teknik tabung pengenceran dan teknik difusi agar.
lempeng kromatografi
ke dalam media dan media dibiarkan mengeras. Lempeng kromatografi
3 METODOLOGI
3.1 Waktu dan Tempat
Penelitian dilaksanakan mulai Maret 2012 sampai Juli 2012. Proses preparasi sampel dan ekstraksi (maserasi) dilakukan di Laboratorium Karakteristik Bahan Baku Hasil Perairan. Proses evaporasi ekstrak dan penghitungan rendemen dilakukan di Laboratorium Kimia Organik, Departemen
Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam. Uji fitokimia dan analisis antimikroba dilakukan di Laboratorium Mikrobiologi Hasil Perairan, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Uji total fenol dan antioksidan dilakukan di Laboratorium Biofarmaka (LUB) IPB.
3.2 Bahan dan Alat
Bahan utama yang dibutuhkan untuk penelitian ini adalah alga cokelat jenis S. polycystum. Bahan-bahan yang dibutuhkan untuk ekstraksi S. polycystum meliputi metanol, etil asetat dan n-heksana. Bahan yang digunakan untuk uji
fitokimia meliputi pereaksi Meyer, pereaksi Wagner, pereaksi Dragendorff (uji alkaloid), kloroform, anhidra asetat, asam sulfat pekat (uji steroid), serbuk
magnesium, amil alkohol (uji flavonoid), air panas, larutan HCl 2 N (uji saponin) dan etanol 70%, larutan FeCl3 5% (uji hidrokuinon), FeCl3 10% (uji tanin). Bahan yang digunakan untuk uji total fenol adalah etanol, akuades, Na2CO3
Alat-alat yang diperlukan dalam penelitian ini meliputi pisau, sudip, cawan porselen, timbangan digital, gegep, kompor listrik, labu Erlenmeyer, pipet mikro, pipet tetes, gelas ukur, gelas piala, tabung reaksi dan autoklaf, rotary 5%, reagen Folin-Ciocalteu 50% dan asam galat sebagai standar. Bahan yang digunakan untuk uji antioksidan meliputi ekstrak kasar metanol, etil asetat, n-heksana, Kristal 1,1-difenil-2-pikrilhidrazil (DPPH) dan antioksidan sintetik (vitamin C) sebagai pembanding. Bahan yang digunakan untuk analisis antimikroba adalah bakteri dan khamir uji (Escherichia coli, Staphylococcus aureus, Bacillus subtilis,
dan Candida maltosa), akuades, kloramfenikol, media Trypticase Soy Agar
vacuum evaporator (RE-MH3), multimeter, spektrofotometer UV-Visible (Shimadzu), refrigerator, vortex.
3.3 Metode Penelitian
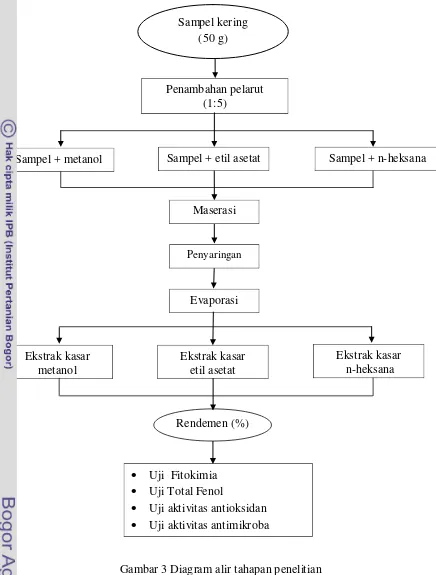
3.3.1 Pengambilan, preparasi dan ekstraksi bahan baku
Pengambilan sampel S. polycystum dilakukan pada tanggal 03 Maret 2012, di Pulau Pramuka, Taman Nasional Kepulauan Seribu yang kemudian dikeringkan. Lokasi ini dipilih karena kondisi perairan laut yang relatif lebih bersih, sehingga S. polycystum tumbuh melimpah. Pengambilan sampel ini dilakukan dengan langsung memetik S. polycystum dari substratnya secara mekanik menggunakan tangan. S. polycystum diisi ke dalam wadah berisi air laut yang kemudian ditransportasikan ke tempat penelitian untuk selanjutnya dikeringkan dengan sinar matahari selama tiga hari dan diekstraksi. Sebelum diekstraksi, sampel kering terlebih dahulu dibersihkan dari komponen-komponen
pengotor seperti pasir, garam, kayu, ranting, dan rumput laut jenis lain.
Tahap selanjutnya adalah ekstraksi bahan aktif. Metode ekstraksi yang
digunakan adalah metode ekstraksi tunggal yang mengacu pada (Quinn 1988 dalam Darusman et al. 1995). Pelarut yang digunakan dalam
penelitian ini yaitu pelarut polar (metanol), semi polar (etil asetat) dan non polar (n-heksana).
Sampel yang telah dihancurkan ditimbang sebanyak 50 gram dan dimaserasi dengan pelarut polar (metanol), semipolar (etil asetat) dan nonpolar (n-heksana) sebanyak 250 mL selama 24 jam. Hasil maserasi yang berupa larutan kemudian disaring dengan kertas saring sehingga didapat filtrat dan residu. Filtrat yang diperoleh dievaporasi hingga pelarut memisah dengan ekstrak menggunakan
rotary vacuum evaporator pada suhu kurang dari 50oC. Diagram alir tahap
Gambar 3 Diagram alir tahapan penelitian
3.3.2 Uji fitokimia
Uji fitokimia dilakukan untuk mengetahui ada tidaknya komponen bioaktif yang terdapat pada ekstrak kasar S. polycystum. Uji fitokimia yang dilakukan
• Uji Fitokimia
• Uji Total Fenol
• Uji aktivitas antioksidan
• Uji aktivitas antimikroba Rendemen (%)
Sampel kering (50 g)
Penambahan pelarut (1:5)
Sampel + n-heksana Sampel + etil asetat
Sampel + metanol
Maserasi
Penyaringan
Evaporasi
Ekstrak kasar n-heksana Ekstrak kasar
etil asetat Ekstrak kasar
merupakan modifikasi dari Harborne (1987) yang meliputi uji alkaloid,
1) Alkaloid
steroid/triterpenoid, flavonoid, saponin, fenol hidrokuinon dan tanin .
Sebanyak 0,05 mg sampel dilarutkan dalam beberapa tetes asam sulfat 2 N kemudian diuji dengan tiga pereaksi alkaloid yaitu, pereaksi Dragendorff, pereaksi Meyer, dan pereaksi Wagner. Hasil uji dinyatakan positif bila dengan pereaksi Meyer terbentuk endapan putih kekuningan, endapan cokelat dengan
pereaksi Wagner dan endapan merah hingga jingga dengan pereaksi Dragendorff.
2) Steroid/triterpenoid
Sebanyak 0,05 mg sampel dilarutkan dalam 2 mL kloroform dalam tabung reaksi yang kering. Kemudian ditambahkan 10 tetes anhidrat asetat dan 3 tetes asam sulfat pekat. Terbentuknya larutan berwana merah untuk pertama kali kemudian berubah menjadi biru dan hijau menunjukan reaksi positif.
3) Flavonoid
Sebanyak 0,05 mg sampel ditambahkan serbuk magnesium 0,1 mg dan 0,4 mL amil alkohol (campuran asam klorida 37% dan etanol 95% dengan volume yang sama) dan 4 mL alkohol kemudian campurkan dikocok. Terbentuk warna merah, kuning atau jingga pada lapisan amil alkohol menunjukkan adanya flavonoid.
4) Saponin
Saponin dapat dideteksi dengan uji busa dalam air panas. Sebanyak 0,05 mg sampel dimasukkan dalam tabung reaksi yang berisi air panas 20 mL.
Busa yang sudah stabil selama 30 menit dan tidak hilang pada penambahan 1 tetes HCl 2 N menunjukkan adanya saponin.
5) Fenol hidrokuinon (pereaksi FeCl3
Sebanyak 0,05 mg sampel diekstrak dengan 20 mL etanol 70%. Larutan
yang dihasilkan diambil sebanyak 1 mL kemudian ditambahkan 2 tetes larutan FeCl
)
6) Tanin
Sebanyak 0,05 mg sampel dimasukkan ke dalam tabung reaksi. Air panas yang telah diseduh diteteskan ke dalam tabung reaksi kemudian didihkan dalam wadah berisi air. Larutan ekstrak yang medidih kemudian disaring. Filtrat ekstrak ditambahkan FeCl3
3.3.3 Uji total fenol
10% dan divorteks sampai terlihat perubahan warna. Perubahan warna reaksi menjadi hitam menunjukkan adanya kandungan tanin dalam ekstrak.
Kandungan total fenol ditentukan dengan menggunakan prosedur Folin-Ciocalteau yang dimodifikasi dari Pambayun et al. (2007) dimana uji
kandungan total fenol dilakukan untuk mengetahui jumlah fenol yang terdapat pada sampel. Ekstrak kasar dengan berat sekitar 5-10 mg ditimbang lalu dilarutkan dengan 2 mL etanol 95%. Kemudian larutan ditambahkan 5 mL akuades dan 0,5 mL reagen Folin-Ciocalteau 50% (v/v). Campuran didiamkan selama 5 menit dan ditambahkan 1 mL Na2CO3
3.3.4Uji aktivitas antioksidan
5% (b/v). Selanjutnya campuran dihomogenkan dan diinkubasi dalam kondisi gelap selama satu jam. Serapan yang dihasilkan diukur dengan spektrofotometer UV-Visible pada panjang gelombang 725 nm. Asam galat digunakan sebagai standar dengan konsentrasi 5, 10, 15, 25, dan 50 mL/L. Kandungan total fenol diinterpretasikan sebagai milligram ekivalen asam galat (GAE = Galic Acid Equivalent) per 100 g sampel (mg GAE/100 g sampel).
Metode uji aktivitas antioksidan yang digunakan dimodifikasi dari Ebrahimzadeh et al. (2010) yaitu metode 1,1-difenil-2-pikrilhidrazil (DPPH). Masing-masing ekstrak kasar dilarutkan dalam etanol dengan konsentrasi yang berbeda, yaitu 31,25, 62,5, 125, 250 dan 500 ppm. Antioksidan Vitamin C digunakan sebagai pembanding dan kontrol positif. Vitamin C dilarutkan dalam
Uji aktivitas antioksidan dilakukan berdasarkan kemampuan sampel yang digunakan dalam mereduksi radikal bebas stabil DPPH. Sebanyak 1 mg ekstrak kasar dan Vitamin C sebagai kontrol positif ditimbang dan kemudian ditambahkan dengan etanol dengan perbandingan 1:1000. Selanjutnya 1,3 mg DPPH diencerkan dengan 25 mL etanol. Sebanyak 1 µL etanol diisikan ke dalam microplate yang telah disiapkan. Setelah itu dilakukan pengisian ekstrak dengan beberapa konsentrasi dan penambahan larutan DPPH. Campuran dihomogenkan
dan diinkubasi pada suhu 37o
Persentase penghambat aktivitas radikal bebas diperoleh dari nilai absorben sampel. Persamaan regresi diperoleh dari hubungan antara konsentrasi sampel dan persentase penghambat aktivitas radikal bebas. Nilai konsentrasi penghambat aktivitas radikal bebas sebanyak 50% (IC
C selama 30 menit. Serapan yang dihasilkan diukur dengan spektrofotometer UV-Visible pada panjang gelombang 517 nm.
50) dihitung dengan
menggunakan persamaan regresi. Nilai IC50 diperoleh dengan memasukkan Y=50 serta nilai A dan B yang telah diketahui. Nilai x sebagai IC50 dapat dihitung dengan persamaan. Aktivitas antioksidan dari masing-masing sampel dan antioksidan pembanding vitamin C dinyatakan dengan persen inhibisi yang dihitung dengan rumus berikut:
Y= A+B Ln(x) Keterangan: Y= persen inhibisi
A = slope B = intercept
x = konsentrasi sampel
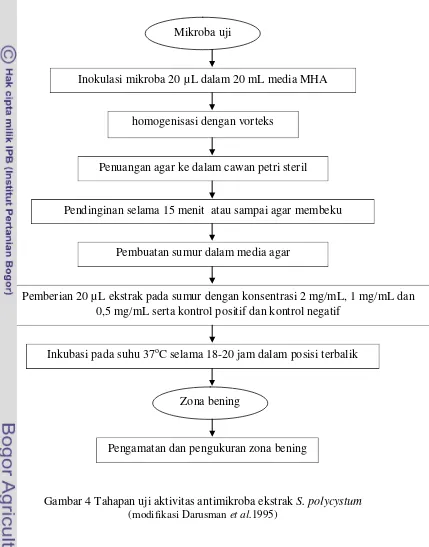
3.3.5 Uji aktivitas antimikroba
Uji aktivitas antimikroba dilakukan terhadap ekstrak S. polycystum. Uji ini
a) Persiapan media padat TSA
Penyegaran mikroba uji, yaitu E. coli dan S. aureus, B. subtilis dan
C. maltosa dilakukan pada media Trypticase Soy Agar (TSA). Media TSA
dibuat dengan melarutkan sebanyak 8 gram media TSA bubuk dalam akuades hingga volume 200 mL, lalu dipanaskan sambil diaduk hingga mendidih. Sebanyak 9 mL TSA dipipet dalam tabung reaksi dan masing-masing tabung ditutup dengan kapas dan aluminium foil. Media lalu disterilisasi dengan
autoklaf pada suhu 121o
b) Persiapan media cair NB
C selama 15 menit. Setelah itu media dimiringkan sekitar 45 derajat dan dibiarkan hingga membeku. Setelah membeku media selanjutnya disimpan dalam refrigerator.
Media Nutrient Broth (NB) dibuat dari 2,6 gram media NB bubuk yang dilarutkan dalam akuades hingga volume 200 mL, selanjutnya dipanaskan sambil diaduk hingga mendidih. Sebanyak 9 mL NB dipipet ke dalam tabung reaksi dan masing-masing tabung ditutup menggunakan kapas dan aluminium foil. Sebelum digunakan, media disterilisasi dengan autoklaf pada suhu 121o
c) Persiapan suspensi mikroba
C selama 15 menit. Setelah itu media didinginkan ditempat yang steril pada suhu ruang.
Sebanyak 1 ose mikroba uji digoreskan pada media TSA dengan pola zig-zag secara aseptik, selanjutnya diinkubasi pada suhu 37oC selama 18-24 jam. Setelah itu 1-2 ose bakteri uji dari media TSA dimasukkan ke dalam media NB yang telah dingin secara aseptik. Selanjutnya diinkubasi pada suhu 37oC selama 18-24 jam. Optical Density (OD600 nm
d) Persiapan media padat MHA
) dihitung menggunakan spektrofotometer untuk menentukan fase hidup bakteri yang digunakan. Nilai OD bakteri setelah inkubasi selama 12-18 jam tiap mikroba berbeda yaitu E. coli 0,607 nm, S. aureus 0,808 nm, B. subtilis 0,540 nm, dan
C. maltosa 0,663 nm.
Media padat yang digunakan untuk pengujian aktivitas antimikroba adalah
kemudian dipanaskan sambil diaduk hingga mendidih. Larutan dipipet 15 mL, kemudian dimasukkan ke dalam tabung reaksi dan masing-masing tabung ditutup dengan kapas dan aluminium foil. Sebelum digunakan, media disterilisasi dengan autoklaf pada suhu 121o
e) Uji aktivitas antimikroba (modifikasi Darusman et a.l 1995)
C selama 15 menit. Media didinginkan pada suhu ruang sampai agar membeku. Setelah membeku, media disimpan dalam refrigerator.
Media MHA cair sebanyak 15 mL ditambah dengan 20 µL mikroba uji yang telah diukur OD-nya (Optical Density) antara 0,5-0,8 pada panjang gelombang 600 nm. Media yang telah ditambah dengan mikroba uji dihomogenkan dengan vorteks, kemudian dimasukkan ke dalam cawan petri steril dan digoyangkan membentuk angka delapan agar menyebar secara merata. Media agar tersebut didiamkan pada suhu ruang selama 15 menit atau sampai agar membeku.
Dalam uji aktivitas antimikroba, setiap sumur diberi ekstrak S. polycystum sebanyak 20 µL dengan konsentrasi 2 mg/mL, 1 mg/mL dan 0,5 mg/mL. Sumur juga diisi dengan kloramfenikol sebagai kontrol positif dengan konsentrasi 2 mg/mL dan pelarut ekstrak sebagai kontrol negatif. Setelah seluruh ekstrak pada sumur dimasukkan dalam cawan petri yang telah berisi agar dan mikroba kemudian cawan petri dilapisi dengan plastik wrapping untuk menghindari kontaminasi dan disimpan dalam inkubator dengan posisi terbalik pada suhu 37o
f) Pengukuran zona hambat
C selama 18-20 jam. Aktivitas antimikroba dapat dilihat dengan mengamati zona hambat yang terbentuk di sekitar sumur. Diagram alir uji aktivitas antimikroba disajikan pada Gambar 4.
Aktivitas antimikroba dinyatakan positif apabila terbentuk zona hambatan berupa zona bening di sekeliling sumur dan aktivitas antimikroba dinyatakan
Zona hambat = A – B Keterangan :
A = Diameter zona hambat yang terbentuk (mm) B = Diameter sumur (mm)
Gambar 4 Tahapan uji aktivitas antimikroba ekstrak S. polycystum (modifikasi Darusman et al.1995)
Pengamatan dan pengukuran zona bening Zona bening
Inkubasi pada suhu 37oC selama 18-20 jam dalam posisi terbalik
Pemberian 20 µL ekstrak pada sumur dengan konsentrasi 2 mg/mL, 1 mg/mL dan 0,5 mg/mL serta kontrol positif dan kontrol negatif
Pembuatan sumur dalam media agar
Pendinginan selama 15 menit atau sampai agar membeku Penuangan agar ke dalam cawan petri steril
homogenisasi dengan vorteks
3.4 Rancangan Percobaan dan Analisis Data
Perlakuan pada penelitian ini adalah dengan penggunaan jenis pelarut
yang memiliki tingkat kepolaran yang berbeda, yaitu metanol, etil asetat dan n-heksana. Semua perlakuan dilakukan sebanyak dua kali ulangan. Model
rancangan yang digunakan untuk menganalisis data rendemen hasil ekstrak, total fenol dan aktivitas antioksidan adalah rancangan acak lengkap (RAL) dengan model dan hipotesis sebagai berikut:
Yij = µ + αi + є Keterangan:
ij
Yij
µ = rataan umum
= hasil pengamatan rendemen ekstrak, total fenol, aktivitas antioksidan dan jenis pelarut (i) pada ulangan ke-j
αi = pengaruh jenis pelarut єij
Analisis ragam digunakan untuk menganalisis data. Uji lanjut Duncan digunakan jika analisis ragam menunjukkan hasil berbeda nyata.
= sisaan akibat jenis pelarut taraf ke-I pada ulangan ke-j
Sy =
�
(KTS ) rRp = qa′ x Sy Keterangan:
Sy = significant range KTS = kuadran tengah sisa r = ulangan
qa′ = significant stidientized range
Rp = wilayah nyata terkecil dari nilai rata-rata
H0 : Jenis pelarut tidak memberikan pengaruh nyata terhadap nilai rendemen, total fenol dan aktivitas antioksidan (αi = 0)
4 HASIL DAN PEMBAHASAN
4.1 Kondisi Perairan Ekosistem S. polycystum di Kepulauan Seribu
Kepulauan Seribu merupakan daerah yang terletak di lepas pantai Jakarta dengan posisi memanjang dari Utara ke Selatan yang ditandai dengan pulau-pulau kecil berpasir putih dan gosong-gosong karang. Kepulauan Seribu terdiri atas 110 pulau dan 11 diantaranya dihuni penduduk. Kawasan ini memiliki tofografi datar
hingga landai dengan ketinggian sekitar 0-2 meter dan luas daratan dapat berubah oleh pasang surut dengan ketinggian pasang antara 1-1,5 meter. Dengan demikian, morfologi Kepulauan Seribu merupakan dataran rendah pantai dengan perairan laut ditumbuhi karang. Sebagai salah satu ekosistem laut di perairan Utara Jakarta, wilayah ini didominasi oleh ekosistem terumbu karang, padang lamun dan daratan pulau-pulau karang yang menjadi habitat penting berbagai jenis biota perairan laut (Noor 2003). Kondisi perairan ekosistem S. polycystum di Kepulauan Seribu dapat dilihat pada Gambar 5.
Gambar 5 Kondisi perairan ekosistem S. polycystum di Kepulauan Seribu
Rumput laut Sargassum umumnya merupakan tanaman perairan yang berukuran relatif besar, tumbuh dan berkembang pada substrat dasar yang kuat. Bagian atas tanaman menyerupai semak yang berbentuk simetris bilateral atau radial serta dilengkapi bagian sisi pertumbuhan. Umumnya rumput laut tumbuh secara liar dan masih belum dimanfaatkan secara baik. Sargassum merupakan alga cokelat yang tersebar luas di Indonesia dan tumbuh di perairan yang
terlindung maupun yang berombak besar pada habitat batu. Pada umumnya
Seribu, terutama di daerah rataan pasir (sand flat). Daerah ini kering pada saat surut rendah, mempunyai dasar berpasir dan terdapat pula pada karang hidup atau mati. Pada batu-batu ini tumbuh dan melekat rumput laut cokelat (Atmadja dan Soelistijo 1998).
4.2 Rendemen Ekstrak S. polycystum
Ekstraksi adalah peristiwa pemindahan zat terlarut (solut) di antara dua pelarut yang tidak saling bercampur (Nur dan Adijuwana 1989). Proses ekstraksi dilakukan dengan tujuan untuk memperoleh bagian-bagian tertentu dari bahan yang mengandung komponen-komponen aktif (Harborne 1987).
Metode ekstraksi yang dilakukan dalam penelitian ini yaitu maserasi tunggal menggunakan pelarut organik dengan tingkat kepolaran yang berbeda, yaitu metanol (polar), etil asetat (semipolar), dan n-heksana (nonpolar). Tujuan dari penggunaan ketiga pelarut tersebut adalah untuk mengetahui rendemen dan
mendapatkan senyawa aktif dari S. polycystum berdasarkan tingkat kepolarannya. rendemen ekstrak kasar S. polycystum disajikan pada Gambar 6.
Gambar 6 Rendemen ekstrak kasar S. polycystum
Diagram batang pelarut metanol (a) yang memberikan pengaruh yang berbeda nyata (p<0.05) terhadap etil asetat dan n-heksana (b) dalam menghasilkan rendemen
Pada proses maserasi, ekstrak kasar masing-masing pelarut dari hasil evaporasi menghasilkan karakteristik yang berbeda-beda. Ekstrak dari ketiga jenis
menunjukkan warna yang relatif sama pada tiap pelarut yaitu hijau kecokelatan. Rendemen yang dihasilkan pada ekstraksi dengan tiga pelarut menunjukkan nilai yang berbeda. Rendemen ekstrak adalah perbandingan jumlah ektrak dan hasilnya dinyatakan dalam persen.
Data nilai rendemen ekstrak kasar S. polycystum pada Gambar 6 menunjukkan bahwa jenis pelarut memberikan pengaruh nyata terhadap nilai rendemen. Rendemen ekstrak tertinggi terdapat pada ekstrak metanol sebesar
17,93%, diikuti dengan etil asetat sebesar 1%, dan terakhir n-heksana sebesar 0,57%. Data tersebut menunjukkan bahwa komponen senyawa aktif yang bersifat polar banyak terdapat dalam jaringan S. polycystum karena banyaknya ekstrak dari pelarut metanol yang dihasilkan. Sebaliknya, komponen senyawa aktif yang
bersifat semipolar dan nonpolar terdapat dalam jumlah kecil dalam jaringan S. polycystum karena sedikitnya ekstrak yang dihasilkan dari pelarut etil asetat dan
n-heksana. Berdasarkan data tersebut, dapat diidentifikasi bahwa S. polycystum mengandung senyawa-senyawa aktif yang relatif larut dalam pelarut polar.
Wijayanto (2010) melaporkan bahwa penggunaan pelarut metanol lebih
efektif dalam ekstraksi alga merah Kappaphycus alvarezii dan Euchema denticullatum dibandingkan dengan etanol yang memiliki tingkat
kepolaran yang lebih rendah. Hal ini dapat mempertegas adanya sifat kelarutan senyawa-senyawa aktif pada rumput laut yang relatif larut pada pelarut yang bersifat polar.
Ekstrak dengan pelarut etil asetat dan n-heksana menghasilkan rendemen yang lebih kecil dibandingkan dengan metanol. Hal ini dapat dikarenakan adanya senyawa flavonoid yang merupakan salah satu metabolit sekunder terbanyak di alam yang umumnya terikat pada glukosa. Proses glikosilasi ini menyebabkan
flavonoid menjadi kurang reaktif dan relatif larut dalam pelarut polar (Markham 1988).
4.3 Kandungan Komponen Fitokimia S. polycystum
mengenai struktur kimianya, biosintesisnya, perubahan serta metabolismenya, penyebarannya secara alamiah dan fungsi biologisnya. Analisis fitokimia dilakukan untuk menentukan ciri senyawa aktif penyebab efek racun atau manfaat, yang ditunjukkan oleh ekstrak kasar bila diuji dengan sistem biologi (Harborne 1987). Uji fitokimia yang dilakukan dalam penelitian ini meliputi uji alkaloid, steroid, flavonoid, fenol hidrokuinon, saponin, dan tanin. Kandungan senyawa fitokimia dalam ekstrak S. polycystum dapat dilihat dalam Tabel 2.
Tabel 2 Hasil uji fitokimia ekstrak S. polycystum
Uji Fitokimia
menjadi biru hingga hitam
Keterangan: - = tidak terdeteksi + = terdeteksi
Secara umum komponen fitokimia yang terdapat dalam ekstrak S. polycystum adalah senyawa steroid, flavonoid dan fenol hidrokuinon. Ekstrak
ketiga pelarut menghasilkan nilai kandungan yang berbeda pada setiap uji. Perbedaan jenis pelarut yang digunakan dalam ekstraksi memberikan pengaruh yang sama, namun yang membedakan adalah intensitas kandungan senyawa fitokimia yang dihasilkan pada masing-masing ektrak. Secara kualitatif, senyawa fitokimia S. polycystum memiliki intensitas yang kuat pada ekstrak dengan pelarut
Sterol adalah triterpena yang kerangka dasarnya sistem cincin siklopentana perhidrofenantrena. Dahulu sterol terutama dianggap sebagai senyawa satwa (sebagai hormon kelamin, asam empedu, dll). Tetapi kemudian makin banyak senyawa tersebut yang ditemukan dalam jaringan tumbuhan. Sterol umumnya terdapat dalam bentuk bebas dan sebagai glukosida sederhana. Terdapat dalam tumbuhan rendah, tapi kadang-kadang terdapat juga dalam tumbuhan tinggi, misalnya fukosterol, yaitu steroid utama pada alga cokelat (Harborne 1987). Hasil
uji steroid dapat dilihat pada Gambar 7.
Gambar 7 Hasil uji steroid ekstrak kasar (a) metanol, (b) n-heksana dan (c) etil asetat
Uji steroid pada S. polycystum yang dilakukan pada penelitian ini menunjukkan bahwa komponen steroid terdeteksi pada semua jenis pelarut ekstrak kasar S. polycystum dengan intensitas yang cukup kuat. Prekursor dari
pembentukan steroid adalah kolesterol yang bersifat non polar, sehingga n-heksana dan etil asetat dapat mengekstrak senyawa tersebut. Steroid juga
terekstrak pada pelarut metanol yang merupakan pelarut polar yang juga mampu mengekstrak komponen lainnya yang bersifat nonpolar dan semipolar. Hasil
penelitian Swantara et al. (2009) menyatakan bahwa senyawa streroid dan ester ditemukan pada ekstrak Sargassum ringgoldianum. Smit (2004) menyatakan komponen seperti sterol dan fenol dapat menjadi bahan antibiotik.
mula-mula didasarkan pada telaah sifat kelarutan dan reaksi warna (Harborne 1987).
Ektrak S. polycystum pada semua pelarut mengandung senyawa flavonoid dengan intensitas yang berbeda. Tabel 2 menunjukkan ekstrak kasar dari metanol dan n-heksana memiliki kandungan flavonoid yang lebih sedikit dibandingkan dengan etil asetat. Hasil pengujian ditunjukkan dengan terbentuknya warna merah dan kuning pada lapisan amil alkohol yang dapat dilihat pada Gambar 8.
Gambar 8 Hasil uji flavonoid ekstrak kasar (a) metanol, (b) n-heksana dan (c) etil asetat
Intensitas flavonoid pada pelarut metanol menunjukkan bahwa komponen flavonoid yang ada pada ekstrak S. polycystum memiliki kandungan flavonoid yang bersifat polar. Hal ini diduga karena flavonoid tersebut berikatan dengan gula sebagai glikosida, sehingga flavonoid yang bersifat polar dapat larut pada pelarut polar. Flavonoid yang larut pada etil asetat dan n-heksana diduga merupakan aglikon flavonoid yang bersifat kurang polar, sehingga dapat larut dalam kedua pelarut tersebut (Harborne 1987). Kandungan flavonoid jenis ini relatif kecil dalam S. polycystum karena jumlah terlarutnya yang kecil. Hasil uji Prajitno (2006) menunjukkan bahwa rumput laut Halimeda opuntia mengandung senyawa flavonoid yang terdiri dari quercitrin, epigallocathecin, cathecol, hesperidia, miricetin dan morin. Epigallocathecin merupakan komponen penting yang digunakan sebagai aktivitas antioksidan.
berkonjugasi dengan dua ikatan rangkap karbon-karbon), naftokuinon, antrakuinon dan kuinon isoprenoid. Tiga kelompok pertama biasanya terhidroksilasi dan bersifat senyawa fenol serta mungkin terdapat in vivo dalam bentuk gabungan dengan gula sebagai glikosida atau dalam bentuk kuinol tanpa warna (Harborne 1987). Hasil uji senyawa fenol hidrokuinon pada penelitian ini dapat dilihat pada Gambar 9.
Gambar 9 Hasil uji fenol hidrokuinon ekstrak kasar (a) metanol,(b) n-heksana dan(c) etil asetat
Ekstrak S. polycystum pada masing-masing pelarut mengandung senyawa kuinon dengan intensitas yang lebih kuat pada ekstrak etil asetat dan metanol. Hal ini dapat dikarenakan senyawa kuinon yang terdapat dalam S. polycystum terbentuk dari berbagai jenis kuinon, dimana jenis kuinon yang larut dalam pelarut semipolar relatif lebih banyak dibanding pelarut lain. Kelompok benzokuinon dan naftokuinon dapat larut dengan pelarut semipolar atau non polar, sedangkan kuinon yang larut dalam metanol merupakan kelompok antrakuinon yang banyak hidrosilnya sangat polar sehingga larut dalam larutan polar (Harborne 1987).
Senyawa kuinon yang terdapat sebagai glikosida mungkin sedikit larut dalam air (polar), tetapi umumnya kuinon mudah larut dalam lemak dan akan terekstraksi dari tumbuhan kasar bersama-sama dengan karotenoid dan klorofil.
Oleh karena itu keberadaan kuinon ditunjukkan dengan warna hijau. Untuk memastikan apakah suatu pigmen termasuk kuinon atau bukan, reaksi
warna sederhana masih tetap berguna, warna yang terlihat beragam, mulai dari jingga dan merah sampai ungu dan biru, bahkan beberapa kasus terbentuk warna hijau (Harborne 1987). Menurut Lincoln et al. (1991) dalam Smit (2004), banyak
Beberapa zat yang penting pada reaksi ini adalah komponen halogen seperti alkali dan alkena, alkohol, aldehida, hidrokuinon, dan keton.
Alkaloid merupakan senyawa kimia tanaman hasil metabolit sekunder yang terbentuk berdasarkan prinsip pembentukan campuran. Alkaloid terbagi menjadi tiga bagian, yaitu elemen yang mengandung N terlibat pada pembentukan alkaloid dan reaksi yang terjadi untuk pengikatan khas elemen-elemen pada alkaloid (Sirait 2007). Uji fitokimia pada alkaloid ekstrak S. polycystum pada
semua pelarut tidak terdeteksi. Suradikusumah (1989) menyatakan bahwa reaksi utama yang mendasari biosintesis senyawa alkaloid adalah reaksi Mannich, yaitu suatu aldehida berkondensasi dengan suatu amina menghasilkan suatu ikatan karbon-nitrogen dalam bentuk imina atau garam iminum diikuti oleh serangan suatu atom karbon nukleofilik yang dapat berupa suatu fenol. Tidak terdeteksinya alkaloid mengidentifikasikan bahwa tidak adanya kandungan amina dalam ekstrak S. polycystum.
Saponin adalah glikosida triterpena dan sterol yang telah terdeteksi dalam lebih dari 90 suku tumbuhan (Harborne 1987). Glikosida saponin terdapat pada tanaman tinggi dan dapat membentuk larutan koloidal dalam air. Kemampuan menurunkan tegangan permukaan disebabkan molekul saponin terdiri dari hidrofob dan hidrofil. Bagian hidrofob adalah aglikon, bagian hidrofil adalah glikon. Sebagian besar saponin bereaksi netral (larut dalam air), beberapa ada yang bereaksi asam (sukar larut dalam air), sebagian kecil ada yang bereaksi basa (Sirait 2007). Hasil penelitian menunjukkan bahwa kandungan senyawa saponin pada ketiga ekstrak S. polycystum bernilai negatif. Hal ini mengidentifikasikan bahwa komponen saponin tidak terkandung dalam S. polycystum. Hal ini berbeda dengan penelitian Sahayaraj dan Kalidas (2011) yang mengidentifikasi adanya senyawa steroid, saponin dan komponen fenol pada ekstrak Padina pavonica dengan pelarut benzena dan kloroform.
pada tumbuhan terestrial berbeda dengan yang berasal dari laut. Florotanin merupakan komponen tanin yang hanya dapat ditemukan dari alga laut. Penelitian Tamat et al. (2007) pada uji fitokimia ekstrak metanol Ulva reticulata menunjukkan tidak adanya intensitas senyawa aktif alkaloid, saponin dan tanin.
4.4 Kandungan Total Fenol S. polycystum
Senyawa fenol meliputi aneka ragam senyawa yang berasal dari tumbuhan, yang mempunyai ciri sama yaitu cincin aromatik yang mengandung satu atau dua gugus hidroksil. Semua senyawa fenol berupa senyawa aromatik sehingga semuanya menunjukkan serapan kuat di daerah spektrum UV. Selain itu, secara khas senyawa fenol menunjukkan geseran batokrom pada spektrumnya bila ditambahkan basa. Karena itu, cara spektrometri sangat penting, terutama untuk identifikasi dan analisis kuantitatif senyawa fenol (Harborne 1987).
Beberapa ribu senyawa fenol di alam telah diketahui strukturnya.
Flavonoid merupakan golongan terbesar, tetapi fenol monosiklik sederhana, fenilpropanoid dan kuinon fenolik juga terdapat dalam jumlah besar. Beberapa bahan polimer penting dalam tumbuhan adalah lignin, melanin dan tanin yang merupakan golongan polifenol. Grup yang paling penting dari senyawa fenolik adalah senyawa flavonoid. Flavonoid sangat efektif digunakan sebagai antioksidan (Harborne 1987).
Salah satu jenis antioksidan dalam bahan pangan adalah senyawa fenolik. Senyawa fenolik terbukti sebagai sumber antioksidan yang efektif, penahan radikal bebas, dan pengkelat ion-ion logam. Aktivitas antioksidan senyawa fenolik berhubungan dengan senyawa fenol (Meskin et al. 2002). Aktivitas antioksidan senyawa fenol dipengaruhi oleh beberapa faktor, yaitu adanya agen pengkelat, pH di lingkungan sekitar, kelarutan, ketersediaan senyawa fenol dalam suatu bahan, dan stabilitas senyawa fenol (Tang 1991).
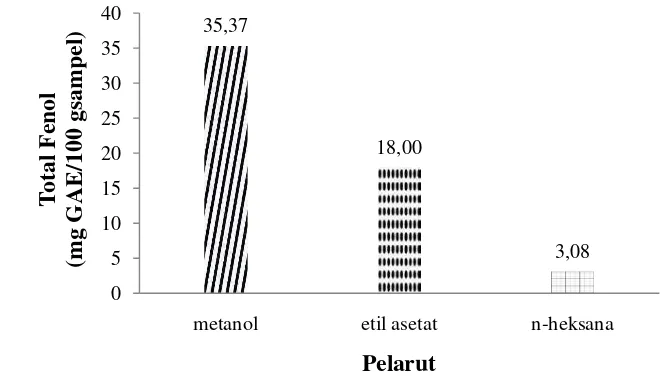
pengukuran dikarenakan asam galat merupakan senyawa polifenol yang terdapat dihampir semua tanaman. Kandungan fenol asam organik ini bersifat murni dan stabil (Kusumaningati 2009). Data total fenol ekstrak S. polycystum dalam berbagai pelarut disajikan pada Gambar 10.
Gambar 10 Total fenol ekstrak S. polycystum dalam berbagai pelarut
Gambar di atas menunjukkan bahwa pelarut yang berbeda menghasilkan nilai total fenol yang berbeda. Ekstraksi dengan menggunakan pelarut metanol menghasilkan total kandungan fenol tertinggi yaitu sebesar 35,37 mg GAE/100 g
sampel yang diikuti dengan pelarut etil asetat yaitu sebesar 18,00 mg GAE/100 g sampel. Ekstrak dengan pelarut n-heksana menghasilkan total kandungan fenol terendah yaitu sebesar 3,08 mg GAE/100 g sampel. Pelarut metanol dan etil asetat
menghasilkan total fenol yang relatif tinggi dibandingkan dengan pelarut n-heksana. Hal ini diduga karena adanya kandungan flavonoid yang terikat pada
glukosa yang dapat larut pada pelarut polar.
Pengujian total fenol sangat tergantung pada struktur kimianya. Senyawa fenol yang mempunyai gugus fungsi hidroksil yang banyak atau dalam kondisi bebas akan menghasilkan kadar total fenol yang tinggi. Hal ini membuktikan bahwa ekstrak kasar metanol memiliki gugus fungsi hidroksil yang relatif tinggi
dibandingkan dengan kedua pelarut lainnya. Hosokawa (2006) dalam Gupta et al. (2011) menyatakan bahwa, serangkaian senyawa fenol seperti
katesin, flavonoid dan flavonoid glikosida telah diidentifikasi dari ekstrak metanol
alga merah dan cokelat dan ditemukan memiliki aktivitas antioksidan dan antimikroba.
4.5 Aktivitas Antioksidan S. polycystum dengan Metode DPPH
Zheng et al. (2001) menyatakan saat ini terjadi peningkatan minat yang besar terhadap penemuan antioksidan alami untuk digunakan dalam makanan ataupun material pengobatan untuk mengganti antioksidan sintetik, yang mungkin dapat bersifat karsinogenik. Antioksidan adalah senyawa kimia yang dapat menyumbangkan satu atau lebih elektron kepada radikal bebas, sehingga radikal bebas tersebut dapat diredam. Pada umumnya terdapat dua kategori dasar dari antioksidan yaitu natural dan sintetik.
Antioksidan alami banyak terdapat pada berbagai macam jenis tumbuhan baik dalam buah-buahan maupun tumbuhan. Senyawa-senyawa fenolat yang terkandung dalam tumbuhan memiliki aktivitas antioksidan karena senyawa ini
dapat menangkap radikal-radikal peroksida dan dapat mengkelat logam besi yang mengkatalis peroksida lemak (Harborne 1987). Andayani et al. (2008) menyatakan biasanya senyawa-senyawa yang memiliki aktivitas antioksidan adalah senyawa fenol yang mempunyai gugus hidroksil yang tersubtitusi pada posisi ortho dan terhadap gugus ─OH dan ─OR.
Keberadaan senyawa antioksidan dalam suatu bahan dapat dideteksi
dengan melakukan uji antioksidan. Uji aktivitas antioksidan pada ekstrak S. polycystum tiga pelarut dengan tingkat kepolaran yang berbeda dilakukan
dengan metode uji DPPH (1,1-diphenyl-2-picrylhydrazil). Pada metode ini larutan DPPH yang berperan sebagai radikal bebas akan bereaksi dengan senyawa antioksidan sehingga DPPH akan berubah menjadi diphenilycrilhydrazine yang
bersifat non-radikal. Menurut Dehpour et al. (2009) dalam Ebrahimzadeh et al. (2010), metode DPPH dapat menstabilkan warna radikal bebas nitrogen dari
warna violet menjadi kuning pada proses reduksi dengan proses hidrogen atau donasi elektron.
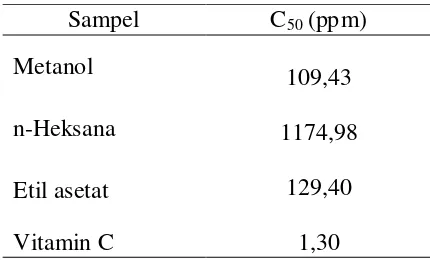
IC50 (Inhibition Concentration 50) yang berarti konsentrasi larutan sampel yang menyebabkan tereduksi aktivitas DPPH sebesar 50%. Nilai IC50 yang semakin kecil menunjukkan aktivitas antioksidan pada bahan uji semakin besar. Suatu senyawa dikatakan sebagai antioksidan sangat kuat jika nilai IC50 kurang dari
50 ppm, kuat untuk IC50 antara 50-100 ppm, sedang jika IC50 bernilai 100-150 ppm dan lemah jika IC50 bernilai 150-200 ppm. Nilai IC50 yang
diperoleh dari larutan vitamin C dan ekstrak S. polycystum pada tiga jenis pelarut
dapat dilihat pada Tabel 3.
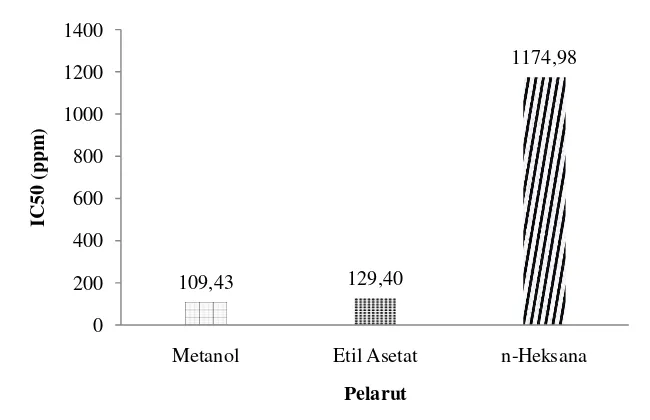
Tabel 3 Nilai IC50 Sampel
larutan vitamin C dan ekstrak S. polycystum C50 (ppm)
Metanol
109,43
1174,98
129,40
1,30 n-Heksana
Etil asetat
Vitamin C
Gambar 11 Nilai rata-rata IC50 antioksidan ekstrak S. polycystum
Perbandingan aktivitas antioksidan pada jenis ekstrak menunjukkan nilai yang relatif berbeda. Gambar di atas menunjukkan bahwa perbedaan pelarut memberikan pengaruh terhadap aktivitas antioksidan. Ekstrak S. polycystum dengan metanol dan etil asetat memiliki nilai aktivitas antioksidan yang masuk dalam kategori sedang sehingga memberikan pengaruh yang berbeda terhadap ekstrak n-heksana yang memiliki aktivitas antioksidan lebih besar dari 500 ppm. Tingginya nilai aktivitas antioksidan pada ekstrak metanol dan etil asetat
berkorelasi positif terhadap kandungan total fenol. Total fenol pada ekstrak metanol dan etil asetat S. polycystum memiliki nilai yang cukup tinggi dibandingkan dengan ekstrak n-heksana. Hasil penelitian Molyneux (2004) menyatakan jika di dalam suatu bahan memiliki konsentrasi senyawa fenol yang tinggi maka aktivitas antioksidan dalam bahan tersebut juga tinggi.
Aktivitas antioksidan vitamin C dan masing-masing ekstrak S. polycystum ditunjukkan oleh nilai inhibisinya pada beberapa konsentrasi yang dapat dilihat pada Lampiran 7. Nilai inhibisi pada beberapa konsentrasi menunjukkan bahwa semakin tinggi nilai vitamin C dan ekstrak S. polycystum yang digunakan, maka semakin besar nilai persentase inhibisi sehingga semakin besar penghambatan terhadap radikal bebas yang dihasilkan. Semakin tinggi konsentrasi ekstrak yang digunakan, maka akan semakin tinggi pula nilai persentase penghambatan aktivitas radikal bebas (persen inhibisi). Hal ini berkorelasi dengan total fenol
109,43 129,40
1174,98
0 200 400 600 800 1000 1200 1400
Metanol Etil Asetat n-Heksana
IC50
(ppm
)
yang terkandung dalam ekstrak S. polycystum. Nilai inhibisi dan aktivitas antioksidan ekstrak metanol dan etil asetat relatif tinggi dibandingkan dengan ekstrak n-heksana pada berbagai konsentrasi. Menurut penelitian Koleva et al. (2001), sebanyak 93% senyawa polifenol merupakan senyawa flavonoid. Komponen ini mampu menghambat reaksi oksidasi dan menangkap radikal bebas. Hal ini dikarenakan adanya gugus hidroksil pada struktur kimianya.
4.6 Aktivitas Antimikroba S. polycystum
Penelitian aktivitas antimikroba dari ekstrak rumput laut telah dilakukan
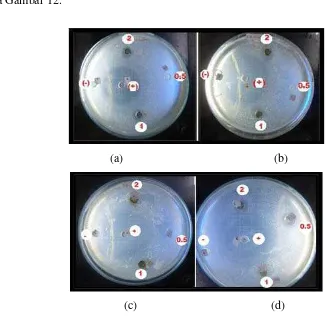
sejak tahun 1917. Berdasarkan Bansemir et al. (2001) dalam Wei et al. (2011), komponen biologi ekstrak dari beberapa spesies rumput laut dari jenis Phaeophyceae, Rhodophyceae dan Chlorophyceae memiliki potensi dalam aktivitas pengobatan seperti antibakteri, antiviral, antitumor, antifungi, antiprotozoa dan kontrol nyamuk dan larva. Hasil uji aktivitas dan diameter zona hambat antimikroba ekstrak S. polycystum dengan pelarut etil asetat dapat dilihat pada Gambar 12.
(a) (b)
(c) (d)
Gambar 12 Zona hambat yang terbentuk dari uji aktivitas antimikroba ekstrak S. polycystum dengan pelarut etil asetat
Uji aktivitas antimikroba dari ekstrak S. polycystum diujikan pada bakteri
dan khamir. Bakteri yang digunakan adalah bakteri Gram-positif yaitu S. aureus dan B. subtilis dan bakteri Gram-negatif yaitu E. coli sedangkan khamir
yang digunakan adalah C. maltosa. Uji ini dilakukan dengan metode difusi agar karena dengan metode ini difusi ekstrak pada agar dalam cawan petri akan lebih baik. Aktivitas antimikroba ditentukan dengan mengukur diameter hambatannya, yaitu daerah bening yang terbentuk di sekitar sumur. Antimikroba dikatakan
mempunyai aktivitas yang tinggi terhadap mikroba apabila nilai konsentrasi penghambatan mikroba yang terendah, tetapi mempunyai diameter penghambatannya besar. Chknikvishvili dan Ramazanov (2000) dalam
Wei et al. (2011) menyatakan komponen fenol memiliki peranan besar dalam
aktivitas antibakteri dan antifungi dan kandungannya berlimpah pada rumput laut
cokelat jika dibandingkan dengan rumput laut merah dan hijau. Aktivitas antimikroba ekstrak S. polycystum pada bakteri S. aureus disajikan pada
Gambar 13.
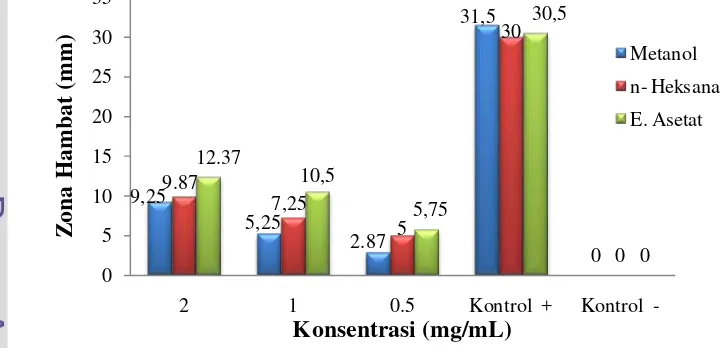
Gambar 13 Aktivitas antimikroba ekstrak S. polycystum pada bakteri S. aureus
Gambar di atas menunjukkan aktivitas antimikroba pada bakteri S. aureus. Aktivitas antimikroba yang terdapat dalam uji ini teridentifikasi pada konsentrasi 2 mg/mL (9,37 mm) dan 1 mg/mL (7,5 mm) pada metanol, konsentrasi 1 mg/mL (6 mm) pada etil asetat. Ekstrak dengan pelarut n-heksana tidak memiliki aktivitas antimikroba atau sangat lemah di setiap konsentrasi karena memiliki zona hambat <6 mm.